氧甲基转移酶fsr2在催化山奈酚4'羟基氧甲基化中的应用
技术领域
1.本发明属于生物技术领域,具体涉及可将山奈酚4'羟基氧甲基化的氧甲基转移酶及其相关应用。
背景技术:
2.真菌生物转化是利用细胞内特定的酶对底物进行结构修饰与改造,从而获得更有价值的化合物的代谢反应。山奈酚(kaempferol)(式1)是一种常见的天然黄酮类植物次生代谢产物,其广泛存在于多种植物的根、叶和果实中。山奈酚具有抗氧化、抗炎症、抑制肿瘤生长及保护肝细胞、抑制血小板聚集和黏附作用等活性,因此受到人们的广泛关注。此外,它还是合成多种黄酮类活性物质的重要中间产物,如淫羊藿苷。如淫羊藿苷。
3.淫羊藿苷(icariin)(式2)是淫羊藿的主要活性成分,为8-异戊烯基黄酮苷类化合物。淫羊藿苷能增加心脑血管血流量、促进造血功能、免疫功能及骨代谢,还具有补肾壮阳、抗衰老等功效。目前获得淫羊藿苷主要是从箭叶淫羊藿、柔毛淫羊藿、巫山淫羊藿巫、朝鲜淫羊藿等干燥茎叶中提取得到,然而,植物生长周期长、产物含量低,导致这种生产方式对野生植物资源造成严重破坏。如何以一种可持续、绿色清洁的方式生产这些高附加值的天然产物,对于保障社会经济可持续发展至关重要。生物质是一种可再生的清洁资源。通过生物制造技术,生物质可以被转化为燃料、大宗化学品和天然产物,从而替代石油化工炼制和植物资源提取。生物制造的核心技术是构建高效的微生物细胞工厂,将生物质原材料转化为各种终端产品。如何拓展微生物细胞生产化学品的种类和如何提高细胞的生产效率是限制细胞工厂产业化的两个关键技术问题。
[0004]4’
位羟基的氧甲基化是从山奈酚出发合成淫羊藿苷的关键步骤之一;构建利用生物质高效合成淫羊藿苷的关键技术之一是能够高效专一地进行山奈酚4’位羟基甲基化反应,实现途径之一就是挖掘具有该生物学功能的氧甲基转移酶。
技术实现要素:
[0005]
本发明的目的是获得能够高效专一地进行山奈酚4’位羟基甲基化反应的甲基转移酶基因,实现4’氧甲基山奈酚的高效合成。
[0006]
本发明通过基因组挖掘,从水稻恶苗病菌(fusarium fujikuroi)中挖掘到了一个氧甲基转移酶fsr2(uniprot s0dqq0),其编码基因属于镰刀菌素生物合成基因簇的一部分,镰刀菌素是负责子实体着色的高色素萘醌。通过cdna扩增氧甲基转移酶基因fsr2,构建了可在酵母菌中表达的重组质粒,并在酵母中进行异源表达转化。通过外源添加山奈酚,从
发酵产物中提取得到了4’氧甲基山奈酚(即山奈素),且无其他转化产物。经与已知黄酮类4’羟基甲基化的甲基转移酶进行比较,发现fsr2转化产生山奈素的产量较高,产物谱专一程度较高。
[0007]
进一步通过同源性挖掘和文献检索还得到具有上述酶活性的酶,即paomt、cromt、kaf 。
[0008]
因此,本发明提供一种甲基转移酶,其氨基酸序列如seq id no. 1、3、5或7所示,或其氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且仍具有甲基转移酶活性。
[0009]
具体地,其中一个或几个氨基酸残基的取代和/或缺失和/或添加是指不超过10个,5个,3个氨基酸残基的取代和/或缺失和/或添加。在一个更具体的实施方式中,在氨基末端或羧基末端连接有标签序列,优选地是poly-arg、poly-his、flag、strep-tag ii、c-myc,更具体是rrrrr、hhhhhh、dykddddk、wshpqfek、eqkliseedl。为了使(a)中的蛋白便于纯化,可在由seq id no.1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
[0010]
表1 标签的序列标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tag8wshpqfekc-myc10eqkliseedl本发明进一步提供所述的甲基转移酶的编码基因,优选地,其核苷酸序列如seq id no. 2、4、6、8所示。
[0011]
更进一步提供所述的编码基因的重组载体、重组菌株、重组细胞,优选是酵母,更优选为酿酒酵母。
[0012]
本发明尤其提供一种制备4’氧甲基山奈酚的方法,其特征在于,以山奈酚为底通过所述的甲基转移酶催化实现。具体地,其是通过含有权利要求4所述的编码基因的重组菌株发酵制备,更优选地,在培养所述重组菌株时添加底物山奈酚;任选地,还包括纯化产物4’氧甲基山奈酚的步骤。更优选地,所述重组菌株是酿酒酵母。
[0013]
本发明还提供所述的甲基转移酶、及其编码基因,或含有所述的编码基因的重组菌株在制备4’氧甲基山奈酚中的应用,具体地以山奈酚为底物,通过山奈酚4’位羟基氧甲基化而实现。
[0014]
同时还提供所述的甲基转移酶、及其编码基因,或含有所述的编码基因的重组菌株在制备淫羊藿苷中的应用,具体地通过以山奈酚为底物,通过山奈酚4’位羟基氧甲基化而得到4’氧甲基山奈酚,再进一步转化为淫羊藿苷。
[0015]
本发明挖掘的甲基转移酶可以催化山奈酚4’位羟基氧甲基化反应,该反应是从山奈酚出发合成淫羊藿苷的关键步骤,因此本发明提供的生物催化方法,可以实现细胞工厂发酵合成淫羊藿苷,具有巨大的应用价值。
附图说明
[0016]
图1为fsr2基因片段的扩增结果;其中,1为pxw425m酶切,2为fsr2扩增。
[0017]
图2为重组载体pxw425m-fsr2的物理图谱;图3为山奈酚修饰前的液相色谱图;图4为山奈酚修饰前的质谱图;图5为山奈素标准样品的液相色谱图;图6为山奈素标准样品的质谱图;图7为山奈酚经fsr2修饰后,产生的hplc液相色谱图(注:化合物1的[m h]
为287,符合山奈酚分子量;化合物2的[m h]
为301,符合山奈素分子量);图8为山奈酚经fsr2修饰后,产生的一个甲基化化合物的质谱图;图9为木犀草素经fsr2修饰后,产生的hplc液相色谱图,从上至下依次为:含有空载体的酵母,底物木樨草素,产物香叶木素,底物饲喂含有fsr2载体的酵母(注:1为底物木樨草素);图10为圣草酚经fsr2修饰后,产生的hplc液相色谱图,从上至下依次为:含有空载体的酵母,底物圣草酚,产物橙皮素,底物饲喂含有fsr2载体的酵母(注:1为底物圣草酚);图11为山奈酚经kaf修饰后,产生的hplc液相色谱图(注:化合物1的[m h]
为287,符合山奈酚分子量;化合物2的[m h]
为301,符合山奈素分子量);图12为山奈酚经paomt修饰后,产生的hplc液相色谱图(注:化合物1的[m h]
为287,符合山奈酚分子量;化合物2的[m h]
为301,符合山奈素分子量;3的[m h]
为315,符合双氧甲基化的山奈酚分子量);图13为山奈酚经cromt修饰后,产生的hplc液相色谱图(注:化合物1的[m h]
为287,符合山奈酚分子量;化合物2的[m h]
为301,符合山奈素分子量)。
具体实施方式
[0018]
以下实验中所用的实验材料说明及来源如下:菌株和载体:水稻恶苗病菌(fusarium fujikuroi)和酵母菌s. cerevisiae bj5464-npga、酵母表达载体prs425m,均来源于中国农业科学院生物技术研究所。
[0019]
酶与试剂盒:限制性内切酶、t4 dna连接酶购自neb公司;rna反转录试剂盒购自takara公司;quick-fusion cloning kit购自biotool公司;热启动高保真dna扩增试剂盒购自biotool公司;dna聚合酶和dna marker购自北京全式金生物公司;质粒小提试剂盒、通用型dna纯化胶回收试剂盒购自天根公司;冷冻酵母转化试剂盒购自ymo research生物公司;大肠杆菌dh5α感受态购自康维世纪公司;其它试剂均为国产分析纯产品。
[0020]
培养基:大肠杆菌培养基为lb培养基(1%蛋白胨、0.5%酵母提取物、1%nacl,ph7.0)。sc-‑
leu缺陷培养基(1%葡萄糖、6.7%difco
tm yeast nitrogen base w/o amino acids、-leu/-trp do supplement)。ypd培养基(1%酵母膏,2% peptone蛋白胨,2% 葡萄糖)。ypd低糖培养基(1%酵母膏,2% peptone蛋白胨,1% 葡萄糖.)若制固体培养基,加入2%琼脂粉。
[0021]
实施例中其它未注明具体条件的实验方法,按照常规方法进行,分子克隆按(new york:cold spring harbor laboratory press,1989) 实验室手册中所述的条件,或按照制造厂商所建议的条件。
[0022]
实施例1 克隆氧甲基转移酶基因fsr2,并构建酵母表达载体获得酵母转化子通过相关生物信息学软件分析水稻恶苗病菌(fusarium fujikuroi)基因组中的氧甲基转移酶,通过比对发现了一个氧甲基转移酶基因fsr2(其氨基酸序列如seq id no.1所示,核苷酸酸序列如seq id no.5所示)。将fsr2的核苷酸序列通过多种软件预测分析去除掉内含子拼接得到fsr2的编码区序列。提取水稻恶苗病菌的rna通过反转录获得cdna,利用设计的引物扩增fsr2的编码基因,回收目的片段交给测序公司测序比对,获得seq id no. 1所示的氧甲基转移酶fsr2。
[0023]
合成时引入酶切位点。在启动子前加入ndei酶切位点,在终止子后加入pmei酶切位点,片段长度为0.75kb。fsr2扩增片段见图1。
[0024]
用ndei和pmeⅰ双酶切穿梭载体pxw06f并回收6114bp大小的片段。利用无缝连接克隆试剂盒将两片段连接。
[0025]
热激法转化入大肠杆菌感受态dh5α。ampr抗性筛选,提取质粒,scai和ndeⅰ酶切鉴定。重组质粒prs425m-fsr2图谱见图2。
[0026]
将酿酒酵母s. cerevisiae bj5464-npga接种至ypd培养基中,30℃、200 r/min培养至o.d.值0.8-1.0,按照zymo公司提供的说明书制备酿酒酵母感受态细胞并进行重组质粒的转化。将含有fsr2基因的prs425m-fsr2重组质粒转化入酿酒酵母中,涂布于亮氨酸缺失的sc固体缺陷培养基,30℃培养3天左右。获得的酵母转化子,划线培养至新的sc-‑
leu缺陷培养基上,于30℃培养箱中培养2天左右。
[0027]
实施例2 应用氧甲基转移酶重组载体prs425m-fsr2实现山奈酚到山奈素的转化通过hplc高效液相分离得到经氧甲基转移酶fsr2修饰后的代谢产物并分析其分子结构。实验方法如下:1)发酵培养采取二步法发酵技术,首先将适量的酿酒酵母转化子菌体接种至相应的25-ml ‑
leu液体缺陷培养基中(1%葡萄糖、6.7%difco
tm yeast nitrogen base w/o amino acids、-trp/-ura do supplement),30℃、200 r
⋅
min-1培养16 h左右,再加入ypd低糖培养基25 ml(1%酵母膏、2% peptone蛋白胨、1%葡萄糖),同时加入5mg 山奈酚纯品继续培养48h;用乙酸乙酯提取发酵产物,乙酸乙酯与发酵液的比例为1:1,即用50 ml的乙酸乙酯提取发酵产物;旋转蒸发仪回收乙酸乙酯干燥萃取物,1 ml甲醇复溶萃取物。
[0028]
2)高效液相(hplc)色谱检测将上述所得发酵产物经高速离心后用高效液相色谱检测。
[0029]
hplc检测条件如下:色谱柱rrhd eclipse plus c18, 4.6 x100mm,采用乙腈-h2o为流动相进行梯度洗脱,梯度洗脱条件: 0~5min,乙腈10%;5~8.5min,乙腈从50%
→
95%;8.5~9.5min, 乙腈为95%;9.5~10min, 乙腈从95%
→
10%。流速3. ml
⋅
min
−
1,检测波长为
280 nm。
[0030]
通过hplc分析发现,山奈酚经转化得到了另外一个峰,无其他明显产物峰,其保留时间与山奈素标准样品一致(见图3、图5和图7)。经高分辨质谱检测,该产物峰的[m h]
质荷比为301.0690,预测分子式为c16h13o6(误差为5.55 ppm),与山奈素一致。经分析二级质谱,该产物与山奈素的谱图高度相似(见图4、图6和图8)。综合上述结果,判断该产物为山奈素。
[0031]
以上结果证明,本发明涉及的氧甲基转移酶可专一地将山奈酚转化为山奈素,用于淫羊藿苷等山奈酚衍生化合物的制备。
[0032]
实施例3 测试氧甲基转移酶重组载体prs425m-fsr2对其他多酚类化合物的转化能力通过hplc高效液相分离得到经fsr2修饰后的代谢产物并分析其分子结构,检验fsr2对其它黄酮类多酚化合物的催化效果。实验方法如下:1)发酵培养:采取二步法发酵技术,首先将适量的酵母转化子菌体接种至相应的25 ml ‑
leu液体缺陷培养基中,30℃、200 r
⋅
min-1培养16 h左右,再加入ypd低糖培养基25 ml,同时分别加入5mg圣草酚或木樨草素的纯品继续培养48h;用乙酸乙酯提取发酵产物,乙酸乙酯与发酵液的比例为1:1,即用50 ml的乙酸乙酯提取发酵产物;旋转蒸发仪回收乙酸乙酯干燥萃取物,1 ml甲醇复溶萃取物。
[0033]
2)高效液相(hplc)色谱检测:将上述所得发酵产物经高速离心后用高效液相色谱检测。
[0034]
hplc检测条件如下:色谱柱rrhd eclipse plus c18, 4.6 x100mm,采用乙腈-h2o为流动相进行梯度洗脱,梯度洗脱条件: 0~5min,乙腈10%;5~8.5min,乙腈从50%
→
95%;8.5~9.5min, 乙腈为95%;9.5~10min, 乙腈从95%
→
10%。流速3. ml
⋅
min
−
1,检测波长为280 nm。
[0035]
通过hplc分析发现,添加的2种底物均不能被fsr2转化,未检测到与底物相关的产物峰。重组菌株发酵产物色谱图见图9和图10。
[0036]
实施例4 应用其它真菌源或植物源氧甲基转移酶转化山奈酚比较不同来源的氧甲基转移酶将山奈酚转化为山奈素的能力。实验方法如下:经过序列比对,发现一种来源于真菌f. buxicola的氧甲基转移酶kaf(accession id:jaavuk010000131)与fsr2序列相似度较高。使用实施例一中的方法分别构建大肠杆菌-酿酒酵母穿梭质粒,转入酿酒酵母;使用实施例二中的方法培养发酵并检测其产物。
[0037]
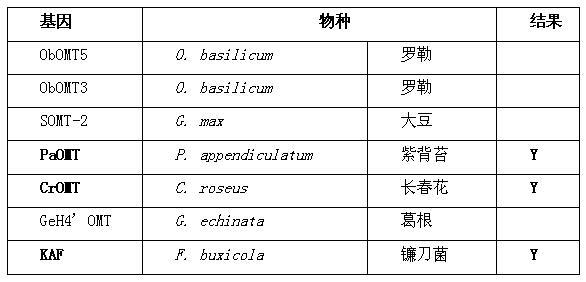
经过文献检索,得到6种可能将山奈酚转化为山奈素的植物源氧甲基转移酶(表2)。使用实施例一中的方法分别构建大肠杆菌-酿酒酵母穿梭质粒,转入酿酒酵母;使用实施例二中的方法培养发酵并检测其产物。
[0038]
经分析,上述7种氧甲基转移酶中,有3种可以转化山奈酚,即paomt(其氨基酸序列如seq id no.2所示,核苷酸酸序列如seq id no.6所示)、cromt(其氨基酸序列如seq id no.3所示,核苷酸酸序列如seq id no.7所示)、kaf(其氨基酸序列如seq id no.4所示,核苷酸酸序列如seq id no.8所示)。kaf、paomt和cromt转化山奈酚的液相色谱图如图11至图13,其中数字1标明 [m h]
为287的化合物,符合山奈酚分子量,且保留时间与山奈酚标准
品一致,表明该化合物为山奈酚;数字2标明[m h]
为301的化合物,符合山奈素分子量,且保留时间与山奈素标准品一致,表明该化合物为山奈素;数字3标明[m h]
为315的化合物,符合双氧甲基化的山奈酚分子量。
[0039]
表2 能将山奈酚转化为山奈素的植物源氧甲基转移酶然而,与fsr2相比,kaf与cromt的催化专一性虽然与fsr2相当,但转化率显著降低;paomt的催化率虽然较高,但专一性较差,增加分离提纯的难度。因此,综合考虑,fsr2在上述氧甲基转移酶中最适合应用于山奈酚到山奈素的生物转化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。