and wargo,2009)。这种scfv与来自念珠菌的热休克蛋白hsp70结合并且提高了两性霉素b的有效性。该药物由于制备问题两次被监管拒绝批准,并且对去除游离胱氨酸残基的经修饰版本进行了测试。检测到两性霉素b活性的增强,但发现其是非特异性的(richie et al.,2012)。依芬古单抗的进一步开发已被放弃。最近,已分离并描述了数种针对念珠菌细胞壁蛋白hyr1和其他未鉴定的细胞壁蛋白的人单克隆抗体(rudkin et al.,2018)。这些抗体在播散性念珠菌病小鼠模型中被动转移后具有保护作用,然而,其通过调理作用发挥作用并且增强白色念珠菌的吞噬作用。这种作用方式可能是在其中巨噬细胞或中性粒细胞功能可能受损的免疫抑制或免疫妥协的患者中使用这些抗体作为治疗剂的缺点,并且另外,白色念珠菌具有通过pra1的功能来降低补体介导的白色念珠菌黏附和摄取的机制(luo et al.,2010)。
11.抗体作用的另外的证据来源于开发基于糖肽的疫苗以防止念珠菌感染的工作。例如,在白色念珠菌细胞壁蛋白中发现的六种推定的t细胞肽与保护性β-1,2-甘露三糖[β-(man)3]聚糖表位缀合以产生糖肽缀合物(xin et al.,2008)。在圆括号中表示的肽所来源于的六种蛋白质是细胞壁相关蛋白质,其包括:果糖-二磷酸醛缩酶(fructose-bisphosphate aldolase,fba)(ygkdvkdldyaqe;seq id no:40)、甲基四氢蝶酰三谷氨酸同型半胱氨酸甲基转移酶(met6)(priggqrelkkite;seq id no:38)以及四种其他蛋白质(xin et al.,2008)。该工作的目的是使用这些肽作为t细胞表位,促进针对糖肽缀合物的聚糖部分的保护性抗体应答。因此,免疫接种方案设计成有利于抗体而不是细胞介导的免疫(cell-mediated immune,cmi)应答,并且产生了针对多种缀合物的聚糖和肽部分二者的抗体。包括β-(man)
3-fba和β-(man)
3-meth缀合物在内的三种糖缀合物诱导保护免受真菌的血源性攻击,如通过小鼠存活和低肾真菌负担证明的。另外,针对单独的fba和met6肽产生的小鼠单克隆抗体也在被动转移之后保护小鼠(xin et al.,2008)。
[0012]
许多念珠菌蛋白已被鉴定为致病因素(mayer,wilson,and hube,2014),包括兼职蛋白(moonlighting protein)果糖-二磷酸醛缩酶(fba)和5-甲基四氢蝶酰三谷氨酸同型半胱氨酸甲基转移酶(met6)(gancedo et al.,2016;medrano-diaz,et al.,2018)。这些代谢酶通常位于胞内,但也通过未知的机制被分泌并与真菌细胞壁结合,在那里其充当毒力因子。兼职蛋白通过多种机制作为毒力因子来发挥作用,所述机制包括与纤溶酶原、纤连蛋白、胞外基质蛋白或补体固定抑制剂的结合,或者作为黏附分子与宿主细胞结合以募集炎性应答。因此,这些毒力因子允许致病性念珠菌属的侵袭和逃避宿主防御机制的能力(henderson and martin,2011)。
[0013]
美国专利6,309,642、6,391,587和6,403,090以及美国专利申请公开u.s.2003/0072775公开了基于模拟磷甘露聚糖(phosphormanna)表位的肽或编码肽模拟表位的多核苷酸的疫苗,并且公开了用于针对白色念珠菌感染的被动免疫接种的小鼠单克隆抗体,包括mab b6.1。
技术实现要素:
[0014]
因此,根据本发明,提供了在对象中检测念珠菌感染的方法。在一些实施方案中,该方法包括(a)使来自所述对象的样品与具有克隆配对的分别来自表3和4的重链cdr序列和轻链cdr序列的抗体或抗体片段接触;(b)通过所述抗体或抗体片段与所述样品中的念珠
菌抗原的结合来检测所述样品中的念珠菌。样品可以是体液,例如血液、痰、泪、唾液、黏液或血清、精液、宫颈或阴道分泌物、羊水、胎盘组织、尿、渗出物(exudate)、渗出液(transudate)、组织刮屑(scraping)或粪便。检测可包括elisa、ria、侧流测定(lateral flow assay)或western印迹。该方法还可包括第二次进行步骤(a)和(b)以及确定与第一次测定相比念珠菌抗原水平的变化。念珠菌可以是任何致病性念珠菌物种,其包括但不限于白色念珠菌、光滑念珠菌、热带念珠菌或耳念珠菌。
[0015]
在一些实施方案中,抗体或抗体片段可由如表1中所示的任何克隆配对可变序列编码。抗体或抗体片段可由与表1中所示的序列具有至少70%同一性的可变序列编码。在某些实施方案中,抗体或抗体片段由与如表1中所示的克隆配对可变序列具有约70%、约80%或约90%同一性的轻链和重链可变序列编码。抗体或抗体片段可由与如表1中所示的克隆配对序列具有约95%同一性的轻链和重链可变序列编码。在一些实施方案中,抗体或抗体片段包含根据来自表2的克隆配对序列的轻链和重链可变序列。抗体或抗体片段包含与表2中所示的序列具有至少70%同一性的可变序列。在某些实施方案中,抗体或抗体片段可包含与来自表2的克隆配对序列具有约70%、约80%或约90%同一性的轻链和重链可变序列。抗体或抗体片段可包含与来自表2的克隆配对序列具有约95%同一性的轻链和重链可变序列,或者可包含根据来自表2的克隆配对序列的轻链和重链可变序列。抗体片段可以是重组scfv(单链可变片段)抗体、fab片段、f(ab’)2片段或fv片段。
[0016]
在另一个实施方案中,提供了治疗感染念珠菌的对象或降低处于感染念珠菌风险之中的对象的感染可能性的方法,其包括向所述对象递送具有克隆配对的分别来自表3和4的重链cdr序列和轻链cdr序列的抗体或抗体片段。抗体或抗体片段可具有克隆配对的cdr,其与表3和4中所示的序列具有至少70%同一性。在某些实施方案中,抗体或抗体片段具有克隆配对的cdr,其与来自表3和4的序列具有约70%、约80%或约90%同一性。抗体或抗体片段可由如表1中所示的克隆配对可变序列编码。抗体或抗体片段可由与表1中所示的序列具有至少70%同一性的可变序列编码。在某些实施方案中,抗体或抗体片段由与如表1中所示的克隆配对可变序列具有约70%、约80%或约90%同一性的轻链和重链可变序列编码。抗体或抗体片段可由与如表1中所示的克隆配对序列具有约95%同一性的轻链和重链可变序列编码。在一些实施方案中,抗体或抗体片段包含根据来自表2的克隆配对序列的轻链和重链可变序列。抗体或抗体片段可包含与表2中所示的序列具有至少70%同一性的可变序列。在某些实施方案中,抗体或抗体片段可包含与来自表2的克隆配对序列具有约70%、约80%或约90%同一性的轻链和重链可变序列。抗体或抗体片段可包含与来自表2的克隆配对序列具有约95%同一性的轻链和重链可变序列,或者可包含根据来自表2的克隆配对序列的轻链和重链可变序列。念珠菌可以是任何致病性念珠菌物种,其包括但不限于白色念珠菌、光滑念珠菌、热带念珠菌或耳念珠菌。
[0017]
抗体片段可以是重组scfv(单链可变片段)抗体、fab片段、f(ab’)2片段或fv片段。抗体可以是嵌合抗体或双特异性抗体。抗体可以是igg或重组igg抗体或抗体片段,其包含突变成改变(消除或增强)fcr相互作用、提高半衰期和/或提高治疗效力的fc部分,例如lala、n297、gasd/alie、yte或ls突变;或者修饰成改变(消除或增强)fcr相互作用的聚糖,例如酶促或化学添加或去除聚糖或者在用限定的糖基化模式改造的细胞系中表达。抗体或抗体片段还可包含细胞穿透肽。抗体或抗体片段可以是胞内抗体。
[0018]
抗体或抗体片段可在感染之前或在感染之后施用。对象可以是妊娠雌性、性活跃雌性或正在接受生育治疗的雌性。递送可包括抗体或抗体片段施用,或者用编码抗体或抗体片段的rna或dna序列或载体进行的遗传递送。
[0019]
在又一个实施方案中,提供了单克隆抗体,其中抗体或抗体片段的特征在于克隆配对的分别来自表3和4的重链cdr序列和轻链cdr序列。抗体或抗体片段可具有克隆配对的cdr,其与表3和4中所示的序列具有至少70%同一性。在某些实施方案中,抗体或抗体片段具有克隆配对的cdr,其与来自表3和4的序列具有约70%、约80%或约90%同一性。抗体或抗体片段可由如表1中所示的克隆配对可变序列编码。抗体或抗体片段可由与表1中所示的序列具有至少70%同一性的可变序列编码。在某些实施方案中,抗体或抗体片段由与如表1中所示的克隆配对可变序列具有约70%、约80%或约90%同一性的轻链和重链可变序列编码。抗体或抗体片段可由与如表1中所示的克隆配对序列具有约95%同一性的轻链和重链可变序列编码。在一些实施方案中,抗体或抗体片段包含根据来自表2的克隆配对序列的轻链和重链可变序列。抗体或抗体片段可包含与表2中所示的序列具有至少70%同一性的可变序列。在某些实施方案中,抗体或抗体片段可包含与来自表2的克隆配对序列具有约70%、约80%或约90%同一性的轻链和重链可变序列。抗体或抗体片段可包含与来自表2的克隆配对序列具有约95%同一性的轻链和重链可变序列,或者可包含根据来自表2的克隆配对序列的轻链和重链可变序列。念珠菌可以是任何致病性念珠菌物种,其包括但不限于白色念珠菌、光滑念珠菌、热带念珠菌或耳念珠菌。
[0020]
抗体片段可以是重组scfv(单链可变片段)抗体、fab片段、f(ab’)2片段或fv片段。抗体可以是嵌合抗体或双特异性抗体。抗体可以是igg或重组igg抗体或抗体片段,其包含突变成改变(消除或增强)fcr相互作用、提高半衰期和/或提高治疗效力的fc部分,例如lala、n297、gasd/alie、yte或ls突变;或者修饰成改变(消除或增强)fcr相互作用的聚糖,例如酶促或化学添加或去除聚糖或者在用限定的糖基化模式改造的细胞系中表达。抗体或抗体片段还可包含细胞穿透肽。抗体或抗体片段可以是胞内抗体。
[0021]
在又一个实施方案中,提供了编码抗体或抗体片段的杂交瘤或经改造的细胞,其中抗体或抗体片段的特征在于克隆配对的分别来自表3和4的重链cdr序列和轻链cdr序列。抗体或抗体片段可具有克隆配对的cdr,其与表3和4中所示的序列具有至少70%同一性。在某些实施方案中,抗体或抗体片段具有克隆配对的cdr,其与来自表3和4的序列具有约70%、约80%或约90%同一性。抗体或抗体片段可由如表1中所示的克隆配对可变序列编码。抗体或抗体片段可由与表1中所示的序列具有至少70%同一性的可变序列编码。在某些实施方案中,抗体或抗体片段由与如表1中所示的克隆配对可变序列具有约70%、约80%或约90%同一性的轻链和重链可变序列编码。抗体或抗体片段可由与如表1中所示的克隆配对序列具有约95%同一性的轻链和重链可变序列编码。在一些实施方案中,抗体或抗体片段可包含根据来自表2的克隆配对序列的轻链和重链可变序列。抗体或抗体片段可包含与表2中所示的序列具有至少70%同一性的可变序列。在某些实施方案中,抗体或抗体片段可包含与来自表2的克隆配对序列具有约70%、约80%或约90%同一性的轻链和重链可变序列。抗体或抗体片段可包含与来自表2的克隆配对序列具有约95%同一性的轻链和重链可变序列,或者可包含根据来自表2的克隆配对序列的轻链和重链可变序列。
[0022]
抗体片段可以是重组scfv(单链可变片段)抗体、fab片段、f(ab’)2片段或fv片段。
抗体可以是嵌合抗体或双特异性抗体。抗体可以是igg或重组igg抗体或抗体片段,其包含突变成改变(消除或增强)fcr相互作用、提高半衰期和/或提高治疗效力的fc部分,例如lala、n297、gasd/alie、yte或ls突变;或者修饰成改变(消除或增强)fcr相互作用的聚糖,例如酶促或化学添加或去除聚糖或者在用限定的糖基化模式改造的细胞系中表达。抗体或抗体片段还可包含细胞穿透肽。抗体或抗体片段可以是胞内抗体。
[0023]
在另一个实施方案中,提供了包含一种或更多种抗体或抗体片段的疫苗制剂,所述抗体或抗体片段的特征在于克隆配对的分别来自表3和4的重链和轻链cdr序列。抗体或抗体片段可具有克隆配对的cdr,其与表3和4中所示的序列具有至少70%同一性。在某些实施方案中,抗体或抗体片段具有克隆配对的cdr,其与来自表3和4的序列具有约70%、约80%或约90%同一性。抗体或抗体片段可由如表1中所示的克隆配对可变序列编码。抗体或抗体片段可由与表1中所示的序列具有至少70%同一性的可变序列编码。在某些实施方案中,抗体或抗体片段由与如表1中所示的克隆配对可变序列具有约70%、约80%或约90%同一性的轻链和重链可变序列编码。抗体或抗体片段可由与如表1中所示的克隆配对序列具有约95%同一性的轻链和重链可变序列编码。在一些实施方案中,抗体或抗体片段可包含根据来自表2的克隆配对序列的轻链和重链可变序列。抗体或抗体片段可包含与表2中所示的序列具有至少70%同一性的可变序列。在某些实施方案中,抗体或抗体片段可包含与来自表2的克隆配对序列具有约70%、约80%或约90%同一性的轻链和重链可变序列。抗体或抗体片段可包含与来自表2的克隆配对序列具有约95%同一性的轻链和重链可变序列,或者可包含根据来自表2的克隆配对序列的轻链和重链可变序列。
[0024]
抗体片段可以是重组scfv(单链可变片段)抗体、fab片段、f(ab’)2片段或fv片段。抗体可以是嵌合抗体或双特异性抗体。抗体可以是igg或重组igg抗体或抗体片段,其包含突变成改变(消除或增强)fcr相互作用、提高半衰期和/或提高治疗效力的fc部分,例如lala、n297、gasd/alie、yte或ls突变;或者修饰成改变(消除或增强)fcr相互作用的聚糖,例如酶促或化学添加或去除聚糖或者在用限定的糖基化模式改造的细胞系中表达。抗体或抗体片段还可包含细胞穿透肽。抗体或抗体片段可以是胞内抗体。
[0025]
在又一个实施方案中,提供了疫苗制剂,其包含编码第一抗体或抗体片段的一种或更多种表达载体,所述第一抗体或抗体片段为如本文中所述的抗体或抗体片段。表达载体可以是辛德毕斯病毒(sindbis virus)或vee载体。疫苗可配制成用于通过针注射、喷射注射或电穿孔来递送。疫苗还可包含编码第二抗体或抗体片段的一种或更多种表达载体,所述第二抗体或抗体片段例如不同的如本文中所述的抗体或抗体片段。
[0026]
并且另外的一个实施方案包括保护感染念珠菌或处于感染念珠菌风险之中的妊娠对象的胎盘和/或胎儿的健康的方法,其包括向所述对象递送抗体或抗体片段,所述抗体或抗体片段具有克隆配对的分别来自表3和表4的重链cdr序列和轻链cdr序列。抗体或抗体片段可具有克隆配对的cdr,其与表3和4中所示的序列具有至少70%同一性。在某些实施方案中,抗体或抗体片段具有克隆配对的cdr,其与来自表3和4的序列具有约70%、约80%或约90%同一性。抗体或抗体片段可由如表1中所示的克隆配对可变序列编码。抗体或抗体片段可由与表1中所示的序列具有至少70%同一性的可变序列编码。在某些实施方案中,抗体或抗体片段由与如表1中所示的克隆配对可变序列具有约70%、约80%或约90%同一性的轻链和重链可变序列编码。抗体或抗体片段可由与如表1中所示的克隆配对序列具有约
95%同一性的轻链和重链可变序列编码。在一些实施方案中,抗体或抗体片段可包含根据来自表2的克隆配对序列的轻链和重链可变序列。抗体或抗体片段可包含与表2中所示的序列具有至少70%同一性的可变序列。在某些实施方案中,抗体或抗体片段可包含与来自表2的克隆配对序列具有约70%、约80%或约90%同一性的轻链和重链可变序列。抗体或抗体片段可包含与来自表2的克隆配对序列具有约95%同一性的轻链和重链可变序列,或者可包含根据来自表2的克隆配对序列的轻链和重链可变序列。念珠菌可以是任何致病性念珠菌物种,其包括但不限于白色念珠菌、光滑念珠菌、热带念珠菌或耳念珠菌。
[0027]
抗体片段可以是重组scfv(单链可变片段)抗体、fab片段、f(ab’)2片段或fv片段。抗体可以是嵌合抗体或双特异性抗体。抗体可以是igg或重组igg抗体或抗体片段,其包含突变成改变(消除或增强)fcr相互作用、提高半衰期和/或提高治疗效力的fc部分,例如lala、n297、gasd/alie、yte或ls突变;或者修饰成改变(消除或增强)fcr相互作用的聚糖,例如酶促或化学添加或去除聚糖或者在用限定的糖基化模式改造的细胞系中表达。抗体或抗体片段还可包含细胞穿透肽。抗体或抗体片段可以是胞内抗体。
[0028]
抗体或抗体片段可在感染之前或在感染之后施用。对象可以是妊娠雌性、性活跃雌性或正在接受生育治疗的雌性。递送可包括抗体或抗体片段施用,或者用编码抗体或抗体片段的rna或dna序列或载体进行的遗传递送。抗体或抗体片段与未经处理的对照相比可提高胎盘的尺寸,或者抗体或抗体片段与未经处理的对照相比可降低胎儿的真菌负荷和/或病理状况。
[0029]
另一个实施方案包括确定念珠菌抗原的抗原性完整性、正确构象和/或正确序列的方法,其包括(a)使包含所述抗原的样品与具有克隆配对的分别来自表3和4的重链cdr序列和轻链cdr序列的第一抗体或抗体片段接触;以及(b)通过所述第一抗体或抗体片段与所述抗原的可检测结合来确定所述抗原的抗原性完整性、正确构象和/或正确序列。样品可包含重组产生的抗原,或者疫苗制剂或疫苗生产批次。检测可包括elisa、ria、western印迹、使用表面等离子体共振或生物层干涉术的生物传感器、或者流式细胞术染色。该方法还可包括第二次进行步骤(a)和(b)以确定抗原随时间的抗原性稳定性。念珠菌可以是任何致病性念珠菌物种,其包括但不限于白色念珠菌、光滑念珠菌、热带念珠菌或耳念珠菌。
[0030]
第一抗体或抗体片段可由如表1中所示的克隆配对可变序列编码。抗体或抗体片段可由与表1中所示的序列具有至少70%同一性的可变序列编码。在某些实施方案中,抗体或抗体片段由与如表1中所示的克隆配对可变序列具有约70%、约80%或约90%同一性的轻链和重链可变序列编码。抗体或抗体片段可由与如表1中所示的克隆配对序列具有约95%同一性的轻链和重链可变序列编码。在一些实施方案中,抗体或抗体片段可包含根据来自表2的克隆配对序列的轻链和重链可变序列。抗体或抗体片段可包含与表2中所示的序列具有至少70%同一性的可变序列。在某些实施方案中,抗体或抗体片段可包含与来自表2的克隆配对序列具有约70%、约80%或约90%同一性的轻链和重链可变序列。抗体或抗体片段可包含与来自表2的克隆配对序列具有约95%同一性的轻链和重链可变序列,或者可包含根据来自表2的克隆配对序列的轻链和重链可变序列。第一抗体片段可以是重组scfv(单链可变片段)抗体、fab片段、f(ab’)2片段或fv片段。
[0031]
该方法还可包括(c)使包含所述抗原的样品与具有克隆配对的分别来自表3和4的重链cdr序列和轻链cdr序列的第二抗体或抗体片段接触;以及(d)通过所述第二抗体或抗
体片段与所述抗原的可检测结合来确定所述抗原的抗原性完整性。检测可包括elisa、ria、western印迹、使用表面等离子体共振或生物层干涉术的生物传感器、或者流式细胞术染色。该方法还可包括第二次进行步骤(c)和(d)以确定抗原随时间的抗原性稳定性。
[0032]
第二抗体或抗体片段可由如表1中所示的克隆配对可变序列编码。抗体或抗体片段可由与表1中所示的序列具有至少70%同一性的可变序列编码。在某些实施方案中,抗体或抗体片段由与如表1中所示的克隆配对可变序列具有约70%、约80%或约90%同一性的轻链和重链可变序列编码。抗体或抗体片段可由与如表1中所示的克隆配对序列具有约95%同一性的轻链和重链可变序列编码。在一些实施方案中,抗体或抗体片段可包含根据来自表2的克隆配对序列的轻链和重链可变序列。抗体或抗体片段可包含与表2中所示的序列具有至少70%同一性的可变序列。在某些实施方案中,抗体或抗体片段可包含与来自表2的克隆配对序列具有约70%、约80%或约90%同一性的轻链和重链可变序列。抗体或抗体片段可包含与来自表2的克隆配对序列具有约95%同一性的轻链和重链可变序列,或者可包含根据来自表2的克隆配对序列的轻链和重链可变序列。第二抗体片段可以是重组scfv(单链可变片段)抗体、fab片段、f(ab’)2片段或fv片段。
[0033]
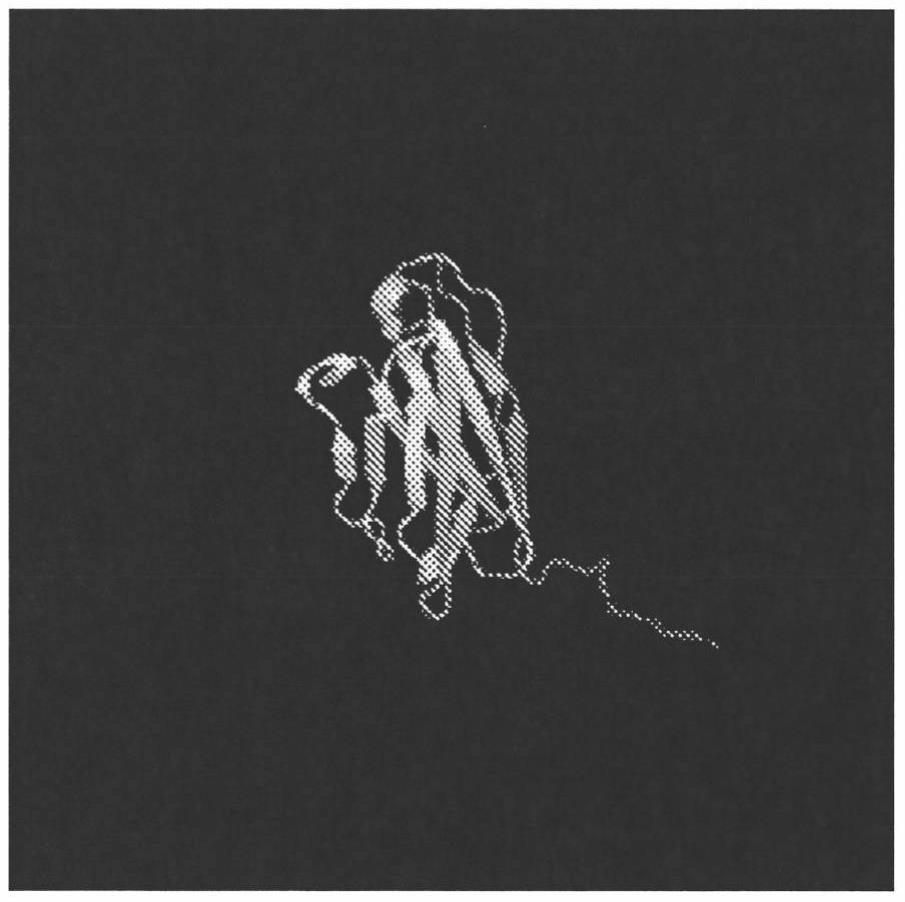
另外,提供了单克隆抗体或其片段,其中该抗体或抗体片段包含克隆配对的重链cdr序列和轻链cdr序列,其中重链cdr序列选自表3,并且其中轻链cdr序列选自表4,并且其中该抗体或其片段通过其vl和/或vh互补位与其同源抗原特异性结合,该互补位包含来自选自图10、图11、图12和图13的带状图中示出的红色或橙色带的至少5个氨基酸。
[0034]
抗体或抗体片段可由根据选自表1的克隆配对序列的轻链和重链可变核苷酸序列编码,可由与选自表1的克隆配对序列具有至少70%、80%或90%同一性的轻链和重链可变核苷酸序列编码,或者可由与选自表1的克隆配对序列具有至少95%同一性的轻链和重链可变核苷酸序列编码。抗体或抗体片段可包含选自表2的克隆配对序列的轻链可变序列和重链可变序列,可包含与选自表2的克隆配对序列具有至少70%、80%或90%同一性的轻链可变序列和重链可变序列,或者可包含与选自表2的克隆配对序列具有95%同一性的轻链可变序列和重链可变序列。
[0035]
抗体片段可以是重组scfv(单链可变片段)抗体、fab片段、片段或fv片段。抗体可以是嵌合抗体或双特异性抗体。抗体可以是igg,或重组igg抗体或抗体片段,其包含突变的fc部分。突变的fc部分可改变、消除或增强fcr相互作用,提高半衰期,提高治疗效力,或其组合。突变的fc部分可包含lala突变、n297突变、gasd/alie突变、yte突变或ls突变。突变的fc部分可以是经聚糖修饰的。聚糖修饰可改变、消除或增强fcr相互作用。聚糖修饰可包括酶促或化学添加或去除聚糖或者在用限定的糖基化模式改造的细胞系中表达。抗体或抗体片段还可包含细胞穿透肽和/或为胞内抗体。
[0036]
当在权利要求书和/或说明书中与术语“包含/包括”结合使用时,没有数量词修饰的名词的使用可意指“一个/种”,但是其也符合“一个/种或更多个/种”、“至少一个/种”和“一个/种或多于一个/种”的含义。本文中使用的词语“约”意指大约、大致、大概或在区域中。当术语“约”与数值范围结合使用时,其通过将边界扩展到所示数值之上和之下来修改该范围。术语“约”可意指加上或减去所述数字的5%。
[0037]
本文中所述的任何方法或组合物可相对于本文中所述的任何其他方法或组合物来实施。根据以下详细描述,本发明的其他目的、特征和优点将变得明显。然而,应理解,详
细描述和具体实例尽管指出了本公开内容的一些具体实施方案,但仅通过举例说明的方式给出,因为根据该详细描述,在本公开内容的精神和范围内的多种改变和修改对于本领域技术人员而言将变得明显。
附图说明
[0038]
本专利或申请文件包含至少一幅彩色绘制的附图。在提出请求并支付必要的费用后,官方将提供带有彩色附图的该专利或专利申请公开的副本。
[0039]
以下附图构成本说明书的一部分,并且被包括在内以进一步说明本发明的某些方面。通过参照这些附图中的一幅或更多幅并结合本文中所示具体实施方案的详细描述,可以更好地理解本公开内容。
[0040]
图1示出了抗体与用肽fba(seq id no:40)或met6(seq id no:38)或来自十个不同人供体(l70.s、l10.s、l56.s、c22-1、c06-1、c07-3、c14-2、l57.s、c-14-1、s-079)的血清样品的缓冲液包被的孔结合的elisa数据。阳性对照包括1.10c(抗met6;seq id no:12和seq id no:13)和1.11d(抗fba;seq id no:10和seq id no:11)。
[0041]
图2示出了针对抗体1.10c(抗met6;seq id no:12和seq id no:13)的elisa抑制数据,使用合成的met6肽(seq id no:38)作为抑制剂来确定1.10c与met6肽的反应和结合亲和力。每个点是三个测定的平均值,并且显示的数据来自四个独立实验的典型实验。
[0042]
图3示出了针对抗体1.11d(抗fba;seq id no:10和seq id no:11)的elisa抑制数据,使用合成的fba肽(seq id no:40)作为抑制剂来确定1.11d与fba肽的反应和结合亲和力。每个点是三个测定的平均值,并且显示的数据来自四个独立实验的典型实验。
[0043]
图4示出了如通过生物层干涉术确定的抗体1.10c(右图)和1.11d(左图)与其同源生物素化肽(met6-生物素,seq id no:39;fba-生物素,seq id no:41)结合的动力学亲和常数的确定。
[0044]
图5示出了通过生物层干涉术确定的抗体1.10c(右图)和1.11d(左图)与其同源生物素化肽(met6-生物素,seq id no:39;fba-生物素,seq id no:41)结合的稳态亲和常数的确定。
[0045]
图6利用生物层干涉术显示出抗体1.11d(抗fba;seq id no:10和seq id no:11)与来自白色念珠菌(顶部)和耳念珠菌(底部)二者的全长重组fba蛋白特异性结合。抗体1.10c(抗met6;seq id no:12和seq id no:13)用作阴性对照。
[0046]
图7利用生物层干涉术显示出抗体1.10c(抗met6;seq id no:12和seq id no:13)与来自白色念珠菌二者的全长重组met6蛋白特异性结合。抗体1.11d(抗fba;seq id no:10和seq id no:11)用作阴性对照。
[0047]
图8示出了通过被动转移mab 1.10c(抗met6;seq id no:12和seq id no:13)和1.11d(抗fba;seq id no:10和seq id no:11)的递送赋予针对由白色念珠菌造成的死亡的保护。在对c57b/l6小鼠用致死剂量的白色念珠菌3153a细胞进行血源性攻击之前四小时,给予其i.p.剂量的单独抗体或组合抗体。氟康唑
tm
(flc)用作阳性对照并且磷酸缓冲盐水(dpbs)用作阴性对照。
[0048]
图9示出了通过被动转移包含mab 1.10c(抗met6;seq id no:12和seq id no:13)和1.11d(抗fba;seq id no:10和seq id no:11)的混合物的递送赋予针对由耳念珠菌造成
的死亡的保护。在对a/j小鼠用致死剂量的耳念珠菌细胞进行血源性攻击之前四小时,给予其i.p.剂量的单独抗体或组合抗体。氟康唑
tm
(flc)用作阳性对照并且磷酸缓冲盐水(dpbs)用作阴性对照。
[0049]
图10至11.met6抗体2b10的蛋白质建模。
[0050]
图12至13.fba抗体2b10的蛋白质建模。
具体实施方式
[0051]
如上所述,本公开内容涉及与念珠菌结合并中和念珠菌的抗体及其使用方法。
[0052]
以下详细描述了本公开内容的这些方面和另一些方面。
[0053]
本文中提供了一个或多个优选实施方案的详细描述。然而,应当理解,本发明可以以各种形式实施。因此,本文中公开的具体细节不应被解释为限制性的,而是应解释为权利要求的基础以及用于教导本领域技术人员以任何适当方式使用本发明的代表性基础。
[0054]
除非上下文另外明确规定,否则单数形式包括复数对象。
[0055]
在本文中使用任意短语“例如”、“如”、“包括”等的任何地方,除非另有明确说明,否则应理解为短语“且没有限制”。类似地,“实例”、“示例性”等被理解为非限制性的。
[0056]
术语“基本上”允许不会对预期目的产生负面影响的与描述对象的偏差。即使没有明确地记载“基本上”一词,描述性术语也应被理解为被术语“基本上”修饰。
[0057]
术语“包含”和“包括”和“具有”和“涉及”(以及类似地“含有”、“含”、“有”和“涉及”)等可互换使用并且具有相同的含义。具体地,每个术语被定义成与美国专利法的共同定义“包括”一致,因此被解释为意指“至少以下”的开放性术语,并且还被解释为不排除另外的特征、限制、方面等。因此,例如,“涉及步骤a、b和c的过程”意指该过程至少包括步骤a、b和c。在不使用数量词的任何地方,都应理解为“一个/种或更多个/种”,除非这种解释在上下文中是无意义的。
[0058]
本文中可互换使用的“对象”、“个体”或“患者”可指脊椎动物,优选哺乳动物,更优选人。在某些实施方案中,“对象”、“个体”或“患者”是指爬行动物。哺乳动物包括但不限于鼠、猿猴、人、农场动物、运动动物和宠物。术语“宠物”包括狗、猫、豚鼠、小鼠、大鼠、兔、雪貂、蛇、龟、蜥蜴、鸟等。术语农场动物包括马、绵羊、山羊、鸡、猪、牛、驴、美洲驼(1lama)、羊驼(alpaca)、火鸡等。
[0059]
术语“样品”或“生物样品”可指从对象分离的组织、细胞和生物流体,以及存在于对象中的组织、细胞和流体。因此,在术语“样品”或“生物样品”的使用中包括血液和血液的一部分或组分,其包括血清、血浆或淋巴。“样品”或“生物样品”还可包括痰、泪、唾液、黏液或血清、精液、宫颈或阴道分泌物、羊水、胎盘组织、尿、渗出物、渗出液、组织刮屑或粪便。
[0060]
i.念珠菌和念珠菌病
[0061]
a.念珠菌属
[0062]
念珠菌是酵母属,并且是全世界真菌感染的最常见原因。许多物种是包括人在内的宿主的无害共生体或内共生体;然而,当黏膜屏障被破坏或免疫系统受损时,它们可侵袭并引起疾病,这被称为机会性感染。白色念珠菌是最常见的分离的物种,并且可在人和其他动物中引起感染(念珠菌病或鹅口疮)。在葡萄酒酿造中,一些念珠菌物种可破坏葡萄酒。
[0063]
在肠菌群中发现了许多物种,包括哺乳动物宿主中的白色念珠菌,而其他物种则
作为昆虫宿主中的内共生体生活。在美国,特别是在具有受损免疫系统(免疫妥协)的患者中的血流和主要器官的全身感染(念珠菌血症或侵袭性念珠菌病)每年影响超过90,000人。
[0064]
抗生素促进酵母(真菌)感染,包括胃肠道(gi)念珠菌过度生长和gi黏膜的穿透。虽然女性对生殖器酵母感染更易感,但男性也可被感染。某些因素,例如长期使用抗生素,提高了男性和女性二者的风险。患有糖尿病或免疫妥协的人,例如感染hiv的那些,对酵母感染更易感。
[0065]
当在实验室中生长时,念珠菌表现为大的、圆的、白色或奶油色的菌落,其在室温下在琼脂板上散发出酵母气味。白色念珠菌将葡萄糖和麦芽糖发酵成酸和气体,将蔗糖发酵成酸,并且不发酵乳糖,这有助于将其与其他念珠菌物种区分开来。
[0066]
最近的分子系统发育研究显示,念珠菌属是极其多系的(涵盖不形成自然群体的远距离相关物种)。在廉价的分子方法出现之前,从受感染患者分离的酵母通常被称为念珠菌而没有与其他念珠菌物种有关系的明显证据。例如,光滑念珠菌、吉利蒙念珠菌和葡萄牙念珠菌明显被错误分类,并且一旦完成系统发育重组,它们将被归入其他属。
[0067]
一些念珠菌物种在将其核基因翻译成多肽的氨基酸序列时使用非标准遗传密码。拥有这种替代密码的物种之间遗传密码的差异是被酵母翻译为不同的氨基酸丝氨酸的密码子cug(通常编码氨基酸亮氨酸)。这些物种中cug密码子的替代翻译是由于丝氨酸-trna中的核酸序列(ser-trnacag),其具有位于反密码子的第33位、5’处的鸟苷。在所有其他trna中,该位置通常被嘧啶(通常是尿苷)占据。这种遗传密码变化在原核生物和真核生物二者中是唯一这样的已知胞质mrna变化,其涉及有义密码子的重新分配。这种遗传密码可以是更快速地适应生物体环境的机制,并且通过产生促进物种形成的遗传屏障在念珠菌属的进化中发挥重要作用。
[0068]
念珠菌在健康成人皮肤上以低数目几乎普遍存在,并且白色念珠菌是呼吸道、胃肠道和雌性生殖道的黏膜正常菌群的一部分。与其他组织相比,皮肤的干燥阻止真菌的生长,但受损的皮肤或擦伤区域的皮肤更容易快速生长。
[0069]
包括白色念珠菌在内的数种物种的过度生长可引起从表面(例如口咽念珠菌病(鹅口疮)或外阴阴道念珠菌病(阴道念珠菌病)和可导致龟头炎的包皮下念珠菌病)到全身(例如真菌血症和侵袭性念珠菌病)的感染。口腔念珠菌病在老年义齿佩戴者中是常见的。在其他健康个体中,这些感染可使用表面或全身抗真菌药物(通常是非处方抗真菌治疗,如咪康唑或克霉唑)来治愈。在衰弱或免疫妥协的患者中,或者如果静脉内地引入(到血液中),念珠菌病可成为产生脓肿、血栓性静脉炎、心内膜炎或者眼或其他器官的感染的全身性疾病。通常,相对严重的中性粒细胞减少(低中性粒细胞)是念珠菌通过皮肤防御并在深层组织中引起疾病的先决条件;在这样的情况下,受感染皮肤部位的机械破坏通常是真菌侵入深层组织的因素。
[0070]
在念珠菌物种中,白色念珠菌是人菌群的正常成分,是皮肤和胃肠道和泌尿生殖道的共生体,是大多数念珠菌血流感染(念珠菌血症)的原因。然而,由光滑念珠菌和皱落念珠菌(c.rugosa)引起的感染的发生率提高,这可能是因为其通常对目前使用的唑类抗真菌剂不那么易感。其他医学上重要的物种包括近平滑念珠菌、热带念珠菌、耳念珠菌和杜氏念珠菌。念珠菌物种,例如橄榄念珠菌(c.oleophila)已在水果中用作生物控制剂。
[0071]
b.念珠菌病
[0072]
念珠菌病是由于任何类型的念珠菌(一种类型的酵母)导致的真菌感染。当其影响口时,其通常被称为鹅口疮。体征和症状包括舌或者口和喉的其他区域上的白斑。其他症状可包括疼痛和吞咽问题。当其影响阴道时,其通常被称为酵母感染。体征和症状包括生殖器瘙痒、灼热、以及有时来自阴道的白色“白乳酪样(cottage cheese-like)”分泌物。阴茎的酵母感染较少见并且通常与发痒的皮疹一起存在。极少地,酵母感染可变成侵袭性的,扩散到身体的其他部位。这可导致发热以及其他症状,这取决于所涉及的部位。
[0073]
超过20种类型的念珠菌可引起感染,其中白色念珠菌是最常见的。口感染在小于一月龄的儿童、老年人和具有弱免疫系统的那些中最常见。导致弱免疫系统的病症包括hiv/aids、在器官移植之后使用的药物、糖尿病和皮质类固醇的使用。其他风险包括义齿和抗生素治疗之后。阴道感染更常发生于妊娠期间、具有弱免疫系统的那些中以及抗生素使用之后。处于侵袭性念珠菌病风险之中的个体包括低出生体重婴儿、从手术中恢复的人、许可进入重症监护病房的人,以及具有在其他情况下受损的免疫系统的人。
[0074]
预防口感染的努力包括在具有差的免疫功能的那些中使用氯己定漱口剂,以及在使用吸入性类固醇之后冲洗口。很少的证据支持用于预防或治疗的益生菌,即使在患有频繁的阴道感染的那些中也是如此。对于口感染,使用表面克霉唑或制霉菌素进行治疗通常是有效的。如果这些方法不发挥作用,可使用通过口或静脉内的氟康唑、伊曲康唑(itraconazole)或两性霉素b。许多表面抗真菌药物可用于阴道感染,包括克霉唑。在患有广泛疾病的那些中,使用棘球白素(echinocandin)例如卡泊芬净(caspofungin)或米卡芬净(micafungin)。可使用数周的静脉内两性霉素b作为替代。在某些处于非常高风险的组中,可预防性地使用抗真菌药物。
[0075]
口感染在约6%的小于一月龄的婴儿中发生。约20%的接受癌症化学治疗的那些和20%的患有aids的那些也发生该疾病。约四分之三的女性在其一生中的某个时间具有至少一次酵母感染。除了有危险因素的那些之外,广泛的疾病是少见的。
[0076]
念珠菌病的体征和症状根据受影响的区域而变化。大多数念珠菌感染导致最小的并发症,例如发红、瘙痒和不适,但是如果在某些群体中不进行治疗,并发症可以是严重甚至致命的。在健康(免疫活性)的人中,念珠菌病通常是皮肤、指甲或趾甲(甲癣)或者黏膜包括口腔和咽(鹅口疮)、食管以及生殖器(阴道、阴茎等)的局部感染;在健康个体中较少见的是,胃肠道、泌尿道和呼吸道是念珠菌感染的部位。
[0077]
在免疫妥协的个体中,与在健康个体中相比,食管中的念珠菌感染更频繁地发生,并且具有更高的可能性成为全身性的、导致严重得多的病症,称为念珠菌血症的真菌血症。食管念珠菌病的症状包括吞咽困难、吞咽疼痛、腹痛、恶心和呕吐。
[0078]
鹅口疮常见于婴儿。除非其持续超过数周,否则在婴儿中不被认为是异常的。
[0079]
阴道或外阴感染可引起严重的瘙痒、灼热、疼痛、刺激和发白或发灰白的白乳酪样分泌物。雄性生殖器感染(龟头炎鹅口疮)的症状包括阴茎头部周围皮肤发红、肿胀、刺激、阴茎头部发痒和疼痛、包皮下黏稠的块状分泌物(discharge)、令人不愉快的气味、难以缩回包皮(包茎),以及排尿时或性交期间的疼痛。
[0080]
健康个体中的胃肠道念珠菌病的常见症状是肛门瘙痒、嗳气(belching)、腹胀、消化不良、恶心、腹泻、胀气、肠痉挛、呕吐和胃溃疡。肛周念珠菌病可引起肛门瘙痒;病变在外观上可以是红斑、丘疹或溃疡,并且其不被认为是性传播疾病。肠中念珠菌的异常增殖可导
致生态失调。虽然尚不清楚,但这种改变可以是通常被描述为肠易激综合征和其他胃肠道疾病的症状的来源。
[0081]
念珠菌酵母通常存在于健康人,通常在人体的正常口腔和肠菌群的一部分中,并且特别是在皮肤上;然而,其生长通常受到人免疫系统以及其他微生物(例如在人体中占据相同位置的细菌)的竞争的限制。念珠菌的生长需要水分,尤其是在皮肤上。例如,长时间穿戴湿泳装被认为是风险因素。在极端情况下,皮肤或黏膜的浅表感染可进入血流并引起全身性念珠菌感染。
[0082]
提高念珠菌病的风险的因素包括hiv/aids、单核细胞增多症、癌症治疗、类固醇、应激、抗生素使用、糖尿病和营养缺乏。激素替代治疗和不孕治疗也可以是诱发因素。用抗生素治疗可导致消除酵母针对口腔和肠菌群中资源的天然竞争者;从而提高病症的严重程度。免疫系统减弱或不发达或者代谢疾病是念珠菌病的显著诱发因素。几乎15%具有减弱的免疫系统的人发生由念珠菌物种引起的全身性疾病。已发现高简单碳水化合物的饮食影响口腔念珠菌病的比率。
[0083]
白色念珠菌分离自19%的表面上健康的女性(即,经历很少感染症状或无感染症状的那些)的阴道。外部使用洗涤剂(detergent)或冲洗剂(douche)或者内部干扰(激素或生理)可扰乱由乳酸菌(例如乳酸杆菌)组成的正常阴道菌群,并导致念珠菌细胞过度生长,引起感染症状(例如局部炎症)。妊娠和使用经口避孕药已被报道为危险因素。糖尿病和使用抗生素也与酵母感染率提高有关。
[0084]
在阴茎念珠菌病中,原因包括与受感染个体的性交、低免疫力、抗生素和糖尿病。雄性生殖器酵母感染是较不常见,但与受感染的伴侣通过性交直接接触而引起的在阴茎上的酵母感染并不少见。
[0085]
阴道念珠菌病的症状也存在于更常见的细菌性阴道病中;需氧性阴道炎是不同的,并且应在鉴别诊断中排除。在2002年的研究中,仅33%的自我治疗酵母感染的女性实际上患有这样的感染,而大多数则患有细菌性阴道病或混合型感染。
[0086]
酵母菌感染的诊断通过显微镜检查或培养来完成。为了通过光学显微术进行鉴定,将受影响区域的刮屑或拭子(swab)放置在显微镜载片上。随后将一滴10%氢氧化钾(koh)溶液添加至试样。koh溶解皮肤细胞,但使念珠菌细胞保持完整,允许许多念珠菌物种特有的假菌丝和出芽酵母细胞的显现。
[0087]
对于培养方法,将无菌拭子在受感染的皮肤表面进行摩擦。随后将拭子在培养基上划线。将培养物在37℃(98.6
°
f)下孵育数天以允许形成酵母或细菌菌落。菌落的特征(例如形态和颜色)可允许对引起疾病症状的生物体进行初始诊断。
[0088]
呼吸道、胃肠道和食管念珠菌病需要内窥镜检查来诊断。对于胃肠道念珠菌病,需要从十二指肠获取3至5毫升流体样品用于真菌培养。胃肠道念珠菌病的诊断基于每毫升包含超过1,000个菌落形成单位的培养物。念珠菌病可分为以下这些类型:
[0089]
黏膜念珠菌病
[0090]
口腔念珠菌病(鹅口疮、口咽念珠菌病)
[0091]
·
假膜性念珠菌病
[0092]
·
红斑念珠菌病
[0093]
·
增生性念珠菌病
[0094]
·
义齿相关性口炎-约90%的病例涉及念珠菌生物体
[0095]
·
口角唇炎-念珠菌物种是约20%的病例的原因,白色念珠菌和金黄色葡萄球菌(staphylococcus aureus)混合感染是约60%的病例的原因。
[0096]
·
正中菱形舌炎
[0097]
念珠菌性外阴阴道炎(阴道酵母感染)
[0098]
念珠菌性龟头炎-阴茎头感染,几乎仅发生在未割包皮的男性中食管念珠菌病(念珠菌性食管炎)
[0099]
胃肠道念珠菌病
[0100]
呼吸道念珠菌病
[0101]
皮肤念珠菌病
[0102]
念珠菌性毛囊炎
[0103]
念珠菌性擦烂(candidal intertrigo)
[0104]
念珠菌性甲沟炎
[0105]
肛周念珠菌病,可表现为肛门瘙痒
[0106]
念珠菌疹
[0107]
慢性黏膜皮肤念珠菌病
[0108]
先天性皮肤念珠菌病
[0109]
尿布念珠菌病:儿童尿布区域的感染
[0110]
芽生菌性指间糜烂(erosio interdigitalis blastomycetica)
[0111]
由念珠菌引起的念珠菌性甲癣(指甲感染)
[0112]
全身性念珠菌病
[0113]
念珠菌血症,可导致脓毒症的真菌血症形式
[0114]
侵袭性念珠菌病(播散性念珠菌病)-通过念珠菌的器官感染慢性全身性念珠菌病(肝脾念珠菌病)-有时在从中性粒细胞减少症恢复期间出现
[0115]
抗生素念珠菌病(医源性念珠菌病)
[0116]
支持免疫系统并且简单碳水化合物不高的饮食有助于口腔和肠菌群的健康平衡。虽然酵母感染与糖尿病相关,但血糖控制水平可不影响风险。穿棉内衣以及不长时间穿湿衣服可有助于降低发生皮肤和阴道酵母感染的风险。
[0117]
当人具有减弱的免疫系统时,口腔卫生可帮助预防口腔念珠菌病。对于接受癌症治疗的人,氯己定漱口水可预防或降低鹅口疮。使用吸入性皮质类固醇的人可通过在使用吸入器之后用水或漱口剂冲洗口来降低发生口腔念珠菌病的风险。
[0118]
对于经历复发性酵母感染的女性,有限的证据是口腔或阴道内的益生菌有助于预防未来的感染。这包括作为丸剂或作为酸奶。
[0119]
念珠菌病用抗真菌药物进行治疗;这些包括克霉唑、制霉菌素、氟康唑、伏立康唑(voriconazole)、两性霉素b和棘球白素。静脉内氟康唑或静脉内棘球白素(例如卡泊芬净)通常用于治疗免疫妥协或危重个体。
[0120]
念珠菌病管理临床实践指南的2016修订版列出了大量针对念珠菌感染的特定治疗方案,其涉及不同的念珠菌物种、抗真菌药物抗性的形式、免疫状态以及感染的定位和严重程度。免疫活性个体中的胃肠道念珠菌病每天用100至200mg氟康唑治疗2至3周。
acad.sci.usa 85(16):5879-5883(1988)。在一些方面中,该区域与十至约25个氨基酸的短接头肽连接。接头可富含甘氨酸以获得柔性,并且富含丝氨酸或苏氨酸以获得溶解性,并且可使vh的n端与v
l
的c端连接,反之亦然。这种蛋白质虽然移除了恒定区并且引入了接头但是保留了原始免疫球蛋白的特异性。已描述了许多方法以辨别化学结构,用于将来自抗体v区域的天然聚集但化学分离的轻多肽链和重多肽链转化到scfv分子中,该scfv分子将折叠成与抗原结合位点的结构基本类似的三维结构。参见,例如,美国专利no.5,091,513、no.5,892,019、no.5,132,405和no.4,946,778,其各自通过引用整体并入。
[0129]
本发明的一些方面提供了分离的单克隆抗体。本文中使用的关于细胞和核酸(例如dna或rna)的术语“分离的”可以指分别从存在于天然来源的大分子中的其他dna或rna分离的分子。术语“分离的”还可以指当通过重组dna技术产生时基本上不含细胞物质、病毒物质或培养基的核酸或肽,或者当化学合成时基本上不含化学前体或其他化学物质的核酸或肽。例如,“分离的核酸”可包含未作为片段天然存在并且未在天然状态下发现的核酸片段。“分离的”还可以指从其他细胞蛋白质或组织中分离的细胞或多肽。分离的多肽可包含纯化的和重组的多肽二者。例如,“分离的抗体”可以是已从其天然环境的组分中分离和/或回收的抗体。其天然环境的污染物组分是会干扰抗体的诊断或治疗用途的物质,并且可包括酶、激素和其他蛋白质性或非蛋白质性溶质。在一些具体实施方案中,抗体被纯化至:(1)通过劳里法(lowry method)确定的抗体的按重量计大于95%,并且最特别地按重量计大于99%;(2)通过使用旋转杯序列分析仪(spinning cup sequenator)足以获得n端或内部氨基酸序列的至少15个残基的程度;或者(3)使用考马斯蓝或银染色剂在还原或非还原条件下通过sds-page的均质。由于抗体天然环境的至少一种组分将不存在,分离的抗体包括重组细胞内的原位抗体。然而,通常来说,分离的抗体将通过至少一个纯化步骤来制备。
[0130]
基础四链抗体单元是由两条相同的轻(l)链和两条相同的重(h)链构成的异四聚体糖蛋白。igm抗体由5个基础异四聚体单元以及被称为j链的另外的多肽组成,并且因此包含10个抗原结合位点,而分泌的iga抗体可聚合以形成包含2至5个基础4链单元以及j链的多价聚集体。在igg的情况下,4链单元通常为约150,000道尔顿。每条l链通过一个共价二硫键与h链连接,而两条h链根据h链同种型通过一个或更多个二硫键彼此连接。每条h和l链还具有规则间隔的链内二硫桥。每条h链在n端具有可变区(vh),随后是对于每个α和γ链的三个恒定结构域(ch),以及对于μ和同种型是四个ch结构域。每条l链在n端具有可变区(v
l
),随后是在其另一端的恒定结构域(cl)。v
l
与vh对齐,并且c
l
与重链的第一恒定结构域(c
h1
)对齐。认为特定的氨基酸残基在轻链和重链可变区之间形成界面。vh和v
l
的配对一起形成单个抗原结合位点。对于不同类别抗体的结构和特性,参见例如basic and clinical immunology,第8版,daniel p.stites,abba i.terr and tristram g.parslow(编辑),appleton&lange,norwalk,conn.,1994,第71页和第6章。
[0131]
来自任何脊椎动物物种的l链可基于其恒定结构域(cl)的氨基酸序列分配为两种明显不同的类型(称为κ和λ)之一。根据其重链的恒定结构域(ch)的氨基酸序列,免疫球蛋白可分为不同类别或同种型。存在五种类别的免疫球蛋白:iga、igd、ige、igg和igm,其具有分别定名为α、δ、ε、γ和μ的重链。基于ch序列和功能的相对较小差异,其γ和α类别进一步分为亚类,人表达以下亚类:igg1、igg2、igg3、igg4、iga1和iga2。
[0132]
术语“可变”可以指v结构域的某些区段在抗体之间序列差异很大的事实。v结构域
介导抗原结合并且提供特定抗体对其特定抗原的特异性。然而,可变性不是均匀地分布于可变区的110个氨基酸跨度中。相反,v区由15至30个氨基酸的称为框架区(framework region,fr)的相对不变的段(stretch)组成,所述相对不变的段被每个9至12个氨基酸长的称为“高变区”的极度可变的较短区域分隔。天然重链和轻链的可变区各自包含通过被形成环连接的三个高变区连接的四个fr,所述四个fr主要采用β-片层构型,并且在一些情况下形成β-片层结构的一部分。每条链中的高变区通过fr紧密地保持在一起,并且与来自其他链的高变区一起有助于抗体的抗原结合位点的形成(参见kabat et al.,sequences of proteins of immunological interest,第5版.public health service,national institutes of health,bethesda,md.(1991))。恒定结构域不直接参与抗体与抗原的结合,但表现出多种效应物功能,例如使抗体参与抗体依赖性细胞毒性(antibody dependent cellular cytotoxicity,adcc)、抗体依赖性细胞吞噬作用(antibody-dependent cellular phagocytosis,adcp)、抗体依赖性嗜中性粒细胞吞噬作用(ntibody-dependent neutrophil phagocytosis,adnp)和抗体依赖性补体沉积(antibody-dependent complement deposition,adcd)。
[0133]
当在本文中使用时,术语“高变区”可以指抗体的负责抗原结合的氨基酸残基。高变区通常包含来自“互补决定区”或“cdr”的氨基酸残基,例如,v
l
中的约第24至34位(l1)、第50至56位(l2)和第89至97位(l3)残基附近,以及vh中的约第31至35位(h1)、第50至65位(h2)和第95至102位(h3)残基附近,当根据kabat编号系统编号时;kabat et al.,sequences of proteins of immunological interest,第5版.public health service,national institutes of health,bethesda,md.(1991);和/或来自“高变环”的那些残基(例如,v
l
中的第24至34位(l1)、第50至56位(l2)和第89至97位(l3)残基,以及vh中的第26至32位(h1)、第52至56位(h2)和第95至101位(h3)残基,当根据chothia编号系统编号时chothia and lesk,j.mol.biol.196:901-917(1987);和/或来自“高变环”/cdr的那些残基(例如,v
l
中的第27至38位(l1)、第56至65位(l2)和第105至120位(l3)残基,以及vh中的第27至38位(h1)、第56至65位(h2)和第105至120位(h3)残基,当根据imgt编号系统编号时;lefranc et al.,nucl.acids res.27:209-212(1999),ruiz et al.,nucl.acids res.28:219-221(2000)。任选地,抗体在以下点中的一个或更多个处具有对称插入:v
l
中的28、36(l1)、63、74至75(l2)和123(l3),以及v
sub
h中的28、36(h1)、63、74至75(h2)和123(h3),当根据aho编号时;honneger,a.and plunkthun,a.,j.mol.biol.309:657-670(2001)。
[0134]“种系核酸残基”意指天然存在于编码恒定区或可变区的种系基因中的核酸残基。“种系基因”是在生殖细胞(即注定要变成卵子或精子的细胞)中发现的dna。“种系突变”是指在单细胞阶段在生殖细胞或受精卵中发生的特定dna的可遗传变化,并且当传递给后代时,这样的突变被并入身体的每个细胞中。种系突变与在单个体细胞中获得的体细胞突变形成对比。在一些情况下,编码可变区的种系dna序列中的核苷酸突变(即体细胞突变)并被不同的核苷酸替换。
[0135]
本文中使用的术语“单克隆抗体”可以指从基本上均质的抗体的群体获得的抗体,即除可能少量存在的可能天然存在突变之外,构成该群体的各抗体是相同的。单克隆抗体是高度特异性的,针对单一抗原位点。此外,与包含针对不同决定簇(表位)的不同抗体的多克隆抗体制备物相反,每种单克隆抗体针对抗原上的单个决定簇。除它们的特异性之外,单
克隆抗体的优点还在于其可被合成而不受其他抗体的污染。修饰语“单克隆”不应被解释为要求通过任何特定方法产生抗体。例如,本发明中可用的单克隆抗体可通过最初由kohler et al.,nature,256:495(1975)描述的杂交瘤方法来制备,或者可在对抗原特异性b细胞、响应于感染或免疫接种的抗原特异性浆母细胞进行单细胞分选,或大量经分选抗原特异性集合中从单个细胞中捕获连接的重链和轻链之后使用重组dna方法在细菌、真核动物或植物细胞中制备(参见,例如美国专利4,816,567)。“单克隆抗体”还可例如使用clackson et al.,nature,352:624-628(1991)和marks et al.,j.mol.biol.,222:581-597(1991)中描述的技术从噬菌体抗体文库分离。
[0136]
完全人抗体是其中包括cdr在内的轻链和重链二者的整个序列由人基因产生的抗体分子。例如,人单克隆抗体可通过使用人b细胞杂交瘤技术(参见kozbor et al.,immunol today 4:72,1983),以及产生人单克隆抗体的ebv杂交瘤技术(参见cole et al.在:monoclonal antibodies and cancer therapy,alan r.liss,inc.,第77至96页,1985)来制备。可使用人单克隆抗体,并且人单克隆抗体可通过使用人杂交瘤(参见cote et al.,proc.nat’l acad.sci.usa 80:2026-2030,1983)或通过在体外用eb病毒(epstein barr virus)转化人b细胞(参见cole et al.,在:monoclonal antibodies and cancer therapy,alan r.liss,inc.,第77至96页,1985)来产生。
[0137]
另外,人抗体也可使用其他技术产生,包括噬菌体展示文库(xee hoogenboom and winter,j.mol.biol,227:381,1991;marks et al.,j.mol.biol.,222:581,1991)。类似地,人抗体可通过将人免疫球蛋白基因座引入到转基因动物,例如其中内源性免疫球蛋白基因已部分或完全失活的小鼠中来制备。在攻击之后观察到人抗体产生,这在所有方面包括基因重排、组装和抗体组库均与在人中所见非常相似。这种方法例如在美国专利no.5,545,807、5,545,806、5,569,825、5,625,126、5,633,425、5,661,016中以及在marks et al.,bio/technology 10,779-783(1992);lonberg et al.,nature 368 856-859(1994);morrison,nature 368,812-13(1994);fishwild et al.,nature biotechnology 14,845-51(1996);neuberger,nature biotechnology 14,826(1996)和lonberg and huszar,intern.rev.immunol.1365-93(1995)中进行了描述。
[0138]
人抗体可另外使用转基因非人动物产生,这些转基因动物被修饰以产生完全人抗体而不是动物内源性抗体以响应于通过抗原的攻击(参见pct公开wo94/02602和美国专利no.6,673,986)。非人宿主中编码重免疫球蛋白链和轻免疫球蛋白链的内源性基因已失能,并且编码人重链和轻链免疫球蛋白的活性基因座被插入到宿主基因组中。例如,使用包含必需的人dna区段的酵母人工染色体并入人基因。随后通过使包含比完全补体更少的修饰的中间转基因动物杂交来获得提供所有期望的修饰的动物作为子代。这样的非人动物的优选实施方案是小鼠并且被称为xenomouse
tm
,如在pct公开wo 96/33735和wo 96/34096中所公开的。这种动物产生分泌完全人免疫球蛋白的b细胞。抗体可从用目的免疫原,如例如多克隆抗体制剂进行免疫接种之后的动物中直接获得,或者替代地从来源于动物的永生化b细胞,例如产生单克隆抗体的杂交瘤中获得。另外,可回收并表达编码具有人可变区的免疫球蛋白的基因以直接获得抗体,或者可进一步修饰以获得抗体的类似物,例如如单链fv(scfv)分子。另外,可聘请公司例如creative biolabs(shirley,ny)以使用与本文中所述的类似的技术来提供针对所选择抗原的人抗体。
[0139]
a.一般方法
[0140]
与念珠菌结合的单克隆抗体将具有多种应用。这些包括产生用于检测和诊断念珠菌感染以及用于治疗其的诊断试剂盒。在这些情况下,可将这样的抗体与诊断或治疗剂连接,将其在竞争性测定中用作捕获剂或竞争剂,或者单独使用它们而没有与其连接的另外的试剂。如下文进一步讨论的,抗体可突变或被修饰。用于制备和表征抗体的方法是本领域中公知的(参见,例如,antibodies:a laboratory manual,cold spring harbor laboratory,1988;美国专利4,196,265)。
[0141]
用于产生单克隆抗体(monoclonal antibody,mab)的方法通常沿着与用于制备多克隆抗体的方法相同的路线开始。这两种方法的第一步均是对合适的宿主进行免疫接种或鉴定由于之前的自然感染或用许可的或实验疫苗进行疫苗接种而免疫接种的对象。如本领域中公知的,用于免疫接种的给定组合物的免疫原性可不同。因此,通常有必要加强宿主的免疫系统,如可通过将肽或多肽免疫原与载体偶联来实现。一些示例性且优选的载体是钥孔戚血蓝蛋白(keyhole limpet hemocyanin,klh)和牛血清白蛋白(bovine serum albumin,bsa)。其他白蛋白例如卵白蛋白、小鼠血清白蛋白或兔血清白蛋白也可用作载体。用于使多肽与载体蛋白缀合的方式是本领域中公知的,并且包括戊二醛、间马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯(m-maleimidobencoyl-n-hydroxysuccinimide ester)、碳二亚胺(carbodiimyde)和双-重氮联苯胺(bis-biazotized benzidine)。同样如本领域中公知的,特定免疫原组合物的免疫原性可通过使用免疫应答的非特异性刺激物(称为佐剂)来增强。动物中的示例性且优选的佐剂包括完全弗氏佐剂(包含经杀伤结核分枝杆菌(mycobacterium tuberculosis)的免疫应答的非特异性刺激物)、不完全弗氏佐剂和氢氧化铝佐剂,并且在人中,包括明矾、cpg、mfp59以及免疫刺激分子的组合(“佐剂系统”,例如as01或as03)。可进行另外实验接种形式来诱导念珠菌特异性b细胞,包括纳米粒疫苗,或在物理递送系统(例如脂质纳米粒或在金生物弹道珠上)中作为dna或rna基因递送以及利用针、基因枪、经皮电穿孔装置递送的基因编码抗原。抗原基因也可由有复制能力或复制缺陷型病毒载体例如腺病毒、腺相关病毒、痘病毒、疱疹病毒或甲病毒复制子或替代地病毒样颗粒编码来携带。
[0142]
在针对天然病原体的人抗体的情况下,合适的方法是识别已暴露于病原体的对象,例如已被诊断为已感染该疾病的那些或已接种疫苗以产生针对该病原体的保护性免疫的那些,或者测试实验疫苗的安全性或有效性。可检测循环的抗病原体抗体,并随后可从抗体阳性对象获得编码或产生b细胞的抗体。
[0143]
用于产生多克隆抗体的免疫原组合物的量根据免疫原的性质以及用于免疫接种的动物而不同。可使用多种途径来施用免疫原(皮下、肌内、皮内、静脉内和腹膜内)。可通过在免疫接种之后的不同时间点对经免疫接种的动物采血来监测多克隆抗体的产生。还可给予第二、加强注射。重复加强免疫和滴定过程直至获得合适的效价。当获得期望的免疫原性水平时,可对经免疫接种的动物采血并分离和储存血清,和/或可将动物用于产生mab。
[0144]
在免疫接种之后,选择可产生抗体的体细胞,特别是b淋巴细胞(b细胞),用于mab产生方案。这些细胞可从活检的脾、淋巴结、扁桃体或腺样体、骨髓抽吸物或活检物、来自黏膜器官例如肺或gi道的组织活检物或者从循环血液获得。然后将来自经免疫接种的动物或免疫人的抗体产生b淋巴细胞与永生化骨髓瘤细胞的细胞融合,其通常是与经免疫接种的
动物为同一物种的永生化骨髓瘤细胞或者是人或人/小鼠嵌合细胞。适用于产生杂交瘤的融合程序的骨髓瘤细胞系优选地不产生抗体、具有高融合效率和酶缺陷,这然后使得其不能在仅支持期望的融合细胞(杂交瘤)生长的某些选择培养基中生长。如本领域技术人员已知的,可使用多种骨髓瘤细胞中的任一种(goding,第65至66页,1986;campbell,第75至83页,1984)。hmma2.5细胞或mfp-2细胞是这样的细胞的特别有用的实例。
[0145]
用于产生抗体产生脾细胞或抗体产生淋巴结细胞与骨髓瘤细胞的杂交体的方法通常包括:在存在促进细胞膜融合的一种或更多种试剂(化学的或电学的)的情况下使体细胞与骨髓瘤细胞以2:1的比例混合,但是该比例可分别为约20:1至约1:1而不等。在一些情况下,用eb病毒(epstein barr virus,ebv)转化人b细胞作为初始步骤提高了b细胞的尺寸,从而增强与相对较大尺寸的骨髓瘤细胞的融合。通过在转化培养基中使用cpg和chk2抑制剂药物增强了ebv的转化效率。或者,可通过在含另外的可溶性因子例如il-21和人b细胞活化因子(baff)(tnf超家族的ii型成员)的培养基中与表达cd40配体(cd 154)的转染细胞系共培养来活化人b细胞。kohler和milstein(1975;1976)已描述了使用仙台病毒(sendai virus)的融合方法,并且gefter et al.,(1977)已描述了使用聚乙二醇(peg)例如37%(v/v)peg的融合方法。使用电诱导融合方法也是合适的(goding,第71至74页,1986),并且一些方法具有更好的效率(yu et al.,2008)。融合程序通常以较低频率(约1
×
10-6
至1
×
10-8
)产生活杂交体,但是利用优化程序可实现接近1/200的融合效率(yu et al.,2008)。然而,相对低的融合效率并不造成问题,因为通过在选择培养基中培养,活的融合杂合体与亲本未融合细胞(特别是在正常情况下将持续无限分裂的未融合骨髓瘤细胞)区分开来。选择培养基通常是在组织培养基中包含阻断核苷酸从头合成的试剂的培养基。示例性且优选的试剂为氨基蝶呤、甲氨蝶呤和重氮丝氨酸。氨基蝶呤和甲氨蝶呤阻断嘌呤和嘧啶二者的从头合成,而重氮丝氨酸仅阻断嘌呤合成。当使用氨基蝶呤或甲氨蝶呤时,向培养基补充次黄嘌呤和胸苷作为核苷酸的来源(hat培养基)。当使用重氮丝氨酸时,向培养基补充次黄嘌呤。如果b细胞来源是ebv转化的人b细胞系,则添加哇巴因(ouabain)以清除未与骨髓瘤融合的ebv转化系。
[0146]
优选的选择培养基是hat或具有哇巴因的hat。只有能够进行核苷酸补救途径的细胞才能在hat培养基中存活。骨髓瘤细胞在补救途径的关键酶(例如,次黄嘌呤磷酸核糖基转移酶(hypoxanthine phosphoribosyl transferase,hprt))中有缺陷,因此其不能存活。b细胞可进行该途径,但是其在培养中具有有限的寿命并且通常在约两周内死亡。因此,只有可在选择培养基中存活的细胞才是由骨髓瘤和b细胞形成的那些杂合体。当用于融合的b细胞的来源是ebv转化b细胞系时,此时还可将哇巴因用于杂合体的药物选择,因为ebv转化b细胞对药物杀伤易感,而选择所使用的骨髓瘤配偶体对哇巴因具有抗性。
[0147]
培养提供了从中选择特定杂交瘤的杂交瘤群体。通常来说,杂交瘤的选择如下进行:通过在微量滴定板中进行单克隆稀释来培养细胞,随后测试单独的克隆上清液(在约两至三周之后)的期望反应性。测定应灵敏、简单并且迅速,例如放射免疫测定、酶免疫测定、细胞毒性测定、噬菌斑测定、斑点免疫结合测定等。然后将选择的杂交瘤连续稀释或通过流式细胞术分选进行单细胞分选,并克隆到单独抗体产生细胞系中,所述克隆然后可无限增殖以提供mab。细胞系可以以两种基本方式用于mab产生。可将杂交瘤样品注射(通常注射到腹膜腔中)到动物(例如,小鼠)中。任选地,在注射之前将动物用烃,特别是油(例如姥鲛烷
(四甲基十五烷))致敏(prime)。当以这种方式使用人杂交瘤时,注射免疫妥协小鼠(例如scid小鼠)是最佳的,以防止肿瘤排斥。经注射动物产生分泌由融合细胞杂合体产生的特异性单克隆抗体的肿瘤。然后,可取出动物的体液(例如血清或腹水)以提供高浓度的mab。也可在体外培养单个细胞系,其中mab自然地分泌到培养基中,从中可容易地获得高浓度的mab。或者,可在体外使用人杂交瘤细胞系以在细胞上清液中产生免疫球蛋白。可将细胞系调整为在不含血清的培养基中生长,以优化回收高纯度的人单克隆免疫球蛋白的能力。
[0148]
如果期望的话,可使用过滤、离心和多种色谱方法(例如fplc或亲和色谱)对通过任一种方式产生的mab进行进一步纯化。本公开内容的单克隆抗体的片段可通过以下方法由经纯化的单克隆抗体获得:其包括用酶(例如胃蛋白酶或木瓜蛋白酶)消化,和/或通过经化学还原切割二硫键。或者,本发明所涵盖的单克隆抗体片段可使用自动化肽合成仪合成。
[0149]
例如,可使用分子克隆方法来产生单克隆抗体。可使用顺磁珠选择或流式细胞术分选来物理地分选用目的抗原标记的单b细胞,然后可从单细胞中分离rna,并通过rt-pcr扩增抗体基因。或者,可将抗原特异性的大量分选的细胞群隔离在微泡中,并使用重链和轻链扩增子的物理连接或对来自囊泡的重链和轻链基因进行共同条码化来从单细胞中回收匹配的重链和轻链可变基因。来自单细胞的匹配的重链和轻链基因也可通过用携带rt-pcr引物和用于以每个细胞一种条码来标记转录物的条码的细胞穿透纳米粒处理细胞来从抗原特异性b细胞群获得。也可通过杂交瘤系的rna提取分离抗体可变基因,并通过rt-pcr获得抗体基因并克隆到免疫球蛋白表达载体中。或者,由从细胞系分离的rna制备组合的免疫球蛋白噬菌粒文库,并使用真菌抗原通过淘选选择表达合适抗体的噬菌粒。该方法相对于常规杂交瘤技术的优点是可在单轮中产生并筛选约104倍多的抗体,并且通过h链和l链组合产生新特异性,其进一步提高了发现合适抗体的机会。
[0150]
教导产生可用于本发明的抗体的其他美国专利(其各自通过引用并入本文)包括美国专利5,565,332,其描述了使用组合方法产生嵌合抗体;美国专利4,816,567,其描述了重组免疫球蛋白制备;和美国专利4,867,973,其描述了抗体-治疗剂缀合物。
[0151]
b.本公开内容的抗体
[0152]
根据本公开内容的抗体可在第一种情况下通过其结合特异性来表征。本文中使用的术语“免疫结合”和“免疫结合特性”可以指在免疫球蛋白分子与该免疫球蛋白对其具有特异性的抗原之间发生的类型的非共价相互作用。免疫结合相互作用的强度或亲和力可按照相互作用的平衡结合常数(kd)来表达,其中较小的kd表示较大的亲和力。通过使用本领域技术人员公知的技术评估给定抗体的结合特异性/亲和力,本领域技术人员可确定这样的抗体是否落入本发明权利要求书的范围内。例如,给定抗体与之结合的表位可包含位于抗原分子内的3个或更多个(例如,3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个)氨基酸的单个连续序列(例如,结构域中的线性表位)。或者,表位可包含位于抗原分子内的多个不连续的氨基酸(或氨基酸序列)(例如,构象表位)。本文中使用的术语“表位”可包含能够与免疫球蛋白、scfv或t细胞受体特异性结合的任何蛋白质决定簇。可变区允许抗体选择性识别并特异性结合抗原上的表位。例如,抗体的vl结构域和vh结构域或互补决定区(cdr)的子集组合以形成限定三维抗原结合位点的可变区。这种四级抗体结构形成了存在于y的每个臂末端的抗原结合位点。表位决定簇通常由分子的化学活性表面组例如氨基酸或糖侧链组成,并且通常具有特定的三维结构特征,以及特定的电荷特征。例如,可产生针
对多肽的n端或c端肽的抗体。更特别地,抗原结合位点由每个vh和vl链上的三个cdr(即cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3)来限定。
[0153]
本领域普通技术人员已知的多种技术可用于确定抗体是否与多肽或蛋白质内的“一个或更多个氨基酸相互作用”。示例性技术包括例如常规的交叉阻断测定,例如在antibodies,harlow and lane(cold spring harbor press,cold spring harbor,n.y.)中描述的。交叉阻断可在多种结合测定(例如elisa、生物层干涉术或表面等离子体共振)中测量。其他方法包括丙氨酸扫描突变分析、肽印迹分析(reineke(2004)methods mol.biol.248:443-63)、肽切割分析、使用单粒子重建的高分辨率电子显微术技术、cryoem、或断层摄影术(tomography)、晶体学研究和nmr分析。另外,可使用例如表位切除、表位提取和抗原的化学修饰的方法(tomer(2000)prot.sci.9:487-496)。可用于鉴定抗体与之相互作用的多肽内氨基酸的另一种方法是通过质谱检测的氢/氘交换。一般而言,氢/氘交换方法涉及氘标记目的蛋白,随后使抗体与氘标记的蛋白质结合。接下来,将蛋白质/抗体复合物转移到水中,并且受抗体复合物保护的氨基酸内的可交换质子以比不是界面一部分的氨基酸内的可交换质子更慢的速率进行氘对氢的反向交换。作为结果,与不包含在界面中的氨基酸相比,形成蛋白质/抗体界面的一部分的氨基酸可保留氘,并且因此表现出相对更高的质量。在抗体解离之后,对靶蛋白进行蛋白酶切割和质谱分析,从而揭示氘标记的残基,其对应于抗体与之相互作用的特定氨基酸。参见,例如ehring(1999)analytical biochemistry 267:252-259;engen and smith(2001)anal.chem.73:256a-265a。当抗体中和念珠菌时,可通过在存在高浓度抗体的情况下在体外或在动物模型中繁殖念珠菌来分离抗体逃逸突变变体生物体。编码抗体所靶向的抗原的念珠菌基因的序列分析揭示了赋予抗体逃逸的突变,表明了表位中的残基或以别构方式影响表位结构的残基。
[0154]
术语“表位”可以指抗原上b和/或t细胞对其做出响应的位点。b细胞表位可由连续氨基酸或通过蛋白质的三级折叠而并列的非连续氨基酸二者形成。由连续氨基酸形成的表位通常在暴露于变性溶剂时保留,而通过三级折叠形成的表位通常在用变性溶剂处理时丢失。表位通常包含具有独特的空间构象的至少3个,并且更通常地至少5或8至l0个氨基酸。
[0155]
修饰辅助谱分析(modification-assisted profiling,map),也称为基于抗原结构的抗体谱分析(antigen structure-based antibody profiling,asap),是根据每种抗体与化学或酶促修饰的抗原表面的结合特性的相似性对大量针对相同抗原的单克隆抗体(mab)进行分类的方法(参见us2004/0101920,特别地其通过引用整体并入本文)。每个类别可反映与通过另一类别所代表的表位明显不同或部分重叠的独特表位。该技术使得能够快速过滤遗传上相同的抗体,从而使表征可集中在遗传上独特的抗体上。当应用于杂交瘤筛选时,map可有助于鉴定产生具有期望特征的mab的罕见杂交瘤克隆。map可用于将本公开内容的抗体分类为结合不同表位的抗体组。
[0156]
本公开内容包括可与相同表位或表位的一部分结合的抗体。同样,本公开内容还包括与本文中所述的任何具体示例性抗体竞争与靶标或其片段结合的抗体。通过使用本领域中已知的常规方法,可容易地确定抗体是否与参考抗体结合相同的表位,或与其竞争结合。例如,为了确定受试抗体是否与参考结合相同表位,允许参考抗体在饱和条件下与靶标结合。接下来,评估受试抗体与靶分子结合的能力。如果受试抗体能够与与参考抗体饱和结合之后的靶分子结合,则可得出结论,受试抗体与参考抗体结合不同的表位。在另一方面,
如果受试抗体不能与与参考抗体饱和结合之后的靶分子结合,则受试抗体可与与由参考抗体结合的表位相同的表位结合。
[0157]
为了确定抗体是否与参考抗念珠菌抗体竞争结合,在两个方向上进行上述结合方法:在第一个方向上,使参考抗体与念珠菌抗原在饱和条件下结合,随后评估受试抗体与念珠菌抗原的结合。在第二个方向上,使受试抗体与念珠菌抗原分子在饱和条件下结合,随后评估参考抗体与念珠菌抗原的结合。如果在两个方向上,仅第一(饱和)抗体能够与念珠菌抗原结合,则可得出结论,受试抗体和参考抗体竞争与念珠菌抗原的结合。如本领域普通技术人员将理解的,与参考抗体竞争结合的抗体可能不一定与参考抗体结合相同的表位,但可通过结合重叠或相邻表位而在空间上阻断参考抗体的结合。
[0158]
如果两种抗体中的一种竞争性地抑制(阻断)另一种与抗原的结合,则两种抗体与相同或重叠的表位结合。即,一种抗体过量1-、5-、10-、20-或100倍会抑制另一种抗体的结合至少50%,但优选75%、90%或甚至99%,如在竞争性结合测定中测量的(参见,例如,junghans et al.,cancer res.199050:1495-1502)。或者,如果抗原中降低或消除一种抗体结合的基本上所有氨基酸突变降低或消除另一种抗体的结合,则两种抗体具有相同表位。如果降低或消除一种抗体结合的一些氨基酸突变降低或消除另一种抗体的结合,则两种抗体具有重叠表位。
[0159]
然后可进行另外的常规实验(例如,肽突变和结合分析)以确认观察到的受试抗体的结合缺乏是否实际上是由于与参考抗体结合相同的表位,或者空间阻断(或其他现象)是否是缺乏观察到的结合的原因。可使用elisa、ria、表面等离子体共振、流式细胞术或本领域可用的任何其他定量或定性抗体结合测定来进行这类实验。使用em或晶体学进行的结构研究也可证明两种竞争结合的抗体是否识别相同的表位。
[0160]
在另一个方面中,提供了单克隆抗体,其具有克隆配对的分别来自如表3和表4中所示的重链和轻链的cdr。单克隆抗体可具有克隆配对的cdr,其与表3和4中所示的序列具有至少70%同一性。在某些实施方案中,抗体或抗体片段与来自表3和4的序列具有约70%、约80%或约90%同一性。这样的抗体可使用本文中所述的方法通过以下在实施例部分中讨论的克隆来产生。
[0161]
在另一个方面中,抗体可由其包含另外的“框架”区的可变序列来表征。这些在表1和2中提供,其编码或表示完整的可变区。此外,抗体序列可不同于这些序列,任选地使用以下更详细讨论的方法。例如,核酸序列可在以下方面不同于上述那些:(a)可变区可与轻链和重链的恒定结构域分离;(b)核酸可不同于上述那些同时不影响由其编码的残基;(c)核酸可以以给定百分比,例如70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同源性不同于上述核酸;(d)核酸可由于在高严格性条件下进行杂交的能力而不同于上述核酸,如通过低盐和/或高温条件所例示的,例如由约50℃至约70℃的温度下约0.02m至约0.15m nacl提供的;(e)氨基酸可以以给定百分比,例如80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同源性不同于上述氨基酸;或者(f)氨基酸可通过允许保守置换(以下讨论)而不同于上述那些。上述各项均适用于如表1所示的核酸序列和表2的氨基酸序列。
[0162]
本公开内容的一些方面的特征在于与本文中所述的抗念珠菌抗体或抗体片段的氨基酸或核苷酸序列具有特定百分比同一性或相似性的抗体。例如,当比较本文中所述的
抗念珠菌抗体或抗体片段中的任一种的特定区域或全长时,抗体可具有60%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的同一性。当比较多核苷酸和多肽序列时,如果两个序列中的核苷酸或氨基酸的序列在比对最大对应性时相同,则这两个序列被称为“相同”,如下所述。两个序列之间的比较通常通过在比较窗上比较序列以鉴定和比较序列相似性的局部区域来进行。本文中使用的“比较窗”是指至少约20个连续位置(通常为30至约75、40至约50个)的区段,其中在将两个序列最佳比对之后,可将序列与相同数目的连续位置的参考序列进行比较。
[0163]
用于比较的序列的最佳比对可使用生物信息学软件的lasergene套件中的megalign程序(dnastar,inc.,madison,wis.)使用默认参数来进行。该程序体现了描述于以下参考文献中的数种比对方案:dayhoff,m.o.(1978)a model of evolutionary change in proteins
‑‑
matrices for detecting distant relationships.in dayhoff,m.o.(编辑)atlas of protein sequence and structure,national biomedical research foundation,washington d.c.第5卷,增刊3,第345至358页;hein j.(1990)unified approach to alignment and phylogeny第626至645页methods in enzymology第183卷,academic press,inc.,san diego,calif.;higgins,d.g.and sharp,p.m.(1989)cabios 5:151-153;myers,e.w.and muller w.(1988)cabios 4:11-17;robinson,e.d.(1971)comb.theor 11:105;santou,n.nes,m.(1987)mol.biol.evol.4:406-425;sneath,p.h.a.and sokal,r.r.(1973)numerical taxonomy
‑‑
the principles and practice of numerical taxonomy,freeman press,san francisco,calif.;wilbur,w.j.and lipman,d.j.(1983)proc.natl.acad.,sci.usa 80:726-730。
[0164]
或者,用于比较的序列的最佳比对可通过以下来进行:smith and waterman(1981)add.apl.math 2:482的局部同一性算法、通过needleman and wunsch(1970)j.mol.biol.48:443的同一性比对算法、通过pearson and lipman(1988)proc.natl.acad.sci.usa 85:2444的检索相似性方法、通过这些算法(wisconsin遗传学软件包中的gap、bestfit、blast、fasta和tfasta,genetics computer group(gcg),575science dr.,madison,wis.)的计算机实施或通过检查。
[0165]
适合于确定序列同一性和序列相似性的百分比的算法的一个特定实例是blast和blast 2.0算法,其分别描述于altschul et al.(1977)nucl.acids res.25:3389-3402和altschul et al.(1990)j.mol.biol.215:403-410中。blast和blast 2.0可例如与本文中所述的参数一起使用,以确定本公开内容的多核苷酸和多肽的序列同一性百分比。用于进行blast分析的软件可通过美国国家生物技术信息中心(national center for biotechnology information)公开获得。抗体序列的重排性质和每个基因的可变长度需要多轮blast检索以寻找单一抗体序列。而且,不同基因的人工组装是困难且容易出错的。序列分析工具igblast(万维网网址为ncbi.nlm.nih.gov/igblast/)鉴定与种系v、d和j基因的匹配,重排接界的细节,ig v结构域框架区和互补决定区的描述。igblast可分析核苷酸或蛋白质序列,并且可分批处理序列,并允许同时对种系基因数据库和其他序列数据库进行检索,以获得最佳匹配的种系v基因。
[0166]
在一个举例说明性实例中,对于核苷酸序列,可使用参数m(匹配残基对的奖励评分;总是>0)和n(错配残基的罚分;总是<0)来计算累积评分。在以下情况下,将停止单词
england)(1995);geller et al.,proc natl.acad.sci.usa 90:7603(1993);geller et al.,proc.nat’l acad.sci.usa 87:1149(1990))、腺病毒载体(参见legal lasalle et al.,science,259:988(1993);davidson et al.,nat.genet.3:219(1993);yang et al.,j.virol.69:2004(1995))和腺相关病毒载体(参见kaplitt et al.,nat.genet.8:148(1994))。
[0177]
痘病毒载体将基因引入到细胞的胞质中。禽痘病毒载体仅导致核酸的短期表达。腺病毒载体、腺相关病毒载体和单纯疱疹病毒(hsv)载体优选用于将核酸引入到神经细胞中。腺病毒载体导致比腺相关病毒(约4个月)更短期的表达(约2个月),腺相关病毒进而比hsv载体更短。选择的特定载体将取决于靶细胞和所治疗的病症。引入可通过标准技术,例如感染、转染、转导或转化。基因转移模式的一些实例包括例如裸dna、cap04沉淀、deae葡聚糖、电穿孔、原生质体融合、脂质体转染、细胞显微注射和病毒载体。
[0178]
这些载体可用于表达大量的可以以多种方式使用的抗体。例如,检测样品中念珠菌的存在。该抗体还可用于尝试结合并破坏念珠菌活性。
[0179]
可通过以下产生重组全长igg抗体:将来自克隆载体的重链和轻链fv dna亚克隆到igg质粒载体中,将其转染到293(例如freestyle)细胞或cho细胞中,并可从293或cho细胞上清液中收集和纯化抗体。另一些合适的宿主细胞系统包括细菌(例如大肠杆菌(e.coli))、昆虫细胞(s2、sf9、sf29、high five)、植物细胞(例如具有或不具有针对类人聚糖进行改造的烟草)、藻类或多种非人转基因环境,例如小鼠、大鼠、山羊或牛。
[0180]
根据本发明也可实践出于随后抗体纯化和出于对宿主进行免疫接种二者目的的编码抗体的核酸的表达。抗体编码序列可以是rna,例如天然rna或经修饰rna。例如,经修饰rna可包含赋予mrna以提高的稳定性和低免疫原性,从而促进治疗上重要的蛋白质的表达的某些化学修饰。例如,就翻译能力而言,n1-甲基-假尿苷(n1mψ)优于数种其他核苷修饰及其组合。除关闭免疫/eif2α磷酸化依赖性翻译抑制之外,并入的n1mψ核苷酸还通过提高mrna上核糖体停顿和密度来显著改变翻译过程的动态。经修饰mrna的核糖体载量提高通过促进同一mrna上的核糖体再循环或从头重新核糖体募集而使它们更易于起始。这样的修饰可用于在接种rna之后增强体内抗体表达。rna,无论是天然的还是经修饰的,均可作为裸rna或在递送载剂(例如脂质纳米粒)中递送。
[0181]
或者,可将编码抗体的dna用于相同目的。将dna包含在含有在为其设计的宿主细胞中具有活性的启动子的表达盒中。表达盒有利地包含在可复制载体,例如常规质粒或微载体中。载体包括病毒载体,例如可使用痘病毒、腺病毒、疱疹病毒、腺相关病毒和慢病毒。还可利用编码抗体基因的复制子,例如基于vee病毒或辛德毕斯病毒的甲病毒复制子。这样的载体的递送在期望体内表达时可通过针通过肌内、皮下或皮内途径,或者通过经皮电穿孔来进行。
[0182]
与最终cgmp制造过程在相同宿主细胞和细胞培养过程中产生的抗体的迅速可用性可降低过程开发计划的持续时间。lonza已经开发了使用在cdacf培养基中培养的合并转染子用于在cho细胞中迅速产生少量(多至50g)抗体的一般方法。尽管比真正的瞬时系统稍慢,但是其优点包括更高的产物浓度和与生产细胞系使用相同的宿主和过程。在一次性生物反应器中表达模型抗体之gs-cho库的生长和生产力的实例为:在以补料分批模式进行的一次性袋状生物反应器培养(5l工作体积)中,在转染后9周内达到了2g/l的收获抗体浓度。
[0183]
抗体分子将包含例如通过mab的蛋白水解切割产生的片段(例如f(ab’)、f(ab’)2)或者例如可通过重组方式产生的单链免疫球蛋白。f(ab’)抗体衍生物是单价的,而f(ab’)2抗体衍生物是二价的。在一个实施方案中,这样的片段可彼此组合,或者与其他抗体片段或受体配体组合以形成“嵌合”结合分子。明显地,这样的嵌合分子可包含能够与同一分子的不同表位结合的取代基。
[0184]
在一些相关实施方案中,抗体是所公开抗体的衍生物,例如,包含与所公开抗体中cdr序列相同的cdr序列的抗体(例如,嵌合抗体或cdr接枝抗体)。或者,可进行修饰,例如向抗体分子中引入保守变化。在进行这种变化时,可考虑氨基酸的亲水指数(hydropathic index)。氨基酸亲水指数在赋予蛋白质以相互作用生物学功能中的重要性是本领域中通常了解的(kyte and doolittle,1982)。已接受的是,氨基酸的相对亲水特性有助于所得蛋白质的二级结构,其转而限定了蛋白质与另一些分子(例如酶、底物、受体、dna、抗体、抗原等)的相互作用。
[0185]
可基于亲水性有效地进行类似氨基酸的替换。美国专利4,554,101(通过引用并入本文)声称:蛋白质的最大局部平均亲水性(如受其邻近氨基酸的亲水性支配)与蛋白质的生物学特性相关。如美国专利4,554,101中所详述的,已向氨基酸残基分配了以下亲水性值:碱性氨基酸:精氨酸( 3.0)、赖氨酸( 3.0)和组氨酸(-0.5);酸性氨基酸:天冬氨酸( 3.0
±
1)、谷氨酸( 3.0
±
1)、天冬酰胺( 0.2)和谷氨酰胺( 0.2);亲水性非离子氨基酸:丝氨酸( 0.3)、天冬酰胺( 0.2)、谷氨酰胺( 0.2)和苏氨酸(-0.4);含硫氨基酸:半胱氨酸(-1.0)和甲硫氨酸(-1.3);疏水性非芳族氨基酸:缬氨酸(-1.5)、亮氨酸(-1.8)、异亮氨酸(-1.8)、脯氨酸(-0.5
±
1)、丙氨酸(-0.5)和甘氨酸(0);疏水性芳族氨基酸:色氨酸(-3.4)、苯丙氨酸(-2.5)和酪氨酸(-2.3)。
[0186]
例如,氨基酸可被替换为具有类似亲水性的另一氨基酸,并且产生在生物学或免疫学上修饰的蛋白质。在这样的变化中,优选亲水性值在
±
2内的氨基酸的替换,特别优选在
±
1内的那些,并且甚至更特别优选在
±
0.5内的那些。
[0187]
如上文概括的,氨基酸替换通常基于氨基酸侧链取代基的相对相似性,例如,其疏水性、亲水性、电荷、大小等。预期多个前述特征的示例性替换是本领域技术人员公知的,并且包括:精氨酸和赖氨酸;谷氨酸和天冬氨酸;丝氨酸和苏氨酸;谷氨酰胺和天冬酰胺;以及缬氨酸、亮氨酸和异亮氨酸。
[0188]
本公开内容还涉及同种型修饰。通过修饰fc区域以具有不同同种型,可实现不同功能。例如,改变为igg1可提高抗体依赖性细胞细胞毒性,转换为a类可改善组织分布,以及转换为m类可改善价位。
[0189]
作为替代或补充,将氨基酸修饰与改变il-23p19结合分子的fc区的c1q结合和/或补体依赖性细胞毒性(cdc)功能的一种或更多种另外的氨基酸修饰组合在一起可以是有用的。特别令人感兴趣的结合多肽可以是与c1q结合并显示出补体依赖性细胞毒性的结合多肽。可修饰具有预先存在的c1q结合活性,任选地还具有介导cdc能力的多肽以使得这些活性中的一种或两种得到增强。改变c1q和/或修饰其补体依赖性细胞毒性功能的氨基酸修饰描述于例如wo/0042072中,其在此通过引用并入。
[0190]
可例如通过修饰c1q结合和/或fcγr结合并由此改变cdc活性和/或adcc活性来设计具有改变的效应物功能的抗体的fc区。“效应物功能”负责激活或减弱生物活性(例如,在
对象中)。效应物功能的一些实例包括但不限于:c1q结合;补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;下调细胞表面受体(例如b细胞受体;bcr)等。这样的效应物功能可需要待与结合结构域(例如抗体可变结构域)组合的fc区,并可使用多种测定(例如fc结合测定、adcc测定、cdc测定等)进行评估。
[0191]
例如,可产生抗体的具有改善的c1q结合和改善的fcγriii结合(例如,具有改善的adcc活性和改善的cdc活性二者)的变体fc区。或者,如果期望降低或消除效应物功能,则可将变体fc区改造为具有降低的cdc活性和/或降低的adcc活性。在另一些实施方案中,可提高这些活性中的仅一种,并且任选地,另一种活性也降低(例如,产生具有改善的adcc活性但是降低的cdc活性的fc区变体,反之亦然)。
[0192]
fcrn结合。还可引入fc突变并将其改造成改变其与新生fc受体(fcrn)的相互作用并改善其药动学特性。已经描述了具有与fcrn的结合改善的人fc变体的集合(shields et al.,(2001).high resolution mapping of the binding site on human igg1 for fcγri,fcγrii,fcγriii,and fcrn and design of igg1 variants with improved binding to the fcγr,(j.biol.chem.276:6591-6604)。已知可导致半衰期提高的许多方法(kuo and aveson,(2011)),包括可通过包括以下的技术产生氨基酸修饰:丙氨酸扫描诱变、随机诱变以及筛选,以评估与新生fc受体(fcrn)结合和/或体内行为。诱变之后的计算策略也可用于选择氨基酸突变中之一以进行突变。
[0193]
因此,本公开内容提供了具有与fcrn的最佳结合的抗原结合蛋白的变体。在一个具体实施方案中,抗原结合蛋白的所述变体在所述抗原结合蛋白的fc区中包含至少一个氨基酸修饰,其中与所述亲本多肽相比,所述修饰选自fc区的第226位、第227位、第228位、第230位、第231位、第233位、第234位、第239位、第241位、第243位、第246位、第250位、第252位、第256位、第259位、第264位、第265位、第267位、第269位、第270位、第276位、第284位、第285位、第288位、第289位、第290位、第291位、第292位、第294位、第297位、第298位、第299位、第301位、第302位、第303位、第305位、第307位、第308位、第309位、第311位、第315位、第317位、第320位、第322位、第325位、第327位、第330位、第332位、第334位、第335位、第338位、第340位、第342位、第343位、第345位、第347位、第350位、第352位、第354位、第355位、第356位、第359位、第360位、第361位、第362位、第369位、第370位、第371位、第375位、第378位、第380位、第382位、第384位、第385位、第386位、第387位、第389位、第390位、第392位、第393位、第394位、第395位、第396位、第397位、第398位、第399位、第400位、第401403位、第404位、第408位、第411位、第412位、第414位、第415位、第416位、第418位、第419位、第420位、第421位、第422位、第424位、第426位、第428位、第433位、第434位、第438位、第439位、第440位、第443位、第444位、第445位、第446位和第447位,其中fc区中氨基酸的编号是kabat中eu索引的编号。在本公开内容的另一方面中,修饰是m252y/s254t/t256e。
[0194]
另外,多个出版物描述了用于获得半衰期被修饰的生理活性分子的方法,参见例如kontermann(2009),通过将fcrn结合多肽引入到分子中,或者通过将分子与保留了fcrn结合亲和力但针对其他fc受体的亲和力已大大降低的抗体融合或与抗体的fcrn结合结构域融合。
[0195]
衍生抗体可用于改变亲本抗体在哺乳动物,特别是人中的半衰期(例如血清半衰期)。这样的改变可导致半衰期大于15天,优选大于20天、大于25天、大于30天、大于35天、大
于40天、大于45天、大于2个月、大于3个月、大于4个月或大于5个月。本公开内容的抗体或其片段在哺乳动物,优选人中的半衰期提高使得所述抗体或抗体片段在哺乳动物中的血清效价更高,并因此降低了所述抗体或抗体片段的施用频率和/或降低了待施用的所述抗体或抗体片段的浓度。具有提高的体内半衰期的抗体或其片段可通过本领域技术人员已知的技术来产生。例如,具有提高的体内半衰期的抗体或其片段可通过对被鉴定为参与fc结构域与fcrn受体之间的相互作用的氨基酸残基进行修饰(例如,替换、缺失或添加)来产生。
[0196]
beltramello et al.(2010)先前报道了通过产生其中ch2结构域的1.3和1.2位的亮氨酸残基(根据c结构域的imgt独特编号)被丙氨酸残基替换来使mab(由于其倾向于增强登革病毒(dengue virus)感染)中和的修饰。该修饰(也称为“lala”突变)消除了与fcγri、fcγrii和fcγriiia结合的抗体,如hessell et al.(2007)所述。比较变体和未经修饰的重组mab的中和和增强四种登革病毒血清型的感染的能力。lala变体保留了与未经修饰mab相同的中和活性,但完全没有增强活性。这种性质的lala突变也可与当前公开的抗体一起使用。
[0197]
糖基化改变。本公开内容的一个具体实施方案是包含无唾液酸、半乳糖或岩藻糖的基本上均质的聚糖的分离的单克隆抗体或其抗原结合片段。在一些实施方案中,单克隆抗体包含重链可变区和轻链可变区,其二者可分别与重链或轻链恒定区连接。前述基本上均质的聚糖可与重链恒定区共价连接。
[0198]
本公开内容的另一个实施方案包含具有新fc糖基化模式的mab。分离的单克隆抗体或其抗原结合片段存在于由gngn或g1/g2糖型表示的基本上均质的组合物中。fc糖基化在治疗性mab的抗病毒和抗癌特性中发挥重要作用。这与最近的研究一致,该研究显示在体外无岩藻糖的抗hiv mab的抗慢病毒细胞介导的病毒抑制提高。
[0199]
与不具有基本上均质的gngn糖型和具有含g0、g1f、g2f、gnf、gngnf或gngnfx糖型的相同抗体相比,包含由gngn或g1/g2糖型表示的基本上均质的组合物的分离的单克隆抗体或其抗原结合片段表现出对fcγri和fcγriii的结合亲和力提高。在本公开内容的一个实施方案中,所述抗体以1
×
10-8
m或更小的kd从fcγri解离并且以1
×
10-7
m或更小的kd从fcγriii解离。
[0200]
fc区的糖基化通常是n-连接或o-连接的。n-连接是指碳水化合物部分与天冬酰胺残基的侧链的连接。o-连接的糖基化是指糖n-乙酰半乳糖胺、半乳糖或木糖中的一种与羟基氨基酸(最通常为丝氨酸或苏氨酸)的连接,尽管也可使用5-羟基脯氨酸或5-羟基赖氨酸。用于将碳水化合物部分与天冬酰胺侧链肽序列酶促连接的识别序列是天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸,其中x是除脯氨酸之外的任何氨基酸。因此,多肽中这些肽序列中任一个的存在均可产生糖基化位点。
[0201]
糖基化模式可例如通过缺失一个或更多个存在于多肽中的糖基化位点和/或添加一个或更多个不存在于多肽中的糖基化位点来改变。通过改变氨基酸序列以使其包含一个或更多个上述三肽序列,方便地实现了将糖基化位点添加至抗体的fc区(对于n-连接的糖基化位点)。示例性的糖基化变体具有重链的残基asn 297的氨基酸替换。该改变也可通过向原始多肽的序列添加一个或更多个丝氨酸或苏氨酸残基或者用一个或更多个丝氨酸或苏氨酸残基替换原始多肽的序列来进行(对于o-连接的糖基化位点)。另外,将asn 297改变为ala可去除糖基化位点之一。
[0202]
在某些实施方案中,抗体在表达β(1,4)-n-乙酰氨基葡萄糖转移酶iii(gnt iii)的细胞中表达,使得gnt iii将glcnac添加至il-23p19抗体。用于以这样的方式产生抗体的方法提供于wo/9954342、wo/03011878、专利公开2003/0003097a1和umana et al.,nature biotechnologγ,17:176-180,february 1999中。可使用基因组编辑技术例如成簇规律间隔短回文重复序列(clustered regularly interspaced short palindromic repeat,crispr)将细胞系改变以增强或降低或消除某些翻译后修饰,例如糖基化。例如,crispr技术可用于在用于表达重组单克隆抗体的293或cho细胞中消除编码糖基化酶的基因。
[0203]
单克隆抗体蛋白质序列缺陷(liability)的消除。从人b细胞获得的抗体可变基因序列可改造成增强其可制造性和安全性。蛋白质序列缺陷可通过检索与包含以下的位点相关的序列基序来鉴定:
[0204]
1)未配对的cys残基,
[0205]
2)n-连接的糖基化,
[0206]
3)asn脱酰胺,
[0207]
4)asp异构化,
[0208]
5)sye截短,
[0209]
6)met氧化,
[0210]
7)trp氧化,
[0211]
8)n端谷氨酸,
[0212]
9)整合素结合,
[0213]
10)cd11c/cd18结合,或
[0214]
11)片段化。
[0215]
这样的基序可通过改变编码重组抗体的cdna的合成基因来消除。
[0216]
在开发治疗性抗体领域中的蛋白质改造工作清楚地揭示了某些序列或残基与溶解度差异相关(fernandez-escamilla et al.,nature biotech.,22(10),1302-1306,2004;chennamsetty et al.,pnas,106(29),11937-11942,2009;voynov et al.,biocon.chem.,21(2),385-392,2010)。文献中来自溶解度改变突变的证据表明与另一些亲水性残基,例如天冬酰胺、谷氨酰胺、苏氨酸、赖氨酸和精氨酸相比,一些亲水性残基例如天冬氨酸、谷氨酸和丝氨酸明显更有利地有助于蛋白质溶解度。
[0217]
稳定性。可对抗体进行改造以增强生物物理特性。可使用平均表观解链温度(average apparent melting temperature),使用升高的温度来使抗体解折叠(unfold)以确定相对稳定性。差示扫描量热术(differential scanning calorimetry,dsc)测量作为温度函数的分子的热容c
p
(使该分子升温每度所需的热)。可使用dsc研究抗体的热稳定性。mab的dsc数据是特别令人感兴趣的,因为其有时解析了mab结构内单独结构域的解折叠,从而在热谱图中产生多至三个峰(来自fab、ch2和ch3结构域的解折叠)。通常来说,fab结构域的解折叠产生最强峰。fc部分的dsc谱和相对稳定性显示了人igg1、igg2、igg3和igg4亚类的特征差异(garber and demarest,biochem.biophys.res.commun.355,751-757,2007)。还可使用圆二色性(circular dichroism,cd)(用cd分光计进行)来确定平均表观解链温度。将以0.5nm的增量在200至260nm范围内测量抗体的远紫外cd谱。最终谱可确定为20次累积的平均值。可在背景减除之后计算残基椭圆率值。抗体(0.1mg/ml)的热解折叠可在235nm处
在25℃至95℃下以及以1℃/分钟的加热速率进行监测。可使用动态光散射(dynamic light scattering,dls)来评估聚集的倾向性。dls用于表征多种颗粒包括蛋白质的尺寸。如果体系在尺寸上不分散,则可确定颗粒的平均有效直径。这种测量取决于颗粒核芯的尺寸、表面结构的尺寸和颗粒浓度。由于dls基本上测量了由颗粒引起的散射光强度的波动,因此可确定颗粒的扩散系数。商业dla仪器中的dls软件显示不同直径的颗粒群。可使用dls方便地进行稳定性研究。样品的dls测量可通过确定颗粒的流体动力学半径是否提高来显示颗粒是否随时间或随温度变化而聚集。如果颗粒聚集,则可看到半径更大的更大颗粒群。取决于温度的稳定性可通过控制原位温度来分析。毛细管电泳(capillary electrophoresis,ce)技术包括经过验证的用于确定抗体稳定性特征的方法。可使用ice方法解析由于脱酰胺、c端赖氨酸、唾液酸化、氧化、糖基化以及可导致蛋白质pi变化的任何其他蛋白质变化而引起的抗体蛋白质电荷变体。可使用protein simple maurice仪器在毛细管柱(cief)中通过高通量、自由溶液等电聚焦(isoelectric focusing,ief)来评价每种表达的抗体蛋白质。可每30秒进行全柱uv吸收检测,以实时监测聚焦在等电点(pi)的分子。这种方法将传统凝胶ief的高分辨率与基于柱的分离中存在的定量和自动化的优点相组合,同时消除了对转移步骤的需要。该技术对表达的抗体的身份、纯度和异质性谱进行可重现、定量分析。结果确定了抗体上的电荷异质性和分子尺寸,在吸光度和天然荧光检测模式二者下并且检测灵敏度低至0.7μg/ml。
[0218]
溶解度。可确定抗体序列的固有溶解度评分。固有溶解度评分可使用camsol intrinsic(sormanni et al.,j mol biol 427,478-490,2015)进行计算。可通过在线程序评价每个抗体片段例如scfv的hcdr3中第95至102位残基(kabat编号)的氨基酸序列,以计算溶解度评分。也可使用实验室技术确定溶解度。存在多种技术,包括将冻干的蛋白质添加至溶液直至溶液变得饱和并达到溶解度极限,或者通过在具有合适的分子量截止值的微浓缩器中超滤进行浓缩。最直接的方法是诱导无定形沉淀,其使用涉及使用硫酸铵进行蛋白质沉淀的方法来测量蛋白质溶解度(trevino et al.,j mol biol,366:449-460,2007)。硫酸铵沉淀提供有关相对溶解度值的快速且准确的信息。硫酸铵沉淀产生具有明确水相和固相的沉淀的溶液,并且需要相对少量的蛋白质。使用通过硫酸铵诱导无定形沉淀进行的溶解度测量也可在不同的ph值下容易地进行。蛋白质溶解度是高度ph依赖性的,并且ph被认为是影响溶解度的最重要的外在因素。
[0219]
自身反应性。通常认为,应在个体发生期间通过负选择消除自身反应性克隆;然而,已经清楚的是,具有自身反应性特性的许多人天然存在抗体在成体成熟库中仍然存在,并且自身反应性可增强许多抗体针对病原体的抗病原体功能。已经注意到,在早期b细胞发育期间抗体中的hcdr3环通常富含正电荷并且表现出自身反应性模式(wardemann et al.,science 301,1374-1377,2003)。可通过在显微镜(使用黏附的hela或hep-2上皮细胞)和流式细胞术细胞表面染色(使用悬浮的jurkat t细胞和293s人胚肾细胞)中评估与人来源细胞结合的水平来测试给定抗体的自身反应性。也可使用对与组织阵列中组织的结合的评估来考察自身反应性。
[0220]
优选残基(“人相似性”)。在许多近期研究中,正在大规模地对来自血液供体的人b细胞进行b细胞库深度测序。关于人抗体库重要部分的序列信息有助于对健康人中常见的抗体序列特征进行统计学评估。利用人重组抗体可变基因参考数据库中有关抗体序列特征
的知识,可估计抗体序列的“人相似性”(human likeness,hl)的位置特异性程度。已表明hl可用于开发临床使用的抗体,如治疗性抗体或作为疫苗的抗体。目的是提高抗体的人相似性,以降低将导致抗体药物的效力显著下降或可诱导严重的健康影响的不良作用和抗抗体免疫应答。可评估总共约4亿个序列的三名健康人血液供体的组合抗体库的抗体特征,并创建了聚焦于抗体的高变区的新“相对人相似性”(rhl)评分。rhl评分使人们容易地区分人序列(正评分)与非人序列(负评分)。可对抗体进行改造,以消除人库中不常见的残基。
[0221]
d.单链抗体
[0222]
单链可变片段(scfv)是用短(通常丝氨酸、甘氨酸)接头连接在一起的免疫球蛋白重链和轻链可变区的融合物。这种嵌合分子虽然去除了恒定区并且引入了接头肽但是保留了原始免疫球蛋白的特异性。这种修饰通常不改变特异性。历史上产生这些分子是为了有利于噬菌体展示,其中将抗原结合结构域表达为单个肽非常方便。或者,可由来源于杂交瘤或b细胞的亚克隆重链和轻链直接产生scfv。单链可变片段缺少存在于完全抗体分子中的恒定fc区,并因此缺少用于纯化抗体的常见结合位点(例如,蛋白a/g)。这些片段通常可使用蛋白l纯化/固定,因为蛋白l与κ轻链的可变区相互作用。
[0223]
柔性接头通常由促进螺旋和转角的氨基酸残基(例如丙氨酸、丝氨酸和甘氨酸)构成。然而,其他残基也可很好地作用。tang et al.(1996)使用噬菌体展示作为从蛋白质接头文库中快速选择用于单链抗体(scfv)的专用接头的方式。构建随机接头文库,其中用于重链和轻链可变结构域的基因通过编码具有可变组成的18-氨基酸多肽的区段连接。在丝状噬菌体上展示scfv库(约5
×
106个不同成员)并且用半抗原进行亲和选择。所选择变体的群体表现出结合活性显著提高,但是保留了相当大的序列多样性。随后筛选1054个单独变体产生了以可溶性形式有效产生的催化活性scfv。序列分析揭示,所选择栓链(tether)的仅有的共同特征是:vhc末端之后的两个残基是接头中的保守脯氨酸以及在其他位置处有大量的精氨酸和脯氨酸。
[0224]
本公开内容的重组抗体还可涉及允许受体二聚化或多聚化的序列或部分。这样的序列包括来源于iga的那些,其允许与j链联合形成多聚体。另一个多聚化结构域是gal4二聚化结构域。在另一些实施方案中,可用允许两个抗体组合的试剂(例如生物素/抗生物素蛋白)对链进行修饰。
[0225]
在一个独立的实施方案中,可通过使用非肽接头或化学单元连接受体轻链和重链来产生单链抗体。通常来说,使轻链和重链在不同细胞中产生,纯化,并且随后以合适的方式连接在一起(即,通过合适的化学桥将重链的n端与轻链的c端连接)。
[0226]
使用交联试剂形成将两个不同分子的官能团系住的分子桥,例如,稳定和凝结剂。然而,可产生相同类似物的二聚体或多聚体或者包含不同类似物的异聚复合体。为了以逐步方式连接两个不同化合物,可使用异-双官能交联剂,其消除了不想要的均聚物形成。
[0227]
一种示例性的异-双官能交联剂包含两个反应性基团:一个与伯胺基(例如,n-羟基琥珀酰亚胺)反应并且另一个与硫醇基团(例如,吡啶基二硫化物、马来酰亚胺、卤素等)反应。通过伯胺反应基,交联剂可与一个蛋白质(例如,所选择的抗体或片段)的赖氨酸残基反应,并且通过硫醇反应基,已经系在第一蛋白质上的交联剂与另一蛋白质(例如,选择剂)的半胱氨酸残基(游离巯基)反应。
[0228]
在一些实施方案中,可使用在血液中具有合理稳定性的交联剂。已知多种类型含
al.,nature,305:537-539(1983))。由于免疫球蛋白重链和轻链的随机分类,因此这些杂交瘤(四源杂交瘤(quadroma))可产生十种不同抗体分子的混合物,其中只有一种具有正确的双特异性结构。通常通过亲和色谱步骤而完成的正确分子的纯化相当繁琐,并且产物产率低。在wo 93/08829和traunecker et al.,embo j.,10:3655-3659(1991)中公开了类似的操作。
[0237]
根据不同的方法,将具有期望结合特异性(抗体-抗原组合位点)的抗体可变区与免疫球蛋白恒定结构域序列融合。优选地,融合是与ig重链恒定结构域(包含铰链区、c
h2
区和c
h3
区的至少一部分)进行的。优选使得包含轻链键合所必需位点的第一重链恒定区(c
h1
)存在于至少一个融合物中。将编码免疫球蛋白重链融合物和(如果期望的话)免疫球蛋白轻链的dna插入到分开的表达载体中,并共转染到合适的宿主细胞中。在当构建中使用的不等比率的三条多肽链提供了期望双特异性抗体的最佳产率时的一些实施方案中,这为调节三个多肽片段的相互比例提供了更大的灵活性。当至少两条多肽链以相等比率的表达导致高产率时,或者当比率对所期望链组合的产率没有显著影响时,可将两条或全部三条多肽链的编码序列插入到单个表达载体中。
[0238]
在该方法的一个特定实施方案中,双特异性抗体由一个臂中的具有第一结合特异性的杂合免疫球蛋白重链和另一个臂中的杂合免疫球蛋白重链-轻链对(提供第二结合特异性)构成。已发现,这种不对称结构有助于从不期望的免疫球蛋白链组合中分离期望的双特异性化合物,因为仅在双特异性分子的一半中存在免疫球蛋白轻链提供了简易的分离方式。该方法在wo 94/04690中公开。对于产生双特异性抗体的另外的详细信息,参见例如suresh et al.,methods in enzymology,121:210(1986)。
[0239]
根据美国专利5,731,168中描述的另一种方法,可对一对抗体分子之间的界面进行改造,以使从重组细胞培养物中回收的异二聚体的百分比最大化。优选的界面包括c
h3
结构域的至少一部分。在该方法中,将来自第一抗体分子的界面的一个或更多个小氨基酸侧链替换为较大的侧链(例如,酪氨酸或色氨酸)。通过将大的氨基酸侧链替换为较小的侧链(例如,丙氨酸或苏氨酸),在第二抗体分子的界面上产生了与一种或更多种大的侧链相同或类似尺寸的补偿“腔”。这提供了提高异二聚体的产率而不是其他不期望的最终产物(例如同二聚体)的产率的机制。
[0240]
双特异性抗体包括交联或“异缀合”抗体。例如,异缀合物中的一种抗体可与抗生物素蛋白偶联,另一种与生物素偶联。例如,已提出这样的抗体以将免疫系统细胞靶向不期望的细胞(美国专利4,676,980),以及用于治疗hiv感染(wo 91/00360、wo 92/200373和ep 03089)。异缀合物抗体可使用任何方便的交联方法来制成。合适的交联剂是本领域公知的,并在美国专利4,676,980中公开,以及许多交联技术。
[0241]
关于从抗体片段产生双特异性抗体的技术也已在文献中描述。例如,可使用化学键联来制备双特异性抗体。brennan et al.,science,229:81(1985)描述了这样的操作,其中完整的抗体被蛋白水解切割以产生f(ab’)2片段。这些片段在二硫醇络合剂亚砷酸钠的存在下被还原,以稳定邻位二硫醇并阻止分子间二硫化物形成。然后将产生的fab’片段转化为硫代硝基苯甲酸酯(tnb)衍生物。然后通过用巯基乙胺还原将一种fab
’‑
tnb衍生物重新转化为fab
’‑
硫醇,并与等摩尔量的另一种fab
’‑
tnb衍生物混合以形成双特异性抗体。产生的双特异性抗体可用作用于选择性固定酶的试剂。
[0242]
存在促进从大肠杆菌直接回收fab
’‑
sh片段的技术,该片段可进行化学偶联以形成双特异性抗体。shalaby et al.,j.exp.med.,175:217-225(1992)描述了人源化双特异性抗体f(ab’)2分子的产生。每个fab’片段单独从大肠杆菌中分泌出,并在体外进行定向化学偶联以形成双特异性抗体。如此形成的双特异性抗体能够与过表达erbb2受体的细胞和正常人t细胞结合,以及触发人细胞毒性淋巴细胞针对人乳腺肿瘤靶标的裂解活性。
[0243]
还已描述了用于直接从重组细胞培养物制备并分离双特异性抗体片段的多种技术(merchant et al.,nat.biotechnol.16,677-681(1998).doi:10.1038/nbt0798-677pmid:9661204)。例如,已使用亮氨酸拉链产生了双特异性抗体(kostelny et al.,j.immunol.,148(5):1547-1553,1992)。通过基因融合,将来自fos和jun蛋白的亮氨酸拉链肽与两种不同抗体的fab’部分连接。抗体同二聚体在铰链区还原以形成单体,然后再氧化以形成抗体异二聚体。该方法也可用于产生抗体同二聚体。hollinger et al.,proc.natl.acad.sci.usa,90:6444-6448(1993)描述的“双抗体”技术为制备双特异性抗体片段提供了替代机制。片段包含通过接头与v
l
连接的vh,该接头太短而无法允许在同一链上的两个结构域之间的配对。因此,一个片段的vh和v
l
结构域被迫与另一片段的互补的v
l
和vh结构域配对,从而形成两个抗原结合位点。还已报道了通过使用单链fv(sfv)二聚体制备双特异性抗体片段的另一种策略。参见gruber et al.,j.immunol.,152:5368(1994)。
[0244]
在一个特定实施方案中,双特异性或多特异性抗体可形成为dock-and-lock
tm
(dnl
tm
)复合物(参见,例如,美国专利7,521,056;7,527,787;7,534,866;7,550,143和7,666,400,其各自的实施例部分通过引用并入本文)。通常来说,该技术利用了在camp依赖性蛋白激酶(pka)的调节(r)亚基的二聚化及对接结构域(dimerization and docking domain,ddd)序列与来源于多种akap蛋白中任何一种的锚定结构域(anchor domain,ad)序列之间发生的特异性和高亲和力结合相互作用(baillie et al.,febs letters.2005;579:3264;wong and scott,nat.rev.mol.cell biol.2004;5:959)。ddd和ad肽可与任何蛋白质、肽或其他分子连接。由于ddd序列自发地二聚化并与ad序列结合,因此该技术允许在可与ddd或ad序列连接的任何选择的分子之间形成复合物。
[0245]
也可产生具有多于二价的抗体。例如,可制备三特异性抗体(tutt et al.,j.immunol.147:60,1991;xu et al.,science,358(6359):85-90,2017)。多价抗体可比二价抗体更快速地被表达抗体与其结合的抗原的细胞内化(和/或分解代谢)。本公开内容的抗体可以是具有三个或更多个抗原结合位点的多价抗体(例如四价抗体),其可通过重组表达编码抗体多肽链的核酸来容易地产生。多价抗体可包含二聚化结构域以及三个或更多个抗原结合位点。优选的二聚化结构域包含fc区或铰链区(或由其组成)。在这种情况下,抗体将包含fc区和fc区氨基末端的三个或更多个抗原结合位点。本文中优选的多价抗体包含三个至约八个,但优选四个抗原结合位点(或由其组成)。多价抗体包含至少一条多肽链(并且优选两条多肽链),其中该一条或更多条多肽链包含两个或更多个可变区。例如,一条或更多条多肽链可包含vd1-(x1)
n-vd2-(x2)
n-fc,其中vd1是第一可变区,vd2是第二可变区,fc是fc区的一条多肽链,x1和x2代表氨基酸或多肽,并且n为0或1。例如,一条或更多条多肽链可包含vh-ch1-柔性接头-vh-ch1-fc区链;或vh-ch1-vh-ch1-fc区链。本文中的多价抗体优选地还包含至少两个(并且优选四个)轻链可变区多肽。本文中的多价抗体可例如包含约二至约八个轻链可变区多肽。轻链可变区多肽包含轻链可变区,并且任选地还包含c
l
结构域。
[0246]
电荷修饰特别可用于多特异性抗体的情况,其中fab分子中的氨基酸替换导致轻链与不匹配重链的错配(本-周型(bence-jones-type)副产物)降低,这可在基于fab的双/多特异性抗原结合分子的产生中发生,所述分子的结合臂中的一个(或更多个,在分子包含多于两个抗原结合fab分子的情况下)具有vh/vl交换(另见pct公开no.wo 2015/150447,特别是其中的实施例,通过引用整体并入本文)。
[0247]
因此,在一些特定实施方案中,治疗剂中所包含的抗体包含
[0248]
(a)与第一抗原特异性结合的第一fab分子
[0249]
(b)与第二抗原特异性结合的第二fab分子,并且其中fab轻链和fab重链的可变结构域vl和vh彼此替换,
[0250]
其中所述第一抗原是活化t细胞抗原并且所述第二抗原是靶细胞抗原,或者所述第一抗原是靶细胞抗原并且所述第二抗原是活化t细胞抗原;并且
[0251]
其中:
[0252]
i)在a)中的所述第一fab分子的恒定结构域cl中,第124位氨基酸被带正电荷的氨基酸替换(根据kabat编号),并且其中在a)中的所述第一fab分子的恒定结构域ch1中,第147位氨基酸或第213位氨基酸被带负电荷的氨基酸替换(根据kabat eu索引编号);或者
[0253]
ii)在b)中的所述第二fab分子的恒定结构域cl中,第124位氨基酸被带正电荷的氨基酸替换(根据kabat编号),并且其中在b)中的所述第二fab分子的恒定结构域ch1中,第147位氨基酸或第213位氨基酸被带负电荷的氨基酸替换(根据kabat eu索引编号)。
[0254]
在某些实施方案中,抗体不包含i)和ii)中提到的两种修饰。在一些实施方案中,第fab分子的恒定结构域cl和ch1不彼此替换(即保持未交换)。
[0255]
在抗体的另一个实施方案中,在a)中的所述第一fab分子的恒定结构域cl中,第124位氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)替换(根据kabat编号)(在一个优选实施方案中独立地被赖氨酸(k)或精氨酸(r)替换),并且在a)中的所述第一fab分子的恒定结构域ch1中,第147位氨基酸或第213位氨基酸独立地被谷氨酸(e)或天冬氨酸(d)替换(根据kabat eu索引编号)。
[0256]
在另一个实施方案中,在a)中的所述第一fab分子的恒定结构域cl中,第124位氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)替换(根据kabat编号),并且在a)中的所述第一fab分子的恒定结构域ch1中,第147位氨基酸独立地被谷氨酸(e)或天冬氨酸(d)替换(根据kabat eu索引编号)。
[0257]
在一个特定实施方案中,在a)中的所述第一fab分子的恒定结构域cl中,第124位氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)替换(根据kabat编号)(在一个优选实施方案中独立地被赖氨酸(k)或精氨酸(r)替换)并且第123位氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)替换(根据kabat编号)(在一个优选实施方案中独立地被赖氨酸(k)或精氨酸(r)替换),并且在a)中的所述第一fab分子的恒定结构域ch1中,第147位氨基酸独立地被谷氨酸(e)或天冬氨酸(d)替换(根据kabat eu索引编号)并且第213位氨基酸独立地被谷氨酸(e)或天冬氨酸(d)替换(根据kabat eu索引编号)。
[0258]
在一个更特定实施方案中,在a)中的所述第一fab分子的恒定结构域cl中,第124位氨基酸被赖氨酸(k)替换(根据kabat编号)并且第123位氨基酸被赖氨酸(k)或精氨酸(r)替换(根据kabat编号),并且在a)中的所述第一fab分子的恒定结构域ch1中,第147位氨基
酸被谷氨酸(e)替换(根据kabat eu索引编号)并且第213位氨基酸被谷氨酸(e)替换(根据kabat eu索引编号)。
[0259]
在一个甚至更特定的实施方案中,在a)中的所述第一fab分子的恒定结构域cl中,第124位氨基酸被赖氨酸(k)替换(根据kabat编号)并且第123位氨基酸被精氨酸(r)替换(根据kabat编号),并且在a)中的所述第一fab分子的恒定结构域ch1中,第147位氨基酸被谷氨酸(e)替换(根据kabat eu索引编号)并且第213位氨基酸被谷氨酸(e)替换(根据kabat eu索引编号)。
[0260]
f.嵌合抗原受体
[0261]
人工t细胞受体(也称为嵌合t细胞受体、嵌合免疫受体、嵌合抗原受体(car))是经改造的受体,其可将任意特异性移植到免疫效应细胞上。通常来说,这些受体用于将单克隆抗体的特异性移植到t细胞上,通过逆转录病毒载体促进其编码序列的转移。以这种方式,可产生大量的肿瘤特异性t细胞以用于过继细胞转移。这种方法的i期临床研究显示出效力。
[0262]
这些分子的最常见形式是来源于单克隆抗体的单链可变片段(scfv)的融合,其与cd3-ζ跨膜和胞内结构域融合。这样的分子导致响应于scfv对其靶标的识别的ζ信号的传递。这样的构建体的一个实例是14g2a-ζ,其是来源于杂交瘤14g2a(识别二唾液酸神经节苷脂gd2)的scfv的融合体。当t细胞表达这种分子(通常通过癌逆转录病毒载体转导实现)时,其识别并杀伤表达gd2的靶细胞(例如神经母细胞瘤细胞)。为了靶向恶性b细胞,研究者使用对b谱系分子cd19具有特异性的嵌合免疫受体重定向了t细胞的特异性。
[0263]
免疫球蛋白重链和轻链的可变部分通过柔性接头融合以形成scfv。该scfv之前是信号肽,以将新生蛋白定向至内质网并随后进行表面表达(这是经切割的)。柔性间隔子允许scfv在不同方向上定向,以允许抗原结合。跨膜结构域是通常来源于信号传导胞内结构域的原始分子的典型疏水α螺旋,所述信号传导胞内结构域突入细胞中并传递所期望的信号。
[0264]
i型蛋白质实际上是其之间通过跨膜α螺旋连接的两个蛋白质结构域。跨膜结构域通过的细胞膜脂质双层用于将内部部分(胞内结构域)与外部部分(胞外结构域)分离。并不出人意料的是,将来自一种蛋白质的胞外结构域与另一种蛋白质的胞内结构域连接产生了将前者的识别与后者的信号组合的分子。
[0265]
胞外结构域。信号肽将新生蛋白定向至内质网中。如果受体待被糖基化并锚定在细胞膜中,这是必不可少的。任何真核信号肽序列通常均很好地发挥作用。通常,使用与最氨基末端组分天然连接的信号肽(例如,在具有轻链-接头-重链取向的scfv中,使用轻链的天然信号)。
[0266]
抗原识别结构域通常是scfv。然而,有很多替代物。已描述了来自天然t细胞受体(t-cell receptor,tcr)α和β单链的抗原识别结构域,如具有简单的胞外结构域(例如识别hiv感染细胞的cd4胞外结构域)和更独特的识别组分例如连接的细胞因子(其导致识别带有细胞因子受体的细胞)。实际上,几乎以高亲和力结合给定靶标的任何事物均可用作抗原识别区域。
[0267]
间隔区将抗原结合结构域与跨膜结构域连接。它应有足够柔性以允许抗原结合结构域在不同方向上定向以促进抗原识别。最简单的形式是来自igg1的铰链区。替代物包括
免疫球蛋白的ch2ch3区域和部分cd3。对于大部分基于scfv的构建体,igg1铰链就足够了。然而,最好的间隔子通常必须凭经验确定。
[0268]
跨膜结构域。跨膜结构域是跨越膜的疏水α螺旋。通常,使用来自胞内结构域最靠近膜的组分的跨膜结构域。令人感兴趣的是,使用cd3-ζ跨膜结构域可导致将人工tcr并入到天然tcr中,该因素取决于天然cd3-ζ跨膜带电荷天冬氨酸残基的存在。不同的跨膜结构域导致不同的受体稳定性。cd28跨膜结构域产生明显表达的稳定受体。
[0269]
胞内结构域。这是受体的“行使功能的一端(business-end)”。在抗原识别之后,受体聚集并且信号传递至细胞。最常用的胞内结构域组分是包含3itam的cd3-ζ。这在抗原被结合之后将活化信号传递至t细胞。cd3-ζ可不提供完全有效的活化信号并且需要另外的共刺激信号传导。
[0270]“第一代”car通常具有来自cd3ξ-链的胞内结构域,其是来自内源性tcr的信号的主要传递器。“第二代”car将来自多种共刺激蛋白受体(例如cd28、41bb、icos)的胞内信号传导结构域添加至car的胞质尾以为t细胞提供另外的信号。临床前研究表明,第二代car设计提高了t细胞的抗肿瘤活性。最近,“第三代”car组合了多种信号传导结构域,例如cd3z-cd28-41bb或cd3z-cd28-ox40,以进一步增强效力。
[0271]
g.adc
[0272]
抗体药物缀合物或adc是被设计为治疗患有感染性疾病的人的靶向治疗的新类别高度强效生物药物。adc是由通过具有不稳定键的稳定化学接头与生物活性细胞毒性/抗病原体有效负荷或药物连接的抗体(完整的mab或抗体片段,例如单链可变片段或scfv)构成的复合分子。抗体药物缀合物是生物缀合物和免疫缀合物的实例。
[0273]
通过将单克隆抗体独特的靶向能力与细胞毒性药物的癌症杀伤能力相结合,抗体-药物缀合物允许灵敏地区分健康组织和患病组织。这意味着,与传统的全身性方法相反,抗体-药物缀合物靶向并攻击受感染细胞,因此健康细胞受到的影响没那么严重。
[0274]
在基于adc的抗肿瘤治疗的开发中,将抗癌药物(例如细胞毒素(cell toxin)或细胞毒素(cytotoxin))与特异性靶向某些细胞标志物(例如,理想地仅在受感染细胞中或受感染细胞上发现的蛋白质)的抗体偶联。抗体在体内追踪这些蛋白质并将其自身附着于癌细胞表面。抗体与靶蛋白(抗原)之间的生化反应触发肿瘤细胞中的信号,肿瘤细胞然后吸收或内化抗体以及细胞毒素。在adc内化之后,细胞毒性药物被释放并杀伤细胞或损害病原体的复制。由于这种靶向,与其他药剂相比,理想地该药物具有更低的副作用并给予更宽的治疗窗。
[0275]
抗体与细胞毒性剂/抗病原体剂之间的稳定连接是adc的一个关键方面。接头基于包括二硫化物、腙或肽(可裂解)或硫醚(不可裂解)的化学基序,并控制细胞毒性剂的分布和向靶细胞的递送。在临床前和临床试验中,已证明可裂解和不可裂解类型的接头是安全的。本妥昔单抗(brentuximab vedotin)包含将强效且高毒性的抗微管剂,合成的抗肿瘤剂单甲基澳瑞他汀e(monomethyl auristatin e)或mmae,递送至人特异性cd30阳性恶性细胞的酶敏感的可裂解接头。mmae由于其高毒性(其通过阻断微管蛋白的聚合来抑制细胞分裂),因此不能用作单一药剂化学治疗药物。然而,与抗cd30单克隆抗体(cac10,肿瘤坏死因子或tnf受体的一种细胞膜蛋白)连接的mmae的组合被证明在胞外流体中是稳定的,可被组织蛋白酶裂解,并且用于治疗是安全的。曲妥珠单抗美坦新(trastuzumab emtansine)作为
另一种批准的adc,是微管形成抑制剂美登素(dm-1)(美登素的衍生物)与抗体曲妥珠单抗(/genentech/roche)通过稳定的、不可裂解的接头连接的组合。
[0276]
更好和更稳定的接头的可用性已改变了化学键的功能。接头的类型(可裂解的或不可裂解的)为细胞毒性(抗癌)药物提供了特定的特性。例如,不可裂解的接头将药物保留在细胞内。作为结果,整个抗体、接头和细胞毒性剂进入靶癌细胞,在那里抗体被降解至氨基酸水平。所得的复合体(氨基酸、接头和细胞毒性剂)现成为活性药物。相反,可裂解的接头被宿主细胞中的酶催化,在那里释放细胞毒性剂。
[0277]
目前在开发中的另一种类型的可裂解接头在细胞毒性药物/抗病原体药物与裂解位点之间添加了额外的分子。该接头技术允许研究人员创建具有更高灵活性的adc,而不必担心改变裂解动力学。研究人员还在开发基于edman降解的肽裂解的新方法,该方法是对肽中的氨基酸进行测序的方法。adc开发的未来方向还包括位点特异性缀合(tdc)的开发,以进一步改善稳定性和治疗指数以及发射α的免疫缀合物和抗体缀合的纳米粒。
[0278]
h.bite
[0279]
双特异性t细胞接合物(bi-specific t-cell engager,bite)是一类人工双特异性单克隆抗体,已被研究用作抗癌药物。其指导宿主的免疫系统,更具体地t细胞的细胞毒性活性,来针对受感染细胞。bite是micromet ag的注册商标。
[0280]
bite是融合蛋白,其包含不同抗体的两个单链可变片段(scfv)或者来自约55道尔顿的单条肽链上的四个不同基因的氨基酸序列。scfv中的一个通过cd3受体与t细胞结合,另一个通过特定分子与受感染细胞结合。
[0281]
与其他双特异性抗体一样,与普通的单克隆抗体不同,bite在t细胞和靶细胞之间形成连接。这导致t细胞独立于mhc i或共刺激分子的存在,通过产生例如穿孔素和颗粒酶的蛋白质对受感染细胞发挥细胞毒性/抗病原体活性。这些蛋白质进入受感染细胞并引发细胞凋亡。该作用模仿了在t细胞攻击受感染细胞期间观察到的生理过程。
[0282]
i.胞内抗体
[0283]
在一个特定实施方案中,抗体是适合在细胞内发挥作用的重组抗体——这样的抗体被称为“胞内抗体”。这些抗体可通过多种机制,例如通过改变胞内蛋白质运输,干扰酶的功能以及阻断蛋白质-蛋白质或蛋白质-dna的相互作用来干扰靶向功能。在许多方面中,它们的结构模仿或类似于以上所讨论的单链和单结构域抗体的那些。实际上,单转录物/单链是重要的特征,其允许在靶细胞中进行胞内表达,并且还使蛋白质跨细胞膜转运更为可行。然而,还需要另外的特征。
[0284]
影响胞内抗体治疗的实施的两个主要问题是递送(包括细胞/组织靶向)和稳定性。关于递送,已采用了多种方法,例如组织定向的递送、细胞类型特异性启动子的使用、基于病毒的递送以及细胞通透性/膜易位肽的使用。关于稳定性,方法通常是通过蛮力(brute force)筛选,包括涉及噬菌体展示并且可包括序列成熟或共有序列的开发的方法,或者更定向的修饰,例如插入稳定序列(例如fc区、伴侣蛋白序列、亮氨酸拉链)和二硫化物替换/修饰。
[0285]
胞内抗体可需要的另外的特征是胞内靶向的信号。已设计了可将胞内抗体(或其他蛋白质)靶向至亚细胞区域(例如细胞质、细胞核、线粒体和er)的载体,并且是可商购的(invitrogen corp.;persic et al.,1997)。
[0286]
凭借其进入细胞的能力,胞内抗体具有其他类型的抗体可能无法实现的另外的用途。在本发明抗体的情况下,在活细胞中与muc1胞质结构域相互作用的能力可干扰与muc1cd相关的功能,例如信号传导功能(与其他分子结合)或寡聚体形成。特别地,这样的抗体可用于抑制muc1二聚体的形成。
[0287]
j.纯化
[0288]
在某些实施方案中,本公开内容的抗体可以是经纯化的。如本文中使用的术语“纯化的”可以指可与其他组分分离的组合物,其中蛋白质被纯化至相对于其可天然获得状态的任何程度。因此,经纯化的蛋白质也指这样的蛋白质,其脱离了其可天然存在的环境。当使用术语“基本上纯化的”时,该指定可以指这样的组合物,其中蛋白质或肽形成该组合物的主要组分,例如构成组合物中蛋白质的约50%、约60%、约70%、约80%、约90%、约95%或更多。
[0289]
蛋白质纯化技术是本领域技术人员公知的。这些技术在一个水平上涉及将细胞环境粗分级至多肽级分和非多肽级分。在使多肽与其他蛋白质分离之后,可使用色谱和电泳技术进一步纯化目的多肽以实现部分纯化或完全纯化(或纯化至均质)。特备适合制备纯肽的分析方法是离子交换色谱、排阻色谱;聚丙烯酰胺凝胶电泳;等电聚集。其他用于蛋白质纯化的方法包括用硫酸铵、peg、抗体等或通过热变性进行沉淀,然后进行离心;凝胶过滤、反相、羟基磷灰石和亲和色谱;以及这些技术与其他技术的组合。
[0290]
在纯化本公开内容的抗体中,可期望在原核或真核表达系统中表达多肽并使用变性条件提取蛋白质。可使用与多肽的标记部分结合的亲和柱从其他细胞组分纯化多肽。如本领域中通常已知的,认为进行各纯化步骤的顺序可改变,或者可省略某些步骤,并且仍然获得适合制备基本上纯化的蛋白质或肽的方法。
[0291]
通常,使用与抗体的fc部分结合的试剂(即,蛋白a)对完全抗体进行分级。或者,可使用抗原以同时纯化和选择合适的抗体。这样的方法通常使用结合在支持物(例如柱、过滤器或珠)上的选择剂。使抗体与支持物结合,除去(例如,冲洗掉)污染物,并通过施加条件(盐、热等)释放抗体。
[0292]
根据本公开内容,本领域技术人员将知道多种用于对蛋白质或肽之纯化程度进行定量的方法。这些包括例如确定活性级分的比活性,或者通过sds/page分析来评估级分中多肽的量。另一种用于评估级分纯度的方法是计算级分的比活性,将其与初始提取物的比活性比较,并因此计算纯度。当然,用于表示活性量的实际单位将取决于根据纯化而选择的特定测定技术,以及所表达蛋白质或肽是否表现出可检测活性。
[0293]
已知多肽的迁移可随着不同的sds/page条件而改变,有时候显著地改变(capaldi et al.,1977)。因此,应理解的是,在不同的电泳条件下,纯化的或部分纯化的表达产物的表观分子量可改变。
[0294]
iii.主动/被动免疫接种和念珠菌感染的治疗/预防
[0295]
a.制剂
[0296]
本公开内容提供了包含抗念珠菌抗体和用于产生该抗念珠菌抗体的抗原的药物组合物。这样的组合物包含预防或治疗有效量的抗体或其片段或者肽免疫原以及可药用载体。本文中使用的术语“可药用载体”可包括与药物施用相容的任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂等。在一个具体实施方案中,术语“可药
用”可意指由联邦或州政府的监管机构批准或者在美国药典或其他公认的药典中列出用于动物并且更特别地用于人。术语“载体”可以指与治疗剂一起施用的稀释剂、赋形剂或载剂。合适的载体在最新版的remington’s pharmaceutical sciences中进行了描述,这是该领域中的标准参考文献,其通过引入并入本文。这样的药用载体可以是无菌液体,例如水和油,包括石油、动物、植物或合成来源的那些,例如花生油、豆油、矿物油、芝麻油等。当药物组合物是静脉内施用时,水是特定的载体。盐水溶液和右旋糖水溶液和甘油溶液也可用作液体载体,特别是用于可注射溶液。另一些合适的药用赋形剂包括但不限于淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂乳粉、甘油、丙二醇、水、乙醇等。
[0297]
如果需要的话,组合物还可包含少量的润湿剂或乳化剂或ph缓冲剂。这些组合物可采取溶液剂、混悬剂、乳剂、片剂、丸剂、胶囊剂、散剂、缓释制剂等形式。经口制剂可包含标准载体,例如药用级的甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。合适的药用剂的一些实例在“remington’s pharmaceutical sciences”中描述。这样的组合物将包含预防或治疗有效量的抗体或其片段(优选以纯化的形式)以及合适量的载体,以便向患者提供用于适当施用的形式。制剂应适合于施用方式,其可以是经口、静脉内、动脉内、颊内、鼻内、雾化、支气管吸入、直肠内、经阴道、表面或通过机械通气递送。本发明的药物组合物被配制成与其预定的施用途径相容。
[0298]
b.施用
[0299]
施用途径的一些实例包括肠胃外,例如静脉内、皮内、皮下、经口(例如吸入)、透皮(即表面)、经黏膜和直肠施用。用于肠胃外、皮内或皮下施加的溶液剂或混悬剂可包含以下组分:无菌稀释剂例如注射用水、盐水溶液、不挥发性油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌剂例如苄醇或对羟基苯甲酸甲酯;抗氧化剂例如抗坏血酸或亚硫酸氢钠;螯合剂例如乙二胺四乙酸(edta);缓冲剂例如乙酸盐、柠檬酸盐或磷酸盐,和用于调节张度的试剂例如氯化钠或右旋糖。ph可用酸或碱调节,例如盐酸或氢氧化钠。肠胃外制剂可封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
[0300]
适合于可注射使用的药物组合物可包括无菌水溶液(在水溶性时)或分散体,以及用于即时制备无菌可注射溶液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、cremophor el
tm
(basf,parsippany,n.j.)或磷酸缓冲盐水(phosphate buffered saline,pbs)。在一些实施方案中,该组合物是无菌的并且是达到存在易注射性的程度的流体。其在制备和储存条件下可以是稳定的,并且可防止微生物例如细菌和真菌的污染作用。载体可以是溶剂或分散介质,其含有例如水,乙醇,多元醇(例如甘油、丙二醇和液体聚乙二醇等)以及其合适的混合物。例如,可通过使用包衣(例如卵磷脂)、通过在分散体的情况下维持所需的颗粒尺寸和通过使用表面活性剂来维持适当的流动性。防止微生物的作用可通过多种抗细菌剂和抗真菌剂,例如,对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等来实现。在许多情况下,将优选在组合物中包含等张剂,例如糖,多元醇例如甘露糖醇、山梨醇,氯化钠。可注射组合物的延长吸收可通过在该组合物中包含延迟吸收的药剂,例如单硬脂酸铝和明胶来实现。
[0301]
无菌可注射溶液可通过将所需量的活性化合物与以上列举的成分中的一种或组合根据需要一起并入适当的溶剂中,随后过滤灭菌来制备。通常,通过将活性化合物并入到
乙氨基乙醇、组氨酸、普鲁卡因等。
[0310]
抗体的被动转移,称为人工获得的被动免疫,通常将涉及静脉内或肌内注射的使用。抗体的形式可以是人或动物血液血浆或血清,作为用于静脉内使用的合并人免疫球蛋白(ivig)或肌内使用的合并人免疫球蛋白(ig),作为来自经免疫接种或来自从疾病中恢复的供体的高效价人ivig或ig,以及作为单克隆抗体(mab)。这样的免疫通常仅持续短的时间段,并且还存在对于超敏反应和血清病,尤其是来自于非人来源的γ-球蛋白的超敏反应和血清病的风险。然而,被动免疫提供即时保护。抗体将被配制在适合于注射(即无菌且可注射)的载体中。
[0311]
通常来说,本公开内容的组合物的成分以单位剂型分开提供或混合在一起提供,例如作为在指示活性剂的量的密封容器(例如安瓿或药袋(sachette))中的干燥的冻干粉末或无水浓缩物提供。当组合物通过输注施用时,其可用含有无菌药用级水或盐水的输液瓶进行分配。当组合物通过注射施用时,可提供一安瓿的无菌注射用水或盐水以便可在施用之前将成分混合。
[0312]
本公开内容的组合物可被配制为中性或盐形式。可药用盐包括与阴离子形成的那些,所述阴离子例如来源于盐酸、磷酸、乙酸、草酸、酒石酸等的那些;以及与阳离子形成的那些,所述阳离子例如来源于钠、钾、铵、钙、铁氢氧化物、异丙胺、三乙胺、2-乙基氨基乙醇、组氨酸、普鲁卡因等的那些。
[0313]
c.msc递送方法
[0314]
间充质干细胞(mesenchymal stem cell,msc)是独特的多能祖细胞,其目前正被用作用于多种病症,包括癌症和自身免疫病的基因治疗载体。尽管msc在同种异体msc移植期间主要以抗炎特性而已知,但是有msc在某些情况下实际上可促进适应性免疫的证据。msc已在广泛多种组织,包括骨髓、脂肪组织、胎盘和脐带血中被鉴定。脂肪组织是msc的最丰富的已知来源之一。
[0315]
已将msc成功移植到多种临床和临床前环境中的同种异体宿主中。这些供体msc通常促进免疫耐受,包括抑制在从主要组织相容性复合体(major histocompatibility complex,mhc)错配的供体进行细胞或组织移植之后可发生的移植物抗宿主病(graft-versus-host disease,gvhd)。在msc转移之后gvhd症状减轻是由于msc直接抑制t和b细胞增殖、静息自然杀伤细胞细胞毒性和树突细胞(dendritic cell,dc)成熟引起。至少一项研究报道了针对移植的同种异体msc的抗体的产生。然而,预防gvhd的能力也表明,在细胞疫苗接种期间,表达外来抗原的msc可比其他细胞类型(即dc)在选择性诱导仅对由msc表达的外来抗原且不是特异性的供体msc的免疫应答的方面具有优势。
[0316]
msc已作为用于抗癌治疗的递送载剂被研究,因为其先天倾向于归巢于肿瘤微环境。msc还被用于通过表达ifnα或ifnγ来促进致瘤性细胞的凋亡。另外,msc最近已被开发用于预防和抑制肿瘤发生和转移。另一些研究表明,永生化的msc可成为致瘤性的,并因此必须仔细研究以确定其是否确实是安全的以用于使用。移植的原代非永生化msc在体内最多仅持续数天。
[0317]
疫苗通常是预防感染性疾病的有效且具有成本效益的手段。疫苗在根除毁灭性疾病天花方面显示出变革性潜能,同时提供了控制先前引起广泛的发病率和死亡率的另一些疾病,包括白喉、脊髓灰质炎和麻疹的能力。然而,迄今为止,传统的疫苗方法未能提供针对
hiv、结核、疟疾和许多其他疾病,包括登革热、疱疹并甚至普通感冒的保护。传统疫苗方法未成功用于这些疾病的原因是复杂且多变的。例如,hiv将功能性前病毒基因组整合到宿主细胞的dna中,从而建立潜伏期或持久性。一旦建立了潜伏期/持久性,即使用高活性抗逆转录病毒治疗,也无法根除hiv。
[0318]
较新的替代免疫接种方法包括dna和细胞疫苗二者。dna疫苗涉及用抗原编码质粒转染在疫苗接种的组织部位处的细胞,该质粒允许局部细胞(即肌细胞)原位产生疫苗抗原。细胞疫苗使用表达或呈递疫苗抗原的预脉冲或转染的宿主抗原呈递细胞(例如树突细胞,dc)的直接转移。这些方法的优点是疫苗抗原在体内产生并且容易用于免疫过程。尽管有许多成功的临床前测试的报道,但两种这样的方法均遇到了障碍。人中的dna疫苗接种研究显示出差的效力,这与小鼠与人之间的先天差异有关。dc疫苗接种策略已显示出治疗性癌症疫苗接种的临床成功有限,并且由于必要的个体定制而具有高产生成本。
[0319]
在此,本发明人设想了附加地(episomally)表达特异性靶向念珠菌的抗体的免疫保护性原代间充质干细胞(immunoprotective primary mesenchymal stems cell,ip-msc)的用途,以及制备和使用ip-msc的方法。ip-msc用编码抗原结合多肽(例如,全抗体、单链可变抗体片段(scfv)、fab或f(ab’)2抗体片段、双抗体、三抗体等)的一种或更多种附加型载体(episomal vector)来转染。任选地,ip-msc还可表达一种或更多种其他免疫调节多肽,例如细胞因子,例如白介素(例如,il-2、il-4、il-6、il-7、il-9和il-12)、干扰素(例如,ifnα、ifnβ或ifnω)等,其可增强抗原结合多肽中和真菌的有效性。每种免疫反应性多肽均包含来自对由真菌产生的抗原具有特异性的中和抗体(例如来自暴露的对象的天然抗体)或者所述中和抗体的抗原结合区的氨基酸序列。每个抗原结合区肽被排列并定向成与病原体或毒素特异性结合并且中和病原体或毒素。
[0320]
在一些实施方案中,ip-msc表达特异性靶向病原体的例如1、2、3、4、5或6种免疫反应性多肽,或多至约10、20、30、40、50、60、70、80、90或100种免疫反应性多肽。例如,每种免疫反应性多肽可特异性靶向来自病原生物体的蛋白质或其片段并且与来自病原生物体的蛋白质或其片段结合。
[0321]
ip-msc可用于产生针对病原体感染的被动免疫或者治疗病原体感染。可在可药用载体(例如,缓冲液例如磷酸缓冲盐水,或适合于维持可生存的转染原代msc的任何其他缓冲材料)中提供ip-msc以用作治疗或预防由病原体引起的感染性疾病的药物组合物。在一些实施方案中,ip-msc包含骨髓来源msc,而在一些其他实施方案中,ip-msc包含脂肪msc细胞、胎盘msc细胞或脐带血msc细胞。
[0322]
本文中所述的ip-msc特别可用于针对真菌的暂时被动保护,至少部分是因为原代msc是通常不被免疫系统靶向的低免疫原性细胞。因此,ip-msc被治疗对象耐受,这允许细胞存活足够的时间用于表达、产生和释放的免疫反应性多肽与对象已经或可能暴露于其中的念珠菌结合并且抑制对象已经或可能暴露于其中的念珠菌。另外,原代msc在体内的寿命通常有限,因此可减轻用msc进行的治疗的不期望的长期副作用(例如致癌性),这可能是永生化msc的问题。
[0323]
本发明人使用多拷贝、非感染性、非整合性环状附加体,其用于同时表达保护性完全人单链抗体片段、全长igg或针对多种(甚至数百种)细菌、病毒、真菌或寄生物蛋白或蛋白质类毒素的其他免疫反应性多肽。在一些实施方案中,附加体基于来源于eb病毒
(epstein-barr virus,ebv)核抗原l表达盒(ebna1)和orip复制起点的组分。这些优选地是仅使用ebv组分,使得无病毒被复制或组装。该系统导致间质干细胞中稳定的染色体外持久性和长期异位基因表达。在本文中所述的方法中,scfv或其他免疫反应性多肽以保护量在msc中有效表达并从msc中分泌。这种技术在美国专利9,101,597中进行了详细描述,其通过引用并入本文。基于ebv的附加体在人细胞中引入并维持非常大的人基因组dna片段(>300kb)的能力是本文中所述方法的另一个显著优点。该特征允许在能够在细菌中复制、适合于大规模纯化、转染到hmsc和作为附加型质粒复制的载体中克隆数十种表达元件。对于每种免疫反应性多肽,免疫反应性多肽(例如,scfv)的靶向表达水平为约10pg/细胞/天,优选表达水平为5pg/细胞/天。对于每种免疫反应性多肽,用具有10pg/细胞/天的生产率的约1
×
10
11
msc进行的输注每天产生约1克可溶性多肽,等同于75kg成人的循环中15mg/ml的水平,这是合适的治疗剂量水平。启动子和其他调节元件用于驱动每种类型的免疫调节分子的表达。
[0324]
文献中的数份报道指出了来自msc中良好表征启动子的非经典表达模式。人巨细胞病毒主要即早期基因启动子(cmv-mie)是已知最强启动子之一,并且是产生每升多克重组蛋白药物产生稳定哺乳动物细胞系的主要元件。然而,cmv-mie在msc中的转录相对较差。相比之下,ef1a、ubc和cagg启动子在无明显的迹象或启动子沉默的情况下在msc中表现出高水平的表达。在本文中所述的方法中使用的附加型载体可包含任何这样的启动子。还提供了无抗生素选择标志物的表达载体用于在大肠杆菌(e.coli)中扩增质粒。附加型质粒的复制性质排除了其在破坏抗生素抗性基因的开放阅读框的限制性内切核酸酶下的线性化。因此,可以预见基因重排将导致抗生素抗性基因的表达,这可在选定的情况下在人中引起不期望的抗生素抗性介导的副作用。如果需要或期望的话,可通过用质粒在大肠杆菌菌株中生长和繁殖的代谢选择性标志物替换抗生素抗性基因来避免这种情况。
[0325]
载体中的调节元件用于适应每种目的免疫调节分子的期望分泌水平和血清水平。全长抗体、scfv或其他免疫反应性多肽的表达受益于强启动子(例如cmv、efla、cagg等),以在msc施用之后小于一天的时间内达到治疗性血清水平。另一些免疫调节分子例如细胞因子通常由msc以低水平且短暂地表达并分泌。为了适应不同的表达水平和时机所需的灵活性,这样的基因由低基础启动子(即tk)驱动,或通过来自tet开/关启动子的受控诱导驱动。tet启动子系统受益于无害抗生素类似物例如无水四环素的使用,所述无水四环素在比用四环素低2log的浓度下激活tet启动子,不导致肠菌群失调、不导致对聚酮抗生素的抗性、并且不表现出抗生素活性,无水四环素是完全溶于水的并且可在饮用配给(drinking ration)中施用以增强转染的msc中所选择基因的激活。作为人体中四环素的第一分解产物的无水四环素的潜在毒性可通过施用其他类似物来规避,例如fda批准的四环素类似物多西环素,其也激活tet开/关启动子系统。该系统优先用于通过严格调节强效促凋亡基因(例如,bax)的诱导型表达来设计万全的“杀伤开关”,以在出现不良副作用事件或当已达到期望的治疗终点时启动靶向经转染msc的凋亡。tet-on系统的最新进展导致在为初始tet系统(tet-on advanced
tm
,tet-on 3g
tm
)中的多至100倍低的浓度处对启动子泄漏的抑制和对dox的响应的极大增强。药物选择性标志物不用于维持经转染msc中的载体稳定性:基于ebv的载体,已知其以每个细胞周期90%至92%的速率复制并保留在子细胞中。
[0326]
因为附加体不产生复制病毒,并且表达其的细胞不产生任何显著量的mhc分子,附
加体不导致将阻止该平台在个体中的后续使用的载体来源免疫。这可通过设计灵敏的测定来检测对来源于eb病毒(ebv)核抗原1表达盒和msc背景(hla分型)的组分的免疫应答(抗体elisa和基于t细胞的测定)来确定。进行遗传研究以研究ebv整合到宿主细胞染色体中的速率(fish、southern印迹、qpcr),并测量载体的瞬时复制性质。已报道了在不存在选择性标志物的情况下,ebv载体在每个细胞周期中保留约90%至92%的复制。降低的复制率有助于载体从宿主系统中清除。在非人灵长类(non-human primate,nhp)中,通过追踪预加载有细胞膜可渗透染料(绿色cmfda、橙色cmtmr)的经荧光标记的细胞来评估所注射msc的区室化,所述染料在酯化之后将不再穿过脂质双层并变得高度荧光。这样的测量在新鲜制备的组织切片(淋巴结、肝、脾、肌、脑、胰腺、肾、肠、心脏、肺、眼、雄性和雌性生殖组织)上或通过全身扫描进行。处理另外的组织切片用于分离dna和rna以用于分析载体序列和对应的转录物。对每种免疫反应性多肽、细胞因子和关闭转录物具有特异性的寡核苷酸的设计允许评估所有组织中的单独基因表达。一些启动子在一些组织中的转录比另一些更活跃,这需要评估msc在注射之后优先定位至外周组织和msc驻留以及重组基因的对应的转录活性二者。为此,可包含两种人工“条码”核酸标签,一种对tet开/关驱动的rna转录物具有特异性,另一种对附加型载体dna具有特异性。这些标签允许快速鉴定nhp和人的基因组与转录组背景中非常独特的序列。
[0327]
msc适于大规模电穿孔,并且效率高至90%。maxcyte,inc.(gaithersburg,md.)销售vlx
tm
大规模转染系统,其为特别设计用于在无菌、封闭转染环境中进行极大体积瞬时转染的占地面积小、易于使用的仪器。使用流式电穿孔技术,vlx
tm
大规模转染系统可在无菌、封闭的转染环境中以高细胞生存力和转染效率在小于约30分钟的时间内转染多至约2
×
10
11
个细胞。这种符合cgmp的系统可用于重组蛋白的快速产生,从工作台到cgmp试点和商业制备”。msc可在化学限定(chemically defined,cd)培养基中、在大规模细胞培养环境中培养。生物过程改造的最新进展导致cd制剂的快速发展,其支持大规模扩增msc而不丧失多能特征并保持遗传稳定性。脂肪来源msc可容易地从吸脂程序中获得,其中平均程序产生约1
×
108个msc,从而提供足够的细胞数用于在储存(banking)之前进行离体扩增(约25次倍增,>3
×
10
15
个细胞),其中剩余寿命和倍增数目(约25次)足以在输注之后维持治疗性分子在体内的表达和递送数周。msc通常显示倍增速率在48至72小时的范围,从而提供50至75天的体内寿命。输注的msc的周转率可通过测量转基因产物的循环水平以及通过由qpcr检测人的血液、鼻抽吸物和尿中的ebv序列来评估。在所期望的治疗时间段之后,基本上完全消除msc可通过固定于表达载体中的促凋亡基因的受控诱导型表达来诱导自毁来实现。也可评估在注射之后循环的msc来源免疫反应性多肽或其他免疫调节剂的水平,以及nhp中载体诱导的自身免疫或gvhd应答。在人中,可测量与自身免疫或同种异体免疫应答相关的另外的标志物,例如肝损伤的生物标志物(alt、ast)、肝功能标志物(alb、bil、ggt、alp等)和肾功能标志物(bun、cre、尿素、电解质等)。
[0328]
淋巴造血谱系抗原表达的缺乏将msc与造血细胞、内皮细胞、内皮祖细胞、单核细胞、b细胞和成红细胞区分开来。原代msc不是永生的并因此经受原代细胞约50次分裂的“海弗利克极限(hayflick limit)”。然而,在一个细胞能够产生多至约10
15
个子细胞的情况下扩增的能力是巨大的。另外,msc具有低的批次间变异性。可通过合并大量预筛选的供体脂肪组织来源msc来产生能够快速保护数百万处于风险中的个体的细胞库大小:100个供体,1
×
108个细胞/供体
×
25代离体=约3
×
10
17
细胞;约1
×
10
11
个细胞/输注=约300万剂量。两种方法可用于产生治疗性msc库(1)分离、扩增、测试、储存,随后是转染、回收和施用;以及(2)分离、扩增、测试、转染、储存以在解冻和短回收之后产生即用型(ready-to-administer)细胞。
[0329]
对于表征,可对主细胞库进行无菌、支原体、体外和体内外来剂(adventitious agent)测试、逆转录病毒测试、细胞鉴定、电子显微术和一些特定的病毒pcr测定(在fda在其1993年和1997年的指导文件中规定14,并且该列表已另外增加了数种推荐的病毒,主要是多瘤病毒)的测试。在原代培养条件下可能最初使用血清的情况下,可对9cfr牛病毒组进行测试。在正常制备期间如果细胞与猪产物接触,则优选也进行猪病毒测试。
[0330]
使用msc用于组织修复的限制之一是细胞在离体扩增和重新注射到其来源的人中之后无法永久定殖器官。无论是注射到mhc匹配的还是不匹配的个体中,msc循环有限的时间段(例如,数周或数月)。成人msc通用基因递送平台开发中的该特定缺点是本文中所述的方法中的益处。对于开发的每个经改造的递送载体平台,可在nhp中评估经转染msc中表达的每种转基因的药代动力学(pharmacokinetic,pk)谱。期望的一个单剂量pk研究在食蟹猴中进行,其中iv施用经转染msc。在这样的研究中,2只雄性猴和2只雌性猴各自被静脉内(i.v.)施用高剂量(约10
11
个细胞)、中剂量(约108个细胞)和低剂量(约105个细胞)的msc。待评价的终点包括:笼侧(cage-side)观察、体重、定性食物消耗、眼科、心电图、临床病理学(例如,血液学、化学、凝结、尿分析)、免疫学(例如,免疫球蛋白和外周白细胞,例如b细胞、t细胞和单核细胞)、免疫原性、大体病理学(例如,尸检和选择的器官重量)、组织病理学、组织结合和药代动力学。每种重组抗体的血清浓度可在9周内在第1、3、6、12、24、36、48和63天用使用抗体特异性捕获和检测(hrp标记的抗id)试剂的合格的夹心型elisa进行监测。pk分析可通过非区室方法使用winnonlin软件(pharsight corp.)进行。每种抗体的药代动力学参数可作为最大血清浓度(c
max
)、剂量归一化的血清浓度(cmax/d)、时间0至无穷大的浓度-时间曲线下面积(auc
0-∞
)、剂量归一化的时间0至无穷大的浓度-时间曲线下面积(auc
0-∞
/d)、全身清除率(cl)、稳态分布体积(v
ss
)、终末阶段期间表观分布体积(vz)、终末消除阶段半衰期(t
1/2,终末
)和平均停留时间(mrt)来表示。可在新鲜制备的组织切片上或通过全身扫描通过追踪如上所述的预加载有细胞膜可渗透cmfda或cmtmr染料的经荧光标记的细胞,在nhp中评估所注射msc的外周循环和区室化。如上所述,可通过qpcr监测载体dna序列和转录物。
[0331]
有大量文献概述了体内缺乏针对msc的排斥。然而,这种现象可在nhp中使用多次注射用同源和异源dna载体修饰的同基因msc进行评价,随后对同种异体应答进行免疫学谱分析。例如,一组nhp可用使用表达lasv抗体的附加型载体转染的同基因msc的推注进行注射,并且另一组用表达流感抗体的类似载体进行注射。可在77天进程内每周评估对msc平台和对载体组分的免疫应答,在此期间应该可检测到任意免疫应答。在通过施用多西环素或其他四环素类似物激活关闭机制之后,nhp中的安全性和免疫原性可以以类似的方式进行评估。在施用多西环素方案之后,对载体组分和msc递送平台的不良免疫应答可以以类似的方式进行评估,所述方式例如,首先前2周半天一次(semi-daily),随后另外的77天每周一次。凋亡细胞死亡的另外的标志物可通过已建立的测定来追踪,例如提高的血清乳酸脱氢酶(1actic dehydrogenase,ldh)和胱天蛋白酶,以及循环msc中的磷脂酰丝氨酸
(phosphatidyl serine,ps)。如果在这77天时期之后未检测到对载体和msc的免疫应答,则可用同源msc再注射nhp,一组用使用同源载体转染的msc,而另一组将接受异源dna载体。同源和异源载体将具有相同的背景,但具有不同的重组抗体库。这种方法可表明针对msc和表达dna载体的免疫原性,而无论重组抗体库如何。用于评估针对msc平台的免疫学反应的77天时间线是基于在食蟹猴中使用人抗体进行的多剂量毒代动力学研究来选择的,该研究显示,在该时间范围内以10mg/kg施用的重组抗体的峰值血清水平平均降低5000倍。在这样的研究中,一些nhp可在第一次施用之后约50至60天产生抗人抗体应答,而一些动物可永不产生可检测到的对异源igg的体液应答。
[0332]
期望地,msc可在允许经遗传修饰msc的暖链(37℃)运输的装置中运输,使得消除了冷链运输,在提高的样品容量和细胞监测技术的情况下,例如来自microq technologies的装置。这些装置维持精确的温暖温度约24至约168小时,从而允许足够的时间用于在世界任何地方展开即用型治疗。可引入另外的储存和运输经包封细胞的能力,并且可根据需要制备能够支持气体交换的胶囊。从包封至施用的经过时间将解释ip-msc的代谢变化、细胞生长速率、生存力的变化以及将影响性能的任何另外的产品变化。
[0333]
d.adcc
[0334]
抗体依赖性细胞介导的细胞毒性(adcc)是导致免疫效应细胞裂解抗体包被的靶细胞的一种免疫机制。靶细胞可以是抗体或其包含fc区的片段通常通过该fc区n端的蛋白质部分与之特异性结合的细胞。具有提高/降低的抗体依赖性细胞介导的细胞毒性(adcc)的抗体可包括通过本领域普通技术人员已知的任何合适方法所确定的具有提高/降低的adcc的抗体。
[0335]
本文中使用的术语“提高/降低的adcc”可意指:在靶细胞周围的介质中的抗体的给定浓度下,通过如上所述的adcc的机制,在给定时间内裂解的靶细胞数量的提高/降低;或者在靶细胞周围的介质中,通过adcc机制,在给定时间内实现给定数量的靶细胞裂解所需的抗体浓度的降低/提高。adcc的提高/降低是相对于使用相同标准的产生、纯化、配制和储存方法(其是本领域技术人员已知的)由同一类型的宿主细胞(但其是未经改造的)产生的相同抗体介导的adcc。例如,由通过本文中所述方法改造为具有改变的糖基化模式(例如,表达糖基转移酶gntiii或其他糖基转移酶)的宿主细胞产生的抗体所介导的adcc的提高是相对于由通过同一类型的未经改造宿主细胞产生的相同抗体介导的adcc。
[0336]
e.cdc
[0337]
补体依赖性细胞毒性(cdc)是补体系统的功能。其是免疫系统中的过程,通过破坏病原体的膜来杀伤病原体而无需免疫系统的抗体或细胞的参与。存在三种主要过程。所有这三种过程都将一种或更多种攻膜复合物(membrane attack complex,mac)插入病原体中,这引起致死的胶体-渗透肿胀,即cdc。其是抗体或抗体片段具有抗真菌作用的机制之一。
[0338]
iv.抗体缀合物
[0339]
本公开内容的抗体可与至少一种试剂连接以形成抗体缀合物。为了提高抗体分子作为诊断剂或治疗剂的效力,常规地与至少一种期望的分子或部分连接或共价结合或复合。这样的分子或部分可包括但不限于至少一种效应分子或报道分子。效应分子包括具有期望活性,例如细胞毒活性的分子。已与抗体连接的效应分子的一些非限制性实例包括毒
素、抗肿瘤剂、治疗性酶、放射性核素、抗病毒剂、螯合剂、细胞因子、生长因子和寡核苷酸或多核苷酸。相比之下,报道分子可以是可使用测定检测的任何部分。已经与抗体缀合的报道分子的一些非限制性实例包括酶、放射性标记、半抗原、荧光标记、磷光分子、化学发光分子、发色团、光亲和分子、着色颗粒或配体,例如生物素。
[0340]
通常优选使用抗体缀合物作为诊断剂。抗体诊断剂通常属于两类:用于体外诊断例如用于多种免疫测定的那些,以及用于通常称为“抗体指导的成像”的体内诊断方案的那些。许多合适的显像剂是本领域中已知的,其与抗体连接的方法也如此(参见,例如,美国专利5,021,236、4,938,948和4,472,509)。所使用的成像部分可以是顺磁性离子、放射性同位素、荧光染料、可nmr检测物质和x-射线显像剂。
[0341]
在顺磁性离子的情况下,可通过以下示例性离子来提及:例如铬(iii)、锰(ii)、铁(iii)、铁(ii)、钴(ii)、镍(ii)、铜(ii)、钕(iii)、钐(iii)、镱(iii)、钆(iii)、钒(ii)、铽(iii)、镝(iii)、钬(iii)和/或铒(iii),其中特别优选钆。在另一些情况(例如x-射线成像)下可用的离子包括但不限于镧(iii)、金(iii)、铅(ii)和特别是铋(iii)。
[0342]
在用于治疗和/或诊断应用的放射性同位素的情况下,可提及砹
211
、
14
碳、
51
铬、
36
氯、
57
钴、
58
钴、铜
67
、
152
eu、镓
67
、3氢、碘
123
、碘
125
、碘
131
、铟
111
、
59
铁、
32
磷、铼
186
、铼
188
、
75
硒、
35
硫、锝
99m
和/或钇
90
。在某些实施方案中通常优选使用
125
i,并且也通常优选锝
99m
和/或铟
111
,因为其能量低和适用于长距离检测。本公开内容的放射性标记的单克隆抗体可根据本领域公知的方法产生。例如,可通过与碘化钠和/或碘化钾和化学氧化剂(例如次氯酸钠)或酶促氧化剂(例如乳过氧化物酶)接触来使单克隆抗体碘化。根据本公开内容的单克隆抗体可通过配体交换过程用锝
99m
标记,例如,通过用亚锡溶液还原高锝酸盐,将还原的锝螯合到sephadex柱上,并将抗体施加于该柱。或者,可使用直接标记技术,例如通过孵育高锝酸盐、还原剂(例如sncl2)、缓冲溶液(例如邻苯二甲酸钠钾溶液)和抗体进行。通常用于使作为金属离子存在的放射性同位素与抗体结合的中间官能团是二乙烯三胺五乙酸(dtpa)或乙二胺四乙酸(edta)。
[0343]
用作缀合物的荧光标记的一些非限制性实例包括alexa 350、alexa 430、amca、bodipy 630/650、bodipy 650/665、bodipy-fl、bodipy-r6g、bodipy-tmr、bodipy-trx、cascade blue、cy3、cy5、6-fam、异硫氰酸荧光素、hex、6-joe、oregon green 488、oregon green 500、oregon green 514、pacific blue、reg、罗丹明绿、罗丹明红、肾造影剂(renographin)、rox、tamra、tet、四甲基罗丹明和/或德克萨斯红(texas red)。
[0344]
根据本公开内容的另外类型的抗体是主要意图体外使用的那些,其中抗体与第二结合配体和/或在与显色底物接触之后产生着色产物的酶(酶标签)连接。合适的酶的一些实例包括脲酶、碱性磷酸酶、(辣根)过氧化氢酶或葡萄糖氧化酶。优选的第二结合配体是生物素以及抗生物素蛋白和链霉抗生物素蛋白化合物。这样的标记的使用对于本领域技术人员是公知的,并且在例如美国专利3,817,837、3,850,752、3,939,350、3,996,345、4,277,437、4,275,149和4,366,241中描述。
[0345]
分子与抗体的位点特异性连接的另一种已知方法包括使抗体与基于半抗原的亲和标记反应。实质上,基于半抗原的亲和标记与抗原结合位点中的氨基酸反应,从而破坏该位点并阻断特异性抗原反应。然而,这可能是不利的,因为其导致通过抗体缀合物的抗原结合丧失。
[0346]
包含叠氮基的分子也可用于经由通过低强度紫外光产生的反应性氮宾中间体来与蛋白质形成共价键(potter和haley,1983)。特别地,已经使用嘌呤核苷酸的2-叠氮类似物和8-叠氮类似物作为定点光探针以鉴定粗制细胞提取物中的核苷酸结合蛋白(owens&haley,1987;atherton et al.,1985)。2-叠氮核苷酸和8-叠氮核苷酸还已被用于对经纯化蛋白质的核苷酸结合结构域进行图谱绘制(khatoon et al.,1989;king et al.,1989;dholakia et al.,1989)并且可用作抗体结合剂。
[0347]
用于使抗体与其缀合部分连接或缀合的数种方法是本领域中已知的。一些连接方法涉及使用金属螯合物复合物,其使用例如与抗体连接的有机螯合剂,例如二乙烯三胺五乙酸酐(dtpa);亚乙基三胺四乙酸;n-氯-对-甲苯磺酰胺;和/或四氯-3α-6α-二苯基甘脲-3(tetrachloro-3α-6α-diphenylglycouril-3)(美国专利4,472,509和4,938,948)。单克隆抗体还可在存在偶联剂例如戊二醛或高碘酸盐的情况下与酶反应。与荧光素标记的缀合物在存在这些偶联剂的情况下或通过与异硫氰酸酯反应来制备。在美国专利4,938,948中,使用单克隆抗体实现了乳腺肿瘤的成像并且使用接头例如甲基-对羟基苯甲亚氨酸酯或n-琥珀酰亚胺基-3-(4-羟基苯基)丙酸酯使可检测成像部分与抗体结合。
[0348]
在另一些实施方案中,通过使用不改变抗体结合位点的反应条件选择性地将巯基引入免疫球蛋白的fc区中来使免疫球蛋白衍生化也是可用的。据公开,根据这种方法产生的抗体缀合物表现出改善的寿命、特异性和灵敏度(美国专利5,196,066,其通过引用并入本文)。在文献中也已经公开了效应分子或报道分子的位点特异性连接,其中报道分子或效应分子与fc区中的糖残基缀合(o’shannessy et al.,1987)。已经报道该方法产生目前处于临床评价之中的在诊断和治疗方面有希望的抗体。
[0349]
v.免疫检测方法
[0350]
在另一些实施方案中,本公开内容涉及用于结合、纯化、去除、定量和以其他方式一般地检测念珠菌及其相关抗原的免疫检测方法。虽然这样的方法可以在传统意义上应用,但另一种用途将是用于疫苗和其他念珠菌储液的质量控制和监测,其中根据本公开内容的抗体可用于评估病毒中抗原的量或完整性(即长期稳定性)。或者,该方法可用于筛选多种抗体的适当/期望反应性谱。
[0351]
其他免疫检测方法包括用于在对象中确定念珠菌之存在的特异性测定。可使用广泛多种测定形式,但具体地是将用于在从对象获得的流体(例如唾液、血液、血浆、痰、精液或尿)中检测念珠菌的那些。特别地,已表明精液作为用于检测念珠菌的可生存的样品(purpura et al.,2016;mansuy et al.,2016;barzon et al.,2016;gornet et al.,2016;duffy et al.,2009;cdc,2016;halfon et al.,2010;elder et al.2005)。可有利地对测定进行格式化以用于非健康护理(家庭)使用,包括类似于家庭妊娠测试的侧流测定(见下文)。这些测定可以以带有适当试剂的试剂盒的形式和说明书一起包装以允许家庭成员的对象使用。
[0352]
一些免疫检测方法包括酶联免疫吸附测定(enzyme linked immunosorbent assay,elisa)、放射免疫测定(radioimmunoassay,ria)、免疫放射测定、荧光免疫测定、化学发光测定、生物发光测定和western印迹等。特别地,还提供了用于检测和定量针对样品中特定寄生物表位的念珠菌抗体的竞争性测定。在科学文献例如doolittle and ben-zeev(1999)、gulbis and galand(1993)、de jager et al.(1993)和nakamura et al.(1987)中
已描述了多种可用免疫检测方法的步骤。通常来说,免疫结合方法包括获得怀疑包含念珠菌的样品并根据本公开内容使样品与第一抗体接触,视情况而定,这在有效允许免疫复合物形成的条件下进行。
[0353]
这些方法包括用于从样品中纯化念珠菌或相关抗原的方法。抗体将优选地连接至固体支持物,例如柱基质形式的固体支持物,并且将怀疑包含念珠菌或抗原成分的样品应用于固定化抗体。不需要的成分将从柱上洗掉,使念珠菌抗原免疫复合至固定化抗体,其然后通过从柱上去除生物体或抗原来收集。
[0354]
免疫结合方法还包括用于在样品中检测和定量念珠菌或相关组分的量以及检测和定量在结合过程期间形成的任何免疫复合物的方法。在此,将获得怀疑包含念珠菌或其抗原的样品,并使该样品与结合念珠菌或其组分的抗体接触,随后检测并定量在特定条件下形成的免疫复合物的量。就抗原检测而言,所分析的生物样品可以是任何怀疑包含念珠菌或念珠菌抗原的样品,例如组织切片或试样,均质化组织提取物,生物流体包括血液和血清,或者分泌物例如粪便或尿。
[0355]
使所选生物样品与抗体在有效条件下接触并持续足以允许形成免疫复合物(初级免疫复合物)的时间通常是简单地将抗体组合物添加至样品并将混合物孵育足够长的时间以使抗体与存在的念珠菌或抗原形成免疫复合物(即与之结合)的问题。在该时间之后,通常对样品-抗体组合物,例如组织切片、elisa板、斑点印迹或western印迹进行洗涤以去除任何非特异性结合的抗体种类,从而允许只有特异性结合在初级免疫复合物中的那些抗体被检测到。
[0356]
通常来说,免疫复合物形成的检测是本领域中公知的,并且可通过应用多种方法来实现。这些方法通常基于标记或标志物(例如那些放射性标签、荧光标签、生物标签和酶标签中的任一种)的检测。有关使用这样的标记的专利包括美国专利3,817,837、3,850,752、3,939,350、3,996,345、4,277,437、4,275,149和4,366,241。当然,如本领域中已知的,通过使用第二结合配体例如第二抗体和/或生物素/抗生物素蛋白配体结合布置,可发现另外的优点。
[0357]
用于检测的抗体可本身与可检测标记连接,其中然后将简单地检测该标记,从而允许确定组合物中初级免疫复合物的量。或者,可通过对第一抗体具有结合亲和力的第二结合配体来检测结合在初级免疫复合物中的该抗体。在这些情况下,第二结合配体可与可检测标记连接。第二结合配体本身通常是抗体,其因此可称为“第二”抗体。使初级免疫复合物与经标记的第二结合配体或抗体在有效条件下接触并持续足以允许形成次级免疫复合物的时间。然后,通常洗涤次级免疫复合物以去除任何非特异性结合的经标记的第二抗体或配体,并且随后检测次级免疫复合物中的剩余标记。
[0358]
另一些方法包括通过两步法检测初级免疫复合物。如上所述,将对抗体具有结合亲和力的第二结合配体(例如抗体)用于形成次级免疫复合物。在洗涤之后,再次使次级免疫复合物与对第二抗体具有结合亲和力的第三结合配体或抗体在有效条件下接触并持续足以允许形成免疫复合物(三级免疫复合物)的时间。第三配体或抗体与可检测标记连接,从而允许检测由此形成的三级免疫复合物。如果期望的话,该系统可提供信号放大。
[0359]
一种免疫检测方法使用两种不同的抗体。将第一生物素化抗体用于检测靶抗原,并且然后将第二抗体用于检测与复合生物素连接的生物素。在该方法中,首先将待测试样
品在包含第一步抗体的溶液中孵育。如果存在靶抗原,则一些抗体与抗原结合形成生物素化抗体/抗原复合物。然后通过在链霉抗生物素蛋白(或抗生物素蛋白)、生物素化dna和/或互补生物素化dna的连续溶液中孵育来扩大抗体/抗原复合物,其中每个步骤向抗体/抗原复合物添加另外的生物素位点。重复扩大步骤直至达到合适的扩大水平,此时将样品在包含针对生物素的第二步抗体的溶液中孵育。该第二步抗体是经标记的,如例如经酶标记的,所述酶可用于使用色原底物通过组织酶学来检测抗体/抗原复合物的存在。经过适当扩大,可产生宏观可见的缀合物。
[0360]
另一种已知的免疫检测方法利用免疫pcr(聚合酶链反应)方法。在与生物素化dna一起孵育之前,pcr方法类似于cantor方法,然而,作为使用多轮链霉抗生物素蛋白和生物素化dna孵育的替代,将dna/生物素/链霉抗生物素蛋白/抗体复合物用低ph或高盐缓冲液洗掉,这释放抗体。然后将所得洗涤溶液用于用合适的引物与合适的对照进行pcr反应。至少在理论上,pcr的巨大扩增能力和特异性可用于检测单抗原分子。
[0361]
a.elisa
[0362]
免疫测定在其最简单和直接的意义上是结合测定。某些优选的免疫测定是本领域中已知的多种类型的酶联免疫吸附测定(elisa)和放射免疫测定(ria)。使用组织切片的免疫组织化学检测也特别有用。然而,将容易理解的是,检测不限于此类技术,并且也可使用western印迹、斑点印迹、facs分析等。
[0363]
在一种示例性elisa中,将本公开内容的抗体固定在表现出蛋白质亲和力的所选表面上,例如聚苯乙烯微量滴定板中的孔上。随后,向孔添加怀疑包含念珠菌或念珠菌抗原的受试组合物。在结合并洗涤以去除非特异性结合的免疫复合物之后,可检测结合的抗原。检测可通过添加与可检测标记连接的另外的抗念珠菌抗体来实现。这种类型的elisa是简单的“夹心elisa”。检测也可通过添加第二抗念珠菌抗体,随后添加对该第二抗体具有结合亲和力的第三抗体来实现,其中该第三抗体与可检测标记连接。
[0364]
在另一种示例性elisa中,将怀疑包含念珠菌或念珠菌抗原的样品固定在孔表面上,并随后与本公开内容的抗念珠菌抗体接触。在结合并洗涤以去除非特异性结合的免疫复合物之后,检测结合的抗念珠菌抗体。当初始抗念珠菌抗体与可检测标记连接时,可直接检测免疫复合物。同样,可使用对第一抗念珠菌抗体具有结合亲和力的第二抗体来检测免疫复合物,其中第二抗体与可检测标记连接。
[0365]
不论使用何种形式,elisa都具有某些共同特征,例如包被、孵育和结合、洗涤以去除非特异性结合的物质以及检测结合的免疫复合物。以下对这些进行描述。
[0366]
在用抗原或抗体包被板中,通常用抗原或抗体的溶液孵育板的孔过夜或持续指定的一段时间。然后对板的孔进行洗涤以去除不完全吸附的物质。然后,将孔的任何剩余可用表面用相对于受试抗血清为抗原性中性的非特异性蛋白质“包被”。这些包括牛血清白蛋白(bsa)、酪蛋白或乳粉溶液。包被允许封闭固定表面上的非特异性吸附位点,并因此降低由抗血清在表面上的非特异性结合引起的背景。
[0367]
在elisa中,可能更习惯于使用二级或三级检测方法而不是直接操作。因此,在蛋白质或抗体与孔结合,用非反应性物质包被以降低背景,并洗涤以去除未结合的物质之后,使固定表面与待测试的生物样品在有效允许免疫复合物(抗原/抗体)形成的条件下接触。然后,免疫复合物的检测需要经标记的第二结合配体或抗体,以及与经标记的第三抗体或
第三结合配体联合的第二结合配体或抗体。
[0368]“在有效允许免疫复合物(抗原/抗体)形成的条件下”意指该条件优选包括用溶液(例如bsa、牛丙种球蛋白(bovine gamma globulin,bgg)或磷酸缓冲盐水(pbs)/吐温)来稀释抗原和/或抗体。这些添加的试剂还倾向于有助于降低非特异性背景。
[0369]“合适的”条件还意指孵育在足以允许有效结合的温度或时间下进行。孵育步骤通常在优选为约25℃至27℃的温度下进行约1至2至4小时左右,或者可在约4℃左右下过夜进行。
[0370]
在elisa中所有孵育步骤之后,洗涤接触的表面以去除未复合的物质。一个优选的洗涤过程包括用溶液例如pbs/吐温或硼酸盐缓冲液洗涤。在受试样品与最初结合物质之间形成特异性免疫复合物并随后进行洗涤之后,可确定甚至是微量的免疫复合物的出现。
[0371]
为了提供检测手段,第二或第三抗体具有缔合的标记以允许检测。优选地,这是在与合适的显色底物孵育之后产生显色的酶。因此,例如,期望在有利于发生进一步的免疫复合物形成的时间和条件下使初级和次级免疫复合物与脲酶、葡萄糖氧化酶、碱性磷酸酶或过氧化氢酶缀合的抗体接触或孵育(例如,在室温下在含有pbs的溶液(例如pbs-吐温)中孵育2小时)。
[0372]
在与经标记的抗体孵育并随后进行洗涤以去除未结合的物质之后,对标记的量进行定量,例如通过与显色底物(例如尿素或溴甲酚紫或2,2
’‑
联氮基-二-(3-乙基-苯并噻唑啉-6-磺酸(abts)或h2o2(在过氧化物酶作为酶标记的情况下))一起孵育进行。然后通过测量产生的颜色的程度,例如使用可见光谱分光光度计实现定量。
[0373]
在另一个实施方案中,本公开内容涉及使用竞争形式。这特别可用于在样品中检测念珠菌抗体。在基于竞争的测定中,未知量的分析物或抗体通过其置换已知量的经标记抗体或分析物的能力来确定。因此,信号的可量化损失指示样品中未知抗体或分析物的量。
[0374]
在此,本发明人提出使用经标记的念珠菌单克隆抗体以确定样品中念珠菌抗体的量。基本形式将包括使已知量的念珠菌单克隆抗体(与可检测标记连接)与念珠菌抗原或颗粒接触。念珠菌抗原或生物体优选附着于支持物。在经标记的单克隆抗体与支持物结合之后,添加样品并在以下条件下孵育:允许样品中任何未经标记的抗体与经标记的单克隆抗体竞争并因此替代经标记的单克隆抗体。通过测量丢失的标记或剩余的标记(并从结合的标记的初始量中将其减去),可确定有多少未经标记的抗体与支持物结合,并因此确定样品中存在多少抗体。
[0375]
b.western印迹
[0376]
western印迹(或者,蛋白质免疫印迹)是用于在给定的组织匀浆或提取物样品中检测特定蛋白质的分析技术。其使用凝胶电泳通过多肽的长度(变性条件)或通过蛋白质的3-d结构(天然/非变性条件)来分离天然或变性的蛋白质。然后将蛋白质转移到膜(通常是硝酸纤维素或pvdf)上,在膜上使用对靶蛋白具有特异性的抗体对其进行探测(检测)。
[0377]
样品可取自整个组织或来自细胞培养物。在大多数情况下,首先使用搅拌器(用于较大的样品体积)、使用均化器(较小的体积)或通过声处理将实体组织机械破碎。细胞也可通过上述机械方法之一破裂。然而,应注意的是,环境样品可以是蛋白质的来源,并因此western印迹不仅限于细胞研究。可使用多种洗涤剂、盐和缓冲液来促进细胞裂解和使蛋白质溶解。通常添加蛋白酶和磷酸酶抑制剂以防止样品被其自身的酶消化。组织制备通常在
低温下进行以避免蛋白质变性。
[0378]
使用凝胶电泳分离样品的蛋白质。蛋白质的分离可通过等电点(pi)、分子量、电荷或这些因素的组合来进行。分离的本质取决于样品的处理和凝胶的性质。这是确定蛋白质的非常有用的方法。也可使用二维(two-dimensional,2-d)凝胶,其将来自单个样品的蛋白质以两个维度散布。在第一维度中根据等电点(蛋白质具有中性净电荷时的ph)分离蛋白质,而在第二维度中根据其分子量分离蛋白质。
[0379]
为了使蛋白质易于进行抗体检测,将其从凝胶中移动到由硝酸纤维素或聚偏二氟乙烯(pvdf)制成的膜上。将膜放置在凝胶的顶部,并在其顶部放置一叠滤纸。将整叠放置在缓冲溶液中,该缓冲溶液通过毛细作用移动至纸上,从而使蛋白质随之移动。用于转移蛋白质的另一种方法称为电印迹,并且使用电流将蛋白质从凝胶拉到pvdf或硝酸纤维素膜中。蛋白质在维持其在凝胶中具有的组织的同时从凝胶中移动到膜上。作为该印迹过程的结果,蛋白质被暴露在薄的表面层上用于检测(参见下文)。选择这两种膜是因为其非特异性的蛋白质结合特性(即,同等良好地结合所有蛋白质)。蛋白质结合基于疏水性相互作用以及膜与蛋白质之间的带电相互作用。硝酸纤维素膜比pvdf便宜,但更加易脆而不能良好地经受反复探测。蛋白质从凝胶转移到膜上的均匀性和整体有效性可通过用考马斯亮蓝或丽春红s(ponceau s)染料对膜进行染色来检查。一旦转移,就使用经标记的初级抗体或未经标记的初级抗体并随后使用经标记蛋白a或与初级抗体的fc区结合的第二经标记抗体进行间接检测来检测蛋白质。
[0380]
c.侧流测定
[0381]
侧流测定,也称为侧流免疫色谱测定,是旨在检测样品(基质)中目标分析物的存在(或不存在)而无需专用且昂贵的设备的简单装置,尽管存在许多由阅读设备支持的基于实验室的应用。通常来说,这些测试用作低资源医学诊断,用于家庭测试,即时检测(point ofcare testing)或实验室使用。广泛传播且公知的应用是家庭妊娠测试。
[0382]
该技术基于一系列毛细管床,例如多孔纸片或烧结聚合物。这些元件中的每一个都具有自发运输流体(例如尿)的能力。第一元件(样品垫)充当海绵并容纳过量的样品流体。一旦浸泡,流体就迁移至制造商已在其中储存所谓缀合物的第二元件(缀合垫),所述缀合物是在盐-糖基质中干燥形式的生物活性颗粒(见下文),该基质包含确保靶分子(例如抗原)与其已固定在颗粒表面上的化学配偶体(例如抗体)之间的优化化学反应的所有物质。在样品流体溶解盐-糖基质的同时,它还溶解颗粒,并且在一种组合的运输作用下,样品和缀合物在流过多孔结构的同时混合。以这种方式,分析物在进一步迁移通过第三毛细管床的同时与颗粒结合。该材料具有一个或更多个区域(通常称为条带(stripe)),制造商已将第三分子固定在该区域上。当样品-缀合物混合物到达这些条带时,分析物已结合在颗粒上,并且第三“捕获”分子结合复合物。一段时间之后,当越来越多的流体已通过条带时,颗粒积聚并且条带区域变色。通常来说,至少有两个条带:一个(对照)捕获任何颗粒,并从而表明反应条件和技术运行良好,第二个包含特定的捕获分子并且仅捕获已将分析物分子固定在其上的那些颗粒。在通过这些反应区之后,流体进入最终的多孔材料,芯(wick),其仅充当废物容器。侧流测试可作为竞争性测定或夹心测定进行操作。侧流测定在美国专利6,485,982中公开。
[0383]
d.免疫组织化学
[0384]
本公开内容的抗体还可与新鲜冷冻和/或福尔马林固定石蜡包埋的组织块二者联合使用,所述组织块为了通过免疫组织化学(immunohistochemistry,ihc)进行研究而制备。由这些颗粒状样本制备组织块的方法已成功用于多种预后因子的先前ihc研究中,并且是本领域技术人员公知的(brown et al.,1990;abbondanzo et al.,1990;allred et al.,1990)。
[0385]
简言之,冷冻切片可通过以下来制备:在室温下在小塑料囊中的磷酸缓冲盐水(pbs)中将50ng冷冻的“粉碎”组织再水合;通过离心使颗粒沉淀;将其重悬在黏性包埋介质(oct)中;将囊倒置和/或通过离心再次沉淀;在-70℃异戊烷中速冻;切割塑料囊和/或取出冷冻的组织圆柱状物;将组织圆柱状物固定在低温恒温切片机卡盘上;和/或从囊上切下25至50个连续切片。或者,可将整个冷冻的组织样品用于连续切片切割。
[0386]
可通过类似的方法制备永久切片,其包括在塑料微量离心管中将50mg样品再水合;沉淀;重悬于10%福尔马林中固定4小时;洗涤/沉淀;重悬于温热的2.5%琼脂中;沉淀;在冰水中冷却以使琼脂硬化;从管中取出组织/琼脂块;将块浸入和/或包埋在石蜡中;和/或切割多至50个连续的永久切片。同样,整个组织样品可替换。
[0387]
e.免疫检测试剂盒
[0388]
在另一些实施方案中,本公开内容涉及与上述免疫检测方法一起使用的免疫检测试剂盒。由于抗体可用于检测念珠菌或念珠菌抗原,因此试剂盒中可包含抗体。免疫检测试剂盒因此在合适的容器装置中包含结合念珠菌或念珠菌抗原的第一抗体和任选地免疫检测试剂。
[0389]
在某些实施方案中,抗念珠菌抗体可与固体支持物,例如柱基质和/或微量滴定板的孔预先结合。试剂盒的免疫检测试剂可采取多种形式中的任一种,包括与给定抗体缔合或连接的那些可检测标记。也可使用与第二结合配体缔合或连接的可检测标记。一些示例性的第二配体是对第一抗体具有结合亲和力的那些第二抗体。
[0390]
用于本发明试剂盒的其他合适的免疫检测试剂包括双组分试剂,其包含对第一抗体具有结合亲和力的第二抗体,以及对第二抗体具有结合亲和力的第三抗体,所述第三抗体与可检测标记连接。如上所述,许多示例性的标记在本领域中是已知的,并且所有这样的标记均可结合本公开内容使用。
[0391]
试剂盒还可包含适当等分的念珠菌或念珠菌抗原的组合物,无论是标记的还是未标记的,如可用于制备用于检测测定的标准曲线那样。试剂盒可包含以完全缀合形式、以中间体形式或作为将由试剂盒使用者进行缀合的独立部分的抗体-标记缀合物。试剂盒的组分可包装在水性介质中或以冻干形式包装。
[0392]
试剂盒的容器装置通常包括至少一个小瓶、试管、烧瓶、瓶、注射器或其他容器装置,其中可放置抗体,或者优选将抗体适当地等分。本公开内容的试剂盒通常还包括用于封闭限制式容纳抗体、抗原和任何其他试剂容器以用于商业销售的装置。这样的容器可包括其中保持期望小瓶的注塑或吹塑的塑料容器。
[0393]
f.疫苗和抗原品质控制测定
[0394]
本公开内容还涉及如本文中所述的抗体和抗体片段用于评估样品中真菌抗原的抗原性完整性(例如,抗原显示出相关或天然抗原性或免疫原性结构的能力)的用途。生物药物产品如疫苗与化学药物的不同之处在于其通常不能在分子上进行表征;抗体是具有显
著复杂性的大分子并且具有制备间(preparation to preparation)广泛变化的能力。其也施用于健康个体,包括刚出生的儿童,并因此必须高度重视其品质,以确保其在预防或治疗危及生命的疾病方面是有效的,而且其本身不引起伤害。
[0395]
疫苗生产和分配的日益全球化为更好地管理公共健康问题打开了新的可能性,但也提出了关于通过多种来源采购的疫苗的等效性和可互换性的问题。因此,起始材料、生产和品质控制测试的国际标准化,以及对这些产品的制备和使用方式的管理监督设置高期望,已经是持续成功的基石。但这仍然是不断变化的领域,并且该领域中的持续技术进步为开发强效的针对旧公共健康威胁以及新的威胁(疟疾、大流行性流感和hiv,仅举几例)的新武器提供了前景,但也给制造商、监管机构和更广泛的医学界施加了巨大压力以确保产品继续达到可实现的最高品质标准。
[0396]
因此,可从任何来源或在制备过程期间的任何点获得抗原或疫苗。因此,品质控制过程可从制备用于鉴定本文中公开的抗体或片段与真菌抗原的结合的免疫测定的样品开始。这样的免疫测定在本文件的其他地方公开,并且这些中的任一种均可用于评估抗原的结构/抗原性完整性。用于发现样品包含可接受量的抗原性的正确和完整抗原的标准可由监管机构来确立。
[0397]
其中评估抗原完整性的另一个重要实施方案是确定保质期和储存稳定性。大多数药物包括疫苗可随时间而变质。因此,至关重要的是确定抗原(例如疫苗中的抗原)随时间降解或不稳定的程度,使得当施用于对象时其不再具有抗原性和/或产生免疫应答的能力。再次,用于发现样品包含可接受量的抗原性的完整抗原的标准可由监管机构来确立。
[0398]
在某些实施方案中,真菌抗原可包含多于一种的保护性表位。在这些情况下,使用观察多于一种抗体(例如2、3、4、5或甚至更多种抗体)结合的测定可证实是可用的。这些抗体与密切相关的表位结合,使得其彼此相邻甚至重叠。另一方面,其可代表来自抗原不同部分的不同表位。通过检查多种表位的完整性,可确定抗原的整体完整性的更完整图片,并因此确定产生保护性免疫应答的能力。
[0399]
如本公开内容中所述的抗体及其片段也可在用于通过检测保护性念珠菌抗体的存在来监测疫苗接种程序的效力的试剂盒中使用。如本公开内容中所述的抗体、抗体片段、或其变体和衍生物也可在用于监测具有期望免疫原性的疫苗制备的试剂盒中使用。
[0400]
vi.实施例
[0401]
包括以下实施例以表明一些优选实施方案。本领域技术人员应理解,以下实施例中公开的技术代表了本发明人发现在实施方案的实施中良好发挥作用的技术,并因此可被认为构成了用于其实践的优选模式。然而,本领域技术人员应理解,根据本发明,可对公开的具体实施方案进行许多改变并且仍然获得相同或类似的结果,而不脱离本公开内容的精神和范围。
[0402]
实施例1-针对人血清样品中fba和met6肽的抗体的存在和人单克隆抗体的分子克隆
[0403]
材料和方法
[0404]
elisa筛选。将96孔测定板的孔用fba(seq id no:40)或met6(seq id no:38)肽在室温下包被90分钟。将肽在ph 9.6的100mm碳酸氢na中稀释至1μg/ml。然后将板洗涤并用包含0.5%tween 20
tm
、4%乳清蛋白和10%胎牛血清的pbs(磷酸缓冲盐水,ph 7.4)(封闭缓冲
液)封闭30分钟。将血清热灭活并在封闭缓冲液中稀释,并以1∶100稀释度进行测试。将100μl每种血清样品在室温下在用肽包被或未用肽包被的孔中孵育90分钟。mab 1.11d(抗-fba;seq id no:10和seq id no:11)和1.10c(抗-met6;seq id no:12和seq id no:13)用作阳性对照。将孔用pbs加0.5%tween 20
tm
进行洗涤,并用hrp缀合的山羊抗人igg(jackson immunoresearch)的封闭缓冲液中的1∶2000稀释液孵育60分钟。将孔用pbs加0.5%tween 20
tm
进行洗涤,并用tmb(3,3’,5,5
’‑
四甲基联苯胺)-h2o2显色。用1m磷酸终止反应,并将颜色读出为450nm处的吸光度。
[0405]
人mab的记忆b细胞刺激和分子克隆。通过耗尽cd2 、cd14 和cd16 非b细胞中的pbmc并随后使用免疫磁珠正选择cd27 b细胞来纯化记忆b细胞(robinson et al.,2016)。将记忆b细胞在包含ms40l饲养细胞、iscoves改良dulbecco培养基、10%fcs、cpg、il-2和il-21的多孔板的孔中培养。ms40l来源于鼠基质细胞系ms5,并且已被改造以表达人cd40l(luo et al.,2009)。ms40l细胞支持稳健的记忆b细胞生长。将b细胞以低细胞密度接种,以在每个孔中实现b细胞的近克隆刺激。在2周时,通过elisa筛选培养液中与念珠菌肽反应的igg抗体。收获抗体阳性孔中的细胞并储存在胍裂解缓冲液(ambion rnaqueous分离试剂盒)中。接下来,将从b细胞中纯化的rna逆转录以制备cdna(tiller et al.,2008)。然后进行嵌套pcr以扩增重链和轻链的可变区,随后将其插入到重链和轻链表达载体中,如(robinson et al.,2016)所述。然后将匹配的重链和轻链载体对转染到293t细胞中。在48小时之后测试培养物上清液的肽结合抗体。使用来自同一b细胞培养物的重基因和轻基因的多种克隆进行交叉转染,以确保产物是克隆的vh和vl基因。一旦确定了制备mab的明确的hc和lc质粒对,就对hc和lc基因进行测序,并使用293t细胞的瞬时转染培养物中的小规模抗体产生以产生纯化的mab,以允许在体外进一步表征mab(costin et al,2013;robinson et al.,2016)。
[0406]
结果和讨论
[0407]
测试了十个人血清样品中是否存在与fba(seq id no:40)或met6(seq id no:38)肽结合的抗体。如图1中所示,数个样品对针对fba肽(seq id no:40)的抗体的存在呈阳性,同时发现数个样品对针对两种肽的抗体呈阳性,这表明抗肽抗体识别存在于人中的fba肽(seq id no:40)或met6肽(seq id no:38)。
[0408]
实施例2-通过竞争elisa表明人单克隆抗体与fba和met6肽的特异性结合
[0409]
材料和方法
[0410]
抗体产生和纯化。将表达1.10c(抗met6;seq id no:12和seq id no:13)或1.11d(抗fba;seq id no:10和seq id no:11)的重链和轻链的匹配的质粒对(或双表达质粒)瞬时转染到freestyle
tm 293细胞中,并将该细胞在freestyle
tm
培养基中在30℃下、8%co2中根据制造商说明(thermo fisher scientific)进行孵育。使用blitz干涉仪(fortebio)上的抗人生物层干涉仪尖端(fortebio)监测免疫球蛋白产生。当抗体产生达到平稳时,通过在6,000g下离心10分钟收获细胞上清液,并随后过滤除菌。通过fast flow protein g(ge lifesciences)亲和色谱来纯化igg。使用蠕动泵将清洁的上清液施加至1ml fast flow protein g琼脂糖柱上,并通过柱循环2至3次。然后用10体积的pbs洗涤柱,并用ph 2.0的0.1m甘氨酸缓冲液从柱中洗脱结合的igg。通过添加1/10体积的ph 8.0的1m tris缓冲液来中和洗脱的级分。然后使用离心超滤器(30至50,000mwco;amicon)将洗脱的蛋白质浓缩至
约1mg/ml的蛋白质浓度,针对pbs进行透析,过滤除菌并储存于4℃。
[0411]
elisa。简言之,将fba(seq id no:40)或met6肽(seq id no:38)溶解在包被缓冲液(4μg/ml)中,并且将该溶液用于包被96孔elisa板(100μl,室温下持续1小时并在4℃下过夜)。将孔用pbs洗涤两次并用200μl的1%牛血清白蛋白/pbs封闭。将抗体1.10c(抗met6;seq id no:12和seq id no:13)或1.11d(抗fba;seq id no:10和seq id no:11)与以200μg/ml至3.125μg/ml的浓度溶解在pbs加1%bsa中的同源肽fba(seq id no:40)或met6(seq id no:38)肽(抑制剂)混合。将所得的每种浓度的溶液以一式三份添加至经fba包被或经met6包被的微量滴定孔中,并在37℃下孵育2小时。将孔用pbs加0.5%tween20
tm
洗涤三次,用pbs洗涤一次,并且添加小鼠抗人igg hrp(sigma,a5420)(在pbs加0.5%tween 20
tm
中以1∶3,000稀释)100μl并在37℃下孵育1小时。将孔用pbst洗涤三次,随后添加100μl的底物溶液(ph5.0的25ml的0.05m磷酸-柠檬酸缓冲液、200μl的50mg/ml的邻苯二胺(sigma)的水溶液和10μl的30%h2o2)。允许显色10至20分钟,通过添加100μl的2m h2so4停止并在492nm处读数(微量滴定板读数器,450型;bio-rad,richmond,calif.)。相对于包含无抑制剂的抗体的孔计算抑制百分比。
[0412]
结果和讨论
[0413]
如图2和图3二者所示,添加的游离肽与结合的肽竞争结合1.10c(抗met6;seq id no:12和seq id no:13)和1.11d(抗fba;seq id no:10和seq id no:11)。这些结果表明抗体与其同源肽的结合是特异性的。
[0414]
实施例3-通过生物层干涉术(bli)确定1.10c和1.11d与其同源肽的结合亲和力
[0415]
材料和方法
[0416]
生物层干涉术。在25℃下在octet htx上进行结合实验。将链霉亲和素(sa)生物传感器在测定缓冲液(有0.1%bsa、0.02%tween-20的pbs(ph 7.4))中水合,并且将测定缓冲液中0.01μg/ml的生物素化肽(fba-生物素,seq id 41;met6-生物素,seq id 39)加载到链霉亲和素(sa)生物传感器上。将加载的传感器浸入同源igg(如上在实施例2中纯化的;300nm起始,1∶3稀释,7个点)的系列稀释液中15分钟,使得结合达到平衡。使用一价(1∶1)结合模型计算动力学常数。还使用稳定-稳定分析(steady-steady analyse)使用以下模型方程来估计抗体与同源肽结合的亲和力:
[0417]
req=rmax*c/(c kd)
[0418]
其中req是缔合期间890至895秒的平均应答水平,rmax是预测的最大应答水平,kd是亲和力,并且c是抗体浓度。
[0419]
结果和讨论
[0420]
动力学测量显示(图4)人抗体1.11d(抗fba;seq id no:10和seq id no:11)与fba肽(fba-生物素,seq id no:41)结合的kd为约5.8
×
10-8
,而人抗体1.10c(抗met6;seq id no:12和seq id no:13)与met6肽(met6-生物素,seq id no:39)结合的kd为约1.8
×
10-7
。稳态测量(图5)显示1.11d(抗fba;seq id no:10和11)与fba肽(fba-生物素,seq id no:41)结合的kd为约7.7
×
10-8
,并且1.10c(抗met6;seq id no:12和seq id no:13)与met6肽(met6-生物素,seq id no:39)结合的kd为约3.1
×
10-7
。
[0421]
实施例4-通过生物层干涉术表明1.10c和1.11d与全长重组蛋白met6和fba的结合
[0422]
材料和方法
[0423]
白色念珠菌和耳念珠菌全长重组fba和met6的产生。如(lietal.,2013)所述,产生了fba的cdna,并使用载体prset a(invitrogen)进行克隆。该诱导型表达载体产生了具有六-组氨酸(6-his)氨基末端标签的重组部分。将所得表达载体转化到特别设计的用于表达经6-his标记的重组蛋白的大肠杆菌菌株nico21(de3)蛋白质产生菌株(new england biolabs)中。化学合成(genscript)来自白色念珠菌的met6基因序列(ncbi参考序列:xm_713126.2)并将其亚克隆到prset a中。
[0424]
包含全长重组fba或met6的细菌上清液的产生。在用prset a met6或prset a fba转化的nico21(de3)细胞的sob(在h2o2中的2%w/v胰蛋白胨、0.5%w/v酵母提取物、10mm nacl、2.5mm kcl、10mm mgcl2、10mm mgso4)中制备的过夜培养物,在37℃下在以250rpm摇动的情况下培养的sob,在37℃下在以250rpm摇动的情况下稀释至0.1的o.d.。当培养物达到0.4至0.6的o.d.时,将异丙基β-d-1-硫代半乳糖苷(iptg)添加至100μm,并将培养物孵育另外的12小时。然后通过在6,000x g下离心100分钟来收获细菌细胞。通过抽吸弃去培养上清液,并且将细胞沉淀重悬在celllytic b
tm
(sigma)(1ml/25ml初始细菌培养物)中。将提取的悬液在室温下在温和混合下孵育15分钟。在提取之后,将悬液在16,000x g下离心10分钟以沉淀不溶性物质。小心地移出上清液,等分试样并在-20℃下冷冻直至使用。
[0425]
fba bli分析。使用fort
è
bio blitz仪器(软件:blitz pro 1.2)完成纯化的人单克隆抗体(humab)与全长白色念珠菌和耳念珠菌fba蛋白的可检测结合。在开始之前,在动力学缓冲液(pbs 0.1%bsa 0.02%tween20)中水合抗五-his传感器(hisk传感器;fort
è
bio)。在动力学缓冲液中进行基线步骤之后,使用用动力学缓冲液1∶1稀释的粗细菌表达上清液将全长经his标记的fba蛋白(白色念珠菌或耳念珠菌)加载到传感器尖端。使用动力学缓冲液进行第二基线步骤。然后在将加载的尖端浸入到包含pbs w/动力学缓冲液(浓度=100ug/ml)中纯化的humab 1.11d(如上在实施例2中制备的;抗fba;seq id no:10和seq id no:11)的溶液中的情况下进行缔合步骤;信号的正提高指示抗体结合。最后,将尖端转移回到动力学缓冲液用于解离步骤。运行阴性对照,省略his-fba加载步骤(仅使用未经转化的细菌上清液),以显示humab 1.11d(抗fba;seq id no:10和seq id no:11)不是简单识别hisk传感器,并且加载到尖端上的物质不是来自细菌上清液。另外,将相同浓度(100μg/ml)的humab 1.10c(抗met6;seq id no:12和seq id no:13)用作缔合步骤中的阴性对照,以显示1.11d抗体与经fba加载的尖端特异性结合。
[0426]
met6 bli分析。使用fort
è
bio blitz仪器(软件:blitz pro 1.2)完成纯化的人单克隆抗体(humab)与全长白色念珠菌met6蛋白(ncbi参考序列:xm_713126.2)的可检测结合。在开始之前,在动力学缓冲液[pbs 0.1%bsa 0.02%tween20]中水合抗五-his传感器(hisk传感器;fort
è
bio)。在动力学缓冲液中进行基线步骤之后,使用用动力学缓冲液1∶1稀释的粗细菌表达上清液将全长经his标记的met6蛋白(白色念珠菌)加载到传感器尖端。使用动力学缓冲液进行第二基线步骤。然后在将加载的尖端浸入到包含dpbs w/动力学缓冲液(浓度=100ug/ml)中纯化的humab 1.10c(抗met6;seq id no:12和seq id no:13)的溶液中的情况下进行缔合步骤;信号的正增长指示抗体结合。最后,将尖端转移回到动力学缓冲液用于解离步骤。运行阴性对照,在加载步骤中省略his-met6(仅使用未经转化的细菌上清液),以显示humab 1.10c(抗met6;seq id no:12和seq id no:13)不是简单识别hisk传感器,并且加载到尖端上的物质不是来自细菌上清液。另外,将相同浓度(100μg/ml)的
humab 1.11d(抗fba;seq id no:10和seq id no:11)用作缔合步骤中的阴性对照,以显示1.10c抗体对经met6加载的尖端的特异性。
[0427]
结果和讨论
[0428]
结果显示人抗体1.10c(抗met6;seq id no:12和seq id no:13)和1.11d(抗fba;seq id no:10和seq id no:11)分别与来自白色念珠菌的天然重组met6和fba蛋白特异性结合(图6顶部和图7),并且1.11d(抗fba;seq id no:10和seq id no:11)也与来自耳念珠菌的重组fba结合(图7),尽管与白色念珠菌肽相比,耳念珠菌肽的同源性降低(表6)。此外,结果表明fba(fba,seq id no:40).和met6(met6,seq id no:38)肽表位可接近天然蛋白质中结合的抗体。
[0429]
实施例5-人单克隆抗体在播散性念珠菌病的小鼠致死模型中的效力评估。
[0430]
材料和方法
[0431]
念珠菌菌株。将白色念珠菌sc5314(atcc)和具有唑类抗性(erg11 y132f)的南美菌株耳念珠菌ar-0386(cdc)在37℃下在葡萄糖-酵母提取物-蛋白胨肉汤中作为稳定期酵母细胞进行培养,洗涤并悬浮在dulbecco’s pbs(dpbs;sigma)中至合适的细胞浓度(白色念珠菌,5
×
106/ml;耳念珠菌,1
×
109/ml),并且用于静脉内(i.v.)感染小鼠,如(han和cutler,1995;han et al.,2000)所述。
[0432]
小鼠品系。使用近交小鼠品系c57bl/6或a/j(nci动物生产计划(animal production program)或harlan)(雌性;5至7周龄)。根据新奥尔良路易斯安那州健康科学中心(louisiana health sciences center in new orleans)的机构动物护理和使用委员会(institutional animal care&use committee,iacuc)规定批准的方案对小鼠进行维护和处理。
[0433]
真菌攻击和保护评估。在这些研究中使用了六至八周龄的c57bl/6小鼠或a/j。将三只小鼠的组一起饲养在无菌笼中,并随意(ad libitum)提供无菌食物和水。在第0天,通过单次注射多至0.5ml的纯化的单克隆抗体(如上在实施例2中制备)来对小鼠组(每种抗体一组)进行i.p.注射,在4小时之后,用白色念珠菌3153a细胞(0.1ml dpbs中5
×
105cfu)或耳念珠菌(0.1ml dpbs中1
×
108cfu)进行i.v.攻击。通过持续35天(白色念珠菌)或40天(耳念珠菌)监测动物存活来评价保护。监测小鼠濒死状态的发生,其被限定为无精打采、对食物或水失去兴趣、以及对指探查无反应。当小鼠被认为是濒死的时候,则将其处死。对于比较,一组接受dpbs,而另一组接受抗真菌药物氟康唑
tm
。评估存活并与对照进行比较。
[0434]
结果和讨论
[0435]
结果表明,在c57b/l6小鼠播散性念珠菌病模型中,抗肽抗体1.10c和1.11d保护小鼠免受白色念珠菌引起的死亡(图8),并且与标准的护理抗真菌氟康唑
tm
相比,单剂量1.10c提供了更好的保护。另外,1.11d显示出明显的剂量响应(图8),并且包含两种抗体的混合物提供了完全保护。在耳念珠菌在a/j中性粒细胞减少小鼠播散性念珠菌病模型中的情况下,仅使用单独抗体观察到有限的保护,而包含两种抗体的混合物增强了对小鼠的保护(图9)。
[0436]
实施例6-针对met6的互补位映射
[0437]
根据由kelley et al.,nature protocols 10,845-858(2015)的用于蛋白质建模、预测和分析的phyre2门户网站针对met6抗体2b10进行蛋白质建模(图10至11)。
[0438]
2b10vh(可变区重链)氨基酸序列:
[0439][0440]
对于2b10vh的3d模型(图10),可在以下链接中检索信息:
[0441]
https://nam01.safelinks.protection.outlook.com/?url=http%3a%2f%2fwww.sbg.bio.ic.ac.uk%2
[0442]
fphyre2%2fphyre2_output%2fcb0eb006b7305071%2fsummary.html&data=02%7c01%7
[0443]
chxin%401suhsc.edu%7cda1cb96339c5434eb12408d70af98ac5%7c3406368982d44e89a3281a
[0444]
b79cc58d9d%7c0%7c0%7c636989939222115355&sdata=zgx4t30tgm1icnbanwwbt
[0445]
pktqjkwifldjiheyfrkjeo%3d&reserved=0
[0446]
2b10vl(可变区轻链)氨基酸序列:
[0447][0448]
对于2b10vl的3d模型(图11),可在以下链接中检索信息:
[0449]
https://nam01.safelinks.protection.outlook.com/?url=http%3a%2f%2fwww.sbg.bio.ic.ac.uk%2
[0450]
fphyre2%2fphyre2_output%2fd7ca058a43f777c0%2fsummary.html&data=02%7c01%7
[0451]
chxin%401suhsc.edu%7c9925559d95ac4b6cc5e008d70b04fb3b%7c3406368982d44e89a3281a
[0452]
b79cc58d9d%7c0%7c0%7c636989988376463149&sdata=q%2fbdj3r%2fy2znuqy0ru2
[0453]
d1hwkqrkdbweais9vpczvpa0%3d&reserved=0
[0454]
paratome-抗原结合区鉴定(abr)
[0455]
对met6肽具有特异性的小鼠mab 2b10c1,人版本的2b1011c为1.10c。2b1011c v序列:
[0456]
重链:dna序列(405bp)(前导序列-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4):
[0457][0458]
重链:氨基酸序列(135aa)(前导序列-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4):
[0459][0460]
轻链:dna序列(393bp)(前导序列-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4):
[0461][0462]
轻链:氨基酸序列(131aa)(前导序列-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4):
[0463][0464]
paratome_1_2b10vh(重链)
[0465][0466]
abr2:wigridpydsethy(seq id no:65的第66至79位)
[0467]
abr3:artaasfdy(seq id no:65的第115至123位)
[0468]
图例:重链:abr1 abr2 abr3
[0469]
paratome_1_2b10vl(轻链)
[0470]
[0471]
abr1:dvvmtqtplslpvslgdqasiscrssqslvhsngnsylh(seq id no:62的第20至58位)
[0472]
abr2:klliykvsnrfs(seq id no:62的第69至80位)
[0473]
abr3:sqsthvpf(seq id no:62的第113至120位)
[0474]
图例:轻链:abr1 abr2 abr3
[0475]
实施例7-针对fba的互补位映射
[0476]
根据由kelley et al.,nature protocols 10,845-858(2015)的用于蛋白质建模、预测和分析的phyre2门户网站针对fba抗体2b 10进行蛋白质建模(图12至13)。
[0477]
2d5vh(可变区重链)氨基酸序列:
[0478][0479]
对于2d5vh的3d模型(图12),可在以下链接中检索信息:
[0480]
https://nam01.safelinks.protecti on.outlook.com/?url=http%3a%2f%2fwww.sbg.bio.ic.ac.uk%2
[0481]
fphyre2%2fphyre2_output%2f51d51f35dfcbf7d6%2fsummary.html&data=02%7c01%7
[0482]
chxin%401subsc.edu%7c88757e5de4324dd8eb8308d70b8ad368%7c3406368982d44e89a3281
[0483]
ab79cc58d9d%7c0%7c0%7c636990563218376621&sdata=yj%2fij5ku6ka7ryqvfiia
[0484]
%2fxvlmg8hksggssrwsxbtvvw%3d&reserved=0
[0485]
2d5vl(可变区轻链)氨基酸序列:
[0486][0487]
对于2d5vl的3d模型(图13),可在以下链接中检索信息:
[0488]
https://nam01.safelinks.protection.outlook.com/?url=http%3a%2f%2fwww.sbg.bio.ic ac.uk%2
[0489]
fphyre2%2fphyre2_output%2f2c8a7c40d54a69f5%2fsummary.html&data=02%7c01%7
[0490]
chxin%401suhsc.edu%7c2b496735c49c4acf569b08d70b8b7f17%7c3406368982d44e89a3281a
[0491]
b79cc58d9d%7c0%7c0%7c636990566093014306&sdata=%2b%2b%2fbvcyegv35a2
[0492]
urqvt7tdr%2bbvlehbi9oflyvzzwquy%3d&reserved=0
[0493]
paratome-抗原结合区鉴定(abr)
[0494]
对fba肽具有特异性的小鼠mab 2d5f7,人版本的2d5f7为1.11d
[0495]
重链:dna序列(420bp)(前导序列-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4):
[0496][0497]
重链:氨基酸序列(140aa)(前导序列-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4):
[0498][0499]
轻链:dna序列(396bp)(前导序列-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4):
[0500][0501]
轻链:氨基酸序列(132aa)(前导序列-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4):
[0502][0503]
paratome_1_2d5_vh(重链)
[0504][0505]
abr2:wigyinpssgytdy(seq id no:72的第66至79位)
[0506]
abr3:rlydnydyyamdy(seq id no:72的第116至128位)
[0507]
图例:重链:abr1 abr2 abr3
[0508]
paratome_1_2d5vl(轻链)
[0509][0510]
abr1:gdivmsqspsslavsagekvtmsckssqsllnsrirknyla(20至60)
[0511]
abr2:lliywastres(seq id no:71的第72至82位)
[0512]
abr3:kqsynll(seq id no:71的第115至121位)
[0513]
图例:轻链:abr1 abr2 abr3
[0514]
实施例8-抗体结合动力学
[0515]
使用fort
è
bio blitz双层干涉仪在25℃下进行结合实验。将链霉亲和素(sa)生物传感器在测定缓冲液(有0.1%bsa、0.02%tween-20的pbs(ph 7.4))中水合,并且将测定缓冲液中0.01μg/ml的生物素化肽(fba-生物素或met6-生物素)加载到链霉亲和素(sa)生物传感器上。将加载的传感器浸入同源igg的系列稀释液中。
[0516]
对于抗体产生,将表达1.10c(抗met6)或1.11d(抗fba)的重链和轻链的匹配的质粒对瞬时转染到freestyle
tm 293细胞中,并通过fast flow protein g(ge life sciences)亲和色谱来纯化分泌的igg。
[0517]
使用fort
è
bio blitz双层干涉仪在25℃下进行结合实验。将链霉亲和素(sa)生物传感器在测定缓冲液(有0.1%bsa、0.02%tween-20的pbs(ph 7.4))中水合,并且将测定缓冲液中0.01μg/ml的生物素化肽(fba-生物素或met6-生物素)加载到链霉亲和素(sa)生物传感器上。将加载的传感器浸入同源igg的系列稀释液中。
[0518]
对于抗体产生,将表达人抗met6或抗fba抗体的重链和轻链的匹配的质粒对瞬时转染到293细胞中,并通过fast flow protein g(ge life sciences)亲和色谱来纯化分泌的igg。表8中示出的结果表明,抗体与其同源肽结合的结合亲和力(kd)为1
×
107或更高。
[0519]
表1-抗体可变区的核苷酸序列
[0520]
[0521]
[0522][0523]
表2-抗体可变区的蛋白质序列
[0524]
[0525][0526][0527]
[0528][0529][0530]
[0531][0532]
*****************
[0533]
根据本发明,不需要过度实验就可进行和实施本文中公开和要求保护的所有组合物和方法。尽管已经按照一些优选实施方案描述了本公开内容的组合物和方法,然而对于本领域技术人员显而易见的是,可对本文中所述组合物和方法以及方法的步骤或步骤的顺序进行改变,而不脱离本公开内容的概念、精神和范围。更具体地,显而易见的是,可用某些
在化学和生理学两个方面均相关的试剂替代本文中所述的试剂,同时实现相同或类似的结果。对于本领域技术人员显而易见的所有这些类似替代和修改被认为在由所附权利要求书示出的本公开内容的精神、范围和概念内。
[0534]
vii.参考文献
[0535]
以下参考文献就其提供补充本文中所阐述的那些操作或细节的示例性操作或其他细节而言特别地通过引用并入本文。
[0536]
美国专利3,817,837
[0537]
美国专利3,850,752
[0538]
美国专利3,939,350
[0539]
美国专利3,996,345
[0540]
美国专利4,196,265
[0541]
美国专利4,275,149
[0542]
美国专利4,277,437
[0543]
美国专利4,366,241
[0544]
美国专利4,472,509
[0545]
美国专利4,554,101
[0546]
美国专利4,680,338
[0547]
美国专利4,816,567
[0548]
美国专利4,867,973
[0549]
美国专利4,938,948
[0550]
美国专利5,021,236
[0551]
美国专利5,141,648
[0552]
美国专利5,196,066
[0553]
美国专利5,563,250
[0554]
美国专利5,565,332
[0555]
美国专利5,856,456
[0556]
美国专利5,880,270
[0557]
美国专利6,485,982
[0558]“antibodies:a laboratory manual,”cold spring harbor press,cold spring harbor,ny,1988.
[0559]
abbondanzo et al.,am.j.pediatr.hematol.oncol.,12(4),480-489,1990.
[0560]
allred et al.,arch.surg.,125(1),107-113,1990.
[0561]
atherton et al.,biol.of reproduction,32,155-171,1985.
[0562]
barzon et al.,euro surveill.2016 aug 11;21(32).
[0563]
beltramello et al.,cell host microbe 8,271-283,2010.
[0564]
brown et al.,j.immunol.meth.,12;130(1),:111-121,1990.
[0565]
campbell,in:monoclonal antibody technology,laboratory techniques in biochemistry and molecular biology,vol.13,burden and von knippenberg,eds.pp.75-83,amsterdam,elsevier,1984.
[0566]
capaldi et al.,biochem.biophys.res.comm.,74(2):425-433,1977.
[0567]
casadevall et al.,cur.opin.micro.5:386-391,2002.
[0568]
chowdry et al.,emerg.infect.dis.,19:1670-1673,2002
[0569]
costin et al.,j.vorol.71.5069-5079,2013.
[0570]
de jager et al.,semin.nucl.med.23(2),165-179,1993.
[0571]
dholakia et al.,j.biol.chem.,264,20638-20642,1989.
[0572]
diamond et al.,j virol 77,2578-2586,2003.
[0573]
doolittle and ben-zeev,methods mol.biol.,109,:215-237,1999.
[0574]
duffy et al.,n.engl.j.med.360,2536-2543,2009.
[0575]
elder et al.infections,infertility and assisted reproduction.part ii:infections in reproductive medicine&part iii:infections and the assisted reproductive laboratory.cambridge uk:cambridge university press;2005.
[0576]
gancedo et al,micro.mol.bio.rev.80:765-777,2016.
[0577]
gefter et al.,somatic cell genet.,3:231-236,1977.
[0578]
gornet et al.,semin reprod med.2016 sep;34(5):285-292.epub 2016 sep 14.
[0579]
gulbis and galand,hum.pathol.24(12),1271-1285,1993.
[0580]
halfon et al.,plos one 2010;5(5)e 10569
[0581]
han and cutler,infet.immun.63:2714-2719,1995
[0582]
han et al.,onfet.immun.68:1649-1654,2000.
[0583]
henderson and martin,lnfect.immun,79:3476-3491,2011.
[0584]
hessell et al.,nature 449,101-4,2007.
[0585]
karwa and wargo,ann.pharmacother.,43:1818-1823,2009
[0586]
khatoon et al.,ann.of neurology,26,210-219,1989.
[0587]
kim and sudbery,j.microbiol.,49:171-177,2011
[0588]
king et al.,j.biol.chem.,269,10210-10218,1989.
[0589]
kohler and milstein,eur.j.immunol.,6,511-519,1976.
[0590]
kohler and milstein,nature,256,495-497,1975.
[0591]
kyte and doolittle,j.mol.biol.,157(1):105-132,1982.
[0592]
li et al.,bmc infect.diseas.,13(i):253-261,2013.
[0593]
low and rotstein,f1000 medicine reports,3(14),2011.
[0594]
luo et al.,blood,113:1422-1431,2009
[0595]
luo,et al.,j.immunol.185:2164-2173,2010.
[0596]
mansuy et al.,lancet infect dis.2016 oct;16(10):1106-7.
[0597]
medrano-diaz,et al.,microbiol.pathogen.,124:21-29,2018.
[0598]
nakamura et al.,in:enzyme immunoassays:heterogeneous and homogeneous systems,chapter 27,1987.
[0599]o′
shannessy et al.,j.immun.meth.,99,153-161,1987.
[0600]
persic et al.,gene 187:1,1997.
[0601]
potter and haley,meth.enzymol.,91,613-633,1983.
[0602]
purpura et al.,lancet infect dis.2016 oct;16(10):1107-8.epub 2016 sep 19.
[0603]
remington`s pharmaceutical sciences,15th ed.,3:624-652,1990.
[0604]
richie et al.,antimirob.agents chemo.,56:3963-3964,2012.
[0605]
robinson et al.,nat.commun.7:11544,2016 may 10.
[0606]
rudkin et al.,nat.commun.9:5288,2018.
[0607]
tang et al..j.biol.chem.,271:28324-28330,1996.
[0608]
tiller et al.,immunol.methods 329:112-124,2008
[0609]
turner and butler,cold spring harb.perspeet.med.,4(9),2014.
[0610]
wawrzynczak&thorpe,in:immunoconjugates,antibody conuugates in radioimaging and therapy of cancer,vogel(ed.),ny,oxford university press,28,1987.
[0611]
xin et al.,proc.natl.acad.sci.usa.105:13526-1353,2008.
[0612]
yu et al.,j immunol methods 336,142-151,doi:10.1016/j.jim.2008.04.008,2008.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。