1.本发明属于医用止血材料领域,涉及一种基于阳离子化多糖的复合止血材料的制备方法。
背景技术:
2.过度失血是造成个体伤亡的重要原因。据不完全统计,除疾病死亡外,80%以上的非自然死亡都与过度失血有关。能够快速实现止血/凝血的材料对于挽救个体生命至关重要。目前,临床上应用的止血材料主要有医用纱布、缝合线和止血绵等,然而这些止血材料往往会存在止血效率低、止血速度慢、应用场景有限、难以满足凝血功能障碍个体等缺点。凝血功能障碍主要是指凝血因子缺乏或功能异常所致的出血性疾病,其中最为常见的就是血友病,血友病属于罕见病中的“大病种”,其危害大、诊断率低,由于其反复出血和难治性并发症会导致患者致残率高,且往往伴随患者终身。目前,应对凝血功能障碍的治疗方法为输注外源性凝血因子制剂。然而,该方法成本高、使用范围小且存在一定的生物安全风险。因此,开发出安全高效、适用范围广、可应对凝血功能障碍的止血材料具有重要意义。基于上述背景,本发明通过对不带电多糖进行阳离子化赋予其正电性,然后将其在高浓度范围内与多酚复合制备阳离子化多糖/多酚复合物,最后将复合物与亲水性多甲基聚合物混合共同制备出具有“强制凝胶化”促凝作用、可应对凝血功能障碍的多类型止血材料,这一技术国内未见报道。
技术实现要素:
3.有鉴于此,本发明提供一种阳离子化多糖多酚复合止血材料的制备方法。
4.本发明具体提供了如下的技术方案:一种基于阳离子化多糖的复合止血材料的制备方法,步骤为:
5.1)用氨基醚化剂对不带电多糖进行接枝改性,得到具有一定正电荷的阳离子化多糖,其中氨基醚化剂的接枝量控制在10%~55%;
6.2)将步骤1)得到的阳离子化多糖配制成高浓度水溶液,并与多酚水溶液混合得到共混溶液,使共混溶液中阳离子化多糖的浓度大于6mg/ml,使阳离子化多糖与多酚的质量比为8:1~16:1;
7.3)将步骤2)得到的共混溶液中加入亲水性多甲基聚合物的水溶液中,制成海绵、凝胶、膜或纤维敷料多种类型的止血材料,所述的多甲基聚合物与阳离子化多糖的质量比为100:3~100。
8.进一步,步骤3)所述的制成海绵的方法为:在共混溶液中加入亲水性多甲基聚合物后,直接冷冻干燥,得到复合海绵;步骤3)所述的制成凝胶的方法为:将共混溶液放到冰水浴中,边搅拌边加入亲水性多甲基聚合物使其溶解,得到复合凝胶;步骤3)所述的制成膜或纤维敷料的方法为:在共混溶液中加入亲水性多甲基聚合物后,经室温风干、高温干燥、真空干燥等高分子膜成型方法,得到复合膜,或者经静电纺丝或溶液纺丝等高分子纤维成
型方法,得到复合纤维敷料。
9.进一步,步骤3)为制成海绵时,所述的亲水性多甲基聚合物为羟丙基纤维素、羟丙基甲基纤维素、羟甲基纤维素的一种或多种组合,多甲基聚合物的水溶液的浓度为10~100mg/ml。
10.进一步,步骤3)为制成凝胶时,所述的亲水性多甲基聚合物为温敏亲水性多甲基聚合物或温敏亲水性多甲基聚合物与其他亲水性多甲基聚合物的组合,其中温敏亲水性多甲基聚合物为泊洛沙姆、聚(n-异丙基丙烯酰胺)、聚(n,n-二乙基丙烯酰胺)的一种,其他亲水性多甲基聚合物为羟丙基纤维素、羟丙基甲基纤维素、羟甲基纤维素的一种或多种组合,温敏多甲基聚合物(或温敏多甲基聚合物与其它亲水性聚合物组合)的水溶液的浓度为100~400mg/ml。
11.进一步,步骤3)为制成膜或纤维敷料时,所述的亲水性多甲基聚合物为羟丙基纤维素、羟丙基甲基纤维素、聚乙烯醇、海藻酸、明胶的一种或多种组合,所述的多甲基聚合物的水溶液的浓度为50~200mg/ml。
12.进一步,步骤2)所述的多酚为单宁酸、表没食子儿茶素、杨梅素、木犀草素、原花青素、葡萄多酚、漆黄素、茶多酚或苹果多酚的一种或多种组合。
13.进一步,步骤2)所述的多酚为单宁酸和原花青素,所述的共混溶液中阳离子化多糖与多酚的质量比为8~12:1。
14.进一步,步骤1)所述的不带电多糖为支链淀粉、羟乙基淀粉、羟乙基纤维素、葡聚糖和羟丙基纤维素。
15.进一步,步骤1)所述的不带电多糖为支链淀粉和葡聚糖。
16.进一步,步骤1)所述的氨基醚化剂为3-氯-2-羟丙基三甲基氯化铵或2,3-环氧丙基三甲基氯化铵,氨基醚化剂的接枝量控制在10%~35%。
17.本发明的有益效果在于:本发明制备了一系列阳离子化多糖多酚复合止血材料,通过对不带电多糖进行阳离子化以制备阳离子化多糖,赋予多糖以正电性。然后将阳离子化多糖在高浓度范围内与多酚复合制备阳离子化多糖/多酚复合物,最后将复合物与亲水性多甲基聚合物混合共同制备出止血材料。使用高浓度的阳离子化多糖/多酚复合物与亲水性多甲基聚合物制备的复合材料虽会表现出一定的血小板黏附能力,但是其会严重影响凝血相关酶的活性,干扰正常的凝血途径,疑似表现出不促凝血的负面效果(这是止血材料开发中的常识)。但是,此高浓度的阳离子化多糖/多酚复合物在凝血测试中却表现出显著的促凝血效果;通过对其凝血机理的研究,我们发现使用高浓度的阳离子化多糖/多酚复合物与亲水性多甲基聚合物制备的止血材料存在一种“强制凝胶化”止血作用,其可不通过正常凝血途径促使血液凝固,同时,这种“强制凝胶化”止血作用在海绵、凝胶等多种基材,以及羟丙基纤维素、f127等多种亲水不带电聚合物中都得到了充分验证。总之,本发明利用高浓度的阳离子化多糖/多酚复合物与亲水性多甲基聚合物制备出了可不依赖正常凝血途径,具有“强制凝胶化”止血作用的止血材料,为开发出可应对凝血功能障碍的新型止血材料提供了新思路。
附图说明
18.为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图:
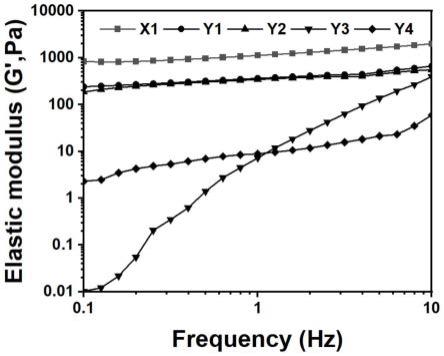
19.图1弹性模量测试结果。
具体实施方式
20.下面结合附图,对本发明的优选实施例进行详细的描述。
21.实施例1
22.1)取1.8g氢氧化钠(naoh)溶解于10ml去离子水,取6g 2,3-环氧丙基三甲基氯化铵(gta)溶解于40ml去离子水,二者混合后备用;称取6g支链淀粉加入到200ml去离子水中配制成分散液,然后加入naoh与gta的混合溶液,加完后,25℃下搅拌反应24h。反应结束后,用1000da透析袋透析两天,冻干,得到阳离子化淀粉qs(gta的接枝率为28%)。
23.2)将400mg qs溶于20ml去离子水中,将40mg单宁酸(ta)溶于10ml去离子水中,然后将qs溶液与ta溶液混合均匀,混匀后得到的qs/ta共混溶液(qs与ta质量比为10:1),记为qst-1。
24.3)取400mg的羟丙基纤维素(hpc)溶于10ml去离子水中(hpc溶液的浓度为40mg/ml),将hpc溶液与上述30ml的qst-1溶液以1:3的体积比混合均匀,冻干,得到具有止血性能的止血海绵x1(hpc和qs的质量比为1:1)。
25.实施例2
26.1)同实施例1步骤1)。
27.2)取150mg qs溶于9ml去离子水,取15mg的ta溶于1ml去离子水,二者混合均匀得到qs/ta共混溶液(qs与ta质量比为10:1),记为qst-2。
28.3)取2g的泊洛沙姆(f127)在冰水浴环境中分多次溶解到上述10ml的qst-2溶液中,得到具有止血性能的止血凝胶x2(f127和qs的质量比为40:3)。
29.实施例3
30.1)同实施例1步骤1)。
31.2)同实施例1步骤2)。
32.3)取10ml qst-1,将1g的hpc分多次溶解于其中,得到hpc-qst-1混合溶液(hpc的浓度为100mg/ml,hpc和qs的质量比为15:2)。取1ml上述混合溶液均匀地铺展于4.4
×
4.4cm2的模具中,50℃烘干24h,得到具有止血性能的止血膜x3。
33.实施例4
34.1)同实施例1步骤1)。
35.2)取100mg qs溶于9ml去离子水,取10mg的原花青素(pc)溶于1ml去离子水,二者混合均匀得到qs/pc共混溶液(qs与pc质量比为10:1),记为qsp-1。
36.3)取2g的泊洛沙姆(f127)在冰水浴环境中分多次溶解到上述10ml的qsp-1溶液中,得到具有止血性能的止血凝胶x4(f127和qs的质量比为20:1)
37.实施例5
38.1)取1.8g氢氧化钠(naoh)溶解于10ml去离子水,取6g 2,3-环氧丙基三甲基氯化铵(gta)溶解于20ml去离子水,二者混合后备用;称取6g葡聚糖溶于200ml去离子水中,然后加入naoh与gta的混合溶液,加完后,25℃下搅拌反应24h。反应结束后,用1000da透析袋透析两天,冻干,得到阳离子化葡聚糖qd(gta的接枝率为17%)。
39.2)将70mg qd溶于9ml去离子水中,将30mg单宁酸(ta)溶于1ml去离子水中,二者混
合均匀得到qd/ta共混溶液(qd与ta质量比为7:3),记为qdt-1。
40.3)取2g的泊洛沙姆(f127)在冰水浴环境中分多次溶解在上述10ml的qdt-1溶液中(f127和qd的质量比为200:7),得到具有止血性能的止血凝胶x5。
41.对比例1
42.1)同实施例1步骤1).
43.2)将400mg qs溶于20ml去离子水中,将80mg单宁酸(ta)溶于10ml去离子水中,然后将qs溶液与ta溶液混合均匀,混匀后得到的qs/ta共混溶液(qs与ta质量比为5:1),记为qst-3。
44.3)取400mg的羟丙基纤维素(hpc)溶于10ml去离子水中,将hpc溶液与上述30ml的qst-3溶液以1:3的体积比混合均匀(hpc和qs的质量比为1:1),冻干,得到复合海绵y1。
45.对比例2
46.1)同实施例步骤1)。
47.2)将400mg qs溶于20ml去离子水中,将20mg单宁酸(ta)溶于10ml去离子水中,然后将qs溶液与ta溶液混合均匀,混匀后得到的qs/ta共混溶液(qs与ta质量比为20:1),记为qst-4。
48.3)取400mg的羟丙基纤维素(hpc)溶于10ml去离子水中,将hpc溶液与上述30ml的qst-4溶液以1:3的体积比混合均匀后冻干,得到复合海绵y2。(hpc和qs的质量比为1:1)。
49.对比例3
50.直接取400mg的羟丙基纤维素(hpc)溶于40ml去离子水中后冻干,得到海绵y3。
51.对比例4
52.1)同实施例步骤1)。
53.2)将1.5g qs溶于10ml去离子水中,将150mg ta溶于10ml去离子水中,然后将qs溶液与ta溶液等体积混合均匀后冻干(qs与ta质量比为10:1),得到不加hpc的复合海绵y4。
54.对比例5
55.1)同实施例步骤1)。
56.2)取20mg的qs溶于9ml去离子水,取2mg的ta溶于1ml去离子水,二者混合均匀得到qs/ta共混溶液(qs与ta质量比为9:1),记为qst-5。
57.3)取2g的泊洛沙姆(f127)在冰水浴环境中分多次溶解在上述10ml的qst-5溶液中(f127和qs的质量比为100:1),得到复合凝胶y5。
58.对比例6
59.直接取2g的泊洛沙姆(f127)在冰水浴环境中分多次溶解10ml去离子水中,得到凝胶y6。
60.测试例1
61.制备的止血材料x1~x5,对比例y1~y6,市售金陵明胶海绵进行体外凝血效果对比实验。
62.测试方法:
63.①
对于海绵样品(x1、y1、y2、y3、y4、金陵明胶海绵)和膜样品(x3)——取5mg材料放入2ml离心管中,再迅速加入110μl的复凝血(取100μl新鲜的抗凝血与10μl 0.2m的cacl2快速混合均匀)。加完复凝血后将离心管快速放到37℃水浴中孵育1min。孵育完成后将离心
管中全部物体都转移到盛满水的10ml离心管中,继续孵育3min,3min后吸取100μl用酶联免疫检测仪测试545nm处的吸光度。
64.②
对于凝胶样品(x2、x4、x5、y5、y6)——在冰水浴环境中用移液枪吸取50μl溶胶放入2ml离心管中,将离心管放到37℃水浴中孵育一段时间待溶胶完全固化成为凝胶,然后按照
①
的相同步骤测试bci。
65.最后通过以下公式来计算凝血指数(bci)。
66.bci%=(abs
样品
/abs
空白
)
×
100%...................式
67.式中:abs
样品
是实验组在545nm处的吸光度;abs
空白
是空白组在545nm处的吸光度。实施例及对比例的bci指数如表1所示:
68.表1体外凝血指数测试结果
69.样品x1x2x3x4x5y1y2y3bci(%)39.414.838.740.627.870.481.772.6样品y4y5y6金陵海绵
ꢀꢀꢀꢀ
bci(%)65.745.668.868.7
ꢀꢀꢀꢀ
70.体外凝血指数bci是表征材料体外促凝血性能、筛选止血材料的重要指标,bci值越小,表明材料的体外促凝血性能越好。从表1可以看出,本发明实施例1~4得到的止血材料x1~x4的bci指数明显低于对比例y1~y6中的同种类材料以及未改性金陵海绵。由此可见,采用本发明的制备方法,可以得到具有优异止血性能的止血材料。
71.通过对不带电多糖进行阳离子化改性,使不带电多糖带有正电性,有利于促进血细胞、血小板的聚集/黏附,进而增强止血。然后将高浓度范围内的阳离子化多糖与多酚复合制备阳离子化多糖/多酚复合物,最后将复合物与亲水性多甲基聚合物混合共同制备出止血材料,这类止血材料虽会影响凝血酶活性/干扰正常凝血途径,但是其可以通过与血细胞、血浆蛋白的“强制凝胶化”作用促使血液凝固,最终实现止血。
72.对比例1是制备步骤2)中,使用阳离子淀粉与过量的单宁酸(qs与ta质量比为5:1)复合后,再与亲水性多甲基聚合物混合,制备得到的复合海绵y1,bci结果表明y1的止血性能较差,如表1所示。因此说明当复合物中的单宁酸组分含量过多时,阳离子淀粉的正电荷被过度屏蔽,材料的正电荷不足,进而不能充分促使血液中的相关成分(血细胞、血小板)聚集/黏附在材料周围,导致材料不具备“强制凝胶化”作用,止血效果差。
73.对比例2是制备步骤2)中,使用阳离子淀粉与少量的单宁酸(qs与ta质量比为20:1)复合后,再与亲水性多甲基聚合物混合,制备得到的复合海绵y2,bci结果表明y2的止血性能较差,如表1所示。因此说明当复合物中的单宁酸组分含量过少时,阳离子淀粉的正电荷未被有效屏蔽,材料虽具有大量的正电荷可促使血液中的相关成分(血细胞、血小板)快速大量地聚集到材料周围,但是却缺少足够的单宁酸使得聚集的血液成分进一步形成凝胶,导致材料不具备“强制凝胶化”作用,止血效果差。
74.对比例3是制备步骤3)中,单独使用羟丙基纤维素(hpc)制备得到的复合海绵y3,bci结果表明y4止血性能较差,如表1所示。因此说明单独的hpc不具备“强制凝胶化”作用,止血效果差。
75.对比例4是制备步骤3)中,单独使用阳离子淀粉/单宁酸复合物(不加hpc)制备得到的复合海绵y4,bci结果表明y4的止血性能较差,如表1所示。因此说明使用单独的阳离子
淀粉/单宁酸复合物,后续不加入羟丙基纤维素(hpc)制备的复合海绵虽具有足够的正电荷可以聚集血液成分、具有足够的单宁酸可促进血液成分发生凝胶化,但是其缺少足够的hpc作为分子骨架、形成空间网状结构,所以无法形成稳定的凝胶,因此也不具备“强制凝胶化”作用,止血效果差。
76.对比例5)是制备步骤2)中,使用低浓度的阳离子淀粉(qs最终浓度为2mg/ml)与单宁酸进行复合后与泊洛沙姆制备的凝胶y5,bci结果表明y5止血性能较差,如表1所示。说明当阳离子淀粉浓度过低时,复合凝胶中阳离子淀粉和单宁酸的含量都过少,其虽能聚集一定的血液成分,但是却不足以使其形成凝胶,因此不具备“强制凝胶化”作用,止血效果差。
77.对比例6)是制备步骤3)中,单独使用泊洛沙姆(f127)制备的凝胶y6,bci结果表明y6止血性能没有添加阳离子淀粉/单宁酸复合物之后的性能好,如表1所示。因此说明单独的f127不具备“强制凝胶化”作用,止血效果差。
78.测试例2
79.通过流变测试测定止血材料x1和对比例y1~y4的弹性模量,对比其“强制凝胶化”作用。测试方法:先安装好流变仪的夹具,选择直径为20mm的工作圆盘,对仪器进行校准后选择振荡频率模式进行测试。设置频率变化范围为0.1hz至10hz,应力为100pa的参数,将10mg的材料放到底盘表面,然后滴加200μl新鲜的抗凝全血,最后启动流变仪的测试程序,按照其操作要求完成实验。流变测试结果如图1所示。由图1可以看出,在相同测试条件下,实施例1中的x1样品与血液作用后的弹性模量处于833pa至1988pa之间(最大值达到1988pa),明显大于对比例中样品y1~y4与血液作用后的弹性模量(y1~y4样品与血液作用后的弹性模量最大值分别为664pa、556pa、59pa、393pa),这证明了x1样品能够最快的促使血液发生凝胶化、且其与血液作用后形成的凝胶具有高弹性模量,即只有x1样品具有明显的“强制凝胶化”作用。
80.说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
