cd38敲除的原代和扩增的人nk细胞的生成
1.相关申请的交叉引用
2.本技术要求于2019年10月31日提交的美国临时申请第62/928,524号的权益,其明确地通过引用并入本文。
背景技术:
3.近年来癌症免疫治疗得到了很大进展。遗传修饰的嵌合抗原受体(car)t细胞是工程化免疫细胞成功应用于癌症免疫治疗的一个很好的实例。这些细胞最近被fda批准用于治疗cd19
b细胞恶性肿瘤,但是迄今为止,成功仅限于携带少数可靶向抗原的疾病,并且靶向这些有限的抗原库易于因免疫逃逸而失败。此外,由于同种异体t细胞引起的移植物抗宿主疾病的风险,car t细胞已经集中于使用自体t细胞。相比之下,nk细胞能够以不依赖于抗原的方式杀死肿瘤靶点并且不会引起gvhd,这使得它们成为癌症免疫治疗的良好候选。当与抗体组合时,nk细胞和抗体的靶向和效应机制与car t细胞的相似。不幸的是,对于一些癌症,目前的治疗不仅靶向癌症,而且还会耗尽患者的nk细胞群。例如,达雷木单抗(daratumumab)靶向在多发性骨髓瘤细胞和白血病上以升高的水平发现的cd38。达雷木单抗的抗肿瘤活性依赖于nk细胞。然而,cd38也以高水平在nk细胞的表面上表达,并且达雷木单抗的施用导致nk细胞自相残杀,从而限制了达雷木单抗的有效性。因此,需要能够克服nk细胞自相残杀问题的新的免疫疗法和/或治疗方法。
技术实现要素:
4.公开了涉及包含cd38基因敲除的遗传修饰的nk细胞的方法和组合物。
5.在一个方面,本文公开了治疗、减轻、抑制、减少、改善和/或预防受试者中的癌症和/或转移(例如,多发性骨髓瘤,白血病(包括但不限于急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all)或母细胞性浆细胞样树突细胞肿瘤(bpdcn))的方法,其包含向受试者施用已被修饰以包含cd38基因敲除的nk细胞。在一些方面,治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移的方法可以进一步包含向受试者施用靶向cd38的小分子、抗体、肽、蛋白质或sirna(例如,抗cd38抗体,包括但不限于达雷木单抗、艾萨妥昔单抗(isatuximab)、tak-079和/或mor202)。
6.本文还公开了治疗、减轻、抑制、减少、改善和/或预防前述任一方面的癌症和/或转移(例如,多发性骨髓瘤、白血病(包括但不限于急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all)或母细胞性浆细胞样树突细胞肿瘤(bpdcn))的方法,其进一步包含向受试者施用血管生成抑制剂(例如,泊马度胺(pomalidomide)、来那度胺(lenalidomide)或阿普斯特(apremilast))和类固醇(例如,糖皮质激素,包括但不限于地塞米松(dexamethasone)、倍他米松(betamethasone)、泼尼松龙(prednisolone)、methodlprenisolone、曲安西龙(triamcinolone)或醋酸氟氢可的松(fludrocortisone acetate))。
7.在一个方面,本文公开了治疗、减轻、抑制、减少、改善和/或预防不直接表达cd38
但其中可靶向癌症微环境中的其它细胞(包括但不限于髓源性抑制细胞(mdsc))的癌症和/或转移的方法,其包含向受试者施用已被修饰以包含cd38基因敲除的nk细胞。
8.在一个方面,本文公开了遗传修饰nk细胞(例如,原代或扩增的nk细胞)的方法,其包含获得对nk细胞(例如,cd38)中的靶dna序列具特异性的向导rna(grna);以及b)通过电穿孔向靶nk细胞中引入核糖核蛋白(rnp)复合物,该核糖核蛋白复合物包含与相应crispr/cas向导rna复合的2类crispr/cas核酸内切酶(cas9),该crispr/cas向导rna与nk细胞的基因组dna内的靶序列杂交,产生cd38敲除的原代或扩增的nk细胞。
9.本文还公开了前述任一方面的方法,其中通过插入或缺失一个或多个碱基对、通过异源dna片段(例如,供体多核苷酸)的插入、通过内源dna片段的缺失、通过内源dna片段的倒位或易位或其组合来修饰nk细胞的基因组。
10.在一个方面,本文公开了遗传修饰前述任一方面的nk细胞的方法,其中在转导(例如,电穿孔)之前,将nk细胞(例如,原代或扩增的nk细胞)在il-2和/或辐射的饲养细胞存在下孵育4、5、6或7天。
11.本文还公开了遗传修饰前述任一方面的nk细胞的方法,其进一步包含在电穿孔后用辐射的表达膜结合白介素-21(mbil-21)的饲养细胞扩增修饰的nk细胞。
12.在一个方面,本文公开了通过前述任一方面的方法制备的修饰的nk细胞。在一个方面,修饰的nk细胞可以包含编码cd38的基因的敲除。例如,在另一方面,本文公开了包含如本文公开的编码分化簇38(cd38)的基因的敲除的遗传修饰的nk细胞,其用作药物,优选地用于治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移的方法。在另一方面,本文公开了包含如本文公开的编码分化簇38(cd38)的基因的敲除的遗传修饰的nk细胞,其用于(i)在有需要的受试者中增加氧化呼吸能力的方法或(ii)在有需要的受试者中限制细胞外nad水解和改善氧化还原呼吸能力的方法。以相同的方式,本文还公开了包含如本文公开的编码分化簇38(cd38)的基因的敲除的遗传修饰的nk细胞在制备药物中的用途,优选地在制备用于治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移的药物中的用途。在另一方面,本文公开了包含如本文公开的编码分化簇38(cd38)的基因的敲除的遗传修饰的nk细胞在制备用于(i)在有需要的受试者中增加氧化呼吸能力或(ii)在有需要的受试者中限制细胞外nad水解和改善氧化还原呼吸能力的药物中的用途。
13.本文还公开了治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移(例如,多发性骨髓瘤、白血病(包括但不限于急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all)或母细胞性浆细胞样树突细胞肿瘤(bpdcn))的方法,其包含向患有癌症的受试者施用前述任一方面的修饰的nk细胞(如cd38敲除的nk细胞)。在一些方面,治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移的方法可以进一步包含向受试者施用靶向cd38的小分子、抗体、肽、蛋白质或sirna(例如,抗cd38抗体,包括但不限于达雷木单抗、艾萨妥昔单抗、tak-079和/或mor202)。
14.在一个方面,本文公开了治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移(例如,多发性骨髓瘤、白血病(包括但不限于急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all)或母细胞性浆细胞样树突细胞肿瘤(bpdcn))的方法,其包含向受试者施用前述任一方面的修饰的nk细胞(例如,cd38敲除的nk细胞)和靶向cd38的小分子、抗体、肽、蛋白质或sirna(例如,抗cd38抗体,包括但不限于达雷木单抗、艾萨妥昔单抗、tak-079
和/或mor202),其进一步包含向受试者施用血管生成抑制剂(诸如,例如,泊马度胺、来那度胺或阿普斯特)和类固醇(诸如,例如糖皮质激素,包括但不限于地塞米松、倍他米松、泼尼松龙、methodlprenisolone、曲安西龙或醋酸氟氢可的松)。
15.本文还公开了在接受抗cd38免疫疗法的受试者中减少nk细胞自相残杀的方法,其包含向受试者施用前述任一方面的遗传修饰的nk细胞。在一个方面,抗cd38免疫疗法可以包含向受试者施用抗cd38抗体,包括但不限于达雷木单抗、艾萨妥昔单抗、tak-079和/或mor202。
16.在一个方面,本文公开了将工程化的nk细胞过继转移至有需要的受试者的方法,所述方法包含:a)获得待修饰的靶nk细胞(诸如原代nk细胞或扩增的nk细胞);b)获得对靶dna序列具特异性的grna;c)通过电穿孔向靶nk细胞中引入rnp复合物,该rnp复合物包含与相应crispr/cas grna复合的2类crispr/cas核酸内切酶(cas9),该crispr/cas grna与靶nk细胞的基因组dna内的靶序列杂交,产生工程化的nk细胞(诸如,例如,已经被修饰以敲除cd38基因的nk细胞);以及d)将工程化的nk细胞转移到受试者中。
17.本文还公开了将工程化的nk细胞过继转移至有需要的受试者的方法,其中nk细胞是原代nk细胞(例如,自体nk细胞,或来自同种异体供体来源的nk细胞),其经离体修饰并在修饰后转移至受试者(例如,已经被修饰以敲除cd38基因的nk细胞)。
18.在一个方面,本文公开了将工程化的nk细胞过继转移至前述任一方面的有需要的受试者的方法,其中nk细胞在体外扩增,如用辐射的表达mbil-21的饲养细胞扩增,或在体内扩增,例如在向受试者施用修饰的nk细胞之前、同时或之后施用il-21。
19.在一个方面,本文公开了将工程化的nk细胞(例如,cd38敲除的nk细胞)过继转移至有需要的受试者的方法,其中接受过继转移的修饰的nk细胞的受试者患有癌症。
20.本文还公开了增加向受试者施用的抗cd38免疫疗法(诸如,例如,靶向cd38的小分子、抗体(包括但不限于,达雷木单抗、艾萨妥昔单抗、tak-079和/或mor202)、肽、蛋白质或sirna)的功效的方法,用于治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移(诸如,例如,多发性骨髓瘤、白血病(包括但不限于,急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all),或母细胞性浆细胞样树突细胞肿瘤(bpdcn)),其包含向受试者施用前述任一方面的修饰的nk细胞(例如,cd38敲除的nk细胞)。
附图说明
21.并入本说明书中并且构成本说明书的一部分的附图展示若干实施例,并且与描述一起展示了所公开的组合物和方法。
22.图1示出了野生型和cd38敲除的nk细胞上的cd38表达。
23.图2示出了野生型和cd38敲除的nk细胞中对达雷木单抗介导的自相残杀的抗性的比较。
24.图3示出了基于图4至6的数据计算的adcc的变化(左)和杀死多发性骨髓瘤的总体有效性的变化(右)。
25.图4示出了在存在或不存在达雷木单抗的情况下,对于野生型和cd38敲除的nk细胞,以各种nk细胞比率杀死rpmi 8226人多发性骨髓瘤细胞的有效性。
26.图5示出了在存在或不存在达雷木单抗的情况下,对于野生型和cd38敲除的nk细
胞,以各种nk细胞比率杀死mm.1s人多发性骨髓瘤细胞的有效性。
27.图6示出了在存在或不存在达雷木单抗的情况下,对于野生型和cd38敲除的nk细胞,以各种nk细胞比率杀死h929人多发性骨髓瘤细胞的有效性。
28.图7a至7b示出了离体扩增的nk细胞的免疫表型。图7a示出了刺激14天后nk细胞的纯度。图7b示出了同一供体的cd38
wt
和cd38
ko nk细胞上cd16表达的代表性facs分析。每个图表示表达cd16的nk细胞的百分比。用填充的直方图描述同种型对照。
29.图8a至8d示出了使用cas9核糖核蛋白复合物(cas9/rnp)从离体扩增的外周血nk(pb-nk)细胞成功生成cd38
ko
nk细胞。
30.图9示出了受cas9/rnp影响的基因的表达。来自表3的高度影响基因的rna-seq的相对mrna表达。
31.图10a至10f示出了cd38
ko
nk细胞对dara诱导的自相残杀的抗性。图10a示出了缀合测定的代表性facs分析。图10b示出了缀合测定的汇总数据(n=3,平均值
±
sd)。图10c示出了自相残杀测定的代表性facs分析。图10d示出了与对照样品相比,用dara处理的cd38
wt
和cd38
ko
nk细胞的存活力(n=3,平均值
±
sd)。图10e示出了用dara或盐水处理7天后nsg小鼠的外周血(pb)的代表性facs分析。图10f示出了治疗期间nsg小鼠中nk细胞持久性的汇总数据。示出了第7天时pb中人nk细胞的频率以及第9天时脾和骨髓中人nk细胞的绝对数(n=5,平均值
±
sd)。
32.图11a至11d示出了cd16
ko nk细胞对dara诱导的自相残杀的抗性。图11a示出了cd16
wt
和cd16
ko nk细胞的facs分析。图11b示出了h929细胞系在存在或不存在dara(10μg/ml)的情况下与cd16
wt
或cd16
ko nk细胞孵育4小时。图11c示出了在dara存在的情况下配对的cd16
wt
和cd16
ko nk细胞抗h929细胞系的adcc活性。图11d示出了在dara(10μg/ml)存在的情况下培养4或24小时的cd16
ko nk细胞确实显示出自相残杀的证据。
33.图12a至12f示出了cd38
ko nk细胞针对mm细胞系和原代mm细胞的增强的dara介导的adcc活性。图12a示出了nk细胞和骨髓瘤细胞系的cd38表达的代表性facs分析。每个图示出了平均荧光强度(mfi)。用填充的直方图描述同种型对照。配对的cd38
wt
和cd38
ko nk细胞针对骨髓瘤细胞系的细胞毒性和dara介导的adcc活性的代表性数据(图12b至12c)和代表性的原代mm样品(图12d)。图12e示出了配对的cd38
wt
和cd38
ko nk细胞针对原代mm样品的adcc活性(e:t比率为0.1:1)。图12f示出了在dara存在的情况下配对的cd38
wt
和cd38
ko nk细胞针对原代dara抗性mm细胞的细胞毒性。
34.图13示出了与cd38
wt nk细胞相比,cd38
ko nk细胞的adcc的改善与mm细胞靶点上的cd38表达水平相关。x轴表示靶细胞的mfi(cd38)与cd38
wt nk细胞的相对比率。y轴表示与cd38
wt nk细胞相比,cd38
ko nk细胞的adcc相对增加。adcc值(e/t=5,在4小时测定中)用于mm.1s、h929和opm-2,而adcc值(e/t=0.1,在24小时测定中)用于rpmi8226和患者样品。给出了斯皮尔曼秩相关系数(r)和p值。
35.图14示出了与atra孵育48小时后mm细胞系上的cd38表达。对照和atra处理的样品分别以黑线和灰线示出。未染色的对照用填充的直方图描绘。
36.图15a至15g示出了atra对dara介导的nk细胞细胞毒性的抑制作用。图15a至15b示出了配对的cd38
wt
和cd38
ko nk细胞针对用50nm atra预处理48小时的骨髓瘤细胞系的细胞毒性和dara介导的adcc活性(平均值
±
sd)。在图15c中,左图示出了在atra治疗或未治疗期
间来自患者的nk细胞(cd3-cd56
细胞)上的cd38表达的代表性facs分析数据。将冷冻的外周血单核细胞解冻并立即分析。右图示出了3名不同患者在atra治疗期间nk细胞的mfi(cd38)与未治疗相比增加倍数。图15示出了与50nm atra或溶剂对照孵育48小时后cd38
wt
和cd38
ko nk细胞上的cd38表达的代表性facs分析数据。对照和atra处理的样品分别以黑线和灰线示出。未染色的对照用填充的直方图描绘。图15e示出了与对照样品相比,在50nm atra或溶剂对照存在的情况下用dara处理48小时的cd38
wt
和cd38
ko nk细胞的存活力(平均值
±
sd)。图15f至15g在50nm atra或溶剂对照存在的情况下在48小时细胞毒性测定中配对的cd38
wt
和cd38
ko nk细胞针对骨髓瘤细胞系的细胞毒性和dara介导的adcc活性。mm.1s的e:t比率为0.25:1,kms-11的e:t比率为0.5:1(平均值
±
sd)。
37.图16a至16d示出了cd38
ko nk细胞的有利的代谢重编程。图16a示出了基于配对的cd38
wt
和cd38
ko nk细胞(n=6)的归一化的rna-seq数据,通过独创性通路分析(ipa)测定的显著改变的通路(胆固醇生物合成和oxphos)的deg热图。图16b示出了deg的主要组分分析,示出了尽管供体间差异很大,但cd38缺失对每个供体的一致影响。图16c示出了配对的cd38
wt
和cd38
ko nk细胞(n=3,平均值
±
sd)的代谢分析的汇总数据。图16d示出了从图16c得出的基础ocr、ecar、ocr/ecar和src的图形分析。所有实验一式五份进行。图16e至16f示出了另外三个供体的分析,包括ocr和src(图16e),以及ecar和糖酵解储备(图16f)。图16g示出了所有六个供体的分析ocr和src。
38.图17示出了6对不同的cd38
wt
和cd38
ko nk细胞的标准化rna-seq数据的火山图。示出了与cd38
wt nk细胞相比,cd38
ko nk细胞中的基因变化最显著。
39.图18示出了在dara治疗期间来自复发病例的mm细胞的cd38表达。来自dara抗性病例的nk细胞和bmsc用fitc标记的多表位抗cd38抗体染色,然后用apc标记的抗fitc抗体染色。mm细胞用cd138 细胞定义。示出了染色样品的mfi(cd38)和荧光减一(fmo)(没有多表位抗cd38抗体)对照。
40.图19示出了cd38的缺失减少了nad再循环,导致nad/nadh比率增加。
41.图20示出了尽管向氧化代谢的显著代谢转变表明线粒体活性增加,但cd38敲除不会改变线粒体膜电位。
42.图21示出了尽管显著的代谢向氧化代谢转变,但cd38敲除不会改变低葡萄糖环境中的nk细胞功能。
具体实施方式
43.在公开和描述本发明的化合物、组合物、制品、装置和/或方法之前,应当理解,除非另外指明,否则所述化合物、组合物、制品、装置和/或方法不限于特定的合成方法或特异性重组生物技术方法,或者除非另外指明,否则不限于特定的试剂,因为所述化合物、组合物、制品、装置和/或方法当然可以变化。还应当理解,本文所使用的术语仅出于描述特定实施例的目的,而不旨在是限制性的。
44.a.定义
45.如本说明书和所附权利要求中所使用的,单数形式“一个”、“一种”以及“所述”包含复数指示物,除非上下文另外清楚地指明。因此,例如,对“药物载体”的提及包含两种或更多种此类载体的混合物等。
46.在本文中,范围可以表示为从“约”一个特定值和/或到“约”另一个特定值。当表达此类范围时,另一个实施例包含从一个特定值和/或到另一个特定值。类似地,当通过使用先行词“约”将值表达为近似值时,应理解,特定值形成另一个实施例。应进一步理解,每个范围的端点相对于另一端点,以及独立于另一端点都是显著的。还应理解,本文公开了许多值,并且每个值在本文中还被公开为“约”为除了所述值本身之外的所述特定值。例如,如果公开值“10”,则还公开“约10”。还应当理解,如本领域的技术人员适当理解的,当公开的值“小于或等于”所述值时,还公开了“大于或等于所述值”以及所述值之间的可能范围。例如,如果公开了值“10”,则还公开了“小于或等于10”以及“大于或等于10”。还应当理解,在整个申请中,以许多不同的格式提供数据,并且此数据表示端点和起点以及数据点的任何组合的范围。例如,如果公开了特定数据点“10”和特定数据点15,则应当理解,认为公开了大于、大于或等于、小于、小于或等于以及等于10和15以及介于10与15之间。还应当理解,还公开了两个特定单元之间的每个单元。例如,如果公开了10和15,则还公开了11、12、13和14。
47.在本说明书和随后的权利要求中,将参考许多术语,这些术语应当被限定为具有以下含义:
[0048]“任选的”或“任选地”意指随后描述的事件或情况可能会或可能不会发生,并且所述描述包含所述事件或情况发生的实例和所述事件或情况未发生的实例。
[0049]“引物”是能够支持某些类型的酶促操作并且能够与靶核酸杂交使得酶促操作能够发生的探针的子集。引物可以由本领域可获得的不干扰酶促操作的核苷酸或核苷酸衍生物或类似物的任何组合制成。
[0050]“探针”是能够与靶核酸相互作用的分子,通常以序列特异性方式,例如通过杂交。核酸的杂交在本领域中是熟知的并在本文中讨论。通常,探针可以由本领域可获得的核苷酸或核苷酸衍生物或类似物的任何组合制成。
[0051]“编码”特定rna的dna序列是转录成rna的dna核酸序列。dna多核苷酸可以编码被翻译成蛋白质的rna(mrna)(并且因此dna和mrna均编码蛋白质),或dna多核苷酸可以编码不被翻译成蛋白质的rna(例如trna、rrna、微rna(mirna)、“非编码”rna(ncrna)、向导rna等)。
[0052]“蛋白质编码序列”或编码特定蛋白质或多肽的序列是当置于适当调节序列的控制下时在体外或体内转录成mrna(在dna的情况下)和翻译(在mrna的情况下)成多肽的核酸序列。编码序列的边界由5'末端(n-末端)的起始密码子和3'末端(c-末端)的翻译终止无义密码子决定。编码序列可以包括但不限于来自原核或真核mrna的cdna、来自原核或真核dna的基因组dna序列和合成核酸。转录终止序列通常位于编码序列的3'。
[0053]
如本文所用,应用于核酸、多肽、细胞或生物体的术语“天然存在的”或“未修饰的”或“野生型”是指在自然界中发现的核酸、多肽、细胞或生物体。例如,存在于生物体(包括病毒)中的多肽或多核苷酸序列是野生型的(和天然存在的),可以从自然界的某个来源分离出来,而且未经人类在实验室中有意修饰。
[0054]“增加”可以指导致更大量的症状、疾病、组合物、病状或活性的任何变化。增加可以是病状、症状、活性、组合物以统计显著量的任何个体、中值或平均增加。因此,增加可以是1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%的增加,只要增加
是统计上显著的即可。
[0055]“减少”可以指导致更少量的症状、疾病、组合物、病状或活性的任何变化。当利用物质的基因产物的遗传输出相对于不利用所述物质的基因产物的输出较低时,所述物质还应被理解为减少基因的遗传输出。还例如,减少可以是病症症状的使得症状比先前观察到的更少的变化。减少可以是病状、症状、活性、组合物以统计学显著量的任何个体、中值或平均减少。因此,减少可以是1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%的减少,只要减少是统计上显著的即可。
[0056]
术语“受试者”是指作为施用或治疗的靶标的任何个体。受试者可以是脊椎动物,例如哺乳动物。一方面,受试者可以是人、非人灵长类动物、牛、马、猪、犬或猫。受试者还可以是豚鼠、大鼠、仓鼠、兔、小鼠或鼹鼠。因此,受试者可以是人或兽医患者。术语“患者”是指在临床医师,例如医师的治疗下的受试者。
[0057]
术语“治疗”是指患者的医疗管理,其中有意治愈、改善、稳定或预防疾病、病理病状或病症。此术语包含积极治疗,即治疗特异性针对疾病、病理病状或病症的改善,并且还包含病因治疗,即治疗针对相关疾病、病理病状或病症的病因的去除。另外,此术语包含姑息治疗,即设计治疗用于减轻症状而不是治愈疾病、病理病状或病症;预防治疗,即治疗针对将相关疾病、病理病状或病症的发展最小化或部分或完全抑制其发展;和支持性治疗,即治疗用于补充针对相关疾病、病理病状或病症的改善的另一种特定治疗。
[0058]
向受试者的“施用”包括向受试者引入或递送药剂的任何途径。施用可以通过任何合适的途径进行,包括口服、局部、静脉内、皮下、经皮、透皮、肌内、关节内、肠胃外、动脉内、皮内、心室内、颅内、腹膜内、病灶内、鼻内、直肠、阴道、通过吸入、经由植入的储库、肠胃外(例如,皮下、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、腹膜内、肝内、病灶内和颅内注射或输注技术)等。如本文所用的“并发施用”、“联合施用”、“同时施用”或“同时施用”意指化合物在相同时间点或基本上彼此紧接地施用。在后一种情况下,在足够接近的时间施用两种化合物,使得观察到的结果与在相同时间点施用化合物时获得的结果没有区别。“全身施用”是指通过将药剂引入或递送至受试者身体的广泛区域(例如大于身体的50%)的途径,例如通过进入循环系统或淋巴系统,将药剂引入或递送至受试者。相反,“局部施用”是指通过将药剂引入或递送至施用点的区域或紧邻施用点的区域的途径将药剂引入或递送至受试者,并且不以治疗显著量全身引入药剂。例如,局部施用的药剂在施用点的局部附近是容易检测的,但在受试者身体的远侧部分是不可检测的或以可忽略的量可检测的。施用包括自我施用和通过他人施用。
[0059]
药剂的“有效量”是指足以提供期望的效果的药剂的量。“有效”的药剂的量将因受试者而异,这取决于许多因素,如受试者的年龄和一般状况、特定的一种或多种药剂等。因此,不可能总是指定定量的“有效量”。然而,本领域普通技术人员可以使用常规实验确定任何受试者情况下的适当“有效量”。而且,如本文所使用的并且除非另有明确说明,否则药剂的“有效量”还可以指涵盖治疗有效量和预防有效量的量。达到治疗效果所必需的药剂的“有效量”可以根据如受试者的年龄、性别和体重等因素而变化。剂量方案可以调整以提供最佳的治疗应答。例如,可以每天施用若干个分开的剂量,或者剂量可以成比例减少,如治疗情况的迫切情况所指示的。
[0060]“药学上可接受的”组分可以指不是生物学上或其它方面不合需要的组分,即,该组分可以并入本发明的药物制剂中并如本文所述施用于受试者,而不引起显著的不合需要的生物效应或以有害方式与含有它的制剂的任何其它组分相互作用。当针对施用于人而使用时,所述术语通常意味着所述组分已满足所需的毒理学和制造测试标准,或者所述组分包含在美国食品和药物管理局(u.s.food and drug administration)制定的非活性成分指南(inactive ingredient guide)中。
[0061]“药学上可接受的载体”(有时称为“载体”)意指可用于制备通常安全且无毒的药物或治疗组合物的载体或赋形剂,并且包括兽医和/或人类药物或治疗用途可接受的载体。术语“载体”或“药学上可接受的载体”可以包含但不限于磷酸盐缓冲盐水溶液、水、乳剂(如油/水或水/油乳剂)和/或各种类型的润湿剂。如本文所使用的,术语“载体”涵盖但不限于任何任何赋形剂、稀释剂、填料、盐、缓冲液、稳定剂、增溶剂、脂质、稳定剂或本领域公知的用于药物调配物并且如本文进一步描述的其它材料。
[0062]
如在“药理学上活性的”衍生物或类似物中的“药理学上活性的”(或简单地“活性的”)可以指具有与母体化合物相同类型的药理学活性并且程度大致相等的衍生物或类似物(例如,盐、酯、酰胺、缀合物、代谢物、异构体、片段等)。
[0063]“治疗剂”是指具有有益生物效应的任何组合物。有益生物效应包含:治疗效应,例如,治疗病症或其它不期望的生理病状;和预防效应,例如,预防病症或其它不期望的生理病状(例如,非免疫原性癌症)。所述术语还涵盖本文具体提及的有益药剂的药学上可接受的药理学上活性的衍生物,包含但不限于盐、酯、酰胺、前体药剂(proagent)、活性代谢物、异构体、片段、类似物等。当使用术语“治疗剂”时,或者当具体鉴定特定药剂时,应当理解,所述术语包含药剂本身以及药学上可接受的药理学上活性的盐、酯、酰胺、前体药剂、缀合物、活性代谢物、异构体、片段、类似物等。
[0064]
组合物(例如,包括药剂的组合物)的“治疗有效量”或“治疗有效剂量”是指有效实现所期望的治疗结果的量。在一些实施例中,所期望的治疗结果是控制i型糖尿病。在一些实施例中,所期望的治疗结果是控制肥胖。给定治疗剂的治疗有效量通常会根据如所治疗的病症或疾病的类型和严重程度以及受试者的年龄、性别和体重等因素而变化。所述术语还可以指有效地促进如疼痛缓解等所期望的治疗效果的治疗剂的量或治疗剂的递送速率(例如,随时间变化的量)。精确的所期望治疗效果将根据待治疗的病状、受试者的耐受性、待施用的药剂和/或药剂调配物(例如,治疗剂的效力、调配物中药剂的浓度等)以及本领域普通技术人员理解的各种其它因素而变化。在一些情况下,在数天、数周或数年的时间段内向受试者施用多剂组合物后实现所期望的生物学或医学应答。
[0065]
贯穿本技术,引用了各种出版物。这些出版物的公开内容特此通过引用整体并入本技术中,以更全面地描述本发明所属领域的现状。对于文献中含有的在文献所依赖的句子中讨论的材料,所公开的参考文献也单独且具体地通过引用并入本文。
[0066]
b.治疗癌症的方法,包含施用cd38敲除的nk细胞
[0067]
多发性骨髓瘤是最常诊断的血液癌症之一。最近,fda已经批准达雷木单抗,一种治疗性单克隆抗体,用于治疗多发性骨髓瘤。达雷木单抗与靶癌细胞上的cd38分子结合并通过抗体依赖性细胞毒性(adcc)和其它机制介导细胞杀伤。包括艾萨妥昔单抗、tak-079和mor202的其它抗cd38抗体也正被开发用于治疗癌症。由这些抗体诱导的adcc由nk细胞介
导。然而,使用靶向cd38的药剂具有限制其有效性的负面影响。因为nk细胞在其细胞表面上表达cd38,所以这些抗cd38抗体的使用导致杀伤nk细胞(自相残杀),而nk细胞是其有效性的活性成分。
[0068]
为了克服由这些抗cd38疗法引起的nk细胞自相残杀的问题并治疗癌症,公认施用已经被工程化以敲除cd38表达的nk细胞可以解决这两个问题。简而言之,对抗cd38免疫疗法引起的nk细胞耗竭具有抗性的工程化的nk细胞增加了抗cd38抗体的功效。因此,在一个方面,本文公开了增加向受试者施用的抗cd38免疫疗法(诸如,例如,靶向cd38的小分子、抗体(包括但不限于,达雷木单抗、艾萨妥昔单抗、tak-079和/或mor202)、肽、蛋白质或sirna)的功效的方法,用于治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移(诸如,例如,多发性骨髓瘤、白血病(包括但不限于,急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all),或母细胞性浆细胞样树突细胞肿瘤(bpdcn)),其包含向受试者施用前述任一方面的修饰的nk细胞(例如,cd38敲除的nk细胞)。
[0069]
应当理解并本文预期,这种增加的功效对癌症患者极为有益。因此,在一个方面,本文公开了治疗、减轻、抑制、减少、改善和/或预防受试者中的癌症和/或转移(例如,多发性骨髓瘤、白血病(包括但不限于急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all)或母细胞性浆细胞样树突细胞肿瘤(bpdcn))的方法,其包含向受试者施用已被修饰以包含cd38基因敲除的nk细胞。在一些方面,治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移的方法可以进一步包含向受试者施用靶向cd38的小分子、抗体、肽、蛋白质或sirna(例如,抗cd38抗体,包括但不限于达雷木单抗、艾萨妥昔单抗、tak-079和/或mor202)。
[0070]
如本文所用的“治疗(treat)”、“治疗(treating)”、“治疗(treatment)”及其语法变体包括施用组合物,其意图或目的是部分或完全预防、延迟、治愈、康复、减轻、缓解、改变、补救、改良、改善、稳定、缓解和/或降低一种或多种疾病或病状、疾病或病状的症状或疾病或病状的潜在原因的强度或频率。根据本发明的治疗可以预防性地、预防性地、缓和性地或补救性地施用。在发病之前(例如,在明显的癌症征兆之前)、在早期发病期间(例如,在癌症的初始征兆和症状之后)或在癌症的确定发展之后,对受试者进行预防性治疗。预防性施用可以在感染症状显现之前的数天或数年内进行。
[0071]“抑制(inhibit)”、“抑制(inhibiting)”和“抑制(inhibition)”意指减少活性、应答、病状、疾病或其它生物参数。这可以包含但不限于活性、应答、病状或疾病的完全消融。这还可以包含例如与天然或对照水平相比,活性、应答、病状或疾病减少10%。因此,与天然或对照水平相比,所述减少可以是10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或其间的任何减少量。
[0072]“减少”或该词语的其它形式,诸如“减少(reducing)”或“减少(reduction)”是指事件或特征(例如,肿瘤生长)的降低。应当理解,这通常与某个标准或预期值有关,换言之它是相对的,但并不总是需要引用标准或相对值。例如,“减少肿瘤生长”意指相对于标准或对照减少肿瘤生长的速率。
[0073]“预防(prevent)”或所述词语的其它形式(如“预防(preventing)”或“预防(prevention)”)意指阻止特定事件或特性,以稳定或延迟特定事件或特性的发展或进展,或最小化特定事件或特性发生的可能性。预防不需要与对照进行比较,因为其通常比例如
减少更绝对。如本文所使用的,某物可以减少但不能预防,但减少的某物也可以预防。同样,某物可以预防但不能减少,但预防的某物也可以减少。应当理解,除非另外明确指出,否则在使用减少或预防的情况下,还明确公开了其它词语的使用。
[0074]
应当理解并本文预期,在治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移(例如,多发性骨髓瘤、aml、t-all和/或bpdcn)的方法中,其包含施用遗传修饰的nk细胞(诸如,本文公开的任何cd38敲除的nk细胞)和抗cd38剂(诸如,例如达雷木单抗、艾萨妥昔单抗、tak-079和/或mor202)和/或血管生成抑制剂(例如,泊马度胺、来那度胺或阿普斯特)和类固醇(例如,糖皮质激素,包括但不限于地塞米松、倍他米松、泼尼松龙,甲泼尼龙、曲安西龙或醋酸氟氢可的松)和/或atra,遗传修饰的nk细胞可在施用任何抗cd38药剂之前、同时和/或之后施用。在一些方面,遗传修饰的nk细胞(诸如,本文公开的任何cd38敲除的nk细胞)可以在施用任何抗cd38药剂之前或之后的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120分钟、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、30、36、42、48、54、60、66、72、78、84、90、96小时、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、35、42、49、54或60天施用至受试者。
[0075]
本文还公开了治疗、减轻、抑制、减少、改善和/或预防本文所述的癌症和/或转移(例如,多发性骨髓瘤、白血病(包括但不限于急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all)或母细胞性浆细胞样树突细胞肿瘤(bpdcn))的方法,其进一步包含向受试者施用血管生成抑制剂(例如,泊马度胺、来那度胺或阿普斯特)和类固醇(例如,糖皮质激素,包括但不限于地塞米松、倍他米松、泼尼松龙、methodlprenisolone、曲安西龙或醋酸氟氢可的松)。
[0076]
应当理解并本文预期,所公开的修饰的nk细胞和修饰的nk细胞的过继转移方法可以是针对癌症的有效免疫疗法。所公开的方法和组合物可用于治疗其中发生不受控制的细胞增殖的任何疾病,诸如癌症。不同类型的癌症的非限制性列表如下:淋巴瘤(霍奇金和非霍奇金)、白血病、癌、实体组织癌、鳞状细胞癌、腺癌、肉瘤、神经胶质瘤、高级神经胶质瘤、母细胞瘤、成神经细胞瘤、浆细胞瘤、组织细胞瘤、黑素瘤、腺瘤、缺氧性肿瘤、骨髓瘤、aids相关淋巴瘤或肉瘤、转移性癌症或一般癌症。
[0077]
所公开的组合物可用于治疗的癌症的代表性但非限制性列表如下:淋巴瘤、b细胞淋巴瘤、t细胞淋巴瘤、蕈样真菌病、霍奇金病、髓样白血病(包括但不限于aml)、t细胞急性成淋巴细胞性白血病(t-all)、膀胱癌、母细胞性浆细胞样树突细胞肿瘤(bpdcn)、脑癌、神经系统癌症、头颈癌、头颈部鳞状细胞癌、肺癌(诸如小细胞肺癌和非小细胞肺癌)、成神经细胞瘤/成胶质细胞瘤、卵巢癌、皮肤癌、多发性骨髓瘤、肝癌、黑素瘤、口腔、咽喉、喉和肺的鳞状细胞癌、宫颈癌症、宫颈癌、乳腺癌,以及上皮癌、肾癌、泌尿生殖道癌、肺癌、食道癌、头颈癌、大肠癌、造血系统癌;睾丸癌;结肠癌、直肠癌、前列腺癌或胰腺癌。因此,在一个方面,本文公开了治疗、减轻、抑制、减少、改善和/或预防受试者中的癌症和/或转移的方法,其包含向受试者施用已被修饰以包含cd38基因敲除的nk细胞。因此,在一个方面,本文公开了治疗、减轻、抑制、减少、改善和/或预防受试者中的癌症和/或转移(例如,多发性骨髓瘤、白血病(包括但不限于急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all)或母细胞性浆细胞样树突细胞肿瘤(bpdcn))或转移的方法,其包含向受试者施用已被修饰以包含
cd38基因敲除的nk细胞。在一些方面,该方法可以进一步包含向受试者施用靶向cd38的药剂(诸如,例如,抗cd38,包括但不限于达雷木单抗、艾萨妥昔单抗、tak-079和mor202)。另外,该方法还可以包含向受试者施用血管生成抑制剂(诸如,例如,泊马度胺、来那度胺或阿普斯特)和糖皮质激素(诸如,例如,地塞米松、倍他米松、泼尼松龙、methodlprenisolone、曲安西龙或醋酸氟氢可的松)。
[0078]
在本文公开的待使用的所述nk细胞或nk细胞的所述用途的一些实施例中,所述nk细胞用于与抗癌剂联合施用,抗癌剂选自(i)靶向cd38的小分子、抗体、肽或蛋白质(例如,抗cd38抗体,包括但不限于达雷木单抗、艾萨妥昔单抗、mor202和/或tak-079)和/或(ii)血管生成抑制剂(例如,泊马度胺、来那度胺或阿普斯特)和类固醇(例如,糖皮质激素,包括但不限于地塞米松、倍他米松、泼尼松龙、甲泼尼龙、曲安西龙或醋酸氟氢可的松),和/或(iii)atra。
[0079]
在实施例中,抗癌剂是抗cd38抗体,诸如艾萨妥昔单抗或达雷木单抗。
[0080]
c.遗传修饰nk细胞的方法
[0081]
crispr/crispr相关(cas)蛋白9(cas9)技术最近已用于工程化免疫细胞,但用质粒对nk细胞进行遗传重编程一直具有挑战性,这是由于以dna依赖性方式进行转基因递送存在困难,如慢病毒和逆转录病毒转导导致大量程序相关的nk细胞凋亡和遗传工程化nk细胞的有限产生。本文描述了利用核酸内切酶核糖核蛋白复合物(例如,cas9/rnp)对原代和扩增的人nk细胞进行无dna基因组编辑以重编程(即,工程化或修饰)nk细胞的方法。
[0082]
核酸内切酶/rnp(例如,cas9/rnp)由三种组分组成,即与crispr基因座复合的重组核酸内切酶蛋白(例如,cas9核酸内切酶)。与crispr基因座复合的核酸内切酶可以被称为crispr/cas向导rna。crispr基因座包含合成的单向导rna(grna),其由可与靶序列复合的互补重复rna(crrna)和反式互补重复rna(tracrrna)杂交的rna组成。因此,crispr/cas向导rna与细胞基因组dna内的靶序列杂交。在一些情况下,2类crispr/cas核酸内切酶是ii型crispr/cas核酸内切酶。在一些情况下,2类crispr/cas核酸内切酶是cas9多肽,并且对应的crispr/cas向导rna是cas9向导rna。与外源dna依赖性方法相比,这些cas9/rnp能够以更高的效率切割基因组靶标,因为它们作为功能复合物递送。另外,cas9/rnp从细胞中的快速清除减少脱靶效应,诸如诱导凋亡。因此,在一个方面,本文公开了遗传修饰nk细胞的方法,其包含获得对nk细胞中的靶dna序列具特异性的向导rna(grna);以及b)将核糖核蛋白(rnp)复合物转导(例如,通过电穿孔引入)到靶nk细胞中,该核糖核蛋白复合物包含与相应crispr/cas向导rna复合的2类crispr/cas核酸内切酶9(cas9),该crispr/cas向导rna与nk细胞的基因组dna内的靶序列杂交。
[0083]
应当理解并本文预期,本文使用的核酸内切酶注意限于通常用于合成cas9的酿脓链球菌(spcas9)的cas9。在一个方面,cas9可以来自不同的细菌来源。cas9的取代也可用于增加靶向特异性,因此需要使用较少的grna。因此,例如,cas9可以衍生自金黄色葡萄球菌(staphylococcus aureus,sacas9)、氨基酸球菌属(acidaminococcus sp,ascpf1)、来自普雷沃氏菌属(prevotella)和弗朗西斯菌属(francisella)的成簇的规则间隔的短回文重复序列1(cpf1),其来源于毛螺菌属细菌(lachnospiracase bacterium,lbcpf1)、脑膜炎奈瑟氏菌(neisseria meningitidis,nmcas9)、嗜热链球菌(streptococcus thermophilus,stcas9)、空肠弯曲杆菌(campylobacter jejuni,cjcas9)、增强的spcas9(espcas9)、
spcas9-hf1、fokl融合的dcas9、扩增的cas9(xcas9)和/或催化死亡的cas9(dcas9)。另外,可以使用其它cas核酸内切酶代替cas9系统,例如casx、casy、cas14、cas4、csn2、cas13a、cas13b、cas13c、cas13d、c2c1或c2c3,或使用任何其它类型的工程化cas蛋白质,包括引物编辑。
[0084]
应当理解并本文预期,为了将cas9核酸酶活性靶向靶位点并且还切割供体质粒以允许供体转基因重组到宿主dna中,使用crispr rna(crrna)。在一些情况下,crrna与tracrrna组合以形成向导rna(grna)。所公开的质粒使用aav整合、蛋白磷酸酶1的内含子1、人染色体19上的调节亚基12c(ppp1r12c)基因(其称为aavs1)作为整合转基因的靶位点。该基因座是“安全港基因”并且允许在许多细胞类型中稳定、长期的转基因表达。由于ppp1r12c的破坏与任何已知的疾病无关,aavs1基因座通常被认为是转基因靶向的安全港。因为aavs1位点被用作靶位置,所以crspr rna(crrna)必须靶向所述dna。在本文中,所公开的质粒中使用的向导rna包含ggggccactagggacaggat(seq id no:2)或其任何10个核苷酸的有义或反义连续片段。尽管aavs1在本文中用于示例性目的,但应当理解并本文预期,其它“安全港基因”可以以等同的结果使用,并且如果更适合于被转染的特定细胞类型或转基因,可以替代aavs1。其它安全港基因的实例包括但不限于5型c-c趋化因子受体(ccr5)、rosa26基因座和trac。
[0085]
应当理解并本文预期,对递送至靶基因组的供体转基因构建体大小可能存在大小限制。增加转基因容许大小的一种方法是通过交换通常用于合成cas9或来自不同细菌来源的cas9的酿脓链球菌的cas9(spcas9)产生额外的空间。cas9的取代也可用于增加靶向特异性,因此需要使用较少的grna。因此,例如,cas9可以衍生自金黄色葡萄球菌(sacas9)、氨基酸球菌属(ascpf1)、毛螺菌属细菌(lbcpf1)、脑膜炎奈瑟氏菌(nmcas9)、嗜热链球菌(stcas9)、空肠弯曲杆菌(cjcas9)、增强的spcas9(espcas9)、spcas9-hf1、fokl融合的dcas9、扩增的cas9(xcas9)和/或催化死亡的cas9(dcas9)。
[0086]
应当理解并本文预期,特定cas9的使用可以改变cas9核酸内切酶(或替代)用于筛选靶标的pam序列。如本文所用,合适的pam序列包含ngg(spcas9 pam)、nngrrt(sacas9 pam)、nnnngatt(nmcas9 pam)、nnnnryac(cjcas9 pam)、nnagaaw(st)、tttv(lbcpf1 pam和ascpf1 pam);tycv(lbcpf1 pam变体和ascpf1 pam变体);其中n可以是任何核苷酸;v=a,c或g;y=c或t;w=a或t;且r=a或g。
[0087]
为了制备rnp复合物,crrna和tracrrna可以以1:1、2:1或1:2比率在约50μm和约500μm(例如,50、60、70、80、90、100、125、150、175、200、225、250、275、300、325、35、375、400、425、450、475或500μm)之间,优选地100μm和约300μm之间,最优选地约200μm的浓度,在95c下混合约5分钟,以形成crrna:tracrrna复合物(即向导rna)。然后可以将crrna:tracrrna复合物与约20μm和约50μm之间(例如21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50μm)的cas核酸内切酶(例如,cas9)的最终稀释液混合。
[0088]
一旦与靶细胞中的靶序列结合,crispr基因座可以通过向靶dna中引入一个或多个碱基对的插入或缺失、通过异源dna片段(例如,供体多核苷酸)的插入、通过内源dna片段的缺失、通过内源dna片段的倒位或易位或其组合来修饰基因组。因此,当与dna组合进行同源重组时,所公开的方法可用于生成敲除或敲入。本文显示,经由cas9/rnp的电穿孔进行转
导是一种简单且相对有效的方法,克服了以前在nk细胞中遗传修饰的限制。
[0089]
应当理解并本文预期,所公开的方法可用于任何细胞类型,包括自然杀伤细胞(nk细胞)、t细胞、b细胞、巨噬细胞、成纤维细胞、成骨细胞、肝细胞、神经元细胞、上皮细胞和/或肌细胞。人nk细胞是由cd56或cd16的表达和t细胞受体(cd3)的缺乏定义的外周血淋巴细胞亚群。nk细胞感知并杀死缺乏主要组织相容性复合物(mhc)-i类分子的靶细胞。nk细胞激活受体尤其包括天然细胞毒性受体(nkp30、nkp44和nkp46)和凝集素样受体nkg2d和dnam-1。它们的配体在应激的、转化的或感染的细胞上表达,但在正常细胞上不表达,使正常细胞对nk细胞杀伤具有抗性。在一个方面,靶细胞可以是来自供体来源(例如,用于过继转移疗法的同种异体供体来源或自体供体来源(即,修饰的nk细胞的最终接受者))、nk细胞系(包括但不限于nk rpmi8866;hfwt、k562和ebv-lcl),或衍生自原代nk细胞来源或nk细胞系的扩增nk细胞来源。
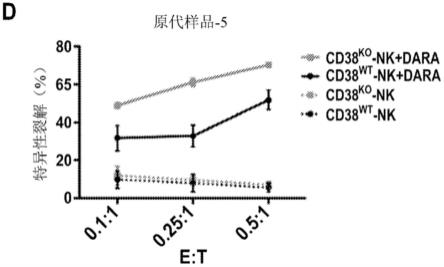
[0090]
在转导nk细胞之前,可以在适合于nk细胞增殖的培养基中孵育nk细胞。应当理解并本文预期,培养条件可以包含添加细胞因子、抗体和/或饲养细胞。因此,在一个方面,本文公开了遗传修饰nk细胞的方法,其进一步包含在支持nk细胞增殖的培养基中转导细胞之前将nk细胞孵育1、2、3、4、5、6、7、8、9、10、11、12、13或14天;其中培养基进一步包含细胞因子、抗体和/或饲养细胞。例如,培养基可以包含il-2、il-12、il-15、il-18和/或il-21。在一个方面,培养基还可以包含抗cd3抗体。在一个方面,可以从刺激nk细胞的饲养细胞中纯化饲养细胞。本文公开的用于要求保护的本发明的nk细胞刺激性饲养细胞可以是辐射的自体或同种异体外周血单核细胞(pbmc)或未经辐射的自体或pbmc;rpmi8866;hfwt、k562;用膜结合的il-15和41bbl或il-21或其任何组合转染的k562细胞;或ebv-lcl。在一些方面,nk细胞饲养细胞与il-21、il-15和/或41bbl的溶液组合提供。饲养细胞可以以1:2、1:1或2:1的比例接种在nk细胞培养物中。应当理解并本文预期,培养期可以是电穿孔后1至14天(即,1、2、3、4、5、6、7、8、9、10、11、12、13或14天),优选地3至7天,最优选地4至6天。
[0091]
应当理解并本文预期,原代nk细胞和扩增的nk细胞的孵育条件可以不同。在一个方面,在电穿孔之前培养原代nk细胞包含少于5天(例如1、2、3或4天)的培养基和细胞因子(例如,il-2、il-12、il-15、il-18和/或il-21)和/或抗cd3抗体。对于扩增的nk细胞,除了或代替细胞因子(例如,il-2、il-12、il-15、il-18和/或il-21)和/或抗cd3抗体,培养可以在nk饲养细胞(例如以1:1的比例)存在下进行。扩增的nk细胞的培养可以在转导之前进行1、2、3、4、5、6、7、8、9或10天。因此,在一个方面,本文公开了遗传修饰nk细胞的方法,其包含在电穿孔之前在il-2存在下孵育原代nk细胞4天,或在电穿孔之前在辐射的饲养细胞存在下孵育扩增的nk细胞4、5、6或7天。
[0092]
应当理解并本文预期,在所公开的方法中修饰nk细胞的转导方法是有限的。由于它们的免疫功能,nk细胞对病毒和细菌载体以及所述载体诱导的nk细胞凋亡具有抗性。因此,在本方法之前,对nk细胞的crispr/cas修饰是不成功的。为了规避病毒载体的问题,所公开的方法使用电穿孔转化靶nk细胞。电穿孔是一种向细胞施加电场以增加细胞膜渗透性的技术。电场的施加引起跨膜的电荷梯度,其吸引诸如核酸的带电分子穿过细胞膜。因此,在一个方面,本文公开了遗传修饰nk细胞的方法,其包含获得对nk细胞中的靶dna序列具特异性的向导rna(grna);以及b)通过电穿孔向靶nk细胞中引入核糖核蛋白(rnp)复合物,该核糖核蛋白复合物包含与相应crispr/cas向导rna复合的2类crispr/cas核酸内切酶
(cas9),该crispr/cas向导rna与nk细胞的基因组dna内的靶序列杂交。
[0093]
在nk细胞的转导(例如,电穿孔)后,现在修饰的nk细胞可以在包含刺激修饰的nk细胞的饲养细胞的培养基中增殖。因此,修饰的细胞保留了存活力和增殖潜力,因为它们能够在电穿孔后使用辐射的饲养细胞进行扩增。本文公开的用于要求保护的本发明的nk细胞刺激性饲养细胞可以是辐射的自体或同种异体外周血单核细胞(pbmc)或未经辐射的自体或pbmc;rpmi8866;hfwt、k562;用膜结合的il-15和41bbl或il-21或其任何组合转染的k562细胞;或ebv-lcl。在一些方面,nk细胞饲养细胞与il-21、il-15和/或41bbl的溶液组合提供。饲养细胞可以以1:2、1:1或2:1的比例接种在nk细胞培养物中。应当理解并本文预期,培养期可以是电穿孔后1至14天(即,1、2、3、4、5、6、7、8、9、10、11、12、13或14天),优选地3至7天,最优选地4至6天。在一些方面,用于培养修饰的nk细胞的培养基可以进一步包含细胞因子,例如il-2、il-12、il-15、il-18和/或il-21。
[0094]
在一个方面,应当理解并本文预期,所公开的遗传修饰nk细胞的方法的一个目标是产生修饰的nk细胞。因此,本文公开了通过所公开的方法制备的遗传修饰的nk细胞。例如,在另一方面,本文公开了包含如本文公开的编码分化簇38(cd38)的基因的敲除的遗传修饰的nk细胞,其用作药物,优选地用于治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移的方法。在另一方面,本文公开了包含如本文公开的编码分化簇38(cd38)的基因的敲除的遗传修饰的nk细胞,其用于(i)在有需要的受试者中增加氧化呼吸能力的方法或(ii)在有需要的受试者中限制细胞外nad水解和改善氧化还原呼吸能力的方法。以相同的方式,本文还公开了如本文公开的包含编码分化簇38(cd38)的基因的敲除的遗传修饰的nk细胞在制备药物中的用途,优选地在制备用于治疗、减轻、抑制、减少、改善和/或预防癌症和/或转移癌的药物中的用途。在另一方面,本文公开了包含如本文公开的编码分化簇38(cd38)的基因的敲除的遗传修饰的nk细胞在制备用于(i)在有需要的受试者中增加氧化呼吸能力或(ii)在有需要的受试者中限制细胞外nad水解和改善氧化还原呼吸能力的药物中的用途。
[0095]
如上所述,在接受抗cd38疗法(诸如达雷木单抗)以治疗癌症(如多发性骨髓瘤、白血病(包括但不限于急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all)或母细胞性浆细胞样树突细胞肿瘤(bpdcn))的受试者中,nk细胞的自相残杀是一个重大问题,因为nk细胞在其细胞表面表达高水平的cd38。因此,应当理解并本文预期,对治疗癌症有利的nk细胞的一种修饰是敲除cd38以产生在抗cd38治疗期间对nk细胞自相残杀不敏感的nk细胞群。这种修饰的细胞在可通过添加nk细胞治疗的任何疾病或病状的免疫疗法中非常有用。因此,在一个方面,本文公开了包含编码cd38的基因的敲除的遗传修饰的nk细胞。
[0096]
如本公开通篇所述,所公开的修饰的nk细胞理想地适用于免疫疗法,例如将修饰的(即,工程化的)nk细胞过继转移至有需要的受试者。因此,在一个方面,本文公开了将工程化的nk细胞过继转移至有需要的受试者的方法,所述方法包含:a)获得待修饰的靶nk细胞;b)获得对靶dna序列具特异性的grna;c)通过电穿孔向靶nk细胞中引入rnp复合物,该rnp复合物包含与相应crispr/cas grna复合的2类crispr/cas核酸内切酶(cas9),该crispr/cas grna与靶nk细胞的基因组dna内的靶序列杂交,产生工程化的nk细胞;以及d)将工程化的nk细胞转移到受试者中。
[0097]
在一个方面,在公开的免疫疗法方法中使用的修饰的nk细胞可以是来自供体来源
(例如,用于过继转移疗法的同种异体供体来源或自体供体来源(即,修饰的nk细胞的最终接受者)、nk细胞系(包括但不限于nk rpmi8866;hfwt、k562和ebv-lcl),或衍生自原代nk细胞来源或nk细胞系的扩增nk细胞来源。因为可以使用原代nk细胞,所以应当理解并本文预期所公开的对nk细胞的修饰可以离体或体外发生。
[0098]
在转导nk细胞后,可以扩增修饰的nk细胞并在将修饰的(即,工程化的)nk细胞施用于受试者之前进行刺激。例如,本文公开了将nk细胞过继转移至有需要的受试者的方法,其中在施用至受试者之前用辐射的表达mbil-21的饲养细胞扩增nk细胞。在一些方面,应当理解并本文预期,修饰的(即,工程化的)nk细胞的刺激和扩增可以在向受试者施用修饰的nk细胞之后或同时在体内发生。因此,本文公开了免疫疗法方法,其中在将nk细胞转移至受试者后,通过施用il-21或辐射的表达mbil-21的饲养细胞在受试者中扩增nk细胞。
[0099]
1.杂交/选择性杂交
[0100]
术语杂交通常是指至少两个核酸分子(诸如引物或探针)与基因之间的序列驱动相互作用。序列驱动的相互作用是指在两个核苷酸或核苷酸类似物或核苷酸衍生物之间以核苷酸特异性方式发生的相互作用。例如,与c相互作用的g或与t相互作用的a是序列驱动的相互作用。通常,序列驱动的相互作用发生在核苷酸的沃森-克里克面或胡斯坦面上。两种核酸的杂交受本领域技术人员已知的多种条件和参数的影响。例如,盐浓度、ph和反应温度都影响两个核酸分子是否杂交。
[0101]
两个核酸分子之间选择性杂交的参数是本领域技术人员熟知的。例如,在一些实施例中,选择性杂交条件可以定义为严格杂交条件。例如,杂交的严格性通过杂交和洗涤步骤之一或两者的温度和盐浓度来控制。例如,实现选择性杂交的杂交条件可以涉及在高离子强度溶液(6x ssc或6x sspe)中在比tm(一半分子从其杂交配偶体解离的解链温度)低约12至25℃的温度下杂交,随后在选择的温度和盐浓度的组合下洗涤,使得洗涤温度比tm低约5℃至20℃。温度和盐条件在初步实验中易于根据经验确定,其中固定在滤膜上的参照dna样品与标记的感兴趣的核酸杂交,然后在不同严格性条件下洗涤。对于dna-rna和rna-rna杂交,杂交温度通常更高。这些条件可以如上所述用于实现严格性,或者如本领域已知的。dna:dna杂交的优选严格杂交条件可以在约68℃下(在水溶液中)在6x ssc或6x sspe中,随后在68℃下洗涤。如果需要,杂交和洗涤的严格性可以随着所需互补性程度的降低而相应地降低,并且进一步地,取决于其中搜索变异性的任何区域的g-c或a-t丰富度。同样,如果需要,杂交和洗涤的严格性可以随着所需同源性的增加而相应地增加,并且进一步地,取决于其中需要高同源性的任何区域的g-c或a-t丰富度,所有这些都是本领域已知的。
[0102]
另一种定义选择性杂交的方法是观察一种核酸与另一种核酸结合的量(百分比)。例如,在一些实施例中,选择性杂交条件将是当至少约60%、65%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%的限制性核酸与非限制性核酸结合时。典型地,非限制性引物为例如10或100或1000倍过量。这种类型的测定可以在以下条件下进行,其中限制性和非限制性引物都是例如低于它们的k
d 10倍或100倍或1000倍,或其中仅一种核酸分子是它们的k
d 10倍或100倍或1000倍,或其中一种或两种核酸分子高于它们的kd。
[0103]
另一种定义选择性杂交的方法是观察在需要杂交以促进所需酶促操作的条件下
进行酶促操作的引物的百分比。例如,在一些实施例中,选择性杂交条件将是当至少约60%、65%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%的引物在促进酶促操作的条件下被酶促操作时,例如如果酶促操作是dna延伸,则选择性杂交条件将是当至少约60%、65%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%的引物分子被延伸时。优选的条件还包括制造商建议的或本领域指出的适于进行操作的酶的那些条件。
[0104]
正如同源性一样,可以理解,本文公开了多种方法用于确定两个核酸分子之间的杂交水平。应当理解,这些方法和条件可以提供两种核酸分子之间不同的杂交百分比,但除非另有说明,否则满足任何方法的参数将是足够的。例如,如果需要80%杂交,并且只要在这些方法的任一种中杂交发生在所需的参数内,则认为在本文中公开。
[0105]
应当理解,本领域技术人员应当理解,如果组合物或方法共同地或单独地满足用于测定杂交的这些标准中的任何一个,则它是本文公开的组合物或方法。
[0106]
2.核酸
[0107]
本文公开了多种基于核酸的分子,包括例如编码例如cd38的核酸,或本文公开的用于产生cd38敲除的任何核酸,或其片段,以及多种功能性核酸。所公开的核酸由例如核苷酸、核苷酸类似物或核苷酸替代物组成。本文讨论了这些和其它分子的非限制性实例。可以理解,例如,当载体在细胞中表达时,所表达的mrna通常由a、c、g和u组成。同样,可以理解,如果例如通过例如外源递送将反义分子引入细胞或细胞环境中,有利的是反义分子由减少反义分子在细胞环境中降解的核苷酸类似物组成。
[0108]
a)核苷酸和相关分子
[0109]
核苷酸是含有碱基部分、糖部分和磷酸部分的分子。核苷酸可以通过它们的磷酸部分和糖部分键合在一起,产生核苷间键。核苷酸的碱基部分可以是腺嘌呤-9-基(a)、胞嘧啶-1-基(c)、鸟嘌呤-9-基(g)、尿嘧啶-1-基(u)和胸腺嘧啶-1-基(t)。核苷酸的糖部分是核糖或脱氧核糖。核苷酸的磷酸部分是五价磷酸。核苷酸的非限制性实例是3'-amp(3'-腺苷单磷酸)或5'-gmp(5'-鸟苷单磷酸)。这些类型的分子有许多种可用于本领域和本文。
[0110]
核苷酸类似物是含有对碱基、糖或磷酸部分的一些类型的修饰的核苷酸。对核苷酸的修饰是本领域熟知的,包括例如5-甲基胞嘧啶(5-me-c)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤和2-氨基腺嘌呤以及糖或磷酸部分的修饰。这些类型的分子有许多种可用于本领域和本文。
[0111]
核苷酸替代物是具有与核苷酸类似的功能特性但不含有磷酸部分的分子,诸如肽核酸(pna)。核苷酸替代物是以沃森-克里克或胡斯坦方式识别核酸的分子,但其通过磷酸部分以外的部分连接在一起。当与合适的靶核酸相互作用时,核苷酸替代物能够符合双螺旋型结构。这些类型的分子有许多种可用于本领域和本文。
[0112]
还可以将其它类型的分子(缀合物)连接至核苷酸或核苷酸类似物以增强例如细胞摄取。缀合物可以与核苷酸或核苷酸类似物化学连接。这种缀合物包括但不限于脂质部分,诸如胆固醇部分。(letsinger等人,《美国国家科学院院刊(proc.natl.acad.sci.usa)》,1989,86,6553-6556)。这些类型的分子有许多种可用于本
领域和本文。
[0113]
沃森-克里克相互作用是与核苷酸、核苷酸类似物或核苷酸替代物的沃森-克里克面的至少一种相互作用。核苷酸、核苷酸类似物或核苷酸替代物的沃森-克里克面包括基于嘌呤的核苷酸、核苷酸类似物或核苷酸替代物的c2、n1和c6位置和基于嘧啶的核苷酸、核苷酸类似物或核苷酸替代物的c2、n3、c4位置。
[0114]
胡斯坦相互作用是在核苷酸或核苷酸类似物的胡斯坦面上发生的相互作用,其暴露在双链体dna的大沟中。胡斯坦面包括嘌呤核苷酸的n7位置和c6位置的反应基团(nh2或o)。
[0115]
b)序列
[0116]
存在与本文公开的信号传导途径中涉及的蛋白质分子(例如cd38)相关的多种序列,所有这些序列均由核酸编码或者是核酸。这些基因的人类似物的序列,以及这些基因的其它类似物和等位基因,以及剪接变体和其它类型的变体可在各种蛋白质和基因数据库中获得,包括基因库(genbank)。本领域技术人员理解如何解决序列差异和差别并将与特定序列相关的组合物和方法调整为其它相关序列。根据本文公开的和本领域已知的信息,可以为任何给定的序列设计引物和/或探针。
[0117]
c)引物和探针
[0118]
公开了包括引物和探针的组合物,其能够与公开的核酸(诸如本文公开的cd38等)相互作用。在某些实施例中,引物用于支持dna扩增反应。通常,引物能够以序列特异性方式延伸。引物以序列特异性方式的延伸包括任何方法,其中与引物杂交或以其它方式缔合的核酸分子的序列和/或组成指导或影响由引物延伸产生的产物的组成或序列。因此,引物以序列特异性方式的延伸包括但不限于pcr、dna测序、dna延伸、dna聚合、rna转录或逆转录。优选以序列特异性方式扩增引物的技术和条件。在某些实施例中,引物用于dna扩增反应,诸如pcr或直接测序。应当理解,在某些实施例中,也可以使用非酶技术延伸引物,其中例如,用于延伸引物的核苷酸或寡核苷酸被修饰,使得它们将化学反应以序列特异性方式延伸引物。通常,公开的引物与公开的核酸或核酸的区域杂交,或者它们与核酸的互补体或核酸的区域的互补体杂交。
[0119]
在某些实施例中,用于与核酸相互作用的引物或探针的大小可以是支持所需的引物酶促操作的任何大小,诸如dna扩增或探针或引物的简单杂交。典型的引物或探针将是至少6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、550、600、650、700、750、800、850、900、950、1000、1250、1500、1750、2000、2250、2500、2750、3000、3500或4000个核苷酸长。
[0120]
在其它实施例中,引物或探针可以小于或等于6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、125、150、175、200、225、250、275、300、325、350、375、400、
425、450、475、500、550、600、650、700、750、800、850、900、950、1000、1250、1500、1750、2000、2250、2500、2750、3000、3500或4000个核苷酸长。
[0121]
cd38基因的引物通常可用于产生含有cd38基因区域或完整基因的扩增dna产物。一般而言,通常产物的大小将使得该大小可以精确地确定为在3或2或1个核苷酸内。
[0122]
在某些实施例中,该产物为至少20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、550、600、650、700、750、800、850、900、950、1000、1250、1500、1750、2000、2250、2500、2750、3000、3500或4000个核苷酸长。
[0123]
在其它实施例中,该产物小于或等于20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、550、600、650、700、750、800、850、900、950、1000、1250、1500、1750、2000、2250、2500、2750、3000、3500或4000个核苷酸长。
[0124]
3.表达系统
[0125]
递送至细胞的核酸通常含有表达控制系统。例如,在病毒和逆转录病毒系统中插入的基因通常含有启动子和/或增强子,以帮助控制所需基因产物的表达。启动子通常是相对于转录起始位点在相对固定的位置起作用的dna序列。启动子含有rna聚合酶和转录因子的基本相互作用所需的核心元件,并且可以含有上游元件和应答元件。
[0126]
a)病毒启动子和增强子
[0127]
控制从哺乳动物宿主细胞中的载体转录的优选启动子可以从各种来源获得,例如病毒的基因组,如:多瘤病毒、猿猴病毒40(sv40)、腺病毒、逆转录病毒、乙型肝炎病毒,最优选地巨细胞病毒,或来自异源哺乳动物启动子,例如β肌动蛋白启动子。sv40病毒的早期和晚期启动子方便地以sv40限制性片段的形式获得,该片段还含有sv40病毒复制起点(fiers等人,《自然(nature)》,273:113(1978))。人巨细胞病毒的立即早期启动子方便地以hindiii e限制性片段的形式获得(greenway,p.j.等人,《基因(gene)》18:355-360(1982))。当然,来自宿主细胞或相关物种的启动子也可用于本发明。
[0128]
增强子通常是指在距转录起始位点不固定的距离处起作用的dna序列,并且可以是5'(laimins,l.等人,《美国国家科学院院刊(proc.natl.acad.sci.)》78:993(1981))或3'(lusky,m.l.等人,《分子细胞生物学(mol.cell bio.)》3:1108(1983))至转录单位。此外,增强子可以在内含子内(banerji,j.l.等人,《细胞(cell)》33:729(1983))以及在编码序列本身内(osborne,t.f.等人,《分子细胞生物学(mol.cell bio.)》4:1293(1984))。它们的长度通常在10和300bp之间,并且它们以顺式起作用。增强子的作用是增加附近启动子的转录。增强子也经常含有介导转录调节的应答元件。启动子还可以含有介导转录调节的应答元件。增强子通常决定基因表达的调节。虽然现在已知许多来自哺乳动物基因(球蛋白、弹性蛋白酶、白蛋白、胎蛋白和胰岛素)的增强子序列,但通常将使用来自真核细胞病毒的增强子进行一般表达。优选的实例是位于复制起点晚期侧的sv40增强子(bp 100-270)、巨
细胞病毒早期启动子增强子、位于复制起点晚期侧的多瘤病毒增强子和腺病毒增强子。
[0129]
启动子和/或增强子可以通过光或触发其功能的特定化学事件而被特异性激活。系统可以通过诸如四环素和地塞米松的试剂调节。还存在通过暴露于辐射(诸如γ辐射)或烷基化化疗药物来增强病毒载体基因表达的方法。
[0130]
在某些实施例中,启动子和/或增强子区域可作为组成型启动子和/或增强子,以使待转录的转录单位区域的表达最大化。在某些构建体中,启动子和/或增强子区域在所有真核细胞类型中具有活性,即使其在特定时间仅在特定类型的细胞中表达。这种类型的优选启动子是cmv启动子(650个碱基)。其它优选的启动子是sv40启动子、巨细胞病毒(全长启动子)和逆转录病毒载体ltr。
[0131]
已经表明,可以克隆所有特异性调节元件并用于构建在特定细胞类型如黑素瘤细胞中选择性表达的表达载体。神经胶质纤维乙酸蛋白(gfap)启动子已经用于在神经胶质来源的细胞中选择性表达基因。
[0132]
在真核宿主细胞(酵母、真菌、昆虫、植物、动物、人或有核细胞)中使用的表达载体还可以含有可能影响mrna表达的转录终止所需的序列。这些区域在编码组织因子蛋白的mrna的非翻译部分被转录为聚腺苷酸化片段。3'非翻译区域还包括转录终止位点。优选地,转录单位还含有聚腺苷酸化区域。这个区域的一个好处是它增加了转录单位像mrna一样被加工和转运的可能性。聚腺苷酸化信号在表达构建体中的鉴定和应用已得到很好的证实。优选地,在转基因构建体中使用同源的聚腺苷酸化信号。在某些转录单位中,聚腺苷酸化区域衍生自sv40早期聚腺苷酸化信号并由约400个碱基组成。还优选地,转录单位含有单独的或与上述序列组合的其它标准序列以提高构建体的表达或稳定性。
[0133]
b)标记
[0134]
病毒载体可以包括编码标记产物的核酸序列。这种标记产物用于确定基因是否已被递送到细胞中,并且一旦被递送就被表达。优选的标记基因是编码β-半乳糖苷酶的大肠杆菌(e.coli)lacz基因和绿色荧光蛋白。
[0135]
在一些实施例中,标记可以是可选择标记。适用于哺乳动物细胞的选择性标记的实例是二氢叶酸还原酶(dhfr)、胸苷激酶、新霉素、新霉素类似物g418、潮霉素和嘌呤霉素。当这种选择性标记成功转移到哺乳动物宿主细胞中时,如果置于选择性压力下,转化的哺乳动物宿主细胞可以存活。存在两种广泛使用的不同类别的选择性方案。第一类是基于细胞的代谢和缺乏独立于补充培养基生长能力的突变细胞系的使用。两个实例是:cho dhfr细胞和小鼠ltk细胞。这些细胞在不添加诸如胸苷或次黄嘌呤的营养物质的情况下缺乏生长的能力。因为这些细胞缺乏完整核苷酸合成途径所必需的某些基因,它们不能存活,除非在补充培养基中提供缺失的核苷酸。补充培养基的另一种方法是将完整的dhfr或tk基因导入缺乏各自基因的细胞中,从而改变它们的生长要求。未用dhfr或tk基因转化的单个细胞不能在未补充的培养基中存活。
[0136]
第二类是显性选择,其指在任何细胞类型中使用的选择方案并且不需要使用突变细胞系。这些方案通常使用药物来阻止宿主细胞的生长。具有新基因的那些细胞将表达输送药物抗性的蛋白质并将在选择中存活。这种显性选择的实例使用药物新霉素(southern p.和berg,p,《分子遗传学应用杂志(j.molec.appl.genet.)》1:327(1982))、霉酚酸,(mulligan,r.c.和berg,p.《科学(science)》209:1422(1980))或潮霉素,(sugden,b.等人,
《分子细胞生物学(mol.cell.biol.)》5:410-413(1985))。这三个实例使用真核控制下的细菌基因以分别传递对适当药物g418或新霉素(遗传霉素)、xgpt(霉酚酸)或潮霉素的抗性。其它包括新霉素类似物g418和嘌呤霉素。
[0137]
4.肽
[0138]
a)蛋白质变体
[0139]
蛋白质变体和衍生物是本领域技术人员熟知的,并且可以包括氨基酸序列修饰。例如,氨基酸序列修饰通常属于以下三类中的一种或多种:取代、插入或缺失变体。插入包括氨基和/或羧基末端融合以及单个或多个氨基酸残基的序列内插入。插入通常是比氨基或羧基末端融合更小的插入,例如大约一至四个残基。免疫原性融合蛋白衍生物,如实例中描述的那些,是通过融合足够大的多肽以通过体外交联或通过用编码融合蛋白的dna转化的重组细胞培养物赋予靶序列免疫原性来制备的。缺失的特征在于从蛋白质序列中去除一个或多个氨基酸残基。通常,在蛋白质分子内的任何一个位点缺失不超过约2至6个残基。这些变体通常通过对编码蛋白质的dna中的核苷酸进行位点特异性诱变来制备,从而产生编码变体的dna,然后在重组细胞培养物中表达该dna。在具有已知序列的dna中的预定位点产生取代突变的技术是众所周知的,例如m13引物诱变和pcr诱变。氨基酸取代通常为单个残基,但可以同时在多个不同位置发生;插入通常为约1至10个氨基酸残基;缺失的范围约为1至30个残基。优选地,以相邻对进行缺失或插入,即缺失2个残基或插入2个残基。取代、缺失、插入或其任何组合可以组合以得到最终的构建体。突变不得将序列置于阅读框之外,并且优选地不产生可能产生二级mrna结构的互补区域。取代变体是其中至少一个残基已被去除且在其位置插入不同残基的那些变体。这种取代通常根据下表1和2进行,称为保守取代。
[0140]
表1:氨基酸缩写
[0141][0142]
表2:氨基酸取代
[0143]
原始残基的示例性保守取代,其它是本领域已知的。
[0144][0145][0146]
通过选择比表2中的取代保守性更低的取代,即选择在其对维持(a)取代区域中多肽主链的结构(例如薄片或螺旋构象),(b)靶位点处分子的电荷或疏水性,或(c)侧链的大
小的影响方面差异更显著的残基,可以使功能或免疫同一性发生实质性变化。通常预期在蛋白质性质中产生最大变化的取代将是其中(a)亲水性残基(例如丝氨酰或苏氨酰)取代疏水性残基(例如亮氨酰、异亮氨酰、苯丙氨酰、缬氨酰或丙氨酰)(或被其取代);(b)半胱氨酸或脯氨酸取代任何其它残基(或被其取代);(c)具有正电性侧链的残基(例如赖氨酰、精氨酰或组氨酰)取代负电性残基(例如谷氨酰或天冬氨酰)(或被其取代);或(d)具有大侧链的残基(例如苯丙氨酸)取代不具有侧链的残基(例如甘氨酸)(或被其取代)的取代,在这种情况下,(e)通过增加用于硫酸化和/或糖基化的位点的数目。
[0147]
例如,将一个氨基酸残基替换为另一个生物学和/或化学上相似的氨基酸残基是本领域技术人员已知的保守替换。例如,保守取代将一个疏水性残基取代另一个疏水性残基,或一个极性残基取代另一个极性残基。取代包括组合,例如gly,ala;val,ile,leu;asp,glu;asn,gln;ser,thr;lys,arg;和phe,tyr。每个明确公开的序列的这种保守替代变体包括在本文提供的嵌合多肽中。
[0148]
取代或缺失诱变可用于插入n-糖基化(asn-x-thr/ser)或o-糖基化(ser或thr)的位点。半胱氨酸或其它不稳定残基的缺失也是需要的。潜在的蛋白水解位点(例如arg)的缺失或取代例如通过缺失一个碱性残基或用谷氨酰胺酰或组氨酰残基取代一个来完成。
[0149]
某些翻译后衍生化是重组宿主细胞对表达的多肽的作用的结果。谷氨酰胺酰和天冬酰胺酰残基通常在翻译后脱酰胺化为相应的谷氨酰基和天冬氨酰基残基。替代地,这些残基在温和酸性条件下脱酰胺。其它翻译后修饰包括脯氨酸和赖氨酸的羟基化、丝氨酰或苏氨酰残基的羟基的磷酸化、赖氨酸、精氨酸和组氨酸侧链的邻氨基的甲基化(t.e.creighton,《蛋白质:结构和分子性质(proteins:structure and molecular properties)》,旧金山w.h.freeman&co.出版社,第79至86页[1983])、n-末端胺的乙酰化和,在一些情况下,c-末端羧基的酰胺化。
[0150]
应当理解,定义本文公开的蛋白质的变体和衍生物的一种方式是通过根据与特定已知序列的同源性/同一性定义变体和衍生物。具体公开的是本文公开的这些和其它蛋白质的变体,其与所述序列具有至少70%或75%或80%或85%或90%或95%的同源性。本领域技术人员容易理解如何确定两种蛋白质的同源性。例如,可以在比对两个序列后计算同源性,使得同源性处于其最高水平。
[0151]
计算同源性的另一种方法可以通过公开的算法来进行。用于比较的序列的最佳比对可以通过smith和waterman在《应用数学进展(adv.appl.math.)》2:482(1981)中的局部同源性算法、通过needleman和wunsch在《分子生物学杂志(j.mol biol.)》48:443(1970)中的同源比对算法、通过pearson和lipman在《美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)》85:2444(1988)中的搜索相似方法、通过这些算法的计算机化实现(威斯康星遗传学软件包(wisconsin genetics software package)中的gap、bestfit、fasta和tfasta,遗传学计算机组、575science dr,威斯康星州麦迪逊),或通过检查进行。
[0152]
可以通过例如zuker,m.《科学》244:48-52,1989,jaeger等人《美国国家科学院院刊(proc.natl.acad.sci.usa)》86:7706-7710,1989、jaeger等人《酶学方法(methods enzymol.)》183:281-306,1989公开的算法获得核酸的相同类型的同源性。
[0153]
应当理解,保守突变和同源性的描述可以以任何组合结合在一起,例如与特定序
列具有至少70%同源性的实施例,其中变体是保守突变。
[0154]
当本说明书讨论各种蛋白质和蛋白质序列时,应当理解也公开了可以编码这些蛋白质序列的核酸。这将包括与特定蛋白质序列相关的所有简并序列,即具有编码一种特定蛋白质序列的序列的所有核酸以及编码所公开的蛋白质序列的变体和衍生物的所有核酸,包括简并核酸。因此,虽然本文中可能没有写出每个特定的核酸序列,但是应当理解,实际上本文通过公开的蛋白质序列公开和描述了每个序列。还应当理解,尽管没有氨基酸序列表明在生物体内编码该蛋白质的特定dna序列,其中本文公开了所公开蛋白质的特定变体,但编码该蛋白质的已知核酸序列也是已知的,并且在本文中公开和描述。
[0155]
应当理解,有许多氨基酸和肽类似物可以掺入所公开的组合物中。例如,存在许多d氨基酸或具有与表1和表2中所示的氨基酸不同的功能性取代基的氨基酸。公开了天然存在的肽的相反立体异构体,以及肽类似物的立体异构体。这些氨基酸可以容易地通过用选择的氨基酸和工程化遗传构建体加载trna分子而掺入多肽链中,遗传构建体利用例如琥珀密码子以位点特异性方式将类似物氨基酸插入肽链中。
[0156]
可以产生类似肽但不通过天然肽键连接的分子。例如,氨基酸或氨基酸类似物的键可以包括ch2nh
‑‑
、
‑‑
ch2s
‑‑
、
‑‑
ch2‑‑
ch2‑‑
、
‑‑
ch=ch
‑‑
(顺式和反式)、
‑‑
coch2‑‑
、
‑‑
ch(oh)ch2‑‑
和
‑‑
chh2so—(这些和其它可以在spatola,a.f.在《氨基酸、肽和蛋白质的化学和生物化学(chemistry and biochemistry of amino acids,peptides,and proteins)》,b.weinstein编辑,marcel dekker,纽约,第267页(1983);spatola,a.f,《vega data》(1983年3月),第1卷,第3期,肽骨架修饰(综述);morley,《药理学趋势(trends pharm sci)》(1980)第463至468页;hudson,d.等人,《国际多肽研究和治疗学杂志(int j pept prot res)》14:177-185(1979)(
‑‑
ch2nh
‑‑
、ch2ch2‑‑
);spatola等人《生命科学(life sci)》38:1243-1249(1986)(
‑‑
ch h2‑‑
s);hann《化学普尔金反应杂志(j.chem.soc perkin trans.)》i 307-314(1982)(
‑‑
ch
‑‑
ch
‑‑
,顺式和反式);almquist等人《药物化学杂志(j.med.chem.)》23:1392-1398(1980)(
‑‑
coch2‑‑
);jennings-white等人《四面体快报(tetrahedron lett)》23:2533(1982)(
‑‑
coch2‑‑
);szelke等人欧洲申请,ep 45665ca(1982):97:39405(1982)(
‑‑
ch(oh)ch2‑‑
);holladay等人《四面体快报》24:4401-4404(1983)(
‑‑
c(oh)ch2‑‑
);和hruby《生命科学》31:189-199(1982)(
‑‑
ch2‑‑s‑‑
)中找到;其各自通过引用并入本文。特别优选的非肽键是
‑‑
ch2nh
‑‑
。应当理解,肽类似物可以在键原子之间具有多于一个原子,如b-丙氨酸、g-氨基丁酸等。
[0157]
氨基酸类似物和类似物以及肽类似物通常具有增强的或期望的性质,如更经济的生产、更大的化学稳定性、增强的药理学性质(半衰期、吸收、效力、功效等)、改变的特异性(例如,广谱的生物活性)、降低的抗原性等。
[0158]
d-氨基酸可用于生成更稳定的肽,因为d-氨基酸不被肽酶等识别。用相同类型的d-氨基酸(例如,d-赖氨酸代替l-赖氨酸)系统性地取代共有序列的一个或多个氨基酸可用于生成更稳定的肽。半胱氨酸残基可用于将两个或更多个肽环化或连接在一起。这有利于将肽限制为特定的构象。
[0159]
5.药物载体/药物产品的递送
[0160]
如上所述,组合物还可以在药学上可接受的载体中体内施用。“药学上可接受的”意指不是生物学上或其它方面不期望的材料,即,所述材料可以与核酸或载体一起施用于
受试者,而不引起任何不期望的生物学效应或以有害的方式与包含它的药物组合物的任何其它组分相互作用。如本领域技术人员所熟知的,载体将被自然地选择来最小化活性成分的任何降解并且最小化受试者中的任何不良副作用。
[0161]
组合物可以口服、肠胃外(例如,静脉内)、通过肌内注射、通过腹膜内注射、透皮、体外、局部等施用,包含局部鼻内施用或通过吸入剂施用。如本文所使用的,“局部鼻内施用”意指组合物通过鼻孔中的一个或两个递送到鼻和鼻道中,并且可以包括通过喷雾机制或液滴机制或通过核酸或载体的气雾化的递送。通过吸入剂施用组合物可以是经由喷雾或液滴机制的递送通过鼻或口。递送还可以通过插管法直接到呼吸系统的任何区域(例如肺)。根据受试者的物种、年龄、体重和一般状况,所治疗的过敏性病症的严重程度,使用的特定核酸或载体,其施用方式等,所需组合物的确切量将随受试者而变化。因此,不可能为每种组合物指定确切的量。然而,在本文给出教导的前提下,本领域普通技术人员仅使用常规实验便可以确定适当的量。
[0162]
组合物的肠胃外施用(如果使用的话)通常通过注射来表征。可以以常规形式(作为液体溶液或悬浮液的形式、适于在注射前溶解或悬浮于液体中的固体形式或作为乳剂的形式)制备注射剂。用于肠胃外施用的最近修订的方法涉及使用缓释或持续释放系统,使得维持恒定的剂量。参见例如,美国专利第3,610,795号,所述美国专利通过引用并入本文。
[0163]
这些材料可以在溶液、悬浮液中(例如,结合到微粒、脂质体或细胞中)。这些材料可以通过抗体、受体或受体配体靶向特定的细胞类型。以下参考文献是使用该技术将特定蛋白靶向肿瘤组织的实例(senter等人,《生物共轭化学(bioconjugate chem.)》,2:447-451,(1991);bagshawe,k.d,《英国癌症杂志(br.j.cancer)》,60:275-281,(1989);bagshawe等人,《英国癌症杂志》58:700-703,(1988);singer等人,《生物共轭化学》,4:3-9,(1993);battelli等人,《癌症免疫学与免疫治疗(cancer immunol.immunother.)》,35:421-425,(1992);pietersz和mckenzie,《免疫学评论(immunolog.reviews)》,129:57-80,(1992);和roffler等人,《生化药理学杂志(biochem.pharmacol)》,42:2062-2065,(1991))。载体如“隐形”和其它抗体缀合的脂质体(包括脂质介导的靶向结肠癌的药物)、通过细胞特异性配体的dna的受体介导的靶向、淋巴细胞定向的肿瘤靶向和体内鼠神经胶质瘤细胞的高度特异性治疗性逆转录病毒靶向。以下参考文献是使用该技术将特定蛋白靶向肿瘤组织的实例(hughes等人,《癌症研究(cancer research)》,49:6214-6220,(1989);和litzinger和huang,《生物化学与生物物理学报(biochimica et biophysica acta)》,1104:179-187,(1992))。通常,受体涉及组成型或配体诱导的内吞作用的途径。这些受体聚集在网格蛋白涂覆的凹坑中,通过网格蛋白涂覆的囊泡进入细胞,穿过其中对受体进行分类的酸化的内体,并且然后循环到细胞表面,变成在细胞内储存,或在溶酶体中降解。内化途径具有多种功能,如营养吸收、活化蛋白的去除、大分子的清除、病毒和毒素的机会性进入、配体的解离和降解以及受体水平调控。根据细胞类型、受体浓度、配体类型、配体价和配体浓度,许多受体遵循超过一种细胞内途径。已经综述了受体介导的胞吞作用的分子和细胞机制(brown和greene,《dna与细胞生物学(dna and cell biology)》10:6,399-409(1991))。
[0164]
应当理解并本文预期,所公开的修饰的nk细胞和修饰的nk细胞的过继转移方法可以是针对癌症的有效免疫疗法。所公开的方法和组合物可用于治疗、抑制、减少和/或预防
其中发生不受控制的细胞增殖的任何疾病,诸如癌症。不同类型的癌症的非限制性列表如下:淋巴瘤(霍奇金和非霍奇金)、白血病、癌、实体组织癌、鳞状细胞癌、腺癌、肉瘤、神经胶质瘤、高级神经胶质瘤、母细胞瘤、成神经细胞瘤、浆细胞瘤、组织细胞瘤、黑素瘤、腺瘤、缺氧性肿瘤、骨髓瘤、aids相关淋巴瘤或肉瘤、转移性癌症或一般癌症。所公开的组合物可用于治疗的癌症的代表性但非限制性列表如下:淋巴瘤、b细胞淋巴瘤、t细胞淋巴瘤、蕈样真菌病、霍奇金病、髓样白血病(包括但不限于aml)、t细胞急性成淋巴细胞性白血病(t-all)、膀胱癌、脑癌、神经系统癌症、头颈癌、头颈部鳞状细胞癌、肺癌(诸如小细胞肺癌和非小细胞肺癌)、成神经细胞瘤/成胶质细胞瘤、卵巢癌、皮肤癌、bpdcn、多发性骨髓瘤、肝癌、黑素瘤、口腔、咽喉、喉和肺的鳞状细胞癌、宫颈癌症、宫颈癌、乳腺癌,以及上皮癌、肾癌、泌尿生殖道癌、肺癌、食道癌、头颈癌、大肠癌、造血系统癌;睾丸癌;结肠癌、直肠癌、前列腺癌或胰腺癌。因此,在一个方面,本文公开了治疗、减轻、抑制、减少、改善和/或预防受试者中的癌症和/或转移(例如,多发性骨髓瘤、白血病(包括但不限于急性髓性白血病(aml)、t细胞急性成淋巴细胞性白血病(t-all)或母细胞性浆细胞样树突细胞肿瘤(bpdcn))或转移的方法,其包含向受试者施用已被修饰以包含cd38基因敲除的nk细胞。在一些方面,该方法可以进一步包含向受试者施用靶向cd38的药剂(诸如,例如,抗cd38,包括但不限于达雷木单抗、艾萨妥昔单抗、tak-079和mor202)。另外,该方法还可以包含向受试者施用血管生成抑制剂(诸如,例如,泊马度胺、来那度胺或阿普斯特)和糖皮质激素(诸如,例如,地塞米松、倍他米松、泼尼松龙、methodlprenisolone、曲安西龙或醋酸氟氢可的松)和/或atra。
[0165]
如本文所述,所公开的修饰的nk细胞(例如,本文公开的cd38敲除的nk细胞,包括但不限于通过本文公开的方法制备的cd38敲除的nk细胞)可用于其中对受试者施用抗cd38疗法可能或已经导致nk细胞自相残杀的治疗中。因此,在一个方面,本文还公开了在接受抗cd38免疫疗法的受试者中减少nk细胞自相残杀的方法,其包含向受试者施用本文公开的任何遗传修饰的nk细胞(包括本文公开的cd38敲除的nk细胞)。在一个方面,抗cd38免疫疗法可以包含向受试者施用抗cd38抗体,包括但不限于达雷木单抗、艾萨妥昔单抗、tak-079和/或mor202。
[0166]
d.实例
[0167]
提出以下实例以便向本领域的普通技术人员提供关于如何制备和评估本文所要求保护的化合物、组合物、制品、装置和/或方法的完整公开内容和描述,并且旨在单纯地是示例性的并不旨在限制本公开。已经做出努力来确保关于数字(例如,量、温度等)的准确性,但应考虑一些误差和偏差。除非另有说明,份为重量份,温度以℃表示或为环境温度,压力为大气压或接近大气压。
[0168]
1.实例1:生成cd38-ko nk细胞以克服自相残杀并增强adcc
[0169]
自然杀伤细胞在通过抗cd38单克隆抗体达雷木单抗(dara)靶向表达cd38的多发性骨髓瘤(mm)中起重要作用。为了克服dara疗法中nk细胞的自相残杀,使用cas9/rnp生成敲除的nk细胞。具体地,grna测序使用cas9/rnp靶向cd38进行缺失。靶向以下序列(在cd38起始密码子附近的外显子1处)的grna由集成dna技术公司(integrated dna technologies)商业生产:5'
–
ctgaactcgcagttggccat
–
3'(seq id no:1)
[0170]
nk细胞用cas9/rnp电穿孔并扩增14天。所产生的基因缺失超过90%有效,将nk细胞中的cd38表达从对照nk细胞中的87%降低到cd38缺失的nk细胞中的7%,而不使用任何
方法对ko群体进行阳性选择(图1)。测试nk细胞对达雷木单抗介导的自相残杀的敏感性。未修饰的对照nk细胞对自相残杀表现出77%的敏感性(生存力从64%降低至14.6%)。相比之下,cd38-ko nk细胞对自相残杀仅表现出11%的敏感性(生存力从55.8%降低至49.9%)(图2)。
[0171]
接下来,测试nk细胞针对多发性骨髓瘤的改善的抗体依赖性细胞毒性(adcc)。当在3种不同靶细胞和3种e:t比率中进行测量时,与野生型对照相比,cd38-ko nk细胞将其adcc增加37.9%(中位数,p=0.004),并将最终存活的癌细胞群减少22.3%(中位数,p=0.004)(图3)。各个结果如图4至6所示。
[0172]
2.实例2:引入。
[0173]
多发性骨髓瘤(mm)的特征在于骨髓(bm)中恶性浆细胞的克隆性积累。尽管引入自体干细胞移植和如蛋白酶体抑制剂(pi——硼替佐米/卡非佐米)等新型药剂以及免疫调节性imid药物(来那度胺/泊马度胺)显著改善了mm患者的存活率,但实际上所有患者均会复发,然后预后差,中位总存活期仅为13个月。
[0174]
最近,靶向cd38的单克隆抗体,达雷木单抗(dara)和艾萨妥昔单抗已对mm患者的管理产生显著影响。美国食品药品监督管理局(fda)批准dara用于新诊断和复发/难治性m患者。dara通过几种机制杀死靶细胞:补体依赖性细胞毒性(cdc)、抗体依赖性细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp),通过cd38在靶细胞上的交联诱导的凋亡,以及通过消除cd38
免疫抑制细胞的免疫调节作用。尽管所有这些作用都涉及抗肿瘤活性,但仍不清楚哪种机制在mm患者中观察到的临床反应中起主要作用。
[0175]
尽管dara具有公认的临床益处,但大多数患者最终会经历疾病复发并继续死于mm。正在进行当前的研究和临床努力以揭示对dara的抗性机制并开发联合疗法以加深/增强反应。临床证据表明,imid与dara协同作用并导致更好的疾病控制。这可能部分是由于激活了介导dara介导的adcc的自然杀伤(nk)细胞,以及imid通过cereblon介导的ikaros/aiolos降解诱导mm细胞上调cd38。
[0176]
另外的证据表明,靶细胞上的cd38表达水平与对dara的敏感性相关。具有较高cd38表达水平的mm细胞优先地被dara杀死,而残留的mm细胞在用dara治疗期间表现出较低的cd38表达水平。因为cd38的转录直接由视黄酸(ra)通过存在于cd38基因内含子i中的ra应答元件控制,所以全反式视黄酸(atra)上调包括mm细胞在内的多种造血细胞上的cd38表达。另外,atra下调补体抑制蛋白(cd55和cd59)的表达并与dara协同杀死靶mm细胞。目前正在一项将atra与dara联合用于mm患者的临床试验中测试该策略(nct02751255)。
[0177]
对dara的次优反应的另一推定机制是在用dara治疗后患者中nk细胞的快速耗竭,因为nk细胞也表达相对高水平的cd38。这种循环nk细胞的减少在停止治疗后持续3至6个月,导致针对mm细胞的无效adcc。nk细胞的过继转移可以是克服这种机制的策略。在临床前模型中,补充离体扩增的nk细胞导致dara在控制疾病负荷方面的显著但适度的改善,因为这些nk细胞也经受dara介导的消除。克服dara介导的消除的一种方法是缺失nk(cd38
ko nk)细胞中的cd38。尽管nk细胞的基因编辑由于其dna感应机制和相关的凋亡而具有挑战性,但是可以使用具有cas9核糖核蛋白复合物(cas9/rnp)的无dna方法实现原代nk细胞中的有效基因缺失。
[0178]
在此,通过在体外和体内评估缀合和自相残杀以及针对mm细胞的adcc来探索nk细
胞中cd38缺失对于dara免疫疗法的生物学后果。最后,研究了cd38作为调节烟酰胺腺嘌呤二核苷酸(nad
)水平对nk细胞代谢和转录的胞外酶的作用。
[0179]
3.实例3:材料和方法。
[0180]
nk细胞的纯化和扩增。外周血nk细胞分离自健康供体。将纯化的nk细胞(cd3-/cd56
)使用辐射的膜结合的il-21(mbil21)/表达4-1bbl的k562(cstx002)以2:1的比率刺激,并在aim-v/icsr扩增培养基(cts
tm
aimv
tm
sfm/cts
tm
免疫细胞sr,赛默飞世尔科技(thermo fisher scientific))和50iu人重组il-2(ril-2)(诺华公司(novartis))中生长7天。刺激后既没有检测到cd3
、cd19
,也没有检测到cd33
细胞(图7)。在扩增的第六天进行电穿孔之前,将一半培养基更换。
[0181]
多发性骨髓瘤细胞。mm细胞系h929、mm.1s和u266购自美国典型培养物保藏中心(american type culture collection)。opm-2和kms-11细胞系从德国微生物和细胞培养物保藏中心(german collection of microorganisms and cell cultures)获得。根据irb批准的方案和美国约翰霍普金斯大学(johns hopkins university)的书面同意,从新诊断或复发的mm患者收集原代mm细胞。患者信息见表1。cd138
mm细胞纯化和细胞培养先前已发表。使用ficoll-paquetm plus(瑞典通用电气健康护理生物科学股份公司(ge healthcare bio-sciences ab,sweden))通过密度梯度离心从新鲜bm抽吸物中分离单核细胞。根据制造商的说明书(加利福尼亚州奥本的美天旎生物技术公司(miltenyi biotec,auburn,ca))通过磁珠和柱选择cd138
mm细胞。所有mm细胞系和原代mm细胞在补充有10%热灭活fbs(弗吉尼亚州马纳萨斯的康宁公司(corning,manassas,va))、2mm l-谷氨酰胺(纽约格兰德艾兰的gibco(gibco,grand island,ny))、100单位/ml青霉素和100μg/ml链霉素(纽约格兰德艾兰的gibco)的rpmi 1640培养基(英国的gibco)中培养。
[0182]
表1
[0183][0184]
小鼠。nod.cg-prkdc
scid
il2rg
tm1wjl
/szj(nsg)小鼠购自杰克逊实验室(the jackson laboratory),并且在特定无病原体条件下饲养。根据我们由美国约翰霍普金斯大学的动物研究委员会批准的动物方案,将六至十周龄雄性nsg小鼠用于实验。
[0185]
免疫分型。nk细胞和mm细胞用荧光团缀合的抗体染色。抗体列表如表2所示。洗涤细胞并使用lsr ii流式细胞仪(becton dickinson biosciences)和flowjo软件(俄勒冈州阿什兰的tree star公司)通过流式细胞术分析。
[0186]
表2
[0187]
品牌反应性姓名克隆格式bd人cd3sk7fitcbd pharmingen人cd163g8pebd pharmingen人cd163g8alexa fluor 647bd pharmingen人cd19sj25c1apc-cy7bd horizon人cd33wm53bv421bd人cd38hb7pebiolegend人cd38hb7apcbiolegend人cd38hit2生物素bd pharmingen人cd56b159alexa fluor 647bd pharmingen人cd138mi15pebd pharmingen人cd45hi30apcbd horizon人cd45hi30bv421bd pharmingen小鼠cd4530-f11fitc
[0188]
crispr修饰细胞的生成。为了生成cd38
ko
和cd16
ko nk细胞,我们使用了crisprrna(crrna)(5-ctgaactcgcagttggccat;seq id no:1)靶向cd38基因的外显子1
34
和crrna(5-aaagagacttggtacccagg;seq id no:3)靶向cd16a基因的外显子5。先前已经描述了生成cas9/rnp复合物。为了生成cd38
ko
和cd16
ko nk细胞,我们使用了crisprrna(crrna)(5-ctgaactcgcagttggccat;seq id no:1)靶向cd38基因的外显子1和crrna(5-aaagagacttggtacccagg;seq id no:4)靶向cd16a基因的外显子5。先前已经描述了生成cas9/rnp复合物。简言之,预转录的crispr-cas9crrna和crispr-cas9 tracrrna(目录号1072532)购自idt(爱荷华州珊瑚村的集成dna技术公司(integrated dna technologies,inc,coralville,iowa))。通过将总体积为10μl的crrna和tracrrna各200μm一起在无核酸酶的idte,ph 7.5(1x te溶液,目录号11-01-02-02)中在95℃孵育5分钟来制备向导rna(grna)。通过孵育2μl的s.p.形成cas9/rnp复合物。将总体积为5μl的hifi cas9核酸酶v3蛋白(122pmol)(目录号1081060)、2μl的grna(400pmol)和1μl的pbs在室温下放置15至20分钟。第7天,将扩增的nk细胞重悬于20μl的p3原代细胞4d-核转染剂tm x溶液和5μl的cas9/rnp复合物和1μl的100μm的cas9电穿孔增强剂(目录号1075915)中,并使用具有脉冲en-138的lonza 4d-核转染剂体系进行电穿孔。野生型nk(cd38wt nk)细胞在没有cas9/rnp复合物的情况下电穿孔。电穿孔后,将nk细胞在补充有50iu的ril-2的aim-v/icsr生长培养基中静置2天,然后使用流式细胞术评估crispr修饰的效率。然后用cstx002扩增细胞。通过用生物素化的抗cd38抗体(biolegend)标记,随后用抗生物素微珠(加利福尼亚州奥本的美天旎生物技术公司)标记并在ld柱(加利福尼亚州奥本的美天旎生物技术公司)上去除残留的cd38 nk细胞。
[0189]
鉴定cd38靶向的cas9/rnp的脱靶效应。全基因组测序用于鉴定靶向cd38的cas9/rnp的脱靶效应。从cd38
wt
和cd38
ko nk细胞中使用dneasy血液和组织试剂盒(德国凯杰(qiagen),目录号/id:69504)分离基因组dna(gdna)。使用nebnext ultra ii-fs dna文库制备试剂盒(马萨诸塞州ipswhich的新英格兰生物实验室)构建dna文库。将样品酶促片段化、5
′
磷酸化、da-尾化,并用独特的双索引衔接子方法连接以防止样品错误分配和解决索引跳跃(爱荷华州的集成dna技术公司)。接头连接的dna通过限制循环pcr扩增并使用基于磁珠的方法纯化。在tapestation高灵敏度d1000screentape(安捷伦生物技术(agilent biotechonologies))上分析文库质量,并通过kapa qpcr(kapa生物系统)进行定量。在illumina hiseq4000平台上,以2x 150bp的读段长度对文库进行测序,深度约为覆盖范围的30倍。
[0190]
鉴定cd38靶向的cas9/rnp的脱靶效应。全基因组测序用于鉴定靶向cd38的cas9/rnp的脱靶效应。从cd38
wt
和cd38
ko nk细胞中使用dneasy血液和组织试剂盒(德国凯杰(qiagen),目录号/id:69504)分离基因组dna(gdna)。使用nebnext ultra ii-fs dna文库制备试剂盒(马萨诸塞州ipswhich的新英格兰生物实验室)构建dna文库。将样品酶促片段化、5
′
磷酸化、da-尾化,并用独特的双索引衔接子方法连接以防止样品错误分配和解决索引跳跃(爱荷华州的集成dna技术公司)。接头连接的dna通过限制循环pcr扩增并使用基于磁珠的方法纯化。在tapestation高灵敏度d1000screentape(安捷伦生物技术(agilent biotechonologies))上分析文库质量,并通过kapa qpcr(kapa生物系统)进行定量。在illumina hiseq4000平台上,以2x 150bp的读段长度对文库进行测序,深度约为覆盖范围的30倍。
[0191]
nk功能测定。如先前公开和如上详述进行nk细胞缀合测定。为了定量自相残杀,cd38
wt
和cd38
ko nk细胞各自用10μg/ml的dara或溶剂对照处理4或24小时,然后用po-pro
tm-1染料(俄勒网州尤金的英杰公司(invitrogen,eugene,oregon))和7-氨基放线菌素d(7-aad)(俄勒网州尤金的英杰公司)
25
染色。如补充方法中详述进行基于流动的杀伤测定。简言之,将cd38
wt
或cd38
ko nk细胞与cfse-标记的靶mm细胞在10μg/ml的dara或作为对照的溶剂存在下共培养4或24小时。
[0192]
将人nk细胞过继转移到nsg小鼠中。将来自相同个体供体的离体扩增的cd38
wt
和cd38
ko nk细胞解冻并用辐射的cstx002再刺激一周。将来自各组的107个nk细胞悬浮于hank平衡盐溶液(纽约格兰德艾兰的gibco)中并通过尾静脉输注至nsg小鼠中,nsg小鼠在同一天用dara(8mg/kg)或溶剂对照腹膜内预处理。每隔一天向小鼠腹膜内提供ril-2(50,000iu)。收集每只小鼠中的外周血(7天后)和脾和bm(9天后)并分析nk细胞的持久性。还计算了来自2根股骨的脾和bm中人nk细胞的绝对数。
[0193]
rna测序和ingenuity通路分析。使用nebnext ultra ii定向rna文库制备试剂盒,按照制造商的建议(马萨诸塞州ipswhich的新英格兰生物实验室)制备链特异性rna-seq文库。总之,使用rna 6000nano试剂盒在agilent 2100生物分析仪(安捷伦生物技术)上评估从相同供体(n=6)cd38
wt
和cd38
ko nk细胞分离的总rna(总共12个样品)质量,并使用qubit rna hs测定试剂盒(美国生命技术公司(life technologies))测量浓度。使用基于neb的人/小鼠/大鼠rnase-h的耗竭试剂盒(新英格兰生物实验室)耗竭40至500ng等份的总rna。去除rrna后,将mrna片段化,然后用随机六聚体引物用于第一和第二链cdna合成。双链cdna
片段进行末端修复和双独特接头(集成dna技术公司)的α-尾化和连接。接头连接的cdna通过限制循环pcr扩增并使用基于磁珠的方法纯化。在tapestation高灵敏度d1000 screentape(安捷伦生物技术(agilent biotechonologies))上分析文库质量,并通过kapa qpcr(kapa生物系统)进行定量。在illumina hiseq 4000平台上以2x 150bp读段长度汇集文库并测序,以生成每个样品约6000至8000万个配对末端读段。我们接下来使用标准化的rna-seq数据,并在输入到ingenuity通路分析(ipa)之前通过消除至少一个样品中在大于或等于10fpm下不表达的基因进行过滤。差异表达基因(deg)被鉴定为其中cd38
wt
和cd38
ko nk细胞之间的基因表达水平的配对双侧t检验产生小于0.05的p值的基因。将deg的p值截止值调整为0.01或0.1,或将最小基因表达截止值调整为5fpm,不会对结论产生定性影响。cd38
wt
和cd38
ko nk细胞中每种基因的平均变化倍数近似等于所报道通路中平均值的变化倍数,因此对于这些结论,个体间效应(来自相同供体的cd38
wt
和cd38
ko nk细胞)可被认为是可忽略的。执行了ipa中核心分析的所有默认设置。我们不能在dara存在的情况下研究cd38
wt
和cd38
ko nk细胞的转录组图样,因为cd38
wt nk细胞被dara诱导的自相残杀杀死。
[0194]
差异表达基因(deg)被鉴定为其中cd38
wt
和cd38
ko nk细胞之间的基因表达水平的配对双侧t检验产生小于0.05的p值的基因。将deg的p值截止值调整为0.01或0.1,或将最小基因表达截止值调整为5fpm,不会对结论产生定性影响。cd38
wt
和cd38
ko nk细胞中每种基因的平均变化倍数近似等于所报道通路中平均值的变化倍数,因此对于这些结论,个体间效应(来自相同供体的cd38
wt
和cd38
ko
nk细胞)可被认为是可忽略的。执行了ipa中核心分析的所有默认设置。我们不能在dara存在的情况下研究cd38
wt
和cd38
ko nk细胞的转录组图样,因为cd38
wt nk细胞被dara诱导的自相残杀杀死。
[0195]
代谢测定。为了测量耗氧速率(ocr)和细胞外酸化速率(ecar),我们在seahorse xfe24(安捷伦科技公司)上使用安捷伦细胞外通量测定试剂盒(安捷伦科技公司)。将扩增的cd38
wt
和cd38
ko nk细胞在xf rpmi中孵育1至2小时,然后在37℃下在非co2培养箱中测量。培养基补充有10 μm的葡萄糖和2μm的左旋谷氨酰胺,无酚红,ph为7.35至7.4。在基础条件下分析ocr、氧化磷酸化(oxphos)的量度和ecar,随后向细胞培养物中添加1μm的寡霉素、1.5μm的fccp和0.5μm的鱼藤酮和抗霉素a。
[0196]
缀合测定、自相残杀测定和基于流动的细胞毒性测定。如burshtyn等人所述,对nk细胞缀合测定进行了微小的修改。简而言之,将每种nk细胞的2
×
106个细胞(1
×
107个细胞/ml)用5μm的绿色染料cfda se(cfse)细胞示踪剂(俄勒冈州尤金的英杰公司)在37℃下染色15分钟或5μm的红色染料pkh26(密苏里州圣路易斯的西格玛奥德里奇(sigma-aldrich,st.louis,mo))在室温下染色5分钟。通过向细胞悬浮液中添加完全培养基来终止染色。用完全培养基洗涤细胞两次。将绿色和红色标记的nk细胞以1:1的比例在补充有10μg/ml的dara或溶剂对照(盐水)的200μl总体积中混合,并在37℃下在5%的co2培养箱中共培养4小时。然后轻轻收集细胞并用200μl的4%甲醛固定,并使用流式细胞术分析20,000个细胞的缀合。
[0197]
为了定量自相残杀,cd38
wt
和cd38
ko nk细胞各自用10μg/ml的dara或溶剂对照处理4或24小时,然后用po-pro
tm-1染料(俄勒冈州尤金的英杰公司)和7-氨基放线菌素d(7-aad)(俄勒冈州尤金的英杰公司)染色。使用珠(becton dickinson biosciences)基于频率或绝对数评估活nk细胞(po-pro
tm-1阴性/7-aad阴性)。
[0198]
为了评估adcc,mm细胞系或纯化的原代cd138
mm细胞用5μm的cfse标记,并与cd38
wt
或cd38
ko nk细胞以指定的效应子—靶(e:t)比率在平底96孔板(美国falcon)中在作为对照
38
的10μg/ml的dara或溶剂存在下共同培养。由于dara抗性原代样品的低频率(cd38
阴性/低
),我们没有纯化这些细胞,并且mm细胞被定义为cd138
cd45-细胞。4小时后对mm细胞系和24小时后对原代样品分析靶细胞的存活力。在一些实验中,骨髓瘤细胞系在4小时细胞毒性测定之前用50nm的atra预处理2天。为了研究atra对总体dara介导的nk细胞细胞毒性的影响,将mm细胞和nk细胞在dara和50nm的atra存在下共培养48小时。从总cfse阳性细胞中7-aad阴性/cfse阳性细胞的百分比或绝对数或使用珠评估活靶细胞。由在不存在效应细胞和dara的情况下孵育的靶细胞确定背景。根据下式计算dara介导的adcc的百分比(%):(1-在具有dara的效应细胞存在下活靶细胞的百分比或绝对数/具有溶剂对照的相应样品的百分比或绝对数)
×
100。所有测定用2或3个独立供体一式三份进行。
[0199]
统计分析。使用graphpad prism 8(graphpad软件公司)进行统计分析。使用学生t检验比较两个独立的组。将三组或更多组与单因素anova检验进行比较,然后与杜克的多重比较检验进行比较。p《0.05被认为表示统计学显著性。
[0200]
4.实例4:结果。
[0201]
在nk细胞中使用cas9/rnp的有效基因靶向。使用cas9/rnp方法,从健康供体的离体扩增的外周血nk(pb-nk)细胞成功生成cd38
ko
nk细胞(图8a)。流式细胞分析显示cd38敲除效率为81.9
±
6.9%(n=5,平均值
±
sd,图8b)。使用磁性分离,将nk细胞纯化至超过99%的cd38
ko
以用于进一步实验(图8c)。cd38
wt
和cd38
ko nk细胞显示出相似的扩增速率,并且cd38
ko nk细胞的纯度在随后的培养后得以保持(图8d)。在cd38
wt
和cd38
ko nk细胞之间的cd16表达的水平中没有观察到差异(图7b)。
[0202]
cas9/rnp在nk细胞中的低脱靶效应。高保真cas9(hifi-cas9)由于其在电穿孔后快速降解而显示具有低脱靶编辑。为了研究crispr修饰的nk细胞中的脱靶效应,进行了全基因组测序(wgs),并且发现了具有cd38
ko nk细胞独有的snp和indel的26个基因。因为突变局限于编码区,所以所有基因具有中等或高潜在影响的突变。snpeff将18个基因分类为中度影响(错义和非移码)的突变,八个基因(包括cd38)分类为高度影响(起始损失、终止增益和移码)的突变(表3)。通过rna-seq,在nk细胞中仅有四个具有可能的高度影响突变的脱靶基因以有意义的水平表达(cc2d1b、dennd4b、kmt2c和wdr89,图9)。这些结果显示这种grna对于nk细胞中cd38靶向的效率和特异性。
[0203]
表3.
[0204]
[0205]
[0206]
[0207][0208]
cd38
ko nk细胞对dara诱导的自相残杀的抗性。dara通过交联cd38和cd16经由nk间adcc诱导nk细胞自相残杀。为了研究cd38
ko nk细胞是否对dara诱导的自相残杀有抗性,评估了配对的cd38
wt
和cd38
ko nk细胞的缀合和生存力。dara增加cd38
wt nk细胞缀合物的形成,但不影响cd38
ko nk细胞缀合物的形成(图10a至10b)。与该结果一致,dara诱导cd38
wt nk细胞的adcc依赖性凋亡,而cd38
ko nk细胞在与dara孵育的整个过程中保持它们的生存力(图10c至10d)。类似地,用dara处理后nk细胞中cd16的缺失也保持了它们的生存力。另外,在不存在nk细胞和补体的情况下没有观察到dara介导的裂解(图11b)。这些结果表明,cd16和cd38对于dara诱导的自相残杀是必需和足够的,并且nk细胞中cd38的缺失使得它们对dara诱导的自相残杀具有抗性。
[0209]
接下来,为了研究cd38
ko nk细胞对dara的抗性是否也有助于体内的优异持久性,将cd38
wt
或cd38
ko nk细胞融合到用dara处理的nsg小鼠中并且检查pb、脾和bm中的nk细胞频率。cd38
wt
或cd38
ko nk细胞在对照小鼠中显示出相当的植入(图10e至10f)。相比之下,用dara治疗显著减少了cd38
wt nk细胞的植入,但对cd38
ko nk细胞的持久性没有影响(图10e至10f)。cd38
wt nk细胞在脾和bm以及外周血中被dara耗竭,而cd38
ko nk细胞在对照和dara处理的小鼠之间的这些区室的任一个中没有显示出显著的耗竭(图10f)。总之,这些结果表明cd38
ko
细胞在体外和体内对dara具有抗性。
[0210]
cd38
ko nk细胞针对mm细胞的优异的dara介导的adcc。因为dara诱导的nk细胞耗竭可以减弱针对靶细胞的细胞依赖性细胞毒性,所以cd38
ko nk细胞也可以比cd38
wt nk细胞更有效地杀死靶细胞。为了研究这一点,在存在或不存在dara的情况下,针对具有高、低或无cd38表达水平的不同mm细胞系,测试配对的cd38
wt
和cd38
ko nk细胞的细胞毒性(图12a)。cd38
wt
和cd38
ko nk细胞对每种mm细胞系的直接细胞毒性是等同的,然而在dara存在下,cd38
ko nk细胞对cd38
靶细胞表现出显著更高的细胞毒性(图12b),表明cd38
ko nk细胞的
adcc更高(图12c)。cd38
wt
和cd38
ko nk细胞都不表现出针对cd38-细胞系u266的adcc。cd38
wt nk细胞对具有低水平cd38表达的mm细胞(如opm-2和kms-11)表现出边缘或无adcc,而cd38
ko nk细胞对这些mm细胞系表现出显著更强的adcc。与细胞系的结果相似,cd38
ko nk细胞对原代mm样品显示更高的dara介导的adcc活性(图12d至12e),包括对来自dara抗性病例的原代cd38
低
mm细胞的改善的细胞毒性(图12f和18)。进一步研究了cd38
ko nk与cd38
wt nk相比的cd38表达与改善的adcc之间的关系(图13),并发现统计学显著的负相关(r=-0.786,p=0.048)。总之,该结果表明cd38
ko nk细胞可以改善dara抗复发性和难治性mm的功效,否则由于低cd38表达而具有dara抗性(图18)。
[0211]
atra对nk细胞细胞毒性的抑制作用。mm细胞上cd38的下调被认为在发展对dara的抗性中起重要作用。用atra治疗可以通过上调cd38
低
靶细胞上的cd38水平来克服这种抗性。为了研究上调mm细胞上的cd38和缺失nk细胞上的cd38的协同作用,在用dara和nk细胞评估adcc之前用atra预处理mm细胞。经证实,用atra预处理上调了mm靶细胞上的cd38水平(图14),并且表明在cd38
wt
和配对的cd38
ko nk细胞存在下,其改善了dara介导的adcc(图15a至15b)。然后,使用在巩固治疗期间接受atra治疗的急性早幼粒细胞白血病(apl)患者的pb-nk检查atra对nk细胞上的cd38表达的体内直接作用。与治疗前获得的样品相比,用atra治疗与这些患者的pb-nk上cd38的显著上调相关(图15c)。类似地,用atra进行的离体处理上调cd38
wt
上的cd38水平,但不上调配对的cd38
ko nk细胞上的cd38水平(图15d)。另外,atra还增强cd38
wt nk细胞的自相残杀(图15e)。与用atra预处理mm细胞相反,用atra同时处理mm和nk细胞显著削弱了dara介导的cd38
wt nk细胞的adcc,但对dara介导的cd38
ko nk细胞的adcc没有影响(图15f)。atra显著降低cd38
wt
和配对的cd38
ko nk细胞的直接细胞毒性至相同程度(图15f)。因此,atra诱导的mm靶细胞上cd38的上调可能被增加的nk细胞自相残杀和受损的nk细胞功能抵消,从而降低dara的总体功效,这可以通过使用cd38
ko nk细胞来缓解(图15g)。
[0212]
cd38
ko nk细胞中更高的oxphos活性。cd38是一种46-kda ii型跨膜糖蛋白并且已经显示具有多种功能,包括作为nad
水解酶的外酶活性以调节细胞内nad
水平。因为nad
是有助于atp产生的酶催化反应的必需辅因子,所以cd38在细胞代谢中起重要作用。最近的一项研究报道,t细胞中的cd38敲除导致更高水平的细胞内nad
,其促进oxphos和atp合成,并因此导致更高的针对癌症的细胞毒性。类似于t细胞,代谢定型在肿瘤环境中nk细胞的细胞毒性和存活中起着至关重要的作用。研究了cd38敲除对nk细胞代谢的影响。首先,对野生型和cd38
ko nk细胞进行rna-seq,鉴定deg,并使用ipa鉴定来自deg的差异调节途径。ipa在cd38
ko nk细胞中显示出胆固醇生物合成(p《0.00001)和oxphos(p《0.00001)途径的显著变化。对这些途径中的基因进行的分析发现,cd38
ko nk细胞中与atp合成、nad再循环和电子转运特别相关的线粒体基因表达有适度但显著的增加(表1、图16a和17)。主要组分分析显示,在基线时存在显著的供体依赖性变化,但在所有供体对中响应于cd38缺失的一致方向变化,除了已经在基线处的谱的远端处的10号供体(图16b)。考虑到这些代谢途径中基因的上调,研究了cd38
ko nk细胞的细胞代谢。使用线粒体应激试验测定,观察到更高的ocr和相当的ecar,导致与cd38
wt nk细胞相比,cd38
ko nk细胞中显著更高的ocr/ecar比率(图16c、16d、16e、16f和16d)。该结果表明,cd38的缺失诱导nk细胞优先使用oxphos以实现它们的生物能需求。重要的是,与cd38
wt nk细胞相比,cd38
ko nk细胞还具有更高的备用呼吸能力
(src)和线粒体呼吸能力(图16d)。这些有利的代谢转变与cd38
ko nk细胞的dara介导的细胞毒性增强相一致。
[0213]
表1.通过ipa鉴定的与显著改变的代谢途径相关的deg的变化倍数和p值。
[0214][0215][0216]
使用dara治疗复发/难治性mm患者是有效的。然而,尽管被纳入前期治疗方案中并且被接受为治疗mm的护理标准,但是越来越清楚,疾病复发是不可避免的。mm细胞对用dara治疗的抗性机制开始阐明。这些机制中的一些与先前提出的对imid或pi的抗性机制重叠,如肿瘤异质性和骨髓微环境的作用,但其它机制对于单克隆抗体疗法可能是独特的。
[0217]
单克隆抗体通过四种机制消除靶标:cdc、adcc、adcp和通过受体交联的激活诱导的细胞死亡。因此,通过抑制这些机制而产生抗性机制。例如,dara抗性与mm细胞表面上的补体抑制蛋白(cd55和cd59)的过表达相关,从而损害dara介导的cdc。关于adcc,独特的情况发生在dara,其中表达高水平cd38的nk细胞在治疗期间被清除,从而削弱dara介导的adcc。通过过继转移离体扩增的nk细胞来拯救dara介导的adcc在使用cd38
低
nk细胞的临床前模型中是成功的。然而,这些cd38
低
nk细胞在离体扩增期间重新获得cd38表达,并因此重新获得对dara介导的清除的敏感性,从而使得临床翻译不太可能。另外,患有多发性骨髓瘤的患者——特别是接受dara治疗的那些患者——具有相对低数量的免疫细胞,包括nk细胞。因此,我们将我们的研究集中于同种异体nk细胞,其中第三方通用供体策略将允许选择具有期望kir基因型或fcgr3a多态性的供体以获得最佳nk细胞功能。
[0218]
在此,使用crispr/cas9系统生成cd38
ko nk细胞。这些细胞对dara诱导的缀合和自相残杀具有抗性,并且在dara存在下在体内持续存在。当与配对的cd38
wt
细胞相比时,cd38
ko nk细胞对mm细胞系和原代样品表现出更高的adcc活性。cd38
ko nk细胞对具有低cd38表达的mm细胞系和来自在dara治疗期间复发的患者的mm细胞特别有效,而cd38
wt nk细胞对那些靶细胞具有最小活性甚至无活性。考虑到在接受dara治疗期间对低cd38表达的mm细胞的选择性压力,cd38
ko nk细胞可以增强dara针对这种残留疾病的治疗效果。
[0219]
nk细胞上cd38的缺失与这些细胞的增加的线粒体呼吸能力和有利于oxphos代谢和胆固醇合成的补偿性转录组图样相关。尽管没有直接研究这种代谢转变在cd38
ko nk细胞的效应子功能中的作用,但是先前的研究显示敲除t细胞中的cd38会导致更高的oxphos活
性和抗肿瘤作用。
[0220]
抗原密度是单克隆抗体的靶标识别和效应子功能中的重要因素,并且因此靶细胞上cd38水平的上调具有增强dara活性的潜力。最近,imid和dara之间的临床协同作用已部分归因于imid对mm细胞上的cd38的上调。atra也显示上调mm细胞上的cd38水平并使其对dara介导的cdc和adcc敏感。与具有已知有利的免疫调节特性的imid相反,关于atra对nk细胞的adcc活性的影响知之甚少。在此,证实了接受atra治疗上调mm细胞上的cd38水平,但也显示其上调apl患者的离体扩增的nk细胞和体内循环的nk细胞上的cd38。这种对nk细胞的调节作用可以在体内增强dara诱导的自相残杀并削弱dara介导的针对mm细胞的adcc。尽管cd38
ko nk细胞没有自相残杀,但atra能显著抑制cd38
wt
和cd38
ko nk细胞的直接细胞毒性。因此,atra介导的mm细胞上cd38水平的上调被其对nk细胞功能的负面影响抵消。总而言之,接受atra治疗的净结果是cd38
wt nk细胞的dara介导的adcc活性整体受损,而使用cd38
ko nk细胞拯救atra对adcc的负面影响。
[0221]
值得一提的是,接受atra治疗可以通过降低mm细胞上的cd55和cd59表达来增强dara介导的cdc。尽管大多数用于临床开发的单克隆抗体是基于它们的cdc活性来选择的,但尚不清楚四种作用机制中的哪一种在临床环境中起最重要的作用。区分这些机制的临床前模型一直很困难,因为单独的dara在根除鼠异种移植物中的mm中的高功效,使得离体扩增的nk细胞的添加比单独的dara具有相对小的益处。cd38
lo mm患者来源的异种移植物的开发可用于dara和nk细胞组合的药代动力学建模和比较cd38
ko
和cd38
wt nk细胞。当前的临床试验(nct02751255)测试对mm患者的atra和dara的联合治疗使用独特的治疗方案,提供了这些药物的短暂和交错暴露。dara药代动力学在治疗期间相对恒定,并且atra水平由复杂的全身和组织依赖性反馈机制严格调节。除了使用这种组合的临床结果之外,理解这种治疗方案对nk细胞数目、功能和dara介导的adcc和cdc的影响也很有意义。另外,已经表明抗kir抗体增强达拉雷木单抗介导的原代骨髓瘤细胞的裂解。研究kir功能/基因型和fcrgiiia多态性对cd38
ko
和cd38
wt nk细胞的adcc活性的影响是未来研究的重要领域,也是将这些发现转化为临床研究的必要步骤。
[0222]
这项研究提供了cd38
ko nk细胞可以增强dara对mm细胞的作用的概念的证据。使用cas9/rnp的新开发的无dna方法成功地有效生成cd38
ko nk细胞,如通过wgs评估的,具有非常低的脱靶效应频率。
[0223]
本文还将方法应用于扩增遗传修饰的nk细胞,这对于获得临床上有意义的数量是至关重要的。总之,这些结果证明了离体扩增的cd38
ko nk细胞与dara联合用于针对mm的过继免疫疗法的合理性和可行性,以及潜在的其它cd38
血液恶性肿瘤,如急性髓性白血病,以及b和t细胞淋巴母细胞白血病和淋巴瘤。另外,nk细胞中cd38缺失的方法可用于生成cd38嵌合抗原受体-nk细胞,以避免它们在细胞制造过程中的自相残杀和体内有效的抗肿瘤活性。
[0224]
5.实例5:使用艾萨妥昔单抗的联合治疗
[0225]
认识到nk cd38
ko nk细胞用于过继免疫疗法与dara联合抗mm的功效,除dara之外的其它抗cd38免疫疗法,如艾萨妥昔单抗可用于治疗癌症。
[0226]
cd38
ko nk细胞对艾萨妥昔单抗诱导的自相残杀的抗性。与dara类似,艾萨妥昔单抗通过交联cd38和cd16经由nk间adcc诱导nk细胞自相残杀。为了研究cd38
ko nk细胞是否对
imids for patients with daratumumab-refractory multiple myeloma can overcome refractoriness to both agents)》《血液》2018;131(4):464-467。
[0254]
guo y,feng k,tong c等人《双特异性cd19/cd22 car t细胞治疗失败后,抗cd38car t细胞在患有复发性b-all的成人患者中的功效和副作用(efficiency and side effects of anti-cd38 car t cells in an adult patient with relapsed b-all after failure of bi-specific cd19/cd22 car t cell treatment)》《细胞与分子免疫学杂志(cell mol immunol.)》2020。
[0255]
guven,h.等人《通过逆转录病毒转导将基因有效转移到原代人自然杀伤细胞中(efficient gene transfer into primary human natural killer cells by retroviral transduction)》《实验血液学(exp hematol.)》33(11),1320-1328,doi:10.1016/j.exphem.2005.07.006,(2005)。
[0256]
hari p,raj rv,olteanu h.《难治性结外自然杀伤细胞-t细胞淋巴瘤中的靶向cd38(targeting cd38 in refractory extranodal natural killer cell-t-cell lymphoma)》《新英格兰医学杂志(n engl j med.)》2016;375(15):1501-1502。
[0257]
howard m,grimaldi jc,bazan jf等人《由cd38淋巴细胞抗原催化的环状adp-核糖的形成和水解(formation and hydrolysis of cyclic adp-ribose catalyzed by lymphocyte antigen cd38)》《科学(science.)》1993;262(5136):1056-1059。
[0258]
hu y,turner mj,shields j等人《阿仑单抗在人cd52转基因小鼠模型中的作用机制的研究(investigation of the mechanism of action of alemtuzumab in a human cd52transgenic mouse model)》《免疫学(immunology.)》2009;128(2):260-270。
[0259]
hu y,wang h,wang q,deng h.《cd38的过表达降低细胞nad水平并改变参与能量代谢和抗氧化剂防御的蛋白质的表达(overexpression of cd38 decreases cellular nad levels and alters the expression of proteins involved in energy metabolism and antioxidant defense)》《蛋白质组研究杂志(j proteome res.)》2014;13(2):786-795。
[0260]
kararoudi mn,likhite s,elmas e,schwartz m,meyer k,lee da.《使用同源重组和aav递送的crispaint在原代人自然杀伤细胞中的高效定点基因插入(highly efficient site-directed gene insertion in primary human natural killer cells using homologous recombination and crispaint delivered by aav)》《biorxiv.》2019:743377。
[0261]
kelly bj,fitch jr,hu y等人《churchill:在临床和群体规模基因组学中发现人类遗传变异的超快速、确定性、高度可扩展和平衡的平行化策略(churchill:an ultra-fast,deterministic,highly scalable and balanced parallelization strategy for the discovery of human genetic variation in clinical and population-scale genomics)》《基因组生物学(genome biol.)》2015;16:6。
[0262]
kim,s,kim,d,cho,s.w,kim,j.&kim,j.s.《通过递送纯化的cas9核糖核蛋白在人细胞中高效的rna引导的基因组编辑(highly efficient rna-guided genome editing in human cells via delivery of purified cas9 ribonucleoproteins)》《基因组研究(genome res.)》24(6),1012-1019,doi:10.1101/gr.171322.113,(2014)。
[0263]
kishimoto h,hoshino s,ohori m等人《视黄酸对人cd38基因表达的分子机制(molecular mechanism of human cd38 gene expression by retinoic acid)》《第一内含子中视黄酸应答元件的鉴定(identification of retinoic acid response element in the first intron)》《生物化学杂志(j biol chem.)》1998;273(25):15429-15434。
[0264]
krejcik j,casneuf t,nijhof is等人《达雷木单抗耗竭cd38 免疫调节细胞、促进t细胞扩增,并歪曲多发性骨髓瘤中的t细胞库(daratumumab depletes cd38 immune regulatory cells,promotes t-cell expansion,and skews t-cell repertoire in multiple myeloma)》《血液》2016;128(3):384-394。
[0265]
krejcik j,frerichs ka,nijhof is等人《单核细胞和粒细胞降低用达雷木单抗治疗的患者中骨髓瘤细胞上的cd38表达水平(monocytes and granulocytes reduce cd38expression levels on myeloma cells in patients treated with daratumumab)》《临床癌症研究(clin cancer res.)》2017;23(24):7498-7511。
[0266]
kumar sk,dimopoulos ma,kastritis e等人《对免疫调节药物和蛋白酶体抑制剂难治的复发性骨髓瘤的自然史:多中心imwg研究(natural history of relapsed myeloma,refractory to immunomodulatory drugs and proteasome inhibitors:a multicenter imwg study)》《白血病(leukemia.)》2017;31(11):2443-2448。
[0267]
laubach j,garderet l,mahindra a等人《复发性多发性骨髓瘤的治疗:国际骨髓瘤工作组的建议(management of relapsed multiple myeloma:recommendations of the international myeloma working group)》《白血病(leukemia.)》2016;30(5):1005-1017。
[0268]
lee,d.a,verneris,m.r.和campana,d.《用于过继免疫疗法的人nk细胞的获得、制备和功能评估(acquisition,preparation,and functional assessment of human nk cells for adoptive immunotherapy)》《分子生物学计算方法(methods mol biol.)》651 61-77,doi:10.1007/978-1-60761-786-0_4,(2010)。
[0269]
leone rd,emens la.《用于癌症免疫治疗的靶向腺苷(targeting adenosine for cancer immunotherapy)》《癌症免疫治疗杂志(j immunother cancer.)》2018;6(1):57。
[0270]
leung-hagesteijn c,erdmann n,cheung g等人《xbp1s——阴性肿瘤b细胞和前成浆细胞在多发性骨髓瘤中介导治疗性蛋白酶体抑制剂抗性(xbp1s-negative tumor b cells and pre-plasmablasts mediate therapeutic proteasome inhibitor resistance in multiple myeloma)》《癌细胞(cancer cell.)》2013;24(3):289-304。
[0271]
li a,he m,wang h等人《全反式视黄酸负向调节自然杀伤细胞系92的细胞毒活性(all-trans retinoic acid negatively regulates cytotoxic activities of nature killer cell line 92)》《生物化学与生物物理研究通讯(biochem biophys res commun.)》2007;352(1):42-47。
[0272]
liang,x.等人《通过cas9蛋白转染的快速和高效的哺乳动物细胞工程(rapid and highly efficient mammalian cell engineering via cas9 protein transfection)》《生物技术杂志(j biotechnol.)》208 44-53,doi:10.1016/j.jbiotec.2015.04.024,(2015)。
[0273]
liang,z.等人《使用crispr/cas9核糖核蛋白复合物对面包小麦进行有效的无dna基因组编辑(efficient dna-free genome editing of bread wheat using crispr/
cas9ribonucleoprotein complexes)》《自然通讯(nat commun.)》8 14261,doi:10.1038/ncomms14261,(2017)。
[0274]
liu j,zhao yj,li wh等人《iii型人cd38与cib1的胞质相互作用调节细胞环状adp-核糖水平(cytosolic interaction of type iii human cd38 with cib1 modulates cellular cyclic adp-ribose levels)》《美国国家科学院院刊(proc natl acad sci u s a.)》2017。
[0275]
maloney dg,grillo-lopez aj,white ca等人《idec-c2b8(利妥昔单抗)抗cd20单克隆抗体治疗复发性低度非霍奇金淋巴瘤(idec-c2b8(rituximab)anti-cd20monoclonal antibody therapy in patients with relapsed low-grade non-hodgkin'slymphoma)》《血液》1997;90(6):2188-2195。
[0276]
martin t,baz r,benson dm等人《艾萨妥昔单抗加来那度胺和地塞米松治疗复发性/难治性多发性骨髓瘤的1b期研究(a phase 1b study of isatuximab plus lenalidomide and dexamethasone for relapsed/refractory multiple myeloma)》《血液》2017;129(25):3294-3303。
[0277]
mateos mv,dimopoulos ma,cavo m等人《达雷木单抗联合硼替佐米、美法仑和泼尼松治疗未经治疗的骨髓瘤(daratumumab plus bortezomib,melphalan,and prednisone for untreated myeloma)》《新英格兰医学杂志(n engl j med.)》2018;378(6):518-528。
[0278]
mehta,r.s.和rezvani,k.《用于癌症免疫治疗的表达嵌合抗原受体的自然杀伤细胞(chimeric antigen receptor expressing natural killer cells for the immunotherapy of cancer)》《免疫学前言(front immunol.)》9 283,doi:10.3389/fimmu.2018.00283,(2018)。
[0279]
meyer s,leusen jh,boross p.《补体的调节和其在癌症的单克隆抗体疗法中的活性的调节(regulation of complement and modulation of its activity in monoclonal antibody therapy of cancer)》《单克隆抗体(mabs.)》2014;6(5):1133-1144。
[0280]
minard-colin v,xiu y,poe jc等人《小鼠cd20免疫治疗期间的淋巴瘤耗竭由巨噬细胞fcgammari、fcgammariii和fcgammariv介导(lymphoma depletion during cd20immunotherapy in mice is mediated by macrophage fcgammari,fcgammariii,and fcgammariv)》《血液》2008;112(4):1205-1213。
[0281]
moreau p,attal m,hulin c等人《新诊断多发性骨髓瘤(cassiopeia)自体干细胞移植前后的硼替佐米、沙利度胺和地塞米松(含或不含达雷木单抗):随机、开放标签、第3阶段研究(bortezomib,thalidomide,and dexamethasone with or without daratumumab before and after autologous stem-cell transplantation for newly diagnosed multiple myeloma(cassiopeia):a randomised,open-label,phase 3study)》《柳叶刀(lancet.)》2019;394(10192):29-38。
[0282]
naeimi kararoudi m,dolatshad h,trikha p等人《使用cas9核糖核蛋白生成敲除原代和扩增的人nk细胞(generation of knock-out primary and expanded human nk cells using cas9 ribonucleoproteins)》《可视化实验杂志(j vis exp.)》2018(136)。
[0283]
naik j,themeli m,de jong-korlaar r等人《cd38作为成人急性髓性白血病和t
细胞急性淋巴细胞白血病的治疗靶标(cd38 as a therapeutic target for adult acute myeloid leukemia and t-cell acute lymphoblastic leukemia)》《血液学学报(haematologica.)》2019;104(3):e100-e103。
[0284]
nijhof is,casneuf t,van velzen j等人《cd38表达和补体抑制剂影响骨髓瘤对达雷木单抗治疗的响应和抗性(cd38 expression and complement inhibitors affect response and resistance to daratumumab therapy in myeloma)》《血液》2016;128(7):959-970。
[0285]
nijhof is,groen rw,lokhorst hm等人《通过全反式视黄酸上调多发性骨髓瘤细胞上的cd38表达提高了达雷木单抗的功效(upregulation of cd38 expression on multiple myeloma cells by all-trans retinoic acid improves the efficacy of daratumumab)》《白血病(leukemia.)》2015;29(10):2039-2049。
[0286]
nijhof is,groen rw,noort wa等人《cd38靶向免疫化疗对来那度胺和硼替佐米难治性多发性骨髓瘤患者治疗潜力的临床前证据(preclinical evidence for the therapeutic potential of cd38-targeted immuno-chemotherapy in multiple myeloma patients refractory to lenalidomide and bortezomib)》《临床癌症研究》2015;21(12):2802-2810。
[0287]
nijhof is,lammerts van bueren jj,van kessel b等人《与人抗kir抗体iph2102和来那度胺组合增强达雷木单抗介导的原代多发性骨髓瘤细胞的裂解(daratumumab-mediated lysis of primary multiple myeloma cells is enhanced in combination with the human anti-kir antibody iph2102 and lenalidomide)》《血液学学报(haematologica.)》2015;100(2):263-268。
[0288]
nooka ak,joseph ns,kaufman jl等人《达雷木单抗、泊马度胺和地塞米松治疗复发性或难治性骨髓瘤的临床功效:达雷木单抗再治疗难治性患者的效用(clinical efficacy of daratumumab,pomalidomide,and dexamethasone in patients with relapsed or refractory myeloma:utility of re-treatment with daratumumab among refractory patients)》《癌症(cancer.)》2019;125(17):2991-3000。
[0289]
o'brien kl,finlay dk.《免疫代谢和自然杀伤细胞反应(immunometabolism and natural killer cell responses)》《自然评论免疫学(nat rev immunol.)》2019;19(5):282-290。
[0290]
orlowski rz,moreau p,niesvizky r等人《卡非佐米-地塞米松与硼替佐米-地塞米松在复发性或难治性多发性骨髓瘤中的作用:更新总体生存率、安全性和子组(carfilzomib-dexamethasone versus bortezomib-dexamethasone in relapsed or refractory multiple myeloma:updated overall survival,safety,and subgroups)》《临床淋巴瘤骨髓瘤和白血病(clin lymphoma myeloma leuk.)》2019;19(8):522-530e521。
[0291]
pomeroy ej,hunzeker jt,kluesner mg等人《一种用于癌症免疫治疗的遗传工程化的原代人自然杀伤细胞平台(a genetically engineered primary human natural killer cell platform for cancer immunotherapy)》《分子治疗(mol ther.)》2020;28(1):52-63。
[0292]
raab ms,podar k,breitkreutz i,richardson pg,anderson kc.《多发性骨髓瘤(multiple myeloma)》《柳叶刀》2009;374(9686):324-339。
[0293]
rezvani k,rouce r,liu e,shpall e.《用于癌症免疫疗法的工程化自然杀伤细胞(engineering natural killer cells for cancer immunotherapy)》《分子治疗》2017;25(8):1769-1781。
[0294]
rezvani,k,rouce,r,liu,e.和shpall,e.《用于癌症免疫疗法的工程化自然杀伤细胞》《分子治疗》25(8),1769-1781,doi:10.1016/j.ymthe.2017.06.012,(2017)。
[0295]
rosario m,liu b,kong l等人《基于il-15的alt-803复合物增强fcgammariiia触发的nk细胞反应和b细胞淋巴瘤的体内清除(the il-15-based alt-803complex enhances fcgammariiia-triggered nk cell responses and in vivo clearance of b cell lymphomas)》《临床癌症研究》2016;22(3):596-608。
[0296]
saltarella i,desantis v,melaccio a等人《多发性骨髓瘤中抗cd38达雷木单抗的机制(mechanisms of resistance to anti-cd38 daratumumab in multiple myeloma)》《细胞(cells.)》2020;9(1)。
[0297]
sanchez-martinez d,krzywinska e,rathore mg等人《全反式视黄酸(atra)诱导mir-23a表达、降低ctsc表达和粒酶b活性,导致nk细胞细胞毒性受损(all-trans retinoic acid(atra)induces mir-23a expression,decreases ctsc expression and granzyme b activity leading to impaired nk cell cytotoxicity)》《国际生物化学与细胞生物学杂志(int j biochem cell biol.)》2014;49:42-52。
[0298]
schultz,l.m,majzner,r,davis,k.l.&mackall,c.《儿科实体瘤免疫治疗的新进展(new developments in immunotherapy for pediatric solid tumors)》《儿科学新见(curr opin pediatr.)》30(1),30-39,doi:10.1097/mop.0000000000000564,(2018)。
[0299]
somanchi,s.s,senyukov,v.v,denman,c.j.&lee,d.a.《人外周血nk细胞的扩增、纯化和功能评估(expansion,purification,and functional assessment of human peripheral blood nk cells)》《可视化实验杂志》(48),doi:10.3791/2540,(2011)。
[0300]
stevison f,jing j,tripathy s,isoherranen n.《视黄酸代谢细胞色素p450s、cyp26在炎症和癌症中的作用(role of retinoic acid-metabolizing cytochrome p450s,cyp26,in inflammation and cancer)》《药理学进展(adv pharmacol.)》2015;74:373-412。
[0301]
sutlu,t.等人《抑制细胞内抗病毒防御机制增强人自然杀伤细胞的慢病毒转导:基因治疗的含义(inhibition of intracellular antiviral defense mechanisms augments lentiviral transduction of human natural killer cells:implications for gene therapy)》《人类基因治疗(hum gene ther.)》23(10),1090-1100,doi:10.1089/hum.2012.080,(2012)。
[0302]
uruno a,noguchi n,matsuda k等人《全反式视黄酸和新合成的类视黄醇他米巴罗汀(am80)差异调节人白血病hl-60细胞中的cd38表达:可能涉及蛋白激酶c-δ(all-trans retinoic acid and a novel synthetic retinoid tamibarotene(am80)differentially regulate cd38 expression in human leukemia hl-60cells:possible involvement of protein kinase c-delta)》《白细胞生物学期刊(j leukoc biol.)》2011;90(2):235-247。
multiple myeloma)》《治疗进展(adv ther.)》2018;35(11):1859-1872。
[0313]
zent cs,secreto cr,laplant br等人《来自用阿来组单抗和利妥昔单抗治疗的高危早期-中期慢性淋巴细胞白血病(cll)患者的cll细胞中的直接和补体依赖性细胞毒性(direct and complement dependent cytotoxicity in cll cells from patients with high-risk early-intermediate stage chronic lymphocytic leukemia(cll)treated with alemtuzumab and rituximab)》《白血病研究(leuk res.)》2008;32(12):1849-1856。
[0314]
zuris,j.a.等人《阳离子脂质介导的蛋白质递送能够在体外和体内进行有效的基于蛋白质的基因组编辑(cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo)》《自然生物技术(nat biotechnol.)》33(1),73-80,doi:10.1038/nbt.3081,(2015)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。