1.本发明属于生物医药技术领域,具体涉及基于阳离子脂多肽及细胞因子的免疫增强剂及制法、应用。
背景技术:
2.棘球蚴病又称包虫病,是由棘球绦虫的幼虫-棘球蚴寄生于人或动物体内而引起的一种严重的人兽共患病,呈全球性分布,我国为高发区。主要流行于北部和西北部、西南部等广大牧区,近年来有从牧区向农业地区蔓延的趋势。我国对该病的防控主要是使用疫苗对绵羊、山羊等易感中间宿主进行免疫预防,近年来部分地区正逐步加强对牦牛的免疫。现已证实eg95蛋白位于细粒棘球绦虫六钩蚴、可育囊生发层、原头蚴以及成虫体被上,可能在六钩蚴钻穿小肠绒毛上皮层的过程中起重要作用。
3.2a肽(18~22aa)是存在2个蛋白之间的寡肽,多肽序列中含有的基序为
“‑
dxexnpgp
‑”
。研究认为2a肽改变了核糖体的活性,促进2a肽残基gly与trna之间酯链的水解,当核糖体到达2a的c端最后两个氨基酸gly-pro时,由于核糖体酰胺中心内部结构的改变导致无法翻译下游基因,此时上游初生肽被水解释放出核糖体,然后核糖体再翻译下游基因,可以实现两个基因的等量表达。
4.il-2是辅助t细胞分泌的淋巴因子,不仅能够促进t/b淋巴细胞、nk细胞等的分化和成熟及激活其生物活性,同时可以促进ifn-γ、tnf-α等细胞因子的合成与释放以及抗体生成,有启动、促进和广泛上调免疫系统的作用。
5.rls是一种环境响应型阳离子脂多肽,文献doi:10.1039/c8tb02650e公开了其由亲水性精氨酸头部通过氧化还原敏感键连接双链油酸尾部而成,可以在水相中通过自组装形成直径100~200nm的纳米颗粒,并带有20~30mv的正电荷。能够在特定的环境条件之下发生断裂如溶酶体或核内体。
6.目前对eg95重组蛋白表达的研究主要有:(1)重组eg95的原核表达包括大肠杆菌表达、根瘤农杆菌表达、结核分枝杆菌表达、重组双歧杆菌表达等;(2)重组eg95抗原的真核表达包括酵母系统表达、杆状病毒-昆虫细胞表达、病毒活载体表达等;(3)eg95 dna疫苗等。但仍存在表达蛋白可溶性差、免疫原性低、免疫持续时间短、毒力返强、生产操作复杂等诸多缺点。
技术实现要素:
7.本发明的目的之一在于,提供一种基于阳离子脂多肽及细胞因子的免疫增强剂,制备简单,成本低、体内维持时间长,且易于保存运输,解决现有技术中eg95重组蛋白表达可溶性差、免疫原性低、免疫持续时间短、生产操作复杂的问题。
8.本发明的目的之二在于,提供该免疫增强剂的制备方法。
9.本发明的目的之三在于,提供该免疫增强剂在制备核酸疫苗中的应用。
10.为实现上述目的,本发明采用的技术方案如下:
11.本发明提供的一种基于阳离子脂多肽及细胞因子的免疫增强剂,所述免疫增强剂由质粒peg95-il2和阳离子脂多肽rls通过静电作用结合而成。
12.本发明的部分实施方案中,所述质粒peg95-il2为eg95核苷酸序列与il-2核苷酸序列连接后,连入真核表达载体所得;优选地,eg95核苷酸序列与il-2核苷酸序列通过2a核苷酸序列连接;更优选地,连接方式为eg95-2a-il2或il2-2a-eg95;
13.优选地,2a肽核苷酸序列如seq.id:10所示:
14.ggcagcggcgtgcagtttggcagcctgctgaaactggcgggcgatgtggaaaacccgggcccg;
15.优选地,阳离子脂多肽rls选自r1ls、r2ls、r3ls中的任意一种。
16.本发明的部分实施方案中,eg95核苷酸序列与il-2核苷酸序列连接后通过hind iii、ecor i酶切位点连入真核表达载体,优选地,所述真核表达载体包括pcdna3.1、pcmv-lacz、pegfp-c1中的任意一种。
17.本发明的部分实施方案中,il-2序列的种属选自人、家畜、家禽、鼠类中的任意一种。
18.本发明提供的上述免疫增强剂的制备方法,包括以下步骤:
19.s1.将eg95核苷酸序列与il-2核苷酸序列通过2a核苷酸序列连接,得到eg95-il2核苷酸序列;
20.s2.eg95-il2核苷酸序列连入真核表达载体,得到质粒peg95-il2;
21.s3.将阳离子脂多肽rls溶于溶剂中,作为有机相;
22.s4.搅拌状态下,将所述有机相逐滴加入去离子水中,得到阳离子脂多肽溶液;
23.s5.将所述质粒peg95-il2加入到阳离子脂多肽溶液中,质粒peg95-il2与阳离子脂多肽通过静电作用进行结合,得到所述免疫增强剂rls@eg95-il2。
24.本发明的部分实施方案中,所述s3中的溶剂包括二甲基亚砜、二甲基砜、环丁砜、甲醇;
25.所述s3的有机相中阳离子脂多肽rls浓度为5~20mg/ml,优选为10mg/ml。
26.本发明的部分实施方案中,有机相与去离子的体积比为:1:5-20,优选为1:10;
27.所述s5中,阳离子脂多肽溶液中rls与质粒peg95-il2的质量比为1:1-80。
28.本发明的部分实施方案中,所述s5中,质粒peg95-il2与阳离子脂多肽的作用时间为10~60min。
29.本发明提供的上述免疫增强剂在制备核酸疫苗中的应用。
30.本发明的部分实施方案中,所述核酸疫苗为注射剂,优选地,为静脉注射剂、肌肉注射剂或皮下注射剂。
31.与现有技术相比,本发明具有以下有益效果:
32.本发明构思巧妙,设计科学,本发明的免疫增强剂制备简单,成本低,体内维持时间长,且易于保存运输。
33.本发明创造性地将eg95核苷酸序列通过2a多肽核苷酸序列与细胞因子il-2核苷酸序列连接得到eg95-il2序列,将eg95-il2序列插入真核表达载体后与阳离子脂多肽rls溶液复合,得到免疫增强剂rls@eg95-il2。本发明制备步骤简单、安全稳定、产量高,可以高效地被体细胞(如dc细胞等)摄取,同时可以促进dc2.4/bmdcs类细胞的成熟,并延长基因在体内的滞留表达时间。本发明的免疫增强剂通过淋巴系统传至全身各部位,可以诱导抗原
特异性的免疫反应。
34.本发明制备方法降低了合成成本,提高了安全性和产量,易于实现大规模的制备和生产。
附图说明
35.图1为质粒peg95-il2构建示意图。
36.图2为阳离子脂多肽r2ls、质粒peg95-il2、免疫增强剂r2ls@eg95-il2的粒径电位图。
37.图3a为阳离子脂多肽r2ls纳米粒的电镜图。
38.图3b为免疫增强剂r2ls@eg95-il2纳米粒的电镜图。
39.图4为阳离子脂多肽r2ls纳米粒与质粒peg95-il2不同作用时间的粒径电位图。
40.图5为阳离子脂多肽r2ls与质粒pcdna3.1-egfp的不同质量比体外转染结果图。
41.图6a为免疫增强剂r2ls@eg95-il2在dc2.4细胞中蛋白il-2和蛋白eg95的间接免疫荧光图。
42.图6b为免疫增强剂r2ls@eg95-il2在bmdcs细胞中蛋白il-2和蛋白eg95的间接免疫荧光图。
43.图7为免疫增强剂r2ls@eg95-il2的小鼠免疫后血清igg抗体图。
44.图8为免疫增强剂r2ls@eg95-il2的小鼠免疫2周后脾细胞t/b淋巴细胞增殖图。
45.图9为免疫增强剂r2ls@eg95-il2的免疫小鼠脾细胞ifn-γ
cd8
和il-4
cd4
细胞百分比图。
46.图10为阳离子脂多肽r2ls与远红外质粒pegl3-e2复合后免疫小鼠体内基因滞留表达时间图。
47.图11a为免疫增强剂r2ls@eg95-il2对dc2.4细胞的相关分子促成熟表达图。
48.图11b为免疫增强剂r2ls@eg95-il2对bmdcs细胞的相关分子促成熟表达图。
具体实施方式
49.以下将结合实施例对本发明进一步清楚、完整地描述,但绝不是对本发明范围的限制。而且,本领域技术人员根据本发明的描述可以对本发明进行等同替换、组合、改良或修饰,但这些都将包括在本发明的范围内。
50.实施例1 2a肽基因的合成
51.该实施例提供了2a肽的基因序列
52.根据seq 1所示的口蹄疫病毒(f2a)氨基酸序列,seq 2所示的马鼻炎a病毒(e2a)氨基酸序列,seq 3所示的点褐翅蛾病毒(t2a)氨基酸序列,seq 4所示的猪特斯琴病毒(p2a)氨基酸序列,按照2a多肽基序的
“‑
dxexnpgp
‑”
特性及小鼠细胞密码子偏爱性,优化设计2a肽核苷酸序列(如seq 10所示)及氨基酸序列(如seq 9所示)。
[0053][0054]
实施例2质粒peg95-il2的构建
[0055]
该实施例提供了含有eg95-il2序列的表达载体的构建方法,包括如下步骤:
[0056]
人工合成eg95核苷酸序列(如seq id:11所示)、il-2核苷酸序列(如seq id:12所示)、2a核苷酸序列,将上述序列按照eg95-2a-il2进行连接。同时为实现克隆,在合成eg95-2a-il2序列的5'端、3'端分别引入ecor i(gaattc)、hind iii(aagctt)酶切位点。
[0057]
用ecor i/hind iii双酶切合成的eg95-2a-il2序列,同时用ecor i/hind iii双酶切pcdna3.1质粒dna载体琼脂糖凝胶电泳鉴定酶切结果,凝胶回收酶切后的eg95-2a-il2和pcdna3.1线性质粒dna。
[0058]
eg95-2a-il2序列的双酶切体系为:eg95-2a-il2序列20μl(0.5μg/μl),5
×
cutsmart buffer 6.0μl,ecor i/hind iii个各(5u/μl)各2.0μl,体积共计30μl;酶切条件为:37℃,酶切2h。
[0059]
酶切后的eg95-2a-il2序列片段和pcdna3.1线性质粒dna(摩尔比10:1),使用伯乐公司的连接试剂盒,25℃连接30min。将连接产物加入大肠杆菌(e.coli)top10菌株感受态细胞悬液中转化,取200μl转化菌液涂布于含有amp的lb固体培养基上,37℃培养14h,挑取单菌落继代培养。提取重组质粒并进行双酶切(ecor i/hind iii)验证,将酶切验证正确的质粒进行测序验证,将构建正确的质粒命名为peg95-il2,调整浓度为0.1mg/ml,备用。
[0060]
实施例3阳离子脂多肽r2ls溶液的制备1
[0061]
该实施例提供了阳离子脂多肽r2ls溶液的制备,包括如下步骤:
[0062]
称取阳离子脂多肽r2ls 1.0mg溶于100μl dmso中,浓度为10mg/ml,作为有机相;取去离子水900μl作为水相。
[0063]
将有机相逐滴加入500r/min转速的水相中,室温下继续搅拌10min后即得阳离子脂多肽r2ls溶液,终浓度为1mg/ml。
[0064]
实施例4阳离子脂多肽r2ls溶液的制备2
[0065]
该实施例提供了阳离子脂多肽r2ls溶液的制备,包括如下步骤:
[0066]
称取阳离子脂多肽r2ls 1.0mg溶于100μl dmso中,浓度为10mg/ml,作为有机相;取去离子水900μl作为水相。
[0067]
将有机相逐滴加入500r/min转速的水相中,室温下继续搅拌60min后即得阳离子脂多肽r2ls溶液,终浓度为1mg/ml。
[0068]
其粒径电位结果如图4所示,结果表明阳离子脂多肽r2ls纳米粒与质粒peg95-il2作用不同时间10min、20min、30min、40min、50min、60min后的粒径电位无明显差异,提示阳离子脂多肽r2ls纳米粒与质粒dna的作用时间可以选择为10~60min。
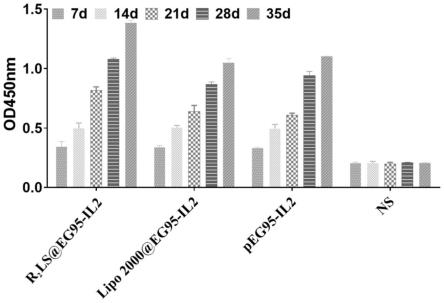
[0069]
实施例5阳离子脂多肽r2ls的转染效果测定
[0070]
该实施例提供了阳离子脂多肽r2ls的转染效果,包括如下步骤:
[0071]
取10μl生工生物工程(上海)股份有限公司的质粒pcdna3.1-egfp,逐滴加入100μl按实施例3方法制备的阳离子脂多肽r2ls溶液中,充分混匀,阳离子脂多肽溶液中r2ls与质粒pcdna3.1-egfp的质量比分别为1:1、1:10、1:20、1:40、1:80。通过静电作用进行结合,作用时间为20min,即得r2ls@egfp。
[0072]
用含10%胎牛血清的完全培养基培养dc2.4细胞和l929细胞,待细胞快长至80%左右时用5μl不同质量比的r2ls@egfp进行体外转染,同时设置lipo2000@egfp、pei@egfp作为对照组,每组转染3个复孔。将上述2种细胞放置于培养箱培养48h后用徕卡倒置显微镜进行egfp荧光蛋白的表达检测。
[0073]
结果如图5所示,试验结果表明,阳离子脂多肽r2ls可以与质粒dna(1:1、1:10、1:20、1:40、1:80)进行不同质量比的混合,且混合后r2ls@egfp在树突状细胞dc2.4、成纤维细胞l929上的转染效果无明显差异。提示阳离子脂多肽rls纳米粒与质粒dna可以按照1:1~80的质量比进行混合。
[0074]
实施例6免疫增强剂r2ls@eg95-il2的制备
[0075]
该实施例提供了免疫增强剂r2ls@eg95-il2的制备,包括如下步骤:
[0076]
取10μl按实施例2的方法制备的质粒peg95-il2,逐滴加入100μl按实施例3方法制备的阳离子脂多肽r2ls溶液中,充分混匀,阳离子脂多肽溶液中r2ls与质粒peg95-il2的质量比为1:25。通过静电作用进行结合,作用时间为60min,即得免疫增强剂r2ls@eg95-il2。
[0077]
实施例7阳离子脂多肽r2ls、质粒peg95-il2、免疫增强剂r2ls@eg95-il2粒径电位的测定
[0078]
该实施例提供了阳离子脂多肽r2ls、质粒peg95-il2、免疫增强剂r2ls@eg95-il2粒径电位的测定,包括如下步骤:
[0079]
使用马尔文纳米激光粒度仪测定纳米粒的粒径、电位分布。分别取实施例2中的质粒peg95-il2、实施例3中的阳离子脂多肽r2ls溶液、实施例4中的免疫增强剂r2ls@eg95-il2溶液各10μl,将上述样品与1ml去离子水混匀,加入样品池内检测,测定温度设为20℃。另设lipo 2000(invitrogen商品化2000转染试剂)、pei(invitrogen商品化pei转染试剂盒)及其分别与质粒peg95-il2溶液的混合物作为对照组,检测方法同上。结果如图2所示,分别为阳离子脂多肽r2ls、质粒peg95-il2及免疫增强剂r2ls@eg95-il2粒径、电位。
[0080]
由图2可知,质粒peg95-il2粒径为250~260nm、电荷为-10~-5mv;
[0081]
阳离子脂多肽r2ls粒径为100~150nm、电荷为25~30mv;
[0082]
对照组lipo 2000粒径为90~100nm、电荷为30~35mv;
[0083]
对照组pei粒径为200~250nm、电荷为10~15mv;
[0084]
免疫增强剂r2ls@eg95-il2的粒径为200~250nm、电荷为15~20mv;
[0085]
对照组lipo 2000@eg95-il2(为使用invitrogen商品化2000转染试剂与实施例2中的质粒peg95-il2溶液按照体积比为1:2配制而成),其粒径为350~400nm、电荷为15~20mv;
[0086]
对照组pei@eg95-il2(为使用invitrogen商品化pei转染试剂盒与质粒peg95-il2溶液按照体积比为1:2配制而成),其粒径为600~650nm、电荷为5~10mv。
[0087]
结果显示:所制备的阳离子脂多肽r2ls粒径为纳米级别,电荷为微正。且与商品化lipo 2000、pei转染试剂的粒径、电位无显著差异。所制备的免疫增强剂r2ls@eg95-il2的粒径为纳米级别,电荷为微正,且与商品化lipo 2000、pei转染试剂与质粒peg95-il2的复合物lipo 2000@eg95-il2、pei@eg95-il2的粒径、电位无显著差异。
[0088]
实施例8阳离子脂多肽r2ls、免疫增强剂r2ls@eg95-il2的形貌特征检测
[0089]
该实施例提供了阳离子脂多肽r2ls、免疫增强剂r2ls@eg95-il2的形貌特征检测,包括如下步骤:
[0090]
分别取按实施例3方法制得的阳离子脂多肽r2ls溶液、实施例4方法制得的免疫增强剂r2ls@eg95-il2溶液各10μl,滴加于铜网上,静置5min,然后用2%磷钨酸染色30s,并用滤纸吸走铜网上多余的染液,室温晾干样品,在200kv条件下观察样品,透射电镜拍照观察。
[0091]
结果如图3a和图3b所示,其中3a为阳离子脂多肽r2ls透射电镜图,图3b为免疫增强剂r2ls@eg95-il2的透射电镜图。由图可知阳离子脂多肽r2ls、免疫增强剂r2ls@eg95-il2均为圆整的颗粒,阳离子脂多肽r2ls粒径为100~150nm,核酸疫苗r2ls@eg95-il2的粒径为200~250nm。
[0092]
试验例1目的蛋白eg95、il-2的瞬时表达结果
[0093]
为了观察目的蛋白eg95、il-2的瞬时表达结果,对瞬时转染的细胞进行了分析。
[0094]
用含10%胎牛血清的完全培养基培养dc2.4细胞和l929细胞,待细胞处于对数生长期时收集细胞。取250μl(10万/ml)接种到35mm玻底皿中。次日细胞快长至80%左右时用5μl r2ls@eg95-il2疫苗进行体外转染,同时设置lipo2000@eg95-il2作为对照组。每组转染3个复孔,设置空白对照。将上述2种细胞放置于培养箱培养48h后用beyotime的免疫荧光染色试剂盒-抗兔cy3根据说明书进行eg95/il-2蛋白的瞬时表达荧光检测。
[0095]
结果如图4a和图4b所示,试验结果表明,所构建的基因表达载体p eg95-il2不仅可以在免疫细胞(如树突状细胞dc2.4)中表达目的蛋白eg95和il-2,而且可以在非免疫类细胞(如成纤维细胞l929)中表达目的蛋白eg95和il-2。且目的蛋白eg95和il-2均有较高表达。
[0096]
试验例2小鼠体内免疫试验结果-1
[0097]
为了观察免疫增强剂r2ls@eg95-il2的免疫效果,对免疫后小鼠进行了分析。
[0098]
本实施例中所述r2ls@eg95-il2为按照实施例6的方法制得;
[0099]
质粒peg95-il2为按实施例2的方法制得;
[0100]
lipo 2000@eg95-il2为按实施例7的方法制得。
[0101]
小鼠体内免疫实验:0天免疫,babl/c小鼠后退臀部肌肉注射100μl r2ls@eg95-il2免疫增强剂,同时设置lipo 2000@eg95-il2、质粒peg95-il2、生理盐水(ns)组作为对照。第7d、14d、21d、28d、35d进行断尾采血天,检测血清中eg95特异性igg抗体的量,结果如
图5所示。
[0102]
由试验结果可知,本发明所述的免疫增强剂r2ls@eg95-il2诱导产生的抗体水平较ns对照组有显著增加。且较lipo2000@eg95-il2、质粒peg95-il2对照组亦有明显提高;表明本发明的r2ls@eg95-il2具有显著的增强免疫的作用。
[0103]
试验例3小鼠体内免疫试验结果-2
[0104]
本实施例中所述r2ls@eg95-il2为按照实施例6的方法制得;
[0105]
质粒peg95-il2为按实施例2的方法制得;
[0106]
lipo 2000@eg95-il2为按实施例7的方法制得。
[0107]
小鼠体内免疫实验:0天免疫,babl/c小鼠后腿臀部肌肉注射100μl r2ls@eg95-il2免疫增强剂,同时设置lipo 2000@eg95-il2、质粒peg95-il2、生理盐水(ns)组作为对照。免疫后第14d在超净台中无菌操作取出小鼠脾脏,裂解红细胞后,收集淋巴细胞,计数(1
×
107个/ml)。分至96孔板,每个样本接种9个孔,100μl/孔,分别加入biolegend公司的cona 5μl/孔(1μg/μl)或lps 10μl/孔(1μg/μl),37℃、5%co2培养60h后各孔加入10μl dojindo公司的cck-8,继续培养90min,用酶标仪测定od
450nm
值,计算t/b淋巴细胞体外增殖能力。公式为:
[0108]
si(刺激指数)=(od
450nm lps或cona-od
450nm
空白):(rpmi 1640对照组-od
450nm
空白)
[0109]
结果如图6所示,其中r2ls@eg95-il2组t/b淋巴细胞增殖能力显著高于对照组lipo2000@eg95-il2和质粒peg95-il2,p<0.005值有统计学意义,表明本发明的r2ls@eg95-il2具有显著的增强免疫的作用。
[0110]
试验例4小鼠体内免疫试验结果-3
[0111]
本实施例中所述r2ls@eg95-il2为按照实施例6的方法制得;
[0112]
质粒peg95-il2为按实施例2的方法制得;
[0113]
lipo 2000@eg95-il2为按实施例7的方法制得。
[0114]
小鼠体内免疫实验:0天免疫,babl/c小鼠后腿臀部肌肉注射100μl r2ls@eg95-il2免疫增强剂,同时设置lipo 2000@eg95-il2、质粒peg95-il2、生理盐水(ns)组作为对照。免疫后第14d处死小鼠取脾脏,裂解红细胞获得脾脏淋巴细胞,将淋巴细胞接种到12孔板中,分别加入eg95多肽刺激物(10μl/孔)或pma(空白对照组10μl/孔)后补加500ml/孔1640培养基,37℃培养箱孵育1h后加入biolegend的brefeldin a(10μl/孔),继续孵育4~6h。收集淋巴细胞,分别加入biolegend的cd8a-fitc抗体或抗小鼠cd4-fitc抗体4℃孵育30min。后清洗,室温避光孵育固定20min。用biolegend的permeabilization wash buffer对淋巴细胞进行破膜,加入biolegend的ifn-γ-pe或il-4-pe抗体室温避光20min。pbs洗涤、重悬后进行上机检测分析:cd4
il-4
双阳,cd8
ifn-γ
双阳。
[0115]
结果如图7a,7b所示。其中图7a为
[0116]
cd8
ifn-γ
双阳结果:r2ls@eg95-il2(2.54%)、对照组lipo2000@eg95-il2(1.00%)、对照组peg95-il2(1.34%)。
[0117]
图7b为cd4
il-4
双阳结果:r2ls@eg95-il2(2.88%)、对照组lipo2000@eg95-il2(1.60%)、对照组peg95-il2(1.62%)。
[0118]
试验结果表明本发明的r2ls@eg95-il2具有显著的增强免疫的作用。
anti-mouse cd86,在冰上黑暗中孵育20min,洗涤后检测。
[0133]
结果如图9a、图9b所示。图9a为r2ls@eg95-il2、lipo 2000@eg95-il2、pei@eg95-il2对dc2.4细胞促成熟结果,lps(脂多糖)作为阳性对照、rpmi 1640作为阴性对照;
[0134]
图9b为r2ls@eg95-il2、lipo 2000@eg95-il2、pei@eg95-il2对bmdcs细胞促成熟结果,lps作为阳性对照、rpmi 1640作为阴性对照。
[0135]
从共刺激分子cd40、cd80、cd86、mhc-ii的表达所占百分比可以得到r2ls@eg95-il2的促成熟效果显著高于其它实验组。说明该r2ls@eg95-il2对dc2.4、bmdcs有明显的促成熟效果。
[0136]
综上所述,本发明的rls@eg95-il2制备步骤简单、安全稳定、产量高,可以高效地被体细胞(如dc细胞等)摄取,同时可以促进dc2.4/bmdcs类细胞的成熟,并延长基因在体内的滞留表达时间;通过淋巴系统传至全身各部位,可以诱导抗原特异性的免疫反应。本发明实施例中所述的阳离子脂多肽rls均为r2ls。本领域技术人知晓,rls是由亲水性精氨酸头部通过氧化还原敏感键连接双链油酸尾部而成,可以在水相中通过自组装形成直径100~200nm的纳米颗粒,并带有20~30mv的正电荷。r2ls与其他rls,如r1ls、r3ls机理相同,因此,当本发明中的rls为r1ls、r3ls时,也能实现与r2ls相同的技术效果。
[0137]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
