1.本发明属于医药技术领域,涉及一种针对焦虑失眠的治疗药物,具体涉及一种稳定的艾司唑仑制剂组合物及其制备方法。
背景技术:
2.艾司唑仑(estazolam),化学名6-苯基-8-氯-4h-[1,2,4]三氮唑并[4,3-a][1,4]苯并二氮杂卓,具有较强的镇静、安眠、抗惊厥、抗焦虑作用,及较弱的中枢性骨骼肌松驰作用。适用于失眠、惊厥、焦虑、紧张、恐惧和癫痫发作症等。
[0003]
艾司唑仑是传统的苯二氮卓类镇静催眠药之一,从药代动力学角度来说,艾司唑仑属于作用时间适中的中效镇静催眠药。艾司唑仑的主要作用机制是通过加强脑内抑制性神经递质,即γ-氨基丁酸而发挥作用,随着剂量的增加,具有抗焦虑、镇静催眠、遗忘、抗惊厥以及骨骼肌松弛作用,因此临床广泛用于抗焦虑、失眠,也用于紧张、恐惧,缓解手术前紧张、焦虑以及抗癫痫、抗惊厥等方面,还可以用于肌紧张性头痛。
[0004]
基本信息:
[0005]
艾司唑仑
[0006]
化学名称:6-苯基-8-氯-4h-[1,2,4]三氮唑-[4,3α][1,4]苯并二氮杂卓
[0007]
化学结构式:
[0008][0009]
cas:29975-16-4
[0010]
基本性质:白色或微黄色结晶或粉末。熔点228-229℃。易溶于氯仿,稍溶于甲醇,难溶于丙酮、乙醇、乙酸乙酯和苯。几乎不溶于乙醚和水,无臭,味苦。
[0011]
艾司唑仑在临床上有注射液和片剂两种剂型,但这两种剂型均存在一定的不足。
[0012]
艾司唑仑注射液临床使用存在以下问题:
①
艾司唑仑几乎不溶于水,艾司唑仑开发注射剂需要加入大量的助溶辅料,临床使用时大量助溶辅料静脉注射到体内,会带来较大的安全风险;
②
本产品的临床主要适应症为抗焦虑和失眠治疗,大多数患者以居家为主,注射给药需要专业医护人员方可实现,实际临床中使用不方便,不利于患者治疗;
③
艾司唑仑口服吸收好,血浆蛋白结合率达到93%,比注射剂无明显的差异,注射液临床优势不明显。
[0013]
根据艾司唑仑片的作用特点,在治疗失眠症状时,其服药方式一般为小剂量(0.5mg,半片)起始,如果患者耐受或必要时可逐渐增加至最低有效剂量,每周3-5天间断服药,不要连续服药,长期服药应按需给药。但是,艾司唑仑片长期服用可产生耐受性和依赖性,久服后突然停药可产生戒断症状,为避免出现戒断症状,长期服用艾司唑仑片的患者停
药时应逐渐减量,停药方案为:每周的日用剂量比上周的日用剂量减少0.25mg(四分之一片),每周减量1次,当日用剂量减至每日0.25mg(四分之一片)时,患者可按该剂量继续用药1周,然后停药。
[0014]
针对艾司唑仑片以上出现的临床服用特点,现国内上市的口服片剂服用时会存在临床需求未被满足的地方:
①
现获批片剂最小规格为1mg,在服用0.5mg甚至0.25mg时需要进行分片,且本产品1mg规格片体积小,分片较困难,精确到四份之一片,容易产生剂量差异,造成服用剂量不准确,影响药效;
②
该品种适应症多,涉及到剂量波动较大,且每天服用次数多,因此大剂量每日服用时容易漏服错服,容易发生服用剂量错误;
③
对于一些特殊群体或者吞食困难的患者,难以服用片剂,临床给药较困难。
④
目前对于18岁以下儿童的使用剂量尚不明确。
⑤
口服片剂3小时候方能达到最高血药浓度,对于治疗失眠等症状时,起效时间偏长,不利于临床治疗。
[0015]
专利cn1274298c提供了一种有效掩味的口腔崩解片及制备方法,其中包含了艾司唑仑口腔崩解片,该口腔崩解片能够有效掩盖药物的不适口感,并且能够迅速崩解,但其仍为片剂剂型,无法解决灵活给药和特殊患者的服用问题,临床起效时间仍需较长时间。
[0016]
专利cn1245160c提供了一种含吲哒帕胺和血管紧张素转换酶抑制剂的复方降压制剂,该复方降压制剂包含了0.05-1mg艾司唑仑,其剂型为片剂和胶囊剂。该复方制剂中艾司唑仑的作用主要是用于改善患者的焦虑、烦躁情绪等,对其他病症起到辅助治疗的作用,对于发挥艾司唑仑的最大治疗作用不够充分。
技术实现要素:
[0017]
针对现上市艾司唑仑制剂口服片剂最小规格不适用、患者给药不方便、口服片剂给药起效速度慢等缺点,结合本产品的治疗用途,本发明提供了一种工艺简单且安全有效、质量稳定的艾司唑仑制剂组合物,该制剂组合物不但具有剂型优势明显,而且在临床治疗上也更具有临床优势。
[0018]
该制剂组合物为口服纳米混悬剂,该制剂组合物和传统意义的口服片剂或注射剂相对比,不但解决了特殊患者灵活给药问题,而且由于其特殊制备工艺,活性成分粒径更小更均匀,提高了药物吸收速度,起效时间明显缩短,具有明确的临床优势。
[0019]
本发明的技术方案如下:
[0020]
一种稳定的艾司唑仑制剂组合物,所述制剂组合物的活性成分为艾司唑仑,制剂组合物的剂型为纳米混悬液。
[0021]
进一步地,所述艾司唑仑的粒径范围为200~400nm。
[0022]
更进一步地,所述艾司唑仑的粒径范围为200~300nm。
[0023]
进一步地,所述制剂组合物的成分还包括表面活性剂、稳定剂、ph调节剂和分散介质。
[0024]
进一步地,按照质量百分数计,所述制剂组合物包括:
[0025]
艾司唑仑,0.01%~0.1%;
[0026]
表面活性剂,5%~10%;
[0027]
稳定剂,0.5%~1%;
[0028]
ph调节剂适量;
[0029]
分散介质,补充至100%。
[0030]
更进一步地,所述艾司唑仑的质量百分数为0.025%~0.05%。
[0031]
进一步地,所述表面活性剂为羟丙基甲基纤维素、聚乙烯吡咯烷酮、泊洛沙姆、聚乙烯醇中一种或多种;
[0032]
所述稳定剂为聚山梨酯80、十二烷基硫酸钠、十六烷基三甲基季铵盐中的一种或多种;
[0033]
所述ph调节剂为氢氧化钠、盐酸、磷酸盐缓冲对中的一种或多种,调节ph值范围为6~7;
[0034]
所述分散介质为纯化水。
[0035]
更进一步地,所述稳定剂为聚山梨酯80和十二烷基硫酸钠。
[0036]
一种稳定的艾司唑仑制剂组合物的制备方法,包括:
[0037]
对艾司唑仑进行微粉化处理,控制粒径d90≤10μm;
[0038]
将表面活性剂加入分散介质中,搅拌至完全溶解,获得溶液a;
[0039]
向溶液a中依次加入稳定剂和艾司唑仑,搅拌得到艾司唑仑初混悬液;
[0040]
将艾司唑仑初混悬液加入ph调节剂,调节ph值至6.0~7.0,加分散介质至全量,搅拌均匀得溶液b;
[0041]
使用高压均质机对溶液b进行均质处理,最终得到艾司唑仑纳米混悬液。
[0042]
进一步地,制得的艾司唑仑纳米混悬液,粒径范围为200~400nm,pdi为0.2~0.4。
[0043]
本发明提供的艾司唑仑制剂组合物,剂型为纳米混悬液,与口服固体制剂或者传统的混悬液相对比,纳米混悬液粒径小于1微米,制剂分散性极好,具有较好的表面反应活性和强吸附能力,可有效增大艾司唑仑饱和溶解度和溶出速度,起效速度快,同时本发明开发的纳米混悬液能够有效黏附体内粘膜组织,延长药物作用时间,降低药物不良反应。
[0044]
本发明制备的纳米混悬液,最佳实施例产品质量优秀,溶出速度快,稳定性期间,有关物质处于较低水平,粒径范围无明显变化,pdi稳定性。
[0045]
具体的:
[0046]
与现有技术相对比,本发明提供的制剂组合物其优势如下:
[0047]
a:本发明提供的艾司唑仑的制剂组合物,可开发成口服纳米混悬剂,混悬剂以液体制剂形态存在,药物在临床服用时更为缓和平滑,通过矫味剂及甜味剂等辅料可以有效改变掩盖药物的特殊味道,使患者更乐于接受,该种形式适合儿童、老年患者及吞服不方便的患者服用,能够有效满足特定患者的临床需求;
[0048]
b:本发明提供的艾司唑仑的制剂组合物,可以针对不同的用法用量进行灵活调节,可以按照临床需求给与不同的给药体积,从而满足多种小剂量、剂量变化大的给药要求;
[0049]
c:本发明提供的艾司唑仑的制剂组合物,配备体积量取容器,能够精确定量,相较于口服片剂特殊剂量服用时需进行分片处理能操作,能明显减少人为操作污染,并且用量更准确,达到更好的治疗效果;
[0050]
d:本发明提供的艾司唑仑的制剂组合物,开发纳米混悬剂,对物料粒径及制剂状态有了进一步控制,能够促进人体的吸收与渗透,提高生物利用度,达到更好的药效作用;
[0051]
e:本发明提供的艾司唑仑的制剂组合物,相对比口服固体制剂,其辅料组成简单,
使用辅料量更少,临床服用引发的不良反应更低,安全性高。
[0052]
同时本发明提供了艾司唑仑制剂组合物的制备方法,该制备方法与现有口服固体制剂相比具有以下优势:
[0053]
a:该制剂组合物主要生产步骤主要为高压均质步骤,无需较多的生产工序,少步骤生产连续性好,生产过程可控性强;
[0054]
b:该制剂组合物生产过程中使用物料较少,生产时限短,能在较短时间内完成整批次的生产制造,利于商业化大规模生产
[0055]
总之,本发明提供的制剂组合物不但能够解决现有产品的临床不足,而且易于产业化,对于生产条件的要求更低。
附图说明
[0056]
图1为六组实施例的粒径与pdi结果示意图;
[0057]
图2为六组实施例的zeta数据结果;
[0058]
图3为实施例3的粒径分布图;
[0059]
图4为六组实施例纳米混悬液与艾司唑仑片剂溶出曲线对比图。
[0060]
图5为两组实验动物血浆中艾司唑仑的平均浓度-时间曲线。
具体实施方式
[0061]
下面结合说明书附图和实施例对本发明做进一步的说明。
[0062]
所有的实施例均采用以下的制备方法:
[0063]
(1)对艾司唑仑进行微粉化处理,控制粒径d90≤10μm;
[0064]
(2)按照处方量将表面活性剂加入纯化水中,搅拌至完全溶解,获得溶液a;
[0065]
(3)向溶液a中依次加入稳定剂和艾司唑仑,15~25℃下搅拌0.5~1小时,使溶液中各组分充分均匀,得到艾司唑仑初混悬液;
[0066]
(4)将艾司唑仑初混悬液加入0.1mol/l的ph调节剂,调节混悬液ph值在6.0~7.0,加纯化水至全量,搅拌均匀,得溶液b;
[0067]
(5)使用高压均质机对溶液b进行均质处理,得到最终艾司唑仑纳米混悬液,粒径范围为200~400nm范围内。
[0068]
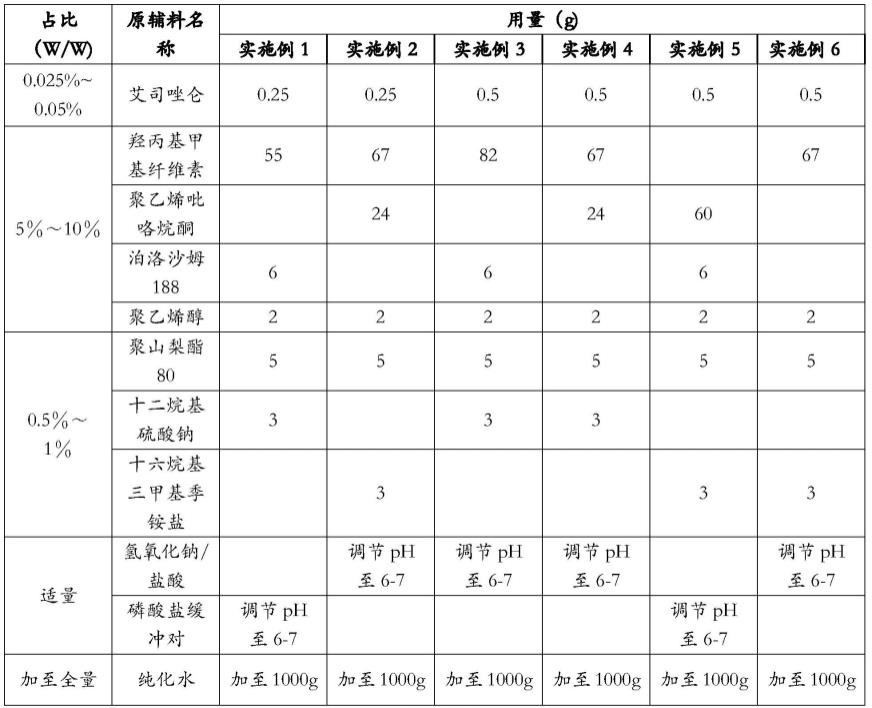
实施例1~6组成如下表所示。
[0069][0070]
根据上述的处方组成和制备工艺,分别展开各实施例的撰写。
[0071]
实施例1
[0072]
处方组成:
[0073]
原辅料组成用量(g)艾司唑仑0.25羟丙基甲基纤维素55泊洛沙姆1886聚乙烯醇2聚山梨酯805十二烷基硫酸钠3磷酸氢二钠/磷酸二氢钠调节至6.5纯化水加至1000g
[0074]
制备工艺:
[0075]
(1)对艾司唑仑进行微粉化处理,控制粒径d90≤10μm范围内;
[0076]
(2)按照处方量称取羟丙基甲基纤维素、泊洛沙姆和聚乙烯醇加入60%比例的纯化水中,室温条件下放置2小时,进行充分溶胀后,快速搅拌至完全溶解,成为均相溶液a。
[0077]
(3)向溶液a中首先加入聚山梨酯80,搅拌至混合均匀,再加入十二烷基硫酸钠和艾司唑仑,15~25℃下搅拌0.5~1小时,使溶液中各组分充分混合,得到溶液b;
[0078]
(4)对溶液b进行ph调节,使用0.1mol/l的磷酸氢二钠和磷酸二氢钠溶液调节溶液
ph至6.5左右,加纯化水至1000g,搅拌均匀,得初级艾司唑仑混悬液;
[0079]
(5)使用高压均质机对初级艾司唑仑混悬液进行均质处理,得到最终艾司唑仑纳米混悬液。
[0080]
实施例2
[0081]
处方组成:
[0082]
原辅料组成用量(g)艾司唑仑0.25羟丙基甲基纤维素67聚乙烯吡咯烷酮24聚乙烯醇2聚山梨酯805十六烷基三甲基季铵盐3氢氧化钠/盐酸调节至6-7纯化水加至1000g
[0083]
制备工艺:
[0084]
(1)对艾司唑仑进行微粉化处理,控制粒径d90≤10μm范围内;
[0085]
(2)按照处方量称取羟丙基甲基纤维素、聚乙烯吡咯烷酮和聚乙烯醇加入60%比例的纯化水中,室温条件下放置2小时,进行充分溶胀后,快速搅拌至完全溶解,成为均相溶液a。
[0086]
(3)向溶液a中首先加入聚山梨酯80,搅拌至混合均匀,再加入十六烷基三甲基季铵盐和艾司唑仑,15~25℃下搅拌0.5~1小时,使溶液中各组分充分混合,得到溶液b;
[0087]
(4)对溶液b进行ph调节,使用0.1mol/l的氢氧化钠和盐酸溶液调节溶液ph至6.5左右,加纯化水至1000g,搅拌均匀,得初级艾司唑仑混悬液;
[0088]
(5)使用高压均质机对初级艾司唑仑混悬液进行均质处理,得到最终艾司唑仑纳米混悬液。
[0089]
实施例3
[0090]
处方组成:
[0091]
原辅料组成用量(g)艾司唑仑0.5羟丙基甲基纤维素82泊洛沙姆6聚乙烯醇2聚山梨酯805十二烷基硫酸钠3氢氧化钠/盐酸调节至6.5纯化水加至1000g
[0092]
制备工艺:
[0093]
(1)对艾司唑仑进行微粉化处理,控制粒径d90≤10μm范围内;
[0094]
(2)按照处方量称取羟丙基甲基纤维素、泊洛沙姆和聚乙烯醇加入60%比例的纯
化水中,室温条件下放置2小时,进行充分溶胀后,快速搅拌至完全溶解,成为均相溶液a。
[0095]
(3)向溶液a中首先加入聚山梨酯80,搅拌至混合均匀,再加入十二烷基硫酸钠和艾司唑仑,15~25℃下搅拌0.5~1小时,使溶液中各组分充分混合,得到溶液b;
[0096]
(4)对溶液b进行ph调节,使用0.1mol/l的氢氧化钠和盐酸溶液调节溶液ph至6.5左右,加纯化水至1000g,搅拌均匀,得初级艾司唑仑混悬液;
[0097]
(5)使用高压均质机对初级艾司唑仑混悬液进行均质处理,得到最终艾司唑仑纳米混悬液。
[0098]
实施例4
[0099]
处方组成:
[0100][0101][0102]
制备工艺:
[0103]
(1)对艾司唑仑进行微粉化处理,控制粒径d90≤10μm范围内;
[0104]
(2)按照处方量称取羟丙基甲基纤维素、聚乙烯吡咯烷酮和聚乙烯醇加入60%比例的纯化水中,室温条件下放置2小时,进行充分溶胀后,快速搅拌至完全溶解,成为均相溶液a。
[0105]
(3)向溶液a中首先加入聚山梨酯80,搅拌至混合均匀,再加入十二烷基硫酸钠和艾司唑仑,15~25℃下搅拌0.5~1小时,使溶液中各组分充分混合,得到溶液b;
[0106]
(4)对溶液b进行ph调节,使用0.1mol/l的氢氧化钠和盐酸溶液调节溶液ph至6.5左右,加纯化水至1000g,搅拌均匀,得初级艾司唑仑混悬液;
[0107]
(5)使用高压均质机对初级艾司唑仑混悬液进行均质处理,得到最终艾司唑仑纳米混悬液。
[0108]
实施例5
[0109]
处方组成:
[0110]
原辅料组成用量(g)艾司唑仑0.5聚乙烯吡咯烷酮60泊洛沙姆1886聚乙烯醇2聚山梨酯805十六烷基三甲基季铵盐3磷酸氢二钠/磷酸二氢钠调节至6.5
纯化水加至1000g
[0111]
制备工艺:
[0112]
(1)对艾司唑仑进行微粉化处理,控制粒径d90≤10μm范围内;
[0113]
(2)按照处方量称取聚乙烯吡咯烷酮、泊洛沙姆和聚乙烯醇加入60%比例的纯化水中,室温条件下放置2小时,进行充分溶胀后,快速搅拌至完全溶解,成为均相溶液a。
[0114]
(3)向溶液a中首先加入聚山梨酯80,搅拌至混合均匀,再加入十六烷基三甲基季铵盐和艾司唑仑,15~25℃下搅拌0.5~1小时,使溶液中各组分充分混合,得到溶液b;
[0115]
(4)对溶液b进行ph调节,使用0.1mol/l的磷酸氢二钠和磷酸二氢钠溶液调节溶液ph至6.5左右,加纯化水至1000g,搅拌均匀,得初级艾司唑仑混悬液;
[0116]
(5)使用高压均质机对初级艾司唑仑混悬液进行均质处理,得到最终艾司唑仑纳米混悬液。
[0117]
实施例6
[0118]
处方组成:
[0119]
原辅料组成用量(g)艾司唑仑0.5羟丙基甲基纤维素67聚乙烯醇2聚山梨酯805十六烷基三甲基季铵盐3氢氧化钠/盐酸调节至6-7纯化水加至1000g
[0120]
制备工艺:
[0121]
(1)对艾司唑仑进行微粉化处理,控制粒径d90≤10μm范围内;
[0122]
(2)按照处方量称取羟丙基甲基纤维素和聚乙烯醇加入60%比例的纯化水中,室温条件下放置2小时,进行充分溶胀后,快速搅拌至完全溶解,成为均相溶液a。
[0123]
(3)向溶液a中首先加入聚山梨酯80,搅拌至混合均匀,再加入十六烷基三甲基季铵盐和艾司唑仑,15~25℃下搅拌0.5~1小时,使溶液中各组分充分混合,得到溶液b;
[0124]
(4)对溶液b进行ph调节,使用0.1mol/l的氢氧化钠和盐酸溶液调节溶液ph至6.5左右,加纯化水至1000g,搅拌均匀,得初级艾司唑仑混悬液;
[0125]
(5)使用高压均质机对初级艾司唑仑混悬液进行均质处理,得到最终艾司唑仑纳米混悬液。
[0126]
实施例7
[0127]
对实施例1~实施例6制备的艾司唑仑纳米混悬液和市售艾司唑仑片进行质量检测,对有关物质、含量、粒径分布、多聚分散系数(pdi)和zeta电位等指标进行检测,同时对各实施例制备样品及市售艾司唑仑片进行溶出曲线考察。
[0128]
1、有关物质
[0129]
采用hplc方法对不同实施例制备的纳米混悬液及市售艾司唑仑片(teva takeda yakuhin ltd.生产,1mg规格)进行有关物质和含量检测。
[0130]
色谱条件:用十八烷基硅烷键合硅胶为填充剂;以甲醇-水(65:35)为流动相;检
测波长为223nm;进样体积20μ1。
[0131]
具体结果如下:
[0132][0133]
根据以上检测结果,艾司唑仑片和实施例3和实施例4制备样品的有关物质处于同等水平,含量指标艾司唑仑片和各实施例样品无明显区别。
[0134]
2、粒径分布、多聚分散系数(pdi)和zeta电位检测
[0135]
本发明中粒径分布、多聚分散系数(pdi)和zeta电位采用zetasizer nano粒度分析仪(英国malvern)进行检测。
[0136]
6组实施例的粒径、多聚分散系数及zeta数据如下表以及图1至图3所示:
[0137] 实施例1实施例2实施例3实施例4实施例5实施例6粒径278
±
59243
±
51223
±
48278
±
39254
±
38345
±
82pdi0.354
±
0.1250.245
±
0.0980.213
±
0.0630.267
±
0.0720.276
±
0.0870.406
±
0.162zeta-31.3
±
0.34-25.6
±
0.16-32.1
±
0.76-36.1
±
0.14-29.1
±
0.71-27.4
±
0.35
[0138]
3、溶出曲线考察
[0139]
对自研制剂和市售的艾司唑仑片剂进行溶出曲线对比,溶出曲线测定方法选用中国药典2020年版四部通则0931第二法,温度37℃,转速为50rpm,溶出体积900ml,取样时间为5、10、15、30、60min,每次取样2ml并及时补充所取体积。
[0140]
如图4所示,与上述市售的艾司唑仑片剂(teva takeda yakuhin ltd.生产,1mg规格)相对比,纳米混悬液溶出速度明显高于片剂,达峰之后释药更平缓。
[0141]
实施例8
[0142]
与上述市售的艾司唑仑片剂(teva takeda yakuhin ltd.生产,1mg规格)相对比,本实施例对实施例3制备的样品进行影响因素和加速稳定性试验,对有关物质、含量、粒径、pdi及zeta电位进行检测。
[0143][0144]
根据试验结果可知,艾司唑仑片在60℃条件和40℃条件下含量基本无变化,杂质稍有增加;实施例3制备的艾司唑仑纳米混悬液在60℃10天及40℃加速6个月条件下,各项
指标无明显变化,产品质量稳定性好。
[0145]
实施例9
[0146]
使用艾司唑仑对家兔进行体内药动学和生物利用度研究,对服用艾司唑仑片和艾司唑仑纳米混悬液后不同时间点进行血药浓度测定,从而对比两种剂型产品在体内生物利用度。
[0147]
实验材料:艾司唑仑片(teva takeda yakuhin ltd.生产,1mg规格),自制艾司唑仑纳米混悬液(实施例3制备的艾司唑仑纳米混悬液);
[0148]
试验动物:健康家兔,体质量2.5kg
±
0.2kg,共6只(雄4只,雌2只)
[0149]
试验方法:
[0150]
将家兔按照雌雄随机分两组,每组2只雄兔和1只雌兔,按照50μg/kg剂量给两组家兔分别服用艾司唑仑片和艾司唑仑纳米混悬液。服药前0.5h试验动物完成进食,服药后于0.5、1、2、3、4、5、6、、12、24、48、72h共计11个时间点分别从家兔耳缘静脉取血2.5ml,进行离心处理后得到血浆样品。
[0151]
采用lc-ms进行检测,两组受试动物给药后血浆中艾司唑仑的平均浓度-时间曲线见图5。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。