1.本技术涉及生物技术领域,尤其涉及一种低强度超声降脂的方法及超声装置。
背景技术:
2.随着社会的不断发展,生活水平的不断提高,人们的饮食习惯不断发生变化,肥胖、2型糖尿病及其相关的代谢性疾病的发病人数逐年递增。这些疾病严重威胁人类健康,同时给社会经济带来巨大的负担。其中,肥胖症是指体内脂肪细胞体积和数量增加,造成体脂占体重的百分比异常增高,导致某些局部脂肪过多沉积;针对肥胖症的预防或者治疗以降脂为主,而目前针对肥胖症存在多种降脂方法,包括:
3.(1)通过化学成分来达到降脂的目的,例如口服减肥药,贴减肥贴等,这些方法优点是快速直接的控制体重,缺点是易反弹,对身体有副作用;
4.(2)通过体育锻炼减肥,例如跑步,游泳,爬山,仰卧起坐,俯卧撑等。这些方法都是比较科学合理健康的,但是作用间接,持续时间较长,不易坚持;
5.(3)通过控制饮食减肥,多吃水果蔬菜,粗粮,并且少吃脂肪和含糖量高的食物,这种方式健康有效但见效慢;
6.(4)通过物理方法,例如抽脂、针灸以及减重手术,风险较大,易对身体造成危害。
7.而上述的方法由于其作用的分子机制、细胞类型及细胞靶点不明确,大多数无法直接对肥胖脂肪组织中最关键的脂肪细胞本身的体积或数量进行作用。
8.机械敏感性离子通道piezo1参与细胞发育、细胞体积调节、细胞迁移、增殖,其广泛表达在血管、脂肪、肺、肠道、肾脏、膀胱等多种承受机械压力较高的组织当中,目前在成熟脂肪细胞中,piezo1可以调节脂肪生成及炎症,而作用在细胞膜上的各种机械刺激可以激活piezol,包括细胞表面的机械压痕、细胞迁移、流体剪切应力、细胞膜压缩、渗透性膨胀或细胞-细胞或细胞-基质界面产生的力;由于超声可以传送和聚焦在体内的一个小区域内,并根据特定的脉冲方案产生热或机械生物效应,因此超声可以对细胞机械方面的机械反应部件进行直接作用,从而导致这些部件感知物理力量并启动细胞信号,目前研究表明在非神经元细胞中piezol可通过高频率的超声或微泡被激活,但是目前有关超声降脂的方法大多是利用超声的热和空化作用,是利用超声的能量将脂肪细胞内的脂肪进行剔除,因此大部分的超声强度较高,对脂肪细胞有一定损害,因此如何无害化的对脂肪细胞降脂,是目前亟需解决的技术问题。
技术实现要素:
9.本技术提供了一种低强度超声降脂的方法及超声装置,以解决现有技术中高强度超声降脂对脂肪细胞损害较大的技术问题。
10.第一方面,本技术提供了一种低强度超声降脂的方法,所述方法包括:
11.将实验对象以预设体重目标进行第一喂养,得到第一实验模型;
12.根据所述第一实验模型的体重和形态,确定皮下脂肪超声的实验部位;
13.将所述实验部位进行皮下脂肪超声、细胞分离和浓度检测,得到对比脂肪细胞的第一浓度数据;
14.构建脂肪细胞特异性敲除piezo1基因的缺陷实验对象;
15.将所述缺陷实验对象以所述预设体重目标进行第二喂养和连续给药,得到第二实验模型;
16.将所述实验对象以所述预设体重目标进行所述第二喂养,得到第三实验模型;
17.分离所述第二实验模型和所述第三实验模型在所述实验部位的脂肪细胞,后以超声装置进行低强度超声,分别得到超声后缺陷脂肪细胞和激活piezo1通道的超声后对比细胞;
18.将所述超声后缺陷脂肪细胞和所述超声后对比细胞分别进行浓度检测,分别得到缺陷脂肪细胞的第二浓度数据和对比细胞的第三浓度数据;
19.根据对比脂肪细胞的所述第一浓度数据、对比细胞的所述第三浓度数据和缺陷脂肪细胞的所述第二浓度数据,判断所述低强度超声是否能激活所述piezo1基因;
20.若是,将待处理的脂肪细胞进行低强度超声,得到无害化减脂后的脂肪细胞;
21.其中,所述皮下脂肪超声和所述低强度超声的声压都为50kpa~1500kpa。
22.可选的,所述皮下脂肪超声和所述低强度超声的超声模式都为脉冲模式,所述皮下脂肪超声和所述低强度超声的脉冲重复频率都为80hz~120hz,所述皮下脂肪超声和所述低强度超声的占空比都为2%~8%。
23.可选的,所述低强度超声的超声作用时间为13min~18min,所述低强度超声包括以第二预设次数和第二预设时间进行低强度超声,所述第二预设次数为1次~2次,所述第二预设2d~3d。
24.可选的,所述皮下脂肪超声的超声作用时间为8min~12min,所述皮下脂肪超声包括以第一预设次数连续超声第一预设时间,所述第一预设次数为2次/d~3次/d,所述第一预设时间为10d~14d。
25.可选的,所述预设体重目标为30g~50g,所述连续给药的时间为4d~6d。
26.可选的,将所述实验部位进行皮下脂肪超声、细胞分离和浓度检测,得到对比脂肪细胞的第一浓度数据,具体包括:
27.将所述实验部位进行皮下脂肪超声,得到超声后实验模型;
28.分离所述超声后实验模型的脂肪组织,后进行细胞分离,得到对比脂肪细胞;
29.将所述对比脂肪细胞进行甘油含量检测,得到对比脂肪细胞的第一浓度数据。
30.可选的,分离所述超声后实验模型的脂肪组织,后进行细胞分离,得到对比脂肪细胞,具体包括:
31.提取所述超声后实验模型的脂肪组织,后进行染色和制片,得到对比脂肪细胞的形态数据;
32.根据所述对比脂肪细胞的形态数据,判断皮下脂肪超声是否影响对比脂肪细胞;
33.若是,则将对比脂肪细胞分离,得到分离后的对比脂肪细胞;
34.若否,则继续皮下脂肪超声至脂肪细胞变小为止。
35.可选的,所述第一喂养的时间≥4周,所述第二喂养的时间≥8周,所述第二喂养的环境温度为21℃~25℃。
36.第二方面,本技术提供了一种低强度超声降脂的超声装置,所述装置用于在第一方面所述的方法中进行低强度超声,所述超声装置包括:
37.超声换能器,所述超声换能器用于产生超声振动;
38.缓冲部,所述缓冲部的一端设置在所述超声换能器的输出端,所述缓冲部的一端固定在所述超声换能器的输出端,用以保证超声强度维持在低强度范围内;
39.承载部,所述承载部设置在所述缓冲部的正下方;
40.离心容器,所述离心容器的底端固定在所述承载部上,所述离心容器的顶端抵接在所述缓冲部的另一端,所述离心容器用以盛装所述对比脂肪细胞或所述缺陷脂肪细胞。
41.可选的,所述承载部包括支撑单元和弹性单元,所述弹性单元设置在所述支撑单元的表面,所述离心容器活动插入所述弹性单元中,用以实现对超声阶段振动的缓释和对离心容器的固定。
42.本技术实施例提供的上述技术方案与现有技术相比具有如下优点:
43.本技术实施例提供的一种低强度超声降脂的方法,通过先对实验对象进行预设体重的第一喂养,从而能根据喂养后的体重和形态,确定要进行皮下脂肪超声的实验部位,再通过对超声的实验部位进行处理,从而得到对比脂肪细胞的形态数据的第一浓度数据,再构建出敲除piezo1基因的缺陷实验对象,再对缺陷实验对象和实验对象分别进行第二喂养,并对缺陷实验对象进行激活剂的连续给药,保证缺陷实验对象中完全不含piezo1基因,由于缺陷实验对象不含piezo1基因,而实验对象含有piezo1基因,因此能构建出piezo1通道缺陷的第二实验模型和正常piezo1通道的第三实验模型,再对第二实验模型第三实验模型进行低强度超声和浓度检测,从而能准确得到对比脂肪细胞的第三浓度数据和缺陷脂肪细胞的第二浓度数据,再根据对比脂肪细胞的第一浓度数据判断皮下脂肪超声对实验对象的影响,再根据第二浓度数据和第三浓度数据进行对比,能有效的确定低强度超声是否能激活piezo1基因,从而能利用该低强度超声的条件对脂肪细胞进行降脂处理,由于采用低强度超声,不会对脂肪细胞的活性产生影响,从而能保证降脂过程对脂肪细胞的无害化处理。
附图说明
44.此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本发明的实施例,并与说明书一起用于解释本发明的原理。
45.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
46.图1为本技术实施例提供的方法的流程示意图;
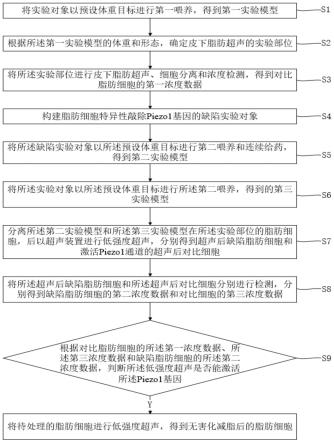
47.图2为本技术实施例提供的方法的详细流程示意图;
48.图3为图2的延续;
49.图4为本技术实施例提供的超声装置的结构示意图;
50.图5为本技术实施例提供的皮下脂肪超声的操作示意图;
51.图6为本技术实施例提供的皮下脂肪超声后的皮下脂肪重量结果示意图;
52.图7为本技术实施例提供的皮下脂肪超声后的皮下脂肪染色结果示意图;
53.图8为本技术实施例提供的皮下脂肪超声后选取的皮下脂肪细胞直径的结果示意图;
54.图9为本技术实施例提供的皮下脂肪超声后的皮肤组织染色结果示意图;
55.图10为本技术实施例提供的皮下脂肪超声后选取的皮肤组织细胞直径的结果示意图;
56.图11为本技术实施例提供的yoda1刺激脂肪细胞后组织上清液中甘油和游离脂肪酸的浓度结果示意图;
57.图12为本技术实施例提供的低强度超声刺激缺陷脂肪细胞后上清液中甘油浓度结果示意图;
58.图13为本技术实施例提供的低强度超声刺激对比脂肪细胞后上清液中甘油浓度的结果示意图;
59.其中,1-超声换能器,2-缓冲部,3-承载部,31-支撑单元,32-弹性单元,4-离心容器。
具体实施方式
60.为使本技术实施例的目的、技术方案和优点更加清楚,下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本技术的一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本技术保护的范围。
61.本技术的创造性思维为:由于在实验过程中发现脂肪细胞中特异性的敲除piezo1的小鼠在高脂饮食喂养时,可以出现抑制前脂肪细胞向成熟脂肪细胞的分化的现象,从而导致成熟的脂肪细胞变大,肥胖小鼠中白色脂肪组织的炎症增加,胰岛素敏感性降低,而piezo1是对物理力最敏感的通道之一,它在毫秒的范围内激活和失效的力量低至10pn,但是目前在非神经元细胞中piezol可通过高频率的超声或微泡被激活,而目前暂未有低强度超声是否能够激活piezol的报道,因此如果能明确低强度超声能实现脂肪细胞的降脂,能有效的保证超声降脂的同时对脂肪细胞的无害化处理。
62.在本技术一个实施例中,如图1所示,提供一种低强度超声降脂的方法,所述方法包括:
63.s1.将实验对象以预设体重目标进行第一喂养,得到第一实验模型;
64.s2.根据所述第一实验模型的体重和形态,确定皮下脂肪超声的实验部位;
65.s3.将所述实验部位进行皮下脂肪超声、细胞分离和浓度检测,得到对比脂肪细胞的第一浓度数据;
66.s4.构建脂肪细胞特异性敲除piezo1基因的缺陷实验对象;
67.s5.将所述缺陷实验对象以所述预设体重目标进行第二喂养和连续给药,得到第二实验模型;
68.s6.将所述实验对象以所述预设体重目标进行所述第二喂养,得到第三实验模型;
69.s7.分离所述第二实验模型和所述第三实验模型在所述实验部位的脂肪细胞,后以超声装置进行低强度超声,分别得到超声后缺陷脂肪细胞和激活piezo1通道的超声后对比细胞;
70.s8.将所述超声后缺陷脂肪细胞和所述超声后对比细胞分别进行浓度检测,分别得到缺陷脂肪细胞的第二浓度数据和对比细胞的第三浓度数据;
71.s9.根据对比脂肪细胞的所述第一浓度数据、对比细胞的所述第三浓度数据和缺陷脂肪细胞的所述第二浓度数据,判断所述低强度超声是否能激活所述piezo1基因;
72.若是,将待处理的脂肪细胞进行低强度超声,得到无害化减脂后的脂肪细胞;
73.其中,所述皮下脂肪超声和所述低强度超声的声压都为50kpa~1500kpa。
74.本技术实施例中,皮下脂肪超声和所述低强度超声的声压都为50kpa~1500kpa的积极效果是在该声压的范围内,能保证对实验对象的超声充分的同时对细胞的损伤更小,甚至不影响细胞的活性,从而保证脂肪细胞的活性;当声压的取值大于该范围的端点值,将导致的不利影响是超声强度过高,超声过程将导致细胞大量死亡或者损伤,当声压的取值小于该范围的端点值,将导致的不利影响是无法对实验对象超声完全,进而影响实验的准确性。
75.在一些可选的实施方式中,所述皮下脂肪超声和所述低强度超声的超声模式都为脉冲模式,所述皮下脂肪超声和所述低强度超声的脉冲重复频率都为80hz~120hz,所述皮下脂肪超声和所述低强度超声的占空比都为2%~8%。
76.本技术实施例中,皮下脂肪超声和低强度超声的脉冲重复频率为80hz~120hz的积极效果是都保证皮下脂肪超声和低强度超声都能产生充足的超声能量,从而实验对脂肪细胞的超声完全,进而保证整体方案得到准确性;当脉冲重复频率的取值大于该范围的端点值,将导致的不利影响是超声频率过快,影响细胞的活性,当脉冲重复频率的取值小于该范围的端点值,将导致的不利影响是超声频率过慢,无法保证将各脂肪细胞超声完全,进而影响实验的准确性。
77.皮下脂肪超声和低强度超声的占空比为2%~8%的积极效果是都保证皮下脂肪超声和低强度超声都能将脂肪细胞超声充分,进而保证整体方案得到准确性;当占空比的取值大于该范围的端点值,将导致的不利影响是超声强度过高,导致细胞死亡或者损伤,影响细胞活性,当占空比的取值小于该范围的端点值,将导致的不利影响是超声强度过低,无法对脂肪细胞进行充分超声,进而影响实验的准确性。
78.在一些可选的实施方式中,所述低强度超声的超声作用时间为13min~18min,所述低强度超声包括以第二预设次数和第二预设时间进行低强度超声,所述第二预设次数为1次~2次,所述第二预设2d~3d。
79.本技术实施例中,低强度超声的超声作用时间为13min~18min的积极效果是在该时间范围内,能保证对缺陷实验对象和实验对象的超声充分,同时对细胞的损伤更小,保证脂肪细胞的活性。
80.限定低强度超声的超声方式,保证对缺陷脂肪细胞和对比脂肪细胞的超声充分,从而保证实验的准确性。
81.在一些可选的实施方式中,所述皮下脂肪超声的超声作用时间为8min~12min,所述皮下脂肪超声包括以第一预设次数连续超声第一预设时间,所述第一预设次数为2次/d~3次/d,所述第一预设时间为10d~14d。
82.本技术实施例中,皮下脂肪超声的超声作用时间为8min~12min的积极效果是在该时间的范围内,能保证对实验对象的超声充分的同时对细胞的损伤更小,保证脂肪细胞
的活性。
83.限定皮下脂肪超声的具体形式,能保证对实验部位的脂肪超声的充分,从而能保证实验的准确性。
84.在一些可选的实施方式中,所述预设体重目标为30g~50g,所述连续给药的时间为4d~6d。
85.本技术实施例中,预设体重目标为30g~50g的积极效果是在该体重范围内,能认定实验对象具有肥胖的特征,保证脂肪细胞数量足够。
86.连续给药的时间为4d~6d的积极效果是在该给药的条件下能保证通过piezol基因激活剂确认敲除piezol基因的缺陷实验对象构建成功,从而保证实验的准确性。
87.在一些可选的实施方式中,如图2和图3所示,将所述实验部位进行皮下脂肪超声、细胞分离和浓度检测,得到对比脂肪细胞的第一浓度数据,具体包括:
88.s31.将所述实验部位进行皮下脂肪超声,得到超声后实验模型;
89.s32.分离所述超声后实验模型的脂肪组织,后进行细胞分离,得到对比脂肪细胞;
90.s33.将所述对比脂肪细胞进行甘油含量检测,得到对比脂肪细胞的第一浓度数据。
91.在一些可选的实施方式中,分离所述超声后实验模型的脂肪组织,后进行细胞分离,得到对比脂肪细胞,具体包括:
92.s321.提取所述超声后实验模型的脂肪组织,后进行染色和制片,得到对比脂肪细胞的形态数据
93.s322.根据所述对比脂肪细胞的形态数据,判断皮下脂肪超声是否影响对比脂肪细胞;
94.若是,则将脂肪细胞分离,得到分离后的对比脂肪细胞;
95.若否,则继续皮下脂肪超声至脂肪细胞变小为止。
96.本技术中,通过限定对比脂肪细胞的第一浓度数据具体得到的步骤,能保证实验的准确性。
97.在一些可选的实施方式中,如图4所示,所述构建脂肪细胞特异性敲除piezo1基因的缺陷实验对象,具体包括:
98.s41.将piezo1
flox/flox
的小鼠和iadipoq-creert2的小鼠进行交配,分别得到基因型为piezo1
flox/-:iadipoq-creert2的f1代杂合子小鼠;
99.s42.将所述f1代杂合子小鼠与piezo1
flox/flox
小鼠合笼进行交配,分别得到基因型为piezo1
flox/flox
:iadipoq-creert2的f2代杂合子小鼠和不含iadipoq-creert2:piezo1
flox/flox
基因型的对照小鼠;
100.s43.以对照小鼠为参照,将所述f2代杂合子小鼠继续培养,后以他莫昔芬连续给药和放置培养,得到特异性敲除piezo1基因的小鼠动物模型。
101.本技术实施例中,通过引入不同小鼠进行杂交,从而简略的得到脂肪细胞特异性敲除piezo1基因的小鼠动物模型,并且能保证小鼠动物模型的纯净度。
102.在一些可选的实施方式中,所述第一喂养的时间≥4周,所述第二喂养的时间≥8周,所述第二喂养的环境温度为21℃~25℃。
103.本技术实施例中,限定第一喂养和第二喂养的时间的积极效果是保证实验对象能
够充分增肥增重,进而保证每个实验对象都处于肥胖症的范围内。
104.限定第二喂养的环境温度为21℃~25℃的积极效果是在该温度范围内,实验对象的采食量和进食效果最佳,因此能够保证实验对象的增肥速度,从而保证实验对象处于肥胖症的范围内。
105.在本技术一个实施例中,提供一种低强度超声降脂的超声装置,所述装置用于在所述方法中进行低强度超声,如图4所示,所述超声装置包括:
106.超声换能器1,所述超声换能器1用于产生超声振动;
107.缓冲部2,所述缓冲部2的一端设置在所述超声换能器1的输出端,所述缓冲部2的一端固定在所述超声换能器1的输出端,用以保证超声强度维持在低强度范围内;
108.承载部3,所述承载部3设置在所述缓冲部2的正下方;
109.离心容器4,所述离心容器4的底端固定在所述承载部3上,所述离心容器4的顶端抵接在所述缓冲部2的另一端,所述离心容器4用以盛装所述对比脂肪细胞或所述缺陷脂肪细胞。
110.其中,缓冲部2为保鲜膜包裹的水袋,超声换能器1为620khz聚焦超声环能器。
111.本技术实施例中,通过限定超声装置的具体构成,利用缓冲部2将超声换能器1输出的超声波缓冲成低强度的超声波,再对离心容器4中的脂肪细胞进行超声,从而能保证对缺陷脂肪细胞和对比脂肪细胞在低强度的条件下的充分超声,同时保证各脂肪细胞的活性,保证后续的第二浓度数据和第三浓度数据的准确性。
112.在一些可选的实施方式中,所述承载部3包括支撑单元31和弹性单元32,所述弹性单元32设置在所述支撑单元31的表面,所述离心容器4活动插入所述弹性单元32中,用以实现对超声阶段振动的缓释和对离心容器4的固定。
113.本技术实施例中,通过限定承载部3由支撑单元31和弹性单元32两部分组成,能保证支撑单元31对整体装置的支撑,同时弹性单元32能抵消超声阶段振动对部件的影响,并且还能起到缓释的作用,避免各脂肪细胞受到高强度的超声而死亡或损伤。
114.实施例1
115.一、主要材料和试剂:
116.小鼠高脂饲料购买于江苏美迪森生物医药有限公司;
117.高脂样本甘油酶法测定试剂盒购买于北京普利莱基因技术有限公司;
118.苏木精染液、伊红染液购买于北京鼎国生物有限公司;
119.多聚甲醛、二甲苯、无水乙醇购买于天津化学试剂厂;
120.collagenase tpye ii购买于西安热默尔生物有限公司。
121.主要试剂配置方法:
122.二、主要试剂配置方法:
123.梯度乙醇溶液:在无水乙醇中加入不同比例的ddh2o混匀,配置成70%、80%、90%和95%的梯度乙醇溶液。
[0124]1×
pbs(1l):称取氯化钠8g,氯化钾0.2g,磷酸二氢钾0.24g,磷酸氢二钠1.438g,用ddh20定容至1l,高压灭菌后使用。
[0125]
hbss:(1l):称取氯化钠8g,氯化钾0.4g,硫酸镁0.1g,氯化镁0.1g,磷酸二氢钾0.06g,磷酸氢二钠0.06g,葡萄糖1g,氯化钙0.14g,碳酸氢钠0.35g,用ddh20定容至1l,调ph
至7.4,过滤除菌并储存于4℃。
[0126]
fat buffer包括:
[0127]
125ml的浓度为1m的nacl溶液;
[0128]
5ml浓度为1m的kcl溶液;
[0129]
1ml浓度为1m的cacl2溶液;
[0130]
25ml浓度为1m的tris溶液,ph=8;
[0131]
2.5ml浓度为1m的mgcl2溶液;
[0132]
1ml浓度为1m的kh2po4溶液;
[0133]
加水至1000ml,调ph至7.4,常温保存,用时在50ml的fat buffer中加0.0396g葡萄糖和1gbsa,置于37℃条件下预热。
[0134]
一种低强度超声降脂的方法,方法包括:
[0135]
s1.将育龄为8周的c57bl/6j实验小鼠以高脂饲料进行4周的第一喂养至体重为30g~50g的范围内,得到第一实验模型
[0136]
s2.根据第一实验模型的具体体重和形态,选取第一实验模型的腹部区域为实验部位;
[0137]
s31.将实验小鼠麻醉后固定在泡沫板上进行皮下脂肪超声,具体操作和部位如图5所示,得到超声后的小鼠,其中,皮下脂肪超声的中心频率为620khz,皮下脂肪超声的焦域负声压为700kpa,皮下脂肪超声的脉冲重复频率为100hz,皮下脂肪超声的占空比为5%,皮下脂肪超声的超声作用时间10min,皮下脂肪超声的次数为2次/天,皮下脂肪超声的持续时间为12d;
[0138]
s321.提取所述超声后实验模型的脂肪组织,后进行染色和制片,得到对比脂肪细胞的形态数据,具体操作包括:
[0139]
1.取脂肪组织:
[0140]
处死小鼠,将其四肢固定在泡沫板上,沿小鼠腹部正中央剪开皮肤,暴露出腹腔,取超声刺激部位皮肤及皮下脂肪,其中皮下脂肪称重,结果显示超声后脂肪重量变小。统计结果见图6。观察皮下脂肪以及皮肤脂肪组织形态学变化,放入装有1ml的质量浓度为4%多聚甲醛的ep管中,固定过夜;
[0141]
2.石蜡包埋
[0142]
组织固定好以后,进行脱水、透明、浸蜡等步骤,再用莱卡石蜡包埋机将组织包埋于蜡块中,具体步骤如下:
[0143]
(1)脱水:将固定好的组织按顺序经质量浓度为70%、80%、90%和95%梯度的乙醇溶液进行脱水,每个梯度浸泡2h,最后将组织放入100%乙醇溶液中过夜;
[0144]
(2)透明:将组织放入二甲苯ⅰ和二甲苯ii中各浸泡2h;
[0145]
(3)浸蜡:将组织样放入石蜡ⅰ和石蜡ii液体中各浸泡2h;
[0146]
3.切片
[0147]
组织蜡块用thermo旋转切片机进行切片,切片厚度为5μm;组织切片经过展片、捞片和烤片三个过程进行,具体步骤如下:
[0148]
(1)展片和捞片:将切好的脂肪切片放于45℃恒温水浴中进行展片,展好后用载玻片小心地捞出,做好标记;
[0149]
(2)烤片:将切片放于37℃烤片机中过夜;
[0150]
4.染色
[0151]
将烘干后的切片放入切片架中,经过脱蜡、苏木素染色、伊红染色、脱水和封片步骤,具体操作如下:
[0152]
(1)脱蜡:将切片架依次放入二甲苯ⅰ、ii和iii中,各浸泡7min,再依次放入100%乙醇溶液ⅰ和ii,以及90%、80%和70%梯度的乙醇溶液中,各浸泡1min,进行脱蜡;
[0153]
(2)苏木素染色:放入苏木素溶液中,染色7min,再用流水冲洗10min;
[0154]
(3)伊红染色:放入伊红溶液中,染色4min,再用流水冲洗1min;
[0155]
(4)脱水:依次放入70%、80%和90%梯度的乙醇溶液中各1min,100%乙醇溶液ⅰ和ii中各1min,二甲苯ⅰ和ii中各3min;
[0156]
(5)封片:用中性树胶封片;
[0157]
利用上述常规方法进行石蜡包埋、切片和h&e染色后,显微镜下拍照,皮下脂肪染色结果见图7,直接观察到超声组脂肪细胞变小;随机选取50个脂肪细胞除测量其直径,对照组脂肪细胞平均直径为78.69μm,超声组脂肪细胞平均直径为45.28μm,结果发现超声组皮下脂肪细胞直径较对对照组变小,统计结果见图8;这一结果表明超声组皮下脂肪细胞变小;
[0158]
皮肤染色结果见图9,直接观察到超声组皮肤脂肪细胞变小;随机选取50个脂肪细胞测量其直径,对照组脂肪细胞平均直径为34.54μm,超声组脂肪细胞平均直径为23.47μm,结果发现超声组皮肤脂肪细胞直径较对对照组变小,统计结果见图10,这些结果均表明超声组脂肪细胞变小。
[0159]
s322.根据所述对比脂肪细胞的形态数据,判断皮下脂肪超声能影响对比脂肪细胞。
[0160]
实施例2
[0161]
将实施例2和实施例1进行对比,实施例2和实施例1的区别在于:
[0162]
s33.将所述对比脂肪细胞进行甘油含量检测,得到对比脂肪细胞的第一浓度数据,具体包括:
[0163]
将小鼠处死,取小鼠附睾或卵巢周围脂肪组织于的hbss(含ca
2
)溶液中,清洗两次。然后将脂肪组织剪碎后加入fat buffer(含collagenase tpye ii 0.25mg/ml)37℃,1h,过滤后离心,取上层脂肪细胞,加入新的fatbuffer,清洗3次后,重悬细胞,得到对比脂肪细胞,待用;
[0164]
(1)对重悬后的上清液中甘油含量进行测定,具体步骤为:
[0165]
取上述经过重悬后获得的上清液70℃加热10min灭活脂肪酶;
[0166]
室温5000rpm离心5min,上层清液即可用于酶学测定;
[0167]
配置工作液:r1:r2=4:1;
[0168]
标准品稀释:将4mm甘油标准品倍比稀释为1000、500、250、125、62.5、31.25、15.625、7.8125;
[0169]
在37℃条件下反应10min,得到反应液;
[0170]
将反应液在紫外分光光度计的550nm处测od值;
[0171]
根据测定的od值绘制标准曲线,并计算超声后小鼠脂肪细胞的甘油浓度;
[0172]
(2)对重悬后的上清液的蛋白含量进行测定,具体步骤为:
[0173]
bca蛋白定量法,采用thermo试剂盒进行蛋白定量,具体步骤为:
[0174]
取适量bca显色剂置于室温,在在96孔板中加入2μl不同浓度的bsa蛋白标准品(0.125mg/ml、0.25mg/ml、0.5mg/ml、0.75mg/ml、1mg/ml、1.5mg/ml、2mg/ml)及待测蛋白样品,设置1组复孔;
[0175]
每孔加入98μl工作液,注意避免气泡出现,避光室温孵育5min;
[0176]
用酶标仪测定562nm条件下的od值;
[0177]
根据所得od值绘制标准曲线,再根据标准曲线计算待测样品的蛋白浓度;
[0178]
实施例3
[0179]
将实施例3和实施例2进行对比,实施例3和实施例2的区别在于:
[0180]
s4.构建脂肪细胞特异性敲除piezo1基因的缺陷实验对象,具体步骤为:
[0181]
s41.将piezo1
flox/flox
的小鼠和iadipoq-creert2的小鼠进行交配,分别得到基因型为piezo1
flox/-:iadipoq-creert2的f1代杂合子小鼠;
[0182]
s42.将所述f1代杂合子小鼠与piezo1
flox/flox
小鼠合笼进行交配,分别得到基因型为piezo1
flox/flox
:iadipoq-creert2的f2代杂合子小鼠和不含iadipoq-creert2:piezo1
flox/flox
基因型的对照小鼠;
[0183]
s43.以对照小鼠为参照,将所述f2代杂合子小鼠继续培养,后以他莫昔芬连续给药和放置培养,得到脂肪细胞特异性敲除piezo1基因的缺陷小鼠动物模型。
[0184]
s5.将所述缺陷实验对象以所述预设体重目标进行第二喂养和连续给药,得到第二实验模型,具体步骤为:将缺陷小鼠动物模型以高脂饲料在环境温度为21℃~25℃的条件下进行8周的第二喂养至体重达到30g~50g的预设体重目标,自由饮水,不限饮食,后连续用他莫昔芬(tm)给药5d和放置培养7d~14d,得到第二实验模型;再针对得到的第二实验模型进行脂肪组织取材和脂肪细胞分离,得到缺陷脂肪细胞。
[0185]
实施例4
[0186]
将实施例4和实施例3进行对比,实施例4和实施例3的区别在于:
[0187]
将缺陷脂肪细胞,用piezo1激活剂yoda1分别刺激缺陷脂肪细胞和对比脂肪细胞,监测细胞组织上清液中甘油和游离脂肪酸的浓度,结果见图11。
[0188]
实验表明,用yoda1刺激缺陷脂肪细胞后,敲除piezo1基因的敲除组的游离脂肪酸和甘油浓度较对比脂肪细胞的对照组均降低,说明敲除piezol后脂肪分解降低。
[0189]
实施例5
[0190]
将实施例5和实施例4进行对比,实施例5和实施例4的区别在于:
[0191]
s6.将实验对象以30g~50g的预设体重目标进行第二喂养,得到第三实验模型;
[0192]
s7.分离第二实验模型和第三实验模型在实验部位的脂肪细胞,后以超声装置进行低强度超声,分别得到超声后缺陷脂肪细胞和激活piezo1通道的超声后对比细胞,具体操作为:
[0193]
将上述得到的缺陷脂肪细胞换新的fatbuffer,混匀,取100μl细胞悬液放于提前剪好的小管,用封口膜封住,注意不能有气泡,放入超声装置,进行低强度超声,其中,低强度超声的中心频率为530khz,强度超声的焦域位置负声压为10kpa,强度超声的脉冲重复频率为100hz,低强度超声的占空比为5%,单次低强度超声的超声作用时间为15min,每天低
强度超声的次数为1次,低强度超声的时间为3d,得到超声后缺陷脂肪细胞;
[0194]
将第三实验模型的实验小鼠分别按照上述的处死过程进行处死,后取小鼠附睾或卵巢周围脂肪组织于的hbss(含ca
2
)溶液中,清洗两次。然后将脂肪组织剪碎后加入fatbuffer(含浓度为0.25mg/ml的collagenase tpye ii)在37℃条件下放置1h,过滤后离心,取上层的对比脂肪细胞,加入新的fat buffer,清洗3次后,重悬细胞,进行低强度超声,得到激活piezo1通道的超声后对比细胞;
[0195]
s8.将所述超声后缺陷脂肪细胞进行缓冲液中游离脂肪酸和甘油含量的检测,将所述超声后对比细胞进行缓冲液中甘油含量的检测,分别得到如图12所示的缺陷脂肪细胞的第二浓度数据和如图13所示的对比细胞的第三浓度数据;
[0196]
s9.根据对比脂肪细胞的所述形态、所述第一浓度数据、对比细胞的所述第三浓度数据和缺陷脂肪细胞的所述第二浓度数据,判断所述低强度超声能激活所述piezo1基因,将待处理的脂肪细胞进行低强度超声,得到无害化减脂后的脂肪细胞;
[0197]
实施例6
[0198]
将实施例6和实施例5进行对比,实施例6和实施例5的区别在于:
[0199]
一种低强度超声降脂的超声装置,用于在方法中进行低强度超声,所用超声装置的具体结构为:超声换能器1,所述超声换能器1用于产生超声振动;
[0200]
缓冲部2,所述缓冲部2的一端设置在所述超声换能器1的输出端,所述缓冲部2的一端固定在所述超声换能器1的输出端,用以保证超声强度维持在低强度范围内;
[0201]
承载部3,所述承载部3设置在所述缓冲部2的正下方;
[0202]
离心容器4,所述离心容器4的底端固定在所述承载部3上,所述离心容器4的顶端抵接在所述缓冲部2的另一端,所述离心容器4用以盛装所述对比脂肪细胞或所述缺陷脂肪细胞。
[0203]
所述承载部3包括支撑单元31和弹性单元32,所述弹性单元32设置在所述支撑单元31的表面,所述离心容器4活动插入所述弹性单元32中,用以实现对超声阶段振动的缓释和对离心容器4的固定。
[0204]
具体工作过程为:在使用阶段,向包括离心管和保鲜膜的离心容器4中加入缺陷脂肪细胞或对比脂肪细胞,并将离心容器4插入弹性单元32中,而弹性单元32一般为泡沫板,可以很好的固定离心容器4,而泡沫板设置在为支撑架的支撑单元31上,因此能将将离心容器4的空间位置固定,再将620khz聚焦超声换能器1下设置缓冲部2,而缓冲部2和离心容器4之间还设置保鲜膜,实现对离心管的密封,随后超声换能器1工作,超声波先经过缓冲部2的声波缓冲,再通过缓冲部2振动带动离心容器4振动,将盛装在内的缺陷脂肪细胞或对比脂肪细胞随之振动超声,从而实现对二者的低强度超声。
[0205]
本技术实施例中的一个或多个技术方案,至少还具有如下技术效果或优点:
[0206]
(1)本技术实施例提供的方法,通过先对普通小鼠进行高脂饲料喂养,再进行低强度的第一皮下脂肪超声,确定第一影响程度,再通过构建特异性敲除piezo1基因的小鼠动物模型,根据构建的敲除基因的小鼠模型进行给药和放置培养,再通过特定的超声装置对敲除基因的脂肪进行第二皮下脂肪超声,进而得到低强度超声对无piezo1基因脂肪细胞的第二影响程度,最后通过对第一影响程度和第二影响程度的对比,可以有效的排除超声本身的影响,从而能有效的揭示低强度超声对piezo1存在影响,进而保证低强度超声降脂能
够促进脂肪分解。
[0207]
(2)本技术实施例提供的方法,明确给出了单纯对小鼠进行超声的参数,以及对离体脂肪细胞进行超声的参数,实验结果表面在低强度的超声条件下,均能促进脂肪细胞的脂肪分解和转变。
[0208]
(3)本技术实施例提供的方法,低强度超声刺激正常脂肪细胞后,与对照组相比缓冲液中甘油含量增加,表明了低强度超声刺激脂肪细胞可以促进脂肪分解,但刺激敲除piezo1的缺陷脂肪细胞后,与对照组相比缓冲液中甘油含量较低,说明敲除脂肪细胞中piezo1后超声的作用减弱,说明低强度超声是通过piezo1影响脂肪分解的。
[0209]
(4)本技术实施例提供的方法,表面低强度超声刺激脂肪细胞可以激活piezo1通道,揭示了降脂的重要通路,开创性地探索了在脂肪细胞中piezo1通道发挥的重要作用,创新性的揭示了低强度超声可以通过激活piezo1通道,促进脂肪细胞中脂肪分解,使脂肪细胞体积变小这一过程。
[0210]
(5)本技术实施例提供的方法,表明低强度超声及其调控的piezo1通道很可能作为从促进脂肪细胞脂肪分解的角度干预肥胖、糖尿病等疾病的新靶点,为临床治疗病理性肥胖提供新的策略。
[0211]
需要说明的是,在本文中,诸如“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括要素的过程、方法、物品或者设备中还存在另外的相同要素。
[0212]
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
[0213]
以上仅是本发明的具体实施方式,使本领域技术人员能够理解或实现本发明。对这些实施例的多种修改对本领域的技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所申请的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。