1.本发明涉及生物技术领域,尤其是涉及细菌菌影的灭活方法。
背景技术:
2.细菌菌影(bacterial ghosts,bgs)是一种没有细胞浆和核酸的细菌体,是革兰阴性菌被裂解后形成的具有完整细菌结构的细菌空壳,由于细菌菌影的制备过程中没有蛋白变性,菌影保留了与活菌完全一样的细菌胞膜结构和相关抗原蛋白,从而能够保留与活菌相似的免疫原性,还可同时刺激机体产生体液免疫和细胞免疫,交叉保护能力优于灭活疫苗。同时由于bgs不包含遗传物质,只存在细菌空壳,因此不存在返毒、恢复毒力的可能,没有致毒副作用,安全性远远优于活疫苗。
3.目前细菌菌影最主要的制备方式为基因工程方法,即通过细菌裂解基因(如噬菌体phix174的裂解基因e)在细菌细胞膜上形成孔道,使得细菌细胞内容物排出而形成菌影,再利用灭活剂进行二次灭活。然而灭活剂浓度过高会对细菌菌影造成损伤,影响其免疫原性,灭活剂浓度过低则又可能造成细菌病原无法被完全灭活的情况。此外,灭活剂的分解、化学反应等也可能造成灭活不彻底,且会存在分解产物,增大疫苗免疫风险。
4.由于细菌残留对疫苗的安全性的影响重大,特别是在布鲁氏菌这种人畜共患病的疫苗产品中,细菌灭活不完全对于动物和人类均有重大安全隐患。因此在保持免疫原性和菌影结构的同时,菌影疫苗中活菌的完全灭活,特别是高浓度菌影疫苗中活菌的完全灭活是现有技术当中菌影制备技术中的难点之一,亟待解决。鉴于此,本发明特提出一种高浓度菌影疫苗灭活方法。
技术实现要素:
5.本发明的目的在于提供一种高浓度菌影疫苗灭活方法,该灭活方法用于解决高浓度菌影疫苗制备过程中的活菌完全灭活,并保持细菌完整结构和免疫原性的问题。
6.为了解决上述技术问题,本发明提供的技术方案为:
7.一种高浓度菌影疫苗灭活方法,包含以下步骤:
8.a)细菌培养结束后,将罐体温度升高,进行灭活培养;
9.b)间隔8h-72h更换一次发酵罐。
10.上述高浓度菌影疫苗灭活方法中,所述步骤a)罐体温度升高至42℃,100r/min培养。
11.上述高浓度菌影疫苗灭活方法中,步骤b)所述更换一次发酵罐的操作步骤为将发酵罐中的全部发酵液收集后打入另一个无菌发酵罐中。
12.上述高浓度菌影疫苗灭活方法中,所述步骤b)倒罐间隔时间优选为12h-36h,进一步优选为24h。
13.上述高浓度菌影疫苗灭活方法中,所述步骤b)倒罐间隔时间可以是8h、12h、24h、36h、72h,优选为24h。
14.进一步地,上述高浓度菌影疫苗灭活方法中抗原灭活培养总时长至少为3日,即72h。
15.受限于当下高浓度培养技术的效果,在本发明的一些实施方案中,所述灭活处理的菌液浓度为4.5
×
10
10
cfu/ml、5.0
×
10
10
cfu/ml、5.5
×
10
10
cfu/ml、6.0
×
10
10
cfu/ml、6.5
×
10
10
cfu/ml、7.0
×
10
10
cfu/ml、7.5
×
10
10
cfu/ml、8.0
×
10
10
cfu/ml、8.5
×
10
10
cfu/ml、9.0
×
10
10
cfu/ml、9.5
×
10
10
cfu/ml、10
11
cfu/ml。
16.在本发明的一些实施方案中,所述的灭活处理的菌液浓度为≥4.5
×
10
10
cfu/ml,随着高浓度培养技术的发展,更高浓度的菌液也适用于本发明的灭活方法。
17.上述高浓度菌影疫苗灭活方法中,当活菌数下降至0cfu/ml时,停止培养。
18.进一步地,上述高浓度菌影疫苗灭活方法还包含菌影制备、培养步骤,所述步骤为:
19.a)菌影制备方式为噬菌体e蛋白介导的裂解机制,将噬菌体e基因克隆入含温控元件的pbv220质粒,以pbv220-e为模板扩增tc-e温控裂解元件,将其与广谱质粒pbbr1mcs-2相连,将质粒电转入布鲁氏菌a19株感受态细胞中,经含卡那霉素的培养基筛选培养、鉴定,获得符合预期的布鲁氏菌a19-bg株;
20.b)将构建好的a19-bg菌株,进行扩繁培养和种子制备;
21.c)将制备好的种子打入发酵罐中,进行细菌放大培养,28℃,300r/min,培养48~56h。
22.进一步地,上述高浓度菌影疫苗灭活方法还包含灭活抗原的收集步骤,所述步骤为:倒罐时将无菌发酵罐中的全部发酵产物,打入另一个无菌发酵罐中,并对倒罐完成后的原抗原罐做蒸汽消杀工作,确保罐体无菌。
23.进一步地,上述高浓度菌影疫苗灭活方法还包含抗原灭活情况的监测步骤,所述步骤为:每次倒罐时取样,进行活菌计数。
24.本技术与现有技术相比,具有以下优点:采用物理方法灭活得到的菌液中完全不含有活细菌,处理后菌株表面有明显空洞,呈空壳状,形态完整,具有良好的免疫能力,且未引入灭活剂,减少其对后续保存和免疫步骤中的影响。同时,发明人通过实验,惊奇的发现,本发明采用的处理方法能够在菌液培养浓度为4.5
×
10
10
cfu/ml以上时,均能取得完全去除活菌的效果,能够应用于疫苗的大规模工业生产,节约生产成本,降低生物安全风险。
25.在本发明中,所述的细菌可以为大肠杆菌、布鲁氏菌、沙门氏菌、巴氏杆菌、胸膜放线杆菌,在本发明的一个实施方案中,所述的细菌为布鲁氏菌。
附图说明
26.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
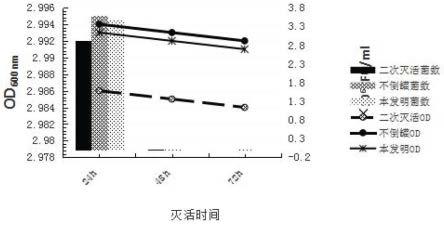
27.图1为实施例1中灭活处理前、后菌液od
600
检测结果
28.图2为a19bg菌株生长曲线测定结果
29.图3为对比例1中不同制备方法处理后活菌数量检测结果
具体实施方式
30.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
31.除非本文另有定义,连同本发明使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。术语的含义和范围应当清晰,然而,在任何潜在不明确性的情况下,本文提供的定义优先于任何字典或外来定义。在本技术中,除非另有说明,术语“包括”及其他形式的使用是非限制性的。
32.一般地,连同本文描述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白和核酸化学和杂交使用的命名法和其技术是本领域众所周知和通常使用的那些。除非另有说明,本发明的方法和技术一般根据本领域众所周知,且如各种一般和更具体的参考文献中所述的常规方法来进行,所述参考文献在本说明书自始至终引用和讨论。连同本文描述的分析化学、合成有机化学以及医学和药物化学使用的命名法、以及其实验室程序和技术是本领域众所周知和通常使用的那些。
33.本发明中所述质粒的构建,以及质粒的构建中引物设计、扩增、酶切、连接步骤可以按照本领域技术人员所公知的分子生物学技术方法进行。
34.下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
35.本发明实施例中用到的主要试剂及仪器信息如下:
36.表1 试剂及仪器信息表
[0037][0038]
本发明中采用布鲁氏菌a19作为示例,来说明本发明技术方案的技术效果。
[0039]
实施例1 a19bg菌株灭活方法
[0040]
1.基础种子扩繁
[0041]-80℃超低温冰箱中取出构建好的菌株,放置于37℃恒温培养箱中解冻,解冻后用一次性接种环在布鲁氏菌琼脂平皿(kana平皿100μg/ml)上划线培养,28℃培养5~7日。
[0042]
2一级种子制备
[0043]
挑取单菌落放入10ml布鲁氏肉汤中,28℃,160r/min,培养24h。
[0044]
3二级种子制备
[0045]
取制备好的一级种子,以2%的接种比例加入到500ml三角摇瓶含200ml布鲁氏肉汤培养基中,取100mg/ml的卡那霉素,按照1:1000的比例添加到培养基中,28℃,300r/min,培养24h。
[0046]
4抗原培养
[0047]
将种子罐中的菌液打入发酵罐中,取100mg/ml的卡那霉素,按照1:1000的比例添加到布鲁氏肉汤中,28℃,100r/min,培养48h以上,至od
600
值达到4.5
×
10
10
cfu/ml以上;在培养18-24h时,加入5%蔗糖溶液。
[0048]
5抗原灭活培养
[0049]
抗原培养结束后,将罐体温度升高至42℃,300r/min培养,每间隔24h,将无菌发酵罐中的全部发酵产物,打入另一个无菌发酵罐中,并对倒罐完成后的原抗原罐做蒸汽消杀工作,确保罐体无菌,每日取样计数及od
600
值监测。
[0050]
6灭活结果检测
[0051]
6.1 od检测结果
[0052]
取灭活后的抗原5ml,加入到5ml的布鲁氏肉汤中,用分光光度计检测菌液od
600
的吸光度值,并记录;按照30℃、200r/min的条件恒温培养12h后,再次检测其od
600
值,od
600
检测结果如图1所示。
[0053]
结果表明,培养前、后测定的od
600
值无变化,说明抗原完全灭活。
[0054]
6.2涂板检测结果
[0055]
灭活72h,取5ml样品,接入10ml布鲁氏肉汤,28℃恒温培养2日,取200μl涂平皿培养,观察有无布鲁氏菌生长。
[0056]
结果表明,培养后的平皿,无布鲁氏菌生长,说明抗原完全灭活。
[0057]
实施例2 培养时长和倒罐时间间隔选择
[0058]
采用实施例1中的扩繁、放大培养方法,每8h取样进行od
600
值检测,进行a19bg菌株生长曲线测定,结果见图2。
[0059]
结果表明,在培养48h后,细菌浓度均已达到4.7
×
10
10
cfu/ml。
[0060]
而后对浓度为4.7
×
10
10
cfu/ml的菌液进行灭活处理和活菌计数,具体试验分组和检测结果如表2所示。
[0061]
表2 不同倒罐时间间隔的od值
[0062][0063]
表2结果显示,在一定的灭活培养时间内,倒罐间隔为8h、12h、24h时,都能使抗原完全灭活,但倒罐时间间隔短势必会造成倒罐次数增加,在最小处理时间(8小时)的基础上适当延长倒罐间隔时间,能够确保生产过程中不同浓度菌液的活菌去除效果不会存在因培养条件差异所造成的灭活不彻底的问题,而倒罐次数过多也会增加生产成本,因此结合活菌去除效果、免疫原性和生产成本考虑,确定灭活培养时间为72h,倒罐间隔为24h。
[0064]
实施例3 不同菌液浓度灭活效果
[0065]
采用实施例1-2中的扩繁、放大和灭活培养方法,分别对a19bg菌株进行抗原培养,
每8h取样进行od
600
值检测,待菌液浓度分别达5.0
×
10
10
cfu/ml、5.5
×
10
10
cfu/ml、6.0
×
10
10
cfu/ml时,对菌液进行灭活处理和活菌计数,验证本发明的灭活效果,具体检测结果如表3所示。
[0066]
表3 不同菌液浓度灭活效果
[0067][0068]
结果表明,本发明的灭活方法可以对菌液浓度为5.0
×
10
10
cfu/ml、5.5
×
10
10
cfu/ml、6.0
×
10
10
cfu/ml的菌液进行完全灭活。
[0069]
对比例1
[0070]
1.a19bg菌液制备
[0071]
采用实施例1中的扩繁、放大培养方法,完成a19bg菌株抗原培养,获得a19bg菌液。
[0072]
2.不同方法处理步骤
[0073]
2.1方法1 a19bg菌液以42℃,300r/min灭活处理72h,处理期间不进行倒罐操作,72h后取样进行检测。
[0074]
2.2方法2 a19bg菌液42℃,以150r/min诱导裂解48h后,向菌液中添加β-丙内酯(blp),间隔2h后再次添加blp,2次添加后使其终浓度为0.1%,42℃,以150r/min继续处理处理36小时,取样进行检测。
[0075]
2.3按照本发明实施例1中方法进行灭活。
[0076]
3.结论
[0077]
上述方法1-2制备得到的菌液活菌检测方法同实施例1,检测结果如图3所示;其中方法1处理后的菌液中仍有2.1
×
102cfu/ml的活菌存在,不能够完全去除活菌,方法2处理后的菌液中仍有16cfu/ml的活菌存在,也不能够完全去除活菌,而本发明制备方法处理的菌液中活菌数量为0,说明本发明在高浓度抗原完全灭活的菌影抗原制备方面具有显著的优势。
[0078]
使用对比例1中的方法制备得到的菌影抗原,制备相同抗原含量的a19bg疫苗,检测3种疫苗免疫动物后的保护效果,具体实验分组和检测结果如表4所示。
[0079]
表4 不同处理方式所制备疫苗保护效率检测结果
[0080][0081]
由以上试验结果可知,本发明所提供的方法制备的菌影可为免疫动物提供有效的保护效力,保护效率高达100%,而不使用倒罐操作或引入灭活剂二次灭活处理的抗原制备疫苗免疫动物后保护效力最高为90%,本发明保护效力提升至100%。
[0082]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽
管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。