1.本发明属于细胞生物学技术领域,尤其涉及胚胎干细胞保存方法及采用的冻存液和其制备方法与应用。
背景技术:
2.胚胎干细胞(embryonic stem cells,escs)是从早期胚胎内细胞团或者胚胎原始生殖细胞分离克隆出来的一种具有无限增殖能力和全向分化能力的干细胞。在特定的条件下,escs可以分化为神经细胞、骨细胞、胰岛细胞、心肌细胞等,被称为“万用细胞”。escs的主要生物学特性有:(一)在适当的培养条件下可以保持特定的细胞形态和生长特性,具有永久的自我更新能力,并表达特定的细胞表面抗原和酶,具有正常的二倍体核型;(二)具有多分化的潜能性,在适当的诱导条件下可以在体外分化出属于三个胚层的分化细胞;(三)易于基因改造,在体外可以导入异源基因、报告基因或标志基因,并且理论上escs经过基因改造后一般仍然能够保持其扩增和分化的全能性。
3.由于escs细胞经长期培养后可能会出现核型异常、未分化的细胞的克隆数相应的减少等,因此,需要将其进行低温保存。而在低温的环境下,细胞容易受到损伤,需要加入冻存保护液来保护细胞。目前常用的细胞冻存保护液为 10%dmso 90%胎牛血清(fbs),其对细胞保护效果好,通用性高,但是配方中含有动物来源的fbs和对细胞有毒性的dmso,这些因素的存在限制其应用。因此,无毒性,不含血清的冷冻保存液的开发显得尤其必要。
4.目前,park等使用人白蛋白替代fbs,即生理盐水 10%dmso 9%人体白蛋白作为冷冻保护剂,冻存效果与含血清相比无明显差异
1.,但是该冷冻保护剂仍然需要加入对细胞存在毒性的dmso。更进一步地,鲁瑞周等使用5%dmso 羟乙基淀粉(hes)组合冷冻脐带造血干细胞,与10%dmso相比,两者在细胞存活率方面无显著差异
2.,该冷冻保护剂虽然不含血清,且降低了dmso的浓度,减少了对细胞的损伤,但仍然无法做到同时不含血清和dmso。可见,目前来说,开发不含血清,同时不含dmso,且不牺牲冻存效果的冷冻保护剂是比较难的。
5.血小板裂解物用于细胞冻存已有报道,如cn107027743a,发明人采用5%血小板裂解物结合bfgf、l-谷氨酰胺、海藻糖、羟乙基淀粉、羧甲基纤维素钠和甘油来冻存脂肪干细胞,其中血小板裂解物可以降低溶液中电解质的浓度,减少阳离子进入细胞的数量。采用该冻存液冻存脂肪干细胞12个月后,细胞存活率能够达到93%,且不影响脂肪干细胞分化能力。在cn108617638b中,发明人采用5~20%的血小板裂解物结合dmso、hsa、pvp、d-海藻糖和血清来冻存皮肤组织或细胞,相比不含血小板裂解物的冻存保护液,该保护液能够更好地保护冻存的细胞或组织,冻存的细胞活力和活率明显提高。可见,将血小板裂解物添加到冻存液中,可能仍然需要加入dmso和/或血清才能获得良好的冻存效应。
6.[1]park s,lee dr,nam js,et al.fetal bovine serum-free cryopreservation methods for clinical banking of human adipose-derived stem cells[j].cryobiolog y,2018,81:65-73.
[0007]
[2]鲁瑞周,贺雪萍,王丹丹等.dmso联合hes冷冻保护剂对脐带造血干细胞冷冻影响研究[j].现代诊断与治疗,2012,23(12):2098-2099.
技术实现要素:
[0008]
本发明目的在于克服现有技术存在的不足,而提供一种不依赖血清和 dmso的胚胎干细胞冻存液,采用本发明冻存液冻存后细胞复苏存活率与血清和dmso冻存相比无明显差异,但前者对细胞损伤更小。
[0009]
为实现上述目的,本发明采取的技术方案为:
[0010]
本发明提供一种胚胎干细胞冻存液,包含:血小板裂解物、聚乙烯醇和聚乙烯吡咯烷酮。
[0011]
聚乙烯醇和聚乙烯吡咯烷酮都属于非渗透性冷冻保护剂,聚乙烯醇具有在降温过程中抑制冰晶形成的作用;聚乙烯吡咯烷酮能够对细胞膜提供一定的保护作用。目前未见将血小板裂解物、聚乙烯醇和聚乙烯吡咯烷酮作为冷冻保护剂,而不依赖血清和dmso。
[0012]
试验证明,加入血小板裂解物后,相比不含血小板裂解物配方的冻存液,细胞存活率更高,且更多的细胞维持在不分化状态。
[0013]
另外,本发明还提供一种胚胎干细胞冻存液,在所述冻存液中,血小板裂解物的体积分数小于1.5%,但是大于0.2%。
[0014]
另外,本发明还提供一种胚胎干细胞冻存液,在所述冻存液中,血小板裂解物的体积分数小于1%,但是大于0.2%。
[0015]
另外,本发明还提供一种胚胎干细胞冻存液,在所述冻存液中,以体积分数计,血小板裂解物的含量为0.3~1.5%,聚乙烯醇的含量为1~3%,聚乙烯吡咯烷酮的含量为1~5%。
[0016]
另外,本发明还提供一种胚胎干细胞冻存液,在所述冻存液中,以体积分数计,血小板裂解物的含量为0.3~1%,聚乙烯醇的含量为1~3%,聚乙烯吡咯烷酮的含量为1~5%。
[0017]
另外,本发明还提供一种胚胎干细胞冻存液,在所述冻存液中,以体积分数计,血小板裂解物的含量为0.3~0.8%,聚乙烯醇的含量为1~3%,聚乙烯吡咯烷酮的含量为1~5%。
[0018]
本发明对血小板裂解物的含量作了进一步限定,是因为发明人意外发现,在低含量血小板裂解物下(<1.5%),与聚乙烯醇和聚乙烯吡咯烷酮组合表现出更理想的冻存效应,当血小板裂解物的含量维持在0.3~1.5%之间时,这种剂量与效果存在规律性,但是含量并不是越低越好,当<0.3%时,效果却发生了明显地下降。这一现象与现有研究相反,因为在之前的研究中,技术人员常常采用的是5%以上含量的血小板裂解物,例如背景技术中的两篇现有文献分别采用了5%和5~15%的值,均显示出良好的冻存效果,且通常认为由于血小板裂解物含有较多利于细胞生长的因子,因此,理论上认为含量高的血小板裂解物更利于细胞的保存,而本发明却与之相反。这可能是与冻存液中存在的其他两种成分聚乙烯醇和聚乙烯吡咯烷酮有关,低浓度的血小板裂解液与聚乙烯醇和聚乙烯吡咯烷酮之间存在某种作用,这种作用表现出利于细胞的保护。
[0019]
在一些具体实施方案中,通常来讲聚乙烯醇的含量可以为1~3%之间的任意值,
聚乙烯吡咯烷酮的含量可以为1~5%之间的任意值,此时,血小板裂解物的含量最好为0.3%~1.5%之间的任意值,更好地是含量为0.3~1%之间的任意值,更好地是含量为0.3~0.8%之间的任意值,优选含量为0.3%、0.4%、0.5%、0.6%、 0.7%和0.8%。这些含量中,血小板裂解物含量为0.4%、0.5%和0.7%时搭配 1~3%的聚乙烯醇和1~5%的聚乙烯吡咯烷酮效果最好,且后两者的含量可以为区间内的任意值。
[0020]
另外,本发明还提供一种胚胎干细胞冻存液,在所述冻存液中,还包括缓冲液。
[0021]
另外,本发明还提供一种胚胎干细胞冻存液,在所述冻存液中,所述缓冲液为pbs或hepes缓冲液。
[0022]
另外,本发明还提供一种胚胎干细胞冻存液,在所述冻存液中,所述缓冲液为pbs缓冲液。
[0023]
另外,本发明还提供一种胚胎干细胞冻存液,在所述冻存液中,在所述冻存液中,血清和dmso的含量为0。
[0024]
本发明提供的胚胎干细胞冻存液与现有技术相比存在的明显优势在于不依赖血清和dmso也能获得与其相当的冻存效果,仅仅以低浓度的血小板裂解物联合pva、pvp即能获得相当优秀的冻存效应,相比现有含血小板裂解物的冻存液成分更简单,毒性更低,更安全。
[0025]
另外,本发明还提供一种胚胎干细胞冻存液的制备方法,其在常温下将各组分进行混合即得。
[0026]
另外,本发明还提供一种胚胎干细胞保存方法,包括将胚胎干细胞冻存于所述冻存液中的步骤。
[0027]
本发明冻存液可以与常规的冷冻保存方法结合使用,如常用的程序式降温法、玻璃化冷冻法等,为了达到更好的冻存效果,优选采用三段式程序式降温法。具体操作为:
[0028]
采用胶原酶将人胚胎干细胞消化,吸管吹成若干个团块,离心去上清,取 80个团块移入上述冻存液中,制备成细胞悬液,装入麦管中,将麦管放入冷冻箱内,采用三段式程序降温法(以2.5℃/min的速率从22℃降到-7℃,置核后停留5min;以0.3℃/min的速率从-7℃降到-30℃;以10℃/min的速率从-30℃降到-150℃),降温到-150℃时立即取出麦管置于液氮罐中保存。
[0029]
另外,本发明所述胚胎干细胞冷冻液还可以被制成试剂盒使用。
[0030]
本发明的有益效果在于:
[0031]
(1)本发明提供了一种胚胎干细胞冻存液,该冻存液在不含血清和dmso 的情况下,仅以低浓度的血小板裂解物结合pva和pvp即能获得与血清 dmso 相当的保存效果,甚至在某些含量下,优于90%血清 10%dmso组合,但显然本发明冻存液对细胞毒性更低,且应用更广。
[0032]
(2)本发明所述胚胎干细胞冻存液目前被证实可以运用胚胎干细胞的冻存,尤其是人胚胎干细胞的保存,而对于其他类型的细胞的冻存效应有待进一步研究。
具体实施方式
[0033]
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。
[0034]
实施例一、不同含量的血小板裂解物对人胚胎干细胞冻存效果的影响
[0035]
1.1试验采用的冷冻保存液配方:
[0036]
①
0.1%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0037]
②
0.2%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0038]
③
0.3%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0039]
④
0.4%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0040]
⑤
0.5%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0041]
⑥
0.6%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0042]
⑦
0.7%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0043]
⑧
0.8%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0044]
⑨
0.9%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0045]
⑩
1.0%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0046]
1.5%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0047]
2%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0048]
3%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0049]
5%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0050]
10%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0051]
15%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0052]
20%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0053]
25%血小板裂解物 1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0054]
1.5v/v%pva 3v/v%pvp 余量pbs缓冲液;
[0055]
对照组:10%dmso 90%胎牛血清。
[0056]
1.2人胚胎干细胞冷冻过程:采用胶原酶将人胚胎干细胞消化,吸管吹成若干个团块,离心去上清,各取80个团块分别移入上述冻存液中,制备成细胞悬液,装入麦管中,将麦管放入冷冻箱内,采用三段式程序降温法(以2.5℃/min 的速率从22℃降到-7℃,置核后停留5min;以0.3℃/min的速率从-7℃降到-30℃;以10℃/min的速率从-30℃降到-150℃),降温到-150℃时立即取出麦管置于液氮罐中保存1个月。
[0057]
1.3人胚胎干细胞的复苏过程:从液氮罐中取出麦管,空气中停留30s,放入37℃恒温水浴箱中至麦管中液体液化,转移至人胚胎干细胞培养液中,离心清洗后再重新加入人胚胎干细胞培养液,用吸管轻轻吹打混匀,复苏后将保持完整形态且细胞未散离的人胚胎干细胞团块回收,计算复苏率。
[0058]
复苏率(%)=团块回收数目/冷冻团块总数
×
100%。
[0059]
2.细胞复苏后生长及分化情况:将复苏后的人胚胎干细胞团块种植到mef 饲养层上(鼠成纤维细胞饲养层,其制备可按照常规技术制备,亦可参考王晶,李亚里等,人胚胎干细胞的保存方法中的方法),在显微镜下观察其生长状态和分化情况,并与同期培养的未经冷冻的胚胎干细胞进行对比。
[0060]
3.试验结果
[0061]
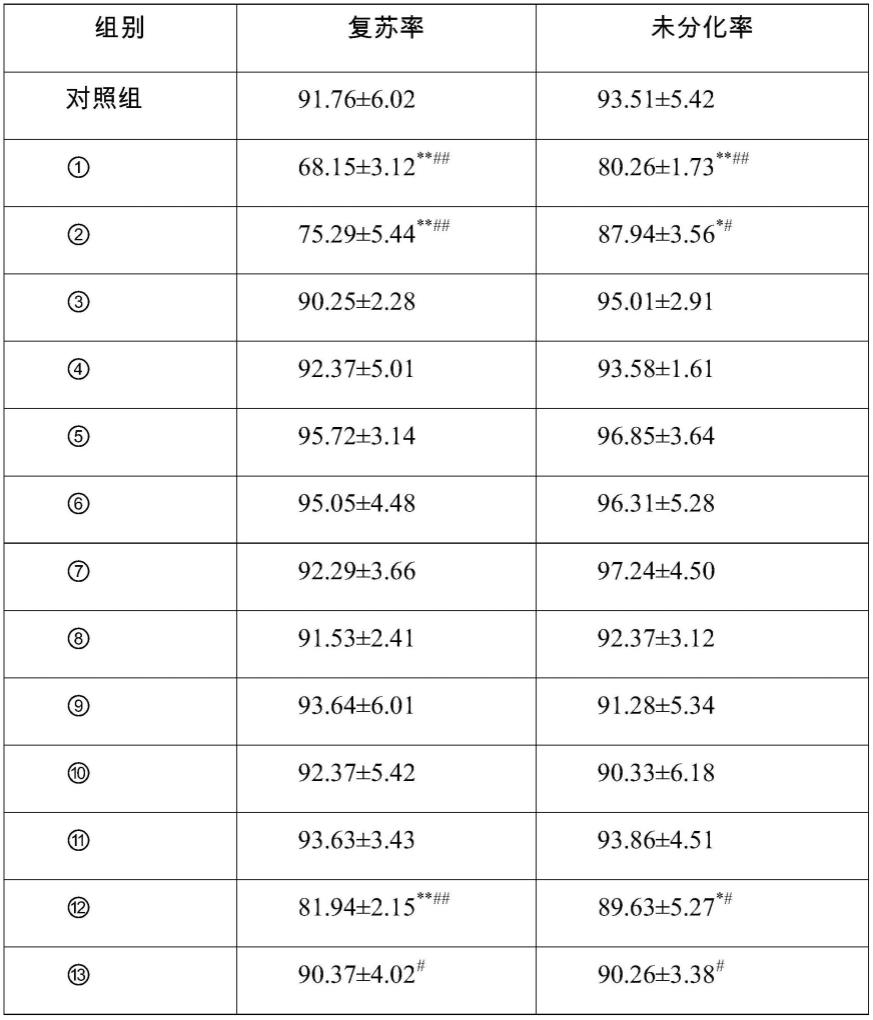
表1不同含量的血小板裂解物对人胚胎干细胞复苏及分化的影响(n=80)
[0062]
[0063][0064]
注:与对照组相比,
*
p<0.05;与组
⑤
相比,
#
p<0.05;未分化是指分化细胞<30%;部分分化是指分化细胞占30~70%;完全分化细胞是指分化细胞>7 0%。
[0065]
分析结果可知,在特定含量范围内(0.3%~1.5%)的血小板裂解物与pva、p vp组合冻存干细胞取得了与10%dmso 90%胎牛血清组合的冻存效果,两组细胞在细胞存活率及未分化率方面无明显差异。
[0066]
分析整体试验结果了解到,在含有pva、pvp的冻存体系中,冻存体系中保持较低量的血小板裂解物反而更利于干细胞的冻存。
[0067]
最后所应当说明的是,以上实施例用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者同等替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。