1.本发明涉及用于创建个体化的基因检测组合计划的方法。此外,本发明还涉及确定系统、计算机程序产品和计算机可读的存储器介质。
背景技术:
2.典型地执行临床研究,以便测试疗法和/或药物对有限数量的参与者或患者的有效性。临床研究的参与者必须典型地满足至少一个分子基因入选标准和/或表型入选标准,以便可以参与临床研究或适合于参与。尤其假定,在临床研究中测试的疗法或在临床研究中测试的药物特别有利地在满足至少一个分子基因入选标准和/或表型入选标准的患者处起作用。分子基因入选标准例如可以包括关于在患者处的特定基因的分子改变和/或关于在患者处的基因的特定表达和/或关于在患者处的基因突变的信息。表型入选标准例如可以是患者的年龄和/或患者的要治疗的疾病。
3.例如,临床研究可以设计用于治疗癌症患者。换言之,可以在对应的临床研究中测试用于治疗癌症疾病或肿瘤疾病的疗法或药物。于是,至少一个分子基因入选标准尤其可以包括关于基因突变的信息,所述基因突变标记在临床研究中治疗的肿瘤。于是,尤其可以将如下患者接纳到临床研究中:所述患者的肿瘤通过基因突变标记。
4.典型地存在大量正在进行的临床研究。寻找适合于特定患者的临床研究通常与高耗费相关联。为了检验患者是否适合于临床研究,必须检查患者是否满足对于临床研究相关的至少一个分子基因入选标准和/或表型入选标准。
5.为了能够从大量正在进行的临床研究中选择在分子基因入选标准方面对于患者合适的临床研究,可以单独检查或分析患者的基因。随后,可以检验患者是否满足至少一个正在进行的临床研究的至少一个分子基因入选标准。然而,各个基因的分析与高成本和高时间耗费相关联。
6.为了检验患者在分子基因入选标准方面是否适合来自大量正在进行的临床研究中的一项临床研究,替选地已知,在基因检测组合中分析患者的多个基因。在此,可以从多个预定义的基因检测组合中选择。基因检测组合包括检查或分析的固定的多个基因和/或基因组区域。预定义的基因检测组合在此典型地包括30至150个基因或基因组区域。所述基因或基因组区域的选择通常是不稳定的并且不与疗法相关。在预定义的基因检测组合上选择基因或基因组区域通常尤其与基因检测组合的提供者相关。尤其通常在基因检测组合上也检查未被分子基因入选标准包括的基因或基因组区域,而不检查在分子基因入选标准方面相关的基因或基因组区域。换言之,在预定义的基因检测组合中通常检查对于临床研究不相关的基因或基因组区域,而不检查相关的基因或基因组区域。
技术实现要素:
7.因此,本发明的目的是,提供一种能够实现对于患者关于多个临床研究创建个体化的基因检测组合计划的方法。
8.所述目的通过根据用于创建个体化的基因检测组合计划的方法、用于创建个体化的基因检测组合计划的确定系统、计算机程序产品和计算机可读的存储器介质来实现。有利的改进方案在以下描述中列举。
9.在下文中,所述目的的根据本发明的解决方案不仅参考所要求保护的设备而且也参考所要求保护的方法来描述。在此提到的特征、优点或替选的实施方式同样也转用于其他所要求保护的主题,反之亦然。换言之,实体性的技术方案(其例如针对设备)也可以借助于结合所述方法描述或要求保护的特征来改进。在此,所述方法的对应的功能特征通过对应的实体性的模块构成。
10.本发明涉及一种计算机实施的用于创建个体化的基因检测组合计划的方法。所述方法包括接收和/或确定多个临床研究的方法步骤。在此,多个临床研究中的每个临床研究包括分子基因入选标准。在此,分子基因入选标准涉及对于相应临床研究相关的基因信息。此外,所述方法对于多个临床研究中的每个临床研究还包括确定至少一个基因组区位的方法步骤,临床研究的基因信息涉及所述至少一个基因组区位。此外,所述方法还包括基于关于多个临床研究确定的基因组区位来创建基因检测组合计划的方法步骤。此外,所述方法还包括提供基因检测组合计划的方法步骤。
11.在接收和/或确定多个临床研究的方法步骤中,接收和/或确定多个临床研究。多个临床研究尤其包括如下研究:对于所述研究要检验患者是否适合于这些临床研究中的至少一个临床研究。换言之,要针对多个临床研究检验患者是否适合于参与这些临床研究中的至少一个临床研究。多个临床研究中的每个临床研究尤其是正在进行的临床研究。对于正在进行的临床研究可以登记合适的患者或参与者。
12.尤其可以从数据库接收多个临床研究。数据库在此可以例如是以下数据库中的一个数据库:clinicaltrials.gov(https://clinicaltrials.gov/)、国际临床试验注册平台(缩写:ictrp)(https://www.who.int/clinical-trials-registry-platform)、德国临床研究注册(缩写:drks)(https://www.drks.de/drks_web/)和/或欧盟临床试验注册(https://www.clinicaltrialsregister.eu/)。
13.多个临床研究中的每个临床研究在此可以关联有明确的特征数值或明确的指标(缩写:id)。换言之,多个临床研究中的每个临床研究可以借助于id可明确地辨识。多个临床研究中的每个临床研究尤其可以包括对应的id。
14.在临床研究中,尤其测试疗法和/或药物对有限数量的患者的有效性和/或兼容性。临床研究尤其可以设计用于具有特定特性的特定患者。换言之,仅至少部分地具有由临床研究预设的特定特性的患者能够参与所述临床研究。特性在此可以例如是基因特性、分子基因特性、表型特性等。这种预设的特性尤其可以描述为入选标准。
15.多个临床研究中的所述临床研究中的每个临床研究在此包括分子基因入选标准。在此,分子基因入选标准涉及对于相应临床研究相关的基因信息。尤其通过分子基因入选标准定义患者参与对应的临床研究的条件。尤其,分子基因入选标准借助于基因信息定义患者参与对应的临床研究关于患者的基因组方面的条件。“相关”在上下文中表示,基因信息包括对于参与对应的临床研究相关的信息。基因信息在此尤其可以包括参与临床研究的基因的前提或条件。基因信息在此可以直接定义基因的前提。例如,基因信息可以定义对于参与临床研究必须具有定义表达的至少一个基因和/或基因组的至少一个区域。替选地,基
因信息可以间接定义参与临床研究的基因的前提。例如,基因信息可以包括至少一个基因和/或基因组的至少一个区域的表达的名字或名称,所述表达是参与临床研究的条件。替选地或附加地,基因信息可以包括通过构成分子基因入选标准的特定的基因表达引起的疾病的名称。例如,名称“brca”可以指示对于乳房癌相关的基因的改变,或例如名称“血友病”指示x染色体上的基因的改变表达。
16.尤其,可以在确定多个临床研究的步骤中对可用集合的临床研究进行过滤,使得临床研究的可用集合的仅包括分子基因入选标准的临床研究是多个临床研究的一部分。在此,多个临床研究是临床研究的可用集合的子集。换言之,多个临床研究可以包括:选择包括分子基因入选标准的临床研究。临床研究的可用集合尤其可以包括正在进行的临床研究。临床研究的可用集合例如可以通过上述数据库中的至少一个数据库提供。
17.在确定临床研究的基因信息所涉及的基因组区位的方法步骤中,根据基因信息针对每个研究确定基因组区位。基因组区位尤其定义患者的基因组上的如下区域或区位:所述区域或区位根据参与对应的临床研究的基因信息必须具有特定表达。基因组尤其可以是人类的或人的基因组。替选地,基因组可以是动物的基因组。基因组区位在此可以尤其直接从基因信息获取。尤其如果基因信息直接定义基因的前提,则可以直接从基因信息提取基因组区位。替选地,如果基因信息间接定义基因的前提,则可以基于基因信息确定基因组区位。尤其可以借助于专业知识和/或一般性的预设和/或数据库从基因信息推导出基因组区位。
18.在创建基因检测组合计划的方法步骤中,基于关于多个临床研究确定的基因组区位来确定个体化的基因检测组合计划。基因检测组合计划在此尤其包括多个临床研究的所有基因组区位。基因检测组合计划尤其定义多个临床研究的所有基因组区位的全体。在基因检测组合计划中,尤其可以定义多个临床研究的所有基因组区位的联合。基因检测组合计划尤其描述:应检查或分析患者的哪些基因组区位,以便确定患者是否适合于参与多个临床研究中的所述临床研究中的至少一个临床研究。基因检测组合计划尤其仅包括对于检验患者对多个临床研究中的所述临床研究的适合性相关的基因组区位。换言之,基因检测组合计划不包括基因组的对于参与多个临床研究不相关的区位。尤其可以根据基因检测组合计划创建基因检测组合。换言之,基因检测组合计划定义基因检测组合。在基因检测组合中,可以分析由基因检测组合计划包括的基因组区位。尤其对于患者个体化确定基因检测组合计划。基因检测组合计划对于多个临床研究尤其是特定的。
19.在提供基因检测组合计划的方法步骤中,可以给使用者提供基因检测组合计划。使用者尤其可以是医生,其决定患者是否参与多个临床研究中的所述临床研究中的一个临床研究。替选地或附加地,使用者也可以是患者。替选地或附加地,使用者可以是医疗助手。替选地或附加地,使用者可以是提供者,其根据基因检测组合计划创建和分析基因检测组合。基因检测组合计划可以经由用户接口提供。基因检测组合计划尤其可以借助于监视器显示给使用者。替选地或附加地,可以以浏览器可扩展数据格式(.bed文档或.bed文件)提供基因检测组合计划。呈.bed文档形式的基因检测组合计划尤其可以电子地传递给提供者。电子的传递尤其可以是通过e-mail和/或经由云系统和/或经由数据库等的传递。
20.发明人已经认识到,可以通过确定用于多个临床研究的基因组区位来创建个体化的基因检测组合计划。尤其可以关于多个临床研究创建基因检测组合计划。换言之,可以特
定地针对多个临床研究创建基因检测组合计划。发明人已经认识到,可以以这种方式创建基因检测组合计划,借助于基因检测组合计划可以个体化针对患者检验:患者是否适合于多个临床研究中的至少一个临床研究或患者是否满足至少一个临床研究的分子基因入选标准。发明人已经认识到,可以根据基因检测组合计划创建基因检测组合,基因检测组合恰好分析对于多个临床研究相关的基因组区位。尤其可以以这种方式节省时间,因为仅仅分析对于参与多个临床研究中的至少一个临床研究相关的基因组区位。此外,可以以这种方式节省成本,因为有针对性地仅分析基于基因检测组合计划的基因检测组合中的相关的基因组区位,所述基因组区位对于参与临床研究中的至少一个临床研究是相关的。
21.根据本发明的一个方面,临床研究的基因信息涉及基因组的至少一个对于临床研究相关的区域。
22.换言之,基因信息提供关于如下的信息:基因组的哪个区域对于患者参与对应的研究是相关的。尤其借助于基因信息定义基因组的至少一个区域,所述至少一个区域的表达对于决定患者是否参与临床研究是相关的。相关的区域尤其描述基因组上的基因的如下区域:所述区域必须具有特定表达,以便满足分子基因入选标准。基因信息尤其可以定义多于一个的相关区域。“相关”在上下文中尤其表示,基因组的相关区域的表达至少一起决定患者是否适合于对应的临床研究。基因组的相关区域尤其可以包括整个的基因。换言之,基因信息可以涉及至少一个完整的基因。
23.发明人已经认识到,借助于基因信息可以定义基因组的至少一个对于临床研究相关的区域。发明人尤其已经认识到,借助于基因信息可以将基因检测组合计划限制到多个临床研究的在基因信息中定义的或提供的区域上。发明人尤其已经认识到,包括分子基因入选标准的临床研究在对应的基因信息中定义基因组的至少一个相关区域。
24.根据本发明的另一方面,基因组的至少一个相关区域具有对于临床研究相关的基因突变。
25.基因突变意味着,基因组的对应区域与标准相比改变。标准例如可以是在人口的大部分中的基因组的区域的表达。换言之,在基因突变的情况下,基因组的对应区域中的遗传物质改变。基因突变尤其可能是基因缺陷。基因缺陷尤其是对于基因或对于基因组具有负面作用的基因突变。例如,基因缺陷可能导致包括所述基因的细胞的无节制生长。
26.基因信息尤其涉及基因组的至少一个包括基因突变的相关区域。基因信息尤其可以定义基因突变处于何处或处于哪个基因上或基因组的哪个区域中。
27.在对应研究中测试的疗法或在对应研究中测试的药物尤其可以特别有利地在具有对应的基因突变的患者处起作用。
28.发明人已经认识到,基因突变通常是用于参与临床研究的分子基因入选标准。发明人已经认识到,基因信息可以包括关于基因突变的信息。发明人已经认识到,基因组的区域的对于临床研究相关的表达可以是基因突变。
29.根据本发明的另一方面,基因信息包括基因组的具有基因突变的区域的名字和/或对于基因突变的名字。
30.具有基因突变的区域的名字尤其可以是突变基因的名字。基因的所有可能的名字的列表例如在hugo基因命名委员会(缩写:hgnc)(https://www.genenames.org/)的数据库中提供。
31.尤其可以借助于基因组的具有基因突变的区域的名字和/或基因突变的名字推断出基因突变处于基因组的哪个区域中。
32.例如,克尔斯滕大鼠肉瘤突变(kras突变)描述kras基因的突变。kras基因主管k-ras蛋白的生产。k-ras蛋白负责细胞的生长过程。kras基因的突变可能引起受干扰的细胞生长。已知kras基因设置在哪个基因组区位中。因此,基因信息尤其可以包括突变(kras突变)的名字和/或突变基因(kras基因)的名字。尤其可以在确定基因组区位的步骤中从中推导出对应的基因组区位。
33.替选地或附加地,基因信息可以包括基因组的突变区域的名字例如egfr exon 21或egrf p.l858r。尤其可以从中更精确地确定基因组区位,因为仅仅基因组在基因突变的位置处的对应区域可以确定作为基因组区位。例如,名字“egfr 21exon”描述基因egfr的整个的exon 21,而名字“egrf p.l858r”指示基因egfr的858氨基酸的点突变。替选地,基因信息可以包括对应的基因突变的名字、例如egfr exon 21缺失(egfr exon 21deletion)。尤其可以从基因突变的名字推导出基因组上的基因突变的区域。
34.基因突变的名字尤其可以是对于由基因突变导致的疾病的抽象名字。例如,疾病“血友病”可以指示x染色体上的特定基因的突变。例如,这种抽象名字可以是“her2 pos”,其指示乳房癌的情况下的突变。
35.发明人已经认识到,根据基因突变的名字和/或基因组的具有基因突变的区域的名字可以推导出对于临床研究相关的基因组区位。发明人已经认识到,基因信息因此尤其可以包括基因突变的名字和/或具有基因突变的区域的名字。发明人已经认识到,通常在临床研究时提供所述信息。发明人已经认识到,因此可以使用现有信息。
36.根据本发明的另一方面,基因组区位包括基因组的至少一个对于临床研究相关的区域的坐标。
37.坐标尤其定义相关的区域在基因组上的位置。坐标尤其可以定义基因组上的相关的区域。尤其可以以这种方式定义基因的子区域作为相关的区域。如果基因信息包括相关的区域的坐标,则尤其可以直接从基因信息读取坐标。替选地,可以从相关的区域的名字推导出坐标。名字在此由基因信息包括。坐标可以借助于数据库从名字推导出。例如,可以使用ensembl数据库(https://grch37.ensembl.org/index.html)和/或ncbi数据库(https://www.ncbi.nlm.nih.gov/),以便从名字推导出坐标。以这种方式尤其也可以从基因突变的名字推导出坐标。替选地,又可以从基因突变的名字推导出相关的区域的名字。
38.发明人已经认识到,坐标简化基因检测组合计划的创建。尤其可以借助于坐标在基因检测组合计划中精确预设要分析的或要检查的基因组区位。发明人已经认识到,以这种方式可以避免,在基于基因检测组合计划的基因检测组合中分析对于多个临床研究不相关的或错误的基因组区位。
39.根据本发明的另一方面,至少一个基因组区位还包括围绕基因组的至少一个相关区域的坐标的缓冲区。
40.换言之,基因组区位包括如下区域:所述区域比相关区域自身大了一个缓冲区。缓冲区在此尤其可以从相关区域来看在所有方向上是相同大小的。缓冲区在此直接连接相关区域。缓冲区例如尤其可以包括至少一个与包括相关区域的基因相邻的基因。替选地,缓冲区可以构成为,使得即使相关区域仅仅包括基因的子区域,基因组区位也包括完整的基因。
换言之,缓冲区可以构成为,使得基因组区位总是包括相对于由相关区域包括的基因相邻的基因和/或完整的或完全的基因。
41.发明人已经认识到,通过缓冲区确保,即使在基于所提供的基因检测组合计划创建基因检测组合时可能不精确的情况下,相关区域也处于实际分析的基因组区位内。换言之,可以借助于缓冲区确保,即使实际分析的基因组区位偏离于在基因检测组合计划中包括或定义的基因组区位,相关区域也处于实际分析的基因组区位内。
42.根据本发明的另一方面,确定多个临床研究的方法步骤包括通过对临床研究的可用集合进行过滤从所述临床研究的可用集合中确定对于患者相关的临床研究的方法步骤。在此,多个临床研究包括对于患者相关的临床研究。
43.临床研究的可用集合尤其可以是数据库中的临床研究的集合。这种数据库例如可以是以下数据库中的一个数据库:https://clinicaltrials.gov/、https://www.who.int/clinical-trials-registry-platform、https://www.drks.de/drks_web/和/或https://www.clinicaltrialsregister.eu/。临床研究的可用集合中的临床研究尤其可以是正在进行的临床研究。
44.患者尤其是如下患者:对于所述患者应检验其是否适合于参与多个临床研究中的至少一个临床研究。
45.在确定对于患者相关的研究的方法步骤中,从临床研究的可用集合中找出对于患者相关的研究。换言之,从临床研究的集合中过滤出如下临床研究:可以直接根据简单特性排除患者对所述临床研究的适合性。多个临床研究尤其包括如下研究:不能够直接排除患者对所述研究的适合性。多个临床研究尤其可以等于对于患者相关的研究。换言之,多个临床研究可以仅包括对于患者相关的研究。临床研究的可用集合尤其可以等于多个临床研究。换言之,临床研究的可用集合和多个临床研究可以由相同的临床研究组成。
46.发明人已经认识到,通过过滤可以最小化多个临床研究中的临床研究的数量。以这种方式可以加速针对多个临床研究中的所有临床研究确定基因组区位。换言之,可以通过过滤确保不将如下基因组区位接纳到基因检测组合计划中:患者从一开始就不适合于所述基因组区位的相关联的临床研究。发明人已经认识到,以这种方式可以实现,基因检测组合计划定义尽可能小的基因检测组合。尤其可以以这种方式防止将过多基因组区位接纳到基因检测组合计划中,过多基因组区位使基于此的基因检测组合不必要地扩大。尤其可以以这种方式节省时间和成本。
47.根据本发明的另一方面,多个临床研究中的至少一个临床研究包括至少一个表型入选标准。在此,临床研究设计用于治疗研究参与者的疾病。在此,表型入选标准包括以下标准中的至少一个标准:研究参与者的年龄、研究参与者的住址、研究参与者的疾病、研究参与者的疾病的阶段。在此,对于患者相关的临床研究的确定基于至少一个表型入选标准。
48.尤其可以借助于疗法和/或借助于药物在临床研究中治疗疾病。研究参与者尤其是参与研究的患者。临床研究尤其可以设计用于特定组的患者。于是,研究参与者尤其是来自所述特定组的患者。尤其可以借助于表型入选标准确定所述组的至少一个共同的特性。尤其可以根据表型入选标准设置患者必须满足的预设或条件,以便允许患者参与研究。尤其如果患者满足临床研究的至少一个表型入选标准,则临床研究可以对于患者是相关的。
49.多个临床研究中的多于一个的临床研究尤其可以分别包括表型入选标准。多个临
床研究中的每个临床研究尤其可以包括表型入选标准。临床研究的可用集合中的不包括表型入选标准的临床研究尤其可以接纳到多个临床研究中。替选地,在过滤时不能够考虑所述临床研究从而不能够将其接纳到多个临床研究中。
50.研究参与者的年龄尤其说明患者应具有的以便适合于临床研究的年龄。年龄尤其可以包括年龄范围。例如,年龄可以将研究参与者限定到18和60岁之间的组上或限定到具有超过60岁的年龄的组上。可考虑相对于根据年龄限定研究参与者的年龄的不同的另外的变型方案。
51.研究参与者的住址尤其说明,患者应住在哪里,以便可以参与临床研究。例如,临床研究仅能够针对特定国家例如德国允许。于是,患者尤其应住在所述国家内,以便适合于研究。于是,所有研究参与者尤其应住在所述特定国家内。替选地,可以经由住址确保,仅如下患者参与临床研究:所述患者为了后续检查和/或随诊检查(kontroll-untersuchungen)和/或用于准备临床研究和/或用于治疗的检查等可以简单地从其住址到达特定诊所和/或特定诊室和/或特定实验室。换言之,研究参与者的住址定义生活在特定范围或特定地区内的一组患者。
52.研究参与者的疾病尤其说明,临床研究设计用于治疗哪种疾病。临床研究尤其可以专门针对所述疾病。疾病尤其定义患有所述疾病的一组患者。如果患者根据表型入选标准具有所述疾病,则患者尤其适合于参与所述临床研究。
53.疾病的阶段说明,患者的疾病应处于哪个阶段,以便使得患者适合于参与临床研究。疾病的阶段尤其可以是疾病的程度。临床研究例如尤其可以仅设计用于治疗深度发展的疾病即处于晚期阶段或具有高程度的疾病。替选地,临床研究可以设计用于治疗处于早期阶段或具有低程度的疾病。
54.表型入选标准尤其可以包括另外的标准、例如研究参与者的性别和/或研究参与者的既往疾病和/或研究参与者的先前治疗等。
55.在确定对于患者相关的临床研究的方法步骤中的过滤尤其可以基于至少一个表型入选标准。在对临床研究的可用集合进行过滤时可以检验:患者是否满足至少一个表型入选标准。尤其可以检验,患者的年龄是否对应于研究参与者的年龄和/或患者的住址是否处于研究参与者的住址的地区内和/或患者的疾病是否与对于参与特定的疾病相一致和/或患者的疾病是否处于研究参与者的疾病的阶段中。尤其,如果患者满足对应的临床研究的至少一个表型入选标准,则来自临床研究的可用集合的临床研究可以接纳到多个临床研究中。尤其,如果患者满足对应的临床研究的所有表型入选标准,则来自临床研究的可用集合的临床研究可以接纳到多个临床研究中。
56.发明人已经认识到,通过根据表型入选标准的过滤以简单的方式可以确定来自临床研究的可用集合的如下临床研究:根据至少一个表型入选标准,患者适合于所述临床研究。尤其可以快速和在不收集附加数据的情况下进行根据表型入选标准的过滤,因为典型地已经存在关于患者的信息。因此,在对于患者相关的研究之后不需要附加的时间或成本耗费来对临床研究的可用集合进行过滤。
57.根据本发明的另一方面,确定对于患者相关的临床研究的方法步骤包括接收患者的患者数据的方法步骤。在此,过滤基于表型入选标准和患者数据的比较。
58.患者数据尤其可以包括关于患者的信息,需要所述信息以便检验患者是否满足至
少一个表型入选标准。患者数据尤其可以包括关于患者的年龄和/或关于患者的住址和/或关于患者的疾病和/或关于患者的疾病的阶段的信息。尤其可以以电子患者病历形式接收患者数据。替选地或附加地,可以通过患者和/或进行治疗的医生提供患者数据。换言之,可以以使用者输入形式接收患者数据。
59.发明人已经认识到,对于根据表型入选标准的过滤需要的数据典型地已经保存在患者的患者数据中。发明人已经认识到,因此可以在没有涉及时间和成本方面的附加耗费的情况下执行过滤。
60.根据本发明的另一方面,从临床研究的可用集合确定对于患者相关的临床研究的方法步骤还包括以下方法步骤:接收患者的患者数据,将经训练的函数应用于临床研究的可用集合和患者数据,其中对于临床研究的可用集合中的每个临床研究确定相关性参数,并且基于相关性参数确定对于患者相关的临床研究。
61.在接收患者数据的方法步骤中,接收患者的患者数据。尤其接收患者的如下患者数据:对于所述患者数据应确定相关的临床研究。患者数据尤其可以包括关于年龄、住址、要治疗的疾病、要治疗的疾病的阶段和/或既往疾病的信息。患者数据尤其可以在诊断和/或治疗疾病和/或治疗既往疾病的过程中收集。患者数据尤其可以保存在电子患者病历中。患者数据尤其可以由使用者提供。
62.在应用经训练的函数的方法步骤中,将经训练的函数应用于临床研究的可用集合和患者数据。在此,对于每个临床研究产生或确定相关性参数。相关性参数尤其可以说明对应的临床研究对于患者的相关性。相关性参数尤其可以说明,患者有多适合于参与对应的临床研究。例如,相关性参数“0”可以表示患者不适合,而相关性参数“3”可以表示患者非常适合。层级可以用相关性参数“1”和“2”描绘。相关性参数的替选的层级是可行的。经训练的函数尤其可以基于至少一个表型入选标准和患者数据来确定相关性参数。替选地或附加地,经训练的函数可以基于已经与临床研究相关联的研究参与者来确定相关性参数。尤其可以在确定相关性参数时考虑已经相关联的研究参与者的特性例如年龄、住址、疾病、疾病的阶段。
63.一般而言,经训练的函数模仿认知功能,所述认知功能将人类与人类思维连接。尤其通过基于训练数据的训练,经训练的函数可以匹配于新环境以及对模式进行识别和外插。
64.一般而言,可以借助于训练匹配经训练的函数的参数。为此尤其可以使用监督(英文:supervised)训练、半监督(英文:semi-supervised)训练、无监督(英文:unsupervised)训练、强化学习(英文:reinforcement learning)和/或主动学习(英文:active learning)。此外,可以使用表示学习(替选的术语是“特征学习”)(英文:representation learning或feature learning)。尤其可以通过多个训练步骤迭代地适配经训练的函数的参数。
65.经训练的函数尤其可以包括神经网络、支持向量机(英文:support vector machine)、随机树或决策树(英文:decision tree)和/或贝叶斯网络,和/或经训练的函数可以基于k平均聚类(英文:k-means clustering)、q学习、遗传算法和/或关联规则。经训练的函数尤其可以包括由多个不相关的决策树构成的组合或由决策树构成的集成(英文:random forest)。尤其可以借助于xgboosting(英文:extreme gradient boosting)确定经
训练的函数。神经网络尤其可以是深度神经网络(英文:deep neural network)、卷积神经网络(英文:convolutional neural network)或卷积深度神经网络(英文:convolutional deep neural network)。此外,神经网络可以是对抗网络(英文:adversarial network)、深度对抗网络(英文:deep adversarial network)和/或生成式对抗网络(英文:generative adversarial network)。神经网络尤其可以是递归神经网络(英文:recurrent neural network)。递归神经网络尤其可以是具有长短期记忆(英文:long-short-term-memory,lstm)的网络、尤其门控循环单元(gru)。经训练的函数尤其可以包括所描述的方案的组合。在此描述的用于经训练的函数的方案尤其称为经训练的函数的网络架构。
66.在确定对于患者相关的临床研究的方法步骤中,基于相关性参数确定对于患者相关的临床研究。尤其对于临床研究的可用集合中的每个临床研究分析相关性参数并且基于所述相关性参数将临床研究分级为相关或不相关。于是,对于患者相关的临床研究包括分级为相关的所有临床研究。例如,已确定了“2”或“3”的相关性参数的所有临床研究可以被分级为相关,而已确定了“0”或“1”的相关性参数的所有临床研究可以分级为不相关。在相关性参数的其他层级的情况下,其他分级是可行的。
67.临床研究的可用集合的过滤尤其基于经训练的函数的应用和对于患者相关的临床研究基于相关性参数的确定。
68.发明人已经认识到,可以借助于经训练的函数将临床研究的可用集合中的临床研究根据关于其对于患者的相关性的相关性参数进行分类。以这种方式可以自动地从临床研究的可用集合确定对于患者相关的研究。此外,发明人已经认识到,可以使用现存数据尤其患者数据作为用于经训练的函数的输入数据。发明人已经认识到,因此不需要其他的、可能的耗费时间的和/或高成本的数据收集。
69.根据本发明的另一方面,创建基因检测组合计划的方法步骤包括将多个临床研究的基因组区位组合成至少一个组合的基因组区位的方法步骤,其中基因检测组合计划包括至少一个组合的基因组区位。
70.组合的基因组区位尤其包括多个临床研究的所有基因组区位。基因检测组合计划尤其可以包括多于一个的组合的基因组区位。如果基因组区位不直接彼此相接或不重叠,则基因检测组合计划尤其可以包括多于一个的组合的基因组区位。换言之,如果在两个基因组区位之间的区域或区位不被至少一个第三基因组区位包括,则基因检测组合计划可以包括多于一个的组合的基因组区位。
71.发明人已经认识到,通过组合可以确保多个临床研究的所有基因组区位被基因检测组合计划包括。
72.根据本发明的另一方面,至少一个组合的基因组区位包括多个临床研究的所有基因组区位的联合。
73.换言之,至少一个组合的基因组区位形成多个临床研究的所有基因组区位的数学联合。至少一个组合的基因组区位尤其仅一次包括多个基因组区位的重叠区域。至少一个组合的基因组区位尤其不包括基因组上的不被基因组区位中的任一基因组区位包括的区域或区位。换言之,至少一个组合的基因组区位不包括基因组上的不被多个临床研究的至少一个基因组区位包括的区位。基因检测组合计划尤其可以包括多于一个的组合的基因组区位。
74.发明人已经确定,通过基因组区位的数学联合,至少一个组合的基因组区位尽可能压缩地包括基因组区位。发明人已经认识到,以这种方式,基因检测组合计划尽可能一目了然。尤其可以以这种方式确保基因检测组合计划不双重地包括两个基因组区位的重叠区域。发明人已经认识到,以这种方式可以防止,基于基因检测组合计划的基因检测组合多次分析基因组区位或基因组区位的一部分。以这种方式可以节省时间和成本。
75.根据本发明的另一方面,多个临床研究中的至少一个临床研究设计用于治疗肿瘤疾病。
76.尤其利用至少一个临床研究测试用于肿瘤疾病的疗法和/或药物对有限数量的患者的有效性。表型入选标准尤其可以包括特定类型的肿瘤疾病,例如肺癌、乳腺癌、前列腺癌、肝癌或胰腺癌等。于是,表型入选标准尤其还可以包括对应的肿瘤疾病的阶段或程度。于是,至少一个相关区域尤其可以被对应的肿瘤的基因组包括。
77.发明人已经认识到,所述方法尤其适合于创建关于肿瘤疾病的基因检测组合计划。
78.本发明可选地涉及一种计算机实施的用于提供经训练的函数的训练方法。训练方法包括接收临床研究的可用集合和患者的患者数据的方法步骤。训练方法还包括接收对于患者相关的临床研究的方法步骤。在此,对于患者相关的临床研究和临床研究的可用集合以及患者数据彼此存在关系。在此,临床研究的可用集合包括对于患者相关的临床研究。训练方法还包括基于临床研究的可用集合、患者数据和对于患者相关的临床研究来训练函数的方法步骤。训练方法还包括提供经训练的函数的方法步骤。
79.尤其手动或用手从临床研究的可用集合确定对于患者相关的临床研究用于训练经训练的函数。
80.本发明还涉及一种用于创建个体化的基因检测组合计划的确定系统,所述确定系统包括接口和计算单元。在此,接口和/或计算单元构成用于接收和/或确定多个临床研究。在此,多个临床研究中的每个临床研究包括分子基因入选标准。在此,分子基因入选标准涉及对于相应临床研究相关的基因信息。在此,计算单元还构成用于对于多个临床研究中的每个临床研究确定至少一个基因组区位,临床研究的基因信息涉及所述至少一个基因组区位。在此,计算单元还构成用于基于关于多个临床研究确定的基因组区位来创建基因检测组合计划。在此,接口还构成用于提供基因检测组合计划。
81.这种确定系统尤其可以构成用于执行上述用于创建个体化的基因检测组合计划的方法及其方面。确定系统构成用于通过接口和计算单元构成用于执行对应的方法步骤来执行所述方法及其方面。
82.接口尤其可以包括多于一个的子接口。计算单元尤其可以包括多于一个的子计算单元。
83.本发明也涉及一种具有计算机程序的计算机程序产品以及一种计算机可读的介质。主要以软件方式的实现方案具有如下优点:也可以以简单的方式通过软件升级来改装至今尚使用的确定系统,以便以所描述的方式工作。除了计算机程序之外,这种计算机程序产品必要时可以包括附加的组成部分、例如文档和/或附加的组件,以及包括硬件组件、例如用于使用软件的硬件秘钥(软件狗等)。
84.本发明尤其也涉及一种计算机程序产品,所述计算机程序产品具有计算机程序,
所述计算机程序能够直接加载到确定系统的存储器中,所述计算机程序产品具有程序段,以便当由确定系统执行程序段时,执行上述用于创建个体化的基因检测组合计划的方法的所有步骤及所述方法的方面。
85.本发明尤其涉及一种计算机可读的存储器介质,在其上存储有由确定系统可读的且可执行的程序段,以便当由确定系统执行程序段时,执行上述用于创建个体化的基因检测组合计划的方法的所有步骤及所述方法的方面。
86.本发明可选地涉及一种用于提供经训练的函数的训练系统,所述训练系统包括训练接口和训练计算单元。训练接口构成用于接收临床研究的可用集合和患者的患者数据。训练接口还构成用于接收对于患者相关的临床研究。在此,对于患者相关的临床研究和临床研究的可用集合以及患者数据彼此存在关系。在此,临床研究的可用集合包括对于患者相关的临床研究。训练计算单元构成用于基于临床研究的可用集合、患者数据和对于患者相关的临床研究来训练函数。训练接口还构成用于提供经训练的函数。
87.本发明可选地也涉及一种具有计算机程序的计算机程序产品以及一种计算机可读的介质。主要以软件方式的实现方案具有如下优点:也可以以简单的方式通过软件升级来改装至今尚使用的训练系统,以便以所描述的方式工作。除了计算机程序之外,这种计算机程序产品可选地可以包括附加的组成部分、例如文档和/或附加的组件,以及包括硬件组件、例如用于使用软件的硬件秘钥(软件狗等)。
88.本发明可选地尤其也涉及一种计算机程序产品,所述计算机程序产品具有计算机程序,所述计算机程序能够直接加载到训练系统的存储器中,所述计算机程序产品具有程序段,以便当由训练系统执行程序段时,执行上述用于提供经训练的函数的训练方法的所有步骤及训练方法的方面。
89.本发明可选地尤其涉及一种计算机可读的存储器介质,在其上存储有由训练系统可读的且可执行的程序段,以便当由训练系统执行程序段时,执行上述用于创建个体化的基因检测组合计划的训练方法的所有步骤及训练方法的方面。
附图说明
90.结合以下附图及其描述,本发明的上述特性、特征和优点变得更清楚和更容易理解。在此,附图和描述不应以任何方式限制本发明及其实施方式。
91.在不同的附图中,相同的组件设有相对应的附图标记。附图通常是不合比例的。
92.附图示出:
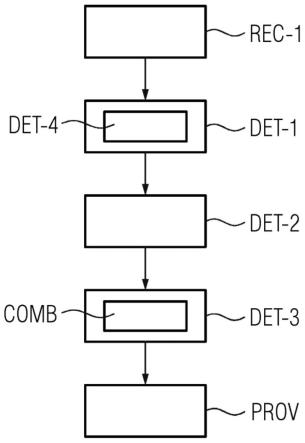
93.图1示出用于创建个体化的基因检测组合计划的方法的第一实施例,
94.图2示出用于创建个体化的基因检测组合计划的方法的第二实施例,
95.图3示出用于确定对于患者相关的临床研究的方法步骤的第一实施例,
96.图4示出用于确定对于患者相关的临床研究的方法步骤的第二实施例,
97.图5示出用于创建个体化的基因检测组合计划的方法的第三实施例,
98.图6示出用于创建个体化的基因检测组合计划的确定系统,
99.图7示出用于提供经训练的函数的训练系统。
具体实施方式
100.图1示出用于创建个体化的基因检测组合计划的方法的第一实施例。
101.在基因检测组合中分析各个基因和/或基因组区域。在此,可以确定基因和/或基因组区域是否具有特定的表达或特性。可以在基因检测组合计划中定义或确定在基因检测组合中分析哪个基因和/或基因组区域。可以借助于以下描述的方法个体化对于患者创建这种基因检测组合计划。
102.在接收rec-1和/或确定det-1多个临床研究的方法步骤中,接收和/或确定多个临床研究。尤其可以利用确定系统sys的接口sys.if接收多个临床研究。
103.在接收rec-1多个临床研究的方法步骤中,尤其从以下数据库中的一个数据库接收临床研究:clinicaltrials.gov(https://clinicaltrials.gov/)、国际临床试验注册平台(缩写:ictrp)(https://www.who.int/clinical-trials-registry-platform)、德国临床研究注册(缩写:drks)(https://www.drks.de/drks_web/)和/或欧盟临床试验注册(https://www.clinicaltrialsregister.eu/)。尤其可以接收在对应的数据库上可用的临床研究的集合中的临床研究的选择。换言之,多个临床研究可以包括可用的临床研究的集合的选择。
104.在确定rec-1多个临床研究的方法步骤中,例如可以从可用的临床研究的集合中确定多个临床研究。在此,可以利用确定系统sys的计算单元sys.cu确定多个临床研究。
105.临床研究尤其设计用于治疗有限数量的研究参与者或患者的疾病。治疗尤其可以包括测试药物和/或疗法。多个临床研究中的至少一个临床研究尤其可以设计用于治疗肿瘤疾病。
106.在一个具体实施例中,多个临床研究可以设计用于早期识别乳房癌或乳腺癌。通过早期识别可以优化乳腺癌的治疗。
107.临床研究尤其可以设计用于具有至少一个共同特性的特定组的患者。这种共同特性例如可以以分子基因入选标准描绘。换言之,分子基因入选标准包括患者必须满足的条件,以便使得患者适合于参与临床研究。在此,多个临床研究中的每个临床研究包括分子基因入选标准。临床研究的分子基因入选标准在此涉及对于相应临床研究相关的基因信息。基因信息可以在此尤其定义适合于参与对应的临床研究的一组患者的共同特性。基因信息尤其涉及一组患者的基因特性。换言之,基因信息涉及关于人类基因组的信息。替选地,基因信息可以涉及关于动物的基因组的信息。基因信息可以涉及基因组的至少一个对于临床研究相关的区域。用于参与临床研究的条件尤其可以是基因组的相关区域具有特定表达。基因信息尤其可以包括所述条件。至少一个相关区域可以包括基因的子区域。替选地,至少一个相关区域可以包括整个的基因。至少一个相关区域尤其可以具有基因突变。于是,基因信息尤其可以包括具有基因突变的区域的名字和/或对于基因突变的名字。换言之,基因信息可以以这种方式间接定义至少一个相关区域。如果相关区域不具有基因突变,则基因信息可以间接通过相关区域的名字定义相关区域。替选地或附加地,基因信息可以包括至少一个相关区域的坐标。以这种方式,基因信息可以直接定义至少一个相关区域。
108.在具体实施例中,多个临床研究中的一个临床研究作为分子入选标准包括以下基因信息:“brca1”。换言之,这表示,具有brca1基因的突变的患者适合于参与临床研究。多个临床研究中的另一临床研究在具体实施例中包括基因信息“brca1p1”。换言之,具有brca1
基因的对应的子区域中的突变的患者适合于参与临床研究。
109.在确定det-2至少一个基因组区位的方法步骤中,对于多个临床研究中的所述临床研究中的每个临床研究确定至少一个基因组区位,基因信息涉及所述至少一个基因组区位。在此,可以对于临床研究中的每个临床研究利用确定系统sys的计算单元sys.cu确定至少一个基因组区位。
110.至少一个基因组区位在此对于多个临床研究中的每个临床研究描述至少一个在基因信息中定义的相关区域。至少一个基因组区位在此根据相关区域在基因组上或基因的相关子区域在基因组上的坐标描述至少一个相关区域。尤其可以借助于坐标也限定基因组上的基因的部分。如果至少一个相关区域包括基因突变,则可以借助于坐标说明基因突变在基因上的精确位置。如果基因信息包括坐标,则可以在确定det-2至少一个基因组区位的方法步骤中直接从基因信息中获取由基因组区位包括的坐标。替选地,可以在确定det-2至少一个基因组区位的方法步骤中从由基因信息包括的名字推导出坐标。尤其可以从至少一个相关区域的名字借助于数据库推导出坐标。这种数据库例如是ensembl数据库(https://grch37.ensembl.org/index.html)或数据库ncbi(https://www.ncbi.nlm.nih.gov/)。尤其也可以从由相关区域包括的基因突变的名字推导出至少一个相关区域的名字。例如,基因突变的名字可以是kras突变。包括基因突变的相关区域的名字在这种情况下是kras基因。相关区域在一个实例中对应于完整的基因。在另一实例中,相关区域的名字可以是“egfr 21exon”。在这种情况下,名字定义基因的一部分尤其exon 21。所属的基因突变“egfr exon 21缺失”在此对应于在exon 21的部位处的基因的突变。
111.在具体实施例中,借助于所述数据库中的一个数据库确定的brca1基因的坐标是crch37坐标中的“染色体17:41,196,312-41,322,262”并且子区域brca1p1的坐标是grch37坐标中的“染色体17:41,320,187-41,320,266”。两个临床研究的对应的基因组区位因此通过坐标描述。
112.多个临床研究中的一个临床研究的至少一个基因组区位尤其可以包括围绕至少一个相关区域的坐标的缓冲区。缓冲区可以同样借助于基因组上的坐标定义。缓冲区可以构成为,使得可以确保:相关区域处于通过坐标定义的基因组区位内。尤其可以以这种方式确保,即使在从用于基因检测组合的基因组提取基因组区位时不精确的情况下,所提取的基因组区位也包括相关区域。缓冲区例如尤其可以构成为,使得即使相关区域仅包括基因的子区域,基因组区位总是也包括完整的基因。替选地或附加地,缓冲区可以构成为,使得分别邻接包括相关区域的基因的基因由缓冲区包括。
113.在具体实施例中,用于brca1基因的缓冲区可以包括第17染色体上的完全的部段41(染色体17:41)。
114.在创建det-3基因检测组合计划的方法步骤中,基于关于多个临床研究确定的基因组区位来创建基因检测组合计划。在此,可以利用确定系统sys的计算单元sys.cu创建基因检测组合计划。
115.基因检测组合计划尤其包括多个临床研究的所有基因组区位。基因检测组合计划尤其包括基因组区位的坐标。
116.在提供prov基因检测组合计划的方法步骤中,提供基因检测组合计划。在此,可以利用确定系统sys的接口sys.if提供基因检测组合计划。
117.尤其给使用者提供基因检测组合计划。可以给使用者以.bed文档形式提供基因检测组合计划。使用者尤其可以是基因检测组合的提供者。使用者尤其可以基于基因检测组合计划创建基因检测组合并且借助于基因检测组合分析在基因检测组合计划中包括的基因组区位。换言之,基因检测组合包括患者的在基因检测组合计划中定义的基因组区位用于分析。尤其,分析患者的基因组的通过基因信息定义的基因组区位。尤其如果对应的临床研究设计用于治疗肿瘤疾病,则从肿瘤细胞获取基因组。
118.图2示出用于创建个体化的基因检测组合计划的方法的第二实施例。
119.根据对于图1的描述构成如下方法步骤:接收rec-1和/或确定det-1多个临床研究,针对多个临床研究中的所述临床研究中的每个临床研究确定det-2至少一个基因组区位,创建det-3基因检测组合计划和提供prov基因检测组合计划。
120.确定det-1多个临床研究的方法步骤包括通过对临床研究的可用集合进行过滤从临床研究的可用集合确定det-4对于患者相关的临床研究的方法步骤。在此,多个临床研究包括对于患者相关的研究。在此,可以利用确定系统sys的计算单元sys.cu确定对于患者相关的研究。
121.在接收rec-1多个临床研究的方法步骤中,尤其可以接收包括多个临床研究的临床研究的可用集合。在此尤其可以从上述数据库接收临床研究的可用集合。
122.在确定det-4对于患者相关的临床研究的方法步骤中,从临床研究的可用集合确定对于患者相关的临床研究。尤其可以为此对临床研究的可用集合进行过滤。为此,多个临床研究中的至少一个临床研究可以包括表型入选标准。于是,可以根据表型入选标准对临床研究的可用集合进行过滤。表型入选标准可以包括以下标准中的至少一个标准:研究参与者的年龄、研究参与者的住址、研究参与者的疾病、研究参与者的疾病的阶段。借助于表型入选标准,除了分子基因入选标准之外,因此可以定义适合于参与对应的临床研究的一组患者的至少一个另外的共同特性。
123.借助于研究参与者的年龄例如可以定义,患者必须具有多大年龄,以便患者可以参与对应的临床研究或适合于参与。例如,表型入选标准可以预设仅允许具有18和60岁之间的年龄的患者参与临床研究。用于参与的多个可行的年龄限制以这种方式是可行的。
124.通过住址,表型入选标准可以限定地区,想参与对应的临床研究的患者应住在所述地区。以这种方式例如可以确保患者住在允许临床研究的地区。替选地或附加地,可以确保患者可以到达以用于定期的随诊检查和/或随访检查。例如,生活在usa的患者不能够或仅能够在特别许可的情况下参与仅对于德国允许的临床研究。此外,由于大的距离,可能未对患者的健康状态进行必要的检查。
125.通过定义疾病,表型入选标准可以将所述一组患者限定到具有设计对应的临床研究所针对的疾病的患者。例如,可以在临床研究中测试用于治疗肺癌的新型化疗。在这种情况下,仅患有对应的肺癌的患者适合于参与临床研究。表型入选标准例如也可以限定疾病的表达。例如,肺癌的位置可以由表型入选标准包括。
126.此外,表型入选标准可以预设参与临床研究的疾病的阶段。疾病的阶段理解为与疾病的程度同义。尤其仅如下患者可以参与对应的研究:其疾病还未达到特定阶段,或其疾病已经超过特定阶段。例如,国际抗癌联盟(英文:union for international cancer control,缩写:uicc)已经规定可以用作表型入选标准的对于乳腺癌的不同阶段。
127.考虑另外的可行的表型入选标准,例如性别、既往疾病、过去的治疗等。
128.可以接收如下患者的患者数据来进行过滤,对于所述患者而言要确定相关研究。患者数据在此尤其可以由电子患者病历包括。替选地,患者数据可以由进行治疗的医生或患者或助手提供。患者数据在此可以包括关于患者的年龄、患者的住址、患者的疾病、患者的疾病的阶段、患者的既往疾病等的信息。多个临床研究可以在过滤之后包括如下临床研究:在所述临床研究中,患者满足至少一个表型入选标准。多个临床研究尤其可以包括如下临床研究:在所述临床研究中,患者满足所有表型入选标准。换言之,临床研究的可用集合的如下临床研究可以分级为对于患者相关:在所述临床研究中,患者满足至少一个或所有表型入选标准。
129.可以按标准地将临床研究的可用集合的不包括表型入选标准的临床研究与多个临床研究相关联。替选地,可以按标准地不将多个临床研究与所述临床研究相关联。
130.于是,多个临床研究尤其仅包括对于患者相关的临床研究。多个临床研究尤其还可以包括如下临床研究:在所述临床研究中,不知道所述临床研究可能对于患者是否相关。
131.在图1中描述的具体实施例中,涉及35岁的女患者,对于所述女患者,应确定关于乳腺癌早期识别的相关临床研究。根据患者数据从临床研究的可用集合确定包括以下表型入选标准的所有临床研究:“性别”:女,“年龄”:30-50,“疾病”:乳腺癌。为此,进行治疗的医生提供对应的患者数据。以这种方式确定的临床研究描述对于女患者相关的临床研究。
132.在相对于所示出的实施例替选的实施例中,在确定det-2至少一个基因组区位的方法步骤之后可以针对多个临床研究中的每个临床研究执行确定det-4对于患者相关的临床研究的方法步骤。然后,在确定det-2至少一个基因组区位的方法步骤中,尤其可以针对临床研究的可用集合的所有临床研究确定至少一个基因组区位。
133.图3示出用于确定det-4对于患者相关的临床研究的方法步骤的第一实施例。
134.根据对于图1的描述构成如下方法步骤:接收rec-1和/或确定det-1多个临床研究,针对多个临床研究中的所述临床研究中的每个临床研究确定det-2至少一个基因组区位,创建det-3基因检测组合计划和提供prov基因检测组合计划。
135.多个临床研究中的至少一个临床研究可以在所述实施例中包括至少一个如在对于图2的描述中描述的表型入选标准。
136.确定det-4对于患者相关的临床研究的方法步骤包括接收rec-2患者数据的方法步骤。在此,可以利用确定系统sys的接口sys.if接收患者数据。
137.在接收rec-2患者数据的方法步骤中,接收患者的患者数据。患者数据在此可以如上所述构成。在此尤其可以以电子患者病历形式接收患者数据。替选地,可以以使用者输入形式接收患者数据。
138.在确定det-4对于患者相关的研究的方法步骤中,过滤基于表型入选标准与患者数据的比较。尤其可以将包括患者根据患者数据满足的入选标准的临床研究分类为相关研究。例如,可以根据患者数据检验患者是否患有疾病,所述疾病根据表型入选标准是对于参与临床研究的前提。
139.图4示出用于确定det-4对于患者相关的临床研究的方法步骤的第二实施例。
140.根据对于图1的描述构成如下方法步骤:接收rec-1和/或确定det-1多个临床研究,针对多个临床研究中的所述临床研究中的每个临床研究确定det-2至少一个基因组区
位,创建det-3基因检测组合计划和提供prov基因检测组合计划。
141.多个临床研究中的至少一个临床研究可以在所述实施例中包括至少一个如在对于图2的描述中描述的表型入选标准。
142.确定det-4对于患者相关的临床研究的方法步骤包括:接收rec-2患者数据的方法步骤,应用app经训练的函数的方法步骤和基于相关性参数确定det-5对于患者相关的临床研究的方法步骤。
143.在接收rec-2患者数据的方法步骤中,接收患者的患者数据。在此,可以利用确定系统sys的接口sys.if接收患者数据。患者数据在此可以如上所述构成。
144.在应用app经训练的函数的方法步骤中,将经训练的函数应用于临床研究的可用集合和患者数据。在此,可以利用确定系统sys的计算单元sys.cu将经训练的函数应用于临床研究的可用集合和患者数据。在此,对于临床研究的可用集合中的每个临床研究确定相关性参数。相关性参数说明对应的临床研究对于患者的相关性。换言之,可以通过应用app经训练的函数将临床研究的可用集合中的临床研究在其对于患者的相关性方面进行分类。例如,可以分类成“0”和“3”之间的类别。“0”在此可以表示对应地分类的临床研究对于患者不相关,“3”可以表示对应地分类的临床研究对于患者非常相关。类别“1”和“2”在此可以是“0”和“3”之间的层级。替选的类别划分和层级细分是可行的。
145.在基于相关性参数确定det-5对于患者相关的临床研究的方法步骤中,从临床研究的可用集合确定对于患者相关的临床研究。尤其可以利用确定系统sys的计算单元sys.cu执行所述方法步骤。尤其可以在关于分类的上述实例中将具有相关性参数“3”或“2”的临床研究添加到对于患者相关的临床研究。于是,所述临床研究尤其可以由多个临床研究包括。
146.图5示出用于创建个体化的基因检测组合计划的方法的第三实施例。
147.根据对于图1的描述构成如下方法步骤:接收rec-1和/或确定det-1多个临床研究,针对多个临床研究中的所述临床研究中的每个临床研究确定det-2至少一个基因组区位,创建det-3基因检测组合计划和提供prov基因检测组合计划。可以根据对于图2和/或对于图3和/或对于图4的描述构成确定det-4对于患者相关的临床研究的方法步骤。
148.创建det-3基因检测组合计划的方法步骤包括将多个临床研究的基因组区位组合成至少一个组合的基因组区位的方法步骤。在此,基因检测组合计划包括至少一个组合的基因组区位。
149.至少一个组合的基因组区位在此包括多个临床研究的所有基因组区位。此外,组合的基因组区位不包括基因组上的不被多个临床研究中的至少一个基因组区位包括的区位。
150.组合的基因组区位包括多个临床研究的所有临床研究的基因组区位的数学联合。至少一个组合的基因组区位在此仅一次包括不同基因组区位的重叠区域。基因组上的不被所述基因组区位中的任一基因组区位包括的区位也不被至少一个组合的基因组区位包括。基因检测组合计划尤其可以包括多于一个的组合的基因组区位。
151.换言之,在基因检测组合计划中定义基因组上的由至少一个基因组区位包括的至少一个区位。所述至少一个区位描述为至少一个组合的基因组区位。至少一个组合的基因组区位尤其可以借助于在基因组上的坐标定义。
152.在图1中描述的具体实施例中,多个临床研究中的两个临床研究的基因组区位是:“染色体17:41,196,312-41,322,262”和“染色体17:41,320,187-41,320,266”。因为基因组区位“染色体17:41,196,312-41,322,262”包括基因组区位“染色体17:41,320,187-41,320,266”,所以组合的基因组区位是“染色体17:41,196,312-41,322,262”。如果考虑上述缓冲区,则包括临床研究的两个基因组区位的组合的基因组区位是“染色体17:41”。
153.图6示出用于创建个体化的基因检测组合计划的确定系统sys,图7示出用于提供经训练的函数的训练系统tsys。
154.所示出的用于创建个体化的基因检测组合计划的确定系统sys构成用于执行根据本发明的用于创建个体化的基因检测组合计划的方法。所示出的训练系统tsys构成用于执行根据本发明的用于提供经训练的函数的方法。确定系统sys包括接口sys.if、计算单元sys.cu和存储单元sys.mu。训练系统tsys包括训练接口tsys.if、训练计算单元tsys.cu和训练存储单元tsys.mu。
155.确定系统sys和/或训练系统tsys尤其可以是计算机、微控制器或集成电路(英文:integrated circuit,ic)。替选地,系统sys和/或训练系统tsys可以是真实的或虚拟的计算机网络(对于真实的计算机网络的技术名称是“集群(cluster)”,对于虚拟的计算机网络的技术名称是“云(cloud)”)。确定系统sys和/或训练系统tsys可以构成为在计算机或真实的计算机网络或虚拟的计算机网络上执行的虚拟系统(技术名称是“虚拟化(virtualization)”)。
156.接口sys.if和/或训练接口tsys.if可以是硬件接口或软件接口(例如pci总线、usb或火线)。计算单元sys.cu和/或训练计算单元tsys.cu可以包括硬件和/或软件组成部分、例如微处理器或所谓的fpga(英文:field programmable gate way(现场可编程门阵列))。存储单元sys.mu和/或训练存储单元tsys.mu可以构成为非持久工作的工作存储器(英文:random access memory,ram)或持久的大容量存储器(硬盘、usb记忆棒、sd卡、固态硬盘(ssd))。
157.接口sys.if和/或训练接口tsys.if尤其可以包括执行相应的根据本发明的方法的不同方法步骤的多个子接口。换言之,接口sys.if和/或训练接口tsys.if可以构成为多个接口sys.if和/或训练接口tsys.if。计算单元sys.cu和/或训练计算单元tsys.cu尤其可以包括执行相应的根据本发明的方法的不同方法步骤的多个子计算单元。换言之,计算单元sys.cu和/或训练计算单元tsys.cu可以构成为多个计算单元sys.cu和/或训练计算单元tsys.cu。
158.即使未明确表明,然而有意义的并且在本发明的意义下,可以将各个实施例、实施例的各个子方面或特征彼此组合或交换,而不脱离本发明的范围。在可转用的情况下,参照实施例描述的本发明的优点在没有明确提及的情况下也适用于其他的实施例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
