1.本发明涉及可以使用多种方法制备的聚合物纳米颗粒,以用作体外和体内诊断的信号分子。
背景技术:
2.纳米材料可以与生物识别分子连接创作出一种特殊的分子诊断探针。纳米技术的最新发展提出了一系列具有独特特性的纳米传感平台,以提高生物检测组件的检测能力、灵敏度、易操作性和便携性,这正在彻底改变医疗保健领域的诊断技术。这种新颖的纳米诊断方法可以进一步开发即时诊断和检测技术。
3.免疫标记是用于检测和定位靶抗原(例如,蛋白质)的成熟技术。该技术已广泛用于分子生物学、生物化学和体外诊断工业等不同领域。免疫标记技术有直接和间接两种方法。在直接方法中,目标抗原是通过与荧光标签或酶偶联的一抗检测的,而在间接方法中,目标抗原是先被一抗识别的,然后再通过标记的第二抗体进行检测,该抗体特异地与一抗结合抗体。直接和间接方法均可应用于免疫印迹、免疫组织化学、免疫荧光、酶联免疫吸附测定(elisa)和荧光激活细胞筛选(facs)。常规来说,直接方法可以使由二抗体潜在引起的物种交叉反应最小化。但是,直接免疫标记的灵敏度远低于间接方法,因为一抗可以与几种标记的二抗结合,从而导致信号放大。
4.侧向层析法(lfa)的工作原理与elisa基本相似。lfa已广泛用于医院和临床实验室以及兽药、环境评估以及食品生产过程中的安全性测试。这种测定价格合理、灵敏、具有特异性、用户友好、快速且稳定。添加样本(例如,尿液和血液)后,无需额外的设备或使用最少的设备,即可在几分钟内获得结果。
5.信号标签是侧向层析测定的关键。这些具有颜色或其他能够进行检测特性的颗粒或分子可以与结合/检测分子偶联。金纳米颗粒已广泛用于侧向层析测定中。该种颗粒的特点是易于制备和功能化、良好的生物相容性和成本效益。金纳米颗粒产生不需要任何可视化设备的读数。
1.然而,这种方法通常是定性或半定量的,信号强度低,灵敏度差。
6.寻找具有更好分析性能的新型标记是一个持续的挑战。尽管已经报道了荧光标记可以促进痕量分析物的灵敏和定量检测,但它们中的大多数发光量子效率太低,无法应用于侧向层析测定中。此外,在给定的单位体积的质量条件下,通常(纳克每毫升或毫克每毫升)或(毫国际单位每毫升),当前的荧光侧向层析测定的检测范围较窄(100–
102)
1.。
7.此外,荧光强度猝灭效应是荧光材料的共同缺点。
2.因此,非常需要找到一种表现出非荧光猝灭并且可以封装成纳米颗粒或纳米团簇的材料。不表现出荧光强度猝灭效应的信号标记可以有效提高检测灵敏度并进行定量分析,同时仍保留普通侧向层析免疫测定的简单性、快速性和便携性。
8.最有优势的荧光标记之一是量子点(qds)。它们具有多种独特的物理化学特性,包括量子产率高、发射波长可调和光稳定性强。但是,qds的缺点包括毒性大、粗糙、合成程序复杂和胶体不稳定性。基于cdse(硒化镉)的量子点具有剧毒,需要稳定的聚合物壳。此外,
在现阶段技术难以实现超过一公斤蛋白质功能化量子点的大规模生产。
3.尽管它们已被证明在制成纳米颗粒时表现出良好的荧光特性,但它们在较高浓度和固态下会受到发射猝灭效应的影响。此外,根据先前的结果,量子点的检测范围非常窄。
[4-6]
[0009]
上转换荧光材料是一类含有稀土的晶体颗粒,能够将较低能量的红外光的光子上转换为较高能量的可见光。但是,这些材料的发光量子产率较低。镧系元素标记,例如eu,发射红色区域和绝对量子产率效率一般在40%。
[7]
[0010]
聚集诱导发光(aie)材料也可以作为荧光信号输出材料。
[8]
[0011]
这里报道的荧光纳米颗粒具有独特的特性,例如,不低于20%的发光量子产率、可调发射颜色和均匀的尺寸分布。更重要的是,荧光纳米颗粒的大规模生产相对容易且成本低廉。在适当的组合中,功能化纳米颗粒探针可以可用于紧凑型床旁平台中的定量单一和多重检测。aie纳米颗粒还可以替代免疫标记中抗体偶联的常规标签。aie偶联抗体可以解决直接免疫标记方法灵敏度低的问题,并可进一步提高间接免疫标记法的灵敏度。因此,我们报道的纳米颗粒可以应用于例如早期疾病检测、基因组技术、体内诊断以及个性化和预测医学。
技术实现要素:
[0012]
在一些实施例中,本发明提供了独特的荧光纳米颗粒和功能化纳米颗粒,它们显示出不低于20%的高固态绝对量子产率。在一些实施例中,荧光核的发射波长可以是紫外光(200-420nm)、可见光(420-780nm)或红外线(780-1200)。可以为不同的诊断目的选择合适的发射波长。在一些实施例中,检测范围为10
0-104(毫国际单位/毫升),比常规产品宽两个数量级。
[0013]
荧光粒子的制备
[0014]
荧光团可以与单体混合,然后进行聚合或可以直接被大分子包裹。这些方法允许在聚集状态、簇或高浓度状态下保持高荧光量子产率。例如,荧光团可以与单体,例如苯乙烯、甲基丙烯酸甲酯(mma)和丙烯酸,然后聚合。荧光纳米颗粒也可以通过其他方法制造,例如微流体和超声波方法,涉及或不涉及化学反应。例如,可以使用涉及化学反应的典型微流体流动聚焦装置制造荧光纳米颗粒(图1)。
[0015]
荧光粒子的特殊性
[0016]
本发明提供的荧光粒子的尺寸范围很广。本发明的荧光粒子的直径可以在几毫米(10-3
米)(毫微粒)到微米(10-6
米)(微粒),到纳米(10-9
米)(纳米颗粒)的范围内,在大小、形状和表面特性方面具有良好的均匀性。也可以使用具有合适特性的微粒。
[0017]
众所周知,纳米颗粒的合适尺寸和良好的均匀性在生物医学应用中很重要。纳米颗粒的尺寸需要优化,以使其功能适合不同的生物医学应用,因为纳米颗粒的化学和物理特性取决于尺寸。此外,纳米颗粒应该具有窄的尺寸分布,以避免在检测中出现任何差异。例如,应用于侧流免疫测定的纳米颗粒的尺寸应该尽可能小。结合分子和抗体通常具有5-15纳米,并且由于它们的小尺寸,比固定在纳米颗粒表面的结合分子的复杂共轭物更容易从共轭垫中释放出来。这使得背景荧光很容易被滤光片去除。此外,本发明的荧光粒子在较高浓度或聚集状态下不会受到猝灭效应影响。
[8]
[0018]
为不同诊断目的而功能化的纳米颗粒
[0019]
为了将纳米颗粒的独特物理特性用于不同的诊断目的,需要用传感分子对纳米颗粒进行进一步的功能化。该分子可以是小分子(例如,生物素)、适体、对分析物或生物大分子,如rna、dna或蛋白质(例如,抗体或酶)。纳米颗粒与传感分子的功能化已经通过(i)静电相互作用,(ii)化学吸附(例如,通过硫醇或胺基团),(iii)共价结合,和(iv)基于亲和力的系统实现。例如,使用诸如1-乙基-3-(3-二甲氨基丙基)-碳二亚胺(edc)或edc/n-羟基琥珀酰亚胺(nhs)之类的交联剂,诸如抗体或其他蛋白质之类的分子可以共价结合到纳米颗粒上。
[0020]
一种具有核壳结构的荧光纳米颗粒,其亲水表面带有用于生物修饰的官能团(例如羧基、胺基、硫醇基等)。例如,蛋白质(例如,抗体)可以通过将附着于纳米颗粒表面的官能团与所述蛋白质的n-末端或c-末端氨基酸连接而附着至纳米颗粒。与抗体连接的荧光纳米颗粒可用于免疫测定。图2描绘了荧光纳米颗粒的一个实施例的示意图。本领域技术人员可以基于蛋白质和其他传感分子的特定需要来选择它们。
附图说明
[0021]
图1描绘了用于制造荧光纳米颗粒的微流体装置的一个实施例。使用以下缩写:甲基丙烯酸甲酯(mma)-丙烯酸(aa)、十二烷基苯磺酸钠(sdbs)、乙醇乙氧基化物(aeo,与重复单元3/5/7),十二烷基硫酸钠(sds)。过硫酸铵(aps)、2,2'-偶氮二异丁腈(aibn)、过氧化苯甲酰(bpo)。
[0022]
图2示出了具有核壳结构的纳米颗粒,其具有用于生物改性的官能团。
[0023]
图3图示了代表本发明的一些实施例的侧向层析免疫试纸的侧视图。
[0024]
图4图示了代表本发明的一些实施例的侧向层析免疫试纸的俯视图。
[0025]
图5示出了不同浓度0、2、5、5、103、25、100、200、500、1000、10000mlu/ml的hcg试纸条的照片,该照片是在试验的第一天(左图)和六个月后(右图)使用相同的摄像机设置在365纳米的光激励下拍摄的。
[0026]
图6示出了在自然光和365纳米紫外激发下,如实施例1所述制备的荧光纳米颗粒的光致发光。
[0027]
图7示出了hcg(左)和lh测试条(右)在不同浓度的hcg(0、20、200、2000、10000mlu/ml)和lh(0、20、200、2000mlu/ml)下的照片,样品体积为100微升,365nm紫外线激发。
[0028]
图8示出了在自然光(左)和365纳米紫外激发(右)下含有aiegen
tm
红的荧光纳米颗粒的照片。
[0029]
图9示出了在365纳米激发下具有两条测试线的纸条照片,其中t1和t2分别用于lh和hcg检测。
[0030]
图10示出了aie偶联抗体的性能测试;(a)使用1:5000 aie偶联小鼠抗β-lh抗体(箭头)在免疫印迹上直接检测7ng lh蛋白;(b)间接检测7ng使用1:5000未结合的小鼠抗β-lh抗体(箭头)和1:5000 fitc结合的山羊抗小鼠二抗(箭头)对lh蛋白进行分析;图a和b上的图像是在相同条件下捕获的。
具体实施方式
[0031]
荧光纳米颗粒偶联物的应用
[0032]
[1]荧光纳米颗粒偶联物可用于蛋白质印迹(wb)作为间接或直接指标,用于免疫组织化学(ihc),用于免疫细胞化学/免疫荧光(icc/if),用于流式细胞术(fc),用于侧向层析测定(lfa)。
[0033]
[2]在一些实施例中,本发明可以有效地提高侧向层析测定的检测灵敏度并实现定量分析。此类测定可应用于例如保健监测、紧急情况和资源贫乏环境中的医学诊断、食品质量控制食源性疾病的案例,以及有害离子污染的水监测。
[0034]
[3]本发明的一个实施例是一种一步式侧向层析免疫试纸,包括样品垫、结合垫、反应膜(例如,硝化纤维素膜(nc))、吸附垫垫和至少一种在分配在结合垫上的较高浓度下不表现出发射猝灭的荧光偶联物。所有这些组件都安装在背卡上。在本发明的一些实施例中,可以使用固体支持基质代替背卡。图3和4描绘了侧向层析测定的一些实施例。
[0035]
[4]一个实施例由重叠的膜组成,按以下顺序安装在背卡或固体支持基质上:样品垫、结合垫、反应膜和吸附垫。结合垫由至少一种组成特定于目标分析物的荧光纳米颗粒偶联物组成,其在较高浓度下不表现出发射猝灭。将样品施加到样品垫上,然后通过毛细管力沿膜移动到达含有荧光纳米颗粒的结合垫偶联物与生物识别分子结合。然后样品到达包含目标分析物的测试线和对照线的反应膜,最后到达吸附垫,吸附垫保留废物。不同的捕获分子可以取决于目标分析物的性质,固定在条带的测试线或对照线上。例如,测试线和对照线分别包括一抗和二抗,用于基于双抗夹心法的侧向层析试纸条。一抗特异性结合目标分析物的第二抗原位点,而二抗特异性结合标记抗体。
[0036]
[5]本发明可应用于在侧向层析免疫分析中检测抗原,如人绒毛膜促性腺激素(hcg)和促黄体激素(lh)。体液,如血液、血清、尿素、唾液、鼻液和眼泪可以应用在样品垫上,并通过结合垫迁移,其中包含对目标分析物具有特异性的荧光抗体偶联物。样品连同与目标分析物结合的抗体偶联物沿着条带移动到nc膜的检测区,其中特定的抗体固定在线路中,与结合到偶联物的抗体上的分析物反应(夹心分析)。样品分析物的识别导致测试线上的适当荧光信号响应,而对照线上的响应表明液体流过试纸条。读数由不同强度的线表示,可以使用专用分析仪进行评估。测试的荧光强度用于确定样品中的待测物的数量。
[0037]
[6]根据目的,本发明的不同实施例可以使用各种分析器。例如,在一些实施例中,可以使用互补金属氧化物半导体(cmos)或电荷耦合器件(ccd)来将荧光图像记录到(x,y,z)的颜色矩阵值上,其中x代表红色,y代表绿色,z代表蓝色。然后使用图像处理算法处理图像,该算法根据荧光强度确定分析物浓度测试线和对照线以及它们的强度比。在一些实施例中,荧光信号被收集并通过光电转换器(例如光电二极管)转换成电子信号。对于这两种方法,分析仪应包括:(i)激发光源,如发光二极管(led);(ii)在cmos/光电二极管捕获荧光信号期间,用于保持led灯亮的电子移动电源或电源驱动器;(iii)向智能手机或个人电脑等智能平台传输数据的传输模块;(iv)用于数据存储的存储器;(v)与所有组件完全集成的印刷电路板;(vi)可选,光纤/光波导玻璃/过滤器。
[0038]
[7]在一些实施例中,本发明对多种可检测的蛋白质具有广泛的检测范围。例如,对于hcg,检测范围可以是从100到104miu/ml。对于lh,检测范围可以是为100~103miu/ml。在一些实施例中,使用半年后可观察到荧光条带无明显降解(图5),表明荧光抗体偶联物具有优异的光稳定性,使其可以长期保存测试记录。
[0039]
[8]在一些实施例中,可以使用在较高浓度或聚集状态下不表现出猝灭的发光源
代替荧光团。
[0040]
[9]纳米颗粒可以通过叠氮基和炔基之间的“点击”反应或通过硫醇与溴化物与无金属催化剂的反应而与生物检测分子交联。可以使用其他合适的交联方法。
[0041]
[10]在一些实施例中,所使用的分析仪能够检测电致发光、机械发光、摩擦发光、化学发光、压致发光和机械致变色等。
[0042]
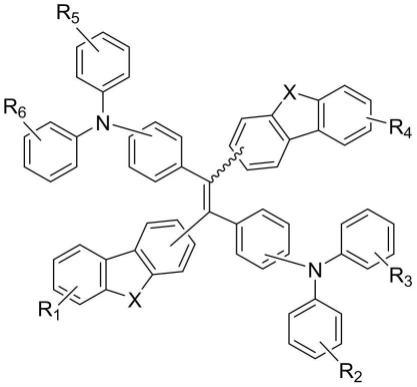
[11]在一些实施例中,发光团可包含荧光团。在一些实施例中,荧光团可具有以下骨架结构:
[0043][0044]
其中每个r1、r2、r3、r4、r5和r6独立地选自氢、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基和杂芳基中的一种;其中每个x独立地选自氧、硫、硒、碲、碳、硅、锗、磷、砷和锑中的一种,其中x可以进一步被氢、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基或杂芳基取代。本领域技术人员可以理解,根据x的价数,它可以带有0-3个取代基。例如,如果x选择第4族元素(例如si),则它可能与两个质子,或两个其他取代基(例如烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基和杂芳基),或质子和另一个取代基结合。
[0045]
[12]在一些实施例中,具有高于20%的发光量子产率的纳米颗粒包含缠结在聚合物网中的发光团,其中在所述聚合物网中的发光团的量可以是1-50w/w%范围内的任意值。
[0046]
通过聚合反应制备荧光纳米颗粒的过程
[0047]
[13]在本发明的一些实施例中,荧光纳米颗粒可根据以下过程制备。
[0048]
[14]优选地,在聚合反应之前,所有单体应该被纯化,例如通过氧化铝(al2o3)柱,并且应该从去离子(di)水中去除氧气,例如通过用氮气鼓泡30分钟。
[0049]
[15]将由两颈烧瓶、机械搅拌装置和油浴组成的装置组装在一起。将两颈烧瓶浸入油浴中。机械搅拌工作时,两颈烧瓶不应摇晃。然后,将0.01-0.2克十二烷基苯磺酸钠(sdbs)、0.05-0.5克碳酸氢铵(nh4hco3)和5-20毫升去离子水加入到双颈烧瓶中。打开机械搅拌装置,转速为100-1000rpm,油浴温度升至60-80摄氏度。
[0050]
[16]通过将0.01-0.1g过硫酸铵[(nh4)2s2o8]溶解在去离子水中制备引发剂水溶液。
[0051]
[17]通过在0.1-900毫升[苯乙烯(st)/甲基丙烯酸甲酯(mma)/丙烯酸(aa)(体积分数比1:0.02-1:0.02-1)]中溶解4,4'-(1,2-双(二苯并[b,d]噻吩-2-基)乙烯-1,2-二基)-双(n,n-二苯基苯胺)(商业名称aiegentm bright green,以前称为nstpe)制备单体混合物。
[0052]
[18]当反应混合物变得透明时,将3-5%体积的制备的单体混合物加入反应混合
物中以进行预乳化。在一些实施例中,1至《100%体积的制备的单体混合物可加入反应中。10-60分钟后,将引发剂水溶液和剩余单体混合物以2-10滴的速度在几分钟内同时加入烧瓶中。稍晚于单体混合物。反应混合物在70-90摄氏度下保持加热直至变成乳白色。然后反应混合物冷却后纯化粗产物。
[0053]
[19]在一些实施例中,用于制备反应混合物的表面活性剂可以是以下一种或多种:癸基苯磺酸钠、十二烷基硫酸钠、多库酯钠、全氟辛烷磺酸、全氟丁烷磺酸硬脂酸钠、季铵盐铵阳离子其中r基团可以是一个或多个烷基或芳基[例如,苯扎氯铵和二硬脂基二甲基氯化铵],烷基多糖苷,其中m可以在1到100之间变化,[例如,癸基葡萄糖苷],单硬脂酸甘油酯,壬基苯氧基聚乙氧基乙醇,其中n可在1到100之间变化等。
[0054]
[20]在一些实施例中,为了实现纳米颗粒的小尺寸和良好的均匀性,使用完全溶于单体溶液的荧光团。如表1所示,荧光团在单体溶液中的溶解度从投料1降低到投料3。如果荧光团不溶于单体溶液(投料3),则不发生聚合。虽然当荧光团部分溶于单体溶液时发生聚合(投料2),但无法实现纳米颗粒的小尺寸和良好均匀性。只有当荧光团完全溶于单体溶液时,纳米颗粒才具有非常小的尺寸(《50纳米)和良好的均匀性。
[0055]
表1.一些荧光团在一些单体中的溶解度:
[0056][0057]
使用微流体装置制造荧光纳米颗粒的过程
[0058]
[21]在一些实施例中,典型的微流体流动聚焦装置可用于制造荧光纳米颗粒(图1)。微流体装置可以使用标准微成型方法由聚二甲基硅氧烷(pdms)制成。或者,可以使用深反应离子蚀刻或湿法蚀刻方法在硅晶片中蚀刻所有具有特定尺寸的微通道。然后可以使用阳极键合将蚀刻后的硅晶片与玻璃基板键合。制造在玻璃基板上的加热器(铂)为微通道提供热量。在玻璃基板上制造的温度传感器(例如铂传感器)可以记录微通道内的温度。通过改变流动参数来调整荧光纳米颗粒的粒径。
[0059]
荧光纳米颗粒的纯化过程
[0060]
[22]在本发明的一些实施例中,可以根据以下过程纯化纳米颗粒。
[0061]
[23]粗品在5-15krpm下离心3-30分钟去除游离的aiegen
tm
亮绿。上层转移至试管,加入乙醇,体积比为1:0.1-10用于破乳。数小时后可观察到明显沉淀。然后将混合物以5-15krpm离心3-30分钟,得到固体产物。然后,在超声波机的帮助下,将分离的产物重新分散在1x磷酸盐缓冲盐水(pbs)中。最终的溶液在室温下储存以备使用。
[0062]
标记反应过程
[0063]
[24]在一些实施例中,标记反应可以如下所述进行。
[0064]
[25]146微升2-乙磺酸(mes)缓冲液(ph 6.0)、50微升纳米颗粒(粒径《200纳米)溶液、2微升1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(edc)溶液(20毫克/毫升)和2微升
n-羟基磺基琥珀酰亚胺(磺基-nhs)溶液(55毫克/毫升)加入1.5ml试管中。edc和磺基-nhs溶液在使用前用mes缓冲液(ph 6.0)制备。反应混合物在室温下以100-1000rpm(eppendorf离心机5424r)振荡15-60分钟后,在管中加入1.4微升2-巯基乙醇以灭活edc。然后,将反应混合物在5-15krpm下离心3-30分钟。收集固体产物并用200微升mes缓冲液洗涤数次。
[0065]
[26]将纯化的固体产物重新分散在600μl 1x pbs缓冲液(ph 7.4)中以制备活化荧光纳米颗粒溶液。将200μl活化荧光纳米颗粒溶液和200μl抗体转移至1.5ml管中。反应混合物保持在室温下以100-1000rpm振荡1-4小时。然后在0-4摄氏度和5-15krpm下离心1-60分钟,收集固体产物。将固体产物再分散于200μl的1%牛血清白蛋白(牛血清蛋白)溶液中(在1xpbs缓冲液中)并将混合物在0-4摄氏度下以100-1000rpm的速度振荡。1-24小时后,将混合物在0-4摄氏度和5-15krpm下离心3-30分钟,收集固体产物。在超声机的辅助下,将固体产物再分散在200μl三乙醇胺缓冲盐水溶液缓冲液(吐温-20 0.05%)中,得到纳米颗粒抗体偶联物。标记的纳米颗粒在4-8摄氏度储存以备使用。
[0066]
侧向层析试纸制备过程
[0067]
[27]在本发明的一些实施例中,侧向层析试纸可根据下述程序制备。
[0068]
[28](i)结合垫的制备:
[0069]
通过使用含有0.1-1mol/l氯化钠(nacl)、1-20mmol/l乙二胺四乙酸(edta)、1-10%(w/v)bsa、1-10%(w/v)蔗糖和0.01-0.1%(w/v)叠氮化钠(nans)的tbs-t缓冲液(ph 7.4)稀释标记的纳米颗粒以产生偶联物溶液,最终浓度为1-100微克/毫升。将5-25ul偶联物溶液添加到尺寸为3x6mm的结合垫中,然后在37℃下干燥3小时。
[0070]
[29](ii)捕获试剂的固定:
[0071]
用于lh试纸的0.1-2mg/ml的小鼠抗人alpha-lh-mab(或用于hcg试纸的小鼠抗人alpha-hcg-mab)和0.1-2mg/ml的山羊抗小鼠igg(lh和hcg检测)分别作为测试线和对照线分别施加在硝酸纤维素膜上。测试线和对照线均设置在距膜中心5mm的位置。将捕获试剂以9μl-1
cm-1
的形式涂在膜上,并在37℃下干燥1-2小时。最后用0.1-5%(w/v)牛血清蛋白封闭膜,干燥后密封保存。
[0072]
[30](iii)样品和吸收垫的制备:
[0073]
样品和吸收垫由无纺布、100%纯纤维素纤维(millipore)制成。15x300毫米的样品垫用ph 8.0缓冲液饱和,缓冲液含有0.5-5.0%(w/v)牛血清蛋白、0.5-5.0%(w/v)的蔗糖、2-20mmol/l硼酸钠和0.01-0.1%(w/v)叠氮化钠,然后干燥储存。将吸附垫切成40
×
300mm尺寸。
[0074]
[31](iv)侧向层析试纸的组装:
[0075]
将样品垫、结合垫、nc膜、吸附垫依次组装在塑料背衬托板上,用1-2mm的动圈搭接,两端用彩膜覆盖后用cm4000切割器(bio-dot)剪切成3毫米宽试纸条,然后将试纸条以干燥剂凝胶的形式密封在塑料袋中,并在4摄氏度下储存。
[0076]
实施例
[0077]
实例1.荧光纳米颗粒的制备
[0078]
[32]表2总结了用于聚合物的一系列化学物和反应条件。表3列出了通过动态光散射(dls)机测量的纳米颗粒参数。
[0079]
[33]组装了一个包括双颈烧瓶、机械搅拌装置和油浴的装置。在机械搅拌工作时,
浸没在油浴中的双颈烧瓶不应摇晃。然后,0.2g在双颈烧瓶中加入sdbs、0.5g nh4hco3和20ml去离子水。打开机械搅拌器,转速为1000rpm,油浴温度升至60摄氏度.
[0080]
[34]然后在烧瓶中加入0.2g sdbs、0.5g nh4hco3和20ml去离子水,打开机械搅拌器,转速为1000转,油浴温度升至60摄氏度。或者,细胞破碎仪(scientz-95e)代替机械搅拌器在600w下搅拌3分钟(在表3中指定为p5)。
[0081]
[35]通过将0.01g过硫酸铵[(nh4)2s2o8]溶解在1ml di水中制备引发剂水溶液。通过将0.001g aiegen
tm bright green溶解在0.1ml st/mma/aa(v/v)来制备单体混合物,具有以下体积比:1:0.1:0.1(在表3中指定为p2);1:1:1(在表3中指定为p3);1:0.02:0.18(表3中指定为p4);1:0.1:0.1(表3中记为p5)。将混合物在60摄氏度下加热5分钟后,荧光团完全溶于单体溶液,溶液变为透明。然后,将制备的单体混合物体积的3%加入反应混合物进行预乳化。10分钟后,将引发剂水溶液和剩余单体混合物以每分钟10滴的速度同时加入到双颈反应烧瓶中。值得注意的是引发剂比单体混合物稍晚加入反应混合物。反应混合物在70摄氏度下保持加热直至呈乳白色。反应混合物冷却后,粗产物进行纯化。
[0082]
实例2.荧光纳米颗粒的制备
[0083]
[36]纳米颗粒p6、p7和p8的制备按照与p2-p4相同的过程进行,不同的是使用如下的纯单体溶液:p6:仅苯乙烯;p7:只有综合格斗;p8:仅aa。p6的粒径为80nm,pdi为0.035;p7的粒径为98nm,pdi为0.05;p8的粒径为103nm,pdi为0.045。
[0084]
表2.聚合反应的反应物和反应条件
[0085][0086]
实例3.荧光纳米颗粒的制备。
[0087]
[37]表4总结了聚合物的一系列化学品和反应条件。表3列出了通过动态光散射(dls)机器测量的纳米颗粒参数。将0.1g sdbs、0.5g nh4hco3和15ml di水加入到两颈烧瓶。将烧瓶置于油浴中,油浴温度升至70摄氏度以溶解固体。取出烧瓶,冷却反应混合物。通过在1ml去离子水中溶解0.02g过硫酸铵制备引发剂水溶液[(nh4)2s2o8]。通过将0.01g aiegen
tm
red溶解在0.6mlst/mma/aa(v/v)中制备单体混合物,体积比为1:0.1:0.1(在表中指定为p93)。将制备好的单体混合物加入反应混合物中,通过细胞破碎仪(scientz-95e)在500w下预乳化0.5小时。组装了包括两颈烧瓶、机械搅拌装置和油浴的装置。将两颈烧瓶浸
入70摄氏度油浴中,机械搅拌300rpm。机械搅拌时装置不应摇晃。搅拌10分钟后,将引发剂水溶液以每分钟5滴的速度加入到双颈反应烧瓶中。之后,将反应混合物在70摄氏度下继续加热1小时。然后在反应混合物冷却后纯化粗产物。
[0088]
实例3.荧光纳米颗粒的纯化
[0089]
[38]将从实施例1获得的粗产物以3krcf离心3分钟以除去游离的aiegen
tm
brightgreen。将上层转移至管中并以1:0.1的体积比加入乙醇以进行破乳。数小时后可观察到明显沉淀。然后将混合物以5krpm速度离心3分钟,得到固体产物。之后,在超声机器(观博仕gs1530p-30l-900w)辅助下,将分离的产物重新分散在1x磷酸盐缓冲盐水(pbs)中,在900w下进行1分钟。最终的溶液在室温下储存以备进一步使用。图6显示了荧光纳米颗粒在自然光和365nm紫外激发下的光致发光。
[0090]
表3.所选实例的粒径
[0091][0092]a超声波预乳化10分钟
[0093]
表4.聚合反应的化学成分及反应条件
900w)辅助下将分离的产物重新分散在1x磷酸盐缓冲盐水(pbs)中,在900w下进行1分钟。最终的溶液在室温下储存以备进一步使用。图8显示了荧光纳米颗粒在自然光和365nm紫外激发下的光致发光效果。
[0099]
实例5.荧光纳米颗粒的纯化
[0100]
[40]将实例3所得粗产物以3krcf离心10分钟两次以除去游离的aiegen
tm
红。将上层转移至管中,加入体积比为1:4的乙醇(粗产物:etoh,v/v)用于破乳。然后将混合物在6600rcf下离心50分钟以获得固体产物。通过短暂的超声波处理将固体产物重新分散在ddi水中。在21krcf下离心30分钟后,将获得的固体产物再次重新分散在ddi水中。再次以21krcf离心30分钟后,在超声波机(观博仕gs1530p-30l-900w)的辅助下,将纯化的产物重新分散在0.1m2-(n-吗啉)乙磺酸(mes,ph6.0)中,以900w进行20分钟。最终的分散体在室温或4摄氏度冰箱中储存以备进一步使用。图8显示了荧光纳米颗粒在自然光和365nm紫外激发下的光致发光的效果。
[0101]
实例6.标记nl10和lh3的过程
[0102]
[41]将146微升2-乙磺酸(mes)缓冲液(ph6.0)、50微升p2纳米颗粒溶液、2微升1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(edc)溶液(20毫克/毫升)、2微升羟基磺基琥珀酰亚胺(磺基-nhs)溶液(55毫克/毫升)加入1.5ml试管中。edc和磺基-nhs溶液在使用前用mes缓冲液(ph6.0)制备。300rpm(eppendorf离心机5424r)室温振荡15分钟,加入1.4微升2-巯基乙醇使edc失活,然后5krpm离心5分钟,收集固体产物并用200微升mes缓冲液洗涤数次。表5列出了抗体标记的实例。
[0103]
[42]将纯化的固体产物重新分散在600微升1xpbs缓冲液(ph7.4)中以制备活化的荧光纳米颗粒溶液。200微升活化的荧光纳米颗粒溶液和200微升抗体(如表5所示的具有β-hcg-mab的nl10或具有β-lh-mab的lh3)转移至1.5毫升管中。将反应混合物在室温下以150rpm的速度持续振荡3小时。然后,将其在0摄氏度和6krpm下离心8分钟并收集固体产物。将固体产物重新分散在200μl1%牛血清白蛋白(牛血清蛋白)溶液(在1xpbs缓冲液中)中,并将混合物在0-4摄氏度下以240rpm摇晃。3小时后,将混合物置于0-4摄氏度,6krpm离心4分钟,收集固体产物。在微升超声波机的帮助下,固体产物再分散于200微升三乙醇胺缓冲盐水溶液缓冲液(吐温-200.05%)中,得到纳米颗粒抗体偶联物。标记的纳米颗粒溶液8摄氏度下保存备用。
[0104]
实例7.侧向层析试纸的制备
[0105]
[43](i)结合垫的制备:
[0106]
用含有0.1摩尔/升氯化钠、20毫摩尔/升乙二胺四乙酸、1%(w/v)牛血清蛋白、1%(w/v)蔗糖和0.02%(w/v)叠氮化钠的稀释剂稀释标记的纳米颗粒来制备最终浓度为50微克/毫升的偶联物溶液。将20微升偶联物溶液加入到3x6毫米大小的结合垫中,然后在37摄氏度下干燥3小时。
[0107]
[44](ii)捕获试剂的固定:
[0108]
将0.1毫克/毫升的用于lh试纸的小鼠抗人alpha-lh-mab(或用于hcg试纸的小鼠抗人alpha-hcg-mab)和0.5毫克/毫升山羊抗小鼠igg(同时用于lh和hcg检测)分别应用在硝酸纤维素膜上作为试验线和对照线。试验线和对照线均设置在距膜中心5mm处。将捕获试剂以9μl-1
cm-1
的形式涂在膜上,并在37℃下干燥1小时。最后用5%(w/v)牛血清蛋白封闭
膜,干燥后密封保存。
[0109]
[45](iii)样品垫和吸收垫的准备:
[0110]
样品和吸收垫由无纺布、100%纯纤维素纤维(millipore)制成。15x300毫米的样品垫用ph 8.0缓冲液饱和,缓冲液含有0.5%(w/v)牛血清蛋白、0.5%(w/v)的蔗糖、2mmol/l硼酸钠和0.01%(w/v)叠氮化钠,然后干燥储存。将吸附垫切成40
×
300mm尺寸。
[0111]
[46](iv)侧向层析试纸条的组装:
[0112]
将样品垫、结合垫、nc膜、吸附垫依次组装在塑料背衬托板上,用2mm的动圈搭接,两端用彩膜覆盖后用cm4000切割器(bio-dot)将母卡切割成3mm宽试纸条。然后将试纸条以干燥凝胶的形式密封在塑料袋中并储存在4摄氏度下备用。
[0113]
实例8.蛋白质标准溶液的检测程序
[0114]
[47]使用实例5进行测试。在三乙醇胺缓冲盐水溶液(ph7.4)中稀释制备0至200mlu/ml的不同浓度lh标准溶液。将100微升样品加载到试纸的样品垫上,10-60分钟后插入含有光电二极管的分析仪。所有实验一式三份,取三份的平均值进行分析。溶液浓度范围为0到1k mlu/ml的hcg标准溶液的检测是相似的。图7显示了在365纳米紫外光激发下不同浓度的hcg和lh试纸条。
[0115]
实例9.标记α-hcg-mab反应的过程
[0116]
[48]将130毫升2-乙磺酸(mes)缓冲液(ph7.0)、60毫升p2纳米颗粒溶液、1-4微升1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(edc)溶液(15-25毫克/毫升)、1μln-羟基磺基琥珀酰亚胺(磺基-nhs)溶液(50毫克/毫升)加入1.5ml试管中。edc和磺基-nhs溶液在使用前用mes缓冲液(ph6.0)制备。200rpm(eppendorf离心机5424r)室温振荡10分钟,加入1微升2-巯基乙醇使edc失活,然后5krpm离心5分钟,收集固体产物并用2微升mes缓冲液洗涤数次。将纯化后的固体产物重新分散在1000微升1xpbs缓冲液中以制备活化荧光纳米颗粒溶液。将200微升活化荧光纳米颗粒溶液和700微升抗体(α-hcg-mab)转移至1.5ml管中。反应混合物室温150rpm振荡3小时,6krpm离心5分钟,收集固体产物。固体产物再分散于700微升2%牛血清白蛋白溶液中(在1xpbs缓冲液中)并将混合物以20rpm在0℃下振荡。3小时后,将混合物以6krpm离心3分钟,收集固体产物。将固体产物用超声再分散在200微升三乙醇胺缓冲液中(吐温-200.05%)得到纳米颗粒抗体偶联物。标记的纳米颗粒溶液于4℃下保存备用。
[0117]
实例10.同时检测两种蛋白质的侧向层析测定试纸的制备
[0118]
[49]结合垫的制备:偶联物溶液是通过稀释标记好的纳米颗粒制作成的,最终溶液浓度为50微克/毫升。稀释溶液是三乙醇胺缓冲盐水溶液,含有0.1摩尔/升氯化钠、20毫摩尔/升乙二胺四乙酸、1%(w/v)牛血清蛋白、1%(w/v)蔗糖和0.02%(w/v)叠氮化钠。20微升偶联物溶液加到3x6毫米的结合垫上,并在37摄氏度下干燥3小时。(ii)固定捕获试剂:将用于lh检测的0.1mg/ml小鼠-抗-人alpha-lh-单克隆抗体作、用于hcg检测的小鼠-抗-人beta-hcg-单克隆抗体以及0.5mg/ml的羊-抗-小鼠igg(用于lh和hcg这两种检测)分别加到硝酸纤维膜上制成检测线1,检测线2和对照线。检测线和对照线分别设置在硝酸纤维膜中间,间隔为4毫米。在膜上以9微升每厘米的速度喷涂这些试剂并在37摄氏度下干燥1小时。最后,通过5%(w/v)牛血清蛋白封闭膜,并干燥置于封闭条件下待用。(iii)样品和吸收垫的制备:样品和吸收垫由无纺布、100%纯纤维素纤维(millipore)制成。15x300mm样品垫用
ph8.0缓冲液饱和,缓冲液含有0.5%(w/v)牛血清蛋白、0.5%(w/v)蔗糖、2mmol/l硼酸钠和0.01%(w/v)nan3,然后晒干保存。吸收垫被切割成40
×
300mm的尺寸。(iv)侧向层析试纸的组装:将样品垫、结合垫、nc膜、吸附垫依次组装在塑料背衬托板上,用2mm的动圈搭接,两端用彩膜覆盖。使用cm4000切割机(bio-dot)将主卡切割成3毫米宽的条带。然后将试纸条以干燥剂凝胶的形式密封在塑料袋中并储存在4摄氏度中。
[0119]
实例11.同时检测两种蛋白质标准溶液的程序
[0120]
[50]使用实例8进行测试。lh和hcg标准溶液的不同组合浓度分别为0-100mlu/ml和0-1000mlu/ml,用pbs缓冲液稀释制备(ph7.4)。100微升样品加载到试纸的样品垫上,10-60分钟后插入分析仪和光电二极管机。所有实验一式两份,取平均值复制品用于分析。图9显示了在365nmuv激发下不同蛋白质浓度的测试条。
[0121]
实例12.covid-19核衣壳蛋白的标记反应过程
[0122]
将130μl2-乙磺酸(mes)缓冲液(ph6.0)、50μlp2纳米颗粒溶液、1-4μl1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(edc)溶液(15-25mg/ml)和1μln-羟基磺基琥珀酰亚胺(磺基-nhs)溶液(50-60mg/ml)加入1.5ml试管中。edc和磺基-nhs溶液在使用前用mes缓冲液(ph6.0)制备。将反应混合物在室温下以200rpm(eppendorf离心机5424r)振荡10分钟后,在管中加入1μl2-巯基乙醇以灭活edc。然后,将反应混合物在5krpm下离心5分钟。收集固体产物并用200μlmes缓冲液洗涤数次。将纯化后的固体产物重新分散在500-1000μl1xpbs缓冲液(ph7.4)中,以制备活化的荧光纳米颗粒溶液。将200-700μl活化荧光纳米颗粒溶液和200-700μl蛋白质(2019-ncov核衣壳蛋白)转移到1.5ml管中。将反应混合物在室温下以150-300rpm保持振荡1-3小时。然后以6-8krpm离心5-10分钟,收集固体产物。将固体产物重新分散在200-700μl0.5-2%牛血清白蛋白(bsa)溶液(在1xpbs缓冲液中)中,并将混合物在0-4℃下以200-300rpm的速度振荡。1-3小时后,将混合物以6-8krpm离心3-10分钟,收集固体产物。在超声波机器的帮助下将固体产物再分散在200-700微升tbs-t缓冲液(吐温-200.05-1%)中以产生纳米颗粒抗体缀合物。标记的纳米颗粒溶液在4-8℃下储存以备进一步使用。
[0123]
实例13.检测2019 ncov核衣壳蛋白igm和igg的侧流层析试纸的制备
[0124]
[51]制备结合垫:偶联物溶液是通过用含有0.1摩尔/升氯化钠、20毫摩尔/升乙二胺四乙酸、1%(w/v)牛血清蛋白、1%(w/v)蔗糖和0.02%(w/v)叠氮化钠的溶液稀释的,并将其稀释到浓度50微克/毫升。将20微升偶联物溶液添加到大小为3x6毫米的结合垫中,然后再37摄氏度下干燥3小时。(ii)捕获试剂的固定;用于igm检测的0.1毫克/毫升鼠抗人igm-mab、用于igg检测的0.1毫克/毫升小鼠抗人igg-mab和0.5毫克/毫升小鼠抗ncov-核衣壳蛋白单抗分别作为测试线1、测试线2和对照线单独施加在硝酸纤维素膜上。测试线和对照线均设置在距膜中心4毫米处。将这些试剂以9微升每厘米的点状涂在膜上,并在37摄氏度下干燥1小时。最后用5%(w/v)牛血清蛋白封闭膜,然后干燥并密封保存。(iii)样品和吸收垫的制备:
[0125]
[52]样品和吸收垫由无纺布和100%纯纤维素纤维(millipore)制成。15x300毫米样品垫用含有0.5%(w/v)牛血清蛋白、0.5%(w/v)蔗糖、2mmol/l硼酸钠和0.01%(w/v)叠氮化钠的ph8.0缓冲液饱和,然后晒干保存。吸收垫被切割成40
×
300mm的尺寸。(iv)侧向层析试纸的组装:将样品垫、结合垫、nc膜、吸附垫依次组装在塑料背衬托板上,用2mm的动圈
搭接,两端用彩膜覆盖。使用cm4000切割机(bio-dot)将主卡切割成3毫米宽的条带。然后将测试条以干燥剂凝胶的形式密封在塑料袋中并储存在4摄氏度下。
[0126]
实例14.检测针对2019-ncov核衣壳蛋白的igm和igg的检测过程
[0127]
[53]使用实施例11进行测试。将患者阳性血清样本或正常个体血清阴性样本加载到试纸的样品垫上,然后插入分析仪和光电二极管机,经过10-60分钟。计算测试线强度比。表6显示了阳性和阴性血清样品的结果。
[0128]
[54]表6
[0129]
样本igm/igg比例阴性血清样本0.55阳性血清样本1.44
[0130]
实例15.aie偶联物抗体在免疫印迹中的应用
[0131]
[55]aie-偶联物抗体可提高免疫标记的敏感性。对aie-偶联物抗体直接免疫标记与传统荧光偶联物(如fitc)抗体间接免疫标记的免疫印迹性能测试。本试验中,将等量的蛋白质印迹在两层能源纤维膜上。蛋白质一层膜(a)与aie-偶联物一抗结合检测;而另一层膜(b)上的蛋白质与等量的未偶联物一抗和fitc偶联物二抗结合检测。在相同条件下,用直接法检测目的蛋白的信号强度。免疫印迹上的aie-偶联物抗体远强于fitc偶联物二抗间接法检测的结果(图10)。
[0132]
参考文献
[0133]
[1]s.thalhammer,e.linares,novel cluster for the detection of an analyte,2016,pct/ep20 15/068 193.
[0134]
[2]j.s.lee,s.lee,m.h.choi,h.soo,s.k.kim,j.y.kim,enhanced infrared ray absorbing/emitting nanoparticles and on-site diagnosis kit using same,2018,pct/kr2018/002616.
[0135]
[3]j.w.moon,t.j.phelps,c.l.fitzgerald,jr.,r.f.lind,j.g.elkins,g.g.jang,p.c.joshi,m.kidder,b.l.armstrong,t.r.watkins,i.n.ivanov,d.e.graham,appl microbiol biotechnol2016,100,7921.
[0136]
[4]s.wang,n.mamedova,n.a.kotov,w.chen,j.studer,nano letters2002,2,817.
[0137]
[5]w.j.parak,d.gerion,t.pellegrino,d.zanchet,c.micheel,s.c.williams,r.boudreau,m.a.l.gros,c.a.larabell,a.p.alivisatos,nanotechnology2003,14,r15.
[0138]
[6]g.m.whitesides,nature biotechnology2003,21,1161.
[0139]
[7]a.care,n.sayyadi,r.connally,a.try,p.l.bergquist,a.sunna,luminescent biomolecmlar complex and use thereof,2016,pct/au2016/000263.
[0140]
[8]j.luo,z.xie,j.w.y.lam,l.cheng,b.z.tang,h.chen,c.qiu,h.s.kwok,x.zhan,y.liu,d.zhu,chemical communications2001,1740.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。