1.本发明属于生物医药技术领域,具体涉及氧化巴马汀在制备治疗和/或预防溃疡性结肠炎药物中的应用。
背景技术:
2.溃疡性结肠炎(ulcerative colitis,uc)是一种慢性、非特异性肠道炎症性疾病,主要表现为腹痛、腹泻、黏液脓血便等症状。该病病程时间长、病变范围广且极易反复发作,因此被世界卫生组织列为现代难治病之一。近年来随着人们生活方式的改变,uc的发病率在我国甚至全球范围内呈上升趋势,常见于青壮年群体。但是,uc的病因和发病机制尚未完全明确。目前多认为其病因可能与免疫异常、遗传易感性和环境因素等有关。临床上用于治疗uc的药物主要有:对氨基水杨酸类,如柳氮磺胺吡啶、美沙拉嗪;肾上腺皮质激素类,如地塞米松、泼尼松;免疫抑制剂,如硫唑嘌呤、6-硫嘌呤和甲氨蝶呤;生物制剂,如英夫利昔单抗、阿达木单抗等;微生态制剂,如益生菌等。虽然这些药物能够在一定程度上缓解病情,但是往往存在给药周期长、依赖性强以及毒副作用大等缺点,在临床上的应用受到了一定的限制。因此,寻求疗效好、耐受性强且副作用小的新药对于溃疡性结肠炎的防治具有重要意义。
3.中医药治疗uc有很大的优势,如疗效确切、不良反应少、复发率低,近年来也取得较多成果,给患者带来新的曙光。黄柏(phellodendri chinensis cortex)是芸香科植物黄皮树phellodendron chinense schneid.的干燥树皮,具有清热燥湿、泻火除蒸的功效,临床上常用于治疗湿热泻痢、热淋涩痛、疮疡肿毒、热淋涩痛等症。研究发现,黄柏生物碱类成分巴马汀(palmatine,pal),又叫黄藤素,具有显著的抗氧化、抗腹泻、抗溃疡性结肠炎等生理活性。鉴于黄柏及其活性成分巴马汀对uc的显著疗效,值得关注的是,同样作为黄柏生物碱类成分的氧化巴马汀(8-oxypalmatine,opal),是巴马汀的氧化产物,其对uc的相关药效和作用机理分析尚未报导。因此,对于opal的功效价值研究需要进一步探索。
技术实现要素:
4.本发明的首要目的在于克服现有技术的缺点与不足,提供氧化巴马汀在制备治疗和/或预防溃疡性结肠炎药物中的应用。
5.本发明的另一目的是提供氧化巴马汀在制备用于治疗和/或预防溃疡性结肠炎的药物组合物中的应用。
6.本发明的再一目的在于提供一种用于治疗和/或预防溃疡性结肠炎的药物组合物及其应用。
7.本发明上述目的通过以下技术方案实现:
8.氧化巴马汀在制备治疗和/或预防溃疡性结肠炎药物中的应用。
9.所述的治疗和/或预防溃疡性结肠炎药物为能够改善溃疡性结肠炎个体的疾病活
动指数,恢复结肠长度、减轻组织病理结构损伤、改善结肠组织炎症因子含量、改善结肠组织中氧化应激相关酶的含量、调控nlrp3炎症小体和nrf2信号通路相关蛋白和mrna表达水平的药物。
10.所述的疾病活动指数包括体重下降、便血、腹泻情况。
11.所述的减轻组织病理结构损伤包括恢复隐窝结构、减少结肠黏膜上皮坏死、减少炎性细胞浸润和降低mpo活性。
12.所述的改善结肠组织中炎症因子含量包括降低结肠组织中炎症因子tnf-α、il-1β、il-6、il-17a、ifn-γ的分泌,提高结肠组织中炎症因子il-10的分泌。
13.所述的改善结肠组织中氧化应激相关酶的含量包括提高结肠组织中抗氧化酶t-aoc、sod、gsh、cat、gsh-px含量,降低mda含量。
14.所述的调控nlrp3炎症小体包括降低nlrp3以及asc的蛋白和mrna的表达量。
15.所述的调控nrf2信号通路相关蛋白和mrna表达水平包括提高nrf2以及ho-1的蛋白和mrna的表达量。
16.所述的氧化巴马汀的结构如式(i)所示:
[0017][0018]
所述的溃疡性结肠炎包括但不限于由葡聚糖硫酸钠(dss)引起的溃疡性结肠炎。
[0019]
所述的氧化巴马汀的有效浓度优选为12.5~50mg/kg。
[0020]
氧化巴马汀在制备用于治疗和/或预防溃疡性结肠炎的药物组合物中的应用。
[0021]
一种用于治疗和/或预防溃疡性结肠炎的药物组合物,包括氧化巴马汀,和/或氧化巴马汀与药学上可接受的酸结合所形成的盐。
[0022]
所述的药物组合物,还包括药学上可接受的辅料。
[0023]
所述的药物组合物的剂型包括但不限于片剂、颗粒剂、胶囊剂、栓剂和口服液中的至少一种。
[0024]
与现有技术相比,本发明具有以下有益效果:
[0025]
(1)本发明提供了氧化巴马汀和包含氧化巴马汀的药物组合物在制备治疗和/或预防溃疡性结肠炎药物中的应用。本发明经研究发现,氧化巴马汀能安全有效地抗溃疡性结肠炎,包括改善溃疡性结肠炎个体的疾病活动指数,恢复结肠长度、减轻组织病理结构损伤、改善结肠组织炎症因子含量、改善结肠组织中氧化应激相关酶的含量、调控nlrp3炎症小体和nrf2信号通路相关蛋白和mrna表达水平。本发明的氧化巴马汀防治溃疡性结肠炎药效与传统一线治疗药物美沙拉嗪相当,优于巴马汀。对于溃疡性结肠炎的临床治疗具有很好的应用前景。而且,据小鼠急性毒性试验证实,与巴马汀相比,氧化巴马汀安全性更高。因
此,从安全角度氧化巴马汀的每日施用剂量不受严格的限制,使用时可根据临床实际情况进行调整,保证氧化巴马汀的疗效。本发明为临床上治疗和/或预防溃疡性结肠炎提供了一种新的药物选择。
附图说明
[0026]
图1为氧化巴马汀改善了dss诱导的小鼠结肠炎的症状(n=6-9)结果图;其中,a为第0天至第7天各组小鼠的每日体重变化结果图;b为第0天至第7天各组小鼠的dai评分结果图;c为第7天各组小鼠的结肠组织的宏观图;d为第7天各组小鼠的结肠长度结果图;其中,#代表与control组相比p《0.05,##代表与control组相比p《0.01;*代表与dss组相比p《0.05,**代表与dss组相比p《0.01;&代表与pal组相比p《0.05,&&代表与pal组相比p《0.01。
[0027]
图2为氧化巴马汀对dss诱导的结肠炎小鼠结肠组织损伤的影响结果图(n=7-9);其中,a为不同药物处理后小鼠结肠组织结构病理学变化结果图;b为不同药物处理后小鼠结肠组织结构病理学评分结果图;c为不同药物处理后小鼠的mpo活性测定结果图;其中,#代表与control组相比p《0.05,##代表与control组相比p《0.01;*代表与dss组相比p《0.05,**代表与dss组相比p《0.01;&代表与pal组相比p《0.05,&&代表与pal组相比p《0.01。
[0028]
图3为氧化巴马汀对dss诱导的结肠炎小鼠炎症因子含量的影响结果图(n=7);其中,a为不同药物对结肠组织炎症因子tnf-α水平的影响结果图;b为不同药物对结肠组织炎症因子il-1β水平的影响结果图;c为不同药物对结肠组织炎症因子ifn-γ水平的影响结果图;d为不同药物对结肠组织炎症因子il-17a水平的影响结果图;e为不同药物对结肠组织炎症因子il-6水平的影响结果图;f为不同药物对结肠组织炎症因子il-10水平的影响结果图;其中,#代表与control组相比p《0.05,##代表与control组相比p《0.01;*代表与dss组相比p《0.05,**代表与dss组相比p《0.01;&代表与pal组相比p《0.05,&&代表与pal组相比p《0.01。
[0029]
图4为氧化巴马汀对dss诱导的结肠炎小鼠氧化应激的影响(n=7)结果图;其中,a为不同药物对结肠组织黏膜细胞ros表达量的影响结果图;b为不同药物对结肠组织中抗氧化酶t-aoc的影响结果图;c为不同药物对结肠组织中抗氧化酶sod的影响结果图;d为不同药物对结肠组织中抗氧化酶gsh的影响结果图;e为不同药物对结肠组织中抗氧化酶cat的影响结果图;f为不同药物对结肠组织中mda的影响结果图;g为不同药物对结肠组织中抗氧化酶gsh-px的影响结果图;其中,#代表与control组相比p《0.05,##代表与control组相比p《0.01;*代表与dss组相比p《0.05,**代表与dss组相比p《0.01;&代表与pal组相比p《0.05,&&代表与pal组相比p《0.01。
[0030]
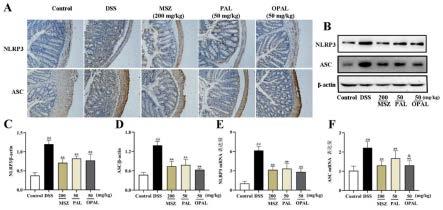
图5为氧化巴马汀通过调控nlrp3炎症小体相关蛋白和mrna表达水平改善结肠组织炎性反应(n=3-6)结果图;其中,a为不同药物对结肠组织nlrp3炎症小体相关蛋白nlrp3以及asc的蛋白的免疫组化图(放大200倍);b为不同药物对结肠组织nlrp3炎症小体相关蛋白nlrp3以及asc表达的蛋白质印迹图;c为不同药物对结肠组织中nlrp3的蛋白表达水平的影响结果图;d为不同药物对结肠组织中asc的蛋白表达水平的影响结果图;e为不同药物对结肠组织中nlrp3的mrna表达水平的影响结果图;f为不同药物对结肠组织中asc的mrna表达水平的影响结果图;其中,#代表与control组相比p《0.05,##代表与control组相比p《0.01;*代表与dss组相比p《0.05,**代表与dss组相比p《0.01;&代表与pal组相比p《0.05,&&
代表与pal组相比p《0.01。
[0031]
图6为氧化巴马汀通过调控nrf2信号通路相关蛋白和mrna表达水平改善结肠组织氧化应激反应(n=3-6)结果图;其中,a为不同药物对结肠组织nrf2信号通路相关蛋白nrf2以及ho-1的蛋白的免疫组化图(放大200倍);b为不同药物对结肠组织nrf2信号通路相关蛋白nrf2以及ho-1表达的蛋白质印迹图;c为不同药物对结肠组织nrf2的蛋白表达水平的影响结果图;d为不同药物对结肠组织中ho-1的蛋白表达水平的影响结果图;e为不同药物对结肠组织中nrf2的mrna表达水平的影响结果图;f为不同药物对结肠组织中ho-1的mrna表达水平的影响结果图;其中,#代表与control组相比p《0.05,##代表与control组相比p《0.01;*代表与dss组相比p《0.05,**代表与dss组相比p《0.01;&代表与pal组相比p《0.05,&&代表与pal组相比p《0.01。
具体实施方式
[0032]
以下结合具体实施例及附图对本发明作进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0033]
除非特别说明,以下实施例所用试剂和材料均为市购。
[0034]
实施例1:氧化巴马汀对溃疡性结肠炎的作用
[0035]
1实验材料
[0036]
1.1实验药物
[0037]
巴马汀(pal,纯度≥95%)购于陕西群创生物科技有限公司;氧化巴马汀(8-oxypalmatine,opal,纯度≥98%,cas号:19716-59-7);美沙拉嗪(msz)购于aspen pharmacare australia pty ltd.(leonards,new south wales,australia)。
[0038]
氧化巴马汀的结构如式(i)所示:
[0039][0040]
1.2实验试剂
[0041]
葡聚糖硫酸钠(dss,mw:36000-50000)购于美国mp biomedicals公司;髓过氧化物酶(mpo)试剂盒、总抗氧化能力(t-aoc)试剂盒、丙二醛(mda)试剂盒、超氧化物歧化酶(sod)试剂盒、过氧化氢酶(cat)试剂盒、谷胱甘肽(gsh)试剂盒以及谷胱甘肽过氧化物酶(gsh-px)试剂盒均购于南京建成生物程研究所;bca蛋白定量试剂盒,购于上海贝博生物科技有限公司;4%多聚甲醛溶液、pbs缓冲液、ros染液、dapi染液、自发荧光淬灭剂、抗荧光淬灭封片剂、3,3'-二氨基联苯胺(dab)试剂盒、苏木精、伊红、ripa裂解液、cocktail、pmsf、磷酸酶
抑制剂a、磷酸酶抑制剂b均购于武汉赛维尔生物科技有限公司;小鼠elisa试剂盒:肿瘤坏死因子α(tnf-α)试剂盒、白介素1β(il-1β)试剂盒、白介素6(il-6)试剂盒、白介素17a(il-17a)试剂盒、γ-干扰素(ifn-γ)试剂盒和白介素10(il-10)试剂盒均购于杭州联科生物技术股份有限公司;nlrp3抗体、asc抗体、nrf2抗体、ho-1抗体、β-actin抗体和辣根过氧化物酶偶联的二抗均购自affinity biosciences公司。
[0042]
1.3实验动物
[0043]6–
8周spf级雄性balb/c小鼠(20~23g)购于广州省医学实验动物中心(合格证编号:syxk 2018
–
0085)。实验期间,动物在温度:23
±
2℃,相对湿度:50
±
10%,每天12小时光照和12小时黑夜的环境中适应性饲养7天。期间,小鼠喂以标准小鼠饲料并可自由饮水。
[0044]
1.4实验仪器
[0045]
shimadzu分析天平,广州湘仪机电设备有限公司;eos m3微单相机,日本canon公司;kz-ii高速组织研磨仪,武汉赛维尔生物科技有限公司;tgl-16台式微量高速冷冻离心机,湖南湘立科学有限公司。multiskan go1510全波长酶标仪,美国thermo fisher scientific公司;eps300垂直电泳仪、4200sf凝胶化学成像系统,上海tanon公司。
[0046]
2 实验方法
[0047]
2.1 动物分组及剂量设计
[0048]
实验开始前,记录balb/c小鼠称重,并按体重随机分组为7组:正常(control)组,模型(dss)组,美沙拉嗪(msz,200mg/kg),巴马汀(pal,50mg/kg),氧化巴马汀低剂量(opla-l,12.5mg/kg),氧化巴马汀中剂量(opal-m,25mg/kg),氧化巴马汀高剂量(opal-h,50mg/kg),每组9只小鼠,每只小鼠标记好号(1~9号)。
[0049]
2.2溃疡性结肠炎模型的建立
[0050]
balb/c小鼠自由饮用3%dss水溶液7天,诱导溃疡性结肠炎(uc)模型。模型建立的同时,各组小鼠(正常(control)组,模型(dss)组,美沙拉嗪(msz,200mg/kg),巴马汀(pal,50mg/kg),氧化巴马汀低剂量(opla-l,12.5mg/kg),氧化巴马汀中剂量(opal-m,25mg/kg),氧化巴马汀高剂量(opal-h,50mg/kg))给予相应的药物进行治疗,其中正常组、模型组则给予治疗药物的相应溶剂(2%tween-80水溶液)。持续给药7天,第8天,所有小鼠眼眶取血后,颈椎脱臼致死。
[0051]
2.3疾病活动指数(disease activity index,dai)评分
[0052]
实验过程中,每天记录各组小鼠体重,活动状况、粪便性状和便血情况。
[0053]
每只小鼠大便性状、血便评分由一个不清楚实验方案的人员按照以下标准进行:体重下降评分:未变化,记为0分;下降1%-5%,记为1分;下降5%-10%,记为2分;下降10%-20%,记为3分;下降大于20%,记为4分。
[0054]
大便性状评分:正常,0分;粪便较软,1分;粪便湿软,2分;半稀便,3分;稀便,4分。便潜血评分:无血便,0分;便血检测阳性,2分;明显血便,4分。dai=(体重下降分数 大便性状分数 血便分数)/3。
[0055]
2.4结肠长度的测量及样品收取
[0056]
结肠长度的测量:小鼠颈椎脱臼处死后,用乙醇润湿腹部毛发,解剖,获取结肠,随后,于洁净白纸上量取自肛门端至结肠-盲肠交汇处长度,记录数据并拍照获取图片。
[0057]
h&e染色及免疫组化样本收集:用4℃预冷生理盐水清洗结肠内残留物,并用滤纸
吸干结肠表面水分,于离直肠约2cm处,取1cm左右的结肠组织置于4%多聚甲醛中用于后续h&e染色实验,再取0.5cm左右的结肠组织置于2ml ep管内用于后续免疫组化实验。
[0058]
mpo测定样本收集:称重40mg左右的结肠组织置于2ml ep管内,-80℃保存,用于后续mpo的测定。
[0059]
elisa测定样本收集:称重50mg左右的结肠置组织于2ml ep管内,-80℃保存,用于后续elisa测定。
[0060]
氧化应激测定样本收集:称量50mg左右的结肠组织置于2ml ep管内,-80℃保存,用于后续氧化应激指标的测定。
[0061]
western-blot及qrt-pcr测定样本收集:称量100mg左右结肠组织置于2ml ep管内,-80℃保存,用于后续western-blot及qrt-pcr测定。
[0062]
2.5结肠组织病理学观察及评分
[0063]
取出固定于4%多聚甲醛溶液小鼠结肠组织样品,进行脱水,石蜡包埋,切片(厚度为5μm),使用苏木精和伊红进行染色,最后于显微镜下观察结肠组织常规病理变化,并按照以下标准进行组织病理状态评分:
[0064]
(1)炎症程度:无炎症,记为0分;浅显炎症,记为1分;轻微溃疡,记为2分;明显溃疡,记为3分。
[0065]
(2)隐窝损伤程度:形态正常,记为0分;少量隐窝变形,记为1分;中等水平隐窝变形,记为2分;高水平隐窝变形,记为3分;明显的隐窝缺失,记为4分。
[0066]
(3)炎症浸润面积:无炎症细胞浸润,记为0分;10%视野呈低水平炎症细胞浸润,记为1分;10%-25%视野呈中等水平炎症细胞浸润,记为2分;25%-50%视野呈高水平炎症细胞浸润,记为3分;明显炎症细胞浸润,记为4分。
[0067]
(4)肠壁炎症深度:无炎症,记为0分;炎症限于黏膜层,记为1分;炎症逐步深入黏膜下层,记为2分;炎症深入固有层,记为3分。
[0068]
总分为0(正常)-14分(严重肠炎)不等。
[0069]
2.6mpo活性的测定
[0070]
取出储存在-80℃中的结肠组织,按重量体积(g:ml)比为1:19加入mpo试剂盒中的试剂2,制备成5%(m/v)的组织匀浆液,继而按照试剂盒说明书操作测定mpo活性。
[0071]
2.7炎症因子含量检测
[0072]
取出储存在-80℃中的结肠组织,按照1:9(w:v)比例加入预冷的生理盐水,加入研磨珠,匀浆,12000g,4℃离心10min后,取上清液,分别按照elisa试剂盒说明书操作,测定炎症因子tnf-α、ifn-γ、il-1β、il-6、il-17a和il-10的含量。
[0073]
2.8结肠黏膜细胞ros表达量检测
[0074]
2.8.1画圈,淬灭组织自发荧光:冰冻切片在室温下复温,控干水分。用组化笔在组织周围画圈(防止抗体流走),在圈内加入自发荧光淬灭剂5min,流水冲洗10min。
[0075]
2.8.2染色:在圈内滴加ros染液,避光恒温箱37℃孵育30min。
[0076]
2.8.3dapi复染细胞核:玻片置于pbs缓冲液(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加dapi染液,避光室温孵育10min。
[0077]
2.8.4封片:玻片置于pbs缓冲液(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后用抗荧光淬灭封片剂封片。
[0078]
2.8.5镜检拍照:切片于荧光显微镜下观察并采集图像。(dapi紫外激发波长330-380nm,发射波长420nm,发蓝光)
[0079]
2.9氧化应激水平检测
[0080]
取出储存在-80℃中的结肠组织,按1:9(w:v)比例加入预冷的生理盐水,加入研磨珠,匀浆,3000g,4℃离心10min后,取上清液,先按照bca蛋白定量试剂盒说明书测定蛋白浓度然后分别按照试剂盒说明书操作,测定t-aoc、sod、gsh、cat、mda和gsh-px含量。
[0081]
2.10免疫组化检测
[0082]
样品切片(4μm)脱蜡,用浓度不同的乙醇复水,再用pbs缓冲液洗涤。然后将其分别与兔抗nlrp3(1:200),兔抗asc(1:200),兔抗nrf2(1:200)和兔抗ho-1(1:150),置于4℃过夜。然后用二抗在室温下孵育2h,然后用3,3'-二氨基联苯胺(dab)试剂盒和苏木精染色1-5min。
[0083]
2.11western-blot检测nlrp3、asc、nrf2和ho-1蛋白表达量。
[0084]
2.11.1组织总蛋白的提取
[0085]
取出储存在-80℃中的结肠组织,按100mg:1ml比例加入裂解液(ripa裂解液:cocktail:pmsf:磷酸酶抑制剂a:磷酸酶抑制剂b=100:2:1:1:1),冰上匀浆,冰上孵育20min(期间偶尔涡旋),14000g,4℃离心10min后,取上清即为蛋白上清液。取蛋白上清液于1.5ml ep管中,并用bca蛋白定量试剂盒,测定相应蛋白浓度。
[0086]
2.11.2western blot分析
[0087]
提取的蛋白上清液以1:4加入5
×
loading buffer后,100℃变性10min,分装保存于-80℃。配制10%的sds-page凝胶,通过电泳分离蛋白样品,并将其湿转到pvdf膜上;再将膜用5%脱脂奶粉封闭1h后,分别与以下抗体在4℃下孵育过夜:nlrp3(1:1000)、asc(1:1000)、nrf2(1:1000)、ho-1(1:1000)和β-actin(1:1000);用tbst缓冲液(用500ml蒸馏水溶解80g nacl和24.2g三羟甲基氨基甲烷,用蒸馏水定容到1l制成tbs(10x),4℃保存;用1350ml蒸馏水溶解150ml tbs(10x)和1.5ml吐温20制成tbs(1x),即tbst)洗膜3次,每次10min,然后与辣根过氧化物酶偶联的二抗(1:5000)室温孵育1小时。将pvdf膜浸于tbst缓冲液中,洗膜3次,每次10min。使用ecl化学发光液显影检测印迹,使用image j软件分析结果。
[0088]
2.12qrt-pcr检测nlrp3、asc、nrf2和ho-1的mrna表达量
[0089]
用trizol试剂(购于invitrogen公司)从结肠组织中提取总rna,用primerscript
rt
试剂盒(购于日本takara公司)将1μg总rna反转录成cdna。实时定量聚合酶链反应(qrt-pcr)的基因引物采用ncbi/primer blast工具软件设计,由生工生物工程(上海)股份有限公司合成(引物序列见表1)。使用cfx manager分析靶基因(nlrp3、asc、nrf2和ho-1基因)的mrna表达水平,以gapdh基因的表达做对照,并使用2-δδct
方法表示为相对于对照组表达的倍数变化。
[0090]
表1:
[0091][0092][0093]
2.13统计方法
[0094]
各数据以均数
±
标准差(mean
±
sd)表示,应用graphpad prism 8软件制图,spss 20.0软件进行统计学分析。各组间差异比较,采用单因素方差分析(one-way anova),方差齐时,组间两两多重比较采用lsd法;方差不齐时,组间两两多重比较采用dunnett’s t3法。p《0.05表示差异有统计学意义。
[0095]
3实验结果
[0096]
3.1氧化巴马汀对uc模型小鼠的一般症状的影响
[0097]
本研究发现,整个试验周期内,control组小鼠摄食饮水正常,毛发干净有光泽,动作灵敏、活跃,体重保持稳定趋势。而给予dss造模后,模型组小鼠毛发稀疏、竖起、无光泽,小鼠常静卧蜷缩,前4天体重稳定,基本保持不变,而第5天后,dss组小鼠体重有所下降,第6天后体重下降明显且呈持续下降状态。氧化巴马汀(opal,12.5mg/kg、25mg/kg和50mg/kg)、巴马汀(pal,50mg/kg)和阳性药美沙拉嗪(msz,200mg/kg)各给药处理组可明显改善小鼠体重下降情况。氧化巴马汀高剂量组与美沙拉嗪相当,小鼠体重接近正常组,但高于巴马汀组,差异没有统计学意义(p》0.05,图1a)。
[0098]
与此同时,研究发现,正常小鼠粪便形状正常,无血便情况;模型组小鼠第4天后便血、稀便情况严重。然而,氧化巴马汀(opal,12.5mg/kg、25mg/kg和50mg/kg)、巴马汀(pal,50mg/kg)和阳性药美沙拉嗪(msz,200mg/kg)各给药处理组明显缓解血便、稀便的症状,且氧化巴马汀呈现出剂量依赖关系。
[0099]
上述观察到的现象,结合小鼠体重变化及排便症状进行疾病活动指数(dai)评分,结果如图1b所示,模型组小鼠dai评分从第3天开始上升且呈持续上升状态,第5天显著上升,评分较正常组显著升高,差异具有统计学意义(p《0.01)。与模型组相比,氧化巴马汀各剂量处理组均显著降低dai评分,差异具有统计学意义(p《0.01),并呈现出剂量依赖关系,且氧化巴马汀中剂量组与巴马汀相当,高剂量组与美沙拉嗪相当,且优于巴马汀。
[0100]
综上可知,氧化巴马汀可明显改善dss诱导的uc模型小鼠的宏观表现,具有抗uc的作用。
[0101]
3.2氧化巴马汀对uc小鼠结肠长度的影响
[0102]
如图1c和1d所示,与control组比较,dss组小鼠结肠长度显著缩短(p《0.01);而给予美沙拉嗪、巴马汀和氧化巴马汀药物治疗后情况有所改善。由此可知,氧化巴马汀可改善uc小鼠结肠缩短情况。
[0103]
3.3氧化巴马汀对uc小鼠结肠组织损伤的影响
[0104]
如图2所示,control组结肠组织结构完整无损,黏膜层中杯状细胞排列整齐,固有层中隐窝及肠腺排列整齐,结构正常,黏膜下层无明显水肿,现少许炎性细胞浸润,组织病理学评分及mpo活性较低。与control相比,dss诱导的结肠炎黏膜结构破坏严重,其特征包括上皮损伤严重、杯状细胞减少、隐窝或肠腺基本消失、黏膜下层或肌层水肿严重、黏膜下层炎症细胞浸润明显,导致较高的组织病理学评分和mpo活性(p《0.01)。然而,与dss相比,不同剂量的氧化巴马汀(opal,12.5mg/kg、25mg/kg和50mg/kg)能够恢复隐窝结构并减少结肠黏膜上皮坏死,改善黏膜下层水肿程度,减少炎性细胞浸润并降低mpo活性(p《0.01),且氧化巴马汀呈现出明显的剂量依赖关系。
[0105]
3.4氧化巴马汀对uc小鼠结肠组织炎症因子含量的影响
[0106]
如图3所示,与control组比较,dss诱导的结肠炎模型组小鼠结肠组织中炎症因子(tnf-α、il-1β、il-6、il-17a、ifn-γ)含量均显著升高,il-10显著下降(p《0.01)。然而,与dss相比,氧化巴马汀剂量依赖性的调节上述6种炎症因子含量(p《0.05),表明氧化巴马汀可通过调节炎症因子含量来改善uc症状。
[0107]
3.5氧化巴马汀对uc小鼠结肠组织氧化应激的影响
[0108]
如图4所示,与control组比较,dss诱导的结肠炎模型组小鼠结肠黏膜细胞中ros表达量显著增多;结肠组织中抗氧化酶(t-aoc、sod、gsh、cat、gsh-px)含量均显著降低,而mda含量则显著升高(p《0.01)。然而,与模型组相比,氧化巴马汀以剂量依赖方式显著改善上述6种氧化应激相关酶的含量(p《0.05),表明氧化巴马汀可通过调节uc小鼠氧化应激水平来改善uc症状。
[0109]
3.6氧化巴马汀对uc小鼠结肠组织nlrp3炎症小体相关蛋白和mrna表达的影响
[0110]
如图5所示,与control组比较,dss诱导的结肠炎模型组小鼠结肠组织中nlrp3以及asc的蛋白和mrna的表达量显著增加(p《0.01)。然而,与模型组相比,氧化巴马汀能显著改善上述蛋白和mrna的表达量,表明氧化巴马汀可通过有效抑制nlrp3炎症小体的激活来改善uc症状。
[0111]
3.7氧化巴马汀对uc小鼠结肠组织nrf2信号通路相关蛋白和mrna表达的影响
[0112]
如图6所示,与control组比较,dss诱导的结肠炎模型组小鼠结肠组织中nrf2以及ho-1的蛋白和mrna的表达量显著降低(p《0.01)。然而,与模型组相比,氧化巴马汀能显著改善上述蛋白和mrna的表达量,表明氧化巴马汀可通过有效调控nrf2信号通路来改善uc症状。
[0113]
实施例2:治疗溃疡性结肠炎的氧化巴马汀药剂(片剂)
[0114]
取氧化巴马汀500g,加入乳糖480g、淀粉754g混合均匀,用7%的淀粉浆350g作为粘合剂,湿法制粒,烘干,加入硬脂酸镁16g混匀,压制成每片含氧化小檗碱50mg的片剂10000片,每片净重0.21g。
[0115]
口服,用于治疗溃疡性结肠炎。
[0116]
症见:腹痛、腹泻、便血、体重减轻等。
[0117]
实施例3:治疗溃疡性结肠炎的氧化巴马汀药剂(胶囊剂)
[0118]
取氧化巴马汀500g,加入乳糖980g、淀粉1254g混合均匀,用7%的淀粉浆350g作为粘合剂,湿法制粒,烘干,加入硬脂酸镁16g混匀,填充至1号胶囊制成10000粒,每粒胶囊内含氧化巴马汀50mg,每粒净重0.31g。
[0119]
口服,用于治疗溃疡性结肠炎。
[0120]
症见:腹痛、腹泻、便血、体重减轻等。
[0121]
实施例4:治疗溃疡性结肠炎的氧化巴马汀药剂(颗粒剂)
[0122]
取氧化巴马汀100g加入到适量β-环糊精中制成包合物,加入适量蔗糖粉、微晶纤维素、淀粉浆,混合均匀,逐渐加入乙醇和水,制成颗粒,进行分装。
[0123]
症见:腹痛、腹泻、便血、体重减轻等。
[0124]
实施例5:治疗溃疡性结肠炎的氧化巴马汀药剂(栓剂)
[0125]
取氧化巴马汀100g,加入可可豆脂等辅料,配置成含氧化巴马汀50mg的栓剂。
[0126]
直肠给药,用于治疗溃疡性结肠炎。
[0127]
症见:腹痛、腹泻、便血、体重减轻等。
[0128]
实施例6:治疗溃疡性结肠炎的氧化巴马汀药剂(口服液)
[0129]
称取100g氧化巴马汀,加入增溶剂泊洛沙姆,和一定比例的乙醇,充分搅匀;然后加入蔗糖、山梨酸钾等适宜附加剂(如矫味剂、抑菌剂、抗氧化剂、着色剂),溶解均匀,滤过澄清,将内容物装入口服液玻璃瓶中,灭菌。规格为每瓶含氧化巴马汀50mg的口服液,每瓶净含量10ml。
[0130]
口服,用于治疗溃疡性结肠炎。
[0131]
症见:腹痛、腹泻、便血、体重减轻等。
[0132]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。