预测bcl2家族蛋白靶向药物的反应性的方法
技术领域
1.本发明提供了一种预测bcl2家族蛋白靶向药物的反应性的方法,以及一种选择适合用bcl2家族蛋白靶向药物治疗的受试者的方法。
背景技术:
2.bcl2(b细胞淋巴瘤2)家族蛋白通过凋亡诱导(促凋亡活性)或抑制(抗凋亡活性)来调节凋亡。
3.bcl2家族蛋白可导致多种癌症,包括黑色素瘤、乳腺癌、前列腺癌、慢性淋巴细胞白血病和肺癌,被称为诱导对癌症治疗抵抗的因素。也有人认为bcl2家族蛋白可能导致精神分裂症和自身免疫性疾病。由于这些原因,bcl2家族蛋白可能是抗癌药物的有希望的靶点,并且已经开发了各种靶向bcl2家族蛋白的抑制剂。
4.为了有效地利用bcl2家族蛋白靶向药物作为癌症治疗药物,需要开发一种定量分析由bcl2家族蛋白诱导的细胞凋亡调节信号的手段。
技术实现要素:
5.技术问题
6.本发明提供了一种个性化治疗技术,其中定量分析介导信号转导的蛋白质相互作用,由此可使用bcl2家族蛋白靶向药物治疗患者癌症(例如,血癌)。
7.一方面提供了一种用于预测受试者对bcl2家族蛋白靶向药物的反应性或用于预测bcl2家族蛋白靶向药物在受试者中的药用功效的方法或用于提供用于预测的信息的方法。
8.另一方面提供了一种选择(识别)对bcl2家族蛋白靶向药物具有反应性的受试者的方法,其中bcl2家族蛋白靶向药物显示出药用功效,或者bcl2家族蛋白靶向药物适当适用于该受试者,或者提供用于选择(识别)的信息的方法。
9.该方法还可包括向对药物具有反应性或显示出药用功效的受试者或适合使用该药物治疗的受试者给药该药物的步骤。
10.另一方面提供了一种组合物,其包含bcl2家族蛋白靶向药物,用于对bcl2家族蛋白靶向药物具有反应性的受试者的癌症治疗,其中bcl2家族蛋白靶向药物显示出药用功效;或对bcl2家族蛋白靶向药物或用其治疗适用的受试者的癌症治疗。
11.另一方面提供了一种用于治疗癌症的方法,该方法包括向受试者给药经所述方法确认的药学上有效量的bcl2家族蛋白靶向药物的步骤,该受试者对bcl2家族蛋白靶向药物具有反应性,其中bcl2家族蛋白靶向药物显示出药用功效;或对bcl2家族蛋白靶向药物或其治疗是适用的。
12.提供了一种用于治疗癌症的方法,该方法包括给药药学上有效量的bcl2家族蛋白靶向药物的步骤。
13.bcl2家族蛋白靶向药物可靶向bcl2家族蛋白(例如,bcl2蛋白抑制剂或mcl1蛋白
抑制剂)。
14.技术方案
15.用于预测受试者对bcl2家族蛋白靶向药物的反应性或用于预测bcl2家族蛋白靶向药物在受试者中的药用功效的方法,或用于提供用于预测的信息的方法;和/或用于选择(识别)对bcl2家族蛋白靶向药物具有反应性的受试者的方法,其中bcl2家族蛋白靶向药物表现出药用功效,或者bcl2家族蛋白靶向药物适用于该受试者;或用于提供选择(识别)的信息的方法,均在本文中提供,所述方法包括以下步骤:(a1)测量样本中凋亡抑制(抗凋亡)蛋白和凋亡诱导(促凋亡)蛋白之间的相互作用(例如,以下步骤(i)和/或(ii));和/或(a2)测量样本中凋亡诱导(促凋亡)蛋白和/或凋亡抑制(抗凋亡)蛋白的水平(例如,以下步骤(iii))。
16.在一种实施方式中,本文提供的方法可包括选自以下步骤中的至少一个(例如,一个、两个或三个):
17.(i)测量样本中的第一蛋白和与第一蛋白相互作用的蛋白之间的相互作用的步骤,其中与第一蛋白相互作用的蛋白是外部提供的(第一蛋白-蛋白相互作用测量步骤);
18.(ii)测量样本内源性第一蛋白和与第一蛋白相互作用的蛋白之间的相互作用的步骤,其中与第一蛋白相互作用的蛋白是样本内源性的(第二蛋白-蛋白相互作用测量步骤);和
19.(iii)测量样本中第一蛋白、与第一蛋白相互作用的蛋白或两者的水平的步骤。
20.在一种实施方式中,本文提供的方法可包括步骤(i)、步骤(ii)或步骤(iii)。在另一种实施方式中,本文提供的方法可包括步骤(i)和步骤(ii)的组合、步骤(i)和步骤(iii)的组合、步骤(ii)和步骤(iii)的组合,或步骤(i)、步骤(ii)和步骤(iii)的组合。
21.第一蛋白和与第一蛋白相互作用的蛋白(下文中,“与第一蛋白相互作用的蛋白”也称为“第一蛋白相互作用蛋白”)可选自抗凋亡亚型蛋白和细胞存活诱导(促存活)亚型蛋白。
22.在一种实施方式中,步骤(i)至(iii)中的第一蛋白可以是选自bcl2家族蛋白的“促存活或抗凋亡亚型蛋白”(以下称为“抗凋亡蛋白”)中的至少一种。例如,步骤(i)至(iii)中的第一蛋白可以是相同或不同的,每一个都可以独立地为选自由bcl2、bclxl、bclw、bfl1和mcl1组成的组中的至少一种(例如,一种、二种或三种)。与步骤(i)至(iii)中的第一蛋白相互作用的蛋白可以是选自bcl2家族蛋白中的促凋亡亚型蛋白(下文中,“促凋亡亚型蛋白”被称为“促凋亡蛋白”)中的至少一种。在一种实施方式中,步骤(i)至(iii)中的第一蛋白相互作用蛋白可以是相同或不同的,每一个都可以独立地为选自由促凋亡蛋白中的bh3亚型(仅bh3)蛋白(第二蛋白)和效应亚型蛋白(第三蛋白)组成的组中的至少一种。例如,第二蛋白可以是选自由bad、bim、puma、bmf、bid、tbid、bik、hrk和noxa组成的组中的至少一种(例如,一种、两种或三种),第三蛋白可以是选自由bax、bok和bak组成的组中的至少一种(例如,一种或两种)。在一种实施方式中,第一蛋白相互作用蛋白可以是选自由bad、bim、puma、bmf、bid、tbid、bik、hrk、noxa、bax、bok和bak组成的组中的至少一种(例如,一种、两种、三种、四种或五种)。当该方法包括步骤(i)至(iii)中的两个或更多个时,各步骤中的第一蛋白相互作用蛋白可以相同或不同。
23.在另一种实施方式中,步骤(i)至(iii)中的第一蛋白可以是选自bcl2家族蛋白中
的促凋亡蛋白中的至少一种。在一种实施方式中,步骤(i)至(iii)中的第一蛋白可以是相同或不同的,可以是选自由bcl2家族蛋白的促凋亡蛋白中的bh3亚型(仅bh3)蛋白和效应亚型蛋白组成的组中的至少一种。举例来说,bh3亚型(仅bh3)蛋白是选自由bad、bim、puma、bmf、tbid、bik、hrk和noxa组成的组中的至少一种(例如,一种、两种或三种),效应亚型蛋白可以是选自由bax、bok和bak组成的组中的至少一种(例如,一种或两种)。步骤(i)至(iii)中的第一蛋白相互作用蛋白可以是选自bcl2家族蛋白中的抗凋亡蛋白中的至少一种。例如,步骤(i)至(iii)中的第一蛋白相互作用蛋白可以是相同或不同的,每一个都可以独立地选自由bcl2、bclxl、bclw、bfl-1和mcl1组成的组中的至少一种(例如,一种、两种或三种)。
24.当该方法包括步骤(i)至(iii)中的两个或更多个时,各步骤中的第一蛋白和第一蛋白相互作用蛋白可以相同或不同。
25.如本文所用,术语“样本”(生物样本)旨在包含从受试者(例如,人类)分离的细胞或细胞裂解物。如本文所用,术语“受试者”是指需要治疗疾病(例如癌症)的动物,是指将要给药bcl2家族蛋白靶向药物的受试者、将要应用bcl2家族蛋白靶向药物治疗的受试者,或者需要确定bcl2家族蛋白靶向药物的给药和用bcl2家族蛋白靶向药物治疗的受试者的药用功效(药物反应)。在一种实施方式中,受试者可以是癌症患者(例如,人类),并且细胞可以是从受试者分离的癌细胞。例如,受试者可以是患有血癌的人类患者,样本可以是选自由从血癌患者分离的白细胞(例如,粒细胞、淋巴细胞和/或单核细胞(例如,外周血单核细胞(pbmc)等)、骨髓细胞(例如,造血干细胞等)、血液、骨髓和血块黄层(每一层都含有细胞和细胞的裂解物)组成的组中的至少一种。从本文提供的方法中选择或识别的受试者获得的样本可表示为“测试样本”,以区别于用于比较的对照样本(例如,用于选择标准值进行比较的阳性对照样本或阴性对照样本,如下文所述)。
26.如本文所用,术语“外部提供的蛋白”(例如,第一蛋白相互作用蛋白)指的是不是样本内源性,而是从外部(外源性)添加到样本中的蛋白。在一种实施方式中,外部提供的蛋白可以用典型探针(例如荧光物质等)标记,但不限于此。
27.在一种实施方式中,步骤(i)可包括测量样本中的bcl2家族蛋白(第一蛋白)与外部提供的(外源性)bcl2家族蛋白(第一蛋白相互作用蛋白)之间的相互作用(第一蛋白-蛋白相互作用测量步骤),其中,使探针标记的外源性第一蛋白相互作用蛋白与固定在基底(样本中的蛋白)上的第一蛋白接触,然后测量第一蛋白(样本中的蛋白)和与其相互作用的蛋白(外源蛋白)之间的蛋白-蛋白相互作用(例如,测量第一蛋白和第一蛋白相互作用蛋白之间形成的复合物的水平)。
28.在一种实施方式中,步骤(ii)可包括测量样本内源性bcl2家族蛋白之间的相互作用(第二蛋白-蛋白相互作用测量步骤),其中,含有第一蛋白的样本与包括可结合至第一蛋白的物质(例如,与第一蛋白结合的抗体等)的基底接触,然后测量第一蛋白(样本内源性蛋白)和第一蛋白相互作用蛋白(样本内源性蛋白)之间的蛋白-蛋白相互作用(例如,测量第一蛋白和第一蛋白相互作用蛋白之间形成的复合物的水平)。
29.在一种实施方式中,在步骤(i)和/或(ii)中,第一蛋白和与其相互作用的蛋白之间形成的复合物的水平可以通过结合至第一蛋白相互作用蛋白(步骤(i))或结合至与第一蛋白相互作用蛋白结合的基底(步骤(ii))的探针产生的信号强度来测量,但不限于此。
30.在一种实施方式中,步骤(iii)可包括测量样本中第一蛋白和第一蛋白相互作用蛋白中的任一种或两种的总表达水平的步骤。样本中的水平可以是样本中的蛋白的表达水平(例如,蛋白浓度)、活化蛋白的表达水平(例如,活化蛋白浓度)、磷酸化蛋白的表达水平(例如,磷酸化蛋白浓度),或者它们的组合。
31.在一种实施方式中,步骤(i)(第一蛋白-蛋白相互作用测量步骤)可包括选自以下子步骤中的至少一个(例如,1、2、3、4、5、6、7、8、9、10、11或12):
32.(i-1)测量样本中bcl2蛋白和外部提供的bad蛋白之间的蛋白-蛋白相互作用;
33.(i-2)测量样本中bcl2蛋白和外部提供的bim蛋白之间的蛋白-蛋白相互作用;
34.(i-3)测量样本中bcl2蛋白和外部提供的bax蛋白之间的蛋白-蛋白相互作用;
35.(i-4)测量样本中bcl2蛋白和外部提供的bak蛋白之间的蛋白-蛋白相互作用;
36.(i-5)测量样本中bclxl蛋白和外部提供的bad蛋白之间的蛋白-蛋白相互作用;
37.(i-6)测量样本中bclxl蛋白和外部提供的bim蛋白之间的蛋白-蛋白相互作用;
38.(i-7)测量样本中bclxl蛋白和外部提供的bax蛋白之间的蛋白-蛋白相互作用;
39.(i-8)测量样本中bclxl蛋白和外部提供的bak蛋白之间的蛋白-蛋白相互作用;
40.(i-9)测量样本中mcl1蛋白和外部提供的noxa蛋白之间的蛋白-蛋白相互作用;
41.(i-10)测量样本中mcl1蛋白和外部提供的bim蛋白之间的蛋白-蛋白相互作用;
42.(i-11)测量样本中mcl1蛋白和外部提供的bax蛋白之间的蛋白-蛋白相互作用;和
43.(i-12)测量样本中mcl1蛋白和外部提供的bak蛋白之间的蛋白-蛋白相互作用。
44.在一种实施方式中,步骤(i)(第一蛋白-蛋白相互作用测量步骤)中测量蛋白-蛋白相互作用的每个子步骤可由以下步骤执行或包括以下步骤:
45.(1)向基底提供样本,该基底包括与第一蛋白结合的物质,以将第一蛋白固定至基底;
46.(2-1)向基底外部提供探针标记的与第一蛋白相互作用的蛋白,以允许与基底上的第一蛋白反应;和
47.(3)使用全内反射荧光(tirf)显微镜在基底表面的近场区域内测量由探针产生的信号。
48.在第一蛋白-蛋白相互作用测量步骤中,外部提供的蛋白(第一蛋白相互作用蛋白)可以是用探针标记(结合)的蛋白。在第一蛋白-蛋白相互作用测量步骤中,蛋白-蛋白相互作用的测量可通过测量在第一蛋白(样本内源性蛋白)和与其相互作用的蛋白(外源性蛋白)之间形成的复合物的水平来进行。在一种实施方式中,可基于连接到第一蛋白相互作用蛋白的探针产生的信号来测量复合物的水平。
49.在一种实施方式中,步骤(ii)(第二蛋白-蛋白相互作用测量步骤)可包括选自以下子步骤中的至少一个(例如,1、2、3、4、5、6、7、8、9、10或11):
50.(ii-1)测量样本中bcl2蛋白和样本中bim蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);
51.(ii-2)测量样本中bcl2蛋白和样本中bax蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);
52.(ii-3)测量样本中bcl2蛋白和样本中bak蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);
53.(ii-4)测量样本中bclxl蛋白和样本中bad蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);
54.(ii-5)测量样本中bclxl蛋白和样本中bim蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);
55.(ii-6)测量样本中bclxl蛋白和样本中bax蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);
56.(ii-7)测量样本中bclxl蛋白和样本中bak蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);
57.(ii-8)测量样本中mcl1蛋白和样本中noxa蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);
58.(ii-9)测量样本中mcl1蛋白和样本中bim蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);
59.(ii-10)测量样本中mcl1蛋白和样本中bax蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平);和
60.(ii-11)测量样本中mcl1蛋白和样本中bak蛋白之间的蛋白-蛋白相互作用(例如,由此形成的复合物的水平)。
61.在一种实施方式中,步骤(ii)(第二蛋白-蛋白相互作用测量步骤)中测量蛋白-蛋白相互作用(例如,由此形成的复合物的水平)的每个子步骤可由以下步骤执行或包括以下步骤:
62.(1)向基底提供(添加)样本,该基底包括与第一蛋白结合的物质,以将第一蛋白固定至基底;
63.(2-2)向基底提供与第一蛋白相互作用蛋白结合的探针标记的物质,以允许与在第一蛋白(样本内源性)和第一蛋白相互作用蛋白(样本内源性)之间形成的复合物中的第一蛋白相互作用蛋白反应;
64.(3)使用全内反射荧光(tirf)显微镜在基底表面的近场区域内测量由探针产生的信号。
65.在另一种实施方式中,步骤(ii)(第二蛋白-蛋白相互作用测量步骤)中测量蛋白-蛋白相互作用(例如,由此形成的复合物的水平)的每个子步骤可由以下步骤执行或包括以下步骤:
66.(1)向基底提供(添加)样本,该基底包括与第一蛋白相互作用蛋白结合的物质,以将第一蛋白相互作用蛋白固定至基底;
67.(2-2)向基底提供与第一蛋白结合的探针标记的物质,以允许与在第一蛋白(样本内源性)和第一蛋白相互作用蛋白(样本内源性)之间形成的复合物中的第一蛋白反应;和
68.(3)使用全内反射荧光(tirf)显微镜在基底表面的近场区域内测量探针产生的信号。
69.在第二蛋白-蛋白相互作用测量步骤中,复合物在样本内源性的第一蛋白和样本内源性的第一蛋白相互作用蛋白之间内源性形成。在第二蛋白-蛋白相互作用测量步骤中,蛋白-蛋白相互作用的测量可通过测量在第一蛋白(样本内源性)和与其相互作用的蛋白(样本内源性)之间形成的复合物的水平来进行。在一种实施方式中,复合物的水平可以基
fisher scientific)、610538(bd)、sc-509、sc-23960、sc-7382(均来自santa cruz)、ta806591、cf806589、um800117、cf806639(均来自origene)等;
86.bcl-xl:2764s、2762s、2870、3498s(均来自cst)、ab77571、ab59348、ab32370、ab178844(均来自abcam)、ma5-11950、ma5-28637(均来自invitrogen)、ma5-15142(thermo fisher scientific)、bsm-51229m(bioss)、sc-56021、sc-136207、sc-271121、sc-70417、sc-23958(均来自santa cruz)、alx-804-660-c100(enzo)、66020-1-ig(proteintech)、nbp2-25240、nbp2-32810、nbp2-44416、nbp1-47665(均来自novus)、ta506188(origene)、h00000598-m01a(abnova)等;
87.mcl1:ab32087(abcam)、5453s、39224s、#94296(均来自cst)、ma5-32060、14-6701-82、14-9047-82、ma5-15236、14-6701-82、14-9047-82(均来自invitrogen)、sp2170p、ta500986、ta500990(均来自origene)、16225-1-ap(proteintech)、ls-c475-0.1(lsbio)、mab8825(abnova)、sc-12756、sc-74437、sc-74436、sc-377487、sc-69839、sc-69840、sc-53951(均来自santa cruz)等;
88.bclw:ma5-15076(invitrogen)、#2724(cst)、sc-293236、sc-130701(均来自santa cruz)、nbp2-61706(novus)等;
89.bfl1:nbp2-67563、nbp2-46568cst(均来自novus)、#14093(cst)、ma5-11757(invitrogen)、sc-166943(santa cruz)等;
90.促凋亡蛋白
91.bax:ab32503、ab182733、ab81083(均来自abcam)、#5023、2774s、2772s(均来自cst)、ma5-14003、ma5-16322、35-9700(均来自invitrogen)、bsm-52316r、bsm-33279m(均来自bioss)、50599-2-ig(proteintech)、sab4502546(merck)、nb100-56096(novus)、610982、610983(均来自bd)、sc-7480、sc-23959、sc-70408(均来自santa cruz)、cf810335、ta810334(均来自origene)、#633602(biolegend)、ls-c357719-20(lsbio)等;
92.bak:ab238515、ab32371、ab69404、ab137646(均来自abcam)、6947s、12105s(均来自cst)、b5897(merck)、06-536、am03-100ugcn、sab1305656(均来自sigma)、h00000578-m01a、mab8753(abnova)、sc-517390、sc-518110(均来自santa cruz)、ma5-36225(invitrogen)、gtx10808(genetex)等;
93.bad:9296s(cst)、sc-8044(santa cruz)、ma5-11117、ma5-15230(均来自invitrogen)等;
94.noxa:ab68523(abcam)、sc-515840、sc-56169、sc-398873(均来自santa cruz)等;和
95.bim:ma5-15763、ma5-15764(均来自invitrogen)、sc-374358(santa cruz)、cf812441(origene)等。
96.上述抗体仅用于说明,但不限于此。只要已知抗体具有与特定蛋白的结合活性,就可以使用任何抗体,并且预期其表现出基本相同的效果。
97.本文中使用的与第一蛋白相互作用蛋白或第一蛋白结合以检测内源性蛋白-蛋白相互作用测量步骤(步骤(ii))中的第一蛋白相互作用蛋白或第一蛋白的物质可以用探针标记。当结合物质为抗体时,抗体或抗体的二级抗体可与探针结合。
98.除了测量bcl2家族蛋白之间的相互作用的步骤(a1)和/或测量样本中bcl2家族蛋
白的水平的步骤(a)之外,本文提供的方法还可包括步骤(b):将步骤(a1)中bcl2家族蛋白之间相互作用的测量值和/或步骤(a2)中样本中bcl2家族蛋白水平的测量值与参考值(b1)进行比较;和/或识别(确定或决定)样本或分离自受试者的样本对bcl2家族蛋白靶向药物具有反应性的患者和/或bcl2家族蛋白靶向药物在样本或分离自受试者的样本中是否表现出药用功效;和/或选择(识别、确定和决定)作为适合使用bcl2家族蛋白靶向药物(b2)治疗目标的受试者。
99.在步骤(b)(更具体地说,步骤(b2))之后,本文提供的方法还可包括向步骤(b)(更具体地说,步骤(b2))中识别的受试者给药bcl2家族蛋白靶向药物的步骤,以对bcl2家族蛋白靶向药物产生反应,以允许药物在其中发挥药用功效,或用药物进行适当治疗。
100.如本文所用,术语“对bcl2家族蛋白靶向药物的反应性”或“药物的药用功效”指作为药物靶向(例如,抑制)靶蛋白(即bcl2蛋白)而获得的病理效应,旨在涵盖抗癌效果(减轻、减少、缓解、移除和治疗癌症(或癌细胞),和/或抑制或延迟癌症的进展和/或转移等),更详细地说,是对血癌的抗癌效果。
101.如本文所使用的术语“适于给药bcl2家族蛋白靶向药物或用药物治疗的受试者”是指bcl2家族蛋白靶向药物可对疾病表现出治疗效果的患者。例如,受试者可以是这样的患者,其中给药bcl2家族蛋白靶向药物或使用bcl2家族蛋白靶向药物的治疗性治疗可以显示抗癌效果(减轻、减少、缓解、移除和/或治疗癌症或癌细胞)。
102.步骤(b)(具体而言,步骤(b1))中的参考值可通过本文提供的方法,基于从预先存在的癌症患者(例如,血癌患者)获得的信息来建立。在一种实施方式中,参考值可以是1)通过将本文提供的方法(步骤(a1)和/或(a2))应用于使用bcl2家族蛋白靶向药物治疗可显示出治疗效果的患者或患者组(患者或患者组对bcl2家族蛋白靶向药物具有反应性),或应用于从患者或患者组中分离的样本(有效组中的样本)而获得的测量值,或2)通过将本文提供的方法(步骤(a1)和/或(a2))应用于使用bcl2家族蛋白靶向药物治疗不能显示出治疗效果的患者或患者组(患者或患者组对bcl2家族蛋白靶向药物无反应性),或应用于从患者或患者组中分离的样本(非有效组中的样本)而获得的测量值。
103.在从有效组中的样本获得参考值的实施方式中,如果在测试样本(a1)中测量bcl2家族蛋白之间的相互作用的步骤和/或在测试样本(a2)中测量bcl2家族蛋白的水平的步骤中获得的测量值高达或大于参考值(围绕参考值的值范围(例如,参考值本身或误差范围为10%或更小、5%或更小、4%或更小、3%或更小、2%或更小、或1%或更小)或超过参考值的值),样本或从受试者中获得的样本可被选择为对bcl2家族蛋白靶向药物具有反应性的患者(或适合使用bcl2家族蛋白靶向药物治疗的患者),或可被识别(确定或决定)为bcl2家族蛋白靶向药物可在其中显示出药用功效的患者(步骤(b2))。
104.在另一种实施方式中,在参考值是从非有效组中的样本中获得的情况下,如果在测试样本(a1)中测量bcl2家族蛋白之间的相互作用的步骤和/或在测试样本(a2)中测量bcl2家族蛋白的水平的步骤中获得的测量值在围绕参考值的范围内(例如,参考值本身或误差范围为10%或更小、5%或更小、4%或更小、3%或更小、2%或更小、或1%或更小)或小于参考值,样本或从受试者中获得的样本可被选为对bcl2家族蛋白靶向药物无反应性的患者(或使用(给药)bcl2家族蛋白靶向药物的治疗未显示出药用功效的患者),或可被识别(确定或决定)为bcl2家族蛋白靶向药物不能显示出药用功效的患者(步骤(b2))。
105.在另一种实施方式中,可将参考值确定为在测量有效组样本内bcl2家族蛋白之间相互作用的步骤(a1)和/或在测量有效组样本内bcl2家族蛋白水平的步骤(a2)中获得的测量值的最小值、中值或平均值。可通过添加患者信息或根据从各种分析值导出的方程式或算法来调整参考值。在本文提供的方法的步骤(b)中,当在步骤(a1)和/或步骤(a2)中获得的测量值高于(类似和/或超过)相应的参考值时,可选择测试样本或从受试者中获得的样本作为对bcl2家族蛋白靶向药物有治疗反应的患者,或适合用bcl2家族蛋白靶向药物治疗的患者。
106.在另一种实施方式中,可将参考值确定为在测量非有效组的样本中bcl2家族蛋白之间的相互作用的步骤(a1)和/或在测量非有效组的样本中bcl2家族蛋白的水平的步骤(a2)中获得的测量值的最大值、中值或平均值。可通过添加患者信息或根据从各种分析值导出的方程式或算法来调整参考值。在本文提供的方法的步骤(b)中,当在步骤(a1)和/或步骤(a2)中获得的测量值低于(类似于和/或低于)相应的参考值时,可选择测试样本或从受试者中获得的样本作为bcl2家族蛋白靶向药物不具有治疗效果的患者。
107.在另一种实施方式中,参考值可以是样本中的比较蛋白和与比较蛋白相互作用的蛋白之间的相互作用程度和/或样本中的比较蛋白和/或与比较蛋白相互作用的蛋白的水平(表达水平或浓度)。比较蛋白和与比较蛋白相互作用的蛋白可以选自抗凋亡蛋白和促凋亡蛋白。比较蛋白和与比较蛋白相互作用的蛋白可分别与上述第一蛋白和第一蛋白相互作用蛋白相同或不同。在一种实施方式中,比较蛋白可以不同于第一蛋白,而与比较蛋白相互作用的蛋白可以与第一蛋白相互作用蛋白相同或不同。
108.在这种情况下,本文提供的方法在步骤(b)之前还可以包括以下步骤(a1’)和/或(a2’):
109.(a1’)测量样本中比较蛋白和与比较蛋白相互作用的蛋白之间的相互作用和/或(a2’)测量样本中比较蛋白和/或与比较蛋白相互作用的蛋白的水平。
110.根据另一实施方式提供了一种治疗癌症(例如血癌)的方法,该方法包括向以下受试者给药bcl2家族蛋白靶向药物的步骤;以及一种药物组合物,其包含通过应用(给药)在以下受试者中用于癌症(例如血癌)治疗的bcl2家族蛋白靶向药物:
111.从受试者获得(分离)的样本中的bcl2家族蛋白之间的相互作用(例如,在步骤(a1)的(i)和/或(ii)中测量)的受试者,和/或受试者体内的bcl2家族蛋白水平(例如,在步骤(a2)中测量)类似于或超过参考值(例如,从有效组获得)的受试者(例如,经识别对bcl2家族蛋白靶向药物具有反应性或允许通过本文提供的方法测量药物的药用功效,用于预测对bcl2家族蛋白靶向药物的反应性和/或预测药物的药用功效的受试者;和/或经识别适合于给药bcl2家族蛋白靶向药物或适于如通过选择适于给药bcl2家族蛋白靶向药物或使用bcl2家族蛋白靶向药物治疗的受试者的方法测量的,使用bcl2家族蛋白靶向药物治疗的受试者)。
112.bcl2家族蛋白通常是指具有共同的bcl-2同源结构域(bh;bh1,bh2,bh3)的蛋白,其功能是调节细胞凋亡(例如线粒体凋亡)。
113.如本文所用,第一蛋白是一种bcl2家族蛋白,指预防凋亡的抗凋亡蛋白,与凋亡蛋白和/或促凋亡蛋白相互作用(结合)以干扰凋亡蛋白和/或促凋亡蛋白的功能。第一蛋白可以包含在从受试者分离的生物样本中,或者可以以与样本分离的形式存在。在一种实施方
式中,第一蛋白可以是源自人类等哺乳动物的蛋白。举例来说,第一蛋白可以是选自由bcl2(例如,ncbi参考序列nm_000633.2等)、bclxl(例如,ncbi参考序列nm_138578.1等)、mcl1(例如,ncbi参考序列nm_021960.3等)、bclw(例如,ncbi参考序列nm_001199839.2等)和bfl1(例如,ncbi参考序列nm_001114735.2等)组成的组中的至少一种。
114.第一蛋白相互作用蛋白可以是选自由bh3亚型(仅bh3)蛋白(第二蛋白);和促凋亡效应蛋白(第三蛋白)组成的组中的至少一种。
115.如本文所用,第二蛋白(bh3亚型蛋白)仅由bh3结构域组成,因此被称为仅bh3的蛋白。例如,第二蛋白可以是选自由以下组成的组中的至少一种:bim(例如,ncbi参考序列b033694)、bid(例如,ncbi参考序列nm_001196.2)、tbid(例如,ncbi参考序列nm_001196.2的n端截断形式等)、bad(例如,ncbi参考序列nm_004322.2等)、noxa(例如,ncbi参考序列nm_001382616.1等)、puma(例如,ncbi参考序列aao16862.1等),bmf(例如,ncbi参考序列nm_001003940.2等)、bik(例如,ncbi参考序列1.nm_001197.5)和hrk(例如,ncbi参考序列1.nm_003806.4等)。
116.如本文所用,第三蛋白是包括多个bh结构域的促凋亡蛋白,可以是选自由例如bax(例如,ncbi参考序列nm_138761.3等)、bak(例如,ncbi参考序列np_001179.1等)和bok(例如,ncbi参考序列nm_032515.5等)组成的组中的至少一种。
117.在另一实施方式中,第一蛋白可以是选自由如上所述的bh3亚型(bh3-only)蛋白(第二蛋白)和促凋亡效应蛋白(第三蛋白)组成的组中的至少一种,而第一蛋白相互作用蛋白可以是选自如上所述的抗凋亡蛋白中的至少一种。
118.在此,外部提供的第一蛋白相互作用蛋白可以是野生型蛋白,或者可以是与野生型蛋白具有50%或更高、60%或更高、70%或更高、80%或更高、90%或更高、91%或更高、92%或更高、93%或更高、94%或更高、95%或更高、96%或更高、97%或更高、98%或更高,或99%或更高的序列同一性或同源性的变体蛋白,条件是能够与第一蛋白相互作用。此外,第一蛋白相互作用蛋白可衍生自人类或可以是能够与人类衍生的第一蛋白相互作用的异种蛋白。
119.受试者可以是哺乳动物,例如人类等,并且例如可以是癌症患者(血癌、实体癌),更具体地说,可以是血癌患者。为了用于确定参考值,受试者可能需要给予bcl2家族蛋白靶向药物或确认其中药物的药用功效。
120.在此,血癌可选自由白血病(例如,急性髓系白血病、急性淋巴细胞白血病、慢性髓系白血病、慢性淋巴细胞白血病等)、淋巴瘤(例如,恶性淋巴瘤、b细胞淋巴瘤、小淋巴细胞淋巴瘤(sll)等)、多发性骨髓瘤和骨髓增生异常综合征组成的组。
121.样本是从患者分离(衍生)的生物样本,可包括细胞、细胞裂解物、组织或其培养物,或已建立的细胞系。例如,细胞或组织可以是癌细胞或癌组织。具体而言,癌症可以是血癌或实体癌(例如乳腺癌、肺癌(例如肺腺癌等)等)。在一种实施方式中,受试者可以是患有血癌的人类患者,而样本可以是选自由白细胞(例如粒细胞、淋巴细胞和/或单核细胞)和骨髓细胞(造血干细胞等)、血液、骨髓和含有细胞、癌细胞、癌组织及其裂解物的血块黄层组成的组中的至少一种,其中白细胞和骨髓细胞均分离自患有血癌或实体癌(例如乳腺癌或肺癌(例如肺腺癌等)的患者。
122.在一种实施方式中,样本可以是选自由白细胞(例如粒细胞、淋巴细胞和/或单核
细胞)和骨髓细胞(造血干细胞等)、血液、骨髓和含有细胞、癌细胞和癌组织的血块黄层组成的组中的至少一种的裂解物,其中白细胞和骨髓细胞均分离自患有血癌或实体癌(例如乳腺癌或肺癌(例如肺腺癌等)的患者。可使用溶剂获得裂解物,该溶剂包括选自由hepes、nacl、甘油、基于胆固醇的洗涤剂(以下称为“表面活性剂”)和磷酸酶抑制剂混合物组成的组中的至少一种。在这方面,可以使用基于胆固醇的洗涤剂(例如,乙二醇薯蓣皂苷配基(gdn)、洋地黄皂苷等)、基于peg的洗涤剂(例如,triton x-100等)等。本发明中可用的洗涤剂可包括gdn、洋地黄皂苷、triton x-100(tx-100)或其组合。例如,基于溶剂的总重量,gdn的使用量可为0.001-10%、0.005-5%、0.008-1.2%、0.01-10%、0.05-5%、0.08-1.2%、0.1-10%、0.5-5%、0.8-1.2%或约1%(重量比重量)。使用前,可将裂解液稀释至适当浓度。与其他类型的洗涤剂相比,基于胆固醇的洗涤剂和/或基于peg的洗涤剂可以在体外以类似于在体内的方式稳定地维持细胞功能和活性和/或三维蛋白结构,并允许蛋白在细胞环境中保持相对完整的结构和/或功能,即使在体外也能对细胞内固有的蛋白特性进行有利的观察。
123.在步骤(i)中,外部提供的(外源性)用探针标记的第一蛋白相互作用蛋白可以细胞裂解物形式使用。可通过使用合适的溶剂(例如,包括tx-100的溶剂或基于胆固醇的洗涤剂)处理表达探针标记的第一蛋白相互作用蛋白的重组细胞来获得细胞裂解物。例如,基于溶剂的总重量,tx-100的含量可为0.001%-1%或0.2-5%(重量比重量),尤其是0.5-2%,更特别是0.8-1.2%,甚至更特别是1%。这样获得的细胞裂解物在应用于基底之前被稀释。就此而言,可将细胞裂解物调整为含有0.02-0.04%量的tx-100。当含有浓度大于上限的tx-100时,溶剂可减少peg包被的基底上出现的非特异性结合信号,但降低从第一蛋白和第一蛋白相互作用蛋白之间的特异性相互作用观察到的测量值(信号值),使蛋白分析变得困难。当tx-100的用量小于下限时,第一蛋白相互作用蛋白的溶解变得不稳定,因为tx-100在溶剂中的存在浓度低于临界胶束浓度(cmc)。因此,第一蛋白相互作用蛋白在peg包被的基底上产生的非特异性结合信号增加,同时无效信号的测量使蛋白分析变得困难。临界胶束浓度也适用于基于胆固醇的洗涤剂。
124.细胞裂解物中第一蛋白相互作用蛋白的浓度可在10-2
至103nm或10-1
至102nm范围内,但可适当调整,且不受限制。
125.在此,bcl2家族蛋白靶向药物可以是选自由蛋白(例如抗体、其类似物等)、核酸分子(例如sirna等)和小分子化合物组成的组中的至少一种物质,每种物质都识别和/或抑制bcl2家族蛋白(例如抗凋亡蛋白),并且可以是凋亡控制药物。在一种实施方式中,bcl2家族蛋白靶向药物可对例如血癌表现出抗癌效果。bcl2靶向药物(例如bcl2抑制剂)的实例包括抗bcl2抗体、维奈托克(venetoclax)和abt737。作为bclxl靶向药物(例如,bclxl抑制剂),例如可使用抗bclxl抗体、abt263等。mcl-1靶向药物(例如mcl-1抑制剂)可通过抗mcl-1抗体、amg-176、azd5991和maritoclax来举例说明。
126.维奈托克(venetoclax)(或)可用于治疗急性髓系白血病(aml)、慢性淋巴细胞白血病(cll)、小淋巴细胞淋巴瘤(sll)等。
127.下文将给出本发明的详细描述。
128.参考代表bcl2家族蛋白靶向药物的维奈托克(venetoclax)来解释实施方式。
129.本文提出了一种血癌患者的诊断方法,其基于使用上述单分子蛋白相互作用测量
方法量化bcl2家族蛋白抑制凋亡的能力。其关键技术如下:(1)蛋白-蛋白相互作用的观察考虑了细胞中存在的bcl2家族蛋白的各种状态,(2)通过蛋白-蛋白相互作用的多方面观察和蛋白水平观察的定量比较,有能力选择对bcl2家族蛋白靶向药物(如venetoclax、amg 176或azd5991)敏感的细胞系和患者。
130.(1)通过维持bcl2家族蛋白的细胞内状态将bcl2家族蛋白捕获到基底上
131.在此,细胞内源性bcl2家族蛋白被捕获到基底上,同时保留其细胞内状态。
132.在一种实施方式中,将典型的血癌细胞系hl60(急性髓系白血病)或oci-ly3(b细胞淋巴瘤)细胞系与venetoclax一起培养以诱导凋亡。然后,进行了测试,以测量具有显示(暴露)的n-末端的凋亡蛋白bax,这解释了其活化构象。观察到,具有显示的n-末端的bax的水平随着venetoclax的治疗而升高。相比之下,通过用tx-100处理细胞裂解物,人工暴露bax蛋白的n端后,观察到洗涤剂激活的bax保持在如相同测试测量的类似水平上。从测试中可以理解,用venetoclax治疗增加了具有暴露的n-末端的bax的活化构象的比例,尽管没有改变bax的表达水平(见图17)。
133.结果表明,本文提出的方法可以反映bcl2家族蛋白的完整细胞内构象/ptm(翻译后修饰)。
134.(2)蛋白-蛋白相互作用(ppi)解释细胞内bcl2家族蛋白的状态变化的鉴定
135.在此,证实了细胞内bcl2家族蛋白状态的变化可通过ppi测量结果来解释。
136.在一种实施方式中,用bcl2抑制剂venetoclax或mcl1抑制剂azd5991处理oci-ly3或hl60细胞,然后比较bcl2家族蛋白(ppi)之间的相互作用的变化。当应用于细胞时,抑制剂预计会在细胞内bcl2家族蛋白中诱导状态改变(例如,复合物形成),因为它们选择性地抑制bcl2和mcl1蛋白与其他蛋白的相互作用。实际上,在有或无venetoclax(bcl2抑制剂)或azd5991(mcl-1抑制剂)的情下培养24小时后,从oci-ly3细胞制备细胞裂解物。然后,从细胞系中提取bcl2和mcl1蛋白,并分析其与bad和noxa(均用gfp标记)的相互作用。经venetoclax处理的细胞裂解物的bcl2-bad相互作用(ppi)高于未经任何抑制剂处理的细胞裂解物(非处理组)。此外,检测到来自azd5991处理的细胞裂解物的mcl1蛋白与noxa(标记)之间的相互作用水平高于来自未处理组中的mcl1蛋白与noxa(标记)之间的相互作用水平。相比之下,venetoclax治疗对mcl1-noxa相互作用(ppi)和azd5991治疗对bcl2-bad相互作用(ppi)没有影响。研究还证明,在本实验中使用的条件下,使用每种药物治疗不会引起bcl2和mcl1表达水平的显著变化。
137.也就是说,特定蛋白响应于特定药物而经历状态变化和/或响应于除特定药物以外的蛋白而不经历状态变化的鉴定,证明本文提供的方法可以分析由药物治疗引起的准确状态变化。
138.传统研究都是指向测量bcl2蛋白的表达水平来评估bcl2的细胞内凋亡活性。然而,本发明的特点是通过观察ppi(包括蛋白的分子特征)来对凋亡抑制进行定量分析。
139.(3)通过观察多方面的蛋白-蛋白相互作用和蛋白水平预测对bcl2家族蛋白靶向药物的敏感性
140.关于促凋亡蛋白和抗凋亡蛋白对细胞或患者样本凋亡的影响,定量测量样本内源性蛋白和外源性蛋白之间的相互作用(第一蛋白-蛋白相互作用),蛋白之间的相互作用(两者均为样本内源性(第二蛋白-蛋白相互作用)),和/或蛋白表达水平,以从多方面分析凋亡
信号。利用分析数据,确定了对bcl2家族蛋白靶向药物(如venetoclax)的敏感性。
141.内源性蛋白和外源性蛋白之间相互作用的测量是基于样本内源性的抗凋亡蛋白(如bcl2、bclxl、mcl1等)和从外部提供的(样本外源性)促凋亡蛋白(如bim、bad、noxa、bax、bak等)之间的相互作用(第一蛋白-蛋白相互作用,也称为“第一ppi”),并且用于定量分析与对bcl2靶向抑制剂(如venetoclax)或mcl1靶向抑制剂(如amg 176)的反应性的相关性。为此,用探针标记外部提供的促凋亡蛋白。
142.内源性蛋白(例如,蛋白复合物形成)之间相互作用的测量是基于抗凋亡蛋白(如bcl2、bclxl、mcl1等)与促凋亡蛋白(如bax、bak、bim、bad、noxa等)之间的相互作用,二者均为同一样本内源性(第二蛋白-蛋白相互作用,也称为第二ppi),并用于定量分析与对bcl2靶向抑制剂(如venetoclax)或mcl1靶向抑制剂(如amg 176)的敏感性的相关性。
143.比较分析内源性蛋白和外源性蛋白之间的相互作用(第一ppi)和/或内源性蛋白之间的相互作用(第二ppi)的水平,允许可以分析与对bcl2靶向抑制剂(如venetoclax)或mcl1靶向抑制剂(如amg 176)的敏感性的相关性。通过比较分析,可以确定细胞内源性抗凋亡蛋白(如bcl2、bclxl、mcl1等)的状态。例如,可以测量抗凋亡蛋白与促凋亡蛋白相互作用的活性部位的暴露程度。通过测量,可以间接估计蛋白之间的结合度和结合亲和力、剩余结合位点、药物敏感性等。
144.在此,测量同一细胞内源性的抗凋亡蛋白(如bcl2、bclxl、mcl1等)或促凋亡蛋白(如bax、bak等)的水平,以确定与对bcl2靶向抑制剂(如venetoclax)或mcl1靶向抑制剂(如amg 176)的敏感性的相关性。蛋白水平可以是蛋白、活化蛋白或磷酸化蛋白的表达水平。
145.本文提供的蛋白-蛋白相互作用的测量可基于单分子下拉和/或共免疫沉淀(co-ip)。
146.如本文所用,术语“蛋白-蛋白相互作用”(ppi)指第一蛋白和第一蛋白相互作用蛋白之间的物理和/或化学关联,或它们之间复合物的形成,并且可以根据例如结合频率、结合强度(亲和力)和结合时间的至少一个因素进行定量。此外,术语“第一蛋白和第一蛋白相互作用蛋白之间的相互作用(结合)”旨在包括由不同蛋白(位于信号通路中的第一蛋白和第一蛋白相互作用蛋白之间)介导的相互作用(结合)以及它们之间的直接相互作用(结合)。在此,蛋白-蛋白相互作用可以是单分子反应(第一蛋白的一个分子和第一蛋白相互作用蛋白的一个分子之间的反应)。
147.如上所述,作为bcl2家族蛋白(抗凋亡蛋白)的第一蛋白可以是bcl-2(例如,ncbi参考序列nm_000633.2等)、bclxl(例如,ncbi参考序列nm_138578.1等)或mcl-1(例如,ncbi参考序列nm_021960.3等)。与第一蛋白相互作用的第一蛋白相互作用蛋白可以是选自由bim(例如,ncbi参考序列b033694)、bid(例如,ncbi参考序列nm_001196.2)或tbid(例如,ncbi参考序列nm_001196.2n端截断形式等)、bad(例如,ncbi参考序列nm_004322.2等)、bax(例如,ncbi参考序列nm_138761.3等)、noxa(例如,ncbi参考序列nm_001382616.1)和bak(例如,ncbi参考序列np_001179.1等)组成的组中的至少一种。
148.在本文提供的方法中,测量第一蛋白和第一蛋白相互作用蛋白之间的相互作用的步骤(a1;(i)和/或(ii))可针对分离的细胞或组织离体或在体外执行。
149.本发明的测量将逐步详细解释。
150.步骤(1):制备第一蛋白固定化基底(与步骤(i)和(ii)相同)
151.在步骤(1)中,通过将第一蛋白或含有第一蛋白的测试样本添加到基底中制备其上固定有第一蛋白的基底,该基底的表面锚定了能够特异性结合第一蛋白的物质。
152.样本可以是从受试者(患者)分离的细胞或组织、细胞或组织的裂解物、匀浆物或提取物,或来自受试者的体液(例如血液(全血、血浆或血清)、唾液等)。患者可能是癌症患者,例如血癌患者。样本可能含有癌细胞(或血癌细胞)。具体实例如上所述。
153.只要允许将第一蛋白固定在基底表面,任何材料和/或结构都可以应用于基底(可以使用结晶或非结晶材料)。在一种实施方式中,基底可由折射率高达或高于水的折射率(约1.3)的材料制成,这是因为水占生物物质的大部分。在一种实施方式中,基底的厚度范围为约0.1至约1mm、约0.1至约0.5mm、约0.1至约0.25mm或约0.13至约0.21mm,折射率为约1.3至约2、约1.3至约1.8、约1.3至约1.6或约1.5至约1.54。基底可以由满足折射率范围的任何材料制成。例如,基底可由选自由玻璃(折射率:约1.52)和石英组成的组中的材料制成,但不限于此。基底可以是通常用于观察生物样本的任何形式,并且可以是井型、载玻片型、通道型、阵列型、微流控芯片型或微管(毛细管)型,但不限于此。为了进行显微镜观察,可将盖玻璃安装在施加样本的基底上。用于覆盖玻璃的材料如上文所述用于基底,并且可以与基底一样薄或比基底更薄(例如,折射率为1.52,厚度为0.17mm,但不限于此)。
154.特异性结合至第一蛋白的物质可以是能够结合至第一蛋白,即bcl2、bclxl、mcl1或其全部的任何物质。例如,特异性结合至第一蛋白的物质可以是选自由抗体、其抗原结合片段(例如,scfv、(scfv)2、scfv-fc、fab、fab',f(ab')2等)、适体(蛋白或核酸分子)、小分子化合物中的至少一种,每一种都特异性结合至bcl2、bclxl、mcl1或其全部。在这方面,特异性结合至第一蛋白(bcl2、bclxl、mcl1或其全部)的物质可作用于不干扰第一蛋白和第一蛋白相互作用蛋白之间相互作用的位点,即,第一蛋白与第一蛋白相互作用蛋白相互作用(结合)的位点以外的位点。
155.在一种实施方式中,基底的表面可以被适当地修饰以包括(锚定)特异性结合至其上的第一蛋白的生物物质(例如抗体等),或者该基底可以具有特异性结合至第一蛋白的物质被锚定到的表面。对于表面修饰,基底的一侧可以用任何具有官能团的化合物处理(例如,包被),该官能团可以保持与第一蛋白特异性结合的生物物质(例如,抗体等)。例如,可使用含有选自由醛基、羧基和胺基组成的组中的官能团的化合物处理基底。在一种实施方式中,含有选自由醛基、羧基和胺基组成的组中的官能团的化合物可以是选自由生物素、牛血清白蛋白(bsa)、生物素化牛血清白蛋白、聚乙二醇(peg)、生物素化peg(peg-生物素)和聚山梨酯(例如,吐温20)组成的组中的至少一种,但不限于此。经表面处理的基底可进一步用选自由中性抗生物素蛋白、链霉亲和素和抗生物素蛋白组成的组中的至少一种进行处理(例如,包被)。
156.步骤(2):使第一蛋白与第一蛋白相互作用蛋白反应
157.可通过以下步骤(2-1)和/或步骤(2-2)执行步骤(2)。
158.步骤(2-1):样本内源性蛋白和样本外源性蛋白之间的相互作用(步骤(i)的第一蛋白-蛋白相互作用)
159.在步骤(2-1)中,向具有下拉的第一蛋白(内源性蛋白)的基底(例如,在步骤(1)中制备)添加探针标记(附着)的第一蛋白相互作用蛋白(外源性蛋白),以允许它们之间反应。可以测量探针产生的信号,以确定内源性蛋白和外源性蛋白之间形成的复合物的水平,这
说明了内源性蛋白和外源性蛋白之间的相互作用的水平。
160.标记的第一蛋白相互作用蛋白是指用探针标记的形式,该探针产生可检测信号(化学(例如,共价或非共价)、重组或与探针物理偶联)或与探针可结合的标签结合。可检测信号可以是可通过检测典型酶反应、荧光、亮度和/或辐射来测量的任何信号(例如,光、放射性射线等)。探针可以是选自由小分子化合物、蛋白、肽和核酸分子组成的组中的任何一种,它们都可以产生信号。例如,探针可以是选自由荧光染料(小分子化合物;青色素(cyanine)、alex、dylight、fluoprobes等)和荧光蛋白(例如绿色荧光蛋白(gfp、增强型gfp)、黄色荧光蛋白(yfp)、青色荧光蛋白(cfp)、蓝色荧光蛋白(bfp)、红色荧光蛋白(rfp)、樱桃色萤光蛋白(mcherry)等)组成的组中的至少一种。只要在本领域中通常可用,就可以使用任何标签,例如his-标签/ni-nta。为了允许准确且容易的检测,而不产生噪声,可在高达约1μm的范围内适当地测定探针的浓度,例如,1nm至1000nm、1nm至500nm、1nm至100nm、10nm至1000nm、10nm至500nm或10nm至100nm,但不限于此。探针产生的信号可通过任何常用检测器(例如荧光显微镜、荧光摄像机、荧光强度测量(量化)装置等)进行测量。
161.步骤(2-2):内源性蛋白之间的相互作用(步骤(ii)中的第二蛋白-蛋白相互作用)
162.在步骤(2-2)中,向具有下拉的第一蛋白的基底(例如,在步骤(1)中制备)添加与第一蛋白相互作用蛋白结合的物质(用探针标记的结合物质),以使结合物质与在第一蛋白(内源性)和第一蛋白相互作用蛋白(内源性)之间形成的复合物的第一蛋白相互作用蛋白反应。可以测量探针产生的信号,以确定样本中复合物的水平,这说明了内源性蛋白-蛋白相互作用的水平。
163.与第一蛋白相互作用蛋白结合的物质指产生可检测信号(化学(例如,共价或非共价)、重组或物理偶联至第一蛋白相互作用蛋白)或可结合至标签的探针。可检测信号可以是可通过检测典型酶反应、荧光、亮度和/或辐射来测量的任何信号(例如,光、放射性射线等)。探针可以是选自由小分子化合物、蛋白、肽和核酸分子组成的组中的任何一种,它们都可以产生信号。例如,探针可以是选自由荧光染料(小分子化合物;青色素(cyanine)、alex、dylight、fluoprobes等)和荧光蛋白(例如绿色荧光蛋白(gfp、增强型gfp)、黄色荧光蛋白(yfp)、青色荧光蛋白(cfp)、蓝色荧光蛋白(bfp)、红色荧光蛋白(rfp)、樱桃色萤光蛋白(mcherry)等)组成的组中选择的至少一种。只要在本领域中通常可用,就可以使用任何标签,例如his-标签/ni-nta。为了允许准确且容易的检测,而不产生噪声,可在高达约1μm的范围内适当地测定探针的浓度,例如,1nm至1000nm、1nm至500nm、1nm至100nm、10nm至1000nm、10nm至500nm或10nm至100nm,但不限于此。探针产生的信号可通过任何常用检测器(例如荧光显微镜、荧光摄像机、荧光强度测量(量化)装置等)进行测量。
164.为了更准确地测量蛋白-蛋白相互作用,该方法还可包括在反应步骤(步骤(2))和随后的蛋白-蛋白相互作用测量步骤(步骤(3))之间已进行反应的基底的洗涤步骤。
165.步骤(3):蛋白-蛋白相互作用测量
166.在步骤(3)中,从步骤(2)(即,(2-1)和/或(2-2))中的反应混合物中测量信号。可以使用能够检测(测量或识别)步骤(2)中使用的探针产生的信号(例如,通常可检测的信号如酶反应、荧光、亮度或辐射)的任何手段来进行信号测量。
167.在一种实施方式中,步骤(3)中蛋白-蛋白相互作用的测量可基于实时分析。
168.在一种实施方式中,当信号是荧光信号时,可以通过使用荧光显微镜、荧光(测量)
摄像机和/或荧光强度测量(定量)装置来对由提供可吸收光的探针产生的荧光信号进行成像和/或定量,从而实现信号检测。
169.当信号是荧光信号时,步骤(3)(蛋白-蛋白相互作用测量步骤)可包括以下子步骤:
170.(i)提供来自光源的光束给步骤(2)的反应混合物;和
171.(ii)检测响应于提供来自光源的光束产生的荧光信号。
172.在提供来自光源的光束的子步骤(i)中,在步骤(2)中,将来自光源的光束提供给第一蛋白和第一蛋白相互作用蛋白的反应混合物。只要实现了这一目标,就不会限制提供来自光源的光束的时间。例如,在步骤(1)之前、与步骤(1)同时或在步骤(1)之后直到步骤(2)之后可以连续提供一段时间的光束,或者在步骤(2)之前、与步骤(2)同时或步骤(2)刚刚之后可以提供一段预定时间的光束,但不限于此。
173.只要其发射与荧光信号相对应的波长,就可以使用任何光源,并且可以由激光器、卤素灯等作为实例。
174.在一种实施方式中,可通过使用全内反射荧光(tirf)显微镜或共焦显微镜提供光束并观察荧光信号来执行测量蛋白-蛋白相互作用的步骤(3)。在另一种实施方式中,全内反射荧光显微镜可配备用于信号成像的荧光(测量)相机,例如emccd(电子倍增电荷耦合器件)或cmos(互补金属氧化物半导体),并可用于提供光束、图像和/或量化荧光信号。
175.下面将参考使用全内反射荧光显微镜和荧光相机的实例更详细地说明测量蛋白-蛋白相互作用的步骤(3),如下所示:
176.a)将步骤(1)或(2)的基底安装在trif显微镜上。在trif显微镜中,无论光源的位置如何,当透镜定位时,光源通常朝向待观察的基底;
177.b)光源可以是激光,其强度范围为约0.5mw至约5mw、约0.5mw至约4.5mw、约0.5mw至约4mw、约0.5mw至约3.5mw、约0.5mw至约3mw、约0.5mw至约2.5mw、约0.5mw至约2mw、约1mw至约5mw、约1mw至约4.5mw、约1mw至约4mw、约1mw至约3.5mw、约1mw至约3mw、约1mw至约2.5mw、约1mw至约2mw、约1.5mw至约5mw、约1.5mw至约4.5mw、约1.5mw至约4mw、约1.5mw至约3.5mw、约1.5mw至约3mw、约1.5mw至约2.5mw,或约1.5mw至约2mw,并且其强度可为约2mw。如前所述,可以根据荧光信号、使用的探针和/或装置的配置(例如,衰减滤波器允许使用高强度光源)适当地选择光源的光波长。
178.c)从光源提供光束而产生的荧光信号可通过荧光(测量)相机进行捕获、成像和/或量化。
179.考虑到探针的荧光信号产生的保留时间(发光时间、寿命),荧光信号的捕获(或成像)可与提供光源同时执行,或在信号产生的保留时间内执行。
180.对于使用荧光相机(例如,emccd相机)捕捉(或成像)荧光信号,可适当控制曝光时间、激光功率、相机增益值、总成像帧等。例如,每帧较短的曝光时间将一帧上的信号累积到较小的程度。为了抵消这一点,可以增加激光功率或荧光相机的灵敏度。在一种实施方式中,每帧曝光时间可以设置为约0.001sec至约5sec、约0.001sec至约3sec、约0.001sec至约2sec、约0.001sec至约1sec、约0.001sec至约0.5sec、约0.001sec至约0.3sec、约0.001sec至约0.1sec、约0.01sec至约5sec、约0.01sec至约3sec、约0.01sec至约2sec、约0.01sec至约1sec、约0.01sec至约0.5sec、约0.01sec至约0.3sec、约0.01sec至约0.1sec、约0.05sec
至约5sec、约0.05sec至约3sec、约0.05sec至约2sec、约0.05sec至约1sec、约0.05sec至约0.5sec、约0.05sec至约0.3sec、约0.05sec至约0.1sec、约0.07sec至约5sec、约0.07sec至约3sec、约0.07sec至约2sec、约0.07sec至约1sec、约0.07sec至约0.5sec、约0.07sec至约0.3sec、约0.07sec至约0.1sec、约0.1sec至约5sec、约0.1sec至约3sec、约0.1sec至约2sec、约0.1sec至约1sec、约0.1sec至约0.5sec、或约0.1sec至约0.3sec,例如约0.1sec,但不限于此。
181.例如,当使用emccd相机时,从探针(例如egfp)产生的光子以通过emccd元件转换的电子形式进行测量(光电效应)。每个光子产生的电子数可以通过增益值来改变。增益值设置得越高,每个光子产生的电子数就越多,这导致emccd的灵敏度增加,同时背景噪声也增加。因此,信噪比可能很重要。在一种实施方式中,增益值可设置为落在以下范围内,但不限于约10至约100、约10至约80、约10至约60、约10至约50、约20至约100、约20至约80、约20至约60、约20至约50、约30至约100、约30至约80、约30至约60或约30至约50,例如约40,以获得良好的信噪比。然而,考虑到相机灵敏度和寿命、装置配置条件、噪声测试条件等,可以适当地选择增益值。
182.将总图像帧数乘以曝光时间,得到总摄影时间(曝光时间
×
总帧数=摄影时间)。因为荧光信号在荧光材料的发射时间(寿命)之后消失,所以可以调整图像帧的总数和/或曝光时间,以便在发射时间(寿命)内进行摄影。
183.为了提高蛋白-蛋白相互作用测量的准确性,对一个或多个(例如两个或更多个、三个或更多个、四个或更多个、五个或更多个、七个或更多个、或十个或更多个)基底(上限可根据基底的尺寸和允许成像的区域确定)或一个或多个通道(每个通道包括两个或更多个基底)进行成像。可以通过测量信号表达点(也称为ppi复合物)的数量来量化获得的荧光信号,这被认为是量化蛋白-蛋白相互作用的一种方法。
184.在另一种实施方式中,可通过借助典型装置将步骤(3)中测量的荧光强度数字化来实现蛋白-蛋白相互作用的定量。为了数据的准确性,可以参考样本量或样本中的蛋白量对测量值进行标准化。
185.当使用两种或更多种不同的第一蛋白和/或第一蛋白相互作用蛋白时,步骤(1)至(3)可针对单个第一蛋白和第一蛋白相互作用蛋白的组合中的每一个执行(即,步骤(1)至(3)可对对应于第一蛋白和第一蛋白相互作用蛋白的组合的数量重复执行若干次)。
186.本文提供的方法还可包括以下步骤(4)。
187.步骤(4):比较步骤(步骤(b),更具体地说(b1))
188.在步骤(4)中,将步骤(3)中获得的结果(蛋白-蛋白相互作用的水平)与第一比较蛋白和第一比较蛋白相互作用蛋白之间相互作用的水平进行比较或与参考值进行比较。第一比较蛋白、第一比较蛋白相互作用蛋白和参考值如上所述。
189.如本文所用,表达“靶向bcl2家族蛋白”意味着识别(特异性结合于)bcl2家族蛋白和/或抑制bcl2家族蛋白的活性。抑制bcl2家族蛋白的活性说明通过结合于bcl2家族蛋白和/或降解和/或结构修饰bcl2家族蛋白来减少或消除bcl2家族蛋白的固有功能,例如抗凋亡功能。
190.本文使用的术语“药物”是指具有药理作用的任何物质,例如是选自由小分子化合物、蛋白(例如,抗体、抗体片段、其类似物等)、肽、核酸分子(例如,dna、rna(即sirna、
microrna、shrna等)、pna(肽核酸)、适体等)、植物提取物、动物提取物和细胞提取物组成的组中的至少一种。
191.在此,所有外部提供的蛋白,例如第一蛋白相互作用蛋白、作为探针的荧光蛋白、作为结合物质的抗体等,可通过重组或化学合成产生,但不限于此。在一种实施方式中,重组生产可包括将编码感兴趣的蛋白的基因或携带该基因的载体转染到哺乳动物细胞(如hek293细胞)、昆虫细胞(如sf9)或细菌细胞(如大肠杆菌)中,然后允许细胞表达该蛋白的步骤。表达的蛋白可能会经历进一步的纯化过程,但这可能不是必需的。纯化的蛋白或含有表达蛋白的细胞裂解物可以原样用于进行蛋白-蛋白相互作用的测量。
192.如本文所用,术语“bcl2家族蛋白靶向治疗”和“使用bcl2家族蛋白靶向药物的治疗”可以彼此互换使用,二者之间具有相同的含义,并且旨在涵盖导致抑制第一蛋白活性的所有医学和/或药学行为。例如,治疗可包括向有需要的受试者处方和/或给药抑制bcl2家族蛋白活性的药物。更详细地说,“bcl2家族蛋白靶向治疗”可包括处方和/或给药结合、降解和/或结构修饰bcl2家族蛋白的药物,以减少或消除内在功能,例如对有需要的受试者的抗凋亡功能。
193.可通过口服或肠胃外途径给药。肠胃外给药可通过静脉注射、皮下注射、肌肉注射、腹腔注射、皮内给药、区域内局部给药、鼻内给药、肺内给药或直肠内给药进行。
194.个体、患者或受试者的实例可包括所有哺乳动物,例如,灵长类动物,如人类、猴子等,啮齿类动物,如小鼠、大鼠等,并且可为患有第一蛋白相关疾病的患者。第一蛋白相关疾病可以是与第一蛋白的过度表达或与信号通路的激活相关的疾病,其中第一蛋白参与细胞或组织,例如癌症和更具体地血癌。在一种实施方式中,个体、患者或受试者可以是癌症患者,尤其是血癌患者。
195.如本文所用,术语“对药物的反应性”是指药物在将药物给药个体中表现出的作用的程度。
196.如本文所用,术语“效果”或“功效”是指药物或疗法旨在对治疗的受试者实现的医疗和/或药物效果,并可能意味着预防和/或治疗受试者的疾病和/或减少和/或缓解疾病症状。例如,当药物、治疗和受试者分别是抗癌剂、抗癌治疗和癌症患者时,效果可能是抗癌效果(对癌症的预防和/或治疗效果)。抗癌效果可包括防止癌症的迁移、侵袭和/或转移、抑制癌症恶化和/或降低或消除癌症抵抗以及抑制癌细胞生长的效果。
197.在另一种实施方式中,提供了一种分析装置,用于预测bcl2家族蛋白靶向药物的效果和/或用于使用bcl2家族蛋白靶向药物治疗的效果。
198.分析装置可包括:
199.反应部,其中包括第一蛋白或用于通过特异性结合至第一蛋白来捕获第一蛋白的物质;和
200.任选地,用于检测第一蛋白相互作用蛋白的试剂和/或信号检测装置。用于检测第一蛋白相互作用蛋白的试剂包含(特异性)结合至第一蛋白相互作用蛋白的物质。结合物质是一种粘合剂(例如,抗体、抗原结合片段、抗体类似物、适体、小分子化合物等),其结合至不同于第一蛋白相互作用蛋白与第一蛋白相互作用(结合)的位点,并且可以用探针标记。
201.第一蛋白如上所述,可用作纯化蛋白或包含在细胞或细胞裂解物中。反应部可包括第一蛋白、细胞或细胞裂解物(每种都包括该蛋白、细胞或细胞裂解物),或具有固定在其
上的该蛋白、细胞或细胞裂解物的基底。
202.分析装置可适于定性和/或定量地确定第一蛋白和第一蛋白相互作用蛋白之间的相互作用。
203.反应部可包括将用于捕获第一蛋白的物质固定于其上的基底,或将第一蛋白直接或通过捕获物质固定至其上的基底。用于捕获第一蛋白的物质可以是与第一蛋白特异性结合的物质,例如抗体或抗原结合片段。反应部可以是井式(例如,多井式)形式、载玻片形式、通道形式、阵列形式、微流控芯片形式或微管(毛细管)形式,但不限于此。
204.分析装置可适于测量第一蛋白和第一蛋白相互作用蛋白之间的相互作用。在这种情况下,分析装置还可以包括第一蛋白相互作用蛋白。在一种实施方式中,第一蛋白相互作用蛋白可以用产生可检测信号的探针标记(例如,化学(例如,共价或非共价)、重组或物理方式与探针偶联),或者可以具有附着在其上的标签,该标签能够与探针偶联。
205.此外,蛋白-蛋白相互作用测量装置还可以包括结合至第一蛋白的探针和能够偶联到探针的标记物质,以便将信号检测装置测量的信号值标准化为第一蛋白的水平。结合至第一蛋白的探针可以是生物分子(例如抗体),其结合至第一蛋白的不同于包含在前述多孔中的捕获物质的位置。所述标记物质可以偶联到产生可检测信号的探针(例如,化学地(例如,共价或非共价地)偶联到探针),并且可以是能够偶联到结合至第一蛋白的探针的生物分子(例如,抗体)。
206.信号检测装置可以是通常根据所用探针产生的信号使用的任何信号检测装置。例如,信号检测装置可以包括信号刺激部和信号检测部。此外,可以包括用于分析(例如,量化或成像)测量信号的信号分析部。在一种实施方式中,可以在各个区域进行信号刺激、信号检测和信号分析。或者,可以在一个区域中同时或连续地进行信号刺激、检测和分析中的至少两个。在一种实施方式中,当探针是荧光材料时,信号检测装置可以从能够生成和检测荧光信号的所有装置中选择,并且可以包括例如荧光信号刺激部(例如,光源)和荧光信号检测部,和/或荧光信号分析部。在一种实施方式中,信号检测装置可包括全内反射荧光(tirf)显微镜或共焦显微镜(光源和荧光信号检测)和可选的荧光相机,例如,电子倍增电荷耦合器件(emccd)摄像机或互补金属氧化物半导体(cmos)摄像机,以提供光源、图像和/或量化荧光信号。光源的波长和强度以及荧光相机的测量条件(例如,每帧曝光时间、激光功率、相机增益值、总帧数等)如上所述。
207.本文提供的蛋白-蛋白相互作用测量装置的优点是,即使使用少量样本,也能够准确且有效地观察、分析、检测和/或测量第一蛋白和第一蛋白相互作用蛋白之间的相互作用和/或第一蛋白和第一蛋白相互作用蛋白的表达水平。因此,即使是非常少量的活组织检查(例如,针式活组织检查)样本,也可以有效地应用多孔和使用多孔的分析方法。
208.本发明的有益效果
209.bcl2家族蛋白靶向药物,如venetoclax等,可用于治疗各种血癌患者。例如,venetoclax可用于治疗急性白血病和骨髓癌。然而,为了减轻患者的负担,需要一种预测药用功效的诊断技术。确定单一bcl2蛋白表达水平和突变基因存在与否的传统方法无法成功预测bcl2家族蛋白靶向药物(如venetoclax等)的疗效。反之,本文提供的基于蛋白-蛋白相互作用和/或蛋白表达的方法能够以快速且特定的方式成功预测bcl2家族蛋白靶向药物,例如venetoclax等,是否有效地作用于患有各种血癌的个体患者,从而允许针对血癌的快
速且有效的定制个人治疗。
210.附图的简要说明
211.图1示出了固定在基底上的个体抗体和靶蛋白之间相互作用的测量。图1a涉及bcl2、bclxl和mcl1,图1b涉及bcl-w和bfl-1。
212.图2a示出了内源性蛋白bcl2、mcl1和bclxl与外源性蛋白bim、noxa和bad之间的ppi计数。图2b示出了内源性蛋白bcl2和bcl-xl与外源性蛋白tbid之间的ppi计数。图2c示出了内源性蛋白bcl2、mcl1和bcl-xl与外源性蛋白bax和bak之间的ppi计数,图2d示出了内源性bcl2、bcl-xl和mcl1之间的ppi计数,以及作为探针的外源性bim蛋白的仅bh3结构域。
213.图3示出了通过测量内源性bcl2和外源性bad之间的相互作用,ppi计数根据第一蛋白相互作用蛋白的浓度的变化。
214.图4示出了通过测量内源性bcl2和外源性bad之间的相互作用,ppi计数根据外部提供的溶液中所含的洗涤剂的类型和浓度的变化。
215.图5示出了通过测量内源性bcl2和外源性bad之间的相互作用,ppi计数根据外部提供的溶液中所含的洗涤剂triton x-100的浓度的变化。
216.图6示出了当外源bim蛋白在物种间高度保守的氨基酸发生突变时,bim变体和bcl-xl或bcl2之间的ppi计数在变体间各不相同。
217.图7示出了bcl2、mcl1或bcl-xl和bim之间的复合物计数,所有这些都是样本内源性的(hl60和oci-ly3)。
218.图8示出了bcl2和bax之间的复合物计数,二者均为样本内源性的(oci-ly3)。
219.图9示出了bcl2、bcl-xl或mcl1和bak之间的复合物计数,所有这些都是样本内源性的(oci-ly3)。
220.图10示出了bcl-xl和bad之间以及mcl1和noxa之间的复合物计数,所有这些都是样本内源性的(hl60、oci-ly3和sudhl8)。
221.图11示出了第一蛋白和第一蛋白相互作用蛋白在测量蛋白复合物计数时彼此可互换。
222.图12中,图12a示出了两种不同类型的bak抗体均可结合至bak。图12b示出了使用所示的下拉抗体(ab)对[mcl1,bak]、[bcl-xl,bak]或[bcl2,bak]共表达的细胞(hek293)获得的信号测量结果,从而证明d4e4克隆的bak抗体能够与bak结合,在共表达时不再与bcl2家族蛋白结合。图12c示出了使用图12a中使用的抗体之一at38e2可检测共表达的bak蛋白。
[0223]
图13示出了mcl1、bcl-xl和bcl2的表达水平,所有这些都是样本内源性的。
[0224]
图14示出了bax和bak的表达水平,二者为样本内源性的。
[0225]
图15示出了在gdn处理的样本(a)、triton x-100处理的样本(b)、gdn处理的样本(c)和triton x-100处理的样本(b)中添加治疗剂(星孢菌素(staurosporine)和venetoclax)后,使用检测抗体测量的bax表达水平。
[0226]
图16示出了在使用venetoclax(a和c)和triton x-100(b和d)处理时间方面,样本中特定折叠构象的bax表达水平。
[0227]
图17示出了使用venetoclax或amg176(a)治疗后,样本内源性bcl2(hl60)和外源性蛋白bad之间的ppi计数,以及使用venetoclax或amg176治疗后,样本内源性bcl2(oci-ly3)和外源性bad之间的ppi计数。
[0228]
图18示出了使用venetoclax和amg176(a)治疗后,样本内源性mcl1(hl60)和外源性noxa之间的ppi计数,以及使用venetoclax或amg176治疗后,样本内源性mcl1(oci-ly3)和外源性noxa之间的ppi计数。
[0229]
图19示出了使用venetoclax和amg176(a)治疗后,样本内源性bcl-xl(hl60)和外源性bad之间的ppi计数,以及使用venetoclax或amg176治疗后,样本内源性bcl-xl(oci-ly3)和外源性bad之间的ppi计数。
[0230]
图20示出了使用venetoclax和amg176(a)治疗后,样本(hl60)中bcl2、mcl1和bcl-xl的表达水平,以及使用venetoclax或amg176(b)治疗后,样本(oci-ly3)中bcl2、mcl1和bcl-xl的表达水平。
[0231]
图21示出了使用venetoclax或amg176(a)治疗后,均为样本(hl60)内源性的bcl2、mcl1或bcl-xl和bim之间的复合物计数,以及使用venetoclax或amg176治疗后,均为样本(oci-ly3)内源性的bcl2、mcl1或bcl-xl和bim之间的复合物计数。
[0232]
图22示出了使用venetoclax或amg176(a)治疗后,两者均为样本(hl60)内源性的mcl1和noxa之间的复合物计数,以及使用venetoclax或amg176治疗后,两者均为样本(oci-ly3)内源性的mcl1和noxa之间的复合物计数。
[0233]
图23示出了使用venetoclax或amg176(a)治疗后,两者均为样本(hl60)内源性的bcl-xl和bad之间的复合物计数,以及使用venetoclax或amg176治疗后,两者均为样本(oci-ly3)内源性的bcl-xl和bad之间的复合物计数。
[0234]
图24示出了与venetoclax治疗时间相关的、两者均为样本(hl60)(a)内源性的bcl2和bax之间的复合物计数,以及与venetoclax治疗时间相关的、两者均为样本(oci-ly3)内源性的bcl2和bax之间的复合物计数蛋白。
[0235]
图25示出了样本(hl60)(a)和样本(oci-ly3)(b)中与venetoclax治疗时间相关的bax表达水平。
[0236]
图26示出了样本(hl60)(a)和样本(oci-ly3)(b)中与venetoclax治疗时间相关的bak表达水平。
[0237]
图27示出了根据venetoclax或azd5991的剂量的样本(hl60)内源性bcl2和外源性bim之间的ppi计数。
[0238]
图28示出了根据venetoclax或azd5991的剂量的样本(hl60)内源性mcl1和外源性bim之间的ppi计数。
[0239]
图29是示出了aml患者(n=32)样本中参数(相互作用(第一ppi)、复合物(第二相互作用)和表达水平)测量结果的z评分热图。
[0240]
图30示出了乳腺癌患者(n=302)样本中bcl2表达的定量测量。
[0241]
图31示出了肺癌患者(n=15)样本中bcl2表达的定量测量结果。
[0242]
图32示出了与使用venetoclax的样本(oci-ly3)的治疗时间相关的内源性蛋白bcl2和外源性蛋白bim之间的ppi计数和复合物计数。
[0243]
图33示出了与使用azd5991的样本(oci-ly3)的治疗时间相关的内源性蛋白mcl1和外源性蛋白noxa之间的ppi计数和复合物计数。
[0244]
图34示出了均为来自患者1的样本内源性的bcl2、mcl1或bcl-xl,与外源性蛋白bim之间的ppi计数,如i)诊断时获得的骨髓,ii)使用flt3靶向抗癌剂(奎扎替尼)治疗后再
次获得的骨髓,以及iii)使用venetoclax和ldac治疗后获得的全血样本中测量的。
[0245]
图35示出了均为来自患者2的样本内源性的bcl2、mcl1或bcl-xl,与外源性bim之间的ppi计数,如i)诊断时获得的骨髓,ii)使用flt3靶向抗癌剂(奎扎替尼)治疗后再次获得的骨髓,以及iii)使用venetoclas和ldac治疗后获得的全血样本中测量的。
[0246]
图36a至36c示出了来自aml患者(n=32)的样本中对venetoclax(纵轴)的反应性与包括ppi(第一ppi)、复合物(第二ppi)、表达水平等21个参数的相关性分析结果。
[0247]
图37示出了来自aml患者的样本中对venetoclax的反应性与包括bcl2-bim ppi(第一ppi)和bcl2-bim复合物(第二ppi)的参数的相关性分析结果。
[0248]
图38示出了基于参数组合对venetoclax的反应性的预测。图38a示出了当参数的数量从1个增加到10个时的相关系数。图38b示出了与单个指标相比,两个指标的组合的相关性分析结果。图38c示出了五个参数的组合的相关分析结果。
[0249]
图39a至39c示出了来自aml患者(n=26)的样本中对azd5991的反应性与包括ppi(第一ppi)、复合物(第二ppi)、表达水平等21个参数的相关性分析结果。
[0250]
图40示出了使用四个主要指标的组合对azd5991的反应性的预测结果。
具体实施方式
[0251]
实施例
[0252]
此后,将通过实施例详细描述本发明。
[0253]
以下实施例仅旨在说明本发明,并不被解释为限制本发明。
[0254]
实施例1.内源性蛋白与外源性蛋白之间蛋白-蛋白相互作用(ppi)的测量
[0255]
1.1.分析裂解物(样本)的制备
[0256]
从如慢性淋巴细胞白血病(cll)和急性髓系白血病等各种血癌患者获得的骨髓样本中,使用菲科尔梯度分离方案(ge healthcare ficoll-paque plus 17-1440-03)仅选择性地采集血块黄层。
[0257]
用dpbs清洗分离出的血块黄层沉淀物(pellet),然后用500g dpbs分离5分钟。重复该步骤两次,以尽可能多地去除残留在血块黄层中的红细胞和血小板。从血块黄层中分离出的血癌细胞被107个细胞等分,等分试样在液氮中快速冷冻,并在-80℃下储存,直到用于实验。
[0258]
血癌细胞(韩国细胞系库和atcc;hl-60(cvcl_0002)、oci-ly3(cvcl_8800))、ramos(cvcl_0597)、u937、thp1和sudhl8)和来自患者的血块黄层的血癌细胞沉淀物分别悬浮在裂解缓冲液(hepes 50nm、nacl 150nm、甘油10%(w/v)gdn(洋地黄皂苷)1%(w/v)和2%(w/v)磷酸酶抑制剂混合物2/3(p5726,p0044))中,并以10分钟的定期间隔旋转三次。30分钟后,含有沉淀匀浆物的裂解缓冲液在15000g下离心10分钟。由此形成的上清液用作分析裂解液,在后续实验中应用于基底。
[0259]
1.2.探针标记的第一蛋白相互作用蛋白的制备
[0260]
通过瞬时转染产生了探针标记的第一蛋白相互作用蛋白(探针蛋白)。简言之,在用限制性内切酶消化pegfp-c1(addgene:pt3028-5)后,将编码蛋白bim(sino biological:hg13819-g)、noxa(sino biological:hg16548-u)和bad(sino biological:hg10020-m)的基因分别插入消化的质粒中以构建gfp表达蛋白载体。使用聚乙烯亚胺将表达载体瞬时转
染到hek293t细胞(atcc;crl-3216)中,以提供过度表达的gfp标记蛋白。
[0261]
表达gfp标记蛋白的hek293t细胞在1%tx100裂解缓冲液中裂解。将由此制备的细胞裂解物在1%tx100裂解缓冲液中稀释至165nm的浓度。在实验前,将稀释液的等分试样快速冷冻并解冻。最后,制备含有标记的第一蛋白相互作用蛋白的细胞裂解物,使其具有浓度为0.03%的tx-100。
[0262]
使用本发明的方法制备bid,或bim、bax或bak的仅bh3结构域的标记的第一蛋白相互作用蛋白。下表1给出了以下实施例中使用的第一蛋白相互作用蛋白(人类衍生),以及它们的uniprot id和氨基酸区域。
[0263]
表1
[0264]
第一蛋白相互作用蛋白uniprot idbadq92934noxaq13794bimq43521bidp55957bim_bh3q43521(aa 134-166)bax_bh3q07812(aa 59-73)bak_bh3q16611(aa 74-88)
[0265]
作为第一蛋白相互作用蛋白的探针,使用绿色荧光蛋白(以下简称“gfp”;使用pegfp-c1载体(克隆技术)标记)将egfp连接到第一蛋白相互作用蛋白的c末端。
[0266]
1.3.基底的制备
[0267]
将尺寸为45mm
×
60mm的玻璃盖玻片涂上3:100(w:w)的生物素peg:mpeg混合物。
[0268]
为了用作将bcl2家族蛋白(第一蛋白)下拉至基底的peg包被的表面的介质,使用了ntv(中性抗生物素蛋白;thermo,a2666)和生物素化山羊抗兔二级抗体(111-065-046jackson immunoresearch)。
[0269]
将ntv和二级抗体偶联到peg包被的基底后,将下拉相应的bcl2家族蛋白(第一蛋白)的一级抗体(见下表2)应用于基底。
[0270]
将10μl量的专利细胞和细胞系(韩国细胞系库和atcc;hl-60、u937、thp1、oci-ly3和sudhl8)的裂解物分别置于每个都涂有抗体(见表2)的孔中,以下拉待观察的蛋白,并在室温下培养一小时,然后用洗涤缓冲液(hepes 50mm nacl 150mm甘油1%gdn 0.03%)洗涤多余的裂解物。
[0271]
表2
[0272]
[0273]
表2中给出的抗体的性能是根据将gfp融合的第一蛋白下拉到基底上的程度来测量的。简单地说,将1nm的gfp融合的bcl2蛋白施加到抗体偶联的基底上并培养。洗涤后,定量测定剩余gfp。对bcl-xl、mcl1、bclw和bfl1也进行了同样的实验。由此获得的结果如图1a和1b所示。如图1a和1b所示,观察到表2中给出的抗体成功地将各自的靶蛋白下拉到基底上。
[0274]
1.4.内源性蛋白和外源性蛋白的测量
[0275]
将在实施例1.2中制备的含有探针标记的第一蛋白相互作用蛋白的细胞裂解物添加到实施例1.3中制备的基底中。简而言之,向每个孔中添加10μl实施例1.2的细胞裂解物,并在室温下孵育15分钟。用洗涤缓冲液(hepes 50mm nacl 150mm甘油1%gdn 0.03%)洗掉多余的裂解物。然后,如下测量蛋白-蛋白相互作用:
[0276]
将基底固定在全内反射荧光上并成像以获得蛋白-蛋白相互作用(结合)的数据。为了提高结果的准确性,在相同条件下,从总共10个不同位置获取图像,并将其平均值用作代表值。
[0277]
荧光图像以16位无符号整数格式存储。为了观察信号,给激光一个合适的波长(对于gfp为488nm)。将激光功率调节至2mw,以保持egfp的发光约11秒。
[0278]
在所有帧(10帧)中,舍弃早期和中期帧,并取三帧(第7帧到第9帧)图像的平均值来生成一幅图像。该过程在一个孔内的不同位置重复进行,以获取总共十幅图像,然后使用这些图像执行以下步骤。在本实施例中,使用emccd(电子倍增电荷耦合器件;andor ixon ultra 897 ex2(du-897u-cs0-exf))相机获得每帧曝光时间为0.1且emccd增益值为40的荧光图像。
[0279]
来自荧光蛋白的信号被检测为局部点扩散函数(psf)。psf(物理值)的数量是bcl2家族蛋白和待测蛋白之间的ppi分数(生物学值)。psf值通过以下程序转换为ppi分数(生物学值):
[0280]
(a)获得局部最大值的位置(例如,第i行、第j列像素)。如前所述,单分子荧光信号被定位并形成在特定位置(在当前的观察装置下,约5
×
5像素大小,1像素=0.167微米)。因此,局部最大值的发现允许选择单个psf。这可以使用matlab提供的工具箱获得。
[0281]
(b)执行确定(a)中获得的局部最大值是否实际由psf生成的过程。首先,定义了局部最大值的最小强度值。仅在上述获得的局部最大值大于最小强度值的情况下进行分析。本实施例中使用的最小强度值为75,可以因激光功率/曝光时间/已建立的装置状态而异。根据最终获得的局部最大坐标检索5
×
5像素的信息,并在5
×
5像素中确定强度的质心。这里,如果获得的强度质心偏离现有局部最大坐标0.5像素或更大(如果psf图案的2d对称性消失),则确定荧光信号异常,并将其排除在分析之外。
[0282]
(c)仅选择通过所有测试条件的psf来确定坐标和总数。在此,获得的psf总数成为ppi计数。
[0283]
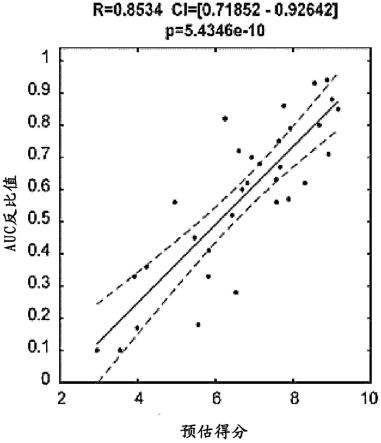
在相同条件下拍摄的每个文件都经过上述程序,以获得psf的数量,然后将这些数量进行合计,并用于计算平均值和标准偏差。该值最终表示特定条件下的ppi计数。在该实施例中,可以通过ppi计数来估计外源性第一蛋白和外源性第一蛋白相互作用蛋白之间形成的复合物。
[0284]
ppi计数的测量如图2a(根据第一蛋白和第一蛋白相互作用蛋白的种类得出的结
果)、图2b(根据细胞系的种类得出的结果)、图2c(根据第一蛋白和细胞系的种类得出的结果)和图2d(根据第一蛋白和细胞系的种类得出的结果)所示。
[0285]
为了确定影响内源性蛋白和外源性蛋白之间相互作用的数据的因素,测量(i)根据分析裂解物(样本)和探针标记的第一蛋白相互作用蛋白的浓度进行的ppi强度(荧光强度)(图3)和(ii)根据分析裂解物(样本)的浓度,以及包括探针标记的第一蛋白相互作用蛋白在内的细胞裂解物中所含的洗涤剂的种类进行的ppi计数(图4)和根据洗涤剂的浓度的ppi计数(图5)。一般来说,ppi计数随分析裂解物(样本)和第一蛋白相互作用蛋白的浓度的增加而增加。
[0286]
此外,根据第一蛋白相互作用蛋白的变化测量ppi计数,如图6所示。
[0287]
实施例2:内源性蛋白之间相互作用的测量(复合物的测量)
[0288]
在这个实施例中,测量了第一蛋白和第一蛋白相互作用蛋白之间的相互作用,这两种蛋白都是同一样本的内源性蛋白。简言之,通过在分析裂解物中检测第一蛋白与第一蛋白相互作用蛋白结合的第一蛋白-第一蛋白相互作用蛋白复合物来测量相互作用。该实施例中测得的第一蛋白-第一蛋白相互作用蛋白复合物如下表3所示:
[0289]
表3
[0290][0291]
表3的图中的数据来自于通过与标记的第一蛋白相互作用蛋白结合的物质测量下拉至基底的第一蛋白和标记的第一蛋白相互作用蛋白之间形成的复合物。或者,使用与标记的第一蛋白结合的物质测量固定在基底上的第一蛋白相互作用蛋白和标记的第一蛋白之间形成的复合物计数(在这种情况下,第一蛋白相互作用蛋白的抗体和第一蛋白的抗体分别用作下拉抗体和检测抗体)(图11)。如图7到图11所示,无论第一蛋白或第一蛋白相互作用蛋白是否被下拉到基底上,都可以获得相同的检测效果。
[0292]
通过测量两种均为样本内源性的第一蛋白和第一蛋白相互作用蛋白之间的相互作用,得出如下结果:
[0293]
首先,将以与实施例1.1相同的方式制备的分析裂解物添加到参考实施例1.3制备的基底中。
[0294]
作为检测样本内源性蛋白-蛋白复合物的结合物质,使用了针对第一蛋白相互作用蛋白的检测抗体。作为用于探测检测抗体的荧光标记的二级抗体,以稀释形式制备cy3 affinipure驴抗小鼠igg(jackson immunoresearch:715-165-151)。
[0295]
将检测抗体添加到制备的基底中。将检测抗体以10μl的量添加到每个孔中,并在室温下孵育15分钟,然后,用洗涤缓冲液(hepes 50nm nacl 150nm甘油1%gdn 0.03%)洗涤掉过量的抗体。然后,将荧光标记的抗体cy3affinipure驴抗小鼠igg(jackson immunoresearch:715-165-151)稀释2000倍,向每个孔中加入10μl稀释液,并孵育10分钟。用洗涤缓冲液洗涤掉过量的抗体(hepes 50nm nacl 150nm甘油1%gdn 0.03%)。测量蛋白-蛋白相互作用(复合物)。以与实施例1-4相同的方式进行测量。
[0296]
下表4中总结了本实施例中使用的结合物质(抗体)的信息:
[0297]
表4
[0298][0299]
如上所述,第一蛋白和第一蛋白相互作用蛋白可以彼此互换。此外,当所用抗体为单克隆抗体时,可使用任何可用制造商提供的任何等效克隆。
[0300]
因此,给出抗体列表仅用于说明实施例,但不应解释为限制本发明。
[0301]
在本发明中,抗体或结合物质与第一蛋白或第一蛋白相互作用蛋白特异性结合,一起形成复合物,抗体或结合物质的使用没有特定限制。然而,当已知参与两种蛋白之间的复合物形成的位点被用作抗体或结合物质的识别位点时,就不可能检测到复合物。在一种实施方式中,为了检测bcl2、bcl-xl和mcl1,它们各自与bak形成复合物,建议抗体识别bak的除bh3结构域以外的位点(例如,非跨膜结构域螺旋1至螺旋4的位点等)(图12)。
[0302]
实施例3.内源性蛋白表达水平的测量
[0303]
在本实施例中,定量测量了分析裂解物中存在的特定蛋白的水平。特异性蛋白包括bcl2、bcl-xl、mcl1、bax和bak。
[0304]
就此而言,以与实施例1-1相同的方式制备细胞裂解物,并将其添加到以与实施例1-3相同的方式制备的基底中。然后,添加如实施例2所制备的标记的检测抗体(用cy3 affinipure驴抗小鼠igg(jackson immunoresearch:715-165-151)标记)。然后,使用与实施例1-4相同的方法测量荧光信号,以量化分析裂解物中目标蛋白与其检测抗体之间的相互作用。
[0305]
在该实施例中,用于将目标蛋白固定至基底上的下拉抗体和用于检测相同蛋白的检测抗体在抗原方面应相同,但在结合位点方面应不同。
[0306]
下表5中总结了本实施例中使用的抗体信息:
[0307]
表5
[0308][0309]
第一结合物质是一种可下拉至基底的抗体,而第二结合物质用于在添加分析裂解物后检测目标蛋白。这里,第一结合物质和第二结合物质可以互换使用。例如,即使在将第二结合物下拉至基底后,也可进行相同的定量分析,分析裂解物和第一结合物可按该顺序提供给基底。给定的抗体不限制本发明的范围。然而,第一和第二结合物质应避免识别完全相同的表位。
[0310]
实施例4.折叠构象特异性蛋白的测量
[0311]
本实施例设想了一种通过使用能够根据折叠构象特异性识别蛋白的抗体或结合物质来检测样本中存在的折叠构象特异性蛋白的方法。在一种实施方式中,折叠构象特异性检测应用于bax和bak。
[0312]
据报道,bax蛋白能在细胞内保留多种折叠构象。其中,已知当bax蛋白折叠成引起凋亡的构象时,会出现约20个n-末端氨基酸的暴露(yi-te hsu等,j.bio.chem.272,(1997),michael a.dengler等,cell rep.27(2019))。在迁移到线粒体脂质膜的过程中,bak蛋白以各种折叠构象诱导细胞凋亡(mark xiang li等,pnas 114(2017))。本发明涉及一种能够识别仅以这种特定折叠构象暴露的结构域的抗体或结合物质的用途。
[0313]
在一种实施方式中,已知识别bax蛋白n端的抗体和能够识别暴露在任何折叠构象中的结构域的抗体可用于识别在诱导样本中凋亡的活性状态下的bax蛋白。在另一种实施方式中,选择性识别bak蛋白的bh3结构域的抗体和识别以任何构象暴露的bak结构域的抗体可成对使用,以检测折叠构象中的bak蛋白,从而允许从样本中暴露bh3。在下面的表6中,列出了用于实现本发明的抗体对。然而,抗体并不限制本发明的范围。此外,无论制造商如何,都可以使用单克隆抗体。
[0314]
表6
[0315]
靶蛋白折叠构象ab 1ab 2bax暴露的n端ab 32503sc-23959bak暴露的bh3sc-517390sab1305656
[0316]
在该表中,ab 1和ab 2分别表示下拉至基底并用于检测的抗体。即使两种抗体相互交换角色,也可能获得相同的结果。例如,当ab 2被拉下至基底,而ab 1被用作检测抗体时,可以预期相同的结果。
[0317]
为了在该方法中使用,可按照与实施例1相同的方式制备分析裂解物。
[0318]
本该实施例中蛋白的定量分析可采用与实施例2或3所述相同的方式进行。例如,所使用的抗体或蛋白特异性结合物质可适于结合至相同的抗原或靶蛋白。同时,这两种蛋
白或蛋白特异性结合物质应结合至靶蛋白的不同位点。此外,当使用两种抗体时,建议两种抗体的宿主彼此不同,除非用相应的探针直接标记抗体。
[0319]
可参考实施例2或3中提出的方法来执行该实施例。例如,为了检测特定折叠构象中的靶蛋白,添加了ab 1、样本和ab 2。
[0320]
为了实现该实施例,可通过人工诱导凋亡来制备样本。例如,通过使用星形孢菌素1小时或使用venetoclax 24小时诱导细胞凋亡。这样制备的样本在含有gdn的裂解缓冲液中裂解,以提供分析裂解物,然后观察到当从中检测到n端暴露的bax时,其显示出增加的信号(图14)。对于使用含有triton x-100的裂解缓冲液从同一样本制备的分析裂解物,非离子洗涤剂triton x-100可强制诱导n端暴露。从该分析裂解物中,检测到n端暴露的bax(图15)。在使用gdn从凋亡诱导的样本制备分析裂解物后,当测量n端暴露的bax时,信号增加。相比之下,当使用triton x-100进行人工n-端暴露时,无论细胞凋亡诱导如何,均获得恒定值。
[0321]
在另一种实施方式中,通过将aml细胞系hl60或dlbcl细胞系oci-ly3与venetoclax培养来诱导凋亡,并测量bax的n端暴露的比率。在用100nm venetoclax处理2、4、8或24小时后,用含有gdn的裂解缓冲液裂解样本,以制备分析裂解物。然后,bax检测信号随venetoclax治疗时间而变化(图16)。相比之下,在通过进一步将相同的分析裂解物与triton x-100混合(最终浓度为1%)来诱导n端暴露后,观察到bax量几乎不随时间变化。
[0322]
如上所述,本文提供的折叠构象特异性蛋白检测方法可提供有助于分析细胞状态的指标,例如,凋亡程度。
[0323]
实施例5.bcl2家族蛋白靶向抑制剂治疗后细胞内bcl2家族信号通路变化的测量
[0324]
本实施例设想了一种通过bcl2家族蛋白靶向抑制剂治疗来测量细胞内信号转导变化的方法。更具体地说,本发明提供了一种用于综合分析各种bcl2家族蛋白(例如bcl2、bcl-xl、mcl1)的样本间和样本内蛋白-蛋白相互作用(复合物)的强度以及蛋白表达水平的变化的方法,其中用bcl2靶向抑制剂venetoclax或mcl1靶向抑制剂azd5991处理蛋白。
[0325]
为了实现本实施例的目标,可分别以与实施例1、2、3和4相同的方式测量样本间蛋白-蛋白相互作用、样本内蛋白-蛋白相互作用以及表达水平的变化。
[0326]
例如,靶向抑制剂venetoclax或azd5991可在100nm的浓度下应用于细胞24小时。对于对照,可在相同条件下应用二甲基亚砜。
[0327]
下表7和表8中总结了本实施例中的分析内容:
[0328]
表7
[0329]
样本间蛋白-蛋白相互作用分析
[0330]
[0331]
(在表7中,bim*代表从bim中切下的gfp标记的bh3结构域,第一蛋白是分析裂解物内源性蛋白,并下拉至基底表面)
[0332]
表8
[0333]
样本内蛋白复合物的测量
[0334][0335]
在表8中,第一蛋白和第一蛋白相互作用(结合)蛋白(形成复合物)均包含在分析裂解物中。即使这两种蛋白中的任何一种被下拉到基底表面,也可能获得相同的结果。例如,下拉至基底表面的抗体可以是针对第一蛋白或第一蛋白相互作用(结合)蛋白的抗体。
[0336]
例如,本实施例中提出的方法可以定量测量bcl2靶向抑制剂治疗前后ppi强度和复合物形成的变化。为此,hl60或oci-ly3细胞用二甲基亚砜、venetoclax 100nm(bcl2靶向抑制剂)或amg176 100nm(mcl1靶向抑制剂)处理24小时,然后从各自样本制备分析裂解物,并测量上述指标。在hl60和oci-ly3两者中,观察到用venetoclax治疗增加bcl2-bad ppi强度(图17)。相比之下,用mcl1靶向抑制剂amg176治疗并没有改变bcl2-bad ppi。结果不仅限于venetoclax-bcl2。经amg176治疗后,观察到mcl1-noxa ppi选择性增加(图18)。bcl-xl对venetoclax/amg176均无反应性,ppi强度根据bcl-xl表达水平而改变。这些数据表明,bcl2和mcl1靶向抑制剂选择性地产生相应蛋白的ppi强度(图19和图20)。
[0337]
在另一种实施方式中,根据bcl2靶向抑制剂的治疗测量复合物形成的变化。在与ppi测量相同的条件下,对采集的样本进行分析,以测量bcl2家族bim复合物(图21)、mcl1-noxa复合物(图22)和bclxl-bad复合物(图23)的形成变化。此外,该方法可用于测量bcl2-bax复合物(图24)以及bax和bak的表达水平(图25和26)的变化。
[0338]
本实施例可用于测量所用靶向抑制剂与bcl2家族蛋白和相关信号传导蛋白之间的直接关系。为此,bcl2或mcl1蛋白被用作第一蛋白,而bim-gfp蛋白被用作第一蛋白相互作用蛋白。当第一蛋白被下拉到基底表面时,加入不同浓度的靶向抑制剂venetoclax或azd5991(mcl1靶向抑制剂)以及第一蛋白相互作用蛋白,以测量ppi强度的变化。bcl2-bim ppi强度仅在bcl2靶向抑制剂venetoclax存在下降低,但不受azd5991的影响(图27)。相反,当mcl1作为第一蛋白时,只有azd5991降低了mcl1-bim ppi强度(图28)。
[0339]
总之,结果表明,本文提出的方法可以定量分析bcl2家族蛋白特征(ppi强度、复合物形成、表达水平等),这些特征是bcl2家族靶向抑制剂应用于样本时出现的。此外,ppi强度的变化被确定由药物的应用直接控制。因此,本文提供的方法旨在根据bcl2靶向抑制剂的治疗测量bcl2家族蛋白的变化,并可作为样本的分子诊断技术。
[0340]
实施例6.患者样本的实用分析方法
[0341]
本实施例中说明的方法是测量来自患者(例如急性髓系白血病(aml)或乳腺癌)的样本中bcl2家族蛋白的特征。
[0342]
对于患者样本之间的等效比较,可使用选自bradford测定、lowry测定和红外吸收中的至少一种方法来确定总蛋白浓度。在保持添加到基底中的样本浓度恒定的条件下,允许对样本之间进行定量比较。对于aml患者,可以从血液或骨髓中分离样本。从实体癌组织中,样本可以通过手术或穿刺活检获得。
[0343]
实施例1、2和3中提出的所有测定均可用于患者样本,但不限于此。这些测定方法都适用于血癌和实体癌。
[0344]
例如,基于从32名aml血癌患者获得的样本的分析结果,可以提供一种综合测定bcl2家族蛋白的ppi(实施例1)、复合物(实施例2)和表达水平(参见实施例3)的分析方法(图29)。
[0345]
在另一种实施方式中,对从302名乳腺癌患者获得的样本的分析可用于量化样本内源性bcl2蛋白的表达水平(图30)。
[0346]
在另一种实施方式中,基于来自15名肺腺癌患者样本的数据的方法可应用于bcl2蛋白表达水平的定量(图31)。
[0347]
实施例7.实施例1的交互测量与实施例2的复杂测量的比较
[0348]
本文提出的两种方法,即,通过使用第一蛋白相互作用蛋白测量ppi强度(实施例1)和测量第一蛋白相互作用蛋白和第一蛋白结合蛋白之间的复合物(实施例2)可以提供不同的信息。
[0349]
简而言之,这些方法可以检测oci-ly3细胞与venetoclax 100nm或azd5991 100nm培养前后ppi强度和复合物形成的差异。例如,观察到用venetoclax处理的样本增加了bcl2-bim ppi计数,但减少了bcl2-bim复合物计数(图32)。此外,用azd5991处理的样本增加了mcl1-noxa ppi计数,但减少了mcl1-noxa复合物计数(图33)。从测定中可以理解,实施例1中实现的ppi计数测量与实施例2中实现的复合物计数测量基本不同。
[0350]
实施例8.通过观察bcl2家族蛋白相互作用的变化追踪患者状态来确定给药的方法
[0351]
本文提供的方法可产生一种随时间追踪患者的分子状态的方法。更详细地说,对从血癌患者在不同阶段采集的骨髓或血液样本的相互作用分析可用于提供有助于确定bcl2家族蛋白依赖性以及是否给予相应的靶向抗癌剂的信息。在这方面,对于患者1,i)在诊断时提取的骨髓中进行bcl2、mcl1和bcl-xl以及bim-gfp之间的ppi测定;ii)在用flt3靶向抗癌剂奎扎替尼治疗后提取的骨髓中进行相同的测定;和iii)根据步骤ii)中获得的ppi信息,对venetoclax和低剂量阿糖胞苷(ldac)治疗后获得的全血样本进行相同的测定(图34)。在诊断时,由于患者表现出较低的bcl2-bim ppi,因此没有足够的理由开处方venetoclax。然而,在开处方flt3靶向抑制剂奎扎替尼后,信号重新发生,从而大幅增加bcl2-bim ppi。由于这种现象,当使用venetoclax和ldac联合治疗时,观察到患者的bcl2-bim ppi再次下降。临床上认为,奎扎替尼治疗后白细胞计数急剧上升,但venetoclax和ldac联合治疗将白细胞计数降低到稳定水平,这表明venetoclax即使在临床水平上也具有药用功效。之后,脐血干细胞移植使患者完全缓解。
[0352]
此外,以与患者1相同的方式对患者2进行时间序列诊断(图35)。在患者2中,bcl2家族蛋白的信号通路也不能通过开处方flt3靶向抑制剂来控制。然而,在venetoclax和ldac联合治疗后,观察到bcl2-bim ppi显著降低。与此结果一致的是,白细胞计数测试显示,在奎扎替尼治疗后,白细胞计数增加了约三倍。从上述结果可以看出,奎扎替尼治疗不能带来任何临床效果。
[0353]
实施例9.bcl2靶向抑制剂的反应性预测方法的发展
[0354]
通过本文提出的方法,可以预测急性髓系白血病患者对bcl2靶向抑制剂venetoclax的反应性。
[0355]
简而言之,在如实施例6所示从aml患者提取的样本(骨髓或血液)中的bcl2家族蛋白中,测量了六种ppi计数(实施例1)、六种表达水平(实施例3)和九种复合物计数(实施例2)(见下表9)。
[0356]
表9
[0357][0358]
为了测量对venetoclax的反应性,在用0、30、100、300或1000nm venetoclax处理分离自患者的样本24小时后,通过流式细胞术对活细胞进行计数。绘制剩余活细胞计数的剂量反应曲线。个别患者对venetoclax的反应性使用auc(曲线下面积)的反比值进行定量。
[0359]
通过对venetoclax对个体测量的反应性进行线性相关分析,获得了最高的预测指数(图36a-36c)。为了进行定量比较,获得了线性相关系数(r,皮尔森相关系数)。在总共21项指标中,测量的bcl2-bad ppi、bcl2-bim ppi、bcl2表达水平和bcl2-bax复合物计数的r值为0.65或更大(图36a-36c中四项指标用正方形表示)。然而,在建立venetoclax反应预测模型时,所选择的指标并不限制本发明的范围(例如,模拟模型中涉及的各种指标)。
[0360]
为了确认ppi计数和复合物计数是彼此不同的指标,可以将bcl2-bim ppi计数和bcl2-bim复合物计数分别与对venetoclax的反应性进行比较(图37)。观察到bcl2-bim ppi和venetoclax之间的相关性高达r=0.74,但与bcl2-bim复合物计数的相关性降至r=0.41。这些结果说明了使用ppi计数和复合物计数作为不同的指标,表明ppi计数可以高度准确地预测对venetoclax的反应性。
[0361]
测量值的组合可以提高对venetoclax的反应性预测的准确性。可以使用包括多元线性回归、逻辑回归、支持向量机等的各种方法来实现测量的这种组合。在本实施例中,采用了多元线性回归,但不限制本发明的范围。当采用单一参数(指标)时,在r=0.75左右检测到最高值,但随着参数数量的增加而增加(图38a)。
[0362]
从21个参数(指标)中可以得出多达2097151种组合。可以考虑各种参数,如生物合理性、数学合理性等,以搜索最佳模型。
[0363]
例如,为了证明两个或更多个指标的组合比单个指标获得更好的分析结果,bcl2-bax或bcl2-bim复合物与对venetoclax的反应性之间的相关性,以及bcl2-bax或bcl2-bim复合物和bcl2-bad ppi的组合与对venetoclax的反应性之间的相关性分别在图38b的上图和下图中描述。如图38b所示,bcl2-bax和bcl2-bim复合物的r值分别为0.67和0.41,但当复合物与bcl2-bad ppi结合时,r值增加到0.76和0.75,表明两个指标的组合导致药物反应性的预测结果改善更多。
[0364]
举例来说,在一个总共有5个参数组合的模型中,观察到线性相关系数r为0.85(图38c)。在这方面,下表10给出了使用的参数。在各种参数的组合中,这种组合表现出最显著的结果。
[0365]
表10
[0366][0367]
实施例10.建立预测对mcl1靶向抑制剂的反应性的方法
[0368]
可以以与实施例9相同的方式提供用于预测对mcl1靶向抑制剂的反应性的方法。例如,azd5991用作mcl1靶向抑制剂,但只要它保留类似的作用机制,任何靶向抑制剂都可以同样使用。使用的药物种类不限制本发明的范围。
[0369]
如实施例9所示,可对单个指标进行线性相关分析,揭示包括mcl1-bim ppi、bclxl-bim ppi、bax表达水平和bak表达水平的指标与对azd5991的反应性的相关联(图39a-39c)。
[0370]
为了提高反应性预测的准确性,可以利用各种参数的组合,如实施例9所示。举例来说,对azd5991的反应性与下表11所列参数组合的相关性分析得出r=0.78(图40),下表11示出了各种参数组合中最显著的结果。
[0371]
表11
[0372][0373]
本发明所属领域的普通技术人员将理解,本发明可以以其他特定形式实施,而不改变本发明的技术精神和基本特征。因此,应当理解,上述实施例在所有方面都是说明性的,而不是限制性的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。