高内涵分析法
背景技术:
1.基于功能测试的精准医疗是一个新兴领域,技术发展迅速。
2.迄今为止,通过预测功能测试实现的个性化主要与特定细胞群(例如肿瘤细胞)的行为的体外分析有关,分析参数诸如在药物的体外刺激后的活力、免疫表型及其变化。细胞可以是来自从患者获得的样品的细胞。
3.需要获得具有高预测准确性的数据,这对于个性化医疗应用是必需的,因此需要复制体外条件,其模拟细胞相互作用和在体内肿瘤细胞周围的微环境。
4.当用于在存在和/或不存在治疗剂的情况下评估细胞死亡时,流式细胞术不允许收集有关微环境和细胞间相互作用的信息。
5.因此,获得更多预测数据的需要导致需要建立最能代表所述微环境和所述细胞间相互作用的体外模型。这可以通过选择导致最大化体外/体内相关性的最合适的体外环境来实现,为此,有必要评估除细胞死亡之外的特性,包括例如生物标志物的表达,以考虑不同细胞群与细胞所在微环境之间的相互作用。除非通过高内涵(high-content)技术,否则无法评估这些特性。
6.随着越来越个性化的疗法进入市场,这种需求更加明显,这些疗法非常昂贵,因此其施用必须尽可能是定向的。此外,在许多疾病中,尤其是癌症,快速进展和抗癌疗法的副作用要求治疗方法从一开始就是最好的。
7.us2017356911公开了一种体外系统,该系统从患者的血液样品中分离出pmbc(外周血单核细胞)并将它们铺板在多孔板中,优选地在384孔板中,从而获得很好地解释生理环境的实验模型。
8.多年来在多孔板中进行的实验工作表明,在每个孔中(例如,在其中接种了等体积的相同细胞悬液),在细胞之间发生不同且高度复杂的关系。非必须地,在每个所述孔中以及在属于所述孔的所有细胞中,创建最佳环境以使孔代表生理环境。
9.使用高内涵分析平台排除其中偏差是非特异性(即与正在进行的分析不相关,并且经常由于样品对生理环境的非代表性)的偏差数据目前是不可行的。
10.因此,强烈需要一种方法,该方法允许对细胞样品获得有效、准确和精确的分析,以便在临床实践中获得有用的适应症。
技术实现要素:
11.本发明涉及一种用于对生物样品进行高内涵分析的方法,其中所述方法基于细胞和/或微孔的集合或子集的选择的分析过程,其允许定义体外模型,其中由所述模型进行的测量和实际的生物体内行为之间的相关性最大化。在一个实施方案中,所述方法允许观察例如试剂和生物样品之间的相互作用,消除与所述试剂的作用无关的干扰。在另一个实施方案中,所述方法允许选择最合适的体外环境以最大化体外/体内相关性。举例来说,根据本发明的方法提供了用于去除代表细胞功能改变的影响(其不是由于治疗而是由于体外微环境的条件,其不同于细胞在体内经受的条件)的那些数据的客观的方法,允许最大化在体
外对患者细胞样品获得的治疗的功效结果与同一患者对相同治疗的实际临床反应之间的相关性。
12.所述方法是大规模的,因此允许将分析集中在对于待进行的特定分析最适合的样品上,排除由于与正在进行的分析无关的原因而是由于生理环境的样品非代表性而导致异常数据的样品,同时保持大量数据以确保结果的统计稳健性。特别地,根据本发明的方法提供了将分析集中在微孔集合上的可能性,每个微孔的特征在于由于在每个所述微孔中在细胞和/或包含在其中的试剂之间产生的不同关系而导致的不同的微环境。
13.定义
14.除非另有定义,本文中使用的所有技术和科学术语与本发明所涉及的本领域技术人员通常理解的含义相同。
15.如本文所用,术语“约”或“大约”表示在给定值或范围的10%内、更优选5%内的变异性。
16.如本文所用,“微孔”是指尺寸为微米(小于1000微米)的容器,包括高度,横截面积,例如微孔为管状时的直径和体积。
17.术语“高内涵”是指在细胞中进行的表型分析方法,包括全细胞或细胞成分的分析,其中同时读取不同的参数,通常通过在显微镜下、在相差和/或荧光下获取图像并分析它们来执行。
18.如本文所用,术语“细胞间相互作用”是指细胞表面之间的直接相互作用,其可以是稳定的,例如通过细胞或瞬时或临时连接产生的那些,例如免疫系统的细胞之间的那些,或涉及组织炎症中的相互作用。所述相互作用也可以是间接的,其中所述细胞不接触但足够接近第一个细胞分泌分子例如蛋白质以对第二个接近的细胞产生功能影响。例如,在使用药剂或操作进行治疗后,如在car-t的情况下,t细胞释放细胞因子,其导致足够接近的靶标死亡。
[0019]“治疗”是指体外细胞或受试者的治疗性治疗,其中目标是改善或减缓(减少)靶标疾病病况或病症,或与其相关的一种或多种症状。所述治疗性治疗可以由药物或治疗剂组成。
[0020]“响应”或“响应性”是指在治疗后表现出至少一种改变的特征的细胞或受试者。类似地,“响应于”或“响应”和类似术语是指在体外细胞或受试者中预防、改善或减少靶标疾病病况或与其相关的一种或多种症状的指示。例如,根据本领域技术人员已知的标准定义的肿瘤细胞或肿瘤块的数量的减少而不是血液学反应被认为是响应。
[0021]
根据本发明的“治疗剂”或“药剂”是由包括但不限于多肽、肽、糖蛋白、核酸、合成或天然来源的药物、肽、多烯、巨红细胞、糖苷、萜类、萜类化合物、脂肪族和芳香族化合物及其衍生物的分子组成的治疗类型。在一个优选的实施方案中,治疗剂是化合物,例如合成和天然药物。在另一个优选的实施方案中,治疗剂引起疾病、病症、与其相关的病理学和/或症状的改善和/或治愈。
[0022]
合适的治疗剂包括但不限于goodman和gilman的the pharmacological basis of therapeutics或the merck index中提出的那些。治疗剂的类型包括但不限于影响炎症反应的药物、影响体液的成分的药物、影响电解质代谢的药物、化学治疗剂(例如,用于过度增殖性疾病,特别是癌症,用于寄生虫感染和用于微生物疾病)、抗肿瘤剂、免疫抑制剂、影响
血液和造血器官的药物、激素和激素拮抗剂、维生素和营养素、疫苗、寡核苷酸以及基因和细胞疗法。应当理解,包含两种或更多种活性剂例如两种药物的组合例如混合物的组合物也包括在本发明中。
[0023]
在一个实施方案中,治疗剂可以是药物或前药、抗体、疫苗或细胞。本发明的方法可用于预测向患者施用治疗剂是否会触发对治疗剂的响应或监测患者对正在进行的治疗的响应。在进一步的应用中,所述方法可用于测试药剂对潜在药理学兴趣的靶标的功效。
[0024]
治疗剂的性质绝不限制本发明的范围。在非限制性实施方案中,本发明的方法可用于评估对合成小分子、天然存在的物质、天然存在的生物制剂或合成产品或以上两种或更多种的任意组合(任选与赋形剂、载体或媒介物组合)的响应。
[0025]
术语“诊断”是指对分子或病理状态、疾病或病况的鉴定,例如癌症的鉴定,或是指对可能受益于特定治疗方案的癌症患者的鉴定。
[0026]
术语“预后”是指预测观察到或未观察到疾病状态变化(例如进展或消退,或某些临床事件的发作,无论施用至受特定病理影响的受试者的特定治疗或治疗剂)的概率。
[0027]
术语“预测”在此用于表示患者将有利或不利地响应特定治疗剂的可能性。在一个实施方案中,预测涉及患者在治疗(例如用特定治疗剂治疗)后是否存活或改善并且在一定时间段内没有疾病进展和/或患者在治疗(例如用特定治疗剂治疗)后存活或改善并且在一定时间段内没有疾病进展的可能性。
[0028]
除非另有说明,否则本文所述的一般方法和技术可根据本领域公知的常规方法进行,以及如在整个这些说明书中引用和讨论的各种一般和更具体的参考文献中所述的进行。参见,例如,sambrook等人,molecular cloning:a laboratory manual,2d ed.,cold spring harbor laboratory press,cold spring harbor,n.y.(1989);ausubel等人,current protocols in molecular biology,greene publishing associates(1992);harlow和lane,antibodies:a laboratory manual,cold spring harbor laboratory press,cold spring harbor,n.y.(1990)。
[0029]“染料”或“标记物”是指可以提供光学可检测信号(例如比色、发光、生物发光、化学发光、磷光或荧光信号)的分子、化合物或物质。在本发明的一个优选的实施方案中,染料是荧光染料。染料的非限制性实例包括cf染料(biotium,inc.)、alexa fluor染料(invitrogen)、dylight染料(thermo fisher)、cy染料(ge healthscience)、irdyes(li-cor biosciences,inc.)和hilyte染料(anaspec,inc.)。在一些实施方案中,染料的激发和/或发射波长在350nm和900nm之间,或在400nm和700nm之间,或在450-650nm之间。在一个实施方案中,标记物是用于表征免疫表型的抗体,活力、细胞凋亡的标记物、显示蛋白质磷酸化和通路激活的抗体。
[0030]
本文中的术语“延时成像”是指在连续时间执行的同一视野的多个图像的获取。
附图说明
[0031]
图1:显示通过对多个微孔进行细胞活力测定获得,然后基于累积衍生特性“微孔中的细胞密度”以及关系“每个细胞与属于同一微孔的细胞的平均距离”选择的细胞死亡率数据(输出参数=细胞死亡,特性=细胞死亡百分比)的图。
[0032]
图2:显示flai-5治疗的剂量/响应测量的图,其中对多个微孔进行细胞活力测定,
并且输出参数,即细胞死亡,是从感兴趣的区域中测量的“细胞死亡”特性推断的,计算具有高于某个阈值的细胞死亡标记物强度并且属于基于累积衍生特性“每孔的细胞数”的所选集合的感兴趣的区域的百分比,即,所述输出参数是从具有高于某个阈值的细胞死亡标记物强度并且属于基于累积衍生特性“每孔的细胞数”选择的微孔集合的感兴趣的区域的分数的计数推断的,其中所述感兴趣的区域是多重性的,其包括包含在每孔含有相同细胞数量的微孔中的所有感兴趣的区域。
[0033]
图3:与通过顺序接种两个同质细胞群获得的共定位相关的理论图(a)以及理论值和实验值之间的比较(b)。
[0034]
图4:对于每孔细胞数量c随着r1的变化而变化所观察到的共定位频率
[0035]
图5:对于两个r2值,观察到的共定位频率随着每孔细胞数量的变化而变化,随着r1的变化。
[0036]
图6:图像获取和处理过程中包括的步骤的示意图:鉴定对应于微孔的区域(a);检测多个感兴趣的区域(b);测量所述感兴趣的区域(表c中的a列)的特性(表c中的b-g列);从基于所述测量的特性中的两个(表d中的c、g列)选择的感兴趣的区域的集合中获得输出参数(表d中的f列)。
[0037]
图7:根据本发明的方法(a)及其两个实施方案(b,c)的框图(μw=微孔)。
[0038]
图8:显示在根据本发明的方法的步骤c)中测量的特性的表格。
[0039]
图9:抗cd38药剂对细胞死亡的影响(
“‑”
表示未处理的微孔;“ ”表示处理的微孔)。
[0040]
图10:根据本发明的系统的图解表示。
[0041]
图11:(a)选择了四个微孔子集的基于icnp的分析,其中每个子集满足下文所述的四个纳入标准(模式)之一。模式1:微孔子集被选择为包含至少一个满足直接特性“nk细胞免疫表型”的感兴趣的区域和至少一个满足直接特性“浆细胞免疫表型”(e/t共定位)的感兴趣的区域;模式2:微孔子集被选择为包含至少一个满足直接特性“浆细胞免疫表型”的感兴趣的区域并且没有满足直接特性“nk细胞免疫表型”的感兴趣的区域;模式3:微孔子集被选择为包含至少一个满足直接特性“nk细胞免疫表型”的感兴趣的区域并且没有满足直接特性“浆细胞免疫表型”的感兴趣的区域;模式4:微孔子集被选择为不包含任何满足直接特性“浆细胞免疫表型”的感兴趣的区域和任何满足直接特性“nk细胞免疫表型”的感兴趣的区域;(b)nk细胞和浆细胞之间的距离d的测量,以图解方式表示并在原始图像中。(c)基于同一微孔中e(nk细胞)和t(浆细胞)数目的数量鉴定的20种模式中的每一种评估的浆细胞死亡率。显示了孔的百分比,指示括号中的模式。(d)在单细胞水平上分析的延时图像的示例。(e)以距离nk细胞零(接触)和(μm)之间的距离位于微孔内的靶细胞(浆细胞)的死亡的测量。该方法允许通过比较在nk细胞与靶细胞接触时死亡事件的频率与在由其中e(nk细胞)为空(无nk)的微孔代表的对照中测量的靶细胞的自发细胞死亡来评估活性nk细胞的分数。(f)以1、3、4、5和6小时的时间推移在实验中测量的以%表示的靶细胞的活力。表格显示了关于微孔中存在的nk细胞的数量和浆细胞的数量,在所选模式中获得的结果。数据显示出明显的相关性,其中浆细胞死亡随着nk细胞的增加而增加,即在图的右下角框中的细胞死亡率更高。在早期阶段(3h)时,效果就已经很明显了。(g)(比较)使用标准cr51释放测定获得的结果。
[0042]
发明详述
[0043]
参考图7a中的框图,本发明涉及一种对含有细胞的多个微孔进行高内涵测定的方法,所述方法包括:
[0044]
a)获取所述多个微孔的至少一个图像;
[0045]
b)在所述图像中,检测多个感兴趣的区域,每个感兴趣的区域对应于单个细胞;
[0046]
c)测量所述感兴趣的区域的直接或衍生的至少一个特性;
[0047]
d)基于一个或多个所述特性选择感兴趣的区域的集合,其中所述一个或多个特性被定义为选择特性;
[0048]
e)从在所选感兴趣的区域的集合中测量的特性推断输出参数,其中所述特性被定义为输出特性,所述输出特性不同于所述选择特性。
[0049]
在优选的形式中,在所述步骤c)中,测量所述感兴趣的区域的至少一个衍生特性和任选的至少一个直接特性,其中所述一个或多个特性是选择特性。
[0050]
在优选形式中,在所述步骤d)中选择所述多个微孔的子集,其中属于所述子集的所述微孔包含基于所述至少一个选择特性选择的感兴趣的区域,并且在所述步骤e)中,输出参数是从在所选感兴趣的区域的集合中测量的特性推断的,其中所述特性被定义为输出特性,所述输出特性不同于所述选择特性,其中所述输出参数是在感兴趣的区域的所述集合中测量的输出特性的处理。
[0051]
在优选的形式中,所述微孔嵌入在包含至少15,000个,或至少18,000个,优选19,200个微孔的板中。
[0052]
所述选择是通过施加纳入标准进行的,其中所述纳入标准包括:
[0053]-从测量的所述直接特性或衍生特性中鉴定一个或多个选择特性;
[0054]-为每个所述选择特性施加阈值或值的范围,所述选择特性必须落入其中。
[0055]
本文中的术语“模式”定义了用于为特定输出参数选择感兴趣的区域的所述集合所采用的纳入标准。
[0056]
在一个优选的实施方案中,在选择所述多个微孔的子集的情况下,选择属于该子集的所述微孔是因为它们包含其中所述至少一个选择特性满足所述纳入标准的感兴趣的区域。
[0057]
在本说明书和权利要求书中,表述“所述感兴趣的区域的直接特性或衍生特性”具有以下所指出的含义。
[0058]
直接特性是与单个感兴趣的区域相关联的特性,即可以通过评估单个感兴趣的区域测量的特性(例如,免疫表型、细胞活力、细胞形态、信号传导活性)。
[0059]
衍生特性是与多个感兴趣的区域相关联的特性,即,为了进行测量,需要评估同一微孔中包含的两个或更多个感兴趣的区域的特性,例如:
[0060]-同一微孔中包含的两个或更多个感兴趣的区域之间的关系特性(例如,细胞间距离);或者
[0061]-感兴趣的区域的共存的特性,例如一种或多种类型的免疫表型;或者
[0062]-包含在同一微孔中的所有感兴趣的区域的累积特性(例如,对于其计算所述累积衍生特性的感兴趣的区域所属的微孔中的细胞数,包含在微孔中的细胞之间的平均距离)。
[0063]
所述直接特性直接从图像分析中获得。所述衍生特性是通过处理直接特性获得
的。在其中纳入标准是免疫表型的一个实施方案中,所述选择特性是直接特性,即免疫表型,并且选择满足纳入标准的感兴趣的区域的集合。
[0064]
仍然维持免疫表型作为纳入标准,在一个实施方案中,在选择所述多个微孔的至少一个子集的情况下,所述选择特性是衍生特性,其中所述衍生特性是共存特性,即通过评估包含在单个微孔中的每个感兴趣的区域的直接免疫表型特性,和通过处理包含在微孔中的每个感兴趣的区域的直接特性,通过推断作为微孔的特殊免疫表型模式的衍生特性(基于这种模式,其将归因于所述多个微孔的子集)产生的特性。
[0065]
作为进一步的示例,细胞间距离是衍生特性,通过处理与包含在同一微孔中的两个感兴趣的区域相关的直接“位置”特性而获得。从所述“细胞间距离”衍生特性的多重性,获得作为进一步关系特性的进一步衍生特性,即包含在围绕所选细胞的给定微孔中的细胞与所述所选细胞之间的平均距离。还衍生了进一步衍生特性,它是包含在给定感兴趣的区域所属的同一微孔中的所有感兴趣的区域的累积特性,即,给定微孔中包含的细胞之间的平均距离。还可以确定从直接特性与关系特性的组合衍生的其他特性。例如,衍生特性“免疫细胞与肿瘤细胞的距离”需要将直接特性“免疫表型”与关系特性“细胞间距离”结合起来。
[0066]
应该注意的是,衍生特性也是感兴趣的区域的特性。属于同一微孔的一些细胞具有相同的关系衍生特性值。属于同一微孔的所有细胞具有相同的累积衍生特性值。例如,包含在同一微孔中的两个细胞具有相同的衍生特性“细胞间距离”值(当这在所述两个细胞之间计算时)。此外,关系特性“包含在围绕由所述所选细胞选择的细胞的给定微孔中的细胞之间的平均距离”对于每个所选细胞具有不同的值,因为对于每个所选细胞,与围绕其的同一微孔中的其他细胞的距离将不同。同样,属于同一微孔的所有细胞都具有相同的累积衍生特性“每个微孔的细胞数”值,这意味着其中放置每个细胞的环境(微孔)的这种特性由每个细胞(即,由每个感兴趣的区域)拥有,属于微孔本身。在这种情况下,或者当讨论累积特性时,对于嵌入相同微孔中的每个感兴趣的区域都相同的是,该特性可以被认为是微孔的特性,这意味着该特性适用于嵌入在所述微孔中的所有感兴趣的区域。
[0067]
感兴趣的区域的所述集合包括:
[0068]-两个或更多个未嵌入同一孔中的感兴趣的区域的子集;和/或
[0069]-同一微孔中包含的两个或更多个感兴趣的区域的子集;和/或
[0070]-同一微孔中包含的所有感兴趣的区域的子集。
[0071]
在优选形式中,感兴趣的区域的所述集合由包含在同一微孔中的所有感兴趣的区域的子集组成,即,感兴趣的区域的所述集合对应于微孔的子集。
[0072]
在一个实施方案中,所述选择特性中的至少一个是共存特性。
[0073]
在一个实施方案中,所述选择特性中的至少一个是同一微孔中包括的所有感兴趣的区域的累积特性。
[0074]
在本说明书和权利要求书中,表述“来自在感兴趣的区域的所选集合中测量的特性的输出参数”将指示在属于所述所选集合的每个感兴趣的区域中测量的输出特性的任何统计处理的结果。“统计处理”是指例如平均值、中位数、均方值等。
[0075]
在其中一个或多个所述选择特性是包括在同一微孔中的所有感兴趣的区域的累积特性的实施方案中,感兴趣的区域的所述集合对应于所述多个微孔的子集并且所述输出
参数是在所述多个微孔的所述子集中测量的输出特性的处理。
[0076]
应当理解,在一个实施方案中,所述选择包括基于第一选择特性对感兴趣的区域的第一集合的选择。随后是在感兴趣的区域的所述第一集合内基于第二选择特性选择感兴趣的区域的子集。所述第一和第二选择特性是独立的直接特性或衍生特性。在优选形式中,感兴趣的区域的所述集合和/或感兴趣的区域的所述子集对应于多个微孔的子集。
[0077]
在另一个实施方案中,所述过程包括第一选择、第二选择和第三或进一步选择。
[0078]
所述至少一个图像是用图像获取装置获取的,该图像获取装置被配置为获取所述多个微孔的至少一个图像。
[0079]
在一个实施方案中,图像分析和处理过程包括以下步骤,在适当的情况下并且纯粹出于解释目的而不以任何方式限制本发明的范围,参考图6:
[0080]-在包含多个微孔的图像中鉴定对应于微孔的区域(图6,小图a);
[0081]-在对应于微孔的区域内检测多个感兴趣的区域,每个感兴趣的区域对应于包含在所述多个微孔中的所述细胞之一(图6,小图b);
[0082]-测量所述感兴趣的区域的至少一个特性(图6,小图c;a列:感兴趣的区域;b、c、d列:直接特性;e、f、g列:衍生特性);
[0083]-基于一个或多个所述特性选择感兴趣的区域的集合(图6,小图d;选择特性的列以灰色突出显示,所选感兴趣的区域的集合以深灰色突出显示);
[0084]-从所述集合中测量的特性推断输出参数(图6,小图d;输出特性被围出)。
[0085]
参考图6,小图d,纳入标准是:特性c=y和特性g=z。输出参数是从特性f推断出来的。被包围在一个圆圈中,与所选感兴趣的区域的集合有关的特性f由此突出显示。在感兴趣的区域的所述集合中测量的所述输出特性f的统计处理的结果是由根据本发明的方法提供的输出参数,代表了所检查的样品的分析中的输出特性f。
[0086]
这里应该注意,为了简单起见,图6c和6d中的图包括有限数量的感兴趣的区域,其中在所述方法的实施中感兴趣的区域有利地非常多。举例来说,在所述多个微孔对应于19,200个微孔的板时,假设平均约20个细胞/微孔,则384,000个感兴趣的区域可用。
[0087]
借助用于图像处理的合适软件产品,由计算机分析获取的图像。这样的软件产品例如是imagej、bioimagexd(p等人,nature methods.2012)、icy(de chaumont f等人,nature methods.2012)、fiji(schindelin j等人,nature methods.2012)、vaa3d(peng h等人,nat biotechnol.2010)、cellprofiler(carpenter ae等人,genome biol.2006)、3d slicer、image slicer、reconstruct(fiala jc.j microsc.2005)、fluorender、imagesurfer、osirix(rosset a等人,j digit imaging.2004)、imod(kremer jr等人,j struct biol[internet].1996)以及其他的(eliceiri kw等人,nature methods.2012)。
[0088]
本领域技术人员可以容易地理解,上述软件产品只是示例性的,并且可以使用此处未明确提及的方法来执行该方法,提供相同类型的结果。
[0089]
在优选的形式中,所述多个微孔嵌入微流体装置中,其中每个微孔与一个或多个微通道流体连通,用于将流体和/或颗粒和/或分子输送到孔中。
[0090]
在一个实施方案中,微孔是倒置开口微孔,即它们是上端和下端均开口的微孔,优选地,所述端在其中存在流体的一个或多个微通道上开口,流体包括细胞或颗粒或分子,或
空气或其他气体。
[0091]
微孔具有在微孔的顶部和底部之间延伸的垂直轴,例如中心轴。在一个实施方案中,所述微孔在被称为上微通道的包含流体的微通道的上端开口,并且在其中存在空气或其他气体的微通道的下端开口。在该实施方案中,插入微通道的流体通过毛细作用填充微孔,而表面张力将流体保持在打开的微孔内,在空气/流体界面处形成弯月面。
[0092]
在一个实施方案中,所述微孔的尺寸被设计成具有等于或大于其直径的高度。
[0093]
在甚至更优选的形式中,所述微孔是申请wo2012072822中描述的类型的微孔。
[0094]
所述细胞根据本领域技术人员已知的方法接种在所述微孔中,并且是同质的(即它们具有相同的免疫表型)或异质的(即具有不同的免疫表型)细胞群。
[0095]
在优选的形式中,所述细胞根据wo2017216739中描述的方法接种。
[0096]
所述细胞在单个步骤中或按顺序接种。举例来说,使用倒置开口微孔,可以加载顺序彼此不同的群体,并且每个群体包含彼此同质的细胞,从而在细胞沉积的体积中产生异质群体。
[0097]
例如,使用直径为70μm的微孔,接种最多20个、最多30个或最多50个细胞/微孔。
[0098]
在一个实施方案中,异质细胞群在单个步骤中接种在微孔的子集上。在进一步的实施方案中,依次执行几个接种过程。例如,进行浓度为c1的群体1的第一次接种和浓度为c2的群体2的第二次接种。在所述浓度c1和c2相等的情况下,接种等体积将导致属于子集的微孔集合中的异质群体,其中1型细胞的数量平均等于2型细胞的数量。相反,细胞将根据分布(通常是泊松分布)存在于微孔内,其看到可变数量的1型和2型细胞。一些孔将只包含1型或2型的细胞,其他将包含两种类型,还有一些可能是空的。通过接种双倍体积的1型群体,将在属于子集的微孔集合中获得异质群体,其中与2型细胞的数量相比,1型细胞的数量平均是2型细胞的数量的两倍。与前一种情况相比,微孔中1型细胞的分布将看到两倍的平均值。
[0099]
在一个实施方案中,所述方法在相同的多个微孔上以连续和重复的时间进行。也就是说,在该实施方案中,获取图像,检测多个感兴趣的区域并且在时间t0以及随后在时间t1、t2、...tn测量至少一个特性。在该实施方案中,测定被定义为动态的,即在连续时间获取同一视野的多个图像(延时成像),并且在时间t0以及随后在时间t1、t2、...tn测量所述至少一个特性返回反映随时间的变化的分析。
[0100]
t0时的所述特性应理解为与t1时的所述特性不同。即,假设测量特性c(pc)、p
ct0
和p
ct1
显然是有明确意图的。
[0101]
结果,在同一测定的执行中,所述输出参数可以从所选感兴趣的区域的集合中的输出特性p
ct1
衍生,其中选择特性是p
ct0
。
[0102]
在进一步的实施方案中,衍生特性是在t0测量的特性和在t1测量的特性之间的变化(例如,差异或比率),反之亦然。
[0103]
在一个实施方案中,当所述细胞保持在所述多个微孔中时,将它们暴露于一种或多种促进或抑制分析的客观效果的试剂,即影响输出参数的试剂。根据本发明的动态方法允许确定所述试剂随时间的影响。
[0104]
举例来说,并参考图8中的表格,对于对应于细胞的每个感兴趣的区域(a列),测量了在t0(第2至20行)时的直接特性“dapi信号强度”、“fitc信号强度”、“cy5信号强度”、“tritc信号强度”、“x轴和y轴上的细胞位置”(b-e、g、h列)和在t1(第21至42行)时的相同特性。还报告了每个细胞所属的微孔(f列)。将b-e、g、h列中提到的所述直接特性和与每个细胞所属的微孔相关的信息相结合,可以计算衍生特性,例如对于每个细胞,可以确定与包含在与所述细胞相同的微孔中的其他细胞的平均距离。
[0105]
特性
[0106]
在以下段落中,列出了一些特性类别,提供了一些允许测量它们的技术实验细节。可以理解,在每个所述过程的下游,包括利用上述计算方法的图像获取和处理步骤,其能够返回与特定特性相关的信息,该信息通常是数字类型的信息。
[0107]
以下列表是说明性的,绝不能解释为限制针对每个特性描述的技术实验方法。给定一个性质,本领域技术人员知道最合适的实验方法来给出其证据。此外,此列表不得解释为限制可能的特性。本领域技术人员知道如何用待根据本发明的方法有效测量的进一步的直接或衍生特性来扩展该列表。
[0108]
可以理解,所述特性可以独立地构成选择特性或输出特性。
[0109]
免疫表型(直接特性)
[0110]
它可以使用本领域已知的方法来确定和/或验证。例如,使用可检测标记物/染料。此类标记物/染料可能对嵌入微孔中的一种或多种亚群具有特异性。在使用特定标记物/染料的情况下,可以选择这些以突出在各种疾病中起作用的细胞群。例如,因为它们负责肿瘤,例如血癌,或者因为它们负责炎症和/或免疫响应。
[0111]
染色可以包括使用多种可检测标记物,例如,细胞可以用与特定靶抗原结合的一抗染色,并且结合一抗或与一抗偶联的分子的二抗可以偶联至可检测标记物。使用间接偶联可以提高信噪比,例如通过减少背景结合和/或通过提供信号放大。
[0112]
染色还可以包括与荧光标记物直接或间接偶联的一抗或二抗。作为非穷举的例子,荧光标记物可以选自:alexa fluor 350、alexa fluor 405、alexa fluor 430、alexa fluor 488、alexa fluor 514、alexa fluor 532、alexa fluor 546、alexa fluor 555、alexa fluor 568、alexa fluor 568 594、alexa fluor 610、alexa fluor 633、alexa fluor 635、alexa fluor 647、alexa fluor 660、alexa fluor 680、alexa fluor 700、alexa fluor 750和alexa fluor 790、异硫氰酸荧光素(fitc)、texas red、sybr green、fluidi dylight、绿色荧光蛋白(gfp)、trit(四甲基罗丹明异硫醇)、nbd(7-硝基苯-2-氧杂-1,3-二唑)、texas red染料、邻苯二甲酸、对苯二甲酸、间苯二甲酸、焦油紫(fast cresyl violet)、甲酚蓝紫、亮甲酚蓝、对氨基苯甲酸、赤藓红、生物素、地高辛、5-羧基-4',5'-二氯-2',7'-二甲氧基荧光素、酞菁、偶氮甲碱、花青(例如,cy3、cy3.5、cy5)、黄嘌呤、琥珀酰荧光素、n,n-二乙基-4-(5'-偶氮苯三唑)-苯胺、氨基吖啶、brilliant violet 421、藻红蛋白(pe)。
[0113]
细胞数/微孔(衍生特性,同一微孔中包含的所有感兴趣的区域的累积)
[0114]
在接种前或在接种在微孔中时,细胞用染料(例如荧光细胞定位标记物7-氨基-4-氯甲基香豆素)染色。
[0115]
细胞间距离(与衍生的关系特性相关的直接特性)
[0116]
在接种之前或之后,细胞被染色,可能使用根据免疫表型并且通过上述图像处理方法区分它们的染色,获得每个细胞的直接特性,其是所述细胞在空间中的位置。将与感兴
趣的区域相关联的所述直接特性“位置”和与不同感兴趣的区域相关联的所述直接特性“位置”组合,获得所需关系的衍生特性,即细胞间距离。
[0117]
细胞活力(直接特性)
[0118]
使用已知的标记物/染料,其特异性识别处于细胞周期的特定阶段的细胞。例如,这些包括针对具有非完整膜的细胞的选择性标记物或针对处于细胞死亡或早期凋亡的晚期阶段的细胞的选择性标记物。例如,可以使用针对细胞色素c的抗体,导致dna更新,或导致细胞存活/死亡的染料,例如碘化丙啶(pi)和钙黄绿素,或导致细胞增殖的染料,或细胞凋亡标记物,例如膜联蛋白v,或通过测量某些蛋白质和酶(例如半胱天冬酶)的信号传导和释放活性而引起细胞凋亡的染料。优选地,将所述标记物/染料添加到微孔中的细胞中。
[0119]
信号传导活动(直接特性)
[0120]
优选地已经在微孔中,用标记物标记细胞以例如突出细胞信号传导,例如能够突出蛋白质的磷酸化或细胞质中钙离子的释放的抗体。在一个实施方案中,“信号强度”特性通过与所用标记物相关联的在t0的延时成像和在t1、t2、...tn的“信号强度”来确定,并且选择具有所述“信号强度”特性随着时间超过某个阈值的变化的细胞。
[0121]
细胞形态(直接特性)
[0122]
通过上述计算方法获取和处理可能根据现有技术中描述和已知的方法之一染色的细胞的图像,返回有关细胞形态的信息。
[0123]
在优选实施方案中,所述选择基于至少2个选择特性,或至少3个,或至少4个,或至少5个选择特性进行。
[0124]
一个或多个所述选择特性导致选择感兴趣的区域的集合,在优选形式中,其对应于将从中衍生输出参数的微孔子集。
[0125]
明确定义的模式允许优化测定结果。
[0126]
本领域技术人员知道如何建立最适合感兴趣的输出参数的模式。
[0127]
举例来说,在进行测定以测量样品中的细胞死亡的情况下,本领域技术人员知道细胞活力受到处于分离的微环境中而不是其他相邻细胞的负面影响,建立至少一种所述选择特性是细胞数/微孔,对该特性施加最小阈值x。因此,模式将是:微孔细胞数》x。结果将衍生自从满足已建立模式的微孔集合推断输出参数。
[0128]
在一个实施方案中,使用根据本发明的方法有利地建立所述模式,以使它们对于进行测定的特定样品是最佳的。例如,在测定中,使用一个或多个对照子集,其中优化了输出参数,随后这些对照值也用于对暴露于治疗的亚组进行分类。例如,在含有未暴露于任何试剂的细胞的多个微孔中,确定每个微孔的最小细胞数,这允许获得24小时的最小死亡率(t0时的细胞数)。在t0时的选择特性“细胞数”的阈值用于选择暴露于药物的感兴趣的区域的集合,和因此暴露于药物的微孔的子集,其中将读取输出特性,然后将推断输出参数,即24小时的死亡率(t
24h
的细胞数)。即,在t
24h
的输出参数“细胞数”将是在属于暴露于所选药物的微孔的子集的每个微孔(因为它们满足模式,即在t0时显示高于上述定义的阈值的许多细胞)中测量的t
24h
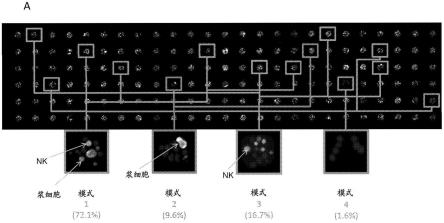
的输出特性“细胞数”的统计处理的结果,在特定情况下是平均值。因此,该模式基于特定样品的生物学特征进行了优化。
[0129]
在另一方面,参考图10,要求保护一种用于对含有细胞的多个微孔进行高内涵测定的系统(1),所述系统包括:
[0130]-图像获取装置(2),其被配置为获取所述多个微孔(3)的至少一个图像;和
[0131]-数据处理单元(4),其被配置为:
[0132]-在所述图像中,检测多个感兴趣的区域,每个感兴趣的区域对应于单个细胞;
[0133]-测量所述感兴趣的区域的至少一个直接或衍生的特性;
[0134]-基于一个或多个所述特性选择感兴趣的区域的集合,其中所述一个或多个特性被定义为选择特性;
[0135]-从在所选感兴趣的区域的集合中测量的特性推断输出参数,其中所述特性被定义为输出特性,所述输出特性不同于所述选择特性。
[0136]
在优选的形式中,所述处理单元被配置为测量所述感兴趣的区域的至少一个衍生特性和任选的至少一个直接特性,其中所述一个或多个特性是选择特性;
[0137]
在优选形式中,所述处理单元被配置为选择所述多个微孔的子集,其中属于所述子集的所述微孔包含基于所述至少一个选择特性选择的感兴趣的区域。
[0138]
在优选形式中,所述处理单元被配置为从在所选感兴趣的区域的集合中测量的特性推断输出参数,其中所述特性被定义为输出特性,所述输出特性不同于所述选择特性,其中所述输出参数是在感兴趣的区域的所述集合中测量的输出特性的处理。
[0139]
在另一方面,要求保护一种用于对含有细胞的多个微孔进行高内涵测定的计算机程序,所述计算机程序包括指令,当所述程序由数据处理单元执行时,所述指令使所述处理单元执行以下步骤:
[0140]-在所述多个微孔的至少一个图像中,检测多个感兴趣的区域,每个感兴趣的区域对应于单个细胞;
[0141]-测量所述感兴趣的区域的至少一个特性;
[0142]-基于一个或多个所述特性选择感兴趣的区域的集合,其中所述一个或多个特性被定义为选择特性;
[0143]-从在所选感兴趣的区域的集合中测量的特性推断输出参数,其中所述特性被定义为输出特性,所述输出特性不同于所述选择特性。
[0144]
在优选的形式中,所述计算机程序包括指令,当所述程序由数据处理单元执行时,所述指令使处理单元执行以下步骤:
[0145]-测量所述感兴趣的区域的至少一个衍生特性和任选的至少一个直接特性,其中所述一个或多个特性是选择特性;
[0146]-选择所述多个微孔的子集,其中属于所述子集的所述微孔包含基于所述至少一个选择特性选择的感兴趣的区域;
[0147]-从在所选感兴趣的区域的集合中测量的特性推断输出参数,其中所述特性被定义为输出特性,所述输出特性不同于所述选择特性,其中所述输出参数是在感兴趣的区域的所述集合中测量的输出特性的处理。
[0148]
实施方案
[0149]
在一个实施方案中,参考图7b中的框图,所述选择是基于选择特性“微孔中包含的细胞数”t0执行的,并且所述输出参数是从在对应于其中所述选择特性大于在t0时的阈值的微孔子集的感兴趣的区域的集合中测量的在t1时的“细胞活力”输出特性推断的。在该实施方案中,在将细胞暴露于影响细胞活力的试剂之后,在晚于用于测量所述选择特性的时间
t0的时间t1测量所述输出特性。假设所述细胞的生长的最佳条件需要在微孔中具有至少10个细胞,因为具有少于10个细胞会导致微孔中不可忽略的细胞死亡,包含多于10个细胞的这些微孔所属于的微孔子集将被选择。所述输出参数是从所述子集推断的。如此获得的细胞活力数据是“清理”数据,即不受含有少于10个细胞的那些孔中的读数(其被认为是异常读数,因为它们伴随着非依赖于细胞暴露于的试剂而是与其实验条件相关联的高细胞死亡)的影响。
[0150]
在另一个实施方案中,参考图7c中的框图,所述选择分三个步骤进行。
[0151]
在第一步中,基于感兴趣的区域在t0时的直接特性“免疫表型c
t”选择感兴趣的区域的第一集合。感兴趣的区域的所述第一集合对应于包括其中存在满足所述选择特性的感兴趣的区域或者其中存在至少一个在t0时具有免疫表型c
t
的细胞的那些微孔的多个微孔的子集。
[0152]
在第二步中,在多个微孔的所述子集中,基于直接特性选择第二子集。
[0153]
在t0时感兴趣的区域的“免疫表型c
e”,所述第二子集因此将包括具有至少一个具有免疫表型c
t
的细胞和至少一个在t0时具有免疫表型ce的细胞的那些微孔。
[0154]
在第三步中,在所述第二子集中,基于感兴趣的区域在t0时的直接特性“免疫表型c
t”选择第三子集,所述第三子集因此将包括在也包括具有免疫表型ce的细胞的微孔中发现的具有免疫表型c
t
的细胞。
[0155]
然后从在所选感兴趣的区域的所述第三子集中测量的在t1时的特性“细胞活力”推断输出参数。
[0156]
也就是说,所述输出参数仅与包含在微孔中的具有免疫表型c
t
的细胞相关地推断,所述微孔在t0时看到具有免疫表型ce的细胞的同时存在。在该实施方案中,在将细胞暴露于影响细胞c
t
的活力的药剂(所述药剂的活性由细胞ce介导)之后,在晚于测量所述选择特性的时间t0的时间t1提供所述输出参数。
[0157]
该实施方案特别有利于进行测量作为免疫疗法的试剂(即其通过促进免疫系统细胞对所述靶标的活性而作用于靶标)的功效的测定。根据本发明的方法有利地允许从结果中排除将不可避免地返回阴性数据(即对免疫治疗剂缺乏响应)的不包含免疫系统细胞的微孔,其中所述缺乏响应不会与被分析的化合物的无效性有关,但与不适合分析本身的样品有关,即如果数据为阳性,则其将与药物对靶标的直接作用的机制有关而不通过免疫系统的细胞介导。
[0158]
在进一步的实施方案中,所述输出参数仅关于包含在微孔中的具有免疫表型c
t
的细胞推断,所述微孔在t0时看到具有免疫表型ce的细胞的同时存在并且其与具有免疫表型c
t
的细胞的距离小于预定阈值。当待评估功效的药剂涉及具有免疫表型c
t
和ce的细胞之间的接触或高度接近从而药剂可以发挥其作用时,该实施方案特别有利。
[0159]
在每个被分析的细胞具有关于测定效果的潜在激动剂或拮抗剂作用的情况下,有利地,所述选择特性是关系特性,例如细胞间距离、信号传导活性。举例来说,当免疫系统的细胞关于肿瘤细胞的活力具有潜在的拮抗作用时,在基于共存的“肿瘤免疫表型”和“免疫系统细胞免疫表型”以包括免疫系统细胞和肿瘤细胞的衍生选择特性以及具有强制肿瘤细胞和免疫系统细胞处于一定距离以允许它们之间的相互作用的模式的衍生选择特性“细胞间距离”进行选择后,对根据本发明的方法鉴定的感兴趣的区域的集合有效地进行测定。在
一个实施方案中,该模式强制上述距离为使得在免疫细胞例如自然杀伤细胞(nk)和靶细胞例如肿瘤细胞之间产生接触。在另一个实施方案中,该模式强制上述距离等于或大于允许免疫细胞与靶细胞之间接触的距离,因为功能效应是由分泌产物产生的,例如由t淋巴细胞产生的细胞因子,其即使在没有接触的情况下也对靶细胞产生影响,只要两种类型的细胞之间的距离足以确保免疫细胞分泌的产物的浓度相当大以产生所需的效果。
[0160]
在一个实施方案中,免疫细胞在分析之前通过已知方法进行修饰,例如car-t细胞、用于自体移植的nk细胞,本文所述的分析旨在验证修饰的细胞产生对靶细胞的预期效果的有效能力。
[0161]
同样,在t0和t1、在所述多个微孔中添加一种或多种试剂之前和之后评估的细胞间距离允许验证由于一种或多种试剂引起的细胞间相互作用的变化。
[0162]
例如,在另一个实施方案中,首先将多个微孔分成同质的亚组,例如2、或3、或4、或16、或32、或64、或96、或128、或384个亚组,并且在每个所述亚组上,测试了不同的治疗,其中每种治疗由特定剂量的特定药剂定义。属于每个亚组的微孔针对在t1时的直接选择特性“免疫表型”进行选择,并且输出参数是从在所选感兴趣的区域的集合中测量的特性“细胞活力”推断的。根据本发明的方法,能够在含有19,200个微孔的板上实施和允许自动分析允许在每个实验板中测试多种不同的条件,例如多达16个或多达32个不同的实验条件,其中数百或数千个微孔专用于每个实验条件。在一个实施方案中,对于每个条件,板包含1,200个孔,并且多个微孔暴露于2或3或4或16或32或64或96或128或384个不同的条件。对属于同一子集的每个微孔中获得的数据使用统计分析进行处理,以返回分析结果。举例来说,在测试所测试的试剂在肿瘤细胞中引起细胞死亡的能力的情况下,输出参数是从在每个微孔子集和其中最大程度的细胞死亡指示最合适的试剂的子集中测量的特性“细胞活力”推断的,其中最合适的试剂是指可以最有效地导致肿瘤细胞在所述细胞所取自的患者中的体内细胞死亡的试剂,或者更一般地说,对测试的生物样品产生预期效果的试剂,排除了除药物本身作用之外的可能导致从其推断出预期效果的输出参数变化的原因。每种实验条件的微孔数量允许维持高统计显著性,即使在根据前述选择特性进行选择之后,实际经受分析的孔的数量显著减少。因此,大量微孔的可用性代表了支持本文讨论的方法的基本要求,其中实际的孔数与分析类型严格相关。为了确保统计显著性,必须在足够数量的样品上读取一个或多个输出参数。通常,足够数量的样品至少为30、100或300。
[0163]
微孔子集的选择有利地允许测试微孔子集中的效果,其中所述选择是基于模式(即所考虑的选择特性的同质特征)进行的。
[0164]
在一个实施方案中,在未暴露于任何试剂的对照子集中确定模式,以确保对照样品本身的最佳功能特征。随后,所述模式也被施加于经受不同体外处理或用可能以不同剂量的不同治疗剂处理的子集。获得所述最佳功能特征,例如,通过最大化细胞活力、最大化细胞增殖率,获得与被分析的细胞所提取自的身体中的预期增殖率相似的细胞增殖率,获得细胞组成,即具有不同免疫表型或属于不同细胞群的细胞之间的相关比率,类似于在所述生物体中观察到的比率。
[0165]
在进一步的实施方案中,在希望将响应于试剂的信号传导确定为选择参数的情况下,在随后的时间通过延时成像观察与标记物相关联的信号的强度。一旦定义了阈值,就选择微孔子集,其中一个或多个效应器在存在或不存在某种试剂的情况下产生了功能效应。
[0166]
优势
[0167]
本发明的方法在微孔中进行,并且通过本文所述的数据获取和处理方法,方便地允许观察和处理与每个微孔中包含的每个细胞有关的所有信息。这意味着拥有生态位(niche)的所有信息,其中在本文生态位是指细胞群所占据的微环境。有利地,该信息允许定义模式,因此在进行测定的环境中评估输出参数。
[0168]
该方法有利地允许对清除了数据的样品进行分析,这些数据会引入相对于分析的测量的偏差或会在分析中引入额外因素,从而增加结果的变异性。因此,根据本发明的方法允许将那些微孔以及可能由于与待进行的测定无关的原因被鉴定为异常值的那些细胞排除在测定之外。由于所述选择是由于对上述定义最佳的模式进行的,因此对样品进行的所述选择是绝对受控和客观的,并且使体外/体内相关性最大化。
[0169]
任选地,一旦选择了感兴趣的微孔,该方法允许在细胞水平上进行进一步选择,从而排除在微孔内表现为异常值的细胞,从而允许分析的进一步精炼。
[0170]
对根据本发明的方法选择的微孔子集进行的测定(通过在足够大量的微孔上进行分析来确保分析的充分平行性)尽管应用了选择标准(这减少了分析中实际考虑的数据数量)但仍产生具有高水平统计显著性的结果。例如,当测定涉及评估导致肿瘤细胞死亡的试剂时,在包含几个相互远离的细胞的微孔中进行测定在某些情况下将不可避免地导致读取对细胞活力的影响,其中所述影响根本不指示测试的试剂的活性,而是与被检查的特定样品所暴露于并且对样品引入了不是由于药物引起的人为的毒性影响的实验体外条件有关。这种人为影响,如果不从分析中消除,将导致关于药物的实际功效的测量的错误结论。
[0171]
此外,根据本发明的方法允许以自动化方式测量和处理所述特性,处理所获取的图像和处理通过计算机获得的数据。
[0172]
这些特征的组合确保测试的样品数量能够确保统计上显著的数据。
[0173]
因此,本发明提供了允许在研究中使用生理学相关的多群细胞样品的方法,其允许基于在单细胞水平上的准确分析定义例如基于药物的治疗的生物效应,从而允许以快速和准确的离体分析预测将被证明在分析的受试者中最有效的药物。
[0174]
以下实施例仅用于说明本发明,并不以任何方式限制本发明,其范围由权利要求限定。
实施例
[0175]
实施例1:细胞死亡对照
[0176]
将hl-60细胞系的细胞接种在具有19,200个微孔的微流体装置的倒置开口微孔中的培养基中。在t0时,细胞用在整个实验期间保持在培养基中的细胞死亡标记物(碘化丙啶,pi)和用荧光细胞定位标记物(7-氨基-4-氯甲基香豆素)标记。然后在24小时孵育(t
24
)后获取图像,并测量感兴趣的区域中的一系列特性。
[0177]
此实施例中使用的选择特性是:
[0178]-累积衍生特性:每个微孔中包含的细胞数;
[0179]-衍生关系特性:每个细胞与属于同一微孔的其他细胞的平均距离。
[0180]
推断的输出参数是细胞死亡率(表示为死细胞(即pi标记物发出的荧光信号强度超过某个阈值的细胞)的百分比)。
[0181]
参考图1,为选择特性“每孔的细胞数”鉴定类别,特别是针对等于2-4、5-6、7-8、9-10、11-12、13-17、15-17个细胞/微孔的值确定7个类别,数据报告在图1中图的x轴上。在每个孔内,然后针对从每个细胞与同一孔中存在的细胞之间的距离的平均值获得的关系衍生的选择特性“每个细胞与同一孔中的细胞的平均距离”进行分类。多个微孔因此被分类为包括接触的细胞的子集,其中同一微孔的细胞的平均距离在0和2d之间,其中d表示被分析的细胞的平均直径,和具有未接触的细胞和看到同一微孔的细胞逐渐越来越远(其中平均距离在2和2.5d之间,在2.5和2.7d之间,在2.7和3d之间,大于3d)的子集,数据在图1中图的y轴上报告。
[0182]
输出参数,即细胞死亡率,在每个上述子集中推断。所述输出参数在图1中用灰度表示。
[0183]
令人惊讶的是,观察到细胞死亡率相对于两种施加的选择特性具有梯度行为。事实上,在与包含较少细胞的微孔子集相对应的感兴趣的区域的集合中和/或在其中距同一微孔的细胞的平均距离更高的感兴趣的区域的集合中观察到增加的细胞死亡(图中更暗的颜色)。在包含相同数量的细胞的情况下,对于那些远离其他细胞的细胞来说,细胞死亡实际上更大。
[0184]
通过定义作为可容忍的人工效应被接受的最大死亡率,本实施例中的测定允许随后和为了后续分析的目的定义最佳模式,建立选择特性“细胞数/微孔”的阈值”和特性“平均细胞间距离”的阈值,其中所述阈值是允许将死亡率保持在容许限度内的那些。
[0185]
举例来说,假设容许限度是10%的最大死亡率,满足此标准的微孔的子集是图1a中用符号(
×
)突出显示的那些。因此,鉴定感兴趣的微孔子集的模式由以下关系定义:
[0186]
(n≥9和p≤3d)或(n≥5和n≤8和p≤2.7d)或(p≤2d)
[0187]
用n表示特性“每个微孔的细胞数”,用p表示特性“平均细胞间距离”。
[0188]
如上所述,该模式方便地应用于对影响细胞活力的试剂的响应测定的执行中,如下面的实施例2中所示。因此,在剂量响应分析中,参考分析通常在对照(例如样品保持在最佳条件中以确保最大活力)上并且在不存在从其确定所述模式的试剂的情况下进行。分析也在其中看到试剂以一个或多个剂量施用的其他条件下进行,其中药物功效的分析是在基于由在对照上的所述参考分析定义的模式鉴定的感兴趣的区域的子集上进行的。
[0189]
实施例2:药剂的功效分析
[0190]
将hl-60细胞系的细胞接种在具有19,200个微孔的微流体装置的倒置开口微孔中的培养基中,并暴露于3种不同浓度(低、中、高)的flai-5:氟达拉滨(fl) ara-c(a) 伊达比星(i)的处理。添加10mm过氧化氢(h2o2)作为阳性对照(对照 ),这种试剂肯定能够在hl-60细胞中引起高度细胞死亡。在t0时,细胞用在整个实验期间保持在培养基中的细胞死亡标记物(pi)和用荧光细胞定位标记物(7-氨基-4-氯甲基香豆素)进行标记。在t0和t
24
测量特性。
[0191]
此实施例中用作选择特性的特性是:
[0192]-衍生特性:t0时每个微孔中包含的细胞数。
[0193]
输出参数是t
24h
时的细胞死亡率,表示为死细胞的百分比,即pi标记物发出的荧光信号强度超过某个阈值的细胞。
[0194]
参考图2,针对t0处的选择特性“每孔的细胞数”选择类别,特别地,针对等于1、2、
3、4、5、6、7、8、9、10、11、12或超过12个细胞/微孔的值选择类别。数据显示在图2中的x轴上。
[0195]
输出参数,即细胞死亡率,被推断到如上分类的微孔子集中。
[0196]
应该注意的是,在对照样品(即未暴露于试剂)中,高于阈值的细胞死亡仅在其中每个微孔的细胞数小于或等于8的那些子集中测量,如图2的图中对照
–
线上的灰度所表示的。
[0197]
图2所示的数据表明,通过仅选择具有低基本死亡率的微孔子集,即选择每个微孔具有大于8的细胞含量的那些微孔,药物的功效百分比大约等于80%,测量为处理样品中的死细胞与对照的百分比。在含量高达7个细胞/孔的微孔子集(即由于根据本发明的方法而被排除在测定之外的那些)中,功效百分比将反而等于约50%,因为较高的基础死亡率百分比会掩盖部分药物效应。
[0198]
结果表明根据本发明的方法如何允许获得稳健的数据,从处理中排除将返回人工数据、受外部或环境因素影响但在任何情况下与进行的分析无关的微孔子集。
[0199]
实施例3:免疫治疗功效分析
[0200]
提供来自患有多发性骨髓瘤的个体的血液样品。这些样品接种在微孔中。该测定中使用的选择特性是:
[0201]-直接特性:“cd38免疫表型”=肿瘤细胞,“cd16-cd56免疫表型”=免疫细胞;
[0202]-共存的衍生特性:免疫细胞和肿瘤细胞在同一微孔中的共定位。
[0203]
选择微孔子集,其中免疫系统细胞(nk细胞)与cd38 肿瘤细胞非常接近。
[0204]
将多个微孔暴露于抗cd38试剂并推断输出参数,该参数是在所选感兴趣的区域的集合中(即在具有与nk细胞的共定位的微孔中发现的肿瘤细胞中)测量的由所述试剂引起的死亡率。这种方法允许以高精度执行adcc测定(抗体依赖性细胞毒性),即限于存在两种类型的感兴趣的细胞的共定位时的微孔。
[0205]
在图9中获得和报告的数据表明,与在总体细胞群(c列)上获得的平均响应相比,抗cd38试剂的活性在包含与肿瘤细胞共定位的免疫系统细胞的微孔子集中(d列)更大。
[0206]
同样在这种情况下,去除偏差数据或将噪声影响引入测量,例如没有两种细胞类型的共定位的孔,允许实现治疗的有效功效和患者特异性免疫系统细胞的活性或适应性水平的更准确的测量。在特定情况下,观察到70%的患者nk细胞一旦受到药物刺激,就有能力导致接触的靶细胞的细胞死亡。
[0207]
可以在同一实验系统中对药物的功效进行进一步的分析和评估。例如,在存在抗cd38药物的情况下,选择不包含nk细胞但仅包含cd38 细胞的微孔子集允许评估药物对靶细胞引起的而不是由nk细胞介导的直接细胞毒性效应作为输出参数(b列)。
[0208]
通过选择包含与nk细胞共定位的cd38 肿瘤细胞的微孔亚组,在没有抗cd38药物的情况下,可以测量nk细胞对肿瘤细胞的自发活性(a列)。
[0209]
最后,随着nk细胞和肿瘤靶标之间距离的变化,可以进行进一步评估以突出显示药物活性,在选择特性中添加衍生特性“肿瘤细胞距nk细胞的距离”。
[0210]
值得注意的是,在获得了图6中小图c的完整特性组后,可以通过独立选择选择特性和输出特性、处理可用数据来进行此处描述的评估和本领域技术人员想要进行的其他评估,如图6中小图d所示。
[0211]
实施例4:微孔中异质细胞群的共定位的控制
[0212]
为了最大化布置具有至少一种a型细胞和一种b型细胞的共定位的微孔的概率,本文定义了不同的方法,详述如下。
[0213]
出于以下实施例的目的,假定以下定义:
[0214]
r1=初始细胞群中效应细胞(例如免疫系统细胞)与总细胞的比率。
[0215]
r2=初始细胞群中靶细胞(例如肿瘤细胞)与总细胞的比率。
[0216]
e:t=效应细胞与总细胞的比率。
[0217]
c=共培养物的浓度。
[0218]
实施例4a
[0219]
在分离自患者的样品上,分成两管,进行第一富集步骤,在第一管中获得等于约100%的r1,在第二管中获得等于约100%的r2。
[0220]
在这样做时,可以确定通过将两个管的已知量的内容物混合在一起获得的e:t,因此可以定义c以获得每个微孔的所需平均细胞数。
[0221]
理论上,在使用2个纯群体的情况下,即r1和r2大约等于100%,通过顺序接种2个群体,如果假设平均10个细胞/微孔,可以获得接近100%的共定位概率(图3a,理论图)。
[0222]
在如上所述富集的nk细胞和肿瘤细胞上获得的实验数据以充分逼近证实了预期的趋势(图3b,实验数据)。
[0223]
实施例4b
[0224]
被分析的样品包含没有任何富集的以不同频率从患者分离的pbmc(外周血单核细胞)中的效应细胞(例如,在分析的8个样品中,r1=5-20%)。
[0225]
肿瘤细胞被富集,或者可选择地使用细胞系(r2~100%)。
[0226]
最优e:t根据概率论是已知的
[0227]
效应细胞和靶细胞依次接种。假设平均有10个细胞/孔,效应细胞/靶细胞共定位的概率为30%至70%。特别是,如图4中的图所示,当r1=5时,共定位的概率为30%,当r1=20%时,概率上升到70%。该图还显示,获得最大共定位的每个微孔的理想细胞数为约10个细胞/微孔。每个条件有1,200个微孔,还考虑了在30%的极限条件下微孔的减少,由于微孔的复制,保持了良好的统计显著性。
[0228]
实施例4c
[0229]
对于该测试,nk效应细胞以不同频率(例如,r1=5-20%)从患者分离的pbmc中获得。
[0230]
肿瘤细胞在同一患者的pbmc中也是可变频率的。
[0231]
在这种情况下,即通过使用从患者中提取的包含5-20%的感兴趣的效应细胞和可变范围的肿瘤细胞的单个群体,就共定位概率而言,可以获得非常不同的情况。一些例子表明,以充分逼近达到通过理论计算预测的值。两个细胞群的频率范围的最小可用极值取决于可用微孔的数量和所需的统计功效。
[0232]
举例来说,图5中的图显示了观察到的共定位频率,随着细胞数/微孔的变化,r2=50%或r2=100%。
[0233]
在真实案例中,受试者a显示r1=17.3和r2=28.1。理论计算导致估计57.2%的微孔中存在共定位。实验数据导致在48.1%的微孔中观察到共定位。在另一个实验案例中,受试者b显示r1=14.2和r2=10.0。理论计算导致估计56%的微孔中存在共定位。实验数据导
致在56.2%的微孔中观察到共定位。
[0234]
实施例5:对来自多发性骨髓瘤患者的细胞的测定
[0235]
edta骨髓样品收集自13名多发性骨髓瘤患者(mm,7例新发和6例复发)。通过密度离心(ficoll-pacque;merck)处理8个原始样品以获得单核细胞,同时保留效应(e)和靶(t)细胞(即分别为nk和浆细胞)的原始组成。用与磁珠偶联的cd138抗体(miltenyi biotec)对5个样品进行处理以获得白细胞群(wbc),该细胞群包含nk细胞并耗尽浆细胞。
[0236]
所得细胞与作为靶细胞的u-266或nci-h929细胞系共培养。u-266细胞在37℃和5%co2下在补充有10%胎牛血清(sigma-aldrich)、1%l-谷氨酰胺(sigma-aldrich)和1%青霉素/链霉素混合物(sigma-aldrich)的1640rpmi培养基(sigma-aldrich)中保持生长。nci-h929细胞在37℃和5%co2下在混合有20%胎牛血清(sigma-aldrich)、1%l-谷氨酰胺(sigma-aldrich)、1%青霉素/链霉素混合物(sigma-aldrich)和1%丙酮酸钠(merck)的1640rpmi培养基(sigma-aldrich)中培养。
[0237]
来自原始样品的细胞用cmac(thermo fisher scientific)染色,用作细胞示踪剂。在共培养实验中,白细胞和靶细胞(u-266或ncih929)分别用calcein am(thermo fisher scientific)和cmac染色。nk细胞(效应细胞,e)和浆细胞(靶细胞,t)分别使用bv421小鼠抗人cd16/cd56(bd biosciences)和af647小鼠抗人cd138(biorad)荧光抗体进行标记。碘化丙啶(pi,thermo fisher scientific)用作细胞毒性标记物。
[0238]
细胞共定位的统计模型
[0239]
创建了一个统计模型来定义最佳实验设置,其产生最大数量的包含所需的效应器/靶标共定位模式(共存的衍生选择特性)的微孔,由效应器/靶标共定位因子e/t
cf
(其是同一微孔中e与t的比率)定义。
[0240]
该模型考虑了影响e/t
cf
因子的四个参数:
[0241]
1)初始效应器/靶标混合比(e:t);
[0242]
2)细胞的总浓度(c);
[0243]
3)效应细胞与输入细胞群之间的比率(r1)和4)靶细胞与输入细胞群之间的比率(r2)。
[0244]
参数r1和r2仅取决于样品的类型(例如,细胞系、患者原始样品),而e:t和c通常可以由用户修改以最大化微孔矩阵中感兴趣的特定模型的频率。对于e细胞和t细胞都是患者的原始样品细胞的实验,e:t不能修改,只能优化c。
[0245]
细胞接种和药物暴露
[0246]
将来自原代或共培养样品的细胞接种在96孔板中,最终浓度为2x105个细胞/孔,具有可变的e:t比率。此外,e:t比率为1:0(仅效应细胞)和0:1(仅靶细胞)的条件用作对照。使用机器人微流体系统,将细胞装载到微流体装置中并捕获在微孔中。达雷妥尤单抗单克隆抗体(抗cd38)以3个剂量使用,通过不同的微通道(0.1μg/ml、1μg/ml和10μg/ml)施用,而没有药物的另一个微通道用作对照。将药物稀释在与10或20%胎牛血清(sigma-aldrich)、1%l-谷氨酰胺(sigma-aldrich)、1%青霉素/链霉素混合物(sigma-aldrich)混合的rpmi 1640培养基(sigma-aldrich)中。每个实验都在荧光显微术中进行长达12小时的延时分析。
[0247]
icnp图像和数据分析
[0248]
icnp是由大量所述微孔的可用性实现的分析方法,基于随机创建大量异质细胞簇
和然后将细胞分类和分析成共有相似细胞间相互作用模式的细胞集群的特定组(图11a)。通过根据本发明的方法可获得的大量集群(在此具体实施例中为19,200)允许在单个实验中鉴定甚至相对罕见的模式或评估多个相互作用模式,同时保持良好的统计显著性。在本实施例中,icnp分析经过优化以进行adcc测定(抗体依赖性细胞毒性),以评估nk细胞在抗cd38(达雷妥尤单抗)刺激下对抗肿瘤细胞系和原发性肿瘤细胞的效力。
[0249]
然后获取所述多个微孔的图像,并使用检测算法获取感兴趣的区域,其中每个感兴趣的区域对应于单个细胞,对于每个所述感兴趣的区域,然后测量包括定位、每个荧光通道中的某些标记物的强度、细胞面积、重心位置和形态的特性。在不同的和随后的时间(在这种情况下,在t=0h、t=1h、t=2h、t=4h、t=12h时)收集与每个所述特性相关的数据并存储在数据库中。
[0250]
然后基于所述特性选择所述多个微孔的子集,其中所述选择基于4个特定的共定位模式,如图11a所示。每个模式的特征在于e/t
cf
值,来自特定数量的e细胞和特定数量的t细胞。因此,对于微流体装置的每个通道,和在同一个细胞池上,评估多个e/t共定位模式。
[0251]
此外,一些微孔还起到内部对照的作用。例如,在用药物刺激的微通道中仅包含靶细胞的孔允许评估由药物引起的直接细胞毒性。
[0252]
对所选择的所述多个微孔的子集,通过基于免疫表型、活力和空间信息评估特定微孔子集中的细胞间相互作用模型,在感兴趣的区域的水平上进行第二分类。在此分类中,关键步骤是评估同一微孔中包含的感兴趣的区域之间的距离和接触。此信息(图11b)来源于被评估的每对感兴趣的区域的中心和半径r的坐标(x,y)。半径是指与感兴趣的区域具有相同面积的圆形对象,即分析中的单个细胞。
[0253]
出于该方法的目的,如果d≤dist'(x1,y1),(x2,y2)/-r1-r2
–
tol,则将一对细胞定义为“接触”,
[0254]
其中dist((x1,y1),(x2,y2))是两个中心之间的距离d,r1和r2是两个感兴趣的区域的半径,tol是公差值,此处设置为4μm。例如,在同一微孔中,基于与免疫细胞的距离对靶细胞进行分类,从而允许鉴定与免疫细胞接触的那些靶细胞或位于距效应细胞一定距离内的那些靶细胞。
[0255]
该方法允许评估nk细胞的效力(即对肿瘤细胞造成的细胞介导的细胞毒性)如何随着与cd138 细胞的距离而变化。
[0256]
具体而言,图11a中所示的4个所选模式是:模式1)包含nk和浆细胞的微孔(72.1%),模式2)仅浆细胞(9.6%),模式3)仅nk细胞(16.7%),模式4)没有感兴趣的细胞(1.6%)。
[0257]
所述微孔子集的选择有利地允许nk介导的细胞毒性的靶向研究,其中该研究仅在针对模式1选择的微孔子集上进行。此外,根据本发明的方法的关键优点在于对于某个实验评估特定共定位模式的可能性。
[0258]
图11c显示了从实验的分析得到的热图,其中分析了nk和u-266细胞的20种不同的共定位模式,热图的每个框都与一个模式相关。将细胞暴露于抗cd38抗体,并且每种模式在同一微孔中包含的e(nk)细胞和t细胞(u-266细胞)的数量不同,因此允许效应细胞:靶标比率对待评估的靶细胞的死亡的影响。用根据本发明的方法在微孔中评估的浆细胞死亡率揭示了靶细胞死亡在具有较高e/t
cf
比率的微孔子集中较高。该数据可以叠加在使用本领域已
知方法(即在培养板中)获得的数据上,如通过cr51释放测定获得的比较数据所示(图11g),其关键优势是能够同时测量多种模式并具有单个感兴趣的区域的分辨率。
[0259]
在对微孔子集进行分类后,对在时间推移中获得的图像进行单细胞水平的详细分析。根据本发明的方法允许研究通过同质相互作用模式对数据进行分组的细胞“网络化”的效果。图11d显示了经分析以详细研究nk细胞和浆细胞之间的相互作用的图像的示例。图像中的每一行对应不同的条件:抗cd38对属于具有模式2(即没有效应细胞(nk-))的微孔的靶细胞的直接作用;具有模式1、没有抗cd38刺激(ctrl-)或具有nk和浆细胞之间的接触的抗cd38刺激(抗cd38)的微孔中靶细胞和效应细胞之间自发相互作用的影响。具有模式1(抗cd38)的样品表明,相互作用导致浆细胞的死亡,如通过碘化丙啶的吸收和随后信号从1小时开始出现、在2小时更明显所检测的(在图像中用箭头指示)。另一方面,浆细胞在针对模式2(即在没有效应细胞的情况下)所示的代表性图像中没有死亡。模式1微孔中的浆细胞死亡是关于与nk细胞的距离来评估的,目的是估计导致观察到的毒性的nk细胞的实际效力。
[0260]
图11e显示了从其中细胞用10μg/ml剂量的达雷妥尤单抗刺激的1,200个微孔中收集的数据。根据本发明的方法允许观察到与nk细胞接触的那些浆细胞的死亡最大并且随着浆细胞-nk细胞距离的增加而减少。与距离较远的细胞相比,不直接接触但紧邻nk细胞的浆细胞显示出更高的死亡率。这些数据表明以下事实,即nk细胞的激活不仅影响与其直接接触的细胞,还可影响周围环境,即位于距离nk细胞最小距离处的细胞,其可能经受通过与nk细胞的接触(这可能发生在与对应于观察的时间不同的时刻)或由于来自接触的nk细胞首次激活后分泌的有毒物质例如穿孔素和颗粒酶而导致的死亡。因此,根据本发明的方法的值即使在对单个细胞进行分析期间也考虑了包含所述细胞的环境,从而允许选择感兴趣的环境的代表性子集。
[0261]
在报告的实验中,该方法允许估计强大nk细胞(即在提供接触时能够杀死靶标)的分数为总数的12.82%。这个数字被计算为属于模式1因此与nk细胞接触的浆细胞的死亡率(23.68%)和属于模式2的浆细胞的死亡率(10.86%)之间的差异,这是由于自发死亡或抗cd38抗体的直接作用。图11f中的热图显示了随时间在不同模式中测量的细胞活力结果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。