用于吲哚胺2,3-双加氧酶抑制及其适应症的药物组合物和方法
1.本技术是申请日为2016年11月4日、中国申请号为201680072585.5、发明名称为“用于吲哚胺2,3-双加氧酶抑制及其适应症的药物组合物和方法”的发明申请的分案申请。
2.相关申请的交叉引用
3.本技术要求2016年11月4日提交的美国临时专利申请号62/250,968的优先权,所述专利申请据此以引用的方式整体并入。
发明领域
4.本发明涉及吲哚胺2,3-双加氧酶抑制剂的药物组合物,并且可用于治疗癌症和其他疾病。
5.发明背景
6.色氨酸(trp)是生物合成蛋白质、烟酸和神经递质5-羟色胺(血清素)所需的必需氨基酸。在将l-色氨酸降解为n-甲酰基犬尿氨酸的过程中,吲哚胺2,3-双加氧酶(也称为indo、ido或ido1)催化第一步骤和限速步骤。在人细胞中,ido活性导致的trp消耗是突出的γ干扰素(ifn-γ)诱导型抗微生物效应机制。ifn-γ刺激诱导ido的活化,其导致trp消耗,从而阻止trp依赖性细胞内病原体如弓形虫和沙眼衣原体的生长。ido活性也对许多肿瘤细胞具有抗增殖作用,并且在异源肿瘤的排斥反应期间在体内观察到ido诱导,表明该酶在肿瘤排斥过程中可能的作用(daubener等人1999,adv.exp.med.biol.,467:517-24;taylor等人1991,faseb j.,5:2516-22)。
7.已经观察到与外周血淋巴细胞(pbl)共培养的hela细胞通过上调ido活性而获得免疫抑制表型。在白细胞介素-2(il2)处理之后的pbl增殖减少被认为是响应于pbl分泌ifng而由肿瘤细胞释放ido引起的。通过用1-甲基-色氨酸(1mt)(一种特异性ido抑制剂)治疗可逆转这种效应。有人提出,肿瘤细胞中的ido活性可能有损于抗肿瘤反应(logan等人,2002,immunology,105:478-87)。
8.最近,trp消耗的免疫调节作用受到了很多关注。几条证据表明ido参与诱导免疫耐受。哺乳动物妊娠、肿瘤耐药性、慢性感染和自身免疫性疾病的研究表明,表达ido的细胞可以抑制t细胞反应并促进耐受。在与细胞免疫活化有关的疾病和病症如感染、恶性肿瘤、自身免疫性疾病和aids中以及在怀孕期间,观察到加速的trp分解代谢。例如,在自身免疫性疾病中观察到ifn水平升高和尿trp代谢物水平升高;据推测,在自身免疫性疾病中发生的trp的全身或局部消耗可能与这些疾病的变性和损害健康的症状有关。为支持这一假设,在从关节炎关节滑膜分离的细胞中观察到高水平的ido。人类免疫缺陷病毒(hiv)患者的ifn也升高,ifn水平升高与预后恶化有关。因此,有人提出ido是由hiv感染长期诱导的,并且由于机会性感染而进一步增加,并且trp的慢性损失启动了引起恶病质、痴呆和腹泻以及aids患者可能的免疫抑制的机制(brown等人,1991,adv.exp.med.biol.,294:425-35)。为此,最近已经显示,ido抑制可以增强病毒特异性t细胞的水平,并伴随地减少hiv小鼠模型中病毒感染的巨噬细胞的数量(portula等人,2005,blood,106:2382-90)。
9.据信,ido在防止子宫内胎儿排斥的免疫抑制过程中发挥作用。40多年前,人们观察到,在怀孕期间,尽管组织移植免疫学可以预测,但遗传上不同的哺乳动物孕体仍然存活(medawar,1953,symp.soc.exp.biol.7:320-38)。母体和胎儿的解剖分离和胎儿的抗原不成熟不能完全解释胎儿同种异体移植物的存活。最近的注意力集中在母亲的免疫耐受性上。由于ido由人类合体滋养层细胞表达并且在正常妊娠期间全身色氨酸浓度降低,所以假设在母体-胎儿界面处的ido表达对于防止胎儿同种异体移植物的免疫排斥是必需的。为了检验这一假设,将怀孕小鼠(怀有同源或异源胎儿)暴露于1mt,观察到所有异源孕体的快速t细胞诱导排斥反应。因此,通过使色氨酸分解代谢,哺乳动物孕体似乎抑制t细胞活性并防止其自身遭受排斥反应,并且在鼠怀孕期间阻断色氨酸分解代谢允许母体t细胞引起胎儿同种异体移植物排斥反应(munn等人,1998,science,281:1191-3)。
10.基于ido色氨酸降解的肿瘤免疫抗性机制的进一步证据来自观察到大多数人类肿瘤组成性表达ido,并且免疫原性小鼠肿瘤细胞表达ido防止其被预免疫化小鼠排斥。这种效应伴随着特异性t细胞在肿瘤部位缺乏积累,并且可以通过在没有显著毒性的情况下用ido抑制剂来全身性治疗小鼠来部分逆转。因此,暗示通过伴随施用ido抑制剂可以改善癌症患者的治疗性疫苗接种的功效(uyttenhove等人,2003,nature med.,9:1269-74)。还显示ido抑制剂1-mt可与化学治疗剂协同作用以减少小鼠中的肿瘤生长,表明ido抑制也可增强常规细胞毒性疗法的抗肿瘤活性(muller等人,2005,nature med.,11:312-9)。
11.促成对肿瘤的免疫无应答的一种机制可能是通过致耐受性宿主apc呈递肿瘤抗原。也已经描述了共表达cd123(il3ra)和ccr6并抑制t细胞增殖的人ido表达抗原呈递细胞(apc)的子集。成熟和未成熟的cd123阳性树突细胞都抑制t细胞活性,并且这种ido抑制活性被1mt阻断(munn等人,2002,science,297:1867-70)。还已经证明,小鼠肿瘤引流淋巴结(tdln)含有组成性表达免疫抑制水平的ido的浆细胞样树突细胞(pdc)的子集。尽管仅构成0.5%的淋巴结细胞,但在体外这些pdc有效地抑制了由pdc本身呈递的抗原的t细胞应答,并且以主导方式抑制由非抑制性apc呈递的第三方抗原的t细胞应答。在pdc群体中,大部分功能性ido介导的抑制活性仅存在于共表达b谱系标志物cd19的pdc的新颖子集中。因此,假设在tdln中通过pdc的ido介导的抑制产生有效抑制宿主抗肿瘤t细胞应答的局部微环境(munn等人,2004,j.clin.invest.,114(2):280
–
90)。
12.ido降解色氨酸、血清素和褪黑激素的吲哚部分,并开始产生神经活性和免疫调节代谢物,统称为犬尿氨酸。通过局部消耗色氨酸和增加促凋亡犬尿氨酸,由树突细胞(dc)表达的ido可以极大地影响t细胞增殖和存活。dc中的ido诱导可能是调节性t细胞驱动的缺失耐受性的常见机制。由于预期这种致耐受性应答可以在各种病理生理学病症中起作用,所以色氨酸代谢和犬尿氨酸的产生可能代表免疫和神经系统之间的关键界面(grohmann等人,2003,trends immunol.,24:242-8)。在持续免疫活化的状态下,游离血清trp的可用性降低,并且由于血清素生成减少,血清素功能也可能受到影响(wirleitner等人,2003,curr.med.chem.,10:1581-91)。
13.有趣的是,已经观察到干扰素-α的施用引起神经精神性副作用,例如抑郁症状和认知功能的改变。对于血清素激活的神经传递的直接影响可能导致这些副作用。此外,由于ido活化导致血清素(5-ht)前体色氨酸水平降低,ido可能通过减少中枢5-ht合成而在这些神经精神性副作用中发挥作用。此外,犬尿氨酸代谢产物如3-羟基-犬尿氨酸(3-oh-kyn)和
喹啉酸(quin)对脑功能具有毒性作用。3-oh-kyn能够通过增加活性氧(ros)的产生而产生氧化应激,并且quin可以产生海马n-甲基-d-天冬氨酸(nmda)受体的过度刺激,这导致细胞凋亡和海马萎缩。ros过量产生和nmda过度刺激引起的海马萎缩都与抑郁症有关(wichers和maes,2004,j.psychiatry neurosci.,29:11-17)。因此,ido活性可能在抑郁症中发挥作用。
14.鉴于ido在免疫抑制、肿瘤耐药性和/或排斥,慢性感染,hiv感染,aids(包括其表现如恶病质、痴呆和腹泻),自身免疫性疾病或病症(如类风湿性关节炎)以及免疫耐受和预防子宫内胎儿排斥反应中的作用的实验数据,旨在通过抑制ido活性来抑制色氨酸降解的治疗剂是所希望的。当t细胞被妊娠、恶性肿瘤或hiv等病毒抑制时,ido抑制剂可用于活化t细胞,从而增强t细胞活化。抑制ido也可能是神经系统或神经精神疾病或病症诸如抑郁症的患者的重要治疗策略。
15.正在开发ido的小分子抑制剂来治疗或预防如上所述的ido相关疾病。例如,在us 2006/0258719和us 2007/0185165中报道了恶二唑和其他杂环ido抑制剂。pct公开wo 99/29310报道了使用ido抑制剂例如1-甲基-dl-色氨酸、p-(3-苯并呋喃基)-dl-丙氨酸、p-[3-苯并(b)噻吩基]-dl-丙氨酸和6-硝基-l-色氨酸)来改变t细胞介导的免疫性,包括改变色氨酸和色氨酸代谢物的局部细胞外浓度(munn,1999)。也公开为欧洲专利1501918的wo 03/087347中报道了制备用于增强或降低t细胞耐受性的抗原呈递细胞的方法(munn,2003)。在wo 2004/094409中进一步报道了具有吲哚胺-2,3-双加氧酶(ido)抑制活性的化合物;并且美国专利申请公开号2004/0234623涉及通过联合使用吲哚胺-2,3-双加氧酶抑制剂和其他治疗方式来治疗患有癌症或感染的受试者的方法。ido抑制剂的实例是4-({2-[(氨基磺酰基)氨基]乙基}氨基)-n-(3-溴-4-氟苯基)-n'-羟基-1,2,5-恶二唑-3-甲脒,其在美国专利号8,088,803中有所描述。仍然需要具有用于治疗ido相关疾病的合适性质的新药物组合物。这里描述的本发明是针对这个目的。
技术实现要素:
[0016]
本发明特别提供了治疗患者癌症的方法,包括向所述患者施用药物组合物,所述药物组合物包含化合物1,
[0017][0018]
或其药学上可接受的盐和一种或多种赋形剂,其中所述治疗包括每日两次口服给药的包含约25mg至约700mg游离形式的化合物1或其药学上可接受的盐的剂量方案。
[0019]
本发明还提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,其在稳定状态下达到约50%或更高的i
min
或约70%或更高的i
avg
。
[0020]
本发明还提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,其在稳定状态下达到:
[0021]
(1)约0.10μm至约10μm的c
max
,约0.01μm至约2.0μm的c
min
,约1h至约6h的t
max
和约1μm*h至约50μm*h的auc
0-τ
;和
[0022]
(2)约50%或更高的i
min
或约70%或更高的i
avg
。
[0023]
本发明还提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐,
[0024][0025]
和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服给药的包含约25mg至约700mg游离碱形式的化合物1或其药学上可接受的盐的给药方案,其在稳定状态下达到约0.10μm至约10μm的c
max
,约0.01μm至约2.0μm的c
min
,约1h至约6h的t
max
和约1μm*h至约50μm*h的auc
0-τ
。
[0026]
本发明还提供了治疗患者癌症的方法,包括向所述患者施用一种或多种本文提供的口服药物组合物和第二种药剂,例如一种或多种免疫检查点分子的抑制剂。
[0027]
本发明还涉及如下项:
[0028]
1.一种治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐,
[0029][0030]
和一种或多种赋形剂的药物组合物,以及包含免疫检查点分子抑制剂和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,所述剂量方案在稳定状态下达到约50%或更高的i
min
或者约70%或更高的i
avg
。
[0031]
2.一种治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐,
[0032][0033]
和一种或多种赋形剂的药物组合物,以及包含免疫检查点分子抑制剂和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,所述剂量方案在稳定状态下达到:
[0034]
(3)约0.10μm至约10μm的c
max
,约0.01μm至约2.0μm的c
min
,约1h至约6h的t
max
和约1μm*h至约50μm*h的auc
0-τ
;和
[0035]
(4)约50%或更高的i
min
或约70%或更高的i
avg
。
[0036]
3.如项1或2所述的方法,其中所述i
min
为约50%至约80%,约50%至约70%或约50%至约60%。
[0037]
4.如项1或2所述的方法,其中所述i
min
为约50%至约60%。
[0038]
5.如项1或2所述的方法,其中所述i
avg
为约70%至约90%或约70%至约80%。
[0039]
6.如项1或2所述的方法,其中所述i
avg
为约70%至约80%。
[0040]
7.如项1-6中任一项所述的方法,其中所述免疫检查点分子抑制剂是派姆单抗。
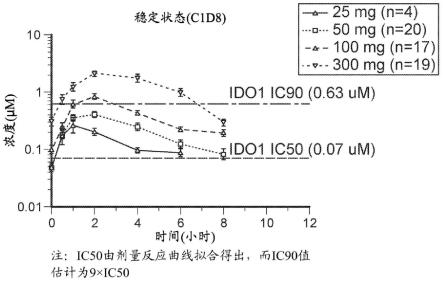
[0041]
8.如项7所述的方法,其中所述剂量方案包含每天两次口服给药的约25mg至约300mg游离形式的化合物1或其药学上可接受的盐,以及每21天给药的派姆单抗。
[0042]
9.如项1所述的方法,其中所述剂量方案包含每天两次给药的以游离碱计约100mg的化合物1或其药学上可接受的盐,其在稳定状态下达到约50%或更高的i
min
,或约70%或更高的i
avg
。
[0043]
10.如项2所述的方法,其中所述剂量方案包括每天两次给药的以游离碱计约100mg的化合物1或其药学上可接受的盐,其在稳定状态下达到:
[0044]
(1)约0.5μm至约2.0μm的c
max
,约2h的t
max
和约4μm*h至约7μm*h的auc
0-τ
;和
[0045]
(2)约50%或更高的i
min
或约70%或更高的i
avg
。
[0046]
11.一种治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐,
[0047][0048]
和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,所述剂量方案包含每天两次口服给药的约25mg至约700mg游离形式的化合物1或其药学上可接受的盐,其在稳定状态下达到约0.10μm至约10μm的c
max
,约0.01μm至约2.0μm的c
min
,约1h至约6h的t
max
和约1μm*h至约50μm*h的auc
0-τ
。
[0049]
12.如项2至8和10至11中任一项所述的方法,其中所述c
max
为约0.20μm至约8.0μm、约0.30μm至约7.0μm、约1.0μm至约7.0μm、约1.0μm至约6.0μm、约1.0μm至约5.0μm、约1.0μm至约4.0μm或约1.0μm至约3.0μm。
[0050]
13.如项12所述的方法,其中所述c
max
为约1.0μm至约3.0μm。
[0051]
14.如项2至8和10至13中任一项所述的方法,其中所述t
max
为约1h至约5h。
[0052]
15.如项14所述的方法,其中所述t
max
为约2h至约3h。
[0053]
16.如项15所述的方法,其中所述t
max
为约2h。
[0054]
17.如项2至8和10至16中任一项所述的方法,其中所述auc
0-τ
为约1μm*h至约40μm*h、约1μm*h至约36μm*h、1μm*h至约34μm*h、约1μm*h至约30μm*h、约1μm*h至约20μm*h、约1μm*h至约10μm*h、约5μm*h至约15μm*h或约5μm*h至约10μm*h。
[0055]
18.如项17所述的方法,其中所述auc
0-τ
为约4μm*h至约10μm*h。
[0056]
19.如项18所述的方法,其中所述auc
0-τ
为约4μm*h至约6μm*h。
[0057]
20.如项2至8和10至19中任一项所述的方法,其中所述c
min
为约0.01μm至约2μm或约0.025μm至约0.5μm。
[0058]
21.一种治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐,
[0059][0060]
和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,所述剂量方案包含每天两次口服给药的约25mg至约700mg游离形式的化合物1或其药学上可接受的盐。
[0061]
22.如项21所述的方法,其中所述给药方案包括每天两次口服给药的约50mg至约100mg游离形式的化合物1或其药学上可接受的盐。
[0062]
23.如项21所述的方法,其中所述剂量方案包含每天两次口服给药的约50mg游离形式的化合物1或其药学上可接受的盐。
[0063]
24.如项21所述的方法,其中所述剂量方案包括每天两次口服给药的约100mg游离形式的化合物1或其药学上可接受的盐。
[0064]
25.如项1至21中任一项所述的方法,其中所述给药方案包括每天两次口服给药的约100mg至约700mg游离形式的化合物1或其药学上可接受的盐。
[0065]
26.如项1至21中任一项所述的方法,其中所述给药方案包括每天两次口服给药的约100mg至约400mg游离形式的化合物1或其药学上可接受的盐。
[0066]
27.如项1至21中任一项所述的方法,其中所述给药方案包括每天两次口服给药的约100mg至约300mg游离形式的化合物1或其药学上可接受的盐。
[0067]
28.一种治疗患者癌症的方法,其包括向所述患者施用包含化合物1,
[0068][0069]
或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,所述剂量方案包含每天两次口服给药的约100mg至约300mg游离形式的化合物1或其药学上可接受的盐,其中所述剂量方案在稳定状态下达到等于或大于ido1的ic
50
的禁食个体的谷血浆浓度,或在12小时间隔内、在稳定状态下达到等于或大于ido1的ic
90
的禁食个体的平均血浆浓度。
[0070]
29.如项1至21和28中任一项所述的方法,其中所述给药方案包含每天两次给药的以游离碱计约100mg、约200mg或约300mg的化合物1或其药学上可接受的盐。
[0071]
30.如项1至21和28中任一项所述的方法,其中所述剂量方案包含每天两次给药的以游离碱计约100mg的化合物1或其药学上可接受的盐。
[0072]
31.如项1至21和28中任一项所述的方法,其中剂量方案包括每天两次给药的以游离碱计约200mg的化合物1或其药学上可接受的盐。
[0073]
32.如项1至21和28中任一项所述的方法,其中所述剂量方案包含每天两次给药的以游离碱计约300mg的化合物1或其药学上可接受的盐。
[0074]
33.如项1至32中任一项的方法,其中每种组合物被配制成片剂。
[0075]
34.如项2或3所述的方法,其中所述剂量方案包含每天两次给药的以游离碱计约
50mg的化合物1或其药学上可接受的盐,其在稳定状态下达到约0.1μm至约1.0μm的c
max
、约2h的t
max
,和约1μm*h至约3μm*h的auc
0-τ
。
[0076]
35.如项2或3所述的方法,其中所述给药方案包含每天两次给药的以游离碱计约100mg的化合物1或其药学上可接受的盐,其在稳定状态下提供约0.5μm至约2.0μm的c
max
、约2h的t
max
和约4μm*h至约7μm*h的auc
0-τ
。
[0077]
36.如项2或3所述的方法,其中所述给药方案包含每天两次给药的以游离碱计约300mg的化合物1或其药学上可接受的盐,其在稳定状态下提供约1.0μm至约3.0μm的c
max
、约2的t
max
,和约8μm*h至约10μm*h的auc
0-τ
。
[0078]
37.如项1至36中任一项所述的方法,其中所述患者处于禁食状态。
[0079]
38.如项1至37中任一项所述的方法,其中所述赋形剂选自乳糖一水合物、微晶纤维素、聚维酮、交联羧甲基纤维素钠、胶体二氧化硅和硬脂酸镁。
[0080]
39.如项38所述的方法,其中乳糖一水合物以所述组合物的约20重量%至约35重量%或约24重量%至约32重量%的量存在。
[0081]
40.如项38或39所述的方法,其中微晶纤维素以所述组合物的约20重量%至约35重量%或约22重量%至约33重量%的量存在。
[0082]
41.如项38至40中任一项所述的方法,其中聚维酮以所述组合物的约0.5重量%至约1.0重量%的量存在。
[0083]
42.如项41所述的方法,其中聚维酮以所述组合物的约0.8重量%的量存在。
[0084]
43.如项38至42中任一项所述的方法,其中交联羧甲基纤维素钠以所述组合物的约1.0重量%至约10.0重量%的量存在。
[0085]
44.如项43所述的方法,其中交联羧甲基纤维素钠以所述组合物的约3重量%或约10重量%的量存在。
[0086]
45.如项38至44中任一项所述的方法,其中胶体二氧化硅以所述组合物的约0.1重量%至约1.0重量%的量存在。
[0087]
46.如项45所述的方法,其中胶体二氧化硅以所述组合物的约0.6重量%或约0.7重量%的量存在。
[0088]
47.如项38至46中任一项所述的方法,其中硬脂酸镁以所述组合物的约0.1重量%至约1.0重量%的量存在。
[0089]
48.如项47所述的方法,其中硬脂酸镁以所述组合物的约0.6重量%的量存在。
[0090]
49.如项1至48中任一项所述的方法,其中所述癌症是结肠癌、胰腺癌、乳腺癌、前列腺癌、肺癌、脑癌、卵巢癌、宫颈癌、睾丸癌、肾癌、头颈癌、淋巴瘤和白血病。
[0091]
50.如项1至48中任一项所述的方法,其中所述癌症是实体肿瘤。
[0092]
51.如项1至48中任一项所述的方法,其中所述癌症是黑素瘤、非小细胞肺癌、泌尿生殖(gu)道的移行细胞癌、肾细胞癌、三阴性乳腺癌(tnbc)、子宫内膜癌、头颈部鳞状细胞癌(scchn)、子宫内膜癌、胃癌、胰腺导管腺癌、弥漫性大b细胞淋巴瘤(dlbcl)或卵巢癌(oc)。
[0093]
52.如项1至51中任一项所述的方法,其还包括施用一种或多种免疫检查点分子抑制剂。
[0094]
53.如项52所述的方法,其中所述免疫检查点分子抑制剂是pd-1、pd-l1、pd-l2、
ctla-4、tim3、lag3、vista、btla、tigit、lair1、cd160、2b4和/或tgfrβ的抑制剂。
[0095]
54.如项52所述的方法,其中所述免疫检查点分子抑制剂是抗pd1抗体、抗pd-l1抗体或抗ctla-4抗体。
[0096]
55.如项54所述的方法,其中所述抗pd1抗体是纳武单抗、派姆单抗、pidilizumab、shr-1210或amp-224。
[0097]
56.如项55所述的方法,其中所述抗pd1抗体是派姆单抗。
[0098]
57.如项56所述的方法,其中所述派姆单抗每三周给药一次。
[0099]
58.如项56或57所述的方法,其中所述派姆单抗以约2mg/kg给药。
[0100]
59.如项54所述的方法,其中所述免疫检查点分子抑制剂是抗pd-l1抗体。
[0101]
60.如项59所述的方法,其中所述抗pd-l1抗体是bms-935559、medi4736、mpdl3280a或msb0010718c。
[0102]
61.如项54所述的方法,其中所述免疫检查点分子抑制剂是抗ctla-4抗体。
[0103]
62.如项61所述的方法,其中所述抗ctla-4抗体是伊匹单抗。
[0104]
63.一种治疗患者中的黑素瘤的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐,
[0105][0106]
和一种或多种赋形剂的药物组合物,以及包含派姆单抗和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,所述剂量方案包含每天两次口服给药的约25mg至约300mg游离形式的化合物1或其药学上可接受的盐,和每三周给药一次的派姆单抗。附图简述
[0107]
图1显示了化合物1结晶形式的xrpd图谱特征。
[0108]
图2显示了化合物1结晶形式的dsc热谱图特征。
[0109]
图3显示了化合物1结晶形式的tga数据特征。
[0110]
图4按照剂量显示了第一剂量后的化合物1血浆浓度的图。
[0111]
图5按照剂量显示了在稳定状态下的化合物1血浆浓度的图。
[0112]
图6显示c1d8和c2d1上化合物1血浆浓度的图。
[0113]
图7显示c1d8上化合物1的剂量比例c
max
(第1部分中的所有组群)的图。
[0114]
图8显示在c1d8上化合物1的剂量比例auc(第1部分中的所有组群)的图。
[0115]
图9显示了不同剂量(n=58)的预计ido1抑制百分比的瀑布图。
[0116]
图10显示接受100mg bid的受试者中第1部分与第2部分之间在第一剂量之后的化合物1血浆浓度的图。
[0117]
图11显示接受100mg bid的受试者中第1部分与第2部分之间在稳定状态下(在c1d8上)的化合物1血浆浓度的图。
[0118]
图12显示接受100mg bid的受试者中c1d8和c2d1上化合物1谷血浆浓度的图。
[0119]
图13显示了各种肿瘤类型的在稳定状态c
max
下的化合物1的盒图。
[0120]
图14显示各种肿瘤类型的在稳定状态auc
tau
下的化合物1的盒图。
[0121]
图15显示了稳定状态下预计的ido1抑制百分比的瀑布图。
具体实施方式
[0122]
使用方法
[0123]
本发明特别提供了治疗患者癌症的方法,包括给予所述患者一种或多种口服药物组合物,每种口服药物组合物包含ido抑制剂4-({2-[(氨基磺酰基)氨基]乙基}氨基)-n-(3-溴-4-氟苯基)-n'-羟基-1,2,5-恶二唑-3-甲脒(化合物1)或其药学上可接受的盐和一种或多种赋形剂,其中所述一种或多种药物组合物提供了可用于治疗诸如癌症的病症的化合物的某种药代动力学特征。下面描述了化合物1的结构。
[0124][0125]
由波浪线表示的结构图中的键旨在表示该结构代表顺式或反式异构体,或者表示任何比例的顺式和反式异构体的混合物。
[0126]
药代动力学(pk)使本领域技术人员能够从给药的那一刻起,直到药物从体内完全消除来监测药物的命运。药代动力学描述了在给药后人体通过吸收和分配机制如何影响特定药物,以及体内物质的化学变化以及药物代谢产物的效应和排泄途径。药物的药代动力学性质可能受到诸如给药部位、制剂、溶解度特征、进食/空腹状况和给药药物的剂量等要素的影响,所述要素可能影响吸收速率。临床pk监测通常通过确定血浆浓度来进行,因为这些数据是可靠的并且可以容易地获得。确定药物的血浆浓度可以帮助缩小治疗范围(例如毒性和治疗浓度之间的差异)以减少或最小化药物由于过量给药可能具有的任何副作用。
[0127]
如本文所述的化合物1被配制成可以施用至受试者例如人受试者的组合物,以实现可有效治疗癌症的所期望的pk概况。给药方案(例如,化合物1每天给药两次)可以在稳定状态下达到约50%或更高的i
min
或约70%或更高的i
avg
,其可以有效治疗各种癌症。通常,在禁食状态下口服给药本发明组合物后,化合物1的峰值血浆浓度通常在给药后2小时达到。化合物1通过2.9小时的几何平均终末处置半衰期来消除。在本文提供的实例中已经显示化合物1c
max
和auc
0-τ
的增加不太与剂量成比例。高脂膳食使化合物1中值t
max
延迟4小时,但不会引起化合物1血浆暴露的临床显著变化,因此,化合物1可以不考虑食物而给药。
[0128]
在体内,相信化合物1清除的主要途径是通过肝脏中的葡糖醛酸化。肠肝循环(ehc)通过药物的胆汁排泄和肠道重吸收发生,通常具有肝结合和肠解离(dobrinska,j clin pharmacol,1989;29:577-580)。不希望受特定理论束缚,基于葡糖苷酸为化合物1的主要代谢物,相信ehc参与化合物1的处置。尽管化合物1的平均血浆浓度概况没有表现出明显的次级峰模式(参见例如实施例2),但是存在若干个别受试者表现出非明确定义的血浆浓度峰值,在浓度-时间曲线中的二次尖峰形成,或化合物1血浆浓度下降异常缓慢,特别是在重复剂量后。然而,延长的t
max
与膳食刺激的胆汁向小肠中的排泄相一致,这触发了化合物1的ehc。使用符合观察到的平均cl/f、vz/f和t
max
值的化合物1的1室pk模型,bid给药的模
拟表明auc
0-τ
在稳定状态下应积累约8%,显著低于如实施例2中观察到的auc
0-τ
增加超过33%,表明超过线性全身积累的化合物螯合。对于经历显著ehc的化合物,使用观察到的t
1/2
值,全身积累倾向于预测偏低,并且基于积累的“有效”t
1/2
计算可能更有意义(dobrinska,j clin pharmacol,1989;29:577-580)。基于auc的积累比率表明约6小时的“有效”t
1/2
。因此,基于这些观察结果,相信ehc参与化合物1的处置。
[0129]
在一些实施方案中,本文提供了治疗患者中的癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括以下剂量方案,每天两次口服给药25mg至约700mg化合物1或其药学上可接受的盐。
[0130]
在一些实施方案中,本文提供治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,其在稳定状态下达到约50%或更高的i
min
或约70%或更高的i
avg
。
[0131]
在一些实施方案中,本文提供了治疗患者中的癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,其在稳定状态下达到:
[0132]
(1)约0.10μm至约10μm的c
max
,约0.01μm至约2.0μm的c
min
,约1h至约6h的t
max
和约1μm*h至约50μm*h的auc
0-τ
;和
[0133]
(2)约50%或更高的i
min
或约70%或更高的i
avg
。
[0134]
在一些实施方案中,本文提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,以及包含免疫检查点分子的抑制剂和一种或多种赋形剂的药物组合物,其中所述治疗包括在稳定状态下达到约50%或更高的i
min
或约70%或更高的i
avg
的给药方案。
[0135]
在一些实施方案中,本文提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,以及包含免疫检查点分子的抑制剂和一种或多种赋形剂的药物组合物,其中所述治疗包括在稳定状态下达到以下目标的剂量方案:
[0136]
(1)约0.10μm至约10μm的c
max
,约0.01μm至约2.0μm的c
min
,约1h至约6h的t
max
和约1μm*h至约50μm*h的auc
0-τ
;和
[0137]
(2)约50%或更高的i
min
或约70%或更高的i
avg
。
[0138]
在一些实施方案中,免疫检查点分子的抑制剂是派姆单抗。在一些实施方案中,所述剂量方案包含每天口服给药两次的25mg至约300mg游离形式的化合物1或其药学上可接受的盐,以及每21天给予派姆单抗。
[0139]
本发明进一步提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服施用的剂量方案,所述剂量方案包含约50mg至约300mg游离形式的化合物1或其药学上可接受的盐,其中所述剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度。
[0140]
本发明进一步提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服施用的剂量方案,所述剂量方案包含约50mg至约300mg游离形式的化合物1或其药学上可
接受的盐,其中剂量方案在12小时间隔期间在稳定状态下达到禁食个体的平均血浆浓度,其等于或大于ido1处的ic
90
。
[0141]
本发明进一步提供了治疗患者癌症的方法,包括给予所述患者包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服施用的剂量方案,所述剂量方案包含约100mg至约300mg游离形式的化合物1或其药学上可接受的盐,其中所述剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度。
[0142]
本发明进一步提供了治疗患者癌症的方法,包括给予所述患者包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服施用的剂量方案,所述剂量方案包含约100mg至约300mg游离形式的化合物1或其药学上可接受的盐,其中所述剂量方案在12小时间隔期间在稳定状态下达到等于或大于ido1处的ic
90
的禁食个体的平均血浆浓度。
[0143]
本发明进一步提供了治疗患者癌症的方法,包括给予所述患者包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服施用的剂量方案,所述剂量方案包含约100mg至约300mg游离形式的化合物1或其药学上可接受的盐,其中剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度,并且在12小时间隔内稳定状态下达到等于或大于ido1处的ic
90
的禁食个体的平均血浆浓度。
[0144]
本发明还提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服给药的剂量方案,其包含约100mg游离形式的化合物1或其药学上可接受的盐,其中剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度,并且在12小时间隔内稳定状态下达到等于或大于ido1处的ic
90
的禁食个体的平均血浆浓度。
[0145]
本发明进一步提供了治疗患者癌症的方法,包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服给药的剂量方案,其包含约200mg游离形式的化合物1或其药学上可接受的盐,其中剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度,并且在12小时间隔内稳定状态下达到等于或大于ido1处的ic
90
的禁食个体的平均血浆浓度。
[0146]
本发明进一步提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服给药的剂量方案,其包含约300mg游离形式的化合物1或其药学上可接受的盐,其中剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度,并且在12小时间隔内稳定状态下达到等于或大于ido1处的ic
90
的禁食个体的平均血浆浓度。
[0147]
本发明进一步提供了治疗患者癌症的方法,包括给予所述患者包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服施用的剂量方案,所述剂量方案包含约100mg至约300mg游离形式的化合物1或其药学上可接受的盐,其中剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度,或在12小时间隔内稳定状态下达到等于或大于ido1处的ic
90
的禁食个体的平均血浆浓度。
[0148]
本发明还提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服给药的剂量方案,其包含约100mg游离形式的化合物1或其药学上可接受的盐,其中剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度,或在12小时间隔内稳定状态下达到等于或大于ido1处的ic
90
的禁食个体的平均血浆浓度。
[0149]
本发明进一步提供了治疗患者癌症的方法,包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服给药的剂量方案,其包含约200mg游离形式的化合物1或其药学上可接受的盐,其中剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度,或在12小时间隔内稳定状态下达到等于或大于ido1处的ic
90
的禁食个体的平均血浆浓度。
[0150]
本发明进一步提供了治疗患者癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服给药的剂量方案,其包含约300mg游离形式的化合物1或其药学上可接受的盐,其中剂量方案在稳定状态下达到等于或大于ido1处的ic
50
的禁食个体的谷血浆浓度,或在12小时间隔内稳定状态下达到等于或大于ido1处的ic
90
的禁食个体的平均血浆浓度。
[0151]
在一些实施方案中,本文提供了治疗患者中的癌症的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服给药的剂量方案,其包含25mg至约700mg游离形式的化合物1或其药学上可接受的盐,其在稳定状态下达到约0.10μm至约10μm的c
max
,约0.01μm至约2.0μm的c
min
,约1h至约6h的t
max
以及约1μm*h至约50μm*h的auc
0-τ
。
[0152]
其中出现术语“给药方案”时,该方法可能涉及给予所述患者一种或多种药物组合物。例如,在一些实施方案中,本文提供的方法包括向患者施用一种或多种药物组合物以提供25mg至约700mg的剂量。例如,为了达到400mg的剂量,可以向患者施用两个组合物,每个组合物包含以游离碱计200mg的化合物1或其药学上可接受的盐。
[0153]
在一些实施方案中,i
min
为约50%至约80%,约50%至约70%或约50%至约60%。例如,i
min
为约50%至约60%。
[0154]
在一些实施方案中,i
avg
为约70%至约90%或约70%至约80%。例如,i
avg
为约70%至约80%。
[0155]
在一些实施方案中,c
max
为约0.20μm至约8.0μm,约0.30μm至约7.0μm,约1.0μm至约7.0μm,约1.0μm至约6.0μm,约1.0μm至约5.0μm,约1.0μm至约4.0μm,或约1.0μm至约3.0μm。
[0156]
在一些实施方案中,c
max
为约0.5μm至约7.0μm,约0.5μm至约6.0μm,约0.5μm至约5.0μm,约0.5μm至约4.0μm或约0.5μm至约3.0μm。
[0157]
在一些实施方案中,c
max
为约1.0μm至约3.0μm。在一些实施方案中,c
max
为约1.0μm,约2.0μm,约3.0μm,约4.0μm,约5.0μm,约6.0μm或约7.0μm。在一些实施方案中,c
max
为约0.9μm至约1.6μm。在一些实施方案中,c
max
为约1.2μm。
[0158]
在一些实施方案中,c
min
为约0.01μm至约2.0μm。在其他实施方案中,c
min
为约0.025μm至约0.5μm。
[0159]
在一些实施方案中,t
max
为约1h至约4h,约1h至约3h或约1h至约2h。在一些实施方案中,t
max
为约2h至约3h。在一些实施方案中,t
max
为约1h至约2h。在一些实施方案中,t
max
为
约1h,约2h,约3h,约4h或约5h。在一些实施方案中,t
max
为约2h。
[0160]
在一些实施方案中,本文提供的方法具有约2h至约4h的消除半衰期(t
1/2
)。在一些实施方案中,t
1/2
为约2.5h至约4h。在其他实施方案中,t
1/2
为约3.2h。
[0161]
在一些实施方案中,auc
0-τ
为约1μm*h至约40μm*h,约1μm*h至约36μm*h,约1μm*h至约30μm*h,约1μm*h至约20μm*h,约1μm*h至约10μm*h,约5μm*h至约15μm*h或约5μm*h至约10μm*h。
[0162]
在一些实施方案中,auc
0-τ
为约4μm*h至约10μm*h。在一些实施方案中,auc
0-τ
为约4μm*h至约6μm*h。在一些实施方案中,auc
0-τ
为约4μm*h至约7μm*h。在一些实施方案中,auc
0-τ
为约8μm*h至约10μm*h。在一些实施方案中,auc
0-τ
为约4μm*h,约5μm*h,约6μm*h,约7μm*h,约8μm*h,约9μm*h或约10μm*h。在一些实施方案中,auc
0-τ
为约5μm*h。在一些实施方案中,auc
0-τ
为约3.5μm*h至约8μm*h。在一些实施方案中,auc
0-τ
为约5.5μm*h。
[0163]
在一些实施方案中,所述剂量方案包含约50mg至约700mg游离形式的化合物1或其药学上可接受的盐。在一些实施方案中,包含约25mg至约400mg或约50mg至约400mg以游离碱计的化合物1或其药学上可接受的盐的剂量方案每日两次施用
[0164]
在一些实施方案中,包含以游离碱计约25mg至约800mg,约25mg至约700mg,约25mg至约600mg,约25mg至约500mg,约25mg至约400mg,约25mg至约300mg,约25mg至约200mg,约25mg至约100mg,约100至约500mg或约100mg至约400mg化合物1,或药学上可接受的盐的剂量方案每天给药两次。
[0165]
在一些实施方案中,每日两次给予包含以游离碱计约25mg至约400mg或约50mg至约400mg化合物1或其药学上可接受的盐的剂量方案。
[0166]
在一些实施方案中,每日两次给予包含以游离碱计约50mg至约400mg的化合物1或其药学上可接受的盐的剂量方案。
[0167]
在一些实施方案中,每日两次给予包含以游离碱计约200mg至约400mg化合物1或其药学上可接受的盐的剂量方案。
[0168]
在一些实施方案中,每日两次给予包含以游离碱计约50mg至约200mg化合物1或其药学上可接受的盐的剂量方案。
[0169]
在一些实施方案中,所述剂量方案包含以游离碱计约50mg至约100mg化合物1或其药学上可接受的盐,每天口服给药两次。
[0170]
在一些实施方案中,所述剂量方案包含约50mg游离形式的化合物1或其药学上可接受的盐,每日两次口服给药。
[0171]
在一些实施方案中,剂量方案包含以游离碱计约100mg化合物1或其药学上可接受的盐,每天口服给药两次。
[0172]
在一些实施方案中,每日两次口服给药包含以游离碱计约100mg至约700mg化合物1或其药学上可接受的盐的剂量方案。
[0173]
在一些实施方案中,每日两次口服给药包含以游离碱计约100mg至约400mg化合物1或其药学上可接受的盐的剂量方案。
[0174]
在一些实施方案中,每日两次口服给药包含以游离碱计约100mg至约300mg化合物1或其药学上可接受的盐的剂量方案。
[0175]
在一些实施方案中,以游离碱计包含约25mg,约50mg,约100mg,约200mg,约300mg,
约400mg,约500mg,约600mg或约700mg的化合物1或其药学上可接受的盐的剂量方案每天给药两次。
[0176]
在一些实施方案中,每日两次施用以游离碱计包含约25mg,约100mg或约300mg的化合物1或其药学上可接受的盐的剂量方案。
[0177]
在一些实施方案中,每日两次给予包含以游离碱计约100mg,约200mg或约300mg化合物1或其药学上可接受的盐的剂量方案。
[0178]
在一些实施方案中,每日两次给予以游离碱计包含约100mg或约300mg的化合物1或其药学上可接受的盐的剂量方案。
[0179]
在一些实施方案中,每日两次给予包含以游离碱计约100mg化合物1或其药学上可接受的盐的剂量方案。
[0180]
在一些实施方案中,每日两次给予包含以游离碱计约200mg化合物1或其药学上可接受的盐的剂量方案。
[0181]
在一些实施方案中,每日两次给予以游离碱计约300mg化合物1或其药学上可接受的盐的剂量方案。
[0182]
在一些实施方案中,所述一种或多种药物组合物每日两次(bid)给予所述患者。在一些实施方案中,所述一种或多种药物组合物每天一次(qd)给予所述患者。在一些实施方案中,所述一种或多种药物组合物每天三次、每天四次或每天五次给予所述患者。
[0183]
在一些实施方案中,每种组合物适合口服给药。在一些实施方案中,每种组合物被配制成片剂、胶囊、液体形式或水溶液形式。在一些实施方案中,每种组合物被配制成片剂。在一些实施方案中,施用多个片剂以达到期望的剂量。例如,可以向受试者施用约300mg的片剂和约100mg的片剂以达到约400mg的剂量。在一些实施方案中,多个片剂同时或顺序服用。
[0184]
在一些实施方案中,每日两次给予包含约50mg游离碱的化合物1或其药学上可接受的盐的给药方案,其在稳定状态下达到约0.1μm至约1.0μm或约0.3μm至约1.3μm的c
max
,约2h的t
max
,以及约1μm*h至约3μm*h的auc
0-τ
。
[0185]
在一些实施方案中,以游离碱计包含约100mg化合物1或其药学上可接受的盐的剂量方案每日两次施用,其在稳定状态下提供约0.5μm至约2.0μm的c
max
,约2h的t
max
和约4μm*h至约7μm*h的auc
0-τ
。
[0186]
在一些实施方案中,包含约300mg以游离碱计的化合物1或其药学上可接受的盐的给药方案每天给药两次,其在稳定状态下提供约1.0μm至约3.0μm的c
max
,约2的t
max
和约8μm*h至约10μm*h的auc
0-τ
。
[0187]
在一些实施方案中,以游离碱计包含约100mg至约300mg的化合物1或其药学上可接受的盐的剂量方案每日两次施用,其在稳定状态下达到约50%或更高的i
min
,或约70%或更高的i
avg
。
[0188]
在一些实施方案中,每日两次给予包含约100mg以游离碱计的化合物1或其药学上可接受的盐的给药方案,其在稳定状态下达到约50%或更高的i
min
或约70%或更高的i
avg
。
[0189]
在一些实施方案中,赋形剂选自乳糖一水合物,微晶纤维素,聚维酮,交联羧甲基纤维素钠,胶体二氧化硅和硬脂酸镁
[0190]
在一些实施方案中,乳糖一水合物以本文提供的组合物的约20重量%至约35重
量%或约24重量%至约32重量%的量存在。在一些实施方案中,乳糖一水合物以约24重量%至约29重量%的量存在。在一些实施方案中,乳糖一水合物以约24重量%,约25重量%,约26重量%,约27重量%,约28重量%,约29重量%,约30重量%,约31重量%,或约32重量%的量存在。在一些实施方案中,乳糖一水合物以约25重量%,约29重量%,约31重量%或约32重量%的量存在。在一些实施方案中,乳糖一水合物以约24.5重量%,约28.8重量%,约30.75重量%或约32.1重量%的量存在。
[0191]
在一些实施方案中,微晶纤维素以本文提供的组合物的约20重量%至约35重量%或约22重量%至约33重量%的量存在。在一些实施方案中,微晶纤维素以约22重量%,约23重量%,约24重量%,约25重量%,约26重量%,约27重量%,约28重量%,约29重量%,约30重量%,约31重量%,约32重量%或约33重量%的量存在。在一些实施方案中,微晶纤维素以约22重量%,约24重量%或约33重量%的量存在。在一些实施方案中,微晶纤维素以约22.0重量%,约24.2重量%或约32.8重量%的量存在。
[0192]
在一些实施方案中,聚维酮以本文提供的组合物的约0.5重量%至约1.0重量%的量存在。在一些实施方案中,聚维酮以约0.8重量%的量存在。
[0193]
在一些实施方案中,交联羧甲基纤维素钠以本文提供的组合物的约1.0重量%至约10.0重量%的量存在。在一些实施方案中,交联羧甲基纤维素钠以约3.2重量%或约9.6重量%的量存在。在一些实施方案中,交联羧甲基纤维素钠以约3.2重量%的量存在。
[0194]
在一些实施方案中,胶体二氧化硅以本文提供的组合物的约0.1重量%至约1.0重量%的量存在。在一些实施方案中,胶体二氧化硅以约0.5重量%至1.0重量%的量存在。在一些实施方案中,胶体二氧化硅以约0.6重量%或约0.7重量%的量存在。
[0195]
在一些实施方案中,硬脂酸镁以本文提供的组合物的约0.1重量%至约1.0重量%的量存在。在一些实施方案中,硬脂酸镁以约0.6重量%的量存在。
[0196]
在一些实施方案中,本发明提供了治疗患者癌症的方法,其包括向所述患者施用一种或多种口服药物组合物,每种口服药物组合物包含25mg化合物1或其药学上可接受的盐和一种或多种选自约31重量%至约32重量%的乳糖一水合物,约24重量%至约33重量%的微晶纤维素,约0.5重量%至约1.0重量%的聚维酮,约1.0重量%至约10.0重量%的交联羧甲基纤维素钠,约0.1重量%至约1.0重量%的胶体二氧化硅,以及约0.1重量%至约1.0重量%的硬脂酸镁的赋形剂。
[0197]
在一些实施方案中,本发明提供了治疗患者癌症的方法,其包括向所述患者施用一种或多种口服药物组合物,每种口服药物组合物包含100mg化合物1或其药学上可接受的盐和一种或多种选自约31重量%至约32重量%的乳糖一水合物,约24重量%至约33重量%的微晶纤维素,约0.1重量%至约1.0重量%的聚维酮,约1.0重量%至约10.0重量%的交联羧甲基纤维素钠,约0.1重量%至约1.0重量%的胶体二氧化硅,以及约0.1重量%至约1.0重量%的硬脂酸镁的赋形剂。
[0198]
在一些实施方案中,本发明提供了治疗患者癌症的方法,其包括向所述患者施用一种或多种口服药物组合物,每种口服药物组合物包含300mg化合物1或其药学上可接受的盐和一种或多种选自约24重量%至约29重量%的乳糖一水合物,约22重量%至约33重量%的微晶纤维素,约0.1重量%至约1.0重量%的聚维酮,约1.0重量%至约10.0重量%的交联羧甲基纤维素钠,约0.5重量%至约1.0重量%的胶体二氧化硅,以及约0.1重量%至约0.6
重量%的硬脂酸镁的赋形剂。
[0199]
在一些实施方案中,本发明提供了治疗患者黑素瘤的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每日口服两次的剂量方案,其包含50mg至约700mg游离形式的化合物1或其药学上可接受的盐,以及一种或多种免疫检查点分子的抑制剂。
[0200]
在一些实施方案中,本发明提供了治疗患者黑素瘤的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,所述剂量方案包含每日两次口服给予的50mg至约300mg游离形式的化合物1或其药学上可接受的盐,以及每三周给予的派姆单抗。
[0201]
在一些实施方案中,本发明提供了治疗患者黑素瘤的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括每天两次口服给药的包含以游离碱计100mg至约300mg的化合物1或其药学上可接受的盐的剂量方案,以及一种或多种免疫检查点分子的抑制剂。
[0202]
在一些实施方案中,本发明提供了治疗患者黑素瘤的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,所述剂量方案包含每天两次口服给药的以游离碱计100mg至约300mg化合物1或其药学上可接受的盐,以及每三周给予的派姆单抗。
[0203]
在一些实施方案中,本发明提供了治疗患者黑素瘤的方法,其包括向所述患者施用包含化合物1或其药学上可接受的盐和一种或多种赋形剂的药物组合物,以及包含派姆单抗和一种或多种赋形剂的药物组合物,其中所述治疗包括剂量方案,所述剂量方案包含每日两次口服给药的约25mg至约300mg游离形式的化合物1或其药学上可接受的盐,以及每三周给予的派姆单抗。
[0204]
在一些实施方案中,本发明涉及制备如本文所述的药物组合物的方法,其包括将化合物1或其药学上可接受的盐与一种或多种选自以下的赋形剂混合:乳糖一水合物、微晶纤维素、聚维酮、交联羧甲基纤维素钠、胶体二氧化硅和硬脂酸镁。
[0205]
在一些实施方案中,患者处于禁食状态。术语“禁食”是指在施用本文提供的组合物之前,患者禁食至少2小时并且在剂量施用后保持禁食1小时。
[0206]
化合物1可以根据美国专利号8,088,803和美国公开号2015/0133674中的程序制备,其全部内容通过引用并入本文。
[0207]
化合物1可以以各种固体形式存在。如本文所用,“固体形式”意指以一种或多种性质来表征的固体,所述性质例如熔点、溶解度、稳定性、结晶度、吸湿性、水含量、tga特征、dsc特征、dvs特征、xrpd特征等。例如,固体形式可以是非晶的、结晶的或其混合物。
[0208]
不同的结晶固体形式通常具有不同的晶格(例如,晶胞),并且因此通常具有不同的物理性质。在一些情况下,不同的结晶固体形式具有不同的水或溶剂含量。不同的晶格可以通过固态表征方法鉴定,例如通过x射线粉末衍射(xrpd)。其他表征方法如差示扫描量热法(dsc),热重分析法(tga),动态蒸气吸附法(dvs)等还有助于确定固体形式以及帮助确定稳定性和溶剂/水含量。
[0209]
在一些实施方案中,固体形式是结晶固体。在一些实施方案中,化合物1是如美国专利号8,088,803中所述的结晶固体。在一些实施方案中,固体形式基本上是无水的(例如,
含有小于约1%的水,小于约0.5%的水,小于约1.5%的水,小于约2%的水)。例如,含水量由卡尔费休滴定法测定。在一些实施方案中,该固体形式的特征在于约162至约166℃的熔点或dsc吸热聚集在约162至约166℃。在一些实施方案中,固体形式的特征在于约164℃的熔点或dsc吸热集中在约164℃。在一些实施方案中,固体形式具有基本上如图2所示的dsc热谱图。在一些实施方案中,以10℃/min的加热速率从20℃加热至150℃,固体形式具有0.3%的重量损失。参见使用ta instrument q500的热重分析(tga)(图3)。
[0210]
在进一步的实施方案中,固体形式具有至少一个、两个或三个选自约18.4
°
、约18.9
°
、约21.8
°
、约23.9
°
、约29.2
°
和约38.7
°
的以2-θ计的xrpd峰。在进一步的实施方式中,固体形式具有基本上如图1所示的xrpd图谱。
[0211]
在一些实施方案中,该结晶形式具有下表中提供的来自2-θ峰列表中的一个或多个峰。
[0212][0213][0214]
反射(峰)的xrpd图谱通常被认为是特定结晶形式的指纹。众所周知,取决于样品制备技术、晶体尺寸分布、所使用的各种过滤器、样品安装程序以及所使用的特定仪器,
xrpd峰的相对强度可以广泛变化。在某些情况下,根据仪器的类型或设置,可能会观察到新的峰或现有的峰可能会消失。如本文所用,术语“峰”是指具有最大峰高度/强度的至少约4%的相对高度/强度的反射。此外,仪器变化和其他因素可能会影响2-θ值。因此,诸如本文所报道的那些峰分配可以正负约0.2
°
(2-θ)变化,并且本文中在xrpd的情况下使用的术语“基本上”意味着包括上述变化。
[0215]
同样,根据仪器、特定设置、样品制备等,与dsc、tga或其他热实验相关的温度读数可以变化约
±
3℃。因此,本文报道的具有“基本上”如任何附图所示的dsc热谱图的结晶形式被理解为适应这种变化。
[0216]
术语“c
max”是指化合物1的最大血浆浓度。术语“c
min”是指化合物1的最小血浆浓度。这些值直接来自观察的血浆浓度数据。
[0217]
术语“t
max”指的是观察到c
max
的时间。该值直接来自观察的血浆浓度数据。
[0218]
术语“t
1/2”是指化合物1的血浆浓度下降其原始值一半所花费的时间。
[0219]
术语“auc”是指血浆中化合物1的浓度随时间变化的曲线下面积。例如,auc
0-24h
是指从时间0到24小时的血浆中化合物1的浓度的曲线下面积。
[0220]
术语“auc
0-∞”是指外推至无穷大的在血浆中化合物1浓度的曲线下面积。
[0221]
术语“auc
0-t”是指从时间0到具有可定量的血浆浓度的最后一个时间点,通常约12-36小时的血浆浓度-时间曲线下面积。
[0222]
如本文所用,“auc
0-τ”是指从时间0到下一次剂量时间的血浆浓度-时间曲线下的面积。
[0223]
术语“cl/f”是指口服清除率。
[0224]
术语“稳定状态”是指当药物的总体摄入接近于与其消除动态平衡时的状态。
[0225]
使用化合物1对ido1的抑制使用以下方程计算:conc/(conc ec
50
)*100(%)。例如,当conc=0时,则抑制=0,并且当conc接近ec
50
时,则抑制接近50%。血药浓度采用经验证的glp lc/ms/ms方法测量,线性范围为0.020至20.0μm。
[0226]
术语“i
max”是指在所有pk时间点上计算的ido抑制的最大百分比。i
max
是药物施用时间至其谷(例如,存在于受试者中的药物的最低浓度)之间的ido抑制的最大或最高百分比。例如,在每日两次给药中,i
max
是指0小时(给药前)至给药后12小时期间ido抑制的最高百分比。
[0227]
术语“i
min”是指在所有pk时间点计算的ido抑制的最小百分比。i
min
是在谷(例如,通常在每天两次给药的第12小时)处的ido抑制的百分比。例如,i
min
≥50是指在谷(例如,在第12小时)ido抑制为50%或更大。
[0228]
术语“i
avg”是指在从药物施用至谷期间的ido抑制的平均百分比。它被计算为随着时间变化的抑制曲线下的面积(auc)(使用线性梯形法计算)除以给药间隔(例如对于bid给药为12小时)。
[0229]
对于每个剂量组,例如25mg qd、50mg qd等,将每个受试者的计算的i
max
、i
min
和i
avg
值汇总为平均值
±
标准偏差(几何平均值)标准统计计算。
[0230]
术语“ic
50”是指响应减少一半的化合物1的浓度。该值可以从剂量反应的曲线拟合中得出。图4和5显示了在第一次剂量之后和在稳定状态下的各种剂量的化合物1的ic
50
。在时间匹配的化合物1、色氨酸和犬尿氨酸血浆浓度的群体药代动力学-药效学分析中,ido1
的ic
50
计算为70nm(参见实施例3以获得更多细节),其与人全血中的体外结果(125
±
26nm[n=5],研究者手册版本7中的表1)和临床结果(127nm[n=284,所有可用数据]和90nm[n=216,仅来自bid给药的数据]一致。
[0231]
术语“ic
90”是指按照ic
50
值的九倍估计的化合物1的浓度。
[0232]
在一些实施方案中,术语“约”是指值的正负10%。本领域的技术人员知道,由于实验条件(例如数据收集或仪器的可变性),本文中呈现的值可能变化。
[0233]
本文所述的化合物1还包括互变异构形式。互变异构形式由单键与相邻双键交换与伴随的质子迁移共同产生。
[0234]
本文所述的化合物1也可包括存在于中间体或最终化合物中的原子的所有同位素。同位素包括原子序数相同但质量数不同的那些原子。举例来说,氢的同位素包括氚和氘。
[0235]
在一些实施方案中,化合物1及其盐基本上是分离的。“大体上分离的”意指化合物从其形成或检测的环境中至少部分地或大体上分离。部分分离可包括,例如,富含化合物1的组合物。大体上分离可包括含有至少约50重量%、至少约60重量%、至少约70重量%、至少约80重量%、至少约90重量%、至少约95重量%、至少约97重量%或至少约99重量%的化合物1或其盐的组合物。分离化合物和其盐的方法在本领域中为常规的。
[0236]
本发明还包括本文所述的化合物1的盐。如本文所用,“盐”是指本公开的化合物的衍生物,其中通过将现有酸或碱部分转化为其盐形式而对母体化合物进行修饰。盐的实例包括但不限于碱性残基例如胺的无机酸(例如hcl、hbr、h2so4)或有机酸(例如乙酸、苯甲酸、三氟乙酸)盐;酸性残基如羧酸的碱金属(如li、na、k、mg、ca)或有机(如三烷基铵)盐;等等。本发明的盐可通过常规化学方法由含有碱性或酸性部分的母体化合物合成。通常,此类盐可通过使游离酸或游离碱形式的化合物1与化学计量的量的适当碱或酸在水或在有机溶剂中或者在水与有机溶剂的混合物中反应来制备;通常,像醚、乙酸乙酯、乙醇、异丙醇或乙腈(acn)的非水性介质为优选的。
[0237]
本发明的“药学上可接受的盐”包括上述“盐”的子集,即母体化合物的例如由无毒无机酸或有机酸形成的常规无毒盐。合适盐的列表在remington’s pharmaceutical sciences,第17版,mack publishing company,easton,pa.,1985,第1418页和journal of pharmaceutical science,66,2(1977)中发现,它们中的每一个通过引用整体并入本文。本文采用短语“药学上可接受的”指在合理医学判断范围内、适用于与人类和动物组织接触而没有过量毒性、刺激、过敏反应或其他问题或并发症、与合理的利益/风险比相称的那些化合物、材料、组合物和/或剂型。
[0238]
在一些实施方案中,本文所述的药物组合物包含一种或多种赋形剂或药学上可接受的载体。这些组合物可以制药领域中熟知的方式制备,并且可根据是需要局部治疗还是全身性治疗以及待治疗的区域而通过多种途径施用。
[0239]
在一些实施方案中,本文所述的药物组合物适用于口服给药。
[0240]
在一些实施方案中,在制作本文提供的组合物时,化合物1与赋形剂混合,由赋形剂稀释或封闭在这种载剂内呈例如胶囊、药囊、纸或其他容器形式。当赋形剂充当稀释剂时,它可为充当活性成分的媒介物、载剂或介质的固体、半固体或液体材料。因此,组合物可呈片剂、丸剂、粉末、糖锭、药囊、扁囊剂、酏剂、混悬液、乳液、溶液、糖浆、气雾剂(呈固体形
式或于液体介质中)、含有例如多达10重量%活性化合物的软膏剂、软和硬明胶胶囊、栓剂、无菌可注射溶液和无菌包装粉末形式。
[0241]
在一些实施方案中,本文所述的药物组合物呈片剂形式。
[0242]
在制备制剂时,化合物1可在与其他成分组合之前进行研磨以提供适当粒度。在一些实施方案中,可以将化合物1研磨至小于200目的粒度。在一些实施方案中,可以通过研磨来调节粒度以在制剂中提供基本均匀的分布,例如,约40目。
[0243]
适合赋形剂的一些实例包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、淀粉、阿拉伯树胶、磷酸钙、海藻酸盐、黄蓍、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆和甲基纤维素。所述制剂可另外包括:润滑剂,诸如滑石、硬脂酸镁和矿物油;湿润剂;乳化剂和悬浮剂;防腐剂,诸如羟基苯甲酸甲酯和羟基苯甲酸丙酯;甜味剂;和调味剂。本文提供的组合物可通过采用本领域中已知的程序配制,以便在向患者施用之后提供活性成分的快速、持续或延迟释放。
[0244]
所述组合物可以配制成单位剂型。术语“单位剂型”是指适合用作人受试者和其他哺乳动物的单位剂量的物理离散单位,各单位均含有经计算结合适合的药物赋形剂可产生所需治疗作用(例如所需pk概况)的预定量的化合物1。
[0245]
在某些实施方案中,为了制备固体组合物如片剂,将化合物与药物赋形剂混合以形成含有化合物1的均匀混合物的固体预制剂组合物。当提及这些预制剂组合物为均质时,化合物1通常均匀分散在整个组合物中以使组合物可易于再分成等效单位剂型,如片剂、丸剂和胶囊。然后将该固体预制剂再分成单位剂型。
[0246]
本发明的片剂或丸剂可包覆或以其他方式混配以提供给予延长作用的优势的剂型。例如,片剂或丸剂可包含内部剂量组分和外部剂量组分,后者呈位于前者之上的包膜形式。两种组分可由肠溶层分开,所述肠溶层用于抵抗胃中的崩解并且允许内部组分完整进入十二指肠或延迟释放。多种材料可用于此类肠溶层或包衣,此类材料包括许多聚合酸和聚合酸与如虫胶、十六醇和乙酸纤维素的材料的混合物。
[0247]
可掺入本文所述组合物用于经口施用的液体形式包括水溶液、适当调味的糖浆、水或油悬浮液,和具有食用油如棉子油、芝麻油、椰子油或花生油的调味乳剂,以及酏剂和类似的药物媒介物。
[0248]
在一些实施方案中,本文所述的组合物通过常规灭菌技术灭菌,或者可以无菌过滤。可包装水性溶液以用于按原样使用或冻干,其中冻干制剂在施用之前与无菌水性载剂组合。化合物制剂的ph值通常将在3与11之间、更优选为5至9并且最优选为7至8。应了解使用某些前述赋形剂、载剂或稳定剂将导致形成药用盐。
[0249]
化合物的治疗剂量可根据,例如,进行治疗的具体用途、化合物的施用方式、患者的健康和状况,以及处方医生的判断而变化。在一些实施方案中,化合物1的剂量通过获得如本文所述的pk特征(例如,某些c
max
、c
min
、t
max
和/或auc值)来确定。化合物1在药用组合物中的比例或浓度可根据许多因素(包括剂量、化学特征(例如疏水性)和施用途径)而变化。化合物1也可与一种或多种其它活性成分组合配制,所述活性成分可包括任何医药剂,如抗病毒剂、疫苗、抗体、免疫增强剂、免疫抑制剂、消炎剂等。
[0250]
如本文所述的化合物1可以抑制吲哚胺-2,3-双加氧酶(ido或ido1)的活性。例如,通过施用抑制量的化合物1,化合物1可用于在细胞中或需要调节酶的个体中抑制ido的活
性。
[0251]
本发明进一步提供在含有表达ido的细胞如组织、活生物体或细胞培养物的系统中抑制色氨酸降解的方法。在一些实施方案中,本发明提供了通过施用有效量的本文提供的化合物1或组合物来改变(例如增加)哺乳动物细胞外色氨酸水平的方法。测量色氨酸水平和色氨酸降解的方法在本领域中是常规的。
[0252]
本发明进一步提供了通过给予患者有效量的本文所述的化合物或组合物来抑制患者中免疫抑制如ido介导的免疫抑制的方法。ido介导的免疫抑制与例如癌症、肿瘤生长、转移、病毒感染、病毒复制等有关。
[0253]
本发明进一步提供了通过向需要这种治疗的个体施用治疗有效量或剂量的本发明的化合物或其药物组合物来治疗与个体(例如患者)中ido的活性或表达(包括异常活性和/或过度表达)有关的疾病的方法。示例性疾病可以包括与ido酶的表达或活性,例如过表达或异常活性直接或间接相关的任何疾病、病症或病状。ido相关性疾病还可包括可通过调节酶活性进行预防、改善或治愈的任何疾病、病症或病状。ido相关疾病的实例包括癌症,病毒感染诸如hiv感染,hcv感染,抑郁症,诸如阿尔茨海默氏病和亨廷顿病的神经退行性疾病,创伤,年龄相关的白内障,器官移植(例如器官移植排斥)和自身免疫疾病包括哮喘,类风湿性关节炎,多发性硬化症,过敏性炎症,炎性肠病,牛皮癣和系统性红斑狼疮。可通过本文方法治疗的示例性癌症包括结肠癌,胰腺癌,乳腺癌,前列腺癌,肺癌,脑癌,卵巢癌,宫颈癌,睾丸癌,肾癌,头颈癌和淋巴瘤,白血病。在一些实施方案中,癌症是实体肿瘤。在一些实施方案中,癌症是黑素瘤,非小细胞肺癌,泌尿生殖器癌症(例如泌尿生殖(gu)道的移行细胞癌),肾细胞癌,三阴性乳腺癌(tnbc),子宫内膜腺癌,头颈部鳞状细胞癌(scchn),子宫内膜癌,胃癌,胰腺导管腺癌,弥漫性大b细胞淋巴瘤(dlbcl)或卵巢癌(oc)。在一些实施方案中,癌症是黑素瘤。化合物1也可用于治疗肥胖和局部缺血。
[0254]
在一些实施方案中,本发明涉及治疗受试者的癌症的方法,其包括向受试者施用本文所述的药物组合物。
[0255]
如本文所用,术语“细胞”意指体外、离体或体内细胞。在一些实施方案中,离体细胞可为自如哺乳动物的生物体切除的组织样本的一部分。在一些实施方案中,体外细胞可为细胞培养物中的细胞。在一些实施方案中,体内细胞是生活在如哺乳动物的生物体中的细胞。
[0256]
如本文所用,术语“接触”是指在体外系统或体内系统中将指定的部分聚集在一起。例如,使ido酶与化合物1“接触”包括将化合物1施用给患有ido的个体或患者,例如人,以及例如将化合物1引入含有细胞或纯化制剂的样品中,所述细胞或纯化制剂含有ido酶。
[0257]
如本文所使用,可互换使用的术语“受试者”、“个体”或“患者”是指包括哺乳动物的任何动物,诸如小鼠、大鼠、其它啮齿类动物、兔、犬、猫、猪、牛、绵羊、马,或灵长类动物,且最优选为人类。
[0258]
如本文所用,术语“治疗(treating)”或“治疗(treatment)”是指1)抑制疾病;例如,在遭受或显示疾病、疾患或病症的病变或症状的个体中抑制疾病、疾患或病症(即,阻止病变或症状的进一步发展),或2)改善疾病;例如,在遭受或显示疾病、疾患或病症的病变或症状的个体中改善疾病、疾患或病症(即,逆转病变或症状的进一步发展)。
[0259]
如本文所用,术语“预防(preventing)”或“预防(prevention)”是指预防个体中的
疾病、疾患或病症,所述个体可能易感染所述疾病、疾患或病症但是还没有遭受或显示所述疾病的病变或症状。
[0260]
组合疗法
[0261]
一种或多种另外的药剂或治疗方法,例如抗病毒剂、化学治疗剂或其他抗癌剂、免疫增强剂、免疫抑制剂、放射、抗肿瘤和抗病毒疫苗、细胞因子疗法(例如il2、gm-csf等)和/或酪氨酸激酶抑制剂可与化合物1联合用于治疗ido相关疾病、病症或病状。所述剂可与化合物1组合成单一剂型,或所述剂可以单独剂型同时或依序施用。
[0262]
考虑与化合物1组合使用的合适的抗病毒剂可以包括核苷和核苷酸逆转录酶抑制剂(nrti)、非核苷逆转录酶抑制剂(nnrti)、蛋白酶抑制剂和其他抗病毒药物。
[0263]
合适的nrti的实例包括齐多夫定(azt);去羟肌苷(ddl);扎西他滨(ddc);司他夫定(d4t);拉米夫定(3tc);阿巴卡韦(1592u89);阿德福韦酯[双(pom)-pmea];洛布卡韦(bms-180194);bch-10652;恩曲他滨[(-)-ftc];β-l-fd4(也称为β-l-d4c并命名为β-l-2'、3'-双脱氧-5-氟胞苷);dapd,((-)-β-d-2,6,-二氨基-嘌呤二氧戊环);和洛德腺苷(fdda)。典型的合适的nnrti包括奈韦拉平(bi-rg-587);地拉夫定(bhap,u-90152);依法韦仑(dmp-266);pnu-142721;ag-1549;mkc-442(1-(乙氧基-甲基)-5-(1-甲基乙基)-6-(苯基甲基)-(2,4(1h,3h)-嘧啶二酮)和( )-卡拉诺莱得a(nsc-675451)和b。典型的合适的蛋白酶抑制剂包括沙奎那韦(ro 31-8959);利托那韦(abt-538);茚地那韦(mk-639);奈非那韦(ag-1343);安普那韦(141w94);拉西那韦(bms-234475);dmp-450;bms-2322623;abt-378;和ag-1 549。其他抗病毒药物包括羟基脲、利巴韦林、il-2、il-12、pentafuside和伊萨姆项目号11607。
[0264]
适合化学治疗剂或其它抗癌剂包括例如烷化剂(不加限制地包括氮芥、乙烯亚胺衍生物、烷基磺酸盐、亚硝基脲和三氮烯),如尿嘧啶氮芥、氮芥(chlormethine)、环磷酰胺(cytoxantm)、异环磷酰胺(ifosfamide)、美法仑(melphalan)、苯丁酸氮芥(chlorambucil)、哌泊溴烷(pipobroman)、三亚乙基-蜜胺、三亚乙基硫代磷酸胺、白消安(busulfan)、卡莫司汀(carmustine)、洛莫司汀(lomustine)、链脲霉素(streptozocin)、达卡巴嗪(dacarbazine)和替莫唑胺(temozolomide)。
[0265]
在治疗黑素瘤时,与本发明化合物组合使用的合适药剂包括:达卡巴嗪(dtic),任选地与其他化疗药物如卡莫司汀(bcnu)和顺铂一起;由dtic、bcnu、顺铂和他莫昔芬组成的“达特茅斯疗法”;顺铂、长春碱和dtic的组合;或替莫唑胺。本发明的化合物也可与免疫疗法药物,包括细胞因子,如干扰素α、白介素2和肿瘤坏死因子(tnf)组合用于治疗黑素瘤。
[0266]
化合物1也可以与疫苗疗法联合用于治疗黑素瘤。在某些方面,抗黑素瘤疫苗与用于预防由脊髓灰质炎、麻疹和腮腺炎等病毒引起的疾病的抗病毒疫苗相似。被称为抗原的弱化黑素瘤细胞或黑素瘤细胞的部分可以被注射到患者体内以刺激机体的免疫系统来破坏黑素瘤细胞。
[0267]
限制在手臂或腿上的黑素瘤也可以用高温隔离肢体灌注技术用化合物1治疗。该治疗方案暂时将所涉肢体的循环与身体的其余部分分开,并将高剂量化疗注入到向肢体供血的动脉中,从而向肿瘤区域提供高剂量而不使内脏暴露于这些剂量,否则可能导致严重的副作用。通常将流体加热至102
°
至104
°
f。美法仑是这种化疗过程中最常使用的药物。这可以与另一种称为肿瘤坏死因子(tnf)的药物一起给药(参见关于细胞因子的部分)。
[0268]
适合化学治疗剂或其它抗癌剂包括例如抗代谢物(不加限制地包括叶酸拮抗剂、嘧啶类似物、嘌呤类似物和腺苷脱氨酶抑制剂),如甲氨蝶呤(methotrexate)、5-氟尿嘧啶、氟尿苷、阿糖胞苷(cytarabine)、6-巯基嘌呤、6-硫鸟嘌呤、磷酸氟达拉滨(fludarabine phosphate)、喷司他丁(pentostatine)和吉西他滨。
[0269]
适合化学治疗剂或其它抗癌剂进一步包括例如某些天然产物和它们的衍生物(例如长春花生物碱、抗肿瘤抗生素、酶、淋巴因子和表鬼臼毒素(epipodophyllotoxin)),如长春花碱(vinblastine)、长春新碱(vincristine)、长春地辛(vindesine)、博莱霉素(bleomycin)、放线菌素d(dactinomycin)、道诺霉素(daunorubicin)、阿霉素(doxorubicin)、表柔比星(epirubicin)、伊达比星(idarubicin)、阿糖胞苷(ara-c)、紫杉醇(taxoltm)、光神霉素(mithramycin)、脱氧柯福霉素(deoxycoformycin)、丝裂霉素-c(mitomycin-c)、l-天冬酰胺酶、干扰素(尤其ifn-a)、依托泊苷(etoposide)和替尼泊苷(teniposide)。
[0270]
其它细胞毒性剂包括诺维本(navelbene)、cpt-11、阿那曲唑(anastrazole)、来曲唑(letrazole)、卡培他滨(capecitabine)、雷洛昔芬(reloxafine)、环磷酰胺、异环磷酰胺和卓洛昔芬(droloxafine)。
[0271]
也适合的是细胞毒性剂,如表鬼臼毒素;抗赘生酶;拓扑异构酶抑制剂;丙卡巴肼(procarbazine);米托蒽醌(mitoxantrone);铂配位络合物,如顺铂和卡铂;生物反应调节剂;生长抑制剂;抗激素治疗剂;甲酰四氢叶酸(leucovorin);替加氟(tegafur);和造血性生长因子。
[0272]
其它抗癌剂包括抗体治疗剂,诸如曲妥珠单抗(herceptin),针对如ctla-4、4-1bb和pd-1的共刺激分子的抗体或针对细胞因子(il-10、tgf-β等)的抗体。
[0273]
在一些实施方案中,本文提供的化合物1可以与一种或多种免疫检查点抑制剂组合用于治疗本文所述的癌症。在一个实施方案中,与本文所述的一种或多种免疫检查点抑制剂的组合可用于治疗黑素瘤。示例性的免疫检查点抑制剂包括针对免疫检查点分子例如cd27、cd28、cd40、cd122、ox40、gitr、cd137、icos、a2ar、b7-h3、b7-h4、btla、ctla-4、lag3、tim3、vista、pd-1、pd-l1和pd-l2的抑制剂。在一些实施方案中,本文提供的化合物1可以与一种或多种选自kir抑制剂、tigit抑制剂、lair1抑制剂、cd160抑制剂、2b4抑制剂和tgfrβ抑制剂的药剂组合使用。
[0274]
在一些实施方案中,免疫检查点分子的抑制剂是抗pd1抗体、抗pd-l1抗体或抗ctla-4抗体。
[0275]
在一些实施方案中,免疫检查点分子的抑制剂是pd-1的抑制剂,例如抗pd-1单克隆抗体。在一些实施方案中,抗pd-1单克隆抗体是纳武单抗、派姆单抗(也称为mk-3475)、pidilizumab、shr-1210或amp-224。在一些实施方案中,抗pd-1单克隆抗体是纳武单抗或派姆单抗。在一些实施方案中,抗pd1抗体是派姆单抗。派姆单抗的量可以为约2mg/kg。在一些实例中,派姆单抗以约每三周的频率施用。
[0276]
在一些实施方案中,免疫检查点分子的抑制剂是pd-l1的抑制剂,例如抗pd-l1单克隆抗体。在一些实施方案中,抗pd-l1单克隆抗体是bms-935559、medi4736、mpdl3280a(也称为rg7446)或msb0010718c。在一些实施方案中,抗pd-l1单克隆抗体是mpdl3280a或medi4736。
[0277]
在一些实施方案中,免疫检查点分子的抑制剂是ctla-4的抑制剂,例如抗ctla-4抗体。在一些实施方案中,抗ctla-4抗体是伊匹单抗。
[0278]
在一些实施方案中,免疫检查点分子的抑制剂是lag3的抑制剂,例如抗lag3抗体。在一些实施方案中,抗lag3抗体是bms-986016。
[0279]
其它抗癌剂也包括阻断免疫细胞迁移的抗癌剂,如针对包括ccr2和ccr4的趋化因子受体的拮抗剂。
[0280]
其它抗癌剂也包括加强免疫系统的抗癌剂,如佐剂或过继性t细胞转移。
[0281]
抗癌疫苗包括树突细胞、合成肽、dna疫苗和重组病毒。
[0282]
大多数这些化学治疗剂的安全和有效施用的方法是本领域技术人员已知的。另外,它们的施用在标准文献中有描述。举例来说,许多化学治疗剂的施用描述于"physicians'desk reference"(pdr,例如1996版,medical economics company,montvale,nj)中,其公开内容以就如同整体阐述一般的引用的方式并入本文。
[0283]
试剂盒
[0284]
本发明还包括可用于例如治疗或预防与ido相关的疾病或病症、肥胖症、糖尿病和其它本文涉及的疾病的药物试剂盒,其包括一个或多个含有本文所述药物组合物的容器。如果需要,这样的试剂盒还可以包括各种常规药物试剂盒组分中的一种或多种,例如,具有一种或多种药学上可接受的载体的容器,额外的容器等,这对于本领域技术人员来说是显而易见的。试剂盒中还可以包含呈插页或标签形式的说明书,其说明要施用的组分的数量、施用指导和/或混合组分的指导。
[0285]
本发明将通过特定实施例的方式更详细描述。下列实施例是出于说明目的而提供,且不欲以任何方式限制本发明。本领域的技术人员将易于认识到可进行改变或修改以产生基本上相同结果的多种非关键参数。
[0286]
实施例
[0287]
实施例1.化合物1的制剂
[0288]
化合物1配制成25mg、100mg和300mg片剂。交联羧甲基纤维素钠的含量从制剂1和3中的9.6重量%降低至制剂2和4中的3.2重量%。进行这种改变是为了使交联羧甲基纤维素钠的水平达到固体口服剂型的更典型的使用范围,并减少患者给药期间片剂过早崩解的可能性。下表1和2提供了制剂1、2、3和4的细节。
[0289]
片剂根据本领域已知的湿法制粒方法制造。制剂2和制剂4的制造过程的差异包括将一部分微晶纤维素在颗粒外掺入(制剂1和3的片剂将所有这种赋形剂掺入片剂颗粒中),以及对于所有三种剂量强度引入片剂凹痕。
[0290]
表1:25mg和100mg制剂
[0291][0292][0293]
表2:300mg制剂
[0294][0295]
为了评估制剂和制造过程中差异对片剂特性的影响,对各制剂的溶出曲线进行比
较。表3中提供的结果显示了片剂溶解的百分比。表3表明制剂2和4的片剂完全释放,并且片剂中的所述差异(降低的崩解剂含量和相关的制剂调整,颗粒外存在的硬脂酸镁和片剂凹痕)不会不利地影响溶出。
[0296]
表3:体外溶出曲线比较
[0297][0298]
实施例2.确定化合物1在晚期恶性肿瘤患者中的药代动力学、安全性和耐受性的剂量递增研究
[0299]
在剂量递增研究中评估化合物1以确定其在晚期恶性肿瘤患者中的药代动力学。共有52名晚期恶性肿瘤患者参加了8个组群,并接受了50mg qd(n=3)、50mg bid(n=4)、100mg bid(n=5)、300mg bid(n=6)、400mg bid(n=11)、500mg bid(n=5)、600mg bid(n=14)和700mg bid(n=4)的化合物1剂量。向受试者提供如实施例1中所述的25mg、100mg或300mg的制剂1和/或3的多个片剂,以达到上述剂量。禁食至少2小时后用水口服给药,受试者在给药后仍保持禁食1小时。
[0300]
使用lavender top(k2edta)管在第1周期第1天和第1周期第15天在给药后0、0.5、1、2、4、6、8和10(任选)小时收集用于测定化合物1的血浆浓度的血液样本。另外,对于未退出的患者,在第1周期第8天和每个后续治疗周期的第1天采集血液样本。本研究中未收集尿样用于化合物1药代动力学分析。
[0301]
血浆样品通过验证的glp、lc/ms/ms方法测定,线性范围为0.020-20.0μm。表4总结了分析来自该研究的血浆样品期间测定质量控制样品的准确度(偏差%)和精度(cv%)。
[0302]
表4:血浆测定质量控制样品的准确度和精度
[0303][0304]
a theo=理论或名义浓度
[0305]
药代动力学分析
[0306]
使用phoenix winnonlin 6.0版(pharsight corporation,mountain view,ca),使用标准的非区室药代动力学方法来分析化合物1血浆浓度数据。因此,c
max
、c
min
和t
max
直接取自观察的血浆浓度数据或在某些情况下进行估算。使用终末处置阶段中的浓度数据的对
数线性回归来估计终末阶段处置速率常数(λz),并且将t
1/2
估计为ln(2)/λz。auc
0-t
和auc
0-τ
使用增加浓度的线性梯形规则和降低浓度的对数梯形规则估计。在pk稳定状态时,表观口服剂量清除率cl/f估计为剂量/auc
0-τ
,并且vz/f估计为剂量/[auc
0-τ
*λz]。
[0307]
统计学分析
[0308]
使用具有针对剂量的因子的1-因子anova,在bid剂量组之间比较对数转换后的药代动力学参数。在进行统计学比较之前,将剂量依赖性暴露参数(c
max
和auc)归一化为常用剂量。
[0309]
对于bid剂量,使用幂函数回归(例如,auc
0-12h
=α
·
剂量
β
)评估化合物1稳定状态(如在第1周期第15天观察到的)c
max
和auc
0-12h
的剂量比例性,其中如果β与1没有统计学显著差异,剂量比例性是可接受的。
[0310]
为了确定食物对稳定状态化合物1药代动力学的作用,使用具有治疗的固定效应和受试者的随机效应的单因子交叉设计的anova来比较对数转换后的药代动力学参数。基于来自anova的调整平均值(最小二乘均值)计算几何平均相对生物利用度(参考处理是在第1周期第15天禁食状态下施用),以及c
max
和auc
0-τ
的90%置信区间(ci)。如果90%ci排除1的值,那么食物对c
max
和auc的影响被认为是统计学显著的。
[0311]
结果
[0312]
研究结果总结在下表中。
[0313]
表7:化合物1稳定状态药代动力学参数的总结
[0314][0315]
在禁食状态下给药后,通常在给药后2小时(中值t
max
)观察到化合物1峰血浆浓度(c
max
),随后,化合物1血浆浓度以单指数或双指数方式下降。终末阶段t1/2似乎是剂量无关的,对于在第1周期第15天具有可估计t1/2值的所有受试者(n=42,受试者间cv=35.2%),几何平均值为2.9小时。
[0316]
在重复bid给予化合物1之后,根据谷血浆浓度的时间过程判断,在给药的第8天或之前观察到pk的稳定状态。50mg qd剂量的谷浓度较低,一般无法量化(》bql)。化合物1的相对短的t
1/2
表明在给药后2天内达到pk稳定状态。
[0317]
对于7种bid剂量,第15天与第1天的平均药物积累指数或c
max
和auc
0-τ
的几何平均比(gmr)分别为1.16和1.33,这明显大于由2.9小时的t
1/2
值暗示的积累程度,这又意味着肝肠再循环或胆道再循环。重复50mg qd给药后没有全身积累的证据。
[0318]
化合物1的暴露度略微不太与剂量成比例。对于稳定状态下的bid剂量,幂函数回归分析产生剂量-比例方程,c
max
=0.330
·
剂量
0.779
(对于β=1,p=0.0025),auc
0-12h
=0.103
·
剂量
0.843
(对于β=1,p=0.043)。幂函数的指数β(或等效的对数转换方程的斜率)的90%ci对于c
max
是(0.664,0.895),对于auc
0-12h
是(0.717,0.969)。由于β的90%ci的上限小于1,化合物1暴露度(c
max
和auc
0-12h
)在50至700mg bid范围内在统计学上显著偏离剂量比例
性。剂量比例性的亚线性程度是中等的,如由auc的0.843的β点估计值所指示的(例如,在剂量增加10倍的情况下,该方程估计auc增加约7倍)。
[0319]
化合物1血浆暴露在稳定状态下表现出适度的受试者间变异性,c
max
的变异系数(cv%)为20.8%至46.8%,auc
0-12h
的变异系数为8.8至44.5%。
[0320]
在一个扩大的组群中,对于600mg bid剂量,评估了标准化高脂肪膳食对化合物1稳定状态药代动力学的食物效应。结果总结于下表8中。
[0321]
表8:高脂肪膳食对化合物1pk的影响
[0322][0323]
值是平均值
±
sd和几何平均值,除了t
max
被报告为中值(范围)以外
[0324]
*由于在进食状态下给药的大多数受试者中无法估计t1/2值,因此在给药后12h的浓度值是从第2周期第1天早上的给药前谷值推断的。
[0325]
**对完成食物效应研究的9名受试者使用对数转换的药物暴露数据进行统计分析。
[0326]
高脂膳食的施用使平均化合物1t
max
延长4小时,几何平均c
max
降低约10%,几何平均auc
0-12h
增加22%。c
max
和auc
0-12h
的gmr点估计的90%ci跨越1的值,并且来自单因子交叉anova的相应p值大于0.05,表明高脂膳食对化合物1血浆暴露的影响没有统计学意义。食物对化合物1暴露影响的程度在临床上似乎也不重要。虽然没有研究中等脂肪膳食的影响,但预计化合物1pk的变化与高脂膳食相比更不明显。
[0327]
口服生物利用度和全身清除率
[0328]
估计口服生物利用度(f)和全身清除率(cl)。汇总来自在第1周期第15天具有可评估的口服剂量清除率(cl
口服
=cl/f)的42位受试者的数据,几何平均值为55.3l/h(范围:23.3-180l/h;受试者间cv%=44.3%)。可以使用方程f=qh/(qh cl/f)和cl=(qh*cl/f)/(qh cl/f)来估算化合物1的f和cl的值(参见gibaldi m和perrier d,pharmacokinetics,第2版,informa healthcare usa,new york 2007),其中q是人肝血流速率的典型值(约87l/h)。这种估计方法假定接近完全的口服吸收,并且肝脏是药物清除的主要器官。由于在小鼠、猴子和狗中观察到的未改变的化合物1的肾排泄小于iv给药的3%,所以化合物1几乎完全被肝脏清除的假设似乎是合理的近似。然而,亚线性剂量-暴露关系表明吸收的口服剂量部分(fa)随着化合物1剂量的增加而降低。基于来自临床前pk研究的数据(未显示),在食蟹猴和比格犬中fa分别可估计为48%和81%。因此,化合物1的人类fa估计为64%(食蟹猴
和比格犬中的平均值)。将上面的方程修改以包含fa的项以适应不完全吸收:cl=(qh*fa*cl/f)/(qh fa*cl/f)。使用fa=64%,qh=87l/h和cl/f=55.3l/h的平均估计值,平均全身清除率cl估计为25l/h,平均绝对生物利用度(f)估计为45%(cl/cl
口服
)。由于估计的肝脏提取率为29%(cl/qh),化合物1可以被认为是低清除率化合物。以肝血流百分比表示,人类(29%)的估计全身清除率与食蟹猴(31%)和比格犬(26%)中观察到的相当。
[0329]
化合物1在血浆中的未结合部分被确定为3.1%,并且计算出最高稳定状态平均未结合每日auc
0-24h
(=2
×
auc
0-12h
)为2.2μm*h,与700mg bid剂量相关联。该值远低于在28天的glp毒理学研究中在500mg/kg/天剂量组中在雄性犬中观察到的7.9μm*h的noael未结合auc
0-24h
。
[0330]
概述
[0331]
总之,在禁食状态下口服给药后,通常在给药后2小时达到化合物1的峰值血浆浓度。化合物1通过2.9小时的几何平均终末处置半衰期来消除。bid给药后的全身性积累分别提高了化合物1c
max
和auc
0-τ
的平均值16%和33%,表明4-6小时的“有效”半衰期。化合物1c
max
和auc
0-τ
的增加不太与剂量成比例。稍低于剂量比例关系最可能是由于该化合物在较高剂量下肠道吸收的速率和/或程度有限。高脂膳食使化合物1中值t
max
延迟了4小时,但没有引起化合物1血浆暴露的临床显著变化。因此,化合物1可以不考虑食物而给药。在禁食状态下给药后,观察到在稳定状态下化合物1血浆暴露的适度受试者间变异性。在该研究(700mg bid剂量组)中观察到的最高稳定状态平均未结合0-24小时auc(2.2μm*h)远低于在28天glp毒理学研究中观察到的7.9μm*h的noael未结合auc
0-24h
。
[0332]
实施例3.化合物1与mk-3475组合
[0333]
在研究中评估化合物1以确定其在患有各种癌症的受试者中的药代动力学。受试者不限于特定的癌症,并且研究包括患有各种癌症的受试者。阶段1是剂量递增阶段,其包括用以下治疗的受试者组群:25mg bid、50mg bid和100mg bid的初始剂量的化合物1与每3周(q3w)2mg/kg的mk-3475(也称为派姆单抗,lambrolizumab和)的组合,以及300mg bid化合物1与mk-3475(200mg/kg q3w)的组合。一个治疗周期由21天组成。每个组群中至少有3名受试者参加并接受治疗,在随后的组群开始登记前,所有3名受试者都至少观察42天(6周)。在42天剂量限制性毒性(dlt)观察期期间,对于至少80%的剂量,受试者必须已经接受了群组特异性剂量的化合物1,并且在42天期间必须已经接受2个剂量的mk-3475或者必须经历dlt才能纳入dlt的组群评估。如果发生导致受试者不能评估dlt的退出或剂量中断或减少,则将其他受试者纳入组群以获得最少3名可评估受试者。当建立50mg bid和100mg bid的初步安全性时,将其他患有黑素瘤的受试者纳入50mg bid,以获得总共9名受试者。与所测试的300mg bid并行地开始100mg bid的另外的安全组群。这也可能限于患有黑素瘤、nsclc或特定癌症类型的受试者,这些癌症类型选自在第1阶段中包括的癌症类型。rp2d是从评估的安全扩展中选择的。这些安全性扩展中的所有受试者均用mk-3475 200mg q3w治疗。
[0334]
将化合物1自行口服施用bid,并且在mk-3475的每3周剂量方案的21天周期期间继续bid。在第1阶段中使用的化合物1的最大耐受剂量(mtd)(或群体调整剂量(pad))用于第2阶段。所有bid剂量在早上和晚上间隔约12小时服用,不考虑食物。如果错过了剂量超过4小时,该剂量被略过并在预定时间重新开始。
[0335]
受试者抵达诊所时已停止其早晨剂量的化合物1。在第1周期第1天、第1周期第8天和第2周期第1天的访视中获得药代动力学样品。在给药前(其定义为在施用mk-3475之前和施用化合物1之前24小时内)后,抽取pk样品,受试者服用化合物1,然后开始输注mk-3475。将pk抽血的确切日期和时间与最后一剂研究药物的日期和时间以及抽血前最后一餐的细节一起记录在ecrf中。
[0336]
采用经验证的glp、lc/ms/ms方法分析血浆样品,线性范围为0.020至20μm,定量限为0.020μm。
[0337]
计划的pk时间点用于初步pk分析。由于在给药后6或8小时内pk取样有限,为了计算auc
0-12h
,c1d10的pk访视的c12h值由同一天的给药前浓度推断。使用phoenix winnonlin 6.4版(pharsight corporation,mountain view,ca),使用标准非区室分析(nca)方法来分析化合物1血浆浓度数据。
[0338]
药代动力学模型
[0339]
在非区室分析(nca)中,epa显示了近似的剂量比例暴露,表明与epa浓度无关的恒定的清除率。(kleiber m.,j theor biol.1975;53(1):199-204)。对于基础结构模型开发,对于包括口服吸收的第一级动力学,1、2或3室分布和来自中央室的线性消除的标准室pk模型的能力进行测试,以便表征epa的观察到的血浆浓度-时间曲线。
[0340]
在确定了最终的基础结构模型后,首先通过目视检查参数(例如,cl/f)的随机变量(η)与协变量之间的相关性来探索包括体重(bw)、年龄和性别的协变量对pk参数的影响。然后在模型中加入显示出暂定相关性的协变量。在前向选择过程中,认为造成目标函数(α=0.01)至少减少6.63的协变量被认为是显著的,如果协变量在后向消除过程中从模型中去除时,造成目标函数值(α=0.001)至少增加10.8,则被认为是显著的。在逐步选择程序完成之后,还针对可能的协变量方程的简化来检查模型,例如如果从理论考虑证明合理可以简化为线性函数(幂项为约1.0)的幂函数。
[0341]
完成模型开发过程后,通过两种验证方法评估最终模型的预测性能:可视预测检查(vpc)和内部验证。使用vpc的最终模型对总共1000个重复的分析数据集进行模拟。所关注的统计数字(第50[中位数],第10-90和第5-95百分位数)是从每个模拟采样时间点的模拟浓度值计算出来的。准备了图形模型评估结果,其中包括基于模拟的复制数据集在预测区间上叠加原始数据。作为内部验证,最终模型在数据子集(在这种情况下,第1天的首次剂量的pk数据)上进行了测试。所估计的参数值缺乏显著变化支持该模型拟合所观察数据的能力。
[0342]
药效学模型
[0343]
构建机理群体pd模型以捕获由ido1和tpo并行催化的trp生物转化成kyn的主要组分。在这个模型中,kyn的血浆浓度是因变量(dv)。trp是必需氨基酸之一,是人体内丰富的内源性化学物质,在本研究中观察到的平均血浆浓度为约60μm。相比之下,kyn是trp的分解代谢产物之一,其产量相对较少(trp的2-3%)。由于trp保持预期的体内平衡,预计对于kyn产生的抑制不会显著改变trp的水平。因此,该pd模型不包括trp的形成速率;在取样时间点的trp浓度是观测值并用作模型输入。假定epa对ido1的抑制遵循s形imax/ic
50
模型:
[0344]
[0345]
其中[epa]是epa血浆浓度,ic
50
是导致50%最大抑制率imax的[epa],其在该模型中被假定为100%(因为在体外高浓度的epa中观察到ido1的几乎完全抑制),而n是希尔因素。通过经由ido1和tpo的平行途径从trp到kyn的生物转化由以下方程描述:
[0346][0347]
其中[trp]和[kyn]分别是trp和kyn的血浆浓度,k1和k2分别是通过ido1和tpo的kyn形成速率常数,而kdeg是kyn降解的速率常数。[kyn]的初始值的估计值由以下计算得出:
[0348][0349]
模型构建和协变量测试的程序与上述pk模型的程序类似。该pd模型的主要终点是ic
50
的估计值。
[0350]
研究结果在下面示出。
[0351]
表9.化合物1首次剂量pk参数(按照组群和剂量)
[0352][0353][0354]
*由于pk概况不完整,受试者103006从pk分析中排除(在0.5、1和2小时仅收集三个给药后pk样品)。
[0355]
**受试者101025实际上是第2部分受试者(nsclc pd-l1高),其在之前的pk更新(2016年6月)中被错误地归类为第1部分第7组受试者。
[0356]
mel:黑素瘤
[0357][0358]
数值以“平均值
±
sd(几何平均数)”的格式呈现,除了t
max
的“中值(最小值,最大值)”以外
[0359]
*由于pk概况不完整,受试者103006(组群6)从pk分析中排除(在0.5、1和2小时仅收集三个给药后pk样品);
[0360]
*受试者101025实际上是第2部分受试者(nsclc pd-l1高),其在之前的pk更新中被错误地归类为第1部分第7组受试者。
[0361]
表10.化合物1稳定状态(c1d8)pk参数(按照组群和剂量)
[0362][0363][0364]
*由于缺少c1d8上的给药前pk样品,因此将受试者101009从pk分析中排除;
[0365]
**受试者101025实际上是第2部分受试者(nsclc pd-l1高),其在之前的pk更新中被错误地归类为第1部分第7组受试者。
[0366][0367][0368]
数值以“平均值
±
sd(几何平均数)”的格式呈现,除了tmax的“中值(最小值,最大值)”以外
[0369]
nc:由于至少一个pk样品是bql而不可计算的;
[0370]
*由于缺少c1d8上的给药前pk样品,因此将受试者101009(组群2)从pk分析中排除;
[0371]
**受试者101025实际上是第2部分受试者(nsclc pd-l1高),其在之前的pk更新中被错误地归类为第1部分第7组受试者。
[0372]
经受c4d1剂量减少的受试者:
[0373]
50mg bid:102006(组群2,50mg bid 2mg/mg q3w),102012(组群4,50mg bid 200mg q3w),102019(组群4,50mg bid 200mg q3w);
[0374]
300mg bid:101015(组群6,300mg bid 200mg q3w),103006(组群6,300mg bid 200mg q3w),104006(组群6,300mg bid 200mg q3w),和101022(组群7,300mg bid 200mg q3w扩展)
[0375]
表11.c1d8上的预计稳定状态ido1抑制(按照组群和剂量)
[0376][0377][0378][0379]
数值以“平均值
±
sd(几何平均数)来呈现;
[0380]
预计的pd(ido)抑制作用计算为conc/(conc ec50)*100(%),其中ec50=70nm;
[0381]
nc:由于至少一个pk样品是bql而不可计算(因此pd抑制预计为0%);
[0382]
使用线性上升对数下降法计算时间平均的ido1抑制;
[0383]
结果也显示在图中。图4和图5是第一剂量后(图4)和稳定状态下(图5)的按照剂量的化合物1血浆浓度(平均值
±
se)的图。图6是c1d8和c2d1上化合物1血浆浓度(平均值
±
se)的图。图7和图8是c1d8上化合物1的剂量比例pk(第1部分中的所有组群)的图。图9显示了各种剂量(n=58)的预计ido1抑制百分比的瀑布图。
[0384]
表12.首次剂量药代动力学参数
[0385]
[0386][0387]
数值以“平均值
±
sd(几何平均数)”的格式呈现,除了t
max
的“中值(最小值,最大值)”以外。
[0388]
dlbcl:弥漫性大b细胞淋巴瘤;gu:泌尿生殖癌;mel:黑素瘤;nsclc:非小细胞肺癌;oc:卵巢癌;rcc:肾细胞癌;scchn:头颈部鳞状细胞癌;tnbc:三重阴性乳腺癌。
[0389]
表13.稳定状态(c1d8)药代动力学参数
[0390]
[0391][0392]
数值以“平均值
±
sd(几何平均数)”的格式呈现,除了tmax的“中值(最小值,最大值)”以外。
[0393]
nc:由于至少一个pk样本是bql而不可计算。
[0394]
经受c4d1剂量减少的受试者:
[0395]
gu:107014;
[0396]
nsclc pd-l1高:101025;
[0397]
oc:102042、109010、113002和116003;
[0398]
scchn:101045。
[0399]
dlbcl:弥漫性大b细胞淋巴瘤;gu:泌尿生殖癌;mel:黑素瘤;nsclc:非小细胞肺癌;oc:卵巢癌;rcc:肾细胞癌;scchn:头颈部鳞状细胞癌;tnbc:三重阴性乳腺癌。
[0400]
表14.c1d8上的预计稳定状态ido抑制
[0401]
[0402][0403]
数值以“平均值
±
sd(几何平均数)来呈现,其中n》2;
[0404]
预计的pd(ido)抑制作用计算为conc/(conc ec50)*100(%),其中ec=70nm;
[0405]
nc:由于至少一个pk样品是bql而不可计算(因此pd抑制预计为0%);
[0406]
使用线性上升对数下降法计算时间平均的ido1抑制;
[0407]
*计数具有可计算iavg的受试者人数;
[0408]
dlbcl:弥漫性大b细胞淋巴瘤;gu:泌尿生殖癌;mel:黑素瘤;nsclc:非小细胞肺癌;oc:卵巢癌;rcc:肾细胞癌;scchn:头颈部鳞状细胞癌;tnbc:三重阴性乳腺癌。
[0409]
结果也显示在图中。图10和图11显示接受100mg bid的受试者中第1部分和第2部分之间的在第一次剂量之后(图10)和在稳定状态下(在c1d8,图11)的化合物1血浆浓度(平均值
±
se)的比较。
[0410]
图12显示接受100mg bid的受试者中c1d8和c2d1的化合物1谷浓度(平均值
±
se)的图。图13和图14显示对于各种肿瘤类型的稳定状态pk的化合物1的盒图。图15显示了稳定状态下预计的ido1抑制百分比的瀑布图。
[0411]
除本文所述的修改之外,本发明的各种修改也将为本领域的技术人员根据以上描述所显而易知。这些修改也意图属于随附权利要求书的范围内。本公开中引用的各参照案,包括所有专利、专利申请和公布皆以全文引用的方式并入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
