1.本发明涉及人工种子技术领域,尤其涉及一种多花黄精人工种子及其制备方法。
背景技术:
2.人工种子是将植物离体培养产生的体细胞胚、微芽(顶芽、腋芽)、微型变态器官(小鳞茎等),包裹在含有养分和具有保护功能的物质中,并在适宜条件下能够发芽出苗的颗粒体,人工种子研究最多的繁殖体是体细胞胚。穆拉希吉1978年在第四届国际植物组织培养大会上首次提出研制人工种子的设想。从20世纪80年代开始,美、日、法相继掀起人工种子研制的热潮。我国也在1987年将人工种子的研究列入高技术发展计划(863计划)。国外已研制成胡萝卜、苜蓿、芹菜、花椰菜、莴苣、花旗松、天竺葵等植物的人工种子。我国继1988年在国际上首次研制成功水稻人工种子后,研制成了旱芹、花椰菜、杂交水稻等许多种作物的人工种子。
3.多花黄精为百合科黄精属多年生草本植物,以其干燥根茎入药,按形状又名“姜形黄精”。多花黄精是公认的品质突出品种,因其显著的药用及食用价值,市场对其需求逐年增大。目前市场上多花黄精的供需矛盾日趋尖锐,野生资源濒临枯竭。人工栽培是解决多花黄精种质资源短缺的有效途径,多花黄精为多年生草本植物,近年逐步实现了人工驯化栽培,其繁育方法主要有有性繁殖、无性繁殖及组培快繁等方法,对于多花黄精人工种子的研究尚且匮乏。
技术实现要素:
4.本发明的目的在于提供一种多花黄精人工种子及其制备方法,缓解多花黄精资源短缺的问题。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种多花黄精人工种子的制备方法,包括如下步骤:将多花黄精体细胞胚和人工胚乳混合后放入人工种皮中,10~20min后漂洗得到多花黄精人工种子。
7.作为优选,所述人工胚乳的配方为:ms 1.5~2.5mg/ml 6-ba 0.1~0.3mg/mlnaa 蔗糖25~30g/l;所述人工胚乳的ph值为5.8~6.0。
8.作为优选,所述人工种皮包括如下重量份的原料:海藻酸钠3~5份、氯化钙1~3份、水92~96份。
9.作为优选,所述多花黄精体细胞胚的制备方法为:
10.(1)将多花黄精无菌苗的叶片切成0.3~0.7cm
×
0.3~0.7cm的小块,在愈伤诱导培养基中培养30~40天,得到多花黄精愈伤组织;
11.(2)将多花黄精愈伤组织接种到悬浮培养基中,在20~30℃、80~120r
·
min-1
条件下摇床培育25~35天后转移到固体培养基中,在21~27℃条件下培养14~21天得到多花黄精体细胞胚。
12.作为优选,所述愈伤诱导培养基的配方为:ms 0.8~1.2mg/ml naa 1.5~2.5mg/
ml 2,4-d 琼脂7.0~7.5g/l 蔗糖25~30g/l;所述愈伤诱导培养基的ph值为5.8~6.0。
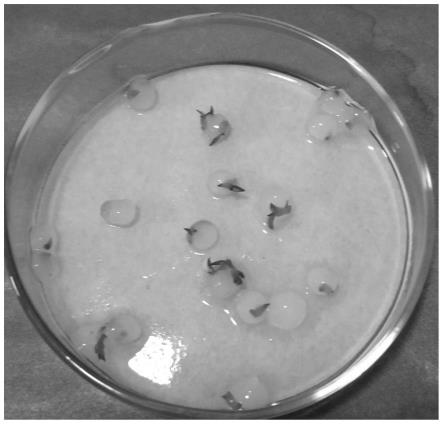
13.作为优选,所述悬浮培养基的配方为:ms 1.5~2.5mg/ml6-ba 0.1~0.3mg/mlnaa 蔗糖25~30g/l;所述悬浮培养基的ph值为5.8~6.0。
14.作为优选,所述固体培养基的配方为:ms 1.5~2.5mg/ml6-ba 0.1~0.3mg/mlnaa 琼脂7.0~7.5g/l 蔗糖25~30g/l;所述固体培养基的ph值为5.8~6.0。
15.本发明还提供了所述制备方法得到的多花黄精人工种子。
16.本发明提供了一种多花黄精人工种子及其制备方法,将多花黄精体细胞胚和人工胚乳混合后放入人工种皮中,10~20min后漂洗得到多花黄精人工种子。本发明的制备方法通过利用现代生物技术解决了多花黄精资源短缺的问题,充分发挥植物体细胞胚生长速度快,性状稳定的特点。本发明所制备的多花黄精人工种子可以有效解决其长期组织培养过程中的褐化、变异、生长周期长和培养成本的缺陷,开辟了一种新的黄精种子种苗繁育途径,同时其萌发率高达90%。
附图说明
17.图1为实施例1中建立成功的黄精无菌系;
18.图2为实施例1中黄精种子萌发的无菌苗;
19.图3为实施例1中诱导成功的黄精愈伤组织团块;
20.图4为实施例1中黄精体细胞胚诱导成功的黄精人工种子。
具体实施方式
21.本发明提供了一种多花黄精人工种子的制备方法,包括如下步骤:将多花黄精体细胞胚和人工胚乳混合后放入人工种皮中,10~20min后漂洗得到多花黄精人工种子。
22.在本发明中,所述漂洗的时间优选为放入人工种皮12~18min后,进一步优选为15min。
23.在本发明中,所述漂洗时优选用无菌水水进行漂洗。
24.在本发明中,所述人工胚乳的配方优选为:ms 1.5~2.5mg/ml 6-ba 0.1~0.3mg/ml naa 蔗糖25~30g/l,进一步优选为ms 2.0mg/ml 6-ba 0.2mg/ml naa 蔗糖27~28g/l。
25.在本发明中,所述人工胚乳的ph值优选为5.8~6.0,进一步优选为5.9。
26.在本发明中,所述人工种皮优选包括如下重量份的原料:海藻酸钠3~5份、氯化钙1~3份、水92~96份,进一步优选为海藻酸钠4份、氯化钙2份、水94份。
27.在本发明中,所述多花黄精体细胞胚的制备方法为:
28.(1)将多花黄精无菌苗的叶片切成0.3~0.7cm
×
0.3~0.7cm的小块,在愈伤诱导培养基中培养30~40天,得到多花黄精愈伤组织;
29.(2)将多花黄精愈伤组织接种到悬浮培养基中,在20~30℃、80~120r
·
min-1
条件下摇床培育25~35天后转移到固体培养基中,在21~27℃条件下培养14~21天得到多花黄精体细胞胚。
30.在本发明中,所述多花黄精无菌苗的制备方法优选为:将多花黄精种子用洗衣粉溶液洗2~4遍,用水清洗2~4遍,吸干表面水分后,在无菌环境中用70~80%的酒精消毒25~35s,再用0.08~0.12%的氯化汞消毒3~7min,用无菌水冲洗2~3遍,切下胚轴的下端后
将种子接种到多花黄精启动培养基中,培养得到多花黄精无菌苗,进一步优选为将多花黄精种子用洗衣粉溶液洗3遍,用水清洗3遍,吸干表面水分后,在无菌环境中用75%的酒精消毒30s,再用0.10%的氯化汞消毒5min,用无菌水冲洗2遍,切下胚轴的下端后将种子接种到多花黄精启动培养基中,培养得到多花黄精无菌苗。
31.在本发明中,所述多花黄精启动培养基的配方优选为:ms 6-ba 0.1~0.3mg/l 2,4-d 0.1~0.3mg/l ga3 1.5~2.5mg/l 琼脂7.0~7.5g/l 蔗糖25~30g/l,进一步优选为ms 6-ba 0.2mg/l 2,4-d 0.2mg/l ga3 2.0mg/l 琼脂7.2~7.3g/l 蔗糖27~28g/l。
32.在本发明中,所述多花黄精启动培养基的ph值优选为5.8~6.0,进一步优选为5.9。
33.在本发明中,所述胚轴的下端优选为与氯化汞接触的一端。
34.在本发明中,步骤(1)中所述小块的大小优选为0.4~0.6cm
×
0.4~0.6cm,进一步优选为0.5cm
×
0.5cm。
35.在本发明中,所述愈伤诱导培养基中培养的时间优选为32~38天,进一步优选为35天。
36.在本发明中,步骤(2)中所述培养悬浮培养基中的温度优选为22~28℃,进一步优选为25℃。
37.在本发明中,步骤(2)中所述悬浮培养基中培养的摇床条件优选为90~110r
·
min-1
,进一步优选为100r
·
min-1
。
38.在本发明中,步骤(2)中所述悬浮培养基中培养的时间优选为28~32天,进一步优选为30天。
39.在本发明中,步骤(2)中所述接种时优选将多花黄精愈伤组织用镊子夹碎。
40.在本发明中,步骤(2)中所述固体培养基中的温度优选为22~28℃,进一步优选为25℃。
41.在本发明中,步骤(2)中所述固体培养基中培养的时间优选为28~32天,进一步优选为30天。
42.在本发明中,所述愈伤诱导培养基的配方优选为:ms naa 0.8~1.2mg/ml 2,4-d 1.5~2.5mg/ml 琼脂7.0~7.5g/l 蔗糖25~30g/l,进一步优选为ms naa 1.0mg/ml 2,4-d 2.0mg/ml 琼脂7.2~7.3g/l 蔗糖27~28g/l。
43.在本发明中,所述愈伤诱导培养基的ph值优选为5.8~6.0,进一步优选为5.9。
44.在本发明中,所述悬浮培养基的配方优选为:ms 1.5~2.5mg/ml 6-ba 0.1~0.3mg/mlnaa 蔗糖25~30g/l,进一步优选为ms 2.0mg/ml 6-ba 0.2mg/mlnaa 蔗糖27~28g/l。
45.在本发明中,所述悬浮培养基的ph优选为5.8~6.0,进一步优选为5.9。
46.在本发明中,所述固体培养基的配方优选为:ms 1.5~2.5mg/ml 6-ba 0.1~0.3mg/mlnaa 琼脂7.0~7.5g/l 蔗糖25~30g/l,进一步优选为ms 2.0mg/ml 6-ba 0.2mg/mlnaa 琼脂7.2~7.3g/l 蔗糖27~28g/l。
47.在本发明中,所述固体培养基的ph优选为5.8~6.0,进一步优选为5.9。
48.本发明还提供了所述制备方法得到的多花黄精人工种子。
49.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解
为对本发明保护范围的限定。
50.实施例1
51.一种多花黄精人工种子的制备方法:
52.(1)将多花黄精种子用洗衣粉溶液洗3遍,用水清洗3遍,吸干表面水分后,在无菌环境中用75%的酒精消毒30s,再用0.10%的氯化汞消毒5min,用无菌水冲洗3遍,切下胚轴的下端(与氯化汞接触的一端)后将种子接种到多花黄精启动培养基(ms 6-ba 0.2mg/l 2,4-d 0.2mg/l ga3 2.0mg/l 琼脂7.2g/l 蔗糖28g/l;ph5.9)中,培养得到多花黄精无菌苗;
53.(2)将多花黄精无菌苗的叶片切成0.5cm
×
0.5cm的小块,在愈伤诱导培养基(ms naa 1.0mg/ml 2,4-d 2.0mg/ml 琼脂7.2g/l 蔗糖28g/l;ph 5.9)中培养35天,得到多花黄精愈伤组织;
54.(3)将多花黄精愈伤组织用镊子夹碎后接种到悬浮培养基(ms 2.0mg/ml 6-ba 0.2mg/mlnaa 蔗糖28g/l;ph 5.9)中,在25℃、100r
·
min-1
条件下摇床培育30天后转移到固体培养基(ms 2.0mg/ml 6-ba 0.2mg/mlnaa 琼脂7.3g/l 蔗糖28g/l;ph 5.9)中,培养得到多花黄精体细胞胚;
55.(4)将多花黄精体细胞胚和人工胚乳(ms 3.0mg/ml 6-ba 0.2mg/ml naa 蔗糖28g/l;ph 5.9)混合后放入人工种皮(海藻酸钠4份、氯化钙2份、水94份)中,15min后漂洗得到多花黄精人工种子。
56.实施例2
57.一种多花黄精人工种子的制备方法:
58.(1)将多花黄精种子用洗衣粉溶液洗2遍,用水清洗2遍,吸干表面水分后,在无菌环境中用80%的酒精消毒25s,再用0.08%的氯化汞消毒7min,用无菌水冲洗3遍,切下胚轴的下端(与氯化汞接触的一端)后将种子接种到多花黄精启动培养基(ms 6-ba 0.1mg/l 2,4-d 0.3mg/l ga3 1.5mg/l 琼脂7.5g/l 蔗糖30g/l;ph 6.0)中,培养得到多花黄精无菌苗;
59.(2)将多花黄精无菌苗的叶片切成0.3cm
×
0.3cm的小块,在愈伤诱导培养基(ms naa 0.8mg/ml 2,4-d 2.5mg/ml 琼脂7.0g/l 蔗糖30g/l;ph 6.0)中培养40天,得到多花黄精愈伤组织;
60.(3)将多花黄精愈伤组织用镊子夹碎后接种到悬浮培养基(ms 1.5mg/ml 6-ba 0.3mg/mlnaa 蔗糖25g/l;ph 6.0)中,在20℃、80r
·
min-1
条件下摇床培育35天后转移到固体培养基(ms 1.5mg/ml 6-ba 0.3mg/mlnaa 琼脂7.0g/l 蔗糖30g/l;ph 6.0)中,培养得到多花黄精体细胞胚;
61.(4)将多花黄精体细胞胚和人工胚乳(ms 2.5mg/ml 6-ba 0.3mg/ml naa 蔗糖30g/l;ph 6.0)混合后放入人工种皮(海藻酸钠3份、氯化钙1份、水96份)中,20min后漂洗得到多花黄精人工种子。
62.实施例3
63.一种多花黄精人工种子的制备方法:
64.(1)将多花黄精种子用洗衣粉溶液洗4遍,用水清洗4遍,吸干表面水分后,在无菌环境中用70%的酒精消毒35s,再用0.12%的氯化汞消毒3min,用无菌水冲洗2遍,切下胚轴的下端(与氯化汞接触的一端)后将种子接种到多花黄精启动培养基(ms 6-ba 0.3mg/l 2,
4-d 0.1mg/l ga3 2.5mg/l 琼脂7.0g/l 蔗糖25g/l;ph5.8)中,培养得到多花黄精无菌苗;
65.(2)将多花黄精无菌苗的叶片切成0.7cm
×
0.7cm的小块,在愈伤诱导培养基(ms naa 1.2mg/ml 2,4-d 1.5mg/ml 琼脂7.5g/l 蔗糖25g/l;ph 5.8)中培养30天,得到多花黄精愈伤组织;
66.(3)将多花黄精愈伤组织用镊子夹碎后接种到悬浮培养基(ms 2.5mg/ml 6-ba 0.1mg/mlnaa 蔗糖25g/l;ph 5.8)中,在30℃、120r
·
min-1
条件下摇床培育25天后转移到固体培养基(ms 2.5mg/ml 6-ba 0.1mg/mlnaa 琼脂7.5g/l 蔗糖25g/l;ph 5.8)中,培养得到多花黄精体细胞胚;
67.(4)将多花黄精体细胞胚和人工胚乳(ms 1.5mg/ml 6-ba 0.1mg/ml naa 蔗糖25g/l;ph 5.8)混合后放入人工种皮(海藻酸钠5份、氯化钙3份、水92份)中,10min后漂洗得到多花黄精人工种子。
68.比较例
69.去黄精叶片以健壮红杆多花黄精植株的幼嫩叶片为外植体,依次用洗衣粉和蒸馏水清洗后,进行初步消毒,然后用流水冲洗后吸干幼嫩叶片表面的水,将幼嫩叶片浸入抑菌剂中浸泡2~5h,然后取出用无菌水冲洗干净,将多花黄精幼嫩叶片切成0.5
×
0.5cm,利用叶柄,叶中间。愈伤组织培养基为:1/2ms 2.4-d 2mg/l naa0.2 mg/l;多花黄精增殖培养基为:ms 2.0mg/l6-ba 0.2mg/lnaa,后续在多花黄精组织培养中当传代次数多时可适当调整为ms 1.0mg/l6-ba 0.1mg/lnaa;待黄精培养较多增殖不定芽时,将黄精不定芽转入生根培养基:ms naa 0.5mg/l。统计黄精组培培养从无菌系建立到大田移栽整个过程的培养周期;将所获的黄精试管苗进行炼苗移栽,并统计其成苗率。将黄精试管苗进行炼苗移栽,统计转化率,是大田移栽试管苗生根、生长良好作为转化成功的标准。
70.试验例
71.由实施例1中所制备的多花黄精人工种子在人工气候室里进行种子发芽试验,方法入下:选取20粒人工种子,重复四次(共取四组),分别均匀播入保持湿度的发芽床上(垫滤纸),保持基质湿润,空气湿度为75%,湿度温度保持在20~25℃左右,每周喷水4~5次,以人工种子突破种皮0.2cm以上为标准记为出芽,统计黄精人工种子萌发率率,萌发率=出芽的人工种子/播种总数
×
100%。待种子萌发后,进行小苗移栽,采用移栽基质进行移栽炼苗,所述穴盘播种基质配方:蛭石:椰糠:营养土=1:1:2,所述基质经过高压灭菌锅灭菌后,移栽20~30d天后,统计黄精人工种子的成苗率。将黄精萌发人工种子接种于腐殖土中,恒温培养个月后,统计转化率,以体胚产生子叶和根作为转化成功的标准。统计黄精人工种子制备到进行温室播种的培养周期,具体结果见下表1所示。
72.表1
[0073][0074]
由以上实施例可知,本发明提供了一种多花黄精人工种子及其制备方法,将多花
黄精体细胞胚和人工胚乳混合后放入人工种皮中,10~20min后漂洗得到多花黄精人工种子。本发明的制备方法通过利用现代生物技术解决了多花黄精资源短缺的问题,充分发挥植物体细胞胚生长速度快,性状稳定的特点。本发明所制备的多花黄精人工种子可以有效解决其长期组织培养过程中的褐化、变异、生长周期长和培养成本的缺陷,开辟了一种新的黄精种子种苗繁育途径,同时其萌发率高达90%,值得广泛推广应用
[0075]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
