1.本发明涉及番茄种植领域,尤其涉及一种生物制剂、应用及番茄灰霉病的防治方法。
背景技术:
2.近年来,灰霉病严重影响了设施蔬菜种植的质量与产量,是设施蔬菜种植种最重要的病害之一。其中,灰霉病对番茄的危害最重,寻找安全有效的灰霉病防治方法迫在眉睫。
3.ε-聚赖氨酸是由二、三十个赖氨酸分子在α-羧基和ε-氨基之间形成酰胺键后连接而成的多聚体,是一种均聚氨基酸,多年来的广泛研究证实其具有抑菌功效,这一特性使其作为防腐剂在食品防腐领域得到了广泛应用。
4.近年来的研究证实,ε-聚赖氨酸对多种霉菌的生长具有一定的抑制作用,在平板对峙中单独使用ε-聚赖氨酸表现出较为理想的抑菌率,因此也有若干研究尝试将其应用于田间各种灰霉病的防治,但试验显示应用于农作物后其防效并未达到理想效果。蔬菜灰霉病菌侵染果实主要依赖残留的花瓣及柱头,推广摘除花瓣和在防落素喷花液中加入具有良好防效的ε-聚赖氨酸,是阻断侵染的有效途径。
5.因此,本发明以ε-聚赖氨酸为主剂研发了生物制剂,以提高ε-聚赖氨酸对于灰霉病的防治效果。
技术实现要素:
6.本发明目的是针对上述问题,提供一种提高番茄灰霉病防治效果的生物制剂、应用及防治番茄灰霉病的方法。
7.为了实现上述目的,本发明的技术方案是:
8.一种防治番茄灰霉病的生物制剂,所述生物制剂以ε-聚赖氨酸溶液为主剂,以壳寡糖溶液为助剂复配制成。
9.进一步的,所述ε-聚赖氨酸溶液的质量浓度为200mg/l,壳寡糖溶液的质量浓度为400mg/l。
10.一种生物制剂的应用,所述生物制剂可用于番茄灰霉病的防治。
11.一种番茄灰霉病的防治方法,包括以下步骤:
12.s1、在5~6叶期的番茄叶片上初次喷施生物制剂;
13.s2、在7天后,再次在番茄叶片上喷施生物制剂;
14.s3、在番茄的花期内喷施防落制剂。
15.进一步的,所述步骤s3中,防落制剂由10~95%的溶剂和5~90%的溶质制成;溶剂为水、芳香族溶剂、醇类溶剂、酮类中的一种;溶质由ε-聚赖氨酸与防落素混合制成,ε-聚赖氨酸与防落素的质量比为1:1~2。
16.进一步的,所述步骤s3中,喷施防落制剂的喷施量为30~50g/亩。
17.与现有技术相比,本发明具有的优点和积极效果是:
18.本发明以ε-聚赖氨酸溶液作为主剂、以寡聚糖溶液作为助剂复配得到生物制剂,主剂与助剂之间具有显著的协同增效作用,能有效提高番茄叶片和果实对灰霉病的抗性和防治效果;并且其通过对番茄灰霉病进行抑菌试验、喷花试验、盆栽和大棚试验,充分证明了该生物制剂可以有效提高了番茄灰霉病的防治效果,同时表明该生物制剂可以对梨树腐烂病菌、香蕉炭疽病菌、番茄早疫病菌等11种植物病原菌均具有较好的抑菌作用;另外,实验证明,ε-聚赖氨酸与壳寡糖复配可诱导番茄防御相关酶活性的提高,通过水杨酸(sa)和茉莉酸(ja)途径提高植株的抗病性,从而影响番茄植株体内激素含量的变化,进一步提高番茄的抗病能力,给番茄的种植作出了一定的贡献。
附图说明
19.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
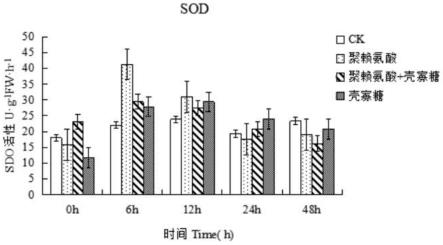
20.图1为不同处理下在番茄叶片不同时间点的sod活性示意图;
21.图2为不同处理下三天后喷施灰霉菌孢子悬浮液后在番茄叶片不同时间点的sod活性示意图;
22.图3为不同处理下在番茄叶片不同时间点的cat活性示意图;
23.图4为不同处理下三天后喷施灰霉菌孢子悬浮液后在番茄叶片不同时间点的cat活性示意图;
24.图5为标准曲线的示意图;
25.图6为不同处理下在番茄叶片不同时间点的pod活性示意图;
26.图7为不同处理下三天后喷施灰霉菌孢子悬浮液后在番茄叶片不同时间点的pod活性示意图;
27.图8为不同处理下在番茄叶片不同时间点的pal活性示意图;
28.图9为不同处理下三天后喷施灰霉菌孢子悬浮液后在番茄叶片不同时间点的pal活性示意图;
29.图10为不同处理下sa在番茄叶片不同时间点的表达情况示意图;
30.图11为不同处理下ja在番茄叶片不同时间点的表达情况示意图;
31.图12为不同处理下aba在番茄叶片不同时间点的表达情况示意图;
32.图13为不同处理下ga-3在番茄叶片不同时间点的表达情况示意图。
具体实施方式
33.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
34.本发明公开了一种防治番茄灰霉病的生物制剂,所述生物制剂可用于番茄灰霉病
的防治;所述生物制剂以ε-聚赖氨酸溶液为主剂,以壳寡糖溶液为助剂复配制成;所述ε-聚赖氨酸溶液的质量浓度为200mg/l,壳寡糖溶液的质量浓度为400mg/l。
35.同时其公开了一种番茄灰霉病的防治方法,包括以下步骤:
36.s1、在5~6叶期的番茄叶片上初次喷施生物制剂;
37.s2、在7天后,再次在番茄叶片上喷施生物制剂;
38.s3、在番茄的花期内喷施防落制剂;喷施防落制剂的喷施量为30~50g/亩。
39.防落制剂由10~95%的溶剂和5~90%的溶质制成;溶剂为水、芳香族溶剂、醇类溶剂、酮类中的一种;溶质由ε-聚赖氨酸与防落素混合制成,ε-聚赖氨酸与防落素的质量比为1:1~2。
40.在本发明中,所称的ε-聚赖氨酸,指的是交联和非交联的赖氨酸聚合物或低聚物,优选采用具有3600~4300g/mol平均摩尔质量(重均)的ε-聚赖氨酸。组成ε-聚赖氨酸的基本赖氨酸单元的氨基可以由α和/或ε位连接,通常是ε位连接。
41.壳寡糖(cos)的抑菌活性与其能改变菌丝体生长形态有关,能增加细胞膜透性导致菌丝体内含物渗漏;壳寡糖还能渗入病原菌细胞内部干扰细胞的正常生长,如穿透疫霉病菌的细胞膜而进入细胞质中,与细胞内dna、rna等目标物强烈结合,从而抑制病原菌的生长繁殖,同时对植株有很好的诱导抗病作用。
42.实施例1、ε-聚赖氨酸与壳寡糖及其复配对灰霉菌菌丝生长的抑制作用
43.含不同浓度ε-聚赖氨酸的培养基的制备:将ε-聚赖氨酸用无菌水配成母液,再将母液分别按比例加入到pda培养基,待充分混匀后,制成含ε-聚赖氨酸100mg/l、200mg/l、300mg/l、400mg/l、500mg/l浓度的平板培养基。待培养基凝固后接种灰霉菌菌饼于培养皿中央,23℃恒温培养3~4d,待对照菌落长满培养皿时,测量菌落直径,计算抑菌率。以无菌水为对照,药剂对照为80%腐霉利稀释液(1000
×
)。每个处理3次重复,结果如表1。用同样的方法,选择合适的浓度范围测定壳寡糖对灰霉菌菌丝生长的抑制作用,结果如表2。
44.表1不同浓度ε-聚赖氨酸对番茄灰霉菌生长的抑制作用
45.浓度(mg/l)菌落直径(mm)抑菌率(%)10070.33
±
1.30b12.89
±
1.74d20031.83
±
1.36c64.22
±
1.82c30021.51
±
0.65d74.69
±
0.87b4009.00
±
0.29e94.67
±
0.38a5008.83
±
0.60e94.89
±
0.80a80%腐霉利(1000
×
)药剂对照6.00
±
0.00e98.67
±
0.00a无菌水对照85.00
±
0.00a-46.ε-聚赖氨酸的抑菌率随着其浓度的增加而增加。当ε-聚赖氨酸浓度达到400mg/l时,其抑菌率可达90%以上,ε-聚赖氨酸的浓度在400~500mg/l范围时,有明显的抑菌作用,且抑菌率无明显差异。
47.表2不同浓度的壳寡糖对灰霉菌菌丝生长的抑制作用
[0048][0049]
壳寡糖对灰霉菌菌丝生长的抑制作用与壳寡糖的浓度呈正相关,壳寡糖的浓度在100~200mg/l范围内对番茄灰霉菌菌丝的生长有一定抑制作用,抑制率差异不明显;当浓度在400~800mg/l范围内有很明显的抑制作用,且抑菌率差异显著;在壳寡糖的浓度为1600mg/l时其抑菌率就可达80%以上。
[0050]
根据上述结果,选择ε-聚赖氨酸(200mg/l)与不同浓度壳寡糖复配,以期寻找到仿效较好的复配结果,结果如表3所示。
[0051]
表3ε-聚赖氨酸与不同浓度壳寡糖复配对灰霉菌菌丝生长的抑制作用
[0052][0053]
壳寡糖的添加对ε-聚赖氨酸抑制番茄灰霉菌菌丝生长起到增效作用,且效果显著,采用200mg/l的ε-聚赖氨酸与不同浓度的壳寡糖复配后得到同样的结果,即壳寡糖可提高ε-聚赖氨酸对灰霉菌菌丝生长的抑制作用,且随着壳寡糖浓度的增加,其抑制作用也随之增强。与200mg/l的壳寡糖复配可使抑制率达到82.61%,与400mg/l的壳寡糖的复配可使抑制率达到90%以上。
[0054]
实施例2、ε-聚赖氨酸与壳寡糖复配的抑菌谱试验
[0055]
选择11种病原菌进行ε-聚赖氨酸、壳寡糖及其复配的抑菌谱测定。制备含200mg/lε-聚赖氨酸及400mg/l壳寡糖的pda培养基,接种不同的病原菌于培养基中央,30℃恒温培养3~5d,当对照菌落长满培养皿时,测量菌落直径,计算抑菌率,得到其抑菌谱。结果见表
4、表5、表6。
[0056]
表4ε-聚赖氨酸的抑菌谱
[0057]
靶标菌菌落直径(mm)抑制率(%)梨树腐烂病菌(valsamali)52.33
±
1.96b40.83
±
2.46e番茄早疫病菌(alternariasolani)12.67
±
0.93fg89.15
±
1.31ab香蕉叶枯病菌(pseudocercosporafijiensis)37.33
±
0.36c57.03
±
0.48d西瓜枯萎病菌(fusariumoxysporum)50.50
±
2.08b42.77
±
2.62e小麦纹枯病菌(rhizotoniacerealis)33.67
±
2.33c59.81
±
3.27d香蕉炭疽病菌(gloeosporiummusarum)26.50
±
1.26d71.96
±
1.64c油菜菌核病菌(sclerotiniasclerotiorum)10.33
±
0.73g93.33
±
0.91a荞麦叶斑病菌(cercosporafagopyri)15.92
±
0.51efg84.79
±
0.71b大蒜白腐病菌(sclerotiumcepivorum)16.33
±
2.33ef85.67
±
2.95b苹果炭疽病菌(glormerellacingulala)58.92
±
3.86a26.14
±
5.28f小麦根腐病菌(cochliobolussativas)21.17
±
0.17de75.57
±
0.25c
[0058]
表5壳寡糖的抑菌谱
[0059][0060][0061]
表6ε-聚赖氨酸与壳寡糖复配的抑菌谱
[0062]
靶标菌菌落直径(mm)抑制率(%)梨树腐烂病菌(valsamali)37.83
±
2.17d58.96
±
2.71d番茄早疫病菌(alternariasolani)13.17
±
1.31g88.44
±
1.85ab香蕉叶枯病菌(pseudocercosporafijiensis)33.50
±
1.04d62.13
±
1.38d西瓜枯萎病菌(fusariumoxysporum)49.33
±
2.05b44.23
±
2.58e小麦纹枯病菌(rhizotoniacerealis)42.83
±
1.92c46.96
±
2.69e香蕉炭疽病菌(gloeosporiummusarum)24.67
±
1.45e74.35
±
1.89c油菜菌核病菌(sclerotiniasclerotiorum)9.67
±
2.17g94.17
±
2.71a
荞麦叶斑病菌(cercosporafagopyri)14.75
±
0.00fg86.41
±
0.00b大蒜白腐病菌(sclerotiumcepivorum)11.50
±
0.75g91.78
±
0.95ab苹果炭疽病菌(glormerellacingulala)60.58
±
3.86a23.86
±
5.28f小麦根腐病菌(cochliobolussativas)19.58
±
0.55f77.96
±
0.83c
[0063]
ε-聚赖氨酸单独使用时病原菌有一定的抑制作用,与壳寡糖复配后,对梨树腐烂病菌、香蕉叶枯病菌、大蒜白腐病菌等病原菌生长的抑制作用增强。
[0064]
实施例3、ε-聚赖氨酸与壳寡糖复配对番茄灰霉病的盆栽防效试验
[0065]
选取生长良好、长势一致的5~6叶期的番茄植株,用200mg/lε-聚赖氨酸、400mg/l壳寡糖及其复配溶液喷施于植株叶片表面,直至叶片完全湿润,自然晾干。以80%腐霉利1000倍稀释液为药剂对照,以清水为空白对照。在叶片中央接种灰霉菌菌饼,23℃、95%湿度条件下培养3d后测量病斑直径,计算病斑面积和防治效果。每处理4株,3次重复。结果如表7。
[0066][0067]
表7ε-聚赖氨酸与壳寡糖复配对番茄灰霉病的盆栽防效试验
[0068][0069]
ε-聚赖氨酸(200mg/l)对番茄灰霉病的防效为43.29%,与壳寡糖(200mg/l)复配后防效为56.01%,且随着壳寡糖浓度的增加,防效逐渐增强。200mg/lε-聚赖氨酸与400mg/l壳寡糖复配对盆栽番茄灰霉病的防效可达60%以上。
[0070]
实施例4、ε-聚赖氨酸与壳寡糖复配对大棚番茄灰霉病的防效试验
[0071]
选取5~6叶期生长旺盛的番茄植株,用ε-聚赖氨酸和壳寡糖以及它们复配的溶液喷施于番茄的叶片上,以80%的腐霉利1000倍稀释液为药剂对照,以清水为对照。设置试剂浓度为a:ε-聚赖氨酸200mg/l;b:ε-聚赖氨酸200mg/l与壳寡糖400mg/l复配;c:壳寡糖400mg/l;d:80%腐霉利1000倍液;e:清水对照。
[0072]
田间每个处理喷2行(10株/行),将四个处理和清水对照间隔排列,为一小区,重复3次。a:ε-聚赖氨酸200mg/l;b:ε-聚赖氨酸200mg/l与壳寡糖400mg/l复配;c:壳寡糖400mg/l;d:80%腐霉利1000倍液;e:空白对照。
[0073]
初次喷药前调查叶片发病情况并标记发病叶片,喷药后7d调查叶片发病情况(将发病掉落叶片记为9级),并进行二次喷药,7d后调查发病情况,计算病情指数。结果如表8。
[0074]
分级标准参照gb/t17980.28-2000:
[0075]
0级:无病;
[0076]
1级:病斑面积占整个叶面积的5%以下;
[0077]
3级:病斑面积占整个叶面积的6%-15%;
[0078]
5级:病斑面积占整个叶面积的16%-25%;
[0079]
7级:病斑面积占整个叶面积的26%-50%;
[0080]
9级:病斑面积占整个叶面积的50%以上。
[0081]
病情指数和防治效果计算方法:
[0082][0083][0084]
式中:ck0—对照区施药前病情指数;ck1—对照区施药后病情指数;
[0085]
t0—处理区施药前病情指数;t1—处理区施药后病情指数。
[0086]
表8ε-聚赖氨酸与壳寡糖及其复配对棚室番茄的防效试验
[0087]
处理喷药前病情指数喷药7d后病情指数病情指数增长值防治效果(%)a2.10
±
0.774.73
±
1.502.63
±
1.0335.22
±
1.33cb1.22
±
1.234.12
±
1.642.90
±
0.2328.57
±
1.20dc1.67
±
1.293.28
±
1.162.61
±
0.8260.41
±
3.10bd1.53
±
0.512.77
±
1.031.24
±
0.6665.17
±
2.39ae2.22
±
1.716.28
±
1.994.06
±
1.52-[0088]
注:a:ε-聚赖氨酸:200mg/l;b:400mg/l壳寡糖;c:200mg/lε-聚赖氨酸 400mg/l壳寡糖;d:80%腐霉利1000倍液;e:无菌水对照。
[0089]
对棚室番茄的防效试验同样选择200mg/l的ε-聚赖氨酸与400mg/l的壳寡糖进行试验。由表8可知,这两种药剂单独处理对灰霉病的防效分别为35.22%和28.57%;而ε-聚赖氨酸与壳寡糖复配处理的植株对番茄灰霉病的防效可达60.41%。
[0090]
实施例5、ε-聚赖氨酸与壳寡糖复配诱导番茄抗灰霉病试验
[0091]
选取生长良好、长势一致的5~6叶期的番茄植株,选择200mg/lε-聚赖氨酸与200mg/l、400mg/l、800mg/l壳寡糖的复配剂进行诱导番茄抗灰霉病的盆栽试验。以80%腐霉利1000倍稀释液为药剂对照,以清水为空白对照。待处理1d、3d和5d后在叶片中央接种灰霉菌菌饼,23℃、95%湿度条件下培养3d后,待对照完全发病,测量病斑直径,计算病斑面积和防治效果。每个处理4株,3次重复,结果见表9、表10、表11。
[0092]
表9ε-聚赖氨酸与壳寡糖复配处理一天诱导番茄抗灰霉病试验
[0093][0094]
表10ε-聚赖氨酸与壳寡糖复配处理三天诱导番茄抗灰霉病试验
[0095][0096]
表11ε-聚赖氨酸与壳寡糖复配处理五天诱导番茄抗灰霉病试验
[0097][0098][0099]
由表9、10、11中数据可知,200mg/lε-聚赖氨酸与400mg/l的壳寡糖复配对灰霉病的诱导抗病作用最好,与培养皿内的试验结果一致,且提前3d处理的植株对番茄灰霉病的
抗病效果较提前1d和5d处理植株的防效好。根据以下三个表的数据可知,与不同浓度的壳寡糖复配后对灰霉病的防效都有一定的增效作用。
[0100]
实验结果表明,ε-聚赖氨酸与壳寡糖复配的诱导抗病作用明显高于ε-聚赖氨酸与壳寡糖单剂对番茄灰霉病的诱导抗病作用。其中200mg/l的ε-聚赖氨酸与400mg/l的壳寡糖复配的诱导抗病作用高于其他浓度复配的作用。该浓度下提前3d处理的植株对番茄灰霉病的诱导抗病性最好,达60%以上。
[0101]
实施例6、防落素中添加ε-聚赖氨酸的番茄喷花试验
[0102]
以ε-聚赖氨酸为主剂,添加到番茄喷花的防落素中,ε-聚赖氨酸与防落素的用量比为1:1-2,优选1:1。在配置好的喷施溶液中,溶剂含量10~95%,溶剂选择水或芳香族溶剂、醇类、酮类等,根据植株的种植密度,按照30~50g/亩的用量进行喷施。在上述实施例中,所用的ε-聚赖氨酸的平均摩尔质量(重均)为3600~4300g/mol。
[0103]
将ε-聚赖氨酸与防落素按照1:1的质量比混合,然后加入400份水中搅拌混合均匀。以单施防落素和防落素 化学农药为对照,在植株的第一层果和第二层果期分别调查病果数和总果数。调查结果如下表12。
[0104]
表12防落素 ε-聚赖氨酸防治灰霉病的效果
[0105][0106]
本发明将ε-聚赖氨酸添加到植株喷花的防落素中,对灰霉病实现完全的防治效果。防治灰霉病的复合药物组合物优先选用ε-聚赖氨酸 防落素。用这种复合药物对番茄植株进行喷花处理,在增加植株坐果的同时,减少病果数。第一层果的防治率:防落素 ε-聚赖氨酸100%;防落素 化学农药100%。第二层果的防治率:防落素 ε-聚赖氨酸98.40%;防落素 化学农药97.50%。
[0107]
实施案例7、番茄植株防御酶活性的测定
[0108]
选取5~6叶期生长旺盛的番茄植株,设置四组处理,分别为:ck、ε-聚赖氨酸(200mg/l)、壳寡糖(400mg/l)、ε-聚赖氨酸和壳寡糖复配溶液。同样喷施于叶片表面至全部润湿,让叶片自然晾干。待处理三天后接种番茄灰霉菌的孢子悬浮液,并保证植株的环境温度(23℃)和湿度(95%以上)利于发病。采取两个处理后0h、6h、12h、24h、48h的植株叶片,进行酶活性的测定。
[0109]
(1)超氧化物歧化酶(sod)活性变化的测定;
[0110]
①
sod的提取:称取处理过的不同时间点的番茄叶片(约0.5g)到预冷的研钵中,冰浴中研磨匀浆,再用提取介质冲洗研钵(2~3次,每次1~2ml),将冲洗液全部转移至量瓶中,定容至10ml。取5ml提取液于4℃下10000r/min离心15min,上清液即为sod粗提液。
[0111]
②
sod活性测定:取质地相同且透明度好的15mm
×
150mm试管7支,每种待测样品3支(1~3号)、光下对照各3支(4~6号),暗中对照(调零)1支(7号),每个试管中加入1.5ml的
50mmol
·
l-1
磷酸缓冲液、0.3ml的130mmol
·
l-1
met溶液、0.3ml的750μmol
·
l-1
nbt溶液、0.3ml的100μmol
·
l-1
edta-na2、0.3ml的20μmol
·
l-1
核黄素溶液、0.5ml的蒸馏水以及0.1ml的粗酶液(其中光下对照和暗中对照中用0.1ml的蒸馏水替代)。
[0112]
7号试管加入核黄素后立即遮光,将试剂全部加完摇匀后置于4000lx荧光灯下进行显色反应(15~20min),反应温度为25~35℃,反应结束后立即将试管遮光,用以终止反应。以暗中对照管做空白,在560nm下测定光下对照管和测定管反应液的吸光度,记录数据。
[0113]
③
结果计算:
[0114][0115]
式中,a0:光下对照管吸光度;as:样品测定管吸光度;vt:样品提取液总体积(ml);vs:测定时取粗酶液量(ml);t:显色反应光照时间(min);fw:样品鲜重(g)。
[0116]
测定结果如图1所示,图1中,ε-聚赖氨酸单剂和ε-聚赖氨酸与壳寡糖复配这两个处理使番茄植株体内的sod的含量在6h时达到峰值,其中ε-聚赖氨酸处理的植株中sod的活性较高,为41.27u
·
g-1
fw
·
h-1
,是ck的1.87倍。经过壳寡糖处理的植株,sod活性在12h达到峰值,为29.37u
·
g-1
fw
·
h-1
,是ck的1.23倍。经过ε-聚赖氨酸处理的植株体内的sod活性变化比较明显。
[0117]
处理三天后接种番茄灰霉病菌的孢子悬浮液,检测接种后植株体内的sod活性变化,检测结果如图2所示。经过提前处理后接种番茄灰霉菌的植株体内的sod活性更高。ε-聚赖氨酸与壳寡糖复配提前处理可明显提高植株体内sod的活性。
[0118]
(2)番茄植物组织中过氧化氢酶(cat)的活性测定;
[0119]
①
酶液的提取:称处理过的不同时间点的番茄叶片0.5g置于预冷的研钵中,加入适量磷酸缓冲液及少量石英砂,在冰浴上研磨匀浆,转移至10ml量瓶中,用磷酸缓冲液冲洗研钵2~3次(每次1~2ml),合并冲洗液于量瓶中,定容至10ml,摇匀。取提取液5ml于离心管中,在4℃、15000g下离心15min,上清液即为酶提取液,4℃下保存备用。
[0120]
②
cat活性测定:取10ml具塞试管,加2ml酶提取液于沸水浴中加热煮死,冷却备用;取10ml试管,每个样品4支,3支为测定管(3个重复),1支为对照,每支试管中加入1.0mltris-hcl(ph7.0)、1.7ml蒸馏水以及0.1ml酶提取液(其中对照试管中加煮死的酶提取液)。
[0121]
将上述试管于25℃水浴中预热3min后,逐管加入0.2ml200mmol
·
l-1
h2o2溶液,每加一管立即在紫外分光光度计上测定a240(蒸馏水调零),每隔30s读数一次,共测3min,记录4支试管的测定值。
[0122]
③
结果计算:按下式计算cat活性。
[0123][0124][0125]
式中,as0:煮死酶液对照管吸光度;as1、as2、as3:样品测定管吸光度;vt:酶提取液总体积(ml);vs:测定时取酶液的体积(ml);fw:样品鲜重。
[0126]
测定结果如图3所示,图3中,ε-聚赖氨酸与壳寡糖复配处理和壳寡糖单剂处理植
株的cat活性在12h出现峰值,分别为9.22u
·
g-1
fw
·
min-1
和6.78u
·
g-1
fw
·
min-1
,分别是ck的2.49倍和1.82倍。经过ε-聚赖氨酸处理植株的cat活性在24h时出现高峰,为5.44u
·
g-1
fw
·
min-1
,是ck的3.38倍。
[0127]
对处理三天后的番茄接种灰霉菌的孢子悬浮液,结果如图4所示,未经过处理的植株与经过ε-聚赖氨酸与壳寡糖复配处理的植株在接种灰霉菌孢子悬浮液后的12h时体内的cat活性均达到峰值,经过ε-聚赖氨酸与壳寡糖复配处理的植株的cat活性是未经过处理的植株体内cat活性的1.44倍。经过ε-聚赖氨酸处理三天后接种孢子悬浮液的植株的cat活性在24h时达到峰值,为5.22u
·
g-1
fw
·
min-1
,是未经过处理植株在接种后24h时cat活性的1.81倍。经过提前处理可使番茄植株体内的cat活性更高,且变化更明显,ε-聚赖氨酸与壳寡糖复配可提高番茄植株体内cat的活性。
[0128]
(3)番茄叶片组织中过氧化物酶(pod)活性的测定;
[0129]
①
标准曲线的制作:取20ml具塞试管6支,编号1~6号,按顺序加入标准母液0、1.25、2.50、5.00、7.50、10.00ml,添加蒸馏水补足至10.00ml配制好四邻甲氧基苯酚标准系列溶液,混匀后以1号管调零,于470nm波长下测定吸光度,以标准液浓度为横坐标,吸光度(a470)为纵坐标绘制标准曲线(如图5所示)。
[0130]
②
pod的提取:取处理番茄叶片0.5g,剪碎混匀于研钵中,加少量石英砂、caco3和适量蒸馏水,冰浴研磨匀浆,蒸馏水定量至50ml,摇匀后离心,上清液即为待测酶液。
[0131]
③
pod活性测定:取20ml具塞试管,每种待测样品3支,3支空白对照。每支加入0.1%愈创木酚1.0ml,酶液1.0ml,蒸馏水6.9ml,摇匀,加入0.18%h2o21.0ml(空白管不加,多加1.0ml蒸馏水),摇匀后计时,25℃下反应10min后,加0.2ml偏磷酸(5%)终止反应。用标准曲线1号管调零,用分光光度计测定测定管和空白对照管的a470。
[0132]
④
结果计算:从标准曲线查出测定管和对照管四邻甲氧基苯酚的含量(平均值,μg
·
ml-1
),按下式计算pod活性。
[0133][0134]
式中,x为测定管四邻甲氧基苯酚的含量(mg);x0为对照四邻甲氧基苯酚的含量(μg);vt为酶液总体积(ml);vs为测定时取酶液的量(ml);t为酶作用的时间(min)。
[0135]
根据配置的溶液,以标准溶液浓度为横坐标,以吸光度为纵坐标得到了标准曲线,得到标准曲线如图5所示,根据测得的吸光度可以从标准曲线上得出测定管和对照管中四邻甲氧基苯酚的含量。通过公式算得pod的活性。
[0136]
如图6所示,经过ε-聚赖氨酸与壳寡糖复配处理的植株的pod活性在24h达到峰值,为18.93μg
·
g-1
fw
·
min-1
,是ck的4.33倍。而经过ε-聚赖氨酸、壳寡糖处理的植株的pod活性在48h时较高,分别为12.15μg
·
g-1
fw
·
min-1
和11.30μg
·
g-1
fw
·
min-1
,分别是ck的3.63倍和3.38倍。
[0137]
处理三天后接种番茄灰霉病菌的孢子悬浮液,检测接种后植株体内的pod活性变化,如图7所示。经过ε-聚赖氨酸与壳寡糖复配处理的植株在接种后24h时体内的pod活性达到峰值,处理后植株体内的pod活性是未处理植株的2.46倍。ε-聚赖氨酸与壳寡糖复配可以提高番茄植株体内pod活性。
[0138]
(4)苯丙氨酸解氨酶(pal)的活性测定
[0139]
①
pal的提取:取待测植物样品0.5g,-15℃冷冻固定后于研钵中加少量的提取介质、少量石英砂,冰浴研磨匀浆,最后用提取介质定容到10ml,搅拌均匀,4层纱布过滤,滤液在4℃下10000r/min离心15min,上清液即为待测酶液,4℃保存备用。
[0140]
②
pal活性测定:取10ml试管(每种样品3支测定管,1支对照管),分别加入0.02mol
·
l-1
l-苯丙氨酸1.0ml(对照管不加,用蒸馏水代替),硼酸缓冲液(ph8.8)2.0ml,酶液1.0ml,总体积4.0ml。摇匀后置30℃恒温水浴保温60min,加0.2ml6mol
·
l-1
hcl终止反应(若有沉淀需离心)。用对照管调零,在290nm处检测测定反应液的吸光度a290。
[0141]
③
结果计算:以测定管反应液每小时a290增加0.01为一个酶活性单位(u):
[0142][0143]
式中,vt:酶液总体积(ml);fw:样品鲜重(g);vs:测定时取酶液的量(ml);υ:反应液总体积(ml);t:反应时间(h)。
[0144]
如图8所示,处理后的植株在48h内的pal活性有一定变化,在12~24h内达到峰值,其中ε-聚赖氨酸单剂和ε-聚赖氨酸与壳寡糖复配处理的植株pal活性在12h时达到峰值,分别为128u/(gfw/h)和328.89u/(gfw/h),分别是ck的12.80倍和30.89倍。壳寡糖处理植株的pal活性在24h达到峰值,为ck的11.65倍。因此,经过ε-聚赖氨酸与壳寡糖复配处理可显著提高番茄植株体内pal活性。
[0145]
处理三天后接种番茄灰霉病菌的孢子悬浮液,如图9所示,接种后植株体内的pal含量在12~24h内达到峰值,表明灰霉菌的侵染可提高植株体内pal的活性,而ε-聚赖氨酸与壳寡糖复配处理使植株体内pal的活性更高,从而使番茄对灰霉病的抗性更强。
[0146]
ε-聚赖氨酸以及与壳寡糖复配可诱导番茄防御相关酶活性的提高。处理后叶片中的防御酶活性明显变化,pod、cat、sod和pal在6~12h内出现酶活高峰。
[0147]
实施案例8、番茄植株激素含量的测定
[0148]
选取5~6叶期生长旺盛的番茄植株,将配好的浓度为200mg/l的ε-聚赖氨酸溶液、400mg/l的壳寡糖溶液以及其复配的溶液喷于植株叶片表面。
[0149]
选取处理0h、12h、24h、48h的植株的相同部位的叶片,将叶片的主叶脉减去,采取约0.5g左右的叶片,放入液氮中冷冻后放入超低温冰箱保存备用。
[0150]
取处理的植株叶片在液氮中冷冻研磨,将研磨后的样品加入2ml离心管中,同时加入1ml萃取液(甲醇:水:冰醋酸=90:9:1),涡旋1min后在冰上放置30min,4℃离心。再用同样的方法再分别加500μl、300μl的萃取液进行萃取,将所有的萃取液都收集到离心管中。将所有样品用氮吹仪进行氮吹干。在吹干的样品中中加入800μl~1ml的甲醇溶解。将溶解后的样品过滤后在液相色谱质谱联用仪上进行检测。
[0151]
(1)番茄植株sa含量的测定;
[0152]
如图10所示,番茄植株在经过ε-聚赖氨酸与壳寡糖复配处理后,植株内的sa含量在48h内有一定的变化,经过ε-聚赖氨酸单剂处理的植株体内的sa含量在12h时达到峰值,为184.8μg/g,是ck的2.36倍;经过ε-聚赖氨酸与壳寡糖复配处理的植株sa含量在48h时出现峰值,为149.2μg/g,是ck的2倍;经过壳寡糖处理植株体内的sa含量的变化并不明显。
[0153]
(2)番茄植株ja含量的测定;
[0154]
如图11所示,经过ε-聚赖氨酸与壳寡糖复配处理后的番茄植株体内的ja含量在
12h时达到峰值。其中复配处理植株中的ja含量变化最明显,在12h时是ck的2.93倍;同时ε-聚赖氨酸单剂和壳寡糖单剂也使番茄植株体内ja含量的在12h达到峰值,分别是ck的1.37倍和1.98倍。
[0155]
(3)番茄植株aba含量的测定;
[0156]
番茄植株的aba含量在经过处理后发生一定的变化,如图12所示。经过ε-聚赖氨酸与壳寡糖复配处理植株的aba含量在12h时达到峰值,为224μg/g,是ck的1.5倍;而经过ε-聚赖氨酸单剂和壳寡糖单剂处理的植株体内的aba含量在48h内变化不明显。
[0157]
(4)番茄植株ga-3含量的测定;
[0158]
经ε-聚赖氨酸和壳寡糖复配处理的植株体内的ga-3含量在12h时有一定变化,为17.2μg/g,含量很低(如图13所示)。
[0159]
ε-聚赖氨酸以及与壳寡糖复配可影响番茄植株体内激素含量的变化。植株体内的sa、ja和aba含量在处理后的12h达到峰值,且sa含量的变化最为明显。ε-聚赖氨酸与壳寡糖复配主要通过sa和ja途径提高植株的抗病性。
[0160]
本发明以ε-聚赖氨酸溶液作为主剂、以寡聚糖溶液作为助剂复配得到生物制剂,主剂与助剂之间具有显著的协同增效作用,能有效提高番茄植株叶片和果实对灰霉病的抗性和防治效果;并且其通过对番茄灰霉病进行抑菌试验、喷花试验、盆栽和大棚试验,充分证明了该生物制剂可以有效提高了番茄灰霉病的防治效果,同时表明该生物制剂可以对梨树腐烂病菌、香蕉炭疽病菌、番茄早疫病菌等11种植物病原菌均具有较好的抑菌作用;另外,实验证明,ε-聚赖氨酸与壳寡糖复配可诱导番茄防御相关酶活性的提高,通过水杨酸(sa)和茉莉酸(ja)途径提高植株的抗病性,从而影响番茄植株体内激素含量的变化,进一步提高番茄植株的抗病效果,给番茄植株的种植作业作出了一定的贡献。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。