1.本发明涉及用于平衡人的肠中胆汁酸谱,特别是减少初级胆汁酸和/或增加次级胆汁酸的产生的方法和组合物。
背景技术:
2.胆汁酸是在肝脏中合成的类固醇酸,在肠道中对膳食脂质和脂溶性维生素的消化和吸收起主要作用。它们还显著影响胃肠运动功能、感觉和分泌功能、肠屏障通透性和炎症反应的调节。它们还具有宿主信号传导功能。因此,胆汁酸功能对胃肠道健康和整体健康很重要。胆汁酸合成和代谢功能障碍与许多疾病有关,例如肝脏疾病、炎性肠病、肠易激综合征、抗生素相关性疾病、肥胖等代谢疾病、以及甚至心血管疾病和呼吸系统疾病。
3.胆汁酸是由肝脏中的胆固醇产生的初级胆汁酸,通常是鹅去氧胆酸(cdca)和胆酸(ca)。此后,初级胆汁酸与甘氨酸或牛磺酸共轭以生成共轭的初级胆汁酸甘氨鹅去氧胆酸或牛磺鹅去氧胆酸(gcdca/tcdca和甘氨胆酸或牛磺胆酸gca/tca)。这些共轭胆汁酸通过胆小管膜转移并在胆汁中运送至胆囊并储存到需要时。在摄入食物后需要时,它们会被释放到十二指肠。一旦释放到肠道中,它们就会发挥消化功能并开始被肠道微生物群代谢。大多数胆汁酸被回肠末端的特异性胆汁酸受体主动吸收,并通过门静脉系统循环回肝脏。少量胆汁酸逃脱吸收并进入结肠,在那里它们经历微生物生物转化形成次级胆汁酸。生物转化的第一步是开始于小肠的去共轭。去共轭是由胆汁盐水解酶(bsh)引起的,该酶由肠道细菌(包括乳酸杆菌、双歧杆菌、梭菌属(clostridium)和拟杆菌属(bacteroides)的成员)产生。去共轭胆汁酸可通过7-脱羟基代谢为次级胆汁酸,如脱氧胆酸(dca)和石胆酸(lca)。已经在毛螺菌科(lachnospiraceae)(xlva簇)和真杆菌属(eubacterium)(这两种细菌均属于厚壁菌门(firmicutes))中鉴定出具有产生次级胆汁酸能力的细菌(等人,cell metabolism 24,41(2016))。初级胆汁酸未能去共轭,以及未能代谢成次级胆汁酸,导致结肠中初级胆汁酸浓度升高。初级胆汁酸水平升高与上述疾病和病症有关。
4.肠道微生物群具有通过代谢胆汁酸来改变宿主体内胆汁酸组成的能力。肠道微生物群是由包括500至1000种不同的细菌种类的大约10
14
个细菌细胞组成的多样化群落。肠道微生物群包含的基因数量至少是人类基因组的100倍,其中大部分具有生理功能。这些公认的作用包括代谢功能,例如维生素合成、调节膳食脂质的摄取和沉积、吸收难消化的碳水化合物、以及调节肠上皮的吸收能力以实现最佳营养代谢。保护功能包括维持肠道屏障的完整性。由于肠道微生物群的众多功能对维护人类健康很重要,最近的研究已经能够将肠道细菌种群的失衡与肠内和肠外疾病联系起来。肠道微生物群的病理失衡与肠道中胆汁酸的代谢异常有关。
5.胆汁酸也有可能改变肠道微生物群和免疫反应。初级和次级胆汁酸都可以通过两种受体(法尼醇x受体(fxr)和质膜结合的g蛋白偶联受体(tgr5))发出信号。初级胆汁酸是法尼醇x受体(fxr)的优先配体,而次级胆汁酸是tgr5的配体。fxr的激活可防止远端小肠中的细菌过度生长和移位,并诱导抗微生物剂(例如,inos和il-18)的转录。tgr5可以通过抑
制nf-kb减少巨噬细胞和kupffer细胞中脂多糖刺激的促炎细胞因子(il-1α、il-2β、il-6和tnfα)的产生。
6.由于肠道微生物群对胆汁酸的影响,失调会导致胆汁酸修饰异常,从而导致肠内和肠外疾病的发展。例如,在代谢疾病中,使用无菌和抗生素治疗的小鼠进行的研究表明,缺乏细菌会导致胆汁酸池主要由初级共轭胆汁酸组成,这可以通过法尼醇x受体(fxr)发出信号诱导饮食诱导的肥胖(fiorucci等人,trends mol.med.21,702(2015))。在喂食高脂肪饮食的小鼠中,在胆汁酸谱改变,次级胆汁酸比例的降低后,肠黏膜屏障的完整性受损。在肝脏疾病中,肝硬化患者的次级/初级胆汁酸比率低于对照组。在所有对照组中均可检测到次级胆汁酸,但在肝硬化患者中的比例显著较低。此外,胆汁酸池的不平衡与关键肠道微生物群的丰度有关(kakiyama等人,j.hepatol.58,949(2013))。在肠道疾病患者中,初级胆汁酸向次级胆汁酸的转化受损,参与胆汁酸转化的e.coli显著增加,双歧杆菌和clostrium菌群显著减少。因此,ibd患者胆汁酸谱的改变可能导致ibd炎症(duboc等人,neurogastroenterol.motil.24,513(2012))。胆汁酸失衡也与长期使用抗生素的后果有关。服用抗生素后,肠道微生物组成的改变和随后胆汁酸代谢组的改变导致对艰难梭菌(c.difficile)的定植抗力丧失。在复发性艰难梭菌患者中,已发现较高浓度的初级胆汁酸,而次级胆汁酸几乎检测不到(weingarden等,am.j.physiol.gastrointest.liver physiol.306,g310(2014))。
7.在ibs患者中也观察到胆汁酸谱的不平衡。例如,与健康对照组相比,腹泻为主的ibs(ibs-d)患者的初级胆汁酸显著增加,而次级胆汁酸相应减少。这与bristol粪便图表测量的更高的排便频率和更低的粪便稠度相关。此外,随着大肠杆菌(escherichia coli)的增加和柔嫩梭菌(clostridium leptum)和双歧杆菌(bifidobacterium)的减少,也观察到失调(dior等人,neurogastroenterol.motil.28,1330(2016))。此外,ibs患者回肠末端的fxr表达升高,cdca刺激肠道细胞增加了促炎细胞因子的通透性和释放。这表明胆汁酸谱的不平衡可能与肠屏障功能的破坏有关,并导致ibs中小肠粘膜的低度炎症(horikawa等人,digestion 100,286(2019))。
8.胆汁酸谱的不平衡可以使用胆汁酸结合剂、通过施用化学合成的胆汁酸和饮食来治疗。胆汁酸结合剂,如考来烯胺(colestyramine)、考来替泊(colestipol)和考来维仑(colesevelam),用于隔离胆汁酸,并允许它们从粪便中的肠道中去除。它们通常用于治疗慢性腹泻。然而,他们治疗症状而不解决根本病因。此外,像所有药物一样,它们也有副作用。纯的、化学合成的次级胆汁酸(如乌索脱氧胆酸(udca))的口服给药用于胆固醇结石患者。udca还被批准用于改善原发性胆汁性肝硬化或硬化性胆管炎患者的肝功能(kim等人,scientific reports8:11874(2018))。在一个病例报告中,每日udca给药也显示成功消除和预防艰难梭菌回肠储袋炎的复发(weingarden等人,2015,j clin gastroenterol)。在一项动物研究中,每日口服udca、牛磺熊去氧胆酸(tudca)或甘氨熊去氧胆酸(gudca)可同样降低葡聚糖硫酸钠诱导的小鼠结肠炎的严重程度(van den bossche等人,appl.environ.microbiol.83,e02766,(2017))。因此,合成的次级胆汁酸可用于治疗某些胆汁酸谱不平衡的疾病。然而,它们也只是治标而不治本,并且不清楚哪种次级胆汁酸混合物最适合任一患者。此外,还有包括增加严重副作用的风险的副作用。饮食是一种安全的选择,但如果没有经常的专业帮助,患者很难管理他们的饮食。
9.因此,需要通过解决胆汁酸的细菌代谢改善人类胆汁酸谱的安全、有效的干预措施。
技术实现要素:
10.本发明的第一个方面涉及一种或多种人乳寡糖(hmo),其用于在人的胃肠道中降低初级胆汁酸和/或增加次级胆汁酸的产生。
11.本发明的第二个方面是合成组合物,其用于在人的胃肠道中降低初级胆汁酸和/或增加次级胆汁酸的产生,所述合成组合物包含一种或多种人乳寡糖(hmo)。
12.所述合成组合物可以是营养或药物组合物。
13.优选地,所述合成组合物含有量为0.5g至15g,更优选1g至10g的一种或多种人乳寡糖。例如,所述合成组合物可以含有2g至7.5g的一种或多种人乳寡糖。
14.所述合成组合物可以含有双歧杆菌;例如,长双歧杆菌(bifidobacterium longum)、婴儿双歧杆菌(bifidobacterium infantis)和/或两歧双歧杆菌(bifidobacterium bifidum)。
15.本发明的第三个方面是一种包装品,其用于减少人胃肠道中初级胆汁酸和/或增加次级胆汁酸的产生,所述包装品包含至少14个单独日剂量的有效量的一种或多种人乳寡糖。
16.包装品中的单独日剂量优选包含0.5g至15g;更优选1g至10g的一种或多种人乳寡糖。例如,所述包装品可包含2g至7.5g的一种或多种人乳寡糖。此外,该包装品优选包含至少约21个单独日剂量;例如,每天大约28个日剂量。
17.优选地,所述一种或多种人乳寡糖选自中性人乳寡糖。优选地,所述一种或多种中性人乳寡糖选自岩藻糖基化的中性人乳寡糖(例如2'-fl、3-fl、dfl或lnfp-i)、非岩藻糖基化的中性人乳寡糖(例如lnnt或lnt),或两者的混合物。
18.优选地,所述人患有一种或多种肝脏疾病、炎性肠病、代谢紊乱、肠易激综合征,和与抗生素治疗相关的病症。
19.本发明的第四个方面是减少人胃肠道中初级胆汁酸和/或增加次级胆汁酸的产生的方法,该方法包括将有效量的人乳寡糖经口服或肠内施用于人。
20.优选地,初级胆汁酸的减少和/或次级胆汁酸的产生增加发生在人的结肠中。
21.所述人可能有患肝脏疾病的风险或患有肝脏疾病。例如,所述肝脏疾病可以是胆固醇结石、肝硬化、非酒精性脂肪性肝炎(nash)、非酒精性脂肪肝(nafld)和/或硬化性胆管炎。
22.所述人可能有患炎性肠病的风险或患有炎性肠病。例如,所述炎性肠病可以是克罗恩病或溃疡性结肠炎。优选地,所述人乳寡糖在炎性肠病发作期间、缓解期间或两者中施用。优选地,所述人乳寡糖的量足以减少硫酸化胆汁酸。
23.所述人可能有患代谢紊乱的风险或患有代谢紊乱。例如,所述代谢紊乱可以是肥胖症、ii型糖尿病或x综合征。优选地,所述人乳寡糖的量足以减少初级胆汁酸。
24.所述人可能有患肠易激综合征(ibs)的风险或患有肠易激综合征(ibs)。例如,所述人可能有患腹泻为主的ibs(ibs-d)、便秘为主的ibs(ibc-c)或混合型ibs(ibs-m)的风险或患有腹泻为主的ibs(ibs-d)、便秘为主的ibs(ibc-c)或混合型ibs(ibs-m)。优选地,在
ibs-d患者中,所述人乳寡糖的量可有效减少初级胆汁酸和增加次级胆汁酸的产生。优选地,在ibs-c患者中,所述人乳寡糖的量可有效减少初级胆汁酸。
25.所述人可能有患与抗生素治疗相关的疾病的风险或患有与抗生素治疗相关的疾病。例如,所述人可能有患艰难梭菌感染、尿路感染和抗生素相关性腹泻的风险或患有艰难梭菌感染、尿路感染和抗生素相关性腹泻。
26.所述人可以是患有艰难梭菌感染的患者并且将有效量的岩藻糖基化的人乳寡糖施用于所述患者以增加所述患者肠道中脱氧胆酸(dca)的浓度。脱氧胆酸有利地抑制艰难梭菌的生长。所述岩藻糖基化的人乳寡糖优选为2'-fl。
27.优选地,所述人乳寡糖施用至少14天,更优选至少21天。例如,所述人乳寡糖可以施用至少28天。
28.优选地,所述一种或多种人乳寡糖选自中性人乳寡糖。优选地,所述一种或多种中性人乳寡糖选自岩藻糖基化的中性人乳寡糖(例如2'-fl、3-fl、dfl或lnfp-i)、非岩藻糖基化的中性人乳寡糖(例如lnnt或lnt),或两者的混合物。
29.优选地,将每天0.5g至15g;更优选每天1g至10g的量的一种或多种人乳寡糖施用于人。例如,可以每天施用于人2g至7.5g。
30.可以先将较高剂量,然后是较低剂量施用于所述人。较高剂量优选为每天约3g至约10g(例如每天约4g至约7.5g),而较低剂量优选为每天约2g至约7.5g(例如每天约2g至约5g)。
31.除了一种或多种人乳寡糖之外,还可以将双歧杆菌施用于人。所述双歧杆菌可以是,例如,长双歧杆菌、婴儿双歧杆菌和/或两歧双歧杆菌。
32.所述人优选非婴儿人。
附图说明
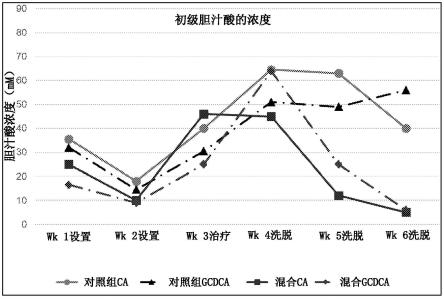
33.图1说明在体外肠道系统中施用抗生素后人乳寡糖对初级胆汁酸(mm)的影响。
具体实施方式
34.现已惊奇地发现,将一种或多种人乳寡糖(hmo)施用于人,通过减少初级胆汁酸和/或增加次级胆汁酸的产生来平衡人胃肠道中的胆汁酸谱。据信,人乳寡糖通过优先促进胆汁酸转化细菌如双歧杆菌和毛螺菌科(xlva簇)的生长至少部分地恢复肠道微生物群的组成或功能来实现这一点。结果,获得了塑造和维持肠道环境,包括胆汁酸谱的更有益的肠道微生物群落。特别是,在第一步中促进了初级胆汁酸的减少,例如,通过产生胆汁盐水解酶(bsh)的肠道微生物群以使初级胆汁酸去共轭。此后,去共轭胆汁酸通过各种机制被肠道微生物群代谢。肠道微生物群促进次级胆汁酸的产生,例如促进7α-脱羟基。
35.在本说明书中,以下术语具有以下含义:
[0036]“青春双歧杆菌(b.adolescentis)系统发育群的双歧杆菌属(bifidobacterium)”是指选自青春双歧杆菌(bifidobacterium adolescentis)、角双歧杆菌(bifidobacterium angulatum)、链状双歧杆菌(bifidobacterium catenulatum)、假小链双歧杆菌(bifidobacterium pseudocatenulatum)、bifidobacterium kashiwanohense、齿双歧杆菌(bifidobacterium dentum)和粪双歧杆菌(bifidobacterium stercoris)的细菌(duranti
等人,appl.environ.microbiol.79,336(2013),bottacini等人,microbial.cell fact.13:s4(2014))。优选地,青春双歧杆菌系统发育群的双歧杆菌属是青春双歧杆菌和/或假小链双歧杆菌。
[0037]“肠内给药”是指用于将组合物递送至人的任何常规形式,其导致组合物在胃肠道(包括胃)中的沉积。肠内给药的方法包括通过鼻胃管或空肠管、口服、舌下和直肠喂养。
[0038]“有效量”是指提供足够量的hmo以在人体中产生所需治疗结果的组合物的量。可以以一个或多个剂量施用有效量以达到期望的治疗结果。
[0039]“人乳寡糖”或“hmo”是指在人乳中发现的复合碳水化合物(urashima等人,milk oligosaccharides.nova science publisher(2011);chen adv.carbohydr.chem.biochem.72,113(2015))。hmo在还原端具有包含乳糖单元的核心结构,该核心结构被一个或多个β-n-乙酰基-乳糖胺基和/或一个或多个β-乳糖-n-二糖基单元延伸,并且该核心结构可以被α-l-吡喃岩藻糖基和/或α-n-乙酰基-神经氨酰(唾液酸基)部分取代。在这方面,非酸性(或中性)hmo没有唾液酸残基,而酸性hmo在其结构中具有至少一个唾液酸残基。非酸性(或中性)hmo可以是岩藻糖基化的或非岩藻糖基化的。这种中性非岩藻糖基化hmo的实例包括乳-n-四糖(lnt)、乳-n-新四糖(lnnt)、乳-n-新六糖(lnnh)、对-乳-n-新六糖(plnnh)、对-乳-n-六糖(plnh)和乳-n-六糖(lnh)。中性岩藻糖基化hmo的实例包括2'-岩藻糖基乳糖(2'-fl)、乳-n-岩藻五糖i(lnfp-i)、乳-n-二岩藻六糖i(lndfh-i)、3-岩藻糖基乳糖(3-fl)、二岩藻糖基乳糖(dfl)、乳-n-岩藻五糖ii(lnfp-ii)、乳-n-岩藻五糖iii(lnfp-iii)、乳-n-二岩藻六糖iii(lndfh-iii)、岩藻糖基-乳-n-六糖ii(flnh-ii)、乳-n-岩藻五糖v(lnfp-v)、乳-n-二岩藻六糖ii(lndfh-ii)、岩藻糖基-乳-n-六糖i(flnh-i)、岩藻糖基-对-乳-n-六糖i(fplnh-i)、岩藻糖基-对-乳-n-新六糖ii(fplnnh ii)和岩藻糖基-乳-n-新六糖(flnnh)。酸性hmo的实例包括3'-唾液酸乳糖(3'-sl)、6'-唾液酸乳糖(6'-sl)、3-岩藻糖基-3'-唾液酸乳糖(fsl)、lst a、岩藻糖基-lst a(flst a)、lst b、岩藻糖基-lst b(flst b)、lst c、岩藻糖基-lst c(flst c)、唾液酸-lnh(slnh)、唾液酸-乳-n-六糖(slnh)、唾液酸-乳-n-新六糖i(slnh-i)、唾液酸-乳-n-新六糖ii(slnh-ii)和二唾液酸-乳-n-四糖(dslnt)。
[0040]“肠易激综合征”和“ibs”是指人,尤其是成人的一类功能性肠病,其特征是一种或多种慢性症状,包括腹痛、腹部不适、腹胀、疲劳和排便模式改变,例如松散或更频繁的排便模式、腹泻和便秘,通常没有任何明显的结构异常。至少有三种形式的ibs,具体取决于哪种症状占主导地位:(1)腹泻为主(ibs-d);(2)便秘为主(ibs-c);(3)交替大便模式的ibs(ibs-m)。ibs也有多种临床亚型,例如感染后ibs(ibs-pi)。
[0041]“微生物群”、“微生物区系”和“微生物组”是指通常栖息在身体器官或部分,尤其是人胃肠器官中的活微生物群落。胃肠道微生物群中最主要的成员包括以下门的微生物:厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)、放线菌门(actinobacteria)、变形菌门(proteobacteria)、互养菌门(synergistetes)、疣微菌门(verrucomicrobia)、梭杆菌门(fusobacteria)和广古菌门(euryarchaeota);以下属水平的微生物:拟杆菌属(bacteroides)、粪杆菌属(faecalibacterium)、双歧杆菌属(bifidobacterium)、氏菌属(roseburia)、另枝菌属(alistipes)、柯林斯菌属(collinsella)、布劳特氏菌属(blautia)、粪球菌属(coprococcus)、瘤胃球菌属(ruminococcus)、真杆菌属
(eubacterium)和多尔氏菌属(dorea);以下种水平的微生物:单形拟杆菌(bacteroides uniformis)、alistipes putredinis、粪副拟杆菌(parabacteroides merdae)、布氏瘤胃球菌(ruminococcus bromii)、dorea longicatena、粪拟杆菌(bacteroides caccae)、多形拟杆菌(bacteroides thetaiotaomicron)、霍氏真杆菌(eubacterium hallii)、扭链胃球菌(ruminococcus torgues)、普拉梭菌(faecalibacterium prausnitzii)、酸奶瘤胃球菌(ruminococcus lactaris)、产气柯林斯菌(collinsella aerofaciens)、dorea formicigenerans、普通拟杆菌(bacteroides vulgatus)和肠道罗斯拜瑞氏菌(roseburia intestinalis)。胃肠道微生物群包括黏膜相关微生物群,其位于或附着于覆盖胃肠道上皮的黏液层,以及存在于胃肠道管腔中的腔相关微生物群。
[0042]“微生物群的调节”是指对微生物群施加调节或控制影响,例如导致双歧杆菌属和/或产生丁酸盐的细菌的固有肠道丰度增加的影响。在另一示例中,该影响可能导致活泼瘤胃球菌(ruminococcus gnavus)和/或变形菌门的肠丰度降低。“变形菌门”是革兰氏阴性菌门,包括多种病原菌,例如埃希氏杆菌属(escherichia)、沙门氏菌属(salmonella)、弧菌属(vibrio)、螺杆菌属(helicobacter)、耶尔森氏鼠疫杆菌属(yersinia)和许多其他重要的属。
[0043]“非婴儿人”或“非婴儿”是指3岁及以上的人。所述非婴儿人可以是儿童、青少年、成年人或老年人。
[0044]“口服给药”是指通过口腔将组合物递送给人的任何常规形式。因此,口服给药是肠内给药的一种形式。
[0045]“预防性治疗”或“预防”是指为降低疾病发作或复发的风险而给予的治疗或采取的行动。
[0046]“细菌的相对丰度”是指该细菌相对于人胃肠道微生物群中的其他细菌的丰度。
[0047]“细菌的相对生长”是指该细菌相对于人胃肠道微生物群中的其他细菌的生长。
[0048]“二级预防”是指预防高危患者的病症发作,或预防或减少已经患有该病症的患者的症状复发。“高危”患者是易患该病的个体;例如,有家族病史的人。
[0049]“合成组合物”是指人工制备的组合物,优选是指含有至少一种通过化学反应、酶促反应或重组的方式离体化学和/或生物学产生的化合物的组合物。合成组合物通常包含一种或多种hmo。此外,在一些实施方式中,合成组合物可包含一种或多种不会不利地影响hmo的功效的营养或药物活性组分。下面描述了本发明的合成组合物的一些非限制性实施方式。
[0050]“疗法”是指为减轻或消除疾病或病理状况的症状而给予的治疗或采取的行动。
[0051]“治疗”是指解决以改善或稳定接受治疗的人的结果或解决潜在的营养需求为目标的医疗状况或疾病。因此,治疗包括通过解决被治疗者的营养需求来对医疗状况或疾病进行饮食或营养管理。“治疗(treating)”和“治疗(treatment)”在语法上具有相应的含义。
[0052]
hmo可以通过众所周知的方法从哺乳动物(包括但不限于人、牛、羊、猪或羊种)分泌的乳汁中分离或富集。hmo也可以通过众所周知的方法使用微生物发酵、酶法、化学合成或这些技术的组合来生产。例如,使用化学方法,lnnt可以如wo 2011/100980和wo 2013/044928中所述制备,lnt可以如wo 2012/155916和wo 2013/044928中所述合成,lnt和lnnt的混合物可以如wo 2013/091660中所述制备,2'-fl可以如wo 2010/115934和wo 2010/
115935中所述制备,3-fl可以如wo 2013/139344中所述制备,6'-sl及其盐可以如wo2010/100979中所述制备,唾液酸化寡糖可以如wo 2012/113404中所述制备,并且人乳寡糖的混合物可以如wo 2012/113405中所述制备。作为酶促生产的实例,唾液酸化寡糖可以如wo 2012/007588中所述制备,岩藻糖基化寡糖可以如wo 2012/127410中所述制备,并且人乳寡糖的有利多样化的混合物可以如wo 2012/156897和wo 2012/156898中所述制备。描述如何使用遗传修饰的e.coli制备可任选地被岩藻糖或唾液酸取代的核心(非岩藻糖基化的中性)人乳寡糖的生物技术方法可在wo 01/04341和wo 2007/101862中找到。
[0053]
所述hmo可以是单一的hmo或适用于本发明目的的任何hmo的混合物。在一个实施方式中,所述混合物包含中性hmo,优选至少第一中性hmo和至少第二中性hmo。第一中性hmo是岩藻糖基化的中性hmo,第二中性hmo是核心hmo(也称为非岩藻糖基化的中性hmo)。特别地,所述hmo的混合物可以包含选自2'-fl、3-fl、dfl、lnfp-i、lnfp-ii、lnfp-iii、lnfp-v、lndfh-i、lndfh-ii、lndfh-iii、flnh-i、flnh-ii、flnnh、fplnh-i和f-plnnh ii的岩藻糖基化hmo,和选自lnt、lnnt、lnh、lnnh、plnh和plnnh的核心hmo。更优选地,所述中性hmo的混合物包含、由或基本上由选自2'-fl、3-fl、dfl和lnfp-i的岩藻糖基化hmo,和选自lnt和lnnt的核心hmo组成;有利地,所述混合物包含、由或基本上由2'-fl以及lnnt和lnt中的至少一种组成;或包含、由或基本上由2'-fl和dfl中的至少一种以及lnnt和lnt中的至少一种组成;或包含、由或基本上由2'-fl、dfl以及lnnt和lnt中的至少一种组成。
[0054]
在其他实施方式中,所述混合物包含至少第一(酸性)hmo和至少第二(中性)hmo,其中所述第一(酸性)hmo选自3'-sl、6'-sl和fsl,所述第二(中性)hmo选自2'-fl、3-fl、dfl、lnfp-i、lnt和lnnt。有利地,所述混合物包含2'-fl和6'-sl;或6'-sl以及2'-fl和dfl中的至少一种;或2'-fl、6'-sl以及lnnt和lnt中的至少一种;或2'-fl、dfl、6'-sl以及lnnt和/或lnt中的至少一种。
[0055]
所述合成组合物可以是营养组合物的形式。例如,所述营养组合物可以是食品组合物、再水化溶液、医疗食品或特殊医疗目的食品、营养补充剂等。所述营养组合物可以含有蛋白质、脂质和/或可消化碳水化合物并且可以是粉末或液体形式。所述组合物可以设计为唯一的营养来源或作为营养补充剂。
[0056]
合适的蛋白质来源包括乳蛋白、大豆蛋白、大米蛋白、豌豆蛋白和燕麦蛋白,或其混合物。乳蛋白可以是乳蛋白浓缩物、乳蛋白分离物、乳清蛋白或酪蛋白或两者的混合物的形式。蛋白质可以是全蛋白质或水解(部分水解或深度水解)蛋白质。水解蛋白质提供更容易消化的优点,这对于患有炎症性或受损胃肠道(gi)的人来说可能很重要。蛋白质也可以以游离氨基酸的形式提供。蛋白质可占营养组合物能量的约5%至约30%,通常为约10%至20%。
[0057]
蛋白质来源可以是谷氨酰胺、苏氨酸、半胱氨酸、丝氨酸、脯氨酸或这些氨基酸的组合。谷氨酰胺来源可以是谷氨酰胺二肽和/或富含谷氨酰胺的蛋白质。由于肠细胞使用谷氨酰胺作为能量来源,因此可以包括谷氨酰胺。苏氨酸、丝氨酸和脯氨酸是产生粘蛋白的重要氨基酸。粘蛋白覆盖胃肠道,可改善肠道屏障功能和粘膜愈合。半胱氨酸是谷胱甘肽的主要前体,是身体抗氧化防御的关键。
[0058]
合适的可消化碳水化合物包括麦芽糖糊精、水解或改性淀粉或玉米淀粉、葡萄糖聚合物、玉米糖浆、玉米糖浆固体、高果糖玉米糖浆、大米来源的碳水化合物、豌豆来源的碳
β)、着色剂、调味剂、以及稳定剂、润滑剂等。
[0065]
营养组合物可以配制成可溶性粉末、液体浓缩物或即用型制剂。可以通过鼻胃管或口服将该组合物喂给有需要的人。也可以存在各种香料、纤维和其他添加剂。
[0066]
营养组合物可以通过用于制备固体或液体形式的营养组合物的任何常用制造技术来制备。例如,可以通过组合各种原料液来制备组合物。可以通过加热和混合脂质来源,然后在加热和搅拌的同时加入乳化剂(例如卵磷脂)、脂溶性维生素和至少一部分蛋白质来源来制备蛋白质脂肪混溶(protein-in-fat)原料液。然后通过在加热和搅拌的同时向水中添加矿物质、微量和超微量矿物质、增稠剂或悬浮剂来制备碳水化合物原料液。在加入碳水化合物(例如,hmo和可消化的碳水化合物来源)之前,将所得溶液继续加热和搅拌保持10分钟。然后将所得的原料液在加热和搅拌下混合在一起,并将ph调节至6.6-7.0,然后对组合物进行高温短时处理,在此过程中组合物被热处理、乳化和均质化,然后允许冷却。添加水溶性维生素和抗坏血酸,必要时将ph值调节至所需范围,添加调味剂,并添加水以达到所需的总固体水平。
[0067]
对于液体产品,可以将所得溶液随后进行无菌包装以形成无菌包装的营养组合物。在这种形式中,营养组合物可以是即食或浓缩液体形式。或者,可以将组合物进行喷雾干燥和加工并包装为可重构粉末。
[0068]
当营养产品是即食营养液时,优选液体中hmo的总浓度,以液体的重量计,为约0.1%至约1.5%,包括约0.2%至约1.0%,例如约0.3%至约0.7%。当营养产品是浓缩的营养液时,优选液体中hmo的总浓度,以液体的重量计,为约0.2%至约3.0%,包括约0.4%至约2.0%,例如约0.6%至约1.5%。
[0069]
在另一个实施方式中,营养组合物为单位剂型。单位剂型可以包含可接受的食品级载体,例如磷酸盐缓冲盐溶液、乙醇水溶液混合物、水和乳剂例如油/水或水/油乳剂,以及各种润湿剂或赋形剂。单位剂型还可以包含当施用于人时不会产生不利、过敏或其他不希望的反应的其他材料。载体和其他材料可以包括溶剂、分散剂、包衣、吸收促进剂、控释剂和一种或多种惰性赋形剂(例如淀粉)、制粒剂、微晶纤维素、稀释剂、润滑剂、粘合剂和崩解剂。优选地,载体和其他材料的fodmap含量较低或不含fodmap。
[0070]
本发明的单位剂型可以口服给药,例如作为含有预定量混合物的片剂、胶囊或丸剂,或作为粉末或含有预定浓度混合物的颗粒剂或凝胶、糊剂、溶液、悬浮液、乳剂、糖浆、大丸剂、冲剂或在水性或非水性液体中含有预定浓度的混合物的浆液。口服给药的组合物可以包括一种或多种粘合剂、润滑剂、惰性稀释剂、调味剂和保湿剂。口服给药的组合物例如片剂可以任选地被包衣并且可以被配制以提供hmo的持续、延迟或控制释放。
[0071]
本发明的单位剂型也可以通过鼻胃管或直接输注到胃肠道(gi)或胃中进行施用。
[0072]
本发明的单位剂型还可以包括治疗剂,例如抗生素、益生菌、镇痛剂和抗炎剂。这种组合物对人的适当剂量可以根据人的病情、免疫状态、体重和年龄等因素以常规方式确定。在某些情况下,剂量的浓度与人乳中组合物的hmo的浓度相似。所需量通常在约每天0.5g至约15g的范围内,在某些实施方式中为每天约1g至约10g,例如每天约2g至约7.5g。可以通过本领域技术人员已知的方法确定合适的剂量方案。
[0073]
在进一步的实施方式中,hmo可以配制成药物组合物。药物组合物可以包含药学上可接受的载体,例如磷酸盐缓冲盐水溶液、乙醇水溶液混合物、水和乳剂例如油/水或水/油
乳剂,以及各种润湿剂或赋形剂。药物组合物还可以包含当施用于人时不会产生不利、过敏或其他不希望的反应的其他材料。载体和其他材料可以包括溶剂、分散剂、包衣、吸收促进剂、控释剂和一种或多种惰性赋形剂(例如淀粉)、制粒剂、微晶纤维素、稀释剂、润滑剂、粘合剂和崩解剂。优选地,载体和其他材料的fodmap含量较低或不含fodmap。
[0074]
所述药物组合物可以口服给药,例如作为含有预定量的片剂、胶囊或丸剂,或作为粉末或含有预定浓度的颗粒剂或凝胶、糊剂、溶液、悬浮液、乳剂、糖浆、大丸剂、冲剂、或在水性或非水性液体中含有预定浓度的浆液。口服给药的组合物可以包括粘合剂、润滑剂、惰性稀释剂、调味剂和保湿剂。口服给药的组合物例如片剂可以任选地被包衣并且可以被配制以提供其中混合物的持续、延迟或控制释放。
[0075]
药物组合物也可以通过直肠栓剂、气雾剂管、鼻胃管或直接输注到胃肠道(gi)或胃中进行施用。
[0076]
药物组合物还可以包括治疗剂,例如抗生素、益生菌、镇痛剂和抗炎剂。这些组合物对人的适当剂量可以根据病情、免疫状态、体重和年龄等因素以常规方式确定。在某些情况下,剂量的浓度与人乳中hmo的浓度相似。所需量通常在每天约0.5g至约15g的范围内,在某些实施方式中为每天约1g至约10g,例如每天约2g至约7.5g。可以通过常规方法确定合适的剂量方案。
[0077]
为减少人胃肠道中的初级胆汁酸和/或增加次级胆汁酸的产生而需要施用的hmo的量将取决于诸如潜在疾病的风险和严重程度、任何其他医疗状况或疾病、年龄、组合物的形式和正在施用的其他药物等因素。此外,用量可能会有所不同,具体取决于hmo是否被用于提供直接效果(当剂量可能较高时)或hmo是否被用于二级预防/维持(当剂量可能较低时)。然而,所需量可以由医生轻易地设定并且通常在每天约0.5g至约15g的范围内,在某些实施方式中在每天约1g至约10g,例如每天约2g至约7.5g的范围内。可以基于若干因素,包括例如体重和/或病情、正在治疗或预防的潜在疾病的严重性、其他病痛和/或疾病、副作用的发生率和/或严重性和给药方式,确定合适的剂量。可以通过本领域技术人员已知的方法确定合适的剂量范围。在初始治疗阶段,剂量可以更高(例如每天3g至15g,优选每天4g至7.5g)。在维持阶段,可以减少给药(例如,每天1g至10g,优选每天2g至7.5g,更优选每天约2g至约5g))。
[0078]
实施例
[0079]
本文所述的工作实施例仅用于说明目的,不应被视为限制性的。
[0080]
实施例1-体外肠道模型
[0081]
体外肠道系统用于模拟感染艰难梭菌的人的结肠区域。该系统接种了来自年龄》65岁的健康个体的新鲜粪便样本。系统运行两周作为稳定系统的设置期。该系统每天都用原料液和胆汁酸(主要是牛磺胆酸和甘胆酸)进行喂养。之后,两种不同的干预措施并行运行4周。
[0082]
·
干预组:每天添加2'-fl和lnnt(比率为4:1,以重量计)加上抗生素(万古霉素),持续7天,然后接下来3周(洗脱期)在不使用抗生素的情况下添加2'-fl和lnnt(比率为4:1,以重量计)。
[0083]
·
对照组:使用抗生素(万古霉素)7天,然后在接下来的3周(洗脱期)内不进行干预。
[0084]
在抗生素治疗和洗脱期,干预组和对照组都接受相同的每日喂养,包括胆汁酸。在三个时间点(设置期结束、抗生素治疗结束和洗脱期结束),分别使用16s测序和hplc-uv方法测量微生物群落和胆汁酸。
[0085]
在干预组和对照组中,抗生素治疗都会导致结肠微生物群出现严重的失调。这进而导致胆汁酸代谢受损和具有高浓度初级胆汁酸的胆汁酸谱。在洗脱期结束时,干预组系统的微生物群得到恢复,结肠胆汁酸代谢重新建立。如图1所示,干预组系统出现初级胆汁酸(胆酸(ca)和甘氨鹅去氧胆酸(gcdca)减少。对于对照组,微生物群的恢复不完全,初级胆汁酸浓度仍然很高。
[0086]
实施例2-体外肠道模型
[0087]
体外肠道系统与实施例1一样运行,只是干预组是每天添加2'-fl加抗生素(万古霉素)7天,然后在接下来的3周(洗脱期)内单独添加2'-fl。对照组如实施例1。
[0088]
·
对照组:抗生素(万古霉素)7天,随后3周(洗脱期)不进行干预。
[0089]
在干预组和对照组中,抗生素治疗都会导致结肠微生物群出现严重的失调。这进而导致胆汁酸代谢受损和具有高浓度初级胆汁酸的胆汁酸谱。在洗脱期结束时,干预组系统的微生物群得到恢复,结肠胆汁酸代谢重新建立。与实施例1一样,在干预组系统中发生初级胆汁酸(胆酸(ca)和甘氨鹅去氧胆酸(gcdca)的减少。此外,次级胆汁酸的测量表明存在次级胆汁酸脱氧胆酸(dca)。对于对照组,微生物群的恢复是不完全的,初级胆汁酸浓度仍然很高,没有鉴定到次级胆汁酸。
[0090]
实施例3-人体试验
[0091]
招募了总共60名男性和女性ibs患者参与该研究。在筛选检查和1-2周的磨合期后,选择患者。患者被随机分为三组,每组20名患者,两组服用治疗产品,一组服用安慰剂产品。治疗组接受5g以重量计为4:1比率的2'-fl和lnnt的组合,或10g以重量计为4:1比率的2'-fl和lnnt的组合。安慰剂组接受5g葡萄糖。两种产品都以粉末形式是在单位剂量容器中。
[0092]
如果患者年龄在18-60岁之间,根据ibs rome iv标准满足ibs-d、ibs-c或ibs-m的定义,并且在2周的磨合期内整体ibs-sss评分》174,那么该患者有资格参加。所有招募的患者都能够并且愿意理解并遵守研究程序。以下患者被排除在外:他们有任何已知的可能导致症状或干扰试验结果的胃肠道疾病,特别是乳糖不耐症和乳糜泻;他们在筛选检查前一个月参加过临床研究;他们在有参与研究临床相关性的筛查测试中现异常结果;他们患有严重的疾病,如恶性肿瘤、糖尿病、严重的冠状动脉疾病、肾脏疾病、神经系统疾病、或严重的精神疾病或任何可能混淆研究结果的情况;研究前1个月使用高剂量益生菌补充剂(允许使用酸奶);研究前1个月服用抗生素药物;在研究前2周定期服用任何可能干扰症状评估的药物;诊断出患有和治疗ibs超过10年;怀孕或哺乳。
[0093]
在筛选检查(visit 1)中,登记临床和病史以及伴随药物。将评估ibs诊断标准并完成ibs-sss问卷的第2部分。
[0094]
粪便样本试剂盒与bristol粪便分型量表(bsfs)和排便日记(bmd)一起分发,日记将在visit 2前的7天内填写。要求患者在visit2前3天登记他们的饮食,并提醒他们在研究期间不要改变他们通常的饮食。
[0095]
在第二次检查(visit 2)时,检查资格标准,并将符合条件的受试者随机分配到试
验的三个组中。进行体格检查并回答几份问卷(gsrs-ibs、ibs-sss、hads、nrs-11、vsi、ibs-qol和phq-15量表)。问卷以电子方式填写。那些不能或不愿意使用电子系统的人填写纸质问卷。根据临床症状和问卷数据,将患者分为以下三组之一;腹泻型(ibs-d)、便秘型(ibs-c)或混合型(ibs-m)。这样可以将每个亚组的患者分配到干预组中。询问患者关于任何不良事件和他们常用药物的任何变化。收集bsfs和bmd,并分发干预期间每天要填写的新的表格。收集粪便样本并分发新样本设备。收集血液样本用于常规临床化学和血液学以及生物标志物分析,收集唾液样本以分析fut2分泌状态。收集饮食记录,并分发新的表格。然后,根据他们被随机分配到的组,随机分配的患者将接受为期4周的安慰剂产品或一种治疗产品。患者和临床工作人员对收到的产品一无所知。指导患者在早晨与早餐一起食用干预产品。
[0096]
在4周后的第三次检查(visit 3)中,进行体格检查并回答一些问卷(gsrs-ibs、ibs-sss、hads、nrs-11、vsi、ibs-qol和phq-15量表)。问卷以电子方式填写。那些不能或不愿意使用电子系统的人填写纸质问卷。收集粪便样本,收集bsfs和bmd,并收集食物和合规日志以检查合规性。收集血样用于常规临床化学和血液学以及生物标志物分析。询问患者关于任何不良事件和他们常用药物的任何变化。
[0097]
为了评估微生物群谱,使用96孔powersoil dna分离试剂盒(mo-bio)从粪便样本中提取dna。在pcr过程中,每个板至少保留一个样品孔作为阴性对照。使用正向引物s-d-bact-0341-b-s-17和连接有illumina适配体的反向引物s-d-bact-0785-a-a-21进行pcr,(klindworth等人,nucleic acids res.41,e1(2013))。这些是靶向v3-v4区的通用细菌16s rdna引物。使用以下pcr程序:98℃30sec,25
×
(98℃10s,55℃20s,72℃20s),72℃5min。通过在1%琼脂糖凝胶上运行产物来验证扩增。使用nextera index kit v2(illumina)在巢式pcr中添加barcode,使用以下pcr程序:98℃30sec,8
×
(98℃10s,55℃20s,72℃20s),72℃5min。通过在1%琼脂糖凝胶上运行产物来验证扩增。巢式pcr的产物使用sequalprep标准化板试剂盒标准化并合并。通过蒸发浓缩合并文库,使用qubit high sensitivity assay kit(thermo fisher scientific)在qubit荧光计上测量合并文库的dna浓度。使用miseq reagent kit v3(illumina)在miseq桌面测序仪上进行2
×
300bp双末端测序。64位版本的usearch用于序列数据的生物信息分析。
[0098]
在visit 2和visit 3之间,所有患者都能耐受干预,组间的耐受性没有差异。所有患者的胃肠道症状均得到改善。与安慰剂组相比,接受治疗产品的患者在visit 3时双歧杆菌水平升高。接受治疗产品的其他患者粪便中初级胆汁酸浓度降低,次级胆汁酸浓度增加。
[0099]
实施例4-胶囊组合物
[0100]
通过使用填充机将约1g hmo填充到000明胶胶囊中来制备胶囊。然后封闭胶囊。hmo是自由流动的粉末形式。
[0101]
实施例5-营养组合物
[0102]
hmo 2'-fl和lnnt以4:1的质量比被引入旋转搅拌机。将0.25w%的二氧化硅引入搅拌机中,混合物搅拌10分钟。然后将混合物在流化床中附聚并填充到5g棒状包装中并密封包装。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。