1.本文公开了用于抑制经历癌症疗法,例如但不限于表达嵌合抗原受体的t细胞(car t细胞)癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的组合物和其方法。进一步地,本文公开了用于减少或抑制经历细胞因子释放综合征或细胞因子风暴的受试者中的细胞因子产生的组合物和其方法。进一步地,本文所公开的组合物可以用于治疗、预防受试者的癌症或肿瘤、抑制所述癌症或肿瘤的生长或降低所述癌症或肿瘤的发病率。组合物可以用于增加患有癌症或肿瘤的受试者的存活期。所使用的组合物可以单独施用或与其它癌症治疗剂或化学疗法组合施用。本文公开的方法包括那些包括施用包含早期凋亡细胞群或其上清液和一种或多种癌症治疗剂(诸如car t细胞)的组合疗法以减缓、减少、抑制或消除受试者中癌症或肿瘤的转移性扩散。
背景技术:
2.虽然针对癌症的标准疗法是外科手术、化学疗法和放射疗法,但是目前正在开发和测试改进方法,如靶向免疫疗法。一种有前景的技术使用在其中对免疫细胞进行修饰以识别和攻击其肿瘤的过继细胞转移(act)。act的一个实例是在患者自身或供体的细胞毒性t细胞被工程化成表达靶向在肿瘤细胞的表面上表达的肿瘤特异性抗原的嵌合抗原受体(car t细胞)时。这些car t细胞然后仅对表达肿瘤特异性抗原的细胞具有细胞毒性。临床试验已经示出,car t细胞疗法在控制晚期急性成淋巴细胞性白血病(all)和淋巴瘤等方面具有巨大潜力。
3.然而,一些给予car t细胞疗法和其它免疫疗法的患者会经历危险的且有时甚至危及生命的被称为细胞因子释放综合征(crs)的副作用,在所述细胞因子释放综合征中,输注的活化的t细胞产生全身性炎性应答,在所述全身性炎性应答中,细胞因子迅速且大量释放到血流中,从而导致危险的低血压、高烧和发抖。
4.在crs严重病例中,患者会经历细胞因子风暴(也被称细胞因子瀑布或高细胞因子血症),其中细胞因子与具有高度升高的细胞因子水平的白血细胞之间存在正反馈回路。这会导致潜在地危及生命的并发症,包含心脏功能障碍、成人呼吸窘迫综合征、神经性毒性、肾和/或肝衰竭、肺水肿和弥漫性血管内凝血。
5.例如,在最近的i期试验中,施用了与t细胞上的cd28受体结合的单克隆抗体tgn1412的六名患者表现出细胞因子风暴和多器官衰竭严重病例。尽管事实上,tgn1412剂量比发现对动物而言安全的剂量低500倍,但是还是发生了这种情况(st.clair ew:the calm after the cytokine storm:lessons from the tgn1412 trial.j clin invest 118:1344-1347,2008)。
6.迄今为止,正在对皮质类固醇、生物疗法(如抗il6疗法)和抗炎药进行评价以控制施用了car t细胞疗法的患者的细胞因子释放综合征。然而,类固醇可能会影响car t细胞的活性和/或增殖,并使患者处于败血症和机会性感染的危险中。抗炎药可能无法有效控制
细胞因子释放综合征或细胞因子风暴,因为细胞因子风暴包含非常大量的细胞因子,而向患者输注抗炎药的能力有限。需要新型策略来控制细胞因子释放综合征(并且具体地,细胞因子风暴)以便实现car t细胞疗法的潜力。
7.在其它感染性和非感染性刺激之后,细胞因子风暴仍是问题。在细胞因子风暴中,许多促炎性细胞因子(如白介素-1(il-1)、il-6、g-干扰素(g-ifn)和肿瘤坏死因子-α(tnfα))释放,从而导致血压过低、出血并且最终导致多器官衰竭。在1918年的h1n1流感大流行以及最近的禽流感h5n1感染中,具有大概免疫系统健康的年轻人的相对高死亡率归因于细胞因子风暴。还已知这种综合征发生在严重急性呼吸道综合征(sars)、埃-巴二氏病毒(epstein-barr virus)相关噬血细胞淋巴组织细胞增生症、革兰氏阴性败血症(gram-negative sepsis)、疟疾和许多其它感染性疾病(包含埃博拉感染(ebola infection))的晚期和末期病例中。
8.细胞因子风暴也可能源自于非感染性原因,如急性胰腺炎、严重烧伤或外伤或急性呼吸窘迫综合征。因此,需要新型策略来控制细胞因子释放综合征,并且尤其是细胞因子风暴。
9.癌症是其中一个或多个细胞群的失控增殖干扰正常生物学功能的异常状态。增殖性变化通常伴随着细胞特性的其它变化,包含逆转到较低分化程度、发育较原始的状态。癌症的体外相关物被称为细胞转化。经转化的细胞通常显示以下特性中的几种或所有特性:球状形态、表达胚胎抗原、生长因子独立性、缺乏接触抑制、锚定独立性和生长至高密度。
10.恶性疾病(如肺癌和皮肤癌)的致死性的主要原因起因于转移性扩散。在许多情况下,无法预防转移性疾病的发作,因为癌症通常在诊断时就已转移,并且即使在这个阶段之前诊断出癌症的情况下,完全外科手术去除或破坏可能最终导致转移的原发性病变组织可能是不可行的。由于转移性病变的体积小和/或原发性病变中不存在可以可靠地预测其存在的可靠标志物,因此转移性疾病可能无法在早期阶段诊断。由于此类病变难以接近、具有弥漫性和/或定位不确定,因此可能难以或无法通过消融方法对其进行治疗。化学疗法/放射疗法、治疗某些转移性恶性肿瘤的当前选择方法通常无效的或次优效的,并且具有与特别有害和/或可能致死的副作用相关的显著缺点。
11.免疫治疗性癌症治疗方法(诸如涉及抗原呈递细胞(apc)疫苗接种的治疗方法)对于治疗难以接近、弥漫性的、微观的、复发性的和/或定位不确定的癌症病变可能具有最优效果。一种有前景的免疫疗法途径涉及使用专业apc(如树突状细胞(dc))以引发全身性抗癌免疫性。
12.树突状细胞是哺乳动物免疫系统的抗原产生和呈递细胞,其处理抗原物质并将其在细胞表面上呈递到免疫系统的t细胞,并且由此能够使t细胞对新抗原和召回抗原两者具有敏感性。dc是最有效的抗原产生细胞,其充当先天免疫系统与适应性免疫系统之间的信使。dc细胞可以用于通过产生攻击和裂解肿瘤的效应子细胞来引发特异性抗肿瘤免疫。
13.凋亡细胞呈递一种生理学细胞死亡途径(最通常经由凋亡发生),这会引发一系列分子稳态机制,包括识别、免疫应答和去除过程。而且,凋亡细胞是能够直接和间接诱导对树突状细胞和巨噬细胞的免疫耐受性的免疫调节细胞。已经示出,凋亡细胞会调节树突状细胞和巨噬细胞并且会致使它们产生耐受性并抑制促炎性活性,诸如促炎性细胞因子的分泌和共刺激分子的表达。
14.对用于治疗、预防受试者的癌症或肿瘤、抑制受试者的癌症或肿瘤的生长或降低受试者的癌症或肿瘤的发病率的组合物和方法的需求仍未得到满足。下文所描述的凋亡细胞制剂、组合物和其用途通过提供可以用于治疗、预防受试者的癌症或肿瘤、抑制受试者的癌症或肿瘤的生长或降低受试者的癌症或肿瘤的发病率的早期凋亡细胞群来满足这个需求。进一步地,本文所描述的使用方法解决了对增加患有癌症和肿瘤的受试者的存活期(包含增加癌症或肿瘤的缓解)的需求。
技术实现要素:
15.在一个方面,本文公开了减缓、减少、抑制或消除受试者中癌症或肿瘤的转移性扩散或其任何组合的方法,所述方法包括向受试者施用包括早期凋亡细胞群和一种或多种癌症治疗剂的组合疗法的步骤,其中所述方法减缓、减少、抑制或消除所述受试者中癌症或肿瘤的转移性扩散或其任何组合。在相关方面,癌症治疗剂包含表达嵌合抗原受体的t细胞(car t细胞)。
16.在另一相关方面,在本文公开的方法中,增加了所述受试者的存活期。在进一步相关方面,受试者是人类受试者。
17.在仍另一相关方面,早期凋亡细胞群包括富集的单核细胞群;稳定超过24小时的凋亡群;不含细胞聚集体的凋亡群;凋亡细胞诱导后经过辐照的早期凋亡细胞群;汇集的早期凋亡细胞群;或单核凋亡细胞群(其包含减少的非静止非凋亡细胞、任何活的非凋亡细胞的遏制的细胞活化、或任何活的非凋亡细胞的减少的增殖、或其任何组合);或其任何组合。
18.在相关方面,癌症或肿瘤包括实体瘤或非实体瘤。在进一步相关方面,非实体癌症或肿瘤包括造血系统恶性肿瘤、血细胞癌、白血病、骨髓增生异常综合征、淋巴瘤、多发性骨髓瘤(浆细胞骨髓瘤)、急性成淋巴细胞性白血病、急性骨髓性白血病、慢性骨髓性白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤或浆细胞白血病。在又另一进一步相关方面,实体瘤包括肉瘤或癌、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨性肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮瘤血管肉瘤、滑膜瘤、间皮瘤、尤文氏瘤(ewing's tumor)、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌或肿瘤、乳腺癌或肿瘤、卵巢癌或肿瘤、前列腺癌或肿瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯瘤(wilm's tumor)、宫颈癌或肿瘤、子宫癌或肿瘤、睾丸癌或肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、神经鞘瘤、脑膜瘤、黑色素瘤、神经母细胞瘤或视网膜母细胞瘤。
19.在相关方面,癌症治疗剂和所述早期凋亡细胞包括在单独的组合物中。在相关方面,car t细胞和所述早期凋亡细胞包括在单独的组合物中。在仍进一步相关方面,包括癌症治疗剂的组合物在施用所述早期凋亡细胞之前、与施用所述早期凋亡细胞同时、或施用所述早期凋亡细胞之后进行施用。在还进一步相关方面,包括car t细胞的组合物在施用所述早期凋亡细胞之前、与施用所述早期凋亡细胞同时、或施用所述早期凋亡细胞之后进行施用。
20.在一个方面,本文公开了减缓、减少、抑制或消除经历癌症疗法的受试者中癌症或
肿瘤的转移性扩散或其任何组合的方法,所述方法包括向所述受试者施用早期凋亡细胞群的步骤,其中与经历癌症疗法且没有被施用早期凋亡细胞群的受试者相比,所述方法减缓、减少、抑制或消除所述受试者中癌症或肿瘤的转移性扩散或其任何组合。在相关方面,癌症疗法包括放射疗法、化学疗法、移植、免疫疗法、靶向疗法、激素疗法、光动力疗法、或外科手术、或其组合。在进一步相关方面,癌症疗法包括嵌合抗原受体t细胞(car t-细胞)疗法。
21.在一个方面,本文公开了改进受试者中癌症疗法的方法,所述方法包括向所述受试者施用早期凋亡细胞群的步骤,其中改进癌症疗法包括增加所述受试者的存活时间,和其中所述方法与经历癌症疗法且没有被施用早期凋亡细胞群的受试者相比改进所述癌症疗法。在相关方面,癌症疗法包括放射疗法、化学疗法、移植、免疫疗法、靶向疗法、激素疗法、光动力疗法、或外科手术、或其组合。在进一步相关方面,癌症疗法包括表达嵌合抗原受体的t细胞(car t-细胞)疗法。
附图说明
22.本说明书的结论部分中特别指出并明确要求保护本文所公开的主题。然而,当结合附图阅读时,可以通过参考以下详细描述最佳地理解本文所公开的组合物和方法(关于组织和操作方法两者)以及其目的、特征和优点。
23.本专利申请文件含有至少一幅彩色附图。在请求并支付必要的费用后,官方将会提供带有一幅或多幅彩色附图的本专利或专利申请公开的副本。
24.图1a-1b.示意图示出了标准car t细胞疗法(图1a)和在患者中进行安全且有效的car t细胞癌症疗法的方法的实施方式,所述方法使用患者自身的细胞(自体的)(图1b)来产生凋亡细胞或凋亡细胞上清液。
25.图2.示意图示出了在患者中进行安全且有效的car t细胞癌症疗法的方法的实施方式,所述方法使用供体细胞来产生凋亡细胞或凋亡上清液。
26.图3.流程图呈现了在早期凋亡细胞群的制备过程的一个实施方式期间的步骤,其中抗凝血剂包括在所述过程中。
27.图4a
–
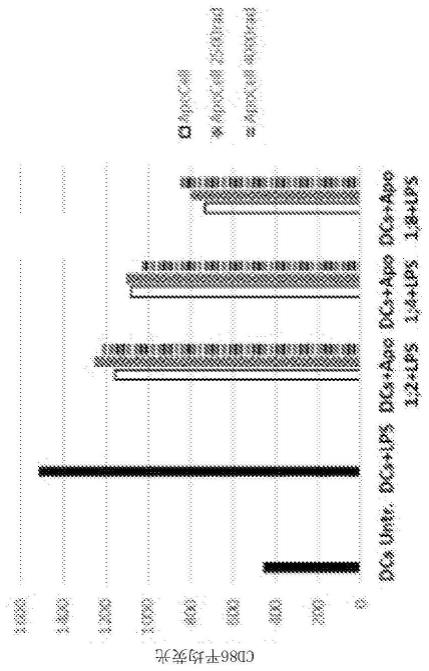
4j.凋亡细胞预防癌症环境中的巨噬细胞活化综合征的lps无菌模型中诱导的体外细胞因子风暴模型中的细胞因子风暴。图4a示出了巨噬细胞活化综合征模型中的lps诱导的il-10水平在存在癌症的情况下在以1:8和1:16的巨噬细胞/单核细胞:apocell比率施用apocell后在两个时间段(6小时和24小时)处有所降低。图4b示出了巨噬细胞活化综合征模型中的lps诱导的il-6水平在存在癌症和car-19的情况下在以1:8和1:16的巨噬细胞/单核细胞:apocell比率施用apocell后在两个时间段(6小时和24小时)处有所降低。图4c示出了巨噬细胞活化综合征模型中的lps诱导的mip-1α水平在存在癌症和car-19的情况下在以1:8和1:16的巨噬细胞/单核细胞:apocell比率施用apocell后在两个时间段(6小时和24小时)处有所降低。图4d示出了巨噬细胞活化综合征模型中的lps诱导的il-8水平在存在癌症和car-19的情况下在以1:8和1:16的巨噬细胞/单核细胞:apocell比率施用apocell后在两个时间段(6小时和24小时)处有所降低。图4e示出了巨噬细胞活化综合征模型中的lps诱导的tnf-α水平在存在癌症和car-19的情况下在以1:8和1:16的巨噬细胞/单核细胞:apocell比率施用apocell后在两个时间段(6小时和24小时)处有所降低。图94示出了巨噬细胞活化综合征模型中的lps诱导的mip-1β水平在存在癌症和car-19的情况下在以
1:4、1:8、1:16、1:32和1:64的巨噬细胞/单核细胞:apocell比率施用apocell后在24小时处有所降低。图94示出了巨噬细胞活化综合征模型中的lps诱导的mcp-1水平在存在癌症和car-19的情况下在以1:4、1:8、1:16、1:32和1:64的巨噬细胞/单核细胞:apocell比率施用apocell后在24小时处有所降低。图94示出了巨噬细胞活化综合征模型中的lps诱导的il-9水平在存在癌症和car-19的情况下在以1:8和1:16的巨噬细胞/单核细胞:apocell比率施用apocell后在两个时间段(6小时和24小时)处有所降低。图4i示出了巨噬细胞活化综合征模型中的lps诱导的il-2r水平在存在癌症和car-19的情况下在以1:4、1:8、1:16、1:32和1:64的巨噬细胞/单核细胞:apocell比率施用apocell后在24小时处有所增加。图4j示出了凋亡细胞没有下调来自细胞的il-2释放。在凋亡细胞的剂量增加的情况下(n=3),将凋亡细胞与巨噬细胞/单核细胞在存在癌症和car-19的情况下一起温育超过24小时的时间段。空条(仅轮廓)-每孔2.5
×
106个凋亡细胞;黑色-每孔5
×
106个凋亡细胞;灰色-每孔10
×
106个凋亡细胞。
28.图5.对t细胞的转导进行的验证示出了对经转导的t4
car-t细胞进行的抗cd124分析的流式细胞术结果。
29.图6.t4
car t细胞减少skov3-luc卵巢腺癌细胞的增殖。条形图中呈现了细胞毒性测定的结果,其中单层skov3-luc细胞由未经转导的t细胞或t4 car-t细胞培养。
30.图7.凋亡细胞没有消除t4
car-t细胞抗肿瘤活性。结果基于细胞毒性测定,其中单层skov3-luc细胞用未经转导的t细胞培养或在存在媒剂(哈特曼氏溶液(hartmann solution))或凋亡细胞(apocell)或凋亡细胞上清液(aposup)或凋亡细胞和单核细胞/巨噬细胞的共培养物的上清液(apomon sup)的情况下用t4
car-t细胞培养。
31.图8.在细胞毒性期间以高水平分泌的il-6通过凋亡细胞下调。此处所示出的结果证实了skov3-luc共培养物的效应,并且人单核细胞/巨噬细胞暴露于凋亡细胞(apocell)或apocell上清液(aposup)或凋亡细胞和单核细胞/巨噬细胞共培养物(apomon sup)。
32.图9.凋亡细胞或凋亡细胞上清液或凋亡细胞和单核细胞的共培养物在car-t细胞疗法期间在lps暴露后的效应。文件记录在脂多糖(lps)添加到细胞毒性测定时il-6的分泌极高。结果示出暴露于凋亡细胞(apocell)或凋亡细胞上清液(aposup)或凋亡细胞和单核细胞/巨噬细胞共培养物的上清液(apomon sup)使il-6下调,其中il-6降低到可接受水平。
33.图10.凋亡细胞或凋亡细胞上清液或凋亡细胞和单核细胞的共培养物在模拟car-t细胞临床疗法的car t细胞治疗期间在lps暴露后的效应。文件记录在脂多糖(lps)添加到细胞毒性测定时il-6的分泌极高。结果示出暴露于凋亡细胞(apocell)或凋亡细胞上清液(aposup)或凋亡细胞和单核细胞/巨噬细胞共培养物的上清液(apomon sup)使il-6下调,其中il-6降低到可接受水平。
34.图11a-11b.小鼠在剔除时的重量和肿瘤大小。图11a示出了实验时间段内的重量变化。蓝色-未施用4.5
×
106个skov3-luc细胞的对照。红色-0.5
×
106个skov3-luc细胞。绿色-1.0
×
106个skov3-luc细胞。紫色-4.5
×
106个skov3-luc细胞。图11b呈现了接受4.5
×
106个skov3-luc细胞的小鼠在注射后39天的代表性skov3-luc肿瘤。
35.图12.skov3-luc肿瘤生长。呈现了通过生物发光成像(bli)成像的携带skov3-luc肿瘤的小鼠,示出了对照(pbs)与接种有0.5
×
106、1
×
106和4.5
×
106个skov3-luc细胞之间的差异。
36.图13a-13d.skov3-luc肿瘤负担。体内skov3-luc肿瘤的生物发光(bli)的定量(参见图12)。按照制造商的指示实施了600光子计数截止。图13a,小鼠接种有0.5
×
106个skov3-luc。图13b,小鼠接种有1
×
106个skov3-luc。图13c,小鼠接种有4.5
×
106个skov3-luc。图13d,平均skov3-luc肿瘤生长。
37.图14.对raji burkett淋巴瘤细胞进行的细胞毒性校准。将raji细胞以各种细胞密度铺板,离心前立即进行细胞裂解。结果示出了raji细胞数量(x轴)与在492nm处的吸光度(y轴)。相对于未裂解的对应物,所有细胞数量均表现出显著的读数。
38.图15.添加早期凋亡细胞不影响car t细胞抗肿瘤活性。e/t比率示出了cd19 car t细胞与海拉细胞(hela cell)的比率。存活率针对cd19 肿瘤细胞。实心圆:cd19 海拉;空心三角:cd19 海拉 原初t细胞;实心三角:cd19 海拉 car t-cd19;空心圆:cd19 海拉 car t-cd19 apocell。
39.图16.在存在和不存在凋亡细胞的情况下对raji burkett淋巴瘤细胞进行的细胞因子分析(gm-csf)。条形图呈现了发现于在存在单核细胞和lps的情况下温育的raji细胞的培养上清液中的细胞因子gm-csf(pg/ml)在添加原初t细胞(raji 原初t)、添加cd19 car t细胞(raji car t)以及以1:8car t细胞:apocell的比率添加cd19 car t细胞和凋亡细胞(apocell)(raji car t apocell 1:8)、以1:32car t细胞:apocell的比率添加cd19 car t细胞和凋亡细胞(apocell)(raji car t apocell1:32)和以1:64car t细胞:apocell的比率添加cd19 car t细胞和凋亡细胞(apocell)(raji car t apocell 1:64)后的浓度测量。
40.图17.在存在和不存在凋亡细胞的情况下raji burkett淋巴瘤细胞中的细胞因子分析(tnf-α)。条形图呈现了发现于在存在单核细胞和lps的情况下温育的raji细胞的培养上清液中的细胞因子tnf-α(tnf-α)(pg/ml)在添加原初t细胞(raji 原初t)、添加cd19 car t细胞(raji car t)以及以1:8car t细胞:apocell的比率添加cd19 car t细胞和凋亡细胞(apocell)(raji car t apocell 1:8)、以1:32car t细胞:apocell的比率添加cd19 car t细胞和凋亡细胞(apocell)(raji car t apocell1:32)和以1:64car t细胞:apocell的比率添加cd19 car t细胞和凋亡细胞(apocell)(raji car t apocell 1:64)后的浓度测量。
41.图18a和18b.实验方案。图18a呈现了用于分析凋亡细胞对car t细胞疗法的影响的实验方案。在第1天向scid小鼠注射raji癌细胞,然后在第6天施用car t-cd19细胞(car t细胞疗法)和凋亡细胞。图18b示出了car t细胞疗法未受到apocell共施用的负面影响。存活率曲线:在添加或没有添加早期凋亡细胞的情况下向scid小鼠注射cd19 raji细胞。
42.图19a、19b和19c.在实体瘤体内模型中,促炎性细胞因子从肿瘤的释放增加。图19a示出了从存在于balb/c和scid小鼠的腹膜中的实体瘤释放的il-6略微增加,其中il-6释放在存在海拉car-cd-19car t细胞的情况下显著增加。类似地,图19b示出了从存在于balb/c和scid小鼠的腹膜中的实体瘤释放的ip-10略微增加,其中ip-10释放在存在海拉car-cd-19car t细胞的情况下显著增加,并且图19c示出了甚至tnf-α释放在存在海拉car-cd-19car t细胞的情况下令人惊讶地增加。
43.图20a和20b.测试海拉cd19的ip模型(白血病)中的cd19-car-t细胞在存在或不存在apocell细胞的情况下的功效。海拉-cd19-蓝色;海拉cd19 假拟-绿色;海拉cd19 car-t-紫色;和海拉cd19 car-t apocell-橙色。图20a使用0.5
×
106个car-t阳性细胞。图20b使用2.2
×
106个car-t阳性细胞。
44.图21.体内弥漫性肿瘤scid小鼠模型的存活率曲线。曲线示出与未施用凋亡细胞(无apo;点划线
····
)的小鼠相比,施用早期凋亡细胞(apo;粗虚线
‑‑‑‑
)延长生存期,其中对照scid小鼠示出100%存活率(实线______)。
45.图22a-22d.凋亡细胞输注增加白血病小鼠的寿命并增加获得完全缓解的小鼠的数量。队列:无白血病(对照-条纹图案);白血病 早期凋亡细胞(斑点图案);仅白血病(实心灰色)。总共n=51(p《0.001)。图22a:凋亡细胞输注增加了白血病诱导后存活至预期寿命的小鼠的百分比。图22b:凋亡细胞输注增加了白血病诱导后存活至预期寿命的12%的小鼠的百分比。图22c:凋亡细胞输注增加了白血病诱导后存活至预期寿命的30%的小鼠的百分比。图22d:凋亡细胞输注增加了白血病诱导后存活至预期寿命的100%且获得完全缓解的小鼠的百分比。
46.图23a-23e.凋亡细胞输注增加白血病小鼠的寿命、增加获得完全缓解的小鼠的数量以及增强抗cd20单克隆抗体(mab)治疗作用。队列:仅白血病(实心灰色);白血病 早期凋亡细胞(条纹图案);白血病 抗cd20 mab(方格);白血病 抗cd20 早期凋亡细胞(斑点)。总共n=28(p《0.002)。图23a:示出了用raji细胞诱导白血病后,存活至小鼠的预期寿命的百分比(%)。图23b:凋亡细胞输注增加了白血病诱导后存活至比预期寿命长24%的小鼠的百分比。图23c:凋亡细胞输注增加了白血病诱导后存活至比预期寿命长59%的小鼠的百分比并且增强了抗cd20 mab对白血病小鼠的寿命的效应。图23d:凋亡细胞输注增加了白血病诱导后存活至比预期寿命长76%的小鼠的百分比并且增强了抗cd20 mab对白血病小鼠的寿命的效应。图23e:凋亡细胞输注增加了获得完全缓解的小鼠的百分比。
47.图24.接受apocell的患有raji白血病/淋巴瘤的scid-bg小鼠的卡普兰-迈耶(kaplan-meier)存活率曲线。(rpmi组,n=15;raji组,n=23;raji apocell组,n=24)rpmi(对照)-黑色;仅raji-橙色;raji apocell-蓝色。
48.图25a-25c.卡普兰-迈耶存活率曲线。图25a呈现了来自如下研究的数据:其中向7周龄的雌性scid-bg小鼠(以色列耶路撒冷的envigo公司(envigo,jerusalem,israel))静脉内注射每只小鼠0.1
×
106个raji细胞(每组n=10,三组)。小鼠接受三个静脉内剂量(第5、8、11天)的30
×
106个apocell。(rpmi-浅蓝色;raji-橙色;和raji apocell-深蓝色)图25b呈现了来自如下研究的数据:其中向7周龄的雌性scid-bg小鼠(以色列耶路撒冷的envigo公司)静脉内注射每只小鼠0.1
×
106个raji细胞(每组n=10,三组)。小鼠接受三个静脉内剂量(第5、8、11天)的30
×
106个apocell。(rpmi-黑色;raji-橙色;和raji apocell-深蓝色)图25c呈现了来自如下研究的数据:其中向8-9周龄的雌性scid-bg小鼠(以色列耶路撒冷的envigo公司)静脉内注射每只小鼠注射0.1
×
106个raji细胞(每组n=10,2组)。小鼠接受三个静脉内剂量(第5、8、12天)的30
×
106个apocell。(raji-橙色;和raji apocell-深蓝色)
49.图26.接受rtx和apocell的患有raji白血病/淋巴瘤的scid-bg小鼠的卡普兰-迈耶存活率曲线。(仅raji-橙色;raji apocell-蓝色;raji rtx 2mg-绿色;raji rtx 2mg apocell-黄色;raji rtx 5mg-紫色;raji rtx 5mg apocell-灰色。)
50.图27.接受rtx和apocell的患有raji白血病/淋巴瘤的scid-bg小鼠的卡普兰-迈耶存活率曲线。(仅raji-橙色;raji apocell-蓝色;raji rtx 2mg-绿色;raji rtx 2mg apocell-黄色。)
51.图28.汇集的apocell制剂的效应。图28呈现了示出了来自多个个体供体(蓝色)的凋亡细胞制剂单次注射对存活率的明显效应(p《0.01)的图。所呈现的图是用来自多个个体供体的单个剂量的经过辐照的汇集的凋亡细胞制剂治疗的gvhd小鼠模型中的卡普兰-迈耶存活率曲线。
52.图29.汇集的apocell制剂的效应。图29呈现了示出了来自多个个体供体(蓝色)的凋亡细胞制剂单次注射对2个比较组的体重减轻百分比的明显效应(p《0.01)的图。
53.图30.对单个供体与汇集的apocell制剂进行的比较。图30呈现了示出了使用诱导的gvhd的小鼠模型在存活率%方面对施用单个剂量的单供体凋亡细胞制剂 /-辐照与施用多供体凋亡细胞制剂 /-辐照进行的比较的图。
54.图31a-31b.效力测试。图31a-31b呈现了效力测试的结果,其示出了通过hla-dr的表达测量的与凋亡细胞相互作用后的树突状细胞(dc)的成熟的抑制。图31a:新鲜最终产物a的hla dr平均荧光(t0)。图31b:最终产物a在2-8℃下24小时后的hladr平均荧光。
55.图32a-32b.效力测试。图32a-32b呈现了效力测试的结果,其示出了通过cd86的表达测量的与凋亡细胞相互作用后的树突状细胞(dc)的成熟的抑制。图32a:新鲜最终产物a的cd86平均荧光(t0)。图32b:最终产物a在2-8℃下24小时后的cd86平均荧光。
56.图33.实例17实验方案的示意图,其示出了通过car t-cd19和apocell施用治疗实体瘤的一般流程,以及终点处的细胞病理学。
57.图34a-34d.单独car t细胞疗法或与凋亡细胞共施用后的存活率。图34a示出了通过单独car t细胞疗法治疗的腹膜实体瘤海拉-cd19的存活率曲线(scid-bg-海拉-cd19:无治疗对照;scid-bg-海拉-cd19 car-t:包括利用car t细胞的治疗;scid-bg-海拉-cd19 假拟-t:假拟t细胞添加对照。图34b代表如实例17中所描述的5个单独实验,并且示出了通过单独car t细胞疗法或car t细胞疗法加凋亡细胞共施用治疗的腹膜实体瘤海拉-cd19的存活率曲线(hela-cd19:无治疗对照;海拉-cd19 car-t:包括利用car t细胞的治疗;海拉-cd19 假拟-t:假拟t细胞添加对照;海拉-cd19 car-t ots-alc-4k:治疗利用car t细胞以及用4000rad辐照的“现成的”凋亡细胞)。图34c呈现了如实例17中所描述的代表结果,并示出了通过单独car t细胞疗法或car t细胞疗法加凋亡细胞共施用治疗的腹膜实体瘤海拉-cd19的存活率曲线(scid-bg-海拉-cd19:无治疗对照;scid-bg-海拉-cd19 car-t:包括利用car t细胞的治疗;scid-bg-海拉-cd19 假拟-t:假拟t细胞添加对照;scid-bg-海拉-cd19 car-t allocetra-ots:治疗利用car t细胞以及用4000rad辐照的“现成的”凋亡细胞)。图34d(体内荧光素酶成像系统(ivis)结果)示出由ivis可视化的肿瘤进展,其代表导致图34b中呈现的存活率曲线结果的发展。肿瘤的扩散在第15天已经可以被可视化(海拉-cd19-luc;无治疗对照),而用car t细胞治疗的小鼠没有显示出任何肿瘤扩散,直到第43天。当小鼠接受凋亡细胞联合car t细胞治疗,出乎意料的是,大多数小鼠未显示出肿瘤扩散,直到第50天,并且肿瘤大小(参见相关性比例)明显更小。
58.图35a-35b.单独car t细胞疗法或与凋亡细胞共施用后的存活率。图35a示出了通过单独car t细胞疗法治疗的腹膜实体瘤海拉-cd19的存活率曲线。图35b示出了通过单独car t细胞疗法或car t细胞疗法加凋亡细胞共施用治疗的腹膜实体瘤海拉-cd19的存活率曲线(scid-bg-海拉-cd19:无治疗对照;scid-bg-海拉-cd19 car-t:包括利用car t细胞的治疗;scid-bg-海拉-cd19 car-t allocetra-ots:治疗利用car t细胞以及用4000rad辐照
的“现成的”凋亡细胞)。
59.图36a-36c.巨噬细胞的facs分析。图36a示出了scid-bg小鼠(对照,无肿瘤)中,scid-bg-海拉-cd19小鼠(具有肿瘤的对照,无治疗)中和scid-bg-海拉-cd19-car t(包括利用car t细胞的治疗)中的定居腹膜巨噬细胞标记f4/80、cd11b、tim4和mertk的facs分析。在scid-bg小鼠中所见的结果提供了定居巨噬细胞特征。数据比较示出了定居腹膜巨噬细胞在肿瘤进展期间消失。图36b示出了肿瘤进展期间,scid-bg小鼠(对照,无肿瘤)中、scid-bg-海拉-cd19小鼠(具有肿瘤的对照,无治疗)中和scid-bg-海拉-cd19-car t(包括利用car t细胞的治疗)中肿瘤相关巨噬细胞(tam)标记ccr2、ly6c、cd206、cd64、cd169和cd74的facs分析。在scid-bg小鼠中所见的结果提供了浸润巨噬细胞特征。数据比较示出了在肿瘤进展期间tam浸润。图36c呈现了fac结果,其示出了在scid小鼠中的定居巨噬细胞大多数是大腹膜巨噬细胞(lpm),而在肿瘤进展期间,大部分定居巨噬细胞消失,和tam、单核细胞和树突状细胞出现。测量了巨噬细胞标记f4/80、cd11b、tim4、mer-tk、rigg2b和rigg2a,和mhcii阳性细胞的百分比一样。
60.图37.单独car t细胞疗法或与凋亡细胞或调理的凋亡细胞共施用后的百分比(%)曲线。附图示出了通过单独car t细胞疗法或car t细胞疗法加凋亡细胞或调理的凋亡细胞共施用治疗的腹膜实体瘤海拉-cd19的存活率曲线(scid-bg-海拉-cd19:无治疗对照;scid-bg-海拉-cd19 car-t:包括利用car t细胞的治疗;scid-bg-海拉-cd19 car-t allocetra-ots:治疗利用car t细胞以及用4000rad辐照的“现成的”凋亡细胞;scid-bg-海拉-cd19 car-t d89e_allocetra-ots:治疗利用car t细胞以及用4000rad辐照的“现成的”调理的凋亡细胞)。
具体实施方式
61.在以下详细描述中,阐述了许多具体细节以便提供对本文所公开的方法的透彻理解。然而,本领域技术人员应理解,这些方法可以在没有这些具体细节的情况下实践。在其它情况下,并未详细描述众所周知的方法、程序和组分,以免模糊本文所公开的方法。
62.众所周知,免疫细胞的基因修饰是用于针对癌症的免疫细胞疗法的策略。这些免疫细胞疗法基于对自体或同种异体免疫细胞的操纵和其向有需要的受试者的施用。基于免疫细胞的疗法包含自然杀伤细胞疗法、树突状细胞疗法和t细胞免疫疗法(包含利用原初t细胞、效应子t细胞(也被称为t辅助细胞)、细胞毒性t细胞和调节性t细胞(treg)的疗法)。
63.在一些实施例中,本文公开了包括经基因修饰的免疫细胞的组合物。在另一个实施例中,所述经基因修饰的免疫细胞是t细胞。在另一实施例中,t细胞为原初t细胞。在另一个实施例中,t细胞是原初cd4 t细胞。在另一个实施例中,t细胞是原初t细胞。在另一个实施例中,t细胞是原初cd8 t细胞。在另一实施例中,经基因修饰的免疫细胞为自然杀伤(nk)细胞。在另一实施例中,经基因修饰的免疫细胞为树突状细胞。在再一实施例中,经基因修饰的t细胞是细胞毒性t淋巴球(ctl细胞)。在另一实施例中,经基因修饰的t细胞是调节性t细胞(treg)。在另一实施例中,经基因修饰的t细胞为嵌合抗原受体(car)t细胞。在另一个实施例中,所述经基因修饰的t细胞是经基因修饰的t细胞受体(tcr)细胞。
64.在一些实施例中,本文公开了包括经基因修饰的免疫细胞和凋亡细胞的组合物。在另一个实施例中,本文公开了包括经基因修饰的免疫细胞和来自凋亡细胞的上清液的组
合物。在另一个实施例中,所述经基因修饰的免疫细胞是t细胞。在另一个实施例中,所述经基因修饰的免疫细胞自然杀伤(nk)细胞。在仍另一个实施例中,所述经基因修饰的免疫细胞是细胞毒性t淋巴细胞(ctl细胞)。在另一个实施例中,所述经基因修饰的免疫细胞是调节性t淋巴细胞(treg细胞)。
65.在一些实施例中,本文公开了在car t细胞癌症疗法期间维持或提高表达嵌合抗原受体的t细胞(car t细胞)的增殖速率的方法,所述方法包括向所述受试者施用包括凋亡细胞或凋亡细胞上清液的组合物的步骤,并且其中与经历car t细胞癌症疗法且未施用所述凋亡细胞或所述凋亡细胞上清液的受试者相比,所述增殖速率在所述受试者体内得以维持或增加。
66.在相关实施例中,所述方法不会降低或抑制所述car t细胞癌症疗法的功效。在相关实施例中,所述方法改进所述car t细胞癌症疗法的功效。在另一个相关实施例中,与未施用所述凋亡细胞或所述凋亡细胞上清液的受试者相比,所述受试者的细胞因子释放综合征(crs)或细胞因子风暴的发病率有所抑制或降低。
67.在一些实施例中,crs自发地发生。在另一个实施例中,crs响应于lps而发生。在另一个实施例中,crs响应于ifn-γ而发生。
68.在一些实施例中,本文公开了增加嵌合抗原受体t细胞(car t细胞)癌症疗法的功效的方法,所述方法包括施用car t细胞和选自凋亡细胞、凋亡细胞上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂的步骤,其中与经历car t细胞癌症疗法且未施用所述另外的药剂的受试者相比,所述car t细胞的所述功效在所述受试者体内有所增加。在相关实施例中,至少一种促炎性细胞因子的产生水平与接受car t细胞癌症疗法且未施用包括所述药剂的组合物的受试者体内的所述促炎性细胞因子的水平相比有所降低。在另一个相关实施例中,所述促炎性细胞因子包括il-6。
69.在相关实施例中,当施用凋亡细胞或凋亡细胞上清液时,与经历car t细胞癌症疗法且未施用所述凋亡细胞或所述凋亡细胞上清液的受试者相比,所述方法提高所述受试者体内的il-2的水平。在另一个实施例中,当施用凋亡细胞或凋亡细胞上清液时,与经历car t细胞癌症疗法且未施用所述凋亡细胞或所述凋亡细胞上清液的受试者相比,所述方法维持所述受试者体内的il-2的水平。在另一个实施例中,当施用凋亡细胞或凋亡细胞上清液时,与经历car t细胞癌症疗法且未施用所述凋亡细胞或所述凋亡细胞上清液的受试者相比,所述方法维持或提高所述受试者体内的il-2的水平。在另一个相关实施例中,与未施用所述另外的药剂的受试者相比,所述受试者的细胞因子释放综合征(crs)或细胞因子风暴的发病率有所抑制或降低。
70.在相关实施例中,car t细胞和所述另外的药剂或其任何组合包括在单个组合物中。在另一个相关实施例中,所述car t细胞和所述另外的癌症治疗剂或其任何组合包括在至少两个组合物中。
71.在一些实施例中,本文公开了一种治疗、预防、抑制受试者的癌症或肿瘤、降低受试者的癌症或肿瘤的发病率、改善或缓解受试者的癌症或肿瘤的方法,所述方法包括施用表达嵌合抗原受体的t细胞(car t细胞)和另外的药剂(所述另外的药剂包括凋亡细胞、凋亡细胞上清液、或ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫
调节剂或其任何组合)的步骤,其中与施用car t细胞且未施用所述另外的药剂的受试者相比,所述方法治疗、预防、抑制所述受试者的癌症或肿瘤、降低所述受试者的癌症或肿瘤的发病率、改善或缓解所述受试者的癌症或肿瘤。
72.在相关实施例中,与施用car t细胞且未施用所述另外的药剂的受试者相比,所述方法在治疗、预防、抑制所述受试者的所述癌症或肿瘤、降低所述受试者的所述癌症或肿瘤的发病率、改善或缓解所述受试者的所述癌症或肿瘤方面的功效提高。
73.在另一个相关实施例中,至少一个促炎性细胞因子的产生水平与施用所述car t细胞且未施用包括所述药剂的组合物的受试者体内的所述促炎性细胞因子的水平相比有所降低。在另一个相关实施例中,所述促炎性细胞因子包括il-6。在另一个相关实施例中,所述另外的药剂包括凋亡细胞或凋亡细胞上清液,与施用所述car t细胞且未施用所述凋亡细胞或所述凋亡细胞上清液的受试者相比,所述方法提高所述受试者体内的il-2的水平。在另一个相关实施例中,所述car t细胞和所述另外的药剂或其任何组合包括在单个组合物中。在又另一个相关实施例中,所述car t细胞和所述另外的药剂或其任何组合包括在至少两个组合物中。
74.在相关实施例中,施用所述另外的药剂在施用所述car t细胞之前、同时或之后发生。在另一个相关实施例中,所述凋亡细胞包括处于早期凋亡状态的凋亡细胞。在另一个相关实施例中,所述凋亡细胞对于所述受试者而言是自体的,或者是汇集的第三方供体细胞。
75.在相关实施例中,所述凋亡细胞上清液通过包括以下步骤的方法获得:(a)提供凋亡细胞、(b)培养步骤(a)的所述细胞以及(c)从所述细胞分离所述上清液。在另一个相关实施例中,所述凋亡细胞上清液是凋亡细胞-白血细胞上清液,并且所述方法进一步包括以下步骤:(d)提供白血细胞、(e)任选地洗涤所述凋亡细胞和所述白血细胞、(f)共培养所述凋亡细胞和所述白血细胞,其中步骤(d)-(f)代替步骤(b)。在另一个相关实施例中,所提供的白血细胞选自吞噬细胞、巨噬细胞、树突状细胞、单核细胞、b细胞、t细胞和nk细胞。因此,在一些实施例中,凋亡上清液包括通过用巨噬细胞培养凋亡细胞而产生的上清液,其中所述巨噬细胞摄取所述凋亡细胞,并且使用由这种共培养产生的所述上清液。在一些实施例中,凋亡上清液包括通过培养凋亡细胞产生的上清液,其中所述上清液是由所述凋亡细胞所分泌的材料产生的。
76.在一些实施例中,本文公开了包括早期凋亡细胞的组合物。在一些实施例中,本文公开了包括早期凋亡细胞与另外的药剂的组合。在一些实施例中,所述另外的药剂可以是car t细胞。在一些实施例中,所述另外的药剂可以是抗体。在一些实施例中,所述抗体包括利妥昔单抗(rituximab)或其功能片段。
77.在一些实施例中,早期凋亡细胞的组合物包括包含处于早期凋亡状态的单核细胞的单核凋亡细胞群,其中所述单核凋亡细胞群包括:非静止非凋亡活细胞的降低的百分比;任何活的非凋亡细胞的遏制的细胞活化;或任何活的非凋亡细胞的减少的增殖;或其任何组合。
78.在一些实施例中,本文公开了包括经基因修饰的t细胞和凋亡细胞的组合物。在另一个实施例中,本文公开了包括经基因修饰的t细胞和凋亡细胞的上清液的组合物。在另一个实施例中,所述经基因修饰的t细胞是嵌合抗原受体(car)t细胞。在另一个实施例中,所述经基因修饰的t细胞是经基因修饰的t细胞受体(tcr)细胞。
79.在一些实施例中,本文公开了包括car t细胞和凋亡细胞的组合物。在另一个实施例中,本文公开了包括经基因修饰的t细胞受体细胞(tcr)和凋亡细胞的组合物。在另一个实施例中,本文公开了包括car t细胞和来自凋亡细胞的上清液的组合物。在另一个实施例中,本文公开了包括经基因修饰的t细胞受体细胞(tcr)和凋亡细胞的上清液的组合物。
80.在某些实施例中,经基因修饰的免疫细胞和凋亡细胞或凋亡细胞上清液包括在单个组合物内。在其它实施例中,经基因修饰的免疫细胞和凋亡细胞或凋亡细胞上清液包括在单独的组合物中。
81.在一些实施例中,本公开提供了包括处于早期凋亡状态的单核细胞的汇集的单核凋亡细胞制剂,其中所述汇集的单核凋亡细胞制剂包括汇集的单个单核细胞群,并且其中所述汇集的单核凋亡细胞制剂包括活的非凋亡细胞的降低的百分比、任何活的非凋亡细胞的遏制的细胞活化或任何活的非凋亡细胞的减少的增殖或其任何组合。在另一个实施例中,已经辐照所述汇集的单核凋亡细胞。在另一个实施例中,本公开提供了汇集的单核凋亡细胞制剂,其在一些实施例中使用从捐献血液获得的白血细胞级分(wbc)。通常,这种wbc级分会被丢弃在血库处,或者其目标是用于研究。
82.在一些实施例中,本文所公开的细胞群是灭活的。在另一个实施例中,灭活包括辐照。在另一个实施例中,灭活包括t细胞受体灭活。在另一个实施例中,灭活包括t细胞受体编辑。在另一个实施例中,灭活包括遏制或消除所述制剂中的免疫应答。在另一个实施例中,灭活包括遏制或消除所述制剂中包括的多个单个群之间的交叉反应性。在其它实施例中,灭活包括降低或消除所述制剂中包括的多个单个群之间的t细胞受体活性。在另一个实施例中,灭活的细胞制剂包括活的非凋亡细胞的降低的百分比、任何活的非凋亡细胞的遏制的细胞活化或任何活的非凋亡细胞的减少的增殖或其任何组合。
83.在另一个实施例中,与未经辐照的细胞制剂相比,灭活的细胞群包括数量减少的非静止非凋亡细胞。在一些实施例中,灭活的细胞群包括百分之50(%)的活的非凋亡细胞。在一些实施例中,灭活的细胞群包括40%的活的非凋亡细胞。在一些实施例中,灭活的细胞群包括30%的活的非凋亡细胞。在一些实施例中,灭活的细胞群包括20%的活的非凋亡细胞。在一些实施例中,灭活的细胞群包括100%的活的非凋亡细胞。在一些实施例中,灭活的细胞群包括0%的活的非凋亡细胞。
84.在一些实施例中,本文公开了一种制备灭活的早期凋亡细胞群的方法。在一些实施例中,本文公开了一种用于产生单核凋亡细胞群的方法,所述单核凋亡细胞群包括非静止非凋亡活细胞的降低的百分比;任何活的非凋亡细胞的遏制的细胞活化;或任何活的非凋亡细胞的减少的增殖;或其任何组合,所述方法包括以下步骤:
85.获得外周血的富集的单核细胞群;
86.在包括抗凝血剂的冷冻培养基中冷冻所述富集的单核细胞群;
87.解冻所述富集的单核细胞群;
88.在包括最终浓度为约10-100μg/ml的甲基泼尼松龙(methylprednisolone)和抗凝血剂的凋亡诱导温育培养基中温育所述富集的单核细胞群;
89.使所述凋亡细胞群重悬于施用培养基中;以及
90.使所述富集的单核群灭活,其中所述灭活在诱导之后发生,
91.其中所述方法产生单核凋亡细胞群,所述单核凋亡细胞群包括降低百分比的非静
止非凋亡细胞;任何活的非凋亡细胞的遏制的细胞活化;或任何活的非凋亡细胞的减少的增殖;或其任何组合。
92.在另一个实施例中,辐照包括γ辐照或uv辐照。在又另一个实施例中,与未经辐照的细胞制剂相比,经辐照的制剂具有数量减少的非静止非凋亡细胞。
93.在另一个实施例中,所述汇集的单核凋亡细胞已经经历t细胞受体灭活。在另一个实施例中,所述汇集的单核凋亡细胞已经经历t细胞受体编辑。
94.在一些实施例中,汇集的血液包括来自相对于接受者而言hla匹配的或hla不匹配的来源的第3方血液。
95.在一些实施例中,本文公开了包括经基因修饰的免疫细胞(例如但不限于car t细胞)和选自凋亡细胞、凋亡细胞上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂的组合物。
96.在一些实施例中,本公开提供了产生包括汇集的单核凋亡细胞制剂的药物组合物的方法,所述汇集的单核凋亡细胞制剂包括处于早期凋亡状态的汇集的单个单核细胞群,其中所述组合物包括活的非凋亡细胞的降低的百分比、具有任何活的非凋亡细胞的遏制的细胞活化的制剂、或具有任何活的非凋亡细胞的减少的增殖的制剂或其任何组合。在另一个实施例中,所述方法提供了一种包括汇集的单核凋亡细胞制剂的药物组合物,所述汇集的单核凋亡细胞制剂包括处于早期凋亡状态的汇集的单个单核细胞群,其中所述组合物包括百分比降低的非静态非凋亡细胞。
97.在一些实施例中,本文公开了一种治疗、预防受试者的癌症或肿瘤、抑制受试者的癌症或肿瘤的生长、降低受试者的癌症或肿瘤的发病率或其任何组合的方法,所述方法包括向所述受试者施用早期凋亡细胞群的步骤,其中所述方法治疗、预防所述受试者的癌症或肿瘤、抑制所述受试者的癌症或肿瘤的生长、降低所述受试者的癌症或肿瘤的发病率或其任何组合。在一些实施例中,本文中的方法包括治疗、预防受试者的癌症或肿瘤、抑制受试者的癌症或肿瘤的生长、延迟疾病进展、降低肿瘤负荷或降低受试者的癌症或肿瘤的发病率或其任何组合,所述方法包括向所述受试者施用包括早期凋亡细胞群的组合物的步骤。在一些实施例中,所述方法进一步包括向所述受试者施用另外的免疫疗法、化疗剂或免疫调节剂或其任何组合。在一些实施例中,所述另外的免疫疗法、化疗剂或免疫调节剂在施用所述早期凋亡细胞之前、同时或之后施用。
98.在一些实施例中,本文公开了一种增加患有癌症或肿瘤的受试者的生存期的方法,所述方法包括向所述受试者施用早期凋亡细胞群的步骤,其中所述方法增加所述受试者的生存期。在一些实施例中,所述方法进一步包括向所述受试者施用另外的癌症疗法。在一些实施例中,所述另外的癌症疗法包括放射疗法、化学疗法、移植、免疫疗法、靶向疗法、激素疗法、光动力疗法、免疫调节剂或外科手术,或其任何组合。在一些实施例中,所述癌症疗法包括car t细胞疗法。在一些实施例中,所述另外的癌症疗法或癌症治疗剂在施用所述早期凋亡细胞之前、同时或之后施用。
99.在一些实施例中,本文公开了一种减小受试者的癌症或肿瘤的大小或降低所述癌症或肿瘤的生长速率或其组合的方法,所述方法包括向所述受试者施用早期凋亡细胞群的步骤,其中所述方法减小大小或降低生长速率。在一些实施例中,所述方法进一步包括向所述受试者施用另外的免疫疗法、化疗剂或免疫调节剂或其任何组合。在一些实施例中,所述
另外的免疫疗法、化疗剂或免疫调节剂在施用所述早期凋亡细胞之前、同时或之后施用。
100.在一些实施例中,施用包括凋亡细胞的组合物不会影响car t细胞治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善所述癌症或肿瘤、降低肿瘤负荷或缓解所述癌症或肿瘤的功效。在另一个实施例中,施用包括凋亡细胞的组合物不会使car t细胞治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善所述癌症或肿瘤、降低肿瘤负荷或缓解所述癌症或肿瘤的功效降低超过约5%。在另一个实施例中,施用包括凋亡细胞的组合物不会使car t细胞治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善所述癌症或肿瘤、降低肿瘤负荷或缓解所述癌症或肿瘤的功效降低超过约10%。在另一个实施例中,施用包括凋亡细胞的组合物不会使car t细胞治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善所述癌症或肿瘤、降低肿瘤负荷或缓解所述癌症或肿瘤的功效降低超过约15%。在另一个实施例中,施用包括凋亡细胞的组合物不会使car t细胞治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善所述癌症或肿瘤、降低肿瘤负荷或缓解所述癌症或肿瘤的功效降低超过约20%。
101.在一些实施例中,施用凋亡细胞使car t细胞的功效提高。在一些实施例中,施用凋亡细胞使car t细胞的功效提高至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45或至少50%。
102.在另一个实施例中,施用包括凋亡细胞上清液的组合物不会使car t细胞治疗、预防、抑制所述癌症或所述肿瘤、降低所述癌症或所述肿瘤的发病率、改善或缓解所述癌症或所述肿瘤的功效降低超过约5%。在另一个实施例中,施用包括凋亡细胞上清液的组合物不会使car t细胞治疗、预防、抑制所述癌症或所述肿瘤、降低所述癌症或所述肿瘤的发病率、改善或缓解所述癌症或所述肿瘤的功效降低超过约10%。在另一个实施例中,施用包括凋亡细胞上清液的组合物不会使car t细胞治疗、预防、抑制所述癌症或所述肿瘤、降低所述癌症或所述肿瘤的发病率、改善或缓解所述癌症或所述肿瘤的功效降低超过约15%。在另一个实施例中,施用包括凋亡细胞上清液的组合物不会使car t细胞治疗、预防、抑制所述癌症或所述肿瘤、降低所述癌症或所述肿瘤的发病率、改善或缓解所述癌症或所述肿瘤的功效降低超过约20%。在另一个实施例中,施用包括所述凋亡细胞上清液的组合物不会影响car t细胞治疗、预防、抑制所述癌症或所述肿瘤、降低所述癌症或所述肿瘤的发病率、改善或缓解所述癌症或所述肿瘤的功效。在另一个实施例中,施用包括所述凋亡细胞上清液的组合物不会使car t细胞治疗、预防、抑制所述癌症或所述肿瘤、降低所述癌症或所述肿瘤的发病率、改善或缓解所述癌症或所述肿瘤的功效降低。
103.在一些实施例中,本文公开了抑制经历car t细胞癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法。在另一个实施例中,本文所公开的方法减少或阻止经历car t细胞癌症疗法的受试者的细胞因子产生,由此抑制受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率。在另一个实施例中,本文所公开的抑制经历car t细胞癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法包括向经历所述癌症疗法的所述受试者施用包括凋亡细胞的组合物的步骤。在另一个实施例中,本文所公开的用于减少或抑制经历car t细胞癌症疗法的受试者的细胞因子产生的方法包括向经历所述癌症疗法的所述受试者施用包括凋亡细胞的组合物的步骤。在
另一个实施例中,施用包括凋亡细胞的组合物不会影响car t细胞疗法的功效。在另一个实施例中,施用包括凋亡细胞或凋亡上清液的组合物不会使car t细胞疗法的功效降低。在另一个实施例中,施用包括凋亡细胞或凋亡细胞上清液的组合物不会使car t细胞疗法的功效降低超过约5%。在另一个实施例中,施用包括凋亡细胞或凋亡细胞上清液的组合物不会使car t细胞疗法的功效降低超过约10%。在另一个实施例中,施用包括凋亡细胞或凋亡细胞上清液的组合物不会使car t细胞疗法的功效降低超过约15%。在另一个实施例中,施用包括凋亡细胞或凋亡细胞上清液的组合物不会使car t细胞疗法的功效降低超过约20%。
104.在一些实施例中,本文公开了减少或抑制经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害的受试者的细胞因子产生的方法,所述方法包括施用如本文所公开的凋亡细胞上清液或包括所述凋亡细胞上清液的组合物的步骤。在另一个实施例中,凋亡细胞上清液包括凋亡细胞-吞噬细胞上清液。
105.在一些实施例中,本文所公开的用于减少或抑制经历car t细胞癌症疗法的受试者的细胞因子产生的方法包括向经历所述癌症疗法的所述受试者施用包括凋亡细胞上清液的组合物的步骤。在另一个实施例中,施用包括凋亡细胞上清液的组合物不会影响car t细胞疗法的功效。在另一个实施例中,施用包括凋亡细胞上清液的组合物不会使car t细胞疗法的功效降低。
106.在一些实施例中,抑制经历表达嵌合抗原受体的t细胞(car t细胞)癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法包括向所述受试者施用包括凋亡细胞或凋亡上清液的组合物的步骤。在另一个实施例中,抑制经历表达嵌合抗原受体的t细胞(car t细胞)癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法减少或抑制所述受试者的至少一种促炎性细胞因子的产生。
107.在另一个实施例中,本公开提供了包括使用如本文所描述的处于早期凋亡状态的单核细胞的汇集的单核凋亡细胞制剂治疗、预防、改善、抑制有需要的受试者的免疫疾病、自身免疫性疾病、炎性疾病、细胞因子释放综合征(crs)、细胞因子风暴或不孕症或降低上述疾病的发病率的方法。在另一个实施例中,本文公开了汇集的单核凋亡细胞制剂,其中在某些实施例中,使用此种细胞制剂不需要例如通过hla分型对供体和接受者进行匹配。
108.经基因修饰的免疫细胞
109.众所周知,免疫细胞的基因修饰是用于针对癌症的免疫细胞疗法的策略。这些免疫细胞疗法基于对自体或同种异体免疫细胞的操纵和其向有需要的受试者的施用。基于免疫细胞的疗法包含自然杀伤细胞疗法、树突状细胞疗法和t细胞免疫疗法(包含利用原初t细胞、效应子t细胞(也被称为t辅助细胞)、细胞毒性t细胞和调节性t细胞(treg)的疗法)。
110.在一个实施例中,本文公开了包括经基因修饰的免疫细胞的组合物。在另一个实施例中,所述经基因修饰的免疫细胞是t细胞。在另一个实施例中,t细胞是原初t细胞。在另一个实施例中,t细胞是原初cd4
t细胞。在另一个实施例中,t细胞是原初t细胞。在另一个实施例中,t细胞是原初cd8
t细胞。在另一实施例中,经基因修饰的免疫细胞为自然杀伤(nk)细胞。在另一实施例中,经基因修饰的免疫细胞为树突状细胞。在再一实施例中,经基因修饰的t细胞是细胞毒性t淋巴球(ctl细胞)。在另一实施例中,经基因修饰的t细胞是调节性t细胞(treg)。在另一实施例中,经基因修饰的t细胞为嵌合抗原受体(car)t细胞。在另
一个实施例中,所述经基因修饰的t细胞是经基因修饰的t细胞受体(tcr)细胞。。
111.在一个实施例中,本文公开了包括经基因修饰的免疫细胞和选自凋亡细胞、凋亡细胞上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂的组合物。在另一个实施例中,本文公开了包括经基因修饰的免疫细胞、凋亡细胞和选自ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂的组合物。在另一个实施例中,本文公开了包括经基因修饰的免疫细胞、凋亡细胞上清液和选自ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂的组合物。
112.在一个实施例中,所述免疫细胞是细胞毒性的。在另一实施例中,可以从受试者(自体)或供体(同种异体)的骨髓获得基因修饰的细胞毒性细胞。在其它情况下,细胞获自干细胞。举例来说,细胞毒性细胞可以来源于人类多能干细胞,如人类胚胎干细胞或人类诱导多能t细胞。在诱导多能干细胞(ipsc)的情况下,此类多能干t细胞可以使用来自将对其提供经基因修饰的细胞毒性细胞的受试者的体细胞获得。在一个实施例中,免疫细胞可以通过以下方式从受试者或供体获得:通过静脉穿刺、通过单采血液成分术方法、通过白细胞动员接着单采血液成分术或静脉穿刺或通过骨髓抽吸来收集细胞。
113.在一个实施例中,免疫细胞(例如t细胞)通过体内特定因子的存在产生和扩增。在另一实施例中,t细胞产生和维持受体内细胞因子影响。在另一个实施例中,影响体内t辅助细胞的产生和维持的细胞因子包括il-1、il-2、il-4、il-6、il-12、il-21、il-23、il-25、il-33和tgfβ。在另一个实施例中,treg细胞通过体内细胞因子诱导从原初t细胞产生。在仍另一个实施例中,tgf-β和/或il-2在分化原初t细胞成为treg细胞中起作用。
114.在另一个实施例中,选自il-1、il-2、il-4、il-6、il-12、il-21、il-23、il-25、il-33和tgfβ的细胞因子的存在使体内t细胞的增殖速率得以维持或有所提高或两者。在另一个实施例中,细胞因子il-2和/或tgfβ的存在使体内t细胞的增殖速率得以维持或有所提高或两者。在另一个实施例中,选自il-1、il-2、il-4、il-6、il-12、il-21、il-23、il-25、il-33和tgfβ的细胞因子的存在使体内car t细胞的增殖速率得以维持或有所提高或两者。在另一个实施例中,细胞因子il-2和/或tgfβ的存在使体内car t细胞的增殖速率得以维持或有所提高或两者。在另一个实施例中,选自il-1、il-2、il-4、il-6、il-12、il-21、il-23、il-25、il-33和tgfβ的细胞因子的存在使体内tcr t细胞的增殖速率得以维持或有所提高或两者。在另一个实施例中,细胞因子il-2和/或tgfβ的存在使体内tcr t细胞的增殖速率得以维持或有所提高或两者。在另一个实施例中,选自il-1、il-2、il-4、il-6、il-12、il-21、il-23、il-25、il-33和tgfβ的细胞因子的存在使体内t-reg细胞的增殖速率得以维持或有所提高或两者。在另一个实施例中,细胞因子il-2和/或tgfβ的存在使体内t-reg细胞的增殖速率得以维持或有所提高或两者。
115.在一个实施例中,具有stat5b编码的蛋白质或bach2编码的蛋白质的改变的表达或形式的t细胞维持延长的时间段或具有提高的增殖速率或两者。在另一个实施例中,所述改变的表达增加表达stat5b多肽。在另一个实施例中,所述改变的表达增加bach2多肽的表达。
116.在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的t细胞在体内维持延长的时间段或具有提高的增殖速率。在另一个实施例中,具有bach2编码的蛋白质的改变
的表达的t细胞在体内维持延长的时间段或具有提高的增殖速率。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的t细胞在体内维持延长的时间段或具有提高的增殖速率。在另一个实施例中,具有bach2编码的蛋白质的改变的形式的t细胞在体内维持延长的时间段或具有提高的增殖速率。
117.在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于1年。在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于2年。在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于3年。在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于4年。在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于5年。在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于10年。在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于20年。
118.在另一个实施例中,具有bach2编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于1年。在另一个实施例中,具有bach2编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于2年。在另一个实施例中,具有bach2编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于3年。在另一个实施例中,具有bach2编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于4年。在另一个实施例中,具有bach2编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于5年。在另一个实施例中,具有bach2编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于10年。在另一个实施例中,具有bach2编码的蛋白质的改变的表达的t细胞在体内维持或提高其增殖速率持续大于20年。
119.在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于1年。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于2年。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于3年。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于4年。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于5年。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于10年。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于20年。
120.在另一个实施例中,具有bach2编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于1年。在另一个实施例中,具有bach2编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于2年。在另一个实施例中,具有bach2编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于3年。在另一个实施例中,具有bach2编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于4年。在另一个实施例中,具有bach2编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于5年。在另一个实施例中,具有bach2编码的蛋白质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于10年。在另一个实施例中,具有bach2编码的蛋白
质的改变的形式的t细胞在体内维持或提高其增殖速率持续大于20年。
121.在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的car t细胞在体内维持延长的时间段或具有提高的增殖速率。在另一个实施例中,具有bach2编码的蛋白质的改变的表达的car t细胞在体内维持延长的时间段或具有提高的增殖速率。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的car t细胞在体内维持延长的时间段或具有提高的增殖速率。在另一个实施例中,具有bach2编码的蛋白质的改变的形式的car t细胞在体内维持延长的时间段或具有提高的增殖速率。
122.在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的tcr t细胞在体内维持延长的时间段或具有提高的增殖速率。在另一个实施例中,具有bach2编码的蛋白质的改变的表达的tcr t细胞在体内维持延长的时间段或具有提高的增殖速率。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的tcr t细胞在体内维持延长的时间段或具有提高的增殖速率。在另一个实施例中,具有bach2编码的蛋白质的改变的形式的tcr t细胞在体内维持延长的时间段或具有提高的增殖速率。
123.在另一个实施例中,具有stat5b编码的蛋白质的改变的表达的treg细胞在体内维持或提高其增殖速率。在另一个实施例中,具有bach2编码的蛋白质的改变的表达的treg细胞在体内维持或提高其增殖速率。在另一个实施例中,具有stat5b编码的蛋白质的改变的形式的treg细胞在体内维持或提高其增殖速率。在另一个实施例中,具有bach2编码的蛋白质的改变的形式的treg细胞在体内维持或提高其增殖速率。
124.在一个实施例中,本文公开了用于维持或提高经基因修饰的免疫细胞的增殖速率的方法,其中所述方法包括施用凋亡细胞或凋亡上清液的步骤。在另一个实施例中,本文公开了用于提高经基因修饰的免疫细胞的功效的方法,其中所述方法包括施用另外的药剂的步骤,所述另外的药剂包括凋亡细胞、凋亡上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合。在另一个实施例中,用于治疗、预防、抑制本文所公开的癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的方法施用经基因修饰的免疫细胞和另外的药剂,其中所述另外的药剂包括凋亡细胞、凋亡上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合。
125.表达嵌合抗原受体的t细胞(car t细胞)
126.在一些实施例中,嵌合抗原受体(car)是由与细胞外肿瘤结合部分融合的细胞内t细胞信号传导结构域(最通常为来自单克隆抗体的单链可变片段(scfv))构成的一种类型的抗原靶向受体。car独立于mhc介导的呈递直接识别细胞表面抗原,从而允许在所有患者体内使用对任何给定抗原具有特异性的单个受体构建体。最初的car将抗原识别域融合到t细胞受体(tcr)复合物的cd3ζ激活链上。虽然这些第一代car在体外诱导t细胞效应子功能,但是其在体内在很大程度上受不良抗肿瘤功效的限制。随后的car迭代具有与cd3ζ串联的次级共刺激信号,包含来自cd28的细胞内结构域或各种tnf受体家族分子,如4-1bb(cd137)和ox40(cd134)。进一步地,除cd3ζ之外,第三代受体包含两个共刺激信号,最常见地来自cd28和4-1bb。第二代和第三代car显著提高抗肿瘤功效,在一些情况下诱导患有晚期癌症的患者的完全缓解。
127.在一些实施例中,car t细胞是包括抗原受体的免疫应答细胞,所述免疫应答细胞
在其受体与其抗原结合时被活化。
128.在一些实施例中,在如本文所公开的组合物和方法中使用的car t细胞是第一代car t细胞。在另一个实施例中,在如本文所公开的组合物和方法中使用的car t细胞是第二代car t细胞。在另一个实施方案中,在如本文公开的组合物和方法中使用的car t细胞是第三代car t细胞。在另一个实施例中,在如本文所公开的组合物和方法中使用的car t细胞是第四代car t细胞。在一些实施例中,每一代car t细胞均比前几代car t细胞更有效。
129.在一些实施例中,第一代car具有一个信号传导结构域,通常是cd3 tcrζ链的细胞质信号传导结构域。
130.在另一个实施例中,如本文所公开的car t细胞是第二代car t细胞。在另一个实施例中,如本文所公开的car t细胞包括三重嵌合受体(tpcr)。在一些实施例中,如本文所公开的car t细胞包括以共刺激非依赖性方式活化原初t细胞的一个或多个信号传导部分。在另一个实施例中,car t细胞进一步对肿瘤坏死因子受体家族的一个或多个成员进行编码,所述肿瘤坏死因子受体家族在一些实施例中是cd27、4-1bb(cd137)或ox40(cd134)或其组合。
131.第三代car t细胞试图利用2个共刺激结构域的信号传导潜能:在一些实施例中,cd28结构域之后是4-1bb或ox-40信号传导结构域。在另一个实施例中,在如本文所公开的组合物和方法中使用的car t细胞进一步对共刺激信号传导结构域(其在一个实施例中是cd28)进行编码。在另一个实施例中,信号传导结构域是cd3ζ链、cd97、gdi la-cd18、cd2、icos、cd27、cd154、cds、ox40、4-1bb、cd28信号传导结构域或其组合。
132.在一些实施例中,端粒长度和复制能力与过继转移的t细胞系的植入效率和抗肿瘤功效相关。在一些实施例中,cd28刺激维持t细胞中的端粒长度。
133.在一些实施例中,经car修饰的t细胞效能可以通过引入另外的基因(包含对增殖性细胞因子(即,il-12)或共刺激配体(即,4-1bbl)进行编码的那些基因)来进一步增强,因此产生“装甲的(armored)”第四代经car修饰的t细胞。在一些实施例中,“装甲的car t细胞”是被保护免受抑制性肿瘤微环境的car t细胞。在另一个实施例中,“装甲的”car技术结合可溶信号传导蛋白的局部分泌,以在肿瘤微环境内放大免疫应答,目标是使全身性副作用最小化。在一些实施例中,信号传导蛋白信号是il-12,其可以刺激t细胞活化和募集。在一些实施例中,“装甲的”car技术在实体瘤适应症方面特别有用,其中微环境和有效免疫抑制机制具有使稳健抗肿瘤应答的建立更具挑战性的潜力。
134.在一些实施例中,car t细胞被基因修饰成对参与预防细胞凋亡、重塑肿瘤微环境、诱导稳态增殖和促进定向t细胞归巢的趋化因子受体的分子进行编码。
135.在另一个实施例中,如本文所公开的组合物和方法中使用的car t细胞疗法使用细胞因子转基因的表达、与小分子抑制剂的组合疗法或单克隆抗体来增强。在另一个实施例中,旨在改进car t细胞疗法(包含使用双car和趋化因子受体以更特异性地靶向肿瘤细胞)的其它策略被视为如本文所公开的car t细胞和car t细胞疗法的一部分。
136.在一些实施例中,如本文所公开的组合物和方法的car t细胞包括可以导致抑制性或放大信号的第二结合结构域,以便增加car t细胞针对癌细胞相对于正常细胞的特异性。例如,car t细胞可以被工程化成使得其将在存在一种靶蛋白的情况下被触发,但是如
果存在第二种蛋白质,那么其将被抑制。可选地,其还可以被工程化以使得最大活化将需要两种靶蛋白。这些方法可以增加car针对肿瘤相对于正常组织的特异性。
137.在一些实施例中,如本文所公开的组合物和方法中使用的car t细胞对基于抗体的外部受体结构和对由基于免疫受体酪氨酸的活化基序构成的信号转导模块进行编码的胞质结构域进行编码。
138.在一些实施例中,car t细胞进一步对结合具有免疫抑制活性的多肽的单链可变片段(scfv)进行编码。在另一个实施例中,具有免疫抑制活性的多肽是cd47、pd-1、ctla-4或其组合。
139.在一些实施例中,car t细胞进一步对结合具有免疫刺激活性的多肽的单链可变片段(scfv)进行编码。在另一个实施例中,具有免疫刺激活性的多肽是cd28、ox-40、4-1bb或其组合。在另一个实施例中,car t细胞进一步对cd40配体(cd40l)进行编码,在一些实施例中,其增强抗原的免疫刺激活性。
140.在一些实施例中,所述免疫细胞是细胞毒性的。在另一个实施例中,用于进行基因修饰的细胞毒性细胞可以从受试者或供体的骨髓获得。在其它情况下,细胞是从干细胞获得的。举例来说,细胞毒性细胞可以来源于人类多能干细胞,如人类胚胎干细胞或人类诱导多能t细胞。在诱导性多能干细胞(ipsc)的情况下,此类多能t细胞可以使用来自向其提供经基因修饰的细胞毒性细胞的受试者的体细胞来获得。在一些实施例中,免疫细胞可以通过以下方式从受试者或供体获得:通过静脉穿刺、通过单采血液成分术方法、通过白细胞动员接着单采血液成分术或静脉穿刺或通过骨髓抽吸来收集细胞。
141.在一些实施例中,如本文所公开的方法包括从受试者获得免疫细胞,并对所述免疫细胞进行基因修饰以表达嵌合抗原受体。在另一个实施例中,如本文所公开的方法包括从受试者获得免疫细胞,对所述免疫细胞进行基因修饰以表达嵌合抗原受体,并与凋亡细胞群组合,从而导致受试者的细胞因子产生减少,但是相对于未与凋亡细胞群一起施用的表达car的免疫细胞,细胞毒性基本上未受影响(图1a-1b和2)。在另一个实施例中,如本文所公开的方法包括从受试者获得免疫细胞,对所述免疫细胞进行基因修饰以表达嵌合抗原受体,并与凋亡细胞上清液或包括所述上清液的组合物组合,从而导致受试者的细胞因子产生减少,但是相对于未与凋亡细胞上清液一起施用的表达car的免疫细胞,细胞毒性基本上未受影响。在另一个实施例中,施用凋亡细胞群或来自凋亡细胞的上清液不会使表达嵌合抗原受体的免疫细胞的功效降低。
142.在一个实施例中,本文公开了免疫细胞(在一些实施例中,car t细胞),其中t细胞对受试者而言是自体的。在另一个实施例中,所述car t细胞对于受试者而言是异源的。在一些实施例中,所述car t细胞是同种异体的。在一些实施例中,所述car t细胞是通用同种异体car t细胞。在另一个实施例中,所述t细胞可以是自体的、同种异体的、或在体外源自经工程化的祖细胞或干细胞。
143.在另一个实施例中,本文所描述的car t细胞和凋亡细胞两者均源自相同来源。在另外的实施例中,本文所描述的car t细胞和凋亡细胞两者均源自受试者(图1)。在可选实施例中,本文所描述的car t细胞和凋亡细胞源自不同来源。在又另一个实施例中,所述car t细胞是自体的,并且本文所描述的凋亡细胞是同种异体的(图2)。技术人员应理解,类似地,凋亡细胞上清液可以由源自与car t细胞(其在一个实施例中可以是自体细胞)相同的
来源的细胞制备,或者凋亡细胞上清液可以由源自与car t细胞的来源不同的来源的细胞制备。
144.技术人员应理解,术语“异源的”可以涵盖源自不同生物体的组织、细胞、核酸分子或多肽。在一些实施例中,异源蛋白质是最初从不同的t细胞类型或与接受者不同的物种克隆或源自其并且通常不存在于细胞或从细胞获得的样品中的蛋白质。
145.因此,如本文所公开的一个实施例涉及细胞毒性免疫细胞(例如,nk细胞或t细胞),其包括嵌合抗原受体(car),由此细胞保持其细胞毒性功能。在另一实施例中,嵌合抗原受体对t细胞是外源性的。在另一实施例中,car以重组方式表达。在另一个实施例中,所述car从载体表达。
146.在一些实施例中,用于产生car t细胞的t细胞是原初cd4 t细胞。在另一个实施例中,用于产生car t细胞的t细胞是原初cd8 t细胞。在另一实施例中,用于产生car t细胞的t细胞为效应t细胞。在另一实施例中,用于产生car t细胞的t细胞为调节性t细胞(treg)。在另一个实施例中,用于产生car t细胞的t细胞是细胞毒性t细胞。
147.已经在文献中广泛地描述了经基因修饰的免疫细胞(例如,t细胞)的来源,参见例如,themelli et al.(2015)new cell sources for t cell engineering and adoptive immunotherapy.cell stem cell 16:357-366;han et al.(2013)journal of hematology&oncology 6:47-53;wilkie et al.(2010)j bio chem 285(33):25538-25544;和van der stegen et al.(2013)j.immunol 191:4589-4598。car t细胞可从商业来源订购,如创新实验室(creative biolabs)(美国纽约),其提供针对嵌合抗原受体(car)的定制的构建和产生服务并且还提供可以通过重组腺病毒疫苗诱导保护性免疫编码的预制备的car构建体库存。定制的car t细胞也可以从可以提供专门设计的car t细胞的普迈生物技术有限公司(promab biotechnologies)(美国加利福尼亚州)获得。
148.t细胞受体(tcr)细胞
149.在一个实施例中,除car t细胞外或代替car t细胞,如本文所公开的组合物和方法还利用设计者t细胞受体(tcr)细胞。tcr为介导t细胞的抗原特异性活化的多亚基跨膜复合物。tcr由两个不同的多肽链构成。tcr通过识别靶细胞(例如肿瘤或癌细胞)上的抗原表位赋予t细胞抗原特异性。在与肿瘤或癌细胞上存在的抗原接触之后,t细胞增殖并且获得允许其消除癌症或肿瘤细胞的表型和功能。
150.在一个实施例中,tcr t细胞疗法包含将对所关注的蛋白质的表位具有特异性的t细胞受体(tcr)引入到t细胞中。在另一实施例中,所关注的蛋白质为肿瘤相关抗原。在另一个实施例中,基因工程化的tcr识别肿瘤细胞上的主要组织相容性复合物(mhc)以及t细胞活化结构域所呈递的肿瘤抗原表位。在另一个实施例中,t细胞受体识别抗原,无论其细胞内或膜定位。在另一个实施例中,tcr识别细胞内表达肿瘤相关抗原的肿瘤细胞。在一个实施例中,tcr识别内部抗原。在另一实施例中,tcr识别血管生成因子。在另一实施例中,血管生成因子是参与形成新血管的分子。本领域中已知各种经基因修饰的t细胞受体和其生产方法。
151.在一个实施例中,tcr t细胞疗法用于治疗、预防、抑制、改善癌症或肿瘤、降低癌症或肿瘤的发病率或缓解癌症或肿瘤。在一个实施例中,tcr t细胞疗法用于治疗、预防、抑制、改善晚期转移性疾病、降低晚期转移性疾病的发病率或缓解晚期转移性疾病,所述晚期
转移性疾病包括具有血液(淋巴瘤和白血病)和实体肿瘤(难治性黑素瘤、肉瘤)的疾病。在一个实施例中,如本文所公开的组合物和方法中使用的tcr t细胞疗法治疗以下文献的表1中所列出的恶性肿瘤:sadelain et al.,(cancer discov.2013apr;3(4):388
–
398)。
152.在另一个实施例中,t细胞受体被基因修饰成结合ny-eso-1表位,并且经tcr工程化的t细胞是抗ny-eso-1。在另一个实施例中,t细胞受体被基因修饰成结合hpv-16e6表位,并且经tcr工程化的t细胞是抗hpv-16e6。在另一个实施例中,t细胞受体被基因修饰成结合hpv-16e7表位,并且经tcr工程化的t细胞是抗hpv-16e7。在另一个实施例中,t细胞受体被基因修饰成结合mage a3/a6表位,并且经tcr工程化的t细胞是抗mage a3/a6。在另一个实施例中,t细胞受体被基因修饰成结合mage a3表位,并且经tcr工程化的t细胞是抗mage a3。在另一实施例中,对t细胞受体进行基因修饰以结合ssx2表位,并且经tcr工程化的t细胞是抗ssx2。在另一实施例中,对t细胞受体进行基因修饰以结合本文所公开的靶抗原。使用本领域中熟知的工具,技术人员将了解,可以对t细胞受体进行基因修饰以结合存在于癌症或肿瘤细胞上的靶抗原,其中经tcr工程化的t细胞包含抗肿瘤或抗癌细胞。
153.在一个实施例中,如本文所公开的方法包含从受试者获得免疫细胞,并且基因修饰免疫细胞以表达重组t细胞受体(tcr)。在另一个实施例中,如本文所公开的方法包括从受试者获得免疫细胞,对所述免疫细胞进行基因修饰以表达重组tcr,并与另外的药剂组合,其中所述另外的药剂包括凋亡细胞群、凋亡细胞上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合。
154.在一个实施例中,用于产生tcr t细胞的t细胞是原初cd4
t细胞。在另一个实施例中,用于产生tcr t细胞的t细胞是原初cd8
t细胞。在另一个实施例中,用于产生tcr t细胞的t细胞是效应子t细胞。在另一个实施例中,用于产生tcr t细胞的t细胞是调节性t细胞(treg)。在另一个实施例中,用于产生tcr t细胞的t细胞是细胞毒性t细胞。
155.已经在文献中广泛描述了tcr t细胞,参见例如,sharpe and mount(2015)ibid.;essand m,loskog asi(2013)genetically engineered t cells for the treatment of cancer(review).j intern med 273:166
–
181;和kershaw et al.(2014)clinical application of genetically modified t cells in cancer therapy.clinical&translational immunology 3:1-7。
156.靶向抗原
157.在一些实施例中,所述car通过针对抗原的抗体或抗体片段与抗原的表位结合。在另一个实施例中,所述抗体是单克隆抗体。在另一实施例中,抗体为多克隆抗体。在另一个实施例中,所述抗体片段是单链可变片段(scfv)。
158.在一个实施例中,所述tcr通过经基因修饰的t细胞受体与抗原的表位结合。
159.在另一个实施例中,如本文所公开的组合物的car t细胞与肿瘤相关抗原(taa)结合。在另一个实施例中,所述肿瘤相关抗原是:粘蛋白1、细胞表面相关(muc1)或多态上皮粘蛋白(pem)、富含精氨酸在早期肿瘤中突变的(armet)、热冲击蛋白60(hsp60)、钙联蛋白(calnexin)(canx)、次甲基四氢叶酸脱氢酶(nadp 依赖性)2、次甲基四氢叶酸环水解酶(mthfd2)、成纤维细胞活化蛋白(fap)、基质金属肽酶(mmp6)、b黑素瘤抗原-1(bage-1)、n-乙酰基葡糖胺基转移酶v的异常转录物(gntv)、q5h943、癌胚抗原(cea)、pmel、激肽释放酶-4、乳腺珠蛋白-1、mart-1、gpr143-oa1、前列腺特异性抗原(psa)、trp1、酪氨酸酶、fgp-5、
neu原癌基因、aft、mmp-2、前列腺特异性膜抗原(psma)、端粒酶相关蛋白-2、前列腺酸性磷酸酶(pap)、尿溶蛋白ii或蛋白酶3。
160.在另一个实施例中,所述car在其想要破坏b细胞的情况下(如在白血病中)与cd19或cd20结合以靶向b细胞。cd19是b细胞谱系特异性表面受体,其从祖b细胞到早期浆细胞的广泛表达使得其对于b细胞恶性肿瘤的免疫疗法而言成为有吸引力的标靶。在另一个实施例中,所述car与ror1、cd22或gd2结合。在另一实施例中,car与ny-eso-1结合。在另一个实施例中,所述car与mage家族蛋白结合。在另一个实施例中,所述car与间皮素结合。在另一个实施例中,所述car与c-erbb2结合。在另一实施例中,car结合肿瘤特异性的突变抗原,例如brafv600e突变和bcr-abl易位。在另一实施例中,car结合肿瘤特异性的病毒抗原,例如hd中的ebv,宫颈癌中的hpv和默克尔癌(merkel cancer)中的多瘤病毒。在另一实施例中,car t细胞结合到her2/neu。在另一个实施例中,所述car t细胞与egfrviii结合。
161.在一些实施例中,所述嵌合抗原受体(car)t细胞结合cd19抗原。在另一个实施例中,所述car结合cd22抗原。在另一个实施例中,所述car与α叶酸受体结合。在另一个实施例中,所述car与caix结合。在另一个实施例中,所述car与cd20结合。在另一个实施例中,所述car与cd23结合。在另一个实施例中,所述car与cd24结合。在另一个实施例中,所述car与cd30的结合。在另一个实施例中,所述car与cd33结合。在另一个实施例中,所述car与cd38结合。在另一个实施例中,所述car与cd44v6的结合。在另一个实施例中,所述car与cd44v7/8结合。在另一个实施例中,所述car与cd123结合。在另一个实施例中,所述car与cd171结合。在另一个实施例中,所述car与癌胚抗原(cea)结合。在另一个实施例中,所述car与egfrviii结合。在另一个实施例中,所述car与egp-2结合。在另一个实施例中,所述car与egp-40结合。在另一个实施例中,所述car与epha2结合。在另一个实施例中,所述car与erb-b2结合。在另一个实施例中,所述car与erb-b 2、3、4结合。在另一个实施例中,所述car与erb-b3/4结合。在另一个实施例中,所述car与fbp结合。在另一个实施例中,所述car与胎儿乙酰胆碱酯酶受体结合。在另一个实施例中,所述car与g
d2
结合。在另一个实施例中,所述car与g
d3
结合。在另一个实施例中,所述car与her2结合。在另一个实施例中,所述car与hmw-maa结合。在另一个实施例中,所述car与il-11rα结合。在另一个实施例中,所述car与il-13rα1结合。在另一个实施例中,所述car与kdr结合。在另一个实施例中,所述car与κ轻链结合。在另一个实施例中,所述car与lewis y结合。在另一个实施例中,所述car与l1细胞粘附分子结合。在另一个实施例中,所述car与mage-a1结合。在另一个实施例中,所述car与间皮素结合。在另一个实施例中,所述car与cmv感染细胞结合。在另一个实施例中,所述car与muc1结合。在另一个实施例中,所述car与muc16结合。在另一个实施例中,所述car与nkg2d配体结合。在另一个实施例中,所述car与ny-eso-1(氨基酸157-165)结合。在另一个实施例中,所述car与癌胚抗原(h5t4)结合。在另一个实施例中,所述car与psca结合。在另一个实施例中,所述car与psma结合。在另一个实施例中,所述car与ror1结合。在另一个实施例中,所述car与tag-72结合。在另一个实施例中,所述car与vegf-r2或其它vegf受体结合。在另一个实施例中,所述car与b7-h6结合。在另一个实施例中,所述car与ca9结合。在另一个实施例中,所述car与αvβ6整联蛋白结合。在另一个实施例中,所述car与8h9结合。在另一个实施例中,所述car与ncam结合。在另一个实施例中,所述car与胎儿乙酰胆碱酯酶受体结合。
162.在另一个实施例中,所述嵌合抗原受体(car)t细胞靶向cd19抗原,并且对患有b细
胞恶性肿瘤、all、滤泡性淋巴瘤、cll和淋巴瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd22抗原,并且对患有b细胞恶性肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向α叶酸受体或叶酸受体α,并且对患有卵巢癌或上皮癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向caix或g250/caix,并且对患有肾细胞癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd20,并且对患有淋巴瘤、b细胞恶性肿瘤、b细胞淋巴瘤、套细胞淋巴瘤、惰性b细胞淋巴瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd23,并且对患有cll的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd24,并且对患有胰腺癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd30,并且对患有淋巴瘤或霍奇金淋巴瘤(hodgkin lymphoma)的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd33,并且对患有aml的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd38,并且对患有非霍奇金淋巴瘤(non-hodgkin lymphoma)的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd44v6,并且对患有严重恶性肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd44v7/8,并且对患有宫颈癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd123,并且对患有髓系恶性肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cea,并且对患有结肠直肠癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向egfrviii,并且对患有胶质母细胞瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向egp-2,并且对患有多发性恶性肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向egp-40,并且对患有结肠直肠癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向epha2,并且对患有胶质母细胞瘤的受试者具有治疗作用。在另一个实施例中,car t细胞靶向erb-b2或erbb3/4,并且对患有乳腺癌和其它癌症、前列腺癌、结肠癌、各种肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向erb-b 2、3、4,并且对患有乳腺癌和其它癌症的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向fbp,并且对患有卵巢癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向胎儿乙酰胆碱酯酶受体,并且对患有横纹肌肉瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向g
d2
,并且对患有神经母细胞瘤、黑色素瘤或尤因氏肉瘤(ewing's sarcoma)的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向g
d3
,并且对患有黑色素瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向her2,并且对患有成神经管细胞瘤、胰腺癌、胶质母细胞瘤、骨肉瘤或卵巢癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向hmw-maa,并且对患有黑色素瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向il-11rα,并且对患有骨肉瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向il-13rα1,并且对患有神经胶质瘤、胶质母细胞瘤或成神经管细胞瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向il-13受体α2,并且对患有严重恶性肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向kdr,并且通过靶向肿瘤新脉管系统而对患有肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向κ轻链,并且对患有b细胞恶性肿瘤(b-nhl、cll)的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向lewis y,并且对患有各种癌或上皮源性肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向l1细胞粘附分子,并且对患有神经母细胞
瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向mage-a1或hla-a1 mage a1,并且对患有黑色素瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向间皮素,并且对患有间皮瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cmv感染细胞,并且对患有cmv的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向muc1,并且对患有乳腺癌或卵巢癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向muc16,并且对患有卵巢癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向nkg2d配体,并且对患有骨髓瘤、卵巢瘤和其它肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向ny-eso-1(157-165)或hla-a2 ny-eso-1,并且对患有多发性骨髓瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向癌胚抗原(h5t4),并且对患有各种肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向psca,并且对患有前列腺癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向psma,并且对患有前列腺癌/肿瘤脉管系统的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向ror1,并且对患有b-cll和套细胞淋巴瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向tag-72,并且对患有腺癌或胃肠癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向vegf-r2或其它vegf受体,并且通过靶向肿瘤新脉管系统而对患有肿瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向ca9,并且对患有肾细胞癌的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向cd171,并且对患有肾神经母细胞瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向ncam,并且对患有神经母细胞瘤的受试者具有治疗作用。在另一个实施例中,所述car t细胞靶向胎儿乙酰胆碱酯酶受体,并且对患有横纹肌肉瘤的受试者具有治疗作用。在另一个实施例中,所述car与以下文献的表1中所列出的靶抗原之一结合,sadelain et al.(cancer discov.2013apr;3(4):388
–
398),所述文献通过引用以其整体并入本文中。在另一个实施例中,car t细胞与碳水化合物或糖脂结构结合。
163.在一个实施例中,所述car t细胞与血管生成因子结合,由此靶向肿瘤脉管系统。在一些实施例中,所述血管生成因子是vegfr2。在另一个实施例中,所述血管生成因子是内皮糖蛋白。在另一个实施例中,本文所公开的血管生成因子是血管生成素;血管生成素1;del-1;成纤维细胞生长因子;酸性(afgf)和碱性(bfgf);卵泡抑素;粒细胞集落刺激因子(g-csf);肝细胞生长因子(hgf)/散射因子(sf);白介素-8(il-8);瘦蛋白;中期因子;胎盘生长因子;血小板衍生的内皮细胞生长因子(pd-ecgf);血小板衍生的生长因子-bb(pdgf-bb);多效生长因子(ptn);颗粒蛋白前体;增殖蛋白;转化生长因子-α(tgf-α);转化生长因子-β(tgf-β);肿瘤坏死因子-α(tnf-α);血管内皮生长因子(vegf)/血管渗透因子(vpf)。在另一个实施例中,血管生成因子是血管生成蛋白。在一些实施例中,生长因子是血管生成蛋白。在一些实施例中,在本文所公开的组合物和方法中使用的血管生成蛋白是成纤维细胞生长因子(fgf);vegf;vegfr和神经纤毛蛋白1(nrp-1);血管生成素1(ang1)和tie2;血小板衍生的生长因子(pdgf;bb-同源二聚体)和pdgfr;转化生长因子β(tgf-β)、内皮糖蛋白和tgf-β受体;单核细胞趋化蛋白-1(mcp-1);整联蛋白αvβ3、αvβ5和α5β1;ve-钙粘蛋白和cd31;肝配蛋白;纤溶酶原活化剂;纤溶酶原激活物抑制剂-1;氧化氮合酶(nos)和cox-2;ac133;或id1/id3。在一些实施例中,在本文所公开的组合物和方法中使用的血管生成蛋白是血管生成素,所述血管生成素在一个实施例中是血管生成素1、血管生成素3、血管生成素
4或血管生成素6。在一些实施例中,内皮糖蛋白被称为cd105;edg;hht1;orw;或orw1。在一些实施例中,内皮糖蛋白是tgfβ共受体。
164.在另一个实施例中,所述car t细胞与和感染原相关的抗原结合。在一些实施例中,所述感染原是结核分枝杆菌(mycobacterium tuberculosis)。在一些实施例中,所述结核分枝杆菌相关抗原是:抗原85b、脂蛋白ipqh、atp依赖性解旋酶假定、未表征的蛋白rv0476/mto4941前体或未表征的蛋白rv1334/mt1376前体。
165.在另一个实施例中,所述car t细胞与抗体结合。在一些实施例中,所述car t细胞是“抗体偶联的t细胞受体”(actr)。根据这个实施例,所述car t细胞是通用car t细胞。在另一实施例中,具有抗体受体的car t细胞在施用抗体之前、之后或同时施用,且接着结合到抗体,使t细胞极为接近肿瘤或癌症。在另一实施例中,抗体针对肿瘤细胞抗原。在另一实施例中,抗体针对cd20。在另一实施例中,抗体是利妥昔单抗(rituximab)。
166.在另一实施例中,抗体是曲妥珠单抗(trastuzumab)(赫赛汀(herceptin);基因泰克(genentech)):针对erbb2的人源化igg1。在另一实施例中,抗体是贝伐单抗(bevacizumab)(阿瓦斯汀(avastin);基因泰克/罗氏(roche)):针对vegf的人源化igg1。在另一个实施例中,抗体是西妥昔单抗(cetuximab)(爱必妥(erbitux);百时美施贵宝公司(bristol-myers squibb)):针对egfr的嵌合人-鼠igg1。在另一实施例中,抗体是帕尼单抗(panitumumab)(维克替比(vectibix);安进):针对egfr的人类igg2。在另一实施例中,抗体是伊派利单抗(ipilimumab)(益伏(yervoy);百时美施贵宝公司):针对ctla4的igg1。
167.在另一实施例中,抗体为阿仑单抗(alemtuzumab)(坎帕斯(campath);健赞(genzyme)):针对cd52的人源化igg1。在另一实施例中,抗体是奥伐木单抗(ofatumumab)(阿扎拉(arzerra);genmab),针对cd20的人类igg1。在另一实施例中,抗体是吉妥单抗奥唑米星(gemtuzumab ozogamicin)(麦罗塔(mylotarg);惠氏(wyeth)):针对cd33的人源化igg4。在另一实施例中,抗体是贝伦妥单抗维多汀(brentuximab vedotin)(阿德曲斯(adcetris);西雅图遗传学公司(seattle genetics)):针对cd30的嵌合igg1。在另一实施例中,抗体是90y-标记的替坦异贝莫单抗(ibritumomab tiuxetan)(zevalin(泽娃灵);idec制药):针对cd20的鼠类igg1。在另一实施例中,抗体是131i标记的托西莫单抗(tositumomab)((bexxar);葛兰素史克(glaxosmithkline)):针对cd20的鼠类igg2。
168.在另一实施例中,抗体是雷莫芦单抗(ramucirumab),其针对血管内皮生长因子受体2(vegfr-2)。在另一实施例中,抗体是雷莫芦单抗(雷莫芦注射(cyramza injection),礼来公司(eli lilly and company))、布林莫单抗(blinatumomab)(blincyto,安进公司)、帕博利珠单抗(pembrolizumab)(克珠达(keytruda),默沙东公司(merck sharp&dohme corp.))、奥必珠单抗(obinutuzumab)(佳仕瓦(gazyva),基因泰克公司;此前被称为ga101)、帕妥珠单抗(pertuzumab)注射液(帕杰它(perjeta),基因泰克公司)或地诺单抗(denosumab)(狄诺塞麦(xgeva),安进公司)。在另一实施例中,抗体是巴利昔单抗(basiliximab)(舒莱(simulect);诺华(novartis))。在另一个实施例中,所述抗体是达利珠单抗(daclizumab)(赛尼哌(zenapax);罗氏公司)。
169.在另一个实施例中,所述car t细胞所偶联的抗体针对本文所描述和/或本领域中已知的肿瘤或癌症抗原或其片段。在另一个实施例中,所述car t细胞所偶联的抗体针对肿瘤相关抗原。在另一个实施例中,所述car t细胞所偶联的抗体针对肿瘤相关抗原或其作为
血管生成因子的片段。
170.在另一个实施例中,所述car t细胞所偶联的抗体针对本文所描述和/或本领域中已知的肿瘤或癌症抗原或其片段。
171.在一些实施例中,本文所描述的抗体可以与本文所描述的组合物组合使用,其例如但不限于包括car-t细胞或早期凋亡细胞或其任何组合的组合物。
172.细胞因子风暴和细胞因子释放综合征
173.在一个实施例中,本文所公开的方法包含提供免疫细胞(如nk细胞、树突状细胞、tcr t细胞或包括经工程化的嵌合抗原受体的t细胞(car t细胞)以及至少一种另外的药剂以减少可能在受试者体内发生的毒性细胞因子释放或“细胞因子释放综合征”(crs)或“严重细胞因子释放综合征”(scrs)或“细胞因子风暴”。在另一个实施例中,所述crs、scrs或细胞因子风暴由于施用免疫细胞而发生。在另一个实施例中,所述crs、scrs或细胞因子风暴是与免疫细胞分离的刺激、病状或综合征的结果(参见下文)。在另一个实施例中,细胞因子风暴、细胞因子瀑布或高细胞因子血症是较严重形式的细胞因子释放综合征。
174.在一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或包括所述凋亡细胞的组合物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞上清液或包括所述上清液的组合物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括ctla-4阻断剂。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或凋亡细胞上清液或其组合物以及ctla-4阻断剂。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括α-1抗胰蛋白酶或其片段或其类似物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或凋亡细胞上清液或其组合物以及α-1抗胰蛋白酶或其片段或其类似物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括碲基化合物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或凋亡细胞上清液或其组合物以及碲基化合物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括免疫调节剂。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或凋亡细胞上清液或其组合物以及免疫调节剂。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括treg细胞。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或凋亡细胞上清液或其组合物以及treg细胞。
175.技术人员应理解,减少毒性细胞因子释放或降低毒性细胞因子水平包括降低受试者体内的毒性细胞因子水平或抑制毒性细胞因子产生,或者抑制受试者的细胞因子释放综合征或细胞因子风暴或降低所述细胞因子释放综合征或细胞因子风暴的发病率。在另一个实施例中,毒性细胞因子水平在crs或细胞因子风暴期间有所降低。在另一个实施例中,降低毒性细胞因子水平或抑制毒性细胞因子水平产生包括治疗crs或细胞因子风暴。在另一个实施例中,降低毒性细胞因子水平或抑制毒性细胞因子水平产生包括预防crs或细胞因子风暴。在另一个实施例中,降低毒性细胞因子水平或抑制毒性细胞因子水平产生包括缓解crs或细胞因子风暴。在另一个实施例中,降低毒性细胞因子水平或抑制毒性细胞因子水平产生包括改善crs或细胞因子风暴。在另一个实施例中,所述毒性细胞因子包括促炎性细胞因子。在另一个实施例中,促炎性细胞因子包括il-6。在另一个实施例中,促炎性细胞因子包括il-1β。在另一个实施例中,促炎性细胞因子包括tnf-α。在另一个实施例中,促炎性
细胞因子包括il-6、il-1β或tnf-α或其任何组合。
176.在一个实施例中,细胞因子释放综合征的特征在于几种炎性细胞因子的水平升高以及受试者体内的不良身体反应,如低血压、高烧和发抖。在另一个实施例中,炎性细胞因子包括il-6、il-1β和tnf-α。在另一个实施例中,crs的特征在于il-6、il-1β或tnf-α或其任何组合的水平升高。在另一个实施例中,crs的特征在于il-8或il-13或其任何组合的水平升高。在另一个实施例中,细胞因子风暴的特征在于tnf-α、ifn-γ、il-1β、il-2、il-6、il-8、il-10、il-13、gm-csf、il-5、分形素(fracktalkine)或其组合或其亚群的增加。在又另一个实施例中,il-6构成crs或细胞因子风暴的标志物。
177.在另一个实施例中,人和小鼠的crs或细胞因子风暴中增加的细胞因子可以包括下表1和2中所列出的细胞因子的任何组合。
178.表1:人和/或小鼠的crs或细胞因子风暴中增加的细胞因子组
[0179][0180]
在一些实施例中,表1的细胞因子flt-3l、分形素、gm-csf、ifn-γ、il-1β、il-2、il-2rα、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12和il-13被认为在crs或细胞因子
风暴中是显著的。在另一个实施例中,表1的ifn-α、ifn-β、il-1和il-1rα在crs或细胞因子风暴中似乎是重要的。在另一个实施例中,m-csf具有未知的重要性。在另一个实施例中,表1中列出的任何细胞因子或其组合可以用作crs或细胞因子风暴的标志物。
[0181]
表2:人和/或小鼠的crs或细胞因子风暴中增加的细胞因子组
[0182][0183]
在一个实施例中,表2的il-15、il-17、il-18、il-21、il-22、ip-10、mcp-1、mip-1α、mip-1β和tnf-α被认为在crs或细胞因子风暴中是显著的。在另一个实施例中,表2的il-27、mcp-3、pge2、rantes、tgf-β、tnf-αr1和mig在crs或细胞因子风暴中似乎是重要的。在另一个实施例中,il-23和il-25具有未知的重要性。在另一个实施例中,表2中列出的任何细胞因子或其组合可以用作crs或细胞因子风暴的标志物。在另一个实施例中,小鼠细胞因子il-10、il-1β、il-2、ip-10、il-4、il-5、il-6、ifnα、il-9、il-13、ifn-γ、il-12p70、gm-csf、tnf-α、mip-1α、mip-1β、il-17a、il-15/il-15r和il-7在crs或细胞因子风暴中似乎是重要的。
[0184]
技术人员应理解,术语“细胞因子”可以涵盖细胞因子(例如,干扰素γ(ifn-γ)、粒细胞巨噬细胞集落刺激因子、肿瘤坏死因子α)、趋化因子(例如,mip 1α、mip 1β、rantes)以及炎症的其它可溶介体(如活性氧种类和氧化氮)。
[0185]
在一个实施例中,特定细胞因子(无论是显著的、重要的或具有未知的重要性)的释放增加并非先验地意指所述特定细胞因子是细胞因子风暴的一部分。在一个实施例中,至少一种细胞因子的增加不是细胞因子风暴或crs的结果。在另一个实施例中,car t细胞可以是特定细胞因子或一组细胞因子的水平升高的来源。
[0186]
在另一个实施例中,细胞因子释放综合征的特征在于任何或所有以下症状:伴有
或不伴有寒战的发烧、不适、疲劳、厌食、肌痛、关节痛、恶心、呕吐、头痛、皮疹、恶心、呕吐、腹泻、呼吸急促、血氧不足、心血管心动过速、脉搏压增宽、血压过低、心输出量增加(早期)、潜在的心输出量减少(晚期)、d-二聚体升高、伴有或不伴有出血的低纤维蛋白原血症、氮血症、肝转氨酶升高、高胆红素血症、头痛、精神状态变化、精神错乱、谵妄、唤词困难或症状明显的失语症、幻觉、震颤、错觉、辨距不良、癫痫发作、步态改变、癫痫。在另一个实施例中,细胞因子风暴的特征在于il-2释放和淋巴组织增生。在另一个实施例中,细胞因子风暴的特征在于car t细胞所释放的细胞因子的增加。在另一个实施例中,细胞因子风暴的特征在于不同于car t细胞的细胞所释放的细胞因子的增加。
[0187]
在另一个实施例中,细胞因子风暴会导致潜在地危及生命的并发症,包含心脏功能障碍、成人呼吸窘迫综合征、神经性毒性、肾和/或肝衰竭和弥漫性血管内凝血。
[0188]
技术人员应理解,细胞因子释放综合征(crs)或细胞因子风暴的特征估计会在触发crs或细胞因子风暴后几天到几周发生。在一个实施例中,car t细胞是crs或细胞因子风暴的触发物。在另一个实施例中,crs或细胞因子风暴的触发物不是car t细胞。
[0189]
在一个实施例中,作为细胞因子风暴的指示的细胞因子水平或浓度的测量可以表示为细胞因子水平或浓度的成倍增加、百分比(%)增加、净增加或变化速率。在另一个实施例中,高于某个水平或浓度的绝对细胞因子水平或浓度可以指示受试者正在经历或将要经历细胞因子风暴。在另一个实施例中,处于某个水平或浓度的绝对细胞因子水平或浓度(例如,通常在未经历car-t细胞疗法的对照受试者体内发现的水平或浓度)可以指示用于抑制经历car t细胞的受试者体内的细胞因子风暴或降低所述细胞因子风暴的发病率的方法。
[0190]
技术人员应理解,术语“细胞因子水平”可以涵盖浓度的度量、成倍变化的度量、百分比(%)变化的度量或速率变化的度量。进一步地,用于测量血液、唾液、血清、尿液和血浆中的细胞因子的方法在本领域中是众所周知的。
[0191]
在一个实施例中,尽管认识到细胞因子风暴与几种炎性细胞因子的升高相关,但是il-6水平可以用作细胞因子风暴的常用度量和/或作为针对细胞因子风暴的治疗的有效性的常用度量。技术人员应理解,其它细胞因子可以用作细胞因子风暴的标志物,例如tnf-α、ib-1α、il-8、il-13或inf-γ。进一步地,用于测量细胞因子的测定方法在本领域中是众所周知的。技术人员应理解,影响细胞因子风暴的方法可以类似地影响细胞因子释放综合征。
[0192]
在一个实施例中,本文公开了减少或抑制经历细胞因子释放综合征或细胞因子风暴的受试者中的细胞因子产生的方法。在另一个实施例中,本文公开了减少或抑制易于经历细胞因子释放综合征或细胞因子风暴的受试者中的细胞因子产生的方法。在另一个实施例中,本文所公开的方法减少或抑制经历细胞因子释放综合征或细胞因子风暴的受试者中的细胞因子产生,其中表1和/或表2中所列出的任何细胞因子或细胞因子组的产生有所减少或得到抑制。在另一个实施例中,细胞因子il-6产生有所减少或得到抑制。在另一个实施例中,细胞因子il-β1产生有所减少或得到抑制。在另一个实施例中,细胞因子il-8产生有所减少或得到抑制。在另一个实施例中,细胞因子il-13产生有所减少或得到抑制。在另一个实施例中,细胞因子tnf-α产生有所减少或得到抑制。在另一个实施例中,细胞因子il-6产生、il-1β产生或tnf-α产生或其任何组合有所减少或得到抑制。
[0193]
在一个实施例中,对细胞因子释放综合征进行分级。在另一个实施例中,1级描述
了其中症状不会危及生命并且仅需要对症治疗的细胞因子释放综合征,例如发烧、恶心、疲劳、头痛、肌痛、不适。在另一个实施例中,2级症状需要适度干预(如针对血压过低的氧气、流体或血管加压药)并且会对其作出应答。在另一个实施例中,3级症状需要积极干预并且会对其作出应答。在另一个实施例中,4级症状是危及生命的症状且需要呼吸机,并且患者显示出器官毒性。
[0194]
在另一个实施例中,细胞因子风暴的特征在于il-6和干扰素γ释放。在另一个实施例中,细胞因子风暴的特征在于表1和2中所列出的任何细胞因子或其组合的释放。在另一个实施例中,细胞因子风暴的特征在于本领域已知的任何细胞因子或其组合的释放。
[0195]
在一个实施例中,症状发作在输注开始后数分钟到数小时开始。在另一个实施例中,症状与峰值细胞因子水平相一致。
[0196]
在一个实施例中,抑制经历car t细胞癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法包括施用凋亡细胞群或凋亡细胞上清液或其组合物。在另一个实施例中,所述凋亡细胞群或凋亡细胞上清液或其组合物可以有助于car t细胞疗法。在另一个实施例中,所述凋亡细胞群或凋亡细胞上清液或其组合物可以有助于抑制所述crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率。在另一个实施例中,所述凋亡细胞群或凋亡细胞上清液或其组合物可以有助于治疗所述crs或细胞因子风暴。在另一个实施例中,所述凋亡细胞群或凋亡细胞上清液或其组合物可以有助于预防所述crs或细胞因子风暴。在另一个实施例中,所述凋亡细胞群或凋亡细胞上清液或其组合物可以有助于改善所述crs或细胞因子风暴。在另一个实施例中,所述凋亡细胞群或凋亡细胞上清液或其组合物可以有助于缓解所述crs或细胞因子风暴。
[0197]
在一个实施例中,抑制经历car t细胞癌症疗法且施用凋亡细胞群或凋亡细胞上清液或其组合物的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法包括施用另外的药剂。在另一个实施例中,所述另外的药剂可以有助于car t细胞疗法。在另一个实施例中,所述另外的药剂可以有助于抑制所述crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率。在另一个实施例中,所述另外的药剂可以有助于治疗所述crs或细胞因子风暴。在另一个实施例中,所述另外的药剂可以有助于预防所述crs或细胞因子风暴。在另一个实施例中,所述另外的药剂可以有助于改善所述crs或细胞因子风暴。在另一个实施例中,所述另外的药剂可以有助于缓解所述crs或细胞因子风暴。
[0198]
在一个实施例中,抑制经历car t细胞癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法包括施用另外的药剂。在另一个实施例中,所述另外的药剂可以有助于car t细胞疗法。在一个实施例中,抑制经历tcr t细胞癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法包括施用另外的药剂。在另一个实施例中,所述另外的药剂可以有助于tcr t细胞疗法。在一个实施例中,抑制经历的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法包括施用另外的药剂。在另一个实施例中,所述另外的药剂可以有助于。在一个实施例中,抑制经历nk细胞疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法包括施用另外的药剂。在另一个实施例中,所述另外的药剂可以有助
于nk细胞疗法。
[0199]
在另一个实施例中,所述另外的药剂可以有助于抑制所述crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率。在另一个实施例中,所述另外的药剂可以有助于治疗所述crs或细胞因子风暴。在另一个实施例中,所述另外的药剂可以有助于预防所述crs或细胞因子风暴。在另一个实施例中,所述另外的药剂可以有助于改善所述crs或细胞因子风暴。在另一个实施例中,所述另外的药剂可以有助于缓解所述crs或细胞因子风暴。
[0200]
在一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或包括所述凋亡细胞的组合物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞上清液或包括所述上清液的组合物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括ctla-4阻断剂。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或凋亡细胞上清液或其组合物以及ctla-4阻断剂。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括α-1抗胰蛋白酶或其片段或其类似物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或凋亡细胞上清液或其组合物以及α-1抗胰蛋白酶或其片段或其类似物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括碲基化合物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或凋亡细胞上清液或其组合物以及碲基化合物。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括免疫调节剂。在另一个实施例中,用于减少有害细胞因子释放的另外的药剂包括凋亡细胞或凋亡细胞上清液或其组合物以及免疫调节剂。
[0201]
在另一个实施例中,本文所公开的组合物和方法利用car t细胞与一种或多种ctla-4阻断剂(如伊匹单抗)的组合疗法。在另一个实施例中,本文所公开的组合物和方法利用包括凋亡细胞、car t细胞和一种或多种ctla-4阻断剂的组合疗法。在另一个实施例中,本文所公开的组合物和方法利用tcr t细胞与一种或多种ctla-4阻断剂(如伊匹单抗)的组合疗法。在另一个实施例中,本文所公开的组合物和方法利用包括凋亡细胞、tcr t细胞和一种或多种ctla-4阻断剂的组合疗法。在另一个实施例中,本文所公开的组合物和方法利用树突状细胞与一种或多种ctla-4阻断剂(如伊匹单抗)的组合疗法。在另一个实施例中,本文所公开的组合物和方法利用包括凋亡细胞、树突状细胞和一种或多种ctla-4阻断剂的组合疗法。在另一个实施例中,本文所公开的组合物和方法利用nk细胞与一种或多种ctla-4阻断剂(如伊匹单抗)的组合疗法。在另一个实施例中,本文所公开的组合物和方法利用包括凋亡细胞、nk细胞和一种或多种ctla-4阻断剂的组合疗法。
[0202]
在另一个实施例中,ctla-4是有助于维持自身耐受性的t细胞活化的有效抑制剂。在另一个实施例中,施用抗ctla-4阻断剂(其在另一个实施例中是抗体)产生t细胞活化的净效应。
[0203]
在另一个实施例中,可以通过本文所公开的组合物和方法治疗、预防、抑制、改善、降低其发病率或缓解的由car t细胞、tcr t细胞、树突状细胞或nk细胞施用产生的其它毒性包括b细胞再生障碍或肿瘤裂解综合征(tls)。
[0204]
在一个实施例中,抑制经历car t细胞癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法不会影响car t细胞疗法的功效。在另一个实施例中,抑制经历car t细胞癌症疗法的受试者的crs或细胞因子
风暴或降低所述crs或细胞因子风暴的发病率的方法使car t细胞疗法的功效降低超过约5%。在另一个实施例中,抑制经历car t细胞癌症疗法的受试者的crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法使car t细胞疗法的功效降低超过约10%。在另一个实施例中,抑制经历car t细胞癌症疗法的受试者的crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法使car t细胞疗法的功效降低超过约15%。在另一个实施例中,抑制经历car t细胞癌症疗法的受试者的crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法使car t细胞疗法的功效降低超过约20%。在另一个实施例中,抑制经历car t细胞癌症疗法的受试者的crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法使car t细胞疗法的功效提高超过约5%。在另一个实施例中,抑制经历car t细胞癌症疗法的受试者的crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法使car t细胞疗法的功效提高超过约10%。在另一个实施例中,抑制经历car t细胞癌症疗法的受试者的crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法使car t细胞疗法的功效提高超过约15%。在另一个实施例中,抑制经历car t细胞癌症疗法的受试者的crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法使car t细胞疗法的功效提高超过约20%。
[0205]
对细胞毒性进行定量的任何适当方法可以用于测定被修饰成表达car的免疫细胞中的活性是否基本上保持不变。例如,可以使用基于细胞培养物的测定(如实例中所描述的细胞毒性测定)来对细胞毒性进行定量。细胞毒性测定法可以使用优先染色死细胞dna的染料。在其他情况下,可以使用测量细胞群体中活细胞和死细胞相对数量的荧光和发光分析。对于此类测定,蛋白酶活性充当细胞活力和细胞毒性的标志物,并且经标记的细胞可渗透肽产生与样品中的活细胞数量成比例的荧光信号。例如,细胞毒性测定可以在流式细胞术分析中使用7-aad。用于各种细胞毒性测定的试剂盒可从制造商(如普洛麦格公司(promega)、艾博抗公司(abcam)和生命技术公司(life technologies))商购获得。
[0206]
在另一个实施例中,细胞毒性的度量可以是定性的。在另一个实施例中,细胞毒性的度量可以是定量的。在另一个实施例中,细胞毒性的度量可以与细胞毒性细胞因子的表达的变化有关。在另一个实施例中,细胞毒性的度量可以通过存活率曲线和骨髓和肝中的肿瘤负荷来测定。
[0207]
在一个实施例中,本文所公开的方法包括可用于克服同种异体供体细胞排斥的另外的步骤。在一个实施例中,所述方法包括在施用car t细胞(其在一个实施例中是同种异体car t细胞)之前进行完全或部分淋巴细胞清除的步骤。在另一个实施例中,对淋巴细胞清除进行调整,使得其将宿主抗移植物反应延迟足以使所述同种异体t细胞攻击其所针对的肿瘤、但在一定程度上不足以要求通过骨髓移植来挽救宿主免疫系统的时间段。在另一个实施例中,使同种异体t细胞从淋巴结外出延迟的药剂(如2-氨基-2-[2-(4-辛基苯基)乙基]丙烷-1,3-二醇(fty720)、5-[4-苯基-5-(三氟甲基)噻吩-2-基]-3-[3-(三氟甲基)苯基-l]1,2,4-二唑(sew2871)、3-(2-(-己基苯氨基)-2-氧乙基氨基)丙酸(w123)、2-铵基-4-(2-氯-4-(3-苯氧基苯基硫代)苯基)-2-(羟甲基)丁基磷酸氢盐(krp-203磷酸盐)或本领域已知的其它药剂)可以作为本文所公开的组合物和方法的一部分使用以允许使用具有效力且不会引发移植物抗宿主疾病的同种异体car-t细胞。在一个实施例中,使由所述同种异体t细胞进行的mhc表达沉默以减少同种异体细胞的排斥。在另一个实施例中,所述凋亡细
胞防止同种异体细胞的排斥。
[0208]
与car t细胞疗法相关的细胞因子释放
[0209]
在一个实施例中,细胞因子释放在施用免疫疗法(如car t细胞疗法)后几天到2周之间发生。在一个实施例中,血压过低和其它症状在细胞因子释放之后,即,从几天到几周。因此,在一个实施例中,在免疫疗法的同时向受试者施用凋亡细胞或凋亡细胞上清液作为预防。在另一个实施例中,在施用免疫疗法后2-3天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后7天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后10天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后14天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后2-14天向受试者施用凋亡细胞或上清液。
[0210]
在另一个实施例中,在施用免疫疗法后2-3小时向受试者施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在施用免疫疗法后7小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后10小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后14小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后2-14小时向受试者施用凋亡细胞或上清液。
[0211]
在可选实施例中,在免疫疗法前向受试者施用凋亡细胞或凋亡细胞上清液作为预防。在另一个实施例中,在施用免疫疗法前1天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前2-3天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前7天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前10天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前14天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前2-14天向受试者施用凋亡细胞或上清液。
[0212]
在另一个实施例中,在施用免疫疗法前2-3小时向受试者施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在施用免疫疗法前7小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前10小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前14小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前2-14小时向受试者施用凋亡细胞或上清液。
[0213]
在另一个实施例中,一旦细胞因子释放综合征已经发生,就可以有疗效地施用凋亡细胞或凋亡细胞上清液。在一个实施例中,一旦检测到细胞因子释放导致或证明细胞因子释放综合征开始,就可以施用凋亡细胞或上清液。在一个实施例中,凋亡细胞或上清液可以使细胞因子水平提高或细胞因子释放综合征结束或避免其后遗症。
[0214]
在另一个实施例中,可以在多个时间点处有疗效地施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在本文所描述的至少两个时间点处施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在本文所描述的至少三个时间点处施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在crs或细胞因子风暴之前,和一旦细胞因子释放综合征已经发生及其任何组合,就施用凋亡细胞或凋亡细胞上清液。
[0215]
在一个实施例中,表达嵌合抗原受体的t细胞(car t细胞)疗法和凋亡细胞疗法或上清液一起施用。在另一个实施例中,在凋亡细胞疗法或上清液之后施用所述car t细胞疗法。在另一个实施例中,在凋亡细胞疗法或上清液之前施用所述car t细胞疗法。根据这个
方面,并且在一个实施例中,在所述car t细胞疗法后大约2-3周施用凋亡细胞疗法或上清液。在另一个实施例中,在所述car t细胞疗法后大约6-7周施用凋亡细胞疗法或上清液。在另一个实施例中,在所述car t细胞疗法后大约9周施用凋亡细胞疗法或上清液。在另一个实施例中,在所述car t细胞疗法后多达数月施用凋亡细胞疗法。
[0216]
因此,在一个实施例中,在免疫疗法的同时向受试者施用凋亡细胞或凋亡细胞上清液作为预防。在另一个实施例中,在施用免疫疗法后2-3天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后7天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后10天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后14天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后2-14天向受试者施用凋亡细胞或上清液。
[0217]
在另一个实施例中,在施用免疫疗法后2-3小时向受试者施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在施用免疫疗法后7小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后10小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后14小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法后2-14小时向受试者施用凋亡细胞或上清液。
[0218]
在可选实施例中,在免疫疗法前向受试者施用凋亡细胞或凋亡细胞上清液作为预防。在另一个实施例中,在施用免疫疗法前1天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前2-3天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前7天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前10天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前14天向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前2-14天向受试者施用凋亡细胞或上清液。
[0219]
在另一个实施例中,在施用免疫疗法前2-3小时向受试者施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在施用免疫疗法前7小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前10小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前14小时向受试者施用凋亡细胞或上清液。在另一个实施例中,在施用免疫疗法前2-14小时向受试者施用凋亡细胞或上清液。
[0220]
在另一个实施例中,一旦细胞因子释放综合征已经发生,就可以有疗效地施用凋亡细胞或凋亡细胞上清液。在一个实施例中,一旦检测到细胞因子释放导致或证明细胞因子释放综合征开始,就可以施用凋亡细胞或上清液。在一个实施例中,凋亡细胞或上清液可以使细胞因子水平提高或细胞因子释放综合征结束或避免其后遗症。
[0221]
在另一个实施例中,可以在多个时间点处有疗效地施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在本文所描述的至少两个时间点处施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在本文所描述的至少三个时间点处施用凋亡细胞或凋亡细胞上清液。在另一个实施例中,在crs或细胞因子风暴之前,和一旦细胞因子释放综合征已经发生及其任何组合,就施用凋亡细胞或凋亡细胞上清液。
[0222]
在一个实施例中,表达嵌合抗原受体的t细胞(car t细胞)疗法和凋亡细胞疗法或上清液一起施用。在另一个实施例中,在凋亡细胞疗法或上清液之后施用所述car t细胞疗法。在另一个实施例中,在凋亡细胞疗法或上清液之前施用所述car t细胞疗法。根据这个
方面,并且在一个实施例中,在所述car t细胞疗法后大约2-3周施用凋亡细胞疗法或上清液。在另一个实施例中,在所述car t细胞疗法后大约6-7周施用凋亡细胞疗法或上清液。在另一个实施例中,在所述car t细胞疗法后大约9周施用凋亡细胞疗法或上清液。在另一个实施例中,在所述car t细胞疗法后多达数月施用凋亡细胞疗法。
[0223]
在其它实施例中,在免疫疗法的同时向受试者施用另外的药剂作为预防。在一个实施例中,所述另外的药剂包括凋亡细胞、凋亡细胞上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节化合物或其任何组合。在另一个实施例中,在施用免疫疗法后2-3天向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法后7天向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法后10天向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法后14天向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法后2-14天向受试者施用另外的药剂。
[0224]
在另一个实施例中,在施用免疫疗法后2-3小时向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法后7小时向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法后10小时向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法后14小时向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法后2-14小时向受试者施用另外的药剂。
[0225]
在可选实施例中,在免疫疗法前向受试者施用另外的药剂作为预防。在另一个实施例中,在施用免疫疗法前1天向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法前2-3天向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法前7天向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法前10天向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法前14天向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法前2-14天向受试者施用另外的药剂。
[0226]
在另一个实施例中,在施用免疫疗法前2-3小时向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法前7小时向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法前10小时向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法前14小时向受试者施用另外的药剂。在另一个实施例中,在施用免疫疗法前2-14小时向受试者施用另外的药剂。
[0227]
在另一个实施例中,一旦细胞因子释放综合征已经发生,就有疗效地施用另外的药剂。在一个实施例中,一旦检测到细胞因子释放导致或证明细胞因子释放综合征开始,就施用另外的药剂。在一个实施例中,另外的药剂可以使细胞因子水平提高或细胞因子释放综合征结束或避免其后遗症。
[0228]
在另一个实施例中,在多个时间点处有疗效地施用另外的药剂。在另一个实施例中,在本文所描述的至少两个时间点处施用另外的药剂。在另一个实施例中,在本文所描述的至少三个时间点处施用另外的药剂。在另一个实施例中,在crs或细胞因子风暴之前,和一旦细胞因子释放综合征已经发生及其任何组合,就施用另外的药剂。
[0229]
在一个实施例中,表达嵌合抗原受体的t细胞(car t细胞)疗法和另外的药剂一起施用。在另一个实施例中,向另外的药剂施用所述car t细胞疗法。在另一个实施例中,在另外的药剂之前施用所述car t细胞疗法。根据这个方面,并且在一个实施例中,在所述car t细胞疗法后大约2-3周施用另外的药剂。在另一个实施例中,在所述car t细胞疗法后大约
6-7周施用另外的药剂。在另一个实施例中,在所述car t细胞疗法后大约9周施用另外的药剂。在另一个实施例中,在所述car t细胞疗法后多达数月施用另外的药剂。
[0230]
在一个实施例中,所述car t细胞对于受试者而言是异源的。在一个实施例中,所述car t细胞源自一个或多个供体。在一个实施例中,所述car t细胞源自一个或多个骨髓供体。在另一个实施例中,所述car t细胞源自一个或多个血库捐献。在一个实施例中,所述供体是匹配的供体。在一个实施例中,car t细胞是通用同种异体car t细胞。在另一个实施例中,car t细胞是同基因car t细胞。在另一个实施例中,car t细胞来自不匹配的第三方供体。在另一个实施例中,car t细胞来自汇集的第三方供体t细胞。在一个实施例中,所述供体是骨髓供体。在另一个实施例中,所述供体是血库供体。在一个实施例中,本文所公开的组合物和方法的car t细胞包括一种或多种mhc非限制性肿瘤定向嵌合受体。在一个实施例中,可以根据本领域已知的方案工程化或施用非自体t细胞以预防或最小化自身免疫反应,如在美国专利申请第20130156794号中所描述的,所述美国专利申请通过引用以其整体并入本文中。
[0231]
在另一个实施例中,car t细胞对于受试者而言是自体的。在一个实施例中,使用患者自身的细胞。在这个实施例中,如果使用患者自身的细胞,则在凋亡细胞疗法后施用car t细胞疗法。
[0232]
在一个实施例中,凋亡细胞对于受试者而言是异源的。在一个实施例中,凋亡细胞源自一个或多个供体。在一个实施例中,凋亡细胞源自一个或多个骨髓供体。在另一个实施例中,凋亡细胞源自一个或多个血库捐献。在一个实施例中,所述供体是匹配的供体。在另一个实施例中,凋亡细胞来自不匹配的第三方供体。在一个实施例中,凋亡细胞是通用同种异体凋亡细胞。在另一个实施例中,凋亡细胞来自同基因供体。在另一个实施例中,凋亡细胞来自汇集的第三方供体细胞。在一个实施例中,所述供体是骨髓供体。在另一个实施例中,所述供体是血库供体。在另一个实施例中,凋亡细胞对于受试者而言是自体的。在这个实施例中,使用患者自身的细胞。
[0233]
根据一些实施例,将本文所公开的富集的治疗性单核细胞制剂或凋亡细胞上清液全身性地施用于受试者。在另一个实施例中,通过静脉内途径施用。可选地,可以根据各种其它途径(包含但不限于肠胃外、腹膜内、关节内、肌肉内和皮下途径)将富集的治疗性单核细胞或上清液施用于受试者。
[0234]
根据一些实施例,将本文所公开的富集的治疗性单核细胞制剂或另外的药剂全身性地施用于受试者。在另一个实施例中,通过静脉内途径施用。可选地,可以根据各种其它途径(包含但不限于肠胃外、腹膜内、关节内、肌肉内和皮下途径)将富集的治疗性单核细胞或另外的药剂施用于受试者。
[0235]
在一个实施例中,以局部而非全身性方式施用制剂,例如,通过将制剂直接注射到患者身体的特定区域中。在另一个实施例中,特定区域包括肿瘤或癌症。
[0236]
在另一个实施例中,将富集的治疗性单核细胞或上清液悬浮于合适的生理缓冲液(如但不限于盐水溶液、pbs、hbss等)中施用于受试者。另外,悬浮培养基可以进一步包括有助于维持细胞活力的补充剂。在另一个实施例中,将另外的药剂悬浮于合适的生理缓冲液(如但不限于盐水溶液、pbs、hbss等)中施用于受试者。
[0237]
根据一些实施例,所述药物组合物静脉内施用。根据另一个实施例,所述药物组合
物以单个剂量施用。根据可选实施例,所述药物组合物以多个剂量施用。根据另一个实施例,所述药物组合物以两个剂量施用。根据另一个实施例,所述药物组合物以三个剂量施用。根据另一个实施例,所述药物组合物以四个剂量施用。根据另一个实施例,所述药物组合物以五个或更多个剂量施用。根据一些实施例,所述药物组合物被调配成用于静脉内注射。
[0238]
在一个实施例中,向受试者提供经修饰的表达car的免疫细胞的任何适当方法可以用于本文所描述的方法。在一个实施例中,用于向受试者提供细胞的方法包括造血细胞移植(hct)、将供体源nk细胞输注到癌症患者体内或其组合。
[0239]
在另一个实施例中,本文公开了抑制经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴或降低所述细胞因子释放综合征或细胞因子风暴的发病率的方法,所述方法包括向所述受试者施用包括凋亡细胞的组合物的步骤。
[0240]
在另一个实施例中,本文公开了抑制经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴或降低所述细胞因子释放综合征或细胞因子风暴的发病率的方法,所述方法包括向所述受试者施用凋亡细胞上清液(如凋亡细胞-吞噬细胞上清液)的步骤。
[0241]
在另一个实施例中,本文公开了抑制经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴或降低所述细胞因子释放综合征或细胞因子风暴的发病率的方法,所述方法包括向所述受试者施用至少一种另外的药剂的步骤。
[0242]
在某些实施例中,car t细胞疗法包括施用本文所公开的包括car t细胞和凋亡细胞或凋亡细胞上清液或本文所公开的另一种另外的药剂或其组合的组合物。在可选实施例中,car t细胞疗法包括施用本文所公开的包括car t细胞的组合物和包括凋亡细胞或凋亡细胞上清液或本文所公开的另外的药剂或其组合的组合物。
[0243]
与非car t细胞应用相关的细胞因子释放
[0244]
在一个实施例中,本文公开了减少或抑制经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害的受试者的细胞因子产生的方法,所述方法包括向所述受试者施用包括凋亡细胞或凋亡上清液的组合物的步骤,其中所述施用减少或抑制所述受试者的细胞因子产生。在另一个实施例中,细胞因子产生与经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害且未施用凋亡细胞或凋亡上清液的受试者相比有所减少或得到抑制。在另一个实施例中,用于减少或抑制细胞因子产生的方法减少或抑制促炎性细胞因子产生。在另一个实施例中,用于减少或抑制细胞因子产生的方法减少或抑制至少一种促炎性细胞因子的产生。在另一个实施例中,用于减少或抑制细胞因子产生的方法减少或抑制至少细胞因子il-6的产生。在另一个实施例中,用于减少或抑制细胞因子产生的方法减少或抑制至少细胞因子il-1β的产生。在另一个实施例中,用于减少或抑制细胞因子产生的方法减少或抑制至少细胞因子tnf-α的产生。在另一个实施例中,本文所公开的用于减少或抑制细胞因子产生的方法使得所述受试者体内的细胞因子il-6、il-1β或tnf-α或任何组合的产生与经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害且未施用凋亡细胞或凋亡
上清液的受试者相比有所减少或得到抑制。
[0245]
癌症或肿瘤还可以影响包含促炎性细胞因子的细胞因子的绝对水平。受试者的肿瘤负担的水平可能会影响细胞因子水平,特别是促炎性细胞因子。技术人员应理解,短语“减少或抑制”或其语法变体可以涵盖细胞因子产生的成倍减少或抑制、或细胞因子产生的净减少或抑制或百分比(%)减少或抑制,或者可以涵盖细胞因子产生的减少或抑制的变化速率。
[0246]
在另一个实施例中,本文公开了减少或抑制经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害的受试者的细胞因子产生的方法,所述方法包括向所述受试者施用凋亡细胞或包括所述凋亡细胞的组合物的步骤。
[0247]
在另一个实施例中,本文公开了减少或抑制经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害的受试者的细胞因子产生的方法,所述方法包括向所述受试者施用凋亡细胞上清液(如凋亡细胞-吞噬细胞上清液)或包括所述上清液的组合物的步骤。
[0248]
在另一个实施例中,本文公开了减少或抑制经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害的受试者的细胞因子产生的方法,所述方法包括向所述受试者施用凋亡细胞上清液(如选自凋亡细胞、凋亡细胞上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂)或包括所述上清液的组合物的步骤。
[0249]
在一个实施例中,感染引起受试者的细胞因子释放综合征或细胞因子风暴。在一个实施例中,所述感染是流感感染。在一个实施例中,所述流感感染是h1n1。在另一个实施例中,所述流感感染是h5n1禽流感。在另一个实施例中,所述感染是严重急性呼吸综合症(sars)。在另一个实施例中,所述受试者患有与埃-巴二氏病毒相关噬血细胞淋巴组织细胞增生症(hlh)。在另一个实施例中,所述感染是败血症。在一个实施例中,所述败血症是革兰氏阴性的。在另一个实施例中,所述感染是疟疾。在另一个实施例中,所述感染是埃博拉病毒感染。在另一个实施例中,所述感染是天花病毒。在另一个实施例中,所述感染是全身性革兰氏阴性细菌感染。在另一个实施例中,所述感染是雅-赫二氏综合症(jarisch-herxheimer syndrome)。
[0250]
在一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是噬血细胞淋巴组织细胞增生症(hlh)。在另一个实施例中,hlh是偶发性hlh。在另一个实施例中,hlh是巨噬细胞活化综合征(mas)。在另一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是mas。
[0251]
在一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是慢性关节炎。在另一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是全身性青少年特发性关节炎(sjia),也被称为史迪尔氏病(still's disease)。
[0252]
在一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是与冷吡啉蛋白(cryopyrin)相关周期综合征(caps)。在另一个实施例中,caps包括家族性寒冷性自身炎性综合症(fcas),也被称为家族性寒冷性荨麻疹(fcu)。在另一个实施例中,caps包括穆-韦二氏综合征(muckle-well syndrome,mws)。在另一个实施例中,caps包括慢性婴儿神经性皮肤关节(cinca)综合征。在又另一个实施例中,caps包括fcas、fcu、mws或cinca综合
征或其任何组合。在另一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是fcas。在另一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是fcu。在另一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是mws。在另一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是cinca综合征。在仍另一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是fcas、fcu、mws或cinca综合征或其任何组合。
[0253]
在另一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是冷吡啉蛋白病(cryopyrinopathy),其包括在nlrp3基因(也被称为ciasi基因)中的遗传性突变或功能重新获得突变。
[0254]
在一个实施例中,受试者的细胞因子释放综合征或细胞因子风暴的原因是遗传性自身炎性紊乱。
[0255]
在一个实施例中,使炎性细胞因子释放的触发物是脂多糖(lps)、革兰氏阳性毒素、真菌毒素、糖基磷脂酰肌醇(gpi)或rig-1基因表达的调节。
[0256]
在另一个实施例中,经历细胞因子释放综合征或细胞因子风暴的所述受试者未患有感染性疾病。在一个实施例中,所述受试者患有急性胰腺炎。在另一个实施例中,所述受试者患有组织损伤,其在一个实施例中是严重烧伤或创伤。在另一个实施例中,所述受试者患有急性呼吸窘迫综合征。在另一个实施例中,所述受试者患有继发于药物使用的细胞因子释放综合征或细胞因子风暴。在另一个实施例中,所述受试者患有继发于毒素吸入的细胞因子释放综合征或细胞因子风暴。
[0257]
在另一个实施例中,所述受试者患有继发于接受免疫疗法(其在一个实施例中是用超激动性cd28特异性单克隆抗体(cd28sa)进行的免疫疗法)的细胞因子释放综合征或细胞因子风暴。在一个实施例中,所述cd28sa是tgn1412。在另一个实施例中,所述免疫疗法是car t细胞疗法。
[0258]
在另一个实施例中,凋亡细胞或上清液或ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合可以用于控制由于施用药物组合物引起的细胞因子释放综合征或细胞因子风暴。在一个实施例中,所述药物组合物是奥沙利铂(oxaliplatin)、阿糖胞苷(cytarabine)、来那度胺(lenalidomide)或其组合。
[0259]
在另一个实施例中,凋亡细胞或上清液或ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合可以用于控制由于施用抗体引起的细胞因子释放综合征或细胞因子风暴。在一个实施例中,所述抗体是单克隆的。在另一个实施例中,所述抗体是多克隆的。在一个实施例中,所述抗体是利妥昔单抗。在另一个实施例中,所述抗体是orthoclone okt3(莫罗单抗-cd3)。在另一个实施例中,所述抗体是阿仑单抗、托妥珠单抗、cp-870,893、lo-cd2a/bti-322或tgn1412。
[0260]
在另一个实施例中,控制炎性细胞因子产生可能对其有益的疾病的实例包括癌症、过敏、任何类型的感染、中毒性休克综合症、败血症、任何类型的自身免疫性疾病、关节炎、克罗恩氏病(crohn's disease)、狼疮、牛皮癣或任何以释放毒素细胞因子而对受试者产生有害效应为标志特征的疾病。
[0261]
α-1-抗胰蛋白酶(aat)
[0262]
α-1-抗胰蛋白酶(aat)是主要由肝产生的循环52-kda糖蛋白。aat主要被称为丝氨
酸蛋白酶抑制剂并且由基因serpina1进行编码。aat抑制嗜中性粒细胞弹性蛋白酶,并且循环aat中的遗传性缺陷会导致肺组织恶化和肝疾病。在炎症期间,健康个体的血清aat浓度增加两倍。
[0263]
aat水平与几种炎性疾病的严重程度之间存在负相关。例如,已经描述了在患有hiv感染、糖尿病、丙型肝炎感染引起的慢性肝病和几种类型的血管炎的患者体内的aat的水平或活性降低。
[0264]
越来越多的证据证实,人血清源α-1-抗胰蛋白酶(aat)会使促炎性细胞因子的产生减少、诱导抗炎性细胞因子并且干扰树突状细胞的成熟。
[0265]
实际上,向人外周血单核细胞(pbmc)添加aat会抑制lps诱导的tnf-α和il-1β释放,但会增加il-1受体拮抗剂(il-1ra)和il-10的产生。
[0266]
aat在体外降低il-1β介导的胰岛毒性,并且aat单一疗法会延长胰岛同种异体移植物生存期、促进小鼠的抗原特异性免疫耐受性并延迟非肥胖糖尿病(nod)小鼠的糖尿病发展。在实验模型中,示出了aat抑制lps诱导的急性肺损伤。最近,在急性心肌缺血-再灌注损伤的小鼠模型中,示出了aat减小梗塞大小和心力衰竭的严重程度。
[0267]
用临床级人aat(haat)的单一疗法减少了循环促炎性细胞因子,降低了移植物抗宿主疾病(gvhd)的严重程度并延长了实验性同种异体骨髓移植后的动物生存期(tawara et al.,proc natl acad sci u s a.2012jan 10;109(2):564-9),所述文献通过引用并入本文中。aat治疗减少了同种异体反应性t效应子细胞的扩增,但增强了t调节性t细胞(treg)的回收,从而改变了供体t效应子细胞与t调节细胞的比率,有利于减少病理过程。在体外,aat遏制了lps诱导的促炎性细胞因子(如tnf-α和il-1β)的体外分泌,增强了抗炎性细胞因子il-10的产生并且损害了宿主树突状细胞中的nf-κb易位。marcondes,blood.2014(oct30;124(18):2881-91)示出了用aat进行治疗不仅改善了gvhd,而且保留了且甚至可能增强了移植物抗白血病(gvl)效应,所述文献通过引用并入本文中。
[0268]
在一个实施例中,本文公开了包括表达嵌合抗原受体的t细胞(car t细胞)和α-1-抗胰蛋白酶(aat)的组合物。在另一个实施例中,car t细胞和α-1-抗胰蛋白酶(aat)在单独的组合物中。在另一个实施例中,aat包括全长aat或其功能片段。在另一个实施例中,aa包括全长aat或其功能片段的类似物。在另一个实施例中,包括aat的组合物进一步包括凋亡细胞或凋亡细胞上清液。
[0269]
在另一个实施例中,本文公开了治疗、预防、抑制受试者的癌症或肿瘤或降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的方法,所述方法包括向所述受试者施用表达嵌合抗原受体的t细胞(car t细胞)和包括α-1-抗胰蛋白酶(aat)的组合物的步骤。在另一个实施例中,所述方法进一步包括凋亡细胞或凋亡细胞上清液。
[0270]
在另一个实施例中,本文公开了抑制经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴或降低所述细胞因子释放综合征或细胞因子风暴的发病率的方法,所述方法包括向所述受试者施用包括α-1-抗胰蛋白酶(aat)的组合物的步骤。在另一个实施例中,治疗经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法包括向所述受试者施用包括α-1-抗胰蛋白酶(aat)的组合物的步骤。在另一个实施例中,预防经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法包括向
所述受试者施用包括α-1-抗胰蛋白酶(aat)的组合物的步骤。在另一个实施例中,改善经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法包括向所述受试者施用包括α-1-抗胰蛋白酶(aat)的组合物的步骤。在另一个实施例中,缓解经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法包括向所述受试者施用包括α-1-抗胰蛋白酶(aat)的组合物的步骤。
[0271]
在另一个实施例中,本文公开了减少或抑制经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害的受试者的细胞因子产生的方法,所述方法包括向所述受试者施用包括α-1-抗胰蛋白酶(aat)的组合物的步骤。
[0272]
在一个实施例中,单独施用aat以控制细胞因子释放。在另一个实施例中,施用aat和凋亡细胞或其组合物或凋亡细胞上清液或其组合物两者以控制细胞因子释放。
[0273]
免疫调节剂
[0274]
本领域技术人员应理解,免疫调节剂可以涵盖细胞外介体、受体、细胞内信号传导途径的介体、翻译和转录的调节剂以及免疫细胞。在一个实施例中,本文所公开的另外的药剂是本领域已知的免疫调节剂。在另一个实施例中,在本文所公开的方法中使用免疫调节剂使至少一种细胞因子的水平降低。在另一个实施例中,在本文所公开的方法中使用免疫调节剂使crs或细胞因子风暴有所减少或得到抑制。在一些实施例中,在本文所公开的方法中使用免疫调节剂以治疗、预防肿瘤或癌症、抑制所述肿瘤或癌症的生长、延迟疾病进展、降低肿瘤负荷或降低所述肿瘤或癌症的发病率或其任何组合。在一些实施例中,将免疫调节剂与本文所公开的另一种组合物(例如但不限于包括早期凋亡细胞或包括car t细胞的组合物)组合使用。
[0275]
在一个实施例中,免疫调节剂包括阻断、抑制或减少细胞因子或趋化因子释放的化合物。在另一个实施例中,免疫调节剂包括阻断、抑制或减少il-21或il-23或其组合的释放的化合物。在另一个实施例中,免疫调节剂包括趋化因子受体-5(ccr5)受体拮抗剂类别中的抗逆转录病毒药物,例如马拉韦罗(maraviroc)。在另一个实施例中,免疫调节剂包括抗dnam-1抗体。在另一个实施例中,免疫调节剂包括选自硫酸肝素、atp和尿酸或其任何组合的损伤/病原体相关分子(damp/pamp)。在另一个实施例中,免疫调节剂包括唾液酸结合ig样凝集素(siglecs)。在另一个实施例中,免疫调节剂包括具有耐受性的细胞介体,例如调节性cd4 cd25 t细胞(treg)或恒定型自然杀伤t细胞(ink t细胞)。在另一个实施例中,免疫调节剂包括树突状细胞。在另一个实施例中,免疫调节剂包括单核细胞。在另一个实施例中,免疫调节剂包括巨噬细胞。在另一个实施例中,免疫调节剂包括选自鲁索替尼(ruxolitinib)和托法替尼(tofacitinib)的jak2或jak3抑制剂。在另一个实施例中,免疫调节剂包括脾酪氨酸激酶(syk)的抑制剂,例如福司他替尼(fostamatinib)。在另一个实施例中,免疫调节剂包括组蛋白脱乙酰酶抑制剂伏立诺他(vorinostat)乙酰化的stat3。在另一个实施例中,免疫调节剂包括类泛素化(neddylation)抑制剂,例如mln4924。在另一个实施例中,免疫调节剂包括mir-142拮抗剂。在另一个实施例中,免疫调节剂包括胞苷的化学类似物,例如阿扎胞苷(azacitidine)。在另一个实施例中,免疫调节剂包括组蛋白脱乙酰酶的抑制剂,例如伏立诺他。在另一个实施例中,免疫调节剂包括组蛋白甲基化的抑制剂。在另一个实施例中,免疫调节剂包括抗体。在另一个实施例中,所述抗体是利妥昔单抗
(rtx)。
[0276]
碲基化合物
[0277]
碲是在人身体中发现的微量元素。各种碲化合物具有免疫调节特性,并且已经在各种临床前和临床研究中示出有益效应。在例如美国专利第4,752,614号;第4,761,490号;第4,764,461号和第4,929,739号中公开了特别有效的含碲化合物家族。在例如美国专利第4,962,207号、第5,093,135号、第5,102,908号和第5,213,899号中描述了这个含碲化合物家族的免疫调节特性,所述美国专利均通过引用并入,如同在本文中完全阐述一样。
[0278]
一种有前景的化合物是三氯(二氧乙烯-o,o')碲酸铵,其在本文和本领域中也被称为as101。作为上文所讨论的含碲化合物家族的代表性实例,as101表现出抗病毒性(《自然免疫与细胞生长调节(nat.immun.cell growth regul.7(3):163-8,1988;aids res hum retroviruses.8(5):613-23,1992)和抗肿瘤活性(nature 330(6144):173-6,1987;j.clin.oncol.13(9):2342-53,1995;j.immunol.161(7):3536-42,1998)。进一步地,as101的特征在于低毒性。
[0279]
在一个实施例中,可以在本文所公开的方法中使用包括含碲免疫调节剂化合物的组合物,其中碲基化合物刺激免疫应答的先天性和获得性部分(arm)。例如,已经示出as101是小鼠(j.natl.cancer inst.88(18):1276-84,1996)和人(nat.immun.cell growth regul.9(3):182-90,1990;immunology 70(4):473-7,1990;j.natl.cancer inst.88(18):1276-84,1996.)的干扰素(ifn)的有效活化剂。
[0280]
在另一个实施例中,碲基化合物诱导一系列细胞因子(如il-1α、il-6和tnf-α)的分泌。
[0281]
在另一个实施例中,碲基化合物包括本领域已知的具有免疫调节特性的碲基化合物。在另一个实施例中,碲基化合物包括三氯(二氧乙烯-o,o')碲酸铵。
[0282]
在一个实施例中,碲基化合物抑制至少一种细胞因子的分泌。在另一个实施例中,碲基化合物减少至少一种细胞因子的分泌。在另一个实施例中,碲基化合物抑制或减少细胞因子风暴的细胞因子释放综合征(crs)。
[0283]
在一个实施例中,本文公开了包括表达嵌合抗原受体的t细胞(car t细胞)和碲基化合物的组合物。在另一个实施例中,car t细胞和碲基化合物在单独的组合物中。在另一个实施例中,aat包括全长aat或其功能片段。在另一个实施例中,aa包括全长aat或其功能片段的类似物。
[0284]
在另一个实施例中,本文公开了治疗、预防、抑制受试者的癌症或肿瘤或降低受试者的癌症或肿瘤的发病率、改善或缓解受试者的癌症或肿瘤的方法,所述方法包括向所述受试者施用表达嵌合抗原受体的t细胞(car t细胞)和包括碲基化合物的组合物的步骤。
[0285]
在另一个实施例中,本文公开了抑制经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴或降低所述细胞因子释放综合征或细胞因子风暴的发病率的方法,所述方法包括向所述受试者施用包括碲基化合物的组合物的步骤。在另一个实施例中,治疗经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法包括向所述受试者施用包括碲基化合物的组合物的步骤。在另一个实施例中,预防经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法包括向所述受试者施用包括碲
基化合物的组合物的步骤。在另一个实施例中,改善经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法包括向所述受试者施用包括碲基化合物的组合物的步骤。在另一个实施例中,缓解经历表达嵌合抗原受体的t细胞(car t细胞)疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法包括向所述受试者施用包括碲基化合物的组合物的步骤。
[0286]
在另一个实施例中,本文公开了减少或抑制经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害的受试者的细胞因子产生的方法,所述方法包括向所述受试者施用包括碲基化合物的组合物的步骤。
[0287]
在一个实施例中,单独施用碲基化合物以控制细胞因子释放。在另一个实施例中,施用碲基化合物和凋亡细胞或其组合物或凋亡细胞上清液或其组合物两者以控制细胞因子释放。
[0288]
树突状细胞
[0289]
在一个实施例中,树突状细胞(dc)是哺乳动物免疫系统的抗原产生和呈递细胞,其处理抗原物质并将其在细胞表面上呈递到免疫系统的t细胞,并且由此能够使t细胞对新抗原和召回抗原两者具有敏感性。在另一个实施例,dc是最有效的抗原产生细胞,其充当先天免疫系统与适应性免疫系统之间的信使。在一个实施例中,dc细胞可以用于通过产生攻击和裂解肿瘤的效应子细胞来引发特异性抗肿瘤免疫。
[0290]
树突状细胞存在于与外部环境接触的那些组织中,如皮肤(此处存在一种被称为朗格汉斯细胞(langerhans cell)的特化树突状细胞类型)以及鼻子、肺、胃和肠的内层。还可以发现它们在血液中处于未成熟状态。一旦活化,它们就会迁移到它们与t细胞和b细胞相互作用的淋巴结以引发并塑造适应性免疫应答。在某些发育阶段,它们会生长出分支状突起,即给予所述细胞其名称的树突。树突状细胞可以被工程化成表达特定肿瘤抗原。
[0291]
t细胞活化所需的三个信号是:(i)同源抗原在自身mhc分子中的呈递;(ii)膜结合受体-配体对的共刺激;以及(iii)可溶性因子直接去极化随之而来的免疫应答。树突状细胞(dc)能够提供t细胞活化所需的所有三个信号,这使它们成为出色的癌症疫苗平台。
[0292]
因此,在一个实施例中,本文公开了包括树突状细胞和另外的药剂的组合物,其中所述另外的药剂包括凋亡细胞、凋亡上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合。
[0293]
在另一个实施例中,本文公开了治疗、预防、抑制受试者的癌症或肿瘤、降低受试者的癌症或肿瘤的发病率、改善或缓解受试者的癌症或肿瘤的方法,所述方法包括向所述受试者施用树突状细胞和包括另外的药剂的组合物的步骤,其中所述药剂包括凋亡细胞、凋亡上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合。
[0294]
基因修饰
[0295]
在一些实施例中,可以使用rna、dna、重组病毒或其组合来完成对t细胞、树突状细胞和/或凋亡细胞的基因修饰。在一些实施例中,衍生自γ逆转录病毒或慢病毒的载体用于本文所公开的组合物和方法中。在另一个实施例中,这些载体可以整合到具有转基因的潜在永久性表达的宿主基因组中并且具有低固有免疫原性。在另一个实施例中,整合到宿主基因组中和/或具有低固有免疫原性的另一种载体可以用于本文所公开的组合物和方法
中。在另一个实施例中,非病毒载体介导的睡美人(sleeping beauty)转座子系统用于将car和其它基因插入t细胞中。在另一个实施例中,将“自杀基因”整合到t细胞中,其中促凋亡基因的表达在对全身性递送的药物具有应答的诱导型启动子的控制下。
[0296]
在一些实施例中,基因修饰可以是瞬时的。在另一个实施例中,基因修饰可以利用信使rna(mrna)。在另一个实施例中,可以多次将大量细胞输注在经瞬时工程化的t细胞(如mrna转染的t细胞)上。在另一个实施例中,使用体外转录的mrna对淋巴细胞进行的基于rna的电穿孔介导蛋白质的瞬时表达持续大约一周并且避免了整合病毒载体的风险。在另一个实施例中,mrna转导的树突状细胞或mrna电穿孔的t和nk淋巴细胞。
[0297]
已经证实,经基因修饰的t细胞可以在过继转移后存留超过十年而没有副作用,这指示对人t细胞进行基因修饰从根本上是安全的。
[0298]
在另一个实施例中,本文所公开的组合物和方法中的基因修饰可以是本领域已知的任何方法。
[0299]
凋亡细胞
[0300]
供本文所公开的组合物和方法中使用的凋亡细胞(“apocell”)的产生已经在wo2014/087408中进行了描述(所述文献通过引用以其整体并入本文中),并且在下文的实例1中进行了简要描述。在另一个实施例中,以本领域已知的任何方式产生供本文所公开的组合物和方法中使用的凋亡细胞。在另一个实施例中,供本文所公开的组合物和方法中使用的凋亡细胞与经历疗法的受试者是自体的。在另一个实施例中,供本文所公开的组合物和方法中使用的凋亡细胞与经历疗法的受试者是同种异体的。在另一个实施例中,包括凋亡细胞的组合物包括如本文所公开的或本领域已知的凋亡细胞。
[0301]
技术人员应理解,术语“自体的”可以涵盖供体和接受者是同一个人的组织、细胞、核酸分子或多肽。
[0302]
技术人员应理解,术语“同种异体的”可以涵盖源自相同物种的单独个体的组织、细胞、核酸分子或多肽。在一些实施例中,同种异体供体细胞在基因上与接受者不同。
[0303]
在一些实施例中,通过白细胞去除术来实现根据本文所公开的产生方法获得富集的单核细胞组合物。技术人员应理解,术语“白细胞去除术”可以涵盖其中白细胞与供体的血液分离的单采血液成分术程序。在一些实施例中,供体的血液经历白细胞去除术并且因此根据本文所公开的产生方法获得富集的单核细胞组合物。应当注意,如本领域所知的,在白细胞去除术期间需要使用至少一种抗凝血剂,以便防止收集的细胞凝结。
[0304]
在一些实施例中,白细胞去除术程序被配置成允许根据本文所公开的产生方法收集富集的单核细胞组合物。在一些实施例中,通过白细胞去除术获得的细胞收集包括至少65%。在其它实施例中,至少70%或至少80%的如本文所公开的单核细胞。在一些实施例中,在本文所公开的产生方法中,并行地收集来自细胞供体的血浆以获得富集的单核细胞组合物。在一些实施例中,根据本文所公开的产生方法,并行地收集来自细胞供体的约300-600ml的血浆以获得富集的单核细胞组合物。在一些实施例中,根据本文所公开的产生方法平行收集以获得富集的单核细胞组合物的血浆用作冷冻和/或温育培养基的一部分。获得用于本文所公开的组合物和方法中的富集的凋亡细胞群的另外的详细方法可以在wo 2014/087408中找到,所述文献通过引用以其整体并入本文中。
[0305]
在一些实施例中,用于本文所公开的方法的早期凋亡细胞包括至少85%的单核细
胞。在另外的实施例中,用于本文所公开的方法的早期凋亡细胞包括至少85%的单核细胞、90%的单核细胞或可选地超过90%的单核细胞。在一些实施例中,用于本文所公开的方法的早期凋亡细胞包括至少90%的单核细胞。在一些实施例中,用于本文所公开的方法的早期凋亡细胞包括至少95%的单核细胞。
[0306]
应当注意,在一些实施例中,虽然细胞收集时的富集的单核细胞制剂包括至少65%、优选地至少70%、最优选地至少80%的单核细胞,但是最终药物群在供本文所公开的方法中使用的早期凋亡细胞的产生方法之后包括至少85%、优选地至少90%、最优选地至少95%的单核细胞。
[0307]
在某些实施例中,用于产生供本文所公开的方法中使用的早期凋亡细胞的组合物的富集的单核细胞制剂在细胞收集时包括至少50%的单核细胞。在某些实施例中,本文公开了用于产生药物群的方法,其中所述方法包括从供体的外周血获得富集的单核细胞制剂,所述富集的单核细胞制剂包括至少50%的单核细胞。在某些实施例中,本文公开了用于产生药物群的方法,其中所述方法包括冷冻包括至少50%的单核细胞的富集的单核细胞制剂。
[0308]
在一些实施例中,细胞制剂包括至少85%的单核细胞,其中制剂中的至少40%的细胞处于早期凋亡状态,其中制剂中的至少85%的细胞是活细胞。在一些实施例中,凋亡细胞制剂包括不超过15%的cd15
高
表达细胞。
[0309]
技术人员应理解,术语“早期凋亡状态”可以涵盖示出凋亡的早期迹象而没有凋亡的晚期迹象的细胞。细胞凋亡的早期迹象的实例包含磷脂酰丝氨酸(ps)暴露和线粒体膜电位损失。晚期事件的实例包含碘化丙锭(pi)进入细胞中以及最终dna切割。为了证明细胞处于“早期凋亡”状态,在一些实施例中,使用通过膜联蛋白-v和pi染色进行的ps暴露检测,并且被膜联蛋白v但未被pi染色或仅被最少pi染色的细胞被认为是“早期凋亡细胞”(an
pi-)。在一些实施例中,最少ip染色包括细胞群内小于或等于(≤)15%的pi 细胞。在一些实施例中,最少ip染色包括细胞群内小于或等于(≤)10%的pi 细胞。在一些实施例中,最少ip染色包括细胞群内小于或等于(≤)5%的pi 细胞。在另一个实施例中,被膜联蛋白-v fitc和高pi两者染色的细胞被认为是“晚期凋亡细胞”。在一些实施例中,高ip染色包括细胞群内大于(》)15%的pi 细胞。在一些实施例中,高ip染色包括细胞群内大于或等于(≥)16%的pi 细胞。在另一个实施例中,膜联蛋白-v或pi未染色的细胞被认为是非凋亡活细胞。
[0310]
在一些实施例中,制剂中至少40%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少45%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少50%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少55%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少60%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少65%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少70%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少75%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少80%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少85%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少90%的细胞处于早期凋亡状态。在一些实施例中,制剂中至少95%的细胞处于早期凋亡状态。
[0311]
在一些实施例中,早期凋亡细胞制剂包括小于或等于(≤)15%pi
细胞。在一些实施例中,早期凋亡细胞制剂包括≤10%的pi
细胞。在一些实施例中,早期凋亡细胞制剂包
括≤9%的pi
细胞。在一些实施例中,早期凋亡细胞制剂包括≤8%的pi
细胞。在一些实施例中,早期凋亡细胞制剂包括≤7%的pi
细胞。在一些实施例中,早期凋亡细胞制剂包括≤6%的pi
细胞。在一些实施例中,早期凋亡细胞制剂包括≤5%的pi
细胞。在一些实施例中,早期凋亡细胞制剂包括≤4%的pi
细胞。在一些实施例中,早期凋亡细胞制剂包括≤3%的pi
细胞。在一些实施例中,早期凋亡细胞制剂包括≤2%的pi
细胞。在一些实施例中,早期凋亡细胞制剂包括≤1%的pi
细胞。
[0312]
在一些实施例中,制剂中至少40%的细胞处于早期凋亡状态(an
),其中≤15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少45%的细胞处于早期凋亡状态(an
),其中≤15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少50%的细胞处于早期凋亡状态(an
),其中≤15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少55%的细胞处于早期凋亡状态(an
),其中≤15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少60%的细胞处于早期凋亡状态(an
),其中≤15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少65%的细胞处于早期凋亡状态(an
),其中≤15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少70%的细胞处于早期凋亡状态(an
),其中≤15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少75%的细胞处于早期凋亡状态(an
),其中≤15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少80%的细胞处于早期凋亡状态(an
),其中≤15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少85%的细胞处于早期凋亡状态(an
),其中《15%或≤14%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少90%的细胞处于早期凋亡状态(an
),其中《10%或≤9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的细胞是pi
。在一些实施例中,制剂中至少95%的细胞处于早期凋亡状态(an
),其中《5%、≤4%、3%、2%、1%或0%的细胞是pi
。
[0313]
技术人员应理解,在一些实施例中,术语“凋亡细胞”、“早期凋亡细胞”、“allocetra”、“autocetra”、“alc”和“apocell”及其语法变体可以互换使用,以代表“早期凋亡细胞”群,其中所述细胞群富集单核细胞并且具有独特特性(参见,例如,实例1)。技术人员应理解,在一些实施例中,本文所描述的组合物和方法包括早期凋亡细胞。
[0314]
在一些实施例中,allocetra包括从单一同种异体供体获得的早期凋亡细胞群。在一些实施例中,allocetra包括从多个同种异体供体获得的早期凋亡细胞群。在一些实施例中,allocetra包括从多个同种异体供体获得的早期凋亡细胞或从血库获得的细胞的汇集的群体。在一些实施例中,allocetra包括从同一同种异体供体获得的早期凋亡细胞的汇集的群体。在一些实施例中,allocetra包括的辐照的早期凋亡细胞群。在一些实施例中,术语“allocetra”与术语“allocetra-ots”可以互换使用。在一些实施例中,术语“allocetra”和“allocetra-ots”涵盖单核早期凋亡细胞,如实例1所述制备,与所述细胞的来源无关。
[0315]
在一些实施例中,凋亡细胞包括处于早期凋亡状态的细胞。在另一个实施例中,凋亡细胞包括其中至少90%的细胞处于早期凋亡状态的所述细胞。在另一个实施例中,凋亡
细胞包括其中至少80%的细胞处于早期凋亡状态的所述细胞。在另一个实施例中,凋亡细胞包括其中至少70%的细胞处于早期凋亡状态的所述细胞。在另一个实施例中,凋亡细胞包括其中至少60%的细胞处于早期凋亡状态的所述细胞。在另一个实施例中,凋亡细胞包括其中至少50%的细胞处于早期凋亡状态的所述细胞。
[0316]
在一些实施例中,在一些实施例中,包括凋亡细胞的组合物进一步包括抗凝血剂。
[0317]
在一些实施例中,早期凋亡细胞是稳定的。技术人员应理解,在一些实施例中,稳定性涵盖随时间维持早期凋亡细胞特征,例如在约2-8℃下储存时维持早期凋亡细胞特征。在一些实施例中,稳定性包括在冷冻温度(例如,处于或低于0℃的温度)下储存时维持早期凋亡细胞特征。
[0318]
在一些实施例中,根据用于本文所公开的方法的早期凋亡细胞的产生方法获得的富集的单核细胞群在冷冻培养基中经历冷冻。在一些实施例中,冷冻是逐进的。在一些实施例中,收集后,将细胞维持在室温下,直到冷冻为止。在一些实施例中,细胞制剂在细胞收集后且在冷冻前在洗涤培养基中经历至少一个洗涤步骤。
[0319]
如本文所使用的,术语“获得细胞”和“细胞收集”可以互换使用。在一些实施例中,将细胞制剂的细胞在收集的3-6小时内冷冻。在一些实施例中,将细胞制剂在细胞收集的至多6小时内冷冻。在一些实施例中,将细胞制剂的细胞在收集的1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时内冷冻。在其它实施例中,将细胞制剂的细胞冷冻至多收集的8小时、12小时、24小时、48小时、72小时。在其它实施例中,收集后,将细胞维持在2-8℃下,直到冷冻为止。
[0320]
在一些实施例中,根据早期凋亡细胞群的产生进行冷冻包括:将细胞制剂在约-18℃到-25℃下冷冻,然后将细胞制剂在约-80℃下冷冻,并且最后将细胞制剂在液氮中冷冻,直到解冻为止。在一些实施例中,根据早期凋亡细胞群的产生进行冷冻包括:将细胞制剂在约-18℃到-25℃下冷冻持续至少2个小时,然后将细胞制剂在约-80℃下冷冻持续至少2个小时,并且最后将细胞制剂在液氮中冷冻,直到解冻为止。在一些实施例中,在解冻前,将细胞在液氮中保持至少8小时、10小时或12小时。在一些实施例中,将细胞制剂的细胞保持在液氮中,直到解冻并与凋亡诱导温育培养基一起温育为止。在一些实施例中,将细胞制剂的细胞保持在液氮中直到造血干细胞移植的当天为止。在非限制性实例中,从细胞收集和冷冻到制备最终群的时间可以介于1-50天之间、可选地介于6-30天之间。在可选实施例中,细胞制剂可以在液氮中保持较长的时间段,如至少几个月。
[0321]
在一些实施例中,根据早期凋亡细胞群的产生进行冷冻包括将细胞制剂在约-18℃到-25℃下冷冻至少0.5小时、1小时、2小时、4小时。在一些实施例中,根据早期凋亡细胞群的产生进行冷冻包括将细胞制剂在约-18℃到-25℃下冷冻约2小时。在一些实施例中,在早期凋亡细胞群的产生中进行冷冻包括将细胞制剂在约-80℃下冷冻至少0.5小时、1小时、2小时、4小时、12小时。
[0322]
在一些实施例中,所述富集的单核细胞组合物可以保持冷冻至少1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、20个月。在一些实施例中,所述富集的单核细胞组合物可以保持冷冻至少0.5年、1年、2年、3年、4年、5年。在某些实施例中,所述富集的单核细胞组合物可以保持冷冻至少20个月。
[0323]
在一些实施例中,将所述富集的单核细胞组合物冷冻至少8小时、10小时、12小时、
18小时、24小时。在某些实施例中,将所述富集的单核细胞组合物冷冻至少8小时的时间段。在一些实施例中,将所述富集的单核细胞组合物冷冻至少约10小时。在一些实施例中,将所述富集的单核细胞组合物冷冻至少约12小时。在一些实施例中,将所述富集的单核细胞组合物冷冻约12小时。在一些实施例中,所述富集的单核细胞组合物的总冷冻时间(在约-18℃到-25℃下、在约-80℃下和在液氮中)为至少8小时、10小时、12小时、18小时、24小时。
[0324]
在一些实施例中,冷冻至少部分地在富集的单核细胞组合物的细胞中诱导早期凋亡状态。在一些实施例中,所述冷冻培养基包括包含l-谷氨酰胺、hepes、hes、二甲亚砜(dmso)和血浆的rpmi 1640培养基。在一些实施例中,所述冷冻培养基中的血浆是捐献群体的富集的单核细胞的供体的自体血浆。在一些实施例中,所述冷冻培养基包括包含2mm l-谷氨酰胺、10mm hepes、5%hes、10%二甲亚砜和20%v/v血浆的rpmi 1640培养基。
[0325]
在一些实施例中,所述冷冻培养基包括抗凝血剂。在某些实施例中,在早期凋亡细胞群的产生期间使用的至少一些培养基(包含冷冻培养基、温育培养基和洗涤培养基)包括抗凝血剂。在某些实施例中,在早期凋亡细胞群的产生期间使用的所有培养基(其包括抗凝血剂)包括相同浓度的抗凝血剂。在一些实施例中,抗凝血剂未添加到细胞群的最终悬浮培养基。
[0326]
在一些实施例中,将抗凝血剂至少添加到所述冷冻培养基提高了细胞制剂的产率。在其它实施例中,在存在高甘油三酸酯水平的情况下,将抗凝血剂添加到所述冷冻培养基提高了细胞制剂的产率。如本文所使用的,细胞制剂的产率的提高涉及以下至少一项的提高:经冷冻的细胞中的活细胞的百分比、活细胞中的早期状态凋亡细胞的百分比和其组合。
[0327]
在一些实施例中,早期凋亡细胞稳定至少24小时。在另一个实施例中,早期凋亡细胞稳定24小时。在另一个实施例中,早期凋亡细胞稳定超过24小时。在另一个实施例中,早期凋亡细胞稳定至少36小时。在另一个实施例中,早期凋亡细胞稳定48小时。在另一个实施例中,早期凋亡细胞稳定至少36小时。在另一个实施例中,早期凋亡细胞稳定超过36小时。在另一个实施例中,早期凋亡细胞稳定至少48小时。在另一个实施例中,早期凋亡细胞稳定48小时。在另一个实施例中,早期凋亡细胞稳定至少48小时。在另一个实施例中,早期凋亡细胞稳定超过48小时。在另一个实施例中,早期凋亡细胞稳定至少72小时。在另一个实施例中,早期凋亡细胞稳定72小时。在另一个实施例中,早期凋亡细胞稳定超过72小时。
[0328]
技术人员应理解,术语“稳定的”涵盖凋亡细胞保持ps阳性(磷脂酰丝氨酸阳性)而pi阳性(碘化丙锭阳性)的百分比非常小。pi阳性细胞提供膜稳定性的指示,其中pi阳性细胞允许进入细胞中,这示出膜的稳定性较差。在一些实施例中,稳定的早期凋亡细胞在早期凋亡中保持至少24小时、至少36小时、至少48小时或至少72小时。在另一个实施例中,稳定的早期凋亡细胞在早期凋亡中保持24小时、36小时、48小时或72小时。在另一个实施例中,稳定的早期凋亡细胞在早期凋亡中保持超过24小时、超过36小时、超过48小时或超过72小时。在另一个实施例中,稳定的早期凋亡细胞在延长的时间段内维持其状态。
[0329]
在一些实施例中,凋亡细胞群没有细胞聚集体。在一些实施例中,凋亡细胞群没有大细胞聚集体。在一些实施例中,与在除从供体收集细胞(白细胞去除术)之外的步骤中不添加抗凝血剂的情况下制备的凋亡细胞群相比,凋亡细胞群的细胞聚集体的数量减少。在一些实施例中,凋亡细胞群或其组合物包括抗凝血剂。
[0330]
在一些实施例中,凋亡细胞没有细胞聚集体,其中所述凋亡细胞从患有高血液甘油三酸酯的受试者获得。在一些实施例中,受试者的血液甘油三酸酯水平高于150mg/dl。在一些实施例中,凋亡细胞群没有细胞聚集体,其中所述凋亡细胞群是从获得自具有正常血液甘油三酸酯的受试者的细胞制备的。在一些实施例中,受试者的血液甘油三酸酯水平等于或低于150mg/dl。在一些实施例中,细胞聚集体在凋亡细胞产生方法期间产生细胞损失。
[0331]
技术人员应理解,术语“聚集体”或“细胞聚集体”可以涵盖在低剪切力下或停滞状态下的血细胞的可逆凝集。在凋亡细胞产生的温育步骤期间可以可视地观察到细胞聚集体。细胞聚集可以通过本领域已知的任何方法来测量,例如通过在光学显微镜下对样品进行视觉成像或使用流式细胞术。
[0332]
在一些实施例中,所述抗凝血剂选自:肝素、酸性柠檬酸盐葡萄糖(acd)配方a和其组合。在一些实施例中,所述抗凝血剂选自:肝素、酸性柠檬酸盐葡萄糖(acd)配方a和其组合。
[0333]
在制备早期凋亡细胞群和其组合物的方法的一些实施例中,将抗凝血剂添加到在制备群期间使用的至少一种培养基。在一些实施例中,在制备群期间使用的至少一种培养基选自:冷冻培养基、洗涤培养基、凋亡诱导温育培养基和其任何组合。
[0334]
在一些实施例中,所述抗凝血剂选自:肝素、acd配方a和其组合。应当注意,可以使用本领域已知的其它抗凝血剂,例如但不限于磺达肝素(fondaparinaux)、比伐卢丁(bivalirudin)和阿加曲班(argatroban)。
[0335]
在一些实施例中,在制备群期间使用的至少一种培养基含有包括10u/ml肝素的5%的acd配方a溶液。在一些实施例中,抗凝血剂未添加到细胞群的最终悬浮培养基。如本文所使用的,术语“最终悬浮培养基”和“施用培养基”可互换使用,具有所有相同的性质和含义。
[0336]
在一些实施例中,在制备群期间使用的至少一种培养基包括浓度介于0.1-2.5u/ml之间的肝素。在一些实施例中,在制备群期间使用的至少一种培养基包括浓度介于1%-15%v/v之间的acd配方a。在一些实施例中,所述冷冻培养基包括抗凝血剂。在一些实施例中,所述温育培养基包括抗凝血剂。在一些实施例中,所述冷冻培养基和所述温育培养基两者包括抗凝血剂。在一些实施例中所述抗凝血剂选自:肝素、acd配方a和其组合。
[0337]
在一些实施例中,所述冷冻培养基中的肝素的浓度介于0.1-2.5u/ml之间。在一些实施例中,所述冷冻培养基中的acd配方a的浓度介于1%-15%v/v之间。在一些实施例中,所述温育培养基中的肝素的浓度介于0.1-2.5u/ml之间。在一些实施例中,所述温育培养基中的acd配方a的浓度介于1%-15%v/v之间。在一些实施例中,抗凝血剂是酸性-柠檬酸盐-葡萄糖(acd)配方a的溶液。在一些实施例中,添加到在制备群期间使用的至少一种培养基的抗凝血剂是含有浓度为10u/ml的肝素的acd配方a。
[0338]
在一些实施例中,用于产生早期凋亡细胞群的凋亡诱导温育培养基包括抗凝血剂。在一些实施例中,所述冷冻培养基和用于产生早期凋亡细胞群的凋亡诱导温育培养基两者包括抗凝血剂。在不希望受到任何理论或机制的束缚的情况下,为了在不同细胞组合物中维持高且稳定的细胞产率,无论细胞收集方案如何,在一些实施例中,添加抗凝血剂包括在产生凋亡细胞群期间将抗凝血剂添加到冷冻培养基和凋亡诱导温育培养基两者。在一些实施例中,组合物内的高且稳定的细胞产率包括用于诱导凋亡的初始细胞群中的至少
30%、优选地至少40%、通常至少50%细胞的细胞产率。
[0339]
在一些实施例中,所述冷冻培养基和所述温育培养基两者包括抗凝血剂。在一些实施例中,将抗凝血剂添加到所述温育培养基和冷冻培养基两者导致无论细胞收集条件(如但不限于在细胞收集期间添加的抗凝血剂的时机和/或类型)如何,群的不同制剂之间的细胞产率高且稳定。在一些实施例中,将抗凝血剂添加到所述温育培养基和冷冻培养基两者导致无论在白细胞去除术期间添加的抗凝血剂的时机和/或类型如何,细胞制剂的产率高且稳定。在一些实施例中,在存在高甘油三酸酯水平的情况下,细胞制剂的产生导致不同制剂之间的细胞产率低和/或不稳定。在一些实施例中,由具有高甘油三酸酯水平的供体的血液产生细胞制剂导致细胞制剂的细胞产率低和/或不稳定。在一些实施例中,术语“高甘油三酸酯水平”是指高于相同性别和年龄的健康受试者的正常水平的甘油三酸酯水平。在一些实施例中,术语“高甘油三酸酯水平”是指高于约1.7毫摩尔/升的甘油三酸酯水平。如本文所使用的,高且稳定的产率是指群中的细胞产量足够高以使得能够制备在施用于受试者时将展示出治疗效率的剂量。在一些实施例中,治疗效率是指治疗、预防或改善受试者的免疫疾病、自身免疫疾病或炎性疾病的能力。在一些实施例中,高且稳定的细胞产率是群中的最初冷冻的细胞中的至少30%、可能至少40%、通常至少50%细胞的细胞产率。
[0340]
在一些实施例中,如果细胞制剂是从具有高甘油三酸酯水平的供体获得的,则所述供体将采取选自以下的至少一种措施:在捐献前服用降低甘油三酸酯的药物(如但不仅限:他汀类(statin)和/或苯扎贝特(bezafibrate));在捐献前禁食至少8小时、10小时、12小时的时间段;在捐献前进食适当饮食至少24小时、48小时、72小时以降低血液甘油三酸酯水平;和其任何组合。
[0341]
在一些实施例中,群中的细胞产率与经受凋亡诱导的细胞的初始数量中的组合物中的细胞数量有关。如本文所使用的,术语“诱导早期凋亡状态”和“诱导凋亡”可以互换使用。
[0342]
在一些实施例中,在冷冻和解冻后,将富集的单核细胞组合物在温育培养基中温育。在一些实施例中,在解冻与温育之间存在至少一个洗涤步骤。如本文所使用的,术语“温育培养基”和“凋亡诱导温育培养基”可互换使用。在一些实施例中,所述温育培养基包括补充有l-谷氨酰胺、hepes、甲基泼尼松龙和血浆的rpmi 1640培养基。在一些实施例中,所述洗涤培养基包括2mm l-谷氨酰胺、10mm hepes和10%v/v血浆。在一些实施例中,所述温育培养基中的血浆源自细胞制剂的细胞所源自的相同供体。在一些实施例中,在温育的当天将血浆添加到所述温育培养基。在一些实施例中,在37℃和5%co2下进行温育。
[0343]
在一些实施例中,所述温育培养基包括甲基泼尼松龙。在一些实施例中,所述温育培养基内的甲基泼尼松龙进一步诱导富集的单核细胞组合物中的细胞进入早期凋亡状态。在一些实施例中,通过在存在甲基泼尼松龙的情况下进行冷冻和温育,富集的单核细胞组合物中的细胞被诱导进入早期凋亡状态。在一些实施例中,早期凋亡细胞群的产生有利地允许在基本上不会诱导坏死的情况下诱导早期凋亡状态,其中细胞在制备后约24小时保持稳定处于所述早期凋亡状态。
[0344]
在一些实施例中,所述温育培养基包括浓度为约10-100μg/ml的甲基泼尼松龙。在一些实施例中,所述温育培养基包括浓度为约40-60μg/ml、可选地约45-55μg/ml的甲基泼尼松龙。在一些实施例中,所述温育培养基包括浓度为50μg/ml的甲基泼尼松龙。
[0345]
在一些实施例中,温育持续约2-12小时、可能4-8小时、通常持续约5-7小时。在一些实施例中,温育持续约6小时。在一些实施例中,温育持续至少6小时。在优选实施例中,温育持续6小时。
[0346]
在一些实施例中,所述温育培养基包括抗凝血剂。在一些实施例中,将抗凝血剂添加到所述温育培养基提高了细胞制剂的产率。在一些实施例中,所述温育培养基中的抗凝血剂的浓度与所述冷冻培养基中的抗凝血剂的浓度相同。在一些实施例中,所述温育培养基包括选自以下的抗凝血剂:肝素、acd配方a和其组合。在一些实施例中,在所述温育培养基中使用的抗凝血剂是含有浓度为10u/ml的肝素的acd配方a。
[0347]
在一些实施例中,所述温育培养基包括肝素。在一些实施例中,所述温育培养基中的肝素的浓度介于0.1-2.5u/ml之间。在一些实施例中,所述温育培养基中的肝素的浓度介于0.1-2.5u/ml之间、可能介于0.3-0.7u/ml之间、通常为约0.5u/ml。在某些实施例中,所述温育培养基中的肝素的浓度为约0.5u/ml。
[0348]
在一些实施例中,所述温育培养基包括acd配方a。在一些实施例中,所述温育培养基中的acd配方a的浓度介于1%-15%v/v之间。在一些实施例中,所述温育培养基中的acd配方a的浓度介于1%-15%v/v之间、可能介于4%-7%v/v之间、通常为约5%v/v。在一些实施例中,所述温育培养基中的acd配方a的浓度为约5%v/v。
[0349]
在一些实施例中,细胞制剂的产率的提高包括所述制剂由其产生的冷冻细胞的数量中所述制剂的早期凋亡活细胞的数量的提高。
[0350]
在一些实施例中,将抗凝血剂添加到冷冻培养基有助于使药物群的不同制剂之间的产率高且稳定。在优选实施例中,将抗凝血剂至少添加到所述冷冻培养基和温育培养基导致无论所使用的细胞收集方案如何,药物组合物的不同制剂之间的产率高且稳定。
[0351]
在一些实施例中,所述冷冻培养基包括选自以下的抗凝血剂:肝素、acd配方a和其组合。在一些实施例中,在所述冷冻培养基中使用的抗凝血剂是含有浓度为10u/ml的肝素的acd配方a。在一些实施例中,所述冷冻培养基包括5%v/v的acd配方a溶液,其包括浓度为10u/ml的肝素。
[0352]
在一些实施例中,所述冷冻培养基包括肝素。在一些实施例中,所述冷冻培养基中的肝素的浓度介于0.1-2.5u/ml之间。在一些实施例中,所述冷冻培养基中的肝素的浓度介于0.1-2.5u/ml之间、可能介于0.3-0.7u/ml之间、通常为约0.5u/ml。在某些实施例中,所述冷冻培养基中的肝素的浓度为约0.5u/ml。
[0353]
在一些实施例中,所述冷冻培养基包括acd配方a。在一些实施例中,所述冷冻培养基中的acd配方a的浓度介于1%-15%v/v之间。在一些实施例中,所述冷冻培养基中的acd配方a的浓度介于1%-15%v/v之间、可能介于4%-7%v/v之间、通常为约5%v/v。在一些实施例中,所述冷冻培养基中的acd配方a的浓度为约5%v/v。
[0354]
在一些实施例中,将抗凝血剂添加到所述温育培养基和/或冷冻培养基导致无论供体的血液中的甘油三酸酯水平如何,群内的细胞产率高且稳定。在一些实施例中,当从甘油三酸酯水平正常或高的供体的血液中获得时,将抗凝血剂添加到所述温育培养基和/或冷冻培养基导致组合物内的细胞产率高且稳定。在一些实施例中,将抗凝血剂至少添加到所述温育培养基导致无论供体的血液中的甘油三酸酯水平如何,组合物内的细胞产率高且稳定。在一些实施例中,将抗凝血剂添加到所述冷冻培养基和温育培养基导致无论供体的
血液中的甘油三酸酯水平如何,组合物内的细胞产率高且稳定。
[0355]
在一些实施例中,所述冷冻培养基和/或温育培养基和/或洗涤培养基包括浓度为至少0.1u/ml、可能至少0.3u/ml、通常至少0.5u/ml的肝素。在一些实施例中,所述冷冻培养基和/或温育培养基和/或洗涤培养基包括浓度为至少1%v/v、可能至少3%v/v、通常至少5%v/v的acd配方a。
[0356]
在一些实施例中,所述富集的单核细胞组合物在细胞收集后且在重悬于所述冷冻培养基中并被冷冻前经历至少一个洗涤步骤。在一些实施例中,所述富集的单核细胞组合物在冷冻和解冻后经历至少一个洗涤步骤。在一些实施例中,洗涤步骤包括将所述富集的单核细胞组合物离心、然后提取上清液并将其重悬于洗涤培养基中。
[0357]
在一些实施例中,所述富集的单核细胞组合物在产生早期凋亡细胞群的每个阶段之间经历至少一个洗涤步骤。在一些实施例中,在产生早期凋亡细胞群的整个过程中,在洗涤步骤期间将抗凝血剂添加到洗涤培养基。在一些实施例中,所述富集的单核细胞组合物在温育后经历至少一个洗涤步骤。在一些实施例中,所述富集的单核细胞组合物使用pbs在温育后经历至少一个洗涤步骤。在一些实施例中,在将细胞制剂重悬于施用培养基前,不将抗凝血剂添加到最终洗涤步骤。在一些实施例中,在将细胞制剂重悬于施用培养基前,不将抗凝血剂添加到在最终洗涤步骤中使用的pbs。在某些实施例中,不将抗凝血剂添加到施用培养基。
[0358]
在一些实施例中,温育期间的细胞浓度为约5x106个细胞/ml。
[0359]
在一些实施例中,在冷冻、解冻和温育后,将所述富集的单核细胞组合物悬于施用培养基中,由此产生药物群。在一些实施例中,所述施用培养基包括适合的生理缓冲液。适合的生理缓冲液的非限制性实例是:盐水溶液、磷酸盐缓冲盐水(pbs)、汉克平衡盐溶液(hank'sbalanced salt solution,hbss)等。在一些实施例中,所述施用培养基包括pbs。在一些实施例中,所述施用培养基包括有助于维持细胞活力的补充剂。在一些实施例中,将所述富集的单核细胞组合物在施用前过滤。在一些实施例中,使用至少200μm的过滤器将所述富集的单核细胞组合物在施用前过滤。
[0360]
在一些实施例中,将所述富集的单核细胞群重悬于施用培养基中,使得所产生的细胞制剂的最终体积介于100-1000ml之间、可能介于200-800ml之间、通常介于300-600ml之间。
[0361]
在一些实施例中,细胞收集是指获得富集的单核细胞组合物。在一些实施例中,在产生早期凋亡细胞群期间进行的洗涤步骤是在洗涤培养基中进行的。在某些实施例中,进行直到产生早期凋亡细胞群的温育步骤为止的洗涤步骤是在洗涤培养基中进行的。在一些实施例中,所述洗涤培养基包括补充有l-谷氨酰胺和hepes的rpmi 1640培养基。在一些实施例中,所述洗涤培养基包括补充有2mm l-谷氨酰胺和10mm hepes的rpmi 1640培养基。
[0362]
在一些实施例中,所述洗涤培养基包括抗凝血剂。在一些实施例中,所述洗涤培养基包括选自以下的抗凝血剂:肝素、acd配方a和其组合。在一些实施例中,所述洗涤培养基中的抗凝血剂的浓度与所述冷冻培养基中的抗凝血剂的浓度相同。在一些实施例中,所述洗涤培养基中的抗凝血剂的浓度与所述温育培养基中的抗凝血剂的浓度相同。在一些实施例中,在所述洗涤培养基中使用的抗凝血剂是含有浓度为10u/ml的肝素的acd配方a。
[0363]
在一些实施例中,所述洗涤培养基包括肝素。在一些实施例中,所述洗涤培养基中
的肝素的浓度介于0.1-2.5u/ml之间。在一些实施例中,所述洗涤培养基中的肝素的浓度介于0.1-2.5u/ml之间、可能介于0.3-0.7u/ml之间、通常为约0.5u/ml。在某些实施例中,所述洗涤培养基中的肝素的浓度为约0.5u/ml。
[0364]
在一些实施例中,所述洗涤培养基包括acd配方a。在一些实施例中,所述洗涤培养基中的acd配方a的浓度介于1%-15%v/v之间。在一些实施例中,所述洗涤培养基中的acd配方a的浓度介于1%-15%v/v之间、可能介于4%-7%v/v之间、通常为约5%v/v。在一些实施例中,所述洗涤培养基中的acd配方a的浓度为约5%v/v。
[0365]
在一些实施例中,将所述富集的单核细胞组合物在预期向受试者施用所述群之前数小时解冻。在一些实施例中,将所述富集的单核细胞组合物在约33℃-39℃下解冻。在一些实施例中,将所述富集的单核细胞组合物解冻约30-240秒、优选地40-180秒、最优选地50-120秒。
[0366]
在一些实施例中,将所述富集的单核细胞组合物在预期的群施用前至少10小时、可选地在预期的群施用前至少20小时、30小时、40小时或50小时解冻。在一些实施例中,将所述富集的单核细胞组合物在预期的群施用前至少15-24小时解冻。在一些实施例中,将所述富集的单核细胞组合物在预期的群施用前至少约24小时解冻。在一些实施例中,将所述富集的单核细胞组合物在预期的群施用前至少20小时解冻。在一些实施例中,将所述富集的单核细胞组合物在预期的群施用前30小时解冻。在一些实施例中,将所述富集的单核细胞组合物在预期的群施用前至少24小时解冻。在一些实施例中,所述富集的单核细胞组合物在解冻前和/或后在洗涤培养基中经历至少一个洗涤步骤。
[0367]
在一些实施例中,所述组合物进一步包括甲基泼尼松龙。在一些实施例中,甲基泼尼松龙的浓度不超过30μg/ml。
[0368]
在一些实施例中,所述凋亡细胞以高剂量使用。在一些实施例中,所述凋亡细胞以高浓度使用。在一些实施例中,使用人凋亡多形核中性粒细胞(pmn)。在一些实施例中,使用其中50%是凋亡细胞的一组细胞。在一些实施例中,通过may-giemsa染色的cytoprep验证凋亡细胞。在一些实施例中,通过台盼蓝(trypan blue)排除法评估细胞活力。在一些实施例中,通过膜联蛋白v/碘化丙啶染色并通过facs检测来证实细胞的凋亡状态和坏死状态。
[0369]
在一些实施例中,本文所公开的凋亡细胞不包括坏死细胞。在一些实施例中,本文所公开的凋亡细胞包括小于1%的坏死细胞。在一些实施例中,本文所公开的凋亡细胞包括小于2%的坏死细胞。在一些实施例中,本文所公开的凋亡细胞包括小于3%的坏死细胞。在一些实施例中,本文所公开的凋亡细胞包括小于4%的坏死细胞。在一些实施例中,本文所公开的凋亡细胞包括小于5%的坏死细胞。
[0370]
在一些实施例中,施用约140
×
10
6-210
×
106个凋亡细胞的剂量。在一些实施例中,施用约10-100
×
106个凋亡细胞的剂量。在一些实施例中,施用约20
×
106个凋亡细胞的剂量。在一些实施例中,施用约30
×
106个凋亡细胞的剂量。在一些实施例中,施用约40
×
106个凋亡细胞的剂量。在一些实施例中,施用约50
×
106个凋亡细胞的剂量。在一些实施例中,施用60
×
106个凋亡细胞。在一些实施例中,施用约60
×
106个凋亡细胞的剂量。在一些实施例中,施用约70
×
106个凋亡细胞的剂量。在一些实施例中,施用约80
×
106个凋亡细胞的剂量。在一些实施例中,施用约90
×
106个凋亡细胞的剂量。在一些实施例中,施用约1-15
×
107个凋亡细胞的剂量。在一些实施例中,施用约10
×
107个凋亡细胞的剂量。在一些实施例中,施
用约15
×
107个凋亡细胞的剂量。
[0371]
在一些实施例中,施用10
×
106个凋亡细胞的剂量。在另一个实施例中,施用10
×
107个凋亡细胞的剂量。在另一个实施例中,施用10
×
108个凋亡细胞的剂量。在另一个实施例中,施用10
×
109个凋亡细胞的剂量。在另一个实施例中,施用10
×
10
10
个凋亡细胞的剂量。在另一个实施例中,施用10
×
10
11
个凋亡细胞的剂量。在另一个实施例中,施用10
×
10
12
个凋亡细胞的剂量。在另一个实施例中,施用10
×
105个凋亡细胞的剂量。在另一个实施例中,施用10
×
104个凋亡细胞的剂量。在另一个实施例中,施用10
×
103个凋亡细胞的剂量。在另一个实施例中,施用10
×
102个凋亡细胞的剂量。
[0372]
在一些实施例中,施用高剂量的凋亡细胞。在一些实施例中,施用35
×
106个凋亡细胞的剂量。在另一个实施例中,施用210
×
106个凋亡细胞的剂量。在另一个实施例中,施用70
×
106个凋亡细胞的剂量。在另一个实施例中,施用约140
×
106个凋亡细胞的剂量。在另一个实施例中,施用35-210
×
106个凋亡细胞的剂量。
[0373]
在一些实施例中,施用单个剂量的凋亡细胞。在一些实施例中,施用多个剂量的凋亡细胞。在一些实施例中,施用2个剂量的凋亡细胞。在一些实施例中,施用3个剂量的凋亡细胞。在一些实施例中,施用4个剂量的凋亡细胞。在一些实施例中,施用5个剂量的凋亡细胞。在一些实施例中,施用6个剂量的凋亡细胞。在一些实施例中,施用7个剂量的凋亡细胞。在一些实施例中,施用8个剂量的凋亡细胞。在一些实施例中,施用9个剂量的凋亡细胞。在一些实施例中,施用超过9个剂量的凋亡细胞。在一些实施例中,施用多个剂量的凋亡细胞。
[0374]
在一些实施例中,所述凋亡细胞可以通过本领域已知的任何方法(包含但不限于静脉内、皮下、结内、肿瘤内、鞘内、胸膜内、腹膜内和直接施用于胸腺)来施用。
[0375]
在一些实施例中,所述凋亡细胞是由从受试者获得的细胞制备的,所述受试者不同于将接受所述凋亡细胞的受试者。在一些实施例中,如本文所公开的方法包括可用于克服同种异体供体细胞排斥的另外的步骤,包含美国专利申请20130156794中所描述的一个或多个步骤,所述美国专利申请通过引用以其整体并入本文中。在一些实施例中,所述方法包括在施用凋亡细胞(其在一些实施例中是同种异体凋亡细胞)之前进行完全或部分淋巴细胞清除的步骤。在一些实施例中,所述淋巴细胞清除被调整成使得其使宿主抗移植物反应延迟足以允许同种异体凋亡细胞控制细胞因子释放的时间段。在一些实施例中,所述方法包括施用使同种异体凋亡t细胞从淋巴结外出延迟的药剂(如2-氨基-2-[2-(4-辛基苯基)乙基]丙烷-1,3-二醇(fty720)、5-[4-苯基-5-(三氟甲基)噻吩-2-基]-3-[3-(三氟甲基)苯基-l]1,2,4-二唑(sew2871)、3-(2-(-己基苯氨基)-2-氧乙基氨基)丙酸(w123)、2-铵基-4-(2-氯-4-(3-苯氧基苯基硫代)苯基)-2-(羟甲基)丁基磷酸氢盐(krp-203磷酸盐)或本领域已知的其它药剂)的步骤,该药剂可以作为本文所公开的组合物和方法的一部分使用以允许使用具有效力且不会引发移植物抗宿主疾病的同种异体凋亡细胞。在另一个实施例中,使由所述同种异体凋亡t细胞进行的mhc表达沉默以减少同种异体细胞的排斥。
[0376]
在一些实施例中,方法包括产生单核凋亡细胞群,所述单核凋亡细胞群包括非静止非凋亡活细胞的降低的百分比;任何活的非凋亡细胞的遏制的细胞活化;或任何活的非凋亡细胞的减少的增殖;或其任何组合,所述方法包括以下步骤:获得外周血的富集的单核细胞群;在包括抗凝血剂的冷冻培养基中冷冻所述富集的单核细胞群;解冻所述富集的单核细胞群;在包括最终浓度为约10-100μg/ml的甲基泼尼松龙和抗凝血剂的凋亡诱导温育
培养基中温育所述富集的单核细胞群;使所述凋亡细胞群重悬于施用培养基中;以及使所述富集的单核群灭活,其中所述灭活在凋亡诱导之后发生,其中所述方法产生单核凋亡细胞群,所述单核凋亡细胞群包括降低百分比的非静止非凋亡细胞;任何活的非凋亡细胞的遏制的细胞活化;或任何活的非凋亡细胞的减少的增殖;或其任何组合。
[0377]
在一些实施例中,所述方法包括以下步骤:在将凋亡细胞群施用于受试者之前,对源自同一受试者的凋亡细胞群进行辐照(自体apocell)。在一些实施例中,所述方法包括以下步骤:在将凋亡细胞群施用于接受者之前,对源自受试者的凋亡细胞进行辐照(同种异体apocell)。
[0378]
在一些实施例中,以将会减少凋亡细胞群内的残留活细胞的增殖和/或活化的方式对细胞进行辐照。在一些实施例中,以减少群中的活的非凋亡细胞的百分比的方式对细胞进行辐照。在一些实施例中,灭活的早期凋亡细胞群中的活的非凋亡细胞的百分比降低到小于所述群的50%。在一些实施例中,灭活的早期凋亡细胞群中的活的非凋亡细胞的百分比降低到小于所述群的40%。在一些实施例中,灭活的早期凋亡细胞群中的活的非凋亡细胞的百分比降低到小于所述群的30%。在一些实施例中,灭活的早期凋亡细胞群中的活的非凋亡细胞的百分比降低到小于所述群的20%。在一些实施例中,灭活的早期凋亡细胞群中的活的非凋亡细胞的百分比降低到小于所述群的10%。在一些实施例中,灭活的早期凋亡细胞群中的活的非凋亡细胞的百分比降低到所述群的0%。
[0379]
在另一个实施例中,经辐照的凋亡细胞保留所有其早期凋亡、免疫调节、稳定性特性。在另一个实施例中,所述辐照步骤使用uv辐射。在另一个实施例中,所述辐射步骤使用γ辐射。在另一个实施例中,所述凋亡细胞包括百分比减少的活的非凋亡细胞,包括具有凋亡细胞制剂内存在的任何活的非凋亡细胞的遏制的细胞活化的制剂,或包括具有凋亡细胞制剂内存在的任何活的非凋亡细胞减少的增殖的制剂或其任何组合。
[0380]
在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约1%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约2%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约3%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约4%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约5%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约6%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约7%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约8%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约9%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约10%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群(pi )增加超过约15%。在一些实施例中,与未经辐照的凋亡细胞相比,凋亡细胞的辐照不会使死细胞的群增加(pi )超过约20%、25%、30%、35%、40%、45%或50%。
[0381]
在一些实施例中,包括级分减少或不存在的活的非凋亡细胞的细胞群可以在一个
实施例中提供不具有任何活(living/viable)细胞的单核早期凋亡细胞群。在一些实施例中,包括级分减少或不存在的活的非凋亡细胞的细胞群可以在一个实施例中提供不会引发接受者的gvhd的单核凋亡细胞群。
[0382]
在一些实施例中,使用经辐照的apocell去除可能的移植物抗白血病效应,使用凋亡群(其包含最小部分的活细胞)可以引起证实在实例(参见实例8)中示出的效应由凋亡细胞引起而并非由凋亡细胞群内存在的具有细胞活性的活的细胞增殖群引起。
[0383]
在另一个实施例中,所述方法包括在施用于接受者之前辐照衍生自来自供体的wbc的凋亡细胞的步骤。在一些实施例中,以避免凋亡细胞群内的残留活细胞的增殖和/或活化的方式对细胞进行辐照。在另一个实施例中,经辐照的凋亡细胞保留所有其早期凋亡、免疫调节、稳定性特性。在另一个实施例中,所述辐照步骤使用uv辐射。在另一个实施例中,所述辐射步骤使用γ辐射。在另一个实施例中,所述凋亡细胞包括百分比减少的活的非凋亡细胞,包括具有凋亡细胞制剂内存在的任何活的非凋亡细胞的遏制的细胞活化的制剂,或包括具有凋亡细胞制剂内存在的任何活的非凋亡细胞减少的增殖的制剂或其任何组合。
[0384]
在一些实施例中,凋亡细胞包括汇集的单核凋亡细胞制剂。在一些实施例中,汇集的单核凋亡细胞制剂包括处于早期凋亡状态的单核细胞,其中所述汇集的单核凋亡细胞包括百分比降低的活的非凋亡细胞、具有任何活的非凋亡细胞的遏制的细胞活化的制剂、或具有任何活的非凋亡细胞的减少的增殖的制剂或其任何组合。在另一个实施例中,已经辐照所述汇集的单核凋亡细胞。在另一个实施例中,本文公开了汇集的单核凋亡细胞制剂,其在一些实施例中源自从捐献血液获得的白血细胞级分(wbc)。
[0385]
在一些实施例中,对凋亡细胞制剂进行辐照。在另一个实施例中,所述辐照包括γ辐照或uv辐照。在又另一个实施例中,与未经辐照的凋亡细胞制剂相比,经辐照的制剂具有数量减少的非凋亡细胞。在另一个实施例中,与未经辐照的凋亡细胞制剂相比,经辐照的制剂具有数量减少的增殖细胞。在另一个实施例中,与未经辐照的凋亡细胞群相比,经辐照的制剂具有数量减少的潜在免疫活性细胞。
[0386]
在一些实施例中,汇集的血液包括在供体与接受者之间不匹配的第3方血液。
[0387]
技术人员应理解,术语“汇集的”可以涵盖血液从多个供体收集、制备并且可能储存以供以后使用。然后可以对这个合并的血液池进行处理以产生汇集的单核凋亡细胞制剂。在另一个实施例中,汇集的单核凋亡细胞制剂确保单核凋亡细胞的可容易获得的供应是可用的。在另一个实施例中,恰好在其中凋亡被诱导的温育步骤之前,对细胞进行汇集。在另一个实施例中,在重悬步骤处,在温育步骤后,对细胞进行汇集。在另一个实施例中,恰好在辐照步骤之前,对细胞进行汇集。在另一个实施例中,在辐照步骤之后,对细胞进行汇集。在另一个实施例中,在制备方法中的任何步骤处,对细胞进行汇集。
[0388]
在一些实施例中,汇集的凋亡细胞制剂衍生自约2个与25个之间的单位血液中存在的细胞。在另一个实施例中,所述汇集的凋亡细胞制剂包含介于约2-5个、2-10个、2-15个、2-20个、5-10个、5-15个、5-20个、5-25个、10-15个、10-20个、10-25个、6-13个或6-25个之间的单位血液中存在的细胞。在另一个实施例中,所述汇集的凋亡细胞制剂由约2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个或25个单位血液中存在的细胞组成。所需的单位血液的数量还取决于从血液回收wbc的效率。例如,低效率wbc回收将导致需要另外的单位,而高效率wbc
回收将导致所需的单位较少。在一些实施例中,每个单位是一袋血液。在另一个实施例中,汇集的凋亡细胞制剂由至少25个单位血液、至少50个单位血液或至少100个单位血液中存在的细胞组成。
[0389]
在一些实施例中,单位血液包括来自血液捐献的白血细胞(wbc)级分。在另一个实施例中,所述捐献可以来自血液中心或血库。在另一个实施例中,所述捐献可以来自在准备汇集的凋亡细胞制剂时聚集在医院中的供体。在另一个实施例中,包括来自多个供体的wbc的单位血液被保存并维持在出于本文所公开的组合物和其方法的目的而被创建的独立血库中。在另一个实施例中,出于本文所公开的组合物和其方法的目的而开发的血库能够供应包括来自多个供体的wbc的单位血液并且包括白细胞去除术单位。
[0390]
在一些实施例中,汇集的wbc的单位不受hla匹配的限制。因此,所产生的汇集的凋亡细胞制剂包括不受hla匹配限制的细胞群。因此,在某些实施例中,汇集的单核凋亡细胞制剂包括同种异体细胞。
[0391]
衍生自不受hla匹配限制的汇集的wbc的汇集的单核凋亡细胞制剂的优点在于wbc来源可容易获得并且获得wbc的成本降低。
[0392]
在一些实施例中,汇集的血液包括独立于hla匹配的来自多个供体的血液。在另一个实施例中,汇集的血液包括来自多个供体的血液,其中与接受者的hla匹配已经纳入考虑。例如,其中1个hla等位基因、2个hla等位基因、3个hla等位基因、4个hla等位基因、5个hla等位基因、6个hla等位基因或7个hla等位基因已经在供体与接受者之间匹配。在另一个实施例中,多个供体是部分匹配的,例如一些供体已经进行hla匹配,其中1个hla等位基因、2个hla等位基因、3个hla等位基因、4个hla等位基因、5个hla等位基因、6个hla等位基因或7个hla等位基因已经在一些供体与接受者之间匹配。每种可能性包括如本文所公开的实施例。
[0393]
在某些实施例中,在下文所描述的凋亡诱导步骤(实例1)之后,一些活的非凋亡细胞(抗凋亡)可以保留。在一些实施例中,在辐照步骤之前观察到这些活的非凋亡细胞的存在。这些活的非凋亡细胞可以能够增殖或被活化。在一些实施例中,衍生自多个供体的汇集的单核凋亡细胞制剂可以针对宿主被活化、针对彼此被活化或两者。
[0394]
在一些实施例中,与未经辐照的细胞制剂相比,如本文所公开的经辐照的细胞制剂的细胞活化遏制并且增殖减少。在另一个实施例中,辐照包括γ辐照或uv辐照。在另一个实施例中,与未经辐照的细胞制剂相比,经辐照的细胞制剂具有数量减少的非凋亡细胞。在另一个实施例中,所述辐照包括约15个戈瑞单位(grey unit,gy)。在另一个实施例中,所述辐照包括约20个戈瑞单位(gy)。在另一个实施例中,所述辐照包括约25个戈瑞单位(gy)。在另一个实施例中,所述辐照包括约30个戈瑞单位(gy)。在另一个实施例中,所述辐照包括约35个戈瑞单位(gy)。在另一个实施例中,所述辐照包括约40个戈瑞单位(gy)。在另一个实施例中,所述辐照包括约45个戈瑞单位(gy)。在另一个实施例中,所述辐照包括约50个戈瑞单位(gy)。在另一个实施例中,所述辐照包括约55个戈瑞单位(gy)。在另一个实施例中,所述辐照包括约60个戈瑞单位(gy)。在另一个实施例中,所述辐照包括约65个戈瑞单位(gy)。在另一个实施例中,所述辐照包括多达2500gy。在另一个实施例中,经辐照的汇集的凋亡细胞制剂维持与未经辐照的汇集的凋亡细胞制剂相同或类似的凋亡概况、稳定性和功效。
[0395]
在一些实施例中,如本文所公开的汇集的单核凋亡细胞制剂稳定长达24小时。在
另一个实施例中,汇集的单核凋亡细胞制剂稳定至少24小时。在另一个实施例中,汇集的单核凋亡细胞制剂稳定超过24小时。在又另一个实施例中,如本文所公开的汇集的单核凋亡细胞制剂稳定长达36小时。在仍另一个实施例中,汇集的单核凋亡细胞制剂稳定至少36小时。在另外的实施例中,汇集的单核凋亡细胞制剂稳定超过36小时。在另一个实施例中,如本文所公开的汇集的单核凋亡细胞制剂稳定长达48小时。在另一个实施例中,汇集的单核凋亡细胞制剂稳定至少48小时。在另一个实施例中,汇集的单核凋亡细胞制剂稳定超过48小时。
[0396]
在一些实施例中,包括辐照步骤的产生汇集的细胞制剂的方法保留在衍生自单匹配供体的凋亡制剂中观察到的早期凋亡、免疫调节和稳定性特性,其中细胞制剂可以不包含辐照步骤。在另一个实施例中,如本文所公开的汇集的单核凋亡细胞制剂不会引发移植物抗宿主疾病(gvhd)应答。
[0397]
对细胞制剂进行的辐照在本领域中被认为是安全的。当前,基于捐献血液常规进行辐照程序以防止对wbc的反应。
[0398]
在另一个实施例中,如本文所公开的汇集的单核凋亡细胞制剂中的凋亡细胞的百分比接近100%,由此减少了细胞制剂中的活的非凋亡细胞的级分。在一些实施例中,凋亡细胞的百分比为至少40%。在另一个实施例中,凋亡细胞的百分比为至少50%。在又另一个实施例中,凋亡细胞的百分比为至少60%。在仍另一个实施例中,凋亡细胞的百分比为至少70%。在另外的实施例中,凋亡细胞的百分比为至少80%。在另一个实施例中,凋亡细胞的百分比为至少90%。在又另一个实施例中,凋亡细胞的百分比为至少99%。因此,在一个实施例中,包括级分减少或不存在的活的非凋亡细胞的细胞制剂可以提供不会引发接受者的gvhd的汇集的单核凋亡细胞制剂。每种可能性表示如本文所公开的实施例。
[0399]
可选地,在另一个实施例中,通过特异性地去除活细胞群(例如,通过靶向沉淀)来降低活的非凋亡wbc的百分比。在另一个实施例中,可以使用与磷脂酰丝氨酸结合的磁珠来降低活的非凋亡细胞的百分比。在另一个实施例中,可以使用结合非凋亡细胞而非凋亡细胞的细胞表面上的标志物的磁珠来降低活的非凋亡细胞的百分比。在另一个实施例中,可以使用与凋亡细胞而非非凋亡细胞的细胞表面上的标志物结合的磁珠来选择凋亡细胞用于进行进一步的制备。在又另一个实施例中,通过使用超声来降低活的非凋亡wbc的百分比。
[0400]
在一个实施例中,凋亡细胞来自汇集的第三方供体。
[0401]
在一些实施例中,汇集的细胞制剂包括选自以下的至少一种细胞类型:淋巴细胞、单核细胞和自然杀伤细胞。在另一个实施例中,汇集的细胞制剂包括富集的单核细胞群。在一些实施例中,汇集的单核细胞是富集的单核细胞制剂,其包括选自以下的细胞类型:淋巴细胞、单核细胞和自然杀伤细胞。在另一个实施例中,富集的单核细胞制剂包括不超过15%、可选地不超过10%、通常不超过5%的多形核白细胞,也被称为粒细胞(即,嗜中性粒细胞、嗜碱性粒细胞和嗜酸性粒细胞)。在另一个实施例中,汇集的单核细胞制剂没有粒细胞。
[0402]
在另一个实施例中,汇集的富集的单核细胞制剂包括不超过15%、可选地不超过10%、通常不超过5%的cd15
高
表达细胞。在一些实施例中,汇集的凋亡细胞制剂包括少于15%的cd15高表达细胞。
[0403]
在一些实施例中,本文所公开的汇集的富集的单核细胞制剂包括至少80%的单核细胞、至少85%的单核细胞、可选地至少90%的单核细胞或至少95%的单核细胞,其中每种可能性是本文所公开的单独的实施例。根据一些实施例,本文所公开的汇集的富集的单核细胞制剂包括至少85%的单核细胞。
[0404]
在另一个实施例中,单核细胞的最终汇集百分比为至少80%的任何汇集的细胞制剂被认为是如本文所公开的汇集的富集的单核细胞制剂。因此,使具有增加的多形核细胞(pmn)的细胞制剂与具有高单核细胞的细胞制剂汇集(所得的“池”具有至少80%的单核细胞)包括如本文所公开的制剂。根据一些实施例,单核细胞包括淋巴细胞和单核细胞。
[0405]
技术人员应理解,术语“单核细胞”可以涵盖具有一个叶核的白细胞。在另一个实施例中,如本文所公开的汇集的凋亡细胞制剂包括少于5%的多形核白细胞。
[0406]
在一些实施例中,所述凋亡细胞是t细胞。在另一个实施例中,所述凋亡细胞衍生自与car t细胞相同的汇集的第三方供体t细胞。在另一个实施例中,所述凋亡细胞衍生自car t细胞群。
[0407]
令人惊讶地,所述凋亡细胞使与细胞因子风暴相关的细胞因子(包含但不限于单独的或组合的il-6和干扰素-γ(ifn-γ))的产生减少,同时使car t细胞疗法的有效性得以维持(实例2)。在一个实施例中,所述凋亡细胞影响巨噬细胞中的细胞因子表达水平。在另一个实施例中,所述凋亡细胞降低巨噬细胞中的细胞因子表达水平。在一个实施例中,所述凋亡细胞遏制巨噬细胞中的细胞因子表达水平。在一个实施例中,所述凋亡细胞抑制巨噬细胞中的细胞因子表达水平。在一个实施例中,所述凋亡细胞使ifn-γ水平维持与car-t细胞施用之前存在的水平匹配或几乎匹配。在另一个实施例中,所述凋亡细胞影响巨噬细胞中的细胞因子表达水平,但不影响car t细胞中的细胞因子表达水平。在另一个实施例中,所述凋亡细胞影响dc中的细胞因子表达水平,但不影响car t细胞中的细胞因子表达水平。因此,出乎意料的是,凋亡细胞将可用于维持car t细胞疗法的有效性。
[0408]
在另一个实施例中,凋亡细胞对巨噬细胞、dc或其组合中的细胞因子表达水平的效应导致crs有所减少。在另一个实施例中,凋亡细胞对巨噬细胞、dc或其组合中的细胞因子表达水平的效应导致严重crs有所减少。在另一个实施例中,凋亡细胞对巨噬细胞、dc或其组合中的细胞因子表达水平的效应导致crs得到遏制。在另一个实施例中,凋亡细胞对巨噬细胞、dc或其组合中的细胞因子表达水平的效应导致严重crs得到遏制。在另一个实施例中,凋亡细胞对巨噬细胞、dc或其组合中的细胞因子表达水平的效应导致crs得到抑制。在另一个实施例中,凋亡细胞对巨噬细胞、dc或其组合中的细胞因子表达水平的效应导致严重crs得到抑制。在另一个实施例中,凋亡细胞对巨噬细胞、dc或其组合中的细胞因子表达水平的效应导致crs得到预防。在另一个实施例中,凋亡细胞对巨噬细胞、dc或其组合中的细胞因子表达水平的效应导致严重crs得到预防。
[0409]
在另一个实施例中,凋亡细胞触发t细胞的死亡,但并非通过细胞因子表达水平的改变。
[0410]
在另一个实施例中,凋亡细胞拮抗巨噬细胞和树突状细胞的引发以分泌将会以其它方式放大细胞因子风暴的细胞因子。在另一个实施例中,凋亡细胞使遏制炎性应答和/或防止细胞因子过度释放的treg有所增加。
[0411]
在一些实施例中,凋亡细胞稳定肿瘤区域中定居巨噬细胞的存在。在一些实施例
中,通过组合癌症疗法与施用早期凋亡细胞治疗癌症的方法导致肿瘤区域中定居巨噬细胞的稳定。在一些实施例中,通过组合癌症治疗剂与施用早期凋亡细胞治疗癌症的方法导致肿瘤区域中定居巨噬细胞的稳定。在一些实施例中,通过组合car-t细胞疗法与施用早期凋亡细胞治疗癌症的方法导致肿瘤区域中定居巨噬细胞的稳定。
[0412]
在一些实施例中,凋亡细胞的施用抑制一种或多种促炎性细胞因子。在一些实施例中,所述促炎性细胞因子包括il-1β、il-6、tnf-α或ifn-γ或其任何组合。在另一个实施例中,凋亡细胞的施用促进一种或多种抗炎性细胞因子的分泌。在一些实施例中,所述抗炎性细胞因子包括tgf-β、il10或pge2或其任何组合。
[0413]
在另一个实施例中,凋亡细胞的施用抑制暴露于tlr配体后的树突状细胞成熟。在另一个实施例中,凋亡细胞的施用产生潜在耐受性的树突状细胞,其在一些实施例中能够迁移,并且在一些实施例中,迁移是由于ccr7引起的。在另一个实施例中,凋亡细胞的施用引发各种信号传导事件,所述信号传导事件在一个实施例中是tam受体信号传导(tyro3、axl和mer),其在一些实施例中抑制抗原呈递细胞中的炎症。
[0414]
在一些实施例中,tyro-3、axl和mer构成受体酪氨酸激酶(rtk)的tam家族,其特征在于激酶结构域和粘附分子样细胞外结构域内的保守序列。在另一个实施例中,凋亡细胞的施用活化通过mertk的信号传导。在另一个实施例中,凋亡细胞的施用活化在一些实施例中负调节nf-κb的磷脂酰肌醇3-激酶(pi3k)/akt途径。在另一个实施例中,凋亡细胞的施用负调节在一个实施例中导致抑制促炎性细胞因子分泌、dc成熟或其组合的炎症小体。在另一个实施例中,凋亡细胞的施用上调抗炎性基因(如nr4a、thbs1或其组合)的表达。在另一个实施例中,凋亡细胞的施用诱导在一些实施例中以泛连接蛋白1依赖性方式积聚的高水平的amp。在另一个实施例中,凋亡细胞的施用遏制炎症。
[0415]
凋亡细胞上清液(aposup和aposup mon)
[0416]
在一些实施例中,用于如本文所公开的方法和治疗的组合物包含如本文所公开的凋亡细胞上清液。
[0417]
在一些实施例中,所述凋亡细胞上清液通过包括以下步骤的方法获得:a)提供凋亡细胞,b)培养步骤a)的所述凋亡细胞,以及c)从所述细胞分离所述上清液。
[0418]
在一些实施例中,用于制备如本文所公开的凋亡细胞上清液的凋亡细胞与经历疗法的受试者是自体的。在另一个实施例中,用于制备本文所公开的凋亡细胞上清液的凋亡细胞与经历疗法的受试者是同种异体的。
[0419]
从其获得凋亡细胞上清液的“凋亡细胞”可以是选自受试者的任何细胞类型的细胞,或本领域技术人员已知的经受诱导凋亡的方法的任何可商购获得的细胞系。诱导凋亡的方法可以是低氧、臭氧、热、辐射、化学品、渗透压、ph变化、x射线辐照、γ射线辐照、uv辐照、血清剥夺、类皮质激素或其组合或本文所描述的或本领域已知的任何其它方法。在另一个实施例中,诱导凋亡的方法产生处于早期凋亡状态的凋亡细胞。
[0420]
在一些实施例中,所述凋亡细胞是白细胞。
[0421]
在实施例中,所述凋亡白细胞衍生自外周血单核细胞(pbmc)。在另一个实施例中,所述白细胞来自汇集的第三方供体。在另一个实施例中,所述白细胞是同种异体的。
[0422]
根据一些实施例,通过选择非贴壁白细胞并使它们经受凋亡诱导、然后在培养基中进行细胞培养步骤来提供凋亡细胞。用于制备凋亡细胞-吞噬细胞上清液的“白细胞”可
以源自免疫系统和/或造血系统的有核细胞的任何谱系或亚谱系,其包含但不限于树突状细胞、巨噬细胞、mast细胞、嗜碱性粒细胞、造血干细胞、骨髓细胞、自然杀伤细胞等。白细胞可以取决于应用和目的、期望的白细胞谱系等根据各种通常实践的方法中的任一种从各种适合的解剖腔室中的任一个以各种适合的方式中的任一种衍生或获得。在一些实施例中,源白细胞是原代白细胞。在另一个实施例中,源白细胞是原代外周血白细胞。
[0423]
原代淋巴细胞和单核细胞可以方便地衍生自外周血。外周血白细胞包含70-95%的淋巴细胞和5-25%的单核细胞。
[0424]
常规地实践从血液中获得特定类型的源白细胞的方法。获得源淋巴细胞和/或单核细胞可以例如通过在存在抗凝血剂(如肝素或柠檬酸盐)的情况下采集血液来实现。然后将采集的血液在ficoll垫之上离心以在梯度界面处使淋巴细胞和单核细胞分离并在沉淀中使嗜中性粒细胞和红细胞分离。
[0425]
可以通过标准免疫磁选择或免疫荧光流式细胞术技术根据其特定的表面标志物或通过离心淘析使白细胞彼此分离。例如,可以选择单核细胞作为cd14 级分,可以选择t淋巴细胞作为cd3 级分,可以选择b淋巴细胞作为cd19 级分,巨噬细胞作为cd206 级分。
[0426]
可以通过使这些细胞经受基质贴壁条件(如通过在组织培养物处理的培养接受者中进行静态培养)而使淋巴细胞和单核细胞彼此分离,这导致单核细胞而不是淋巴细胞与细胞贴壁基质选择性贴壁。
[0427]
白细胞也可以从可以如本文所描述的进行分离的外周血单核细胞(pbmc)获得。
[0428]
本领域普通技术人员将具有必要的专门知识以适当地培养原代白细胞以产生期望量的如本文所公开的培养的源白细胞,并且在本领域的文献中可获得用于实践此种培养方法的足够指导。
[0429]
本领域普通技术人员将进一步具有必要的专门知识以建立、购买或以其它方式获得适合的自其衍生凋亡白细胞的建立的白细胞细胞系。适合的白细胞细胞系可以从商业供应商(如美国组织类型保藏所(american tissue type collection,atcc))获得。对于本领域技术人员显而易见的是,不应通过将会显著干扰其产生凋亡白细胞的能力的技术获得源白细胞。
[0430]
在另一个实施例中,所述凋亡细胞可以是凋亡淋巴细胞。可以通过用血清剥夺、皮质类固醇或辐照处理原代淋巴细胞来诱导淋巴细胞(如原代淋巴细胞)的凋亡。在另一个实施例中,通过用皮质类固醇处理来诱导原代淋巴细胞的凋亡是通过用地塞米松(dexamethasone)处理原代淋巴细胞来实现的。在另一个实施例中,地塞米松的浓度为约1微摩尔。在另一个实施例中,通过辐照诱导原代淋巴细胞的凋亡是通过用γ辐照处理原代淋巴细胞来实现的。在另一个实施例中,剂量为约66rad。此种处理导致产生适于与吞噬细胞进行共培养步骤的凋亡淋巴细胞。
[0431]
在另一个实施例中,凋亡细胞可以是凋亡单核细胞,如原代单核细胞。为了产生凋亡单核细胞,使单核细胞在血清剥夺的条件下经受体外基质/表面贴壁条件。此种处理导致产生适于与吞噬细胞进行共培养步骤的非促炎性凋亡单核细胞。
[0432]
在其它实施例中,所述凋亡细胞可以是本文所描述的任何凋亡细胞,其包括同种异体凋亡细胞、第三方凋亡细胞和凋亡细胞池。
[0433]
在其它实施例中,所述凋亡细胞上清液可以通过凋亡细胞与其它细胞的共培养来
获得。
[0434]
因此,在一些实施例中,所述凋亡细胞上清液是通过包括以下步骤的方法获得的凋亡细胞上清液:a)提供凋亡细胞、b)提供其它细胞、c)任选地洗涤来自步骤a)和b)的所述细胞、d)共培养步骤a)和b)的所述细胞以及任选地e)从所述细胞分离所述上清液。
[0435]
在一些实施例中,与所述凋亡细胞共培养的所述其它细胞是白血细胞。
[0436]
因此,在一些实施例中,所述凋亡细胞上清液是通过包括以下步骤的方法获得的凋亡白血细胞上清液:a)提供凋亡细胞、b)提供白血细胞、c)任选地洗涤来自步骤a)和b)的所述细胞、d)共培养步骤a)和b)的所述细胞以及任选地e)从所述细胞分离所述上清液。
[0437]
在一些实施例中,所述白血细胞可以是吞噬细胞,如巨噬细胞、单核细胞或树突状细胞。
[0438]
在一些实施例中,所述白血细胞可以是b细胞、t细胞或自然杀伤细胞(nk细胞)。
[0439]
因此,在一些实施例中,供如本文所公开的方法和治疗中使用的组合物包含如wo2014/106666中所描述的凋亡细胞-吞噬细胞上清液,所述文献通过引用以其整体并入本文中。在另一个实施例中,供如本文所公开的组合物和方法中使用的凋亡细胞-吞噬细胞上清液是以本领域已知的任何方式产生的。
[0440]
在一些实施例中,所述凋亡细胞-吞噬细胞上清液从吞噬细胞与凋亡细胞的共培养获得。
[0441]
在一些实施例中,所述凋亡细胞-吞噬细胞上清液通过包括以下步骤的方法获得:a)提供吞噬细胞、b)提供凋亡细胞、c)任选地洗涤来自步骤a)和b)的所述细胞、d)共培养步骤a)和b)的所述细胞以及任选地e)从所述细胞分离所述上清液。
[0442]
术语“吞噬细胞”表示通过摄取(吞噬)有害的外源颗粒、细菌以及死细胞或垂死细胞来保护身体的细胞。吞噬细胞包含例如被称为嗜中性粒细胞、单核细胞、巨噬细胞、树突状细胞和肥大t细胞的细胞,优选地树突状细胞和单核细胞/巨噬细胞。吞噬细胞可以是树突状细胞(cd4 hla-dr 谱系-bdca1/bdca3 )、巨噬细胞(cd14 cd206 hla-dr )或衍生自单核细胞(cd14 )。区分这些不同的吞噬细胞的技术是本领域技术人员已知的。
[0443]
在实施例中,单核细胞是通过塑性贴壁步骤获得的。所述单核细胞可以与具有标志物cd14 的b细胞和t细胞区分开,而不需要的b细胞则表达cd19 和t细胞cd3 。在一些实施例中,巨噬细胞集落刺激因子(m-csf)诱导成熟后,获得的巨噬细胞对标志物cd14 、cd206 、hla-dr 呈阳性。
[0444]
在一个实施例中,所述吞噬细胞衍生自外周血单核细胞(pbmc)。
[0445]
吞噬细胞可以通过本领域已知的用于获得吞噬细胞的任何方法来提供。在一些实施例中,吞噬细胞(如巨噬细胞或树突状细胞)可以直接从受试者分离或通过成熟步骤衍生自前体细胞。
[0446]
在一些实施例中,巨噬细胞可以直接从受试者的腹膜腔分离并在完全rrpmi培养基中培养。也可以从脾分离巨噬细胞。
[0447]
吞噬细胞也可以从外周血单核细胞获得。在所述实例中,在向细胞培养基添加但不限于巨噬细胞集落刺激因子(m-csf)时,单核细胞在培养时分化成单核细胞衍生的巨噬细胞。
[0448]
例如,吞噬细胞可以衍生自外周血单核细胞(pbmc)。例如,pbmc可以通过ficoll梯
度离心从来自个体的细胞净化袋分离,将其在细胞贴壁步骤中铺板在完全rpmi培养基(10%fbs、1%青霉素/链霉素)中持续90分钟。通过塑性贴壁步骤去除非贴壁t细胞,并在补充有重组人m-csf的完整rpmi环境中培养贴壁t细胞。培养期后,获得单核细胞衍生的巨噬细胞。
[0449]
吞噬细胞可以通过细胞贴壁步骤进行选择。所述“细胞贴壁步骤”是指通过允许将培养的细胞贴壁到表面(细胞粘附表面(例如,组织培养皿、基质、用适当类型的尼龙或塑料的囊或袋))的培养条件来选择吞噬细胞或可以成熟为吞噬细胞的细胞。技术人员应理解,术语“细胞粘附表面”可以涵盖亲水性的和带负电荷的并且可以以本领域中已知的各种方式中的任何方式获得。在另一个实施例中,通过使用例如电晕放电或气体等离子对聚苯乙烯表面进行修饰。这些过程产生高能氧离子,其移植到表面聚苯乙烯链上,使得表面变得具有亲水性并且带负电荷。从各种商业供应商(例如,corning,perkin-elmer,fisher scientific,evergreen scientific,nunc等)可获得设计用于促进对其细胞贴壁的培养接受者。
[0450]
b细胞、t细胞和nk细胞可以通过本领域已知的用于获得此类细胞的任何方法来提供。在一些实施例中,b细胞、t细胞或nk细胞可以直接从受试者分离或通过成熟步骤衍生自前体细胞。在另一个实施例中,b细胞、t细胞或nk细胞可以来自b细胞系、t细胞系或nk细胞系。本领域普通技术人员将具有必要的专业知识以建立、购买或以其它方式获得适合的建立的b细胞系、t细胞系和nk细胞系。适合的细胞系可以从商业供应商(如美国组织类型保藏所(atcc))获得。
[0451]
在实施例中,在共培养步骤d)之前单独地培养所述凋亡细胞和所述白血细胞(如吞噬细胞、b细胞、t细胞或nk细胞)。
[0452]
吞噬细胞的细胞成熟例如由于向培养基添加成熟因子而在细胞培养期间发生。在一个实施例中,所述成熟因子是m-csf,其可以例如用于获得单核细胞衍生的巨噬细胞。
[0453]
用于成熟或选择吞噬细胞的培养步骤可能需要数小时到数天。在另一个实施例中,将所述早熟吞噬细胞在适当的培养基中培养2小时、4小时、6小时、8小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、26小时、28小时、30小时、32小时、34小时、36小时、38小时、40小时、42小时、44小时、46小时、48小时、50小时、52小时、54小时、56小时、58小时。
[0454]
吞噬细胞的培养基是本领域技术人员已知的,并且可以是例如但不限于rpmi、dmem、x-vivo和ultraculture milieus。
[0455]
在实施例中,凋亡细胞和吞噬细胞的共培养在生理溶液中发生。
[0456]
在这个“共培养”之前,可以对细胞进行洗涤步骤。在一些实施例中,在共培养步骤之前将白血细胞(例如,吞噬细胞)和凋亡细胞洗涤。在另一个实施例中,将细胞用pbs洗涤。
[0457]
在所述共培养期间,可以将白血细胞(例如,吞噬细胞(如巨噬细胞、单核细胞或吞噬细胞)或b细胞、t细胞或nk细胞)和凋亡细胞以10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1或1:1的比率或以1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9或1:10的比率(白血细胞:凋亡细胞)混合。在一个实例中,白血细胞与凋亡细胞的比率为1:5。
[0458]
细胞的共培养可能持续数小时到数天。在一些实施例中,将所述凋亡细胞培养2小时、4小时、6小时、8小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、
26小时、28小时、30小时、32小时、34小时、36小时、38小时、40小时、42小时、44小时、46小时、48小时、50小时、52小时。本领域技术人员可以通过测量抗炎性化合物的存在、白血细胞的存活量和迄今为止尚未被消除的凋亡细胞的量来评价共培养的最佳时间。由于凋亡细胞的消失,吞噬细胞消除凋亡细胞可用光学显微镜观察到。
[0459]
在一些实施例中,凋亡细胞的培养,如与白血细胞(例如,吞噬细胞(如巨噬细胞、单核细胞或吞噬细胞)或b细胞、t细胞或nk细胞)的培养的共培养,在培养基中和/或在与向受试者施用(例如,注射)相容的生理溶液中发生。
[0460]
技术人员应理解,“生理溶液”可以涵盖不会导致白血细胞在培养时间内死亡的溶液。在一些实施例中,所述生理溶液在2小时、4小时、6小时、8小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、26小时、28小时、30小时、32小时、34小时、36小时、38小时、40小时、42小时、44小时、46小时、48小时、50小时、52小时内不会导致死亡。在其它实施例中,48小时或30小时。
[0461]
在一些实施例中,将所述白血细胞(例如,吞噬细胞(如巨噬细胞、单核细胞或吞噬细胞)或b细胞、t细胞或nk细胞)和所述凋亡细胞在所述生理溶液中温育至少30分钟。这种培养时间允许引起吞噬和分泌细胞因子和其它有益物质。
[0462]
在实施例中,此种生理溶液不会抑制由白细胞衍生的巨噬细胞进行的凋亡白细胞消除。
[0463]
在培养或共培养步骤结束时,任选地将上清液从培养的凋亡细胞或共培养细胞分离。从细胞分离上清液的技术是本领域已知的。例如,可以收集和/或过滤和/或离心上清液以消除细胞和碎片。例如,可以将所述上清液在室温下以3000pm离心15分钟以将其从细胞分离。
[0464]
上清液在使用前可以例如通过辐照被“灭活”。因此,用于制备所述凋亡细胞上清液的所述方法可以包括任选的另外的辐照步骤f)。所述“辐照”步骤可以被认为是一种使用x射线辐照(25-45gy)以足够的速率杀伤微生物的消毒方法,如常规进行以使血液产物灭活。
[0465]
对上清液进行的辐照在本领域中被认为是安全的。当前,针对捐献血液常规进行辐照程序以防止对wbc的反应。
[0466]
在实施例中,所述凋亡细胞上清液被调配成如本文中详细描述的适于施用于受试者的药物组合物。
[0467]
在一些实施例中,将最终产物储存在 4℃下。在另一个实施例中,在接下来的48小时内使用最终产物。
[0468]
在一些实施例中,可以将凋亡细胞上清液(如凋亡细胞-吞噬细胞上清液或包括上清液的药物组合物)冻干,例如储存在-80℃下。
[0469]
在一个具体实施例中,如wo 2014/106666的实例1中所描述的,可以使用胸腺细胞作为凋亡细胞来制备凋亡细胞-吞噬细胞上清液。分离后,对胸腺细胞(例如,用35x灰色辐照)进行辐照,并将其在完全dmem培养基中培养例如6小时以允许凋亡发生。平行地,将巨噬细胞从腹膜腔分离、洗涤并在完全rpmi(10%fbs、peni-strepto、eaa、hepes、nap和2-巯基乙醇)中培养。然后将巨噬细胞和凋亡细胞洗涤,并在无酚x-vivo培养基中以1/5的巨噬细胞/凋亡细胞比率共培养持续另外48小时的时间段。然后,将上清液收集、离心以去除碎片,
并且可以将其冷冻或冻干以保存。可以通过facs使用f4/80阳性染色来确认巨噬细胞富集。可以使用膜联蛋白-v阳性染色和7aad排除通过facs确认凋亡。
[0470]
在一个实施例中,与从单独培养的巨噬细胞或凋亡细胞获得的上清液相比,所述凋亡细胞上清液以tgf-β水平富集在活性和潜在形式的tgf-β中。在一个实施例中,与单独培养的巨噬细胞相比,il-10水平也有所提高,并且与单独培养的凋亡细胞相比,水平显著提高。在另一个实施例中,未检测到炎性细胞因子(如il-6),并且无法检测到il-1β和tnf或其水平非常低。
[0471]
在实施例中,当与来自单独培养的巨噬细胞或来自单独培养的凋亡细胞的上清液相比,所述凋亡细胞上清液除tgf-β和il-10外还具有提高水平的il-1ra、timp-1、cxcl1/kc和ccl2/je/mcp1,这可能与上清液控制炎症的耐受性作用有关。
[0472]
在另一个具体实施例中,如wo 2014/106666的实例3中所描述的,人凋亡细胞-吞噬细胞上清液可以由衍生自用凋亡pbmc培养的外周血单核细胞(pbmc)的巨噬细胞的共培养物制备。因此,pbmc通过例如ficoll梯度离心从来自健康志愿者的细胞净化袋分离。然后将pbmc铺板在完全rpmi培养基(10%fbs、1%青霉素/链霉素)中持续90分钟。然后,将非贴壁t细胞例如使用35gy剂量的x射线辐照去除并使其凋亡,并在完整的rpmi环境中培养4天(包含在培养的前48小时后进行细胞洗涤),以便允许凋亡发生。平行地,将贴壁t细胞在补充有50μg/ml的重组人m-csf的完整rpmi环境中培养4天,包含在前48小时后进行细胞洗涤。在4天的培养期结束时,将单核细胞衍生的巨噬细胞和凋亡细胞洗涤,并以一个巨噬细胞比5个凋亡细胞的比率在x-vivo培养基中一起再次培养48小时。然后收集来自后一个培养的上清液,将其离心以除去细胞和碎片,并且可以将其冷冻或冻干以保存和随后使用。
[0473]
在实施例中,如wo 2014/106666中所描述的,人凋亡细胞-吞噬细胞上清液可以在6天内从外周血单核细胞(pbmc)获得。在培养中使用m-csf添加四天获得pbmc衍生的巨噬细胞,并且将pbmc衍生的巨噬细胞与凋亡细胞共培养再多2天,这对应于非贴壁pbmc在第0天分离。
[0474]
在实施例中,如wo 2014/106666中所述,标准化的人凋亡细胞-吞噬细胞上清液可以独立于pbmc的供体或来源(细胞净化或血沉棕黄层)获得。塑性贴壁步骤足以获得富集单核细胞的显著起始群(在贴壁于塑性培养皿后的20%到93%的cd14 细胞)。另外,此类贴壁t细胞证实b细胞和t细胞的存在非常低(1.0%的cd19 b细胞和12.8%的cd3 t细胞)。将贴壁t细胞在存在m-csf的情况下培养4天后,单核细胞衍生的巨噬细胞的比例从cd14 cd206 hla-dr 巨噬细胞的0.1%显著增加到77.7%。当时,单核细胞衍生的巨噬细胞可以与凋亡非贴壁pbmc(如通过膜联蛋白v染色和7aad排除示出的47.6%凋亡)共培养以在48小时期间产生凋亡细胞-吞噬细胞上清液。
[0475]
在实施例中,所收集的凋亡细胞-吞噬细胞上清液比单独的单核细胞衍生的巨噬细胞或在炎性条件下( lps)处理的单核细胞衍生的巨噬细胞的培养上清液含有显著更多的潜在tgf,并且仅含有痕量或低水平的炎性细胞因子(如il-1β或tnf)。
[0476]
在一些实施例中,包括凋亡细胞上清液的组合物进一步包括抗凝血剂。在一些实施例中,所述抗凝血剂选自:肝素、酸性柠檬酸盐葡萄糖(acd)配方a和其组合。
[0477]
在另一个实施例中,在制备凋亡细胞的过程期间添加抗凝血剂。在另一个实施例中,所添加的抗凝血剂选自acd和肝素或其任何组合。在另一个实施例中,acd的浓度为1%。
在另一个实施例中,acd的浓度为2%。在另一个实施例中,acd的浓度为3%。在另一个实施例中,acd的浓度为4%。在另一个实施例中,acd的浓度为5%。在另一个实施例中,acd的浓度为6%。在另一个实施例中,acd的浓度为7%。在另一个实施例中,acd的浓度为8%。在另一个实施例中,acd的浓度为9%。在另一个实施例中,acd的浓度为10%。在另一个实施例中,acd的浓度为介于约1-10%之间。在另一个实施例中,acd的浓度为介于约2-8%之间。在另一个实施例中,acd的浓度为介于约3-7%之间在另一个实施例中,acd的浓度为介于约1-5%之间。在另一个实施例中,acd的浓度为介于约5-10%之间。在另一个实施例中,肝素的最终浓度为0.5u/ml。在另一个实施例中,肝素的最终浓度为约0.1u/ml-1.0u/ml。在另一个实施例中,肝素的最终浓度为约0.2u/ml-0.9u/ml。在另一个实施例中,肝素的最终浓度为约0.3u/ml-0.7u/ml。在另一个实施例中,肝素的最终浓度为约0.1u/ml-0.5u/ml。在另一个实施例中,肝素的最终浓度为约0.5u/ml-1.0u/ml。在另一个实施例中,肝素的最终浓度为约0.01u/ml-1.0u/ml。在另一个实施例中,肝素的最终浓度为0.1u/ml。在另一个实施例中,肝素的最终浓度为0.2u/ml。在另一个实施例中,肝素的最终浓度为0.3u/ml。在另一个实施例中,肝素的最终浓度为0.4u/ml。在另一个实施例中,肝素的最终浓度为0.5u/ml。在另一个实施例中,肝素的最终浓度为0.6u/ml。在另一个实施例中,肝素的最终浓度为0.7u/ml。在另一个实施例中,肝素的最终浓度为0.8u/ml。在另一个实施例中,肝素的最终浓度为0.9u/ml。在另一个实施例中,肝素的最终浓度为1.0u/ml。在另一个实施例中,acd的浓度为5%,并且肝素的最终浓度为0.5u/ml。
[0478]
在一些实施例中,包括凋亡细胞上清液的组合物进一步包括甲基泼尼松龙。在一些实施例处,甲基泼尼松龙的浓度不超过30μg/ml。
[0479]
在一些实施例中,所述组合物可以以总剂量或等分试样的凋亡细胞上清液使用,所述凋亡细胞上清液源自通过细胞净化获得的约14
×
109个cd45 细胞的共培养物,等于每千克体重(受试者70kg)约2亿个细胞。在实施例中,此种总剂量以单位剂量的源自每千克体重约1亿个细胞的上清液施用,和/或以单位剂量以每周间隔施用,在另一个实施例中,两者均可。根据这个实施例的适合的总剂量包含源自每千克体重约1000万到约40亿个细胞的上清液的总剂量。在另一个实施例中,所述上清液源自每千克体重约4000万到约10亿个细胞。在另一个实施例中,所述上清液源自每千克体重约8000万到约5亿个细胞。在另一个实施例中,所述上清液源自每千克体重约1.6亿到约2.5亿个细胞。根据这个实施例的合适的单位剂量包含源自每千克体重约400万到约4亿个细胞的上清液的单位剂量。在另一个实施例中,所述上清液源自每千克体重约800万到约2亿个细胞。在另一个实施例中,所述上清液源自每千克体重约1600万到约1亿个细胞。在又另一个实施例中,所述上清液源自每千克体重约3200万到约5000万个细胞。
[0480]
在另一个实施例中,施用源自约10
×
106个凋亡细胞的共培养物的凋亡细胞上清液的剂量。在另一个实施例中,施用源自10
×
107个凋亡细胞的剂量。在另一个实施例中,施用源自10
×
108个凋亡细胞的剂量。在另一个实施例中,施用源自10
×
109个凋亡细胞的剂量。在另一个实施例中,施用源自10
×
10
10
个凋亡细胞的剂量。在另一个实施例中,施用源自10
×
10
11
个凋亡细胞的剂量。在另一个实施例中,施用源自10
×
10
12
个凋亡细胞的剂量。在另一个实施例中,施用源自10
×
105个凋亡细胞的剂量。在另一个实施例中,施用源自10
×
104个凋亡细胞的剂量。在另一个实施例中,施用源自10
×
103个凋亡细胞的剂量。在另一个
实施例中,施用源自10
×
102个凋亡细胞的剂量。
[0481]
在一些实施例中,施用源自35
×
106个凋亡细胞的凋亡细胞上清液的剂量。在另一个实施例中,施用源自210
×
106个凋亡细胞的剂量。在另一个实施例中,施用源自70
×
106个凋亡细胞的剂量。在另一个实施例中,施用源自140
×
106个凋亡细胞的剂量。在另一个实施例中,施用源自35-210
×
106个凋亡细胞的剂量。
[0482]
在一些实施例中,所述凋亡细胞上清液或包括所述凋亡细胞上清液的组合物可以如本文中详细讨论的通过本领域已知的任何方法(包含但不限于静脉内、皮下、结内、肿瘤内、鞘内、胸膜内、腹膜内和直接施用于胸腺)来施用。
[0483]
令人惊讶地,所述凋亡细胞上清液(如凋亡细胞-吞噬细胞上清液)使与细胞因子风暴相关的细胞因子(如il-6)的产生有所减少。另一种细胞因子il-2尽管由dc和巨噬细胞少量分泌,但是不涉及细胞因子释放综合征。然而,其是car-t细胞的存活和增殖所需的并且大部分由这些t细胞产生。出乎意料的是,所述凋亡细胞上清液(如凋亡细胞-吞噬细胞上清液)没有充分降低il-2水平而不利地影响car t细胞的存活。
[0484]
在一些实施例中,所述凋亡细胞上清液(如凋亡细胞-吞噬细胞上清液)影响巨噬细胞和dc中的细胞因子表达水平,但不影响t细胞自身中的细胞因子表达水平。因此,出乎意料的是,所述凋亡细胞上清液可用于增强car t细胞疗法或树突状细胞疗法。
[0485]
在另一个实施例中,凋亡细胞上清液触发t细胞的死亡,但并非通过细胞因子表达水平的改变。
[0486]
在另一个实施例中,凋亡细胞上清液(如凋亡细胞-吞噬细胞上清液)拮抗巨噬细胞和树突状细胞的引发以分泌将会以其它方式放大细胞因子风暴的细胞因子。在另一个实施例中,凋亡细胞上清液使遏制炎性应答和/或防止细胞因子过度释放的treg有所增加。
[0487]
在一些实施例中,凋亡细胞上清液(如凋亡细胞-吞噬细胞上清液)的施用抑制一种或多种促炎性细胞因子。在一些实施例中,所述促炎性细胞因子包括il-1β、il-6、tnf-α或ifn-γ或其任何组合。在另一个实施例中,凋亡细胞上清液的施用促进一种或多种抗炎性细胞因子的分泌。在一些实施例中,所述抗炎性细胞因子包括tgf-β、il10或pge2或其任何组合。
[0488]
在另一个实施例中,凋亡细胞上清液(如凋亡细胞-吞噬细胞上清液)的施用抑制暴露于tlr配体后的树突状细胞成熟。在另一个实施例中,凋亡细胞上清液的施用产生潜在耐受性的树突状细胞,其在一些实施例中能够迁移,并且在一些实施例中,迁移是由于ccr7引起的。在另一个实施例中,凋亡细胞上清液的施用引发各种信号传导事件,所述信号传导事件在一个实施例中是tam受体信号传导(tyro3、axl和mer),其在一些实施例中抑制抗原呈递细胞中的炎症。在一些实施例中,tyro-3、axl和mer构成受体酪氨酸激酶(rtk)的tam家族,其特征在于激酶结构域和粘附分子样细胞外结构域内的保守序列。在另一个实施例中,凋亡细胞上清液的施用活化通过mertk的信号传导。在另一个实施例中,凋亡细胞上清液的施用活化在一些实施例中负调节nf-κb的磷脂酰肌醇3-激酶(pi3k)/akt途径。在另一个实施例中,凋亡细胞上清液的施用负调节在一个实施例中导致抑制促炎性细胞因子分泌、dc成熟或其组合的炎症小体。在另一个实施例中,凋亡细胞上清液的施用上调抗炎性基因(如nr4a、thbs1或其组合)的表达。在另一个实施例中,凋亡细胞上清液的施用诱导在一些实施例中以泛连接蛋白1依赖性方式积聚的高水平的amp。在另一个实施例中,凋亡细胞上清液
的施用遏制炎症。
[0489]
组合物
[0490]
如本文所使用的,术语“组合物”和“药物组合物”在一些实施例中可以可互换使用,具有所有相同的性质和含义。在一些实施例中,本文公开了用于治疗如本文所描述的病状或疾病的药物组合物。
[0491]
在另一个实施例中,本文公开的药物组合物用于维持或提高经基因修饰的免疫细胞的增殖速率。在另一个实施例中,用于维持或提高经基因修饰的免疫细胞的增殖速率的方法进一步包括降低或抑制细胞因子释放综合征(crs)或细胞因子风暴的发病率。在另一个实施例中,本文公开了用于提高经基因修饰的免疫细胞疗法的功效的药物组合物。在另一个实施例中,用于提高免疫细胞疗法的功效的方法中所使用的组合物进一步包括降低或抑制crs或细胞因子风暴的发病率。在另一个实施例中,本文公开了用于治疗、预防、抑制受试者的肿瘤的癌症、降低受试者的肿瘤的癌症的发病率、改善或缓解受试者的肿瘤的癌症的方法的组合物。在另一个实施例中,用于治疗、预防受试者的癌症或肿瘤、降低受试者的癌症或肿瘤的发病率、改善或缓解受试者的癌症或肿瘤的方法中所使用的组合物进一步包括降低或抑制crs或细胞因子风暴的发病率。
[0492]
在另一个实施例中,药物组合物包括经基因修饰的免疫细胞或其经基因修饰的受体。在另一个实施例中,经基因修饰的免疫细胞包括t细胞。在另一个实施例中,经基因修饰的免疫细胞包括嵌合抗原受体car t细胞。在另一个实施例中,经基因修饰的免疫细胞包括嵌合抗原受体tcr t细胞。在另一个实施例中,经基因修饰的免疫细胞包括细胞毒性t淋巴细胞。在另一个实施例中,经基因修饰的免疫细胞包括树突状细胞。在另一个实施例中,经基因修饰的免疫细胞包括自然杀伤细胞。在另一个实施例中,经基因修饰的受体包括经基因修饰的t细胞受体。
[0493]
在另一个实施例中,药物组合物包括早期凋亡细胞群。在另一个实施例中,药物组合物包括凋亡上清液。
[0494]
在仍另一个实施例中,用于治疗如本文所描述的病状或疾病的药物组合物包括在药学上可接受的赋形剂中的有效量的如本文所描述的经基因修饰的免疫细胞或其经基因修饰的受体。在另一个实施例中,用于治疗如本文所描述的病状或疾病的药物组合物包括有效量的如本文所描述的car t细胞和药学上可接受的赋形剂。在另一个实施例中,用于治疗如本文所描述的病状或疾病的药物组合物包括有效量的如本文所描述的tcr t细胞和药学上可接受的赋形剂。在另一个实施例中,用于治疗如本文所描述的病状或疾病的药物组合物包括有效量的如本文所描述的细胞毒性t细胞和药学上可接受的赋形剂。在另一个实施例中,用于治疗如本文所描述的病状或疾病的药物组合物包括有效量的如本文所描述的经基因修饰的树突状细胞和药学上可接受的赋形剂。在另一个实施例中,用于治疗如本文所描述的病状或疾病的药物组合物包括有效量的如本文所描述的经基因修饰的自然杀伤细胞和药学上可接受的赋形剂。在另一个实施例中,用于治疗如本文所描述的病状或疾病的药物组合物包括有效量的如本文所描述的经基因修饰的t细胞受体和药学上可接受的赋形剂。在仍另一个实施例中,用于治疗如本文所描述的病状或疾病的药物组合物包括在药学上可接受的赋形剂中的有效量的如本文所描述的早期凋亡细胞群。在另一个实施例中,用于治疗如本文所描述的病状或疾病的药物组合物包括药学上可接受的赋形剂中的有效
量的如本文所描述的凋亡上清液。
[0495]
在另一个实施例中,如本文所描述的病状或疾病是肿瘤或癌症。在另一个实施例中,本文公开了一种组合物,其包括与如本文所描述的所关注蛋白质或肽结合的经基因修饰的免疫细胞或其受体(例如,car t细胞)。在另一个实施例中,本文公开了一种组合物,其包括识别并结合如本文所描述的所关注蛋白质或肽的经基因修饰的免疫细胞或其受体(例如,tcr t细胞)。在另一个实施例中,所述所关注蛋白质或肽包括肿瘤抗原或其片段。
[0496]
在另一个实施例中,本文所公开的和本文所公开的方法中使用的组合物包括凋亡细胞或凋亡细胞上清液以及药学上可接受的赋形剂。在一些实施例中,包括凋亡细胞或凋亡细胞上清液的组合物用于本文所公开的方法中,例如用于治疗、预防受试者的癌症或肿瘤、抑制受试者的癌症或肿瘤的生长、延迟疾病进展、降低肿瘤负荷或降低受试者的癌症或肿瘤的发病率或其任何组合。
[0497]
在又另一个实施例中,包括有效量的经基因修饰的免疫细胞或其经基因修饰的受体的组合物可以与包括凋亡细胞群或凋亡细胞上清液的组合物相同。在另一个实施例中,包括有效量的car t细胞、tcr t细胞或细胞毒性t细胞或经基因修饰的树突状细胞或其经基因修饰的自然杀伤细胞的组合物可以与包括凋亡细胞群或凋亡细胞上清液的组合物相同。在又另一个实施例中,包括有效量的经基因修饰的t细胞受体的组合物可以与包括凋亡细胞群或凋亡细胞上清液的组合物相同。在仍另一个实施例中,包括有效量的选自car t细胞、tcr t细胞、细胞毒性t细胞、自然杀伤细胞或树突状细胞的经基因修饰的免疫细胞的组合物可以与包括凋亡细胞群或凋亡细胞上清液的组合物不相同。在另一个实施例中,组合物包括表达嵌合抗原受体的t细胞(car t细胞)和凋亡细胞或凋亡细胞上清液以及药学上可接受的赋形剂。在另一个实施例中,组合物包括表达经基因修饰的t细胞受体的t细胞(tcr t细胞)和凋亡细胞或凋亡细胞上清液以及药学上可接受的赋形剂。在另一个实施例中,包括有效量的经基因修饰的t细胞受体的组合物与包括凋亡细胞群或凋亡细胞上清液的组合物不相同。
[0498]
在另一个实施例中,组合物中包括的凋亡细胞包括处于早期凋亡状态的凋亡细胞。在另一个实施例中,组合物中包括的凋亡细胞是汇集的第三方供体细胞。在另一个实施例中,从早期凋亡细胞收集本文所公开的组合物中包括的凋亡细胞上清液。在另一个实施例中,本文所公开的组合物中包括的凋亡细胞上清液是所收集的汇集的第三方供体细胞。
[0499]
在一个实施例中,包括经基因修饰的免疫细胞(例如,car t细胞)的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,car t细胞)和凋亡细胞的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,car t细胞)和凋亡细胞上清液的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。
[0500]
在一个实施例中,包括经基因修饰的免疫细胞(例如,tcr t细胞)的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,tcr t
细胞)和凋亡细胞的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,tcr t细胞)和凋亡细胞上清液的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。
[0501]
在一个实施例中,包括经基因修饰的免疫细胞(例如,树突状细胞)的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,树突状细胞)和凋亡细胞的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,树突状细胞)和凋亡细胞上清液的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。
[0502]
在一个实施例中,包括经基因修饰的免疫细胞(例如,nk细胞)的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,nk细胞)和凋亡细胞的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,nk细胞)和凋亡细胞上清液的组合物进一步包括用于预防、遏制或调节患有细胞因子释放综合征或经历细胞因子风暴的患者的细胞因子释放的另外的药物组合物。
[0503]
在一个实施例中,所述另外的药物组合物包括ctla-4阻断剂,其在一个实施例中是伊匹单抗。在另一个实施例中,所述另外的药物组合物包括如本文所公开的α-1抗胰蛋白酶或其片段或其类似物。在另一个实施例中,所述另外的药物组合物包括如本文所公开的碲基化合物。在另一个实施例中,所述另外的药物组合物包括如本文所公开的免疫调节剂。在另一个实施例中,所述另外的药物组合物包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节化合物或其任何组合。
[0504]
在一个实施例中,包括经基因修饰的免疫细胞(例如,car t细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、或凋亡细胞上清液、碲基化合物或免疫调节剂中的任何一个的药物组合物的组合物包括单一组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,car t细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、或凋亡细胞上清液、碲基化合物或免疫调节剂或其任何组合中的任何一个的药物组合物的组合物包括多个组合物,其中所述经基因修饰的免疫细胞(其在一个实施例中是car t细胞)、所述ctla-4阻断剂、所述α-1抗胰蛋白酶或其片段或其类似物、所述凋亡细胞、或所述凋亡细胞上清液、所述碲基化合物或所述免疫调节剂或其任何组合中的每个包括在单独的组合物中。在又另一个实施例中,包括经基因修饰的免疫细胞(其在一个实施例中是car t细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、凋亡细胞上清液、碲基化合物或免疫调节剂或其任何组合中的任何一个的药物组合物的组合物包括多个组合物,其中所述经基因修饰的免疫细胞(其在一个实施例中
是car t细胞)、所述ctla-4阻断剂、或所述α-1抗胰蛋白酶或其片段或其类似物、所述碲基化合物或所述免疫调节剂或其任何组合或其任何组合存在于在经基因修饰的免疫细胞(例如,car t细胞)组合物中,并且所述凋亡细胞或所述凋亡细胞上清液包括在单独的组合物中。
[0505]
在一个实施例中,包括经基因修饰的免疫细胞(例如,tcr t细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、或凋亡细胞上清液、碲基化合物或免疫调节剂中的任何一个的药物组合物的组合物包括单一组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,tcr t细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、或凋亡细胞上清液、碲基化合物或免疫调节剂或其任何组合中的任何一个的药物组合物的组合物包括多个组合物,其中所述经基因修饰的免疫细胞(其在一个实施例中是tcr t细胞)、所述ctla-4阻断剂、所述α-1抗胰蛋白酶或其片段或其类似物、所述凋亡细胞、或所述凋亡细胞上清液、所述碲基化合物或所述免疫调节剂或其任何组合中的每个包括在单独的组合物中。在又另一个实施例中,包括经基因修饰的免疫细胞(其在一个实施例中是tcr t细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、凋亡细胞上清液、碲基化合物或免疫调节剂或其任何组合中的任何一个的药物组合物的组合物包括多个组合物,其中所述经基因修饰的免疫细胞(其在一个实施例中是tcr t细胞)、所述ctla-4阻断剂、或所述α-1抗胰蛋白酶或其片段或其类似物、所述碲基化合物或所述免疫调节剂或其任何组合或其任何组合存在于在经基因修饰的免疫细胞(例如,tcr t细胞)组合物中,并且所述凋亡细胞或所述凋亡细胞上清液包括在单独的组合物中。
[0506]
在一个实施例中,包括经基因修饰的免疫细胞(例如,树突状细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、或凋亡细胞上清液、碲基化合物或免疫调节剂中的任何一个的药物组合物的组合物包括单一组合物。在另一个实施例中,包括经基因修饰的免疫细胞(例如,树突状细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、或凋亡细胞上清液、碲基化合物或免疫调节剂或其任何组合中的任何一个的药物组合物的组合物包括多个组合物,其中所述经基因修饰的免疫细胞(其在一个实施例中是树突状细胞)、所述ctla-4阻断剂、所述α-1抗胰蛋白酶或其片段或其类似物、所述凋亡细胞、或所述凋亡细胞上清液、所述碲基化合物或所述免疫调节剂或其任何组合中的每个包括在单独的组合物中。在又另一个实施例中,包括经基因修饰的免疫细胞(其在一个实施例中是树突状细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、凋亡细胞上清液、碲基化合物或免疫调节剂或其任何组合中的任何一个的药物组合物的组合物包括多个组合物,其中所述经基因修饰的免疫细胞(其在一个实施例中是树突状细胞)、所述ctla-4阻断剂、或所述α-1抗胰蛋白酶或其片段或其类似物、所述碲基化合物或所述免疫调节剂或其任何组合或其任何组合存在于在经基因修饰的免疫细胞(例如,树突状细胞)组合物中,并且所述凋亡细胞或所述凋亡细胞上清液包括在单独的组合物中。
[0507]
在一个实施例中,包括经基因修饰的免疫细胞(例如,nk细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、或凋亡细胞上清液、碲基化合物或免疫调节剂中的任何一个的药物组合物的组合物包括单一组合物。在另一个实施例中,包括
经基因修饰的免疫细胞(例如,nk细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、或凋亡细胞上清液、碲基化合物或免疫调节剂或其任何组合中的任何一个的药物组合物的组合物包括多个组合物,其中所述经基因修饰的免疫细胞(其在一个实施例中是nk细胞)、所述ctla-4阻断剂、所述α-1抗胰蛋白酶或其片段或其类似物、所述凋亡细胞、或所述凋亡细胞上清液、所述碲基化合物或所述免疫调节剂或其任何组合中的每个包括在单独的组合物中。在又另一个实施例中,包括经基因修饰的免疫细胞(其在一个实施例中是nk细胞)以及包括ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、凋亡细胞、凋亡细胞上清液、碲基化合物或免疫调节剂或其任何组合中的任何一个的药物组合物的组合物包括多个组合物,其中所述经基因修饰的免疫细胞(其在一个实施例中是nk细胞)、所述ctla-4阻断剂、或所述α-1抗胰蛋白酶或其片段或其类似物、所述碲基化合物或所述免疫调节剂或其任何组合或其任何组合存在于在经基因修饰的免疫细胞(例如,nk细胞)组合物中,并且所述凋亡细胞或所述凋亡细胞上清液包括在单独的组合物中。
[0508]
在一些实施例中,组合物包括凋亡细胞和另外的药剂。在一些实施例中,组合物包括凋亡细胞和抗体或其功能片段。在一些实施例中,组合物包括凋亡细胞和rtx抗体或其功能片段。在一些实施例中,凋亡细胞和抗体或其功能片段可以包括在单独的组合物中。在一些实施例中,凋亡细胞和抗体或其功能片段可以包括在同一组合物中。
[0509]
技术人员应理解,“药物组合物”可以涵盖本文所描述的活性成分中的一种或多种活性成分与其它化学组分(如生理学上适合的载体和赋形剂)的制剂。药物组合物的目的是促进将化合物施用于生物体。
[0510]
在一些实施例中,本文公开了用于治疗、预防癌症或肿瘤、抑制所述癌症或肿瘤的生长或降低所述癌症或肿瘤的发病率的药物组合物。在一些实施例中,本文公开了用于增加患有癌症或肿瘤的受试者的生存期的药物组合物。在一些实施例中,本文公开了用于减小肿瘤或癌症的大小或降低所述肿瘤或癌症的生长速率的药物组合物。在一些实施例中,本文公开了药物,其包括用于降低患有癌症或肿瘤的受试者的肿瘤负荷。在一些实施例中,本文公开了药物,其包括用于延迟患有癌症或肿瘤的受试者的疾病进展。在一些实施例中,本文公开了药物,其包括用于降低患有癌症或肿瘤的受试者的癌症或肿瘤的发病率。在一些实施例中,本文公开了药物,其包括用于减小患有癌症或肿瘤的受试者的癌症或肿瘤的大小和/或降低所述肿瘤或癌症的生长速率。
[0511]
在一些实施例中,药物组合物包括如本文所描述的早期凋亡细胞群。在一些实施例中,药物组合物包括如本文所描述的早期凋亡细胞群和药学上可接受的赋形剂。
[0512]
技术人员应理解,短语“生理学上可接受的载体”、“药学上可接受的载体”、“生理学上可接受的赋形剂”和“药学上可接受的赋形剂”可以互换使用,可以涵盖不对生物体造成显著刺激并且不消除所施用的活性成分的生物活性和特性的载体、赋形剂或稀释剂。
[0513]
技术人员应理解,“赋形剂”可以涵盖添加到药物组合物以进一步促进活性成分的施用的惰性物质。在一些实施例中,赋形剂包含碳酸钙、磷酸钙、各种糖和各种类型的淀粉、纤维素衍生物、明胶、植物油以及聚乙二醇。
[0514]
用于调配和施用药物的技术发现于“remington’s pharmaceutical sciences,”mack publishing co.,easton,pa,latest edition,所述文献通过引用并入本文中。
[0515]
在一些实施例中,组合物是同时施用的。在可选实施例中,组合物在不同时间施
用。在另一个实施例中,在输注或经基因修饰的免疫细胞或其受体之前施用包括凋亡细胞的组合物。在另一个实施例中,在car-t细胞输注之前施用包括凋亡细胞的组合物。在另一个实施例中,在细胞毒性t细胞输注之前施用包括凋亡细胞的组合物。在另一个实施例中,在自然杀伤细胞输注之前施用包括凋亡细胞的组合物。在另一个实施例中,在树突状细胞输注之前施用包括凋亡细胞的组合物。在另一个实施例中,在输注经基因修饰的t细胞受体之前施用包括凋亡细胞的组合物。
[0516]
在另一个实施例中,在输注或经基因修饰的免疫细胞或其受体之前施用包括凋亡细胞上清液的组合物。在另一个实施例中,在car-t细胞输注之前施用包括凋亡细胞上清液的组合物。在另一个实施例中,在细胞毒性t细胞输注之前施用包括凋亡细胞上清液的组合物。在另一个实施例中,在自然杀伤细胞输注之前施用包括凋亡细胞上清液的组合物。在另一个实施例中,在树突状细胞输注之前施用包括凋亡细胞上清液的组合物。在另一个实施例中,在输注经基因修饰的t细胞受体之前施用包括凋亡细胞上清液的组合物。
[0517]
在另一个实施例中,在输注经基因修饰的免疫细胞或其受体之前施用包括凋亡细胞上清液的组合物。在另一个实施例中,在经基因修饰的免疫细胞或其受体输注前约24小时施用包括凋亡细胞的组合物。在另一个实施例中,在car t细胞或细胞毒性t细胞或天然杀伤细胞或树突状细胞或经基因修饰的t细胞受体输注前约24小时施用包括凋亡细胞的组合物。在另一个实施例中,在car t细胞或细胞毒性t细胞或天然杀伤细胞或树突状细胞或经基因修饰的t细胞受体输注前约24小时施用包括凋亡细胞上清液的组合物。
[0518]
在一些实施例中,组合物是同时施用的。在可选实施例中,组合物在不同时间施用。在另一个实施例中,在施用抗体或其片段或包括所述抗体或其片段的组合物之前施用包括凋亡细胞的组合物。
[0519]
在另一个实施例中,在抗体或其片段或包括所述抗体或其片段的组合物之前约2小时、4小时、6小时、8小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、36小时、48小时、60小时或72小时施用包括凋亡细胞的组合物。在另一个实施例中,在抗体或其片段或包括所述抗体或其片段的组合物之前约2小时、4小时、6小时、8小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、36小时、48小时、60小时或72小时施用包括凋亡细胞上清液的组合物。
[0520]
在另一个实施例中,在抗体或其片段或包括所述抗体或其片段的组合物之前约1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天或15天施用包括凋亡细胞的组合物。在另一个实施例中,在抗体或其功能片段或包括所述抗体或其功能片段的组合物之前约2周、3周、4周、5周、6周、7周或8周施用包括凋亡细胞上清液的组合物。
[0521]
在另一个实施例中,在输注抗体或其片段或包括所述抗体或其片段的组合物之后施用包括凋亡细胞的组合物。在另一个实施例中,在抗体或其片段或包括所述抗体或其片段的组合物之后施用包括凋亡细胞的组合物。在另一个实施例中,在施用抗体或其片段或包括所述抗体或其片段的组合物之后施用包括凋亡细胞上清液的组合物。在另一个实施例中,在施用抗体或其片段或包括所述抗体或其片段的组合物之后施用包括凋亡细胞上清液的组合物。在另一个实施例中,在抗体或其片段或包括所述抗体或其片段的组合物后约24小时施用包括凋亡细胞的组合物。在另一个实施例中,在施用抗体或其片段或包括所述抗体或其片段的组合物之后施用包括凋亡细胞的组合物。在另一个实施例中,在施用抗体或
4抗体、蒽环类);芳香酶抑制剂;细胞周期反应调节剂;酶;法呢基蛋白转移酶抑制剂;激素和抗激素剂和类固醇(包括合成类似物、糖皮质激素、雌激素/抗雌激素[如,serm]、雄激素/抗雄激素、孕激素、孕酮受体激动剂和促黄体激素释放[lhrh]激动剂和拮抗剂);胰岛素样生长因子(igf)/胰岛素样生长因子受体(igfr)系统调节剂(包括igfr1抑制剂);整合素信号传导抑制剂;激酶抑制剂(包括多激酶抑制剂和/或src激酶或src/ab1的抑制剂、细胞周期蛋白依赖性激酶[cdk]抑制剂、panher、her-1和her-2抗体、vegf抑制剂(包括抗-vegf抗体)、egfr抑制剂、parp(多adp-核糖聚合酶)抑制剂、丝裂原活化蛋白[map]抑制剂、met抑制剂、极光激酶抑制剂、pdgf抑制剂、和其他酪氨酸激酶或丝氨酸/苏氨酸激酶抑制剂;微管破坏剂,诸如海鞘素或其类似物和衍生物;微管稳定剂,诸如紫杉烷,铂类抗肿瘤药物(platins),例如顺铂、卡铂、奥沙利铂、奈达铂、四硝酸三铂、菲铂(phenanthriplatin)、吡铂和沙铂,以及天然存在的埃坡霉素及其合成和半合成类似物;微管结合,去稳定剂(包括长春花生物碱);拓扑异构酶抑制剂;异戊二烯蛋白转移酶抑制剂;铂配位化合物;信号转导抑制剂;组蛋白脱乙酰酶抑制剂(hdi)、溴结构域和末端外基序(bet)的抑制剂、蛋白质精氨酸甲基转移酶5(prmt5)的抑制剂、视黄酸和其他用作抗癌剂和细胞毒剂的药剂,诸如生物反应调节剂、生长因子和免疫调节剂。
[0533]
在一些实施例中,“癌症治疗剂”或“化疗剂”包括抗体或其抗原结合片段。
[0534]
在一些实施例中,如本文所描述的,使用早期凋亡细胞的方法包含与抗体组合地使用早期凋亡细胞或其组合物。在一些实施例中,所述抗体针对肿瘤细胞抗原。在另一个实施例中,所述抗体针对cd20。在另一个实施例中,所述抗体是利妥昔单抗(rtx)。
[0535]
在一些实施例中,早期凋亡细胞和抗体包括在同一组合物中。在一些实施例中,早期凋亡细胞和抗体包括在不同的组合物中。在一些实施例中,早期凋亡细胞和抗体的组合或其一种或多种组合物的施用是同时的。在一些实施例中,早期凋亡细胞和抗体的组合或其一种或多种组合物的施用包括在抗体之前施用凋亡细胞或其组合物。在一些实施例中,早期凋亡细胞和抗体的组合或其一种或多种组合物的施用包括在施用抗体之后施用凋亡细胞或其组合物。
[0536]
在另一个实施例中,所述抗体是曲妥珠单抗(赫赛汀;基因泰克):针对erbb2的人源化igg1。在另一实施例中,抗体是贝伐单抗(bevacizumab)(阿瓦斯汀(avastin);基因泰克/罗氏(roche)):针对vegf的人源化igg1。在另一个实施例中,抗体是西妥昔单抗(cetuximab)(爱必妥(erbitux);百时美施贵宝公司(bristol-myers squibb)):针对egfr的嵌合人-鼠igg1。在另一实施例中,抗体是帕尼单抗(panitumumab)(维克替比(vectibix);安进):针对egfr的人类igg2。在另一实施例中,抗体是伊派利单抗(ipilimumab)(益伏(yervoy);百时美施贵宝公司):针对ctla4的igg1。
[0537]
在另一实施例中,抗体为阿仑单抗(alemtuzumab)(坎帕斯(campath);健赞(genzyme)):针对cd52的人源化igg1。在另一实施例中,抗体是奥伐木单抗(ofatumumab)(阿扎拉(arzerra);genmab),针对cd20的人类igg1。在另一实施例中,抗体是吉妥单抗奥唑米星(gemtuzumab ozogamicin)(麦罗塔(mylotarg);惠氏(wyeth)):针对cd33的人源化igg4。在另一实施例中,抗体是贝伦妥单抗维多汀(brentuximab vedotin)(阿德曲斯(adcetris);西雅图遗传学公司(seattle genetics)):针对cd30的嵌合igg1。在另一实施例中,抗体是90y-标记的替坦异贝莫单抗(ibritumomab tiuxetan)(zevalin(泽娃灵);
idec制药):针对cd20的鼠类igg1。在另一实施例中,抗体是131i标记的托西莫单抗(tositumomab)((bexxar);葛兰素史克(glaxosmithkline)):针对cd20的鼠类igg2。
[0538]
在另一实施例中,抗体是雷莫芦单抗(ramucirumab),其针对血管内皮生长因子受体2(vegfr-2)。在另一实施例中,抗体是雷莫芦单抗(雷莫芦注射(cyramza injection),礼来公司(eli lilly and company))、布林莫单抗(blinatumomab)(blincyto,安进公司)、帕博利珠单抗(pembrolizumab)(克珠达(keytruda),默沙东公司(merck sharp&dohme corp.))、奥必珠单抗(obinutuzumab)(佳仕瓦(gazyva),基因泰克公司;此前被称为ga101)、帕妥珠单抗(pertuzumab)注射液(帕杰它(perjeta),基因泰克公司)或地诺单抗(denosumab)(狄诺塞麦(xgeva),安进公司)。在另一实施例中,抗体是巴利昔单抗(basiliximab)(舒莱(simulect);诺华(novartis))。在另一个实施例中,所述抗体是达利珠单抗(赛尼哌;罗氏公司)。
[0539]
在另一个实施例中,与凋亡细胞组合施用的抗体针对本文所描述和/或本领域中已知的肿瘤或癌症抗原或其片段。在另一个实施例中,所述抗体针对肿瘤相关抗原。在另一个实施例中,所述抗体针对肿瘤相关抗原或其作为血管生成因子的片段。
[0540]
在一些实施例中,本文所描述的抗体可以与本文所描述的组合物组合使用,例如但不限于包括早期凋亡细胞的组合物。
[0541]
在一些实施例中,组合疗法包括一种或多种癌症治疗剂。在一些实施例中,组合疗法包括至少一种癌症治疗剂。在一些实施例中,组合疗法包括一种癌症治疗剂。在一些实施例中,组合疗法包括两种癌症治疗剂。在一些实施例中,组合疗法包括3种癌症治疗剂。在一些实施例中,组合疗法包括4种癌症治疗剂。在一些实施例中,组合疗法包括5种癌症治疗剂。在一些实施例中,组合疗法包括6种癌症治疗剂。
[0542]
在一些实施例中,本文公开了包括本文所描述的早期凋亡细胞群和一种或多种癌症疗法的组合疗法。在一些实施例中,癌症疗法包括放射疗法、化学疗法、移植、免疫疗法、靶向疗法、激素疗法、光动力疗法、或外科手术或其组合。
[0543]
在一些实施例中,癌症疗法包括本文所描述的表达嵌合抗原受体的t细胞(car t-细胞)疗法。在一些实施例中,癌症疗法包括免疫疗法,所述免疫疗法包括施用抗体或其抗原结合部分,如本文所描述。在一些实施例中,癌症疗法包括放射疗法。在一些实施例中,癌症疗法包括化学疗法。在一些实施例中,癌症疗法包括移植。在一些实施例中,癌症疗法包括免疫疗法。在一些实施例中,癌症疗法包括靶向疗法。在一些实施例中,癌症疗法包括激素疗法。在一些实施例中,癌症疗法包括光动力疗法。在一些实施例中,癌症疗法包括外科手术。
[0544]
调配物(配方)
[0545]
本文所公开的包括早期凋亡细胞群的药物组合物可以方便地以可以缓冲到所选择ph的无菌液体制剂(例如,等渗水溶液、悬浮液、乳液、分散液或粘性组合物)的形式提供。液体制剂通常比凝胶、其它粘性组合物和固体组合物容易制备。另外地,施用液体组合物(尤其通过注射)稍微更加方便。另一方面,粘性组合物可在适当粘度范围内调配以提供与特定组织的更长接触周期。液体或粘性组合物可以包括载体,所述载体可以是含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如,甘油、丙二醇、液体聚乙二醇等)和其适合的混合物的溶剂或分散介质。
[0546]
无菌可注射溶液可以通过将本文所描述的并用于实践本文所公开的方法的早期凋亡细胞群按照期望与各种量的其它成分一起掺入所需量的适当的溶剂中来制备。此类组合物可以与适合的载体、稀释剂或赋形剂(如无菌水、生理盐水、葡萄糖、右旋糖等)混合。也可以将组合物冻干。取决于施用途径和期望的制剂,组合物可以含有辅助物质,如润湿剂、分散剂或乳化剂(例如,甲基纤维素)、ph缓冲剂、胶凝或粘度增强添加剂、防腐剂、调味剂、着色剂等。可以查询标准文本(如通过引用并入本文中的《雷明顿药物科学》(remington's pharmaceutical science),第17版,1985)以在不用进行过度实验的情况下制备适合的制剂。
[0547]
可以添加增强组合物的稳定性和无菌性的各种添加剂,包含抗微生物防腐剂、抗氧化剂、螯合剂和缓冲剂。可以通过各种抗细菌剂以及抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸等来确保防止微生物的作用。可以通过使用延迟吸收的药剂(例如,单硬脂酸铝(aluminum monosterate)和明胶)来实现可注射药物形式的延长的吸收。然而,根据本文的公开,所使用的任何媒剂、稀释剂或添加剂将必须与经基因修饰的免疫应答细胞或其祖细胞相容。
[0548]
本文所公开的组合物或调配物可以是等渗的,即,其可以具有与血液和泪液相同的渗透压。如本文所公开的组合物的期望的等渗性可以使用氯化钠或其它药学上可接受的药剂(如右旋糖、硼酸、酒石酸钠、丙二醇或其它无机或有机溶质)来实现。氯化钠对于含有钠离子的缓冲液是特别优选的。
[0549]
如果期望的话,组合物的粘度可以使用药学上可接受的增稠剂维持在所选择水平。甲基纤维素可以因为其易于获得且经济适用且容易起作用而是优选的。
[0550]
其它适合的增稠剂包含例如黄原胶、羧甲基纤维素、羟丙基纤维素、卡波姆(carbomer)等。增稠剂的优选浓度将取决于所选择的药剂。重要的点是使用将会实现所选择粘度的量。显然,适合的载剂和其它添加剂的选择将取决于具体施用途径和具体剂型(例如,液体剂型)的性质(例如,组合物是否被调配成溶液、悬浮液、凝胶或另一种液体形式,如时间释放形式或液体填充形式)。
[0551]
本领域技术人员应认识到,组合物或调配物的组分应被选择呈化学惰性并且将不会影响如本文所公开的用于本文所公开的方法的早期凋亡细胞群的活力或功效。这对化学和药学原理的技术人员而言将不存在问题,或者问题可以通过参考标准文本或通过来自本公开和本文所引用的文献的简单实验(不涉及过度实验)而容易避免。
[0552]
关于本文所公开的经基因修饰的免疫应答细胞的治疗用途的一个考虑是实现最佳效果所需的细胞数量。待施用细胞的数量将针对所治疗的受试者而变化。在一些实施例中,向人类受试者施用介于104个到10
10
个之间、介于105个到109个或介于106个与108个之间的本文所公开的经基因修饰的免疫应答细胞。更有效的细胞可以以甚至更小的数量施用。在一些实施例中,向人类受试者施用至少约1
×
108个、2
×
108个、3
×
108个、4
×
108个和5
×
l08个本文所公开的经基因修饰的免疫应答细胞。对将被视为有效剂量的剂量的精确测定可以基于每个受试者的个体因素,包含其大小、年龄、性别、体重和特定受试者的病状。本领域技术人员从本公开和本领域知识中可以容易地确定剂量。
[0553]
本领域技术人员可以容易地测定组合物中细胞和任选的添加剂、媒剂和/或载体的量,并在本文所公开的方法中施用。通常,任何添加剂(除了一种或多种活性细胞和/或一
种或多种药剂之外)以0.001%到50%(重量)溶液的量存在于磷酸盐缓冲生理盐水中,并且活性成分以微克到毫克(如约0.0001到约5wt%)的量级存在。在另一个实施例中,约0.0001到约1wt%。在仍另一个实施例中,约0.0001到约0.05wt%或约0.001到约20wt%。在另外的实施例中,约0.01到约10wt%。在另一个实施例中,约0.05到约5wt%。当然,对于待施用于动物或人的任何组合物,并且对于任何特定施用方法,优选的是测定:毒性,如通过在适合的动物模型(例如,啮齿动物,如小鼠)中测定致死剂量(ld)和ld50;以及测定一种或多种组合物的剂量、其中组分的浓度和施用引发适合的应答的一种或多种组合物的时机。此类测定不需要根据本领域技术人员的知识、本公开和本文所引用的文献进行过度实验。并且,可以在不用进行过度实验的情况下确定依序施用的时间。
[0554]
核酸序列、载体、细胞
[0555]
在一些实施例中,本文公开了对如本文所描述的用于如本文所公开的组合物和方法中的嵌合抗原受体(car)进行编码的分离的核酸序列。
[0556]
在另一个实施例中,本文公开了包括对如本文所描述的嵌合抗原受体(car)进行编码的核酸序列的载体。
[0557]
在一些实施例中,本文公开了对如本文所描述的用于如本文所公开的组合物和方法中的经基因修饰的t细胞受体(tcr)进行编码的分离的核酸序列。在另一个实施例中,本文公开了包括对如本文所描述的经基因修饰的t细胞受体(tcr)进行编码的核酸序列的载体。
[0558]
免疫应答细胞(例如,t细胞、ctl细胞、nk细胞)的基因修饰可以通过用重组dna构建体转导基本上同质的细胞组合物来完成。在一些实施例中,逆转录病毒载体(γ-逆转录病毒或慢病毒)用于将dna构建体引入细胞中。例如,可以将对结合抗原(例如,肿瘤抗原或其变体或其片段)的受体进行编码的多核苷酸克隆到逆转录病毒载体中,并且可以从其内源启动子、从逆转录病毒长末端重复序列或从对所关注靶t细胞类型具有特异性的启动子中驱动表达。也可以使用非病毒载体。
[0559]
非病毒方法也可以用于蛋白质在细胞中的表达。例如,可以通过在存在脂质转染(feigner等人,《美国国家科学院院刊》84:7413,1987;ono等人,《神经科学快报(neuroscience letters)》17:259,1990;brigham等人,《北美医学科学杂志(am.j.med.sci.)》298:278,1989;staubinger等人,《酶学方法(methods in enzymology)》101:512,1983)、无唾液酸糖蛋白-聚赖氨酸缀合(wu等人,《生物化学期刊(journal of biological chemistry)》263:14621,1988;wu等人,《生物化学期刊》264:16985,1989)的情况下或在手术条件下通过微注射(wolff等人,《科学(science)》247:1465,1990)施用核酸分子来将核酸分子引入细胞中。其它非病毒的基因转移手段包含使用磷酸钙、deae葡聚糖、电穿孔和原生质体融合进行体外转染。脂质体对于将dna递送到细胞中而言也可能具有潜在的益处。将正常基因移植到受试者的受影响组织中也可以通过将正常核酸离体转移到可培养的细胞类型(例如,自体或异源原代细胞或其子代)中、之后将细胞(或其后代)注射到靶向组织中或全身性注射来完成。重组受体也可以使用转座酶或靶向核酸酶(例如,锌指核酸酶、大范围核酸酶或tale核酸酶)衍生或获得。瞬时表达可以通过rna电穿孔获得。用于多核苷酸疗法方法的cdna表达可以从任何适合的启动子(例如,人巨细胞病毒(cmv)、猿猴病毒40(sv40)或金属硫蛋白启动子)被引导并由任何适合的哺乳动物调节元件或内含子(例
如,延伸因子ia增强子/启动子/内含子结构)来调节。例如,如果期望的话,已知优先在特定细胞类型中引导基因表达的增强子可以用于引导核酸的表达。所使用的增强子可以包含但不限于被表征为组织或细胞特异性增强子的那些增强子。可选地,如果将基因组克隆用作治疗性构建体,则可以通过同源调节序列或(如果期望的话)通过源自包含上文所描述的任何启动子或调节元件的异源来源的调节序列来介导调节。
[0560]
在另一个实施例中,本文公开了包括载体的细胞,所述载体包括对如本文所公开的嵌合抗原受体(car)进行编码的核酸序列。
[0561]
使用方法
[0562]
在一些实施例中,本文公开了减缓、减少、抑制或消除受试者中癌症或肿瘤的转移性扩散或其任何组合的方法,其包括向受试者施用本文所描述的包括早期凋亡细胞群和一种或多种癌症治疗剂的组合疗法的步骤。在一些实施例中,癌症治疗剂包括car t细胞。在一些实施例中,癌症治疗剂包括抗体或其抗原结合部分。在一些实施例中,与未被施用早期凋亡细胞群的受试者相比,该方法减缓、减少、抑制或消除受试者中癌症或肿瘤的转移性扩散或其任何组合。
[0563]
技术人员会理解,术语“转移”涵盖癌细胞从它们首次形成的地方扩散到身体的另一部分。在转移过程中,癌细胞脱离原始(原发)肿瘤,穿过血液或淋巴系统,并在身体的其他器官或组织中形成新的肿瘤。在一些实施例中,新的转移性肿瘤与原发性肿瘤属于同一类型的癌症。例如,如果乳腺癌扩散到肺部,那么肺部的癌细胞就是乳腺癌细胞,而不是肺癌细胞。
[0564]
技术人员将熟悉用于确定减缓、减少、抑制或消除转移性扩散的有效性的方法。例如,成像方法可用于确定受试者的肿瘤是否已扩散到身体的新的或第二部分或器官。
[0565]
在一些实施例中,本文公开了减缓、减少、抑制或消除经历癌症疗法的受试者中癌症或肿瘤的转移性扩散或其任何组合的方法,所述方法包括向所述受试者施用早期凋亡细胞群的步骤,其中与未经历癌症疗法并且未被施用早期凋亡细胞群的受试者相比,所述方法减缓、减少、抑制或消除所述受试者中癌症或肿瘤的转移性扩散或其任何组合。在一些实施例中,癌症疗法包括放射疗法、化学疗法、移植、免疫疗法、靶向疗法、激素疗法、光动力疗法、或外科手术、或其组合。在一些实施例中,癌症疗法包括car t细胞疗法。在一些实施例中,癌症疗法包括放射疗法。在一些实施例中,癌症疗法包括化学疗法。在一些实施例中,癌症疗法包括移植。在一些实施例中,癌症疗法包括免疫疗法。在一些实施例中,癌症疗法包括靶向疗法。在一些实施例中,癌症疗法包括激素疗法。在一些实施例中,癌症疗法包括光动力疗法。在一些实施例中,癌症疗法包括外科手术。
[0566]
在一些实施例中,经历癌症疗法的受试者包括正在用嵌合抗原受体t细胞(car t-细胞)疗法、放射疗法、化学疗法、移植、免疫疗法、靶向疗法、激素疗法、光动力疗法治疗或之前已经用嵌合抗原受体t细胞(car t-细胞)疗法、放射疗法、化学疗法、移植、免疫疗法、靶向疗法、激素疗法、光动力疗法治疗、已经进行外科手术治疗或其任何组合的受试者。
[0567]
在一些实施例中,癌症疗法包括car t细胞疗法。在一些实施例中,癌症疗法包括放射疗法、化学疗法、移植、免疫疗法、靶向疗法、激素疗法、光动力疗法、已经进行外科手术治疗、或其任何组合。
[0568]
在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括稳定癌症
或肿瘤区域中的定居巨噬细胞。在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括增加癌症或肿瘤区域中的定居巨噬细胞的数量。在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括增加癌症或肿瘤区域中的抗肿瘤巨噬细胞群。
[0569]
在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括减少转移至淋巴结的发病率。在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括减少血管生成的发病率。在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括减少所述肿瘤或所述癌症的转移速率。在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括减少具有转移潜力的癌细胞的形成。在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括减少癌细胞的迁移。
[0570]
在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括转移的发病率降低10%-100%。在一些实施例中,减缓、减少、抑制或消除癌症或肿瘤的转移性扩散包括转移的发病率降低高达10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
[0571]
在一些实施例中,癌症治疗剂包括表达嵌合抗原受体的t细胞(car t细胞)。在一些实施例中,car t细胞和早期凋亡细胞包括在单独的组合物中。在一些实施例中,car t细胞和早期凋亡细胞一起施用。在一些实施例中,car t细胞和早期凋亡细胞同时施用。在一些实施例中,car t细胞在早期凋亡细胞之前施用。在一些实施例中,car t细胞在施用早期凋亡细胞之后施用。
[0572]
在一些实施例中,包括早期凋亡细胞群和一种或多种癌症治疗剂的组合疗法的施用在相同的施用部位发生。在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂在不同的施用部位施用。在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂静脉内施用至受试者。在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂口服施用至受试者。
[0573]
在一些实施例中,一种或多种癌症治疗剂在施用早期凋亡细胞群之前数天施用。在一些实施例中,一种或多种癌症治疗剂在施用早期凋亡细胞群之前1、2、3、4或5天施用。
[0574]
在一些实施例中,一种或多种癌症治疗剂在施用早期凋亡细胞群之后数天施用。在一些实施例中,一种或多种癌症治疗剂在施用早期凋亡细胞群之后1、2、3、4或5天施用。
[0575]
在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂在治疗周期期间施用至少一次。在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂在同一天施用至受试者。在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂在不同的天内施用至受试者。在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂根据治疗方案(或治疗周期)在同一天或在不同的天内施用至受试者。
[0576]
在一些实施例中,治疗周期包括至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少14天、至少21天、至少28天、至少48天、或至少96天或更多。在一个实施例中,治疗周期是7天。在一个实施例中,治疗周期是14天。在一个实施例中,治疗周期是28天。在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂在同一治疗周期内施用或在分配给每个的不同的治疗周期内同时施用。在一些实施例中,治疗周期由医疗保健专业人员根据受试者的病状和需要确定。
[0577]
在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂在28天治疗周期的至
少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少8天、至少9天、至少10天、至少11天、至少12天、至少13天、至少14天、至少21天、或全部28天施用。在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂一天一次施用至受试者。在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂一天两次施用。
[0578]
在一些实施例中,早期凋亡细胞群和一种或多种癌症治疗剂在一个或多个治疗周期内施用至受试者。在一些实施例中,受试者施用1、2、3、4、5、6、7、8、9或10个治疗周期。在一些实施例中,本文所描述的早期凋亡细胞群和一种或多种癌症治疗剂施用持续数年。在一些实施例中,本文所描述的早期凋亡细胞群和一种或多种癌症治疗剂在一个或至六个月之间施用。
[0579]
早期凋亡细胞群和一种或多种癌症治疗剂施用至有需要的受试者的次数取决于医疗专业人员的判断、紊乱、紊乱的严重程度以及受试者对组合疗法的应答。在受试者紊乱没有改善的情况中,基于医生的判断,早期凋亡细胞群和一种或多种癌症治疗剂进行长期施用,即持续延长的时间段,包括在受试者的整个生命周期,从而减缓、减少、抑制或消除癌症或肿瘤的转移性扩散,或以其他方式控制或限制受试者疾病或紊乱的症状。
[0580]
在受试者的状态确实改善的情况下,基于医生的判断,早期凋亡细胞群和一种或多种癌症治疗剂连续施用;或施用的剂量可以暂时减少或暂时暂停一定时间长度(即,“药物假期”)。药物假期的长度在2天和1年之间改变,包括例如仅2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天、35天、50天、70天、100天、120天、150天、180天、200天、250天、280天、300天、320天、350天和365天。药物假期期间的剂量减少可以是10%-100%,包括例如仅10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%。
[0581]
在一个实施例中,本文公开了用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的方法,所述方法包括施用如本文所公开的组合物的步骤。
[0582]
在一些实施例中,本文公开了治疗、预防、抑制受试者的肿瘤的癌症或肿瘤、降低受试者的癌症或肿瘤的发病率、改善或缓解受试者的癌症或肿瘤的方法,所述方法包括施用包括凋亡细胞的组合物的步骤。在一些实施例中,本文公开了治疗、预防受试者的癌症或肿瘤、抑制受试者的癌症或肿瘤的生长、延迟疾病进展、降低肿瘤负荷或降低受试者的癌症或肿瘤的发病率或其任何组合的方法。在一些实施例中,本文所公开的方法减小肿瘤或癌症的大小和/或降低所述肿瘤或癌症的生长速率。在一些实施例中,本文所公开的方法增加患有肿瘤或癌症的受试者的存活率。在一些实施例中,使用凋亡细胞或其组合物使经基因修饰的免疫细胞疗法(例如但不限于car t细胞疗法)的功效有所提高。
[0583]
在另一个实施例中,本文公开了用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的方法,所述方法包括施用经基因修饰的免疫细胞和包括另外的药剂的组合物的步骤,其中所述另外的药剂包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合,其中与施用所述经基因修饰的免疫细胞且未施用所述另外的药剂的受试者相比,所述方法治疗、预防、抑制所述受试者的癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤。在另一个实施例中,所述经基因修饰的免疫细胞包括经
基因修饰的t细胞、细胞毒性t细胞、treg细胞、效应子t细胞、辅助t细胞、nk细胞或树突状细胞。
[0584]
在另一个实施例中,本文公开了用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的方法,所述方法包括施用表达嵌合抗原受体的t细胞(car t细胞)和包括另外的药剂的组合物的步骤,其中所述另外的药剂包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合,其中与施用所述经基因修饰的免疫细胞且未施用所述另外的药剂的受试者相比,所述方法治疗、预防、抑制所述受试者的癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤。
[0585]
在另一个实施例中,本文公开了用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的方法,所述方法包括施用经基因修饰的t细胞受体细胞(tcr t细胞)和包括另外的药剂的组合物的步骤,其中所述另外的药剂包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、碲基化合物或免疫调节剂或其任何组合,其中与施用所述经基因修饰的免疫细胞且未施用所述另外的药剂的受试者相比,所述方法治疗、预防、抑制所述受试者的癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤。
[0586]
在另一个实施例中,施用凋亡细胞或凋亡上清液或其组合物不会使所述施用表达嵌合抗原受体的t细胞用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的功效降低。在另一个实施例中,施用包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂或其组合物不会使所述施用表达嵌合抗原受体的t细胞用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的功效降低。
[0587]
在另一个实施例中,施用凋亡细胞或凋亡上清液或其组合物使所述施用表达嵌合抗原受体的t细胞用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的功效提高。在另一个实施例中,施用包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂或其组合物使所述施用表达嵌合抗原受体的t细胞用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的功效提高。
[0588]
在一个实施例中,提高经基因修饰的免疫细胞癌症疗法的功效的方法包括施用所述经基因修饰的免疫细胞和包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂或其组合物,其中所述功效与未施用所述另外的药剂的受试者相比有所提高。在另一个实施例中,所述经基因修饰的免疫细胞是t细胞。在另一个实施例中,t细胞是原初t细胞。在另一个实施例中,t细胞是原初cd4
t细胞。在另一个实施例中,t细胞是原初t细胞。在另一个实施例中,t细胞是原初cd8
t细胞。在另一实施例中,经基因修饰的免疫细胞为自然杀伤(nk)细胞。在另一实施例中,经基因修饰的免疫细胞为树突状细胞。在再一实施例中,经基因修饰的t细胞是细胞毒性t淋巴球(ctl细胞)。在另一实施例中,经基因修饰的t细胞是调节性t细胞(treg)。在另一个实施例中,所述经基因修饰的t细胞是嵌合抗原受体(car)t细胞。在另
一个实施例中,所述经基因修饰的t细胞是经基因修饰的t细胞受体细胞(tcr t细胞)。在另一个实施例中,提高car t细胞癌症疗法的功效的方法包括施用所述经基因修饰的免疫细胞和包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂或其组合物,其中所述功效与未施用所述另外的药剂的受试者相比有所提高。
[0589]
在另一个实施例中,本文中的方法使至少一个促炎性细胞因子的产生水平与接受免疫癌症疗法且未施用另外的药剂的受试者体内的所述促炎性细胞因子的水平相比有所降低。在另一个实施例中,本文中的方法抑制经历经基因修饰的免疫细胞癌症疗法且未施用另外的药剂的受试者的细胞因子释放综合征或细胞因子风暴或降低所述细胞因子释放综合征或细胞因子风暴的发病率。
[0590]
在另一个实施例中,本文所公开的方法减少il-6。
[0591]
在另一个实施例中,本文中的方法使至少一种细胞因子的产生与接受免疫癌症疗法且未施用另外的药剂的受试者体内的所述细胞因子的水平相比有所提高。在一些实施例中,所述另外的药剂是凋亡细胞,在其它实施例中,所述另外的药剂是凋亡细胞上清液。在另一个实施例中,本文所公开的方法增加il-2。
[0592]
技术人员应理解,如本文所使用的关于细胞因子的术语“产生”可以涵盖细胞因子的表达以及细胞因子从细胞的分泌。在一个实施例中,细胞因子的产生增加导致细胞因子从细胞的分泌增加。在可选实施例中,细胞因子的产生减少导致细胞因子从细胞的分泌减少。在另一个实施例中,本文所公开的方法减少至少一种细胞因子的分泌。在另一个实施例中,本文所公开的方法减少il-6的分泌。在另一个实施例中,本文所公开的方法增加至少一种细胞因子的分泌。在另一个实施例中,本文所公开的方法增加il-2的分泌。
[0593]
在另一个实施例中,分泌至少一种细胞因子的细胞是肿瘤细胞。在另一个实施例中,分泌至少一种细胞因子的细胞是t细胞。在另一个实施例中,分泌至少一种细胞因子的细胞是免疫细胞。在另一个实施例中,分泌至少一种细胞因子的细胞是巨噬细胞。在另一个实施例中,分泌至少一种细胞因子的细胞是b细胞淋巴细胞。在另一个实施例中,分泌至少一种细胞因子的细胞是肥大细胞。在另一个实施例中,分泌至少一种细胞因子的细胞是内皮细胞。在另一个实施例中,分泌至少一种细胞因子的细胞是成纤维细胞。在另一个实施例中,分泌至少一种细胞因子的细胞是基质细胞。技术人员应认识到,可以取决于细胞周围的环境使分泌细胞因子的细胞中的细胞因子的水平提高或降低。
[0594]
在又另一个实施例中,在本文所公开的方法中使用的另外的药剂增加至少一种细胞因子的分泌。在又另一个实施例中,在本文所公开的方法中使用的另外的药剂维持至少一种细胞因子的分泌。在仍另一个实施例中,在本文所公开的方法中使用的另外的药剂不会降低至少一种细胞因子的分泌。在另一个实施例中,在本文所公开的方法中使用的另外的药剂增加il-2的分泌。在另一个实施例中,在本文所公开的方法中使用的另外的药剂增加il-2r的分泌。在另一个实施例中,在本文所公开的方法中使用的另外的药剂维持il-2的分泌水平。在另一个实施例中,在本文所公开的方法中使用的另外的药剂维持il-2r的分泌水平。在另一个实施例中,在本文所公开的方法中使用的另外的药剂不会降低il-2r的分泌水平。在另一个实施例中,在本文所公开的方法中使用的另外的药剂维持或增加il-2的分泌水平。在另一个实施例中,在本文所公开的方法中使用的另外的药剂维持或增加il-2r的
分泌水平。在另一个实施例中,在本文所公开的方法中使用的另外的药剂不会降低il-2r的分泌水平。
[0595]
在仍另外的实施例中,在本文所公开的方法中使用的另外的药剂降低il-6的分泌。在另一个实施例中,在本文所公开的方法中使用的另外的药剂维持、增加或不会降低il-2的分泌水平,同时降低il-6的分泌。在另一个实施例中,在本文所公开的方法中使用的另外的药剂维持、增加或不会降低il-2r的分泌水平,同时降低il-6的分泌。
[0596]
在一个实施例中,提高本文所公开的car t细胞癌症疗法的功效的方法包括使所述受试者的il-6水平降低,所述方法包括施用car t细胞和包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂或其组合物,其中所述功效与未施用所述另外的药剂的受试者相比有所提高。在另一个实施例中,提高本文所公开的car t细胞癌症疗法的功效的方法包括使所述受试者的il-2水平提高,所述方法包括施用car t细胞和包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂或其组合物,其中所述功效与未施用所述另外的药剂的受试者相比有所提高。在另一个实施例中,提高本文所公开的car t细胞癌症疗法的功效的方法包括使所述car t细胞的增殖增加,所述方法包括施用car t细胞和包括凋亡细胞、来自凋亡细胞的上清液、ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合的另外的药剂或其组合物,其中所述功效和所述car t细胞的增殖与未施用所述另外的药剂的受试者相比有所提高。
[0597]
在一个实施例中,提高car t细胞癌症疗法的功效的方法使受试者的细胞因子产生有所减少或得到抑制,所述方法包括施用包括car t细胞以及ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合或其组合物的组合物的步骤。在另一个实施例中,用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的方法使受试者的细胞因子产生有所减少或得到抑制,所述方法包括施用包括car t细胞以及ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合或其组合物的组合物的步骤。
[0598]
在另一个实施例中,本文公开了治疗经历car t细胞癌症疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法。
[0599]
在另一个实施例中,治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的方法使受试者的细胞因子产生有所减少或得到抑制,所述方法包括施用包括car t细胞以及ctla-4阻断剂、α-1抗胰蛋白酶或其片段或类似物、碲基化合物或免疫调节剂或其任何组合或其组合物的组合物的步骤。
[0600]
在另一个实施例中,本文公开了一种治疗受试者的癌症或肿瘤的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。在另一个实施例中,本文公开了一种预防受试者的癌症或肿瘤的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。在另一个实施例中,本文公开了一种抑制受试者的癌症或肿瘤的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。在另一个实施例中,本文公开了一种减少受试者的癌症或肿瘤的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。在另一个实
施例中,本文公开了一种改善受试者的癌症或肿瘤的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。在另一个实施例中,本文公开了一种缓解受试者的癌症或肿瘤的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。
[0601]
在一个实施例中,本文公开了在免疫疗法期间维持或提高经基因修饰的免疫细胞的增殖速率的方法,所述方法包括在免疫疗法期间施用包括凋亡细胞或凋亡上清液的组合物的步骤。在另一个实施例中,所述经基因修饰的免疫细胞包括t细胞、原初t细胞、原初cd4 t细胞、原初cd8 t细胞、自然杀伤(nk)细胞、树突状细胞、细胞毒性t淋巴细胞(ctl细胞)、调节性t细胞(treg)、嵌合抗原受体(car)t细胞或经基因修饰的t细胞受体(tcr)细胞。在另一个实施例中,本文公开了在免疫疗法期间维持或提高car t细胞的增殖速率的方法,所述方法包括在免疫疗法期间施用包括凋亡细胞或凋亡上清液的组合物的步骤。
[0602]
在另一个实施例中,维持或提高经基因修饰的免疫细胞的增殖速率的方法不会降低或抑制免疫疗法的功效。例如,在另一个实施例中,维持或提高car t细胞的增殖速率的方法不会降低或抑制car t细胞癌症疗法的功效。在另一个实施例中,维持或提高经基因修饰的免疫细胞(例如,car t细胞)的增殖速率的方法减少或抑制受试者的细胞因子产生。
[0603]
在另一个实施例中,如本文所公开的组合物和方法利用与如本文所公开的凋亡细胞或凋亡上清液以及一种或多种ctla-4阻断剂(如伊匹单抗)的组合疗法。在一个实施例中,ctla-4是有助于维持自身耐受性的t细胞活化的有效抑制剂。在一个实施例中,施用抗ctla-4阻断剂(其在另一个实施例中是抗体)产生t细胞活化的净效应。在另一个实施例中,本文所公开的组合物和方法利用包括凋亡细胞、car t细胞和一种或多种ctla-4阻断剂的组合疗法。
[0604]
在一些情况下,相对于未经修饰的氨基酸序列,本文所公开的多肽以及用于本文所公开的方法中的多肽包括至少一个保守氨基酸取代。在其它情况下,多肽包括非保守氨基酸取代。在此类情况下,具有此类修饰的多肽相对于缺乏此种氨基酸取代的多肽表现出增加的稳定性或更长的半衰期。
[0605]
在一些实施例中,“治疗”包括治疗性处理,并且“预防”包括预防性(prophylactic/preventative)措施,其中目的是如上文所描述的预防或减轻靶向病理病状或紊乱。因此,在一些实施例中,治疗可以包含直接影响或治愈、遏制、抑制、预防、减轻疾病、紊乱或病状的严重程度、延迟所述疾病、紊乱或病状的发作、减少与所述疾病、紊乱或病状相关的症状或其组合。因此,在一些实施例中,“治疗”、“改善”和“缓解”尤其指延迟进展、加快缓解、诱导缓解、增加缓解、加快恢复、增加疗效或降低对替代疗法的抵抗,或其组合。在一些实施例中,“预防”尤其是指延迟症状的发作、预防疾病复发、减少复发事件的次数或频率、增加有症状的事件之间的时延或其组合。在一些实施例中,“遏制”或“抑制”尤其是指降低症状的严重程度、降低急性事件的严重程度、减少症状次数、减少疾病相关症状的发病率、减少症状的时延、改善症状、减少次级症状、减少次级感染、延长患者生存期或其组合。
[0606]
技术人员应理解,术语“抗原识别受体”可以涵盖能够响应于抗原结合而活化免疫细胞(例如,t细胞)的受体。示例性抗原识别受体可以是天然或内源性t细胞受体或嵌合抗原受体,其中肿瘤抗原结合结构域与能够活化免疫细胞(例如,t细胞)的细胞内信号传导结构域融合。
[0607]
在一些实施例中,本文所描述的方法增加患有癌症或肿瘤的受试者的存活率,并且包括向所述受试者施用早期凋亡细胞群,其中所述方法增加受试者的存活率。
[0608]
技术人员应理解,术语“疾病”可以涵盖损害或干扰细胞、组织或器官的正常功能的任何病状或紊乱。疾病的实例包含瘤形成或细胞的病原体感染。
[0609]
技术人员应理解,术语“有效量”可以涵盖足以具有治疗作用的量。在一些实施例中,“有效量”是足以阻止、改善或抑制瘤形成的持续增殖、生长或转移(例如,侵袭或迁移)的量。
[0610]
技术人员应理解,术语“瘤形成”是指特征在于细胞或组织的病理性增殖和其随后迁移到或侵袭其它组织或器官的疾病。瘤形成生长通常不受控制且是渐进性的,并且在将不会引发或将引起正常细胞繁殖停止的条件下发生。瘤形成可以影响多种细胞类型、组织或器官,包含但不限于选自以下的器官:膀胱、骨、大脑、乳房、软骨、胶质细胞、食道、输卵管、胆囊、心脏、肠、肾脏、肝、肺、淋巴结、神经组织、卵巢、胸膜、胰、前列腺、骨骼肌、皮肤、脊髓、脾、胃、睪丸、胸腺、甲状腺、气管、泌尿生殖道、输尿管、尿道、子宫和阴道或其组织或细胞类型。瘤形成包含癌症,如肉瘤、癌或浆细胞瘤(浆细胞的恶性肿瘤)。
[0611]
技术人员应理解,术语“病原体”可以涵盖能够引起疾病的病毒、细菌、真菌、寄生虫或原生动物。
[0612]
技术人员应理解,术语“肿瘤抗原”或“肿瘤相关抗原”可以涵盖与正常或非is肿瘤细胞相比在肿瘤细胞上唯一或差异表达的抗原(例如,多肽)。关于本文所公开的组合物和方法,肿瘤抗原包含由肿瘤表达的能够通过抗原识别受体(例如,cd19、muci)活化或诱导免疫应答或能够通过受体-配体结合(例如,cd47、pd-l1/l2、b7.1/2)遏制免疫应答的任何多肽。
[0613]
技术人员应理解,术语“病毒抗原”可以涵盖由病毒表达的能够诱导免疫应答的多肽。
[0614]
术语“包括(comprise)”、“包括(comprising)”旨在具有美国专利法中赋予其的广义含义并且可以意指“包含(include)”、“包含(including)”等。类似地,术语“由
……
组成”和“基本上由
……
组成”具有美国专利法赋予其的含义。设想本文所公开的组合物和方法包括活性成分或特定步骤,由活性成分或特定步骤组成,或者基本上由活性成分或特定步骤组成。
[0615]
技术人员应理解,术语“治疗”可以涵盖尝试改变所治疗的个体或细胞的疾病进程的临床干预,并且可以针对预防或在临床病理的进程期间进行。治疗的治疗作用包含但不限于预防疾病发生或复发、缓解症状、减少疾病的任何直接或间接病理性后果、预防转移、降低疾病进展速率、改善或缓和疾病状态以及缓解或改进预后。通过预防疾病或紊乱的进展,治疗可以防止受影响或诊断的受试者或怀疑患有所述紊乱的受试者的由于紊乱引起的恶化,而且治疗可以预防有患上所述紊乱的风险或怀疑患有所述紊乱的受试者的所述紊乱的发作或所述紊乱的症状。
[0616]
技术人员应理解,术语“受试者”可以涵盖脊椎动物,在一些实施例中涵盖哺乳动物,并且在一些实施例中涵盖人。在一些实施例中,受试者还可以指家养的,如牛、绵羊、马、猫、狗和实验动物,如小鼠、大鼠、沙鼠、仓鼠等。
[0617]
在一些实施例中,本文公开了car t细胞,其中car针对所关注肽。在一些实施例
中,所述car与所关注肽结合。在另一个实施例中,所述car靶向所关注肽。在另一个实施例中,所述car活化所关注肽。在另一个实施例中,所述car是所述所关注肽的配体。在另一个实施例中,所述所关注肽是所述car的配体。这些实施例中的每个实施例被认为是本文所公开的一部分。
[0618]
在一些实施例中,如本文所公开的免疫细胞不是t细胞。在另一个实施例中,如本文所公开的免疫细胞不是nk细胞。在另一个实施例中,如本文所公开的免疫细胞不是ctl。在另一个实施例中,如本文所公开的免疫细胞不是调节性t细胞。在另一个实施例中,所述免疫细胞不是人胚胎干细胞。在另一个实施例中,所述免疫细胞不是可以从其分化淋巴样细胞的多能干细胞。
[0619]
免疫疗法的一种方法涉及对患者自身的免疫细胞进行工程化以产生将会识别并攻击其肿瘤的经基因修饰的免疫细胞。如本文所描述的,收集免疫细胞并对其进行基因修饰例如以在其细胞表面上产生嵌合抗原受体(car),这将允许免疫细胞(例如,t细胞)识别肿瘤或癌细胞上的特定蛋白质抗原。然后将经基因修饰的免疫细胞(例如,car t细胞)扩增群施用于患者。在一些实施例中,所施用的细胞在患者的身体内繁殖并且识别并杀伤在其表面上具有抗原的癌症和肿瘤细胞。在另一个实施例中,所施用的细胞在患者的身体内繁殖并且识别并杀伤肿瘤相关抗原,这导致癌症和肿瘤细胞死亡。
[0620]
在一些实施例中,本文公开了抑制经历car t细胞癌症疗法的受试者的细胞因子释放综合征或细胞因子风暴或降低所述细胞因子释放综合征或细胞因子风暴的发病率的方法,以及减少或抑制经历细胞因子释放综合征或细胞因子风暴的受试者的细胞因子产生的方法,所述方法包括施用包括凋亡细胞或凋亡细胞上清液的组合物的步骤。在另一个实施例中,本文公开了治疗经历car t细胞癌症疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法。在另一个实施例中,本文公开了预防经历car t细胞癌症疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法。在另一个实施例中,本文公开了缓解经历car t细胞癌症疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法。在另一个实施例中,本文公开了改善经历car t细胞癌症疗法的受试者的细胞因子释放综合征或细胞因子风暴的方法。在另一个实施例中,施用凋亡细胞或凋亡上清液或其组合物不会使car t细胞疗法的功效降低。
[0621]
在一些实施例中,本文公开了抑制经历表达嵌合抗原受体的t细胞(car t细胞)癌症疗法的受试者的细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率的方法,其中所述方法包括向所述受试者施用包括凋亡细胞或凋亡细胞上清液或其组合物的组合物的步骤。在另一个实施例中,抑制细胞因子释放综合征(crs)或细胞因子风暴或降低所述crs或细胞因子风暴的发病率是通过测量经历表达嵌合抗原受体的t细胞癌症疗法且施用凋亡细胞或凋亡上清液的受试者体内的细胞因子水平来测定的。在另一个实施例中,将测量到的细胞因子水平与未经历car t细胞癌症疗法的受试者体内的细胞因子水平进行比较。在另一个实施例中,将测量到的细胞因子水平与未施用凋亡细胞或凋亡上清液的受试者体内的细胞因子水平进行比较。在另一个实施例中,将测量到的细胞因子水平与对照受试者进行比较。
[0622]
在另一个实施例中,与经历car t细胞癌症疗法且未施用所述凋亡细胞或所述凋亡细胞上清液或其组合物的受试者相比,所述受试者体内的促炎性细胞因子的水平有所降
低。在另一个实施例中,与经历car t细胞癌症疗法且未施用所述凋亡细胞或所述凋亡细胞上清液或其组合物的受试者相比,本文所公开的方法使至少一种促炎性细胞因子的产生水平有所降低或得到抑制。
[0623]
在另一个实施例中,本文所公开的方法可以进一步包括施用另外的药剂。可选地,本文所公开的方法可以包括施用另外的药剂并且不施用凋亡细胞或凋亡细胞上清液。在仍另外的实施例中,另外的药剂可以是增强或改善car t细胞癌症疗法或其任何组合的那些化合物或组合物。在又另外的实施例中,增强或改善car t细胞癌症疗法的另外的药剂包含ctla-4阻断剂、α-1抗胰蛋白酶或其功能片段或其类似物、碲基化合物或免疫调节剂或其任何组合。在另一个实施例中,另外的药剂包含凋亡细胞或凋亡上清液。在另一个实施例中,本文所描述的另外的药剂的施用在所述car t细胞癌症疗法之前、同时或之后。
[0624]
在一些实施例中,il-6受体拮抗剂(其在一个实施例中是托珠单抗)与如本文所公开的组合物和方法一起使用。
[0625]
在一些实施例中,过继转移的t细胞移植在淋巴细胞减少的宿主中并更有效地扩增。因此,在一些实施例中,在转移car t细胞或其它经修饰的免疫细胞之前,对受试者进行淋巴细胞清除。在另一个实施例中,接受car t细胞的受试者被给予t细胞支持性细胞因子。
[0626]
在一些实施例中,所述t细胞是效应子t细胞。在另一个实施例中,所述t细胞是原初t细胞。在另一个实施例中,所述t细胞是中枢记忆(t
cm
)t细胞。在另一个实施例中,所述t细胞是th17细胞。在另一个实施例中,所述t细胞是t干记忆细胞。在另一个实施例中,所述t细胞具有高复制能力。在另一个实施例中,t细胞扩增在患者体内发生。在另一个实施例中,可以将少量细胞转移到患者。在另一个实施例中,t细胞扩增在体外发生。在另一个实施例中,可以将大量细胞转移到患者,可以将细胞和/或上清液多次转移到患者,或其组合。
[0627]
在一些实施例中,car t细胞的优点在于,因为其对细胞表面分子具有特异性,所以其克服了mhc限制性tcr识别的限制并通过抗原呈递或人白细胞抗原表达的损伤避免了肿瘤逃逸。
[0628]
在一些实施例中,本文公开了一种减轻受试者的肿瘤负担的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。
[0629]
在一些实施例中,减轻所述肿瘤负担包括减少受试者的肿瘤细胞的数量。在另一个实施例中,减轻所述肿瘤负担包括减少受试者的肿瘤大小。在另一个实施例中,减轻所述肿瘤负担包括根除受试者的肿瘤。
[0630]
在另一个实施例中,本文公开了一种诱导受试者的肿瘤细胞死亡的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。在另一个实施例中,如本文所公开的用于诱导受试者的肿瘤细胞死亡的方法包括施用免疫细胞(如nk细胞或包括经工程化的嵌合抗原受体的t细胞)以及至少一种另外的药剂以减少受试者的毒性细胞因子释放或“细胞因子释放综合征”(crs)或“严重细胞因子释放综合征”(scrs)或“细胞因子风暴”。
[0631]
在另一个实施例中,本文公开了一种增加或延长患有瘤形成的受试者的生存期的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。在另一个实施例中,如本文所公开的用于增加或延长受试者的生存期的方法包括施用免疫细胞(如包括经工程化的嵌合抗原受体的nk细胞或t细胞)以及至少一种另外的药剂以减少受
试者的毒性细胞因子释放或“细胞因子释放综合征”(crs)或“严重细胞因子释放综合征”(scrs)或“细胞因子风暴”。
[0632]
在另一个实施例中,本文公开了一种增加或延长患有瘤形成的受试者的生存期的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。
[0633]
在一些实施例中,本文公开了一种延迟受试者的癌症进展的方法,所述方法包括向所述受试者施用本文所描述的组合物中的任何组合物或组合物的组合的步骤。在一些实施例中,本文公开了一种延迟受试者的白血病或淋巴瘤的进展的方法,所述方法包括向所述受试者施用本文所描述的组合物中的任何组合物或组合物的组合的步骤。在一些实施例中,本文公开了一种增加、扩展(extending)或延长(prolonging)患有癌症或肿瘤的受试者的生存期的方法,所述方法包括向所述受试者施用本文所描述的组合物中的任何组合物或组合物的组合的步骤。在一些实施例中,本文公开了一种增加、扩展(extending)或延长(prolonging)患有白血病或淋巴瘤的受试者的生存期的方法,所述方法包括向所述受试者施用本文所描述的组合物中的任何组合物或组合物的组合。在一些实施例中,本文公开了一种减轻受试者的肿瘤细胞负担的方法,所述方法包括向所述受试者施用本文所描述的组合物中的任何组合物或组合物的组合。在一些实施例中,肝和骨髓的肿瘤负担减轻。
[0634]
在另一个实施例中,本文公开了一种预防受试者的瘤形成的方法,所述方法包括向所述受试者施用本文所描述的组合物中的任何组合物或组合物的组合的步骤。在一些实施例中,所述瘤形成选自:血液癌、b细胞白血病、多发性骨髓瘤、成淋巴细胞性白血病(all)、慢性淋巴细胞性白血病、非霍奇金淋巴瘤、卵巢癌或其组合。
[0635]
在另一个实施例中,本文公开了一种治疗有需要的受试者的血液癌的方法,所述方法包括向所述受试者施用如本文所描述的组合物中的任何组合物的步骤。在一些实施例中,所述血液癌选自:b细胞白血病、多发性骨髓瘤、急性成淋巴细胞性白血病(all)、慢性淋巴细胞性白血病和非霍奇金淋巴瘤。
[0636]
在一些实施例中,施用包括施用包括car t细胞的组合物。在一些实施例中,施用包括施用包括早期凋亡细胞的组合物。在一些实施例中,施用包括施用包括从早期凋亡细胞获得的上清液的组合物。在一些实施例中,施用包括施用本文所描述的组合物的组合。在一些实施例中,施用包括施用在相同或不同的组合物中的car t细胞和凋亡细胞。在一些实施例中,施用包括施用car t细胞与如本文所描述的另外的药剂组合。在一些实施例中,施用包括施用在相同或不同的组合物中的凋亡细胞和其抗体或片段。
[0637]
在一些实施例中,组合疗法提供协同效应。在一些实施例中,与单独使用car t细胞相比,将早期凋亡细胞与car t细胞组合使用的方法使car t细胞功效提高。在一些实施例中,与单独使用car t细胞相比,将早期凋亡细胞与car t细胞组合使用的方法使患有癌症或肿瘤的受试者的生存期时间延长。在一些实施例中,与单独使用car t细胞相比,将早期凋亡细胞与car t细胞组合使用的方法使患有淋巴瘤或白血病的受试者的生存期时间延长。
[0638]
在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段组合使用的方法使癌症的发作或肿瘤的出现延迟。在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段组合使用的方法使癌症的进展延迟。在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段组合使
用的方法使肿瘤的生长延迟。在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段组合使用的方法使患有癌症或肿瘤的受试者的生存期时间延长。在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段组合使用的方法使患有淋巴瘤或白血病的受试者的生存期时间延长。
[0639]
在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段(包括rtx)组合使用(包括施用)的方法使癌症的发作或肿瘤的出现延迟。在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段(包括rtx)组合使用的方法使癌症的进展延迟。在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段(包括rtx)组合使用的方法使肿瘤的生长延迟。在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段(包括rtx)组合使用的方法使患有癌症或肿瘤的受试者的生存期时间延长。在一些实施例中,与单独使用凋亡细胞或抗体相比,将早期凋亡细胞与抗体或其片段(包括rtx)组合使用的方法使患有淋巴瘤或白血病的受试者的生存期时间延长。
[0640]
在一些实施例中,本文所描述的使用方法使肿瘤负荷降低。技术人员应理解,术语“肿瘤负荷”可以指癌细胞的数量、肿瘤的大小或体内癌症量。术语“肿瘤负荷”可以与术语“肿瘤负担”互换使用,具有所有相同含义和性质。在一些实施例中,与未施用凋亡细胞的受试者相比,使用(包括施用)早期凋亡细胞的方法使受试者的癌细胞的数量减少、使受试者的肿瘤的大小减小或使受试者体内的癌症量减少或其任何组合。在一些实施例中,与未施用凋亡细胞或未施用抗体或其组合的受试者相比,将早期凋亡细胞与抗体或其片段组合使用(包括施用)的方法使受试者的癌细胞的数量减少、使受试者的肿瘤的大小减小或使受试者体内的癌症量减少或其任何组合。在一些实施例中,与未施用凋亡细胞、rtx抗体或其组合的受试者相比,将早期凋亡细胞与rtx抗体或其片段组合使用(包括施用)的方法使受试者的癌细胞的数量减少、使受试者的肿瘤的大小减小或使受试者体内的癌症量减少或其任何组合。
[0641]
在一些实施例中,如本文所公开的减少或抑制经历细胞因子释放综合征或细胞因子风暴或易受细胞因子释放综合征或细胞因子风暴侵害的受试者的细胞因子产生的方法减少或抑制细胞因子产生。在另一个实施例中,所述方法减少或抑制促炎性细胞因子产生。在另一个实施例中,所述方法减少或抑制至少一个促炎性细胞因子。在其中受试者正在经历car t细胞癌症疗法的另一个实施例中,所述方法不会使car t细胞疗法的功效降低。
[0642]
本文所提供的方法包括以有效实现期望效应(无论是减轻现有病状还是预防复发)的量施用本文所公开的t细胞、nk细胞或ctl细胞。为了治疗,所施用的量是有效产生期望效应的量。可以以一次施用或一系列施用提供有效量。可以以团注或通过连续灌注来提供有效量。
[0643]
技术人员应认识到“有效量”(或“治疗有效量”)可以涵盖足以在治疗后产生有益或期望的临床结果的量。可以以一个或多个剂量将有效量施用于受试者。就治疗而言,有效量是足以缓解、改善、稳定、逆转或减慢疾病进展或以其它方式减少疾病的病理性后果的量。有效量通常由医生根据具体情况确定并且在本领域技术人员的能力范围内。在确定实现有效量的适当剂量时通常要考虑几个因素。这些因素包含受试者的年龄、性别和体重、所治疗的病状、病状的严重程度以及所施用的抗原结合片段的形式和有效浓度。
[0644]
在一个实施例中,本文所公开的方法包括施用包括经基因修饰的细胞和另外的药剂或其组合的组合物,所述经基因修饰的细胞和所述另外的药剂或其组合包括在单个组合物中。在另一个实施例中,方法包括施用包括car t细胞和另外的药剂或其组合的组合物,所述car t细胞和所述另外的药剂或其组合包括在单个组合物中。在另一个实施例中,方法包括施用包括tcr t细胞和另外的药剂或其组合的组合物,所述tcr t细胞和所述另外的药剂或其组合包括在单个组合物中。
[0645]
在一个实施例中,本文所公开的方法包括施用包括经基因修饰的细胞和另外的药剂或其组合的组合物,所述经基因修饰的细胞和所述另外的药剂或其组合包括在至少两个组合物中。在另一个实施例中,方法包括施用包括car t细胞和另外的药剂或其组合的组合物,所述car t细胞和所述另外的药剂或其组合包括在至少两个组合物中。在另一个实施例中,方法包括施用包括tcr t细胞和另外的药剂或其组合的组合物,所述tcr t细胞和所述另外的药剂或其组合包括在至少两个组合物中。
[0646]
对于使用抗原特异性t细胞(例如,car t细胞)的过继免疫疗法,通常输注10
6-10
10
的范围内(例如,109)的细胞剂量。在将经基因修饰的细胞施用于宿主并且随后分化后,诱导特异性针对特定抗原的t细胞。t细胞的“诱导”可以包含如通过缺失或无反应性使抗原特异性t细胞灭活。灭活特别适用于如在自身免疫紊乱中建立或重新建立耐受性。经修饰的细胞可以通过本领域已知的任何方法(包含但不限于静脉内、皮下、结内、肿瘤内、鞘内、胸膜内、腹膜内和直接施用于胸腺)来施用。在一些实施例中,所述t细胞未腹膜内施用。在一些实施例中,所述t细胞肿瘤内施用。
[0647]
包括如本文所公开的经基因修饰的免疫应答细胞(例如,t细胞、n细胞、ctl细胞或其祖细胞)的组合物可以全身性地或直接地提供给受试者以治疗瘤形成、病原体感染或感染性疾病。在一些实施例中,将本文所公开的细胞直接注射到所关注的器官(例如,受瘤形成影响的器官)中。可选地,包括经基因修饰的免疫应答细胞的组合物例如通过施用于循环系统(例如,肿瘤脉管系统)中而间接地提供给所关注的器官。可以在施用细胞之前、期间或之后提供扩增剂和分化剂以增加t细胞、nk细胞或ctl细胞的体外或体内产生。
[0648]
如上文所描述的,在本文所公开的方法中,可以在施用经基因修饰的免疫细胞之前、同时或之后提供包括另外的药剂的组合物。在一个实施例中,在本文所公开的方法中,在如本文所公开的另外的药剂之前施用经基因修饰的免疫细胞(例如,car t细胞)。在另一个实施例中,在本文所公开的方法中,在如本文所公开的另外的药剂的同时施用经基因修饰的免疫细胞(例如,car t细胞)。在另一个实施例中,在本文所公开的方法中,在施用另外的药剂之后施用经基因修饰的免疫细胞(例如,car t细胞)。
[0649]
在一个实施例中,本文所公开的方法施用包括如本文所公开的凋亡细胞的组合物。在另一个实施例中,本文所公开的方法施用包括如本文所公开的凋亡细胞上清液的组合物。
[0650]
经修饰的细胞可以以任何生理学上可接受的媒剂(通常血管内)施用,尽管其也可以被引入骨骼或细胞可以找到用于进行再生和分化的适当部位的其它方便部位(例如,胸腺)中。通常,将施用至少1
×
105个细胞,最终达到1
×
10
10
或更多。本文所公开的经基因修饰的免疫应答细胞可以包括经纯化的细胞群。本领域技术人员可以使用各种众所周知的方法(如荧光活化细胞分选(facs))容易地测定群中的经基因修饰的免疫应答细胞的百分比。在
一些实施例中,包括经基因修饰的免疫应答细胞的群中的纯度范围为约50%到约55%、约55%到约60%和约65%到约70%。在其它实施例中,纯度为约70%到约75%、约75%到约80%、约80%到约85%。在另外的实施例中,纯度为约85%到约90%、约90%到约95%、约95%到约100%。剂量可以由本领域技术人员容易地调整(例如,纯度降低可能需要增加剂量)。细胞可以通过注射、导管等引入。如果期望的话,还可以包括因子,包含但不限于白介素(例如il-2、il-3、il-6、il-11、il7、il12、ilis、il21以及其它白介素)、集落刺激因子(如g-、m-和gm-csf)、干扰素(例如γ-干扰素)和促红细胞生成素。
[0651]
组合物包含包括经基因修饰的免疫应答细胞或其祖细胞和药学上可接受的载体的药物组合物。施用可以是自体的或异源的。例如,免疫应答细胞或祖细胞可从一个受试者获得,并且施用于相同受试者或不同的相容受试者。本文所公开的外周血衍生的免疫应答细胞或其子代(例如体内、离体或体外衍生的)可以通过局部注射施用,包含导管施用、全身注射、局部注射、静脉内注射或肠胃外施用。当施用如本文所公开的治疗组合物(例如,含有经基因修饰的免疫应答细胞的药物组合物)时,通常将其调配成单位剂量可注射形式(溶液、悬浮液、乳液)。
[0652]
在另一个实施例中,本文公开了一种产生包括如本文所公开的car t细胞或其它免疫细胞和凋亡细胞或凋亡细胞上清液的组合物的方法,所述方法包括将对与所关注抗原结合的car编码的核酸序列引入t细胞或免疫细胞中。在可选实施例中,包括如本文所公开的car t细胞或其它免疫细胞的组合物与包括凋亡细胞或凋亡上清液的组合物分离。
[0653]
在一个实施例中,本文公开了一种治疗、预防、抑制恶性肿瘤、降低恶性肿瘤的发病率、改善或缓解恶性肿瘤的方法,所述方法包括施用包括表达嵌合抗原受体的t细胞(car t细胞)和凋亡细胞或凋亡细胞上清液的组合物的步骤。
[0654]
技术人员应理解,由经基因修饰的免疫细胞(例如,经car修饰的t细胞)引发的抗肿瘤免疫应答可以是主动免疫应答或被动免疫应答。另外,car介导的免疫应答可以是过继免疫疗法方法的一部分,其中经car修饰的t细胞诱导对car中的抗原结合部分具有特异性的免疫应答。
[0655]
技术人员应理解,免疫治疗可以涵盖使用免疫效应子细胞和分子靶向和破坏癌细胞。免疫效应子可以是例如对肿瘤细胞的表面上的一些标志物具有特异性的抗体。单独的抗体可以充当疗法的效应子,或者其可以募集其它细胞来实际实现细胞杀伤。抗体也可以与药物或毒素(化疗剂、放射性核素、蓖麻毒蛋白a链、霍乱毒素、百日咳毒素等)缀合并且仅充当靶向剂。可选地,效应子可以是携带与肿瘤细胞靶标直接或间接相互作用的表面分子的淋巴细胞。各种效应子细胞包含细胞毒性t细胞和nk细胞。
[0656]
在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于治疗、预防本领域已知的任何血液系统肿瘤、抑制所述任何血液系统肿瘤的生长或降低所述任何血液系统肿瘤的发病率。在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于治疗、预防本领域已知的任何弥漫性癌症(例如但不限于弥漫性乳腺癌,其中实体瘤未在乳房中形成)、抑制所述任何弥漫性癌症的生长或降低所述任何弥漫性癌症的发病率。在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于延长本领域已知的任何血液系统肿瘤的生存期时间。在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于延长本领域已知的任何弥漫性癌症(例如但不限于弥漫性乳腺癌,其中实体瘤未在乳
房中形成)的生存期时间。
[0657]
在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于增加患有本领域已知的任何血液系统肿瘤的受试者的存活率。在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于增加患有本领域已知的任何弥漫性癌症(例如但不限于弥漫性乳腺癌,其中实体瘤未在乳房中形成)的受试者的存活率。
[0658]
在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于降低本领域已知的任何血液系统肿瘤的生长速率。在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于降低本领域已知的任何弥漫性癌症(例如但不限于弥漫性乳腺癌,其中实体瘤未在乳房中形成)的生长速率。
[0659]
在一些实施例中,所治疗的肿瘤或癌症包括肿瘤或癌症的转移。在一些实施例中,本文中的使用方法预防或减少肿瘤或癌症的转移。在一些实施例中,本文中的使用方法抑制转移的生长或降低所述转移的发病率。
[0660]
在一些实施例中,所述受试者是人受试者。在一些实施例中,所述受试者是儿童。在一些实施例中,所述受试者是成人。在一些实施例中,所述受试者是哺乳动物。
[0661]
在一些实施例中,本文所公开的方法包括施用包括如上文详细描述的富集的单核细胞群的早期凋亡细胞群。在一些实施例中,本文所公开的方法包括施用包括稳定群细胞的早期凋亡细胞群,其中所述细胞群稳定超过24小时。上文已经详细描述了早期凋亡细胞的稳定群。在一些实施例中,本文所公开的方法包括施用包括不含细胞聚集体的细胞群的早期凋亡细胞群。上文已经详细描述了不含聚集体的早期凋亡细胞群和其制备方法。
[0662]
在一些实施例中,本文所公开的方法包括向有需要的受试者施用自体早期凋亡细胞群。在一些实施例中,本文所公开的方法包括向有需要的受试者施用同种异体早期凋亡细胞群。
[0663]
在一些实施例中,早期凋亡细胞群或其组合物的施用方法包括施用所述凋亡细胞群或其组合物的单次输注。在一些实施例中,可以将单次输注作为预防剂施用于预定有患上癌症或肿瘤的风险的受试者。在一些实施例中,可以将单次输注定期施用于患有癌症或肿瘤的受试者作为受试者治疗性治疗的一部分。在一些实施例中,可以将单次输注作为预防剂施用于患有癌症或肿瘤的受试者以便预防转移性癌症、降低转移性癌症的风险或延迟转移性癌症的出现。
[0664]
在一些实施例中,早期凋亡细胞群或其组合物的施用方法包括施用所述凋亡细胞群或其组合物的多次输注。在一些实施例中,可以将多次输注作为预防剂施用于预定有患上癌症或肿瘤的风险的受试者。在一些实施例中,可以将多次输注定期施用于患有癌症或肿瘤的受试者作为受试者治疗性治疗的一部分。在一些实施例中,可以将多次输注作为预防剂施用于患有癌症或肿瘤的受试者以便预防转移性癌症、降低转移性癌症的风险或延迟转移性癌症的出现。
[0665]
在一些实施例中,多次输注包括至少两次输注。在一些实施例中,多次输注包括2次输注。在一些实施例中,多次输注包括多于2次输注。在一些实施例中,多次输注包括至少3次输注。在一些实施例中,多次输注包括3次输注。在一些实施例中,多次输注包括多于3次输注。在一些实施例中,多次输注包括至少4次输注。在一些实施例中,多次输注包括4次输注。在一些实施例中,多次输注包括多于4次输注。在一些实施例中,多次输注包括至少5次
输注。在一些实施例中,多次输注包括5次输注。在一些实施例中,多次输注包括多于5次输注。在一些实施例中,多次输注包括至少六次输注。在一些实施例中,多次输注包括6次输注。在一些实施例中,多次输注包括多于6次输注。在一些实施例中,多次输注包括至少7次输注。在一些实施例中,多次输注包括7次输注。在一些实施例中,多次输注包括多于7次输注。在一些实施例中,多次输注包括至少8次输注。在一些实施例中,多次输注包括8次输注。在一些实施例中,多次输注包括多于8次输注。在一些实施例中,多次输注包括至少九次输注。在一些实施例中,多次输注包括9次输注。在一些实施例中,多次输注包括多于9次输注。在一些实施例中,多次输注包括至少10次输注。在一些实施例中,多次输注包括10次输注。在一些实施例中,多次输注包括多于10次输注。
[0666]
在一些实施例中,多次输注包括较少量的早期凋亡细胞,其中所施用的细胞的总剂量是输注的总和。
[0667]
在一些实施例中,在数小时的时间段内施用多次输注。在一些实施例中,在数天的时间段内施用多次输注。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少12小时。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少24小时。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少一天。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少两天。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少三天。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少四天。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少五天。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少六天。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少七天。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少一周。在一些实施例中,在数小时的时间段内施用多次输注,其中输注之间存在至少两周。
[0668]
在一些实施例中,多次输注中的细胞量基本上彼此相等。在一些实施例中,多次输注中的细胞量彼此不同。
[0669]
在一些实施例中,本文所描述的方法进一步包括向所述受试者施用另外的化疗剂或免疫调节剂。
[0670]
在一些实施例中,另外的化疗剂或免疫调节剂与早期凋亡细胞同时或基本同时施用。在一些实施例中,另外的化疗剂或免疫调节剂包括在与早期凋亡细胞相同的组合物中。在一些实施例中,另外的化疗剂或免疫调节剂包括在与早期凋亡细胞不同的组合物中。
[0671]
在一些实施例中,另外的化疗剂或免疫调节剂在施用早期凋亡细胞之前施用。在一些实施例中,另外的化疗剂或免疫调节剂在施用早期凋亡细胞之后施用。
[0672]
在一些实施例中,所述化疗剂包括烷化剂、氮芥(nitrogen mustard)、亚硝基脲、四嗪、氮丙啶、顺铂(cisplatin)和衍生物、非经典烷化剂、二氯甲基二乙胺、环磷酰胺(cyclophosphamide)、美法仑(melphalan)、苯丁酸氮芥、异环磷酰胺(ifosfamide)、白消安(busulfan)、n-亚硝基-n-甲基脲(mnu)、卡莫司汀(carmustine,bcnu)、洛莫司汀(lomustine,ccnu)、司莫斯汀(semustine,meccnu)、福莫司汀(fotemustine)、链脲佐菌素(streptozotocin)、达卡巴嗪(dacarbazine)、米托唑胺(mitozolomide)、替莫唑胺(temozolomide)、噻替派(thiotepa)、丝裂霉素(mitomycin)、亚丝醌(diaziquone,azq)、顺
铂、卡铂(carboplatin)、奥沙利铂(oxaliplatin)、丙卡巴肼(procarbazine)、六甲基三聚氰胺、抗代谢物、抗叶酸剂、甲氨蝶呤(methotrexate)、培美曲塞(pemetrexed)、氟嘧啶、氟尿嘧啶、卡培他滨(capecitabine)、脱氧核苷类似物、阿糖胞苷、吉西他滨(gemcitabine)、地西他滨(decitabine)、阿扎胞苷(azacitidine)、氟达拉滨(fludarabine)、奈拉滨(nelarabine)、克拉屈滨(cladribine)、氯法拉滨(clofarabine)、和喷司他丁(pentostatin)、硫嘌呤(thiopurines)、硫代鸟嘌呤(thioguanine)、巯嘌呤(mercaptopurine)、抗微管剂、长春花生物碱(vinca alkaloids)、紫杉烷(taxanes)、长春新碱(vincristine)、长春花碱(vinblastine)、半合成长春花生物碱、长春瑞滨(vinorelbine)、长春地辛(vindesine)、长春氟宁(vinflunine)、紫杉醇(paclitaxel)、多西他赛(docetaxel)、鬼臼毒素(podophyllotoxin)、依托泊苷(etoposide)、替尼泊苷(teniposide)、拓扑异构酶抑制剂、伊立替康(irinotecan)、托泊替康(topotecan)、喜树碱(camptothecin)、依托泊苷、多柔比星(doxorubicin)、米托蒽醌(mitoxantrone)、替尼泊苷(teniposide)、催化抑制剂、新生霉素(novobiocin)、美巴龙(merbarone)、阿柔比星(aclarubicin)、细胞毒性抗生素、蒽环类(anthracyclines)、博莱霉素(bleomycin)、丝裂霉素c(mitomycin c)、米托蒽醌(mitoxantrone)、放线菌素(actinomycin)、多柔比星、柔红霉素(daunorubicin)、表柔比星(epirubicin)、依达比星(idarubicin)、蒽环类、吡柔比星(pirarubicin)、阿柔比星(aclarubicin)、米托蒽醌、博莱霉素、丝裂霉素、靶向疗法、单克隆抗体、裸单克隆抗体、缀合的单克隆抗体、化学标记的抗体、双特异性单克隆抗体或其任何组合。
[0673]
在一些实施例中,免疫调节剂包括抗体或其功能片段。在一些实施例中,抗体或其功能片段包括单克隆抗体、单链抗体、fab片段、f(ab')2片段或fv片段。
[0674]
在一些实施例中,本文公开了本文所公开的多肽或肽结构域中任何多肽或肽结构域的活性片段。技术人员应理解,术语“片段”可以涵盖至少5个、10个、13个或15个氨基酸。在其它实施例中,片段是至少20个连续氨基酸。本文所公开的片段可以通过本领域技术人员已知的方法产生或者可以由正常的蛋白质加工产生(例如,将生物活性不需要的氨基酸从新生多肽去除或者将氨基酸通过替代性mrna剪接或替代性蛋白质加工事件去除)。
[0675]
术语“抗体”和“免疫球蛋白”在最广泛的意义上可互换使用并且具体是指保留抗体的结合活性的多克隆抗体、单克隆抗体或其任何片段。在某些实施例中,本文所公开的方法包括使用嵌合抗体、人源化抗体或人抗体。
[0676]
在一些实施例中,术语“抗体”是指能够如本文所描述的与期望靶标特异性相互作用(例如,与吞噬细胞结合)的完整分子以及其功能片段,如fab、f(ab')2和fv。在一些实施例中,所述抗体片段包括:
[0677]
(1)fab,可以通过用酶木瓜蛋白酶消化整个抗体以产生完整轻链和一条重链的一部分来产生的含有抗体分子的单价抗原结合片段的片段;
[0678]
(2)fab',可以通过用胃蛋白酶处理整个抗体、然后通过还原以产生完整轻链和重链的一部分来获得的抗体分子的片段;每个抗体分子获得两个fab'片段;
[0679]
(3)(fab')2,可以通过用胃蛋白酶处理整个抗体而无需随后的还原来获得的抗体的片段;f(ab')2是通过两个二硫键保持在一起的两个fab'片段的二聚体;
[0680]
(4)fv,含有表达为两条链的轻链可变区和重链可变区的基因工程化片段;以及
[0681]
(5)单链抗体("sca"),含有轻链可变区和重链可变区、通过适合的多肽连接子连接作为基因融合的单链分子的基因工程化分子。
[0682]
制备这些片段的方法是本领域已知的。(参见例如,harlow和lane,《抗体:实验室手册(antibodies:a laboratory manual)》,冷泉港实验室,纽约,1988,通过引用并入本文中)。
[0683]
在一些实施例中,抗体片段可以通过抗体的蛋白水解或通过对片段进行编码的dna在大肠杆菌或哺乳动物细胞中的表达(例如,中国仓鼠卵巢细胞培养或其它蛋白质表达系统)来制备。
[0684]
在一些实施例中,抗体片段可以通过常规方法通过胃蛋白酶或木瓜蛋白酶消化整个抗体来获得。例如,抗体片段可以通过用胃蛋白酶对抗体进行酶促切割以提供表示为f(ab')2的5s片段来产生。可以使用硫醇还原剂和任选地由二硫键的切割产生的巯基的保护基进一步切割这种片段以产生3.5s fab'单价片段。可选地,使用胃蛋白酶的酶促切割直接产生两个单价fab'片段和fc片段。这些方法例如由goldenberg,美国专利第4,036,945号和第4,331,647号以及其中含有的参考文献来描述,所述专利通过引用以其整体并入本文。还参见porter,r.r.,《生物化学期刊(biochem.j.)》,73:119-126,1959。只要片段与完整抗体所识别的抗原结合,还可以使用切割抗体的其它方法(如分离重链以形成单价轻链片段、进一步切割片段或其它酶促、化学或基因技术)。
[0685]
fv片段包括vh链和vl链的缔合。如inbar等人,《美国国家科学院院刊》69:2659-62,1972中所描述的,这种缔合可以是非共价的。可选地,可变链可以通过分子间二硫键连接或通过化学物质(如戊二醛)交联。优选地,fv片段包括通过肽连接子连接的vh链和vl链。这些单链抗原结合蛋白(sfv)可以通过构建包括对通过寡核苷酸连接的vh结构域和vl结构域进行编码的dna序列的结构基因来制备。将结构基因插入表达载体中,所述表达载体随后被引入宿主细胞(如大肠杆菌)中。重组宿主细胞通过桥接两个v结构域的连接子肽合成单一多肽链。用于产生sfv的方法例如由whitlow和filpula,《方法(methods)》,2:97-105,1991;bird等人,《科学》242:423-426,1988;pack等人,《生物技术(bio/technology)》11:1271-77,1993;和ladner等人,美国专利第4,946,778号(所述美国专利通过引用以其整体并入本文)来描述。
[0686]
抗体片段的另一种形式是对单个互补决定区(cdr)进行编码的肽。cdr肽(“最小识别单位”)可以通过构建对所关注抗体的cdr进行编码的基因来获得。例如,通过使用聚合酶链式反应从产生抗体的细胞的rna合成可变区来制备此类基因。参见例如,larrick和fry,《方法》,2:106-10,1991。
[0687]
在一些实施例中,如本文所描述的抗体或片段可以包括抗体的“人源化形式”。在一些实施例中,术语“抗体的人源化形式”是指非人(例如,鼠类)抗体,其是含有衍生自非人免疫球蛋白的最小序列的免疫球蛋白、免疫球蛋白链或其片段(如fv、fab、fab'、f(ab').sub.2或抗体的其它抗原结合亚序列)的嵌合分子。人源化抗体包含人免疫球蛋白(接受者抗体),其中来自接受者的互补决定区(cdr)的残基被来自具有期望的特异性、亲和力和能力的如小鼠、大鼠或兔等非人物种(供体抗体)的cdr的残基置换。在一些情况下,人免疫球蛋白的fv框架残基被对应的非人残基置换。人源化抗体还可以包括既未在接受者抗体中发现也未在输入的cdr或框架序列中发现的残基。通常,人源化抗体将包括至少一个并且典型
的两个可变结构域中的基本上所有可变结构域,其中所有或基本上所有cdr区对应于非人免疫球蛋白的那些区,并且所有或基本上所有fr区是人免疫球蛋白共有序列的那些区。人源化抗体最佳地还将包括免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白的至少一部分[jones等人,《自然》,321:522-525(1986);riechmann等人,《自然》,332:323-329(1988);和presta,《当代结构生物学评论(curr.op.struct.biol.)》,2:593-596(1992)]。
[0688]
用于人源化非人抗体的方法是本领域众所周知的。通常,人源化抗体具有从非人的来源引入到其的一个或多个氨基酸残基。这些非人氨基酸残基通常被称为“输入(import)”残基,所述输入残基通常取自“输入”可变结构域。人源化可以基本上按照winter和其同事的方法[jones等人,《自然》,321:522-525(1986);riechmann等人,《自然》332:323-327(1988);verhoeyen等人,《科学》,239:1534-1536(1988)]通过用啮齿动物cdr或cdr序列取代人抗体的对应序列来执行。因此,此类人源化抗体是嵌合抗体(美国专利第4,816,567号),其中已由来自非人物种的对应序列取代基本上少于完整的人可变结构域。在实践中,人源化抗体通常是其中一些cdr残基和可能的一些fr残基被来自啮齿动物抗体中的类似位点的残基取代的人抗体。
[0689]
人抗体还可以使用本领域已知的各种技术来产生,包含噬菌体展示文库[hoogenboom和winter,《分子生物学杂志(j.mol.biol.)》,227:381(1991);marks等人,《分子生物学(mol.biol.)》,222:581(1991)]。cole等人和boerner等人的技术还可用于制备人单克隆抗体(cole等人,《单克隆抗体与癌症疗法(monoclonal antibodies and cancer therapy)》,艾伦r利斯公司(alan r.liss),第77页(1985)和boerner等人,《免疫学杂志》,147(1):86-95(1991)]。类似地,可以通过将人免疫球蛋白基因座引入转基因动物(例如,其中内源性免疫球蛋白基因已被部分或完全灭活的小鼠)来制备人。激发后,观察到人抗体产生,其在所有方面与人类中所见到的密切相似,包含基因重排、组装和抗体库。这种方法描述于例如美国专利第5,545,807号;第5,545,806号;第5,569,825号;第5,625,126号;第5,633,425号;第5,661,016号中以及以下科学出版物中:marks等人,《生物技术》10,779-783(1992);lonberg等人,《自然》368 856-859(1994);morrison,《自然》368 812-13(1994);fishwild等人,《自然生物技术(nature biotechnology)》14,845-51(1996);neuberger,《自然生物技术》14,826(1996);和lonberg和huszar,《国际免疫学评论(intern.rev.immunol.)》13 65-93(1995)。
[0690]
在一些实施例中,所述免疫调节剂包括抗cd20单克隆抗体。在一些实施例中,所述抗cd20单克隆抗体是利妥昔单抗。利妥昔单抗可商购获得并以渤健公司(biogen)和美国基因泰克公司(genentech usa,inc.)联合推向市场的名称销售。
[0691]
在一些实施例中,本文所公开的方法包括一线疗法。
[0692]
技术人员应理解,术语“一线疗法”可以涵盖针对疾病的第一治疗。其通常是一组标准治疗的一部分,如手术然后进行化学疗法和放射。一线疗法单独使用时是被接受为最佳治疗的疗法。如果其不能治愈疾病或者其引起严重副作用,则可以添加或替代地使用其它治疗。也被称为诱导疗法、初级疗法和初级治疗。
[0693]
在一些实施例中,本文所公开的方法包括辅助疗法。
[0694]
技术人员应理解,术语“辅助疗法”可以涵盖除初级或初始治疗之外所给予的治疗。在一些实施例中,辅助疗法可以包括在进一步治疗的准备中在初级治疗之前给予的另
外的癌症治疗。在一些实施例中,辅助疗法可以包括在初级治疗之后给予另外的癌症治疗以降低癌症复发的风险。辅助疗法可以包含化学疗法、放射疗法、激素疗法、靶向疗法或生物疗法。
[0695]
在一些实施例中,本文所公开的方法减少微小残留疾病、增加缓解、增加缓解持续时间、降低肿瘤复发率、减小所述肿瘤的大小、降低所述肿瘤或所述癌症的生长速率、防止所述肿瘤或所述癌症的转移、或降低所述肿瘤或所述癌症的转移速率、或其任何组合。
[0696]
技术人员应理解,术语“微小残留疾病”可以涵盖在治疗期间或当患者没有疾病的症状或体征时在治疗后保留在患者体内的少量癌细胞。
[0697]
另外地,术语“缓解”可以涵盖癌症的体征和症状的减少或消失,尽管癌症可能仍在身体内。在一些实施例中,缓解可以包括部分缓解,其中癌症的一些但并非所有体征和症状已经消失。在一些实施例中,缓解包括完全缓解,其中癌症的所有体征和症状均已消失,尽管癌症可能仍在身体内。在一些实施例中,本文所公开的方法可以包括缓解诱导疗法,其中用早期凋亡细胞或其组合物进行初始治疗使癌症的体征或症状减少或使其消失。
[0698]
技术人员应理解,术语“复发”可以涵盖在一段时间的改善后疾病或疾病的体征和症状的再现。在一些实施例中,本文所使用的方法导致无复发的生存期,其中所述无复发的生存期涵盖癌症的初级治疗结束后患者在没有所述癌症的任何体征或症状的情况下存活的时间长度。
[0699]
恶性肿瘤
[0700]
在一些实施例中,car t细胞用于治疗、预防、抑制癌症或肿瘤、降低所述癌症或肿瘤的发病率、改善或缓解所述癌症或肿瘤的方法中,其中所述方法包括施用表达嵌合抗原受体的t细胞(car t细胞)的步骤。如本文所公开的,这些方法可以进一步包括为了抑制crs或细胞因子风暴或降低所述crs或细胞因子风暴的发病率而施用另外的药剂。
[0701]
在一些实施例中,本文所公开的方法增加受试者的存活率。在一些实施例中,本文公开了一种增加或延长患有弥漫性癌症的受试者的生存期的方法,所述方法包括向所述受试者施用早期凋亡细胞群的步骤,其中所述方法增加受试者的生存期(存活率)。
[0702]
在一些实施例中,癌症是b细胞恶性肿瘤。在一些实施例中,所述b细胞恶性肿瘤是白血病。在另一个实施例中,所述b细胞恶性肿瘤是急性成淋巴细胞性白血病(all)。在另一个实施例中,所述b细胞恶性肿瘤是慢性淋巴细胞性白血病。
[0703]
在一些实施例中,所述癌症是白血病。在一些实施例中,所述癌症是淋巴瘤。在一些实施例中,所述淋巴瘤是大b细胞淋巴瘤。
[0704]
在一些实施例中,本文所描述的方法使癌症或肿瘤的大小减小或降低所述癌症或肿瘤的生长速率,并且包括向所述受试者施用早期凋亡细胞群,其中所述方法使癌症或肿瘤的大小减小或降低所述癌症或肿瘤的生长速率。在一些实施例中,本文公开了降低弥漫性癌症的生长速率的方法,其包括向所述受试者施用早期凋亡细胞群的步骤,其中所述方法使所述癌症的生长速率降低。在一些实施例中,本文公开了减小实体癌或肿瘤的大小或降低所述实体癌或肿瘤的生长速率的方法,所述方法包括向受试者施用早期凋亡细胞群的步骤,其中所述方法使所述实体癌或肿瘤的大小减小或降低所述实体癌或肿瘤的生长速率。
[0705]
在一些实施例中,癌症可以包括实体瘤。在一些实施例中,实体瘤包括通常不含囊
肿或液体区域的异常组织块。实体瘤可以是良性的(不是癌症)或恶性的(癌症)。不同类型的实体瘤针对形成其的细胞的类型而命名。实体瘤的实例为肉瘤、癌和淋巴瘤。白血病(血液癌症)通常不会形成实体瘤。在一些实施例中,实体瘤包括肉瘤或癌。
[0706]
在一些实施例中,实体瘤是通过除血液、骨髓或淋巴细胞以外的身体组织细胞的异常生长形成的肿瘤(细胞的新生长)或病变(解剖结构的损伤或生理功能的扰乱)。在一些实施例中,实体瘤由异常细胞块组成,所述异常细胞块可能源于不同组织类型(如肝、结肠、乳房或肺)并且最初在其细胞来源的器官中生长。然而,此类癌症可能会在疾病的晚期阶段通过转移性肿瘤生长扩散到其它器官。
[0707]
在一些实施例中,实体瘤的实例包括肉瘤、癌和淋巴瘤。在一些实施例中,实体瘤包括肉瘤或癌。在一些实施例中,所述实体瘤是腹膜内肿瘤。
[0708]
在一些实施例中,实体瘤包括但不限于肺癌、乳腺癌、卵巢癌、胃癌、食道癌、宫颈癌、头颈癌、膀胱癌、肝癌和皮肤癌。在一些实施例中,实体瘤包括纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨性肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤,淋巴管内皮瘤血管肉瘤、滑膜瘤、间皮瘤、尤文氏瘤(ewing's tumor)、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌或肿瘤、乳腺癌或肿瘤、卵巢癌或肿瘤、前列腺癌或肿瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯瘤(wilm'stumor)、宫颈癌或肿瘤、子宫癌或肿瘤、睾丸癌或肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、神经鞘瘤、脑膜瘤、黑色素瘤、神经母细胞瘤或视网膜母细胞瘤。
[0709]
在一些实施例中,所述实体瘤包括肾上腺皮质肿瘤(腺瘤和癌)、癌、结肠直肠癌、硬纤维瘤、增生性小圆细胞肿瘤、内分泌肿瘤、尤文肉瘤、生殖细胞瘤、肝母细胞瘤、肝细胞癌、黑色素瘤、神经母细胞瘤、骨肉瘤、视网膜母细胞瘤、横纹肌肉瘤、除横纹肌肉瘤之外的软组织肉瘤、和威尔姆斯瘤。在一些实施例中,所述实体瘤是乳腺肿瘤。在另一个实施例中,所述实体瘤是前列腺癌。在另一个实施例中,所述实体瘤是结肠癌。在一些实施例中,所述肿瘤是脑肿瘤。在另一个实施例中,所述肿瘤是胰腺肿瘤。在另一个实施例中,所述肿瘤是结肠直肠肿瘤。
[0710]
在一些实施例中,如本文所公开的早期凋亡细胞或其组合物对癌症或肿瘤(例如,肉瘤和癌(例如,纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨性肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤文氏瘤、平滑肌肉瘤、横纹肌肉瘤)、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、维尔姆斯氏瘤、宫颈癌、子宫癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突神经胶质瘤、神经鞘瘤、脑膜瘤、黑素瘤、神经母细胞瘤和视网膜母细胞瘤)具有治疗和/或预防功效。
[0711]
在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于治疗、预防本领域已知的任何实体瘤、抑制所述任何实体瘤的生长或降低所述任何实体瘤的发病率。
[0712]
在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可以用于增加患有如
本文所公开的或本领域已知的任何实体瘤的受试者的存活率。
[0713]
在一些实施例中,如本文所公开的早期凋亡细胞和其组合物可用于使本文所公开的或本领域已知的任何实体瘤的大小减小或降低所述任何实体瘤的生长速率。
[0714]
在一些实施例中,癌症可以是弥漫性癌症,其中所述癌症广泛传播;非局部的或封闭的。在一些实施例中,弥漫性癌症可以包括非实体瘤。弥漫性癌症的实例包含白血病。白血病包括始于如骨髓等血液形成组织并且引起大量异常血液细胞生成并且进入血流的癌症。
[0715]
在一些实施例中,弥漫性癌症包括b细胞恶性肿瘤。在一些实施例中,所述弥漫性癌症包括白血病。在一些实施例中,所述癌症是淋巴瘤。在一些实施例中,所述淋巴瘤是大b细胞淋巴瘤。
[0716]
在一些实施例中,所述弥漫性癌症或肿瘤包括血液系统肿瘤。在一些实施例中,血液系统肿瘤是影响血液、骨髓和淋巴结的癌症类型。血液系统肿瘤可能衍生自两种主要的血细胞谱系:髓样细胞系和淋巴样细胞系。髓样细胞系通常产生粒细胞、红细胞、血小板、巨噬细胞和mast细胞,而淋巴样细胞系产生b细胞、t细胞、nk细胞和浆细胞。淋巴瘤(例如,霍奇金淋巴瘤)、淋巴细胞性白血病和骨髓瘤衍生自淋巴样系,而急性和慢性骨髓性白血病(aml、cml)、骨髓增生异常综合征和骨髓增生性疾病均起源于骨髓。
[0717]
在一些实施例中,非实体(弥漫性)癌症或肿瘤包括造血系统恶性肿瘤、血细胞癌、白血病、骨髓增生异常综合征、淋巴瘤、多发性骨髓瘤(浆细胞骨髓瘤)、急性成淋巴细胞性白血病、急性骨髓性白血病、慢性骨髓性白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤或浆细胞白血病。
[0718]
在另一个实施例中,如本文所公开的早期凋亡细胞和其组合物具有针对弥漫性癌症(例如但不限于白血病(例如,急性白血病、急性淋巴细胞性白血病、急性髓细胞性白血病、急性粒细胞性白血病、急性早幼粒细胞白血病、急性髓细胞单核细胞白血病、急性单核细胞性白血病、急性红白血病、慢性白血病、慢性髓细胞性白血病、慢性淋巴细胞性白血病)、真性红细胞增多症、淋巴瘤(霍奇金氏病、非霍奇金氏病)、瓦尔登斯特伦的巨球蛋白血症(waldenstrom's macroglobulinemia)、重链疾病)的治疗和/或预防功效。
[0719]
如本文公开的组合物和方法可以用于治疗、预防、抑制、改善本领域已知的任何血液系统肿瘤、降低所述任何血液系统肿瘤的发病率或缓解所述任何血液系统肿瘤。
[0720]
技术人员应理解,在某些实施例中,术语“包括”的使用可以被术语“基本上由
……
组成”或“由
……
组成”代替。技术人员应理解,术语“包括”旨在意指系统包含所列举的元素,但不排除可能是任选的其它元素。例如,包括早期凋亡细胞但不限于这个细胞群的组合物。进一步地,术语“基本上由
……
组成”可以涵盖如此方法,其包含所列举的要素(例如,基本上由早期凋亡细胞组成的组合物)但排除可能对方法的性能具有重要的显著影响的其它要素。因此,此种组合物仍然可以包含在治疗癌症中不包括基本活性的药学上可接受的赋形剂。进一步地,“由
……
组成”涵盖排除超过痕量的其它要素。因此,由早期凋亡细胞组成的此种组合物将不包含超过痕量的如本文所公开的其它要素。
[0721]
在一些实施例中,如本文所公开的方法可以表示为出于如本文所描述的各种治疗和预防目的而使用如本文所描述的组合物,或者可选地,出于如本文所描述的各种治疗和预防目的而在药物或治疗组合物或组合物的制备中使用如本文所描述的组合物。
[0722]
在一些实施例中,如本文所公开的组合物和方法包括各种组分或步骤。然而,在另一个实施例中,如本文所公开的组合物和方法基本上由各种组分或步骤组成,其中可以包含其它组分或步骤。在另一个实施例中,如本文所公开的组合物和方法由各种组分或步骤组成。
[0723]
在一些实施例中,术语“包括”可以涵盖包含组合物的本领域可能已知的影响组合物功效的其它组分。在一些实施例中,术语“基本上由
……
组成”包括具有表达嵌合抗原受体的t细胞(car t细胞)和凋亡细胞或任何凋亡细胞上清液的组合物。然而,可以包含不直接涉及组合物的用途的其它组分。在一些实施例中,术语“组成”涵盖如本文所描述的任何形式或实施例中的具有表达嵌合抗原受体的t细胞(car t细胞)和如本文所公开的凋亡细胞或凋亡细胞上清液的组合物。
[0724]
技术人员应理解,术语“约”可以涵盖与所指示的数字或数字范围存在0.0001%-5%之间的偏差。进一步地,所述术语可以涵盖与所指示的数字或数字范围存在1%-10%之间的偏差。另外,所述术语可以涵盖与所指示的数字或数字范围存在多达25%的偏差。
[0725]
技术人员应理解,除非上下文另有明确指示,否则单数形式“一个(a)”、“一种(an)”以及“所述(the)”包含复数指代物。例如,术语“药剂”或“至少一种药剂”可以包含多种药剂,包含其混合物。
[0726]
贯穿本技术,本文所公开的各个实施例可以采用范围格式来呈现。应当理解,采用范围格式的描述仅仅是为了方便和简洁起见,并且不应当解释为是对本公开的范围的非灵活限制。因此,对范围的描述应当被认为已经明确地公开了所有可能的子范围以及所述范围内的单独数值。例如,对如从1到6等范围的描述应当被认为是具有明确公开的子范围,如从1到3、从1到4、从1到5、从2到4、从2到6、从3到6等;以及所述范围内的单独数字,例如,1、2、3、4、5和6。无论范围的广度如何,这都适用。
[0727]
无论何时在本文中指示数值范围,其意图包含在所指示的范围内的任何引用的数字(分数或整数)。短语第一指示数字与第二指示数字“之间的变动范围/范围”以及从第一指示数字“到”第二指示数字的“变动范围/范围”在本文中可互换使用,并且意指包含所述第一指示数字和第二指示数字以及在其之间的所有分数和整数。
[0728]
给出以下实例是为了更全面地展示本文所公开的实施例。然而,所述实例决不应该被解释为限制本公开的广泛范围。
[0729]
实例
[0730]
实例1:凋亡细胞产生
[0731]
目的:产生早期凋亡细胞。
[0732]
方法:制备早期凋亡细胞群的方法已经充分记录于国际公开第wo 2014/087408号和美国申请公开第us2015/0275175-a1中,参见例如实例之前的“早期凋亡细胞群制备”和“凋亡细胞的产生”处的方法部分(第[0223]段到第[0288]段)以及实例11、12、13和14,所述公开以其整体并入本文中。
[0733]
图1中所呈现的流程图提供了在产生早期凋亡细胞群的过程期间所使用的步骤的一个实施例的概述,其中解冻和诱导凋亡步骤中包含抗凝血剂。如在国际公开号第wo2014/087408号的实例14和美国申请公开第us us-2015-0275175-a1号中详细描述的,制备了早期凋亡细胞群,其中在冷冻时、或在温育时、或在冷冻时和在温育时添加了抗凝血剂。所使
用的抗凝血剂是酸性柠檬酸盐葡萄糖,向nih配方a(acd配方a)补充10u/ml肝素到最终浓度为总体积的5%acd和0.5u/ml肝素。
[0734]
简而言之:收集细胞,并且然后将其在向冷冻培养基添加5%抗凝血剂柠檬盐葡萄糖配方a和10u/ml肝素(acdhep)的情况下冷冻。解冻、在含有5%acdhep的凋亡诱导培养基中温育以及最终产物制备在封闭系统中进行。
[0735]
在每个实验中进行凋亡和活力分析、效力测定和细胞群表征。为了在早期凋亡细胞产物的产生中建立一致性,将初始批次的凋亡细胞的最终产物(fp)储存在2-8℃下,并在t0、t24小时、t48小时和t72小时对其进行检查。在每个点处进行凋亡分析、短效力测定(申请者cd14 冷冻细胞)、台盼蓝测量和细胞群表征。对fp的细胞计数进行测试以评估储存和凋亡以及活力析期间的平均细胞损失。
[0736]
上文所引用的方法部分以及国际公开第wo 2014/087408号的实例11和美国申请公开第us us-2015-0275175-a1号提供了在不存在抗凝血剂的情况下制备凋亡细胞群的其它实施例的细节并且完整并入本文中。
[0737]
制备经辐照的凋亡细胞的方法:使用类似的方法来制备灭活的凋亡细胞群,其中单核早期凋亡细胞群包括降低百分比的非静止非凋亡细胞、或具有任何活的非凋亡细胞的遏制的细胞活化的细胞群、或具有任何活的非凋亡细胞的减少的增殖的细胞群或其任何组合。
[0738]
简而言之,通过白细胞去除术程序从健康的、有资格的供体收集富集的单核细胞级分。单采血液成分术完成后,将细胞洗涤并用包括5%抗凝血剂柠檬酸盐葡萄糖溶液-配方a(acd-a)和0.5u/ml肝素的冷冻培养基重悬。然后将细胞逐渐冷冻并转移到液氮以长期储存。
[0739]
为了制备经辐照的apocell,将低温保存的细胞解冻、洗涤并用包括5%acd-a、0.5u/ml肝素钠和50μg/ml甲基泼尼松龙的凋亡诱导培养基重悬。然后,将细胞在37℃下在5%co2中温育6小时。温育结束时,使用细胞加工系统(费森尤斯卡比公司(fresenius kabi),德国)将细胞收集、洗涤并重悬于哈特曼氏溶液中。制备完成后,在放射疗法装置(哈达莎埃因卡勒姆)处使用g相机以4000cgy对apocell进行辐照。通过流式细胞仪使用膜联蛋白v和pi(美国马萨诸塞州mbl)染色(分别≥40%和≤15%)测定apocell的凋亡和活力。使用fcs express软件对结果进行分析。
[0740]
这个经辐照的apocell群被认为包含早期凋亡细胞,其中存在的任何活细胞的细胞活性遏制且增殖能力降低或没有增殖能力。在某些情况下,apocell群没有活的非凋亡细胞。
[0741]
结果:
[0742]
下文在表3中示出了在冷冻和温育(凋亡诱导)时包含抗凝血剂的情况下产生的并且然后在2-8℃下储存的fp的稳定性。
[0743]
表3:细胞计数*-使用micros 60血液学分析仪进行
[0744]
fp时间点细胞浓度(
×
106个细胞/ml)细胞损失的%t020.8nat24h20.0-3.85t48h20.0-3.85
t72h19.7-5.3
[0745]
*结果代表6(六)次实验。
[0746]
当在诱导培养基中不包含抗凝血剂的情况下制备细胞时,细胞稳定24小时并且此后较不稳定。如表3中所示出的,使用抗凝血剂出乎意料地使凋亡细胞群的稳定性延长至少72小时。
[0747]
表4:台盼蓝测量
[0748]
fp时间点台盼蓝阳性细胞(%)t03.0t24h5.9t48h5.2t72h6.5
[0749]
表4的结果示出fp的活力保持高持续至少72小时。
[0750]
表5:凋亡分析-(anpi染色)使用流式细胞术进行
[0751][0752]
表5的结果示出,在制备细胞后至少72小时的延长的时间段内,凋亡细胞对坏死细胞的百分比得以维持,早期凋亡细胞的百分比也是如此。.
[0753]
冷冻时和诱导凋亡期间均包含抗凝血剂导致稳定的早期凋亡细胞的产率最一致地高(早期凋亡细胞的平均产率为61.3
±
2.6%%对48.4
±
5.0%,其中100%产率基于冻结时的细胞数量)。即使在2-8℃下储存24小时后仍维持这种高产率。
[0754]
接下来,对在冷冻时或在解冻时或在两者时包含抗凝血剂之间进行比较,其中对回收百分比(%)以及稳定性进行了测量。所有群的凋亡温育混合物中均包含抗凝血剂。表6呈现了这些研究的结果。
[0755]
表6:对在冷冻(“f”)和解冻(“tha”)期间添加(“ ”)或未添加(
“‑”
)抗凝血剂的情况下从所收集的细胞制备的最终产物(fp)进行的产率和稳定性比较。
[0756][0757]
对在添加和未添加抗凝血剂的情况下制备的早期凋亡细胞群(细胞批次)进行的另外的群分析比较示出了这些结果的一致性。
[0758]
表7:在添加和未添加抗凝血剂的情况下制备的批次之间进行的细胞群分析比较
[0759][0760][0761]
在存在或不存在抗凝血剂的情况下的最终产物细胞(产率)的百分比。与上文在表3处所呈现的结果相似,表6中所呈现的数据证实,与在没有抗凝血剂的情况下冷冻的细胞相比,从在存在抗凝血剂的情况下冷冻的细胞制备的早期凋亡细胞对新鲜最终产物(fp t0)的平均产率产生有益效应。当在仅冷冻(61.3
±
2.6%对48.4
±
5.0%)或冷冻和解冻两者(56.5
±
5.2%对48.4
±
5.0%)时使用抗凝血剂时,看到有益效应。当在仅解冻(44.0
±
8.5%对48.4
±
5.0%)时使用抗凝血剂时,有益效应不太显著。这些是非高甘油三酸酯样品。
[0762]
抗凝血剂对聚集的效应。在这3个非高甘油三酸酯样品或21个另外的样品(数据未示出)中均未看到细胞聚集。然而,在41个在没有抗凝血剂的情况下制备的其它非高甘油三酸酯样品中(数据未示出),在10个(24.4%)中看到轻度聚集体并且在5个(12.2%)中看到
严重聚集体;因此,抗凝血剂完全避免细胞聚集体。
[0763]
抗凝血剂对稳定性的效应。将在具有或没有抗凝血剂的情况下制备的新鲜fp储存在2-8℃下24小时以测定向制备程序添加acdhep是否会损害fp的稳定性。储存24小时后对细胞进行采样,并计算细胞计数的产率。与表3中所示出的延长的时间段(长达72小时)的结果类似,表6示出了当在仅冷冻(59.8
±
2.1%对47.5
±
4.7%)或冷冻和解冻两者(56.4
±
5.3%对47.5
±
4.7%)时使用抗凝血剂时,有益效应保持并被观察到。当仅在解冻时添加抗凝血剂时,有益效应不太显著(42.4
±
6.1%对47.5
±
4.7%)。这些是所有非高甘油三酸酯样品。这些结果示出,在所有处理中,fp储存24小时后细胞损失最小,对在冷冻和解冻两者期间用抗凝血剂处理的细胞具有显著优势。相较于没有抗凝血剂的1.9
±
3.3%,在仅冷冻期间用抗凝血剂处理的细胞的平均损失为2.3
±
3.2%;相较于没有抗凝血剂的1.9
±
3.3%,仅解冻时为3.0
±
4.7;并且相较于没有抗凝血剂的1.9
±
3.3%,将细胞在具有acdhep的情况下冷冻和解冻两者时为0.2
±
0.4%。总之,抗凝血剂对产率的有益效应保持至少24小时。
[0764]
下文在表8中示出了fp的代表性细胞群的特征。
[0765]
表8:对在冷冻(“f”)程序和解冻(“tha”)程序期间添加(“ ”)或未添加(
“‑”
)抗凝血剂的情况下从所收集的细胞制备的新鲜(t0)fp的细胞群的表征。*
[0766][0767]
*所有批次均使用含有抗凝血剂的培养基进行凋亡的诱导。
[0768]
表8的结果示出了在冷冻和解冻时在具有或没有抗凝血剂的情况下制备的最终产物(fp)的细胞特征。对批次进行采样,进行单核标志物染色,并通过流式细胞术进行分析以测定每个样品中的细胞分布并检查添加抗凝血剂是否影响细胞群。如表7中所呈现的,在冷冻或解冻时在具有或没有抗凝血剂的情况下制备的细胞群中未检测到显著差异。相较于冷冻前的62.9
±
1.1%,新鲜fp中的平均t细胞群(cd3 细胞)在治疗之间为62.3
±
1.2%;相较于冷冻前的3.1
±
0.8%,平均b细胞群(cd19 细胞)在治疗之间为8.3
±
2.5%;相较于冷冻前的12.9
±
0.5%,平均自然杀伤细胞群(cd56 细胞)在治疗之间为9.5
±
0.7%;相较于冷冻前的17.5
±
0.3%,平均单核细胞细胞群(cd14 细胞)在治疗之间为13.8
±
0.5%;并且相较于冷冻时的0.35
±
0.2%,新鲜fp中的平均粒细胞群(cd15 细胞)为0.0%。
[0769]
还对早期凋亡群的效力进行了检查。
[0770]
表9:对在冷冻(“f”)程序和解冻(“tha”)程序期间添加(“ ”)或未添加(
“‑”
)抗凝血剂的情况下从细胞制备的新鲜(t0)fp的效力分析。
[0771][0772]
表9中所呈现的结果来自进行以测定每个最终产物在用(lps)刺激后增强未成熟树突状细胞(idc)中的耐受性状态的能力的效力测定。通过评估idc上的共刺激分子hla-dr和cd86表达在与早期凋亡细胞群相互作用和导致lps上调的不同处理后的下调来测定耐受性效应。在dcsign 细胞上进行分析。结果表示与早期凋亡细胞群相互作用后和添加lps后的成熟延迟对lps诱导的成熟的百分比。实验对在具有或没有抗凝血剂的情况下制备的新鲜fp(t0)的效力进行了测试。表9中所呈现的结果示出在具有或没有抗凝血剂的情况下制备的凋亡细胞以剂量依赖性方式增强两种共刺激标志物的耐受性效应。
[0773]
本文所产生的早期凋亡细胞来自非高甘油三酸酯样品。即使在供体血浆中甘油三酸酯含量高的情况下,稳定的早期凋亡细胞的这种一致高产率也会产生(参见例如,国际公开第wo 2014/087408号的实例12和13以及美国申请公开第us us-2015-0275175-a1号)。注意,未将抗凝血剂添加到用于调配供输注的最终早期凋亡细胞剂量的pbs培养基。
[0774]
汇总
[0775]
这项研究的目的是产生稳定的、高产率的早期凋亡细胞群。使用抗凝血剂的合理性在于,首先在甘油三酸酯含量高的患者中看到聚集体,但是随后才在很大一部分的其它患者中看到聚集体。此处关注的是美国专利第us 6,489,311号中的公开内容,即抗凝血剂的使用阻止细胞凋亡。
[0776]
简而言之,在对细胞的组合物、活力、稳定性和凋亡性质产生最小影响的情况下,最终产物(产率)中的所收集的细胞的数量在添加有抗凝血剂时显著提高至少10%-20%。在这项研究中示出了产率提高多达13%,这表示在受控条件下产率增加26.8%,但是在实际gmp条件下,产率提高多达33%,并且然后可以在单次收集中产生细胞数量的更大增加。这种效应至关重要,因为其可以避免对从供体进行第二次单采血液成分术的需要。
[0777]
这种效应是令人惊讶的,因为预计预期的影响是轻度聚集体的溶解。已经假设,在具有抗凝血剂的情况下解冻细胞会减小聚集体的量。这些聚集体在形成时最终会导致大量细胞损失。在没有抗凝血剂的情况下收集并冷冻的细胞证实聚集体在洗涤后立即在解冻时形成。此外,在没有抗凝血剂的情况下冷冻并用含有抗凝血剂的培养基重悬的细胞中也检测到高水平的聚集体。在用含有抗凝血剂的培养基冷冻并重悬的细胞中未看到聚集体。总之,得出结论:在冷冻和凋亡诱导期间添加抗凝血剂非常重要,并且似乎没有对细胞群的早期凋亡的诱导造成负面影响。
[0778]
出于稳定性目的而例如在2-8℃下储存24小时后进一步对早期凋亡细胞的回收进行了测试,在此期间测量到平均细胞损失为3-4.7%(无论制备条件如何),对于用含有抗凝血剂的培养基冷冻和解冻的细胞,结果令人满意(fp储存24小时后细胞损失为0.2
±
0.4%),这表明在冷冻和解冻期间添加抗凝血剂至关重要,但是一旦最终调配成,早期凋亡细胞群是稳定的。延长的时间点研究示出这种稳定性达到至少72小时。
[0779]
在冷冻和/或解冻阶段添加抗凝血剂不会显著影响fp产物的凋亡和活力以及细胞组合物。根据各种特征测量到的值是类似的,这指示acdhep不会改变早期凋亡细胞的特征并且最终产物满足≥40%凋亡细胞的接受标准。
[0780]
用于测试凋亡细胞效力的测定基于未成熟树突状细胞(idc),其是特征在于如吞噬作用、抗原呈递和细胞因子产生等功能的dc。
[0781]
选择hla-dr(mhc ii类)膜分子和共刺激分子cd86作为标志物以检测抗原呈递细胞(apc)的耐受性效应。使用流式细胞术,在用lps刺激后以及在存在具有或没有抗凝血剂的情况下制备并用lps刺激的早期凋亡细胞群的情况下测量idc上的hla-dr和cd86的表达的变化。将早期凋亡细胞群以1:2、1:4和1:8idc:早期凋亡细胞群的递增比率提供给dc。如表6中所呈现的,示出了早期凋亡细胞群相较于经刺激的dc以剂量依赖性方式增强了耐受性效应,在冷冻和凋亡诱导两者时在具有抗凝血剂的情况下制备的早期凋亡细胞群的结果稍微更好。
[0782]
总之,得出结论:向冷冻培养基和凋亡培养基两者添加抗凝血剂对于提高细胞回收和避免由于聚集体而造成的大量细胞损失以及避免在许多情况下从供体进行第二轮单采血液成分术而言非常重要。示出了所有细胞均满足经过验证的fp的接受标准,这指示添加抗凝血剂不会损害fp。
[0783]
实例2:凋亡细胞对体外细胞因子风暴模型中的细胞因子风暴的效应
[0784]
目的:对凋亡细胞对在巨噬细胞活化综合征的lps无菌模型中诱导的细胞因子风暴中的细胞因子风暴标志物(细胞因子il-6、il-10、mip-1α、il-8、tnf-α、mip-1β、mcp-1和il-9)的水平的效应进行测试。
[0785]
方法
[0786]
细胞系和培养试剂
[0787]
将人淋巴瘤细胞系raji(ecacc,英国,登录号85011429)、人宫颈腺癌细胞系海拉(atcc,美国,编号:ccl-2)和海拉-cd19(普迈生物技术有限公司,美国,目录号pm-海拉-cd19)在下文称为“完全培养基”的补充有10%fbs(gibco,赛默飞世尔科技公司(thermofisher scientific),南美,目录号12657-029)、2mm glutamax(gibco,赛默飞世尔科技公司,美国,目录号35050-038)和100u/ml青霉素 100u/ml链霉素(gibco,赛默飞世尔科技公司,美国,目录号15140-122)的rpmi 1640(gibco,赛默飞世尔科技公司,美国,目录号31870-025)中培养。在标准培养期间,向海拉-cd19培养基进一步补充1μg/ml嘌呤霉素(西格玛奥德里奇公司(sigma-aldrich),美国,目录号p9620)作为选择性抗生素。
[0788]
将所有细胞保持在亚汇合条件下。将raji细胞维持在0.3
×
10
6-2
×
106个细胞/ml的浓度范围内。当接受器被填充到90%汇合时,将海拉和海拉-cd19细胞传代。
[0789]
从血液贡献的血沉棕黄层(以色列舍巴医学中心(sheba medical center))分离原代单核细胞。首先,在ficoll密度梯度(ficoll-paque plus,ge医疗公司(ge healthcare),英国,目录号17-1440-03)上分离外周血单核细胞(pbmc)。离心(800x g,2-8℃,20分钟,中断为0)后,将含有pbmc的中间相转移到新鲜试管,并用下文称为“洗涤培养基”的补充有2mm l-谷氨酰胺(龙沙集团(lonza),瑞士,目录号be17-605e)和10mm hepes
(龙沙集团,瑞士,目录号be17-737b)的rpmi-1640(龙沙集团,瑞士,目录号be12-918f)洗涤,并离心(650x g,2-8℃,10分钟)。将沉淀的细胞重悬于“洗涤培养基”中至15
×
106个细胞/ml的浓度。将细胞以0.9ml滴接种在35-mm板(康宁公司,美国,目录号430165)的中心处。将板在加湿温育箱中温育1.5小时(37℃,5%co2),使单核细胞贴壁,并且然后用预温热的pbs(龙沙集团,瑞士,目录号be17-516f)洗涤三次,去除其它细胞类型。洗涤后,将细胞在又称为“完全培养基”的补充有10%fbs(gibco,赛默飞世尔科技公司,南美,目录号12657-029)、2mm glutamax(gibco,赛默飞世尔科技公司,美国,目录号35050-038)和100u/ml青霉素 100u/ml链霉素(gibco,赛默飞世尔科技公司,美国,目录号15140-122)的2ml rpmi 1640(gibco,赛默飞世尔科技公司,美国,目录号31870-025)中培养。
[0790]
将所有细胞系在37℃下和含有5%co2的加湿温育箱中培养。
[0791]
简而言之,并按照制造商的指南,将靶细胞(海拉或海拉-cd19)单独培养或与单核细胞结合培养。在靶细胞贴壁到板(6小时-过夜)后,将培养物暴露于y
×
106个apocell细胞1小时,之后通过4-5次rpmi洗涤将这些细胞洗涤掉。在光学显微镜下在视觉上确认apocell细胞的去除。将10ng/ml lps(西格玛奥德里奇公司,美国,目录号l4391)引入到共培养物并温育1小时。温育后,将lps用rpmi通过3-5个洗涤周期去除。以一种或多种指定的e/t比率添加活的cd19-car t细胞或原初t细胞,并将其温育4小时。为了收集培养基,将板以250x g、在2-25℃下离心4分钟(离心机5810r,eppendorf,德国)使细胞沉降。将来自每个孔的50μl的上清液培养基转移到新鲜的平底96孔微板孔(康宁公司,美国,目录号3596)中,并向每个孔添加50μl的cytotox 96试剂。将板于黑暗中在室温下温育30分钟,之后通过每孔添加50μl终止溶液来终止反应。使用infinite f50(帝肯(tecan),瑞士)在492nm处读取并使用magellan f50软件捕获吸光度。使用microsoft excel 2010执行数据分析和图形生成。
[0792]
与凋亡细胞一起温育或与来自凋亡细胞的上清液一起温育后,使用liminex技术进行对细胞因子释放的分析。
[0793]
结果:图4a到4h示出了体外巨噬细胞活化综合征模型中的由lps诱导的细胞因子风暴标志物il-10、il-6、mip-1α、il-8、tnf-α、mip-1β、mcp-1和il-9的水平显著降低。虽然施用apocell以实现巨噬细胞:apocell比率为1:8导致释放到培养基中的il-10、il-6、mip-1α、il-8、tnf-α、mip-1β、mcp-1和il-9的水平显著降低(图4a、4b、4c、4d、4e、4f、4g、4h),但是施用apocell以实现巨噬细胞:apocell比率为1:16实际上抑制或几乎抑制这个模型中的细胞因子il-10、il-6、mip-1α、il-8、tnf-α、mip-1β、mcp-1和il-9的释放。
[0794]
添加凋亡细胞导致巨噬细胞活化中所诱导的至少20个促炎性细胞因子和趋化因子得到抑制,在图4a-4h中示出了结果的样品。促炎性细胞因子和趋化因子的共同机制是nf-κb抑制。
[0795]
对促炎性细胞因子和趋化因子的释放的抑制似乎是特异性的,因为在类似条件下对细胞因子il-2r(il-2受体)水平的检查示出所释放的il-2r水平没有以与促炎性细胞因子相同的方式受到影响。(图4i)。以1:4和1:8的比率添加凋亡细胞使il-2r的释放有所增加。进一步地,图4j示出了凋亡细胞在24小时的时间段内对il-2的释放没有影响。il-2受体的活化被认为在免疫系统的关键功能(包含耐受性)中起重要作用。
[0796]
结论:在存在癌症和car-19的情况下向巨噬细胞活化综合征的细胞因子风暴模型中添加早期凋亡细胞导致促炎性细胞因子(例如,il-10、il-6、mip-1α、il-8、tnf-α、mip-1
β、mcp-1和il-9)显著减少并且令人惊讶地甚至得到防止,而细胞因子il-2r水平有所提高或未受影响。因此,此处结果示出,虽然通过与凋亡细胞一起温育使促炎性细胞因子有所减少,但是用早期凋亡细胞的温育没有以相同方式影响il-2和il-2r。因此,t细胞相关细胞因子不受car t细胞疗法 凋亡细胞的影响,而先天免疫细胞因子(例如从单核细胞、巨噬细胞和树突状细胞释放的那些先天免疫细胞因子)受其影响。
[0797]
实例3:凋亡细胞在未对car-t细胞功效造成负面效应的情况下对细胞因子风暴的效应
[0798]
目的:对凋亡细胞或源自凋亡细胞的上清液对细胞因子风暴标志物细胞因子的效应和car t细胞针对肿瘤细胞的功效进行测试。
[0799]
方法:
[0800]
t4 car t细胞
[0801]
使用据报告在小鼠体内诱导细胞因子风暴的实体瘤模型(van der stegen等人,2013同上)。在这个模型中,用靶向某些erbb二聚体的嵌合抗原受体(car)对t细胞进行工程化(t4
car-t细胞),其在特定的实体瘤(如头颈瘤和卵巢癌)中通常会被高度上调。使用cd3微珠从与外周血分离的pbmc分离t细胞。构建含有嵌合t4 受体的载体,并将其转导到分离的t细胞中,从而产生t4 car t细胞。对于本文中进行的实验,t4 car t细胞购自创新实验室(美国纽约)或普迈生物技术有限公司(美国加利福尼亚州)。图5呈现了使用抗cd124单克隆抗体验证t4 car t细胞上的4αβ嵌合受体的表面表达的流式细胞术曲线(wilkie等人,同上)。另外,进行pcr程序,并且其验证了经转导的t细胞中的载体的存在。
[0802]
skov3-luc细胞
[0803]
skov3-luc卵巢腺癌组织培养细胞购自细胞实验室(cell biolabs)(目录号akr-232)。skov3-luc高度表达erbb受体并且是t4
car-t细胞的靶标(van der stegen等人,2013,同上)。这些细胞已经进一步繁殖以组成性地表达萤火虫荧光素酶基因,从而允许对体外细胞增殖和体内肿瘤生长和消退进行跟踪。
[0804]
凋亡细胞
[0805]
按照实例1制备凋亡细胞。
[0806]
凋亡细胞上清液
[0807]
在12孔板中每孔接种八(8)百万个凋亡细胞。24小时后,将细胞离心(290g,4摄氏度,10分钟)。收集上清液,并将其以等分试样冷冻在-80度下,直到使用。使用不同数量的细胞来制备上清液。一些等分试样含有浓缩上清液。
[0808]
单核细胞分离
[0809]
使用ficoll(ge医疗公司,英国)从健康的、有资格的供体获得的外周血/血沉棕黄层分离pbmc。使细胞在rpmi1640(gibco,赛默飞世尔科技公司,美国马萨诸塞州)中达到15
×
106个细胞/ml的浓度,并将其以0.9ml滴接种在35mm板(康宁公司,美国纽约)的中间。然后将板在37℃下在5%co2中温育1小时。温育结束时,将细胞用pbs(生物工业有限公司(biological industries),以色列拜特埃梅克)洗涤三次,并使用光学显微镜对贴壁进行测定。然后将细胞与完全培养基(rpmi1640 10%热灭活的fbs 1%glutamax 1%penstrep,均来自gibco)一起温育。
[0810]
还使用了替代性单核细胞分离方法,其中通过密度梯度离心将人单核细胞从肝素
化外周血分离。然后通过磁珠分离(美天旎生物技术有限公司(miltenyi biotec.),奥本,加利福尼亚州,美国)通过阳性选择单核细胞作为cd14 级分、阳性选择b-细胞作为cd22 分数并且阴性选择t细胞作为cd14-cd22-级分来将分离的单核细胞分成单核细胞群、b细胞群和t细胞群。单核细胞的纯度大于95%。
[0811]
对于巨噬细胞分化,在贴壁结束时,将细胞用pbs洗涤三次,然后与rpmi1640 1%glutamax 1%penstrep和10%热灭活的人ab血清(西格玛,美国密苏里州)一起温育。将细胞在37℃和5%下温育7-9天,在第3天和第6天时进行培养基更换。通过光学显微镜通过形态测定分化。
[0812]
来自apo 单核细胞的上清液
[0813]
将cd14 单核细胞与如上文所制备的凋亡细胞以1:16的比率培养24小时。单核细胞数量为:在12孔板中每孔50万个细胞,并且凋亡细胞数量为:在12孔板中每孔800万个细胞。温育24小时后,将细胞离心(290g,4摄氏度,10分钟)。收集上清液,并将其以等分试样冷冻在-80度下,直到使用为止。可以以不同比率的单核细胞:凋亡细胞和/或使用其它细胞来源(如巨噬细胞和树突状细胞)进行类似的程序。
[0814]
体外培养条件
[0815]
通过将skov3-luc癌细胞与凋亡细胞或凋亡上清液一起温育1小时、然后与t4 car t细胞( /-单核细胞-巨噬细胞)共培养48小时来进行初始实验。
[0816]
为了模拟体内条件,1
×
105个thp-1细胞/ml(美国htcc)或单核细胞或巨噬细胞或树突状细胞将用200nm(123.4ng/ml)佛波醇肉豆蔻酸乙酸酯(pma)分化72小时,并且然后将在完全培养基中在没有pma的情况下培养另外24小时。接下来,癌症或肿瘤细胞(例如,skov3-luc细胞)将以5
×
105个skov3-luc细胞/孔平板接种在24孔板中在分化的thp-1细胞上。在癌症或肿瘤细胞的初始培养后,4
×
10
5-8
×
105个凋亡细胞(apocell)将添加到培养物持续1-3小时以诱导免疫耐受环境。将对每种细胞类型的癌细胞与apocell的比率进行优化。洗涤后,共培养物将用10ng/ml lps进行处理,之后将添加1
×
106个t4
car t细胞(或将通过效应子/靶标比率图测定的数量)。肿瘤细胞和t4 car t细胞的比率将有所不同,以便针对每种肿瘤或癌细胞类型生成效应子/靶标(e/t)比率图。
[0817]
为了测定skov3癌细胞的细胞毒性,制备了裂解物,并在48小时温育期后对荧光素酶活性进行了测定。将进行对其它癌细胞类型的癌症或肿瘤细胞的细胞毒性进行测定的另外的实验并且将以48小时温育时间段内的间隔进行。可选地,将使用普洛麦格公司的cytotox 96非放射性细胞毒性测定(普洛麦格公司,目录号g1780)。
[0818]
裂解物制备
[0819]
将skov3-luc单层用pbs洗涤以去除任何残留血清并添加70μl cclr裂解缓冲液
×
1/孔(用于24孔板)来制备skov3-luc细胞裂解物。通过对孔底部进行物理刮擦来进一步增强脱离。涡旋15秒后,将裂解物在4℃下以12,000g离心2分钟。收集上清液,并将其储存在-80℃下。
[0820]
体外荧光素酶活性
[0821]
为了检测培养物中的skov3-luc细胞中的荧光素酶活性,使用荧光素酶测定系统(普洛麦格公司,目录号e1501)。用光度计读数器(耶路撒冷希伯来大学(hebrew university of jerusalem)的哈达莎埃因卡勒姆医学院的核心设施)对这个试剂盒的校准
通过使用quantilum重组荧光素酶(普洛麦格公司,目录号e170a)来进行。使用612ag-61.2μg(10-20-10-9
摩尔)来测定检测范围并按照制造商的指南。简而言之,将20μl体积的每个荧光素酶量放置在黑色96孔板(nunc)的孔中。每个量一式三份地进行。将100μl lar(来自荧光素酶测定系统试剂盒的荧光素底物)添加到每个孔并在暴露10秒钟后立即读取。
[0822]
为了进行荧光素酶活性读取,将裂解物在冰上解冻,并将20μl样品放置于黑色96孔板(nunc)中。每个样品一式两份地读取。添加100μl lar,并且每2.5分钟读取一次10秒钟曝光时间段的发光,持续25分钟,并在随后的10分钟内每40秒进行一次读取。
[0823]
细胞因子分析
[0824]
对il-2、il-2受体(il-2r)、il-6、il-1α、il-4、il-2、tnf-α进行了初始测定。为了对il-2、il-2受体(il-2r)、il-6、il-1α、il-4、il-2、tnf-α以及其它细胞因子的细胞因子释放减少进行测定,收集上清液,并使用luminex magpix读数器和elisa测定针对所选择细胞因子对其进行检查。
[0825]
结果:
[0826]
skov3-luc生长
[0827]
使用荧光素酶活性作为指示对skov3-luc生长进行追踪以在将来的实验中测定靶skov3-luc细胞数量。将3.8
×
10
4-3.8
×
105个skov3-luc细胞/孔平板接种在24孔板(康宁公司)中,并每天监测荧光素酶活性,持续3天。平板接种的1.9
×
105个细胞/孔或更高数量的细胞达到汇合并在平板接种后2天呈现出荧光素酶活性所指示的生长饱和(图6)。注意,3.8
×
10
4-1.1
×
105个skov3-luc细胞/孔在平板接种后三天仍处于线性或指数生长阶段(图6,绘图橙色、蓝绿色和紫色)。阴性对照(没有lar底物的情况下,3.8
×
105个skov3-luc细胞)仅显示出背景水平读数并且证实了来自skov3-luc细胞的生物发光读数由于荧光素酶活性而产生。
[0828]
针对skov3-luc肿瘤细胞的t4
car-t细胞活性的验证
[0829]
为了证实t4
car-t细胞活性,将多层skov3-luc暴露于1,000,000(一百万)个t4
car-t细胞或暴露于1,000,000(一百万)个未经转导的t细胞。24小时温育后,与未经转导的t细胞对照相比,t4
car-t细胞使skov3-luc增殖降低30%(图7),这示出了t4
car-t细胞的抗肿瘤活性。
[0830]
将针对skov3-luc肿瘤细胞的独立的t4 car-t细胞的活性与暴露于凋亡细胞后的活性进行比较
[0831]
对凋亡细胞(apocell)和凋亡细胞上清液(aposup和apomon sup)进行测试以测定其是否干扰t4 car-t细胞抗肿瘤活性。将skov3-luc肿瘤细胞与凋亡细胞一起温育一小时,然后添加t4 car-t细胞(500,000个,五十万个)或t4 未经转导的t细胞(500,000个,五十万个)(t4
car-t细胞与凋亡细胞的比率为1:2)。然后将肿瘤细胞/凋亡细胞/t4
car t细胞共培养48小时。将对照skov3-luc肿瘤细胞与t4 car-t细胞和哈特曼氏溶液(凋亡细胞的媒剂)(但没有凋亡细胞)共培养48小时。
[0832]
结果示出,温育48小时后,t4 car-t细胞抗肿瘤活性优于与未经转导的t细胞一起温育。用凋亡细胞或凋亡细胞上清液进行类似的温育。令人惊讶地,在暴露或未暴露于凋亡细胞或凋亡细胞上清液的情况下,t4 car t细胞抗肿瘤活性是相当的。(图8)。
[0833]
凋亡细胞对改善、减少或抑制由于car-t治疗而引起的细胞因子风暴的效应
[0834]
接下来对凋亡细胞减少细胞因子风暴的效应进行检查。il-6是在细胞因子风暴中释放的原型促炎性细胞因子(lee dw等人(2014)《血液》124(2):188-195)并且通常用作细胞因子风暴应答的标志物。
[0835]
建立培养物以模拟体内car t细胞疗法环境。在存在人单核细胞-巨噬细胞和t4 car t细胞的情况下培养skov3-luc肿瘤细胞。在培养基中测量到的il-6浓度为大约500-600pg/ml。il-6的这种浓度表示细胞因子风暴。
[0836]
出乎意料的是,在其中肿瘤细胞先前已经与凋亡细胞一起温育一小时(t4 car-t细胞与凋亡细胞的比率为1:2)的skov3-luc肿瘤细胞、人单核细胞-巨噬细胞、t4 car-t细胞的培养基中测量到的il-6水平显著降低。类似地,在其中肿瘤细胞先前已经与凋亡细胞上清液一起温育一小时的skov3-luc肿瘤细胞、人单核细胞-巨噬细胞、t4 car-t细胞的培养基中测量到的il-6水平也显著降低。il-6浓度的这种降低表示细胞因子风暴的减少(图9)。
[0837]
得出结论:出乎意料的是,凋亡细胞和凋亡上清液没有消除car-t细胞对肿瘤细胞增殖的效应,而同时其使促炎性细胞因子(如被认为是导致发病的主要细胞因子的il-6)下调。
[0838]
使用更大范围的细胞因子进行分析
[0839]
为了进一步评价对未在实验程序期间产生但在人细胞因子风暴期间在临床环境中出现的可能更大范围和水平的细胞因子的效应,将lps(10ng/ml)添加到上文所概述的skov3-luc培养条件。预期lps的添加会使细胞因子风暴水平指数提高。如所预期的,lps的添加使细胞因子风暴效应增加,并且因此,il-6水平提高到大约30,000pg/ml。已知在细胞因子风暴期间以高水平表达的其它细胞因子示出了升高的水平,例如:tnf-α(250-300pg/ml)、il-10(200-300pg/ml)、il1-α(40-50pg/ml)和il-18(4-5pg/ml)。如图10中所示出的,暴露于凋亡细胞使il-6的水平甚至在细胞因子风暴的指数状态期间也显著降低到可以在临床环境中看到并且在用car t细胞进行的实验程序中通常看不到的几乎正常的水平。这种效应在其它促炎性细胞因子tnf-α、il-10、il1-α、il-1β和il-18中是类似的,所述其它促炎性细胞因子示出了介于20%-90%之间的降低。在使用凋亡细胞上清液代替凋亡细胞时发现了类似结果。
[0840]
凋亡细胞对il-2和il-2r的效应
[0841]
将skov3-luc细胞与t4 car t细胞一起温育后,在培养上清液中测量到的il-2浓度为1084pg/ml。令人惊讶地,当首先将skoc3-luc细胞与凋亡细胞一起温育并且然后与t4 car t细胞一起温育时,il-2的浓度增加到1190pg/ml。类似地,将skov3-luc细胞与t4 car t细胞一起温育后,在培养上清液中测量到的il-2r浓度为3817pg/ml。令人惊讶地,当首先将skoc3-luc细胞与凋亡细胞一起温育并且然后与t4 car t细胞一起温育时,il-2r的浓度增加到4580pg/ml。在仅skov3-luc中,il-2的浓度为3.2pg/ml,并且在添加凋亡细胞的情况下,浓度为10.6pg/ml。在仅skov3-luc中,il-2r的浓度为26.3pg/ml,并且在添加凋亡细胞的情况下,浓度为24.7pg/ml。
[0842]
结论
[0843]
car-t细胞疗法已经被文件记录为引起大量患者的细胞因子风暴。这些结果证实,凋亡细胞和凋亡细胞上清液令人惊讶地在没有影响car-t细胞针对肿瘤细胞的功效的情况
下使细胞因子风暴细胞因子标志物减少。而且,似乎凋亡细胞使细胞因子il-2增加,这可以通过维持或增加car t细胞增殖来增加car t细胞疗法的持续时间。
[0844]
实例4:凋亡细胞疗法预防施用了car t细胞疗法的小鼠的细胞因子风暴
[0845]
目的:在实体瘤模型(skov3卵巢腺癌)中对凋亡细胞或凋亡细胞上清液的体内效应进行测试,以便测定t4 car t细胞功效和细胞因子风暴标志物细胞因子的水平。
[0846]
材料与方法
[0847]
体外研究:
[0848]
上文已经在实例1中描述了包含制备、培养和分析上文所描述的结果的方法并且与使用识别erbb靶抗原的t4 car t细胞(本文中被称为“t4 car t细胞”)、skov3-luc细胞、凋亡细胞、凋亡上清液、单核细胞、巨噬细胞有关的体外方法和各种测定。本文使用了相同的方法。
[0849]
体内研究
[0850]
小鼠
[0851]
从哈兰(harlan)(以色列)购买7-8周龄的scid-浅褐色小鼠和nsgs小鼠,并将其保存在夏里特研究院(sharett institute)的spf动物设施中。
[0852]
将skov3-luc肿瘤细胞(1
×
106个或2
×
106个)通过腹膜内注射在pbs中或皮下注射在200ml matrigel(bd生物科学公司(bd biosciences))中而接种到scid浅褐色小鼠或nsgs小鼠中。在注射后约14-18天时,通过生物发光成像(bli)确认肿瘤植入,并在施用t细胞前将小鼠分选成具有类似信号强度的组。
[0853]
小鼠将在施用t4 car t细胞前24小时或与施用t4 car t细胞(10-30
×
106个t4 car t细胞)同时接受30
×
106个凋亡细胞。肿瘤生长之后将进行生物发光成像(bli),并且循环细胞因子水平将由luminex来测定。
[0854]
体内荧光素酶测定
[0855]
通过萤火虫荧光素酶活性每周监测肿瘤生长。简而言之,将3mg d-荧光素(e1605.普洛麦格公司,美国)/小鼠(100μl的30mg/ml d-荧光素)腹膜内注射到异氟烷麻醉的小鼠中,并在注射后10分钟使用ivis成像系统和live image图像捕获软件(均来自珀金埃尔默公司(perkin elmer),美国)获取腹侧图像。
[0856]
d-荧光素注射“自动”选项后5分钟通过对接受0.5
×
106个skov3-luc细胞/小鼠的小鼠进行成像来针对每个图像会话(session)选择图像获取参数。使用24倍镜头针对分箱4、f/光圈1.2和2-4分钟的曝光设置捕获参数。使用live image软件进行数据分析和定量,并使用microsoft的excel程序生成图。
[0857]
体内细胞毒性
[0858]
为了评估t细胞的体内独享,从小鼠收集器官,将所述器官福尔马林固定,并对其进行组织病理学分析。
[0859]
细胞因子分析
[0860]
使用luminex magpix读数器和/或elisa试剂盒、如制造商所描述的流式细胞术珠阵列(th1/th2/th17;bd生物科学公司)对上清液和血清进行分析。例如,可以针对促炎性细胞因子进行分析,尽管在一些实施例中,本文中可以分析表1和表2中所列出的或本领域已知的任何细胞因子,但是在一种情况下所述促炎性细胞因子为il-6。
[0861]
结果
[0862]
校准体内skov3-luc肿瘤
[0863]
将0.5
×
106个、1
×
106个或4.5
×
106个skov3-luc细胞腹膜内注射到scid浅褐色小鼠中,并且每周进行生物发光成像(bli),以便如方法中所描述的追踪肿瘤生长(数据未示出)。
[0864]
小鼠的临床得分
[0865]
小鼠在最初4周内未显示出任何临床症状。然而,skov3-luc注射后28天,接受高剂量(4.5
×
106个;紫色线)的小鼠的体重开始稳步减轻(图11a),并且小鼠的整体外观恶化,表现为嗜睡、起搏异常和总体活性丧失。这个组在第39天时被剔除,并进行腹部尸检以暴露肿瘤的外观和大小(图11b)。skov3-luc肿瘤较大、呈固体、血管化并显示出发白光亮肤色。一个大肿瘤在腹腔中的尾部或延髓部在注射侧(左侧)上占据主导地位。这个肿瘤占腔的大约25-75%,并且明显压迫和干扰肠道。在腹腔内的各个位置处也观察到较小病灶。腹腔内含有肿瘤,并且在任何小鼠的身体的任何其它部分中未观察到其它肿瘤。接受低剂量(0.5
×
106个)或中等剂量(1
×
106个)的skov3-luc的小鼠在skov3-luc注射40天后停止体重增长并且体重开始稳步减轻。在skov3-luc注射后50天终止实验。
[0866]
skov3-luc肿瘤动力学
[0867]
注射pbs以控制skov3-luc细胞,并且这些小鼠在整个实验中并未表现出任何荧光素酶活性(图12,左图)。肿瘤检测和生长是剂量依赖性的。较低剂量(0.5
×
106个skov3-luc细胞)在注射后25天开始显示出肿瘤(4/5动物),中等剂量(1
×
106个)注射在注射后18天示出肿瘤(4/5动物),而在较高剂量(4.5
×
106个)下,早在注射后11天在3/5动物中检测到肿瘤,并且到第18天,所有动物均显示出已建立的肿瘤(图12和图13a-13d)。
[0868]
car t细胞疗法诱导细胞因子释放综合征
[0869]
向三组无肿瘤小鼠以及患有肿瘤的小鼠施用(腹膜内或直接施用于肿瘤中)增加剂量的t4 car t细胞(3
×
106个、10
×
106个或30
×
106个)。在最高剂量下,无肿瘤小鼠和患有肿瘤的小鼠在24小时内均表现出受抑(subdued)行为、毛发直立和移动性降低,伴随着体重迅速减轻,然后在48小时内死亡。在来自给予最高剂量的car t细胞的小鼠的血液样品中,至少可检测到人干扰素-γ和小鼠il-6。接受针对不同肿瘤抗原的高剂量的car t细胞的动物没有表现出体重减轻或行为变化。
[0870]
施用凋亡细胞抑制由car t细胞疗法诱导的细胞因子释放综合征或使所述细胞因子释放综合征的发病率降低
[0871]
向给予了最高剂量的car t细胞的一组小鼠伴随性施用2.10
×
108个/kg的凋亡细胞,这先前已经被证实是安全且有效的剂量。接受人car t 凋亡细胞的小鼠的小鼠il-6水平显著降低、体重减轻并且死亡率降低。
[0872]
实例5:组合免疫疗法对体外弥漫性肿瘤模型的效应
[0873]
目的:对凋亡细胞或源自凋亡细胞的上清液在弥漫性肿瘤模型中的效应进行测试,其中癌症广泛传播并且非局部的或封闭的,以便测定car t细胞对癌细胞和细胞因子风暴标志物细胞因子水平的功效。
[0874]
方法:
[0875]
cd19 t4 car t细胞(“cd19 car t细胞”)
[0876]
cd19特异性car-t细胞购自普迈有限公司(批号012916)。t细胞对car呈30%阳性(根据制造商的facs数据-fab染色)。简而言之,将细胞解冻到aimv 5%热灭活的fbs中,离心(300g,5分钟,室温),然后重悬于aimv中。在实验的第6天,每个小鼠静脉内注射20
×
106个细胞(70%膜联蛋白pi阴性,其中30%car阳性)。
[0877]
表达cd19的重组海拉细胞将用作在其细胞表面也表达cd19的对照细胞类型。
[0878]
cd123 car t细胞
[0879]
t4 car t细胞也将用靶向cd123表位的car(在本文中被称为“cd123 car t细胞”)进行工程化。
[0880]
raji细胞、表达cd19的海拉细胞和表达cd123的白血病细胞
[0881]
raji细胞,raji细胞购自ecacc(目录号85011429),并将其常规地培养在完全培养基(rpmi-1640,其补充有10%h.i.fbs、1%glutamax和1%青霉素/链霉素)中,并维持在3
×
10
5-3
×
106个细胞/ml的浓度下。在实验的第1天,每个小鼠静脉内注射0.1
×
106个细胞。
[0882]
类似地,将在实验室中产生表达cd19的海拉细胞,并将其用作cd19 car t细胞的靶标。表达cd123的白血病细胞将用作cd123 car t细胞的靶标。另外,原发性癌细胞将用作car t细胞的靶标。
[0883]
使用本领域已知的方法制备表达cd19的海拉细胞。如本领域众所周知的,将培养细胞。
[0884]
cd123是膜生物标志物和血液恶性肿瘤中的治疗靶标。如本领域中已知的,将培养表达cd123的白血病细胞,例如白血病母细胞和白血病干细胞。
[0885]
将如实例1中所描述的制备凋亡细胞、凋亡细胞上清液和单核细胞分离。所产生的早期凋亡细胞至少50%为膜联蛋白v-阳性细胞并且小于5%为pi阳性细胞。
[0886]
巨噬细胞。通过贴壁从cd14阳性细胞中产生。
[0887]
树突状细胞。在存il4和gmcsf的情况下cd14衍生生长。
[0888]
流式细胞术。使用了以下抗体:hcd19-pe(e生物科学公司(ebiosciences),目录号12-0198-42);migg1-pe(e生物科学公司,目录号12-0198-42);hcd3-fitc(e生物科学公司,目录号11-0037-42);migg2a-fitc(e生物科学公司,目录号11-4724-82)。使用bd的facs calibur进行获取。
[0889]
原初t细胞。将原初t细胞使用磁珠(bd)从血沉棕黄层分离,并冷冻保存在90%人ab血清和10%dmso中。解冻和注射与car-t细胞相同。
[0890]
体外培养条件
[0891]
细胞系和培养试剂
[0892]
将人淋巴瘤细胞系raji(ecacc,英国,登录号85011429)、人宫颈腺癌细胞系海拉(atcc,美国,编号:ccl-2)和海拉-cd19(普迈生物技术有限公司,美国,目录号pm-海拉-cd19)在此后称为“完全培养基”的补充有10%fbs(gibco,赛默飞世尔科技公司,南美,目录号12657-029)、2mm glutamax(gibco,赛默飞世尔科技公司,美国,目录号35050-038)和100u/ml青霉素 100u/ml链霉素(gibco,赛默飞世尔科技公司,美国,目录号15140-122)的rpmi 1640(gibco,赛默飞世尔科技公司,美国,目录号31870-025)中培养。在标准培养期间,向海拉-cd19培养基进一步补充1μg/ml嘌呤霉素(西格玛奥德里奇公司,美国,目录号p9620)作为选择性抗生素。
[0893]
将所有细胞保持在亚汇合条件下。将raji细胞维持在0.3
×
10
6-2
×
106个细胞/ml的浓度范围内。当接受器被填充到90%汇合时,将海拉和海拉-cd19细胞传代。
[0894]
从血液贡献的血沉棕黄层(以色列舍巴医学中心)分离原代单核细胞。首先,在ficoll密度梯度(ficoll-paque plus,ge医疗公司,英国,目录号17-1440-03)上分离外周血单核细胞(pbmc)。离心(800x g,2-8℃,20分钟,中断为0)后,将含有pbmc的中间相转移到新鲜试管,并用此后称为“洗涤培养基”的补充有2mm l-谷氨酰胺(龙沙集团,瑞士,目录号be17-605e)和10mm hepes(龙沙集团,瑞士,目录号be17-737b)的rpmi-1640(龙沙集团,瑞士,目录号be12-918f)洗涤,并离心(650x g,2-8℃,10分钟)。将沉淀的细胞重悬于“洗涤培养基”中到15
×
106个细胞/ml的浓度。将细胞以0.9ml滴接种在35-mm板(康宁公司,美国,目录号430165)的中心处。将板在加湿温育箱中温育1.5小时(37℃,5%co2),从而允许单核细胞贴壁,并且然后用预温热的pbs(龙沙集团,瑞士,目录号be17-516f)洗涤三次,从而去除其它细胞类型。洗涤后,将细胞在又称为“完全培养基”的补充有10%fbs(gibco,赛默飞世尔科技公司,南美,目录号12657-029)、2mm glutamax(gibco,赛默飞世尔科技公司,美国,目录号35050-038)和100u/ml青霉素 100u/ml链霉素(gibco,赛默飞世尔科技公司,美国,目录号15140-122)的2ml rpmi 1640(gibco,赛默飞世尔科技公司,美国,目录号31870-025)中培养。
[0895]
将所有细胞系在37℃下和含有5%co2的加湿温育箱中培养。
[0896]
将cd19-car t细胞(普迈有限公司,美国,目录号fmc63)以aim-v培养基或冷冻的形式递送。将用于进行体外实验的冷冻保存的car t细胞在实验的当天在35-38℃浴中解冻并立即浸入补充有5%fbs(gibco,南美,目录号12657-029)的预温热的aim v培养基(gibco,赛默飞世尔科技公司,美国,目录号12055-091)中。将dmso通过离心细胞(300x g,室温,5分钟)并重悬于预温热的aim v培养基中来去除。通过用facscalibur流式细胞仪(bd,美国)对抗-flag(生物传奇公司(biolegend),美国,目录号637310)染色和膜联蛋白v和pi染色(mebcyto凋亡试剂盒,mbl,美国,目录号4700)进行读取来测定cd19-car 细胞群的浓度和活力。
[0897]
对于原初t细胞分离,从根据白细胞去除术部门的sop使用cobe spectratm单采血液成分术设备(gambro bct,美国)从哈达莎医学中心(埃因卡勒姆大学(ein kerem campus),耶路撒冷,以色列)处的已签署知情同意书的有资格的供体收集的白细胞去除术级分或从装载在ficoll密度梯度上的血沉棕黄层(以色列舍巴医学中心,以色列)中提取pbmc,并将其离心(800x g,2-8℃,20分钟)。按照制造商的指南使用magnisort人cd3阳性选择试剂盒(e生物科学公司,美国,目录号8802-6830-74)从阳性级分分离t细胞。将t细胞冷冻保存在含有另外的20%fbs(gibco,赛默飞世尔科技公司,南美,目录号12657-029)和5%dmso(cryosure-dmso,wak-chemie medical gmbh,德国,目录号wak-dmso-70)的“完全培养基”(定义如上)中,并在实验的当天将其与cd19-car t细胞并行解冻。
[0898]
ldh细胞毒性测定
[0899]
乳酸脱氢酶(ldh)是由经历裂解的细胞以关联方式释放的稳定的细胞溶质酶。因此,培养基中的ldh水平可以用于定量细胞毒性活性。cytotox 96非放射性细胞毒性测定(普洛麦格公司,美国,目录号g1780)是用于定量培养基中的ldh水平的比色测定。将四唑盐底物(碘硝基-四唑紫,int)过量地引入培养基中,并且ldh将底物转化成红色甲臜产物。形
成的红色颜色的量与裂解的细胞的数量成正比。
[0900]
简而言之,并按照制造商的指南,将靶细胞(海拉或海拉-cd19)单独培养或与单核细胞结合培养。在靶细胞贴壁到板(6小时-过夜)后,将培养物暴露于y
×
106个apocell细胞1小时,之后通过4-5次rpmi洗涤将这些细胞洗涤掉。在光学显微镜下在视觉上确认apocell细胞的去除。将10ng/ml lps(西格玛奥德里奇公司,美国,目录号l4391)引入到共培养物并温育1小时。温育后,将lps用rpmi通过3-5个洗涤周期去除。以一种或多种指定的e/t比率添加活的cd19-car t细胞或原初t细胞,并将其温育4小时。为了收集培养基,将板以250x g、在2-25℃下离心4分钟(离心机5810r,eppendorf,德国)使细胞沉降。将来自每个孔的50μl的上清液培养基转移到新鲜的平底96孔微板孔(康宁公司,美国,目录号3596)中,并向每个孔添加50μl的cytotox 96试剂。将板于黑暗中在室温下温育30分钟,之后通过每孔添加50μl终止溶液来终止反应。使用infinite f50(帝肯,瑞士)在492nm处读取并使用magellan f50软件捕获吸光度。使用microsoft excel 2010执行数据分析和图形生成。
[0901]
流式细胞术细胞毒性测定
[0902]
将海拉-cd19(靶标)细胞和海拉(对照)细胞用5μm羧基荧光素琥珀酰亚胺酯(cfse,生命技术公司,美国,目录号c1157)预染色,混合在一起,并平板接种在新鲜板上或在填充有分离的原代单核细胞的板上。在靶细胞贴壁到板(6小时-过夜)后,将培养物暴露于y
×
106个apocell细胞1小时。将板用rpmi洗涤3-5次,并在视觉上验证悬浮的apocell细胞被洗涤掉。将10ng/ml lps引入到共培养物并温育1小时,之后将lps通过用rpmi进行3-5个洗涤周期去除。然后将活的cd19-car t细胞按照一种或多种特定的e/t比率所指示的添加到共培养物并温育4小时。温育后,通过添加胰蛋白酶-edta(生物工业有限公司,以色列,目录号03-052-1b)并在37℃下温育4分钟来采集细胞。为了终止酶促活性,添加两到四倍体积的“完全培养基”。收集细胞,将其以200x g在室温下离心5分钟,并重悬于100μl rpmi中(gibco,赛默飞世尔科技公司,美国,目录号15140-122)。随后,首先针对在黑暗中在室温下温育30分钟的抗cd19(e生物科学公司,美国,目录号12-0198-42)进行染色。离心(290x g,1分钟,2-8℃)并重悬于300μl rpmi中后,将细胞针对抗7aad进行染色(e生物科学公司,美国,目录号00-6993-50)。将分析门控(gate)于7add阴性细胞(活细胞),其中对活靶细胞(海拉-cd19)和活对照细胞(海拉)进行计算。通过将活靶细胞百分比除以活对照细胞百分比来计算存活率百分比。为了校正起始细胞数量和自发靶细胞死亡的变化,将存活率百分比除以靶细胞百分比与对照细胞百分比(在没有效应子细胞(cd19-car t细胞)的情况下培养的)的比率。最后,通过将经校正的存活率百分比从100%中减去来测定细胞毒性百分比2。
[0903]
通过将raji癌细胞与cd19 car t细胞( /-单核细胞-巨噬细胞)一起温育48小时来进行初始实验,以便测定cd19 car t细胞与靶raji癌细胞的最佳比率,以96孔板中5
×
104个raji细胞/孔开始。基于结果构建效应子/靶标(e/t)比率板。
[0904]
通过将raji癌细胞与凋亡细胞或凋亡上清液一起温育1小时、然后与cd19 car t细胞( /-单核细胞-巨噬细胞)共培养48小时来进行组合免疫疗法实验。
[0905]
为了模拟体内条件,1
×
105个thp-1细胞/ml将用200nm(123.4ng/ml)佛波醇肉豆蔻酸乙酸酯(pma)分化72小时,并且然后将在完全培养基中在没有pma的情况下培养另外24小时。接下来,raji癌细胞将以5
×
105个raji细胞/孔平板接种在24孔板中在分化的thp-1细胞上。
[0906]
在raji癌细胞的初始培养后,将4
×
10
5-8
×
105个凋亡细胞(apocell)添加到培养物持续1-3小时以诱导免疫耐受环境。将对每种细胞类型的癌细胞与apocell的比率进行优化。洗涤后,基于e/t比率图,将共培养物用预定数量的cd19
car-t细胞进行处理。在某些实验中,在添加cd19 car t细胞之前,将10ng/ml lps添加到培养基。在其它实验中,在添加cd19 car t细胞之前,将干扰素γ(ifn-γ)添加到培养基。预期lps或ifn-γ的添加会使细胞因子风暴水平指数提高。
[0907]
为了测定raji癌细胞的细胞毒性,制备了裂解物,并在48小时温育期后对活力进行了测定。将进行对raji细胞的细胞毒性进行测定的另外的实验并且将以48小时温育时间段内的间隔进行。可选地,将使用普洛麦格公司的cytotox 96非放射性细胞毒性测定(普洛麦格公司,目录号g1780)。
[0908]
用表达cd19的海拉细胞和cd19 car t细胞运行类似的实验。
[0909]
用表达cd123的白血病细胞和cd123 car t细胞运行类似的实验。
[0910]
细胞因子分析
[0911]
初始细胞因子测定对培养上清液中的mip1a、il-4、il-2、il-2r、il-6、il8、il-9、il-10、il-13、il-15、inf-γ、gmcsf、tnf-α的水平进行检查。
[0912]
另外的细胞因子测定对细胞因子il-10、il-1β、il-2、ip-10、il-4、il-5、il-6、ifnα、il-9、il-13、ifn-γ、il-12p70、gm-csf、tnf-α、mip-1α、mip-1β、il-17a、il-15/il-15r或il-7或其任何组合的水平进行检查。
[0913]
建立培养物以模拟体内car t细胞疗法环境。将raji burkett淋巴瘤细胞在存在人单核细胞-巨噬细胞、lps和cd19 car t细胞的情况下在添加和未添加凋亡细胞的情况下培养。
[0914]
将raji细胞在存在单核细胞和lps的情况下温育,然后添加原初t细胞(raji 原初t)、添加cd19 car t细胞(raji car t)以及以1:8car t细胞:apocell的比率添加cd19 car t细胞和凋亡细胞(apocell)(raji car t apocell 1:8)、以1:32car t细胞:apocell的比率添加cd19 car t细胞和凋亡细胞(apocell)(raji car t apocell 1:32)和以1:64car t细胞:apocell的比率添加cd19 car t细胞和凋亡细胞(apocell)(raji car t apocell 1:64)。在gm-csf和tnf-α(tnf-α)之后进行浓度测量。
[0915]
为了对il-6、il-8和il-13以及其它细胞因子的细胞因子释放减少进行测定,收集上清液,并使用luminex magpix读数器和elisa测定针对所选择细胞因子对其进行检查。可以使用mapix系统分析仪(默克密理博公司(mereck millipore))和miliplex分析软件(默克密理博公司)通过luminex技术对细胞因子(小鼠或人)进行评价。通过quantikine elisa(r&d系统(r&d systems))对小鼠il-6rα、mig(cxcl9)和tgf-β1进行评价。
[0916]
组织分析
[0917]
使用流式细胞术和免疫组织化学对骨髓和肝进行评价。处死后,收集肝和骨髓进行组织病理学分析。将组织在室温下固定在4%福尔马林中48小时,并且然后提交到希伯来大学处的动物设施进行加工。加工前将骨脱钙。对石蜡切片进行苏木精和曙红染色以及cd19染色。
[0918]
ifn-γ效应
[0919]
通过stat1磷酸化和生物产物两者来评价ifn-γ效应。
[0920]
结果:
[0921]
校准细胞毒性测定的细胞数量
[0922]
为了测定要在体外模型中使用的raji细胞的数量,对细胞毒性测定的灵敏度极限进行评估。将5
×
10
4-20
×
104个raji细胞/孔一式四份地平板接种在96孔板中。对一组一式四份进行裂解以与仍完全活的细胞进行比较。裂解是瞬时的,在离心前立即添加裂解溶液以模拟部分细胞的细胞毒性。实际上,所有细胞数量表现出远高于活细胞的读数,其中5
×
104个细胞数量产生最大的相对读数(图14;数据的外推)。因此,除非实验设计另有要求,否则随后的实验将使用这个细胞数量作为默认值。
[0923]
针对raji burkett淋巴瘤细胞的cd19
car-t细胞活性的验证
[0924]
为了证实cd19
car-t细胞活性,将raji癌细胞单层暴露于1,000,000(一百万)个cd19
car-t细胞或暴露于1,000,000(一百万)个未经转导的t细胞。24小时温育后,cd19
car-t细胞使raji癌细胞增殖减少,这示出了cd19
car-t细胞的抗肿瘤活性。
[0925]
将针对raji burkett淋巴瘤细胞的独立的cd19 car-t细胞的活性与暴露于凋亡细胞后的活性进行比较
[0926]
对凋亡细胞(apocell)和凋亡细胞上清液(aposup和apomon sup)进行测试以测定其是否干扰cd19 car-t细胞抗肿瘤活性。将raji burkett淋巴瘤细胞与凋亡细胞一起温育一小时,然后添加cd19 car-t细胞(500,000个,五十万个)或cd19 未经转导的t细胞(500,000个,五十万个)(cd19
car-t细胞与凋亡细胞的比率为1:2)。然后将肿瘤细胞/凋亡细胞/cd19
car t细胞共培养48小时。将对照raji burkett淋巴瘤细胞与cd19 car-t细胞和哈特曼氏溶液(凋亡细胞的媒剂)(但没有凋亡细胞)共培养48小时。
[0927]
结果示出,温育48小时后,cd19 car-t细胞抗肿瘤活性优于与未经转导的t细胞一起温育。用凋亡细胞上清液进行类似的温育。令人惊讶地,在暴露或未暴露于凋亡细胞或凋亡细胞上清液的情况下,cd19 car t细胞抗肿瘤活性是相当的。
[0928]
在存在或不存在凋亡细胞的情况下在car t的e/t比率结果相当的情况下均未看到凋亡细胞对针对cd19的经car修饰的t细胞的体外负面效应。
[0929]
针对海拉白血病细胞的cd19
car-t细胞活性的验证
[0930]
海拉细胞是特异性的表达cd19的细胞,这使得其对car cd19
t细胞活性敏感。另外,与属于非贴壁细胞系的raji细胞相反,海拉细胞是贴壁的。
[0931]
为了证实cd19
car-t细胞活性,将海拉癌细胞单层暴露于1,000,000(一百万)个cd19
car-t细胞或暴露于1,000,000(一百万)个未经转导的t细胞。24小时温育后,cd19
car-t细胞使海拉癌细胞增殖减少,这示出了cd19
car-t细胞的抗肿瘤活性(图15cd19
rpmi和cd19
car t-19细胞)。
[0932]
将针对cd19
海拉细胞的独立的cd19
car-t细胞的活性与暴露于凋亡细胞后的活性进行比较
[0933]
对凋亡细胞(apocell)进行测试以测定其是否干扰cd19 car-t细胞抗肿瘤活性。将海拉细胞与凋亡细胞一起温育一小时,然后添加cd19 car-t细胞(500,000个,五十万个)或cd19 未经转导的t细胞(原初t细胞;500,000个,五十万个)(cd19
car-t细胞与凋亡细胞的比率为1:2)。然后将肿瘤细胞/凋亡细胞/cd19
car t细胞共培养48小时。将对照海拉细胞与cd19 car-t细胞和rpmi(凋亡细胞的媒剂)(但没有凋亡细胞)共培养48小时。cd19
car-t细胞:海拉细胞的比率(e/t比率)的范围为5-20(图15)。
[0934]
图15示出了,温育48小时后,cd19 car-t细胞抗肿瘤活性优于与未经转导的t细胞(原初细胞)或仅缓冲液一起温育。用凋亡细胞进行类似的温育。令人惊讶地,在暴露或未暴露于凋亡细胞的情况下,cd19
car t细胞抗肿瘤活性是相当的。使用凋亡细胞上清液进行类似的实验。图15示出了car t-cd19疗法在添加或未添加apocell的情况下具有相同的体外细胞毒性效应。
[0935]
在存在或不存在凋亡细胞的情况下在e/t比率相当的情况下未观察到凋亡细胞对针对cd19 海拉细胞的经car修饰的t细胞的负面效应。
[0936]
因此,观察到cd19
car t细胞在添加或未添加早期凋亡细胞的情况下具有相同的体外细胞毒性效应。
[0937]
凋亡细胞对改善、减少或抑制由于car-t治疗而引起的细胞因子风暴的效应
[0938]
在添加cd19 car t细胞之前或之后在培养基中测量到细胞因子il-8和il-13,并且所述细胞因子正在示出与细胞因子风暴一致的浓度。添加凋亡细胞或凋亡细胞上清液示出培养基中的il-8和il-13浓度降低。
[0939]
使用更大范围的细胞因子进行分析
[0940]
为了进一步评价对未在实验程序期间产生但在人细胞因子风暴期间在临床环境中出现的可能更大范围和水平的细胞因子的效应,将lps(10ng/ml)在存在癌症和car-19的情况下添加到上文所概述的raji细胞培养条件。预期lps的添加会使细胞因子风暴水平指数提高。暴露于凋亡细胞使细胞因子的水平显著降低。图16和图17中所呈现的结果示出,虽然添加cd19 car t细胞使培养基中的gm-csf和tnf-α的细胞因子浓度(pg/ml)大大增加,但是gm-csf和tnf-α两者在存在凋亡细胞的情况下均显著减少。细胞因子浓度的降低相对于car t细胞与凋亡细胞的凋亡细胞比率是剂量依赖性的。
[0941]
结论:
[0942]
凋亡细胞能够下调与car t细胞临床程序相关的细胞因子风暴的细胞因子标志物。显著地,凋亡细胞未示出对car t细胞的肿瘤活性的效应。凋亡细胞使源自先天免疫的促炎性细胞因子减少并且在不损害ifn-γ水平和car-t细胞毒性的情况下抑制ifn-γ效应。
[0943]
实例6:凋亡细胞疗法预防施用了car t细胞疗法的弥漫性癌症体内模型的细胞因子风暴
[0944]
目的:对凋亡细胞或源自凋亡细胞的上清液在弥漫性肿瘤模型中的体内效应进行测试,以便测定car t细胞对癌细胞和细胞因子风暴标志物细胞因子水平的功效。
[0945]
材料与方法
[0946]
体外研究
[0947]
参见实例5中针对体外研究所描述的方法。
[0948]
细胞和细胞培养
[0949]
将raji burkitt淋巴瘤细胞(西格玛奥德里奇公司,目录号85011429)按照制造商的指南进行培养。cd19 car t细胞、细胞培养、凋亡细胞、凋亡细胞上清液、单核细胞分离和体外测量如以上实例所示。所产生的早期凋亡细胞至少50%为膜联蛋白v-阳性细胞并且小于5%为pi阳性细胞。
[0950]
体内研究
[0951]
小鼠
[0952]
7-8周龄的scid浅褐色小鼠购自envigo(以前称为哈兰)。将小鼠按照机构iacuc指南保持在无spf的动物设施中。在实验过程期间,每天监测小鼠,并且每周称重3次。将示出后肢麻痹的小鼠处死。处死后,收集骨髓和肝进行facs分析和组织学处理,并将血清冷冻在-80℃下进行细胞因子谱分析。
[0953]
体内实验
[0954]
将scid浅褐色小鼠(c.b-17/icrhsd-prkdc-scid-lyst-bg,哈兰,以色列)以spf条件并按照实验室动物护理评估和认证协会(aaalac)圈养在耶路撒冷希伯来大学的动物设施管理局(aaf)(埃因卡勒姆大学,以色列)处。这项研究得到了希伯来大学动物实验伦理委员会的批准,并尽可能地最小化了动物所受的痛苦。
[0955]
(图18a)对于播散性肿瘤模型,向7-8周龄的雌性scid浅褐色小鼠每只小鼠静脉内注射悬浮于200μl rpmi(gibco,赛默飞世尔科技公司,美国,目录号15140-122)中的1
×
105个raji细胞(第1天)。在第6天,向相关组的小鼠每只小鼠静脉内接种含30
×
106个细胞apocell的200μl哈特曼氏溶液乳酸化林格氏注射(teva medical,以色列,目录号awn2324)。在第6天,向相关组的小鼠每只小鼠静脉内接种含10
×
106个活的cd19-car t细胞或原初t细胞的200μl aim v。对照小鼠在每种治疗中均接受等体积的rpmi。
[0956]
检查小鼠的临床指征,并每周称重两次,并在发展出后肢麻痹时处死。耶路撒冷的希伯来大学的动物设施部门制备了骨骼和肝的病理学样品,并针对人cd20(塞尔马克公司(cell marque),美国,克隆l26,目录号120m-84)进行了染色以检测raji细胞并针对人cd3(细胞信号传导技术公司(cell signaling technology),美国,目录号85061)进行了染色以检测人t细胞。
[0957]
在某些实验中,lps将在添加cd19 car t细胞之前施用于动物受试者。在其它实验中,干扰素-γ(ifn-γ)将在添加cd19 car t细胞之前施用。预期lps或ifn-γ的添加会使细胞因子风暴水平指数提高。
[0958]
细胞因子测定对包含但不限于il-10、il-1β、il-2、ip-10、il-4、il-5、il-6、ifnα、il-9、il-13、ifn-γ、il-12p70、gm-csf、tnf-α、mip-1α、mip-1β、il-17a、il-15/il-15r或il-7或其任何组合的细胞因子的水平进行检查。使用mapix系统分析仪(默克密理博公司)和miliplex分析软件(默克密理博公司)通过luminex技术对细胞因子(小鼠或人)进行评价。通过quantikine elisa(r&d系统(r&d systems))对小鼠il-6rα、mig(cxcl9)和tgf-β1进行评价。
[0959]
组织分析
[0960]
使用流式细胞术和免疫组织化学对骨髓和肝进行评价。处死后,收集肝和骨髓进行组织病理学分析。将组织在室温下固定在4%福尔马林中48小时,并且然后提交到希伯来大学处的动物设施进行加工。加工前将骨脱钙。对石蜡切片进行苏木精和曙红染色以及cd19染色。
[0961]
ifn-γ效应
[0962]
通过stat1磷酸化和生物产物两者来评价ifn-γ效应。
[0963]
结果
[0964]
car t细胞疗法诱导细胞因子释放综合征
[0965]
向三组无肿瘤小鼠以及患有肿瘤的小鼠施用(腹膜内或直接施用于肿瘤中)增加剂量的cd19 car t细胞(3
×
106个、10
×
106个或30
×
106个)。在最高剂量下,无肿瘤小鼠和患有肿瘤的小鼠在24小时内均表现出受抑行为、毛发直立和移动性降低,伴随着体重迅速减轻,然后在48小时内死亡。在来自给予最高剂量的cd19 car t细胞的小鼠的血液样品中,可检测到人干扰素-γ和小鼠il-6、il-8和il-13。接受针对不同肿瘤抗原的高剂量cd19 car t细胞的动物没有表现出体重减轻或行为变化。
[0966]
施用凋亡细胞抑制由car t细胞疗法诱导的细胞因子释放综合征或使所述细胞因子释放综合征的发病率降低
[0967]
向给予了最高剂量的cd19 car t细胞的一组小鼠伴随性施用2.10
×
108个/kg的凋亡细胞,这先前已经被证实是安全且有效的剂量。接受人cd19 car t 凋亡细胞的小鼠的至少一种小鼠促炎性细胞因子的水平显著降低、体重减轻并且死亡率降低。
[0968]
与car t细胞施用组合地施用凋亡细胞不会影响car t细胞抗肿瘤活性
[0969]
图18b示出了在没有施用cd19
car t细胞的情况下注射cd19
raji细胞的scid小鼠的预期死亡为18-21天。接受了cd19
car t细胞的小鼠中有百分之四十(40%)存活到至少第30天(图18点划线和双点划线)。存活者的百分比独立于凋亡细胞的添加(图18)。在第30天处死存活的小鼠。
[0970]
结论:生存期相当,并且没有凋亡细胞对针对cd19的经car修饰的t细胞的体内负面效应。
[0971]
文件记录了促炎性细胞因子(包含il-6、ip-10、tnf-α、mip-1α、mip-1β)的显著下调(p《0.01)。ifn-γ未被下调,但是其对巨噬细胞和树突状细胞的效应在磷酸化stat1的水平和ifn-γ诱导的cxcl10和cxcl9表达两个方面均受到抑制。
[0972]
结论:
[0973]
凋亡细胞使源自先天免疫的促炎性细胞因子减少并且在不损害ifn-γ水平和car-t细胞毒性的情况下抑制ifn-γ效应。
[0974]
实例7:凋亡细胞疗法预防施用car t细胞疗法的实体瘤癌症体内模型的细胞因子风暴
[0975]
目的:对凋亡细胞或源自凋亡细胞的上清液在实体瘤模型中的体内效应进行测试,以便测定car t细胞对癌细胞和细胞因子风暴标志物细胞因子水平的功效。
[0976]
材料与方法
[0977]
体外研究
[0978]
细胞和细胞培养
[0979]
使用了cd19 car t细胞——含有tmcd28的第二代car-t-cd19细胞,细胞培养、凋亡细胞、凋亡细胞上清液、单核细胞分离和体外测量如以上实例2和4和6所示。如实例1中详细描述的,所产生的早期凋亡细胞至少50%为膜联蛋白v-阳性细胞并且小于5%为pi阳性细胞。
[0980]
体内研究
[0981]
小鼠
[0982]
从哈兰(harlan)(以色列)购买7-8周龄的scid-浅褐色小鼠和nsgs小鼠,并将其保
存在夏里特研究院(sharett institute)的spf动物设施中。
[0983]
将scid浅褐色小鼠或nsgs小鼠用可以粘附到腹膜的表达cd19的海拉细胞接种,以便形成实体腹膜内肿瘤。在t细胞施用之前,将小鼠分选成几组。
[0984]
静脉内接种后六天,在第5天在具有和没有凋亡细胞(apocell)预先调理的情况下向小鼠施用10
×
106个cd19 car t细胞。向接受了预先调理的小鼠施用5
×
106个或30
×
106个apocell。每周调查一次肿瘤,并且每周监测循环细胞因子水平并通过luminex系统对其进行测定。使用luminex技术对25种小鼠细胞因子和32种人细胞因子进行评价。实验终止后,将小鼠剔除,并针对肿瘤的存在/大小对器官(骨髓、肝和脾)进行检查(通过facs和免疫组织化学)。
[0985]
细胞因子测定对包含但不限于gm-csf、ifnγ、il-1β、il-10、il-12p70、il-13、il-15、il-17a、il-2、il-4、il-5、il-6、il-7、il-9、mip-1α、tnfα、mip-1β、ifnα和ip-10的细胞因子的水平进行检查。使用mapix系统分析仪(默克密理博公司)和miliplex分析软件(默克密理博公司)通过luminex技术对细胞因子(小鼠或人)进行评价。通过quantikine elisa(r&d系统(r&d systems))对小鼠il-6rα、mig(cxcl9)和tgf-β1进行评价。
[0986]
组织分析
[0987]
使用流式细胞术和免疫组织化学对骨髓和肝进行评价。
[0988]
ifn-γ效应
[0989]
通过stat1磷酸化和生物产物两者来评价ifn-γ效应。
[0990]
结果results
[0991]
car t细胞疗法诱导细胞因子释放综合征
[0992]
向三组无肿瘤小鼠以及患有肿瘤的小鼠施用(腹膜内或直接施用于肿瘤中)增加剂量的cd19 car t细胞(3
×
106个、10
×
106个或30
×
106个)。在最高剂量下,无肿瘤小鼠和患有肿瘤的小鼠在24小时内均表现出受抑行为、毛发直立和移动性降低,伴随着体重迅速减轻,然后在48小时内死亡。
[0993]
图19a-19c以图形方式示出了从肿瘤释放的il-6、ip-10以及令人惊讶地甚至tnf-α细胞因子的水平甚至在car t细胞存在前有所提高。图19a-19c示出了il-6、ip-10和tnf-α令人惊讶地甚至在没有进行car t细胞疗法的情况下通过癌细胞的存在而有所增加。在存在car t细胞疗法(海拉-car t细胞cd-19)的情况下,细胞因子的释放显著增加。这些结果示出,肿瘤自身释放促炎性细胞因子。
[0994]
为了评价添加早期凋亡细胞的益处,在三个实验中对细胞因子gm-csf、ifnγ、il-1β、il-10、il-12p70、il-13、il-15、il-17a、il-2、il-4、il-5、il-6、il-7、il-9、mip-1α、tnfα、mip-1β、ifnα和ip-10进行了测量,其中结果示出了巨噬细胞相关的细胞因子在存在apocell施用的情况下被下调,而t细胞相关的细胞因子水平没有显著变化(表10)。
[0995]
表10:来自含有表达cd19的海拉细胞实体瘤、 /-car t细胞cd19疗法和 /-apocell的腹膜内体内模型的细胞因子水平
[0996][0997]
表10示出了car t细胞施用 /-apocell后二十四(24)小时的细胞因子测量。由于car t细胞疗法所产生的细胞毒性使细胞因子(包含gm-csf、il-10、il-12p70、il-6、mip-1α、tnfα、mip-1β和ip-10)升高,所述细胞因子的水平在存在apocell的情况下被显著下调(p《0.05-0.0001)。这些细胞因子主要与巨噬细胞相关。相反,与t细胞相关的细胞因子(如il-2、il-4、il-13和il15)的水平没有显著变化。
[0998]
图19a-c和表10中所呈现的结果展示了crs在癌症和car的背景下具有几种成分:可以分泌细胞因子的肿瘤;对肿瘤和car和其它因子作出应答的先天免疫;分泌影响先天免疫的细胞因子的car-t细胞导致死亡。apocell正在与先天免疫(主要是巨噬细胞、单核细胞和树突状细胞)相互作用以在不与t细胞或car t细胞相互作用的情况下使这些巨噬细胞、单核细胞和树突状细胞的应答下调。
[0999]
接受针对不同肿瘤抗原的高剂量cd19 car t细胞的动物没有表现出体重减轻或行为变化。
[1000]
施用凋亡细胞抑制由car t细胞疗法诱导的细胞因子释放综合征或使所述细胞因子释放综合征的发病率降低
[1001]
向给予了最高剂量的cd19 car t细胞的一组小鼠伴随性施用2.10
×
108个/kg的凋亡细胞,这先前已经被证实是安全且有效的剂量。凋亡细胞对针对cd19具有特异性的经car修饰的t细胞没有体外或体内负面效应。在存在/不存在凋亡细胞的情况下,car t细胞的体外e/t比率相当,并且体内存活率曲线相当(数据未示出)。
[1002]
接受人cd19 car t 凋亡细胞的小鼠的至少一种小鼠促炎性细胞因子的水平显著降低、体重减轻并且死亡率降低。
[1003]
在存在或不存在凋亡细胞的情况下在car t的e/t比率结果相当且体内存活率曲线相当的情况下未看到凋亡细胞对针对cd19的经car修饰的t细胞的体内负面效应。
[1004]
文件记录了促炎性细胞因子(包含il-6、ip-10、tnf-α、mip-1α、mip-1β)的显著下调(p《0.01)(数据未示出)。ifn-γ未被下调,但是其对巨噬细胞和树突状细胞的效应在磷酸化stat1的水平和ifn-γ诱导的cxcl10和cxcl9表达两个方面均受到抑制(数据未示出)。
[1005]
结论:
[1006]
crs由多种因素(包含肿瘤生物学、与单核细胞/巨噬细胞/树突状细胞的相互作用以及对car t细胞效应和扩增的应答)演变而来。凋亡细胞使源自先天免疫的促炎性细胞因子减少并且在不损害ifn-γ水平或car-t细胞毒性的情况下抑制ifn-g对单核细胞/巨噬细胞/树突状细胞的效应。因此,凋亡细胞使源自先天免疫的促炎性细胞因子减少并且在不损害ifn-γ水平和car-t细胞毒性的情况下抑制ifn-γ效应。这些结果支持在使用car-t细胞疗法的临床研究中安全使用apocell预防crs。
[1007]
实例8:凋亡细胞使细胞因子释放综合征(crs)下调并使car-t细胞功效提高
[1008]
目的:为了测试早期凋亡细胞在延长的时间段内对细胞因子和car t细胞的细胞毒性的效应。为了证实cd19-car t细胞的体内功效。为了证实早期凋亡细胞和cd19-car t细胞的协同效应。
[1009]
方法:单独使用或在与人巨噬细胞共温育后使用表达cd19的海拉细胞(普迈有限公司)在小鼠中进行体外和腹膜内实验。体内使用raji以进行白血病诱导。使用lps和ifn-g触发另外的细胞因子释放。使用第二代、携带cd28的、cd19特异性的经car修饰的细胞(普迈有限公司或使用纤维连接蛋白(retronectin)制备方案或多烯制备方案产生)来进行针对携带cd19的细胞的抗肿瘤效应。在体内(7-aad流式细胞术)和体外(存活率曲线;骨髓和肝中的肿瘤负荷;流式细胞术和免疫组织化学)对细胞毒性测定进行检查。crs自发地发生或对lps和ifn-g应答发生。对小鼠il-10、il-1β、il-2、ip-10、il-4、il-5、il-6、ifn-α、il-9、il-13、ifn-g、il-12p70、gm-csf、tnf-a、mip-1a、mip-1β、il-17a、il-15/il-15r、il-7和32种人类细胞因子进行了评价(luminex技术,mapix系统;milliplex分析员,默克密理博公司)。对小鼠il-6rα、mig(cxcl9)和tgf-β1进行评价(quantikine elisa、r&d系统)。评价ifn-γ效应(stat1磷酸化、生物产物)。人巨噬细胞和树突状细胞由单核细胞产生。通常如以上实例1中所呈现的产生早期凋亡细胞;≥40%的细胞呈膜联蛋白v阳性;≤15%呈pi阳性。
[1010]
小鼠:在实验的第1天和第2天向scid-bg小鼠(雌性,7-8周龄)腹膜内(i.p)注射2个连续剂量的0.25
×
106个海拉-cd19细胞。在第9天,小鼠腹膜内接受一个剂量的10
×
106个经4000-rad(cgy)辐照的apocell(使用细胞加工系统),并在之后一天,腹膜内接受一个剂量的包括0.5
×
106个car-t阳性细胞或2.2
×
106个car-t阳性细胞的10
×
106个car-t细胞的群。作为对照,小鼠接受10
×
106个活化的单核细胞或假拟-t细胞。将小鼠按照机构iacuc指南保持在spf动物设施中。每周对小鼠称重两次,并且每天监测其临床体征和腹膜炎。终点被定义为严重腹膜炎,表现为腹部肿大且紧张、嗜睡、移动性降低或呼吸努力增加。根据卡普兰-迈耶方法进行存活率分析。
[1011]
结果:文件记录了促炎性细胞因子(包含il-6、ip-10、tnf-α、mip-1a、mip-1β)的显著下调(p《0.01)(数据未示出)。ifn-g未被下调,但是其对巨噬细胞和树突状细胞的效应在磷酸化stat1的水平方面受到抑制(数据未示出)。ifn-γ诱导的cxcl10和cxcl9在巨噬细胞中的表达降低(数据未示出)。
[1012]
在使用了0.5
×
106个car-t阳性细胞的实验中,在第17天和第21天,每组处死2只小鼠。经hela-cd19处理的小鼠示出腹膜炎,表现为腹膜中的血液积聚、脾肿大和肿瘤病灶(数据未示出)。用对照mnc处理的小鼠的腹膜中的血液少一点且肿瘤病灶少一些。用car-t或car-t和apocell处理的小鼠没有腹膜炎的体征。这个观察与图20a中所呈现的存活率曲
线相关。
[1013]
在其中使用了2.2
×
106个car-t阳性细胞的实验中,观察到用减少四倍的car t细胞看到了相同的效应模式(图20b)。car-t治疗使具有腹膜hela-cd19的小鼠的生存期延长(p=0.0002)。效应可能由于较大数量的输注的car t细胞(2.2对0.5
×
106个car-t阳性细胞)而在这个实验中更加显著。即使具有更加显著和延长的效应,早期凋亡细胞也具有协同效应和延长的生存期(p=0.0032)。car t的体外e/t比率在存在/不存在凋亡细胞的情况下是相当的。令人惊讶地,与单独的car疗法相比,在存在凋亡细胞的情况下给予的car t细胞疗法改善小鼠的存活率,具有至少12天的显著且可重现的增加(p《0.0032,图20a和20b)。
[1014]
结论:car-t细胞治疗使具有腹膜hela-cd19细胞的小鼠的生存期延长。与单独的car-t细胞治疗相比,在car-t前一天施用经辐照的早期凋亡细胞具有协同效应并且使小鼠生存期延长超过10天(p《0.044,对数秩检验)。
[1015]
在处理scid小鼠的携带cd19的海拉细胞方面,经辐照的凋亡细胞输注对cd19特异性car t细胞具有显著的协同效应。在这个实例中,观察到的结果与实例5和6中所呈现的结果类似。与实例5和6相比,通过在这个实例中使用经辐照的凋亡细胞,“移植物抗白血病效应”的可能性已经被去除。因此,这种令人惊讶的协同效应似乎是通过所提供的经辐照的凋亡细胞介导的。
[1016]
crs由多种因素(包含肿瘤生物学、与单核细胞/巨噬细胞/树突状细胞的相互作用以及对car t细胞效应和扩增的应答)演变而来。凋亡细胞使源自先天免疫的促炎性细胞因子减少并且在不损害ifn-γ水平或car-t细胞毒性的情况下以及car-t细胞功效显著提高的情况下抑制ifn-γ对单核细胞/巨噬细胞/树突状细胞的效应。出乎意料的是,用经辐照的凋亡细胞进行治疗对car-t细胞疗法进行了补充,从而有效地扩增了car-t细胞疗法的抗癌效应。
[1017]
实例9:凋亡细胞治疗对非实体瘤模型的效应
[1018]
目的:对凋亡细胞对非实体瘤模型的效应进行测试,其中癌症广泛传播并且非局部的或封闭的,以便测定凋亡细胞对癌症存活率的功效。
[1019]
方法
[1020]
raji细胞
[1021]
raji细胞购自ecacc(目录号85011429),并将其常规地培养在完全培养基(rpmi-1640,其补充有10%h.i.fbs、1%glutamax和1%青霉素/链霉素)中,并维持在3
×
10
5-3
×
106个细胞/ml的浓度下。
[1022]
按照实例1所描述的制备凋亡细胞。所产生的早期凋亡细胞至少50%为膜联蛋白v-阳性细胞并且小于5%为pi阳性细胞。
[1023]
非实体(弥漫性)肿瘤模型
[1024]
scid小鼠在实验的第1天接受105个raji细胞的单次静脉内注射。对照组的scid小鼠接受盐水溶液的单次静脉内注射。(对3个队列进行测试;使用raji细胞在2个队列中诱导白血病,并将1个队列维持作为对照。)。
[1025]
实体瘤模型
[1026]
scid小鼠将在实验的第1天接受105个raji细胞的单次ip注射,其中对照组将接受盐水溶液的单次ip注射。
[1027]
凋亡细胞治疗
[1028]
在初步研究中,小鼠在输注raji细胞后6天接受早期凋亡细胞的输注。在随后的研究中,来自上述白血病队列之一的小鼠在输注raji细胞后6天开始接受早期凋亡细胞(30
×
106个细胞)的3次输注。
[1029]
结果
[1030]
scid小鼠没有t细胞,并且因此无法在没有进行疗法的情况下从白血病恢复。
[1031]
令人惊讶地,在初步研究中和如图21中所示出的,输注raji后6天进行凋亡细胞输注(apo)使注射有cd19 raji的scid的无肿瘤死亡与并未接受凋亡细胞输注(无apo)的小鼠相比显著延长。
[1032]
在白血病(无apo)队列中,接受raji细胞的小鼠中有70%存活至其寿命,相较于接受raji细胞和凋亡细胞两者的小鼠中有94%(总共n=51只动物,p《0.001)。如所预期的,100%的对照小鼠存活至其预期寿命(图22a)。在白血病队列中,接受raji细胞且无凋亡细胞的小鼠中有9%存活至超过预期寿的12%,相较于接受raji细胞和凋亡细胞两者的小鼠中有47%(图22b)。没有接受raji细胞且无凋亡细胞的小鼠存活至预期寿命的30%以上,相较于接受raji细胞和凋亡细胞两者的小鼠中有41%(图22c)。没有接受raji细胞且无凋亡细胞的小鼠获得完全缓解,相较于接受raji细胞和凋亡细胞两者的小鼠中有10%(图22d)。
[1033]
结论:
[1034]
施用凋亡细胞输注使白血病小鼠的寿命得以维持和有所增加,其中在某些情况下,施用了早期凋亡细胞的小鼠获得完全缓解(图2和图3a-3d)。
[1035]
实例10:组合的凋亡细胞和抗cd20 mab治疗对弥漫性肿瘤模型的效应
[1036]
目的:为了测试施用早期凋亡细胞和抗cd20 mab的组合对弥漫性(非实体)肿瘤模型的效应,其中癌症广泛传播且非局部的或封闭的,以便测定这种组合疗法对存活率的功效。
[1037]
raji细胞、凋亡细胞、非实体(弥漫性)肿瘤模型、实体瘤模型和凋亡细胞治疗如以上实例1和9中所描述的。
[1038]
抗cd20 mab
[1039]
可商购获得的抗cd20 mab从罗氏公司获取。
[1040]
抗cd20 mab治疗
[1041]
小鼠接受5mg的抗cd20 mab的静脉内输注。
[1042]
组合的凋亡细胞和抗cd20 mab治疗
[1043]
在raji细胞施用后的第6天开始,小鼠接受三次静脉内输注,每次输注30
×
106个凋亡细胞。另外,小鼠接受5mg的抗cd20 mab的静脉内输注。
[1044]
结果
[1045]
100%的接受raji细胞、raji细胞 抗cd20 mab和raji细胞 抗cd20 凋亡细胞的小鼠存活至白血病小鼠的预期寿命,相较于接受raji细胞和凋亡细胞两者的小鼠中有86%(总共n=28只动物,p《0.0002)(图23a)。没有接受raji细胞的小鼠存活超过预期寿命的24%,相较于接受raji细胞 凋亡细胞两者的小鼠中有29%以及100%的接受raji细胞 抗cd20 mab或raji细胞 抗cd20 凋亡细胞的小鼠(图23b)。没有接受raji细胞的小鼠存活超过预期寿命的59%,相较于接受raji细胞 凋亡细胞两者的小鼠中有29%、接受raji细胞
抗cd20 mab的小鼠中有57%、以及100%的接受raji细胞 抗cd20 凋亡细胞的小鼠(图23c)。没有接受raji细胞的小鼠存活超过预期寿命的76%,相较于接受raji细胞 凋亡细胞两者的小鼠中有29%、接受raji细胞 抗cd20 mab的小鼠中有14%、以及raji细胞 抗cd20 凋亡细胞的小鼠中有85%(图23d)。没有接受raji细胞或raji细胞 抗cd20 mab的小鼠存活超过小鼠的预期寿命的100%,相较于接受raji细胞 凋亡细胞或raji细胞 抗cd20 凋亡细胞的小鼠中有29%(图23e)。
[1046]
结论:
[1047]
凋亡细胞输注增加白血病小鼠的寿命、增加获得完全缓解的小鼠的数量以及增强抗cd20 mab治疗作用(图23a-23e)。
[1048]
实例11:apocell(早期凋亡细胞)对白血病/淋巴瘤的效应
[1049]
目的:此处所呈现的工作具有三个主要目标:(1)在疾病发作、进展和继而发生的死亡方面对apocell在白血病-淋巴瘤小鼠模型中的效应进行评价;(2)在用apocell进行治疗后对肿瘤细胞在白血病-淋巴瘤小鼠模型中的分布进行评估;以及(3)对apocell和利妥昔单抗(rtx)在治疗scid-bg小鼠的白血病-淋巴瘤中的可能的协同效应进行评估。作为实现这些目的的工作的一部分,对apocell施用后的白血病小鼠的生存期的测量进行了测量。同样,在用apocell进行治疗后对肿瘤细胞的分布进行了测量。
[1050]
方法:
[1051]
小鼠。向7周龄的雌性scid-bg小鼠(envigo,耶路撒冷,以色列)静脉内注射raji细胞,每只小鼠注射0.1
×
106个细胞。在实验的第5天、第8天和第11天,小鼠静脉内接受3个剂量的30
×
10
6个
apocell。对于组合疗法,在apocell施用后1.5小时,小鼠接受一个剂量(第8天)的rtx(2或5mg/kg;美罗华(mabthera),罗氏公司,巴塞尔,瑞士)。
[1052]
每天追踪小鼠,并且每周称重两次。终点被定义为死亡或由于以下症状中的任一种症状的发展而处死:截瘫(下肢麻痹)、相较于小鼠起始体重减轻20%、嗜睡、移动性降低或呼吸努力增加。
[1053]
根据卡普兰-迈耶方法进行存活率分析。将小鼠按照机构动物护理和使用委员会(iacuc)指南保持在无特异性病原体(spf)的动物设施中。
[1054]
raji细胞系。这种人类伯基特氏淋巴瘤(burkitt's lymphoma)细胞系购自欧洲鉴定细胞培养物保藏中心(ecacc,目录号:85011429),并将其常规地培养在完全培养基(补充有10%热灭活的fbs、1%glutamax、1%青霉素/链霉素的rpmi-1640)中。
[1055]
apocell。基本上,如实例1中所描述的。简而言之,通过白细胞去除术从健康的、有资格的供体收集富集的单核细胞级分。单采血液成分术完成后,将细胞洗涤,并用由ph7.4的plasmalyte a、5%人血清白蛋白、10%二甲亚砜(dmso)、5%抗凝血剂柠檬酸盐葡萄糖溶液配方a(acd-a)和0.5u/ml肝素构成的冷冻培养基重悬。然后将细胞逐渐冷冻并转移到液氮以长期储存。
[1056]
为了制备apocell,将冷冻保存的细胞解冻,洗涤,并用由补充有2mm l-谷氨酰胺和10mm肝素的rpmi 1640、10%自体血浆、5%acd-a、0.5u/ml肝素钠和50μg/ml甲基泼尼松龙构成的凋亡诱导培养基重悬。然后将细胞在37℃下在5%co2中温育6小时。温育结束时,使用细胞加工系统将细胞收集、洗涤并重悬于哈特曼氏溶液中。将apocell以290g在2-8℃下离心10分钟,并重悬于哈特曼氏溶液中以供注射。使用fcs express软件使用膜联蛋白v
和碘化丙啶(pi,医学和生物实验室(medical&biological laboratories),名古屋,日本)测定apocell的凋亡和活力。
[1057]
流式细胞术。从处死的小鼠收集小鼠脾、肝和骨髓(如上文所定义的临床体征的恶化后),并通过流式细胞术(facscalibur,bd,富兰克林湖,新泽西州,美国)针对raji肿瘤(抗cd20)的存在进行分析。
[1058]
结果:
[1059]
部分a:apocell延迟白血病小鼠的疾病发作和继而发生的死亡
[1060]
图24是呈现了3个单独实验的卡普兰-迈耶存活率曲线(rpmi组,n=15;raji组,n=23;raji apocell组,n=24)。在每个实验中,向雌性scid-bg小鼠(7
–
8周龄)静脉内注射0.1
×
106个raji细胞,并向对照组注射rpmi。然后,在第5天、第8天和第11天,通过静脉内施用(iv)向小鼠施用三个剂量的30
×
106个apocell。每天追踪小鼠,并且每周称重两次。终点被定义为死亡或由于以下症状中的任一种症状的发展而处死:截瘫(下肢麻痹)、相较于小鼠起始体重减轻20%、嗜睡、移动性降低或呼吸努力增加。实验细节在表11中给出。看到apocell的显著有益效应(p=0.002,对数秩(mantel-cox)检验)。
[1061]
表11:图a曲线的实验细节
[1062][1063][1064]
*dfs=无疾病存活
[1065]
图25a-25c中呈现了单独研究的数据。
[1066]
如上文所描绘的,在施用raji细胞后,与未经治疗的小鼠相比,用3个剂量的apocell治疗的小鼠的疾病进展较慢,并且死亡显著较晚(p=0.0020)。
[1067]
用apocell治疗的白血病小鼠的症状发作显著延迟,与未经治疗的对照小鼠相比,表现出较慢的疾病进展,并且死亡较晚。有趣的是,用raji细胞和apocell进行施用的小鼠中约有10%在这种白血病/淋巴瘤模型中没有发展出预期症状特征中的任何预期症状特征,并且保持健康直到实验终止(第53天或第60天)。
[1068]
apocell使白血病小鼠的肿瘤负荷减轻
[1069]
在处死后,在如上文所描述的临床体征恶化后,收集所关注器官用于进行分析(即,肝、脾和骨髓)。通过流式细胞术针对人肿瘤细胞(raji细胞对cd20呈阳性)的存在对这些靶器官的细胞进行分析。
[1070]
以下数据(表12)描述了来自上文所描述的3个实验的处死的小鼠的靶器官中的细胞群平均百分比;每个实验中的单独小鼠的值可以在下表13-18中找到。
[1071]
表12:脾、骨髓和肝中的肿瘤群的平均百分比(流式细胞术)
[1072][1073]
体内实验011
[1074]
对骨髓、脾和肝中的cd20 细胞进行facs分析:
[1075]
在第60天处死时,接受三个剂量的apocell的一只小鼠是健康的。
[1076]
收集肝、脾和骨髓细胞,并通过流式细胞术(facscalibur,bd)针对人cd20-fitc(生物传奇公司,目录号302206);migg1-fitc(生物传奇公司,目录号400110)的存在对其进行分析。
[1077]
体内实验019
[1078]
对骨髓、脾和肝中的肿瘤细胞进行facs分析:
[1079]
从在如方法中所定义的临床恶化后被处死的小鼠收集小鼠脾、肝和骨髓细胞,并通过流式细胞术(facscalibur,bd)针对人cd20(fitc)的存在对其进行分析。
[1080]
脾、骨髓和肝的分析结果在下表13-15中呈现。
[1081]
表13:脾
[1082][1083]
表14:骨髓
[1084][1085][1086]
表15:肝
[1087][1088]
体内实验023
[1089]
如通过流式细胞术所测定的脾、骨髓和肝中的cd20肿瘤细胞的表达(%)。从(在如
方法中所定义的临床恶化后)被处死的小鼠收集小鼠脾、肝和骨髓细胞,并通过流式细胞术(facscalibur,bd)针对人cd20(fitc)的存在对其进行分析。单独小鼠的脾、骨髓和肝的结果在下表16-18中呈现。
[1090]
表16:脾
[1091][1092][1093]
表17:骨髓
[1094][1095][1096]
表18:肝
[1097][1098][1099]
初步结论:综上所述,小鼠器官中的肿瘤分布与存活率曲线中所看到的有益效应相关并且在经治疗的小鼠的骨髓和肝中显著减少。
[1100]
部分b:apocell和利妥昔单抗(rtx)在治疗白血病/淋巴瘤中的协同效应
[1101]
接下来,通过在两个实验中对rtx和apocell对白血病小鼠的组合作用进行评价来检查apocell治疗是否与白血病/淋巴瘤的其它常规治疗协同。
[1102]
目的:对rtx和apocell施用后的白血病小鼠的生存期进行测量,并对白血病小鼠中的骨髓、肝和脾中的肿瘤细胞进行检测。
[1103]
方法:以下工作是对在组合疗法实验(apocell和rtx)中获得的结果的代表性描述。简而言之,向雌性scid浅褐色小鼠静脉内注射0.1
×
106个raji细胞(所有组中n=7)。在第5天、第8天和第12天,小鼠静脉内接受三个剂量的30
×
106个apocell。在第8天,在apocell注射后1.5小时,小鼠接受2或5mg/kg rtx的单个静脉内剂量。每天追踪小鼠,并且每周称重两次。终点被定义为死亡或由于以下症状中的一种或多种症状的发展而处死:截瘫(下肢麻痹)、相较于起始体重减轻20%、嗜睡、移动性降低或呼吸努力增加。
[1104]
结果:
[1105]
如图26中所示出的,apocell具有有益效应,从而证实了图24中所呈现的结果。仅rituxan(rtx)相较于2mg和5mg两种剂量的apocell而言具有优越效应,但是apocell和rituxan的组合在2mg(p=0.104)和5mg两种剂量下都具有协同效应,尽管以5mg所见到的协同效应并未达到统计学显著性。小鼠器官中的肿瘤分布与有益效应相关(表19)。
[1106]
表19:对存活率分布进行统计分析(对数秩(mantel-cox)检验)
[1107][1108]
实验结束-第57天
[1109]
实验结束后,宣布一只小鼠(raji rtx 2mg/kg apocell)无疾病
[1110]
在另外的实验中,对一个2mg rtx剂量的协同效应进行了测量。如这个实验中所明确示出的(图27),apocell和rtx的协同效应再次被验证为显著的(p=0.01)。
[1111]
如表20中所述示出的,脾未被肿瘤细胞填充(0.1-0.3表示背景染色)并且用作对照。相反,骨髓和肝是肿瘤靶标。通过apocell和rtx单独治疗后,骨髓和肝中的肿瘤群(如使用cd20标志物测量的rajji细胞)减少,并且当组合给予两者时,益处增加;对于raji rtx(2mg/kg) apocell,p=0.0034(**),并且对于raji rtx(5mg/kg) apocell,p=0.0031(**)(t检验)。如所预期的,rtx使白血病小鼠的靶器官中的肿瘤负担显著减轻。有趣的是,仅用apocell进行治疗使那些器官中的肿瘤细胞减少到与用常规rtx疗法进行治疗相当的水平。
[1112]
表20:脾、骨髓和肝中的平均肿瘤细胞群(流式细胞术)
[1113][1114]
结论:总之,存活率曲线(图24、图26和图27)明确证实了单独的apocell和rtx的有益效应以及组合的apocell和rtx的协同效应。值得注意的是,当常规rtx治疗与apocell组合时,无论rtx剂量如何,生存期时间均显著增加,这指示两种疗法有效的协同效应。支持性临床观察是骨髓和肝中的肿瘤细胞群的减少(表12)。
[1115]
令人惊讶地,独立于任何其它治疗,apocell制剂对白血病小鼠模型中的疾病进展和生存期具有显著有益的效应。10-20%的小鼠在卡普兰-迈耶分析中具有延长的生存期(图24、图26和图27),并且肝和骨髓中的肿瘤细胞负担减轻。此外,当apocell和rtx组合施用时,具有明显的协同效应,从而进一步延迟了疾病发作和进展,并提高了存活率。
[1116]
实例12:汇集的凋亡细胞制剂在gvhd白血病/淋巴瘤模型中的使用
[1117]
在以下初步工作中,对相同输注在gvhd白血病/淋巴瘤模型中的效应进行了检查。对经辐照的多供体单次凋亡细胞输注(汇集的经辐照的单核凋亡细胞制剂)用于预防经历骨髓移植(bmt)的小鼠的急性gvhd的安全性和有效性进行了检查。在这个模型中,bmt挽救了经辐照的小鼠(80-100%)。
[1118]
关于移植物抗白血病(gvl)效应可能失去的问题在潜在地避免高等级agvhd的每一次成功治疗中都会出现,因为发现这种效应与gvhd的严重程度相关。
[1119]
方法
[1120]
按照以上实例1制备凋亡细胞,以下除外:在当前实验中,同时从4个供体进行制备。在从4个供体进行制备后,将细胞制剂在最后步骤处(辐照之前)组合,之后立即对其进行辐照,并在辐照之后将其立即注射。辐照为25gy。
[1121]
结果
[1122]
图28和29中所呈现的两个图示出了单次注射来自多个个体供体的凋亡细胞(点划线)对生存期和体重减轻两者的明显效应(p《0.01)。图28是用来自多个个体供体的单个剂量的经辐照的凋亡细胞治疗的gvhd小鼠模型中的kaplan-meier存活率曲线,其中生存期得到显著改善。图29是遵从图28的发现并与所述发现相关的2个比较组的体重减轻的百分比。
[1123]
总之,在gvhd小鼠模型中,单次输注多供体的经辐照的凋亡细胞成功且显著地提高了预期寿命。
[1124]
实例13:来自多个个体供体的凋亡细胞的稳定性标准
[1125]
这项研究的目的是建立来自多个个体供体的凋亡细胞的稳定性标准并与未经辐照的hla匹配的凋亡细胞进行可比性研究(mevorach等人(2014)《血液与骨髓移植生物学(biology of blood and marrow transplantation)》20(1):58-65;mevorach等人(2015)《血液与骨髓移植生物学》21(2):s339-s340)。
[1126]
在凋亡细胞最终产物制剂在2-8℃下储存8小时、24小时、48小时和60小时并在每个时间点处进行采样后,将对其细胞数量、活力、凋亡表型和效力进行评价。将按照标准操作程序(sop)(实例1;实例5)和批次记录(br;即,特定的制备程序)来制备凋亡细胞最终产物批次。为了进行效力评价,将对早期凋亡细胞制剂最终产物批次的样品用于抑制脂多糖(lps)诱导的未成熟树突状细胞(时间点0-24小时)或单核细胞(时间点0-6)上的mhc-ii表达的上调进行测试,并将根据sop执行并记录在br上。将对分别源自多个个体供体和源自单一供体的制剂中的汇集产物和非汇集产物进行这些系列的测试。
[1127]
另外,将对cd3(t细胞)、cd19(b细胞)、cd14(单核细胞)、cd15
高
(粒细胞)和cd56(nk细胞)的流式细胞术分析进行文件记录。这些研究的目的为了证实结果在窄范围内的一致性。初步结果与这些目标一致,未注意到与sop的偏差,并且未报告技术问题。然而,需要进行进一步研究以便总结出有效治疗的范围和稳定性。初步结果示出所有这些参数等效。进一步地,单一供体稳定性研究示出至少在48小时的时间段内具有稳定性(参见实例1)。
[1128]
实例14:多供体的经辐照的凋亡细胞作为针对急性移植物抗宿主疾病的预防的安全性和功效
[1129]
目的:1/2a期、多中心、开放性研究对以下进行评价:来自多个不匹配供体的经辐照的凋亡细胞的单个剂量施用以预防经历同种异体的hla匹配的造血干细胞移植的人白细胞抗原匹配的亲属(related)和非亲属(unrelated)患者的造血恶性肿瘤中的移植物抗宿主疾病的安全性、耐受性和初步功效。
[1130]
主要目的:为了测定多供体的经辐照的凋亡细胞治疗的安全性和耐受性。
[1131]
次要目的:为了测定来自多个个体供体的经辐照的凋亡细胞作为计划经历造血干细胞移植(hsct)的患有造血恶性肿瘤的患者的急性gvhd(agvhd)的预防措施的功效。出于这项研究的目的,hsct可以是骨髓移植(bmt)或外周血干细胞移植(pbsct)。
[1132]
治疗适应征:人白细胞抗原(hla)匹配的、亲属和非亲属患者的造血恶性肿瘤中的
移植后移植物抗宿主疾病(gvhd)。
[1133]
研究设计:这是一项对计划在完全清髓性调理方案或强度降低的清髓性调理方案之后经历来自hla匹配的亲属或非亲属供体的hsct(骨髓移植或外周血干细胞移植)的被诊断患有造血恶性肿瘤的患者进行的开放性研究、多中心、1/2a期研究。
[1134]
在接受者患者签署知情同意书、供体筛选期以及开始调理方案之前进行的细胞收集之后,有资格的接受者患者将被分配到(通过预防性治疗和比率为1:1的亲属移植供体与非亲属移植供体进行分层)在hsct移植前12-36小时接受静脉内(iv)注射或被分配到:
[1135]
研究组:来自磷酸盐缓冲溶液(pbs)中的多个个体供体的经辐照的早期凋亡细胞/kg体重的单个剂量的140
×
106±
20%个细胞/kg。
[1136]
所有患者也将用机构护理标准(soc)免疫抑制方案进行治疗:环孢霉素(cyclosporine)/甲氨蝶呤或他克莫司(tacrolimus)/甲氨蝶呤用于完全清髓并且霉酚酸酯(mycofenolate)/环孢霉素或霉酚酸酯/他克莫司用于强度降低的。患者将按照医学指示住院。
[1137]
对于次要功效终点,将对患者进行为期180天的随访,对于主要安全性和第三功效终点,将对患者进行为期1年的随访。参加这项研究的患者的访视次数将与处于其病状中的患者习惯的访视次数相当。对于供体,将在筛选期期间针对单采血液成分术程序进行研究特异性访视。
[1138]
由于这些患者患有许多潜在的医疗病状并且可能会经历与agvhd相容的症状,因此尽管自使用凋亡细胞进行gvhd预防的先前1-2a期研究就存在基础数据,但是可能难以绝对地测定毒性是否与凋亡细胞有关(mevorach等人(2014)《血液与骨髓移植生物学》20(1):58-65)。单次输注供体单核早期凋亡细胞作为针对清髓性的hla匹配的同种异体骨髓移植中的移植物抗宿主疾病的预防:i/iia期临床试验。(《bbmt》20(1)58-65)。
[1139]
数据安全性监测委员会(dsmb)将满足如dsmb章程中所规定的,包含在计划的中期分析之时(180天),前提是事先没有提出安全性隐患。
[1140]
研究程序:
[1141]
研究将包含筛选期、治疗期和随访期。
[1142]
1.筛选期(第-60天到第-2天)
[1143]
潜在的接受者患者将在任何研究相关程序之前签署知情同意书。批准前的标准评估将由移植中心在筛选期期间针对供体进行并且通常包含:人口统计学数据、病史、hla匹配状态验证(无需匹配)、体检、身高和体重、生命体征、妊娠测试(所有女性)、血液学、血液化学、感染性疾病筛选、ecg和尿液分析。
[1144]
接受者(研究患者)在筛选期期间将经历以下评估:人口统计学数据、病史、卡诺夫斯基(karnofsky)表现状态、hla匹配验证、体检、身高和体重、生命体征、妊娠测试(所有女性)、ecg、肺功能测试、血液学、血液化学、凝血标志物、感染性疾病筛选和尿液分析。
[1145]
在初始筛选评价后,如果接受者有资格参加研究,则将在调理方案的第一天将接受者患者分配到接受140
×
106±
20%个细胞/kg的多供体凋亡细胞的单次静脉内输注。调理方案应在计划于研究第-1天进行的凋亡细胞输注的前一天或当天完成。
[1146]
将针对每个接受者患者计算凋亡细胞剂量,并且将因此决定推测的单采血液成分术收集次数和供体数量。
[1147]
对于外周干细胞移植供体:在第-6天到第-1天之间,供体将接受一次或多次g-csf的每天一次注射以动员祖细胞,并且在第0天,将经历单采血液成分术以产生供体造血干细胞以供移植。用于骨髓移植的造血干细胞的制备将由受过训练的医院工作人员根据中心标准实践进行。用于hsct的造血干细胞将不会在施用前繁殖或被t细胞耗竭。
[1148]
对于骨髓移植供体:骨髓将按照中心标准实践来采集和制备并且将不会以其它方式繁殖。
[1149]
2.治疗日(第-1天)
[1150]
在第-1天(hsct前12-36小时),有资格的患者将接受多个个体供体的经辐照的早期凋亡细胞的140
×
106±
20%个细胞/kg的单次静脉内输注。输注期间每小时应监测一次生命体征,此后的前24小时每4个小时监测一次。输注后将立即对治疗相关ae进行评估。。
[1151]
在第0天,患者将根据当地机构指南经历造血干细胞移植。
[1152]
3.短期随访期(第0天到第180天)
[1153]
患者将接受随访至研究第180天以对主要终点安全性和耐受性以及次要和第三终点进行评估:ii-iv级agvhd的累积发病率(基于przepiorka等人的“改良的glucksberg(modified glucksberg)”共识);任何等级和高等级agvhd的累积发病率(即,发展出ii-iv级agvhd的时间);对gvhd的任何全身性治疗;以及cgvhd的发展。
[1154]
将在住院以进行移植期间每天进行短期随访访视(通常至少为第-1天到第 14天或更多)并且将在出院后的前7周期间每周进行一次访视;第 7天、第 14天、第 21天、第 28天、第 35天、第 42天,并且然后在第60天、第100天、第140天和第180天。在随后的长达180天的随访期期间,针对每周一次访视(前7周),访视窗口将为
±
5天,并且针对每两周一次或更多周一次访视,访视窗口将为
±
5天。
[1155]
将在第1天、第3天、第7天、第 7天、第 28天、第 42天、第60天、第100天、第140天和第180天获得血液样品,并针对植入、免疫恢复、血浆和血清生物标志物(“michigan”)和细胞亚群的文件记录对其进行检查。
[1156]
4.长期随访期(第181天到第365天/1年)
[1157]
hsct后将对患者进行为期一年的长期随访以监测次要终点:非复发死亡率和总体生存期(os)、复发的发病率、无白血病生存期(lfs)和慢性gvhd。要进行至少两次长期随访访视,最后一次是在hsct后的12
±
1个月。
[1158]
研究持续时间:对于每名参加患者,研究的持续时间将长达14个月,如下:
[1159]
筛选:长达60天(2个月)
[1160]
治疗:1天
[1161]
随访:365天(12个月),由以下组成:
[1162]
短期:180天
[1163]
长期: 180天
[1164]
研究群体:总共25名患者将被纳入这项研究中并将与历史对照进行比较,所述患者被诊断患有血液恶性肿瘤,计划在清髓性调理方案或强度降低的调理方案之后按照中心标准实践经历用至少15名非亲属供体进行的hsct(骨髓移植或外周血干细胞移植)。
[1165]
纳入/排除标准:
[1166]
接受者患者排除标准
[1167]
1.有资格针对以下恶性肿瘤进行同种异体hsct的患者,年龄》18:
[1168]
处于完全缓解(任何缓解)或超越完全缓解但从形态学来看骨髓中的母细胞《5%的急性髓性或未分化或双表型白血病。
[1169]
处于完全缓解的急性髓性白血病(aml),如果其已经从骨髓增生异常综合症(mds)演变(应在诊断出急性髓性白血病前至少3个月对诊断出mds进行文件记录)。或从真性红细胞增多症或特发性血小板增多症演变。
[1170]
处于完全缓解(任何缓解)、从形态学来看骨髓中的母细胞《5%的急性成淋巴细胞性白血病(all)。
[1171]
处于慢性或加速期的慢性髓性白血病(cml)。
[1172]
骨髓增生异常综合症-难治性血细胞减少症伴多系发育异常(rcmd)、ra(难治性贫血)、ra伴环形铁粒幼红细胞(rars;所有《5%母细胞)、ra伴母细胞增多(raeb;5%到20%母细胞)。
[1173]
移植供体和接受者患者必须在hlaa、b、c、dq和dr基因座处具有至少8/8hla匹配,并且没有抗原或等位基因错配。然而,用于凋亡细胞形成的白细胞的一个或多个供体不限于hla匹配。
[1174]
筛选访视时的表现状态得分为至少70%(针对成人进行卡诺夫斯基并且针对《16岁的接受者进行兰斯基(lansky))。
[1175]
在开始调理的4周内的成人的心脏左心室射血分数》40%;如果先前接触蒽环类或有心脏疾病史,则需要进行muga扫描或心脏echo。
[1176]
对dlco1、fev1(用力呼气量)和fvc(用力肺活量)进行的肺功能测试》所预测的60%。
[1177]1肺对一氧化碳的扩散能力
[1178]
室内空气中的氧气饱和度为至少90%。
[1179]
患者必须具有如下所定义的充分的器官功能:
[1180]
ast(sgot)/alt(sgpt)《3
×
正常上限(uln)。
[1181]
血清肌酐《2.0mg/dl(成人,》16岁)或《0.8(1-2岁)、《1(3-4岁)、《1.2(5-9岁)、《1.6(10-13岁)和1.8(14-15岁)。
[1182]
血清胆红素《3mg/dl,除非由于吉尔伯特氏病(gilbert's disease)或溶血。
[1183]
由患者或监护人(在未成年人的情况下)签署独立参加研究的书面知情同意书。
[1184]
符合研究要求的能力。
[1185]
在4周(从第-1天开始)的持续时间内,女性和男性都必须同意:
[1186]
使用可接受的避孕方法,或者在存在bmt相关限制的情况下,在第一个月或更长时间内进行外科手术绝育。
[1187]
无论生育能力如何,妊娠测试呈阴性。
[1188]
接受者患者排除标准
[1189]
纳入标准中未指定的有资格进行hsct的所有疾病。
[1190]
筛选访视的30天内参加介入性研究试验。
[1191]
患有进行性或控制不良的恶性肿瘤。
[1192]
如果bmt计划包含t细胞耗尽同种异体移植。
[1193]
如果bmt计划包含抗胸腺细胞球蛋白(atg)或阿仑单抗作为用于预防移植后gvhd的免疫抑制方案或高剂量环磷酰胺疗法的一部分。
[1194]
筛选访视的两周内出现不受控制的感染,包含败血症、肺炎伴血氧不足、持续性菌血症或脑膜炎。
[1195]
当前已知的活动性急性或慢性hbv或hcv感染。
[1196]
已知的人免疫缺陷病毒(hiv)感染。
[1197]
需要呼吸机支持的患有严重或症状性的限制性或阻塞性肺疾病或呼吸衰竭的患者。
[1198]
患有其它并发的严重和/或不受控制的医学病状的患者,所述医学病状可能会损害研究的参与度(即,活动性感染、不受控制的糖尿病、不受控制的高血压、充血性心力衰竭、不稳定的心绞痛、室性心律不齐、活动性缺血性心脏病、六个月内的心肌梗塞、慢性肝或肾疾病、活动性上消化道溃疡)。
[1199]
任何容易干扰研究产物功效评价的慢性或急性病状。
[1200]
据研究者的见解容易干扰研究的进行的任何形式的物质滥用(包含药物或酒精滥用)、精神紊乱或任何慢性病状。
[1201]
同种异体器官移植或干细胞移植的既往史(仅同种异体)。
[1202]
有生育能力的女性的母乳喂养。
[1203]
在研究期间可能不顺应或不合作的患者。
[1204]
研究产物途径和剂型
[1205]
将在hsct前12-36小时采用静脉内输注140
×
106 20%个细胞/kg的经辐照的多供体凋亡细胞产物来施用凋亡细胞。
[1206]
凋亡细胞是由多个个体供体的凋亡细胞构成的基于细胞的治疗剂。产物以液体悬浮液的形式含有同种异体供体的富集的单核的细胞,其中至少40%为早期凋亡细胞。根据gmp法规用pbs溶液从多个个体供体制备悬浮液,并且应将其储存在2-8℃下直到输注。最终产物在不透明转移包袋中的总体积为300-600ml,并且在制备后将以25gy对其进行辐照。研究产物应在完成制备过程的48小时内施用于患者。
[1207]
安全性结果/功效终点/结果量度
[1208]
主要:
[1209]
安全性和耐受性终点包含移植和体检的时间以在第180天和第360天(1年)时测定不良事件、伴随用药和安全性实验室。进一步地,预期经辐照的汇集的凋亡细胞制剂将示出缺少体外和体内细胞增殖并且缺少体内活化。此种示出将汇集的凋亡细胞制剂鉴定为可安全使用。
[1210]
次要:
[1211]
第180天时的ii-iv级agvhd的累积发病率,使用“改良的glucksberg”共识,基于(rowlings等人1997)(用于对急性移植物抗宿主疾病进行分级的ibmtr严重程度指数:与glucksberg等级进行回顾性比(ibmtr severity index for grading acute graft-versus-host disease:retrospective comparison with glucksberg grade)《英国血液学杂志(br j haematol.)》1997年6月;97(4):855-64)。
[1212]
1年非复发死亡率和总体生存期(os)
[1213]
1年复发的发病率
[1214]
1年无白血病生存期(lfs)
[1215]
前180天内的agvhd的最高等级
[1216]
iii-iv级agvhd的累积发病率
[1217]
第180天和第360天(1年)时的慢性gvhd的发病率,根据(jagasia等人,2015)。
[1218]
第20天到第180天时的用于治疗agvhd的包含皮质类固醇的任何“全身性治疗”(是否使用以及累积剂量)
[1219]
与t、b、nk和单核细胞有关的第 28天、第100天、第180天和第360天(1年)的免疫重建和功能
[1220]
第180天和1年内的主要感染率(包含肺浸润、cmv再活化和任何其它需要住院的感染)。
[1221]
第三/探索性:
[1222]
住院天数占处于风险的总天数、活的总天数和出院天数的百分比。或直到移植后首次出院的总住院天数。
[1223]
器官特异性gvhd
[1224]
第180天的t reg、cd4 tcon、cd8、nk和b细胞水平
[1225]
统计分析:
[1226]
在个体具有相当的基线特征的情况下,将研究结果与历史对照进行比较。
[1227]
描述性统计将用于汇总结果量度和基线特征。在这个分析中,将在不会对任何缺失数据进行插补的情况下呈现所有可用数据。受试者将贡献可用的数据,直到退出或研究完成或死亡为止。描述性统计(如均值、中值、标准偏差、最小值和最大值)将用于汇总连续变量。接受凋亡细胞输注的所有受试者将被纳入安全性分析中。还接受hsct的受试者将被纳入功效分析中。由于这项研究本质上是探索性的,因此计划进行专门分析。
[1228]
样品大小考虑
[1229]
总共将纳入25名患者,至少15名匹配的非亲属患者将入选。凋亡细胞活性将给予所有(根据gvhd预防方案分层)以及亲属与非亲属移植供体。
[1230]
群体分析定义
[1231]
将对意向治疗(itt)群体进行所有功效分析,并将其与充分的历史对照进行比较。安全性群体将被定义为接受一定剂量的研究药物的所有患者。
[1232]
统计方法
[1233]
将在适当时使用频率和百分比或中值(范围)来对患者、疾病和移植的特征进行描述。
[1234]
安全性分析
[1235]
描述性统计将用于汇总安全性结果,其重点是研究治疗输注与hsct程序(24-30小时窗口)之间所报告的ae。不会因dsmb审查引起研究进行的改变,包含样品大小调整。因此,作为中期分析的结果,将不需要对整体i型错误进行罚分调整。
[1236]
次要终点分析
[1237]
将使用累积发病率估计器描述ii-iv级agvhd,其中agvhd前的死亡作为竞争事件。
[1238]
将使用累积发病率描述嗜中性粒细胞和血小板恢复、iii-iv级agvhd、慢性gvhd、
感染、复发和移植相关死亡率,其中复发作为trm的竞争事件并且死亡作为所有其它的竞争事件。将使用卡普兰-迈耶估计器描述总体生存期和无白血病生存期。将分别使用曼-惠特尼u检验(mann whitney u test)和卡方检验(chi-square test)使用频率和百分比来描述前180天内的agvhd的最高等级和180天时对类固醇的需求。将使用中值和范围曼-惠特尼检验在每个时间点处描述每个细胞亚群和treg的免疫恢复。
[1239]
实例15:对gvhd白血病/淋巴瘤模型中的汇集的凋亡细胞制剂对单个供体凋亡细胞制剂进行比较
[1240]
目的:将从单个供体获得的人早期凋亡细胞对gvhd鼠类模型中的gvhd的严重程度的有益临床效应与从多个个体供体获得的人早期凋亡细胞(如果有的话)对gvhd鼠类模型中的gvhd的严重程度的临床效应进行比较,其中所述多个个体供体表示hla不匹配的异源供体。
[1241]
以上实例12示出了从多个个体供体汇集的经辐照的凋亡细胞的有益效应。图28和图29中所示出的结果令人惊讶,因为技术人员可以认识到,多个来源的不匹配细胞可能已经使细胞的抗原性的多样性增加,并且因此将会预期使临床效应显著降低。出乎意料的是,汇集的不匹配的早期凋亡细胞也使早期凋亡细胞对降低gvhd严重程度并且因此延长直至死亡的天数的已知有益效应减轻(图28),据称这将会由于汇集的多个不匹配来源细胞而使抗原性增加。
[1242]
另外的目的是了解使用经辐照的早期凋亡细胞与使用未经辐照的凋亡细胞之间是否存在差异。
[1243]
技术人员应理解,不匹配的、经辐照的细胞保持其如apc机制以及其已经输注到其中的宿主的t细胞所识别的抗原谱。因此,在汇集异源的不匹配的细胞群时,关注问题包含正在汇集的单独群之间的交叉反应性、汇集的群的混合细胞淋巴反应或汇集的群之间的可能会减少或消除细胞的t细胞免疫反应或其任何组合。
[1244]
方法
[1245]
小鼠模型:在错配的gvhd模型中,将雌性7-9周龄的balb/c小鼠(h-2d)用作接受者,并将雌性8-9周龄的c57bl/6小鼠(h-2b)用作供体。在骨髓和脾细胞移植前24小时以850cgy对接受者进行全身辐照。使用供体骨髓细胞进行骨髓重建。用rpmi 1640从股骨和胫骨中提取骨髓细胞。裂解红细胞,然后将细胞洗涤并用pbs重悬。使用台盼蓝染料排除法对活力进行评估(》90%活力)。使用供体脾细胞进行gvhd诱导。将脾去除并均质化,并获得单细胞悬浮液。裂解红细胞,并将脾细胞用pbs重悬。使用台盼蓝染料对至少90%活细胞进行评估。
[1246]
早期凋亡细胞:从类似于实例1的健康供体进行富集的单核细胞级分单采血液成分术来产生凋亡细胞。简言之:
[1247]
通过白细胞去除术从健康的、有资格的供体获得富集的单核细胞(mnc)级分。除400-600ml的自体血浆外,还通过spectra单采血液成分术系统从12升的血液收集细胞。预期来自供体的富集的单核细胞级分的估计产率为大约1.2-1.5
×
10
10
个细胞。在白细胞去除术程序之前,对供体进行测试并确认其对以下病毒载体呈阴性:
[1248]
1.1型和2型人免疫缺陷病毒(hiv);
[1249]
2.乙型肝炎病毒(hbv);
[1250]
3.丙型肝炎病毒(hcv);
[1251]
4.巨细胞病毒(cmv);
[1252]
5.梅毒螺旋体(梅毒);
[1253]
6.i型和ii型人t嗜淋巴细胞病毒(htlv)。
[1254]
细胞收集后,将细胞用rpmi洗涤并如下进行冷冻。冷冻调配物由ph 7.4的注射用plasmalyte a、10%dmso、5%人血清白蛋白和接种有10u/ml肝素的5%抗凝血剂柠檬酸盐葡萄糖溶液构成。
[1255]
在袋中制备冷冻培养基,并在cgmp条件下在封闭系统中进行冷冻程序。
[1256]
在白细胞去除术程序完成后,将富集的mnc级分用plasmalyte a洗涤并用冰冷的冷冻培养基重悬到50-65
×
106个细胞/ml的浓度。然后将细胞转移到冷冻袋,将袋转移到预冷却的铝盒,并将盒立即转移到-18-(-25)℃持续两小时。
[1257]
两小时后,将盒转移到-80℃持续另外2小时,并且然后转移到液氮(》-135℃)中以长期储存。
[1258]
将自体血浆分成50gr等分试样。将血浆等分试样转移到-80℃持续2小时,并且然后转移到-18-(-25)℃以长期储存。
[1259]
为了凋亡诱导,将细胞解冻,并用含有10mm hepes缓冲液、2mm l-谷氨酰胺和接种有10u/ml肝素的5%抗凝血剂柠檬酸盐葡萄糖溶液的预温热的rpmi1640洗涤。在上清液提取后,将细胞以5
×
106/ml的浓度重悬于rpmi 1640中,其补充有10mm hepes、2mml-谷氨酰胺、并添加10%自体血浆和50μg/ml甲基泼尼松龙和接种有10u/ml肝素的5%抗凝血剂柠檬酸盐葡萄糖溶液。然后将细胞转移到细胞培养袋,并在37℃、5%co2的加湿温育箱处温育6小时以使凋亡稳定。
[1260]
温育后,采集细胞,将其用pbs洗涤并重悬于pbs中。
[1261]
早期凋亡细胞产物是由一个单个供体或组合的10个不同的个体供体产生的,在这种情况下,细胞就在辐照前进行组合。因为多供体产物中的组分之间(例如,活的非凋亡细胞之间)可能会发生干扰,所以将早期凋亡细胞产物细分,并在施用前以2500cgy对要在体内测试的早期凋亡细胞的样品进行辐照(下文的样品f),并将其储存在2-8℃直到施用为止。实例6的表3下面呈现了早期凋亡细胞产物的膜联蛋白v阳性/碘化丙啶阴性比率和细胞表面标志物的细节,这确立了维持施用于小鼠的凋亡细胞的一致性。最终产物在2-8℃下稳定48小时。
[1262]
在移植的当天,根据以下实验设计,小鼠接受5
×
106个骨髓细胞、3
×
106个脾细胞和30
×
106个单个供体或多供体早期凋亡细胞产物:
[1263]
辐照对照
[1264]
重建对照-辐照 骨髓移植(bm)
[1265]
gvhd对照-辐照 骨髓和脾细胞移植
[1266]
单个供体、经辐照-辐照 骨髓和脾细胞移植 来自单个供体的经辐照的早期凋亡细胞产物
[1267]
单个供体、未经辐照-辐照 骨髓和脾细胞移植 来自单个供体的未经辐照的早期凋亡细胞产物
[1268]
多个供体、经辐照-辐照 骨髓和脾细胞移植 来自多个供体的经辐照的早期凋亡
细胞产物
[1269]
多个供体、未经辐照-辐照 骨髓和脾细胞移植 来自多个个体供体的未经辐照的早期凋亡细胞产物。
[1270]
监测-标记移植小鼠并监测其存活率。在实验的前两周,每两天评估一次体重,并且然后每天评估一次。将相较于初始体重减轻35%测定为主要终点,并将小鼠处死,并相应地更新存活率曲线。体重结果与实例12中观察到的结果相当,图29。
[1271]
使用已知的评分系统对gvhd的严重程度进行评估(cooke kr等人,骨髓移植后特发性肺炎综合征的实验模型,i.次要h抗原和内毒素的作用(an experimental model of idiopathic pneumonia syndrome after bone marrow transplantation.i.the roles of minor h antigens and endotoxin),《血液》1996;8:3230
–
3239),所述已知的评分系统涉及五个临床参数:体重减轻、姿势(弯腰驼背)、活性、毛皮纹理和皮肤完整性。针对每个标准,对小鼠进行评价,并从0到2进行分级。通过对五个临床得分进行汇总,产生了临床指标值(指标数量随gvhd的严重程度而增加)。
[1272]
结果
[1273]
图30中以图形方式呈现了不同小鼠群体的存活率百分比。如从未接受骨髓重建的小鼠所预期的,仅辐照对照小鼠在第8天与第12天之间死亡(n=13)。大多数gvhd对照小鼠(接受骨髓和脾)在第6天与第27天之间死亡。一只小鼠没有死亡(n=18)。在骨髓重建对照组(bm)中,7只小鼠中有3只在第6天与第8天之间死亡。在其余小鼠中,骨髓由供体骨髓重建,并且小鼠保持存活(》50天)。
[1274]
单个供体、未经辐照的小鼠在第15天与第36天之间死亡。因此,如先前所示出的,单个供体、未经辐照的早期凋亡细胞具有有益效应且生存期延长(p《0.01)。
[1275]
单个供体、经辐照的小鼠在第7天与第35天之间死亡,一只小鼠保持无疾病存活(》50天)。这证实了单个供体、经辐照的凋亡细胞也提供了相对于gvhd的有益效应。因此,辐照不会损害早期凋亡细胞的免疫调节效应。与gvhd对照相比,其均对gvhd鼠类模型的存活率具有有益效应(p《0.01)。
[1276]
与gvhd对照(n=11)相比,未经辐照的多供体治疗没有提供有益效应。存活模式与gvhd对照类似,并且小鼠在第6天与第28天之间死亡(p=ns-不显著)。令人惊讶地并且与未经辐照的凋亡细胞相反,与gvhd对照相比,经辐照的多个个体供体凋亡细胞(治疗f)(n=10)具有与单个供体治疗类似的有益效应。gvhd症状出现显著较晚,并且小鼠在第18天与第34天之间死亡(p《0.01)。
[1277]
经辐照的多个个体供体(n=10)、经辐照的单个供体(n=10)和未经辐照的单个供体治疗(n=10)具有类似的存活模式,并且在这三个治疗组之间未观察到对生存期的效应的显著差异。
[1278]
实验指示,在gvhd诱导的小鼠中,凋亡细胞的输注具有明显效应。对于经辐照的多个个体供体凋亡细胞以及经辐照的和未经辐照的单个供体凋亡细胞的治疗具有显著的生存期延长效应。
[1279]
多供体治疗在未经辐照时并未延长小鼠的生存期,但在施用于小鼠前对凋亡细胞产物的辐照改善了结果,并且治疗与单个供体治疗具有接近的存活模式。
[1280]
如上所述,图30示出了与以下相比而言:(1)从不匹配的单个供体获得的未经辐照
的凋亡细胞;(2)从不匹配的单个供体获得的经辐照的凋亡细胞;以及(3)从多个不匹配的供体获得的经辐照的凋亡细胞,从多个不匹配的供体获得的未经辐照的凋亡细胞已经使对gvhd和死亡率的降低(存活率%)的阳性临床效应显著降低。另外,所有三种(未经辐照的早期凋亡细胞,单个供体;经辐照的早期凋亡细胞,单个供体;以及经辐照的早期凋亡细胞,多个个体供体)具有类似效应。
[1281]
这个数据是令人惊讶的,因为预期从多个个体供体获得的未经辐照的凋亡细胞的抗原性与从多个个体供体获得的经辐照的凋亡细胞的抗原性类似,为什么两者均不会对植入的骨髓产生类似的敌对抗原反应,以及为什么两者均无法使gvhd和死亡率降低?
[1282]
如果抗原性是此处的主要问题,则预期看到从单个供体获得的未经辐照的凋亡细胞与从单个供体获得的经辐照的凋亡细胞的临床效应之间的差异。然而,数据并未示出这种差异。
[1283]
一种可能性是由多个个体供体制备的未经辐照的汇集的凋亡细胞制剂缺乏功效,这是由于存在于汇集的制剂中的个体单核群之间的交叉相互作用所导致的。这些相互作用似乎不直接归因于对宿主的抗原性,因为经辐照的细胞维持其抗原性,但功效与未经辐照的细胞显著不同。因此,似乎在接受辐照的汇集的早期凋亡细胞制剂中的交叉相互作用出乎意料地被消除,并且宿主对细胞的施用应答良好。
[1284]
如所示出的,经辐照的汇集的供体与未经辐照的单个供体具有基本上相同的效应。
[1285]
实例16:辐照对最终凋亡细胞产物的效应
[1286]
凋亡细胞由于其固有的免疫调节特性和抗炎特性而越来越多地用于新型治疗策略中。早期凋亡细胞制剂可以含有多达20-40%的活细胞(如通过以下测量到的:缺乏ps暴露和无pi进入;膜联蛋白v阴性和碘化丙啶阴性),其中一些在用于输液中后可能发生凋亡,但一些将保持存活。在从匹配的供体进行骨髓移植的情况下,活细胞并不表示临床问题,因为接受者已经在实际移植中接受了更多的活细胞。但是,在第三方输液的情况下(或如在汇集的单核凋亡细胞制剂中可能表示的第四方或更多方),使用包含活细胞的凋亡细胞群可能会引入第二种gvhd诱导剂。此外,迄今为止尚未评估辐照对早期凋亡细胞的免疫调节潜能的影响。技术人员可以考虑,对早期凋亡细胞群进行另外的辐照可能会导致细胞进展到凋亡或坏死的晚期。由于这关于临床应用似乎是特别相关的问题,因此下文所呈现的实验旨在解决这个问题,其至少一个目标是提高功能性凋亡细胞的生物安全性。
[1287]
因此,目的是促进凋亡细胞在许多适应征中的临床利用,其中凋亡细胞的效力可能依赖于旁观者效应而不是移植的细胞的植入。
[1288]
目的:对辐照对早期凋亡细胞的效应进行检查,其中辐照在诱导凋亡之后发生。
[1289]
方法(简言之):收集细胞,并基本上如实例5中所描述的制备早期凋亡细胞。
[1290]
在不同的日期制备三个单独的早期凋亡细胞批次(收集404-1、0044-1和0043-1)。
[1291]
将每个最终产物划分成三组:
[1292]
未经治疗的
[1293]
2500rad
[1294]
4000rad。
[1295]
辐照后,立即(t0)针对细胞计数、膜联蛋白v阳性-pi阴性染色、细胞表面标志物
(不同细胞类型的群%)和效力(树突状细胞(dc)),对早期凋亡细胞进行测试。在t0处进行检查后,将早期凋亡细胞储存在2-8℃下24小时,并在第二天使用相同的测试面板(t
24小时
)(细胞计数、膜联蛋白v阳性-pi阴性染色以及细胞表面标志物和效力)对其进行检查。
[1296]
先前,开发了释放后效力测定,其对供体单核早期凋亡细胞(早期凋亡细胞)诱导耐受性的能力进行评估(mevorach等人,《bbmt》2014同上)。测定基于使用流式细胞术评估暴露于lps后在idc膜上的ii类mhc分子(hla-dr)和共刺激分子(cd86)表达。如先前和反复所示出的,耐受性dc可以在与凋亡细胞相互作用时产生(verbovetsky等人,《实验医学期刊(j exp med)》2002,krispin等人,《血液》2006),并且抑制lps处理的dc的成熟(抑制dr和cd86表达)以剂量依赖性方式发生。
[1297]
在早期凋亡细胞临床研究的1/2a期期间,对每个早期凋亡细胞批次进行释放后效力测定(总体结果n=13)以便对每个批次诱导耐受性的能力进行评估(结果在图1中示出,mevorach等人(2014)《血液与骨髓移植生物学》20(1):58-65)。
[1298]
从收集自未知且非亲属的健康供体的新鲜血沉棕黄层针对每个早期凋亡细胞批次生成dc,并将其以不同比率(分别为1:2、1:4和1:8dc:早期凋亡细胞)与早期凋亡细胞组合。与早期凋亡细胞一起温育并暴露于lps后,基于在一种或多种dc:早期凋亡细胞的比率下hla dr或cd86的dc膜表达下调来测定效力。在所有13种测定中,早期凋亡细胞表现出耐受性效应,这在以最大dc:早期凋亡细胞比率进行制备的情况下可见,并且对于两种标志物,以剂量依赖性方式。
[1299]
单核细胞获得的未成熟dc(idc)是从健康供体的外周血pbmc产生的,并将其在存在1%自体血浆、g-csf和il-4的情况下培养。然后将idc以1:2、1:4和1:8的比率与新鲜制备的凋亡细胞最终产物或在2-8℃下储存24小时的凋亡细胞最终产物一起预温育2小时。同时对两种最终产物进行检查,以便测定储存是否影响凋亡细胞的效力能力。温育后,将lps添加指定孔,放置另外24小时。温育结束时,收集idc,将其洗涤并用dc-sign和hla-dr或cd86两者进行染色,以便测定表达的变化。使用流式细胞仪分析细胞,并使用fcs-express软件从dc-sign阳性细胞门进行分析以确保仅对dc进行分析。
[1300]
图31a和31b以及图32a和32b示出了经辐照的汇集的凋亡细胞相较于未经辐照的单个供体细胞的效力测试。
[1301]
结果:
[1302]
单个供体制剂
[1303]
表21呈现了未经辐照的凋亡细胞与经辐照的凋亡细胞的比较结果;24小时处的平均细胞损失(%);0小时和24小时处的膜联蛋白阳性(
)碘化丙啶(pi)阴性(-)%(早期凋亡细胞的%);0小时和24小时处的膜联蛋白阳性(
)碘化丙啶(pi)阳性(
)%(晚期凋亡细胞的%);0小时和24小时处的细胞表面抗原cd3(t细胞)、cd19(b细胞)、cd56(nk细胞)、cd14(单核细胞)和cd15
高
(粒细胞)的存在。
[1304]
表21:
[1305][1306]
表21中的结果示出,未经辐照的凋亡细胞和经辐照的凋亡细胞两者都具有相当百分比的早期(第2行和第3行)凋亡细胞和晚期(第4行和第5行)凋亡细胞。因此,在这种高水平的γ辐照之前,25gy或40gy辐照不会使凋亡或坏死过程加速。进一步地,关于细胞类型,经辐照的细胞群与对照未经辐照的群之间具有一致性。
[1307]
图31a-31b(hla-dr表达)和图32a-32b(cd86表达)中所呈现的效力测定的结果示出了,在与未经辐照的凋亡细胞相比时,新鲜的(图32a、图32a)和储存24小时的(图31b和图32b)经辐照的凋亡细胞的免疫调节能力没有变化。
[1308]
在图31a-31b和图32a-32b两者中,在暴露于成熟剂lps后hla-dr和cd86表达两者均有明显上调。在存在来自单个供体或经辐照的汇集的供体的新鲜制备的凋亡细胞的情况下,观察到两种共刺激标志物的显著(p《0.01)剂量依赖性下调。另外,在存在储存在2-8℃下24小时的凋亡细胞的情况下,两种标志物中维持剂量依赖性下调,这指示最终产物储存24小时后的稳定性和效力。
[1309]
对树突状细胞的效应。为了测试凋亡细胞的免疫调节能力,使用了释放后效力测定(mevorach等人,(2014)《bbmt》,同上)。在树突状细胞中未观察到免疫调节测定的变化。(数据未示出)。
[1310]
对混合的淋巴细胞反应(mlr)的效应。为了进一步测试免疫调节效应,建立了标准化的mlr测定。此处,刺激细胞和应答细胞(即,mlr)的共培养产生了强大且可靠的增殖。在将未经辐照的凋亡细胞添加到mlr后,淋巴细胞的增殖显著降低》5倍,这清楚地证实了细胞对增殖的抑制。由经辐照的凋亡细胞介导的mlr中的淋巴细胞增殖的抑制完全相当。(数据未示出)。
[1311]
下一个步骤是对完全错配的小鼠模型中的经辐照和未经辐照的凋亡细胞进行体内评价。如图28和29中所示出的,经辐照的和未经辐照的早期凋亡细胞制剂具有相当的体内有益效应。
[1312]
单个供体制剂结论:
[1313]
综上所述,25gy或40gy的辐照不会使凋亡细胞群的凋亡或诱导坏死显著加速。显著地,这些群在体外和体内两者均维持凋亡细胞的免疫调节效应。
[1314]
多供体制剂
[1315]
接下来,进行实验以验证用单个供体、第三方制剂所观察到的现象对于多第三方供体也是如此。出乎意料地,当使用汇集的个体供体凋亡细胞制剂时,不匹配的单个供体的有益效应丧失(图30)。这不是由于gvhd,因为每个供体的有益效应单独地维持(测试结果未示出)。一种可能性是早期凋亡细胞制剂的有益效应由于它们中个体供体细胞之间的相互作用而丧失。进一步检查是否可以通过γ辐照避免不同供体的这种可能的相互作用。
[1316]
如图30中所示出的,单个供体的有益效应在γ辐照后完全恢复,其中经辐照的多供体制剂和单个供体制剂(经辐照的或未经辐照的)具有类似的存活模式。
[1317]
结论:
[1318]
此处首次示出了,令人惊讶地,辐照(以及可能导致t细胞受体抑制的任何方法)不仅避免了t细胞的不需要的增殖和活化,而且还在使用多供体第三方凋亡细胞的制剂时允许免疫调节的有益效应。
[1319]
实例17:组合的凋亡细胞和car-t细胞治疗对实体瘤模型的效应
[1320]
目的:为了测试car-t细胞疗法对人腹膜实体瘤模型的效应,并评估凋亡细胞输注对car-t细胞疗法抗癌作用的任何可能的协同效应。
[1321]
方法
[1322]
海拉-cd19细胞系:表达cd19的海拉细胞购买自普迈生物(普迈生物技术有限公司,美国,目录号pm-海拉-cd19)。为了在体内跟踪肿瘤生长,使用plenti-pgk-v5-luc-neo(美国addgene,质粒#21471)稳定转导海拉-cd19,并通过流式细胞术细胞分选仪分离单个克隆并用500μg/ml g418(西格玛奥德里奇公司,美国,目录号a1720-1g)作为选择试剂进行培养。该细胞系在pgk启动子下稳定并连续表达萤火虫luc基因。基因组整合通过pcr进行验证,并且通过流式细胞术和生物发光成像(bli)阳性克隆进行表达验证。
[1323]
在称为“完全培养基”的补充有10%fbs(gibco,赛默飞世尔科技公司,南美,目录号12657-029)、2mm glutamax(gibco,赛默飞世尔科技公司,美国,目录号35050-038)和100u/ml青霉素 100u/ml链霉素(gibco,赛默飞世尔科技公司,美国,目录号15140-122)的rpmi 1640(gibco,赛默飞世尔科技公司,美国,目录号31870-025)中培养细胞。在标准培养期间,海拉-cd19培养基进一步补充1μg/ml嘌呤霉素(西格玛奥德里奇公司,美国,目录号p9620),作为选择性抗生素。
[1324]
对于生物发光成像,为小鼠腹膜内注射150mg/kg xenolight d-荧光素(珀金埃尔默(perkinelmer),美国,目录号122799)并用4%的异氟醚进行麻醉。注射后10分钟,使用caliper ivis-kinetics(珀金埃尔默,美国)和living image软件v4.2(珀金埃尔默,美国)拍摄生物发光。
[1325]
cd19-car-t细胞:使用ficoll梯度从健康供体的外周血中分离新鲜单核细胞(mnc)级分。然后将细胞逐渐冷冻并储存在液氮中直至使用。解冻后,洗涤细胞,并分别引入按照制造商说明以1:2的珠:细胞比例加载的cd28 cd3 珠(美天旎生物技术有限公司)。然后将细胞在300u/ml重组人il-2(rhil-2,peprotech)存在下温育3天。在mnc感染前48小时,使用jetprime试剂(polyplus,114-01)以2:1的jetprime:dna比率用第三代cd19-car质粒(创新实验室)转染293lenti-x细胞(clontech-takara,632180)。在感染前24小时,根据制造商说明,用7.5ug/cm2的纤维连接蛋白(takara-clontech,t100a)包被未处理的24-孔平板(spl,bn30006)。在感染当天,根据制造商说明,使用0.45um过滤器(密理博公司)过滤从转染的293lenti-x细胞收集的含病毒的上清液,并转移至纤维连接蛋白包被的平板(每个孔0.75ml的病毒上清液),并离心。然后向平板中添加活化的t细胞(每个孔0.5x106个细胞)并还以290g离心。然后将平板在加湿的温育箱中温育60小时。温育后,收集细胞,使用胰蛋白酶分离残留的贴壁细胞。用补充有2.5%的hepes缓冲液(lonza)的汉克平衡盐溶液(hbss,生物工业有限公司)洗涤细胞两次。在300u/ml rhil-2存在的情况下重新接种细胞,并每48小时用含有300u/ml的rhil-2的新鲜培养基稀释至1.0x 106的浓度。在感染后第12天,分别以1:2的珠:细胞比例用cd28 cd3 珠再次活化细胞。细胞温育另外的两天,然后在感染后第14天注射(在rpmi中)给动物,每只动物总共注射10x 106个细胞。制备假拟-t细胞(假拟-t)作为car-t细胞,其质粒不含抗cd19区,并注射作为对照。pcr和egfr (爱必妥、默克)表达被用于转导效力。体外细胞毒性试验用于car t细胞的功能测试。
[1326]
凋亡细胞:通过白细胞去除术程序从健康、合格的人类供体收集富集的单核细胞级分,并如本文实施例1中提供的以及如本文生产的经伽马辐照的凋亡细胞(2000-6000rad辐照)制备。在该实例中使用的经辐照的凋亡细胞被认为是“现成的”(over the shelf)(ots),其中供体和受体不一定是hla匹配的。在一些实施例中,对于本文的使用方法,供体和受体不是hla匹配的。在一些实施例中,对于本文的使用方法,供体和受体是hla匹配的。[如本文所述,使用膜联蛋白v和pi染色(mbl,ma,usa)测定凋亡细胞的凋亡和活力。使用羧基荧光素琥珀酰亚胺酯(cfse)染色和珠刺激显示缺乏增殖。
[1327]
cfse染色:用rpmi1640使细胞达到10x106个细胞/ml的最终浓度,并在室温(rt)下用5μm cfse染色10分钟,并略微倾斜避光。温育结束时间后,染色反应用完全fbs停止1分钟。然后将细胞洗涤两次以去除过量的cfse染料。
[1328]
细胞接种:用培养基(rpmi1640和biotarget,补充有2mm l-谷氨酰胺、10mm hepes、10%热活化的fbs和100u/ml重组人il-2)使细胞达到10x106个细胞/ml的浓度。然后将细胞接种在24孔平板中,每个孔1ml,其具有或没有1:3的细胞:珠比率的cd3 cd28 加载珠。在温育箱(enlivex equipment number enx01051)中在5%的co2的存在下温育平板。
[1329]
样品分析:每48小时,通过流式细胞仪对每种制剂进行取样、计数和分析,以获取细胞数和cfse染色。用培养基将浓度超过1.5x106个细胞/ml的制剂稀释至1x106个细胞/ml。未超过1.5x106个细胞/ml的制剂用培养基更新处理(弃去0.3ml的培养基,并加入新鲜培养
基)。整个8天总共进行了4个测试点。
[1330]
亚群的facs分析:对以下标记物和同型对照,通过流式细胞术(lsr-ii,bd)评估腹膜细胞:mmhc-ii-pe(12-5321)、mcd19-fitc(11-0193)、mcd11c-pe-cy5.5(35-0114)、mf4/80-eflour450(48-4801)、mcd11b-apc-eflour780(47-0112)、rigg2b-pe(12-4031)、rigg2a-fitc(11-4321)、armenian-hamster igg-pe-cy5.5(35-4888)、rigg2a-eflour450(48-4801)、rigg2b-apc-eflour780(47-4031)、hcd19-apc(17-0198)and migg1-apc(17-4714)(e生物科学公司)。
[1331]
根据ghosn等人(pnas 2010)february 9,2010.107(6)2568-2573以及casado等人(plosone 2011)(公开于2011年7月22日)进行巨噬细胞亚群表征。简言之,通过其cd11b和f4/80表达将非-cd19、非cd11c腹膜细胞分为大腹膜巨噬细胞(lpm)
–
f4/80高cd11bpos、小腹膜巨噬细胞(spm)
–
f4/80低cd11bpos、和粒细胞(gra)
–
f4/80低cd11bneg(ghosn等人(2010同上)。casado等人(2011同上)稍微不同地描述了相同的巨噬细胞亚群
–
通过其mhc-ii和f4/80表达将非cd19、非cd11c、f4/80阳性细胞分为lpm
–
f4/80高mhc-iineg、spm-f4/80低mhc-iipos、gra-f4/80低mhc-iineg。
[1332]
通过facs分析确认tim4、mertk、f4/80、cd11b、ccr2、ly6c、cd206、cd64、c169和cd74的单个细胞分析。基于细胞表面f4/80、cd11b、tim4和mertk的表达水平鉴定定居腹膜巨噬细胞。基于细胞表面ccr2、ly6c、cd206、cd64、cd169和cd74的表达鉴定渗透性巨噬细胞。
[1333]
细胞因子分析:通过luminex细胞因子分析测试人或小鼠细胞因子。定制multiplex试剂盒购买自e生物科学公司(奥地利维也纳)或r&d systems(美国明尼阿波利斯)。
[1334]
对于腹膜内实体瘤模型,在实验的第1天和第2天,为scid-bg小鼠腹膜内(i.p)注射2个连续剂量的0.25x106人海拉-cd19-荧光素酶细胞。在第9天,小鼠还接受了10x106个人凋亡细胞(如上描述进行辐照,2000-6000rad辐照),或载体;以及在第10天接受了10x106个cd19-car-t(第3代)细胞或假拟t细胞。小鼠每周称重两次,每天监测临床症状和腹膜液积聚。在一些实验中,进行了预先安排的牺牲来表征细胞和巨噬细胞亚群概况。其余的小鼠被保留用于生存分析。生存终点由基于严重腹膜积液的评分限定,表现为腹部扩大和紧张,活动能力降低或呼吸努力增加。这些临床发现与腹膜中大量海拉细胞的积累有关。根据卡普兰-迈耶对数秩统计检验进行生存分析。
[1335]
处理:图33呈现了实验方案。
[1336]
结果
[1337]
在该模型中,小鼠生存约30
±
5天(27-37)并因为在腹膜腔中形成实体瘤随后出现血性腹膜液蓄积和临床恶化而死亡。假拟处理显示了实体瘤或小鼠生存改变没有显著改善(34
±
4天;范围30-38)。单独的car t细胞疗法显著地改善小鼠生存至55
±
11(范围34-76,p《0.05)(图34a)。然而,当小鼠接受凋亡细胞和car t细胞的共施用时,与单独的car t细胞相比,可见生存的进一步显著增加,其中生存达到70
±
20天(范围48-90,p《0.05)。此外,2/10小鼠没有疾病持续150天(实验结束)。图34b(表示5个单独实验)显示了在对照和治疗条件下腹膜实体瘤海拉-cd19的生存曲线。图34c呈现了生存曲线,其显示了凋亡细胞(allocetra-ots)极大地增强了car t抗癌作用。图34c显示了通过体内成像系统(ivis)可
视化的肿瘤进展,表示了用于图34b的生存曲线的结果。最早可在第15天观察到肿瘤的扩散(海拉-cd19-luc),而用car治疗的小鼠没有显示任何肿瘤扩散直到第43天。当小鼠接受凋亡细胞时,大多数小鼠没有显示肿瘤扩散直到第50天并且肿瘤大小(见相关性比例)明显更小,如生存曲线中所反映的(图34b)。
[1338]
图35a和35b提供了car t细胞的效应通过与早期凋亡细胞(allocetra-ots)共施用增强的另外的证据,其中承受肿瘤负担的小鼠的生存因为凋亡细胞施用的加入而延长。scid-bg小鼠腹膜内注射人海拉-cd19-荧光素酶细胞,随后cd19-car t细胞,其中施用car-t细胞增加了百分比生存并延长小鼠的预期寿命(图35a)。其中scid-bg小鼠腹膜内注射人海拉-cd19-荧光素酶细胞,随后cd19-car t细胞(具有或没有凋亡细胞(allocetra-ots))的类似实验显示了随时间生存的甚至更大的百分比增加,其中一些小鼠(海拉-cd19 car-t 凋亡细胞)在第140天依然活着(图35b)。
[1339]
治疗过程中巨噬细胞亚群的分析揭示了令人惊讶的结果。图36a显示了,基于标记f4/80、cd11b、tim4和mertk的定居腹膜巨噬细胞特征的表达,定居巨噬细胞在肿瘤进展期间消失(比较上行(无肿瘤)和中行(海拉-cd19肿瘤))。令人惊讶地,利用car-t细胞的治疗导致定居巨噬细胞的再出现(下行 car t)。同时,肿瘤相关巨噬细胞(tam)特征标记ccr2、ly6c、cd206、cd64、cd169和cd74的表达的测量(图36b)显示了tam在肿瘤进展期间出现(比较上行(无肿瘤)和中行(海拉-cd19肿瘤))。利用car-t细胞的治疗导致这些tam的减少和消失(下行 car t)。scid小鼠中的定居巨噬细胞大部分被鉴定为大腹膜巨噬细胞(lpm)(图36c)。图36a-36c中所示结果显示了全部的f4/80高细胞是cd11b阳性的,而仅13.5%的f4/80高细胞是mhcii阳性的。因此,scid小鼠中的定居巨噬细胞群是f4/80高/tim4 、mhcii低、mertk /cd11b ,并且在肿瘤进展期间,该群消失,而tam、单核细胞和树突状细胞出现。利用car t细胞的治疗逆转该效应,其中定居巨噬细胞再现,而tam消失。
[1340]
为了解决car t细胞后存在的定居巨噬细胞的作用,为scid-bg小鼠腹膜内注射人海拉-cd19-荧光素酶细胞,随后cd19-car t细胞(具有或不具有凋亡细胞(allocetra-ots)),或调理的凋亡细胞(d89e_allocetra-ots),其避免凋亡细胞被定居巨噬细胞清除。结果预料不到地显示了,在不存在施用的凋亡细胞(海拉-cd19 car-t d89e_allocetra-ots)清除的情况下,承受肿瘤负担的小鼠的百分比生存降低至几乎单独的car t细胞施用所见的水平(海拉-cd19 car-t)(图37)。该结果表明了,在一些实施例中,定居巨噬细胞可以在癌症疗法期间中是有效的工具,其中在car t细胞施用后,定居巨噬细胞标记可以被靶向以触发定居巨噬细胞活化。此外,本领域技术人员将认识到,癌症疗法可包括除car t细胞疗法以外的癌症疗法。例如,免疫疗法、放射疗法、化学疗法、移植、靶向疗法、激素疗法、光动力疗法、或外科手术、或其组合,其中定居巨噬细胞的稳定将是用于癌症疗法的有效工具。
[1341]
总结:如所讨论,嵌合抗原受体(car)t细胞疗法是新颖且具有创造性的免疫疗法。car-t细胞是经基因工程化的t细胞,携带mhc独立的特异性抗原受体和可活化对癌症特异性抗原的免疫反应的共刺激分子。这种疗法在血液系统恶性肿瘤中显示出很好的效果,但在血液和非血液系统实体瘤中均无法达到类似的疗效。这种失败的可能原因可能是缺乏抗原、运输不畅和敌对的肿瘤微环境。在此,car t细胞疗法对scid小鼠中人腹膜实体瘤模型的效应得到了证实,其中凋亡细胞输注对car t细胞疗法的抗癌作用的协同作用显著。
[1342]
本文提供的结果表明,小鼠存活了30
±
5天,假拟处理未显著改善其存活至34
±
4天。car t细胞疗法显著改善其存活至55
±
11天。通过流式细胞术确认的单细胞分析揭示了与抗肿瘤活性相关的定居巨噬细胞在肿瘤进展期间完全消失,并在成功的car t疗法期间再现。在肿瘤进展期间注射的凋亡细胞能够稳定巨噬细胞的存在,如通过单细胞和流式细胞术分析所确认的,并且与抗肿瘤car-t细胞效应协同作用,导致抗肿瘤巨噬细胞群显著增加并增加生存至75
±
10天(p《0.05)。
[1343]
虽然本文中已说明和描述了本文中公开的某些特征,但本领域普通技术人员现在将想到许多修改、替换、改变和等效物。因此,应当理解,所附权利要求旨在涵盖落入本文所公开的真实精神内的所有此类修改和变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。