用于配体依赖性转录调控的新型受体
关于联邦政府资助研发的声明
1.本发明是在由美国国立卫生研究院授予的授权号od025751下在美国政府支持下完成的。政府拥有本发明中的某些权利。相关申请的交叉引用
2.本技术要求2019年9月24日提交的美国临时专利申请号62/905,248和2019年11月13日提交的美国临时专利申请号62/935,024的优先权,所述申请的公开内容通过引用以其整体(包含任何附图在内)并入本文。序列表的并入
3.本技术含有序列表,所述序列表通过引用以其整体特此并入。所附的名称为“048536_649001wo_sequence_listing_st25.txt”的序列表文本文件创建于2020年9月23日,并且为92kb。
技术领域
4.本公开文本总体上涉及结合细胞表面配体并且具有可选择的特异性和活性的新合成细胞受体。本公开文本还提供了可用于产生此类受体的组合物和方法、编码此类受体的核酸、经所述核酸遗传修饰的宿主细胞、以及用于调节细胞的活性和/或用于治疗各种健康状况或疾病如癌症的方法。
背景技术:
5.限制工程化细胞疗法在人中的开发的重要问题是调控治疗性基因表达以降低或消除引起关于嵌合抗原受体t细胞(car-t)的施用的严重副作用的相互作用,所述副作用如例如,脱靶活性、中靶/脱肿瘤活性(即,其中car-t靶标也发现于肿瘤外部的正常细胞上)以及不能在需要时调节或关闭car-t活性。这些问题的可能的解决方案是使用能够修饰基因表达和/或细胞行为的替代性合成受体。
6.notch受体是跨膜蛋白,其介导细胞间接触信号传导并且在发育和细胞间通讯(例如在两个接触细胞之间的通讯,其中一个接触细胞是“接收”细胞并且另一个接触细胞是“发送”细胞)的其他方面中发挥核心作用。在接收细胞中表达的notch受体识别它们的在发送细胞上表达的配体(例如,delta/serrate/lag或“dsl”蛋白家族)。notch和delta在这些接触细胞上的接合导致notch受体的两步蛋白水解,其最终导致受体的胞内部分从膜释放到细胞质中。notch具有通常被notch负调控区(nrr)保护免于切割的金属蛋白酶切割位点(表示为“s2”),所述notch负调控区是由三个lin-12-notch重复(lnr)模块和一个异二聚化结构域(hd)组成的结构域。认为这种蛋白水解通过发送细胞施加的力来调控:dsl配体拉动notch受体,并且改变nrr的构象,从而暴露金属蛋白酶位点。然后该位点被组成型活性的蛋白酶切割,释放所述受体的胞外结合部分和负调控区。受体的配体结合部分的释放又暴露另外一个或多个切割位点(表示为“s3”),所述切割位点被细胞膜内的γ分泌酶切割以从细胞膜释放核归巢胞内结构域。w.r.gordon等人,dev cell(2015)33:729-36。这种释放的结
构域通过作为转录调控因子发挥作用而改变接收细胞行为。notch受体参与发育期间的多种细胞功能并且是所述细胞功能所需的,并且对于物种之间的众多种细胞类型的功能是重要的。
7.notch受体的现有第一代合成衍生物(通常称为“synnotch受体”)的例子通过以下方式来利用这种简单直接的信号传导行为:用抗体衍生物替代胞外配体结合结构域(其在野生型notch中含有多个egf样重复),以及用选定的转录激活物替代胞质结构域,同时仍依赖于notch nrr(l.morsut等人,cell(2016)164:780-91)。通常,synnotch信号传导与配体结合相关,但是难以调控受体的敏感性和反应。另外,nrr跨越大约160个氨基酸,使得仅此结构域就具有一些成熟蛋白质如胰岛素或表皮生长因子(egf)的大小。这使所述受体的表达不太有效,并且由于与载体容量相关的大小约束,所得嵌合受体可能超过一些克隆和转染载体的容量。
8.本文引用的所有参考文献和专利都是通过引用整体特此并入,如同本文中充分陈述一般。
技术实现要素:
9.本公开文本提供合成嵌合受体,令人惊讶地,虽然完全不存在notch负调控区(nrr),但所述合成嵌合受体仍发挥功能。此外,这些受体提供宽范围的敏感性,包括当在t细胞中表达时对t细胞激活程度敏感的受体。另外,通过省略notch/synnotch负调控区的一个或多个结构域,可以使编码本公开文本的受体的多核苷酸小于synnotch编码多核苷酸,从而促进具有更有限容量的载体的使用,或者原本由于与载体容量相关的大小约束而被排除的另外的元件的包括。
10.在一个方面,本文提供嵌合多核苷酸,其从n末端到c末端包括:(a)对选定的配体具有结合亲和力的胞外配体结合结构域;(b)连接序列;(c)包括一个或多个配体诱导型蛋白水解切割位点的跨膜结构域;以及(d)包括转录调控因子的胞内结构域,其中所述选定的配体与所述胞外配体结合结构域的结合诱导在所述转录调控因子与所述连接序列之间的配体诱导型蛋白水解切割位点处的切割,并且其中嵌合多肽不包括notch受体的lin-12-notch重复(lnr)和/或异二聚化结构域(hd)。
11.根据本公开文本的嵌合多肽的非限制性示例性实施方案包含以下特征中的一个或多个。在一些实施方案中,所述跨膜结构域还包括停止转移序列(sts)。在一些实施方案中,所述胞外结构域包含能够结合至细胞表面上的配体的抗原结合部分。在一些实施方案中,所述细胞是病原体。在一些实施方案中,所述细胞是人细胞。在一些实施方案中,所述人细胞是肿瘤细胞。在一些实施方案中,所述人细胞是终末分化细胞。在一些实施方案中,所述配体包括蛋白质或碳水化合物。在一些实施方案中,所述配体选自cd1、cd1a、cd1b、cd1c、cd1d、cd1e、cd2、cd3d、cd3e、cd3g、cd4、cd5、cd7、cd8a、cd8b、cd19、cd20、cd21、cd22、cd23、cd25、cd27、cd28、cd33、cd34、cd40、cd45、cd48、cd52、cd59、cd66、cd70、cd71、cd72、cd73、cd79a、cd79b、cd80(b7.1)、cd86(b7.2)、cd94、cd95、cd134、cd140(pdgfr4)、cd152、cd154、cd158、cd178、cd181(cxcr1)、cd182(cxcr2)、cd183(cxcr3)、cd210、cd246、cd252、cd253、cd261、cd262、cd273(pd-l2)、cd274(pd-l1)、cd276(b7h3)、cd279、cd295、cd339(jag1)、cd340(her2)、egfr、fgfr2、cea、afp、ca125、muc-1、mage、bcma(cd269)、alppl2、gfp、egfp和
sirpα。
12.在另一方面,本文提供重组细胞,其包括(a)如本文所公开的嵌合多肽和/或(b)如本文所公开的重组核酸。在相关方面,还公开了细胞培养物,其包含至少一种如本文公开的重组细胞和培养基。
13.在另一方面,本文提供药物组合物,其包括药学上可接受的载体以及以下中的一种或多种:(a)如本文所公开的重组核酸,和(b)如本文所公开的重组细胞。在一些实施方案中,所公开的药物组合物包含如本文公开的重组核酸和药学上可接受的载体。在一些实施方案中,所述重组核酸被包封在病毒衣壳或脂质纳米颗粒中。
14.在另一方面,本文提供用于调节细胞的活性的方法,其包括(a)提供本公开文本的重组细胞,以及(b)使所述重组细胞与选定的配体接触,其中所述选定的配体与所述胞外配体结合结构域的结合诱导配体诱导型蛋白水解切割位点的切割并释放所述转录调控因子,其中所释放的转录调控因子调节(例如,抑制或诱导)所述重组细胞的活性。另一方面涉及用于调节个体中靶细胞的活性的方法,其包括向所述个体施用有效数量的本公开文本的重组细胞,其中所述重组细胞调节(例如,抑制或诱导)所述个体中靶细胞的活性。
15.另一方面涉及用于治疗个体的健康状况(例如,疾病)的方法,其包括向所述个体施用有效数量的本公开文本的重组细胞,其中所述重组细胞治疗所述个体的健康状况。
16.在另一方面,本公开文本的一些实施方案涉及用于调节细胞的活性、抑制靶癌细胞或治疗有需要的个体的健康状况(例如,疾病)的系统,其中所述系统包括以下中的一种或多种:本公开文本的嵌合多肽;本公开文本的多核苷酸;本公开文本的重组细胞;或本公开文本的药物组合物。
17.本公开文本的另一方面涉及用于制备本公开文本的重组细胞的方法,所述方法包括(a)提供能够表达蛋白质的细胞以及(b)使所提供的细胞与本公开文本的重组核酸接触。在一些实施方案中,通过对从受试者获得的样品进行的白细胞单采术获得所述细胞,并且离体接触所述细胞。在一些实施方案中,所述重组核酸被包封在病毒衣壳或脂质纳米颗粒中。
18.本公开文本的又另一方面是以下中的一种或多种的用途:本公开文本的嵌合多肽;本公开文本的多核苷酸;本公开文本的重组细胞;或者本公开文本的药物组合物;其用于健康状况(例如,疾病)的治疗。在一些实施方案中,所述健康状况是疾病(例如,癌症)。
19.本公开文本的另一方面是以下中的一种或多种的用途:本公开文本的嵌合多肽;本公开文本的多核苷酸;本公开文本的重组细胞;或者本公开文本的药物组合物;其用于制造用于疾病治疗的药物。
20.前述发明内容仅是说明性的,并不旨在以任何方式进行限制。除了本文描述的说明性实施方案和特征之外,根据附图、具体实施方式和权利要求,本公开文本的其他方面、实施方案、目的和特征将变得完全清楚。
附图说明
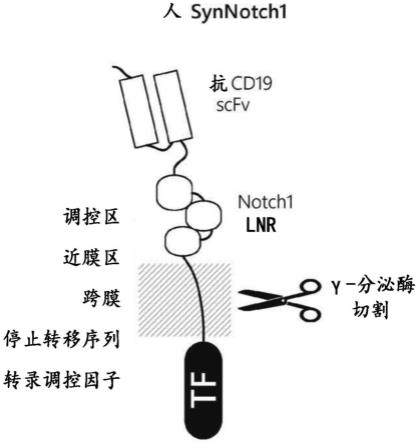
21.图1a-图1b示意性地说明synnotch受体与本公开文本的嵌合多肽之间的差异。图1a描绘现有合成notch受体(synnotch)的示意性结构,其包括胞外配体结合结构域(抗cd19 scfv)、调控区、近膜区(jmd)、跨膜结构域(tmd)、停止转移序列(sts)和转录调控因子(tf)。
这种示例性synnotch具有notch负调控区(nrr)作为调控区,并且jmd、tmd和sts都来自notch1。图1b描绘如本文所公开的示例性第二代合成notch受体(微型notch受体)的示意性结构。与synnotch受体相比,微型notch受体没有nrr。
22.图2a-图2c示意性地概括与第一代的synnotch受体相比,微型notch受体的设计、其在人cd4 t细胞中的表达以及tcr激活。图2a描绘synnotch1受体(左小图)和微型notch受体(右小图)的示意图。图2b描绘受体表达的示例性流式细胞术数据,其展现出微型notch受体在人cd4 t细胞中表达。图2c描绘微型notch受体的tcr激活。顶部小图概括在没有tcr激活的情况下,受体激活测试的结果。将1x105个表达抗cd19受体的双阳性t细胞与以下共培养24小时:1x105个k562细胞(上迹线)或1x105个cd19 k562细胞(下迹线)。随后使用fortessa x-50(bd biosciences)测量诱导型bfp报告基因的转录激活。底部小图概括在tcr激活的情况下,受体激活的结果。在此实验中,将一种dag类似物佛波醇12-十四酸酯13-乙酸酯(pma)添加至共培养物以模拟pkc信号传导。
23.图3示意性地概括实验结果,在上述实验中用并行t细胞激活进行synnotch和微型notch受体的激活测试以评估例如tcr信号传导。在这些实验中,为了模拟t细胞激活,使用抗mcam、抗cd3双特异性t细胞接合器(mcam bite),其在k562细胞的存在下激活t细胞受体。
24.图4a-图4b示意性地概括实验结果,在所述实验中用共表达的car进行synnotch和微型notch受体的激活测试以评估例如car信号传导增强。在这些实验中,将synnotch1和微型notch1与靶向alppl2的car共转导。如图4b中所示,将1x105个表达抗cd19 synnotch或微型notch和抗alppl2 car的双阳性t细胞与以下共培养24小时:空白样品(顶部迹线)、1x105个k562细胞(从顶部起第二个迹线)、1x105个cd19 k562细胞(从顶部起第三个迹线)、1x105个alppl2 k562细胞(从顶部起第四个迹线)或者1x105个cd19 k562细胞和1x105个alppl2 k562细胞(底部迹线)。随后使用fortessa x-50(bd biosciences)测量诱导型bfp报告基因的转录激活。
25.图5a-图5b示意性地概括用于测试具有其他配体识别结构域的微型notch受体(通过微型notch1所例示)的实验的结果。除了抗cd19 scfv外,还使用抗gfp lag17纳米抗体和抗alppl2 scfv。图5b显示使用另外的配体识别结构域的激活测试。在这些实验中,将原代cd8人t细胞用抗cd3/抗cd28 dynabeads(gibco)激活并用表达notch受体或转录报告物构建体的两种慢病毒构建体转导。
26.图6a-图6b示意性地概括为了评估使用共表达的car的微型notch受体激活(如通过微型notch1所例示)而进行的实验的结果。图6a显示通过共表达的靶向alppl2的car激活示例性微型notch受体(“微型synnotch1”)与synnotch1受体的简图。如图6b中所示,将表达三种抗cd19 notch构建体(微型notch、第一代鼠synnotch和第一代人synnotch;参见从左至右的三个小图)中的任一种的cd4 t细胞与以下共培养24小时:阴性对照(无任何添加;顶部迹线)、表达alppl2的k562细胞(从顶部起第二个迹线)、表达cd19的k562细胞(从顶部起第三个迹线)或者表达alppl2和cd19二者的k562细胞(底部迹线)。随后使用fortessa x-50(bd biosciences)测量诱导型bfp报告基因的转录激活。
具体实施方式
27.本公开文本总体上尤其涉及一种新类别的以配体依赖性方式调节转录调控的工
程化嵌合多肽受体。特别地,所述新受体(称为“微型notch”),虽然衍生自notch,但不需要先前认为对于所述受体的功能是必需的notch负调控区(nrr)。此新类别的受体是合成的和重组的,并且未在自然界中出现。在一些实施方案中,本文所公开的非天然存在的受体结合靶细胞表面配体,从而触发所述受体的蛋白水解切割以及调节细胞中的定制转录程序的转录调控因子的释放。本公开文本还提供了可用于产生此类受体的组合物和方法、编码此类受体的核酸、经所述核酸遗传修饰的宿主细胞、以及用于调节细胞的活性和/或用于治疗各种病症或疾病如癌症的方法。
28.在以下具体实施方式中,参考形成其一部分的附图。在附图中,除非上下文另外指出,否则类似的符号通常标识类似的组分。在具体实施方式、附图和权利要求中描述的说明性替换方案不意为是限制性的。在不脱离在此呈现的主题的精神或范围的情况下,可以使用其他替代方案并且可以进行其他改变。将容易理解的是,如在本文总体上描述的以及在附图中展示的方面可以以各种各样的不同配置来布置、取代、组合和设计,所有这些都被明确地考虑并构成本技术的一部分。定义
29.除非上下文另外明确指出,否则单数形式“一个/一种(a)”、“一个/一种(an)”和“所述”包括复数指示物。例如,术语“一种细胞”包括一种或多种细胞,包括其混合物。本文中使用“a和/或b”来包括所有的以下替代形式:“a”、“b”、“a或b”以及“a和b”。
30.如本文所用,术语“施用(administration)”和“施用(administering)”是指通过施用途径递送组合物或配制品,所述施用途径包括但不限于静脉内、动脉内、颅内、肌内、腹膜内、皮下、肌内和局部施用,或其组合。所述术语包括但不限于由医学专业人员进行的施用和自我施用。
[0031]“癌症”是指具有致癌细胞典型特征(如不受控制的增殖、永生性、转移潜能、快速的生长和增殖速率,以及某些特征性的形态特征)的细胞的存在。一些类型的癌细胞可以聚集成块,如肿瘤,但是一些癌细胞可以单独存在于受试者体内。肿瘤可以是实体瘤、软组织肿瘤或转移病灶。如本文所用,术语“癌症”还涵盖其他类型的非肿瘤癌症。非限制性例子包括血癌或血液恶性肿瘤,如白血病、淋巴瘤和骨髓瘤。癌症可以包括恶变前癌症以及恶性癌症。
[0032]
术语“宿主细胞”和“重组细胞”在本文中可互换使用。应理解,此类术语以及“细胞”、“细胞培养物”、“细胞系”不仅指特定的主题细胞或细胞系,而且指这种细胞或细胞系的后代或潜在后代,而不考虑培养中的转移或传代次数。应理解,并非所有后代都与亲代细胞完全相同。这是因为在后代中可能由于突变(例如,故意或非故意突变)或环境影响而发生某些修饰,使得后代可能事实上与亲代细胞不同,但是仍然包括在如本文所用的所述术语的范围内。
[0033]
如本文所用,术语“可操作地连接”表示两个或更多个元件(例如,多肽序列或多核苷酸序列)之间的物理或功能连接,这允许它们以其预期方式操作。
[0034]
在两个或更多个核酸或蛋白质的上下文中,如本文所用的术语“同一性百分比”是指两个或更多个序列或子序列相同或具有指定百分比的相同核苷酸或氨基酸(例如,当在比较窗口或指定区域上比较和比对以获得最大对应时,约60%序列同一性、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一
性),如使用采用如下所述的默认参数的blast或blast 2.0序列比较算法或通过手动比对和视觉检查所测量。参见例如,ncbi网址ncbi.nlm.nih.gov/blast。则将此类序列称为“基本上相同”。此定义也指或可以应用于序列的互补体。此定义还包括具有缺失和/或添加的序列以及具有取代的序列。可以在长度为至少约20个氨基酸或核苷酸的区域上,或在长度为10-100个氨基酸或核苷酸的区域上,或在给定序列的整个长度上计算序列同一性。序列同一性可以使用已公布的技术和广泛可用的计算机程序来计算,所述计算机程序如gcs程序包(devereux等人,nucleic acids res.12:387,1984)、blastp、blastn、fasta(atschul等人,j mol biol 215:403,1990)。序列同一性可以使用序列分析软件以所述软件的默认参数来测量,所述序列分析软件如university of wisconsin biotechnology center(威斯康星州麦迪逊,大学大道1710号,53705)的genetics computer group的序列分析软件包。
[0035]
如本文所用,并且除非另外指定,否则药剂的“治疗有效量”是足以在健康状况如疾病(例如,癌症)的治疗或管理中提供治疗益处的量,或者足以延迟或最小化与疾病相关的一种或多种症状的量。治疗有效量的化合物意指单独或与其他治疗剂组合的一定量的治疗剂,其在治疗或管理疾病方面提供治疗益处。术语“治疗有效量”可以涵盖改善疾病的整体疗法、减轻或避免疾病的症状或原因、或增强另一治疗剂的治疗功效的量。“有效量”的例子是足以促成治疗、预防或减轻疾病的一种或多种症状的量,其也可以称为“治疗有效量”。症状的“减轻”意指一种或多种症状的严重程度或频率的降低或一种或多种症状的消除。组合物的确切量(包括“治疗有效量”)将取决于治疗的目的,并且将由本领域技术人员使用已知技术来确定(参见例如,lieberman,pharmaceutical dosage forms(第1-3卷,2010);lloyd,the art,science and technology of pharmaceutical compounding(2016);pickar,dosage calculations(2012);以及remington:the science and practice of pharmacy,第22版,2012,gennaro编辑,lippincott,williams&wilkins)。
[0036]
如本文所用,“受试者”或“个体”包括动物,如人(例如,人个体)和非人动物。在一些实施方案中,“受试者”或“个体”是在医生的护理下的患者。因此,所述受试者可以是患有、有风险患上或怀疑患有目标疾病(例如癌症)和/或疾病的一种或多种症状的人患者或个体。所述受试者也可以是在诊断时或之后被诊断为具有目的病症的风险的个体。术语“非人动物”包括所有脊椎动物,例如哺乳动物(例如,啮齿动物,例如小鼠)和非哺乳动物(如非人灵长类动物),例如绵羊、狗、牛、鸡、两栖动物、爬行动物等。
[0037]
在提供了一系列值时,应理解的是每个中间值,到下限的第十个单位(除非上下文另外明确指出),所述范围的上限与下限之间以及任何其他陈述的或在所述陈述范围内的中间值均被涵盖在本公开文本之内。这些更小范围的上限和下限可以独立地被包括在更小范围之内,并且也被涵盖在本公开文本之内,服从于陈述的范围内的任何确切排除的界限。当陈述的范围包括一个或两个界限时,排除那些包括的界限中的任一个或两个的范围也包括在本公开文本中。
[0038]
本文公开的所有范围还涵盖任何且所有可能的子范围及其子范围的组合。任何列出的范围都可以被认为充分描述和允许将相同的范围分解为至少相等的两份、三份、四份、五份、十份等。作为非限制性例子,本文所讨论的每个范围可以容易地分解为下三分之一、中间三分之一和上三分之一,等等。同样如本领域技术人员将理解的,如“高达”、“至少”、“大于”、“小于”等所有言辞都包括所列举的数字并且涉及随后可以分解为如上所讨论的子范围的范围。最后,如本领域技术人员将理解的,范围包括每个单独成员。因此,例如,具有1-3个物品的组是指具有1、2或3个物品的组。类似地,具有1-5个物品的组是指具有1、2、3、4或5个物品的组等等。
[0039]
应了解,为明确起见在单独实施方案的上下文中描述的本公开文本的某些特征也可以在单个实施方案中组合提供。相反,为简洁起见在单个实施方案的上下文中描述的本公开文本的各种特征还可以分开地或以任何合适的子组合提供。属于本公开文本的实施方案的所有组合确切地涵盖在本公开文本中并且在本文中公开如同每个和每一种组合均单独地和明确地公开一样。此外,各种实施方案及其要素的所有子组合也确切地涵盖在本公开文本中并且在本文中公开如同每个和每一种这样的子组合均单独地和明确地在本文中公开一样。notch受体
[0040]
notch受体是大型跨膜蛋白,其通常在与相邻细胞上表达的表面结合的配体结合后传递信号。notch信号依赖于细胞间接触。脊椎动物和无脊椎动物的进化趋异伴随至少两轮基因重复:苍蝇具有单一notch基因,蠕虫具有两个(glp-1和lin-12),并且哺乳动物具有四个(notch1-4)。notch信号的转导依赖于三个关键事件:(i)配体识别;(ii)配体依赖性切割位点的构象暴露;以及(iii)核转录激活复合物的组装。
[0041]
规范的notch信号通过称为调控的膜内蛋白水解的过程转导。在细胞表面上,notch受体通常维持静止的蛋白水解抗性构象,但是配体结合启动蛋白水解级联,从而从膜释放所述受体的胞内部分(icn)。关键的调控的切割步骤受adam金属蛋白酶的影响,并且发生在紧邻质膜外部的称为s2的位点。这种截短的受体被称为next(针对notch胞外截短(notch extracellular truncation)),其保持膜栓系直至其在位点s3被γ分泌酶(一种多蛋白酶复合物)加工。
[0042]
在γ分泌酶介导的切割后,icn最终进入细胞核,在其中icn组装转录激活复合物,所述转录激活复合物含有称为csl的dna结合转录因子和mastermind家族的转录辅激活物。然后,此复合物与另外的辅激活物蛋白如p300接合,以募集基础转录机构并激活下游靶基因的表达。
[0043]
如下文更详细地讨论,notch受体具有模块性结构域组织。notch受体的notch胞外亚基(nec)由一系列的负责配体结合的n末端表皮生长因子受体(egfr)样重复组成。这些egfr重复的o-连接糖基化(包括由o-岩藻糖、fringe和rumi糖基转移酶修饰)还响应于蝇类和哺乳动物中的不同配体亚型调节notch受体的活性。
[0044]
egfr重复之后是三个lin-12/notch重复(lnr)模块,其对于notch受体是独特的,并且被广泛报告参与防止过早的受体激活。通过弗林蛋白酶切割分裂notch1的异二聚化(heterodimerization,hd)结构域,使得其n末端部分(hd-n)终止nec,并且其c末端的一半(hd-c)构成notch跨膜亚基(ntm)亚基的开端。在nec的胞外hd-c区域后是跨膜区段和胞内区域(icn),其包括ram结构域(rbp-jκ相关分子,其最初表示为“ram23”结构域)、两侧为两个核定位信号(nls)的七个锚蛋白(ank)重复、反式激活结构域(transactivation domain,tad)以及富含脯氨酸(p)、谷氨酸(e)、丝氨酸(s)和苏氨酸(t)并参与蛋白质降解的pest区域。关于notch受体和notch介导的细胞信号传导的另外的信息可以参见例如以下文献:
w.r.gordon等人,dev cell(2015)33:729-36和w.r.gordon等人,j.cell sci.(2008)121:3109-19,两个文献通过引用特此并入。本公开文本的组合物
[0045]
如下文更详细描述的,本公开文本提供了一种新类别的嵌合多肽受体,所述嵌合多肽受体被工程化为以配体依赖性方式调节转录调控,具有优于现有合成notch受体的各种优点。特别地,所述新受体,虽然衍生自notch,但不需要先前认为对于所述受体的功能是必需的notch负调控区(nrr)。
[0046]
本领域技术人员将理解,本文公开的嵌合多肽受体有助于在某些细胞和环境背景下的扩增激活。例如,实施例4中描述的实验的结果已经展现出,激活水平(例如,转录输出的量)通过用佛波醇12-十四酸酯13-乙酸酯(pma)处理或t细胞激活(例如,tcr的刺激)随pkc信号传导而增加。特别地,激活转录的细胞分数增加并且转录水平用某些受体设计如微型synnotch1来增加(参见例如,图2c,底部小图)。这种类型的受体活性反馈是新的特征,其可以用于增强和调控由工程化的细胞实现的治疗有效载荷的产生。此外,如下文更详细地描述,本文所公开的多种受体变体比现有synnotch受体更易于表达,因为它们可以以更高的效率进行转导,并且以更高的水平在人原代t细胞的细胞表面上表达。
[0047]
另外,如下文更详细地描述,本公开文本的某些嵌合受体提供一定范围的敏感性,包括当在t细胞中表达时对t细胞激活程度敏感的受体。本文所述的某些受体既提供更高的信号水平也提供更宽范围的敏感性。它们还在信号水平与噪声水平(例如,在不存在配体的情况下的信号水平)之间提供一定范围的权衡。另外,由于天然notch受体因nec亚基含有几十个串联egfr样重复而较大,通过省略notch调控区或甚至整个nec亚基,可以使编码本公开文本的受体的多核苷酸小于天然notch受体和现有synnotch编码多核苷酸,从而促进具有更有限容量的载体的使用,或者原本由于与载体容量相关的大小约束而被排除的另外的元件的包括。
[0048]
如下文更详细地描述,本文公开的某些嵌合多肽受体具有优于现有synnotch受体的活性,如通过例如期望转录输出的配体诱导的信号水平所确定,并且提供更具模块性的平台用于工程化另外的notch受体。这种模块性平台促进具有不同功能的结构域容易地与来自例如其他物种的相应结构域交换,从而使得能够定制受体激活谱。如实施例中更详细地描述,如本文所提供的微型notch受体可以在很大程度上定制,其中受体胞外、跨膜和胞内结构域的所有元件都可用于定制。例如,对衍生自四种人notch变体(notch1-4)的微型notch受体的测试展现出,所有四种具有不同的信号传导特征(例如激活水平、对t细胞激活的敏感性)。不受任何具体理论束缚,认为当与synnotch1的鼠或人形式相比时,本文所述的微型notch受体可以提供更高水平的配体诱导的信号。现有synnotch受体可以用配体结合结构域如scfv和纳米抗体工程化,但是难以将来自受体/配体的天然胞外结构域用于synnotch受体。相比之下,本文公开的多种第二代notch受体适合于其他类型的配体结合结构域,从而扩大了可靶向疾病和组织的范围。例如,与通常表达和激活较差的现有人synnotch1相比,如本文所述的某些微型notch1受体已经展现接受更宽子集scfv的能力。
[0049]
如实施例4-7中所述,已经在原代人t细胞中测试并验证某些新嵌合多肽受体。预期这些新受体在小鼠模型中显示类似的性能。本文公开的受体可以被工程化到各种免疫细胞类型中以增强肿瘤的辨别和消除,或工程化到工程化的细胞中以控制自身免疫和组织再
生。因此,工程化的细胞如被工程化为表达本文公开的嵌合受体中的一种或多种的免疫细胞也在本公开文本的范围内。嵌合多肽
[0050]
本公开文本提供新型的非天然存在的重组嵌合多肽,其被工程化为以配体依赖性方式调节转录调控。特别地,所述新受体,虽然衍生自notch,但不需要先前认为对于受体的功能是必需的notch调控区(nrr)。在一些实施方案中,本文所公开的工程化受体结合靶细胞表面展示的配体,从而触发所述受体的蛋白水解切割以及调节细胞中的定制转录程序的转录调控因子的释放。
[0051]
在一些实施方案中,本文提供一种嵌合多肽,其从n末端到c末端包括:(a)具有对选定的配体的结合亲和力的胞外配体结合结构域(extracellular ligand-binding domain,ecd);(b)连接序列(jmd,近膜结构域(juxtamembrane domain));(c)跨膜结构域(transmembrane domain,tmd),其包括一个或多个配体诱导型蛋白水解切割位点;以及(d)胞内结构域(intracellular domain,icd),其包括转录调控因子,其中所述选定的配体与所述ecd的结合诱导在所述转录调控因子与所述jmd之间的配体诱导型蛋白水解切割位点处的切割,并且其中所述嵌合多肽不包括notch受体的lin-12-notch重复(lnr)和/或异二聚化结构域(hd)。胞外结构域(ecd)
[0052]
在一些实施方案中,本文所公开的嵌合多肽受体的ecd具有对一种或多种靶配体的结合亲和力。所述靶配体在细胞表面上表达,或以其他方式锚定、固定或限制,从而它可以对所述嵌合受体施加机械力。这样,不受任何特定理论的束缚,本文提供的嵌合受体的ecd与细胞表面配体的结合不一定从靶细胞表面去除靶配体,而是对所述嵌合受体产生机械拉力。例如,如果其他可溶性配体结合至表面或胞外基质中的分子,则所述其他可溶性配体可以被靶向。在一些实施方案中,靶配体是细胞表面配体。合适的配体类型的非限制性例子包括细胞表面受体;粘附蛋白;表面结合的碳水化合物、脂质、糖脂、脂蛋白和脂多糖;整合素;粘蛋白;以及凝集素。在一些实施方案中,所述配体是蛋白质。在一些实施方案中,所述配体是碳水化合物。
[0053]
在一些实施方案中,所述胞外结构域包含受体的配体结合部分。在一些实施方案中,所述胞外结构域包含结合至一种或多种靶抗原的抗原结合部分。本领域技术人员在阅读本公开文本后将容易理解,术语“其功能片段”或“其功能变体”是指与衍生所述片段或变体的野生型分子具有共同的定量和/或定性生物活性的分子。例如,抗体的功能片段或功能变体是这样的,其保留与衍生所述功能片段或功能变体的抗体基本上相同的结合至相同表位的能力。例如,能够与细胞表面受体的表位结合的抗体可以在n末端和/或c末端处截短,并且使用本领域技术人员已知的测定评估其表位结合活性的保留。在一些实施方案中,所述抗原结合部分包含抗体或其功能性抗原结合片段的一种或多种抗原结合决定簇。在一些实施方案中,抗原结合部分选自抗体、纳米抗体、双抗体、三抗体、或微型抗体、f(ab')2片段、f(ab)片段、单链可变片段(scfv)和单结构域抗体(sdab)或其功能片段。在一些实施方案中,所述抗原结合部分包含scfv。
[0054]
抗原结合部分可以包括天然存在的氨基酸序列或者可以被工程化、设计或修饰以提供期望的和/或改进的特性,如例如,结合亲和力。通常,抗原结合部分(例如,抗体)对靶
抗原(例如,cd19抗原)的结合亲和力可以通过frankel等人,mol.immunol,16:101-06,1979描述的斯卡查德(scatchard)方法计算。在一些实施方案中,通过抗原/抗体解离速率测量结合亲和力。在一些实施方案中,通过竞争放射免疫测定测量结合亲和力。在一些实施方案中,通过elisa测量结合亲和力。在一些实施方案中,通过流式细胞术测量抗体亲和力。“选择性结合”抗原(如cd19)的抗体是基本上不结合其他抗原但以高亲和力,例如以如下平衡常数(kd)结合所述抗原的抗原结合部分:100nm或更小,如60nm或更小,例如30nm或更小,如15nm或更小、或10nm或更小、或5nm或更小、或1nm或更小、或500pm或更小、或400pm或更小、或300pm或更小、或200pm或更小、或100pm或更小。
[0055]
技术人员可以基于被遗传修饰以表达本公开文本的嵌合多肽或微型notch受体的细胞的期望定位或功能来选择ecd。例如,具有包含对her2抗原具有特异性的抗体的ecd的嵌合多肽或微型notch受体可以将遗传修饰的细胞靶向表达her2的乳腺癌细胞。在一些实施方案中,嵌合多肽微型notch受体的ecd能够结合肿瘤相关抗原(taa)或肿瘤特异性抗原(tsa)。taa包括在肿瘤细胞上和在正常细胞上存在,或者在许多正常细胞上存在但浓度远低于在肿瘤细胞上的分子(如例如,蛋白质)。相比之下,tsa通常包括存在于肿瘤细胞上但不存在于正常细胞上的分子,例如蛋白质。
[0056]
在一些情形中,抗原结合部分对肿瘤细胞表达的抗原(即,肿瘤相关抗原)中存在的表位具有特异性。肿瘤相关抗原可以是与例如以下相关的抗原:乳腺癌细胞、b细胞淋巴瘤、胰腺癌、霍奇金淋巴瘤细胞、卵巢癌细胞、前列腺癌细胞、间皮瘤、肺癌细胞、非霍奇金b细胞淋巴瘤(b-nhl)细胞、卵巢癌细胞、前列腺癌细胞、间皮瘤细胞、黑色素瘤细胞、慢性淋巴细胞性白血病细胞、急性淋巴细胞性白血病细胞、神经母细胞瘤细胞、神经胶质瘤、胶质母细胞瘤、结直肠癌细胞等。还将理解,肿瘤相关抗原也可以由非癌细胞表达。在一些实施方案中,所述抗原结合结构域对存在于组织特异性抗原中的表位具有特异性。在一些实施方案中,所述抗原结合结构域对存在于疾病相关抗原中的表位具有特异性。在一些实施方案中,抗原结合结构域对既是组织特异性也是疾病特异性的抗原中存在的表位具有特异性。
[0057]
合适的靶抗原的非限制性例子包括cd19、b7h3(cd276)、bcma(cd269)、胎盘碱性磷酸酶样蛋白2(alppl2)、绿色荧光蛋白(gfp)、增强型绿色荧光蛋白(egfp)、和信号调节蛋白α(sirpα)、cd123、cd171、cd179a、cd20、cd213a2、cd22、cd24、cd246、cd272、cd30、cd33、cd38、cd44v6、cd46、cd71、cd97、cea、cldn6、clecl1、cs-1、egfr、egfrviii、elf2m、epcam、epha2、肝配蛋白b2、fap、flt3、gd2、gd3、gm3、gprc5d、her2(erbb2/neu)、igll1、il-11rα、kit(cd117)、muc1、ncam、pap、pdgfr-β、prss21、psca、psma、ror1、ssea-4、tag72、tem1/cd248、tem7r、tshr、vegfr2、alpi、瓜氨酸化波形蛋白、cmet和axl。
[0058]
在一些实施方案中,靶抗原选自cd19、b7h3(cd276)、bcma(cd269)、cd123、cd171、cd179a、cd20、cd213a2、cd22、cd24、cd246、cd272、cd30、cd33、cd38、cd44v6、cd46、cd71、cd97、cea、cldn6、clecl1、cs-1、egfr、egfrviii、elf2m、epcam、epha2、肝配蛋白b2、fap、flt3、gd2、gd3、gm3、gprc5d、her2(erbb2/neu)、igll1、il-11ra、kit(cd117)、muc1、ncam、pap、pdgfr-β、prss21、psca、psma、ror1、ssea-4、tag72、tem1/cd248、tem7r、tshr、vegfr2、alpi、瓜氨酸化波形蛋白、cmet、axl、gpc2、人表皮生长因子受体2(her2/neu)、cd276(b7-h3)、il-13rα1、il-13rα2、α-甲胎蛋白(afp)、癌胚抗原(cea)、癌症抗原-125(ca-125)、
ca19-9、钙视网膜蛋白、muc-1、上皮膜蛋白(ema)、上皮肿瘤抗原(eta)、酪氨酸酶、黑色素瘤相关抗原(mage)、cd34、cd45、cd123、cd93、cd99、cd117、嗜铬粒蛋白、细胞角蛋白、结蛋白、胶质细胞原纤维酸性蛋白(gfap)、巨囊性病液蛋白(gcdfp-15)、alk、dlk1、fap、ny-eso、wt1、hmb-45抗原、蛋白质黑色素-a(由t淋巴细胞识别的黑色素瘤抗原;mart-1)、myo-d1、肌肉特异性肌动蛋白(msa)、神经丝、神经元特异性烯醇化酶(nse)、胎盘碱性磷酸酶、突触小泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、aoc3(vap-1)、cam-3001、ccl11(嗜酸性粒细胞趋化因子-1)、cd125、cd147(basigin)、cd154(cd40l)、cd2、cd20、cd23(ige受体)、cd25(异二聚il-2受体的亚基)、cd3、cd4、cd5、ifn-α、ifn-γ、ige、ige fc区、il-1、il-12、il-23、il-13、il-17、il-17a、il-22、il-4、il-5、il-5、il-6、il-6受体、整合素α4、整合素α4β7、lfa-1(cd11α)、肌生成抑制蛋白、ox-40、硬化蛋白、sost、tgfβ1、tnf-α、vegf-a、丙酮酸激酶同工酶m2型(肿瘤m2-pk)、cd20、cd5、cd7、cd3、trbc1、trbc2、bcma、cd38、cd123、cd93、cd34、cd1a、slamf7/cs1、flt3、cd33、cd123、talla-1、cspg4、dll3、κ轻链、λ轻链、cd16/fcγriii、cd64、fitc、cd22、cd27、cd30、cd70、gd2(神经节苷脂g2)、gd3、egfrviii(表皮生长因子变体iii)、egfr及其同种变体、tem-8、精子蛋白17(sp17)、间皮素。
[0059]
合适抗原的另外的非限制性例子包括pap(前列腺酸性磷酸酶)、前列腺干细胞抗原(psca)、prostein、nkg2d、tarp(t细胞受体γ可变阅读框蛋白)、trp-p8、steap1(前列腺六次跨膜上皮抗原1)、异常ras蛋白、异常p53蛋白、整合素β3(cd61)、催乳素、k-ras(v-ki-ras2柯尔斯顿大鼠肉瘤病毒癌基因)、ral-b、gpc2、cd276(b7h3)或il-13rα。在一些实施方案中,抗原包括her2。在一些实施方案中,抗原包括alppl2。在一些实施方案中,抗原包括bcma。在一些实施方案中,所述ecd的抗原结合部分对报告蛋白如gfp和egfp具有特异性。这样的抗原结合部分的非限制性例子包括lag17抗gfp纳米抗体。在一些实施方案中,ecd的抗原结合部分包括抗bcma完全人源化vh结构域(fhvh)。在一些实施方案中,抗原包括信号调节蛋白α(sirpα)。
[0060]
适合于由本文所公开的嵌合多肽受体靶向的另外的抗原包括但不限于gpc2、人表皮生长因子受体2(her2/neu)、cd276(b7h3)、il-13rα1、il-13rα2、α-甲胎蛋白(afp)、癌胚抗原(cea)、癌症抗原-125(ca-125)、ca19-9、钙视网膜蛋白、muc-1、上皮膜蛋白(ema)、上皮肿瘤抗原(eta)。其他合适的靶抗原包括但不限于酪氨酸酶、黑色素瘤相关抗原(mage)、cd34、cd45、cd123、cd93、cd99、cd117、嗜铬粒蛋白、细胞角蛋白、结蛋白、胶质纤维酸性蛋白(gfap)、巨囊性病液体蛋白(gcdfp-15)、alk、dlk1、fap、ny-eso、wt1、hmb-45抗原、蛋白质黑色素-a(t淋巴细胞识别的黑色素瘤抗原;mart-1)、myo-d1、肌肉特异性肌动蛋白(msa)、神经丝、神经元特异性烯醇化酶(nse)、胎盘碱性磷酸酶、突触小泡蛋白、甲状腺球蛋白、甲状腺转录因子-1。
[0061]
适合于由本文所公开的嵌合受体靶向的另外的抗原包括但不限于与炎性疾病相关的那些,如aoc3(vap-1)、cam-3001、ccl11(嗜酸性粒细胞趋化因子-1)、cd125、cd147(basigin)、cd154(cd40l)、cd2、cd20、cd23(ige受体)、cd25(异二聚il-2受体的亚基)、cd3、cd4、cd5、ifn-α、ifn-γ、ige、ige fc区、il-1、il-12、il-23、il-13、il-17、il-17a、il-22、il-4、il-5、il-5、il-6、il-6受体、整合素α4、整合素α4β7、lfa-1(cd11α)、肌生成抑制蛋白、ox-40、硬化蛋白、sost、tgfβ1、tnfα和vegf-a。
[0062]
适合于由本文所公开的嵌合多肽和微型notch受体靶向的其他抗原包括但不限于
丙酮酸激酶同工酶m2型(肿瘤m2-pk)、cd20、cd5、cd7、cd3、trbc1、trbc2、bcma、cd38、cd123、cd93、cd34、cd1a、slamf7/cs1、flt3、cd33、cd123、talla-1、cspg4、dll3、κ轻链、λ轻链、cd16/fcγriii、cd64、fitc、cd22、cd27、cd30、cd70、gd2(神经节苷脂g2)、gd3、egfrviii(表皮生长因子变体iii)、egfr及其同种变体、tem-8、精子蛋白17(sp17)、间皮素。合适的抗原的其他非限制性例子包括pap(前列腺酸性磷酸酶)、前列腺干细胞抗原(psca)、prostein、nkg2d、tarp(t细胞受体γ交替阅读框蛋白)、trp-p8、steap1(前列腺六跨膜上皮抗原1)、异常ras蛋白、异常p53蛋白、整合素β3(cd61)、催乳素、k-ras(v-ki-ras2 kirsten大鼠肉瘤病毒癌基因)和ral-b。在一些实施方案中,抗原是gpc2、cd19、her2/neu、cd276(b7h3)、il13-rα1或il-13rα2。在一些实施方案中,所述抗原是alppl2。在一些实施方案中,所述抗原是bcma。在一些实施方案中,所述ecd的抗原结合部分对报告蛋白如gfp和egfp具有特异性。这种抗原结合部分的非限制性例子包括lag17抗gfp纳米抗体。在一些实施方案中,所述ecd的抗原结合部分包含抗bcma完全人源化vh结构域(fhvh)。
[0063]
在一些实施方案中,适合于由本文所公开的嵌合多肽和微型notch受体靶向的抗原包括衍生自病原体的配体。例如,所述抗原可以是由her2阳性乳腺癌细胞产生的her2。在一些实施方案中,所述抗原可以是在b细胞白血病上表达的cd19。在一些实施方案中,所述抗原可以是在多形性胶质母细胞瘤(gbm)上表达但在健康cns组织上表达少得多的egfr。在一些实施方案中,所述抗原可以是与成人癌症例如结肠癌相关的cea。
[0064]
在一些实施方案中,胞外结构域的抗原结合部分对细胞表面靶标具有特异性,其中细胞表面靶标的非限制性例子包括cd19、cd30、her2、alppl2、bcma、cd22、enpp3、egfr、cd20、cd52、cd11α和α-整合素。在一些实施方案中,本文所公开的嵌合多肽和微型notch受体包括具有结合cd19、cea、her2、muc1、cd20、bcma、alppl2或egfr的抗原结合部分的胞外结构域。在一些实施方案中,本文所公开的嵌合多肽和微型notch受体包括包含结合cd19、bcma、her2或alppl2的抗原结合部分的胞外结构域。
[0065]
在一些实施方案中,抗原结合部分包括与序列表中seq id no:10-18中的一个或多个具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的氨基酸序列。在一些实施方案中,抗原结合部分包括与选自seq id no:10-18的序列具有至少90%序列同一性的氨基酸序列。在一些实施方案中,抗原结合部分包括与选自seq id no:10-18的序列具有至少95%序列同一性的氨基酸序列。在一些实施方案中,抗原结合部分包括与seq id no:10-18中的一个或多个具有100%序列同一性的氨基酸序列。在一些实施方案中,抗原结合部分包括具有选自seq id no:10-18的序列的氨基酸序列,其中seq id no:10-18中的任一个中的一个、两个、三个、四个或五个氨基酸残基被不同的氨基酸残基取代。连接多肽和jmd
[0066]
如上所述,本公开文本的嵌合多肽和受体包括设置在胞外结合结构域(ecd)与跨膜结构域(tmd)之间的连接序列。现有“synnotch”受体包含异源胞外配体结合结构域、具有与包括nrr的notch受体jmd的基本序列同一性的连接多肽、tmd和icd。相比之下,本公开文本的嵌合多肽和微型notch受体包含异源胞外配体结合结构域、具有与notch受体jmd的基本序列同一性但缺少nrr(lin-12-notch重复(lnr)模块和异二聚化结构域)的连接多肽、tmd和icd。换句话说,在微型notch受体中,连接多肽替代天然notch的负调控区(nrr)和异
二聚化(hd)结构域。三至50个氨基酸残基(例如,3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个等的氨基酸残基)可以用作多肽接头。在一些实施方案中,可以优化接头多肽序列的长度和氨基酸组成以改变ecd和tmd相对于彼此的取向和/或接近度,以实现本公开文本的嵌合多肽的期望活性。在一些实施方案中,接头多肽序列包括与选自序列表中seq id no:19-27的序列具有至少80%序列同一性(如至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或99%序列同一性)的序列。在一些实施方案中,接头多肽序列包括与选自seq id no:19-27的序列具有至少90%序列同一性的氨基酸序列。在一些实施方案中,接头多肽序列包括与选自seq id no:19-27的序列具有至少95%序列同一性的氨基酸序列。在一些实施方案中,接头多肽序列包括与选自seq id no:19-27的序列具有约100%序列同一性的氨基酸序列。在一些实施方案中,接头多肽序列包括具有选自seq id no:19-27的序列的氨基酸序列,其中seq id no:19-27中的任一个的一个、两个、三个、四个或五个氨基酸残基被不同的氨基酸残基取代。跨膜结构域
[0067]
如上所述,本公开文本的嵌合多肽包括包含一个或多个配体诱导型蛋白水解切割位点的跨膜结构域。
[0068]
notch受体中的蛋白水解切割位点(例如,s2或s3)的例子如上所述。适合于本文公开的组合物和方法的另外的蛋白水解切割位点包括但不限于选自以下的mmp的金属蛋白酶切割位点:胶原酶-1、胶原酶-2和胶原酶-3(mmp-1、mmp-8和mmp-13),明胶酶a和明胶酶b(mmp-2和mmp-9),溶基质蛋白酶1、溶基质蛋白酶2和溶基质蛋白酶3(mmp-3、mmp-10和mmp-11),基质分解素(matrilysin)(mmp-7),和膜金属蛋白酶(mt1-mmp和mt2-mmp)。例如,mmp-9的切割序列是pro-x-x-hy(其中,x表示任意残基;hy表示疏水残基,如leu、ile、val、phe、trp、tyr、val、met和pro)(seq id no:58),例如,pro-x-x-hy-(ser/thr)(seq id no:59),例如,pro-leu/gln-gly-met-thr-ser(seq id no:60)或pro-leu/gln-gly-met-thr(seq id no:61)。合适的蛋白酶切割位点的另一个例子是血纤蛋白溶解酶原激活物切割位点,例如,尿激酶血纤蛋白溶解酶原激活物(upa)或组织血纤蛋白溶解酶原激活物(tpa)切割位点。合适的蛋白酶切割位点的另一个例子是催乳素切割位点。upa和tpa的切割序列的具体例子包括包含val-gly-arg(seq id no:62)的序列。可以包含在蛋白水解可切割接头中的另一个示例性蛋白酶切割位点是烟草蚀刻病毒(tev)蛋白酶切割位点,例如glu-asn-leu-tyr-thr-gln-ser(seq id no:63),其中蛋白酶在谷氨酰胺与丝氨酸之间切割。可以包含在蛋白水解可切割接头中的蛋白酶切割位点的另一个例子是肠激酶切割位点,例如asp-asp-asp-asp-lys(seq id no:64),其中切割发生在赖氨酸残基之后。可以包含在蛋白水解可切割接头中的蛋白酶切割位点的另一个例子是凝血酶切割位点,例如leu-val-pro-arg(seq id no:65)。包含蛋白酶切割位点的另外的合适的接头包括可通过以下蛋白酶切割的序列:prescission
tm
蛋白酶(包含人鼻病毒3c蛋白酶和谷胱甘肽-s-转移酶的融合蛋白)、凝血酶、组织蛋白酶b、eb病毒(epstein-barr virus)蛋白酶、mmp-3(溶基质蛋白酶)、mmp-7(基质溶解因子)、mmp-9;嗜热菌蛋白酶样mmp、基质金属蛋白酶2(mmp-2)、组织蛋白酶l;组织蛋白酶d、基质金属蛋白酶l(mmp-l)、尿激酶型血纤蛋白溶解酶原激活物、膜1型基质金属蛋白酶(mt-mmp)、溶基质蛋白酶3(或mmp-11)、嗜热菌蛋白酶、成纤维细胞胶原酶和溶基质蛋白酶-1、基质金属蛋白酶13(胶原酶-3)、尿激酶血纤蛋白溶解酶原激活物(upa)、组织型血纤蛋白
溶解酶原激活物(tpa)、人前列腺特异性抗原、激肽释放酶(hk3)、嗜中性粒细胞弹性蛋白酶以及钙蛋白酶(钙激活的中性蛋白酶)。对于其中表达受体的宿主细胞(例如,tev)并非天然的蛋白酶可以用作另一种调控机制,其中在表达或以其他方式提供蛋白酶之前,微型notch的激活是不可能的。另外,蛋白酶可以是肿瘤相关的或疾病相关的(表达程度显著高于在正常组织中的表达程度),并且作为独立的调控机制。例如,一些基质金属蛋白酶在某些癌症类型中高度表达。
[0069]
通常,适合于本文所公开的嵌合多肽和微型notch受体的跨膜结构域(tmd)可以是包括至少一个γ-分泌酶切割位点的1型跨膜受体的任何跨膜结构域。γ分泌酶复合物及其底物蛋白(包括淀粉样前体蛋白(app)和notch)的结构和功能的详细描述可以例如在zhang等人,frontiers cell neurosci(2014)的最近综述中见到。来自1型跨膜受体的非限制性的合适tmd包括来自clstn1、clstn2、aplp1、aplp2、lrp8、app、btc、tgbr3、spn、cd44、csf1r、cxcl16、cx3cl1、dcc、dll1、dsg2、dag1、cdh1、epcam、epha4、ephb2、efnb1、efnb2、erbb4、ghr、hla-a和ifnar2的那些,其中tmd包含至少一个γ分泌酶切割位点。适合于本文所述的组合物和方法的另外的tmd包括但不限于来自1型跨膜受体il1r1、il1r2、il6r、insr、ern1、ern2、jag2、kcne1、kcne2、kcne3、kcne4、kl、chl1、ptprf、scn1b、scn3b、npr3、ngfr、plxdc2、pam、ager、robo1、sorcs3、sorcs1、sorl1、sdc1、sdc2、spn、tyr、tyrp1、dct、vasn、flt1、cdh5、pkhd1、nectin1、pcdhgc3、nrg1、lrp1b、cdh2、nrg2、ptprk、scn2b、nradd和ptprm的跨膜结构域。在一些实施方案中,本公开文本的嵌合多肽或notch受体的tmd是衍生自钙同线蛋白家族成员如阿卡德因(alcadein)α和阿卡德因γ的tmd。在一些实施方案中,本公开文本的嵌合多肽或notch受体的tmd是notch受体的已知的tmd。在一些实施方案中,本公开文本的嵌合多肽或notch受体的tmd是衍生自不同notch受体的tmd。例如,在基于人notch1的微型notch中,notch1 tmd可以被人notch2 tmd、人notch3 tmd、人notch4 tmd或来自非人动物(如斑马鱼(danio rerio)、黑腹果蝇(drosophila melanogaster)、光滑爪蟾(xenopus laevis)或原鸡(gallus gallus))的notch tmd取代。
[0070]
在一些实施方案中,跨膜结构域包括展现与序列表中的seq id no:28-36中的一个或多个的至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的氨基酸序列。在一些实施方案中,跨膜结构域包括与选自seq id no:28-36的序列具有至少90%序列同一性的氨基酸序列。在一些实施方案中,跨膜结构域包括与选自seq id no:28-36的序列具有至少95%序列同一性的氨基酸序列。在一些实施方案中,跨膜结构域包括与seq id no:28-36中的一个或多个具有100%序列同一性的氨基酸序列。在一些实施方案中,跨膜结构域包括具有选自seq id no:28-36的序列的氨基酸序列,其中seq id no:28-36中的任一个的一个、两个、三个、四个或五个氨基酸残基被不同的氨基酸残基取代。
[0071]
在一些实施方案中,所述tmd内的一个或多个氨基酸取代包含tmd的“gv”基序内的一个或多个取代。在一些实施方案中,至少一个这样的取代是取代为丙氨酸。例如,序列fmyvaaaafvllffvgcgvlls(seq id no:28)以及seq id no:29-36中的任一个的一个、两个、三个、四个、五个或更多个氨基酸残基可以被不同的氨基酸残基取代。在一些实施方案中,seq id no:28内“gv”基序的位置18和/或19处的氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,seq id no:28的位置18处的甘氨酸残基被不同的氨基酸残基取代。在一
些实施方案中,seq id no:28的位置19处的缬氨酸残基被不同的氨基酸残基取代。在一些实施方案中,跨膜结构域包含具有对应于seq id no:28的序列的氨基酸序列,其在对应于seq id no:28的位置18的位置处具有突变,如g18a突变。在一些实施方案中,跨膜结构域包含具有对应于seq id no:28的序列的氨基酸序列,其在对应于seq id no:28的位置19的位置处具有突变,如v19a突变。停止转移序列
[0072]
在一些实施方案中,本公开文本的嵌合多肽和微型notch受体包括停止转移序列(sts),其构成位于tmd与icd之间的高电荷结构域。不受任何特定理论的约束,设置在tmd与icd之间的这种高电荷结构域防止icd进入膜。sts从n末端到c末端按以下顺序与tmd和icd连接:tmd-sts-icd。原则上,对所述sts的长度和/或氨基酸组成没有特别限制。在一些实施方案中,包含约4至约40个氨基酸残基(例如,4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个等的氨基酸残基)的任何任意单链肽可以用作sts。在一些实施方案中,所述sts包含约4至15、约6至20、约8至25、约10至30、约12至35、约14至40、约5至40、约10至35、约15至30、约20至25、约20至40、约10至30、约4至20、或约5至25个氨基酸残基。在一些实施方案中,所述sts包含约4至10、约5至12、约6至14、约7至18、约8至20、约9至22、约10至24、或约11至26个氨基酸残基。在一些实施方案中,所述sts包含约4至10个残基,如4、5、6、7、8、9至10个氨基酸残基。
[0073]
在一些实施方案中,所述sts包含与来自clstn1、clstn2、notch1、notch2、notch3、notch4、csf1r、cxcl16、dag1、ghr、ptprf、ager、kl、nrg1、lrp1b、jag2、epcam、kcne3、cdh2、nrg2、ptprk、btc、epha3、il1r2或ptprm的sts序列具有至少70%序列同一性,如至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或99%序列同一性的序列。在一些实施方案中,sts包含在首4个残基中仅包含lys(k)或arg(r)的序列。在一些实施方案中,sts包含一个、两个、三个、四个、五个或更多个碱性残基。在一些实施方案中,所述sts包含五个、四个、三个、两个、一个或零个芳族残基或具有疏水和/或庞大侧链的残基。
[0074]
在一些实施方案中,sts包括与选自序列表中seq id no:37-45的序列具有至少80%序列同一性(如至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或99%序列同一性)的序列。在一些实施方案中,sts包括与选自seq id no:37-45的序列具有至少90%序列同一性的氨基酸序列。在一些实施方案中,sts包括与选自seq id no:37-45的序列具有至少95%序列同一性的氨基酸序列。在一些实施方案中,sts包括与选自seq id no:37-45的序列具有约100%序列同一性的氨基酸序列。在一些实施方案中,sts包括具有选自seq id no:37-45的序列的氨基酸序列,其中seq id no:37-45中的任一个的一个、两个、三个、四个或五个氨基酸残基被不同的氨基酸残基取代。胞内结构域
[0075]
本公开文本的嵌合多肽和微型notch受体包括转录调控因子。本公开文本的转录调控因子是如下多肽元件,所述多肽元件用以激活或抑制启动子驱动的dna序列的转录。适合于本公开文本的组合物和方法的转录调控因子可以是天然存在的转录调控因子或者可以被工程化、设计或修饰以提供期望的和/或改进的特性,例如,调节转录。如上所讨论,本公开文本的工程化受体的优点在于,它们可以提供在工程化细胞中触发定制转录程序的能
no:19-27中的任一个具有至少95%序列同一性的氨基酸序列;(b)跨膜结构域,其包含与seq id no:28-36中的任一个具有至少95%序列同一性的氨基酸序列;以及(c)停止转移序列,其包含与seq id no:37-45中的任一个具有至少95%序列同一性的氨基酸序列。
[0080]
在一些实施方案中,本公开文本的嵌合多肽包含:(a)连接多肽,其包含选自seq id no:19-27的氨基酸序列;(b)跨膜结构域,其包含选自seq id no:28-36的氨基酸序列;以及(c)停止转移序列结构域,其包含选自seq id no:37-45的氨基酸序列。
[0081]
在一些实施方案中,本公开文本的嵌合多肽包含:(a)连接多肽,其包含选自seq id no:19-27的氨基酸序列,其中seq id no:19-27中的任一个的一个、两个、三个、四个或五个氨基酸残基被不同的氨基酸残基取代;(b)跨膜结构域,其包含选自seq id no:28-36的氨基酸序列,其中seq id no:28-36中的任一个的一个、两个、三个、四个或五个氨基酸残基被不同的氨基酸残基取代;以及(c)停止转移序列结构域,其包含选自seq id no:37-45的氨基酸序列,其中seq id no:37-45中的任一个的一个、两个、三个、四个或五个氨基酸残基被不同的氨基酸残基取代。
[0082]
在一些实施方案中,本公开文本的嵌合受体包括与本文所公开的嵌合受体具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,本文提供嵌合受体包括与如在序列表中标识的seq id no:1-9中的任一个具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,嵌合受体包括与seq id no:1具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,嵌合受体包括与seq id no:2具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,嵌合受体包括与seq id no:3具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,嵌合受体包括与seq id no:4具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
[0083]
在一些实施方案中,嵌合受体包括与seq id no:5具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,嵌合受体包括与seq id no:6具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,嵌合受体包括与seq id no:7具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,嵌合受体包括与seq id no:8具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,嵌合受体包括与seq id no:9具有至少约80%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。核酸分子
[0084]
在另一方面,本文提供包含编码本公开文本的嵌合多肽和微型notch受体的核苷酸序列的各种核酸分子,包括含有这些核酸分子的表达盒和表达载体,所述核酸分子与异源核酸序列可操作地连接,所述异源核酸序列如例如促进所述受体在宿主细胞中的体内表达的调控序列。
[0085]
本公开文本的核酸分子可以具有任何长度,包括例如在约1.5kb与约50kb之间、在约5kb与约40kb之间、在约5kb与约30kb之间、在约5kb与约20kb之间或在约10kb与约50kb之
间,例如在约15kb至30kb之间、在约20kb与约50kb之间、在约20kb与约40kb之间、约5kb与约25kb之间或约30kb与约50kb之间。
[0086]
在一些实施方案中,本文提供一种包含编码嵌合多肽或微型notch受体的核苷酸序列的核酸分子,其从n末端到c末端包括:(a)包含具有对选定的配体的结合亲和力的结合部分的ecd;(b)连接多肽;(c)包括一个或多个配体诱导型蛋白水解切割位点的tmd;以及(d)包括转录调控因子的icd,其中所述选定的配体与所述ecd的结合诱导在所述转录调控因子与所述连接多肽之间的配体诱导型蛋白水解切割位点处的切割,并且其中所述嵌合多肽不包括notch受体的lin-12-notch重复(lnr)和/或异二聚化结构域(hd)。
[0087]
在一些实施方案中,所述核苷酸序列被并入表达盒或表达载体中。应理解,表达盒通常包含遗传物质的构建体,所述构建体含有编码序列和足够的调控信息以引导编码序列在体内和/或离体的受体细胞中恰当转录和/或翻译。通常,可以将所述表达盒插入用于靶向期望的宿主细胞的载体中和/或个体中。这样,在一些实施方案中,本公开文本的表达盒包含:如本文公开的嵌合多肽的编码序列,所述编码序列可操作地连接至表达控制元件如启动子,以及任选的影响编码序列转录或翻译的其他核酸序列中的任一个或组合。
[0088]
在一些实施方案中,所述核苷酸序列被并入表达载体中。本领域技术人员将理解,术语“载体”通常是指如下重组多核苷酸构建体,其被设计用于在宿主细胞之间转移并且可以用于转化的目的,例如将异源dna引入宿主细胞中。这样,在一些实施方案中,所述载体可以是复制子,如质粒、噬菌体或粘粒,可以在其中插入另一个dna区段以引起插入区段的复制。在一些实施方案中,所述表达载体可以是整合载体。
[0089]
在一些实施方案中,所述表达载体可以是病毒载体。如本领域技术人员将理解的,术语“病毒载体”广泛用于指包含衍生自病毒的核酸元件的核酸分子(例如,转移质粒)或指介导核酸转移的病毒颗粒,所述衍生自病毒的核酸元件通常有助于将核酸分子转移或整合到细胞的基因组中。病毒颗粒通常包括各种病毒组分,并且有时还包括除了一种或多种核酸以外的宿主细胞组分。术语病毒载体可以指能够将核酸转移到细胞中的病毒或病毒颗粒,或者指转移的核酸本身。病毒载体和转移质粒含有主要衍生自病毒的结构性和/或功能性遗传元件。术语“逆转录病毒载体”是指含有主要衍生自逆转录病毒的结构性和功能性遗传元件或其部分的病毒载体或质粒。术语“慢病毒载体”是指含有包含主要衍生自慢病毒(为逆转录病毒的属)的结构性和功能性遗传元件或其部分(包括ltr)的病毒载体或质粒。
[0090]
在一些实施方案中,本文提供了编码具有与本文公开的嵌合受体具有至少约80%、90%、95%、96%、97、98%、99%、或100%序列同一性的氨基酸序列的多肽的核酸分子。在一些实施方案中,本文提供了编码具有与序列表中标识的seq id no:1-9中的任一个具有至少约80%、90%、95%、96%、97、98%、99%、或100%序列同一性的氨基酸序列的多肽的核酸分子。在一些实施方案中,所述核酸分子编码具有与seq id no:1具有至少约80%、90%、95%、96%、97、98%、99%、或100%序列同一性的氨基酸序列的多肽。在一些实施方案中,所述核酸分子编码具有与seq id no:2具有至少约80%、90%、95%、96%、97、98%、99%、或100%序列同一性的氨基酸序列的多肽。在一些实施方案中,所述核酸分子编码具有与seq id no:3具有至少约80%、90%、95%、96%、97、98%、99%、或100%序列同一性的氨基酸序列的多肽。在一些实施方案中,所述核酸分子编码具有与seq id no:4具有至少约80%、90%、95%、96%、97、98%、99%、或100%序列同一性的氨基酸序列的多肽。在一
laboratory press;beaucage,s.l.等人(2000).current protocols in nucleic acid chemistry.纽约,纽约州:wiley,(包括至2014年的增刊);以及makrides,s.c.(2003).gene transfer and expression in mammalian cells.阿姆斯特丹,荷兰:elsevier sciences b.v.,所述文献的公开内容通过引用并入本文。
[0094]
可以经由常规转化或转染技术将dna载体引入真核细胞中。用于转化或转染宿主细胞的合适方法可以在以下文献中见到:sambrook等人(2012年,同上)和其他标准分子生物学实验室手册,如磷酸钙转染、deae-葡聚糖介导的转染、转染、显微注射、阳离子脂质介导的转染、电穿孔、转导、划痕负载(scrape loading)、弹道引入、核穿孔、流体动力冲击和感染。可以在本公开文本中使用的病毒载体包括例如逆转录病毒载体、腺病毒载体和腺相关病毒载体、慢病毒载体、疱疹病毒、猿猴病毒40(sv40)和牛乳头瘤病毒载体(参见例如,gluzman(编辑),eukaryotic viral vectors,csh laboratory press,cold spring harbor,纽约)。例如,如本文公开的嵌合受体可以在真核宿主如哺乳动物细胞(例如,cos细胞、nih 3t3细胞或hela细胞)中产生。这些细胞可以从许多来源获得,包括美国典型菌种保藏中心(弗吉尼亚州马纳萨斯)。在选择表达系统时,应注意确保组分彼此相容。技术人员或普通技术人员能够做出这样的决定。另外,如果在选择表达系统时需要指导,则技术人员可以查询p.jones,“vectors:cloning applications”,john wiley and sons,new york,n.y.,2009)。
[0095]
所提供的核酸分子可以含有天然存在的序列,或与天然存在的那些序列不同,但是由于遗传密码的简并性而编码相同多肽(例如,抗体)的序列。这些核酸分子可以由rna或dna(例如,基因组dna、cdna,或合成dna(如通过基于亚磷酰胺的合成产生的dna))或这些类型的核酸内的核苷酸的组合或修饰组成。此外,所述核酸分子可以是双链或单链的(例如,有义链或反义链)。
[0096]
核酸分子不限于编码多肽(例如,抗体)的序列;也可以包含位于编码序列(例如,嵌合受体的编码序列)上游或下游的一些或全部非编码序列。分子生物学领域的普通技术人员熟悉用于分离核酸分子的常规程序。它们可以例如通过用限制性核酸内切酶处理基因组dna或通过进行聚合酶链式反应(pcr)来产生。在核酸分子是核糖核酸(rna)的情况下,分子可以例如通过体外转录产生。重组细胞和细胞培养物
[0097]
可以将本公开文本的核酸引入宿主细胞如人t淋巴细胞中,以产生含有所述核酸分子的重组细胞。因此,本公开文本的一些实施方案涉及一种制备重组细胞的方法,其包括(a)提供能够表达蛋白质的细胞,以及(b)使所提供的细胞与本公开文本的重组核酸接触。
[0098]
将本公开文本的核酸分子引入细胞可以通过本领域技术人员已知的方法进行,所述方法例如病毒感染、转染、缀合、原生质体融合、脂质体转染、电穿孔、核转染、磷酸钙沉淀、聚乙烯亚胺(pei)介导的转染、deae-葡聚糖介导的转染、脂质体介导的转染、粒子枪技术、磷酸钙沉淀、直接显微注射、纳米颗粒介导的核酸递送等。
[0099]
因此,在一些实施方案中,核酸分子可以通过本领域中已知的病毒或非病毒递送手段和方法来递送。例如,核酸分子可以被稳定整合于宿主基因组中,或者可以以附加体复制,或者作为用于瞬时表达的微环表达载体存在于重组宿主细胞中。因此,在一些实施方案
中,所述核酸分子在所述重组宿主细胞中作为附加体单元维持和复制。在一些实施方案中,所述核酸分子稳定地整合到所述重组细胞的基因组中。稳定的整合可以使用经典随机基因组重组技术或用更精确的基因组编辑技术来实现,如指导rna引导的crispr/cas9基因组编辑、使用ngago(格氏嗜盐碱杆菌(natronobacterium gregoryi)argonaute)的dna指导的核酸内切酶基因组编辑或者talen基因组编辑(转录激活物样效应核酸酶(transcription activator-like effector nucleases))。在一些实施方案中,核酸分子作为用于瞬时表达的微环表达载体存在于重组宿主细胞中。
[0100]
可以将核酸分子包封在病毒衣壳或脂质纳米颗粒中。可替代地,一种或多种核酸内切酶多肽可以通过本领域中已知的病毒或非病毒递送手段和方法(如电穿孔或脂质纳米颗粒)来递送。例如,将核酸引入细胞中可以使用病毒转导方法来实现。在非限制性例子中,腺相关病毒(aav)是一种无包膜病毒,其可以被工程化以经由病毒转导将核酸递送至靶细胞。已经描述了若干种aav血清型,并且所有已知的血清型可以感染来自多种不同组织类型的细胞。aav能够在体内转导广泛的物种和组织,没有毒性证据,并且它产生相对温和的先天性和适应性免疫应答。
[0101]
慢病毒系统也适合于经由病毒转导的核酸递送和基因疗法。慢病毒载体作为基因递送媒介物提供了若干种有吸引力的特性,包括:(i)通过将载体稳定整合到宿主基因组中进行持续的基因递送;(ii)能够感染分裂细胞和非分裂细胞二者;(iii)具有广泛的组织趋性,包括重要的基因和细胞疗法靶细胞类型;(iv)载体转导后不表达病毒蛋白;(v)能够递送复杂遗传元件,如多顺反子序列或含有内含子的序列;(vi)具有可能更安全的整合位点特征;以及(vii)为相对容易的用于载体操纵和生产的系统。
[0102]
在一些实施方案中,可以用例如本技术的载体构建体对宿主细胞进行基因工程化(例如,转导或转化或转染),所述载体构建体可以是例如病毒载体或用于同源重组的载体(包含与宿主细胞基因组的一部分同源的核酸序列),或者可以是用于表达目的多肽的表达载体。宿主细胞可以是未转化的细胞或已经用至少一种核酸分子转染的细胞。
[0103]
在一些实施方案中,所述重组细胞是原核细胞或真核细胞。在一些实施方案中,所述细胞在体内。在一些实施方案中,所述细胞是离体的。在一些实施方案中,所述细胞在体外。在一些实施方案中,所述重组细胞是动物细胞。在一些实施方案中,所述动物细胞是哺乳动物细胞。在一些实施方案中,所述动物细胞是人细胞。在一些实施方案中,所述细胞是非人灵长类动物细胞。在一些实施方案中,所述哺乳动物细胞是免疫细胞、神经元、上皮细胞和内皮细胞,或干细胞。在一些实施方案中,所述重组细胞是免疫系统细胞,例如淋巴细胞(例如,t细胞或nk细胞)或树突细胞。在一些实施方案中,所述免疫细胞是b细胞、单核细胞、自然杀伤(nk)细胞、嗜碱性粒细胞、嗜酸性粒细胞、嗜中性粒细胞、树突细胞、巨噬细胞、调节性t细胞、辅助性t细胞(th)、细胞毒性t细胞(t
ctl
)或其他t细胞。在一些实施方案中,所述免疫系统细胞是t淋巴细胞。
[0104]
在一些实施方案中,所述细胞是干细胞。在一些实施方案中,所述细胞是造血干细胞。在所述细胞的一些实施方案中,所述细胞是淋巴细胞。在一些实施方案中,所述细胞是前体t细胞或t调节性(treg)细胞。在一些实施方案中,所述细胞是cd34 细胞、cd8 细胞或cd4 细胞。在一些实施方案中,所述细胞是选自幼稚cd8 t细胞、中枢记忆cd8 t细胞、效应记忆cd8 t细胞和大量(bulk)cd8 t细胞的cd8 t细胞毒性淋巴细胞。在所述细胞的一些实
施方案中,所述细胞是选自幼稚cd4 t细胞、中枢记忆cd4 t细胞、效应记忆cd4 t细胞和大量cd4 t细胞的cd4 t辅助性淋巴细胞。在一些实施方案中,可以通过对从受试者获得的样品进行的白细胞单采术获得所述细胞。在一些实施方案中,所述受试者是人患者。
[0105]
在一些实施方案中,重组细胞还包括如本文所公开的第二核酸分子,其中第一核酸分子和第二核酸分子不具有相同的序列。在一些实施方案中,重组细胞还包括如本文所公开的第二嵌合多肽,其中第一嵌合多肽或微型notch受体和第二嵌合多肽或微型notch受体不具有相同的序列。在一些实施方案中,第一嵌合多肽调节第二嵌合多肽的表达和/或活性。
[0106]
在一些实施方案中,重组细胞还包括编码目的蛋白的表达盒,所述目的蛋白与启动子可操作地连接,其中所述目的蛋白的表达由转录调控因子调节(例如,抑制、阻遏或诱导)。在一些实施方案中,目的蛋白对于重组细胞是异源的。原则上,关于可以通过转录调控因子调节表达的合适的蛋白质没有特别限制。可以通过本文所公开的方法调节表达的蛋白质的示例性类型包括细胞因子、细胞毒素、趋化因子、免疫调节剂、促凋亡因子、抗凋亡因子、激素、分化因子、去分化因子、免疫细胞受体或报告物。在一些实施方案中,免疫细胞受体包括t细胞受体(tcr)。在一些实施方案中,免疫细胞受体包括嵌合抗原受体(car)。在一些实施方案中,将编码目的蛋白的表达盒并入编码本公开文本的嵌合受体的相同核酸分子中。在一些实施方案中,将编码目的蛋白的表达盒并入与编码本公开文本的嵌合受体的核酸分子分开的第二表达载体中。
[0107]
在另一方面,本文提供包含至少一种如本文所公开的重组细胞和培养基的各种细胞培养物。通常,所述培养基可以是用于本文所述的细胞的任何合适的培养基。用于转化多种多样的上述宿主细胞和物种的技术是本领域已知的并且描述于技术和科学文献中。因此,包含至少一种如本文公开的重组细胞的细胞培养物也在本技术的范围内。适合于产生和维持细胞培养物的方法和系统是本领域已知的。药物组合物
[0108]
在一些实施方案中,本公开文本的核酸和重组细胞可以并入组合物(包括药物组合物)中。这样的组合物通常包含核酸和/或重组细胞,以及药学上可接受的赋形剂,例如载体。
[0109]
适合于注射使用的药物组合物包含无菌水溶液(水溶性的)或分散体,以及用于临时制备无菌可注射溶液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、cremophor el
tm
(basf,帕西帕尼,新泽西州)或磷酸盐缓冲盐水(pbs)。在所有情况下,组合物应是无菌的并且应是易于注射的程度的流体。其在制造和储存条件下应是稳定的并且必须抵抗微生物(如细菌和真菌)的污染作用而保存。所述载体可以是溶剂或分散介质,所述溶剂或分散介质含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)及其合适的混合物。例如,可以通过使用包衣如卵磷脂、通过在分散体的情况下维持所需的粒度、以及通过使用表面活性剂(例如,十二烷基硫酸钠),维持适当的流动性。防止微生物的作用可以通过各种抗细菌剂和抗真菌剂(例如,对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等)来实现。在许多情况下,通常在所述组合物中包含等渗剂,例如糖、多元醇(如甘露糖醇、山梨糖醇)和氯化钠。通过在所述组合物中包含延迟吸收的药剂(例如,单硬脂酸铝和明胶),可以实现可注射组合物的延长吸收。
[0110]
无菌可注射溶液可以通过以下方式制备:将活性化合物以所需量并入视需要具有上文所列举成分中的一种或组合的适当溶剂中,随后过滤灭菌。通常,通过将活性化合物并入无菌媒介物中来制备分散体,所述无菌媒介物含有基础分散介质和来自以上列举的那些的所需其他成分。
[0111]
在一些实施方案中,本公开文本的嵌合多肽和notch受体还可以通过转染或感染使用本领域已知的方法来施用,所述方法包括但不限于以下文献中描述的方法:mccaffrey等人(nature 418:6893,2002);xia等人(nature biotechnol.20:1006-10,2002);或putnam(am.j.health syst.pharm.53:151-60,1996,勘误于am.j.health syst.pharm.53:325,1996)。本公开文本的方法
[0112]
本文所述的治疗组合物中的任一种(例如,核酸、重组细胞和药物组合物)的施用可以用于治疗患者的相关健康状况或疾病,如癌症和慢性感染。在一些实施方案中,可以将本文所述的核酸、重组细胞和药物组合物并入治疗剂中以用于治疗患有、怀疑患有或者可能有高风险患上一种或多种与检查点抑制相关的自身免疫障碍或疾病的方法中。示例性自身免疫性障碍和疾病可以包括但不限于癌症和慢性感染。
[0113]
因此,在一个方面,本公开文本的一些实施方案涉及用于调节(例如,刺激或抑制)个体中靶细胞的活性的方法,所述方法包括向所述个体施用包括如本文所公开的核酸、重组细胞和药物组合物中的一种或多种的第一疗法,其中所述第一疗法调节(例如,抑制或刺激)所述靶细胞的活性。例如,如果所述靶细胞的增殖降低,如果所述靶细胞的病理性或致病性行为减少,如果所述靶细胞被破坏或杀伤等,则所述靶细胞的活性可能被抑制。抑制包括所测量的病理性或致病性行为减少至少约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%或约95%。在一些实施方案中,所述方法包括向所述个体施用有效数量的如本文所公开的重组细胞,其中所述重组细胞调节所述个体中靶细胞的活性。通常,所公开的方法的靶细胞可以是所述个体的任何细胞,并且可以是例如急性骨髓瘤白血病细胞、间变性淋巴瘤细胞、星形细胞瘤细胞、b细胞癌细胞、乳腺癌细胞、结肠癌细胞、室管膜瘤细胞、食管癌细胞、胶质母细胞瘤细胞、神经胶质瘤细胞、平滑肌肉瘤细胞、脂肪肉瘤细胞、肝癌细胞、肺癌细胞、套细胞淋巴瘤细胞、黑色素瘤细胞、神经母细胞瘤细胞、非小细胞肺癌细胞、少突神经胶质瘤细胞、卵巢癌细胞、胰腺癌细胞、外周t细胞淋巴瘤细胞、肾癌细胞、肉瘤细胞、胃癌细胞、癌细胞、间皮瘤细胞或肉瘤细胞。在一些实施方案中,所述靶细胞是致病细胞。
[0114]
在另一方面,本公开文本的一些实施方案涉及用于治疗有需要的个体的健康状况(例如,疾病)的方法,所述方法包括向所述个体施用包括包含如本文所公开的嵌合多肽或微型notch受体的重组细胞和/或如本文所公开的药物组合物中的一种或多种的第一疗法,其中所述第一疗法治疗所述个体的健康状况。在一些实施方案中,所述方法包括向所述个体施用第一疗法,所述第一疗法包含有效数量的如本文公开的重组细胞,其中所述重组细胞治疗所述健康状况。
[0115]
在另一方面,本公开文本的一些实施方案涉及用于辅助治疗有需要的个体的健康状况(例如,疾病)的方法,所述方法包括向所述个体施用包括如本文所公开的嵌合多肽或微型notch受体、核酸、重组细胞和药物组合物中的一种或多种的第一疗法和第二疗法,其
中所述第一疗法和所述第二疗法一起治疗所述个体的健康状况。在一些实施方案中,所述方法包括向所述个体施用第一疗法,所述第一疗法包含有效数量的如本文公开的重组细胞,其中所述重组细胞治疗所述健康状况。向个体施用重组细胞
[0116]
在一些实施方案中,本公开文本的方法涉及将有效量的本公开文本的重组细胞施用至需要这样的治疗的个体中。这个施用步骤可以使用本领域中已知的任何递送方法来完成。例如,重组细胞可以直接输注于个体的血流中或者以其他方式施用至个体。
[0117]
在一些实施方案中,本文公开的方法包括将重组细胞通过导致将引入的细胞至少部分定位在期望部位从而产生一种或多种期望的作用的方法或途径施用(该术语与“引入”、“植入”和“移植”可互换使用)于个体。可以通过任何适当的途径施用重组细胞或其分化的后代,所述适当的途径导致递送至个体的期望位置,所施用的细胞或细胞组分的至少一部分在此位置保持存活。在施用至个体后,细胞的活力时间段可以短至几小时(例如,二十四小时),至几天,至长达几年,或者甚至所述个体的寿命,即长期移植。
[0118]
当预防性提供时,可以将本文所述的重组细胞在待治疗的疾病或病症的任何症状出现之前施用于个体。因此,在一些实施方案中,重组细胞群的预防性施用预防疾病或病症的症状的发生。
[0119]
当在一些实施方案中以治疗方式提供时,在疾病或病症的症状或指征发作时(或之后),例如在疾病或病症发作时,提供重组细胞。
[0120]
为了在本文所述的各种实施方案中使用,如本文公开的重组细胞的有效量可以是至少102个细胞、至少5
×
102个细胞、至少103个细胞、至少5
×
103个细胞、至少104个细胞、至少5
×
104个细胞、至少105个细胞、至少2
×
105个细胞、至少3
×
105个细胞、至少4
×
105个细胞、至少5
×
105个细胞、至少6
×
105个细胞、至少7
×
105个细胞、至少8
×
105个细胞、至少9
×
105个细胞、至少1
×
106个细胞、至少2
×
106个细胞、至少3
×
106个细胞、至少4
×
106个细胞、至少5
×
106个细胞、至少6
×
106个细胞、至少7
×
106个细胞、至少8
×
106个细胞、至少9
×
106个细胞、或其倍数。所述重组细胞可以源自一个或多个供体或者可以从自体来源获得。在一些实施方案中,将所述重组细胞在施用于有需要的个体之前在培养物中扩增。
[0121]
在一些实施方案中,通过方法或途径将重组细胞组合物(例如,包含根据本文所述的任何细胞的多个重组细胞的组合物)递送至个体中导致所述细胞组合物至少部分定位于期望部位处。包含重组细胞的组合物可以通过导致个体的有效治疗的任何适当途径来施用,例如,施用导致递送至个体体内的期望位置,其中所递送组合物的至少一部分(例如,至少1
×
104个细胞)被递送至期望部位持续一段时间。施用方式包括注射、输注、滴注。“注射”包括而不限于静脉内、肌肉内、动脉内、鞘内、心室内、囊内、眼眶内、心内、皮内、腹膜内、经气管、皮下、角质层下、关节内、囊下、珠网膜下、脊柱内、脑脊髓内和胸骨内注射和输注。在一些实施方案中,所述途径是静脉内的。对于细胞的递送,通过注射或输注进行递送是优选的施用方式。
[0122]
在一些实施方案中,将所述重组细胞例如经由输注或注射全身施用。例如,不直接将重组细胞群施用至靶部位、组织或器官,使得其进入个体的循环系统,并且由此经历代谢和其他类似的生物过程。
[0123]
包括本文所提供的任何组合物的治疗用于治疗疾病或病症的功效可以由熟练的
临床医师来确定。然而,本领域技术人员将理解,如果疾病的任何一种或全部体征或症状或标记物得到改善或改进,则认为治疗是有效的。还可以通过如由减少住院治疗或对医疗干预的需要(例如,疾病进展停止或至少减缓)所评估的个体恶化的失败来测量疗效。测量这些指示物的方法是本领域技术人员已知的和/或在本文中描述。治疗包括对个体或动物的疾病的任何治疗(一些非限制性例子包括人或哺乳动物)并且包括:(1)抑制疾病,例如,停止或减缓症状的进展;或(2)缓解疾病,例如,导致症状消退;以及(3)预防或减少症状发展的可能性。
[0124]
如上文所讨论的,治疗有效量包括治疗组合物当施用于个体时足以促进特定有益作用的量,所述个体如患有、怀疑患有或有风险患上疾病的个体。在一些实施方案中,有效量包括足以预防或延迟疾病的症状的发展、改变疾病的症状的进程(例如但不限于,减缓疾病的症状的进展)或逆转疾病的症状的量。应理解,对于任何给定的病例,本领域普通技术人员使用常规实验可以确定适当的有效量。
[0125]
在所公开的方法的一些实施方案中,所述个体是哺乳动物。在一些实施方案中,所述哺乳动物是人。在一些实施方案中,所述个体患有或怀疑患有与由细胞表面配体或抗原介导的细胞信号传导的抑制相关的疾病。适合于通过本公开文本的组合物和方法治疗的疾病包括但不限于癌症、自身免疫病、炎性疾病和感染性疾病。在一些实施方案中,所述疾病是癌症或慢性感染。另外的疗法
[0126]
如上所讨论的,可以将本文所述的重组细胞和药物组合物与一种或多种另外的治疗剂例如化学治疗剂或抗癌剂或抗癌疗法组合施用。与一种或多种另外治疗剂“组合”施用包括同时(并行)施用和以任何顺序连续施用。在一些实施方案中,所述一种或多种另外的治疗剂、化学治疗剂、抗癌剂或抗癌疗法选自化学疗法、放射疗法、免疫疗法、激素疗法、毒素疗法和手术。“化学疗法”和“抗癌剂”在本文中可互换使用。可以使用各种类别的抗癌剂。非限制性例子包括:烷化剂、抗代谢物、蒽环类、植物生物碱、拓扑异构酶抑制剂、鬼臼毒素、抗体(例如,单克隆或多克隆的)、酪氨酸激酶抑制剂(例如,甲磺酸伊马替尼(或))、激素治疗、可溶性受体和其他抗肿瘤药。用于调节细胞的活性的方法
[0127]
在另一方面,本文提供了用于调节细胞的活性的各种方法。所述方法包括以下步骤:(a)提供有效数量的本文提供的任何重组细胞,以及(b)使所述重组细胞与选定的配体接触,其中所述选定的配体与所述胞外配体结合结构域的结合诱导配体诱导型蛋白水解切割位点的切割并释放所述转录调控因子,其中所释放的转录调控因子调节(例如,抑制或刺激)所述重组细胞的活性。本领域技术人员在阅读本公开文本后将理解,所公开的方法可以在体内、离体或体外进行。
[0128]
可以使用本文提供的方法调节的非限制性示例性细胞活性包括但不限于基因表达、增殖、凋亡、非凋亡性死亡、分化、去分化、迁移、基因产物的分泌、细胞粘附以及细胞溶解活性。
[0129]
在一些实施方案中,所释放的转录调控因子调节细胞的基因产物的表达。在一些实施方案中,所释放的转录调控因子调节细胞中异源基因产物的表达。异源基因产物是通常在细胞中没有发现、例如通常不由细胞产生的基因产物。例如,可以用包含编码异源基因
产物的核苷酸序列的核酸对细胞进行遗传修饰。
[0130]
在一些实施方案中,所述异源基因产物是分泌的基因产物。在一些实施方案中,所述异源基因产物是细胞表面基因产物。在一些情况下,所述异源基因产物是胞内基因产物。在一些实施方案中,所释放的转录调控因子同时调节细胞中两种或更多种异源基因产物的表达。
[0131]
在一些实施方案中,细胞中的异源基因产物选自趋化因子、趋化因子受体、嵌合抗原受体、细胞因子、细胞因子受体、分化因子、生长因子、生长因子受体、激素、代谢酶、病原体衍生的蛋白质、增殖诱导剂、受体、rna指导的核酸酶、位点特异性核酸酶、t细胞受体(tcr)、嵌合抗原受体(car)、毒素、毒素衍生的蛋白质、转录调控因子、转录激活物、转录阻遏物、翻译调节因子、翻译激活物、翻译阻遏物、激活性免疫受体、抗体、凋亡抑制剂、凋亡诱导剂、工程化t细胞受体、免疫激活物、免疫抑制剂以及抑制性免疫受体。
[0132]
在一些实施方案中,所释放的转录调控因子调节所述细胞的分化,并且其中所述细胞是免疫细胞、干细胞、祖细胞或前体细胞。
[0133]
当使用相同的结合结构域和icd时,本公开文本的嵌合受体与标准synnotch受体相比提供更高程度的表达。根据配体/结合结构域对及其亲和力,嵌合受体或微型notch受体可以提供比相应的synnotch受体高约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%或约50%的表达增强。
[0134]
另外,本公开文本的嵌合受体可以提供转录调控,所述转录调控响应于t细胞激活的程度,而与配体结合无关。例如,当在t细胞中表达时,如与t细胞未被激活时产生的配体诱导的信号相比,本公开文本的一些受体在t细胞被激活时提供更强的配体诱导的信号。这允许在使用中具有额外的灵活性,例如在尽管不存在嵌合受体配体但当被激活时仍期望增强或阻遏t细胞应答的情况下。系统和试剂盒
[0135]
本文还提供系统和试剂盒,其包括本文提供并描述的嵌合多肽、微型notch受体、重组核酸、重组细胞或药物组合物以及用于它们的制备和使用的书面说明书。例如,在一些实施方案中,本文提供系统和/或试剂盒,其包括以下中的一种或多种:如本文所述的嵌合多肽、如本文所述的微型notch受体、如本文所述的重组核酸、如本文所述的重组细胞或如本文所述的药物组合物。在一些实施方案中,本公开文本的系统和/或试剂盒还包括一个或多个注射器(包括预填充注射器)和/或导管(包括预填充注射器),用于将所提供的嵌合多肽、微型notch受体、重组核酸、重组细胞或药物组合物中的任一种施用至个体。在一些实施方案中,试剂盒可以具有一种或多种另外的治疗剂,所述另外的治疗剂可以与其他试剂盒组分同时或依序施用以用于期望目的,例如用于调节细胞的活性、抑制靶癌细胞或治疗有需要的个体的健康状况(例如,疾病)。
[0136]
任何上述系统和试剂盒还可以包含一种或多种另外的试剂,其中此类另外的试剂可以选自:稀释缓冲液、重构溶液、洗涤缓冲液、对照试剂、对照表达载体、阴性对照多肽、阳性对照多肽、用于体外产生所述嵌合受体多肽的试剂。
[0137]
在一些实施方案中,系统或试剂盒的组分可以在分开的容器中。在一些其他实施方案中,系统或试剂盒的组分可以组合在单个容器中。
[0138]
在一些实施方案中,系统或试剂盒还可以包含使用所述试剂盒的组分来实践所述
方法的说明书。用于实践所述方法的说明书通常记录在合适的记录介质上。例如,所述说明书可以印刷在基材如纸或塑料等上。所述说明书可以作为包装插入物存在于试剂盒中、试剂盒的容器或其组分的标签中(即,与包装或分包装相关联)等。所述说明书可以作为存在于合适的计算机可读存储介质(例如,cd-rom、软盘、闪存驱动器等)上的电子存储数据文件而存在。在一些情形下,实际说明书不存在于所述试剂盒中,而是可以提供用于从远程源(例如,经由互联网)获得所述说明书的手段。这个实施方案的例子是包括网址的试剂盒,在其中可以查看说明书和/或可以从其下载说明书。与说明书一样,可以将这种用于获得说明书的手段记录在合适的基材上。
[0139]
本公开文本中所提到的所有出版物和专利申请都通过引用并入本文,并入程度如同确切且单独地指示每个单独出版物或专利申请都通过引用并入一般。
[0140]
不承认本文引用的任何参考文献构成现有技术。参考文献的讨论陈述其著者的主张,并且诸位发明人保留质疑所引用文献的准确性和相关性的权利。应清楚地理解,尽管本文中提及许多信息源,包括科学期刊文章、专利文件和教科书;但是该提及并不意味着承认这些文件中的任何文件构成了本领域中公知常识的一部分。
[0141]
本文给出的一般方法的讨论仅旨在用于说明目的。在审阅本公开文本之后,其他替代方法和替代方案对于本领域技术人员而言将是清楚的,并且将被包括在本技术的精神和范围内。实施例
[0142]
除非另有说明,否则本公开文本的实践将采用本领域技术人员众所周知的分子生物学、微生物学、细胞生物学、生物化学、核酸化学和免疫学的常规技术。在上面引用的文献中对此类技术进行了充分解释。
[0143]
在以下实施例中进一步详细公开了另外的实施方案,所述实施例仅以说明方式提供,而并非旨在以任何方式限制本公开文本或权利要求的范围。实施例1嵌合受体和应答元件构建体的设计和构建
[0144]
此实施例描述了嵌合notch受体家族的设计和构建。本公开文本的各种示例性受体的详细信息可以在下表1和表2中见到。表1.这个表提供了对如序列表中所示的嵌合notch受体、其对应组分以及对应序列标识符中的每一种的简要描述。ecd:胞外结构域;n-jmd:n末端近膜结构域(即,连接多肽);tmd:跨膜结构域;sts:停止转移序列;tf:转录因子。表1
表2.这个表提供了对每种嵌合notch受体和相应组分(其中组分由逗号分开)的简要描述。除非另有说明,否则条目是指人来源的蛋白质。例如,“notch1,notch1”指示将来自notch1的两个序列融合以产生此蛋白模块。表2
[0145]
上文表1-表2中描述的嵌合受体通过以下方式来构建:将识别cd19的单链抗原结合片段(scfv)(porter dl等人,2011)或抗gfp纳米抗体(lag17)与相应受体支架和合成转录调控因子gal4-vp64融合。对于这些受体的构建,编码表1和序列表中提供的氨基酸序列的dna片段是从含有所指示蛋白质的dna序列的合成基因片段或质粒pcr扩增的,并且使用标准克隆技术(例如,单链突出端pcr、融合pcr和in-fusion克隆)与侧接的翻译起始和终止序列一起组装至慢病毒表达载体phr-sin-pgk的bamhi克隆位点中(l.morsut等人,cell(2016)164:780-91;addgene质粒#76120)。
[0146]
用于这些实验的转录调控因子gal4-vp64含有与激活结构域vp64融合的来自酵母gal4转录因子的dna结构域,所述激活结构域vp64由单纯疱疹蛋白vp16的最小激活结构域(氨基酸437-447)的四聚体重复组成。所有受体都含有用于膜靶向的n末端cd8α信号肽(malpvtalllplalllhaarp)(seq id no:55)和myc标签(eqkliseedl)(seq id no:56),所述标签便于用缀合至荧光染料(α-myc cell signaling technology,目录号2233)的抗体适当地确定表面表达。将所述受体各自克隆至含有磷酸甘油酸激酶(pgk)启动子的修饰的慢病毒phr
′
sin:csw载体中(kt roybal等人,cell2016年10月6日;167(2):419-32),用于下文实施例3-4中描述的所有原代t细胞实验。
[0147]
phr'sin:csw载体也被修饰以产生应答元件质粒。为此目的,将用于结合gal4 dbd
结构域(ggagcactgtcctccgaacg)(seq id no:57)的靶序列的五个拷贝克隆至最小pybtata启动子的5'侧。应答元件质粒中还包含组成型驱动黄色荧光报告蛋白(mcitrine)表达以适当地鉴定成功转导的t细胞的pgk启动子。
[0148]
为了构建所有诱导型bfp载体,经由位于gal4应答元件的3'侧的多克隆位点中的bamhi位点克隆蓝色荧光报告蛋白(bfp)的编码序列。为了构建所有诱导型car载体,将car在c末端用绿色荧光报告蛋白(gfp)标记,并且经由位于gal4应答元件3'侧的多克隆位点中的bamhi位点克隆。所有构建体都是根据制造商的说明书经由克隆试剂盒(克隆,clontech#st0345)克隆的。实施例2原代人t细胞分离和培养
[0149]
此实施例描述了原代人t细胞的分离和培养,所述原代人t细胞随后用于以下实施例3中描述的各种细胞转导实验。
[0150]
在这些实验中,原代cd4
t细胞和原代cd8
t细胞在单采术后从血液中分离,并且使用人t细胞分离试剂盒(人cd4
和cd8
富集混合物;stemcell technologies目录号15062和15063)通过阴性选择富集。血液获自太平洋血液中心(blood centers of the pacific)(加利福尼亚州旧金山市),如大学机构审查委员会(university institutional review board)批准的。将t细胞冷冻保存在具有20%人ab血清(valley biomedical inc.,#hp1022)和10%dmso的生长培养基(rpmi-1640,ucsf细胞培养核心)中。解冻后,对于所有实验,在补充有30单位/毫升il-2(nci brb临床前储存库)的含有x-vivo
tm 15(lonza#04-418q)、5%人ab血清和10mm中和的n-乙酰基l-半胱氨酸(sigma-aldrich#a9165)的人t细胞培养基中培养t细胞。实施例3用慢病毒载体稳定转导人t细胞
[0151]
所述实施例描述用于人t细胞的慢病毒转导的通用方案。
[0152]
通常,用水疱性口炎病毒包膜g蛋白(vsv-g)假型化的慢病毒载体(泛嗜性载体)是通过用phr
′
sin:csw转基因表达载体以及病毒包装质粒pcmvdr8.91和pmd2.g使用mirus
ꢀ‑
lenti(mirus,#mir 6606)转染lenti-x
tm
293t细胞(clontech#11131d)来产生。通常,将原代t细胞在同一天解冻,并且在培养24小时后,用具有结合至表面的抗cd3抗体和抗cd28抗体的珠粒(人t激活物cd3/cd28 life technologies#11131d)以1:3细胞:珠粒比刺激原代t细胞。在48小时,收获病毒上清液,并且将原代t细胞暴露于病毒,持续24小时。在t细胞刺激后第5天,去除珠粒,并且进行t细胞扩增,直到第14天,此时它们静止并且可以用于测定。用beckton dickinson(bd biosciences)facsaria
tm ii流式细胞仪分选t细胞用于测定。在分选期间门控出展现基础car表达的与门t细胞。实施例4微型notch设计、表达和激活
[0153]
这个实施例描述微型notch受体的设计,以及为了展现其在人cd4 t细胞中的表达和tcr激活而进行的实验。图2b描绘示例性流式细胞术数据,其证实微型notch受体在人cd4 t细胞中表达。在这些实验中,将原代人t细胞用抗cd3/抗cd28 dynabeads(gibco)激活并用表达notch受体或转录报告物构建体的两种慢病毒构建体转导。使用alexafluor647标记
的抗myc抗体(cell signaling)测量受体表达。通过在报告物质粒上携带的组成型mcitrine基因来测量报告物表达。在初始t细胞刺激后第5天分选双阳性细胞,并且进一步扩增用于激活测试。图2c描绘微型notch受体的tcr激活。顶部小图概括在没有tcr激活的情况下,受体激活测试的结果。将1x105个表达抗cd19受体的双阳性t细胞与以下共培养24小时:1x105个k562细胞(上迹线)或1x105个cd19 k562细胞(下迹线)。随后使用fortessa x-50(bd biosciences)测量诱导型bfp报告基因的转录激活。底部小图概括在tcr激活的情况下,受体激活的结果。在此实验中,将一种dag类似物佛波醇12-十四酸酯13-乙酸酯(pma)添加至共培养物以模拟pkc信号传导。实施例5使用并行t细胞激活的synnotch与微型notch受体激活
[0154]
这个实施例描述用并行t细胞激活进行的为了比较synnotch激活与微型notch受体激活而进行的实验。在这些实验中,为了模拟t细胞激活,使用抗mcam、抗cd3双特异性t细胞接合器(mcam bite),其在k562细胞的存在下激活t细胞受体(图3)。将1x105个表达抗cd19受体的双阳性t细胞与以下共培养24小时:mcam bite(上迹线)、1x105个k562细胞 mcam bite(中迹线)或1x105个cd19 k562细胞 mcam bite(下迹线)。随后使用fortessa x-50(bd biosciences)测量诱导型bfp报告基因的转录激活。实施例6使用共表达的car的synnotch与微型notch受体激活
[0155]
这个实施例描述如下实验,其中用共表达的car进行synnotch和微型notch受体的激活测试。在这些实验中,将synnotch1和微型notch1与靶向alppl2的car共转导(图4a)。如图4b中所示,将1x105个表达抗cd19 synnotch或微型notch和抗alppl2car的双阳性t细胞与以下共培养24小时:空白样品(顶部迹线)、1x105个k562细胞(从顶部起第二个迹线)、1x105个cd19 k562细胞(从顶部起第三个迹线)、1x105个alppl2 k562细胞(从顶部起第四个迹线)或者1x105个cd19 k562细胞和1x105个alppl2 k562细胞(底部迹线)。随后使用fortessa x-50(bd biosciences)测量诱导型bfp报告基因的转录激活。实施例7具有其他配体识别结构域的微型notch受体的测试
[0156]
这个实施例描述了为了展现出除了抗cd19 scfv外也可以使用其他配体识别结构域而进行的实验。如图5a中所说明,还可以使用抗gfp lag17纳米抗体和抗alppl2scfv。图5b概括使用另外的配体识别结构域的激活测试的结果。在这些实验中,将原代cd8 人t细胞用抗cd3/抗cd28 dynabeads(gibco)激活并用表达受体或转录报告物构建体的两种慢病毒构建体转导。使用alexafluor647标记的抗myc抗体(cell signaling)测量受体表达。通过在报告物质粒上发现的组成型荧光蛋白基因来测量报告物表达。在初始t细胞刺激后第5天分选双阳性细胞,并且进一步扩增用于激活测试。
[0157]
对于测试,将1x105个表达抗gfp或抗alppl2微型notch的双阳性cd8 t细胞与以下共培养24小时:无(上迹线)、1x105个k562细胞(中迹线)或者1x105个表面gfp k562细胞/alppl2 k562细胞(下迹线)。随后使用fortessa x-50(bd biosciences)测量诱导型bfp报告基因的转录激活。实施例8
体外刺激原代t细胞
[0158]
这个实施例描述了为了展现通过本文所述的嵌合微型notch多肽对原代t细胞的体外刺激而进行的实验。
[0159]
对于所有体外t细胞刺激,将1
×
105个t细胞与发送细胞以1:1比率在平底96孔组织培养板中共培养。在24小时用bd fortessa
tm x-50分析培养物的报告物激活。所有流式细胞术分析都在flowjo
tm
软件(treestar,inc.)中进行。
[0160]
微型notch构建体pray050(微型notch1)、piz605(微型notch2)、piz608(微型notch3)、piz611(微型notch4)中的每一种能够刺激原代t细胞,如通过bfp报告基因的表达所确定。
[0161]
这个实验的结果概括于下文表3中。表3受体“开关样”对t细胞激活敏感微型notch-1是是微型notch-2否-始终开启否微型notch-3是-比微型notch-1噪声更大否微型notch-4是-比微型notch-1噪声更大否
[0162]
还观察到:(1)二肽-gln-his-(qh)在微型notch1构建体中没有发现,但是在微型notch1-qh构建体中被发现,所述微型notch1-qh构建体与pray050构建体相同,但sts的长度长两个氨基酸残基,以及(2)将“qh”二肽添加至微型notch1的sts轻度改进受体信号。实施例9
[0163]
这个实施例描述以与daudi肿瘤等同的水平表达cd19的髓性白血病细胞的生成。
[0164]
所用的癌细胞系是k562髓性白血病细胞(atcc#ccl-243)和daudi b细胞淋巴母细胞(atcc#ccl-213)。k562细胞用慢病毒转导以按与daudi肿瘤等同的水平稳定表达人cd19。cd19水平是通过将细胞用α-cd19 apc(#302212)染色来确定。针对转基因的表达分选所有细胞系。实施例10报告物jurkat t细胞的产生
[0165]
这个实施例描述报告jurkat t细胞的生成,其随后用于筛选跨膜结构域(tmd)和/或停止转移序列(sts)。在本公开文本中,这些报告jurkat细胞用于针对jurkat细胞中的微型notch受体进行的所有实验。
[0166]
在这些实验中,将e6-1 jurkat t细胞(atcc#tib-152)用携带诱导型bfp报告基因和组成型mcitrine报告基因的报告质粒进行慢病毒转导,如先前所述(roybal kt等人,cell,164:1-10,2016)。使用beckton dickinson(bd biosciences)facsaria
tm ii流式细胞仪针对mcitrine表达分选报告物阳性jurkat细胞并扩增。
[0167]
用受体转基因表达载体产生慢病毒颗粒,如先前所述(morsut等人,cell(2016)164:780-91)。用单独的受体转导报告物阳性jurkat细胞,并且在96孔板中扩增用于实验。实施例11
[0168]
这个实验描述了为了展现由本文所述的嵌合微型notch多肽在体外对jurkat t细胞的刺激而进行的实验。
[0169]
对于所有体外jurkat t细胞刺激,将1
×
105个jurkat t细胞与发送细胞以1:1比率在平底96孔组织培养板中共培养。在24小时针对受体(myc)表达和报告物激活用bd fortessa x-50
tm
分析培养物。所有流式细胞术分析都在flowjo
tm
软件(treestar,inc.)中进行。使用上文方案在人原代t细胞中确认具有阳性tmd和sts命中以及阴性命中的选择的受体。
[0170]
尽管已经公开了本公开文本的特定替代方案,但是应理解,各种修改和组合是可能的并且涵盖于所附权利要求的真实精神和范围内。因此,无意限制于本文呈现的确切摘要和公开文本。实施例12
[0171]
这个实施例描述了为了展现使用共表达的car的受体激活而进行的实验的结果。图6a显示通过共表达的靶向alppl2的car激活示例性微型notch受体(“微型synnotch1”)与synnotch1受体的简图。如图6b中所示,将1x105个表达抗cd19受体的双阳性t细胞与以下共培养:无添加(顶部迹线)、1x105个alppl2 k562细胞(从顶部起第二个迹线)、1x105个cd19 k562细胞(从顶部起第三个迹线)或者1x105个alppl2 cd19 k562细胞(底部迹线)。随后使用fortessa x-50(bd biosciences)测量诱导型bfp报告基因的转录激活。包括使用鼠原始synnotch构建体和人原始synnotch构建体的激活用于比较。实施例13
[0172]
这个实施例描述针对本文所提供和表1中所述的一些嵌合notch受体进行的如本文所述的实验的结果。表4
kolinko,joseph h.choe,whitney j.walker,krista a.mcnally,and wendell a.lim.engineering t cells with customized therapeutic response programs using synthetic notch receptors.cell.2016oct 6;167(2):419
–
432.samulski and muzyczka(2014).aav-mediated gene therapy for research and therapeutic purposes.annu.rev.virol.1,427.sakuma,et al.(2012).lentiviral vectors:basic to translational.biochem.j.443,603.watson d.j.,wolfe j.h.viral vectors for gene therapy:methods and protocols.totowa,nj,usa:humana press;2003.pp.383
–
404.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
