1.本公开文本提供了一种用于使用免疫疗法来治疗患有癌症的受试者的方法。
背景技术:
2.人类癌症具有许多的遗传和表观遗传改变,产生了潜在地可被免疫系统识别的新抗原(sjoblom等人,science(2006)314(5797):268-274)。由t淋巴细胞和b淋巴细胞构成的适应性免疫系统具有强大的抗癌潜力,具有广泛的能力和精确的特异性以响应多样的肿瘤抗原。此外,免疫系统展现了相当大的可塑性和记忆组分。成功地利用适应性免疫系统的所有这些属性将使得免疫疗法在所有癌症治疗方式中是独特的。
3.直到最近,癌症免疫疗法将大量努力集中于通过过继性转移激活的效应细胞、针对相关抗原进行免疫或提供非特异性免疫刺激剂(如细胞因子)来增强抗肿瘤免疫应答的方法。然而,在过去的十年中,开发特异性免疫检查点途径抑制剂的大量努力已经开始提供用于治疗癌症的新的免疫治疗方法,包括开发与程序性死亡蛋白-1(pd-1)受体特异性结合并阻断抑制性pd-1/pd-1配体途径的抗体(如纳武单抗(nivolumab)和派姆单抗(pembrolizumab)(先前为兰布利珠单抗(lambrolizumab);usan委员会声明,2013))(topalian等人,2012a,b;topalian等人,2014;hamid等人,2013;hamid和carvajal,2013;mcdermott和atkins,2013)。
4.pd-1是由激活的t细胞和b细胞表达的关键免疫检查点受体,并介导免疫抑制。pd-1是cd28受体家族(包括cd28、ctla-4、icos、pd-1和btla)的成员。已经鉴定出了pd-1的两种细胞表面糖蛋白配体,即程序性死亡蛋白配体-1(pd-l1)和程序性死亡蛋白配体-2(pd-l2),它们在抗原呈递细胞以及许多人类癌症上表达并且已经显示在与pd-1结合后下调t细胞激活和细胞因子分泌。在临床前模型中,pd-1/pd-l1相互作用的抑制介导有效的抗肿瘤活性(美国专利号8,008,449和7,943,743),并且使用pd-1/pd-l1相互作用的抗体抑制剂来治疗癌症已经进入临床试验(brahmer等人,2010;topalian等人,2012a;topalian等人,2014;hamid等人,2013;brahmer等人,2012;flies等人,2011;pardoll,2012;hamid和carvajal,2013)。
5.纳武单抗(先前命名为5c4、bms-936558、mdx-1106或ono-4538)是完全人igg4(s228p)pd-1免疫检查点抑制剂抗体,其选择性地阻止与pd-1配体(pd-l1和pd-l2)的相互作用,从而阻断抗肿瘤t细胞功能的下调(美国专利号8,008,449;wang等人,2014)。纳武单抗已经在多种晚期实体瘤中显示出活性,所述多种晚期实体瘤包括肾细胞癌(肾腺癌或肾上腺样瘤)、黑色素瘤和非小细胞肺癌(nsclc)(topalian等人,2012a;topalian等人,2014;drake等人,2013;wo 2013/173223)。包含纳武单抗和吲哚胺2,3-双加氧酶1(ido1)抑制剂林罗司他(bms-986205)的组合治疗目前正在进行临床试验(clinicaltrials.gov标识符nct02658890)。
6.吲哚胺2,3-双加氧酶(ido1)是含有血红素的酶,其催化l-色氨酸o2依赖性氧化成n-甲酰基犬尿氨酸。该反应是犬尿氨酸途径中的第一和限速步骤,其导致色氨酸降解产生
烟酰胺腺嘌呤二核苷酸。在患者中,ido1被ifnγ上调,并且被抗pd-1治疗(例如纳武单抗)进一步上调(moon yw,等人j immunother cancer 2015;3:51;liu m等人j hematol oncol 2018;11(1):100)。ido1和tdo2催化色氨酸途径中的限速步骤以产生犬尿氨酸(kyn)(moon yw,等人j immunother cancer 2015;3:51;liu m,等人j hematol oncol 2018;11(1):100)。林罗司他抑制色氨酸代谢为犬尿氨酸,从而降低犬尿氨酸水平并潜在地增加效应t细胞功能(hunt jt,等人clin cancer res 2017;77(suppl.).摘要4964)。参见,例如,美国专利号9,643,972,将其通过引用以其整体并入本文。
7.免疫系统和对免疫疗法的反应是复杂的。此外,抗癌剂的有效性可以根据独特的患者特征而变化。因此,需要有针对性的治疗策略,其鉴定出更可能对特定的抗癌剂有反应的患者,从而改善被诊断患有癌症的患者的临床结局。
技术实现要素:
8.本公开文本提供了一种用于治疗患有癌症的人受试者的方法,其包括向所述受试者施用抗pd-1拮抗剂和吲哚胺2,3-双加氧酶1(ido1)抑制剂,其中所述受试者在施用前被鉴定为展现出组合生物标记物,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低色氨酸2,3-双加氧酶2(tdo2)基因表达得分;并且其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中包含干扰素γ(ifnγ)相关基因的一组套炎症基因(“ifnγ炎症基因组套”)的表达并从所述表达值计算得分来确定的。
9.还提供了一种用于治疗患有癌症的人受试者的方法,其包括(i)鉴定展现出组合生物标记物的受试者,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分;和(ii)向所述受试者施用抗pd-1拮抗剂和ido1抑制剂;其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中ifnγ炎症基因组套的表达并从所述表达值计算得分来确定的。
10.还提供了一种用于鉴定患有适合于用抗pd-1拮抗剂和ido1抑制剂治疗的癌症的人受试者的方法,所述方法包括测量从所述受试者获得的样品中ifnγ炎症特征得分和tdo2基因表达;其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中ifnγ炎症基因组套的表达并从所述表达值计算得分来确定的。在一些方面,受试者展现出组合生物标记物,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分。在一些方面,所述方法还包括向受试者施用抗pd-1拮抗剂和ido1抑制剂。
11.本发明还提供了一种用于在有需要的人受试者中与抗pd-1拮抗剂组合治疗癌症的ido1抑制剂,其中所述受试者在施用前被鉴定为展现出组合生物标记物,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分;并且其中所述ifnγ炎症特征得分是通过测量从受试者获得的样品中ifnγ炎症基因组套的表达并从所述表达值计算得分来确定的。
12.还提供了用于鉴定患有适合于用与用抗pd-1拮抗剂治疗组合的ido1抑制剂治疗的癌症的人受试者的组合生物标记物,其中所述组合生物标记物包含在从所述受试者获得的样品中测量的(i)ifnγ炎症特征得分和(ii)tdo2基因表达;并且其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中ifnγ炎症基因组套的表达并从所述表达值计算得分来确定的。在一些方面,受试者展现出组合生物标记物,所述组合生物标记物包含
(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分。
13.在一些方面,ifnγ炎症基因组套基本上由1种炎症基因、2种炎症基因、3种炎症基因、4种炎症基因、5种炎症基因、6种炎症基因、7种炎症基因、8种炎症基因、9种炎症基因、10种炎症基因、11种炎症基因、12种炎症基因、13种炎症基因、14种炎症基因、15种炎症基因、16种炎症基因、17种炎症基因、18种炎症基因、19种炎症基因或20种炎症基因组成。在一些方面,炎症基因选自ifnγ、cxcl10、hla-dra、cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e、ccr5、cxcl11、gzma、prf1、ir2rg、cd3d、cd2、itgal、tagap、ciita、ptprc、cd3e、gzmk、gzmb、pdcd1、slamf6、cxcl13及其任何组合。
14.在一些方面,ifnγ炎症基因组套由以下组成或基本上由以下组成:(i)ifnγ、cxcl10、cxcl9、hla-dra、ido1和stat1;(ii)ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1、ccr5、cxcl11、gzma和prf1;(iii)cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1和hla.e;或(vi)其任何组合,或(i)至(iii)中基因的任何组合。
15.在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分大于平均ifnγ炎症特征得分,其中平均ifnγ炎症特征得分是通过对从患有癌症的受试者群体获得的癌症样品中ifnγ炎症基因组套的基因表达平均化来确定的。在一些方面,平均ifnγ炎症特征得分是通过对从受试者群体获得的癌症样品中ifnγ炎症基因组套基因的表达平均化来确定的。在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分高于参考样品的平均ifnγ炎症特征得分。
16.在一些方面,所述参考样品包括所述受试者的非肿瘤组织、所述受试者的相应非肿瘤组织、或没有肿瘤的受试者的相应组织。在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分比平均ifnγ炎症特征得分高至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%或至少约300%。
17.在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分比平均ifnγ炎症特征得分高至少约50%。在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分比平均ifnγ炎症特征得分高至少约75%。
18.在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达小于平均tdo2基因表达得分,其中平均tdo2基因表达得分是通过对从患有癌症的受试者群体获得的癌症样品中tdo2基因的表达平均化来确定的。在一些方面,平均tdo2基因表达得分是通过对从受试者群体获得的癌症样品中tdo2基因的表达平均化来确定的。在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达低于参考样品的平均tdo2基因表达得分。在一些方面,所述参考样品包括所述受试者的非肿瘤组织、所述受试者的相应非肿瘤组织、或没有肿瘤的受试者的相应组织。在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分比平均tdo2基因表达得分低至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少
约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%或至少约300%。
19.在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分比平均tdo2基因表达得分低至少约50%。在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分比平均tdo2基因表达得分低至少约75%。
20.在一些方面,癌症是肿瘤。在一些方面,肿瘤是癌。在一些方面,肿瘤选自膀胱癌、宫颈癌、肺癌、胰腺癌、肾癌、头颈癌、黑色素瘤、子宫内膜癌、肝细胞癌(hcc)或胶质母细胞瘤。在一些方面,肺癌是非小细胞肺癌(nsclc)。在一些方面,肾癌是肾细胞癌(rcc)。在一些方面,头颈癌是头颈鳞状细胞癌(scchn)。在一些方面,胶质母细胞瘤是多形性胶质母细胞瘤(gbm)。在一些方面,肿瘤不是黑色素瘤。在一些方面,癌症是血液癌症。在一些方面,血液癌症是淋巴瘤。在一些方面,淋巴瘤是弥漫性大b细胞淋巴瘤(dlbcl)。
21.在一些方面,样品是肿瘤组织活检物。在一些方面,样品是从肿瘤的间质获得的。在一些方面,样品是福尔马林固定的石蜡包埋的组织、新鲜冷冻的组织或血液样品。
22.在一些方面,ifnγ炎症基因组套中的基因的表达和/或tdo2基因表达是通过检测基因mrna的存在、由所述基因编码的蛋白质的存在或两者来确定的。在一些方面,编码ifnγ炎症基因组套中的基因和/或tdo2基因的mrna的存在是使用逆转录酶pcr确定的。在一些方面,由ifnγ炎症基因组套中的基因和/或tdo2基因编码的蛋白质的存在是使用免疫组织化学(ihc)测定确定的。在一些方面,所述ihc测定是自动化ihc测定。在一些方面,测定是包括与ifnγ炎症基因组套相关的拓扑学的蛋白质ihc测定。
23.在一些方面,抗pd-1拮抗剂是抗pd-1抗体或其抗原结合部分。在一些方面,抗pd-1抗体或其抗原结合部分与纳武单抗交叉竞争与人pd-1的结合。在一些方面,抗pd-1抗体或其抗原结合部分与纳武单抗结合相同的表位。在一些方面,抗pd-1抗体是嵌合、人源化或人单克隆抗体或其一部分。在一些方面,抗pd-1抗体包含人igg1或igg4同种型的重链恒定区。在一些方面,抗pd-1抗体包括纳武单抗、派姆单抗或其抗原结合部分。在一些方面,抗pd-1抗体是纳武单抗、派姆单抗或西米普利单抗。
24.在一些方面,抗pd-1拮抗剂是抗pd-l1抗体或其抗原结合部分。在一些方面,抗pd-l1抗体包括阿维鲁单抗、阿特珠单抗、度伐鲁单抗或其抗原结合部分。在一些方面,抗pd-l1抗体是阿维鲁单抗、阿特珠单抗或度伐鲁单抗。
25.在一些方面,将抗pd-1抗体或抗pd-l1抗体以范围从至少约0.1mg/kg至至少约10.0mg/kg体重的剂量约每1周一次、约每2周一次或约每3周一次施用。在一些方面,将抗pd-1抗体或抗pd-l1抗体以至少约3mg/kg体重的剂量约每2周施用一次。在一些方面,将抗pd-1抗体或抗pd-l1抗体或其抗原结合部分以平剂量施用。在一些方面,将抗pd-1抗体或抗pd-l1抗体或其抗原结合部分以如下平剂量施用:至少约200mg/剂、至少约220mg/剂、至少约240mg/剂、至少约260mg/剂、至少约280mg/剂、至少约300mg/剂、至少约320mg/剂、至少约340mg/剂、至少约360mg/剂、至少约380mg/剂、至少约400mg/剂、至少约420mg/剂、至少约440mg/剂、至少约460mg/剂、至少约480mg/剂、至少约500mg/剂、至少约520mg/剂、至少约540mg/剂或至少约550mg/剂。
26.在一些方面,将抗pd-1抗体或抗pd-l1抗体或其抗原结合部分以约240mg/剂的平
剂量施用。在一些方面,将抗pd-1抗体或抗pd-l1抗体或其抗原结合部分以约480mg/剂的平剂量施用。在一些方面,将抗pd-1抗体或抗pd-l1抗体或其抗原结合部分以平剂量约每1周一次、每2周一次、每3周一次或每4周一次施用。在一些方面,将抗pd-1抗体或抗pd-l1抗体或其抗原结合部分以约240mg/剂的平剂量约每两周施用一次。在一些方面,将抗pd-1抗体或抗pd-l1抗体或其抗原结合部分以约480mg/剂的平剂量约每四周施用一次。在一些方面,只要观察到临床益处就持续施用抗pd-1抗体或抗pd-l1抗体,或直到发生不可管控的毒性或疾病进展。在一些方面,将抗pd-1抗体或抗pd-l1抗体配制用于静脉内施用。在一些方面,将抗pd-1抗体或抗pd-l1抗体以亚治疗剂量施用。
27.在一些方面,ido1抑制剂选择性地抑制ido1。在一些方面,ido1抑制剂不抑制tdo2酶活性。在一些方面,ido1抑制剂是林罗司他((2r)-n-(4-氯苯基)-2-(顺式-4-(6-氟喹啉-4-基)环己基)丙酰胺)。在一些方面,ido1抑制剂是林罗司他盐。在一些方面,林罗司他盐是甲磺酸林罗司他。在一些方面,ido1抑制剂选自林罗司他、1-甲基-dl-色氨酸、对-(3-苯并呋喃基)-dl-丙氨酸、对-[3-苯并(b)噻吩基]-dl-丙氨酸;6-硝基-l-色氨酸,及其任何组合。在一些方面,将ido1抑制剂配制用于口服施用。在一些方面,将ido1抑制剂以约25mg/剂、50mg/剂或100mg/剂的平剂量施用。在一些方面,将ido1抑制剂以约200mg/剂的平剂量施用。
[0028]
在一些方面,将ido1抑制剂以如下平剂量施用:至少约50mg/剂、至少约60mg/剂、至少约70mg/剂、至少约80mg/剂、至少约90mg/剂、至少约100mg/剂、至少约120mg/剂、至少约140mg/剂、至少约160mg/剂、至少约180mg/剂、至少约200mg/剂、至少约220mg/剂、至少约240mg/剂、至少约260mg/剂、至少约280mg/剂、至少约300mg/剂、至少约330mg/剂、至少约340mg/剂、至少约360mg/剂、至少约380mg/剂或至少约400mg/剂。
[0029]
在一些方面,将ido1抑制剂以约100mg/剂的平剂量每天施用。在一些方面,将ido1抑制剂以约200mg/剂的平剂量每天施用。
[0030]
在一些方面,抗pd-1拮抗剂是以240mg剂量每两周或480mg剂量每四周静脉内施用的抗pd-1抗体,并且将ido1抑制剂以100mg或200mg剂量每天口服施用。在一些方面,抗pd-1拮抗剂是以240mg每两周静脉内施用的抗pd-1抗体,并且ido1抑制剂以100mg剂量每天口服施用。在一些方面,抗pd-1拮抗剂是以480mg剂量每四周静脉内施用的抗pd-1抗体,并且将ido1抑制剂以100mg剂量每天口服施用。在一些方面,抗pd-1拮抗剂是以240mg每两周静脉内施用的抗pd-1抗体,并且将ido1抑制剂以200mg剂量每天口服施用。在一些方面,抗pd-1拮抗剂是以480mg剂量每四周静脉内施用的抗pd-1抗体,并且将ido1抑制剂以200mg剂量每天口服施用。
[0031]
在一些方面,抗pd-1抗体是纳武单抗,并且ido1抑制剂是甲磺酸林罗司他。在一些方面,癌症是复发性的。在一些方面,癌症是难治性的。在一些方面,将pd-1拮抗剂在ido1抑制剂之前或之后施用。在一些方面,将pd-1拮抗剂与ido1抑制剂并行施用。在一些方面,癌症在包括施用至少一种抗癌剂的至少一种先前疗法后是难治性的。在一些方面,至少一种抗癌剂包括标准护理疗法。在一些方面,所述至少一种抗癌剂包括免疫疗法。在一些方面,癌症是局部晚期的。在一些方面,癌症是转移性的。
[0032]
在本文公开的方法和/或组合物的一些方面,向受试者施用抗pd-1拮抗剂和吲哚胺2,3-双加氧酶1(ido1)抑制剂治疗癌症。在一些方面,施用减少了癌症负荷。在一些方面,
与施用前的癌症负荷相比,癌症负荷减少至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、或约100%。
[0033]
在一些方面,所述受试者在所述初始施用后展现出至少约一个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约一年、至少约十八个月、至少约两年、至少约三年、至少约四年或至少约五年的无进展存活期。
[0034]
在一些方面,所述受试者在所述施用后展现出疾病稳定。在一些方面,所述受试者在所述施用后展现出部分反应。在一些方面,所述受试者在所述施用后展现出完全反应。在一些方面,与未展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物的受试者的无进展存活概率相比,施用将无进展存活概率提高至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约105%、至少约110%、至少约115%、至少约120%、至少约125%、至少约130%、至少约135%、至少约140%、至少约145%、或至少约150%。
[0035]
在一些方面,与未展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物的受试者的总存活概率相比,施用将总存活概率提高至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%、至少约300%、至少约325%、至少约350%或至少约375%。
[0036]
本公开文本还提供了用于治疗患有癌症的受试者的试剂盒或制品,所述试剂盒或制品包含(a)一定剂量的抗pd-1拮抗剂;(b)一定剂量的ido1抑制剂;和(c)根据本文公开的任何方法使用抗pd-1或抗pd-l1抗体和ido1抑制剂的说明书。
[0037]
本公开文本还提供了至少包含ifnγ和tdo2基因的基因组套,其用于(i)鉴定适合于用包含抗pd-1拮抗剂和ido1抑制剂的组合治疗的受试者;(ii)确定用包含抗pd-1拮抗剂和ido1抑制剂的组合进行治疗的受试者的预后;(iii)开始、暂停或改变包含抗pd-1拮抗剂和ido1抑制剂的组合的施用;或(iv)其组合。
[0038]
在一些方面,基因组套包含tdo2和以下中的至少一种:ifnγ、cxcl10、hla-dra、cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e、ccr5、cxcl11、gzma、prf1、ir2rg、cd3d、cd2、itgal、tagap、ciita、ptprc、cd3e、gzmk、gzmb、pdcd1、slamf6、cxcl13或其组合。
[0039]
在一些方面,基因组套由以下组成或基本上由以下组成:(i)ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1和tdo2;(ii)ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1、ccr5、cxcl11、gzma、prf1和tdo2;(iii)cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、
cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1和hla.e;或或(iv)其任何组合或(i)至(iii)中基因的任何组合。
附图说明
[0040]
图1a和图1b示出了从患者获得、汇集在一起并用于随后的实验/分析的每种肿瘤类型的样品的百分比。这些图描述了使用的生物标记物样品和对每组样品进行的评估。分析基因表达结果与反应、无进展存活和总存活的关系。图1a示出了收集、冷冻和用于液相色谱-质谱实验以检测犬尿氨酸(kyn)的肿瘤和血清样品中每种类型的肿瘤的百分比。治疗开始时(第1周期,第1天;c1d1)和治疗期间(第1周期,第15天;c1d15)收集血清和肿瘤样品。图1b示出了治疗前福尔马林固定和石蜡包埋的每种类型肿瘤的百分比(基线)。这些样品用于rna测序实验以确定ifnγ特征、ido1的表达和tdo2的表达。c1d1=第1周期第1天;c1d15=第1周期第15天;dlbcl=弥漫性大b细胞淋巴瘤;ido1=吲哚胺2,3-双加氧酶-1;ifnγ=干扰素γ;kyn=犬尿氨酸;lc-ms/ms=液相色谱-质谱;nsclc=非小细胞肺癌;os=总存活期;pfs=无进展存活期;rcc=肾细胞癌;seq=测序;scchn=头颈部鳞状细胞癌;tdo2=色氨酸2,3-双加氧酶2。
[0041]
图2a和图2b示出了ifnγ特征与免疫肿瘤学初治患者对用纳武单抗和ido1抑制剂林罗司他治疗的临床反应的关联。示出了合并的肿瘤样品的最佳总反应(图2a)和客观反应(图2b)。cr=完全反应;ifnγ=干扰素γ;ne=不可评价;pd=疾病进展;pr=部分反应;sd=疾病稳定。
[0042]
图3a和图3b是具有低、中或高ifnγ特征的免疫肿瘤学初治患者在用纳武单抗和林罗司他治疗后的存活概率曲线。无进展存活曲线(图3a)和总存活曲线(图3b)示出了对应于其中ifnγ特征得分为低、中或高的合并肿瘤样品的存活概率(%)。评价合并的肿瘤类型,并基于ifnγ作为连续变量描述p值。存活曲线在视觉上表示为三分位数。ifnγ=干扰素γ;os=总存活期;pfs=无进展存活期。
[0043]
图4a和图4b是示出在用纳武单抗和林罗司他治疗期间免疫肿瘤学初治患者中kyn水平和tdo2肿瘤水平的关联的箱线图。图4a示出了来自肿瘤的肿瘤kyn水平,而图4b示出了来自血清的kyn水平。肿瘤kyn的非肿瘤组织水平和血清kyn的健康志愿者水平以灰色条示出。评价合并的肿瘤类型。n表示kyn和tdo2表达的重叠。tdo2高和低由中值tdo2水平定义。c1d1=第1周期第1天;c1d15-第1周期第15天;kyn=犬尿氨酸;tdo2=色氨酸2,3-双加氧酶2。
[0044]
图5a和图5b是示出免疫肿瘤学初治患者中tdo2表达与对纳武单抗单一疗法(图5b)或纳武单抗和林罗司他组合疗法(图5a)的反应的关联的箱线图。tdo2表达由中值确定。所有肿瘤都是来自生物标记物队列的反应者(临床试验号nct02658890)。纳武单抗单一疗法数据来自checkmate试验。ne=不可评价;pd=疾病进展;pr=部分反应;scchn=头颈部鳞状细胞癌;sd=疾病稳定;tdo2=色氨酸2,3-双加氧酶2。
[0045]
图6a和图6b示出了用纳武单抗和林罗司他治疗的免疫肿瘤学初治患者的所有肿瘤类型(图6a)或非黑色素瘤肿瘤(图6b)中,ifnγ表达和tdo2表达与客观反应率之间的关系。线表示每个队列中标记物的中值。cr=完全反应;ifnγ=干扰素γ;ne=不可评价;orr
=客观反应率;pd=疾病进展;pr=部分反应;sd=疾病稳定;tdo2=色氨酸2,3-双加氧酶2。
[0046]
图7a和图7b是用纳武单抗和林罗司他治疗的免疫肿瘤学初治患者的非黑色素瘤肿瘤的客观反应率和ifnγ特征(图7a)或客观反应率、ifnγ特征和tdo2表达(图7b)的灵敏度和特异性的接受者操作特征曲线。分析基于总样品量,且不限于生物标记物队列。auc=曲线下面积;ci=置信区间;ifnγ=干扰素γ;orr=客观反应率;tdo2=色氨酸2,3-双加氧酶2。
具体实施方式
[0047]
本公开文本提供了用于基于复合或组合生物标记物的存在或不存在来治疗癌症、作出治疗决定(例如,决定是否开始、暂停或修改用特定治疗组合物或其组合的治疗)、选择或排除患者进行治疗、或确定患者的预后的方法,所述复合或组合生物标记物包含(i)ifnγ炎症特征得分和(ii)色氨酸2,3-双加氧酶2(tdo2)基因表达得分。
[0048]
如果在施用之前ifnγ炎症特征得分高并且tdo2基因表达得分低,当将包含抗pd-1拮抗剂(例如,抗pd-1抗体如纳武单抗)和ido1抑制剂(例如甲磺酸林罗司他)的组合治疗施用于患有癌症(例如,肿瘤)的受试者时,本文公开的复合生物标记物已被确定为预测阳性结局(疾病稳定、部分反应或完全反应)。
[0049]
因此,本公开文本提供了用于治疗患有癌症(例如肿瘤)的人受试者的方法,其包括向所述受试者施用抗pd-1拮抗剂(例如抗pd-1抗体、抗pd-l1抗体或其抗原结合部分)和ido1抑制剂(例如甲磺酸林罗司他),其中所述受试者在施用前被鉴定为展现出组合生物标记物,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低色氨酸2,3-双加氧酶2(tdo2)基因表达得分;并且其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中包含干扰素γ(ifnγ)相关基因的一组套炎症基因(“ifnγ炎症基因组套”)的表达并随后基于所述表达值计算得分来确定的。
[0050]
还提供了用于治疗患有癌症的人受试者的方法,其包括(i)鉴定展现出组合生物标记物的受试者,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分;和(ii)向所述受试者施用抗pd-1拮抗剂(例如抗pd-1抗体、抗pd-l1抗体或其抗原结合部分)和ido1抑制剂(例如甲磺酸林罗司他);其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中ifnγ炎症基因组套的表达并随后基于所述表达值计算得分来确定的。
[0051]
还提供了用于鉴定患有适合于用抗pd-1拮抗剂(例如抗pd-1抗体、抗pd-l1抗体或其抗原结合部分)和ido1抑制剂(例如甲磺酸林罗司他)治疗的癌症的人受试者的方法,所述方法包括测量从所述受试者获得的样品中ifnγ炎症特征得分和tdo2基因表达;其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中ifnγ炎症基因组套的表达并随后基于所述表达值计算得分来确定的。在一些具体方面,抗pd-1抗体是纳武单抗。i.术语
[0052]
为了可以更容易地理解本公开文本,首先定义某些术语。如本技术所用,除非本文另外明确提供,否则以下术语中的每一个应当具有下文所阐述的含义。另外的定义贯穿本技术进行阐述。
[0053]“施用”是指使用本领域技术人员已知的多种方法和递送系统中的任何一种将包含治疗剂的组合物物理引入至受试者。用于免疫疗法的优选施用途径(例如抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体的施用)包括静脉内、肌肉内、皮下、腹膜内、脊柱或其他肠胃外施用途径,例如通过注射或输注。如本文所用,短语“肠胃外施用”意指除了肠施用和局部施用之外,通常通过注射的施用方式,并且包括但不限于静脉内、肌肉内、动脉内、鞘内、淋巴管内、病灶内、囊内、眼眶内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注以及体内电穿孔。其他非肠胃外途径包括口服、局部、表皮或粘膜施用途径,例如鼻内地、阴道地、直肠地、舌下地或局部地。施用还可以例如进行一次、多次和/或经一个或多个延长的时间段。在一些方面,静脉内施用抗pd-1抗体(例如,纳武单抗)。在一些方面,口服施用ido1抑制剂(例如林罗司他)。
[0054]
如本文所用,“不良事件”(ae)是与医学治疗的使用相关联的任何不利的并且通常是无意的或不希望的体征(包括异常的实验室发现)、症状或疾病。例如,不良事件可能与响应于治疗的免疫系统的激活或免疫系统细胞(例如,t细胞)的扩增相关联。医学治疗可能具有一种或多种相关联的ae,并且每种ae可能具有相同或不同级别的严重程度。对能够“改变不良事件”的方法的提及意指降低与不同治疗方案的使用相关联的一种或多种ae的发生率和/或严重程度的治疗方案。
[0055]“抗体”(ab)应当包括但不限于糖蛋白免疫球蛋白(其与抗原特异性结合并包含通过二硫键相互连接的至少两条重(h)链和两条轻(l)链)或其抗原结合部分。每条h链包含重链可变区(本文缩写为vh)和重链恒定区。重链恒定区包含三个恒定结构域,即c
h1
、c
h2
和c
h3
。每条轻链包含轻链可变区(本文缩写为v
l
)和轻链恒定区。轻链恒定区包含一个恒定结构域:c
l
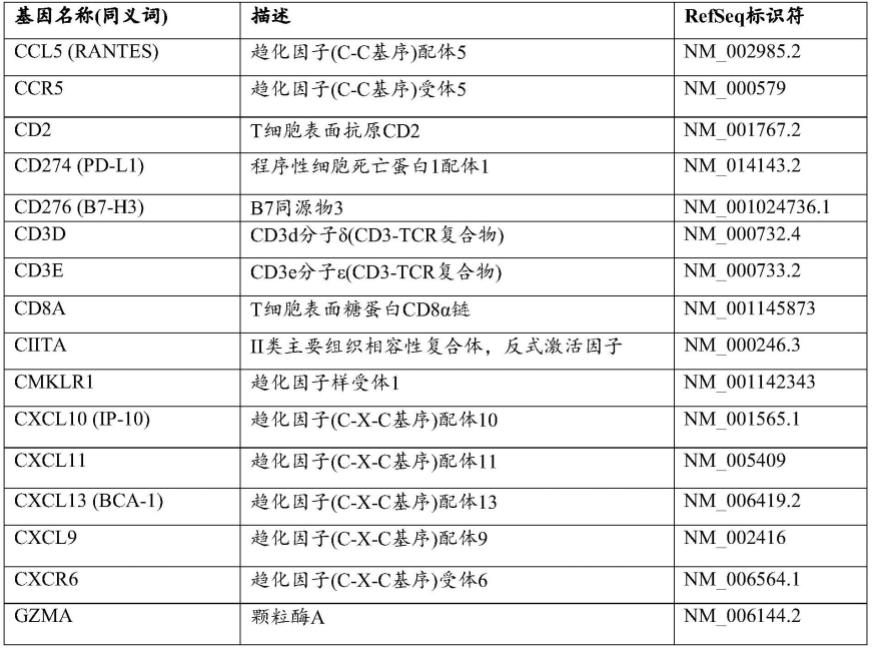
。vh和v
l
区可以进一步细分为高变性区域,称为互补决定区(cdr),其间穿插有更保守的区域,称为框架区(fr)。每个vh和v
l
包含三个cdr和四个fr,按照以下顺序从氨基末端到羧基末端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,所述宿主组织或因子包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(c1q)。因此,术语“抗pd-1抗体”包括与pd-1特异性结合、具有两条重链和两条轻链的全抗体和全抗体的抗原结合部分。抗原结合部分的非限制例子在本文别处示出。在本公开文本的一些方面,抗pd-1抗体是纳武单抗或其抗原结合部分。
[0056]
免疫球蛋白可以源自任何公知的同种型,包括但不限于iga、分泌型iga、igg和igm。igg亚类也是本领域技术人员熟知的,并且包括但不限于人igg1、igg2、igg3和igg4。“同种型”是指由重链恒定区基因编码的抗体类别或亚类(例如,igm或igg1)。举例来说,术语“抗体”包括天然存在的抗体和非天然存在的抗体二者;单克隆抗体和多克隆抗体;嵌合抗体和人源化抗体;人抗体或非人抗体;全合成抗体;和单链抗体。可以通过重组方法将非人抗体人源化以降低其在人体中的免疫原性。在没有明确说明的情况下,除非上下文另有指示,否则术语“抗体”还包括任何上述免疫球蛋白的抗原结合片段或抗原结合部分,并且包括单价和二价片段或部分以及单链抗体。
[0057]“分离的抗体”是指基本上不含具有不同抗原特异性的其他抗体的抗体(例如,与pd-1特异性结合的分离的抗体基本上不含与pd-1以外的抗原特异性结合的抗体)。然而,与pd-1特异性结合的分离的抗体可能与其他抗原(如来自不同物种的pd-1分子)具有交叉反
应性。此外,分离的抗体可以基本上不含其他细胞材料和/或化学物质。
[0058]
术语“单克隆抗体”(mab)是指具有单一分子组成的抗体分子的非天然存在的制剂,即其一级序列基本上相同并且对特定表位展现出单一结合特异性和亲和力的抗体分子。单克隆抗体是分离的抗体的例子。单克隆抗体可以通过杂交瘤、重组、转基因或本领域技术人员已知的其他技术产生。
[0059]“人抗体”(humab)是指具有这样的可变区的抗体,其中框架区和cdr区二者均源自人种系免疫球蛋白序列。此外,如果抗体含有恒定区,则所述恒定区也源自人种系免疫球蛋白序列。本公开文本的人抗体可以包括不是由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)。然而,如本文所用,术语“人抗体”不旨在包括其中源自另一种哺乳动物物种(如小鼠)的种系的cdr序列已经被移植到人框架序列上的抗体。术语“人抗体”和“完全人抗体”同义使用。
[0060]“人源化抗体”是指非人抗体的cdr外的一些、大部分或所有氨基酸被源自人免疫球蛋白的相应氨基酸替代的抗体。在人源化形式的抗体的一个方面,cdr外的一些、大部分或所有氨基酸已经被来自人免疫球蛋白的氨基酸替代,而一个或多个cdr内的一些、大部分或所有氨基酸未改变。氨基酸的少量添加、缺失、插入、取代或修饰是被允许的,只要它们不消除抗体结合特定抗原的能力即可。“人源化抗体”保留与原始抗体相似的抗原特异性。
[0061]“嵌合抗体”是指其中可变区源自一个物种并且恒定区源自另一物种的抗体,如其中可变区源自小鼠抗体并且恒定区源自人抗体的抗体。
[0062]“抗抗原抗体”是指与抗原特异性结合的抗体。例如,抗pd-1抗体与pd-1特异性结合,并且抗pd-l1抗体与pd-l1特异性结合。
[0063]
抗体的“抗原结合部分”(也称为“抗原结合片段”)是指抗体的一个或多个片段,其保留与由完整抗体结合的抗原特异性结合的能力。已经显示抗体的抗原结合功能可以由全长抗体的片段执行。涵盖在术语抗体(例如本文所述的抗pd-1抗体或抗pd-l1抗体)的“抗原结合部分”内的结合片段的例子包括(i)fab片段(来自木瓜蛋白酶切割的片段)或由v
l
、vh、lc和ch1结构域组成的相似的单价片段;(ii)f(ab')2片段(来自胃蛋白酶切割的片段)或包含由铰链区的二硫桥连接的两个fab片段的相似的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的v
l
和vh结构域组成的fv片段;(v)dab片段(ward等人,(1989)nature 341:544-546),其由vh结构域组成;(vi)分离的互补决定区(cdr);以及(vii)可以任选地通过合成接头连接的两个或更多个分离的cdr的组合。此外,尽管fv片段的两个结构域v
l
和vh由分开的基因编码,但是它们可以使用重组方法通过合成的接头进行连接,从而将它们制成单个蛋白质链,在所述单个蛋白质链中v
l
和vh区配对形成单价分子(称为单链fv(scfv));参见例如bird等人(1988)science 242:423-426;以及huston等人(1988)proc.natl.acad.sci.usa 85:5879-5883)。此类单链抗体也旨在涵盖在抗体的“抗原结合部分”术语内。这些抗体片段是使用本领域技术人员已知的常规技术获得的,并且以与完整抗体相同的方式针对效用筛选所述片段。抗原结合部分可以通过重组dna技术或通过完整的免疫球蛋白的酶促或化学切割来产生。
[0064]“癌症”是指一组广泛的不同疾病,其特征在于体内异常细胞的不受控制的生长。不受调节的细胞分裂和生长导致恶性肿瘤的形成,恶性肿瘤侵入邻近组织并且还可以通过淋巴系统或血流转移到身体的远端部分。术语“肿瘤”是指实体癌。术语“癌”是指上皮来源
的癌症。
[0065]
如本文所用的术语“ido1”是指吲哚胺2,3-双加氧酶1。吲哚胺-吡咯2,3-双加氧酶(ido或indo ec 1.13.11.52)是在人类中由ido1基因编码的含血红素的酶。它是催化犬尿氨酸途径中的第一和限速步骤的三种酶之一,所述步骤即l-色氨酸o2依赖性氧化为n-甲酰基犬尿氨酸,其他两种酶为ido2和色氨酸2,3-双加氧酶(tdo)。ido通过其限制t细胞功能和参与免疫耐受机制的能力而涉及免疫调节。ido在肿瘤发展期间被激活,帮助恶性细胞逃脱免疫系统的根除。干扰素γ对许多肿瘤细胞具有抗增殖作用,至少部分是因为吲哚胺2,3-双加氧酶的诱导。
[0066]
如本文所用的术语“ido1抑制剂”是指吲哚胺2,3-双加氧酶1抑制剂。ido1抑制剂抑制吲哚胺2,3-双加氧酶,导致犬尿氨酸水平降低以及促炎细胞因子活性降低。1-甲基色氨酸是一种弱程度抑制吲哚胺双加氧酶的外消旋化合物,但也是非常缓慢的底物。特定外消旋体1-甲基-d-色氨酸(称为吲哚莫德)在临床试验中用于各种癌症。艾卡哚司他(epacadostat)(incb24360)和那沃莫德(navoximod)(gdc-0919)是吲哚胺2,3-双加氧酶的有效抑制剂并且在临床试验中用于各种癌症。在一些方面,ido1抑制剂是林罗司他(bms-986205)。在一些方面,ido1抑制剂是林罗司他盐,例如甲磺酸林罗司他。参见wo 2015031295、wo 2016073770和wo 201809049,其全部通过引用以其整体并入本文。
[0067]
术语“免疫疗法”是指通过包括诱导、增强、抑制或以其他方式修饰免疫应答的方法治疗患有疾病或者有感染疾病或遭受疾病复发风险的受试者。受试者的“治疗”或“疗法”是指对受试者进行的任何类型的干预或处理,或者向受试者施用活性剂,目的是逆转、减轻、改善、抑制、减缓或预防症状、并发症或病症的发作、进展、发展、严重程度或复发或者与疾病相关联的生化指标。
[0068]“程序性死亡蛋白-1”(pd-1)是指属于cd28家族的免疫抑制性受体。pd-1主要在体内先前激活的t细胞上表达,并与两种配体即pd-l1和pd-l2结合。如本文所用,术语“pd-1”包括人pd-1(hpd-1),hpd-1的变体、亚型和物种同源物,以及与hpd-1具有至少一个共同表位的类似物。完整的hpd-1序列可以在genbank登录号u64863下找到。
[0069]“程序性死亡蛋白配体-1”(pd-l1)是pd-1的两种细胞表面糖蛋白配体之一(另一种是pd-l2),其在与pd-1结合后下调t细胞激活和细胞因子分泌。如本文所用,术语“pd-l1”包括人pd-l1(hpd-l1),hpd-l1的变体、亚型和物种同源物,以及与hpd-l1具有至少一个共同表位的类似物。完整的hpd-l1序列可以在genbank登录号q9nzq7下找到。人pd-l1蛋白由人cd274基因(ncbi基因id:29126)编码。
[0070]
如本文所用,术语“受试者”包括任何人或非人动物。术语“非人动物”包括但不限于脊椎动物,如非人灵长类动物、绵羊、狗和啮齿动物(如小鼠、大鼠和豚鼠)。在具体方面,受试者是人。术语“受试者”和“患者”在本文可互换使用。
[0071]
关于本公开文本的方法和剂量的术语“平剂量”的使用意指在不考虑患者的体重或体表面积(bsa)的情况下向患者施用的剂量。因此,所述平剂量不以mg/kg剂量提供,而是以药剂(例如,抗pd-1抗体)的绝对量提供。例如,60kg的人和100kg的人将接受相同剂量的抗体(例如,240mg的抗pd-1抗体)。
[0072]
关于本公开文本的方法的术语“固定剂量”的使用意指治疗剂,例如抗pd-1拮抗剂(例如纳武单抗)或ido1抑制剂(例如林罗司他)以特定(固定)量存在于组合物,药物组合物
中。在一些方面,固定剂量基于治疗剂的重量(例如,mg)。在某些方面,固定剂量基于治疗剂的浓度(例如,mg/ml)。如本文所提及的术语“基于体重的剂量”意指基于患者的体重计算的向患者施用的剂量。例如,当体重为60kg的患者需要3mg/kg的抗pd-1抗体时,人们可以计算并使用适当量的抗pd-1抗体(即,180mg)进行施用。
[0073]“免疫应答”是如本领域所理解的,并且通常是指脊椎动物内针对外来因子(agent)或异常例如癌细胞的生物学应答,所述应答保护生物免受这些因子和由其引起的疾病的侵害。免疫应答是由免疫系统的一种或多种细胞(例如,t淋巴细胞、b淋巴细胞、自然杀伤(nk)细胞、巨噬细胞、嗜酸性粒细胞、肥大细胞、树突细胞或嗜中性粒细胞)和通过这些细胞或肝脏中的任何一种产生的可溶性大分子(包括抗体、细胞因子和补体)的作用介导的,所述作用导致选择性靶向、结合、损伤、破坏和/或消除脊椎动物体中侵入的病原体、感染病原体的细胞或组织、癌性或其他异常细胞,或者在自身免疫性或病理性炎症的情况下导致选择性靶向、结合、损伤、破坏和/或消除正常的人细胞或组织。免疫反应包括例如t细胞(例如效应t细胞、th细胞、cd4
细胞、cd8
t细胞或treg细胞)的激活或抑制,或免疫系统的任何其他细胞(例如nk细胞)的激活或抑制。
[0074]“免疫相关的反应模式”是指在用免疫治疗剂治疗的癌症患者中通常观察到的临床反应模式,所述免疫治疗剂通过诱导癌症特异性免疫应答或通过修饰天然免疫过程而产生抗癌作用。此反应模式的特征在于在癌症负荷初始增加或新病变出现(其在传统化学治疗剂的评价中将被分类为疾病进展并且将与药物失效同义)之后的有益治疗效果。因此,对免疫治疗剂的适当评价可能需要长期监测这些药剂对目标疾病的影响。
[0075]
如本文所用,术语“治疗”(“treat”、“treating”和“treatment”)是指对受试者进行的任何类型的干预或过程,目的是逆转、减轻、缓解、抑制或减缓或防止症状、并发症、病症或与疾病有关的生化指标的进展、发展、严重程度或复发,或提高总存活期。治疗可以是对患有疾病的受试者或没有疾病的受试者(例如,用于预防)。
[0076]
将术语“有效剂量”(“effective dose”或“effective dosage”)定义为足以达到或至少部分达到所需效果的量。
[0077]
药物或治疗剂的“治疗有效量”或“治疗有效剂量”是药物的当单独地或与另一种治疗剂组合地使用时保护受试者免受疾病的发作或促进通过疾病症状的严重程度的降低、无疾病症状期的频率和持续时间的增加或由于疾病困扰引起的损伤或残疾的预防所证实的疾病消退的任何量。药物的治疗有效量或剂量包括“预防有效量”或“预防有效剂量”,其是当单独地或与另一种治疗剂组合施用于有患上疾病或发生疾病复发风险的受试者时,抑制疾病的发展或复发的任何量。
[0078]
可以使用熟练的从业人员已知的多种方法评价治疗剂促进疾病消退(例如癌症消退)的能力,如在临床试验期间的人受试者中,在预测人体中功效的动物模型系统中,或者通过测定药剂在体外测定中的活性进行评价。
[0079]
举例来说,“抗癌剂”或其组合促进受试者的癌症消退。在一些方面,治疗有效量的治疗剂促进癌症消退至消除癌症的程度。在本公开文本的一些方面,将抗癌剂作为疗法的组合施用:包括施用抗pd-1抗体(例如,纳武单抗)的静脉内疗法,和包括施用ido1抑制剂(例如,甲磺酸林罗司他)的口服疗法。“促进癌症消退”意指施用有效量的药物或其组合(作为单一治疗组合物或作为如上所讨论的单独治疗中的单独组合物一起施用)导致癌症负荷
减少,例如肿瘤生长或大小的减小、肿瘤的坏死、至少一种疾病症状的严重程度的降低、无疾病症状期的频率和持续时间的增加或由于疾病困扰引起的损伤或残疾的预防。
[0080]
另外,关于本文公开的治疗的术语“有效的”和“有效性”包括药理学有效性和生理学安全性。药理学有效性是指药物促进患者中癌症消退的能力。生理学安全性是指由药物的施用引起的在细胞、器官和/或生物水平的毒性水平或其他不利生理效应(不利效应)。
[0081]
举例来说,对于肿瘤的治疗,相对于未治疗的受试者,治疗有效量的抗癌剂优选将癌细胞生长或肿瘤生长抑制至少约20%、更优选至少约40%、甚至更优选至少约60%、并且再更优选至少约80%。类似地,在血液癌症中,相对于未治疗的受试者,治疗有效量的抗癌剂优选地将细胞生长抑制或将循环癌细胞的数目减少至少约20%、更优选至少约40%、甚至更优选至少约60%、并且再更优选至少约80%。
[0082]
在一些方面,相对于未治疗的受试者,治疗有效量或剂量的药物将癌细胞生长或肿瘤生长抑制至少约20%与约40%之间、至少约30%与约50%之间、至少约40%与约60%之间、至少约50%与约70%之间、至少约60%与约80%之间、至少约70%与约90%之间、至少约30%与约60%之间、至少约40%与约70%之间、至少约50%与约80%之间、至少约60%与约90%之间。在一些方面,治疗有效量或剂量的药物完全抑制细胞生长或肿瘤生长,即,100%抑制细胞生长或肿瘤生长。
[0083]
在本公开文本的一些方面,可观察到癌症消退(例如肿瘤消退)并持续以下的时间段:至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约13个月、至少约14个月、至少约15个月、至少约16个月、至少约17个月、至少约18个月、至少约19个月、至少约20个月、至少约21个月、至少约22个月、至少约23个月、至少约24个月、至少约3年、至少约4年、或至少约5年。尽管有这些治疗有效性的最终测量,免疫治疗药物的评价还必须考虑免疫相关的反应模式。治疗剂抑制癌症生长(例如肿瘤生长)的能力可使用本文所述的测定和本领域已知的其他测定来评价。可替代地,可以通过检查化合物抑制细胞生长的能力来评价组合物的这种特性,可以通过熟练从业者已知的测定在体外测量这种抑制。
[0084]
在其他方面,例如治疗血液癌症,相对于未治疗的受试者,治疗有效量或剂量的药物将癌细胞生长抑制或将癌症负荷减少至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%。在一些方面,治疗有效量或剂量的药物完全抑制细胞生长或消除癌症负荷,即100%抑制细胞生长或可检测癌细胞的总群体。化合物减少癌症负荷的能力可使用本文所述的测定和本领域已知的其他测定来评价。
[0085]
在一些方面,可观察到癌症(例如肿瘤)稳定或消退(部分反应或完全反应)并持续以下的时间段:至少约20天、至少约30天、至少约40天、至少约50天、至少约60天、至少约70天、至少约80天、至少约90天、至少约100天、至少约120天、至少约140天、至少约160天、至少约180天、至少约200天、至少约225天、至少约250天、至少约275天、至少约300天、至少约350天、至少约400天、至少约450天、至少约500天、至少约550天或至少约600天。
[0086]
如本文所用,术语“生物样品”是指从受试者分离的生物材料。所述生物样品可以
含有适合于例如通过对癌症(例如肿瘤细胞或循环癌细胞)中的核酸测序并且鉴定所测序的核酸中的基因组改变来确定靶基因表达的任何生物材料。在一些方面,基因组改变是突变。在其他方面,基因组改变是癌细胞中某种基因相对于参照的表达水平变化。
[0087]
生物样品可以是任何合适的生物组织或流体,例如癌组织、血液、血浆和血清。在一个方面,样品是肿瘤组织活检物,例如福尔马林固定的石蜡包埋的(ffpe)肿瘤组织或新鲜冷冻的肿瘤组织等。在另一方面,所述生物样品是液体活检物,在一些方面,其包括血液、血清、血浆、循环肿瘤细胞、exorna、ctdna和cfdna中的一种或多种。
[0088]
如本文所用,术语“约每周一次”、“约每两周一次”或任何其他类似的给药间隔术语意指近似数。“约每周一次”可以包括每七天
±
一天,即每六天至每八天。“约每两周一次”可以包括每十四天
±
三天,即每十一天至每十七天。例如,类似的近似适用于约每三周一次、约每四周一次、约每五周一次、约每六周一次和约每十二周一次。
[0089]
在一些方面,约每六周一次或约每十二周一次的给药间隔分别意指可以在第一周的任何日期施用第一剂量,然后可以在第六周或第十二周的任何日期施用下一剂量。在其他方面,约每六周一次或约每十二周一次的给药间隔分别意指在第一周的特定日期(例如,星期一)施用第一剂量,然后在第六周或第十二周的相同日期(即星期一)施用下一剂量。
[0090]
除非上下文另外清楚地说明,否则单数形式“一个/一种(a/an)”以及“所述(the)”包括复数指示物。术语“一个/一种(a或an)”以及术语“一个/一种或多个/多种(one or more)”和“至少一个/至少一种(at least one)”可以在本文中互换使用。在某些方面,术语“一个”或“一种”意指“单个”。在其他方面,术语“一个/一种(a或an)”包括“两个/两种或更多个/更多种(two or more)”或“多个/多种(multiple)”。
[0091]
此外,本文使用的“和/或”被视为两个指定特征或组分中的每一个与或不与其他特征或组分的特定公开。因此,如在本文中以短语如“a和/或b”使用的术语“和/或”旨在包括“a和b”、“a或b”、“a”(单独)和“b”(单独)。同样地,如以短语如“a、b和/或c”使用的术语“和/或”旨在涵盖以下方面中的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);以及c(单独)。
[0092]
术语“约”或“基本上由
……
构成”是指在如通过本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,其将部分取决于如何测量或确定所述值或组成,即测量系统的限制。例如,根据本领域的实践,“约”或“基本上由
……
构成”可以意指在1个或多于1个标准差内。可替代地,“约”或“基本上由
……
构成”可以意指多达10%的范围。此外,特别是关于生物系统或过程,所述术语可以意指高达值的一个数量级或高达值的5倍。当在本技术和权利要求中提供特定值或组成时,除非另有说明,否则应假定“约”或“基本上由
……
构成”的含义在该特定值或组成的可接受误差范围内。
[0093]
如本文所用,如应用于一个或多个目的值的术语“大约”是指类似于所述参考值的值。在某些方面,除非另外陈述或者上下文另有明确含义,否则术语“大约”是指落在所述参考值的任一方向(大于或小于)上的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小内的值的范围(这个数字超过可能值的100%的情况除外)。
[0094]
如本文所述,除非另有说明,否则任何浓度范围、百分比范围、比率范围或整数范围应理解为包括所列举范围内的任何整数及(在适当时)其分数(诸如整数的十分之一和百分之一)的值。
[0095]
除非另外定义,否则本文所使用的所有技术和科学术语均具有与本公开文本所属技术的本领域技术人员通常所理解的相同的含义。例如,concise dictionary of biomedicine and molecular biology,juo,pei-show,第2版,2002,crc出版社;the dictionary of cell and molecular biology,第3版,1999,学术出版社;以及oxford dictionary of biochemistry and molecular biology,修订版,2000,牛津大学出版社,为本领域技术人员提供本公开文本中所使用的许多术语的一般解释。
[0096]
应当理解,本文中无论用语言“包括/包含(comprising)”描述任何方面,还提供了以“由
……
组成”和/或“本质上由
……
组成”描述的其他类似方面。
[0097]
单位、前缀和符号均以其国际单位制(si)可接受的形式表示。本文提供的标题不是对本公开文本的各个方面的限制,所述各个方面可以通过参考说明书作为整体而获得。因此,通过从整体上参考说明书,更全面地定义所定义的术语。
[0098]
本文使用的缩写在本公开文本通篇中定义。在以下小节中更详细地描述本公开文本的各个方面。ii.使用的方法和组合物
[0099]
本公开文本涉及用于治疗患有癌症(例如肿瘤)的人受试者的方法,其包括向所述受试者施用抗pd-1拮抗剂(例如抗pd-1抗体(如纳武单抗)、抗pd-l1抗体或其抗原结合部分)和吲哚胺2,3-双加氧酶1(ido1)抑制剂(例如甲磺酸林罗司他),其中所述受试者在施用前被鉴定为展现出组合生物标记物,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低色氨酸2,3-双加氧酶2(tdo2)基因表达得分;并且其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中包含干扰素γ(ifnγ)相关基因的一组套炎症基因(“ifnγ炎症基因组套”)的表达来确定的。从对ifnγ炎症基因组套中的每种基因测量的表达水平计算ifnγ炎症特征得分。
[0100]
如本文所用,术语“ifnγ相关基因”是指与ifnγ介导的细胞信号传导相关的基因。在本公开文本的一个方面,ifnγ相关基因涵盖例如ifnγ、cxcl10、hla-dra、cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e、ccr5、cxcl11、gzma、prf1、ir2rg、cd3d、cd2、itgal、tagap、ciita、ptprc、cd3e、gzmk、gzmb、pdcd1、slamf6和cxcl13。因此,“ifnγ炎症基因组套”可包含这些基因的任何子集。在一个方面,ifnγ炎症基因组套包含以下、由以下组成或基本上由以下组成:ifnγ、cxcl10、hla-dra、cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e、ccr5、cxcl11、gzma、prf1、ir2rg、cd3d、cd2、itgal、tagap、ciita、ptprc、cd3e、gzmk、gzmb、pdcd1、slamf6和cxcl13。在一个方面,ifnγ炎症基因组套包含以下、由以下组成或基本上由以下组成:ir2rg、cxcr6、cd3d、cd2、itgal、tagap、ciita、hla-dra、ptprc、cxcl9、ccl5、nkg7、gzma、prf1、ccr5、cd3e、gzmk、ifnγ、hla-e、gzmb、pdcd1、slamf6、cxcl13、cxcl10、ido1、lag3、stat1和cxcl11。在另一方面,ifnγ炎症基因组套包含以下、由以下组成或基本上由以下组成:cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1和hla.e。在另一方面,ifnγ炎症基因组套包含以下、由以下组成或基本上由以下组成:ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1、ccr5、cxcl11、gzma和prf1。在另一方面,ifnγ炎
症基因组套包含以下、由以下组成或基本上由以下组成:ifnγ、cxcl10、cxcl9、hla-dra、ido1和stat1。参见表1,其提供了本文公开的ifnγ相关基因和tdo2的基因名称、描述和refseq序列标识符。
[0101]
参考序列(refseq)数据库是公开可用的核苷酸序列(dna、rna)及其蛋白质产物的开放访问、注释和整理的集合。该数据库由美国国家生物技术信息中心(ncbi)建立,并且与genbank不同,其仅提供范围从病毒到细菌再到真核生物的主要生物体的每种天然生物分子(即dna、rna或蛋白质)的单一记录。可以在www.ncbi.nlm.nih.gov/refseq访问refseq数据库。表1
[0102]
本公开文本还提供了用于治疗患有癌症(例如肿瘤)的人受试者的方法,其包括(i)鉴定展现出组合生物标记物的受试者,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分;和(ii)向所述受试者施用抗pd-1拮抗剂(例如抗pd-1抗体(如纳武单抗)、抗pd-l1抗体或其抗原结合部分)和ido1抑制剂(例如甲磺酸林罗司他);其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中ifnγ炎症基因组套的表达并随后由所测量的表达水平计算得分来确定的。
[0103]
还提供了用于鉴定患有适合于用抗pd-1拮抗剂(例如抗pd-1抗体(如纳武单抗)、抗pd-l1抗体或其抗原结合部分)和ido1抑制剂(例如甲磺酸林罗司他)治疗的癌症(例如肿瘤)的人受试者的方法,所述方法包括测量从所述受试者获得的样品中的ifnγ炎症特征得分和tdo2基因表达;其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中ifnγ炎症基因组套的表达并随后由所测量的表达水平计算得分来确定的。
[0104]
在一些方面,受试者展现出组合生物标记物,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分。在一些方面,所述方法还包括向受试者施用抗pd-1拮抗剂(例如抗pd-1抗体(如纳武单抗)、抗pd-l1抗体或其抗原结合部分)和ido1抑制剂(例如甲磺酸林罗司他)。
[0105]
本公开文本还提供了一种用于在有需要的人受试者中与抗pd-1拮抗剂(例如抗pd-1抗体(如纳武单抗)、抗pd-l1抗体或其抗原结合部分)组合治疗癌症的ido1抑制剂(例如甲磺酸林罗司他),其中所述受试者在施用前被鉴定为展现出组合生物标记物,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分;并且其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中包含干扰素γ(ifnγ)的一组套炎症基因的表达并随后由所测量的表达水平计算得分来确定的。
[0106]
还提供了用于鉴定患有适合于用ido1抑制剂(例如林罗司他甲磺酸盐)和抗pd-1拮抗剂(例如抗pd-1抗体(如纳武单抗)、抗pd-l1抗体或其抗原结合部分)组合治疗的癌症的人受试者的ido1抑制剂(例如甲磺酸林罗司他),其中测量从所述受试者获得的样品中ifnγ炎症特征得分和tdo2基因表达;并且其中所述ifnγ炎症特征得分是通过测量从所述受试者获得的样品中ifnγ炎症基因组套的表达并随后由所测量的表达水平计算得分来确定的。在一些方面,受试者展现出组合生物标记物,所述组合生物标记物包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分。
[0107]
如本文所用的术语“生物标记物”是指作为生物过程、生物事件和/或病理病症的区别性指示物的因子,例如对用例如ido1抑制剂(例如林罗司他)与抗pd-1拮抗剂(例如抗pd-1抗体(如纳武单抗)、抗pd-l1抗体或其抗原结合部分)组合的癌症治疗的临床反应的预测物。如本文所用,术语生物标记物涵盖分子生物标记物和从此类分子生物标记物的测量得到的测量值和/或得分。因此,在本公开文本的上下文中,术语“生物标记物”涵盖例如生物学生物标记物(例如,一个或多个特定基因或表达产物(如mrna或蛋白质))和数值或其他定量或定性描述符(例如整合一个或多个测量值的“得分”)。
[0108]
在特定方面,术语生物标记物是指可确定并与例如癌症治疗的结局相关联的基因产物(例如,核酸或蛋白质)或其组合。
[0109]
在一些方面,生物标记物是“组合生物标记物”或“复合生物标记物”,即,包含若干离散生物标记物的生物标记物。在本公开文本的一个方面,生物标记物是包含两个得分的“组合生物标记物”,即,与多基因干扰素γ炎症特征相关的得分和对应于tdo2基因的表达水平的第二得分。相对于参考水平,本公开文本的组合生物标记物的组分可以升高(即,它们可以“更高”)或它们可以降低(即,它们可以“更低”)。如本文所用的术语“参考水平”是指本文公开的一种或多种生物标记物的水平,或从本文公开的一种或多种生物标记物的测量得到的得分,其中所述水平高于或低于对应于参考组(例如初治个体,与特定组如预后组(例如癌症复发或癌症对特定治疗剂无反应)相关的个体,或其组合)的参考水平或参考得分。
[0110]
在一些方面,ifnγ炎症特征得分是通过测量从受试者获得的癌症样品(例如,肿瘤样品)中一组套ifnγ相关炎症基因(“ifnγ炎症基因组套”)的表达来确定的,其中所述ifnγ炎症基因组套包含1种炎症基因、2种炎症基因、3种炎症基因、4种炎症基因、5种炎症基因、6种炎症基因、7种炎症基因、8种炎症基因、9种炎症基因、10种炎症基因、11种炎症基因、12种炎症基因、13种炎症基因、14种炎症基因、15种炎症基因、16种炎症基因、17种炎症基因、18种炎症基因、19种炎症基因或20种炎症基因,其中所述炎症基因是选自ifnγ、cxcl10、hla-dra、cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e、ccr5、cxcl11、
gzma、prf1、ir2rg、cd3d、cd2、itgal、tagap、ciita、ptprc、cd3e、gzmk、gzmb、pdcd1、slamf6和cxcl13的ifnγ相关炎症基因。
[0111]
在一些方面,ifnγ炎症特征得分是通过测量从受试者获得的癌症样品(例如,肿瘤样品)中炎症基因ifnγ组套(“ifnγ炎症基因组套”)的表达来确定的,其中所述ifnγ炎症基因组套由以下组成或基本上由以下组成:1种炎症基因、2种炎症基因、3种炎症基因、4种炎症基因、5种炎症基因、6种炎症基因、7种炎症基因、8种炎症基因、9种炎症基因、10种炎症基因、11种炎症基因、12种炎症基因、13种炎症基因、14种炎症基因、15种炎症基因、16种炎症基因、17种炎症基因、18种炎症基因、19种炎症基因或20种炎症基因,其中所述炎症基因是选自ifnγ、cxcl10、hla-dra、cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e、ccr5、cxcl11、gzma、prf1、ir2rg、cd3d、cd2、itgal、tagap、ciita、ptprc、cd3e、gzmk、gzmb、pdcd1、slamf6和cxcl13的ifnγ相关炎症基因。
[0112]
在一些方面,ifnγ炎症基因组套由以下组成:少于约25种、少于约24种、少于约23种、少于约22种、少于约21种、少于约20种、少于约19种、少于约18种、少于约17种、少于约16种、少于约15种、少于约14种、少于约13种、少于约12种、少于约11种、少于约10种、少于约9种、少于约8种、少于约7种、少于约6种或少于约5种ifnγ相关炎症基因。
[0113]
在一些方面,ifnγ炎症基因组套由少于25种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于24种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于23种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于22种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于21种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于20种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于19种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于18种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于17种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于16种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于15种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于14种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于13种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于12种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于11种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于10种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于9种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于8种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于7种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于6种ifnγ相关炎症基因组成。在一些方面,ifnγ炎症基因组套由少于5种ifnγ相关炎症基因组成。在某些方面,ifnγ炎症基因组套由4种ifnγ相关炎症基因组成。在某些方面,ifnγ炎症基因组套由3种ifnγ相关炎症基因组成。
[0114]
在一些方面,ifnγ炎症基因组套包含选自ifnγ、cxcl10、hla-dra、cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e、ccr5、cxcl11、gzma、prf1、ir2rg、cd3d、cd2、itgal、tagap、ciita、ptprc、cd3e、gzmk、gzmb、pdcd1、slamf6和cxcl13的至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、或20种基因。
[0115]
因此,在一些方面,ifnγ炎症基因组套可包含与细胞溶解活性(例如颗粒酶a/b/k和/或prf1)、用于引发炎症的细胞因子/趋化因子(例如cxcr6、cxcl9、ccl5和/或ccr5)、t细胞标记物(例如cd3d、cd3e、cd2和/或il2rg[编码il-2rγ])、nk细胞活性(例如nkg7和/或hla-e)、抗原呈递(例如ciita和/或hla-dra)和/或其他免疫调节因子(例如lag3、ido1和/或slamf6)相关的基因。参见,例如,ayers等人(2017)j.clin.invest.127:2930-40;和美国申请公开号us2016-0304969,将其通过引用以其整体并入本文。
[0116]
在一些方面,ifnγ炎症基因组套由以下组成或基本上由以下组成:(i)ifnγ、cxcl10、cxcl9、hla-dra、ido1和stat1;(ii)ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1、ccr5、cxcl11、gzma和prf1;(iii)ifnγ、cxcr6、cd3d、cd2、itgal、tagap、ciita、hla-dra、ptprc、cxcl9、ccl5、nkg7、gzma、prf1、ccr5、cd3e、hla-e、gzmk、gzmb、pdcd、slamf6、cxcl13、cxcl10、ido1、lag3、stat1和cxcl11;(iv)ir2rg、cxcr6、cd3d、cd2、itgal、tagap、ciita、hla-dra、ptprc、cxcl9、ccl5、nkg7、gzma、prf1、ccr5、cd3e、gzmk、ifng、hla-e、gzmb、pdcd1、slamf6、cxcl13、cxcl10、ido1、lag3、stat1和cxcl11;或(v)其任何组合或(i)-(iv)中基因的任何组合。
[0117]
在一个方面,ifnγ炎症基因组套由以下组成:ifnγ、cxcl10、cxcl9、hla-dra、ido1和stat1。
[0118]
在一个方面,ifnγ炎症基因组套由以下组成:ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1、ccr5、cxcl11、gzma和prf1。
[0119]
在一个方面,ifnγ炎症基因组套由以下组成:cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1和hla.e。
[0120]
在一个方面,ifnγ炎症基因组套由以下组成:ir2rg、cxcr6、cd3d、cd2、itgal、tagap、ciita、hla-dra、ptprc、cxcl9、ccl5、nkg7、gzma、prf1、ccr5、cd3e、gzmk、ifng、hla-e、gzmb、pdcd1、slamf6、cxcl13、cxcl10、ido1、lag3、stat1和cxcl11。
[0121]
在一些方面,ifnγ炎症基因组套由以下组成:ifnγ、cxcl10、cxcl9、hla-dra、ido1和stat1、以及1种另外的ifnγ相关炎症基因、2种另外的ifnγ相关炎症基因、3种另外的ifnγ相关炎症基因、4种另外的ifnγ相关炎症基因、5种另外的ifnγ相关炎症基因、6种另外的ifnγ相关炎症基因、7种另外的ifnγ相关炎症基因、8种另外的ifnγ相关炎症基因、9种另外的ifnγ相关炎症基因、10种另外的ifnγ相关炎症基因、11种另外的ifnγ相关炎症基因、12种另外的ifnγ相关炎症基因、13种另外的ifnγ相关炎症基因、14种另外的ifnγ相关炎症基因、15种另外的ifnγ相关炎症基因、16种另外的ifnγ相关炎症基因、17种另外的ifnγ相关炎症基因、18种另外的ifnγ相关炎症基因、19种另外的ifnγ相关炎症基因、或20种另外的ifnγ相关炎症基因。
[0122]
在其他方面,ifnγ炎症基因组套由以下组成:ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1、ccr5、cxcl11、gzma和prf1、以及1种另外的ifnγ相关炎症基因、2种另外的ifnγ相关炎症基因、3种另外的ifnγ相关炎症基因、4种另外的ifnγ相关炎症基因、5种另外的ifnγ相关炎症基因、6种另外的ifnγ相关炎症基因、7种另外的ifnγ相关炎症基因、8种
另外的ifnγ相关炎症基因、9种另外的ifnγ相关炎症基因、10种另外的ifnγ相关炎症基因、11种另外的ifnγ相关炎症基因、12种另外的ifnγ相关炎症基因、13种另外的ifnγ相关炎症基因、14种另外的ifnγ相关炎症基因、15种另外的ifnγ相关炎症基因、16种另外的ifnγ相关炎症基因、17种另外的ifnγ相关炎症基因、18种另外的ifnγ相关炎症基因、19种另外的ifnγ相关炎症基因、或20种另外的ifnγ相关炎症基因。
[0123]
在其他方面,ifnγ炎症基因组套由以下组成:cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1和hla.e、以及1种另外的ifnγ相关炎症基因、2种另外的ifnγ相关炎症基因、3种另外的ifnγ相关炎症基因、4种另外的ifnγ相关炎症基因、5种另外的ifnγ相关炎症基因、6种另外的ifnγ相关炎症基因、7种另外的ifnγ相关炎症基因、8种另外的ifnγ相关炎症基因、9种另外的ifnγ相关炎症基因、10种另外的ifnγ相关炎症基因、11种另外的ifnγ相关炎症基因、12种另外的ifnγ相关炎症基因、13种另外的ifnγ相关炎症基因、14种另外的ifnγ相关炎症基因、15种另外的ifnγ相关炎症基因、16种另外的ifnγ相关炎症基因、17种另外的ifnγ相关炎症基因、18种另外的ifnγ相关炎症基因、19种另外的ifnγ相关炎症基因、或20种另外的ifnγ相关炎症基因。
[0124]
在其他方面,ifnγ炎症基因组套由以下组成:ifnγ、ir2rg、cxcr6、cd3d、cd2、itgal、tagap、ciita、hla-dra、ptprc、cxcl9、ccl5、nkg7、gzma、prf1、ccr5、cd3e、gzmk、hla-e、gzmb、pdcd1、slamf6、cxcl13、cxcl10、ido1、lag3、stat1、cxcl11、以及1种另外的ifnγ相关炎症基因、2种另外的ifnγ相关炎症基因、3种另外的ifnγ相关炎症基因、4种另外的ifnγ相关炎症基因、5种另外的ifnγ相关炎症基因、6种另外的ifnγ相关炎症基因、7种另外的ifnγ相关炎症基因、8种另外的ifnγ相关炎症基因、9种另外的ifnγ相关炎症基因、10种另外的ifnγ相关炎症基因、11种另外的ifnγ相关炎症基因、12种另外的ifnγ相关炎症基因、13种另外的ifnγ相关炎症基因、14种另外的ifnγ相关炎症基因、15种另外的ifnγ相关炎症基因、16种另外的ifnγ相关炎症基因、17种另外的ifnγ相关炎症基因、18种另外的ifnγ相关炎症基因、19种另外的ifnγ相关炎症基因、或20种另外的ifnγ相关炎症基因。
[0125]
本文公开的ifnγ、cxcl10、hla-dra、cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e、ccr5、cxcl11、gzma、prf1、ir2rg、cd3d、cd2、itgal、tagap、ciita、ptprc、cd3e、gzmk、gzmb、pdcd1、slamf6和cxcl13分子生物标记物还包括(i)与它们的相应野生型序列具有至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%或至少约99%序列同一性的蛋白质或其片段;以及(ii)与编码相应分子生物标记物的各自野生型核酸序列具有至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约
85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%或至少约99%序列同一性的核酸(例如mrna)。
[0126]
本文公开的分子生物标记物还包括其同种型和/或变体。如本文所用,与相应野生型多肽的氨基酸序列相比,“变体”生物标记物含有至少一个氨基酸序列改变。氨基酸序列改变可以是例如一个或多个氨基酸的取代、缺失或插入,优选保守取代。变体生物标记物可以具有氨基酸取代、缺失或插入的任何组合。在一个方面,生物标记物变体多肽可具有整数个氨基酸改变,使得其氨基酸序列与相应野生型多肽的氨基酸序列共享至少约60%、至少约70%、至少约80%、至少约85%、至少约90%、至少约95%、至少约97%、至少约98%、至少约99%、至少约99.5%或100%同一性。
[0127]
在其他方面,与相应dna或rna(例如,mrna)的核酸序列相比,变体生物标记物含有至少一个核酸序列改变。核酸序列改变可以是例如一个或多个核苷酸的取代、缺失或插入,优选保守取代。变体生物标记物可以具有核酸取代、缺失或插入的任何组合。在一个方面,生物标记物变体基因或基因产物(例如,mrna)可具有整数个核苷酸改变,使得其核苷酸序列与相应野生型基因或基因产物(例如,mrna)的核酸序列共享至少约60%、至少约70%、至少约80%、至少约85%、至少约90%、至少约95%、至少约97%、至少约98%、至少约99%、至少约99.5%或100%同一性。
[0128]
在一些方面,本文公开的方法可以包括确定、提交取自受试者的样品用于确定、或指导临床实验室确定本文公开的分子生物标记物的表达水平或活性,或其组合。
[0129]
本公开文本涉及用于治疗患有癌症的人受试者的方法,所述方法包括向受试者施用组合疗法,所述组合疗法包括(i)使用通常静脉内施用的抗pd-1拮抗剂(例如抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体或其抗原结合部分)的疗法,和(ii)使用通常口服施用的ido1抑制剂(例如甲磺酸林罗司他)的疗法。
[0130]
在某些方面,抗pd-1抗体或其抗原结合部分与纳武单抗交叉竞争与人pd-1的结合。在一些方面,抗pd-1抗体或其抗原结合部分与纳武单抗结合相同的表位。在一些方面,抗pd-1抗体是嵌合、人源化或人单克隆抗体或其抗原结合部分。在一些方面,抗pd-1抗体包含人igg1或igg4同种型的重链恒定区。
[0131]
在一些方面,抗pd-1抗体包括纳武单抗、派姆单抗、西米普利单抗、或其抗原结合部分。在一些方面,抗pd-1抗体是纳武单抗、派姆单抗或西米普利单抗。
[0132]
在一些方面,抗pd-l1抗体包括阿维鲁单抗、阿特珠单抗、度伐鲁单抗或其抗原结合部分。在一些方面,抗pd-l1抗体是阿维鲁单抗、阿特珠单抗或度伐鲁单抗。
[0133]
在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体每周施用一次、每2周施用一次、约每3周施用一次、约每4周施用一次、约每5周施用一次、或约每6周施用一次。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体以范围从约0.1mg/kg至约20.0mg/kg体重的剂量施用。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体以约0.1mg/kg、约0.5mg/kg、约1mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg或约20mg/kg的剂量施用。
[0134]
在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体以如下范围的剂量约
每1、2、3、4、5或6周施用一次:从至少约0.1mg/kg至至少约10.0mg/kg体重,例如,约0.1mg/kg、约0.5mg/kg、约1mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg或约20mg/kg。在一个方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体以范围从至少约0.1mg/kg至至少约10.0mg/kg体重的剂量约每1、2或3周施用一次。在另一方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体以至少约3mg/kg体重的剂量约每2周施用一次。
[0135]
在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体或其抗原结合部分以平剂量施用。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体或其抗原结合部分以如下平剂量施用:至少约25mg/剂、至少约50mg/剂、至少约75mg/剂、至少约100mg/剂、至少约125mg/剂、至少约150mg/剂、至少约175mg/剂、至少约200mg/剂、至少约220mg/剂、至少约240mg/剂、至少约260mg/剂、至少约280mg/剂、至少约300mg/剂、至少约320mg/剂、至少约340mg/剂、至少约360mg/剂、至少约380mg/剂、至少约400mg/剂、至少约420mg/剂、至少约440mg/剂、至少约460mg/剂、至少约480mg/剂、至少约500mg/剂或至少约550mg/剂。
[0136]
在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体或其抗原结合部分以约240mg/剂的平剂量施用。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体或其抗原结合部分以约480mg/剂的平剂量施用。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体或其抗原结合部分以平剂量约每1、2、3或4周施用一次。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体或其抗原结合部分以约240mg/剂的平剂量约每两周施用一次。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体或其抗原结合部分以约480mg/剂的平剂量约每四周施用一次。
[0137]
在一些方面,只要观察到临床益处就持续施用抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体,或直到发生不可管控的毒性或疾病进展。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体配制用于静脉内施用。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体经由静脉内推注施用来施用。在一些方面,推注是快速推注。在其他方面,推注是缓慢推注。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体经由静脉内输注来施用。在一些方面,将抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体以亚治疗剂量施用。
[0138]
在一些方面,用抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体的免疫疗法伴随有第二疗法,所述第二疗法包括向受试者施用ido1抑制剂(例如甲磺酸林罗司他)。在一些方面,ido1抑制剂是选择性地抑制ido1的化合物。在一些方面,ido1抑制剂不抑制tdo2酶活性。在本公开文本的一些具体方面,ido1抑制剂是林罗司他((2r)-n-(4-氯苯基)-2-(顺式-4-(6-氟喹啉-4-基)环己基)丙酰胺)或其盐。在一些方面,林罗司他盐是甲磺酸林罗司他。在一些方面,ido1抑制剂选自林罗司他、1-甲基-dl-色氨酸、对-(3-苯并呋喃基)-dl-丙氨酸、对-[3-苯并(b)噻吩基]-dl-丙氨酸;6-硝基-l-色氨酸、艾卡哚司他、pf-06840003(3-(5-氟-1h-吲哚-3-基)吡咯烷-2,5-二酮)、那沃莫德、iom2983、rg-70099、tpst-8844、srx-3217、pdx-26116、nlg-802、mk-7162、ly-3381916、ly-01013、khk-2455、io-102、io-101、吲哚莫德、hti-1090、eos-200271、dn-1406131、dn-016、blh-1131、bgb-5777、bebt-303、an-0015、ai-001、及其任何组合。参见,prendergast等人(2017)cancer res.77(24);6795-811,将其通过引用以其整体并入本文。
[0139]
在一些方面,将ido1抑制剂(例如甲磺酸林罗司他)配制用于口服施用。在一些方面,将ido1抑制剂(例如甲磺酸林罗司他)以约100mg的平剂量施用。在一些方面,将ido1抑制剂(例如甲磺酸林罗司他)以约200mg的平剂量施用。在一些方面,将ido1抑制剂(例如甲磺酸林罗司他)以约100mg的平剂量每天施用。在一些方面,将ido1抑制剂(例如甲磺酸林罗司他)以约200mg的平剂量每天施用。在一些方面,将ido1抑制剂以约25mg/天、约50mg/天、约75mg/天、约100mg/天、约125mg/天、约150mg/天、约175mg/天、约200mg/天、约225mg/天、约250mg/天、约275mg/天或约300mg/天的平剂量施用。
[0140]
在一些方面,在用抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体治疗的历程期间,将ido1抑制剂(例如甲磺酸林罗司他)以约100mg的平剂量每天施用。在一些方面,在用抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体治疗的历程期间,将ido1抑制剂(例如甲磺酸林罗司他)以约200mg的平剂量每天施用。在一些方面,在用抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体治疗的历程期间,将ido1抑制剂以约25mg/天、约50mg/天、约75mg/天、约100mg/天、约125mg/天、约150mg/天、约175mg/天、约200mg/天、约225mg/天、约250mg/天、约275mg/天或约300mg/天的平剂量施用。
[0141]
在一个具体方面,抗pd-1抗体是纳武单抗,并且ido1抑制剂是甲磺酸林罗司他。在一些方面,将纳武单抗以约240mg/剂的平剂量约每两周一次向有需要的受试者(例如患有癌症的受试者)施用,并且在用纳武单抗治疗的历程期间,将甲磺酸林罗司他以约100mg/剂的平剂量每天施用。在一些方面,将纳武单抗以约480mg/剂的平剂量约每四周一次向有需要的受试者(例如患有癌症的受试者)施用,并且在用纳武单抗治疗的历程期间,将甲磺酸林罗司他以约100mg/剂的平剂量每天施用。在一些方面,将纳武单抗以约240mg/剂的平剂量约每两周一次向有需要的受试者(例如患有癌症的受试者)施用,并且在用纳武单抗治疗的历程期间,将甲磺酸林罗司他以约200mg/剂的平剂量每天施用。在一些方面,将纳武单抗以约480mg/剂的平剂量约每四周一次向有需要的受试者(例如患有癌症的受试者)施用,并且在用纳武单抗治疗的历程期间,将甲磺酸林罗司他以约200mg/剂的平剂量每天施用。在一些方面,如果受试者展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物,则向受试者施用这些治疗。在一些方面,可将本文所述的治疗施用于患有难治性癌症的受试者,例如,在至少一种先前的抗癌疗法(例如,包括施用至少一种抗癌剂的抗癌疗法)之后,癌症是难治性的。在一些方面,所述至少一种抗癌剂包括免疫疗法。
[0142]
在一些方面,将抗pd-1拮抗剂(例如,抗pd-1抗体如纳武单抗)在施用ido1抑制剂(例如甲磺酸林罗司他)的同一天、之前或之后施用,例如,在施用ido1抑制剂之前或之后立即施用。在一些方面,将抗pd-1拮抗剂(例如,抗pd-1抗体如纳武单抗)与ido1抑制剂(例如甲磺酸林罗司他)并行施用。
[0143]
在一些方面,施用本文公开的组合疗法(例如,包括向有需要的受试者施用纳武单抗和ido1抑制剂(如甲磺酸林罗司他)的抗癌疗法)治疗癌症。在一些方面,施用组合疗法减少癌症负荷。在一些方面,与施用前的癌症负荷相比,癌症负荷减少至少约10%、至少15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、或约100%。
[0144]
在一些方面,施用组合疗法减小肿瘤体积。在一些方面,与施用前的肿瘤体积相
比,肿瘤体积减小至少约10%、至少15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、或约100%。
[0145]
在一些方面,施用组合疗法减少癌细胞增殖。在一些方面,与施用前的癌细胞增殖相比,癌症增殖减少至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、或约100%。
[0146]
在一些方面,施用组合疗法减少肿瘤生长。在一些方面,与施用前的肿瘤生长相比,肿瘤生长减少至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、或约100%。
[0147]
在一些方面,在初始施用本文公开的组合疗法后(例如,如果受试者展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物则向受试者施用的抗癌疗法,其包括向有需要的受试者施用纳武单抗和ido1抑制剂(如甲磺酸林罗司他)),所述受试者展现出至少约一个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约一年、至少约十八个月、至少约两年、至少约三年、至少约四年或至少约五年的无进展存活期。
[0148]
在一些方面,在施用本文公开的组合疗法后(例如,如果受试者展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物则向受试者施用的抗癌疗法,其包括向有需要的受试者施用纳武单抗和ido1抑制剂(如甲磺酸林罗司他)),所述受试者展现出疾病稳定。
[0149]
在一些方面,在施用本文公开的组合疗法后(例如,如果受试者展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物则向受试者施用的抗癌疗法,其包括向有需要的受试者施用纳武单抗和ido1抑制剂(如甲磺酸林罗司他)),所述受试者展现出部分反应。
[0150]
在一些方面,在施用本文公开的组合疗法后(例如,如果受试者展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物则向受试者施用的抗癌疗法,其包括向有需要的受试者施用纳武单抗和ido1抑制剂(如甲磺酸林罗司他)),所述受试者展现出完全反应。
[0151]
在一些方面,与未展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物的受试者的无进展存活概率相比,向有需要的受试者施用本文公开的组合疗法(例如,如果受试者展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物则向受试者施用的抗癌疗法,其包括向有需要的受试者施用纳武单抗和ido1抑制剂(如甲磺酸林罗司他))将无进展存活概率提高至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约110%、至少约120%、至少约130%、至少约140%、或至少约150%。
[0152]
在一些方面,与未展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物的受试者的总存活概率相比,向有需要的受试者施用本文公开的组合
疗法(例如,如果受试者展现出包含(a)高ifnγ炎症特征得分和(b)低tdo2基因表达得分的组合生物标记物则向受试者施用的抗癌疗法,其包括向有需要的受试者施用纳武单抗和ido1抑制剂(如甲磺酸林罗司他))将总存活概率提高至少约25%、至少约50%、至少约75%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%、至少约300%、至少约325%、至少约350%或至少约375%。iii.组合生物标记物和基因组套
[0153]
本公开文本的方法涉及具有以下两个组分的组合生物标记物的预测性用途:从ifnγ炎症基因组套获得的ifnγ炎症特征得分;和第二得分即tdo2基因表达得分,其源自tdo2基因的表达水平。
[0154]
如本文所用,ifnγ炎症特征得分是从受试者获得的样品中ifnγ炎症基因组套中存在的基因的组合表达水平的量度,所述ifnγ炎症基因组套例如包含以下、由以下组成或基本上由以下组成:(i)ifnγ、cxcl10、cxcl9、hla-dra、ido1和stat1;(ii)ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1、ccr5、cxcl11、gzma和prf1;或(iii)cxcr6、cd3d、cd2、itgal、tagap、ciita、hla-dra、ptprc、cxcl9、ccl5、nkg7、gzma、prf1、ccr5、cd3e、hla-e、gzmk、gzmb、pdcd、slamf6、cxcl13、cxcl10、ido1、lag3、stat1和cxcl11;或(iv)ifnγ、ir2rg、cxcr6、cd3d、cd2、itgal、tagap、ciita、hla-dra、ptprc、cxcl9、ccl5、nkg7、gzma、prf1、ccr5、cd3e、gzmk、hla-e、gzmb、pdcd1、slamf6、cxcl13、cxcl10、ido1、lag3、stat1和cxcl11。
[0155]
原则上,包含一种或多种癌细胞的任何生物样品均可用于本文所公开的方法中。在一些方面,样品选自癌症(例如肿瘤)活检物、血液样品、血清样品或其任何组合。在一些方面,样品是从肿瘤的间质获得的。在某些方面,样品是在施用抗pd-1拮抗剂(例如抗pd-1抗体或抗pd-l1抗体)之前和/或在施用ido1抑制剂(例如甲磺酸林罗司他)之前从受试者收集的肿瘤活检物。在一些方面,从受试者获得的样品是福尔马林固定的肿瘤活检物。在一些方面,从受试者获得的样品是石蜡包埋的肿瘤活检物。在一些方面,从受试者获得的样品是福尔马林固定的石蜡包埋的组织。在一些方面,从受试者获得的样品是新鲜冷冻的肿瘤活检物。在一些方面,从受试者获得的样品是血液样品,或其通过处理血液样品获得(例如,样品是从血液样品提取的特定细胞亚群)。
[0156]
本领域已知的用于测量特定基因(例如,tdo2)或一组套基因(例如,ifnγ炎症基因组套中的基因)的表达的任何方法可用于本公开文本的方法中。在一些方面,通过检测从ifnγ相关炎症基因或tdo2基因转录的mrna的存在、由ifnγ相关炎症基因或tdo2基因编码的蛋白质的存在或两者来确定ifnγ炎症基因组套中一种或多种炎症基因的表达。
[0157]
在一些方面,ifnγ炎症基因组套中一种或多种基因和/或tdo2基因的表达是通过测量从受试者获得的至少一个样品中炎症基因mrna的水平来确定的,例如通过测量ifnγmrna、cxcl10 mrna、cxcl9 mrna、hla-dra mrna、ido1 mrna、stat1 mrna、ccr5 mrna、cxcl11 mrna、gzma mrna、prf1 mrna或tdo2 mrna中一种或多种的水平来确定。
[0158]
在某些方面,ifnγ炎症特征得分是通过测量从受试者获得的至少一个样品中ifnγmrna、cxcl10 mrna、cxcl9 mrna、hla-dra mrna、ido1 mrna和stat1 mrna的水平来确定
的。
[0159]
在某些方面,ifnγ炎症特征得分是通过测量从受试者获得的至少一个样品中ifnγmrna、cxcl10 mrna、cxcl9 mrna、hla-dra mrna、ido1 mrna、stat1 mrna、ccr5 mrna、cxcl11 mrna、gzma mrna和prf1 mrna的水平来确定的。
[0160]
在某些方面,ifnγ炎症特征得分是通过测量从受试者获得的至少一个样品中cxcr6 mrna、tigit mrna、cd274(pd-l1)mrna、pdcd1lg2(pd-l2)mrna、lag3 mrna、nkg7 mrna、psmb10 mrna、cmklr1 mrna、cd8a mrna、ido1 mrna、ccl5 mrna、cxcl9 mrna、hla.dqa1 mrna、cd276 mrna、hla.drb1 mrna、stat1 mrna和hla.e mrna的水平来确定的。
[0161]
在某些方面,ifnγ炎症特征得分是通过测量从受试者获得的至少一个样品中ifnγmrna、ir2rg mrna、cxcr6 mrna、cd3d mrna、cd2 mrna、itgal mrna、tagap mrna、ciita mrna、hla-dra mrna、ptprc mrna、cxcl9 mrna、ccl5 mrna、nkg7 mrna、gzma mrna、prf1 mrna、ccr5 mrna、cd3e mrna、gzmk mrna、hla-e mrna、gzmb mrna、pdcd1 mrna、slamf6 mrna、cxcl13 mrna、cxcl10 mrna、ido1 mrna、lag3 mrna、stat1 mrna和cxcl11 mrna的水平来确定的。
[0162]
在一些方面,tdo2表达得分是通过测量从受试者获得的至少一个样品中tdo2 mrna的水平来确定的。在一些方面,所有mrna水平测量是使用单个样品进行的。在其他方面,所有mrna水平测量是使用多于一个样品进行的。
[0163]
本领域已知的任何方法可用于测量来自ifnγ炎症基因组套中的基因和/或tdo2的mrna水平。在一些方面,编码ifnγ炎症基因组套中的基因和/或tdo2基因的mrna的存在是使用逆转录酶pcr确定的。在一些方面,使用逆转录酶pcr测量来自ifnγ炎症基因组套中的基因和/或tdo2的mrna。在一些方面,使用rna原位杂交测量来自ifnγ炎症基因组套中的基因和/或tdo2的mrna。
[0164]
在一些方面,ifnγ炎症基因组套中一种或多种基因和/或tdo2的表达是通过测量从受试者获得的至少一个样品中所表达蛋白的水平来确定的,例如通过测量ifnγ、cxcl10、hla-dra、cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e、ccr5、cxcl11、gzma、prf1、ir2rg、cd3d、cd2、itgal、tagap、ciita、ptprc、cd3e、gzmk、gzmb、pdcd1、slamf6、cxcl13和tdo2中一种或多种的蛋白水平来确定。
[0165]
在某些方面,ifnγ炎症特征得分是通过测量从受试者获得的至少一个样品中ifnγ蛋白、cxcl10蛋白、cxcl9蛋白、hla-dra蛋白、ido1蛋白和stat1蛋白的水平来确定的。
[0166]
在某些方面,ifnγ炎症特征得分是通过测量从受试者获得的至少一个样品中ifnγ蛋白、cxcl10蛋白、cxcl9蛋白、hla-dra蛋白、ido1蛋白、stat1蛋白、ccr5蛋白、cxcl11蛋白、gzma蛋白和prf1蛋白的水平来确定的。
[0167]
在某些方面,ifnγ炎症特征得分是通过测量从受试者获得的至少一个样品中cxcr6蛋白、tigit蛋白、cd274(pd-l1)蛋白、pdcd1lg2(pd-l2)蛋白、lag3蛋白、nkg7蛋白、psmb10蛋白、cmklr1蛋白、cd8a蛋白、ido1蛋白、ccl5蛋白、cxcl9蛋白、hla.dqa1蛋白、cd276蛋白、hla.drb1蛋白、stat1蛋白和hla.e蛋白的水平来确定的。
[0168]
在某些方面,ifnγ炎症特征得分是通过测量从受试者获得的至少一个样品中ifnγ蛋白、ir2rg蛋白、cxcr6蛋白、cd3d蛋白、cd2蛋白、itgal蛋白、tagap蛋白、ciita蛋白、
hla-dra蛋白、ptprc蛋白、cxcl9蛋白、ccl5蛋白、nkg7蛋白、gzma蛋白、prf1蛋白、ccr5蛋白、cd3e蛋白、gzmk蛋白、hla-e蛋白、gzmb蛋白、pdcd1蛋白、slamf6蛋白、cxcl13蛋白、cxcl10蛋白、ido1蛋白、lag3蛋白、stat1蛋白和cxcl11蛋白的水平来确定的。
[0169]
在某些方面,tdo2基因表达得分是通过测量从受试者获得的至少一个样品中tdo2蛋白的水平来确定的。
[0170]
本领域已知的任何方法可用于测量对应于ifnγ炎症基因组套中一种或多种基因和/或tdo2基因的所表达蛋白的水平。在一些方面,由ifnγ炎症基因组套中的基因和/或tdo2基因编码的蛋白质的存在是使用ihc测定确定的。在一些方面,使用免疫组织化学(ihc)测定来测量所表达蛋白的水平。在某些方面,所述ihc是自动化ihc。在一些方面,测定是包括与ifnγ炎症基因组套相关的拓扑学的蛋白质ihc测定。
[0171]
在一些方面,将ifnγ炎症基因组套中一种或多种基因和/或tdo2基因的表达相对于一种或多种管家基因的表达归一化。在一些方面,所述一种或多种管家基因由在各种受试者的各种癌症类型(例如肿瘤类型)中具有相对一致表达的基因构成。
[0172]
在一些方面,按照标准基因表达谱分析(gep)方案对原始基因表达值进行归一化。在这些方面,ifnγ炎症特征得分和/或tdo2基因表达得分可计算为ifnγ炎症基因组套中所有靶基因和/或tdo2基因的log2变换的归一化和缩放表达值的中值或平均值,并以线性标度呈现。在某些方面,得分具有正值或负值,这取决于基因表达在特定条件下是上调还是下调。
[0173]
在某些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分大于参考ifnγ炎症特征得分。
[0174]
在一些方面,参考ifnγ炎症特征得分是平均炎症特征得分。在一些方面,通过测量从受试者群体获得的癌症(例如肿瘤)样品中ifnγ炎症基因组套中存在的基因的表达并计算受试者群体的平均值来确定平均ifnγ炎症特征得分。在一些方面,平均ifnγ炎症特征得分是通过对从受试者群体获得的癌症样品中ifnγ炎症基因组套基因的表达平均化来确定的。
[0175]
在一些方面,参考ifnγ炎症特征得分是中值炎症特征得分。在一些方面,通过测量从受试者群体获得的癌症(例如肿瘤)样品中ifnγ炎症基因组套中存在的基因的表达并计算受试者群体中分布的中值来确定中值ifnγ炎症特征得分。在一些方面,通过测量从受试者群体获得的癌症(例如肿瘤)样品中ifnγ炎症基因组套中存在的基因的表达并计算受试者群体中分布的中值来确定中值ifnγ炎症特征得分。在一些方面,中值ifnγ炎症特征得分由从受试者群体获得的癌症样品中ifnγ炎症基因组套基因的表达分布确定。
[0176]
在一些方面,参考ifnγ炎症特征得分是预定的截止值或阈值。
[0177]
在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分高于参考样品(例如,从受试者或受试者组获得的样品或样品组)的平均ifnγ炎症特征得分。在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分高于参考样品(例如,从受试者或受试者组获得的样品或样品组)的中值ifnγ炎症特征得分。在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分高于预定的截止值或阈值。
[0178]
在一些方面,所述参考样品包括所述受试者的非肿瘤组织、所述受试者的相应非肿瘤组织、或没有肿瘤的受试者的相应组织。在一些方面,所述参考样品包括来自受试者群
体的非肿瘤组织、受试者群体的相应非肿瘤组织、或没有肿瘤的受试者群体的相应组织。
[0179]
在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分比平均ifnγ炎症特征得分高至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%或至少约300%。
[0180]
在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分比中值ifnγ炎症特征得分高至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%或至少约300%。
[0181]
在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分比预定的截止值或阈值ifnγ炎症特征得分高至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%或至少约300%。
[0182]
在一些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分比平均ifnγ炎症特征得分、中值ifnγ炎症特征得分、或预定的截止值或阈值ifnγ炎症特征得分高至少约1.25倍、至少约1.30倍、至少约1.35倍、至少约1.40倍、至少约1.45倍、至少约1.50倍、至少约1.55倍、至少约1.60倍、至少约1.65倍、至少约1.70倍、至少约1.75倍、至少约1.80倍、至少约1.85倍、至少约1.90倍、至少约1.95倍、至少约2倍、至少约2.25倍、至少约2.50倍、至少约2.75倍、至少约3倍、至少约3.25倍、至少约3.50倍、至少约3.75倍或至少约400倍。
[0183]
在某些方面,高ifnγ炎症特征得分的特征在于ifnγ炎症特征得分为至少约-0.20、至少约-0.15、至少约-0.10、至少约-0.05、至少约0.00、至少约0.05、至少约0.10、至少约0.15、至少约0.20、至少约0.25、至少约0.30、至少约0.35、至少约0.40、至少约0.45、至少约0.50、至少约0.55、至少约0.60、至少约0.65、至少约0.70、至少约0.75、至少约0.80、至少约0.85、至少约0.90、至少约0.95或至少约1.00,其中所述ifnγ炎症特征得分是根据本文所公开的方法确定的。
[0184]
在某些方面,平均ifnγ炎症特征得分为约-0.2、约-0.15、约-0.1、约-0.05、约0、约0.05、约0.1、约0.15、约0.2、约0.25、约0.3、约0.35、约0.4、约0.45、约0.5、约0.55、约0.6、约0.65、约0.7、约0.75、约0.8、约0.85、约0.9、约0.95、或约1,其中所述平均ifnγ炎症特征得分是根据本文所公开的方法确定的。
[0185]
在某些方面,平均ifnγ炎症特征得分为-0.2、-0.15、-0.1、-0.05、0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95、或1,其中所述平均ifnγ炎症特征得分是根据本文所公开的方法确定的。
[0186]
在某些方面,中值ifnγ炎症特征得分为约-0.2、约-0.15、约-0.1、约-0.05、约0、约0.05、约0.1、约0.15、约0.2、约0.25、约0.3、约0.35、约0.4、约0.45、约0.5、约0.55、约0.6、约0.65、约0.7、约0.75、约0.8、约0.85、约0.9、约0.95或约1,其中所述中值ifnγ炎症
特征得分是根据本文所公开的方法确定的。
[0187]
在某些方面,中值ifnγ炎症特征得分为-0.2、-0.15、-0.1、-0.05、0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95、或1,其中所述中值ifnγ炎症特征得分是根据本文所公开的方法确定的。
[0188]
在某些方面,阈值ifnγ炎症特征得分为约-0.2、约-0.15、约-0.1、约-0.05、约0、约0.05、约0.1、约0.15、约0.2、约0.25、约0.3、约0.35、约0.4、约0.45、约0.5、约0.55、约0.6、约0.65、约0.7、约0.75、约0.8、约0.85、约0.9、约0.95或约1,其中所述阈值ifnγ炎症特征得分是根据本文所公开的方法确定的。
[0189]
在某些方面,阈值ifnγ炎症特征得分为-0.2、-0.15、-0.1、-0.05、0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95、或1,其中所述阈值ifnγ炎症特征得分是根据本文所公开的方法确定的。
[0190]
在某些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分小于(低于)参考tdo2基因表达得分。
[0191]
在一些方面,参考tdo2基因表达得分是平均tdo2基因表达得分。在一些方面,通过测量从受试者群体获得的癌症(例如肿瘤)样品中tdo2基因的表达并计算受试者群体的平均值来确定平均tdo2基因表达得分。在一些方面,平均tdo2基因表达得分是通过对从受试者群体获得的癌症样品中tdo2基因的表达平均化来确定的。
[0192]
在一些方面,参考tdo2基因表达得分是中值tdo2基因表达得分。在一些方面,通过测量从受试者群体获得的癌症(例如肿瘤)样品中tdo2基因的表达并计算受试者群体中分布的中值来确定中值tdo2基因表达得分。在一些方面,通过测量从受试者群体获得的癌症(例如肿瘤)样品中存在的tdo2基因的表达并计算受试者群体中分布的中值来确定中值tdo2基因表达得分。在一些方面,由从受试者群体获得的癌症样品中tdo2基因的表达分布确定中值tdo2基因表达得分。
[0193]
在一些方面,参考tdo2基因表达得分是预定的截止值或阈值。
[0194]
在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分低于参考样品(例如,从受试者或受试者组获得的样品或样品组)的平均tdo2基因表达得分。在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分低于参考样品(例如,从受试者或受试者组获得的样品或样品组)的中值tdo2基因表达得分。在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分低于预定的截止值或阈值。
[0195]
在一些方面,tdo2参考样品包括所述受试者的非肿瘤组织、所述受试者的相应非肿瘤组织、或没有肿瘤的受试者的相应组织。在一些方面,tdo2参考样品包括来自受试者群体的非肿瘤组织、受试者群体的相应非肿瘤组织、或没有肿瘤的受试者群体的相应组织。
[0196]
在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分比平均tdo2基因表达得分低至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%或至少约300%。
[0197]
在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分比中值tdo2基因表达得分低至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、
至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%或至少约300%。
[0198]
在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分比预定的截止值或阈值ifnγ炎症特征得分低至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%或至少约300%。
[0199]
在一些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分比平均tdo2基因表达得分、中值tdo2基因表达得分、或预定的截止值或阈值tdo2基因表达得分低至少约1.25倍、至少约1.30倍、至少约1.35倍、至少约1.40倍、至少约1.45倍、至少约1.50倍、至少约1.55倍、至少约1.60倍、至少约1.65倍、至少约1.70倍、至少约1.75倍、至少约1.80倍、至少约1.85倍、至少约1.90倍、至少约1.95倍、至少约2倍、至少约2.25倍、至少约2.50倍、至少约2.75倍、至少约3倍、至少约3.25倍、至少约3.50倍、至少约3.75倍或至少约400倍。
[0200]
在某些方面,低tdo2基因表达得分的特征在于tdo2基因表达得分小于约5、小于约4.9、小于约4.8、小于约4.7、小于约4.6、小于约4.5、小于约4.4、小于约4.3、小于约4.2、小于约4.1、小于约4、小于约3.9、小于约3.8、小于约3.7、小于约3.6、小于约3.5、小于约3.4、小于约3.3、小于约3.2、小于约3.1、小于约3、小于约2.9、小于约2.8、小于约2.7、小于约2.6、小于约2.5、小于约2.4、小于约2.3、小于约2.2、小于约2.1、小于约2、小于约1.9、小于约1.8、小于约1.7、小于约1.6、小于约1.5、小于约1.4、小于约1.3、小于约1.2、小于约1.1、小于约1、小于约0.9、小于约0.8、小于约0.7、小于约0.6、小于约0.5、小于约0.4、小于约0.3、小于约0.2、小于约0.1或小于约0,其中所述tdo2基因表达得分是根据本文公开的方法确定的。
[0201]
在某些方面,平均tdo2基因表达得分为约5、约4.9、约4.8、约4.7、约4.6、约4.5、约4.4、约4.3、约4.2、约4.1、约4、约3.9、约3.8、约3.7、约3.6、约3.5、约3.4、约3.3、约3.2、约3.1、约3、约2.9、约2.8、约2.7、约2.6、约2.5、约2.4、约2.3、约2.2、约2.1、约2、约1.9、约1.8、约1.7、约1.6、约1.5、约1.4、约1.3、约1.2、约1.1、约1、约0.9、约0.8、约0.7、约0.6、约0.5、约0.4、约0.3、约0.2、约0.1或约0,其中所述平均tdo2基因表达得分是根据本文公开的方法确定的。
[0202]
在某些方面,平均tdo2基因表达得分为5、4.9、4.8、4.7、4.6、4.5、4.4、4.3、4.2、4.1、4、3.9、3.8、3.7、3.6、3.5、3.4、3.3、3.2、3.1、3、2.9、2.8、2.7、2.6、2.5、2.4、2.3、2.2、2.1、2、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、或0,其中所述平均tdo2基因表达得分是根据本文公开的方法确定的。
[0203]
在某些方面,中值tdo2基因表达得分为约5、约4.9、约4.8、约4.7、约4.6、约4.5、约4.4、约4.3、约4.2、约4.1、约4、约3.9、约3.8、约3.7、约3.6、约3.5、约3.4、约3.3、约3.2、约3.1、约3、约2.9、约2.8、约2.7、约2.6、约2.5、约2.4、约2.3、约2.2、约2.1、约2、约1.9、约1.8、约1.7、约1.6、约1.5、约1.4、约1.3、约1.2、约1.1、约1、约0.9、约0.8、约0.7、约0.6、约0.5、约0.4、约0.3、约0.2、约0.1或约0,其中所述中值tdo2基因表达得分是根据本文公开的方法确定的。
[0204]
在某些方面,中值tdo2基因表达得分为5、4.9、4.8、4.7、4.6、4.5、4.4、4.3、4.2、4.1、4、3.9、3.8、3.7、3.6、3.5、3.4、3.3、3.2、3.1、3、2.9、2.8、2.7、2.6、2.5、2.4、2.3、2.2、2.1、2、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、或0,其中所述中值tdo2基因表达得分是根据本文公开的方法确定的。
[0205]
在某些方面,阈值tdo2基因表达得分为约5、约4.9、约4.8、约4.7、约4.6、约4.5、约4.4、约4.3、约4.2、约4.1、约4、约3.9、约3.8、约3.7、约3.6、约3.5、约3.4、约3.3、约3.2、约3.1、约3、约2.9、约2.8、约2.7、约2.6、约2.5、约2.4、约2.3、约2.2、约2.1、约2、约1.9、约1.8、约1.7、约1.6、约1.5、约1.4、约1.3、约1.2、约1.1、约1、约0.9、约0.8、约0.7、约0.6、约0.5、约0.4、约0.3、约0.2、约0.1或约0,其中所述阈值tdo2基因表达得分是根据本文公开的方法确定的。
[0206]
在某些方面,阈值tdo2基因表达得分为5、4.9、4.8、4.7、4.6、4.5、4.4、4.3、4.2、4.1、4、3.9、3.8、3.7、3.6、3.5、3.4、3.3、3.2、3.1、3、2.9、2.8、2.7、2.6、2.5、2.4、2.3、2.2、2.1、2、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、或0,其中所述阈值tdo2基因表达得分是根据本文公开的方法确定的。iv.可用于本公开文本的抗pd-1抗体
[0207]
在本公开文本的一些方面,抗pd-1拮抗剂是抗pd-1抗体或其抗原结合部分。本领域已知的抗pd-1抗体可以用于本发明所述的组合物和方法中。以高亲和力与pd-1特异性结合的多种人单克隆抗体已经公开在美国专利号8,008,449中。已经证明美国专利号8,008,449中披露的抗pd-1人抗体展现出以下特征中的一种或多种:(a)以1x10-7m或更小的kd与人pd-1结合,如使用biacore生物传感器系统通过表面等离子体共振确定的;(b)基本上不与人cd28、ctla-4或icos结合;(c)在混合淋巴细胞反应(mlr)测定中增加t细胞增殖;(d)在mlr测定中增加干扰素-γ产生;(e)在mlr测定中增加il-2分泌;(f)与人pd-1和食蟹猴pd-1结合;(g)抑制pd-l1和/或pd-l2与pd-1的结合;(h)刺激抗原特异性记忆应答;(i)刺激抗体应答;以及(j)抑制体内肿瘤细胞生长。可用于本公开文本中的抗pd-1抗体包括与人pd-1特异性结合并且展现出前述特征中的至少一种、在一些方面至少五种的单克隆抗体。
[0208]
其他抗pd-1单克隆抗体已经描述于例如以下中:美国专利号6,808,710、7,488,802、8,168,757和8,354,509,美国公开号2016/0272708,以及pct公开号wo 2012/145493、wo 2008/156712、wo 2015/112900、wo 2012/145493、wo 2015/112800、wo 2014/206107、wo 2015/35606、wo 2015/085847、wo 2014/179664、wo 2017/020291、wo 2017/020858、wo 2016/197367、wo 2017/024515、wo 2017/025051、wo 2017/123557、wo 2016/106159、wo 2014/194302、wo 2017/040790、wo 2017/133540、wo 2017/132827、wo 2017/024465、wo 2017/025016、wo 2017/106061、wo 2017/19846、wo 2017/024465、wo 2017/025016、wo 2017/132825和wo 2017/133540,将所述文献中的每一篇均通过引用以其整体并入。
[0209]
在一些方面,所述抗pd-1抗体选自纳武单抗(也称为5c4、bms-936558、mdx-1106和ono-4538)、派姆单抗(merck;也称为兰洛利珠单抗(lambrolizumab)和mk-3475;参见wo2008/156712)、pdr001(novartis;参见wo 2015/112900)、medi-0680(astrazeneca;也称为amp-514;参见wo 2012/145493);塞普利单抗(cemiplimab)(regeneron;也称为regn-2810;参见wo 2015/112800)、js001(taizhou junshi pharma;也称为特瑞普利单抗(toripalimab);参见si-yang liu等人,
j.hematol.oncol.10:136(2017))、bgb-a317(beigene;也称为替雷利珠单抗(tislelizumab);参见wo 2015/35606和us 2015/0079109)、incshr1210(jiangsu hengrui medicine;也称为shr-1210;参见wo 2015/085847;si-yang liu等人,j.hematol.oncol.10:136(2017))、tsr-042(tesaro biopharmaceutical;也称为anb011;参见wo2014/179664)、gls-010(wuxi/harbin gloria pharmaceuticals;也称为wbp3055;参见si-yang liu等人,j.hematol.oncol.10:136(2017))、am-0001(armo)、sti-1110(sorrento therapeutics;参见wo 2014/194302)、agen2034(agenus;参见wo 2017/040790)、mga012(macrogenics,参见wo 2017/19846)、bcd-100(biocad;kaplon等人,mabs 10(2):183-203(2018)、和ibi308(innovent;参见wo 2017/024465、wo 2017/025016、wo 2017/132825和wo 2017/133540)。
[0210]
在一个方面,所述抗pd-1抗体是纳武单抗。纳武单抗是完全人igg4(s228p)pd-1免疫检查点抑制剂抗体,其选择性地阻止与pd-1配体(pd-l1和pd-l2)的相互作用,从而阻断抗肿瘤t细胞功能的下调(美国专利号8,008,449;wang等人,2014cancer immunol res.2(9):846-56)。
[0211]
在另一方面,所述抗pd-1抗体是派姆单抗。派姆单抗是针对人细胞表面受体pd-1(程序性死亡蛋白-1或程序性细胞死亡蛋白-1)的人源化单克隆igg4(s228p)抗体。派姆单抗描述于例如美国专利号8,354,509和8,900,587中。
[0212]
可用于所公开的组合物和方法中的抗pd-1抗体还包括分离的抗体,其与人pd-1特异性结合并且与本文所公开的任何抗pd-1抗体(例如,纳武单抗)交叉竞争与人pd-1的结合(参见例如,美国专利号8,008,449和8,779,105;wo 2013/173223)。在一些方面,所述抗pd-1抗体与本文所述的任何抗pd-1抗体(例如,纳武单抗)结合相同的表位。抗体交叉竞争结合抗原的能力指示这些单克隆抗体结合抗原的相同表位区域并且在空间上阻碍其他交叉竞争抗体与该特定表位区域的结合。预期这些交叉竞争抗体由于它们结合pd-1的相同表位区域而具有与参考抗体(例如,纳武单抗)非常相似的功能特性。在标准pd-1结合测定(如biacore分析、elisa测定或流式细胞术)中可以基于交叉竞争抗体与纳武单抗交叉竞争的能力容易地鉴定它们(参见例如,wo 2013/173223)。
[0213]
在某些方面,与纳武单抗交叉竞争与人pd-1的结合或与纳武单抗结合人pd-1抗体的相同表位区域的抗体是单克隆抗体。对于施用于人受试者,这些交叉竞争抗体是嵌合抗体、工程化抗体或者人源化抗体或人抗体。可以通过本领域熟知的方法来制备和分离此类嵌合、工程化、人源化或人单克隆抗体。
[0214]
可用于所公开的公开文本的组合物和方法中的抗pd-1抗体还包括上述抗体的抗原结合部分。已经充分地证明,抗体的抗原结合功能可以通过全长抗体的片段来执行。
[0215]
适用于所公开的组合物和方法的抗pd-1抗体是以高特异性和亲和力与pd-1结合、阻断pd-l1和或pd-l2的结合并抑制pd-1信号传导途径的免疫抑制作用的抗体。在本文所公开的任何组合物或方法中,抗pd-1“抗体”包括与pd-1受体结合并且在抑制配体结合和上调免疫系统方面展现出与完整抗体相似的功能特性的抗原结合部分或片段。在某些方面,所述抗pd-1抗体或其抗原结合部分与纳武单抗交叉竞争与人pd-1的结合。
[0216]
在一些方面,将所述抗pd-1抗体以范围从0.1mg/kg至20.0mg/kg体重的剂量每2、3、4、5、6、7或8周施用一次,例如以0.1mg/kg至10.0mg/kg体重每2、3或4周施用一次。在其他
方面,将所述抗pd-1抗体以约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg或10mg/kg体重的剂量每2周施用一次。在其他方面,将所述抗pd-1抗体以约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg或10mg/kg体重的剂量每3周施用一次。在一个方面,将所述抗pd-1抗体以约5mg/kg体重的剂量约每3周施用一次。在另一方面,将所述抗pd-1抗体(例如,纳武单抗)以约3mg/kg体重的剂量约每2周施用一次。在其他方面,将所述抗pd-1抗体(例如,派姆单抗)以约2mg/kg体重的剂量约每3周施用一次。
[0217]
可以将可用于本公开文本的抗pd-1抗体以平剂量施用。在一些方面,将所述抗pd-1抗体以从约100至约1000mg、从约100mg至约900mg、从约100mg至约800mg、从约100mg至约700mg、从约100mg至约600mg、从约100mg至约500mg、从约200mg至约1000mg、从约200mg至约900mg、从约200mg至约800mg、从约200mg至约700mg、从约200mg至约600mg、从约200mg至约500mg、从约200mg至约480mg或从约240mg至约480mg的平剂量施用。在一个方面,将所述抗pd-1抗体以约1、2、3、4、5、6、7、8、9或10周的给药间隔以至少约200mg、至少约220mg、至少约240mg、至少约260mg、至少约280mg、至少约300mg、至少约320mg、至少约340mg、至少约360mg、至少约380mg、至少约400mg、至少约420mg、至少约440mg、至少约460mg、至少约480mg、至少约500mg、至少约520mg、至少约540mg、至少约550mg、至少约560mg、至少约580mg、至少约600mg、至少约620mg、至少约640mg、至少约660mg、至少约680mg、至少约700mg或至少约720mg的平剂量施用。在另一方面,将所述抗pd-1抗体以约1、2、3或4周的给药间隔以如下平剂量施用:约200mg至约800mg、约200mg至约700mg、约200mg至约600mg、约200mg至约500mg。
[0218]
在一些方面,将所述抗pd-1抗体以约200mg的平剂量约每3周施用一次。在其他方面,将所述抗pd-1抗体以约200mg的平剂量约每2周施用一次。在其他方面,将所述抗pd-1抗体以约240mg的平剂量约每2周施用一次。在某些方面,将所述抗pd-1抗体以约480mg的平剂量约每4周施用一次。
[0219]
在一些方面,将纳武单抗以约240mg的平剂量约每2周施用一次。在一些方面,将纳武单抗以约240mg的平剂量约每3周施用一次。在一些方面,将纳武单抗以约360mg的平剂量约每3周施用一次。在一些方面,将纳武单抗以约480mg的平剂量约每4周施用一次。
[0220]
在一些方面,将派姆单抗以约200mg的平剂量约每2周施用一次。在一些方面,将派姆单抗以约200mg的平剂量约每3周施用一次。在一些方面,将派姆单抗以约400mg的平剂量约每4周施用一次。v.可用于本公开文本的抗pd-l1抗体
[0221]
在本公开文本的某些方面,抗pd-1拮抗剂是抗pd-l1抗体或其抗原结合部分。本领域已知的抗pd-l1抗体可以用于本公开文本的组合物和方法中。可用于本公开文本的组合物和方法中的抗pd-l1抗体的例子包括美国专利号9,580,507中披露的抗体。已经证明美国专利号9,580,507中披露的抗pd-l1人单克隆抗体展现出以下特征中的一种或多种:(a)以1x10-7m或更小的kd与人pd-l1结合,如使用biacore生物传感器系统通过表面等离子体共振确定的;(b)在混合淋巴细胞反应(mlr)测定中增加t细胞增殖;(c)在mlr测定中增加干扰素-γ产生;(d)在mlr测定中增加il-2分泌;(e)刺激抗体应答;以及(f)逆转t调节细胞对t细胞效应细胞和/或树突细胞的作用。可用于本公开文本中的抗pd-l1抗体包括与人pd-l1
特异性结合并且展现出前述特征中的至少一种、在一些方面至少五种的单克隆抗体。
[0222]
在某些方面,所述抗pd-l1抗体选自bms-936559(也称为12a4、mdx-1105;参见例如美国专利号7,943,743和wo 2013/173223)、阿特珠单抗(atezolizumab)(roche;也称为mpdl3280a、rg7446;参见us 8,217,149;还参见herbst等人.(2013)j clin oncol 31(增刊):3000)、度伐鲁单抗(durvalumab)(astrazeneca;也称为imfinzi
tm
、medi-4736;参见wo 2011/066389)、阿维鲁单抗(avelumab)(pfizer;也称为msb-0010718c;参见wo 2013/079174)、sti-1014(sorrento;参见wo2013/181634)、cx-072(cytomx;参见wo 2016/149201)、kn035(3d med/alphamab;参见zhang等人,cell discov.7:3(2017年3月)、ly3300054(eli lilly co.;参见例如wo 2017/034916)、bgb-a333(beigene;参见desai等人,jco 36(15增刊):tps3113(2018))以及ck-301(checkpoint therapeutics;参见gorelik等人,aacr:abstract 4606(2016年4月))。
[0223]
在某些方面,所述pd-l1抗体是阿特珠单抗阿特珠单抗是完全人源化igg1单克隆抗pd-l1抗体。在某些方面,所述pd-l1抗体是度伐鲁单抗(imfinzi
tm
)。度伐鲁单抗是人igg1κ单克隆抗pd-l1抗体。在某些方面,所述pd-l1抗体是阿维鲁单抗阿维鲁单抗是人igg1λ单克隆抗pd-l1抗体。
[0224]
可用于所公开的组合物和方法中的抗pd-l1抗体还包括分离的抗体,其与人pd-l1特异性结合并且与本文所公开的任何抗pd-l1抗体(例如,阿特珠单抗、度伐鲁单抗和/或阿维鲁单抗)交叉竞争与人pd-l1的结合。在一些方面,所述抗pd-l1抗体与本文所述的任何抗pd-l1抗体(例如,阿特珠单抗、度伐鲁单抗和/或阿维鲁单抗)结合相同的表位。抗体交叉竞争结合抗原的能力指示这些抗体结合抗原的相同表位区域并且在空间上阻碍其他交叉竞争抗体与该特定表位区域的结合。预期这些交叉竞争抗体由于它们结合pd-l1的相同表位区域而具有与参考抗体(例如,阿特珠单抗和/或阿维鲁单抗)非常相似的功能特性。在标准pd-l1结合测定(如biacore分析、elisa测定或流式细胞术)中可以基于交叉竞争抗体与阿特珠单抗和/或阿维鲁单抗交叉竞争的能力容易地鉴定它们(参见例如,wo 2013/173223)。
[0225]
在某些方面,与阿特珠单抗、度伐鲁单抗和/或阿维鲁单抗交叉竞争与人pd-l1的结合或与阿特珠单抗、度伐鲁单抗和/或阿维鲁单抗结合人pd-l1抗体的相同表位区域的抗体是单克隆抗体。对于施用于人受试者,这些交叉竞争抗体是嵌合抗体、工程化抗体或者人源化抗体或人抗体。可以通过本领域熟知的方法来制备和分离此类嵌合、工程化、人源化或人单克隆抗体。
[0226]
可用于所公开的公开文本的组合物和方法中的抗pd-l1抗体还包括上述抗体的抗原结合部分。已经充分地证明,抗体的抗原结合功能可以通过全长抗体的片段来执行。
[0227]
适用于所公开的组合物和方法的抗pd-l1抗体是以高特异性和亲和力与pd-l1结合、阻断pd-1的结合并且抑制pd-1信号传导途径的免疫抑制作用的抗体。在本文所公开的任何组合物或方法中,抗pd-l1“抗体”包括与pd-l1结合并且在抑制受体结合和上调免疫系统方面展现出与完整抗体相似的功能特性的抗原结合部分或片段。在某些方面,所述抗pd-l1抗体或其抗原结合部分与阿特珠单抗、度伐鲁单抗和/或阿维鲁单抗交叉竞争与人pd-l1的结合。
[0228]
可用于本公开文本的抗pd-l1抗体可以是与pd-l1特异性结合的任何pd-l1抗体,
例如与度伐鲁单抗、阿维鲁单抗或阿特珠单抗交叉竞争与人pd-1的结合的抗体,例如与度伐鲁单抗、阿维鲁单抗或阿特珠单抗结合相同表位的抗体。在特定方面,所述抗pd-l1抗体是度伐鲁单抗。在其他方面,所述抗pd-l1抗体是阿维鲁单抗。在一些方面,所述抗pd-l1抗体是阿特珠单抗。
[0229]
在一些方面,将所述抗pd-l1抗体以如下范围的剂量约每2、3、4、5、6、7或8周施用一次:从约0.1mg/kg至约20.0mg/kg体重、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg或约20mg/kg。
[0230]
在一些方面,将所述抗pd-l1抗体以约15mg/kg体重的剂量约每3周施用一次。在其他方面,将所述抗pd-l1抗体以约10mg/kg体重的剂量约每2周施用一次。
[0231]
在其他方面,可用于本公开文本的抗pd-l1抗体是平剂量。在一些方面,将所述抗pd-l1抗体以约200mg至约1600mg、约200mg至约1500mg、约200mg至约1400mg、约200mg至约1300mg、约200mg至约1200mg、约200mg至约1100mg、约200mg至约1000mg、约200mg至约900mg、约200mg至约800mg、约200mg至约700mg、约200mg至约600mg、约700mg至约1300mg、约800mg至约1200mg、约700mg至约900mg或约1100mg至约1300mg的平剂量施用。在一些方面,将所述抗pd-l1抗体以至少约240mg、至少约300mg、至少约320mg、至少约400mg、至少约480mg、至少约500mg、至少约560mg、至少约600mg、至少约640mg、至少约700mg、至少720mg、至少约800mg、至少约840mg、至少约880mg、至少约900mg、至少960mg、至少约1000mg、至少约1040mg、至少约1100mg、至少约1120mg、至少约1200mg、至少约1280mg、至少约1300mg、至少约1360mg或至少约1400mg的平剂量以约1、2、3或4周的给药间隔施用。在一些方面,将所述抗pd-l1抗体以约1200mg的平剂量约每3周施用一次。在其他方面,将所述抗pd-l1抗体以约800mg的平剂量约每2周施用一次。在其他方面,将所述抗pd-l1抗体以约840mg的平剂量约每2周施用一次。
[0232]
在一些方面,将阿特珠单抗以约1200mg的平剂量约每3周施用一次。在一些方面,将阿特珠单抗以约800mg的平剂量约每2周施用一次。在一些方面,将阿特珠单抗以约840mg的平剂量约每2周施用一次。
[0233]
在一些方面,将阿维鲁单抗以约800mg的平剂量约每2周施用一次。
[0234]
在一些方面,将度伐鲁单抗以约10mg/kg的剂量约每2周施用一次。在一些方面,将度伐鲁单抗以约800mg/kg的平剂量约每2周施用一次。在一些方面,将度伐鲁单抗以约1200mg/kg的平剂量约每3周施用一次。vi.癌症
[0235]
在一些方面,癌症是肿瘤,即实体癌。在其他方面,癌症是上皮来源的肿瘤,即癌。在一些方面,肿瘤源自选自膀胱癌、宫颈癌、肺癌、胰腺癌、肾癌、头颈癌、肝细胞癌、胶质母细胞瘤、黑色素瘤或子宫内膜癌的癌症。在一些方面,肿瘤不是黑色素瘤。
[0236]
在某些方面,肿瘤源自具有高ifnγ炎症特征得分的癌症。在某些方面,肿瘤源自膀胱,其中所述肿瘤具有高ifnγ炎症特征得分。在某些方面,肿瘤源自宫颈癌,其中所述肿瘤具有高ifnγ炎症特征得分。在某些方面,肿瘤源自肺癌,其中所述肿瘤具有高ifnγ炎症特征得分。在某些方面,肿瘤源自胰腺癌,其中所述肿瘤具有高ifnγ炎症特征得分。在某些方面,肿瘤源自肾癌,其中所述肿瘤具有高ifnγ炎症特征得分。在一些方面,肿瘤源自头颈
癌,其中所述肿瘤具有高ifnγ炎症特征得分。在一些方面,肿瘤源自肝细胞癌,其中所述肿瘤具有高ifnγ炎症特征得分。在一些方面,肿瘤源自胶质母细胞瘤,其中所述肿瘤具有高ifnγ炎症特征得分。在一些方面,肿瘤源自黑色素瘤,其中所述肿瘤具有高ifnγ炎症特征得分。在一些方面,肿瘤源自子宫内膜癌,其中所述肿瘤具有高ifnγ炎症特征得分。
[0237]
在某些方面,肿瘤源自具有低tdo2基因表达得分的癌症。在某些方面,肿瘤源自膀胱,其中所述肿瘤具有低tdo2基因表达得分。在某些方面,肿瘤源自宫颈癌,其中所述肿瘤具有低tdo2基因表达得分。在某些方面,肿瘤源自肺癌,其中所述肿瘤具有低tdo2基因表达得分。在某些方面,肿瘤源自胰腺癌,其中所述肿瘤具有低tdo2基因表达得分。在一些方面,肿瘤源自肾癌,其中所述肿瘤具有低tdo2基因表达得分。在一些方面,肿瘤源自头颈癌,其中所述肿瘤具有低tdo2基因表达得分。在一些方面,肿瘤源自肝细胞癌,其中所述肿瘤具有低tdo2基因表达得分。在一些方面,肿瘤源自胶质母细胞瘤,其中所述肿瘤具有低tdo2基因表达得分。在一些方面,肿瘤源自黑色素瘤,其中所述肿瘤具有低tdo2基因表达得分。在一些方面,肿瘤源自子宫内膜癌,其中所述肿瘤具有低tdo2基因表达得分。
[0238]
在某些方面,肿瘤源自具有高ifnγ炎症特征得分和低tdo2基因表达得分的癌症。在某些方面,肿瘤源自膀胱,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。在某些方面,肿瘤源自宫颈癌,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。在某些方面,肿瘤源自肺癌,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。在某些方面,肿瘤源自胰腺癌,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。在一些方面,肿瘤源自肾癌,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。在一些方面,肿瘤源自头颈癌,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。在一些方面,肿瘤源自肝细胞癌,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。在一些方面,肿瘤源自胶质母细胞瘤,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。在一些方面,肿瘤源自黑色素瘤,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。在一些方面,肿瘤源自子宫内膜癌,其中所述肿瘤具有高ifnγ炎症特征得分和低tdo2基因表达得分。
[0239]
在一些方面,肺癌是非小细胞肺癌(nsclc)。在一些方面,肾癌是肾细胞癌(rcc)。在一些方面,头颈癌是头颈鳞状细胞癌(scchn)。在一些方面,胶质母细胞瘤是多形性胶质母细胞瘤(gbm)。
[0240]
在一些方面,癌症是血液癌症。在一些方面,血液癌症是淋巴瘤。在一些方面,淋巴瘤是弥漫性大b细胞淋巴瘤(dlbcl)。在一些方面,血液癌症(例如淋巴瘤)具有高ifnγ炎症特征得分。在一些方面,血液癌症(例如淋巴瘤)具有低tdo2基因表达得分。在一些方面,血液癌症(例如淋巴瘤)具有高ifnγ炎症特征得分和低tdo2基因表达得分。
[0241]
在某些方面,所述受试者已经接受过一种、两种、三种、四种、五种或更多种先前癌症治疗。在其他方面,所述受试者是未经治疗的。在一些方面,所述受试者在其他癌症治疗时发生了进展。在某些方面,所述先前癌症治疗包括免疫疗法。在其他方面,所述先前癌症治疗包括化学疗法。在一些方面,所述肿瘤已经复发。在一些方面,所述肿瘤是转移性的。在其他方面,所述肿瘤不是转移性的。在一些方面,所述肿瘤是局部晚期的。
[0242]
在一些方面,所述受试者已经接受过先前疗法来治疗所述肿瘤并且所述肿瘤是复发性或难治性的。在某些方面,所述至少一种先前疗法包括标准护理疗法。在一些方面,所
述至少一种先前疗法包括手术、放射疗法、化学疗法、免疫疗法或其任何组合。在一些方面,所述至少一种先前疗法包括化学疗法。在一些方面,所述受试者已经接受过先前免疫肿瘤学(i-o)疗法来治疗所述肿瘤并且所述肿瘤是复发性或难治性的。在一些方面,所述受试者已经接受过超过一种先前疗法来治疗所述肿瘤并且所述受试者是复发性或难治性的。在其他方面,所述受试者已经接受过抗pd-1或抗pd-l1抗体疗法。
[0243]
在一些方面,先前疗法线包括化学疗法。在一些方面,先前疗法线包括施用抗癌剂,所述抗癌剂选自铂药剂(例如,顺铂、卡铂)、紫杉烷类药剂(例如,紫杉醇、白蛋白结合型紫杉醇、多西他赛)、长春瑞滨、长春碱、依托泊苷、培美曲塞、吉西他滨、贝伐单抗厄洛替尼克唑替尼西妥昔单抗及其任何组合。
[0244]
在一些方面,所述受试者在所述至少一种先前疗法之后经历了疾病进展。在某些方面,受试者已经接受至少两种先前疗法、至少三种先前疗法、至少四种先前疗法或至少五种先前疗法。在某些方面,所述受试者已经接受至少两种先前疗法。在一个方面,所述受试者在所述至少两种先前疗法之后经历了疾病进展。在某些方面,所述至少两种先前疗法包括第一先前疗法和第二先前疗法,其中受试者在第一先前疗法和/或第二先前疗法之后经历了疾病进展,并且其中第一先前疗法包括手术、放射疗法、化学疗法、免疫疗法或其任何组合;并且其中第二先前疗法包括手术、放射疗法、化学疗法、免疫疗法或其任何组合。在一些方面,所述第一先前疗法包括基于铂的双药化学疗法,并且第二先前疗法包括单一药剂化学疗法。在某些方面,所述单一药剂化学疗法包括多西他赛。vii.药物组合物和剂量
[0245]
本公开文本的治疗剂,例如抗pd-1拮抗剂(例如纳武单抗)和ido1抑制剂(例如甲磺酸林罗司他)可以构成在组合物中,例如含有抗pd-1拮抗剂(例如纳武单抗)和/或ido1抑制剂(例如甲磺酸林罗司他)和药学上可接受的载体的药物组合物。如本文所用,“药学上可接受的载体”包括生理上可相容的任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。在一些方面,用于含有抗体(例如抗pd-1抗体如纳武单抗)的组合物的载体适合于静脉内、肌肉内、皮下、肠胃外、脊柱或表皮施用(例如,通过注射或输注),而用于含有ido1抑制剂如甲磺酸林罗司他的组合物的载体适合于非肠胃外(例如,口服)施用。
[0246]
在一些方面,所述皮下注射是基于halozyme therapeutics的药物递送技术(参见美国专利号7,767,429,将其通过引用以其整体并入本文)。使用抗体与重组人透明质酸酶(rhuph20)的共配制品,其消除了由于细胞外基质而对可皮下递送的生物制剂和药物的体积的传统限制(参见美国专利号7,767,429)。
[0247]
本公开文本的药物组合物可以包括一种或多种药学上可接受的盐、抗氧化剂、水性和非水性载体、和/或佐剂,如防腐剂、润湿剂、乳化剂和分散剂。因此,在一些方面,用于本公开文本的药物组合物可以还包含重组人透明质酸酶(例如,rhuph20)。
[0248]
尽管已经达到了高达每两周一次10mg/kg的较高纳武单抗单一疗法给药而未达到最大耐受剂量(mtd),但在检查点抑制剂加抗血管生成疗法的其他试验中报告的显著毒性(参见例如,johnson等人,2013;rini等人,2011)支持选择低于10mg/kg的纳武单抗剂量。
[0249]
只要观察到临床益处就继续治疗或直到出现不可接受的毒性或疾病进展。然而,在某些方面,所施用的抗pd-1拮抗剂(例如,抗pd-1抗体或抗pd-l1抗体)和/或ido1抑制剂(例如甲磺酸林罗司他)的剂量显著低于所述药剂的批准剂量,即亚治疗剂量。
[0250]
可以将抗pd-1拮抗剂(例如,抗pd-1抗体或抗pd-l1抗体)以这样的剂量施用,已经显示其在临床试验中作为单一疗法产生最高功效,例如每三周施用一次的约3mg/kg纳武单抗(topalian等人,2012a;topalian等人,2012);或者以显著更低的剂量即以亚治疗剂量施用。在一些方面,将ido1抑制剂(例如林罗司他)以亚治疗剂量施用。
[0251]
剂量和频率根据抗体(例如纳武单抗)和ido1抑制剂(例如甲磺酸林罗司他)在受试者体内的半衰期而变化。通常,人抗体显示出最长的半衰期,其次是人源化抗体、嵌合抗体和非人抗体。施用的剂量和频率可以根据治疗是预防性的还是治疗性的而变化。在预防性应用中,通常以相对不频繁的间隔长时间施用相对低的剂量。一些患者在余生持续接受治疗。在治疗性应用中,有时需要以相对短的间隔相对高的剂量,直到疾病的进展减少或终止,并且优选直到患者显示疾病症状的部分或完全改善。此后,可以向患者施用预防性方案。
[0252]
本公开文本的药物组合物中活性成分的实际剂量水平可以改变以便获得对于特定患者、组合物和施用方式有效实现所需治疗反应而不会对患者造成过度毒性的量的活性成分。
[0253]
所选择的剂量水平将取决于多种药代动力学因素,包括所采用的本公开文本的特定组合物的活性,施用途径,施用时间,所采用的特定化合物的排泄速率,治疗持续时间,与所采用的特定组合物组合使用的其他药物、化合物和/或材料,所治疗患者的年龄、性别、体重、病症、一般健康状况和既往病史,以及医学领域熟知的类似因素。
[0254]
可以使用本领域熟知的多种方法中的一种或多种,通过一种或多种施用途径来施用本公开文本的组合物。如熟练技术人员将理解的,施用的途径和/或模式将根据期望的结果而变化。viii.试剂盒、制品和基因组套
[0255]
用于治疗用途例如治疗癌症的包含(a)一定剂量的抗pd-1拮抗剂(例如抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体)和(b)一定剂量的ido1抑制剂(例如林罗司他)的试剂盒和制品也在本公开文本的范围内。试剂盒通常包括指示试剂盒内容物的预期用途的标签和如下使用说明书,例如,如果受试者被鉴定为具有(a)高ifnγ炎症特征得分和(b)低色氨酸2,3-双加氧酶2(tdo2)基因表达得分,则将抗pd-1拮抗剂(例如,抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体)和ido1抑制剂(例如林罗司他)施用于患有癌症(例如肿瘤)的受试者。术语标签包括在试剂盒或制品上或与试剂盒或制品一起提供的任何书写或记录材料,或者试剂盒或制品以其他方式附带的材料。术语标签还涵盖以电子方式分布和/或可例如经由网络服务器通过电子方式访问的说明书。
[0256]
在一个方面,本公开文本提供了用于治疗患有癌症的受试者的试剂盒或制品,所述试剂盒包含(a)一定剂量的抗pd-1拮抗剂(例如纳武单抗),(b)一定剂量的ido1抑制剂(例如林罗司他),和(c)根据本文公开的方法使用抗pd-1抗体或抗pd-l1抗体和ido1抑制剂的说明书。在一个方面,本公开文本提供了用于治疗患有癌症的受试者的试剂盒或制品,所述试剂盒包含(a)一定剂量的抗pd-1拮抗剂(例如纳武单抗),和(b)根据本文公开的方法使
用抗pd-1抗体或抗pd-l1抗体的说明书。在一个方面,本公开文本提供了用于治疗患有癌症的受试者的试剂盒或制品,所述试剂盒包含(a)一定剂量的抗ido1抑制剂(例如林罗司他),和(b)根据本文公开的方法使用ido1抑制剂的说明书。
[0257]
本领域技术人员将容易地认识到,本公开文本的试剂盒可以含有,例如,(a)在一个或多个小瓶中的抗pd-1拮抗剂(例如抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体),以及在一些方面附带包含一种或多种溶剂的一个或多个另外的小瓶;(b)在一个或多个小瓶中的ido1抑制剂(例如林罗司他),以及在一些方面包含一种或多种溶剂的一个或多个另外的小瓶;(c)用以确定ifnγ炎症特征得分的测定;(d)用以确定色氨酸2,3-双加氧酶2(tdo2)基因表达得分的测定;(e)进行和定量ifnγ炎症特征得分测定和/或tdo2基因表达得分测定的说明书;(f)施用抗pd-1拮抗剂和/或ido1抑制剂的说明书;(g)确定是否根据本文公开的方法向受试者施用抗pd-1拮抗剂和/或ido1抑制剂的说明书(例如,如果受试者被鉴定为具有(i)高ifnγ炎症特征得分和(ii)低色氨酸2,3-双加氧酶2(tdo2)基因表达得分);(h)其任何组合。
[0258]
本领域技术人员还将容易地认识到,试剂盒或制品可包含上文公开的任何组分或其组合,并且它们可容易地并入本领域熟知的已建立的试剂盒形式中的一种中或作为伴随诊断的一部分。
[0259]
因此,本公开文本提供了一种用于治疗患有癌症(例如肿瘤)的受试者的试剂盒或制品,所述试剂盒或制品包含:(a)剂量范围为从0.1至10mg/kg体重的抗pd-1抗体(例如纳武单抗)或剂量范围为从0.1至20mg/kg体重的抗pd-l1抗体;和(b)用于根据本文公开的方法使用抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体的说明书。
[0260]
本公开文本还提供了一种用于治疗患有癌症(例如肿瘤)的受试者的试剂盒或制品,所述试剂盒包含:(a)剂量范围为从约4mg至约500mg的抗pd-1抗体(例如纳武单抗)或剂量范围为从约4mg至约2000mg的抗pd-l1抗体;和(b)用于根据本文公开的方法使用抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体的说明书。
[0261]
在一些方面,本公开文本提供了一种用于治疗患有癌症(例如肿瘤)的受试者的试剂盒或制品,所述试剂盒或制品包含:(a)剂量范围为从200mg至800mg的抗pd-1抗体(例如纳武单抗)或剂量范围为从200mg至1800mg的抗pd-l1抗体;和(b)用于根据本文公开的方法使用抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体的说明书。
[0262]
在用于治疗患有癌症(例如肿瘤)的人患者的某些方面,试剂盒或制品包含本文公开的抗人pd-1抗体(例如纳武单抗或派姆单抗)或其抗原结合部分。在用于治疗患有癌症(例如肿瘤)的人患者的某些方面,试剂盒或制品包含本文公开的抗人pd-l1抗体(例如阿特珠单抗、度伐鲁单抗或阿维鲁单抗)或其抗原结合部分。
[0263]
在一些方面,试剂盒或制品还包括ido1抑制剂(例如林罗司他)和根据本文公开的方法将(a)抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体和(b)ido1抑制剂(例如林罗司他)施用于被鉴定为具有(a)高ifnγ炎症特征得分和(b)低色氨酸2,3-双加氧酶2(tdo2)基因表达的受试者的说明书。
[0264]
在一些方面,试剂盒还包括本文公开的炎症基因组套测定,例如定量ifnγ炎症特征得分的基因组套测定和/或定量色氨酸2,3-双加氧酶2(tdo2)基因表达得分的基因测定。在一些方面,试剂盒或制品还包括根据本文公开的方法将(a)抗pd-1抗体(例如纳武单抗)或抗pd-l1抗体和(b)ido1抑制剂(例如林罗司他)施用于被鉴定为具有(a)高ifnγ炎症特征得分和(b)低色氨酸2,3-双加氧酶2(tdo2)基因表达得分的受试者的说明书。
[0265]
在一些方面,本公开文本提供了至少包含ifnγ和tdo2基因的基因组套,其用于(i)鉴定适合于用包含抗pd-1拮抗剂和ido1抑制剂的组合治疗的受试者;(ii)确定用包含抗pd-1拮抗剂和ido1抑制剂的组合进行治疗的受试者的预后;(iii)开始、暂停或改变包含抗pd-1拮抗剂和ido1抑制剂的组合的施用;或者(iv)其组合。
[0266]
在一些方面,所述基因组套包含(i)ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1和tdo2;(ii)ifnγ、cxcl10、cxcl9、hla-dra、ido1、stat1、ccr5、cxcl11、gzma、prf1和tdo2;(iii)cxcr6、tigit、cd274(pd-l1)、pdcd1lg2(pd-l2)、lag3、nkg7、psmb10、cmklr1、cd8a、ido1、ccl5、cxcl9、hla.dqa1、cd276、hla.drb1、stat1、hla.e和tdo2;或(iv)ifnγ、ir2rg、cxcr6、cd3d、cd2、itgal、tagap、ciita、hla-dra、ptprc、cxcl9、ccl5、nkg7、gzma、prf1、ccr5、cd3e、gzmk、hla-e、gzmb、pdcd1、slamf6、cxcl13、cxcl10、ido1、lag3、stat1、cxcl11和tdo2。
[0267]
在一些方面,本公开文本提供了用于检测和/或定量基因组套中的基因和/或它们的表达产物(例如,mrna或蛋白质)的一组试剂(例如,抗体)或阵列(例如,寡核苷酸阵列),以及根据本公开文本的方法使用试剂或阵列作为预测性生物标记物的说明书。***
[0268]
将以上引用的所有参考文献以及本文引用的所有参考文献均通过引用以其整体并入本文。
[0269]
通过说明的方式而不是通过限制的方式,提供以下实施例。实施例实施例1生物标记物样品和评估
[0270]
开发了临床试验以检查使用纳武单抗和ido1抑制剂林罗司他的组合疗法在患有晚期肿瘤的患者中的效果(临床试验标识符nct02658890)。
[0271]
临床试验的第1部分涉及在选择的先前治疗的晚期肿瘤中的剂量递增研究。允许先前治疗免疫检查点抑制剂和靶向t细胞共刺激的疗法。患者用240mg纳武单抗治疗(静脉内,每两周一次),并且每天口服不同剂量(25mg、50mg、100mg、200mg、400mg、600mg或800mg)的林罗司他。临床试验的第2部分涉及剂量扩展研究。这些患者用纳武单抗单一疗法(240mg,静脉内,每两周一次)或纳武单抗和林罗司他组合疗法(静脉内每四周一次480mg纳武单抗,和每天口服100mg或200mg林罗司他)治疗。
[0272]
血清和肿瘤样品取自参与研究的剂量扩展阶段(第2部分)的患者。在基线(第1周期,第1天;c1d1)和治疗期间(第1周期,第15天;c1d15),从患有实体瘤(膀胱、宫颈、黑色素
瘤、肺、胰腺、肾细胞、头颈部)或淋巴瘤的患者获得肿瘤和血清样品。这些样品随后用于通过液相色谱-质谱法定量kyn和色氨酸水平。还获得基线时的实体瘤样品并进行福尔马林固定、石蜡包埋。这些样品用于通过rna测序来定量ifn-γ特征基因、ido1和tdo2表达水平。图1a和图1b示出了从总患者群体中获得的每种肿瘤类型的百分比。实施例2ifnγ特征与临床反应的关联
[0273]
先前已确立可预测黑色素瘤中对pd-1检查点阻断的反应的ifnγ基因特征(ayers等人j clin invest.2017;127(8):2930-2940)。在本实施例中,检查ifnγ特征基因的表达与对纳武单抗和林罗司他组合疗法的临床反应之间的关联。通过对福尔马林固定的石蜡包埋的实体瘤样品进行rna测序来定量ifnγ特征基因的表达。通过将肿瘤分成五组来确定临床反应:不可评价(ne)、疾病进展(pd)、疾病稳定(sd)、部分反应(pr)和完全反应(cr)。ifn-γ特征基因的表达与用纳武单抗和林罗司他治疗的患者的改善的临床反应相关(图2a和图2b)。实施例3ifn-γ特征与无进展存活期和总存活期的关联
[0274]
评价了ifnγ特征基因的表达与用纳武单抗和林罗司他治疗的患者的存活的关联。根据ifnγ特征基因表达将患者分为三组:低、中或高表达。以200天增量监测患者存活期直到600天。在用纳武单抗和林罗司他治疗的免疫肿瘤学初治患者中,高ifnγ特征与改善的无进展存活期(图3a和表2)和总存活期(图3b和表3)相关。表2.基于无进展存活期的存活患者数表3.基于总存活期的存活患者数实施例4肿瘤tdo2表达对kyn减少的影响
[0275]
在来自用纳武单抗和林罗司他治疗的患者的tdo2高和tdo2低肿瘤中检查kyn表达水平。
[0276]
在基线(第1周期,第1天;c1d1)和治疗期间(周期1,第15天;c1d15),从患者获得肿瘤和血清样品。低肿瘤tdo2表达与肿瘤(图4a)和血清(图4b)中kyn的更大减少和kyn减少至正常水平相关。高肿瘤tdo2表达与kyn被较少抑制(特别是在肿瘤中)相关。实施例5tdo2表达与反应的关联
[0277]
由于林罗司他选择性抑制ido1但不抑制tdo2酶活性,因此高tdo2表达可驱动对纳
武单抗和林罗司他组合疗法的耐药性。因此,评价tdo2表达和临床反应之间的关联。通过中值确定高或低tdo2表达水平。基于客观反应率,26%的低tdo2表达患者对治疗有反应,而仅13%的高tdo2表达患者对治疗有反应(表4)。在用纳武单抗和林罗司他治疗的非黑色素瘤样品中的反应者中观察到低tdo2表达(图5a)。使用纳武单抗单一疗法没有观察到tdo2表达和反应之间的关联(图5b)。表4.tdo2表达与客观反应率的关联实施例6ifnγ特征和tdo2表达与客观反应率的关联
[0278]
评价所有肿瘤的ifn-γ和tdo2与客观反应率的关联。高ifnγ特征和低tdo2表达与免疫肿瘤学初治患者对纳武单抗和林罗司他治疗的最高反应率相关(图6a)。低ifnγ特征和高tdo2表达与免疫肿瘤学初治患者对纳武单抗和林罗司他治疗无反应相关。另外,在非黑色素瘤亚组(n=49)中,与仅ifnγ特征(p=0.063)相比,ifnγ特征和tdo2基因表达的复合生物标记物与反应(p=0.021)更显著相关(图6b)。实施例7在非黑色素瘤队列中作为复合生物标记物的ifn-γ特征和tdo2表达胜过仅ifnγ
[0279]
将表达ifnγ特征基因和tdo2作为复合生物标记物的灵敏度和特异性与仅ifnγ特征基因表达进行比较。在非黑色素瘤亚组(n=49)中,在免疫肿瘤学初治患者(n=79)中,复合生物标记物ifnγ和tdo2表达(图7b)作为反应预测因子比仅ifnγ特征(图7a)在数值上表现得更好。在黑色素瘤亚组(n=30)中,与仅ifnγ特征[auc 77%(95%ci,59-95)]相比,ifnγ特征和tdo2表达[auc 79%(95%ci,62-95)]在反应预测方面没有显示差异。因此,ifnγ特征和tdo2基因表达可用作复合生物标记物以鉴定患有更可能对甲磺酸林罗司他和纳武单抗治疗有反应的某些肿瘤类型的患者。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。