1.本发明系关于免疫检查点抑制剂的有效性的评估。详细而言,本发明系关于使用电纺纤维管鉴别有效免疫检查点抑制剂。
背景技术:
2.癌症免疫疗法为一个快速发展的领域,其已取得令人印象深刻且有前景的突破。免疫疗法的基础为免疫系统的操作及/或调节,包括先天性免疫反应及应变性免疫反应两者。在正常条件下,免疫检查点需要维持活化信号与抑制信号之间的平衡且在免疫系统对外来物或病原剂作出反应时确保形成有效免疫反应同时防护避免自体免疫的发生或对组织造成损害。重要的免疫检查点受体为表现于t细胞上且高度表现于调节性t细胞(treg)上的ctla-4。认为ctla-4充当抑制性分子或免疫反应「制动」且主要调节t细胞活化的幅度。另一重要免疫检查点受体为pd-1,其在活化之后表现于t细胞上、高度表现于treg上且表现于包括b细胞及自然杀手(nk)细胞的其他活化细胞上。与ctla-4类似,认为pd-1充当抑制性分子及针对免疫反应的「制动」。
3.调节癌症免疫性的药剂的首次临床成功已证实作为新颖路径的癌症免疫疗法在癌症患者中获得持久且长效的临床反应。获得用于治疗转移性黑素瘤的销售批准的第一此类药剂伊匹单抗(ipilimumab)(yervoy,bms)为阻断ctla4受体(免疫检查点蛋白)的抗体。在研发下的其他免疫检查点抑制剂为阻断pd-1受体与其配位体pd-l1及pd-l2之间的相互作用的抗体。靶向pd-1路径的若干抗体目前处于用于治疗黑素瘤、肾细胞癌、非小细胞肺癌、弥漫性大b细胞淋巴瘤及其他肿瘤的临床研发中。然而,利用免疫检查点阻断的治疗具有较低反应率。
4.免疫疗法评估面对来自药物研发的最早阶段的许多挑战。已研发出许多活体外分析来筛选及评估免疫细胞介导的杀灭的功效。然而,在活体外分析结果与临床结果之间存在极大差距。此外,研发多种活体内动物模型以评估免疫检查点抑制剂的有效性。然而,其通常花费长时间,需要特定小鼠(诸如免疫缺乏动物及人类化小鼠)及多个实验室小鼠来完成活体内分析。尽管us 5,676,924提供一种测定癌症疗法的有效性的方法,其藉由将肿瘤细胞密封于半透膜中空纤维的片段中,将经密封的纤维片段植入于哺乳动物中,用癌症疗法治疗所述哺乳动物及评估癌症疗法对中空纤维片段中的细胞的作用。但us5,676,924中所揭露的方法不适于评估免疫反应中的化合物。
5.因此,由于难以预测免疫检查点抑制剂的治疗有效性,因此非常需要鉴别适用于诊断及治疗目的的免疫检查点抑制剂。
技术实现要素:
6.本发明提供一种活体内筛选免疫检查点抑制剂的方法,其包含(a)将黏附肿瘤细胞及悬浮免疫细胞活体外共培养于微管数组膜(mtam)的内腔内,其中所述mtam包含一或多层静电纺纤维集合体,其具有高度对齐且紧密填充的奈米尺寸的中空纤维;(b)将所述膜移
植至非人类动物中;及(c)向所述非人类动物投与免疫检查点抑制剂;(d)分离所述肿瘤细胞与所述免疫细胞;及(e)测定所述肿瘤细胞的细胞存活率或所述免疫细胞的活性,或测定所述肿瘤或免疫细胞中的免疫检查点蛋白表现;其中若所述肿瘤细胞的细胞存活率显著低于对照组的细胞存活率或所述免疫细胞的活性显著高于对照组的活性;或若所述肿瘤或免疫细胞中的免疫检查点蛋白表现相对于对照组改变,则所述免疫检查点抑制剂具有抗肿瘤作用。
7.在一个实施例中,所述纤维具有自其内表面延伸的奈米级毛发状结构。在一些实施例中,毛发状结构的长度介于100nm至1μm范围内或毛发状结构的纵横比至多15:1。在另一个实施例中,毛发状结构的表面覆盖率为约10%至约80%。
8.在某些实施例中,所述黏附肿瘤细胞或所述悬浮免疫细胞以约1
×
104个细胞/μl至1
×
107个细胞/μl的浓度接种。黏附肿瘤细胞的某些实施例包含以下的细胞:肝细胞癌、结肠直肠癌、神经胶母细胞瘤、胃癌、食道癌、非小细胞肺癌(nsclc)、胰脏癌、肾细胞癌、良性前列腺增生、前列腺癌、卵巢癌、黑素瘤、乳癌、慢性淋巴球性白血病(cll)、梅克尔细胞癌(merkel cell carcinoma)、小细胞肺癌(sclc)、非霍奇金淋巴瘤(non-hodgkin lymphoma)、急性骨髓白血病(aml)、胆囊癌及胆管癌、膀胱癌及子宫癌。悬浮免疫细胞的某些实施例包含外周血液单核细胞(pbmc)、淋巴细胞、t淋巴细胞、t细胞、t辅助细胞、单核球、自然杀手(nk)细胞、巨噬细胞及粒细胞。
9.非人类动物的某些实施例包含啮齿动物(诸如鼠类)、兔、狗、猪及猴。
10.在一些实施例中,免疫检查点抑制剂包含结合于免疫检查点蛋白的抗体(例如单株抗体、嵌合抗体、人类化抗体及人类抗体)、工程化结合蛋白、可溶受体、适体、肽或小分子。
11.在一个实施例中,步骤(a)的活体外共培养花费约1至约2天。在一个实施例中,在步骤(b)的移植约1至约3天之后进行步骤(c)中的免疫检查点抑制剂的投与。在一个实施例中,在步骤(c)的投与约8至约15天之后测定肿瘤细胞的细胞存活率或免疫细胞的活性或免疫检查点蛋白表现。
12.本发明进一步提供一种活体外筛选免疫检查点抑制剂的方法,其包含(a)将黏附肿瘤细胞及悬浮免疫细胞活体外共培养于mtam的纤维的内腔内;(b)向所述膜添加免疫检查点抑制剂;(c)分离所述肿瘤细胞与所述免疫细胞且测定所述肿瘤细胞的细胞存活率或所述免疫细胞的活性,或测定所述肿瘤或免疫细胞中的免疫检查点蛋白表现;其中若所述肿瘤细胞的细胞存活率显著低于对照组的细胞存活率或所述免疫细胞的活性显著高于对照组的活性;或若所述肿瘤或免疫细胞中的免疫检查点蛋白表现相对于对照组改变,则所述免疫检查点抑制剂具有抗肿瘤作用。
13.图式简单说明
14.图1(a)至(h)展示细胞的细胞存活率。在tcp(a)及膜腔(b)中培养的a549细胞视培养天数而增加,且抗pd-1药物的添加不影响细胞存活率(p》0.05)。在tcp(c)及膜腔(d)中培养的pbmc细胞的细胞存活率视培养天数而降低,且抗pd-1药物的添加不影响细胞存活率。将a549细胞及不活化t细胞在tcp中共培养(e)且其生长类似于对照组的生长。在膜中共培养的a549细胞及不活化t细胞展现类似结果(f)。将a549细胞及活化t细胞在tcp中共培养(g)且其生长类似于对照组(一种细胞类型)的生长。与对照组相比,共培养的细胞存活率在
第五天降低约14%(未添加抗pd-1药物)及约31%(添加抗pd-1药物)。在膜中共培养的a549细胞及活化t细胞(h)展现细胞存活率分别降低约19%(未添加抗pd-1药物)及约70%(添加抗pd-1药物)。
15.图2展示裸小鼠及常见小鼠的膜中的细胞存活率视时间而增加且不存在显著差异。
16.图3展示裸小鼠及常见小鼠的膜中的干扰素γ含量极低。
17.图4展示裸小鼠及常见小鼠中的血管数目视时间而增加。
18.图5展示在第七天,常见小鼠中的血管数目与裸小鼠相比增加约38%。
19.图6(a)及(b)展示将黏附肿瘤细胞(a549)保持在膜的纤维的内壁上(a)且分离悬浮液细胞(pbmc)(b)。
20.图7(a)至(d)展示癌细胞与经抗pd1抗体处理的初始活化pbmc共培养。
具体实施方式
21.除非另外指明,否则当描述本发明(包括其各种态样及实施例)时,以下术语具有以下含义。
22.术语「一(a/an)」系指一个或多于一个(亦即,至少一个)冠词的语法宾语。藉助于实例,「一要素」意谓一个要素或多于一个要素。
23.术语「微管数组膜」(缩写为「mtam」)系指包含电纺纤维集合体的薄膜或膜,所述电纺纤维集合体具有高度对齐且紧密封装的奈米尺寸的中空纤维。
24.如本文中所使用,术语「抗体」系指衍生自与抗原特异性结合的免疫球蛋白分子的蛋白质或多肽序列。抗体可为多株或单株、多链或单链或完整的免疫球蛋白且可衍生自天然来源或重组来源。抗体可为免疫球蛋白分子的四聚体。
25.术语「抗癌作用」系指可藉由各种手段显现的生物作用,包括但不限于例如肿瘤体积的减小、癌细胞数目的减少、癌转移数目的减少、预期寿命的增加、癌细胞增殖的减少、癌细胞存活的减少或与癌病况相关的各种生理学症状的改善。「抗癌作用」亦可藉由肽、聚核苷酸、细胞及抗体阻止首次癌症的出现的能力表明。术语「抗肿瘤作用」系指可藉由各种手段显现的生物作用,包括但不限于例如肿瘤体积的减小、肿瘤细胞数目的减少、肿瘤细胞增殖的减少或肿瘤细胞存活的减少。
26.术语「有效量」或「治疗有效量」在本文中可互换使用,且系指有效达成特定生物结果的如本文中所描述的化合物、调配物、材料或组合物的量。
27.「免疫反应」系指免疫系统的细胞(例如,t淋巴细胞、b淋巴细胞、自然杀手(nk)细胞、巨噬细胞、嗜酸性球、肥大细胞、树突状细胞及嗜中性球)及由此等细胞中的任一者或肝脏产生的可溶性巨分子(包括抗体、细胞激素及补体)的作用,其引起自脊椎动物体内选择性靶向、结合于、损害、破坏及/或消除侵入病原体、受病原体感染的细胞或组织、癌细胞或其他异常细胞或在自体免疫或病理性炎症的情况下,普通人类细胞或组织。
28.术语「免疫检查点蛋白」在此项技术中已知。在此术语的已知含义内,熟习此项技术者应清楚,在「免疫检查点蛋白」的层面上,免疫系统向其组分提供抑制信号以便平衡免疫反应。已知免疫检查点蛋白可包含ctla-4、pd1及其配位体pd-l1及pd-l2以及另外的lag-3、btla、b7h3、b7h4、tim3、mr。涉及lag3、btla、b7h3、b7h4、tim3及mr的路径在此项技术中经
识别以构成与ctla-4及pd-1依赖性路径类似的免疫检查点路径(参见例如pardoll,2012.nature rev cancer 12:252-264;mellman等人,2011.nature 480:480-489)。
29.术语「癌症」系指广泛群体的各种疾病,其特征为异常细胞在体内不受控生长。不受调控的细胞分裂及生长导致形成侵入邻近组织且亦可经由淋巴系统或血流转移至身体的远程部分的恶性肿瘤。「癌」或「癌组织」可包括肿瘤。
30.如本文中所使用,「给药时间间隔」意指向个体投与本文中所揭露的调配物的多种剂量之间流逝的时间量。因此,给药时间间隔可指示为范围。
31.如本文中所用,术语「给药频率」系指在既定时间内投与本文中揭露的调配物的剂量的频率。给药频率可指示为每既定时间的给药的次数,例如,一周一次或两周一次。
32.术语「生物材料」系指任何天然或人造材料,其整体或部分由执行、加强或代替天然功能的活性物质(诸如灌注有细胞或细胞提取物的聚合物支架)构成或衍生自所述活性物质。
33.术语「细胞株」系指可在培养物中维持及生长的特定类型的细胞。细胞株通常均质且具有良好特征,且可长期储存(例如,低温保藏)。某些细胞株可具有有限寿命,而其他细胞株可无限分裂。
34.术语「活体内」系指在生物体体内,诸如在人类临床试验或治疗中的动物中进行或发生的实验方法或过程。
35.如本文中所使用,术语「电纺」系指使用流体动力学与带电表面之间的相互作用自溶液产生称为电纺纤维的奈米尺寸的纤维的技术。一般而言,电纺纤维的形成涉及将溶液提供至与电压源电连通的体内的孔,其中电力有助于形成沈积于可接地表面上或以其他方式在低于主体的电压下的精细纤维。在电纺中,将由一或多个针、槽或其他孔提供的聚合溶液或熔融物相对于收集栅格充电至高电压。电力克服表面张力且使得聚合溶液或熔体的细流朝向接地或带相反电荷的收集栅格移动。
36.如本文中所使用,术语「聚合物」系指且一般包括但不限于均聚物、共聚物(诸如嵌段、接枝、无规及交替共聚物、三元共聚物等)及其掺合物及变体。较佳地,其可包括但不限于聚乳酸交酯、聚乳酸、聚烯烃、聚丙烯腈、聚胺基甲酸酯、聚碳酸酯、聚己内酯、聚乙烯醇(pva)、纤维素、聚葡萄胺糖耐纶(例如,耐纶6、耐纶406、耐纶6-6等)、聚苯乙烯、蛋白质及其类似物或其组合。除非另外特定限制,否则术语「聚合物」意欲包括材料的所有可能的几何组态。此等组态包括但不限于等规、间规及无规对称。用于各聚合物的适合溶剂可选自熟习此项技术者已知的溶剂,包括但不限于硫酸、甲酸、氯仿、四氢呋喃、二甲基甲酰胺、水、丙酮及其组合。
37.如本文中所使用,术语「奈米尺寸纤维」或「奈米纤维」系指平均直径不超过约1500奈米(nm)的极小直径纤维。奈米纤维通常理解为具有约10至约1500nm、更具体来说,约10至约1000nm、更具体来说,约20至约500nm、且最具体来说,约20至约400nm的纤维直径范围。其他例示性范围包括约50至约500nm、约100至500nm或约40至约200nm。在存在微粒且非均质分布于奈米纤维上的例子中,奈米纤维的平均直径可使用已知技术(例如,与电子显微法联用的影像分析工具)来量测,但不包括相对于纤维的无粒子部分由额外粒子的存在显著放大的纤维的部分。
38.如本文中所使用,术语「定向纤维」指示特定结构或数组中的大体上所有纤维彼此
平行排列在纵向方向(「单向定向」)或在界定明确的三维网络(「三维定向」)中。换句话说,纤维并非相对于彼此任意在空间上排列。在大多数情况下,本文中所描述的纤维在相对于支撑基板表面的大体垂直方向上生长,且(若存在)存在个别纤维股线的极小分支。
39.如本文中所使用,术语「单层材料」或「单层的材料」系指由厚度可变化的单层构成的材料。
40.如本文中所使用,术语「复数个层」或「多层材料」系指单层的材料的「堆栈」。
41.本发明提供一种活体内筛选免疫检查点抑制剂的方法,其包含(a)将黏附肿瘤细胞及悬浮免疫细胞活体外共培养于微管数组膜(mtam)的内腔内,其中mtam包含电纺纤维集合体,其具有高度对齐且紧密封装的奈米尺寸的中空纤维;(b)将所述膜移植至非人类动物中;及(c)向所述非人类动物投与免疫检查点抑制剂;(d)分离所述肿瘤细胞与所述免疫细胞;及(e)测定所述肿瘤细胞的细胞存活率或所述免疫细胞的活性,或测定所述肿瘤或免疫细胞中的免疫检查点蛋白表现;其中若所述肿瘤细胞的细胞存活率显著低于对照组的细胞存活率或所述免疫细胞的活性显著高于对照组的活性;或若所述肿瘤或免疫细胞中的免疫检查点蛋白表现相对于对照组改变,则所述免疫检查点抑制剂具有抗肿瘤作用。
42.在一些实施例中,所述黏附肿瘤细胞或所述悬浮免疫细胞以约1
×
104个细胞/μl至1
×
107个细胞/μl的浓度接种。在一些实施例中,所述黏附肿瘤细胞或所述悬浮免疫细胞以1
×
104个细胞/μl至约1
×
106个细胞/μl、约1
×
104个细胞/μl至约1
×
105个细胞/μl、约1
×
105个细胞/μl至约1
×
107个细胞/μl、约1
×
105个细胞/μl至约1
×
106个细胞/μl、约2
×
104个细胞/μl至约2
×
107个细胞/μl、约2
×
104个细胞/μl至约2
×
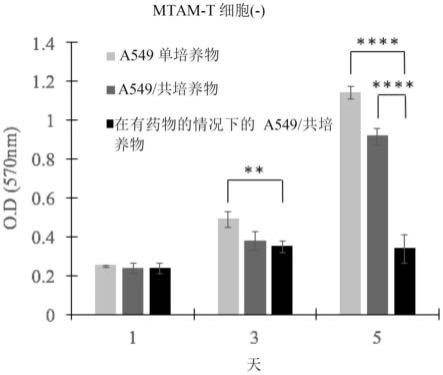
106个细胞/μl、约2
×
104个细胞/μl至约2
×
105个细胞/μl、约2
×
105个细胞/μl至约2
×
107个细胞/μl或约2
×
105个细胞/μl至约2
×
106个细胞/μl的浓度接种。
43.在一些实施例中,所述黏附肿瘤细胞包括但不限于以下的细胞:肝细胞癌、结肠直肠癌、神经胶母细胞瘤、胃癌、食道癌、非小细胞肺癌(nsclc)、胰脏癌、肾细胞癌、良性前列腺增生、前列腺癌、卵巢癌、黑素瘤、乳癌、慢性淋巴球性白血病(cll)、梅克尔细胞癌(merkel cell carcinoma)、小细胞肺癌(sclc)、非霍奇金淋巴瘤(non-hodgkin lymphoma)、急性骨髓白血病(aml)、胆囊癌及胆管癌、膀胱癌或子宫癌。
44.在一些实施例中,所述悬浮免疫细胞包括但不限于外周血液单核细胞(pbmc)、淋巴细胞、t淋巴细胞(诸如cd8-阳性t淋巴细胞)、t细胞(诸如cd4-阳性t细胞、cd8-阳性t细胞、cd4-阳性辅助t细胞、cd4-阳性-辅助-t细胞及cd8-阳性细胞毒性t细胞)、t辅助细胞、单核球、自然杀手(nk)细胞、巨噬细胞或粒细胞(诸如嗜中性球、嗜碱性球及嗜酸性球)。
45.将包含黏附肿瘤细胞及悬浮免疫细胞的膜移植至非人类动物中。使用本发明的方法,任何类型的动物可用于活体内筛选免疫检查点抑制剂。例如,常见实验室大鼠或小鼠可用于本发明方法中以筛选临床前分析中的免疫检查点抑制剂,且不需要免疫缺乏动物或人类化小鼠。
46.在一些实施例中,非人类动物为啮齿动物(诸如鼠类)、兔、狗、猪或猴。在一些实施例中,非人类动物为鼠类,诸如大鼠及小鼠。
47.将所关注的免疫检查点抑制剂投与非人类动物用于筛选。在一个实施例中,免疫检查点抑制剂在步骤(b)的移植24小时之后投与。
48.在本发明中,免疫检查点抑制剂为抑制免疫检查点蛋白功能的任何化合物。抑制
包括降低功能及完全阻断。详细而言,免疫检查点蛋白系人类免疫检查点蛋白。因此,免疫检查点抑制剂较佳为人类免疫检查点蛋白的抑制剂。
49.在一些实施例中,免疫检查点抑制剂包括但不限于结合于免疫检查点蛋白的抗体(例如,单株抗体、嵌合抗体、人类化抗体及人类抗体)、工程化结合蛋白、可溶受体、适体、肽或小分子。
50.在一些实施例中,免疫检查点抑制剂包含抑制性受体的拮抗剂。在一些实施例中,免疫检查点抑制剂抑制pd1路径或ctla4路径。在一些实施例中,免疫检查点抑制剂结合于pd1、pd-l1或pd-l2。在一些实施例中,免疫检查点抑制剂结合于ctla4。
51.较佳免疫检查点蛋白抑制剂为特异性识别免疫检查点蛋白的化合物或抗体。已知许多ctla-4、pd1、pdl-1、pd-l2、lag-3、btla、b7h3、b7h4、tim3及mr抑制剂且类似于此等已知免疫检查点蛋白抑制剂,将来可研发替代性免疫检查点抑制剂。例如,伊匹单抗为当前以名称yervoy(bristol-myers squibb)销售的全人类ctla-4阻断抗体。第二ctla-4抑制剂为曲美木单抗(tremelimumab)。pd-1抑制剂的实例包括但不限于阻断人类pd-1的人类化抗体,诸如拉立珠单抗(lambrolizumab)或皮立珠单抗(pidilizumab),以及诸如尼沃单抗(nivolumab)的全人类抗体。其他pd-1抑制剂可包括可溶pd-1配位体的呈现,包括但不限于亦称为b7-dc-ig或amp-244的pd-l2 fc融合蛋白及当前所研究及/或研发用于疗法中的其他pd-1抑制剂。另外,免疫检查点抑制剂可包括但不限于阻断pd-l1的人类化或全人类抗体(诸如medi-4736及mih1)及当前所研究的其他pd-l1抑制剂。根据本发明,免疫检查点抑制剂较佳选自ctla-4、pd-1或pd-l1抑制剂。此等免疫检查点蛋白的已知抑制剂可原样使用或可使用类似物,尤其抗体的嵌合、人类化或人类形式。
52.分离肿瘤细胞及免疫细胞。孔洞中空纤维的孔径阻止细胞进入及离开纤维。由于肿瘤细胞的黏附特性及免疫细胞的悬浮特性,肿瘤细胞可容易与免疫细胞分离。
53.为筛选免疫检查点抑制剂,测定肿瘤细胞的细胞存活率或免疫细胞的活性。当肿瘤细胞的细胞存活率显著低于对照组的细胞存活率或免疫细胞的活性显著高于对照组的活性时,免疫检查点抑制剂测定为具有抗肿瘤作用。
54.在一个实施例中,步骤(a)的活体外共培养花费约1至约2天。特定而言,步骤(a)的活体外共培养花费约1天。
55.在一个实施例中,在步骤(b)的移植约1至约3天之后进行步骤(c)中的免疫检查点抑制剂的投与。在另一实施例中,在步骤(b)移植约2天之后进行步骤(c)中的免疫检查点抑制剂的投与。
56.在一个实施例中,在步骤(c)的投与约8至约15天之后测定肿瘤细胞的细胞存活率或免疫细胞的活性或免疫检查点蛋白表现。在另一实施例中,在步骤(c)约8天之后测定肿瘤细胞的细胞存活率或免疫细胞的活性或免疫检查点蛋白表现。
57.因此,步骤(b)至步骤(d)的总时间花费约9天至18天。在另一实施例中,步骤(b)至步骤(d)的总时间花费约10天。
58.根据此项技术中已知的方法测定肿瘤细胞的细胞存活率或免疫细胞的活性。例如,细胞存活率可藉由mtt分析测定。
59.在一个实施例中,mtam包含揭露于us 2011264235中的一或多层高度对齐且紧密封装的电纺纤维集合体。特定而言,mtam包含高度对齐且紧密封装的电纺纤维集合体,其中
至少五(5)种电纺纤维封装在一起以形成单层,且电纺纤维的定向相对于集合体的纵轴不大于 /-5
°
,其中电纺纤维经连接以使得电纺纤维经对齐且紧密封装以形成单层,且其中纤维的对齐在定向上不超过 /-5
°
。在一些实施例中,纤维集合体由选自由以下组成的群的聚合物构成:环氧乙烷、聚氧化乙烯、乙二醇、聚乙二醇、聚(乳酸)(pla)、聚(乙醇酸)(pga)、聚(环氧乙烷)(peo)、耐纶、聚酯、聚酰胺、聚(胺基酸)、聚酰亚胺、聚醚、聚酮、聚胺基甲酸酯、聚己内酯、聚丙烯腈、芳族聚酰胺、共轭聚合物、聚(2-甲氧基、5乙基(2'己氧基)对伸苯基伸乙烯基)(meh-ppv)、聚伸苯基伸乙烯基、聚伸芳基-伸乙烯基、聚伸噻吩基-伸乙烯基、聚吡咯-伸乙烯基、聚伸杂芳基-伸乙烯基、聚苯胺、聚苯、聚伸芳、聚噻吩、聚吡咯、聚伸杂芳、聚伸苯基-伸乙炔、聚伸芳基-伸乙炔、聚噻吩并-伸乙炔、聚伸杂芳基-伸乙炔及其混合物。在一些实施例中,各纤维的平均壁厚度为约1至约5μm。在一些实施例中,至少20种纤维封装在一起以形成单层。在另一实施例中,至少50个纤维封装在一起以形成单层。在一些实施例中,各纤维的l/d大于约100。在一些实施例中,各纤维的l/d大于约1,000。在一些实施例中,各纤维的l/d为约20至约10,000。在一些实施例中,各纤维的平均壁厚度为约1至约3μm。
60.在一个实施例中,中空电纺纤维集合体及mtam的纤维具有自纤维的内表面延伸的毛发状的结构。毛发状结构自纤维的内表面生长。毛发状结构的表面覆盖率比率为约10%至约80%、约10%至约70%、约10%至约60%、约10%至约50%、约10%至约40%、约10%至约30%、约20%至约80%、约20%至约70%、约20%至约60%、约20%至约50%、约30%至约80%、约30%至约70%、约30%至约60%、约40%至约80%、约40%至约70%、约50%至约80%,或约60%至约80%。表面覆盖率比率可基于tem影像来估计。纤维中的毛发状结构提供较大表面积且容易地可缩放,从而使得较少纤维用于各种应用中且因此可降低成本。例如,「毛发」的纵横比至多20:1。毛发状结构的纵横比的实施例包括但不限于至多15:1、至多10:1、至少1:1、至少3:1、或至少5:1、1:1至20:1。
61.mtam-毛发状的纤维系使用包含以约7:约2至约9:约1的比率溶解于溶剂中的约5wt%至约40wt%聚合溶液的聚合核溶液;及包含以约7:约2至约9:约1的比率溶解于溶剂中的约5wt%至约40wt%聚合溶液的聚合壳溶液在二流体同轴电纺过程中制备。在一个实施例中,溶剂为二氯甲烷:二甲基甲醛(dcm:dmf)的共溶剂。在另一实施例中,流速为3至10ml(核溶液)及2至12ml(壳溶液)及/或收集速度为约80至约120rpm的鼓收集器用于本发明的方法中。
62.用作核溶液或壳溶液的聚合物的实施例包括但不限于环氧乙烷、聚氧化乙烯(peo)、乙二醇、聚乙二醇(peg)、聚(乳酸)(pla)、聚(乙醇酸)(pga)、聚(环氧乙烷)(peo)、耐纶、聚酯、聚酰胺、聚(酰胺酸)、聚酰亚胺、聚醚、聚酮、聚胺基甲酸酯、聚己内酯、聚丙烯腈、芳族聚酰胺、共轭聚合物,诸如电致发光聚合物、聚(2-甲氧基、5乙基(2'己氧基)对伸苯基伸乙烯基)(meh-ppv)、聚伸苯基伸乙烯基、聚伸芳基-伸乙烯基、聚伸噻吩基-伸乙烯基、聚吡咯-伸乙烯基、聚伸杂芳基-伸乙烯基、聚苯胺、聚苯、聚伸芳、聚噻吩、聚噻吩、聚吡咯、聚伸杂芳、聚伸苯基-伸乙炔、聚伸芳基-伸乙炔、聚噻吩并-伸乙炔、聚伸杂芳基-伸乙炔及其混合物。在一些实施例中,聚合物为生物可降解及/或生物可吸收聚合物,诸如聚乙交酯(pga)及其无规共聚物聚(乙交酯-共-丙交酯)(pga-共-pla)、包括甲基丙烯酸乙酯的聚甲基丙烯酸羟烷酯及水凝胶,诸如聚乙烯吡咯啶酮、聚丙烯酰胺、胶原蛋白、明胶、褐藻酸、甲壳素、聚葡萄胺糖、纤维蛋白、玻尿酸、聚葡萄糖及聚胺基酸或其混合物。在另一实施例中,
所述溶液为pla、peo及peg的混合物。
63.纤维表面上的「孔隙」具有约5nm至约1μm范围内的尺寸。在一些实施例中,孔径范围介于约20nm至约500nm、约20nm至约400nm、约20nm至约300nm、约20nm至约200nm、约20nm至约100nm、约20nm至约80nm、约20nm至约70nm或约20nm至约60nm。表面上的孔隙的密度范围介于约0.1%至约30%。在一些实施例中,密度为约0.1%至约25%、约0.1%至约20%、约0.1%至约15%、约0.1%至约10%、约0.1%至约5%、约0.1%至约15%、约1%至约30%、约1%至约25%、约1%至约20%、约1%至约15%、约1%至约10%、约1%至约5%、约5%至约30%、约5%至约25%、约5%至约20%、约5%至约15%、约5%至约10%、约10%至约30%、约15%至约25%、或约15%至约20%。
64.在一个实施例中,纤维为中空的且在内表面上具有孔。在一个实施例中,纤维为中空的且在内表面及外表面两者上均具有孔。在纤维的(一或多个)表面上具有孔隙,纤维集合体被认为具有「海绵状」外观。
65.在另一实施例中,mtam包括至少两层纤维集合体。mtam具有如下结构:其中纤维集合体的层经交替排列,称为交替层。本文中所用的术语「交替地」或「交替层」意谓纤维的层紧密堆栈且不沿层的z方向完全对齐。例如,在经由z方向观察时,在双层膜中的纤维层可具有「a-b」组态。对于三层膜,纤维的层在经由z方向观测时可具有「a-b-a」或「a-b-c」组态。本文中所使用的术语「垂直」或「垂直层」意谓纤维的层紧密堆栈且沿层的z方向完全对齐。此等mtma均表示为「mtma-al」,但可添加其他内容足以清楚地指定mtma的组态及层数目。例如,交替排列有两个层的mtma可表示为「mtma-dl-al」。另外,mtma-交替层可展现以下特征或益处:面积的消耗减至最少、较大填充密度、可能存在的额外管可减小系统内压力等。
66.另一方面,mtam具有如下结构:其中纤维集合体的层经垂直排列,称为垂直层。亦即,mtma具有沿z方向(垂直于膜平面的方向)上对齐的多个纤维层。例如,沿z方向上对齐的具有两个纤维层的mtma由「mtma-dl」表示;沿z方向上对齐的具有三个纤维层的mtma由「mtma-tl」表示;等。亦可提供具有较多纤维层的mtma。mtma-垂直层可展现以下特征或益处:较大填充密度、增强型机械特性、归因于串主链的简易操作等。
67.沿z方向上对齐的具有多个纤维层的mtam,在流速大于10ml/h且电压为约8kv至约11kv下同时维持纺丝头高度为约1-3cm,系使用包含约15重量%至约25重量%聚合溶液的壳溶液藉由壳-流体同轴电纺过程来制备。在一个实施例中,聚合溶液为溶解于thf与dmac的共溶剂中的psf/pvp。制备具有多层结构的mtam-dl-al包含在壳-流体同轴电纺过程中,在流速大于10ml/h且电压为约8kv至约11kv下使用包含约15重量%至约25重量%聚合溶液的壳溶液。在一个实施例中,聚合溶液为溶解于thf与dmac的共溶剂中的psf/pvp。
68.mtam可封闭于装袋中。装袋为mtam提供保护且使得能够容易操作mtam。
69.在另一态样中,本发明亦提供一种活体外筛选免疫检查点抑制剂的方法,其包含(a)将黏附肿瘤细胞及悬浮免疫细胞活体外共培养于本发明的孔洞中空纤维膜的内腔内;(b)向所述膜添加免疫检查点抑制剂;(c)分离所述肿瘤细胞与所述免疫细胞且测定所述肿瘤细胞的细胞存活率或所述免疫细胞的活性,或测定所述肿瘤或免疫细胞中的免疫检查点蛋白表现;其中若所述肿瘤细胞的细胞存活率显著低于对照组的细胞存活率或所述免疫细胞的活性显著高于对照组的活性;或若所述肿瘤或免疫细胞中的免疫检查点蛋白表现相对于对照组改变,则所述免疫检查点抑制剂具有抗肿瘤作用。
70.在一个实施例中,步骤(a)的活体外共培养花费约1至约2天。特定而言,步骤(a)的活体外共培养花费约1天。
71.在一个实施例中,在步骤(a)的移植约1至约3天之后进行步骤(b)中的免疫检查点抑制剂的添加。在另一实施例中,在步骤(a)的移植约2天之后进行步骤(b)中的免疫检查点抑制剂的投与。
72.在一个实施例中,在步骤(b)的投与约8至约15天之后测定肿瘤细胞的细胞存活率或免疫细胞的活性或免疫检查点蛋白表现。在另一实施例中,在步骤(b)约8天之后测定肿瘤细胞的细胞存活率或免疫细胞的活性或免疫检查点蛋白表现。
73.因此,步骤(b)至步骤(c)的总时间花费约9天至18天。在另一实施例中,步骤(b)至步骤(c)的总时间花费约10天。
74.在活体外方法中,免疫检查点抑制剂、mtam、黏附肿瘤细胞、悬浮免疫细胞、细胞存活率分析及投与等的实施例描述于本文中。
75.本发明的方法可改良评估抗癌药物的精确性且建立快速、可靠且低成本的抗癌药物筛选平台。本发明的方法为用于筛选免疫检查点抑制剂的可行动物模型且提供诸如快速、低成本及高度谨慎的优点。
76.以下实例藉助于说明呈现且不意欲限制本文中所揭露的主题的范畴。
77.实例
78.实例1使用mtam的活体外研究
79.将a549细胞(1
×
105个细胞/5μl)及pbmc(2
×
105个细胞/5μl)单独及呈组合形式分别在如us 2011264235中所揭露的组织培养盘(tcp)及mtam的纤维的内腔中培养。每天将抗pd-1药物添加至组织培养盘及膜中。如图1(a)及(b)中所示,在tcp及膜内腔中培养的a549细胞的细胞存活率视培养天数而增加,且抗pd-1药物的添加不影响细胞存活率(p》0.05)。如图1(c)及(d)中所示,在tcp及膜内腔中培养的pbmc细胞的细胞存活率视培养天数而降低,且抗pd-1药物的添加不影响细胞存活率(p》0.05)。
80.图1(e)及(f)展示将a549细胞及不活化t细胞在tcp中共培养且其生长类似于对照组的生长。与包含一种细胞类型的培养物相比,共培养的细胞存活率在第五天降低8%(未添加抗pd-1药物)及12%(添加抗pd-1药物)。抗pf-1的添加不具有显著差异。在膜中共培养的a549细胞及不活化t细胞展现类似结果。
81.图1(g)及(h)展示将a549细胞与活化t细胞在tcp中共培养且其生长类似于对照组(一种细胞类型)的生长。与对照组相比,共培养的细胞存活率在第五天降低约14%(未添加抗pd-1药物)及约31%(添加抗pd-1药物)。抗pf-1的添加展现显著差异。在膜中共培养的a549细胞及活化t细胞展现细胞存活率分别降低约19%(未添加抗pd-1药物)及约70%(添加抗pd-1药物)。
82.mtam-毛发状亦用于如上所述的活体外研究中。发现在mtam中共培养的a549细胞及活化t细胞展现降低的细胞存活率。
83.实例3在动物模型中的筛选
84.如us 2011264235中所揭露,将1
×
106个肿瘤细胞(a549细胞)移植至mtam的内腔中。在24小时之后,将膜植入裸小鼠(缺乏t细胞)及具有完全免疫的常见小鼠(bala/c小鼠)中。量测血管生成、细胞存活率及干扰素γ含量。如图2中所示,裸小鼠及常见小鼠的膜中的
细胞存活率视时间而增加且不存在显著差异。裸小鼠及常见小鼠的膜中的干扰素γ含量极低(参见图3)。图4及图5展示裸小鼠及常见小鼠中的血管数目视时间而增加且常见小鼠中的血管数目在第七天比裸小鼠中的血管数目增加约38%。
85.实例4使用mtam的活体内动物研究
86.如us 2011264235中所揭露将a549细胞(1
×
105个细胞/5μl)及pbmc(2
×
105个细胞/5μl)移植至mtam的纤维的内腔中且密封膜的两端以避免细胞自纤维离开。膜在具有rpmi-1640培养基的培养皿中培养。在24小时之后,使肿瘤细胞黏附至纤维内壁。
87.将bala/c小鼠(7周龄)用于动物研究中。将以上所得膜移植至小鼠的背部中。在24小时之后,每隔一天向小鼠投与抗pd-1药物(200μg/小鼠)持续15天。在6、9、12及15天自小鼠采集膜以观测血管生成。将膜置于mtt(0.5%;sigma,usa)溶液(1,000μl pbs 200μl mtt)中。在30分钟之后,采集膜且在670g下离心10分钟以分离及收集pbmc。在离心之后,采集悬浮液样品且将其置于载片中。藉由荧光染色载片及膜,随后藉由荧光显微镜观测。如图6(a)及(b)中所示,将黏附肿瘤细胞(a549)保持在膜纤维的内壁上且分离悬浮液细胞(pbmc)。随后,将膜放入500μl dmso溶液中;在24小时之后,将各膜的100μl溶液样品放入96孔盘中且藉由elisa读取器量测吸收度(570nm)。
88.图7(a)至(d)展示癌细胞与经抗pd1抗体处理的初始活化pbmc共培养。
89.mtam-毛发状亦用于如上文所提及的活体内动物研究中。已发现mtam-毛发状在筛选抗肿瘤药物方面呈现良好效应。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。