three exons generates at least five different mrnas encoding human leukocyte common antigens,j.exp.med.166:1548
–
1566;chang等人,2016,initiation of t cell signaling by cd45 segregation at
‘
close-contacts’,nat.immunol.17(5):574-582)。这三个外显子编码多个o-连接的糖基化位点,并被唾液酸可变修饰。因此,各种同工型的大小(391至552个氨基酸;分子量范围为180-240kda)、形状和负电荷有很大不同。剩余的膜近端细胞外结构域是高度n-糖基化的,并包含富含半胱氨酸的间隔区,随后是三个纤连蛋白iii型重复序列。
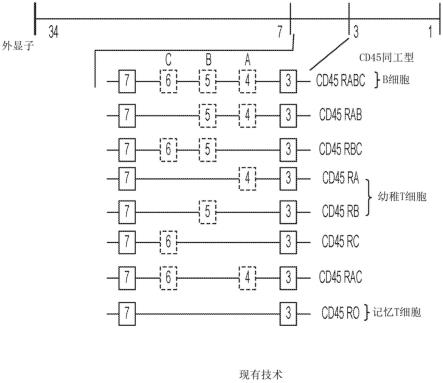
11.虽然cd45的八种同工型是可能的,但在人类中仅鉴定出六种:ro(缺少所有三个外显子)、ra(外显子a)、rb(外显子b)、rab(外显子a和b)、rbc(外显子b和c)和rabc(外显子a、b和c)。这些不同的同工型在b细胞淋巴细胞和t细胞淋巴细胞的亚群上差异表达,并且对细胞的激活和成熟状态具有特异性。例如,cd45-ra和cd45-rb在幼稚t细胞上表达,而cd45-ro在激活的t细胞、一些b细胞亚群、激活的单核细胞/巨噬细胞和粒细胞上表达,cd45-rabc优先在b细胞上表达(hermiston et al.,2003,cd45:a critical regulator of signaling thresholds in immune cells,ann.rev.immunol.,21:107-137)。
12.已经鉴定了选择性识别cd45的各种同工型的抗体。此外,还鉴定了结合所有不同同工型共有的表位的单克隆抗体(mab)。例如,抗cd45鼠抗体bc8识别cd45抗原的所有人类同工型。
13.虽然已经探索了使用碘131(
131
i)标记的bc8治疗需要骨髓移植的受试者(参见国际公开号wo 2017/155937,其全文通过引用并入本文),但仍然需要用于治疗恶性和非恶性血液疾病的组合物及其使用方法。具体而言,需要一种治疗组合物和方法,其(i)使用比化疗剂更特异的药剂,(ii)足够有效以在低剂量下有效,并且(iii)至少使某些类型的造血干细胞免于严重消耗。
技术实现要素:
14.本公开利用bc8单克隆抗体的泛特异性来提供可用于特定细胞群的消耗、可逆免疫抑制和/或清除的组合物和方法,以及进一步使用这些组合物和方法治疗某些恶性和非恶性血液疾病的方法。
15.本公开提供了用于治疗各种造血系统病症以及代谢病症、癌症和自身免疫性疾病等的组合物及其使用方法。本公开的另外特征在于用于在接受造血干细胞移植疗法之前调理患者以促进造血干细胞移植物的植入的方法。患者可以是患有一种或多种血液病症(例如血红蛋白病或其他造血病理学)的患者。患者可以是需要造血干细胞移植的患者。
16.如本文所述,造血干细胞能够分化成造血谱系中的多种细胞类型并且可以施用于患者以填充或重新填充患者中缺乏的细胞类型。本公开的特征在于用放射性标记的抗体治疗患者的方法,特别是锕-225(
225
ac)或镥-177(
177
lu)标记的抗cd45免疫球蛋白,其能够靶向造血细胞以(i)通过选择性地消耗、可逆地抑制或清除表达cd45的细胞群(例如异常血细胞、癌细胞或自身免疫细胞)来直接治疗疾病,例如血液病症、代谢疾病、癌症或自身免疫性疾病以及本文描述的其他疾病,和/或(ii)消耗、可逆地抑制或清除患者体内的内源性造血干细胞群。
17.前一种活性能够直接治疗与造血谱系的细胞(例如b细胞或t细胞谱系的白血病细
胞或淋巴瘤细胞)、自身免疫淋巴细胞(例如表达与自身抗原交叉反应的t细胞受体的t细胞)以及其他细胞类型相关的宽范围的病症。后一种活性,即造血干细胞的选择性消耗、可逆抑制或清除,反过来会产生一个空缺,随后可以通过移植外源性(例如,自体、同种异体或同源的)造血干细胞移植物来填补该空缺。
18.因此,本公开提供了用于治疗多种非癌性造血病况(例如血红蛋白病(例如镰状细胞病或scd和β-地中海贫血)、先天性免疫缺陷(例如严重联合免疫缺陷或scid、范可尼贫血、wiskott-aldrich综合征、diamond-blackfan贫血和schwachman-diamond综合征、腺苷脱氨酶缺乏)和病毒感染(例如hiv感染和获得性免疫缺陷综合征))的方法。本公开进一步提供了用于治疗癌性病症(例如血液癌症或实体瘤)的方法。示例性的血液癌症包括急性髓性白血病、急性淋巴性白血病、慢性髓性白血病、慢性淋巴性白血病、多发性骨髓瘤、弥漫性大b细胞淋巴瘤和非霍奇金淋巴瘤。
19.因此,本公开涉及一种稳定的组合物,其包含其锕-225(
225
ac)或镥-177(
177
lu)放射性标记形式的分离的抗cd45免疫球蛋白(例如,bc8 mab克隆),及其用于治疗恶性和非恶性血液疾病和病症的治疗用途。bc8抗体能够结合人体内所有cd45抗原的同工型,因此有望在高密度cd45抗原负荷细胞上特异性且优先地积累治疗性高辐射剂量。
20.因此,本公开还涉及用放射性核素(如
225
ac或
177
lu)放射性标记抗cd45免疫球蛋白(如bc8抗体)的方法。根据某些方面,bc8抗体与螯合剂如s-2-(4-异硫氰酸苄基)-1,4,7,10四氮杂环十二烷四乙酸(p-scn-bn-dota;简称dota)缀合以形成dota-bc8,并用放射性核素如
225
ac进行放射性标记以形成
225
ac-dota-bc8(即
225
ac-bc8)或用放射性核素如
177
lu进行放射性标记以提供
177
lu-dota-bc8(即
177
lu-bc8)。
21.225
ac-bc8或
177
lu-bc8可以作为包含一种或多种药学上可接受的载体、盐或赋形剂的稳定制剂提供。某些示例性载体或赋形剂包括盐水、磷酸盐缓冲盐水(例如,50mm pbs缓冲液,ph 7),和/或0.5%至5.0%(w/v)的一种或多种抗坏血酸、聚乙烯吡咯烷酮(pvp)、人血清白蛋白(hsa)、hsa的水溶性盐及其混合物。
22.bc8抗体可以包含具有如seq id no:1所示的氨基酸序列的轻链可变结构域,或具有如seq id no:9所示的n末端氨基酸序列的重链可变结构域。bc8抗体可以包含具有至少一个具有如seq id no:3、seq id no:4和seq id no:5所示的氨基酸序列的互补决定区(cdr)的轻链可变结构域。bc8抗体可以包含具有如seq id no:12或seq id no:13所示的氨基酸序列的轻链。
23.bc8抗体可以包含具有如seq id no:2所示的氨基酸序列的重链可变结构域,或具有如seq id no:10所示的n末端氨基酸序列的重链可变结构域。bc8抗体可以包含具有至少一个具有如seq id no:6、seq id no:7和seq id no:8所示的氨基酸序列的互补决定区(cdr)的重链可变结构域。bc8抗体可以包含具有如seq id no:15或seq id no:16所示的氨基酸序列的重链。
24.根据某些方面,bc8抗体包含具有seq id no:15或16所示的氨基酸序列的重链,其中141位(相对于n末端氨基酸)的氨基酸是asp或asn。在bc8蛋白群中141位的asp:asn的比率可以在1:99至99:1的范围内,例如10:90至90:10。
25.根据某些方面,bc8抗体包含具有如seq id no:2所示的氨基酸序列的重链可变结构域,或具有如seq id no:10所示的n末端氨基酸序列的重链可变结构域,其中重链的141
位(相对于n末端氨基酸)的氨基酸是asp或asn,在bc8蛋白群中asp:asn的比率在1:99至99:1的范围内,例如10:90至90:10。
26.根据某些方面,任何上述bc8抗体(即包括seq id no:1-10中的一个或多个的那些)可以是嵌合或人源化抗体,即bc8c。bc8c抗体可以包含分别具有如seq id no:17-19所示的氨基酸序列的人igg1、igg2或igg4重链恒定区,具有如seq id no:20所示的氨基酸序列的人igg4重链恒定区(包括突变s228p),和/或具有如seq id no:21所示的氨基酸序列的人κ轻链恒定区。
27.本公开提供了用于直接治疗患有cd45阳性血液恶性肿瘤的受试者的方法,包括向受试者施用有效量的
225
ac-bc8或
177
lu-bc8作为单独的低剂量单次治疗剂或与其他疗法联合。
28.本公开提供了用于直接治疗患有cd45阳性血液恶性肿瘤的受试者的方法,包括向受试者施用有效量的
225
ac-bc8或
177
lu-bc8作为单独的低剂量单次治疗剂或与具有干细胞支持的其他疗法联合。
29.本公开涉及用于消耗、可逆地抑制或清除受试者的造血干细胞的方法,包括向受试者施用有效量的
225
ac-bc8或
177
lu-bc8。
30.本公开提供了通过以如下剂量向受试者施用有效量的
225
ac-bc8或
177
lu-bc8来消耗或可逆地抑制循环肿瘤细胞(例如,如在白血病、淋巴瘤、骨髓瘤、mds中发现的)的方法,所述剂量不会清髓,因此不会不可逆地消耗造血干细胞。这样的细胞可以至少包括调节性t细胞、髓源性抑制细胞、肿瘤相关巨噬细胞、分泌il-1和/或il-6的活化巨噬细胞中的任何一种及其组合。
31.本公开进一步提供了用于消耗、可逆地抑制或清除受试者的淋巴细胞的方法,包括向受试者施用有效量的
225
ac-bc8或
177
lu-bc8。
32.本公开还提供了用于治疗患有非癌性病症的受试者的方法,包括向受试者施用有效消耗、可逆地抑制或清除受试者的造血干细胞的量的
225
ac-bc8或
177
lu-bc8。根据某些方面,所述病症可通过基因编辑的细胞疗法治疗,并且所述方法进一步包括在施用
225
ac-bc8或
177
lu-bc8后对受试者执行所述疗法以治疗受试者的病症。根据某些方面,所述病症是scd并且所述疗法是基因编辑的β-珠蛋白造血干细胞疗法。根据某些方面,所述病症是scid并且所述疗法是基因编辑的造血干细胞疗法,其中经编辑的基因是共有γ链(γc)基因、腺苷脱氨酶(ada)基因和/或janus激酶3(jak3)基因。例如,干细胞疗法可以是同种异体的或自体的。
33.本公开还提供了用于治疗患有可通过基因编辑的细胞疗法治疗的癌性病症的受试者的方法,包括(i)向受试者施用有效消耗、可逆地抑制或清除受试者的造血干细胞的量的
225
ac-bc8或
177
lu-bc8,和(ii)在合适的时间段后,对受试者执行所述疗法以治疗受试者的病症。根据某些方面,适合治疗受试者的病症的疗法可以是骨髓移植或过继细胞疗法。
34.最后,本公开提供了一种制品,其包含(a)放射性标记的抗cd45抗体,例如
225
ac-bc8或
177
lu-bc8,和(b)指示使用者向受试者施用有效量的抗体以消耗受试者的造血干细胞的标记。
附图说明
35.专利或申请文件包含至少一幅以彩色制作的图。将根据专利局的要求和支付的必要费用提供本专利或专利申请公开的彩色附图副本。
36.图1显示了通过人cd45基因的差异剪接产生的cd45的各种同工型中的外显子使用的示意图。
37.图2提供了抗cd45单克隆抗体bc8轻链(vl)和重链(vh)的互补决定区(cdr)、骨架区和可变结构域序列的蛋白质序列。cdr以粗体和下划线显示(seq id no:1和2)。
38.图3提供了抗cd45单克隆抗体bc8轻链和重链的cdr和n末端蛋白质序列(seq id no:3-10)。
39.图4a提供了抗cd45单克隆抗体bc8轻链的完整核苷酸(seq id no:11)和氨基酸(seq id no:12)序列。
40.图4b提供了不含前导序列的抗cd45单克隆抗体bc8轻链的氨基酸(seq id no:13)序列。
41.图5a提供了抗cd45单克隆抗体bc8重链的完整核苷酸(seq id no:14)和氨基酸(seq id no:15)序列,其中发现在蛋白质群中的至少一部分的141位(从蛋白质序列的n末端)的天冬酰胺被脱氨基成天冬氨酸。
42.图5b提供了不含前导序列的抗cd45单克隆抗体bc8重链的氨基酸(seq id no:16)序列,其中发现在蛋白质群中的至少一部分的141位(从蛋白质序列的n末端)的天冬酰胺被脱氨基成天冬氨酸。
43.图6a-6c分别提供了人重链恒定区的氨基酸序列seq id no:17-19。
44.图6d提供了包含突变s228p的人重链恒定区的氨基酸序列(seq id no:20)。
45.图6e提供了人κ轻链恒定区的氨基酸序列(seq id no:21)。
46.图7描绘了根据本公开的某些方面在进行过继细胞疗法之前对受试者进行清淋的方法。
47.图8描绘了展示根据本公开的清淋方案的示例性清除和给药时间的药代动力学数据。
48.图9a和9b提供了用锕(
225
ac)对抗cd45单克隆抗体bc8进行放射性标记的方法的示意图,其中图9a说明了双功能螯合剂s-2-(4-异硫氰酸苄基)-1,4,7,10四氮杂环-十二烷四乙酸(p-scn-bn-dota;在图中称为dota)与抗cd45单克隆抗体的连接,图9b说明了用
225
ac对dota-抗cd45缀合物进行放射性标记以提供
225
ac-dota-抗cd45。
49.图10a和10b提供了来自sec-hplc(尺寸排阻色谱-高效液相色谱)的bc8标准品和
225
ac-dota-bc8的洗脱曲线,其中图10a说明了bc8标准品的洗脱,图10b说明了
225
ac-dota-bc8的洗脱(13分钟处的峰是为稳定缀合的抗体而添加的hsa)。
50.图11提供了显示
225
ac-dota-bc8在各种储存稀释度和温度下的稳定性作为时间的函数的图。
51.图12提供了显示
225
ac-dota-bc8对ramos细胞(cd45阳性细胞)和el4细胞(cd45阴性细胞)的免疫反应性的图。
52.图13a和13b提供了显示通过流式细胞术测量的各种抗体样品与cytotrol细胞的结合的图,其中图13a比较了幼稚bc8和幼稚18b7(对照非特异性)抗体与cytotrol细胞的结
合,图13b比较了幼稚bc8和dota-bc8抗体与cytotrol细胞的结合。
53.图14a提供了比较通过流式细胞术测量的幼稚bc8和dota-bc8与cytotrol细胞的结合的图。
54.图14b提供了显示通过洗涤后保留在细胞上的片段辐射测量的来自图14a的dota-bc8样品在用
225
ac标记后(即
225
ac-dota-bc8)的立即结合与
225
ac-18b7的结合(与cytotrol细胞结合)进行比较的条形图。
55.图15a和15b显示了比较通过流式细胞术(图15a)测量的或用
225
ac标记后(即
225
ac-dota-bc8;图15b)通过洗涤后保留在细胞上的片段辐射测量的dota-bc8与不同人类多发性骨髓瘤细胞系(即h929和u266)的结合的图。
56.图16a和16b显示了比较
225
ac-dota-bc8(图16a)和
225
ac-dota-18b7(图16b)抗体在对照小鼠中1小时、4小时、24小时、48小时和96小时的生物分布的条形图。
57.图17a和17b显示了比较
225
ac-dota-18b7(对照;图17a)和
225
ac-dota-bc8(图17b)抗体在u266和h929 scid-nod荷瘤小鼠中1小时、4小时、24小时、48小时和96小时的生物分布的条形图。
58.图18a显示了在用
225
ac-dota-bc8或
225
ac-dota-18b7(对照)进行放射免疫疗法治疗后,对负荷h929多发性骨髓瘤异种移植物的scid-nod小鼠的肿瘤体积进行比较的图。
59.图18b显示了在用
225
ac-dota-bc8或
225
ac-dota-18b7(对照)进行放射免疫疗法治疗后,对负荷u266多发性骨髓瘤异种移植物的scid-nod小鼠的肿瘤体积进行比较的图。
60.图19a-19d显示了从负荷u266和h929多发性骨髓瘤异种移植物的scid-nod小鼠切除的肿瘤的组织学分析,其中图19a显示了未经治疗的h929肿瘤,图19b显示了经
225
ac-dota-bc8治疗的h929肿瘤,图19c显示了未经治疗的u266肿瘤,图19d显示了经
225
ac-dota-bc8治疗的u266肿瘤。
61.图20显示了注射(i.p.)
111
ln-抗cd45的c57bl/6小鼠在注射后1小时、24小时、48小时、72小时、96小时和6天后采集的microspec/ct扫描。
62.图21了显示在用(a)
177
lu-抗cd45或(b)
131
i-抗cd45处理后,非荷瘤c57bl/6小鼠中各种免疫细胞亚群的消耗量的条形图。
63.图22显示了在用(a)
177
lu-抗cd45或(b)
131
i-抗cd45处理后,非荷瘤c57bl/6小鼠的脾脏中各种免疫细胞群的消耗量的条形图。
64.图23显示了证明
177
lu-抗cd45和
131
i-抗cd45清淋能够在ot i过继细胞治疗模型中控制肿瘤的图,其中(a)证明
177
lu-抗cd45和
131
i-抗cd45介导的靶向调理先于过继转移的ot i t细胞能够控制eg.7肿瘤的生长;(b)显示每组中个体小鼠的肿瘤大小;(c)显示未接受调理或ot i t细胞的对照小鼠以及用
177
lu-抗cd45和
131
i-抗cd45调理的对照小鼠的存活率。
65.序列简述
66.seq id no:1是抗cd45鼠免疫球蛋白bc8的轻链可变结构域的氨基酸序列。
67.seq id no:2是抗cd45鼠免疫球蛋白bc8的重链可变结构域的氨基酸序列。
68.seq id no:3是抗cd45鼠免疫球蛋白bc8的轻链cdr1的氨基酸序列。
69.seq id no:4是抗cd45鼠免疫球蛋白bc8的轻链cdr2的氨基酸序列。
70.seq id no:5是抗cd45鼠免疫球蛋白bc8的轻链cdr3的氨基酸序列。
71.seq id no:6是抗cd45鼠免疫球蛋白bc8的重链cdr1的氨基酸序列。
72.seq id no:7是抗cd45鼠免疫球蛋白bc8的重链cdr2的氨基酸序列。
73.seq id no:8是抗cd45鼠免疫球蛋白bc8的重链cdr3的氨基酸序列。
74.seq id no:9是抗cd45鼠免疫球蛋白bc8的轻链n末端的氨基酸序列。
75.seq id no:10是抗cd45鼠免疫球蛋白bc8的重链n末端的氨基酸序列。
76.seq id no:11是抗cd45鼠免疫球蛋白bc8的轻链的核苷酸序列。
77.seq id no:12是包含前导序列的抗cd45鼠免疫球蛋白bc8的轻链的氨基酸序列。
78.seq id no:13是抗cd45鼠免疫球蛋白bc8的轻链的氨基酸序列,起始于蛋白质n末端(即,不含前导序列)。
79.seq id no:14是抗cd45鼠免疫球蛋白bc8的重链的核苷酸序列。
80.seq id no:15是包含前导序列的抗cd45鼠免疫球蛋白bc8的重链的氨基酸序列。
81.seq id no:16是抗cd45鼠免疫球蛋白bc8的重链的氨基酸序列,起始于蛋白质n末端(即,不含前导序列)。
82.seq id no:17是人iggl重链恒定区的氨基酸序列。
83.seq id no:18是人igg2重链恒定区的氨基酸序列。
84.seq id no:19是人igg4重链恒定区的氨基酸序列。
85.seq id no:20是包含突变s228p的人igg4重链恒定区的氨基酸序列。
86.seq id no:21是人κ轻链恒定区的氨基酸序列。
87.定义和缩写
88.在整个本技术中,引用了各种出版物。这些出版物的公开内容在此通过引用并入本技术中,以更全面地描述本公开所属领域的状况。
89.在本技术中,使用了某些术语,其应具有如下所列出的含义。
90.除非上下文另有明确规定,否则单数形式“一个/一种(a)”、“一个/一种(an)”、“所述/该(the)”等包括复数指示物。因此,例如,提及“一种”抗体包括单一抗体和多种不同抗体。
91.当在数值名称(例如温度、时间、量和浓度)之前使用时,术语“约/大约”包括范围,表示可以变化
±
10%、
±
5%或
±
1%的近似值。
92.如本文所用,就抗体而言,“施用”是指通过适合抗体递送的任何已知方法将抗体递送至受试者的身体。具体的施用方式包括但不限于静脉内、经皮、皮下、腹膜内和鞘内施用。抗体的示例性施用方法可以基本上如国际公开号wo2016/187514中所述,其通过引用整体并入本文。
93.此外,根据本公开的方面,可以使用一种或多种常规使用的药学上可接受的载体来配制抗体。这样的载体是本领域技术人员熟知的。例如,可注射的药物递送系统包括溶液、悬浮液、凝胶、微球和聚合物注射剂,并且可以包含赋形剂,例如溶解度改变剂(例如,乙醇、丙二醇和蔗糖)和聚合物(例如,聚辛内酯和plga’s)。
94.如本文所用,术语“抗体”包括但不限于:(a)识别抗原的包含两条重链和两条轻链的免疫球蛋白分子;(b)多克隆和单克隆免疫球蛋白分子;(c)其单价和二价片段(例如,di-fab);和(d)其双特异性形式。免疫球蛋白分子可以衍生自任何众所周知的类别,包括但不限于iga、分泌型iga、igg和igm。igg亚类也是本领域技术人员熟知的,并且包括但不限于人igg1、igg2、igg3和igg4。抗体可以是天然存在的和非天然存在的(例如,igg-fc-沉默的)。
此外,抗体包括嵌合抗体、全合成抗体、单链抗体及其片段。抗体可以是人类的、人源化的或非人类的。
[0095]“人源化”抗体是指其中非人类抗体的cdr结构域外的一些、大部分或所有氨基酸被来源于人免疫球蛋白的相应氨基酸取代的抗体。在抗体的人源化形式的一个实施方案中,cdr结构域外的一些、大部分或所有氨基酸已被来自人免疫球蛋白的氨基酸取代,而一个或多个cdr区内的一些、大部分或所有氨基酸未改变。氨基酸的少量添加、缺失、插入、替换或修饰是允许的,只要它们不消除抗体与特定抗原结合的能力。“人源化”抗体保留了与原始抗体相似的抗原特异性。
[0096]“嵌合抗体”是指其中可变区来源于一个物种而恒定区来源于另一物种的抗体,例如其中可变区来源于小鼠抗体而恒定区来源于人抗体的抗体。
[0097]
如本文所用,“非癌性病症”或“非恶性肿瘤病症”包括但不限于血红蛋白病(例如scd)、先天性免疫缺陷(例如scid)、自身免疫性病症(例如多发性硬化症、类风湿性关节炎、硬皮病、系统性红斑狼疮、1型糖尿病、重症肌无力、干燥病、多发性肌炎等)和病毒感染(例如hiv感染)。非癌性病症排除例如实体癌(例如肿瘤)和血液恶性肿瘤。
[0098]
如本文所用,“癌症”或“恶性肿瘤病症”包括但不限于实体癌(例如肿瘤)和血液恶性肿瘤。“血液恶性肿瘤”,也称为血癌,是一种起源于造血组织(例如骨髓或免疫系统的其他细胞)的癌症。血液恶性肿瘤包括但不限于白血病(例如急性髓性白血病(aml)、急性早幼粒细胞白血病、急性淋巴细胞白血病(all)、急性混合系白血病、慢性髓性白血病、慢性淋巴细胞白血病(cll)、毛细胞白血病和大颗粒淋巴细胞白血病)、骨髓增生异常综合征(mds)、骨髓增殖性病症(真性红细胞增多症、原发性血小板增多症、原发性骨髓纤维化和慢性髓性白血病)、淋巴瘤、多发性骨髓瘤、mgus和类似病症、霍奇金淋巴瘤、非霍奇金淋巴瘤(nhl)、原发性纵隔大b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、转化滤泡性淋巴瘤、脾边缘区淋巴瘤、淋巴细胞性淋巴瘤、t细胞淋巴瘤和其他b细胞恶性肿瘤。
[0099]“实体癌”包括但不限于骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼内恶性黑色素瘤、子宫癌、卵巢癌、前列腺癌、直肠癌、肛门区癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、小儿肿瘤、膀胱癌、肾癌或输尿管癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管生成、脊髓轴肿瘤、脑干神经胶质瘤、垂体腺瘤、卡波西肉瘤、表皮样癌、鳞状细胞癌、环境诱发的癌症(包括由石棉诱发的癌症)。
[0100]
如本文所用,术语“负荷”在与癌细胞结合使用时是指数量。因此,癌细胞“负荷”是指癌细胞的数量。癌细胞具有关于其起源组织(即疾病的原发部位)的负荷,例如在aml的情况下的“骨髓胚细胞(blast)负荷”。癌细胞还具有关于起源组织之外的一种或多种组织的负荷,例如在aml的情况下的血液、肝脏和脾脏中的胚细胞负荷。术语“外周负荷”与此类细胞有关。可以以不同的方式测量癌细胞的外周负荷,例如在aml的情况下的胚细胞,具有不同的结果。例如,在aml的情况下,“外周胚细胞负荷”可以被测量为骨髓以外的总胚细胞群,或血液、脾脏和肝脏结合的总胚细胞群,或简单地以每单位体积的细胞为单位测量的血液的胚细胞群。如本文结合aml和其他起源于骨髓的癌症所使用的,并且除非另有说明,术语“外周癌细胞负荷”(例如外周胚细胞负荷)是指以每单位体积的细胞(例如细胞/μl)为单位测量的血液的癌细胞群。例如,这种基于血液的测量对于更繁琐的脾脏和肝脏负荷测量来
说是一个有用的代理。
[0101]
在本文中,如果当以最大安全剂量向受试者施用靶向血液恶性肿瘤相关抗原的药剂(例如本公开的放射性标记的抗cd45抗体)时,该药剂无法以足够与该部位处90%以上的靶抗原结合的量到达疾病的原发部位,则受试者中的外周癌细胞负荷是“高的”。相反,如果当以最大安全剂量向受试者施用药剂时,该药剂以足够与该部位处90%以上的靶抗原结合的量到达疾病的原发部位,则受试者中的外周癌细胞负荷是“低的”。在aml的情况下,低外周胚细胞负荷的实例是产生等于或低于1,000个胚细胞/μl、等于或低于500个胚细胞/μl、等于或低于400个胚细胞/μl、等于或低于300个胚细胞/μl、等于或低于200个胚细胞/μl、等于或低于100个胚细胞/μl以及等于或低于50个胚细胞/μl的血液胚细胞负荷的那些。
[0102]
如本文所用,本公开的放射性标记的抗cd45抗体的“低剂量”是亚饱和的,因此向受试者体内引入比靶抗原(即cd45分子)更少的靶抗原结合位点(即施用的抗体上的cd45结合位点)。根据某些方面,放射性标记的抗cd45抗体的低剂量是其中cd45结合位点与cd45分子的比率小于或等于9:10(例如小于或等于1:2、或小于或等于1:5、或小于或等于1:10、或小于或等于1:20、或小于或等于1:100)的剂量。
[0103]
如本文所用,术语“受试者”或“患者”是可互换的,并且包括但不限于哺乳动物,例如人类、非人类灵长类动物、狗、猫、马、绵羊、山羊、牛、兔子、猪、大鼠和小鼠。在受试者是人的情况下,受试者可以是任何年龄。根据某些方面,受试者是婴儿。根据进一步的方面,受试者是1、2、3、4、5、6、7、8、9或10。根据又进一步的方面,受试者是从10到15或从15到20。根据又进一步的方面,受试者是20岁或以上、25岁或以上、30岁或以上、35岁或以上、40岁或以上、45岁或以上、50岁或以上、55岁或以上、60岁或以上、65岁或以上、70岁或以上、75岁或以上、80岁或以上、85岁或以上、或90岁或以上。
[0104]
如本文所用,“治疗”患有病症的受试者应包括但不限于,(i)减缓、停止或逆转病症的进展,(ii)减缓、停止或逆转病症症状的进展,(iii)降低和理想地消除病症复发的可能性,和/或(iv)降低和理想地消除病症症状复发的可能性。根据某些优选方面,治疗患有病症的受试者是指(i)逆转病症的进展,理想地达到消除病症的程度,和/或(ii)逆转病症症状的进展,理想地达到消除症状的程度,和/或(iii)降低或消除复发的可能性。理想地,治疗患有病症的受试者是指通过消除其遗传原因或以其他方式使其遗传原因失效来治愈病症。
[0105]
如本文所用,关于受试者的特定细胞类型的“消耗”是指将受试者内的细胞群减少至少10%、20%、30%、40%、50%、60%、70%、80%、90%或95%。如本文所用,关于受试者的特定细胞类型的“清除”是指将受试者内的细胞群减少大于95%,例如减少至少96%、或97%、或98%、或99%、或甚至100%。
[0106]
使用本公开的组合物和方法消耗的特定细胞类型至少包括造血干细胞(即多能造血干细胞,也称为成血细胞)和淋巴细胞,例如外周血淋巴细胞或骨髓淋巴细胞。造血干细胞(“hsc”)是多能的、自我更新的祖细胞,所有分化的血细胞类型都在造血过程中由其产生。hsc被认为分化成两种谱系受限的、淋巴性和髓性-红系的寡能祖细胞,尽管另一种用于血液谱系发育的“基于骨髓”的模型描述了一种新型的中间髓性-淋巴性祖细胞,它具有产生两个谱系的后代的能力。
[0107]
如本文所用,术语“造血干细胞”(“hsc”)是指具有自我更新和分化成成熟血细胞
的能力的未成熟血细胞,其包括但不限于粒细胞(例如,早幼粒细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞(例如,网织红细胞、红细胞)、凝血细胞(例如,成巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如,单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞)。这样的细胞可以包括cd34 细胞。cd34 细胞是表达cd34细胞表面标志物的未成熟细胞。
[0108]
测量hsc群的方法是常规的。它们包括例如使用流式细胞术检测骨髓样品中的人类hsc,并对各种细胞表面标志物(例如lin、cd34、cd38、cd43、cd45ro、cd45ra、cd59、cd90、cd109、cd117、cd133、cd166和hla dr)进行染色。在外周血中也可以检测到患者的免疫细胞的减少。测量外周血淋巴细胞群的方法是常规的。它们包括例如对全血样品进行流式细胞术,以基于用针对特定细胞表面标志物(例如cd45、cd3、cd4或cd8)的荧光抗体进行标记来确定淋巴细胞计数。测量外周血嗜中性粒细胞群的方法也是常规的。它们包括例如对全血样品进行流式细胞术,以基于用针对特定细胞表面标志物(例如ly6g)的荧光抗体进行标记来确定嗜中性粒细胞计数。
[0109]
根据本公开的某些方面,通过测量受试者的外周血淋巴细胞水平来确定受试者的淋巴细胞减少。如本文所用,受试者的“外周血淋巴细胞”应指在受试者的血液中循环的成熟淋巴细胞。外周血淋巴细胞的实例包括但不限于外周血t细胞、外周血nk细胞和外周血b细胞。因此,举例来说,如果受试者的外周血淋巴细胞中至少一种类型的群体降低不超过95%,则受试者的淋巴细胞群被消耗。例如,如果受试者的外周血t细胞水平降低50%,受试者的外周血nk细胞水平降低40%,和/或受试者的外周血b细胞水平降低30%,则受试者的淋巴细胞被消耗。在该实例中,即使另一种免疫细胞类型(例如嗜中性粒细胞)的水平没有降低,受试者的淋巴细胞也被消耗。根据某些方面,消耗受试者的淋巴细胞是通过外周血淋巴细胞群减少至少10%、20%、30%、40%、50%、60%、70%、80%、90%或95%反映的。
[0110]
如本文所用,“需要”造血干细胞移植的患者包括在一种或多种血细胞类型中表现出缺乏的患者,以及患有干细胞病症、自身免疫性疾病、癌症或本文描述的其他病理学的患者。造血干细胞通常表现出1)多能性,因此可以分化成多种不同的血液谱系,包括但不限于粒细胞(例如,早幼粒细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞(例如,网织红细胞、红细胞)、凝血细胞(例如,成巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如,单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞),2)自我更新,因此可以产生与母细胞具有同等潜力的子细胞,以及3)被重新引入移植受体的能力,然后它们回到造血干细胞生态位并重新建立生产性和持续的造血作用。
[0111]
另外或替代地,“需要”造血干细胞移植的患者可以是患有或未患有病理学但仍然表现出降低水平(例如,与健康受试者的水平相比)的造血谱系中的一种或多种内源性细胞类型,例如巨核细胞、凝血细胞、血小板、红细胞、肥大细胞、成肌细胞、嗜碱性粒细胞、嗜中性粒细胞、嗜酸性粒细胞、小胶质细胞、粒细胞、单核细胞、破骨细胞、抗原呈递细胞、巨噬细胞、树突细胞、自然杀伤细胞、t淋巴细胞和b淋巴细胞。
[0112]
抗cd45抗体
[0113]
如本文所用,“抗cd45抗体”或“抗cd45免疫球蛋白”是与cd45表位结合的抗体。根据某些方面,抗cd45抗体可以与由单克隆抗体“bc8”识别的表位结合。bc8是已知的,其制备
no:21所示的氨基酸序列的人κ轻链恒定区(图6a-6e)。
[0121]
根据某些方面,bc8单克隆抗体可以是嵌合的(bc8c),其包含具有如seq id no:17-20中任一项所示的氨基酸序列的人iggl、igg2或igg4重链恒定区和具有如seq id no:21所示的氨基酸序列的人κ轻链恒定区(图6a-6e)。
[0122]
根据某些方面,嵌合bc8c单克隆抗体可以包含具有seq id no:1所示的氨基酸序列的轻链可变区(图2)。bc8c单克隆抗体可以包含具有seq id no:9所示的n末端氨基酸序列的轻链(图3)。bc8c单克隆抗体可以包含具有至少一个互补决定区的轻链,该互补决定区具有如seq id no:3、seq id no:4或seq id no:5所示的氨基酸序列(图3)。
[0123]
根据某些方面,嵌合bc8c单克隆抗体可以包含具有seq id no:2所示的氨基酸序列的重链可变区(图2)。bc8c单克隆抗体可以包含具有seq id no:10所示的n末端氨基酸序列的重链(图3)。bc8c单克隆抗体可以包含具有至少一个互补决定区的重链,该互补决定区具有如seq id no:6、seq id no:7或seq id no:8所示的氨基酸序列(图3)。
[0124]
根据某些方面,bc8或bc8c单克隆抗体的重链包含c末端赖氨酸、已丢失c末端赖氨酸(k)的c末端甘氨酸(g),或缺乏两者gk。当提及包含本文所述的经修饰的重链恒定区的抗体时,该抗体可以包含具有c末端gk或k,或者缺少gk或k的所提供的序列。
[0125]
患者特异性组合物
[0126]
如本文所用,包含
225
ac标记的bc8的组合物包括锕-225标记的抗体和未标记的抗体,少数是锕-225标记的抗体。同样,对于
177
lu标记的bc8,组合物将包括标记和未标记的抗体群。可以使用已知方法调整标记抗体与未标记抗体的比率。因此,根据本公开的某些方面,抗cd45抗体可以以至多100mg,例如至多60mg,例如5mg至45mg的总蛋白量提供,或以0.001mg/kg患者体重至3.0mg/kg患者体重,例如0.005mg/kg患者体重至2.0mg/kg患者体重,或0.01mg/kg患者体重至1mg/kg患者体重,或0.1mg/kg患者体重至0.6mg/kg患者体重,或0.3mg/kg患者体重,或0.4mg/kg患者体重,或0.5mg/kg患者体重,或0.6mg/kg患者体重的总蛋白量提供。
[0127]
根据本公开的某些方面,放射性标记的抗cd45抗体(即,
225
ac标记的bc8或
177
lu标记的bc8)可以包含标记部分和未标记部分,其中标记:未标记的比率可以是约0.01:10至1:10,例如0.01:5至0.1:5,或0.01:3至0.1:3,或0.01:1至0.1:1的标记:未标记。此外,放射性标记的抗cd45抗体可以作为针对特定患者定制的单剂量组合物提供,其中组合物中标记和未标记的抗cd45抗体的量可以至少取决于患者的体重、年龄、性别和/或疾病状态或健康状况。参见例如在国际公开号wo 2016/187514中公开的施用方法,其通过引用整体并入本文。根据某些方面,可以以多剂量提供放射性标记的抗cd45抗体,其中方案中的每个剂量可以包含针对特定患者定制的组合物,其中组合物中标记和未标记的抗cd45抗体的量可以至少取决于患者的体重、年龄、性别和/或疾病状态或健康状况。
[0128]
抗cd45抗体的标记部分和未标记部分的本发明组合允许针对特定患者定制组合物,其中基于至少一个患者特定参数针对该患者对单克隆抗体的辐射剂量和蛋白质剂量中的每一个进行个性化。因此,可以为特定患者制备组合物的每个小瓶,其中小瓶的全部内容物以单剂量递送给该患者。当治疗方案需要多剂量时,每个剂量可以作为患者特定剂量被配制在小瓶中,以“单剂量”施用给患者(即,一次施用小瓶的全部内容物)。可以以类似的方式配制随后的剂量,使得方案中的每个剂量在单剂量容器中提供患者特定剂量。所公开的
组合物的优点之一是不存在需要由医务人员丢弃或处理的剩余辐射,例如无需稀释或其他操作以获得患者的剂量。当提供在单剂量容器中时,该容器简单地在线放置在输注管组中以便输注给患者。此外,可以对体积进行标准化,从而大大降低医疗错误(即,递送不正确的剂量,因为组合物的整个体积将在一次输注中施用)的可能性。
[0129]
血液疾病的治疗
[0130]
大多数血液系统来源的恶性肿瘤,无论是骨髓还是淋巴来源的,都不同程度地在肿瘤细胞表面表达cd45。这包括白血病(例如急性髓性白血病(aml)、急性早幼粒细胞白血病、急性淋巴细胞白血病(all)、急性混合系白血病、慢性髓性白血病、慢性淋巴细胞白血病(cll)、毛细胞白血病和大颗粒淋巴细胞白血病)、骨髓增生异常综合征(mds)、骨髓增生性病症(真性红细胞增多症、原发性血小板增多症、原发性骨髓纤维化和慢性髓性白血病)、淋巴瘤、多发性骨髓瘤、mgus和类似病症、霍奇金淋巴瘤、非霍奇金淋巴瘤(nhl)、原发性纵隔大b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、转化滤泡性淋巴瘤、脾边缘区淋巴瘤、淋巴细胞性淋巴瘤、t细胞淋巴瘤和其他b细胞恶性肿瘤。因此,当将一定量的放射性标记的抗cd45抗体施用于患者时,将有效地作为直接抗肿瘤疗法以减少外周和免疫细胞区室(例如骨髓、脾脏和淋巴结)中的肿瘤胚细胞计数。
[0131]
使用放射性标记的抗cd45抗体的直接疗法可以作为减少肿瘤胚细胞计数但可逆地保留造血干细胞所必需的低剂量单一药剂,或与其他治疗剂如化疗剂或靶向治疗剂组合(例如但不限于:hdac抑制剂、bcl2抑制剂、单克隆抗体或酪氨酸激酶受体抑制剂
–
tki)。
[0132]
有效控制肿瘤生长并减少胚细胞计数而不会不可逆地消耗造血干细胞的
225
ac放射性标记的抗cd45抗体的剂量将在低于阈值水平下递送对骨髓的辐射暴露。2gy的剂量被认为是非清髓性辐射剂量。理想的剂量将递送至少2gy的剂量,但足以消除白血病或淋巴瘤肿瘤细胞并提供短暂但可逆的骨髓抑制。预计高于2gy但低于清髓剂量的剂量水平可有效控制淋巴瘤和白血病的肿瘤负荷。此外,将单一低剂量的放射性标记的抗cd45抗体治疗与另一种靶向药剂相结合,可以使用较低剂量的抗体放射性缀合物来实现有效的抗肿瘤活性,从而进一步避免造血干细胞的消耗。
[0133]
示例性低剂量可以是小于150μci(例如10μci至100μci)的
225
ac-bc8剂量,或小于2μci/kg(例如0.01μci/kg至1.5μci/kg或0.1μci/kg至1.0μci/kg)的剂量。
[0134]
循环肿瘤和骨髓胚细胞的消耗
[0135]
血液恶性肿瘤,包括但不限于白血病,例如急性髓性白血病、急性淋巴细胞白血病、多发性骨髓瘤等,对有效疗法提出了一系列独特的问题。如果杀死得太快,通常与白血病相关的循环肿瘤细胞的高负荷可能对患者有毒。细胞减灭疗法是减少循环胚细胞的数量的过程。
[0136]
根据某些方面,细胞减灭疗法可用于治疗血液恶性肿瘤,并且通常包括施用低剂量的放射性标记的抗cd45,例如消耗循环肿瘤细胞(例如白血病、淋巴瘤、骨髓瘤、mds)的剂量,但不是清髓性的,因此不会不可逆地消耗hsc。示例性低剂量可以是小于150μci(例如10μci至100μci)的
225
ac-bc8剂量,或小于2μci/kg(例如0.01μci/kg至1.5μci/kg或0.1μci/kg至1.0μci/kg)的剂量。
[0137]
造血干细胞疗法
[0138]
造血干细胞疗法包括造血干细胞的施用,例如骨髓移植(bmt)。可以将造血干细胞
t细胞;(ii)不能正确表达特定t细胞受体但能正确表达所有检查点受体和所有其他t细胞受体的同种异体基因编辑的car t细胞;和(iii)不能正确表达pd1也不能正确表达特定t细胞受体,但能正确表达所有其他检查点受体和所有其他t细胞受体的同种异体基因编辑的car t细胞。
[0147]
用于产生同种异体的通用car t细胞的t细胞基因编辑的实例包括eyquem及其同事的工作(eyquem等人,2017,nature.543:113-117)。在该研究中,内源性t细胞受体α恒定基因座(trac)被重组car基因构建体有效取代。通过这种方法,重组car被有效地置于细胞天然tcr调节信号的控制之下。通过该同样的策略,car或重组tcr可以通过敲入t细胞受体β恒定基因座(trbc)或β-2微球蛋白(b2m)mhc-i相关基因座而被有效地插入,已知在所有t细胞中表达。另一个实例包括ren及其同事的工作(ren等人,2017,clin.cancer res 23:2255-2266)。认识到检查点受体具有免疫抑制作用并且可能减弱对外源性自体或同种异体car t细胞的刺激,该小组利用crispr/cas9技术消除内源性tcrα和β基因座(trac和trbc)以及b2m基因,同时也沉默内源性pd1基因。通过这种方法,工程化的细胞不会引发移植物抗宿主病,但会抵抗免疫检查点受体抑制。
[0148]
清淋和清髓
[0149]
在给患者施用一定剂量的hst(例如,骨髓移植)或工程化的免疫细胞之前,通常对患者进行清淋。清淋过程被认为对bmt和过继细胞治疗(act)方法的成功非常重要,实际上是必不可少的。该过程在免疫微环境(例如骨髓)中创造了足够的空间,以允许转移细胞的植入。它还通过引发有利的细胞因子谱为转移细胞的成功植入、增殖和持久性创造了有利的免疫稳态环境。它引发了这种细胞因子谱,特别是在外周免疫生态位(例如骨髓、脾脏和淋巴结)中,用于工程化的细胞的建立和增殖。(参见,例如,maine等人,2002,j.clin.invest.,110:157-159;muranski等人,2006,nat.clin.pract.oncol.,3(12):668-681;klebanoff等人,2005,trends immunol.,26(2):111-117)。
[0150]
如上文所述,骨髓和淋巴来源的细胞表达cd45。有效减少胚细胞计数而不会不可逆地消耗造血干细胞的
225
ac放射性标记的抗cd45抗体的剂量将在低于阈值水平下递送对骨髓的辐射暴露。2gy的剂量被认为是非清髓性辐射剂量。至少2gy的剂量可以提供短暂但可逆的骨髓抑制。清髓剂量是可变的,例如在8-18gy的范围内,但通常包括向骨髓递送超过10-12gy的剂量。因此,可以提供可逆免疫抑制(有或没有干细胞支持)的治疗性低剂量范围将是2gy或更高,但低于清髓剂量,例如等于或低于8gy。对于更高剂量,可能需要干细胞支持。
[0151]
如本文所用,当施用一定量的放射性标记的抗cd45抗体时,如果细胞群减少至少10%、20%、30%、40%、50%、60%、70%、80%、90%或95%,则对于消耗特定的靶向细胞类型是“有效的”。例如,当施用一定量的放射性标记的抗cd45抗体时,如果外周血淋巴细胞被消耗而不消耗受试者的嗜中性粒细胞,或受试者的嗜中性粒细胞减少少于10%或20%,则对于消耗受试者的外周血淋巴细胞是“有效的”。“有效”量的放射性标记的抗cd45抗体也可以与将消耗受试者的调节性t细胞、髓源性抑制细胞、肿瘤相关巨噬细胞、分泌il-1和/或il-6的活化巨噬细胞及其组合的量相关,例如至少20%、或30%、40%、50%、60%、70%、80%、90%或95%。
[0152]
如本文所用,当施用一定量的放射性标记的抗cd45抗体时,如果细胞群(例如受试
者的hsc水平或淋巴细胞水平)降低超过95%,例如至少96%,或97%,或98%,或甚至99%,则对于可逆地抑制靶向细胞类型是“有效的”。“可逆免疫抑制”通常包括使用低剂量治疗剂或其组合,例如本文公开的锕-225标记的bc8,以比标准清淋更大程度地消耗靶向细胞而不清除靶细胞,即,以小于清髓剂量的剂量(非清髓剂量)。此外,可逆免疫抑制可能表明靶向免疫群体(免疫特权细胞群或组织)只是被暂时消耗,而其他未靶向群体不受影响。
[0153]
如下文公开的,本公开的可逆免疫抑制通常可以包括施用锕-225标记的bc8和另一种药剂,例如另一种免疫治疗剂或放射增敏剂。
[0154]
如本文所用,当施用一定量的放射性标记的抗cd45抗体时,如果细胞群(例如受试者的hsc水平或淋巴细胞水平)降低100%(也称为清髓),则对于清除靶向细胞类型是“有效的”。
[0155]
根据本公开的某些方面,放射性标记的抗cd45抗体是锕-225标记的bc8(
225
ac标记的bc8),并且
225
ac标记的bc8的有效量低于例如5.0μci/kg(即,向受试者施用的
225
ac-bc8的量递送低于5.0μci/kg受试者体重的辐射剂量)。
[0156]
根据本公开的方面,
225
ac标记的bc8的有效量低于4.5μci/kg、4.0μci/kg、3.5μci/kg、3.0μci/kg、2.5μci/kg、2.0μci/kg、1.5μci/kg、1.0μci/kg、0.9μci/kg、0.8μci/kg、0.7μci/kg、0.6μci/kg、0.5μci/kg、0.4μci/kg、0.3μci/kg、0.2μci/kg、0.1μci/kg、0.05μci/kg或0.01μci/kg。根据某些方面,
225
ac标记的bc8的有效量为至少0.01μci/kg、或0.05μci/kg、0.1μci/kg、0.2μci/kg、0.3μci/kg、0.4μci/kg、0.5μci/kg、0.6μci/kg、0.7μci/kg、0.8μci/kg、0.9μci/kg、1μci/kg、1.5μci/kg、2μci/kg、2.5μci/kg、3μci/kg、3.5μci/kg、4μci/kg或4.5μci/kg。根据某些方面,225ac标记的bc8可以包括如本文所述的上限和下限的任何组合的剂量施用,例如从至少0.1μci/kg至低于5μci/kg,或从至少0.5μci/kg至低于3μci/kg。
[0157]
根据某些方面,
225
ac标记的bc8的有效量低于1.0mci,例如低于0.5mci(即,其中
225
ac以非基于体重的剂量施用于受试者)。根据某些方面,
225
ac标记的bc8的有效剂量可以低于1.0mci,例如低于0.9mci、0.8mci、0.7mci、0.6mci、0.5mci、0.45mci、0.4mci、0.35mci、0.3mci、0.25mci、0.2mci、0.1mci、90μci、80μci、70μci、60μci、50μci、40μci、30μci、20μci、10μci或5μci。
225
ac标记的bc8的有效量可以是至少2μci,例如至少5μci、10μci、20μci、30μci、40μci、50μci、60μci、70μci、80μci、90μci、100μci、120μci、140μci、160μci、180μci、200μci、300μci、400μci、500μci、600μci、700μci、800μci或900μci。根据某些方面,
225
ac标记的bc8可以以包括如本文所述的上限和下限的任何组合的剂量施用,例如从至少15μci至低于120μci,或从至少20μci至低于100μci,或从80μci至低于500μci。根据某些方面,
225
ac标记的bc8可以以低剂量施用。示例性低剂量可以是小于150μci(例如从10μci至100μci)的
225
ac-bc8剂量,或小于2μci/kg(例如从0.01μci/kg至1.5μci/kg或0.1μci/kg至1.0μci/kg)的剂量。
[0158]
根据本公开的某些方面,放射性标记的抗cd45抗体是镥-177标记的bc8(
177
lu标记的bc8),并且
177
lu标记的bc8的有效量低于例如500μci/kg(即,向受试者施用的
177
lu-bc8的量递送低于500μci/kg受试者体重的辐射剂量)。
[0159]
根据本公开的方面,
177
lu标记的bc8的有效量低于450μci/kg、400μci/kg、350μci/kg、300μci/kg、250μci/kg、200μci/kg、150μci/kg、100μci/kg、90μci/kg、80μci/kg、70μci/kg、60μci/kg、50μci/kg、40μci/kg、30μci/kg、20μci/kg、10μci/kg、5μci/kg或1μci/kg。根
据某些方面,
177
lu标记的bc8的有效量为至少1μci/kg、2.5μci/kg、5μci/kg、10μci/kg、20μci/kg、30μci/kg、40μci/kg、50μci/kg、60μci/kg、70μci/kg、80μci/kg、90μci/kg、100μci/kg、150μci/kg、200μci/kg、250μci/kg、300μci/kg、350μci/kg、400μci/kg或450μci/kg。根据某些方面,
177
lu标记的bc8可以以包括如本文所述的上限和下限的任何组合的剂量施用,例如从至少5μci/kg至低于50μci/kg,或从至少50μci/kg至低于500μci/kg。
[0160]
根据某些方面,
177
lu标记的bc8的有效量低于20mci,例如低于15mci、10mci、9mci、8mci、7mci、6mci、5mci、3mci、2mci、1mci、800μci、600μci、400μci、200μci、100μci或50μci。
177
lu标记的bc8的有效量可以是至少10μci,例如至少25μci、50μci、100μci、200μci、300μci、400μci、500μci、600μci、700μci、800μci、900μci、1mci、2mci、3mci、4mci、5mci、10mci或15mci。根据某些方面,
177
lu标记的bc8可以以包括如本文所述的上限和下限的任何组合的剂量施用,例如从至少10μci至低于20mci,或从至少100μci至低于3mci,或从3mci至低于20mci。
[0161]
如本文所用,在向受试者施用放射性标记的抗cd45抗体之后和对受试者进行另外的治疗之前的“合适的时间段”是足以允许施用的抗体消耗、可逆地抑制或清除受试者的靶向细胞(例如受试者的hsc和/或淋巴细胞)的时间段。根据某些方面,合适的时间段为少于15天、少于14天、少于13天、少于12天、少于11天、少于10天、少于9天、少于8天、少于7天、少于6天、少于5天、少于4天或少于3天。根据某些方面,合适的时间段是1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天或超过15天。
[0162]
根据某些方面,在施用放射性标记的抗cd45抗体之后可以进行act程序的合适的时间段是3天、4天、5天、6天、7天、8天或9天,例如优选6、7或8天。
[0163]
在整个本技术中,引用了各种出版物。这些出版物的公开内容在此通过引用并入本技术中,以更全面地描述本公开所属领域的状况。除非另有定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文所述的方法和材料相似或等效的方法和材料可用于本文所述的实践或测试,但合适的方法和材料如下所述。
具体实施方式
[0164]
本公开通过提供一种预料不到的优越方式来消耗、可逆地免疫抑制或清除受试者中的特定细胞,例如受试者的造血干细胞或淋巴细胞,从而解决了本领域中未满足的需求。这些细胞的可逆免疫抑制可用于治疗cd45阳性血液恶性肿瘤,并且可以使用低剂量治疗来实现,例如以亚饱和辐射剂量施用抗cd45抗体。
[0165]
放射性标记的抗cd45抗体已显示出在骨髓移植前进行靶向清髓性调理的临床潜力。cd45是有吸引力的用于调理的靶标,因为它在包括造血干细胞、淋巴和骨髓细胞在内的所有有核免疫细胞中高度表达。强效α发射体225-锕(
225
ac)是很有前途的用于靶向调理的放射性核素,在短路径长度上具有高线性能量转移(80-100kev/μm),半衰期长达9.9天。
[0166]
此外,使用高剂量治疗剂(即更高的辐射剂量)来消耗或清除这些细胞可能是基于细胞的疗法如骨髓移植和/或过继细胞疗法(例如嵌合抗原受体疗法、car t细胞疗法或tcr细胞疗法)或基于基因编辑的细胞疗法(例如,针对镰状细胞病scd的基因编辑的β-珠蛋白造血干细胞疗法)的先行处理(precursor)。
[0167]
因此,本公开使用放射性标记的抗cd45抗体(例如
225
ac-bc8)来消耗、可逆地免疫抑制或清除受试者中的特定细胞。抗体可以通过靶向调理安全有效地消耗或清除受试者的造血干细胞或淋巴细胞。这种方法避免了由不太特异性的药剂(如化学治疗剂或外部束辐射)引起的某些不利影响。
[0168]
本公开提供了治疗多种病症的方法,例如造血谱系中的细胞类型的疾病、癌症、自身免疫性疾病、代谢病症和干细胞病症等。本文所述的组合物和方法可以(i)直接消耗或清除引起病理学的细胞群,例如癌细胞(例如白血病细胞)群和自身免疫细胞(例如自身反应性t细胞)群,和/或(ii)消耗或清除内源性造血干细胞群,从而通过提供移植细胞可归巢的生态位来促进移植的造血干细胞的植入。
[0169]
上述活性可以通过施用包含
225
ac-bc8或
177
lu-bc8的组合物来实现。在直接治疗疾病的情况下,这种施用可以导致引起目标病理学的细胞数量减少。在为患者准备造血干细胞移植疗法的情况下,这种施用可以导致内源性造血干细胞群的选择性消耗、可逆抑制或清除,从而在造血组织(例如骨髓或淋巴细胞)中产生空缺,随后可以由移植的外源性造血干细胞填充该空缺,即骨髓移植或过继细胞转移。
[0170]
放射性标记的免疫治疗剂
[0171]
根据本公开的方面,抗cd45免疫球蛋白bc8可以包括
225
ac或
177
lu。根据某些优选方面,抗cd45免疫球蛋白bc8可以用发射α的放射性核素锕-225(
225
ac)进行放射性标记。与单克隆抗体bc8缀合的
225
ac有效载荷将高能α粒子直接递送到靶向细胞,产生致命的双链dna断裂。由于其路径长度短,其高能α粒子发射的范围只有几个细胞直径的厚度,从而限制了对附近非恶性或正常组织的损害。因此,
225
ac-bc8可以在低于
177
lu-bc8的辐射量下提供治疗有效剂量。
[0172]
此外,
225
ac-抗体缀合物提供优于现有技术的抗体-药物缀合物的关键优点,因为发现它们甚至在具有低靶抗原表达肿瘤的患者中也是有效的。这是因为
225
ac具有巨大的细胞毒性作用,这与抗体-药物缀合物形成鲜明对比,后者需要数百个抗体分子与其各自的抗原结合,从而对靶向细胞或组织产生作用。
[0173]
放射性有效载荷相对于药物或毒素的其他优点包括:1)递送辐射的抗体不需要被内化来杀死细胞;2)并非靶向组织或肿瘤中的每个细胞都需要被抗体靶向;和3)与抗体-药物缀合物相比,与抗体连接的放射性同位素不太可能引发可能限制后续使用的显著免疫反应。此外,本文报道的研究证明了
225
ac标记的抗体的稳定性及其高度靶向的细胞毒性。
[0174]
根据本公开的某些方面,
225
ac可以被缀合至单克隆抗体的螯合剂连接或螯合。如在下文实施例3中详述,可以通过以下制备抗cd45免疫球蛋白:首先形成螯合剂缀合的抗cd45(“缀合的抗cd45”),然后将放射性核素与缀合的抗cd45螯合以形成放射性标记的抗cd45抗体(即,
225
ac-bc8)。
[0175]
根据本文所述的形成放射性标记的抗cd45的方法,抗cd45单克隆抗体可以溶解在包含螯合剂的缓冲溶液中。可以选择ph以优化螯合剂与抗体在缀合反应混合物中缀合的条件。缀合反应混合物可以包含碳酸氢盐缓冲液或磷酸盐缓冲液。缀合反应混合物可以具有约8.0至约9.2的ph。例如,缀合反应混合物可以具有约8.0、约8.1、约8.3、约8.4、约8.5、约8.6、约8.7、约8.8、约8.9、约9.0、约9.1或约9.2的ph。可以调节缀合反应混合物的温度以促进螯合剂与靶向部分的缀合。例如,缀合反应混合物可以在约室温或约37℃的温度下孵育。
可以将缀合反应混合物孵育足以提供缀合的任何时间量,例如约1.5小时。
[0176]
缀合的抗cd45可以溶解在包含放射性核素的缓冲溶液中。可以选择ph以优化放射性核素与缀合的抗cd45在螯合反应混合物中的螯合条件。螯合反应混合物可以具有约5.5至约7.0的ph。例如,螯合反应混合物可以具有约5.5、约5.6、约5.7、约5.8、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8、约6.9或约7.0的ph。
[0177]
可以调节螯合反应混合物的温度以促进放射性核素与缀合的抗cd45免疫球蛋白的螯合。例如,螯合反应混合物可以在约37℃的温度下孵育。螯合反应混合物可以孵育约1.5小时。一段时间后,可以通过添加淬灭螯合物(例如二亚乙基三胺五乙酸(dtpa))来淬灭溶液,并且可以纯化反应混合物。螯合反应混合物可以在加入淬灭螯合物后进一步孵育,例如在加入淬灭螯合物后在约37℃下孵育约30分钟。
[0178]
可用于本公开的螯合剂是具有螯合金属离子加上共价结合生物载体(例如抗体)的能力的双重功能的化合物。许多螯合剂是本领域已知的。适用于本公开的示例性螯合剂包括但不限于以下螯合剂,例如s-2-(4-异硫氰酸苄基)-1,4,7,10四氮杂环十二烷四乙酸(p-scn-bn-dota)、二亚乙基三胺五乙酸(dtpa);乙二胺四乙酸(edta);1,4,7,10-四氮杂环十二烷-n,n',n",n'"-四乙酸(dota);对异硫氰酸-苄基-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(p-scn-bz-dota);1,4,7,10-四氮杂环十二烷-n,n',n"-三乙酸(do3a);1,4,7,10-四氮杂环十二烷-1,4,7,10-四(2-丙酸)(dotma);3,6,9-triaza-12-氧杂-3,6,9-三羧基亚甲基-10-羧基-13-苯基-十三酸(“b-19036”);1,4,7-三氮杂环壬烷-n,n',n"-三乙酸(nota);1,4,8,11-四氮杂环十四烷-n,n',n",n'"-四乙酸(teta);三亚乙基四胺六乙酸(ttha);反式-1,2-二氨基己烷四乙酸(cydta);1,4,7,10-四氮杂环十二烷-1-(2-羟丙基)-4,7,10-三乙酸(hp-do3a);反式环己烷二胺四乙酸(cdta);反式(1,2)-环己烷二亚甲基三胺五乙酸(cdtpa);1-氧杂-4,7,10-三氮杂环十二烷-n,n',n"-三乙酸(otta);1,4,7,10-四氮杂环十二烷-1,4,7,10-四{3-(4-羧基)-丁酸};1,4,7,10-四氮杂环十二烷-1,4,7,10-四(乙酸-甲基酰胺);1,4,7,10-四氮杂环十二烷-1,4,7,10-四(亚甲基膦酸);及其衍生物。
[0179]
一个或多个步骤可用于将缀合的cd45与缀合反应混合物的其他成分分离或将放射性标记的抗cd45与螯合反应混合物的其他成分分离。例如,可以将反应混合物转移到具有特定截留分子量的过滤装置(例如,millipore离心装置),使得通过过滤装置过滤反应混合物可以将缀合的抗cd45或放射性标记的抗cd45与相应反应混合物的其他成分分离。过滤可用于获得缀合的抗cd45或放射性标记的抗cd45,其具有至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约97%、至少约98%、至少约99%或至少约99.5%的纯度。
[0180]
根据本公开的某些方面,来自分离(例如纯化)的缀合的抗cd45免疫球蛋白或放射性标记的抗cd45免疫球蛋白的得率为最终产物的至少约70%、至少约75%、至少约80%、至少约85%、或至少约90%、至少95%、至少96%、至少97%、至少98%或至少99%。
[0181]
根据本公开的一个方面,单克隆抗体可以首先与p-scn-bn-dota或dota螯合剂缀合以形成缀合的抗cd45免疫球蛋白,然后通过p-scn-bn-dota或dota将
225
ac螯合在缀合的抗cd45免疫球蛋白上以形成放射性标记的抗cd45免疫球蛋白。因此,根据本公开的方面,仅需要涉及
225
ac的单个步骤来标记抗cd45免疫球蛋白。
[0182]
根据本公开的某些方面,放射性标记的抗cd45免疫球蛋白
225
ac-bc8是相对稳定
的。例如,超过85%的
225
ac-bc8在4℃下储存24小时后可以保持完整(见图11)。此外,
225
ac-bc8显示出对表达cd45的细胞(见图12、15a、15b)和组织(见图16a)的特异性。
225
ac-bc8的标记效率、稳定性和免疫反应性结合起来提供了一种有效的治疗剂。
[0183]
用镥-177(
177
lu)放射性标记以提供
177
lu-dota-bc8也是可能的并且在本公开的范围内。此外,除非另有明确说明,否则提及
225
ac-bc8或
177
lu-bc8可分别包括提及
225
ac-dota-bc8或
177
lu-dota-bc8中的任一个。
[0184]
用于消耗或清除靶向细胞的方法
[0185]
本公开提供了一种用于消耗、可逆地抑制或清除受试者的造血干细胞的方法,该方法包括向受试者施用有效量的放射性标记的抗cd45免疫球蛋白,例如
225
ac-bc8。本公开提供了一种用于消耗受试者的淋巴细胞的方法,该方法包括向受试者施用有效量的放射性标记的抗cd45免疫球蛋白,例如
225
ac-bc8。本公开提供了一种用于消耗、减少或消除受试者的造血癌胚细胞的方法,该方法包括将有效量的放射性标记的抗cd45免疫球蛋白(例如
225
ac-bc8)单独作为单一药剂疗法或与其他疗法联合施用给受试者。
[0186]
根据该方法的某些方面,
225
ac-bc8的有效量为0.05μci/kg至5.0μci/kg受试者体重。有效量的实例包括但不限于0.05μci/kg至5.0μci/kg,例如0.1μci/kg至0.2μci/kg、0.2μci/kg至0.3μci/kg、0.3μci/kg至0.4μci/kg,0.4μci/kg至0.5μci/kg、0.5μci/kg至0.6μci/kg、0.6μci/kg至0.7μci/kg、0.7μci/kg至0.8μci/kg、0.8μci/kg至0.9μci/kg、0.9μci/kg至1.0μci/kg、1.0μci/kg至1.5μci/kg、1.5μci/kg至2.0μci/kg、2.0μci/kg至2.5μci/kg、2.5μci/kg至3.0μci/kg、3.0μci/kg至3.5μci/kg、3.5μci/kg至4.0μci/kg、4.0μci/kg至4.5μci/kg或4.5μci/kg至5.0μci/kg。
[0187]
根据该方法的某些方面,
225
ac-bc8的有效量为小于1mci,例如小于500μci。有效量的实例包括但不限于1μci至500μci,例如10μci至400μci、或10μci至300μci、10μci至200μci、10μci至100μci、15μci至75μci、20μci至75μci、10μci至50μci、50μci至100μci、100μci至150μci、150μci至200μci、200μci至250μc、250μci至300μci、300μci至350μci、350至400μci、400μci至450μci或450μci至500μci。
[0188]
示例性低剂量可以是小于120μci(例如10μci至100μci)的
225
ac-bc8的低剂量,或小于2μci/kg(例如0.01μci/kg至1.5μci/kg或0.1μci/kg至1.0μci/kg)的剂量。
[0189]
225
ac-bc8的示例性高剂量可以是至少120μci(例如120μci至500μci)的中高剂量,或至少2μci/kg(例如2μci/kg至5μci/kg,或3μci/kg至5μci/kg)的剂量。
[0190]
根据该方法的某些方面,
225
ac-bc8的有效量是有效消耗受试者的造血干细胞或淋巴细胞的量,例如有效消耗受试者的至少25%的造血干细胞、或受试者的至少50%的造血干细胞、或受试者的至少70%的造血干细胞、或受试者的至少80%的造血干细胞、或受试者的高达90%的造血干细胞的量。
[0191]
根据该方法的某些方面,
225
ac-bc8的有效量是有效可逆地免疫抑制受试者的造血干细胞或淋巴细胞(例如受试者的至少90%的造血干细胞,或受试者的至少92%、或至少94%、或至少96%、或高达98%的造血干细胞)而不会完全清除受试者的造血干细胞或淋巴细胞的量。
[0192]
根据该方法的某些方面,
225
ac-bc8的有效量是有效消耗受试者的循环肿瘤细胞(例如造血干细胞或淋巴细胞)的量,例如有效消耗受试者的至少25%的造血干细胞或淋巴
细胞、或受试者的至少50%的造血干细胞或淋巴细胞、或受试者的至少70%的造血干细胞或淋巴细胞、或受试者的至少80%的造血干细胞或淋巴细胞、或受试者的高达90%的造血干细胞或淋巴细胞的量,而没有清髓。根据某些方面,该量可以是
225
ac-bc8的低剂量,例如小于150μci或120μci,例如10μci至100μci,或小于2μci/kg的剂量,例如0.01μci/kg至1.5μci/kg或0.1μci/kg至1.0μci/kg。如下文公开的,该剂量可以单独施用或与其他另外的治疗剂一起施用。
[0193]
根据该方法的某些方面,
225
ac-bc8的有效量是作为单一药剂或与其他疗法联合而有效消耗、减少或消除患者的25%、50%或100%的造血癌胚细胞的量。取决于施用的剂量,有效消耗、减少或消除患者的癌胚细胞的剂量可能需要干细胞支持。
[0194]
当这样的细胞已被消耗或可逆地抑制时,或在其完全清除后,可以向患者提供干细胞支持。例如,治疗具有高癌细胞负荷的患者可能需要更高剂量的放射性标记的抗cd45抗体,因此可能导致患者的显著百分比的造血干细胞消耗或抑制。在这种情况下,可能需要干细胞支持来影响这些细胞的重新增殖。根据某些方面,可能不需要干细胞支持,并且可能存在足够量的造血干细胞并且其能够重新增殖。
[0195]
根据该方法的某些方面,
225
ac-bc8的有效量是有效清除受试者的100%的造血干细胞(也称为清髓)的量。示例性剂量包括至少在本文中作为高剂量指出的那些。
[0196]
该方法通常包括以单剂量(例如单一患者特定剂量)向受试者施用有效量的
225
ac-bc8。可以通过上文公开的任何方法确定淋巴细胞或造血干细胞的减少量。
225
ac-bc8的剂量可能取决于所需的消耗量或免疫抑制量。例如,造血干细胞的消耗可以在低剂量下实现,例如低于2gy的
225
ac-bc8。可以在
225
ac-bc8的小于8gy的剂量(例如2gy至8gy的剂量)下实现造血干细胞的可逆免疫抑制,并且可以在
225
ac-bc8的高剂量如8gy或更高(例如约10-12gy)下实现清除。
[0197]
该方法可以进一步包括以分级剂量向受试者施用有效量的
225
ac-bc8,例如多次施用单一患者特定剂量的部分,或施用多个单一患者特定剂量。当与第二种药剂一起施用时,
225
ac-bc8的剂量可能取决于所需的消耗量或免疫抑制量。
[0198]
治疗非恶性血液病症的方法
[0199]
这种消耗方法(在本文中也称为调理方法)可能是有用的,例如,用于改善随后需要消耗造血干细胞的基于基因编辑的细胞疗法的结果。根据该方法的某些方面,受试者患有可通过基因编辑的细胞疗法治疗的非癌性病症并且将要接受这种疗法以治疗该病症。本公开还提供了用于治疗患有可通过基因编辑的细胞疗法治疗的非癌性病症的受试者的方法,该方法包括(i)向受试者施用有效消耗受试者的造血干细胞的量的放射性标记的抗cd45抗体,和(ii)在合适的时间段后,对受试者执行所述疗法以治疗受试者的病症。
[0200]
非癌性病症的实例包括但不限于血红蛋白病(例如,scd和β-地中海贫血)、先天性免疫缺陷(例如,scid和范可尼贫血)和病毒感染(例如,hiv感染)。根据某些方面,该病症是scd并且该疗法是基因编辑的β-珠蛋白造血干细胞疗法。例如,干细胞疗法可以是同种异体的或自体的。根据某些方面,该病症是scid并且该疗法是基因编辑的造血干细胞疗法,其中经编辑的基因是共有γ链(γc)基因、腺苷脱氨酶(ada)基因和/或janus激酶3(jak3)基因。例如,干细胞疗法可以是同种异体的或自体的。
[0201]
根据本发明方法的某些优选方面,放射性标记的抗cd45抗体是放射性标记的bc8,
例如
225
ac-bc8。
225
ac-bc8的有效量是有效消耗、可逆地抑制或清除受试者的造血干细胞的量,并且可以是例如0.01μci/kg至1.0μci/kg、1.0μci/kg至3.0μci/kg、3.0μci/kg至5.0μci/kg、或0.1μci/kg至5.0μci/kg受试者体重。根据某些方面,该方法包括(i)向受试者施用0.1μci/kg至5.0μci/kg的
225
ac-bc8,和(ii)在6、7或8天后,对受试者执行疗法以治疗受试者的病症。根据某些其他方面,该方法包括(i)向受试者施用0.1μci/kg至1.0μci/kg的
225
ac-bc8,和(ii)在6、7或8天后,对受试者执行疗法以治疗受试者的病症。根据又进一步的方面,该方法包括(i)向受试者施用1.0μci/kg至3.0μci/kg的
225
ac-bc8,和(ii)在6、7或8天后,对受试者执行疗法以治疗受试者的病症。根据又进一步的方面,该方法包括(i)向受试者施用3.0μci/kg至5.0μci/kg的
225
ac-bc8,和(ii)在6、7或8天后,对受试者执行疗法以治疗受试者的病症。
[0202]
治疗恶性血液病症的方法
[0203]
本公开还提供了一种用于治疗患有恶性疾病或病症(例如癌症)的受试者的方法。该方法通常可以包括向受试者施用有效消耗、可逆地抑制或清除受试者的hsc或淋巴细胞或造血癌胚细胞的量的放射性标记的抗cd45抗体。根据至少一种示例性方法,施用低剂量的放射性标记的抗cd45抗体以减少或消耗造血干细胞或淋巴细胞和/或循环肿瘤细胞的数量,而不进行清髓。该剂量可以是本文定义的低剂量。
[0204]
根据某些方面,该方法可以进一步包括施用干细胞支持。根据某些方面,该方法可以进一步包括在合适的时间段后进行调理疗法。调理疗法可以是对受试者进行的造血干细胞移植(例如骨髓移植)或过继细胞疗法,以治疗受试者的癌症。
[0205]
根据该方法的某些方面,受试者患有癌症并且将要接受过继细胞疗法以治疗癌症。过继细胞疗法是已知的,并且包括例如car t细胞疗法(例如,自体细胞疗法和同种异体细胞疗法)。过继细胞疗法提供了一种促进受试者癌症消退的方法,并且通常包括(i)收集自体t细胞(白细胞分离术);(ii)扩增t细胞(培养);(iii)对受试者施用非清髓性清淋化疗;和(iv)在施用非清髓性清淋化疗后,向受试者施用扩增的t细胞。本公开的方法包括使用放射性标记的抗cd45抗体代替清淋化疗,和/或在施用扩增的细胞(例如,t细胞、nk细胞、树突细胞等)之后使用放射性标记的抗cd45抗体。抗cd45抗体的这种后期施用(即,在施用扩增的细胞之后)可用于准备移植自体干细胞(hsct),或施用第二有效量或数量的扩增的细胞。
[0206]
因此,本公开提供了用于治疗增殖性疾病(例如血液恶性肿瘤)的方法,其包括施用放射性标记的抗cd45抗体和过继细胞疗法。过继细胞疗法通常可以包括在用放射性标记的抗cd45抗体进行清淋后在回输(过继细胞疗法,例如car t细胞疗法)之前对自体细胞进行基因编辑的单采术。替代地,同种异体细胞可以在清淋后被重新输注,以提供过继细胞疗法。根据本公开的方法,放射性标记的抗cd45抗体可以在过继细胞疗法之前3至9天(例如6至8天)作为单剂量提供。
[0207]
根据该方法的某些方面,放射性标记的抗cd45抗体是如上文所述的放射性标记的bc8,其以上文所述的剂量提供,其中所述剂量通常取决于特定的放射性核素标记物(例如,
225
ac-bc8)。根据该方法的某些方面,施用放射性标记的抗cd45抗体后的合适的时间段为3天、4天、5天、6天、7天、8天或9天,例如优选6、7或8天。
[0208]
根据某些方面,治疗患有癌症的受试者的方法包括(i)向受试者施用有效消耗受
试者的淋巴细胞的单剂量的放射性标记的抗cd45抗体,和(ii)在合适的时间段(例如,6、7或8天)后,对受试者执行过继细胞疗法以治疗受试者的癌症。根据某些方面,治疗患有癌症的受试者的方法由以下组成:(i)向受试者施用有效消耗受试者的淋巴细胞的单剂量的放射性标记的抗cd45抗体,和(ii)在合适的时间段(例如,6、7或8天)后,对受试者执行过继细胞疗法以治疗受试者的癌症。
[0209]
根据该方法的某些方面,
225
ac-bc8的有效量为0.01μci/kg至5.0μci/kg受试者体重。
[0210]
根据某些方面,治疗患有癌症的受试者的方法由以下组成:(i)向受试者施用对骨髓抑制受试者有效的单剂量的放射性标记的抗cd45抗体,和(ii)在合适的时间段(例如,4、5、6、7或8天)后,对受试者进行骨髓移植以治疗受试者的癌症。根据某些方面,治疗患有癌症的受试者的方法由以下组成:(i)向受试者施用有效消耗受试者的骨髓细胞的单剂量的放射性标记的抗cd45抗体,和(ii)在合适的时间段(例如,4、5、6、7或8天)后,对受试者进行骨髓移植以治疗受试者的癌症。
[0211]
根据该方法的某些方面,
225
ac-bc8的有效量是低剂量,例如小于120μci的剂量(例如10μci至100μci),或小于2μci/kg的剂量(例如0.01μci/kg至1.5μci/kg或0.1μci/kg到1.0μci/kg)。
[0212]
另外的治疗剂
[0213]
目前公开的组合物和方法可以与某些另外的治疗剂联合使用。例如,另外的免疫治疗剂可以与本文公开的抗cd45抗体组合物联合施用。示例性的另外的免疫治疗剂包括至少针对cd33和/或cd38的抗体(参见例如国际公开号wo 2019/094931,其通过引用整体并入本文)和/或针对cd34、cd117和/或cd135的抗体(参见例如美国临时专利申请号62/838,646和62/838,589,其通过引用整体并入本文)。
[0214]
目前公开的组合物和方法可以与放射增敏剂联合使用,这可以增强所公开的放射免疫疗法(例如,
225
ac-bc8)的功效。例如,bcl-2抑制剂与辐射(例如由
225
ac-bc8提供的)相结合可以对许多癌细胞系具有活性。此外,bcl-2蛋白的小分子抑制剂显示出与其他抗癌剂(包括但不限于依托泊苷、多柔比星、顺铂、紫杉醇和辐射)的协同作用。
[0215]
抑制细胞凋亡被广泛认为是从正常细胞转变为癌细胞的必要步骤,并且几种癌症疗法通过逆转这一过程发挥其作用。对细胞凋亡的投入是由线粒体外膜的透化引起的——这一过程由bcl-2家族不同成员之间的结合调节。此外,bcl-2家族成员还与内质网结合,在那里它们改变诸如未折叠蛋白反应和自噬等过程,这些过程也会导致或改变不同类型的细胞死亡。
[0216]
bcl-2过表达最初在滤泡性淋巴瘤中被描述为t(14;18)易位的结果,并且作为急性髓性白血病(aml)和非霍奇金淋巴瘤的不良预后标志物。随后在前列腺癌、乳腺癌和结肠癌以及胶质母细胞瘤中描述了bcl-2的过表达。在复发性aml中鉴定了另一种抗凋亡、bcl-2相关蛋白mcl-1的过表达,并且与预后不良有关。在癌细胞中鉴定的bcl-2相关蛋白表达的其他变化包括bax基因的不同突变,以及促凋亡与抗凋亡bcl-2蛋白比率的变化。因此,由于正常凋亡机制的缺陷,癌细胞无法执行凋亡程序通常与对辐射和/或免疫疗法诱导的细胞凋亡的抵抗力增加有关。
[0217]
因此,目前公开的方法可以包括添加放射增敏剂例如bcl-2抑制剂,其可以以与放
射性标记的抗cd45抗体协同的方式直接或间接诱导癌细胞的细胞凋亡。bcl-2抑制剂包括小分子和反义寡核苷酸药物,例如at-101((-)棉子酚)、(g3139或奥利默森(oblimersen);bcl-2-靶向反义寡核苷酸)、ipi-194、ipi-565、abt-737、abt-263、gx-070甲磺酸酯(obatoclax)等。
[0218]
根据优选的方面,bcl-2抑制剂可以是维奈托克(venetoclax),一种已被批准用于治疗慢性淋巴细胞白血病(“cll”)的药物。维奈托克与bcl-2的bh3结合槽结合,取代bim等促凋亡蛋白以启动线粒体外膜透化(“momp”)、细胞色素c的释放和半胱天冬酶激活,最终导致程序性癌细胞死亡(即细胞凋亡)。理想情况下,通过改变促凋亡和抗凋亡刺激之间的平衡,维奈托克将促进癌细胞的程序性细胞死亡,从而改善患者的预后。
[0219]
根据某些方面,目前公开的放射免疫疗法(例如,
225
ac-bc8)可以与bcl-2抑制剂如维奈托克联合使用以提供用于治疗患有癌症的受试者的方法,所述方法包括向受试者施用(i)bcl-2抑制剂联合(ii)放射性标记的抗cd45抗体(例如,
225
ac-bc8),其中当彼此联合施用时,bcl-2抑制剂和放射性标记的抗cd45抗体的量对治疗癌症是治疗有效的。
[0220]
本公开还提供了一种治疗患有血液疾病或病症的人类受试者的方法,所述方法包括向受试者施用(i)bcl-2抑制剂(如维奈托克)联合(ii)
225
ac-bc8,其中当彼此联合施用时,维奈托克和
225
ac-bc8的量对治疗急性髓性白血病是治疗有效的。
[0221]
如本文所用,向受试者施用bcl-2抑制剂“联合”放射性标记的抗cd45抗体(如
225
ac-bc8)是指在施用
225
ac-bc8之前、期间或之后施用bcl-2抑制剂。这种施用包括但不限于以下情形:(i)首先施用bcl-2抑制剂(例如,每天口服一次,持续21天、28天、35天、42天、49天或更长期间,在此期间被治疗的癌症没有进展并且在此期间bcl-2抑制剂没有引起不可接受的毒性),然后施用
225
ac-bc8(例如,在几周期间内以单剂量或多剂量静脉内施用);(ii)bcl-2抑制剂与
225
ac-bc8同时施用(例如,每天一次口服施用bcl-2抑制剂,持续n天,并且在bcl-2抑制剂方案的2至n-1天的其中一天以单剂量静脉内施用
225
ac-bc8);(iii)bcl-2抑制剂与
225
ac-bc8同时施用(例如,口服施用bcl-2抑制剂,持续时间超过一个月(例如,每天口服一次,持续35天、42天、49天或更长期间,在此期间被治疗的癌症没有进展并且在此期间bcl-2抑制剂没有引起不可接受的毒性),并且在bcl-2抑制剂方案的第一个月内的一天以单剂量静脉内施用
225
ac-bc8);和(iv)首先施用
225
ac-bc8(例如,在几周期间内以单剂量或多剂量静脉内施用),然后施用bcl-2抑制剂(例如,每天口服一次,持续21天、28天、35天、42天、49天或更长期间,在此期间被治疗的癌症没有进展并且在此期间bcl-2抑制剂没有引起不可接受的毒性)。
[0222]
施用的放射性标记的抗cd45抗体的量可以足以消耗、可逆地免疫抑制或清除患者中的血液干细胞。一般来说,放射性标记的抗cd45抗体的剂量是可以可逆地免疫抑制血液干细胞的亚饱和剂量。
[0223]
另外的放射增敏剂包括,例如,组蛋白去乙酰化酶抑制剂(hdaci),如伏立诺他、贝利司他和罗米地辛;甲硝唑、米索硝唑、动脉内budr、静脉内碘脱氧尿苷(iudr)、硝基咪唑、5-取代的-4-硝基咪唑、2h-异吲哚二酮、[[(2-溴乙基)-氨基]甲基]-硝基-1h-咪唑-1-乙醇、硝基苯胺衍生物、dna亲和性缺氧选择性细胞毒素、卤代dna配体、1,2,4苯并三嗪氧化物、2-硝基咪唑衍生物、含氟硝唑衍生物、苯甲酰胺、烟酰胺、吖啶嵌入剂、5-硫代四唑衍生物、3-硝基-1,2,4-三唑、4,5-二硝基咪唑衍生物、羟基化的texaphrin、顺铂、丝裂霉素、替
拉扎明、亚硝基脲、巯基嘌呤、甲氨蝶呤、氟尿嘧啶、博来霉素、长春新碱、卡铂、表柔比星、多柔比星、环磷酰胺、长春地辛、依托泊苷、紫杉醇、热(热疗)等。
[0224]
术语“组蛋白去乙酰化酶抑制剂”或“hdaci”是指可分为四类的组蛋白去乙酰化酶抑制剂:异羟肟酸类(帕比司他(lbh-589)、曲古抑菌素-a(tsa)、伏立诺他(saha)、贝利司他(pxd101)、nvp-laq824和givinostat(itf2357))、环肽类(罗米地辛(缩酚酸肽))、脂肪酸类(丙戊酸(vpa)和苯基丁酸钠)和苯甲酰胺类(ms-275,mgcd0103)。hdaci被表征为i类特异性hdac抑制剂(mgcd0103、罗米地辛和ms-275)或表示抗i类和ii类hdac的活性的泛hdac抑制剂(tsa、帕比司他、伏立诺他和贝利司他)。
[0225]
组蛋白脱乙酰酶抑制剂被认为在癌细胞中发挥多种细胞毒作用,通常是通过非组蛋白的乙酰化。一些公认的hdaci致死机制包括,除了松弛dna和去抑制基因转录外,干扰伴侣蛋白功能、自由基生成、诱导dna损伤、上调细胞周期进程的内源性抑制剂和促进细胞凋亡。有趣的是,这类药剂对转化细胞具有相对选择性,在这些转化细胞中发现它们会导致化疗后dna修复停止,并促进化疗的功效。
[0226]
根据某些方面,本公开的放射免疫疗法(例如,
225
ac-bc8)可以与hdaci(如伏立诺他、贝利司他或罗米地辛)联合使用以提供用于治疗患有癌症的受试者的方法,所述方法包括向受试者施用(i)hdaci联合(ii)放射性标记的抗cd45抗体(例如,
225
ac-bc8),其中当彼此联合施用时,hdaci和放射性标记的抗cd45抗体的量为对治疗癌症是治疗有效的。
[0227]
本公开还提供了治疗患有血液疾病或病症的人类受试者的方法,其包括向受试者施用(i)hdaci(如伏立诺他、贝利司他或罗米地辛)联合(ii)
225
ac-bc8,其中当彼此联合施用时,hdaci和
225
ac-bc8的量对治疗急性髓性白血病是治疗有效的。
[0228]
与bcl-2抑制剂一样,向受试者施用hdaci“联合”放射性标记的抗cd45抗体(如
225
ac-bc8)是指在施用
225
ac-bc8之前、期间或之后施用hdaci。这种施用包括但不限于以下情况:(i)首先施用hdaci(例如,每天口服一次,持续21天、28天、35天、42天、49天或更长期间,在此期间被治疗的癌症没有进展并且在此期间hdaci没有引起不可接受的毒性,或在28天周期的第1、8、15天静脉内施用),然后施用
225
ac-bc8(例如,在几周期间内以单剂量或多剂量静脉内施用);(ii)hdaci与
225
ac-bc8同时施用(例如,hdaci每天一次口服施用,持续n天,或静脉内施用n天,并且在hdaci方案的2至n-1天的其中一天以单剂量静脉内施用
225
ac-bc8);(iii)hdaci与
225
ac-bc8同时施用(例如,如本文所述,口服施用hdaci超过一个月的持续时间,并且在hdaci方案的第一个月内的其中一天以单剂量静脉内施用
225
ac-bc8);和(iv)首先施用
225
ac-bc8(例如,在几周期间内以单剂量或多剂量静脉内施用),然后施用hdaci(如本文所述)。
[0229]
制品
[0230]
本公开进一步提供了一种制品,其包含(a)放射性标记的抗cd45免疫球蛋白,和(b)标签,所述标签指示使用者向受试者施用有效消耗受试者的造血干细胞的量的免疫球蛋白。
[0231]
根据主题文章的某些方面,放射性标记的抗cd45免疫球蛋白是
225
ac-bc8,其中有效量可以是例如0.01μci/kg至5.0μci/kg或0.01μci/kg至1.0μci/kg的
225
ac-bc8,或1.0μci/kg至3.0μci/kg的
225
ac-bc8,或3.0μci/kg至5.0μci/kg的
225
ac-bc8,或10μci至120μci的
225
ac-bc8,或100μci至250μci的
225
ac-bc8,或200μci至500μci的
225
ac-bc8,或5μci至80μ
ci的
225
ac-bc8。
[0232]
根据主题文章的某些方面,放射性标记的抗cd45免疫球蛋白是
177
lu-bc8,其中有效量可以是例如1μci/kg至500μci/kg,或1μci/kg至100μci/kg的
177
lu-bc8,或100μci/kg至300μci/kg的
177
lu-bc8,或300μci/kg至500μci/kg的
177
lu-bc8。
[0233]
通过参考以下实施例将更好地理解本公开,但是本领域技术人员将容易理解,详细的具体实施例仅用于说明如在随后的权利要求中更充分描述的公开内容。
[0234]
本发明的方面
[0235]
本技术中公开了以下方面:
[0236]
方面1.一种用于消耗受试者的造血干细胞的方法,包括向受试者施用有效量的放射性标记的抗cd45免疫球蛋白。
[0237]
方面2.方面1的方法,其中有效量的放射性标记的抗cd45免疫球蛋白消耗受试者的至少25%的造血干细胞,或受试者的50%的造血干细胞,或受试者的至少70%的造血干细胞,或受试者的至少80%的造血干细胞,或受试者的至少90%的造血干细胞,或受试者的至少95%的造血干细胞,或受试者的不超过90%的造血干细胞,或受试者的不超过95%的造血干细胞。
[0238]
方面3.方面1的方法,其中有效量的放射性标记的抗cd45免疫球蛋白消耗受试者的至少90%的造血干细胞,或受试者的至少95%的造血干细胞,或受试者的至少98%的造血干细胞,或受试者的至少99%的造血干细胞,或受试者的不超过98%的造血干细胞,或受试者的不超过99%的造血干细胞。
[0239]
方面4.根据方面1至3中任一项的方法,进一步包括:施用有效量的第二治疗剂,所述第二治疗剂包含免疫治疗剂、放射增敏剂或化疗剂中的一种或多种。
[0240]
方面5.方面4的方法,其中免疫治疗剂包含一种或多种针对cd33、cd34、cd38、cd119和cd135的抗体。
[0241]
方面6.方面4的方法,其中放射增敏剂包含bcl-2抑制剂或hdac抑制剂(hdaci)。
[0242]
方面7.方面1的方法,其中有效量的放射性标记的抗cd45免疫球蛋白消耗受试者的100%的造血干细胞(即,清除造血干细胞)。
[0243]
方面8.一种用于消耗受试者的淋巴细胞的方法,所述方法包括向受试者施用有效量的放射性标记的抗cd45免疫球蛋白。
[0244]
方面9.方面8的方法,其中有效量的放射性标记的抗cd45免疫球蛋白消耗受试者的至少25%的淋巴细胞,或受试者的50%的淋巴细胞,或受试者的至少70%的淋巴细胞,或受试者的至少80%的淋巴细胞,或受试者的至少90%的淋巴细胞,或受试者的至少95%的淋巴细胞,或受试者的至少98%的淋巴细胞,或受试者的至少99%的淋巴细胞,或受试者的不超过90%的淋巴细胞,或受试者的不超过95%的淋巴细胞,或受试者的不超过98%的淋巴细胞,或受试者的不超过99%的淋巴细胞。
[0245]
方面10.方面8的方法,其中有效量的放射性标记的抗cd45免疫球蛋白消耗受试者的至少25%的造血癌胚细胞,或受试者的50%的造血癌胚细胞,或受试者的至少70%的造血癌胚细胞,或受试者的至少80%的造血癌胚细胞,或受试者的至少90%的造血癌胚细胞,或受试者的至少95%的造血癌胚细胞,或受试者的至少98%的造血癌胚细胞,或受试者的至少99%的造血癌胚细胞,或受试者的不超过90%的造血癌胚细胞,或受试者的不超过
95%的造血癌胚细胞,或受试者的不超过98%的造血癌胚细胞,或受试者的不超过99%的造血癌胚细胞。
[0246]
方面11.方面8的方法,其中有效量的放射性标记的抗cd45免疫球蛋白消耗受试者的100%的淋巴细胞(即,清除淋巴细胞),或消耗受试者的100%的造血癌胚细胞。
[0247]
方面12.根据方面1至11中任一项的方法,其中受试者患有可通过基因编辑的细胞疗法治疗的非癌性病症,并且将要接受这样的疗法以治疗所述病症,并且有效量的放射性标记的抗cd4免疫球蛋白作为单剂量施用。
[0248]
方面13.用于治疗患有可通过基因编辑的细胞疗法治疗的非癌性病症的受试者的方法,所述方法包括(i)向受试者施用有效消耗受试者的造血干细胞的量的放射性标记的抗cd45免疫球蛋白,和(ii)在合适的时间段后,对受试者执行所述疗法以治疗受试者的病症。
[0249]
方面14.根据方面12或13的方法,其中所述病症选自由血红蛋白病、先天性免疫缺陷和病毒感染组成的组。
[0250]
方面15.根据方面14的方法,其中所述病症选自由镰状细胞病(scd)、严重联合免疫缺陷病(scid)、β-地中海贫血和范可尼贫血组成的组。
[0251]
方面16.方面14的方法,其中所述病症是scd并且所述疗法是基因编辑的β-珠蛋白造血干细胞疗法。
[0252]
方面17.方面14的方法,其中所述病症是scid并且所述疗法是基因编辑的造血干细胞疗法,其中经编辑的基因选自由共有γ链(γc)基因、腺苷脱氨酶(ada)基因和janus激酶3(jak3)基因组成的组。
[0253]
方面18.根据方面1至7中任一项的方法,其中受试者患有癌性病症并且将要经历造血干细胞移植如骨髓移植以治疗所述病症,并且其中有效量的放射性标记的抗cd4免疫球蛋白作为单剂量施用。
[0254]
方面19.根据方面8至11中任一项的方法,其中受试者患有可通过基因编辑的细胞疗法治疗的癌性病症并且将要接受这样的疗法以治疗所述病症,并且有效量的放射性标记的抗cd4免疫球蛋白作为单剂量施用。
[0255]
方面20:一种用于治疗患有可通过基因编辑的细胞疗法治疗的癌性病症的受试者的方法,包括(i)向受试者施用有效消耗受试者的淋巴细胞的量的放射性标记的抗cd4免疫球蛋白,和(ii)在合适的时间段后,对受试者执行所述疗法以治疗受试者的病症。
[0256]
方面21:根据方面18至20中任一项的方法,其中癌性病症是急性髓性白血病、急性淋巴性白血病、慢性髓性白血病、慢性淋巴性白血病、多发性骨髓瘤、弥漫性大b细胞淋巴瘤、或非霍奇金淋巴瘤。
[0257]
方面22:根据方面19或20的方法,其中基因编辑的细胞疗法是治疗癌性病症的过继细胞疗法。
[0258]
方面23:根据方面22的方法,其中过继细胞疗法是car t细胞疗法,其中car t细胞疗法包括施用基因编辑的car t细胞,并且其中基因编辑的car t细胞不能正确表达至少一种检查点受体和/或至少一种t细胞受体。
[0259]
方面24:根据方面23的方法,其中car t细胞疗法是自体细胞疗法。
[0260]
方面25:根据方面23的方法,其中car t细胞疗法是同种异体细胞疗法。
[0261]
方面26:根据方面1至25中任一项的方法,其中放射性标记的抗cd45抗体是
225
ac-bc8或
177
lu-bc8。
[0262]
方面27.根据方面26的方法,其中
225
ac-bc8的有效量为0.01μci/kg至5.0μci/kg受试者体重,或0.01μci/kg至1.0μci/kg受试者体重,或1.0μci/kg至3.0μci/kg受试者体重,或3.0μci/kg至5.0μci/kg受试者体重;或者,其中
225
ac-bc8的有效量为从2μci至低于0.5mci,或从至少2μci至低于120μci,或从10μci至低于120μci,或从50μci至低于250μci;或者,其中
177
lu-bc8的有效量为1μci/kg至500μci/kg受试者体重,或1μci/kg至100μci/kg受试者体重,或100μci/kg至300μci/kg受试者体重,或300μci/kg至500μci/kg受试者体重;或者,其中
177
lu-bc8的有效量为10μci至20mci,或100μci至3mci,或3mci至20mci。
[0263]
方面28:根据方面1至27中任一项的方法,其中抗cd45免疫球蛋白包括bc8,其中bc8包含具有如seq id no:1所示的氨基酸序列的轻链,或如seq id no:9所示的轻链n末端氨基酸序列。
[0264]
方面29:根据方面1至28中任一项的方法,其中抗cd45免疫球蛋白包括bc8,其中bc8的轻链包含至少一个具有如seq id no:3、seq id no:4或seq id no:5所示的氨基酸序列的互补决定区。
[0265]
方面30:根据方面1至29中任一项的方法,其中抗cd45免疫球蛋白包括bc8,其中bc8包含具有seq id no:12或seq id no:13所示的氨基酸序列的轻链。
[0266]
方面31:根据方面1至30中任一项的方法,其中抗cd45免疫球蛋白包括bc8,其中bc8包含具有如seq id no:2所示的氨基酸序列的重链,或如seq id no:10所示的重链n末端氨基酸序列。
[0267]
方面32:根据方面1至31中任一项的方法,其中抗cd45免疫球蛋白包括bc8,其中bc8的重链包含至少一个具有如seq id no:6、seq id no:7或seq id no:8所示的氨基酸序列的互补决定区。
[0268]
方面33:根据方面1至32中任一项的方法,其中抗cd45免疫球蛋白包括bc8,其中bc8包含具有seq id no:15或seq id no:16所示的氨基酸序列的重链。
[0269]
方面34:根据方面1至33中任一项的方法,其中抗cd45免疫球蛋白包括bc8,并且bc8的重链包含在141位(相对于n末端氨基酸)的氨基酸asp或asn。
[0270]
方面35:根据方面34的方法,其中bc8蛋白群中asp:asn的比率在1:99至99:1的范围内,例如10:90至90:10。
[0271]
方面36:根据方面1至35中任一项的方法,其中抗cd45免疫球蛋白包括bc8,所述bc8已被修饰以包含来自人iggl、igg2或igg4的重链恒定区,即,如seq id no:17-19之一所示的氨基酸序列。
[0272]
方面37:根据方面1至36中任一项的方法,其中抗cd45免疫球蛋白包括bc8,所述bc8已被修饰以包含来自人igg4的包含突变s228p的重链恒定区,所述重链恒定区具有如seq id no:20所示的氨基酸序列。
[0273]
方面38:根据方面1至37中任一项的方法,其中抗cd45免疫球蛋白包括bc8,所述bc8已被修饰以包含来自人的轻链κ恒定区,所述轻链κ恒定区具有如seq id no:21所示的氨基酸序列。
[0274]
方面39.一种制品,其包含(a)放射性标记的抗cd45抗体,和(b)标签,所述标签指
示使用者向受试者施用有效消耗或清除受试者的造血干细胞或受试者的淋巴细胞的量的抗体。
[0275]
方面40.方面39的制品,其中放射性标记的bc8是
225
ac-bc8,并且
225
ac-bc8的有效量为0.01μci/kg至5.0μci/kg,或0.01μci/kg至1.0μci/kg受试者体重,或1.0μci/kg至3.0μci/kg受试者体重,或3.0μci/kg至5.0μci/kg受试者体重;或者,其中
225
ac-bc8的有效量为从2μci至低于0.5mci,或2μci至250μci,或75μci至400μci。
[0276]
实施例
[0277]
实施例1
–
抗cd45免疫球蛋白bc8的生产
[0278]
鼠抗cd45单克隆抗体bc8由杂交瘤(atcc号hb-10507)制备,该杂交瘤最初是通过将小鼠骨髓瘤ns1细胞与来自用经植物血凝素(pha)刺激的人单核细胞超免疫的balb/c小鼠的脾细胞融合而开发的。在筛选微生物污染后,使用补充有1-2%胎牛血清(fbs)的jrh-biosciences excell 300培养基培养原始融合细胞。
[0279]
杂交瘤细胞系适合于在无血清培养基中培养。简而言之,使用补充有谷氨酰胺、胆固醇、胰岛素和转铁蛋白的组合培养基将培养物中的细胞缓慢而逐渐地脱离血清白蛋白。然后细胞在高达500l的规模中生长至》1
×
106个细胞/ml的密度。使用阳离子交换层析、蛋白质-a层析和阴离子交换膜分离的组合来收获和处理培养基以纯化抗cd45抗体。通过纳米过滤(30kd截留)浓缩纯化的抗体。纯化的产物的浓度测量为5.2mg/ml并储存在2-8℃。
[0280]
纯化的抗体通过sds-page、ief和sec-hplc技术进行表征。使用sec-hplc记录单个产物峰(99.4%),聚集体约为0.6%。非还原性sds-page显示抗体的单条带。还原条件下的sds-page证实了轻链和重链的存在(共99.9%)。
[0281]
实施例2
–
抗cd45免疫球蛋白bc8的测序
[0282]
按照reagent的技术手册从杂交瘤细胞中分离总rna。通过琼脂糖凝胶电泳分析总rna,并按照primescript
tm
1st strand cdna synthesis kit的技术手册,使用同种型特异性反义引物或通用引物将总rna逆转录成cdna。扩增vh、vl、ch和cl的抗体片段并使用标准分子克隆程序将其分别克隆到标准克隆载体中。进行菌落pcr筛选以鉴定具有正确大小插入片段的克隆。对于每个抗体片段,对五个以上具有正确大小插入片段的单菌落进行测序。轻链和重链的完整核苷酸序列显示在图4a、4b、5a和5b中。
[0283]
使用质谱肽映射(mapping)法对抗cd45免疫球蛋白(即bc8抗体)进行测序。用单独的酶对bc8抗体进行去糖基化、还原和消化;胰蛋白酶、lys-c和糜蛋白酶。然后使用ms/ms片段分析方法通过lc耦合质谱技术分析肽片段。bc8抗体重链和轻链的蛋白质测序表明,实际氨基酸序列与由dna序列预测的序列仅重链中的一个氨基酸不同。如在图5a和5b中突出显示的,编码141位氨基酸的密码子预测asn-141,而不是通过蛋白质测序发现的实际的asp-141。此外,对不同批次蛋白质的测序表明141位的asp和asn含量不同,即发现蛋白质以1:99至99:1的比率包含asn-141和asp-141,例如10:90至90:10(asn-141:asp-141)。见表1。
[0284]
表1:
[0285]
对两批分离的bc8单克隆抗体的肽段124-151的lcms/ms分析显示了“n”和“d”在141位处均存在差异丰度。
[0286][0287][0288]
这种类型的翻译后修饰(即脱氨基)可能取决于细胞环境,并且在一些情况下,已假定与蛋白质寿命有关(例如,可能提供蛋白质降解的信号)。然而,未鉴定出其他脱氨基的氨基酸这一事实可能表明asp-141具有重要且特定的作用。至少,asp-141可能位于折叠蛋白上的暴露或可接近区域。也就是说,asn-141可能是溶剂可及的并且位于抗体的构象灵活区域内。脱氨基对bc8抗体生物活性的影响可以从人体临床试验的结果中确定。
[0289]
实施例3
–
bc8:标记和纯化以形成
225
ac-bc8
[0290]
bc8和无关对照单克隆抗体18b7(小鼠igg1)与dota的缀合
[0291]
用缀合缓冲液(含1mm edta的碳酸钠缓冲液,ph=8.5-9.0)平衡抗cd45抗体(即,bc8抗体)和对照(即,对真菌多糖葡糖醛木甘露聚糖反应的小鼠单克隆;各2mg),通过使用mw截留为50,000的centricon过滤器或mw截留为50,000的vivaspin超滤管进行四次超滤旋转;每次旋转使用1.5毫升(ml)的缀合缓冲液。对于每次旋转,抗体在4℃下在带有固定角度转子的thermo iec centra cl3r离心机中以53,000rpm旋转5-20分钟,使残留滞留物体积达到100-200微升(μl)。不同抗体和不同蛋白质浓度的旋转时间不同。在第二次和第三次旋转后,将抗体在4℃下孵育30分钟,以便有时间进行平衡。
[0292]
表2
[0293]
[0294][0295]
对于缀合,通过涡旋溶解制备3mg/ml的dota-pscn(mw=678)在0.15m nh4oac中的溶液。dota-pscn和抗体(》5mg/ml)在eppendorf管中以5、7.5和15摩尔比混合在一起并在室温下孵育15小时(参见图9a)。为了纯化dota-抗体缀合物,如上所述通过7轮超滤除去未反应的dota-pscn,每次用1.5ml的0.15m nh4oac缓冲液洗涤,ph=6.5,体积减少到约100μl。最后一次洗涤后,加入0.15m nh4oac缓冲液,使每个样品的最终浓度达到约1mg/ml。
[0296]
通过简化的lowry方法测量dota抗体缀合物的最终浓度。如dadachova等人,1999,spectrophotometric method for determination of bifunctional macrocyclic ligands in macrocyclic ligand-protein conjugates,nuclear medicine&biology,26:977-982中所述测定与抗体缀合的dota分子的数量(dota与蛋白质的摩尔比)。dota与蛋白质的摩尔比的测定结果如表2所示。
[0297]
用
225
ac对dota-抗体缀合物进行放射性标记
[0298]
在eppendorf反应管中混合包含15μl 0.15m nh4oac缓冲液,ph=6.5和2μl(10μg)dota-bc8(5mg/ml)的反应,随后加入在0.05m hcl中的4μl 225
ac(10μci)(参见图9b)。用移液管吸头混合管中的物质,将反应混合物在37℃下孵育90分钟,同时以100rpm摇动。在孵育期结束时,将3μl的1mm dtpa溶液添加到反应混合物中,并在室温下孵育20分钟以将未反应的
225
ac结合到
225
ac-dtpa复合物中。
[0299]
具有10cm硅胶条和10mm edta/生理盐水流动相的快速薄层色谱(itlc)被用来通过从游离
225
ac(
225
ac-dtpa)中分离
225
ac标记的bc8(
225
ac-dota-bc8)来测定
225
ac-dota-bc8的放射化学纯度。在该系统中,放射性标记的抗体停留在应用点,
225
ac-dtpa与溶剂前沿一起移动。将条带切成两半,并在配备有多通道分析仪的伽马计数器中计数,使用通道72-110
用于
225
ac以排除其子代。选择的放射性标记结果如表2所示,其表明dota与bc8的初始摩尔比为7.5时形成的缀合物提供了最高的缀合比率(dota与bc8蛋白),并被选择用于下文描述的所有后续实验(批次a)。
[0300]
225
ac-dota-bc8的纯化和纯化的
225
ac-dota-bc8的hplc
[0301]
在用1%hsa预封闭的pd10柱上或在具有50kda mw截留的vivaspin离心浓缩器上纯化
225
ac-dota-bc8样品,进行2
×
1.5ml洗涤,每次旋转3分钟。使用配备流通式waters uv和bioscan辐射检测器的waters hplc系统对纯化后的
225
ac-dota-bc8进行hplc分析。进样量为30μl。在tsk3000sw xl柱上进行洗脱,使用ph=7.4的pbs作为洗脱液,流速为1ml/min。实施例色谱图提供在图10a和10b中,其显示了
225
ac-dota-bc8的sec-hplc(尺寸排阻色谱-hplc),其中图10a显示了bc8标准,图10b显示了
225
ac-dota-bc8(13分钟处的峰是为稳定最终制剂而添加的hsa)。
[0302]
实施例4
–
225
ac-bc8:稳定性
[0303]
225
ac-dota-bc8稳定性测定
[0304]
dota-bc8(批次a)用于所有免疫反应性实验,并如上述程序中所述以1μci/μg比活性用
225
ac放射性标记。对于稳定性测定,
225
ac-dota-bc8在20μl的原始体积中进行测试,或用工作缓冲液(0.15m nh4oac)稀释至40μl或60μl并在室温(rt)下孵育48小时或在4℃下孵育96小时并由itlc测试。所有样品一式两份进行分析,实验进行3次。
[0305]
结果显示在图11中,其表明锕-225标记的bc8(
225
ac-dota-bc8)在4℃下可稳定长达96小时。
[0306]
实施例5
–
225
ac-bc8:免疫反应性
[0307]
使用细胞系进行
225
ac-dota-bc8免疫反应性(ir)测定
[0308]
dota-bc8(批次a)用于所有免疫反应性实验,并如上述程序中所述以1μci/μg比活性用
225
ac放射性标记。ramos cd45阳性细胞和对照cd45阴性el4细胞以每个样品100-750万个细胞的量使用,一式两份。实验进行了两次。结果如图12所示,其表明
225
ac-dota-bc8与ramos细胞特异性结合,其中50%的放射性标记的抗体与这些细胞结合,而仅约10%与对照el4细胞结合。然而,在实验室中连续培养两个细胞系用于qc并不具有成本效益,并且需要更简单的测定来确定ir。使用以下条件作为对照:ramos细胞用1%bsa预封闭;el4细胞;el4细胞用1%bsa预封闭。
[0309]
使用cytotrol细胞进行
225
ac-dota-bc8免疫反应性(ir)测定
[0310]
cytotrol细胞(beckman coulter)最初用于通过流式细胞术测定幼稚bc8抗体相对于对照18b7抗体(针对真菌多糖葡糖醛木甘露聚糖的非特异性对照抗体)与那些细胞的结合(图13a)。将细胞放在rpmi培养基中,二抗是来自biolegend的pe标记的大鼠抗小鼠igg1。cytotrol细胞是从外周血中分离出来的具有cd45表面抗原的冻干人淋巴细胞,并根据其商业可用性(beckman coulter)和一致性进行选择。
[0311]
将幼稚bc8与cytotrol细胞的结合和dota-bc8的结合进行比较(图13b)。幼稚bc8显示与cytotrol细胞的强结合,而对照18b7单克隆抗体仅在背景水平结合(图13b)。dota与bc8的连接将其ir降低到幼稚bc8 ir的大约70%(图13b)。
[0312]
表3
[0313]
使用cytotrol细胞对6个
225
ac-dota-bc8样品进行ir测定
[0314][0315]
随后,我们对
225
ac-dota-bc8进行了ir测定。为了测量放射性标记的抗体与cytotrol细胞的结合,我们对每个样品使用3管cytotrol细胞(批号729154),并测量重复样品的结合。使用0.5ml重组缓冲液,从小瓶到小瓶洗涤,我们汇集细胞。用另外两份0.5ml的等分试样洗涤小瓶,并合并洗涤液。通过在4000rpm下离心4分钟收集细胞,用1ml含有1%牛血清白蛋白(bsa)的rpmi封闭,重新旋转,并重新悬浮在0.5ml rpmi/bsa中。每瓶添加约25,000cpm的标记抗体。将小瓶在37℃下孵育1小时,以150rpm摇动,以4000rpm旋转4分钟,收集3次洗涤液,对洗涤液和细胞进行计数。表3显示了6个
225
ac-dota-bc8样品的ir测定。平均ir为64.8
±
2.14%。
[0316]
最后,我们通过流式细胞术对dota-bc8样品与cytotrol细胞的结合进行并排比较(图14b),然后立即用
225
ac对同一样品进行放射性标记,并将放射性标记的样品与cytotrol细胞结合(图14a)。通过流式细胞术,dota-bc8与细胞的结合(大约60%的幼稚bc8结合)和放射性标记的
225
ac-dota-bc8与cytotrol细胞的结合相匹配。因此,发现cytotrol测定是评估
225
ac-dota-bc8的ir的一种方便且具有成本效益的方法,
225
ac-dota-bc8通常以64.8
±
2.14%与细胞结合。
[0317]
实施例6
–
225
ac-bc8:多发性骨髓瘤的放射免疫疗法
[0318]
评估人h929和u266多发性骨髓瘤细胞作为模型细胞系用于用
225
ac-dota-bc8对多发性骨髓瘤进行的放射免疫疗法(rit)的适用性
[0319]
多发性骨髓瘤(mm)细胞系h929和u266购自american type tissue collection attc,并根据atcc说明进行培养。通过流式细胞术测量未标记的dota-bc8与两种细胞系的结合(图15a),然后是
225
ac-dota-bc8与细胞的结合(图15b)。
[0320]
随后,将h929和u266细胞用于
225
ac-dota-bc8的体外杀伤试验。使用两剂
225
ac-dota-bc8(20pci/ml和250pci/ml)。在总体积为200ul的96孔板中进行细胞与放射性标记的抗体的孵育。使用相同的两剂对照抗体
225
ac-dota-18b7。在4小时和12小时的时间点将细胞从未结合的放射性物质中清除,并在3天后用台盼蓝测定法评估它们的存活率(表4)。两种细胞系的杀伤是抗体特异性和剂量依赖性的。也就是说,两种细胞系都在其表面表达了足够量的cd45,可用于
225
ac-dota-bc8的特异性靶向,并可用于随后的体内实验。
[0321]
表4
[0322]
用
225
ac-dota-bc8处理h929和u266细胞并在3天后测试存活率的两个实验的合并数据
[0323][0324][0325]
实施例7
–
225
ac-bc8:生物分布
[0326]
225
ac-dota-bc8在幼稚小鼠模型中的生物分布
[0327]
本研究的目的是在幼稚小鼠模型中评估
225
ac-dota-bc8与对照
225
ac-dota-18b7抗体的药代动力学生物分布,以确定在没有疾病的情况下的基线生物分布和清除。如上文详述,用
225
ac对dota缀合的bc8抗体(批次a)和18b7抗体(以与批次a相同的摩尔比产生;7.5摩尔dota与ab)进行放射性标记。抗体被放射性标记,比活性为0.4μci/μg。用cytotrol细胞测试了
225
ac-dota-bc8的免疫反应性,并证明了55%的结合,因此满足了50%的最低结合要求。
[0328]
将五十(50)只健康cd-1小鼠雌性小鼠随机分配到两组并用
225
ac-dota-bc8或对照
225
ac-dota-18b7进行腹膜内注射。每只小鼠接受5μg(2μci)在100μl含抗坏血酸的0.15m nh4oac缓冲液中的放射性标记的抗体。在长寿命放射性核素(例如
225
ac)的情况下,腹膜内途径优先于尾静脉注射,以避免对人员、动物和设施的污染(即,由于尾部可能的背压飞溅)。根据我们自己和其他小组的数据,腹膜内注射的抗体在注射后一小时内完全离开腹膜。在1、4、24、48和96小时(每个时间点每个构建体n=5只小鼠)对小鼠实施安乐死。从每只小鼠中收集组织样品(大脑、肌肉、骨骼(带有骨髓的股骨)、心脏、肺、肝脏、脾脏、肾脏、胃、肠和血液),称重,然后使用
225
ac能量窗在伽马计数器中计算每个组织的累积活性。
[0329]
每克注射剂量的百分比(id/g,%)显示在图16a和16b中。结果表明,两种抗体的生物分布和药代动力学清除模式彼此非常接近,这证明了一步标记的抗体在体内的整体稳定性。来自血液和富含血液的器官的清除和对照
225
ac-dota-18b7的摄取稍低,这是由于鼠类蛋白质和18b7抗原(真菌多糖葡糖醛木甘露聚糖)之间缺乏同源性所致。
[0330]
我们还使用图16a和16b中的数据以及prizm 5.0软件(graphpad,san diego,ca)进行计算以确定
225
ac-dota-bc8和
225
ac-dota-18b7抗体在血液和富含血液的器官(肺和心脏)中的半衰期。结果如表5所示,其显示
225
ac-dota-bc8的半衰期为约100小时(4.2天),这对于哺乳动物抗原的全尺寸鼠igg1而言是典型的,并且
225
ac-dota-18b7(也是鼠igg1)的半衰期仅为30小时(1.25天),这可能是由于其各自抗原(真菌多糖)的外来性质。因此,看起来放射性标记的抗体在体内是稳定的,从血液和富含血液的器官中快速清除,并且适用于随后在cd45阳性荷瘤小鼠中进行的药代动力学实验。
[0331]
表5
[0332]
225
ac-dota-bc8和
225
ac-dota-18b7在血液和富含血液的器官中的半衰期
[0333][0334]
225
ac-dota-bc8单克隆抗体在骨髓瘤荷瘤scid小鼠中的生物分布
[0335]
本研究的目的是了解
225
ac-dota-bc8与对照
225
ac-dota-18b7抗体在多发性骨髓瘤scid小鼠模型中的生物分布。用
225
ac对dota缀合的bc8(批次a)和18b7(如上)进行放射性标记,比活性为0.4μci/μg。用cytotrol细胞测试了它们的免疫反应性,并证明了61%的结合,因此满足了50%的最低结合要求。
[0336]
将107个人类多发性骨髓瘤h929细胞(atcc)皮下注射到五十(50)只scid-nod(严重联合免疫缺陷非肥胖性糖尿病)雌性4-5周龄小鼠(charles river laboratories)的右侧,并将107个人类多发性骨髓瘤u266细胞(atcc)皮下注射到其左侧。在大约20天内,当肿瘤直径达到3-4mm时,将小鼠随机分为两组,每组25只小鼠,并在眶内注射
225
ac-dota-bc8或对照
225
ac-dota-18b7单克隆抗体。然后每只小鼠接受0.4μci(1μg)在50μl含有抗坏血酸的0.15m nh4oac缓冲液中的放射性标记的抗体。如上所述,眶内途径优先于尾静脉注射,以避免尾部可能的背压飞溅。在1、4、24、48和96小时(每个时间点每个构建体n=5只小鼠)对小鼠实施安乐死。从每只小鼠收集肿瘤和组织样品(大脑、肌肉、股骨、骨髓、心脏、肺、肝脏、脾脏、肾脏、胃、肠和血液),称重,并使用
225
ac能量窗在伽马计数器中计算每个组织的累积活性。
[0337]
结果在图17a和17b中以每克注射剂量的百分比(id/g,%)表示。h929和u266肿瘤中
225
ac-dota-bc8的摄取显著(p=0.01)高于
225
ac-dota-18b7的摄取。两种抗体都迅速从血液和富含血液的器官中清除。重要的是,骨髓中没有摄取
225
ac-dota-bc8,这证明小鼠骨髓中与人cd45缺乏任何同源性。这些结果表明,
225
ac-dota-bc8特异性定位于h929和u266肿瘤中,因此可用于进一步的放射免疫疗法(rit)实验。
[0338]
实施例8
–
225
ac-bc8:小鼠肿瘤的放射免疫疗法
[0339]
用
225
ac-dota-bc8对scid-nod小鼠中的h929和u266肿瘤进行放射免疫疗法(rit)
[0340]
使用四十(40)只scid-nod雌性4-5周龄小鼠评估
225
ac-dota-bc8在小鼠模型中治疗多发性骨髓瘤异种移植物的治疗潜力。和在生物分布实验中一样,向小鼠皮下注射107个h929(右侧)和u266(左侧)人类多发性骨髓瘤细胞。在大约19天中,当肿瘤直径达到3-4mm时,将小鼠随机分为8组,并用以下进行眶内治疗:0.3μci 225
ac-dota-bc8;0.3μci 225
ac-dota-18b7对照单克隆抗体;匹配数量的未标记的bc8;或未经治疗。在治疗当天和之后每三天用电子卡尺测量肿瘤的大小。监测小鼠的肿瘤大小和健康状况30天。
[0341]
rit研究的结果显示在图18a和18b中。
225
ac-dota-bc8对h929和u266肿瘤都有明显的治疗作用。对照
225
ac-dota-18b7的匹配活性对肿瘤大小有一定影响,但显著(p=0.02)低于
225
ac-dota-bc8。因此,很明显,负荷多发性骨髓瘤异种移植物的小鼠的rit几乎可以完全消除肿瘤生长,并且没有任何不良副作用。
[0342]
rit后肿瘤的组织学分析
[0343]
在完成rit实验时,处死小鼠,切除它们的肿瘤,置于乙醇中,然后置于缓冲福尔马林中,石蜡化,切成5μm切片并用h&e染色。图19a-19d显示了来自未经治疗的和经
225
ac-dota-bc8治疗的小鼠的h929和u266肿瘤。未经治疗的肿瘤比经rit治疗的肿瘤更黏连,后者表现出缺乏黏连性和坏死。
[0344]
实施例9
–
225
ac-30f11:抗cd45替代物的骨髓清除作用
[0345]
在这项研究中,我们已经评估了
225
ac标记的抗小鼠泛cd45抗体克隆30f11在小鼠中用于bmt之前的靶向调理的耐受性和清髓作用。因此,评估了
225
ac-抗cd45抗体(30f11)对b6-ly5a小鼠的剂量依赖性清髓作用。此外,该研究评估了用b6-ly5b(用于监测嵌合体的cd45同种异型差异)进行同系骨髓移植后的植入程度和供体嵌合体。
[0346]
实验方法:
[0347]
(1)30f11的缀合和标记。
[0348]
如上所述,抗cd45抗体30f11与螯合剂dota缀合。为了测试dota缀合的30f11是否保留免疫反应性,将显示为cd45阳性的细胞与裸露的30f11和dota-30f11一起孵育,并通过流式细胞术使用抗大鼠igg2b
pe
检测结合的抗体来确定结合ab的量。
[0349]
如上所述,用
111
in或
225
ac放射性标记dota-30f11至抗体的比活性分别为5μci/1μg(1:1)或1μci/1μg(1:1),放射化学纯度为99
±
1。
[0350]
(1)抗cd45抗体30f11在c57b1/6小鼠中的生物分布。
[0351]
用60μg 111
in-30f11对c57bl/6小鼠进行静脉注射,比活性为5μci/μg。注射后1至240小时,发现脾脏对
111
in标记的30f11的摄取最高,其次是骨髓和肝脏。肾脏、卵巢、肺和血液的摄取量极少。将每个器官的生物分布拟合到时间-活动曲线中以计算每个器官的累积活性。然后应用
225
ac的平衡剂量常数以获得每次施用的活性对器官的剂量,如表6所示。
[0352]
表6
[0353]
器官吸收的
225
ac-cd45抗体剂量
[0354]
器官cgy/uci血液24.3脾脏8691.8肝脏2310.6
卵巢97.5肾脏578.0肺140.8骨髓3963.5
[0355]
(2)
225
ac-30f11在b6-ly5a小鼠中的剂量依赖性耐受性。
[0356]
为了确定
225
ac-cd45抗体放射性缀合物的耐受性,在第0天用递增剂量的
225
ac-30f11治疗c57bl/6(每个队列5只)。施用三个递增剂量水平(100nci、250nci和500nci),以总共10ug(约0.5mg/kg)的30f11抗体(体积100至200ul)注射到尾静脉(iv)中。五只未经治疗的小鼠作为本研究的对照。紧接在调理之前,从对照小鼠中抽取预治疗血样用于基线血细胞计数测量。在第1周和第2周分别测量rbc和wbc,并在第4周对小鼠实施安乐死。从被安乐死的小鼠收集血液并分析肝脏和肾脏毒性,即测量的血尿素氮(bun)、肌酸、丙氨酸转氨酶(alt)和天冬氨酸氨基转移酶(ast)。kaplan-meier图显示100nci和250nci剂量均具有良好的耐受性,而500nci剂量显示1周后存活概率降低。
[0357]
(3)
225
ac-30f11在b6-ly5a小鼠中的安全性。
[0358]
为了确定
225
ac-cd45骨髓移植的安全性,用
225
ac-30f11治疗c57b1/6小鼠并如下用供体骨髓(cd45.1)重建:在第0天注射100nci或250nci的
225
ac-30f11(如上)。调理后四天,一半的队列接受了从c57bl/6-ly5b小鼠中收获的同源骨髓(bmt),靶标密度为经由尾静脉注射的107个有核细胞。定期监测小鼠的体重以及健康和行为变化的明显迹象。
[0359]
通过采血评估植入和供体嵌合,并且在12周时对小鼠实施安乐死。通过总wbc、rbc、hsc、嗜中性粒细胞和血小板计数以及bun、肌酐、alt和ast评估植入。
[0360]
结果:发现500nci 225
ac-30f11是这种清髓方式的最大耐受剂量。经250和100nci的
225
ac-30f11治疗的小鼠以剂量依赖性方式表现出有效的清髓性调理和供体bm植入,而没有任何长期的血液学毒性。
[0361]
结论:装备有
225
ac的泛cd45靶向抗体30f11似乎是一种安全有效的bmt靶向调理方法。该数据支持在bmt之前使用装备
225
ac的抗体开发cd45靶向的清除。
[0362]
实施例10
–
用
177
lu-抗cd45和
131
i-抗cd45进行清淋
[0363]
在患者接受一定剂量的过继细胞转移(例如工程化的自体或同种异体car-t细胞)之前,通常使用高剂量化疗进行清淋步骤。这个过程被认为对于在免疫微环境(例如骨髓)中创造足够的空间很重要,以允许转移细胞的植入。此外,它似乎为供体淋巴细胞的建立和增殖引发了有利的细胞因子谱。在这项研究中,测试了使用β发射器
177
lu(6.6天半衰期;1.5mm路径长度)在小鼠模型中介导有效的清淋。使用
177
lu标记和
131
i标记的替代性抗小鼠泛cd45抗体(30f11)进行了临床前研究,以在小鼠模型中研究靶向rit清淋对特定免疫细胞类型的反应以及由此导致的免疫细胞因子表达的变化。
[0364]
在单剂量施用非清髓性剂量的
177
lu-cd45-rit后,在治疗后96小时和10天从8-12周的c57bl/6小鼠收集外周血、骨髓和脾脏样品用于免疫表型分析,以评估淋巴和骨髓亚群的清淋,以及血清的细胞因子分析。显示
177
lu-cd45-rit可以有效地对淋巴细胞和骨髓细胞进行清淋,包括免疫抑制性t reg和mdsc。还将呈现在用ova特异性cd8 t细胞进行过继细胞转移之前,在e.g7淋巴瘤荷瘤小鼠中评估这种靶向清淋方案的研究。
[0365]
方法和材料
[0366]
用镥-177(
177
lu-cd45)和碘-131(
131
i-cd45)标记抗小鼠泛cd45抗体30f11,并用作放射性标记的泛人bc8的替代物以在小鼠中进行靶向清淋。在基于cd45 细胞的结合试验中确认免疫反应性》95%。
[0367]
对于小鼠中的清淋研究:用20ug的30f11处理雌性青春期c57bl/6小鼠,该30f11用20或40μci的
177
lu或者50或100μci的
131
i标记,以确定选择性地清除免疫细胞亚群的能力。通过流式细胞术测量免疫细胞亚群定量。
[0368]
对于ot i小鼠模型中的清淋研究:用表达ova的cd45 e.g7-ova淋巴瘤肿瘤细胞皮下注射雌性青春期c57bl/6cd45.1小鼠,直到达到100mm3肿瘤体积。肿瘤细胞注射后约7天,用
177
lu-cd45(40μci)、
131
icd45(100μci)处理小鼠,或不接受清淋处理。清淋后4天,将分离自cd45.2 ot i小鼠的分离的cd8 t细胞施用于小鼠。监测肿瘤体积和体重,当肿瘤体积超过4000mm3或坏死时处死小鼠。
[0369]
结果
[0370]
抗cd45抗体以20:1的比例与dota缀合,然后以5:1的比例用
111
in标记。c57bl/6小鼠腹腔注射60μg 111
in标记的比活性为5μci/μg的抗cd45抗体,并在指定时间点通过microspect/ct监测抗体分布。cd45抗体归巢于免疫系统器官:淋巴结、脾脏和骨髓(见图20)。
[0371]
发现放射性标记的抗cd45抗体
177
lu-cd45和
131
i-cd45瞬时消耗cd45 免疫细胞亚群而不影响血小板、红细胞或骨髓细胞。如图21所示,用(a)20或40μci 177
lu-cd45或(b)50或100μci 131-i cd45抗体治疗非荷瘤c57b/6小鼠同样有效地对各种免疫细胞群进行瞬时清淋而不影响骨髓细胞、红细胞或血小板。
[0372]
此外,发现
177
lu放射性标记的抗cd45抗体瞬时消耗脾脏中表达cd45的免疫细胞亚群。如图22所示,用40μci 177
lu-cd45抗体治疗非荷瘤c57b/6小鼠有效地瞬时消耗脾脏中的各种免疫群体,包括调节性t细胞(t-reg)。这种清淋使ot 1过继细胞治疗模型中的肿瘤控制成为可能。
[0373]
如图23所示,在e.g7肿瘤植入后,小鼠要么不接受调理(未经治疗和ot i),要么在第0天用40μci 177lu-cd45或100μci 131i-cd45进行调理,然后在第4天接受1
×
106个ot i cd8 cd45.2 ova反应性t细胞。图a显示了在过继转移的ot i t细胞能够控制eg.7肿瘤生长之前,
177
lu-cd45和
131
i-cd45介导的靶向调理的结果。图b显示了每组中个体小鼠的肿瘤大小。在处死时在小鼠中证实了ot1 t细胞的持久性和扩增。图c显示了对照小鼠(即未接受调理或ot i t细胞)、接受ot 1t细胞的小鼠以及还接受
177
lu-cd45和
131
i-cd45介导的靶向调理的小鼠的总体存活率。
[0374]
结论
[0375]
这些研究证明了在过继细胞疗法之前使用低剂量的
177
lu-cd45或
131
i-cd45放射免疫疗法作为瞬时非清髓性靶向清淋方案的可行性。
111
in-cd45成像证明了cd45靶向将辐射选择性地递送到免疫豁免组织。研究确定,40μci 177
lu-cd45或100μci 131
i-cd45可以有效地消耗小鼠中的各种免疫细胞亚群,但不影响骨髓细胞、红细胞和血小板。在使用负荷eg.7-ova肿瘤的cd45.1 ot1小鼠的过继细胞治疗模型中,接受rit介导的清淋的小鼠与未接受清淋的小鼠相比,表现出增强的肿瘤控制。该数据支持在过继细胞治疗之前使用非清髓剂量的
131
i-cd45或
177
lu-cd45 rit进行cd45靶向清淋。
[0376]
实施例11
–
225
ac-bc8:镰状细胞病(scd)
[0377]
本实施例描述了在scd患者中用基因编辑的hsc移植前的hsc清除(即100%消耗)。
[0378]
scd是全世界最常见的血红蛋白病。非裔美国人中scd的发病率约为500分之一。据估计,美国有100,000人患有此病。scd是由产生镰状血红蛋白的β-珠蛋白基因中的单核苷酸突变引起的。scd患者可能表现出贫血、血管闭塞危象(voc)、溶血、慢性器官功能障碍和早期死亡。患有scd的儿童的死亡率为每100,000人中有0.5人。然而,成年人的死亡率超过每100,000人中有2.5人,患有scd的男性和女性的中值寿命预期均低于50岁。
[0379]
目前,scd的唯一治愈性治疗是造血干细胞移植(hsct)。不幸的是,scd的hsct并非没有问题。根据国际血液和骨髓移植研究中心,从1991年到2017年4月,只有1,089名scd患者接受了hsct。与hsct相关的风险包括使用同种异体供体干细胞引起的并发症(如移植物抗宿主病)。
[0380]
随着基因编辑技术的出现,现在有机会使用自体干细胞治愈scd患者,其中导致scd的β-珠蛋白基因中的突变已得到纠正。zfn、talen、crispr/cas9和其他核酸酶介导的编辑方法可用于修复或移除和替换scd患者的干细胞。例如,sun和zhao(biotech.and bioeng.,2014,111(5))证明了使用talen成功修复了患者多能hsc中的人类β-珠蛋白基因突变。此外,dever等人(nature,2016,539:384-389)证明了使用crispr/cas9可有效修复导致患者hsc中的scd的glu6val突变。使用这种方法用于scd的临床试验现已开始。
[0381]
不幸的是,使用高剂量化疗或全身辐照的标准清髓性调理方案(即,100%hsc消耗方案)目前用于移植,包括用于自体基因编辑的细胞移植。对于这些患者,需要一种更安全、更有效的调理方法。放射性标记的bc8(例如
225
ac-bc8)更能保护患者的正常组织。值得注意的是,患有scd的老年患者可能已经因为他们的疾病而出现器官损伤,并且暴露于非特异性辐射或化疗作为清髓性调理方案可能会使进行干细胞移植的风险更大。放射性标记的bc8方法为这些患者提供了更好的选择。
[0382]
此外,由于该疾病的遗传性质,优选尽可能在生命早期通过移植基因编辑的hsc来纠正该疾病,因为该疾病的并发症可能是不可逆的并且对病人的长期生存具有负面影响。因此,设想使用基因编辑的hsc治疗患有scd的婴儿或幼儿。为此,放射性标记的bc8,特别是用发射α的放射性核素(如
225
ac)标记的bc8,将是理想的。使用发射α的放射性核素(如
225
ac),其辐射路径长度非常短,能量高,可以将辐射集中在cd45阳性细胞上,并允许有效的清髓,而无需隔离接受治疗的患者(如用清髓剂量的
131
i-bc8进行调理所需的)。
[0383]
实施例12
–
225
ac-bc8:严重联合免疫缺陷(scid)
[0384]
该实施例描述了在患有严重联合免疫缺陷(scid)的患者中用基因编辑的hsc进行移植之前的hsc清除。
[0385]
scid是种系遗传病症,其中患病的患者存在严重的t细胞缺陷,伴有或不伴有b细胞缺陷。scid涉及一种有缺陷的适应性免疫反应,它会阻止患者对病原体产生有效的抗体反应。scid是最严重的原发性免疫缺陷形式,至少有九种不同的已知基因,其突变会导致scid。由于scid患者无法产生适应性免疫反应,他们容易受到感染,早期死亡率很高。scid也被称为“泡泡男孩”病,因为患者必须保持在无菌环境中以避免危及生命的感染。
[0386]
scid中最常见的遗传缺陷是常见的γ链(γc),它是白细胞介素il-2、il-4、il-7、il-9、il-15和il-21的受体共有的蛋白质。其他可导致scid的突变基因是ada和jak3。和scd
一样,只有干细胞移植治疗才可能治愈scid。然而,延迟免疫恢复和gvhd对这些患者来说是重大风险。此外,和scd患者一样,scid患者年轻,因此需要有效和安全的治疗方法,包括移植前更好的调理方案。
[0387]
基因编辑技术可以精确修复scid患者的自身hsc中的缺陷。一旦返回体内,这些经过工程化的hsc可以产生正常的淋巴细胞并建立有效的适应性免疫反应以防止感染。最近,chang等人(cell reports,2015,12:1668-1677)报道了通过crispr/cas9介导的小鼠jak3基因突变修复可有效恢复正常淋巴细胞发育。此外,alzubi等人(nature,scientific reports,2017,7:12475)最近证明了使用talen技术在小鼠中精确修复il2rg(通用γ链)中的遗传缺陷,该基因负责x-scid。
[0388]
重要的是开发用于调理人类scid患者的更安全和更有效的方法。需要α发射体cd45放射免疫疗法(例如用
225
ac-bc8)来安全地调理这些绝大多数的年轻患者。
[0389]
实施例13
–
225
ac-bc8:非恶性肿瘤病症的治疗概要
[0390]
表7总结了使用基因编辑的干细胞施用之前通过施用锕放射性标记的bc8抗体(即,调理剂;
225
ac-bc8)去除hsc的选定治疗方案。
[0391]
表7
[0392]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。