1.本公开涉及数个脂质体大麻素。
背景技术:
2.被认为与当前公开的主题背景相关的参考文献如下所列:
3.国际专利申请公开号wo2017203529;
4.国际专利申请公开号wo2001003668;
5.美国专利申请公开号us20170044092;
6.国际专利申请公开号wo2018145213;
7.美国专利申请公开号us20180193399;
8.美国专利号us 9,095,555;
9.美国专利号us1,011,7883;
10.美国专利申请公开号us20170281701;
11.美国专利申请公开号us20180318237;
12.美国专利申请公开号us20180271924a1;
13.美国专利申请公开号us20170107280;
14.国际专利申请公开号wo2017191630;
15.美国专利申请公开号us20180303791;
16.美国专利申请公开号us20180042845;
17.美国专利申请公开号us20180185324;
18.美国专利申请公开号us20180289665;
19.美国专利号us9655910;
20.美国专利号us8242178;
21.美国专利申请公开号us20180221304。
22.此处对上述参考文献的陈述不应被推断为意味着这些参考文献以任何方式与当前公开的主题的可专利性相关。
23.很少有出版物描述了与各种脂质体相关的大麻二酚(cannabidiol,cbd)的用途,例如:wo2017203529描述了包含大麻二酚(cbd)或其一衍生物及透明质酸或其一盐的一组合的数个组合物;一磷脂,及任选的一生理上可接受的载体。所述大麻二酚可掺入由所述数个磷脂形成的数个脂质体中。所述组合物被描述用于治疗炎症性关节疾病,或与此类疾病相关的疼痛或炎症。所述组合物是为局部注射而配制的。
24.描述脂质体大麻二酚的其他出版物包括wo2001003668,描述了脂质体包埋的数个大麻素的肺部递送;us20180318237描述了数个大麻素的局部施用,所述数个大麻素可能在所述数个脂质体中;wo2017191630描述了大麻二酚(可能在数个脂质体中)的用途,用于减少一类固醇剂量及治疗炎症及自身免疫性疾病;us20180303791、us20180042845及us20180185324描述了使用大麻素治疗多发性骨髓瘤,所述数个大麻素可以在数个脂质体
中;us9655910描述了数个大麻素(可能在数个脂质体中)的用途,用于治疗成瘾;us8242178描述了大麻二酚(可能在数个脂质体中)的用途,用于治疗自身免疫性肝炎;及us20180221304描述了含有大麻素的数个复杂混合物,用于治疗肥大细胞相关或嗜碱性粒细胞介导的炎症性疾病,其中数个脂质体被建议作为局部递送的一工具。
技术实现要素:
25.本公开提供了一种延长释放制剂,所述延长释放制剂包含数个脂质体,所述数个脂质体具有一脂质膜及一脂质体内水性核心,其中所述脂质体包含一或多个形成脂质体的脂质、一包埋的大麻素(例如大麻二酚(cannabidiol,cbd)或其功能同系物及一大麻素(例如pg、hsa、ivig)的至少一分散剂,所述至少一分散剂并非环糊精(cyclodextrin,cd)化合物。所述脂质体内核心也可能包括环糊精(cd)。
26.本公开还提供了包含一种延长释放制剂,所述延长释放制剂包含数个脂质体,所述数个脂质体具有一脂质膜及一脂质体内水性核心,所述脂质膜包含一或多个形成脂质体的脂质,其中所述脂质体包含一包埋的大麻素,所述大麻素的至少一部分包埋在所述脂质膜中,并且其中所述脂质膜包含在所述大麻素及所述一或多个形成脂质体的脂质之间的一摩尔比,所述摩尔比在1至10之间的范围内。
27.本公开还提供了一种治疗方法,包括以下步骤:对有需要的一受试者施用一治疗有效量的一延长释放制剂,所述延长释放制剂包含数个脂质体所述数个脂质体具有一脂质膜及一脂质体内水性核心,其中所述脂质体包含一或多个形成脂质体的脂质、一包埋的大麻素化合物及一大麻素的至少一分散剂,所述至少一分散剂并非一环糊精(cd)化合物。
28.此外,本公开提供了一种治疗方法,包括以下步骤:对需要治疗的一受试者施用一延长释放制剂,所述延长释放制剂包含数个脂质体,所述数个脂质体具有一脂质膜及一脂质体内水性核心,所述脂质膜包含一或多个形成脂质体的脂质,其中所述脂质体包含一包埋的大麻素,所述大麻素的至少一部分包埋在所述脂质膜中,并且其中所述脂质膜包含在所述大麻素及所述一或多个形成脂质体的脂质之间的一摩尔比,所述摩尔比在1至10范围内。
29.在一些实施例中,所述制剂还包含一包埋的环糊精(cd)化合物。
附图说明
30.为了更好地理解本文公开的主题并举例说明如何在实践中实施,现在将参考附图仅通过非限制性范例的方式描述数个实施例,其中:
31.图1a至图1c是各种大麻二酚制剂的数个显微图像(zeiss sn 221209,x200放大倍数),所述各种大麻二酚制剂包括脂质体大麻二酚(f1,图1a)、脂质体大麻二酚-hsa 50mg/ml;(图1b),脂质体大麻二酚-hsa100mg/ml(图1c)。
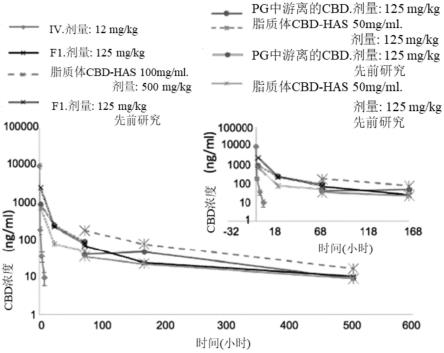
32.图2a至图2b是显示静脉注射12mg/kg剂量与不同im制剂后血浆大麻二酚浓度(ng/ml)的数个图表(n=3,平均值
±
sd,无异常值两个独立的体内研究)。
33.图3a至图3b是显示肌肉注射不同制剂后肌肉释放的绝对大麻二酚(mg)的数个图表(n=3,平均值
±
sd,无异常值)(图3a)及肌肉注射不同制剂后肌肉释放的大麻二酚百分比(n=3,平均值
±
sd,无异常值)(图3b)。
34.图4是dmpc:dppc-大麻二酚脂质体的一显微图像(zeiss sn 221209,x200放大倍数)。
具体实施方式
35.本公开基于以下意外发现,包埋在一脂质体双层中的大麻二酚的存在影响了(降低/减慢)大麻二酚从所述脂质体的释放速率,从而允许从所述脂质体制剂中大麻二酚的一延长递送。本发明还发现在脂质体内水环境中存在一分散剂(能够均匀分散大麻二酚)(在脂质体内水环境中存在或不存在大麻二酚)也可以降低从脂质体的大麻二酚的所述释放速率。
36.因此,根据其一第一方面,本公开提供了一种延长释放制剂,所述延长释放制剂包含一脂质体,所述脂质体具有一脂质膜及一脂质体内水性核心,其中所述脂质体包含一或多个形成脂质体的脂质、一包埋的大麻素化合物及至少一大麻素分散剂,所述至少一大麻素分散剂并非(即不是)一环糊精(cd)化合物。
37.根据一第二方面,本公开提供了一种延长释放制剂,所述延长释放制剂包含一脂质体,所述脂质体具有一脂质膜及一脂质体内水性核心,所述脂质膜包含一或多个形成脂质体的脂质,其中所述脂质体包含一包埋的大麻素或其功能同系物,所述大麻素的至少一部分包埋在所述脂质膜中,并且其中所述脂质膜包含所述大麻素及所述一或多个形成脂质体的脂质之间的一摩尔比,所述摩尔比在1至10之间的范围内。
38.本公开还提供了一种利用上述延长的脂质体制剂治疗需要延长一大麻素化合物递送的一病症的方法,所述方法因此包括向所述受试者施用所述延长释放制剂。
39.本文公开的所述数个制剂包含至少一大麻素。在本公开的上下文中,当提及大麻素时,应理解为包括一单一化合物或数个大麻素化合物的一组合(即,如本文所用的术语包括单一或数个此类化合物)。在一些实施例中,数个大麻素的所述组合包含所述植物提取物的数个成分,即多种大麻素及任选的数个植物黄酮类化合物(plant flavonoids)及数个萜类化合物(terpenoids)。
40.在一些范例中,所述大麻素为大麻二酚(cbd)或包含大麻二酚(cbd)。
41.在一些其他范例中,所述大麻素为四氢大麻酚(thc)(delta9-thc及/或delta8-thc)或包含四氢大麻酚(thc)(delta9-thc及/或delta8-thc)。
42.落入本公开范围内的其他大麻素包括选自由大麻酚(cbg)、大麻酚酸(cbga)、大麻酚单甲醚(cbgm)、大麻色素(cbc)、大麻色酮(cbcn)、大麻色烯酸(cbca)、大麻色烯(cbcv)、大麻色烯酸(cbcva)、异四氢大麻酚(异-thc)、大麻酚(cbn)、大麻酚酸(cbna)、大麻酚甲醚(cbnm)、大麻酚c4(cbn-c4)、大麻酚c2(cbn-c2)、大麻酚c1(cbn-c1)、大麻二酚(cbnd)、大麻二酚(cbe)、大麻二酚a(cbea-a)、大麻二酚b(cbea-b)、大麻二环醇(cbl)、大麻二环酸(cbla)、大麻二环素(cblv)、大麻三醇(cbt)、大麻三酚(cbtv)、乙氧基大麻三酚(cbtve)、大麻二酚(cbv)、大麻二酚(cbvd)、四氢大麻酚(thcv)、大麻二酚(cb)dv)、大麻二酚(cbgv)、大麻二酚酸(cbgva)、大麻呋喃(cbf)、脱氢大麻二酚(dcbf)、大麻酚(cbr)组成的群组中的一种或两种或更多种大麻素的任意组合,各自构成本公开的一单独实施例。
43.在一些范例中,所述大麻素为大麻二酚或包含大麻二酚及任何一或多个以上列出的大麻素的一组合。
44.在一些优选范例中,所述制剂中的所述大麻素为大麻二酚。
45.在本公开的上下文中,术语大麻二酚化合物包括大麻二酚及其功能同系物。当提到一大麻二酚功能同系物时,应将其理解为具有与大麻二酚相似的物理化学性质的一化合物。
46.在一些实施例中,所述大麻二酚功能同系物是大麻二酚的一化学类似物,包含至少一苯环及大于4的一logp。
47.在一些范例中,一大麻二酚功能同系物包括大麻二酚的结构同系物(包括异构体),所述结构同系物与大麻二酚类似,所述结构同系物缺乏四氢大麻酚(tetrahydrocannabinol,thc)的所述精神活性(psychoactivity)。
48.在一些范例中,所述大麻二酚化合物是一天然植物大麻素。
49.在一些范例中,所述大麻二酚化合物是一合成的大麻二酚同系物。
50.数个大麻二酚化合物的数个非限制性范例包括名称为2-[(1r,6r)-6-异丙烯基-3-甲基环己基-2-烯-1-基]-5-戊基苯并-1,3-二醇(2-[(1r,6r)-6-isopropenyl-3-methylcyclohex-2-en-1-yl]-5-pentylbenzo-1,3-diol)(大麻二酚,cbd)、合成的大麻二酚-二甲基庚基(cannabidiol-dimethylheptyl,cbd-dnh)、植物大麻素大麻二酚(phytocannabinoids cannabidivarin,cbdv)、大麻二酚酸(cannabidivarinolic acid,cbdva)、大麻二酚单甲醚(cannabidiol monomethyl ether,cbdm)[paula morales、patricia h.reggio及nadine jagerovic“大麻二酚合成及天然衍生物的药物化学概述(an overview on medicinal chemistry of synthetic and natural derivatives of cannabidiol)”front pharmacol.”8:422,(2017)]。
[0051]
在一些范例中,所述活性成分是大麻二酚,其化学名称为2-[(1r,6r)-6-异丙烯基-3-甲基环己基-2-烯-1-基]-5-戊基苯并-1,3-二醇(2-[(1r,6r)-6-isopropenyl-3-methylcyclohex-2-en-1-yl]-5-pentylbenzo-1,3-diol)。
[0052]
所述大麻素(优选大麻二酚化合物)包埋在所述数个脂质体中/与所述数个脂质体结合。在本公开的上下文中,当提及所述化合物在所述脂质体中的包埋时,应理解为定义所述大麻素及所述脂质体本身之间的任何形式的物理或化学结合。然而,应清楚的是,仅由于所述数个磷脂以脂质体的形式存在所述物理结合,而所述大麻素及磷脂本身之间不具有化学结合。可以通过将大麻素包埋在所述脂质体内的所述水性核心/介质中,及/或至少部分嵌入所述脂质膜中(例如,由于所述大麻素的所述疏水性),及/或与所述脂质体的所述外表面缔合(例如通过数个物理力)。
[0053]
可以使用商业色谱技术确定包埋在脂质体中的大麻素的所述量。在一些范例中,大麻素的浓度是使用高效液相色谱(hplc)/uv方法测定的。
[0054]
在一些实施例中,包埋在所述脂质膜中的所述大麻素通过本领域已知的方法确定。例如,但不限于,所述脂质膜中的所述一或多个脂质体形成脂质与所述大麻二酚之间的所述比率可以通过差示扫描量热法(differential scanning calorimetry,dsc)确定。
[0055]
为了计算大麻素的所述脂质体内浓度,还需要水性脂质体内捕获体积,可以如前所述计算[bangham ad,等人,(1965)j moi生物学。13(l):238-52]。
[0056]
在一些实施例中,由所述脂质体包埋的所述大麻素及优选所述大麻二酚化合物的所述量至少为30mg/ml;有时,至少40mg/ml;有时,至少50mg/ml;有时,至少60mg/ml;有时,
至少70mg/ml;有时,至少80mg/ml;有时,至少90mg/ml;有时,至少100mg/ml;有时,至少110mg/ml;有时,至少120mg/ml;有时,至少130mg/ml;有时,至少140mg/ml;有时,至少150mg/ml;有时,至少160mg/ml;有时,至少170mg/ml;有时,至少180mg/ml;有时,至少190mg/ml;甚至至少20mg/ml。
[0057]
在一些实施例中,由所述脂质体包埋的所述大麻素及优选所述大麻二酚化合物的所述量最多为400mg/ml;有时,最多350mg/ml;有时,最多330mg/ml;有时,最多310mg/ml;有时,最多300mg/ml;有时,最多280mg/ml;有时,最多260mg/ml;有时,最多240mg/ml;有时,最多220mg/ml;有时,最多200mg/ml;有时,最多190mg/ml;有时,最多180mg/ml;有时,最多170mg/ml;有时,最多160mg/ml;有时,最多150mg/ml;有时,最多140mg/ml;有时,最多130mg/ml;有时,最多120mg/ml。
[0058]
在一些实施例中,由所述脂质体包埋的大麻素及优选所述大麻二酚化合物的量在30mg/ml至400mg/ml的范围内,有时在30mg/ml至350mg/ml的范围内;有时,在30mg/ml至350mg/ml的范围内;有时,在30mg/ml至350mg/ml的范围内;有时,在30mg/ml至350mg/ml的范围内;有时,在30mg/ml至200mg/ml的范围内;有时,在50mg/ml至250mg/ml的范围内;有时,在40mg/ml至180mg/ml的范围内;有时,在40mg/ml至250mg/ml的范围内;有时,在30mg/ml至120mg/ml的范围内;有时,在40mg/ml至150mg/ml的范围内;有时,在50mg/ml至300mg/ml的范围内;或在上述确定的浓度上下限内的任何范围内。
[0059]
在一些实施例中,确定所述大麻素与脂质的摩尔比。
[0060]
在一些实施例中,所述大麻素化合物/脂质摩尔比为1至10之间、有时为1至9之间、有时为1至8之间、有时为1至7之间、有时为1至6之间、有时为1至5之间。
[0061]
本公开的一独特特征在于在所述脂质体内隔室中存在一大麻素,且优选为大麻二酚化合物与至少一种非环糊精(cd)的大麻素分散剂组合。这是独一无二的,因为大麻素的溶解度非常低,例如大麻二酚在水溶液中的溶解度(大麻二酚的预测log p为7.03),这是使用不同的分散剂实现的。不受理论的束缚,认为所述分散剂(即并非一环糊精化合物,但可以与一环糊精化合物组合)存在于所述脂质体内水性核心的所述脂质体中时,保持所述数个大麻素的一量以溶解或均匀分散的形式,从而提高所述脂质体内大麻素的可持续性。
[0062]
在本公开的上下文中,术语“大麻素分散剂”应理解为包括促进或增强所述(数个)大麻素(数个大麻素的一或多个组合)在用于装载数个大麻素的所述液体介质中的所述分散性进入脂质体的任何化学实体(优选但不完全是,通过被动加载)。不受理论束缚,所述大麻素分散剂与所述大麻素物理性结合,从而以非共价复合物的形式包埋在所述数个脂质体中。
[0063]
在一些范例中,所述分散剂是一增溶剂(solubilizer)(也被视为增溶剂(solubilization enhancing agent))。当提及增溶剂(solubilizer)时,应理解为包括至少一种非环糊精的化合物。因此,在本公开的上下文中,术语“非环糊精的增溶剂”应理解为不是环糊精的任何增溶化合物,但它可以与环糊精组合,作为一另外的增溶化合物。
[0064]
数个增溶剂已知可用于提高药物溶解度,特别是在使用不溶性药物或溶解度低的药物时。在本公开的一些范例中,在脂质相及水相中都添加大麻素,因此认为所述大麻素化合物分布在脂质相(脂质膜)及所述水性脂质体内相之间,从而提供两种不同的活性成分(即大麻素,例如大麻二酚化合物)的数个池。
[0065]
换言之,不受理论的束缚,认为所述分散剂将大麻素维持在所述脂质体内水性介质中并促进所述活性成分(例如大麻二酚化合物,来自所述脂质体)的所述受控(具体地,延长,例如甚至长达3周)释放。
[0066]
有不同类型的增溶剂。增溶剂可以是共溶剂,即少量添加到主要溶剂(有机溶剂或水)中以增加/改善难溶性化合物溶解度的物质;例如但不限于聚乙二醇(peg),例如peg300、peg400、丙二醇(pg)、n,n-二甲基乙酰胺(n,n-dimethylacetamide,dma)、乙醇;或者它们可以被认为是表面活性剂,例如但不限于tween80(聚氧乙烯(20)脱水山梨糖醇单油酸酯)(polyoxyethylene(20)sorbitan monooleate)、cremophor(丙烷-1,2,3-三醇:环氧乙烷(1:1)(propane-1,2,3-triol:oxirane(1:1))),或者它们可以被认为是作为络合剂(complexing agents),例如环糊精化合物家族的成员。
[0067]
在一些实施例中,所述增溶剂是一共溶剂。一优选的共溶剂是聚乙二醇(peg)。另一优选的共溶剂是丙二醇(pg)。
[0068]
所述分散剂可以不是一增溶剂。在一些范例中,所述分散剂是一蛋白质,所述蛋白质是根据其在溶解它的水性介质中分散大麻素的能力来选择的,最好是大麻二酚。
[0069]
在一些范例中,所述分散蛋白是一血清蛋白。
[0070]
在一些范例中,所述血清蛋白是白蛋白。
[0071]
在一些范例中,所述血清蛋白是人血清白蛋白(hsa)。
[0072]
在一些范例中,所述血清蛋白是一球蛋白。
[0073]
在一些范例中,所述血清蛋白是一免疫球蛋白。
[0074]
所述分散剂及所述大麻素通过非共价键结合。在一些实施例中,所述分散剂及所述大麻素形成一物理复合物,从而在合适的条件下,允许所述大麻素从所述分散剂中释放出来。因此,在一些范例中,所述分散剂及所述大麻素彼此非共价地结合。
[0075]
在一些范例中,所述制剂包括两种或更多种分散剂的一组合。
[0076]
在一些范例中,两种或更多种分散剂的所述组合包括至少一环糊精(cd)化合物。
[0077]
在一些范例中,数个分散剂的所述组合包括两种或更多种这样的化合物,其中没有一种是一环糊精化合物。
[0078]
如上所述,所述数个脂质体还可以包括一环糊精化合物。环糊精化合物被认为是由具有一亲油的中心空腔及亲水的外表面的数个(α-1,4)-连接的α-d-吡喃葡萄糖单元((α-1,4)-linkedα-d-glucopyranose units)组成的数个环状寡糖(cyclic oligosaccharides)。在本公开的上下文中,所述环糊精可以是一天然存在的环糊精,以及天然存在的环糊精的衍生物。天然环糊精包括分别由六个、七个及八个吡喃葡萄糖单元组成的α-、β-或γ-环糊精(αcd、βcd或γcd)。当提到天然环糊精的衍生物(也包括在通用术语“环糊精化合物”下)时,应理解为由具有一亲油中心腔及亲水外表面的(α-1,4)-连接的α-d-吡喃葡萄糖单元((α-1,4)-linkedα-d-glucopyranose units)组成的任何环状寡糖。
[0079]
在一些范例中,所述环糊精化合物是2-羟丙基-β-环糊精(2-hydroxypropyl-β-cyclodextrin,hpβcd)。
[0080]
在一些范例中,所述环糊精化合物是2-羟丙基-γ-环糊精(hpγcd)。
[0081]
在一些范例中,所述环糊精化合物是溶剂丁基醚(sbe)环糊精(solfobutyl ether cyclodextrin)。
[0082]
在一优选的范例中,所述环糊精是hpβcd或简称hpcd。
[0083]
所述制剂还包含数个脂质体。
[0084]
先验地制备所述数个脂质体,所述数个脂质体具有至少一种形成脂质体的脂质。在本发明的上下文中,术语“形成脂质体的脂质(liposome forming lipids)”主要表示在水中形成数个囊泡(例如但不限于数个脂质体)的数个甘油磷脂(glycerophospholipids)或数个鞘磷脂(sphingomyelins),如下文进一步讨论的。
[0085]
当提及数个甘油磷脂时,应理解为具有一甘油主链的数个脂质,其中在所述头部基团的至少一个、优选两个羟基被酰基、烷基或链烯基链、磷酸基中的一者或两者取代,或由任何上述的组合取代,及/或由其数个衍生物取代,并且可以在所述头部基团处包含一化学反应性基团(例如胺、酸、酯、醛或醇),从而为所述脂质提供一极性头部基团。所述数个鞘磷脂由一神经酰胺单元组成,所述神经酰胺单元具有附接到位置1的一磷酸胆碱部分,因此实际上是一n-酰基鞘氨醇。鞘磷脂中的所述磷酸胆碱部分构成了鞘磷脂的极性头部基团。
[0086]
在一些其他范例中,形成脂质体的脂质是二月桂酰-sn-甘油-2磷酸胆碱(di-lauroyl-sn-glycero-2phosphocholine,dlpc)。在一些范例中,形成脂质体的脂质是1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(1,2-dimyristoyl-sn-glycero-3-phosphocholine,dmpc)。在一些范例中,形成脂质体的脂质是1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(1,2-dipalmitoyl-sn-glycero-3-phosphocholine,dppc)。在一些范例中,形成脂质体的脂质是1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(1,2-dipalmitoyl-sn-glycero-3-phosphocholine,dppc)。在一些范例中,形成脂质体的脂质是1,2-二十七烷酰基-sn-甘油-3-磷酸胆碱(1,2-diheptadecanoyl-sn-glycero-3-phosphocholine)。在一些范例中,形成脂质体的脂质是1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(1,2-distearoyl-sn-glycero-3-phosphocholine,dspc)。在一些范例中,形成脂质体的脂质是1,2-二十二烷酰基-sn-甘油-3-磷酸胆碱(1,2-dinonadecanoyl-sn-glycero-3-phosphocholine)。在一些范例中,形成脂质体的脂质是1,2-双花生酰基-sn-甘油-3-磷酸胆碱(1,2-diarachidoyl-sn-glycero-3-phosphocholine,dbpc)。在一些范例中,形成脂质体的脂质是1,2-二壬二酰-sn-甘油-3-磷酸胆碱(1,2-dihenarachidoyl-sn-glycero-3-phosphocholine)。在一些范例中,形成脂质体的脂质是1,2-二山嵛酰基-sn-甘油-3-磷酸胆碱,1,2-二十三烷酰基-sn-甘油-3-磷酸胆碱(1,2-dibehenoyl-sn-glycero-3-phosphocholine,1,2-ditricosanoyl-sn-glycero-3-phosphocholine)。在一些范例中,形成脂质体的脂质是1,2-二木质素酰-sn-甘油-3-磷酸胆碱(1,2-dilignoceroyl-sn-glycero-3-phosphocholine)。在一些范例中,形成脂质体的脂质是1-肉豆蔻酰-2-硬脂酰-sn-甘油-3-磷酸胆碱(1-myristoyl-2-stearoyl-sn-glycero-3-phosphocholine)。在一些范例中,形成脂质体的脂质是1-棕榈酰-2-硬脂酰-sn-甘油-3-磷酸胆碱(1-palmitoyl-2-stearoyl-sn-glycero-3-phosphocholine,pspc)。在一些范例中,形成脂质体的脂质是1-硬脂酰-2-棕榈酰-sn-甘油-3-磷酸胆碱(1-stearoyl-2-palmitoyl-sn-glycero-3-phosphocholine,sppc)。在一些范例中,形成脂质体的脂质是1,2-二油酰-sn-甘油-3-磷酸胆碱(1,2-di-oleoyl-sn-glycero-3-phosphocholine,dopc)或二月桂酰-sn-甘油-2磷酸胆碱(di-lauroyl-sn-glycero-2phosphocholine,dlpc)。
[0087]
在一些范例中,所述形成脂质体的脂质包含至少氢化大豆磷脂酰胆碱
(hydrogenated soy phosphatidylcholine,hspc)。
[0088]
在一个优选的范例中,所述形成脂质体的脂质包含氢化大豆磷脂酰胆碱(hspc)或由氢化大豆磷脂酰胆碱(hspc)组成。
[0089]
在一些范例中,所述形成脂质体的脂质包含至少1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(1,2-dipalmitoyl-sn-glycero-3-phosphocholine,dppc)。
[0090]
在一些范例中,所述形成脂质体的脂质包含至少1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(1,2-dimyristoyl-sn-glycero-3-phosphocholine,dmpc)。
[0091]
在一优选的范例中,所述形成脂质体的脂质包含dmpc及dppc的一组合或由其组成。在一些范例中,所述两种形成脂质体的脂质的dmpc:dppc摩尔比为约45:55。不限于此,含有dmpc:dppc的制剂适合非人类(兽医)使用。
[0092]
在一些范例中,所述脂质体包含一甾醇(sterol),例如胆固醇。
[0093]
在一些范例中,当所述脂质体中存在胆固醇时,其量不超过4摩尔%。
[0094]
在一些额外或其他范例中,脂质体包含一脂质聚合物,例如聚乙二醇衍生的脂质(peg化脂质)。
[0095]
所述数个脂质体可以是任何形式或大小。
[0096]
在一些范例中,所述数个脂质体是数个多层囊泡或数个寡层囊泡。
[0097]
在一些范例中,所述数个脂质体是数个多层囊泡。
[0098]
在一些其他范例中,所述数个脂质体是数个单层囊泡,优选为数个大单层囊泡。
[0099]
所述数个脂质体可以是小的、中的、大的甚至巨型的。当提到小的脂质体时,应理解为具有约20nm-100nm范围内的平均尺寸;当提及中等大小的脂质体时,应理解为具有在约100nm-200nm之间的范围内的平均大小;当提到大的脂质体时,应理解为平均尺寸大于约200nm;当提到巨型的脂质体(通常是巨型的单层或多层囊泡)时,应理解为是指大于1mm的脂质体。
[0100]
在一些范例中,所述数个脂质体是数个多层囊泡(mlv)。在一些范例中,所述多层囊泡具有最小等于或大于100nm的尺寸分布。
[0101]
在一些范例中,包含所述数个脂质体的所述制剂为干燥形式。具体而言,尽管不完全是,所述数个脂质体是冻干的。
[0102]
在一些其他范例中,所述制剂包含保持在一介质中的所述数个脂质体,在本文中称为术语“外部介质”。所述外部介质可以是适合在其中容纳所述数个脂质体的任何组成。在一些范例中,所述外部介质是一种适合于所述数个脂质体储存的介质,而在一些其他范例中,所述外部介质是一种适合于所述数个脂质体施用的介质,例如生理上可接受的载体。
[0103]
在一些范例中,通常当所述外部介质是适合施用的一种时,所述外部介质可以包括一大麻素。所述大麻素可能与所述脂质体包埋的所述大麻素相同或不同。
[0104]
所述大麻素及所述分散剂的所述组合允许了所述延长释放制剂的所述形成,优选地,以受控方式形成。在本公开的上下文中,当提及“控制的释放”或“延长的释放”时,其应理解为表示在一段时间内的一控制的释放。所述时间段至少包括几天,有时至少3天;有时,至少4天;有时,至少5天;有时,至少6天;有时,至少7天;有时,至少8天;有时,至少9天;有时,至少10天;有时,至少11天;有时,至少12天;有时,至少13天;有时,至少14天;有时,至少15天;有时,至少16天;有时,至少17天;有时,至少18天;有时,至少19天;有时,至少20天;有
时,至少21天,甚至超过30天。术语“延长的释放”包括除立即释放以外的任何形式的控制的释放(例如,在前24小时内释放超过50%),并包括扩增的/延长的释放及/或延迟的释放。所述延长的释放可以通过如范例3所述的体外释放测定来确定。50%血清培养2小时后释放≤70%、有时≤60%、有时≤50%,可视为延长的释放。
[0105]
本公开内容还在所述制剂中提供了适于通过注射或输注施用的一生理学上可接受的载体。
[0106]
在本发明的上下文中,一生理学上可接受的载体是指可用于制备药物制剂的任何载体,所述药物制剂通常是安全的、无毒的并且在生物学上或其他方面都不是不合需要的。在一些范例中,所述生理上可接受的载体是适合通过注射施用的一水基溶液(aqueous based solution)。在一些范例中,适用于全身施用的生理学上可接受的载体包括水性及非水性等渗无菌注射/输液溶液,其可以含有抗氧化剂、缓冲剂、抑菌剂及使制剂与血液等渗的溶质的预期收件人。在一些范例中,所述载体是盐水、缓冲溶液、糖水溶液(葡萄糖、蔗糖等)等中的任何一种或组合。在一些范例中,所述载体还可以包括增稠剂、稳定剂及防腐剂。
[0107]
在一些实施例中,施用是通过肌内(intramuscular,i.m.)、腹膜内(intra-peritoneal,i.p.)、静脉注射(intravenous,i.v.)及皮下(subcutaneous,s.c.)注射。
[0108]
在一优选的范例中,所述脂质体制剂用于肌内注射。与非脂质体大麻素制剂的静脉注射相比,肌内注射表现出一延长的/扩增的释放曲线的优势。
[0109]
在一些范例中,针对一哺乳动物受试者进行施用。
[0110]
在一些范例中,针对一人类受试者进行施用。
[0111]
在一些其他范例中,针对一非人类(即兽类)受试者施用。
[0112]
所述数个脂质体中的所述数个大麻素化合物的量被设计为足以在对一受试者施用所述制剂时提供一治疗效果。
[0113]
足以或有效地在施用后实现一治疗效果的量应理解为包括已知由所述数个大麻素化合物实现或与所述数个大麻素化合物(尤其是大麻二酚)相关的至少一治疗效果。
[0114]
不限于此,所述治疗效果可以是治疗/改善/减轻疼痛及/或炎症的任何一种或组合,以及已知与特定大麻素化合物(特别是大麻二酚)的施用相关的任何其他治疗效果。
[0115]
通过所公开的脂质体制剂递送的大麻素的量取决于本领域技术人员已知的各种参数,并且可以基于适当设计的临床试验(剂量范围研究)来确定,并且本领域技术人员将知道如何适当地进行此类试验以确定有效量。用量主要取决于待治疗疾病的类型及严重程度以及治疗方案(施用方式)、治疗对象的性别及/或年龄及/或体重等。
[0116]
所述制剂中的所述数个脂质体及所述数个制剂本身可以通过数个脂质体制剂领域已知的任何技术或任何参数来表征。这包括但不限于脂质体尺寸及/或尺寸分布(例如使用动态光散射(dynamic light-scattering,dls))、多分散指数(polydispersity index,pdi)、界面电位(zeta potential)、使用ph计测量分散液ph值等。
[0117]
本公开还提供了用所述数个大麻素治疗一受试者的施用方法,所述方法包括以下步骤:对需要这种治疗的一受试者施用本文公开的所述脂质体制剂。
[0118]
鉴于上述,在本公开的上下文中,当提及通过本文公开的所述制剂或数个脂质体进行的治疗时,应理解为包括改善与疾病相关的非期望的症状、在这些症状出现之前预防它们的表现、减缓疾病的进展、减缓症状的恶化、增强疾病缓解期的开始、减缓疾病进行性
慢性阶段造成的不可逆损害、延缓进行性阶段的开始、减轻严重程度或治愈疾病、提高存活率或更快速地从疾病中恢复、防止疾病发生、或以上两种或多种的组合。
[0119]
如本文所用,形式“一”及“所述”包括单数及复数引用,除非上下文明确规定否则。例如,术语“大麻素”包括一或多个大麻素。
[0120]
此外,如本文所用,术语“包含”旨在表示所述脂质体包括所述大麻素及所述分配剂,但不排除其他成分,例如生理上可接受的载体及赋形剂以及其他试剂。术语“基本上由
…
组成”用于定义例如数个脂质体,其包括所列举的元件,但不包括可能对大麻素的递送具有一重要意义的其他元件。“由
…
组成”是指排除上述其他元件的微量元件以上。由这些过渡术语中的每一个定义的实施例都在本发明的范围内。
[0121]
此外,所有数值,例如当提及构成所述数个脂质体的所述数个元件的量或范围以及包含所述成分的制剂时,是与所述数值相差( )或(-)高达20%、有时高达10%的近似值。应理解的是,即使并非总是明确说明,所有数值名称前面都带有术语“约”。
[0122]
现在将通过根据本发明实施的数个非限制性范例来描述本发明。应当理解,这些范例旨在说明而非限制的性质。显然,根据以上教导,这些范例的许多修改及变化是可能的。因此,应当理解,在所附权利要求的范围内,本发明可以多种可能的方式以不同于下文具体描述的方式实施。
[0123]
数个实施例说明
[0124]
范例1-数个大麻二酚脂质体制剂
[0125]
脂质体制备及表征
[0126]
材料
[0127]
羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,hpcd)获自roquette
[0128]
氢化大豆磷脂酰胆碱(hydrogenated soy phosphatidylcholine,hspc)及1,2-二肉豆蔻酰-sn-甘油-3-磷酸胆碱(1,2-dimyristoyl-sn-glycero-3-phosphocholine,dmpc)购自lipoid gmbh(ludwigshafen,德国)
[0129]
大麻二酚(cannabidiol,cbd)-获自thc pharm(批次:cbdapi1802)
[0130]
无水乙醇-购自merck
[0131]
增溶剂:聚乙二醇(peg)300、丙二醇(pg)、tween 80及二甲基乙酰胺(dimethylacetamide,dma)购自merck,cremophor,由sigma获得。
[0132]
方法:
[0133]
脂质体制备
[0134]
使用并测试了其酰基链组成不同的不同类型的磷脂酰胆碱(phosphatidylcholines)。这些包括不含胆固醇或含胆固醇(5%或10%)的hspc(主要是硬脂酰(stearoyl),c18)、dppc二棕榈酰(dppc dipalmitoyl)、c16 dmpc(二肉豆蔻酰(di-myristoyl),c14)及dopc(二油酰(di-oleoyl),c18:1)。
[0135]
由于含有dopc的所述数个制剂产生不太有利的脂质体,因此这些被排除在进一步研究之外。
[0136]
制备的不同脂质体详见表1。
[0137]
如下制备制剂f1:在小瓶中称量hspc(s pc-3,类脂,批次:525600-2180662-01/042)及大麻二酚(批次:cbdapi1802)。加入无水乙醇(merck),将小瓶放入65℃的水浴中直
至溶液澄清。然后,将一毫升等渗水溶液(例如5%葡萄糖)放入水浴中。一旦所述脂质相变得澄清,就在65℃下将其加入温水中,同时在65℃下搅拌30分钟。
[0138]
在所述水相中含有大麻二酚的数个制剂是用类似于为f1制备的所述脂质相制备的。所述水相是通过混合特定水相的所有组分,然后加入浓缩的大麻二酚乙醇溶液(700mg/ml)来制备的。在搅拌下缓慢加入乙醇溶液,然后在某些情况下短时间加热。一旦所述水相澄清或分散均匀,在65℃下缓慢加入所述脂质相,并在65℃下继续搅拌30分钟。
[0139]
释放测定
[0140]
在25%牛血清及25%蔗糖的存在下,在37℃温育后的零时间点、1小时(在某些情况下)及24小时测定所述数个脂质体中的大麻二酚的释放。在每个时间点,如下所述来确定总大麻二酚及游离大麻二酚。
[0141]
总大麻二酚测定
[0142]
将所述脂质体大麻二酚在25%血清及25%蔗糖中稀释20倍,将其在甲醇中进一步稀释并在本领域已知的条件下通过hplc分析以通过hplc检测大麻二酚。
[0143]
游离大麻二酚检测
[0144]
脂质体大麻二酚在25%血清及25%蔗糖中稀释20倍。将此稀释液离心,脂质体漂浮在透明相的顶部。下层透明相(游离大麻二酚)用甲醇稀释并通过hplc分析。
[0145]
脂质浓度
[0146]
脂质浓度通过改进的bartlett方法确定,在某些情况下通过具有蒸发光散射(evaporative light scattering,elsd)检测器的hplc方法确定。
[0147]
结果
[0148]
所述脂质相中含有胆固醇的数个制剂。
[0149]
制备了在所述脂质相中含有胆固醇的数个大麻二酚制剂。大麻二酚溶解在所述脂质相中。所有测试配方中的脂质相均为125mg/ml(包括大麻二酚),大麻二酚为脂质相含量的70%摩尔。配方中含有hspc及dmpc,不含胆固醇,含有5%及10%摩尔胆固醇。这些制剂仅在脂质相中含有大麻二酚(不在水相中),并在表1中进行说明。
[0150]
结果表示出,与dmpc脂质体相比,hspc的释放曲线稍慢。胆固醇增加了脂质体中大麻二酚的释放,这种作用对dmpc更为明显。
[0151]
因此,用脂质相中的hspc(125mg/ml脂质相,70%摩尔大麻二酚)及允许了大麻二酚在水相中溶解或分散的不同水相组成来制备其他制剂。
[0152]
表2显示出两种大麻二酚制剂,其中大麻二酚处于仅含有hpcd的水相中。这些制剂产生了与f1制剂相似的装载量(就d/l比率而言)及释放曲线(如表1所述)。这可能是所述数个规律大麻二酚浓度(law cbd concentrations)能够加载到仅含有hpcd(8mg/ml)的水相的结果。
[0153]
表3描述了在水相中具有hpcd及数个表面活性剂(cremphor el及tween 80)的大麻二酚制剂,允许了21mg/ml大麻二酚分散。这些制剂不会导致更高的d/l比率,并且它们的释放曲线无法确定,因为它们导致大量的小脂质体未被我们的释放方法分离。
[0154]
表4显示出在水相中具有hpcd及25%peg 300的配方,允许了14mg/ml大麻二酚分散。其中两种配方(a39及a42)的hpcd含量不同,导致d/l比率显着更高,释放曲线更慢。将这些制剂与在水相中没有大麻二酚的具有相同水性组成的脂质体进行比较,导致d/l比率低
得多,释放曲线更快。证明了在含水储层中含有大量大麻二酚会减慢释放速度。
[0155]
表5描述了在水相中具有hpcd及10-15%pg的数个大麻二酚制剂,允许了21mg/ml大麻二酚分散。对于每种配方,还制备了具有相同水相组成但不含大麻二酚的对照配方。结果表示出,在所有情况下,在水相中含有大麻二酚的制剂的释放速度较慢,并且在d/l比率显着高于对照的情况下释放更为明显。
[0156]
不受限于此,从本文提供的数据看来,通过添加共溶剂(分散剂)或表面活性剂实现的向水相中添加大麻二酚有助于延迟大麻二酚从所述脂质体中的释放。
[0157]
此外,但不限于此,从本文提供的数据显示,在胆固醇存在的情况下,将大麻二酚添加到所述脂质相中的量高于4%摩尔,例如5-10%摩尔,导致大麻二酚从脂质体中快速释放(参见表1,水相为ddw)。
[0158]
此外,但不限于此,从本文提供的数据显示,当大麻二酚脂质体仅在水相中用大麻二酚制备时,脂质相仅由脂质组成,例如hspc(不含大麻二酚),从脂质体中释放大麻二酚的速度也很快(24小时后释放78%)。不受理论的束缚,这可能是由于脂质膜不含大麻二酚或一定量的胆固醇时缺乏膜稳定性。
[0159]
可以从本文公开的发现得出一结论,即所述脂质膜中的大麻二酚稳定了膜,从而允许了大麻二酚从所述脂质体中的所述受控的释放(延长的)。
[0160]
表1-含有胆固醇的脂质体-大麻二酚组成及表征
[0161]
[0162][0163]
表2-具有大麻二酚且处于脂质相(hspc)及水相的脂质体大麻二酚制剂,含有大麻二酚及hpcd
[0164][0165]
表3-具有大麻二酚且处于脂质相(hspc)及水相中的脂质体大麻二酚制剂,含有大麻二酚、hpcd及表面活性剂(cremophor或tween 80)
[0166]
[0167][0168]
表4-在脂质相(hspc)及水相中具有大麻二酚的脂质体大麻二酚制剂,在具有及不具有大麻二酚下含有hpcd及peg 300。
[0169]
[0170][0171][0172]
表5-在脂质相(hspc)及水相中具有大麻二酚的脂质体大麻二酚制剂,在具有及不具有大麻二酚下含有hpcd及pg。
[0173]
[0174][0175]
a-所述浓度不可靠。可能是由于非均匀采样。
[0176]
范例2-含有大麻二酚(cbd)-hsa的脂质体
[0177]
开发了含有大麻二酚(cbd)-hsa作为所述水相的一脂质体制剂(脂质体-大麻二酚(cbd)-hsa)。对于所述制剂,通过将大麻二酚(cbd)分散在5%中来制备水相,将大麻二酚在小瓶中称重并加入5%hsa溶液。将分散体在4℃搅拌至少两天,直到获得均匀的悬浮液,在小瓶壁上没有观察到颗粒。将所述分散体添加到加热的hspc粉末中并在65℃下搅拌15分钟。开发了一种分析方法,能够区分脂质体结合的大麻二酚及hsa结合的大麻二酚。发现虽然悬浮液中脂质体的体积低于额外的脂质体体积,但大多数大麻二酚是脂质体结合的。下表6显示了不同脂质体-大麻二酚-hsa制剂中的脂质体大麻二酚百分比。大麻二酚对脂质体及hsa的亲及力因此被测试如下详述。
[0178]
制备了两种配方:
[0179]
大麻二酚(cbd)-hsa制剂与空mlv(5%葡萄糖中的40mg/ml hspc)的体积比率为1:1
[0180]
f1配方(大麻二酚(cbd)仅存在于所述数个膜脂中)与hsa溶液的体积比率为1:1。
[0181]
将混合物置于37℃的培养箱中,以50rpm的速度摇动2小时。表7显示出结果。与hsa一起培育的f1制剂显示只有1%的总大麻二酚从脂质体转移到hsa。在大麻二酚-hsa与空mlv一起培育的情况下,35%的大麻二酚被转移到脂质体中,表示出大麻二酚对脂质的亲及力要高得多。这些结果与脂质体-大麻二酚-hsa制剂获得的结果一致(表6),表示出大麻二酚主要为脂质体的。
[0182]
向所述数个脂质体中添加hsa使我们能够在所述数个脂质体中达到高的d/l摩尔比。
[0183]
表6-不同脂质体-大麻二酚-hsa制剂中的大麻二酚分布
[0184][0185]
表7-大麻二酚对脂质与hsa的亲及力
[0186][0187][0188]
在50%的成年牛血清中测试了不同配方中大麻二酚的释放。在hplc小瓶中,称重50mg制剂并加入950ul 50:50的血清:葡萄糖5%溶液。将混合物涡旋并置于培养箱中,在37℃及50rpm下振摇2小时。在甲醇中稀释25倍后,测试所述混合物的总大麻二酚含量。将剩余的混合物转移到eppendorf中并离心(30分钟,14,000rpm,4℃),将上相在甲醇中稀释10倍并进行hplc分析。测试了几种脂质体及大麻二酚含量不同的脂质体-大麻二酚-hsa制剂的
体外释放,并在表8中进行了描述。体外释放试验表示出,随着制剂中大麻二酚浓度的增加,释放速度较慢。
[0189]
表8-50%血清中大麻二酚的释放
[0190][0191][0192]
范例3-大麻二酚制剂的体内pk研究
[0193]
进行了两项体内研究以研究im注射不同大麻二酚制剂后肌肉中的血浆分布及残留大麻二酚:第一项研究测试了4种制剂长达3天,第二项研究测试了4种制剂长达3周。每项研究的详细描述见下文。
[0194]
第一项研究
[0195]
制剂制备及表征
[0196]
用于制备制剂的材料的详细信息总结在表9中。所有制剂均在无菌条件下在生物罩中使用高压灭菌设备制备以确保无菌制剂。
[0197]
a、pg中的游离大麻二酚:制备浓度为50mg/gpg的大麻二酚并涡旋直至获得澄清溶液。
[0198]
b、f1:大麻二酚的脂质体制剂,其中大麻二酚仅溶解在脂质体的膜磷脂中:将大麻二酚及hspc一起溶解在65℃的乙醇中(脂质相),直到获得澄清溶液。在搅拌的同时将脂质相添加到65℃的5%葡萄糖溶液中并搅拌30分钟(在65℃)。然后将获得的多层脂质体(mlv)制剂用5%葡萄糖溶液洗涤,直到制剂的重量摩尔渗透压浓度为等渗的。
[0199]
c、f-hpcd-peg:大麻二酚的脂质体制剂,其中大麻二酚溶解在脂质体膜磷脂中,并且还使用增溶剂:hpcd及peg300分散在脂质体内的水相中。大麻二酚及hspc在乙醇(脂质相)中于65℃溶解直至获得澄清溶液。通过在65℃下将乙醇中的大麻二酚溶液添加到含有27%(w/w)hpcd及10%(w/w)peg300的溶液中来制备水相。水相几乎是透明的。在搅拌的同时将脂质相在65℃下添加到水相中并放置搅拌30分钟(在65℃下)。然后将获得的制剂用5%葡萄糖溶液洗涤,直到制剂的重量摩尔渗透压浓度为等渗的。
[0200]
d、脂质体-大麻二酚-hsa:大麻二酚首先分散在5%的hsa溶液中。将所述分散体添加到加热的hspc中并在65℃搅拌15分钟。
[0201]
表9-材料
[0202][0203]
配方表征
[0204]
大麻二酚检测
[0205]
用hplc法测定总及游离大麻二酚含量。所用色谱条件基于屈大麻酚的usp方法,总结在表10中。
[0206]
用于分析的样品制备因每种配方而异,如下所述。
[0207]
所有配方的总大麻二酚浓度相似。具体而言,称取10-20mg制剂放入10ml容量瓶中。将甲醇加入管线。涡旋后,样品离心,分析上层相。
[0208]
测试了f1及脂质体大麻二酚-hsa的游离大麻二酚含量:将200μl制剂置于eppendorf中并在40c、14,000rpm下离心30分钟。然后将澄清的上层相用甲醇稀释10倍,然后涡旋及离心(14,000rpm,10分钟,40℃)。对上相进行hplc分析。
[0209]
对脂质体大麻二酚-hsa制剂的白蛋白结合大麻二酚(albumin bound cbd)进行量化:开发此方法是为了能够分离脂质体及白蛋白结合大麻二酚。为此,使用了等渗介质,允许基于密度的分离。用溶解在50ml ddw(容量瓶)中的1.5g葡萄糖(sigma,d9434,批次119k0042)及10gficoll 400(sigma,f-4375,批次29c-0095)制备培养基。中等渗透压为290mosm/kg。将50mg制剂置于eppendorf管中并加入1.5ml培养基。将试管涡旋,然后离心(4℃,30分钟,14,000rpm)。将管的上相切开,除去残留在下半部分的含有沉淀物的所有液体。将沉淀物转移到另一eppendorf并加入1ml甲醇。涡旋及离心后,上相用甲醇稀释10倍。
[0210]
cremophore中的iv制剂:乙醇按上述总大麻二酚浓度测试总含量。检查用盐水稀释后的外观以遵循用于注射的制剂行为并确保没有沉淀。用盐水将制剂稀释10倍并在1小时后(制剂制备后允许注射的时间)记录外观。
[0211]
表10:大麻二酚测定的色谱条件
[0212][0213]
释放试验
[0214]
在50%的成年牛血清中测试了不同配方中大麻二酚的释放。在hplc小瓶中,称量50mg配方,并添加950ul 50:50的血清:葡萄糖5%溶液。将混合物旋转并放置在37℃及50rpm的培养箱中,摇晃2小时。在甲醇中稀释25倍后,测试混合物的总大麻二酚含量。剩余的混合物转移到eppendorf中,离心(30分钟,14000rpm,4℃),上层在甲醇中稀释10倍,并进行hplc分析。
[0215]
颗粒尺寸测量
[0216]
使用coulter ls 130测定粒度。
[0217]
渗透压
[0218]
使用advanced仪器,型号3320渗透压计通过冰点法来测量渗透压。
[0219]
脂质浓度
[0220]
通过hplc/elsd方法测定脂质浓度。
[0221]
显微镜观察
[0222]
在光学显微镜(zeiss sn 221209)下观察所述数个制剂。观察到的方面(fields)很少,并为每种配方拍摄了一张具有代表性的照片。
[0223]
可注射性
[0224]
用0.3-0.5毫升制剂填充一毫升注射器。将25g针头连接到注射器上,测定未卡住的制剂注射量。这个过程重复了三遍。
[0225]
无菌
[0226]
hadassah aliquot的微生物学部门对每种配方中的一个小瓶进行了测试。从每个小瓶中取出的等分试样接种在血琼脂及巧克力琼脂上,并置于室温及37℃的培养箱中。
[0227]
体内研究方案
[0228]
总共36只12周龄的雌性balb/c小鼠被肌肉注射,每种制剂的单剂量(每组9只小鼠)注射体积为~50μl(1个注射部位~2.5ml/kg)。f1具有较低的大麻二酚浓度,在2个注射部位注射,总注射量约为100μl。为确保给药剂量准确,注射前后对注射器进行称重,记录实际注射量。
[0229]
在下面详述的时间点,每组3只小鼠用co2安乐死,并立即从标记的0.5ml k3edta采血管(mini collect,greiner)中的眶后窦收集终末血液-bio-one,奥地利)。将血液以2000g离心10分钟,然后提取血浆,收集在标记的试管中,收集后立即在-20℃冷冻。然后将样品储存在-80℃等待分析。
[0230]
采血后,将股四头肌收集到预先称重的15ml试管中。
[0231]
血液及肌肉采集的时间点是:注射后2小时、24小时及72小时。
[0232]
生物分析检测
[0233]
血浆中大麻二酚的测定
[0234]
大麻二酚是从加标大麻酚(cannabigerol)(cbg,1mg/ml甲醇溶液,sigma,cat.c-141-1)用作内标准(internal standard,is),然后用乙腈(acetonitrile)将血浆稀释五倍。剧烈涡旋后离心,分析上层相。样品中的最终is浓度为100ng/ml。
[0235]
通过lcms方法分析血浆提取物。具体来说,lc-ms/ms分析是在sciex(framingha,ma,美国)triple quad
tm
5500质谱仪与shimadzu(日本京都)uhplc系统联用上进行的。浓度是根据血浆中大麻二酚在1-1,000ng/ml范围内的校准曲线计算的,其中is为100ng/ml。
[0236]
在乙腈中制备用于制备血浆校准曲线的大麻二酚加标溶液。cbg在甲醇中制备。
[0237]
肌肉中大麻二酚的测定(注射部位)
[0238]
通过手术切除肌肉,并记录它们的重量。此后,加入2ml 15%胶原酶溶液(sigma,c7657),并将试管在37℃下培育过夜。培育后,加入8ml乙腈,涡旋并离心。对上相进行hplc分析。色谱条件参见表10。
[0239]
基于大麻二酚在乙腈中的校准曲线计算每个肌肉中大麻二酚的浓度。
[0240]
将大麻二酚制剂掺入肌肉与掺入乙腈相比,确定了每种制剂从肌肉中回收大麻二酚的情况。
[0241]
结果
[0242]
对制剂的大麻二酚及hspc总含量及其摩尔比、颗粒尺寸及显微镜外观进行表征。除了f1的大麻二酚含量为30mg/g外,所有配方的大麻二酚浓度都在50-60mg/g的范围内。表11总结了这些结果。
[0243]
用制备的制剂向小鼠肌肉注射。注射前后记录注射器重量,准确计算注射剂量。
[0244]
表12总结了获得的血浆及肌肉浓度。这项研究清楚地表示出,大麻二酚在注射部位(肌肉)保留超过72小时。在此期间,肌肉中的贮库以取决于所用配方的速率将大麻二酚释放到血浆中。
[0245]
表11-配方表征
[0246][0247]
表12-获得的血浆及肌肉浓度
[0248]
[0249][0250]
nc=未计算
[0251]
第二项研究
[0252]
制剂制备及表征
[0253]
材料及方法
[0254]
材料
[0255]
表13总结了有关用于制剂制备的材料的详细信息。
[0256]
表13:材料详细信息
[0257][0258]
[0259]
方法
[0260]
制剂制备
[0261]
所有制剂均在无菌条件下在一生物罩中使用高压灭菌设备制备,以确保无菌制剂。肌肉注射(im)药代动力学(pk)研究使用了三种制剂类型。
[0262]
ctrl-pg:溶解在丙二醇(pg)中的大麻二酚的对照制剂。制备浓度为50mg/g pg的大麻二酚并涡旋直至获得澄清溶液。
[0263]
f1:大麻二酚的脂质体制剂,其中大麻二酚仅溶解在脂质体的膜磷脂中。将大麻二酚及hspc一起溶解在65℃的乙醇(脂质相)中,直到获得澄清溶液。将脂质相加入到65℃的5%葡萄糖溶液中,同时搅拌,并放置搅拌30分钟(在65℃)。然后将获得的多层脂质体(mlv)制剂用5%葡萄糖溶液洗涤,直到制剂的重量摩尔渗透压浓度为等渗的。
[0264]
脂质体-大麻二酚-hsa:大麻二酚的脂质体制剂,其中大麻二酚首先分散在hsa中,然后将大麻二酚-hsa被动地包埋在脂质体中。大麻二酚首先分散在5%hsa溶液中。将所述分散体添加到加热的hspc中并在65℃下搅拌15分钟。
[0265]
iv制剂:用于iv施用的制剂是溶解在cremophor:ethanol 50:50溶液中的10mg/g大麻二酚制剂。所述制剂在注射前用生理盐水稀释10倍,稀释后浓度为1mg/ml。配制后1小时内使用稀释的制剂。
[0266]
在下文中,配方定义为含有50mg蛋白质的大麻二酚量/ml溶液。因此,例如,“脂质体大麻二酚/hsa 50mg/ml”表示包含50mg大麻二酚及50mg hsa的脂质体制剂。
[0267]
配方表征-如第一项研究所述
[0268]
体内研究方案
[0269]
iv施用
[0270]
总共18只12周龄的雌性balb/c小鼠被静脉注射单剂量的10mg/kg大麻二酚制剂在cremophor:乙醇中。
[0271]
在下面详述的时间点,用co2对3只小鼠实施安乐死,并立即在标记的0.5ml k3edta血液收集器中从眶后窦收集终末血液管(mini collect,greiner-bio-one,奥地利)。将血液以2000xg离心10分钟,然后提取血浆,收集在标记的试管中,收集后立即在-20℃冷冻。然后将样品储存在-80℃等待分析。
[0272]
采血时间点:2分钟、1小时、4小时、8小时、24小时及48小时。
[0273]
即时通讯管理
[0274]
总共36只12周龄的雌性balb/c小鼠被肌肉注射单剂量的im制剂。每个配方九只老鼠。在注射前后对注射器进行称重,以准确记录每只小鼠接受的确切体积及剂量。表14中总结了每组的注射量及估计剂量的详细信息。
[0275]
两只小鼠未注射制剂,并用作体重(bw)随时间变化的对照。
[0276]
在下面详述的时间点,每组3只小鼠用co2安乐死,并立即从眶后窦(retro-orbital sinus)收集终末血,用标记的0.5ml k3 edta采血管(mini collect,greiner-bio-one,奥地利)。将血液以2000xg离心10分钟,然后提取血浆,收集在标记的试管中,收集后立即在-20℃冷冻。然后将样品储存在-80℃等待分析。
[0277]
采血后,将股四头肌收集到预先称重的15ml试管中。
[0278]
采血时间点:注射后72小时、1周及3周。
[0279]
在施用前及安乐死前记录小鼠体重。在第3周时间点处死的小鼠也在施用后两周称重。
[0280]
表14:每组的注射量及估计剂量
[0281][0282]
结果
[0283]
本范例定义了三种基于颗粒的大麻二酚制剂与大麻二酚在丙二醇(pg)中的溶液在im施用或iv施用后的药代动力学曲线(给药剂量为12mg/kg,基于文献,这在几种动物模型1-3中是有效的)。
[0284]
配方
[0285]
通过在65℃下用大麻二酚-hsa分散体水合hspc来制备脂质体大麻二酚-hsa制剂。所获得的脂质体是球形及同质的,可以通过显微镜图像观察到(图1b至图1c)。
[0286]
50mg/ml制剂的脂质体平均直径为8.1μm,100mg/ml制剂的平均直径为6.7μm。
[0287]
所述数个制剂中的大麻二酚浓度是预期浓度(基于计算)。100mg/ml制剂呈现出3.05的高摩尔药物与脂质(d/l)比率。这些制剂中的大麻二酚似乎分布在脂质体大麻二酚(在所述膜及所述内部水相中)及所述数个脂质体外的白蛋白(大麻二酚-hsa)之间。
[0288]
配方表征在表15中提供,颗粒尺寸总结在表16中。
[0289]
表15:制剂表征(im施用)
[0290][0291]
*2小时后结合,在50%血清中
[0292]
**自由意味着所有体积的制剂都立即/自由地从注射器中注入
[0293]
值得注意的是,还发现所有制剂都是无菌的,即在任何测试制剂中均未检测到微生物生长。
[0294]
还表征了用于iv施用的cremophor:乙醇中的大麻二酚制剂。浓缩物中大麻二酚的浓度为11.7(mg/ml)。用盐水稀释后,溶液澄清至少1小时。
[0295]
表16:颗粒尺寸(平均值,d10、d50及d90)
[0296]
[0297]
*跨度=(d90-d10)/d50
[0298]
测定了这些制剂中脂质体(膜核及脂质体内核)与大麻二酚-hsa之间的大麻二酚分布,并总结在表17中。
[0299]
表17:脂质体-大麻二酚-hsa制剂中的大麻二酚分布
[0300][0301]
表17显示出,尽管脂质体体积低于额外的脂质体体积,但大多数大麻二酚为脂质体的(86%-91%),相对小部分在脂质体外与hsa结合(9%-14%)。因此假设大多数hsa结合的大麻二酚被转移到形成脂质体的脂质中。所述观察结果与范例2的表6中描述的hsa及脂质之间的大麻二酚分配一致。
[0302]
在50%血清存在下培育2小时后,对于50mg/ml及100mg/ml制剂,游离大麻二酚浓度分别为33mg/ml及53mg/ml,占70%及57%释放(100%结合=%释放)。所述释放速率更接近于f1脂质体获得的速率。f1是一种脂质体制剂,所述大麻二酚在所述脂质体制剂中被所述数个膜脂溶解,且所述大麻二酚可能仅位于所述脂质体膜中。由于从制剂中去除乙醇所需的洗涤步骤,所述制剂中的大麻二酚浓度为21.3mg/ml,低于其他制剂。显微镜下的f1外观显示小圆形颗粒,彼此距离相对较远(图1a)。平均直径为9.2μm(表16)。血清中的释放率为49%,类似于脂质体-hsa制剂(表15)。
[0303]
使用的参考im配方是大麻二酚在丙二醇中的溶液。另一参考包括一组小鼠静脉注射12mg/g剂量(cremophore:注射前用盐水稀释的乙醇制剂)。
[0304]
pk简介
[0305]
在iv施用12mg/kg大麻二酚剂量后获得的pk曲线总结在表18中。
[0306]
表18:iv施用12mg/kg剂量后的血浆大麻二酚曲线
[0307][0308]
*blod
–
低于检测限
[0309]
表18显示出大麻二酚浓度从5分钟的8,856ng/ml迅速下降到施用后8小时的9.5ng/ml。在较晚的时间点(24小时及48小时),大麻二酚浓度低于检测限(blod)。
[0310]
im施用后获得的血浆浓度总结在表19a至表19b及图2中。
[0311]
表19a:跨im制剂的大麻二酚血浆浓度
[0312][0313]
*血浆浓度标准化为剂量(ng/ml/mg/kg)
[0314]
**平均
±
sd血浆浓度标准化为剂量(ng/ml/mg/kg)
[0315]
#假定是注入错误(因此不包括在平均计算中)
[0316]
##异常值。定义为具有比所述组平均值高两倍的值。
[0317]
表19b:跨im制剂的大麻二酚血浆浓度
[0318][0319]
*血浆浓度标准化为剂量(ng/ml/mg/kg)
[0320]
**平均
±
sd血浆浓度标准化为剂量(ng/ml/mg/kg)
[0321]
表19a至表19b及图2a显示出,所有im制剂施用后及施用后最多3周的血浆浓度在施用后1小时至8小时获得的iv曲线范围内。这意味着通过im注射制剂延长递送。图2b还包含第二项研究中测试的相同配方的第一项研究(在图中称为“先前研究”)的所述pk数据,但是,从时间点t=2小时及24小时,因此,为我们提供了完整的iv或im施用后大麻二酚血浆曲线的概述。
[0322]
有趣的是,虽然在静脉注射治疗剂量的大麻二酚后,在施用后立即获得高水平的大麻二酚血浆,但血浆水平在几个小时内下降;然而,对于高剂量大麻二酚的im施用,血浆
大麻二酚的初始水平与iv剂量相似(例如2小时后),然后对于所有im制剂,所述水平在至少3周内基本上保持高水平。
[0323]
此外,对于所有制剂,血浆水平的下降非常缓慢,在3周内下降不到一个数量级。与iv配方的快速下降相比,这种缓慢的下降表示出im曲线的最终斜率并非消除依赖性的,而是吸收依赖性的,表示出配方在这段长时间内不断地从肌肉中释放大麻二酚。
[0324]
表20总结了与施用给每只小鼠的初始大麻二酚相比的肌肉中大麻二酚的残留含量,图3a至图3b显示出与初始施用的大麻二酚相比的每组肌肉释放的平均大麻二酚含量。
[0325]
表20-大麻二酚肌肉浓度(每组n=3)
[0326]
[0327][0328][0329]
a-从肌肉中释放的大麻二酚百分比=100
×
(施用的大麻二酚-肌肉中的大麻二酚)/(施用的大麻二酚)
[0330]
b-计算20g小鼠的估计每日大麻二酚剂量(mg/kg)
[0331]
=每日释放的大麻二酚/0.02kg
[0332]
*异常值。不包括在平均值的计算中
[0333]
#可能是注入的问题。不包括在平均值的计算中
[0334]
nc由于肌肉及血浆浓度的异常值,未计算
[0335]
在1周的时间点,发现高剂量组释放更多的组之间存在差异。在3周的时间点没有发现到这些差异。将肌肉释放的大麻二酚量标准化为施用后的天数,以估计每天释放的大麻二酚量,从而估计每天达到循环的大麻二酚剂量(假设20g小鼠)。当血浆水平被标准化到这个估计的每日剂量时,平均标准化值在各组之间是相似的,并且在1.7-4.5ng/ml/mg/kg的范围内。这些值与施用后4小时至8小时后获得的iv值相似(表18),并证明血浆浓度取决于肌肉释放的大麻二酚,因此可能受制剂控制。根据%大麻二酚释放数据,可以为每种配方计算肌肉中的大麻二酚储量。游离大麻二酚及脂质体制剂在3周时间点释放了大部分大麻二酚(不包括脂质体大麻二酚-hsa 100mg/ml的无法解释的低值,3周)。
[0336]
表21-大麻二酚iv施用12mg/kg剂量后获得的药代动力学参数
[0337][0338][0339]
对iv及im施用进行药代动力学分析。表21给出了获得的iv pk参数。大麻二酚的半衰期很快,为1.68小时,按照剂量标准化的auc暴露量为417小时*ng/ml/mg/kg。对在第一项研究期间也注射的三种制剂进行im施用后的药代动力学分析,允许每种制剂有5个时间点(来自先前研究的2小时、24小时及72小时以及来自当前研究的1周及3周)。组合数据集的pk分析见表22。pg中的f1及游离大麻二酚导致最高的auc。这与以下发现一致:对于这两组,肌肉中的大部分大麻二酚在3周内释放(分别为70%及84%,图3b),导致auc标准化为与iv注射(分别为388小时*ng/ml/mg/kg及293小时*ng/ml/mg/kg)。脂质体-大麻二酚-hsa 50mg/ml制剂的标准化auc值较低(167小时*ng/ml/mg/kg),对应于所述制剂获得的肌肉释放百分比较低(分别为68%,图3b)。
[0340]
表22-在本(第二项)研究及第一项研究中注射的大麻二酚制剂im施用后获得的药代动力学参数
[0341][0342][0343]
讨论
[0344]
iv施用12mg/kg剂量后的pk曲线与通过im途径施用的大麻二酚长效制剂的4种制剂进行比较。im注射制剂的血浆曲线显示血浆水平在注射后至少3周内处于iv血浆曲线范围内。脂质体-大麻二酚-hsa及f1制剂含有≥30%的注射剂量,而游离大麻二酚组的肌肉中仅含有14%。im制剂的大麻二酚血浆水平维持与iv有效剂量观察到的相似的血浆浓度这一事实表示出,这些制剂可能允许延长体内大麻二酚作用。pk曲线的差异允许选择性地设计用于特定所需释放曲线的优选配方。
[0345]
范例4-dmpc/dppc-大麻二酚脂质体的制备
[0346]
制备了摩尔比为45:55的dmpc:dppc中的大麻二酚脂质体制剂。
[0347]
材料:
[0348]
1,2-二肉荳蔻酰-sn-甘油-3-磷酸胆碱(1,2-dimyristoyl-sn-glycero-3-phosphocholine,dmpc):类脂,货号556200(批号:556200-2190329-01)
[0349]
二棕榈酰磷脂酰胆碱(dipalmitoylphosphatidylcholine,dppc):类脂货号556300(批号:556300-2170149-01)
[0350]
大麻二酚(cbd):thc制药
[0351]
结果:
[0352]
形成的所述脂质体包含摩尔比为45:55的dmpc:dppc的组合。脂质相组成详述于表23。
[0353]
表23:dmpc/dppc-大麻二酚脂质体的脂质相组成
[0354][0355]
具体而言,将ph 6.5的组氨酸(0.155%w/v)-甘露醇(4%w/v)缓冲液(hmb)用作所述制剂的水相。脂质相及水相在55℃下预热。然后将脂质相添加到水相中并在55℃下搅拌15分钟。在用组氨酸甘露醇缓冲液洗涤4个循环后通过在4℃下离心从制剂中除去乙醇。
[0356]
图4显示出显微镜下的配方外观(放大倍数200倍)。脂质体的平均大小为5.55μm,总大麻二酚浓度为25.3mg/ml。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。