synthesis of monodisperse noble metal nanocrystals),藉由合成之具双金字塔构型的金纳米粒子,在具特定波长的发光二极管激发下,来产生的电浆子加热方式,藉此在微型反应槽中快速的产生pcr反应所需的温度(热)循环。上述的方法都是藉由贵金属材料及特殊构型,在特定波长光源激发光下,以局域性表面电浆共振(localized surface plasmon resonance;lspr)的方式,将光能转换成热能(反应时间》100皮秒),这样的光热转换特性可以视作快速而实时的反应,此种纳米级加热器概念,在pcr热循环的升温速度快,且热场产生均匀,可藉由调整此纳米粒子的浓度、与入射光的能量强度,轻易地达到温度调控的目的。但上述方法还是有一些挑战及问题需克服,例如:(1)微型反应槽中的反应液体蒸散问题,(2)温度(热)循环中的冷却降温效应不明显,仍需要辅以外接装置(例如:风扇)来达成降温目的,(3)局域性表面电浆共振所需之入射光光源,其波长范围可能会与一些有机荧光染剂的光谱重叠,这现象可能会限制其在荧光定量pcr中的应用。
8.除了上述以光热纳米粒子的电浆子加热方式之外,还有以施加交变磁场使磁性纳米颗粒产热的方式,也被应用于pcr核酸扩增技术,例如:成功大学谢达斌团队,美国us10,913,069b2发明专利公开号(发明名称:method and device for polymerase chain reaction),其专利请求项提及扩增核酸的方法,包括在反应单元中包含目标核酸的反应混合物与过渡金属材料的颗粒接触;并使用频率约为200khz至500thz的电磁辐射(emr)来照射过渡金属材料粒子,以产生pcr核酸扩增所需之温度(热)循环,类似的商品化设备如mic qpcr,其为世界第一台利用电磁引热作为热源的qpcr机器,系由澳洲生物分子系统公司(bio molecular systems,bms)所制造销售之产品。
9.上述使用光热纳米粒子或磁性纳米粒子的加热方式,亦或是传统pcr以电热元件加热pcr反应液,整体而言,这些加热的方式都是属于“体积加热”(volumetric heating)(既透过加热使“整体反应液”的温度上升)。
10.有别于此,德国分子诊断公司(gna biosolutions gmbh)以独创的“脉冲控制扩增技术”(pulse controlled amplification;pca),来实现超快速pcr反应,根据文献名称为「ultra-fast pcr technologies for point-of-care testing」之论文(发表在journal of laboratory medicine,发表日期:2017年10月12日,论文发表者:lars ullerich,stephanie campbell,frank krieg-schneider,federico b
ü
rsgens and joachim stehr)及美国us9,382,583b2发明专利公开号(发明名称:method for the amplification of nucleic acids using heat transfer for nanoparticles,相关申请公开案:de102012201475b4、cn107604052a、ep2809806b1、wo2013113910a1)所揭露,此种脉冲控制的核酸扩增技术是一种控制区域“局部加热”(localized heating)的技术,该技术藉由整合具有光热转换特性的(引物功能化)纳米粒子、镭射光源、及用于冷却目的大体积反应液,透过短时镭射光脉冲式照射(镭射光激发的间隔时间在10纳秒至500毫秒之间),每次镭射光照射于部分金纳米颗粒,可产生pcr反应所需之特殊热辐射场,这种方法所产生之热辐射场非常迅速。此外,这种方法仅可有效地加热金纳米粒子表面区域(包含其结合的引物或扩增子)的微小环境,一旦镭射光停止照射纳米颗粒,这些纳米颗粒(因其高比表面积特性)会快速地冷却至周围核酸扩增反应液的温度。在整体pcr的反应过程中(既重复的温度循环),纳米颗粒所在的周围核酸扩增反应液温度几乎没有改变,上述说明pca技术可以快速实现核酸扩增(例如:pcr)所需之温度(热)循环,该技术不仅可以大幅改善前述“体积加热”所可
能造成的反应液体蒸散问题(会影响后续检测工作的精确度),也可降低传统核酸扩增(例如:pcr)过程中,需要特殊且精准控制的冷却装置(例如:使用风扇与温度反馈控制)之需求,但仍有其缺点,下文另有详细说明。
11.另外,针对前述利用“脉冲控制扩增技术”来创造“区域局部加热”的现象,这技术不仅只能利用“光热粒子”来实现上述局部加热,亦可利用其它原理或机制来产生“区域局部加热”的现象,在gna biosolutions公司欧洲ep3733292a1号发明专利公开案(发明名称:method for carrying out a polymerase chain reaction and device for carrying out the method,相关申请公开案:us2019/0249168a1与文献名称为「pulse-controlled amplification-a new powerful tool for on-site diagnostics under resource limited conditions」之论文(发表在plos neglected tropical diseases,发表日期:2021年1月29日,论文发表者:katharina m
ü
ller,sarah daβen,scott holowachuk,katrin zwirglmaier,joachim stehr,federico buersgens,lars ullerich,kilian stoecker),其揭露利用快速能量脉冲加热微循环器的核酸扩增技术(直接在核酸扩增反应中嵌入微型金属加热元件),藉由几微秒地通电加热,其瞬间产生之热辐射场,仅发生在微型金属加热元件的表面区域(所设计之核酸扩增反应区域),待上述通电状态解除后,该金属加热元件会瞬间被周围的大体积反应液冷却。透过反覆控制与产生上述温度场,该设计可快速产生核酸扩增反应(例如:pcr)所需之温度(热)循环,进而实现快速核酸扩增之目的。
12.由前述的专利前案与文献可知,gna biosolutions公司其独创的“脉冲控制扩增技术”(pulse controlled amplification,简称:pca)可能实现超快速核酸扩增反应(例如:pcr)及其后续之核酸分子检测。虽然该技术可大幅改善传统pcr反应中,因为“体积加热”所造成的反应液蒸散问题,也可降低传统核酸扩增(例如:pcr)过程中,所需要特殊的冷却设计或装置之需求。
13.然而,该技术主要透过动态式控制镭射光与pcr反应区的相对位置,使得高功率激光束以间隔时间在10纳秒至500毫秒通过pcr反应区,藉此选择性和特异性地照射pcr反应区内的部分金纳米粒子,来产生核酸扩增反应所需之温度场(如前述)。基本上,此种操作控制有一定的技术难度,除此之外,pca技术中用于降温目的pcr反应液体积(100~500μl)相对大,因为在pca核酸扩增反应的核酸产物(例如:dna),系是以游离态单链dna(ssdna)的形式存在于pcr反应液当中,其扩增核酸分子之侦测方式,如欧洲ep2481817a1号发明专利公开案(发明名称:process for detecting nucleic acids)与ep3733292a1号发明专利公开案和m
ü
ller等人(2020)所述,系藉由侦测(引物功能化)光热纳米粒子与扩增游离态单链dna所形成的聚合物,在650纳米(nm)波长上之光谱差异,抑或是来自于taqman probe产生的荧光信号。在上述核酸检测方法下,使用大体积的pcr反应液(100~500μl),(因为浓度稀释效应)会造成需要更多的核酸扩增次数去累积核酸扩增的信号,此缺点会进而影响整体核酸扩增与检测所需之时间。
14.除此之外,根据gna biosolutions公司的专利前案中提到pca核酸扩增的方法与装置,仍有许多需要改进的部分,在此整理如下:
15.1、区域加热:整合悬浮相的光热纳米粒子及大体积的pcr反应液,虽然可以实现“超快速核酸扩增”所需的“超快速温度(热)循环”,且超快速核酸扩增过程中,pcr反应液的温度未有明显的变化,这特性可以改善“传统快速核酸扩增”技术中,微量pcr反应液在温度
(热)循环过程中,所产生之pcr反应液蒸散问题(进而影响检测的准确性)。然而,该技术主要透过动态式控制镭射光与pcr反应区的相对位置,使得高功率激光束以10纳秒至500毫秒的间隔时间通过pcr反应区,藉此选择性和特异性地照射pcr反应区内的部分金纳米粒子,来产生核酸扩增反应所需之温度场(如前述)。基本上,此种操作与控制有一定的技术难度。
16.2、gna biosolutions公司的专利前案中提到,pca核酸扩增反应所采用的pcr,系采用二步骤的温度程序,其分别为使双股dna分子变性所需的95℃,以及使引物黏合和聚合酶延伸所需的65℃。虽然该技术系以大体积pcr反应液,来当作冷却的媒介,使金纳米粒子由95℃下降至65℃,因为其温度差只有30℃,因此其降温的速率可能不如其技术所宣称之“实时降温”效果。
17.3、该技术系以大体积的pcr反应液来当作冷却的媒介,使得升温的纳米粒子能够被冷却降温。然而,pca核酸扩增反应的核酸产物,系是以游离态单链dna(ssdna)的形式产生于pcr反应液当中,因此大体积的pcr反应液(既稀释效应)会造成需要更多的核酸扩增次数,去累积核酸扩增的信号,此缺点会进而影响整体核酸扩增与检测所需之时间。
18.4、若面对复杂性的核酸待测物:传统pcr核酸扩增系采用双引物的设计,当面对复杂性高的核酸待测物时,若有部分核酸片段有部分序列相似时,它们会在黏合的过程中发生部份的杂合配对,进而产生非专一性嵌合副产物,导致非专一性核酸序列扩增,此会导致如定点照护检验仪器的错误判别。
19.因此,如何在实现简单及快速的核酸扩增检测时,同时能避免上述技术问题,仍是目前亟待解决的课题。
技术实现要素:
20.有鉴于先前技术的问题,本发明之一目的,系提供操作与控制简易且快速地形成核酸扩增反应所需要的温度(热)循环,且此核酸扩增反应系扩增核酸分子会被部分固定于固相载体表面上之核酸扩增方法及其装置。本发明之另一目的,系于固相载体表面上之核酸可以快速地被纯化分离与浓缩,藉此将有利于后续目标核酸分子的高专一性与高灵敏度检测与分析的方法与装置。
21.根据本发明之一目的,系提供一种核酸扩增方法,包括:在一反应单元的内部包括至少一个待测物、一核酸扩增反应液、至少一个固相载体,其中反应单元及其内部的待测物、核酸扩增反应液、固相载体处于一冷却环境,冷却环境具有一冷却温度;以及调控一外部能量的输出与其开启或关闭的时序,同时藉由冷却环境的冷却温度,形成进行核酸扩增反应所需之一个或多个反应温度循环,使得每一反应温度循环中,所有固相载体同时受外部能量激发而分别形成原位环境,或者各固相载体停止受外部能量使得原位环境逐渐消散,令各固相载体、待测物与核酸扩增反应液在原位环境形成与消散的过程中进行核酸扩增反应,而产生扩增反应物。
22.其中,核酸扩增反应包含聚合酶链式反应(polymerase chain reaction,pcr)、连接酶链式反应(ligase chain reaction,lcr)或等温核酸扩增技术(isothermal nucleic acid amplification technologies,inaat)。
23.其中,每一反应温度循环的开启期间,反应单元内所有的固相载体同时被激发,让所有的固相载体的周遭皆形成原位环境,且于各固相载体产生扩增反应物,该等扩增反应
物一部分保留在各个固相载体,及另一部分的该些扩增反应物释放至核酸扩增反应液中,并在每一反应温度循环的关闭期间,停止激发各该固相载体,并藉由冷却环境的冷却温度,使得各该原位环境逐渐消散。
24.其中,酵素系可为聚合酶,聚合酶更包含脱氧核糖核酸聚合酶(dna polymerase)、核糖核酸聚合酶(rna polymerase),酵素亦可为反转录酶(reverse transcriptase,rt)、核糖核酸酶(ribonuclease,rnase)、解旋酶(helicases)、dna连接酶(dna ligase)的其中之一或任二者以上的组合,可与聚合酶协同作用。
25.其中,外部能量激发各固相载体的方式,系包括接触式激发或非接触式激发。
26.其中,非接触式激发包括光热激发或磁变激发。又光热激发系为镭射、led阵列的其中之一,光能的波长为可见光谱至近红外线光谱,波长范围为380纳米(nm)~1.4微米(μm)。
27.其中,磁变激发系以交变磁场产热。交变磁场系以交变磁场产生器所形成,该交变磁场的振幅和频率系以该等固相载体产生核酸扩增反应所需之温度的场域条件而设定。进一步而言,交变磁场的振幅为0.5~550ka/m和交变磁场的频率为3~3,500khz。
28.其中,接触式激发系为电热产热,电能传输可以电子线路与感应磁通量来进行电能传输(无线充电),电热产热系可为焦耳加热(joule heating)、热电效应(thermoelectric heating)与表面声波(surface acoustic waves;saws)产热。
29.其中,所有固相载体的总体积与核酸扩增反应液体积比例为1:200至1:1
×
109。
30.其中,各固相载体的大小为8~2,000,000nm,其中用于光热激发产热与磁变激发产热的优选固相载体大小为8~1,000纳米;用于电热的优选固相载体大小为1,000~2,000,000纳米。
31.其中,各固相载体系为球形、椭圆形、盘形、星形、杆形、方形、各向异性突次状体、纳米壳、纳米笼、双三角锥、微丝状的其中之一或任二者以上的组合。
32.其中,各固相载体可以为悬浮于反应单元或各固相载体固定于反应单元腔体内壁的其中之一或任二以上组合。
33.其中,冷却温度系为-10~50℃。
34.其中,反应单元或核酸扩增反应液可以事先预冷至冷却温度,或被容置在外部辅助冷却单元内,由预冷的反应单元、预冷的核酸扩增反应液或是外部辅助冷却单元维持冷却温度的状态下,进行一个或多个该反应温度循环。
35.其中,外部辅助冷却单元系为冰、高分子聚合吸水树脂、化学吸热反应物和致冷芯片的其中之一或任二者以上的组合。而高分子聚合吸水树脂系为羧甲基纤维素(carboxymethyl cellulose),其中化学吸热反应物系为硝酸铵溶于或是尿素溶于水所产生的吸热反应。
36.其中,待测物系为细胞、胞器、细菌、病毒、原生生物或其组合,而各固相载体系包括一多功能本体、至少一富集配体及至少一扩增配体,其中各富集配体连接在多功能本体的表面,且各富集配体提供结合待测物,各该扩增配体连接在多功能本体的表面,且各扩增配体是提供结合生物物质。其中生物物质系由待测物所释放出来的脱氧核糖核酸或核糖核酸、或者在扩增配体复制后再释放到核酸扩增反应液的扩增反应物。其中,富集配体可以是抗体、核酸适配体、寡核苷酸、蛋白质、多糖类或其组合。其中,扩增配体可以是核酸适配体、
寡核苷酸,具有用于与固相载体键结的官能基修饰,其可以一级胺、生物素、硫醇基修饰或其组合;增加寡核苷酸与生物物质捕抓的专一性与稳定性修饰,其可以是锁核酸(locked nucleic acid,lna)、硫代磷酸(phosphorothioates)、吗啉(morpholino)修饰或其组合。
37.其中,待测物系为细胞、胞器、细菌、病毒、原生生物或其组合。而一部分的该固相载体系包括一富集本体及至少一个富集配体,其中各富集配体连接在富集本体的表面,且各该富集配体提供结合该待测物,另一部分的固相载体系包括一扩增本体与至少一扩增配体,各扩增配体连接在扩增本体的表面,且各扩增配体提供结合待测物所释放出来的生物物质。其中生物物质系由待测物所释放出来的脱氧核糖核酸或核糖核酸、或者在扩增配体复制后再释放到扩增反应液的扩增反应物。其中,富集本体相当于多功能本体仅具有富集配体之态样。其中,扩增本体相当于多功能本体仅具有扩增配体之态样。
38.其中该待测物系为游离性脱氧核糖核酸或核糖核酸物质,而各固相载体系包括一扩增本体与至少一扩增配体,各扩增配体连接在扩增本体的表面,且各扩增配体提供结合该待测物。
39.根据本发明之一目的,系提供一种快速核酸扩增系统,包括反应单元、辅助冷却单元、外部能源激发单元、整合式驱动器;其中反应单元提供容置一反应溶液、待测物、核酸扩增反应液与至少一个固相载体;其中辅助冷却单元系可为事先预冷至冷却温度的核酸扩增反应液,或系由设置在反应单元周围的外部辅助冷却单元持续对该反应单元进行降温,并使核酸扩增反应液维持在冷却温度;其中外部能源激发单元,系提供固相载体激发产热;其中整合式驱动器,系用以控制外部能源激发单元的能量输出、开启与关闭的时序,并可依据外部能源校正器与温度侦测单元进行能源输出、对外部辅助冷却单元进行反馈控制,形成进行核酸扩增反应所需之一个或多个反应温度循环。
40.根据本发明的另一目的,系提供一种核酸检测方法,系于核酸扩增方法完成后,以下列步骤进行核酸检测,使用一操作单元,辅助纯化分离、浓缩该等固相载体上所结合的该扩增反应物,使用一侦测模块,识别固相载体上的扩增反应物上产生的光学变化、热传感变化、电化学变化、磁性变化或电质量变化的其中之一或任二者以上之组合。进一步在侦测模块识别出与固相载体结合的扩增反应物。
41.其中,该扩增反应物上产生的光学变化的方法,包含于该扩增反应物拌入核酸标记并使用光度计侦测光强度,或该扩增反应物使用酶联免疫吸附分析法检测产生的光学变化或化学发光变化,或者该固相载体与该扩增反应物结合产生的光谱变化。
42.其中,该扩增反应物上产生的光学变化的方法,该侦测模块系为核酸侧向流试纸条检测或免疫侧向流试纸条,用以检测产生的光学变化。
43.其中,该核酸侧向流试纸条检测或免疫侧向流试纸条检测辅以热传感侦测、表面等离子共振图谱或任其组合,以加强该核酸侧向流试纸条检测或免疫侧向流试纸条检测的反应灵敏度。
44.其中,该扩增反应物上产生电化学式变化的方法,包含酶联免疫吸附分析的电化学法侦测、电阻抗谱(eis)检测的其中之一或两者之组合。
45.其中,该扩增反应物上产生磁性变化的方法,包含交流磁导入仪检测与巨磁阻检测或任二者组合。
46.其中,该扩增反应物上产生电质量变化的方法系为石英晶体微天平。
47.根据本发明的另一目的,系提供一种快速核酸检测装置,包括操作单元与侦测模块,其中操作单元,辅助纯化分离、浓缩固相载体,侦测模块系辨识固相载体上的扩增反应物上产生的光学变化、热传感变化、电化学变化、磁性变化或电质量变化的其中之一或任二者以上之组合,而用以检测固相载体上结合的扩增反应物。
48.综上所述,本发明有别于现有的核酸扩增方法,并具有下述优点:
49.(1)简单地透过控制外部能量激发的特性(例如:能量大小及频率)、及反应单元中的冷却效应,可于固相载体表面之原位环境,快速地产生核酸分子扩增所需之温度循环,进而实现快速核酸扩增之目的。
50.(2)核酸扩增反应液本身先降低到冷却温度,或者藉由辅助冷却单元让反应单元处于冷却环境,可以抑制非目标的引物黏合,以及非目标核酸的扩增,因此可以提高目标核酸分子扩增之专一性。
51.(3)受限于固相载体表面之空间,因此,在相对短的操作时间下(或是相对较少的核酸放大循环次数下),固相载体表面的固定化扩增核酸分子既可达到饱和状态,这将有助于后续的扩增核酸分子检测工作。
52.(4)若固相载体具有强磁性,固相载体上因核酸扩增所产生的扩增反应物,可透过操作单元的磁场操作,来进一步纯化与浓缩这些固定于固相载体的扩增反应物,此技术特性将有利于后续扩增扩增反应物的检测工作(例如:提高其检测的效能)。
53.(5)因整体核酸扩增反应液维持于低温状态,不仅能避免核酸扩增反应液的蒸发与气泡生成问题,也具有抑制或降低非特异性核酸扩增等优点。
附图说明
54.图1(a)为本发明之一实施例快速升温示意图;
55.图1(b)为本发明之一实施例快速降温示意图;
56.图2为本发明之一实施例中固相载体之结构与表面特征示意图;
57.图3为本发明之一实施例的核酸扩增系统之架构示意图;
58.图4(a)为本发明之一实施例中固相载体在反应单元拌入核酸扩增反应液中的悬浮状态示意图;
59.图4(b)为本发明之一实施例中固相载体在反应单元中以键结的方式半固定于反应槽的底部,以半悬浮方式键结于反应单元的腔体内壁;
60.图4(c)为本发明之一实施例中固相载体在反应单元中固定在反应单元的腔体内壁示意图;
61.图5为发明之一实施例,以具光热转换能力的固相载体,进行水冷式珠上聚合酶链式反应之核酸扩增系统的构成示意图;
62.图6为本发明之一实施例以操作单元纯化固相载体之示意图;
63.图7(a)~(e)为本发明之一实施例中水冷式珠上聚合酶链式反应(on-bead pcr)第一次反应过程示意图;
64.图7(f)~(g)为完成图7(a)~(e)后的第二次反应过程示意图;
65.图7(h)~(k)为完成图7(f)~(g)后的第三次反应过程示意图;
66.图7(l)为完成多次反应过程示意图;
67.图8为本发明核酸扩增方法暨检测方法之流程图;
68.图9(a)为本发明之一实施例环介导等温扩增反应(lamp)的引物对示意图;
69.图9(b)~(e)为以图9(a)进行脉冲式水冷式珠上环介导等温扩增反应(lamp)示意图;
70.图10(a)为本发明之一实施例中,固相载体以激发60秒后停止激发120秒连续反覆10次的光热转化温度测量示意图;
71.图10(b)为本发明之一实施例中,固相载体于不同功率激发的温度测量示意图;
72.图11(a)为本发明之一实施例选用纳米金磁壳(magnetic gold nanoshells,mgns)微尺度悬浮液,施加于其上的镭射强度与纳米金磁壳光热转换温度的关系图;
73.图11(b)为微尺度纳米金磁壳悬浮夜中以不同功率激发后的红外线热成图像;
74.图12(a)为本发明的辅助冷却单元之一实施例的外观示意图;
75.图12(b)为图12(a)的辅助冷却单元给予核酸扩增反应液在100次的外部镭射激发循环下(400毫瓦(mw)/0.16平方公分(cm2),照射1.25秒;关闭0.5秒;150mw/0.16cm2照射7.5秒),含有单相纳米金磁壳的核酸扩增反应液整体温度变化;
76.图13(a)为本发明一实施例,以免疫侧向流试纸条侦测水冷式珠上聚合酶链式反应的检测前示意图;
77.图13(b)为本发明一实施例,以免疫侧向流试纸条侦测水冷式珠上聚合酶链式反应的检测结果示意图;
78.图14(a)为将图13(b)以电浆子热传感分析免疫侧向流试纸条,以侦测固相载体核酸扩增的检测结果的阳性反应示意图;
79.图14(b)为将图13(b)以电浆子热传感分析免疫侧向流试纸条,以侦测固相载体核酸扩增的检测结果之阴性反应示意图;
80.图15(a)为本发明一实施例中以808nm波长镭射进行水冷式珠上聚合酶链式反应,以镭射循环时间循环(400mw/0.16cm2照射1.25秒,150mw/0.16cm2照射7.5秒),不同镭射循环时间循环下(10~50次循环),纳米金磁壳上的扩增反应物以免疫侧向流试纸条进行检测的检测结果示意图;
81.图15(b)为本发明一实施例中以808nm波长镭射进行水冷式珠上聚合酶链式反应,在最适镭射激发条件与最短的镭射循环时间循环(400mw/0.16cm2照射1.25秒,150mw/0.16cm2照射7.5秒),不同镭射循环时间循环下(10~30次),纳米金磁壳上的扩增反应物与核酸扩增反应液中残留的扩增反应物的电泳分析结果示意图;
82.图16(a)为待测物为简单样品进行传统的聚合酶链式反应后的电泳分析结果示意图;
83.图16(b)为待测物为简单样品进行水冷式珠上聚合酶链式反应后以免疫侧向流试纸条进行检测的检测结果示意图;
84.图17(a)为待测物为复杂样品(混有多种致病菌的核酸与大肠杆菌核酸样品)进行传统的聚合酶链式反应后的电泳分析结果示意图;
85.图17(b)为待测物为复杂样品进行水冷式珠上聚合酶链式反应后以免疫侧向流试纸条进行检测的检测结果示意图;
86.图18(a)为本发明之一实施例中混合富集本体和扩增本体的悬浮液,使用808nm波
长镭射以不同镭射功率的激发进行光热裂解菌体反应后,以菌落形成试验检测结果示意图;
87.图18(b)为本发明之一实施例中混合富集本体和扩增本体的悬浮液,使用808nm波长镭射以不同镭射功率的光热裂解后,进行水冷式珠上聚合酶链式反应后,以免疫侧向流试纸条进行检测的检测结果示意图;
88.图19(a)为本发明实施例中混合两种功能性磁性纳米金磁壳,其中以大肠杆菌悬浮液作为待测物,评估镭射激发进行水冷式珠上聚合酶链式反应的侦测效能与整体操作流程示意图;
89.图19(b)为本发明实施例中混合富集本体和扩增本体的悬浮液,其中以大肠杆菌悬浮液作为待测物,以免疫侧向流试纸条评估镭射激发水冷式珠上聚合酶链式反应(on-bead pcr)灵敏度的检测结果示意图;
90.图20(a)为图19(b)的免疫侧向流试纸条位于测试线的影像,以影像分析软件(image j)进行相素强度分析,其影像量化的示意图;
91.图20(b)为免疫侧向流试纸条在不同的808nm镭射能量激发下(24mw与140mw),以红外线镜头对焦在测试在线侦测的热成像图;
92.图20(c)为图20(b)之该热成像图扣除环境中的背景温度后上升之温度差的量化图表;
93.图21(a)为镭射激发水冷式珠上聚合酶链式反应在不同的pcr反应起始温度的温度变化示意图;
94.图21(b)为镭射激发水冷式珠上聚合酶链式反应在不同的pcr反应起始温度的效能评估示意图;
95.其中,
96.10 反应单元;
97.11 整合式驱动器;
98.12 能量激发单元;
99.121 镭射准直器;
100.122 镭射发射器;
101.13 外部辅助冷却单元;
102.14 温度侦测单元;
103.15 操作单元;
104.16 外部能源校正器;
105.17 侦测模块;
106.171 免疫侧向流试纸条;
107.1711 测试线;
108.1712 控制线;
109.172 镭射复合红外线热感应器;
110.20 待测物;
111.21 生物物质;
112.30 核酸扩增反应液;
113.301 引物;
114.3011 荧光标记;
115.302 聚合酶;
116.40 固相载体;
117.401 磁性内核;
118.402 中间层;
119.403 纳米金壳;
120.41 多功能本体;
121.42 扩增本体;
122.43 富集本体;
123.50 原位环境;
124.60 扩增反应物;
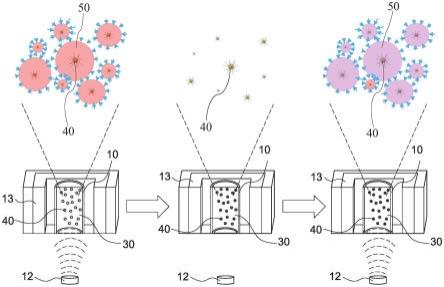
125.70 富集配体;
126.71 扩增配体;
127.72 聚乙二醇;
128.73 牛血清蛋白;
129.s10~s90 步骤;
130.s100~s400 步骤。
具体实施方式
131.为了使本发明的目的、技术方案及优点更加清楚明白,下面结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,但并不用于限定本发明。
132.本发明系一种核酸扩增方法,在反应单元10的内部提供待测物20、核酸扩增反应液30、至少一个固相载体40,且反应单元10处于达成所需冷却温度的冷却环境,冷却温度系为-10~50℃,较佳的冷却温度为15~30℃、30~50℃,优选的冷却温度为-10~0℃、2~15℃,透过控制外部能量激发的操作条件(例如:能量及频率),加上反应单元10的冷却环境提供冷却效应,使得反应单元10内部于固相载体40表面周遭形成原位环境50,以及在原位环境50中进行原位核酸扩增反应所需要的温度(热)循环,使得反应单元10内部于固相载体40在每一次温度循环过程,进行一次原位核酸扩增产生扩增反应物60。在此需要说明的是,在反应单元10内部进行核酸扩增反应所需要的温度(热)循环系指为使核酸分子变性、引物黏合与聚合酶延伸所需之不同温度,但实际实施时,并不限于此。各固相载体40的大小为8~2,000,000纳米(nm),其中用于光热与磁热的优选之固相载体40大小为8~1,000纳米;用于电热的优选之固相载体40大小为1,000~2,000,000纳米。
133.本发明所述的「原位环境50」之定义,请参阅图1(a)及图1(b)所示,当反应单元10内部的固相载体40在理想均匀分布的状态下,藉由控制外部能量激发的操作条件(图1(a)所示),及反应单元10中冷却环境的冷却温度,可以调整固相载体40的热辐射场向外辐射范围的大小,并且使得固相载体40表面的热辐射场间彼此不互相重叠形成独立的核酸扩增反应空间,或者称之为固相载体40的区域加热范围(图1(b)所示),在本发明中简称为原位环
境50。此外,当外部能量的激发瞬间停止时,反应单元10的冷却温度则用于使得固相载体40可以快速达到冷却降温目的。
134.又,本发明所述的「原位核酸扩增反应」之定义,系指核酸扩增反应系发生于固相载体40表面之原位环境50,且扩增反应物60会被固定于固相载体40表面上,其中扩增反应物60包括但不限于扩增的核酸分子,且经原位核酸扩增反应产生出的该等扩增反应物60一部分保留在各个固相载体40,该等扩增反应物60的另一部分则释放扩增反应物60到核酸扩增反应液30中。
135.在本发明中,核酸扩增反应液30系包括游离的引物301、核苷酸、酵素与反应添加物。酵素系可为聚合酶302,聚合酶302更包含脱氧核糖核酸聚合酶(dna polymerase)、核糖核酸聚合酶(rna polymerase),酵素亦可为反转录酶(reverse transcriptase,rt)、核糖核酸酶(ribonuclease,rnase)、解旋酶(helicases)、dna连接酶(dna ligase)的其中之一或任二者以上的组合,可与聚合酶协同作用。
136.在本发明中,核酸扩增反应可以是聚合酶链式反应(polymerase chain reaction,pcr)、连接酶链式反应(ligase chain reaction,lcr),也可以是等温核酸扩增反应(isothermal nucleic acid amplification technologies,inaats),在众多inaats方法中,优选环介导等温扩增反应(loop-mediated isothermal amplification,lamp),其中在聚合酶链式反应法采用2步骤温度(热)循环程序,其中分别用于核酸变性的温度位于85~95℃,与引物黏合和聚合酶延伸的温度位于60~65℃;环介导等温扩增反应的温度位于60~65℃。
137.在本发明之一实施例中,参照图2,固相载体40系包括多功能本体41、至少一富集配体70及至少一扩增配体71,其中富集配体70连接多功能本体41的表面,富集配体70可以是抗体、核酸适配体、寡核苷酸、蛋白质、多糖类或其组合,其中扩增配体71连接多功能本体41的表面,扩增配体71可以是核酸适配体、寡核苷酸具有用于与固相载体键结的官能基修饰,其可以一级胺、生物素、硫醇基修饰、蛋白质、多糖类或其组合;增加寡核苷酸与生物物质捕抓的专一性与稳定性修饰,其可以是锁核酸(lna,locked nucleic acid)、硫代磷酸(phosphorothioates)、吗啉(morpholino)修饰或其组合,但本发明实际实施时,并不在此限。
138.本实施例选用的富集配体70系可与前述提及待测物20匹配,此处所称之待测物20可为细胞、胞器、细菌、病毒、原生生物或其组合。富集配体70经过专一性结合待测物20,将待测物20吸附在固相载体40的富集配体70上。
139.在本实施例中,至少一扩增配体71设于多功能本体41上,其可与核酸扩增反应液30中游离的引物结合。更进一步来说,扩增配体71可以是结合生物物质21,此生物物质21系可为经高温所释放出的待测物20的核酸分子,或者在扩增配体复制后再释放到核酸扩增反应液30的扩增反应物60。另外,扩增反应物60可与核酸扩增反应液30中带有标记的引物301结合,前述带有标记的引物301中的标记系为核酸标记,其中核酸标记包含但不限于放射性同位素(例如:3h、14c及32p等)、地高新(digoxin,dig)、生物素(biotin)、荧光标记3011(例如:异硫氰酸荧光素(fluorescein isothiocyanate,fitc)、得克萨斯红(texas red)、cy2、cy3、cy5、cy7、玫瑰红b(rhodamineb)等)及发光物质(例如:吖啶酯(2',6'-dimethylcarbonylphenyl-10-sulfopropylacridinium-9-carboxylate 4'-nhs ester)),
但本发明实际实施时,并不在此限。
140.又在本实施例中,固相载体40的表面皆经过至少一道以上手续的表面加工,形成功能化且具有极高的专一性的富集配体70与扩增配体71,据以针对微量的待测物20进行分析。
141.在本发明的另一实施例中,待测物20可为细胞、胞器、细菌、病毒、原生生物或其组合,而其中一部分的各固相载体40系包括富集本体至少一富集配体70,且另一部分的各该固相载体40系包括扩增本体42及至少一扩增配体71,其中富集本体连接富集配体70,而富集配体70提供与待测物20匹配结合,扩增本体42连接扩增配体71,且扩增配体71提供结合待测物20所释放出来的生物物质21,或者结合在该扩增配体71复制后再释放到该核酸扩增反应液30的扩增反应物60。
142.在本发明的又另一实施例中,待测物20可为游离性脱氧核糖核酸、核糖核酸物质。又,游离性核酸物质包含体液游离核酸物质、肿瘤游离核酸物质或其组合,各固相载体40系包括扩增本体42及至少一扩增配体71,扩增本体42连接扩增配体71,且扩增配体71提供结合待测物20,或者结合在该扩增配体71复制后再释放到该核酸扩增反应液30的扩增反应物。
143.在本发明之各实施例中,又为了让固相载体40能够适应不同的外部能量激发方式,不同的外部能量激发固相载体40的方式,包含了光热转换或高频感应电磁方式进行实时加热,其中固相载体40的表层结构系能够以电浆子加热,或者固相载体40的表层为有机光热涂层性,其可利用光能加热;或者固相载体40系为具有磁性的固相载体40,可以应用于具有磁性的固相载体40的区域加热,藉由将具有磁性的固相载体40放置于外加磁场频率应在交变磁场的振幅为0.5~550ka/m和交变磁场的频率为3~3,500khz的射频范围内(交变磁场),以达到所需的核酸变性、引物黏合与聚合酶延伸所需的温度区间。
144.进一步而言,固相载体40的多功能本体41、富集本体、扩增本体42系可为不同的型态,在本发明之一实施例中,以「光热」激发的固相载体40而言,固相载体40可据以实施的本体的型态,系为由金属或是复合材料所形成球形包含有磁性内核401,与稳定与维持外层的光热转换层结构的中间支撑层402,其中支撑层可为硅壳,其整体构型可以为球形、椭圆形、盘形、星形、杆形、方形、各向异性突次状的(如纳米星型)、纳米壳、纳米笼、双三角锥、微丝状的其中之一或任二者以上的组合形式,不限于此形式;磁性内核401包含过渡金属亦须包括其氧化物,如氧化亚铁(feo)、氧化铁(fe2o3)、四氧化三铁(fe3o4)、氧(氢氧)化铁(feo(oh))、氢氧化亚铁(fe(oh)2)、氢氧化铁(fe(oh)3)、一氧化钴(coo)、氧(氢氧)化钴(coo(oh))、四氧化三钴(co3o4)及其衍生物、混合物所组成之群组,本发明并不加以限制,固相载体40的表面则是由具区域表面电浆共振(lspr)效应的贵金属层,如金、银、钯(palladium)、铂或其组合或具光热转换效率的有机层所组成,如更可并入具近红外光(near infrared spectroscopy,nir)吸收光谱的青色素(cyanine)类、聚吡咯(polypyrrole)或石墨烯(graphene)等材料。
145.请参阅图3所示,本发明提供一种快速核酸扩增系统,包括反应单元10、整合式驱动器11、能量激发单元12、辅助冷却单元。其中,反应单元10系提供容置核酸扩增反应液30与复数个固相载体40,其中固相载体40系悬浮于核酸扩增反应液30(图4(a))或以半悬浮方式键结于反应单元10的腔体内壁(图4(b))或固定在反应单元10的腔体内壁(图4(c)),辅助
冷却单元可为下列几种形式:
146.1.核酸扩增反应液30(体积至少100μl)即为辅助冷却单元,其先使用外部辅助冷却单元13对核酸扩增反应液30进行降温到冷却温度,再导入反应单元10中,使得反应单元10内的核酸扩增反应液30作为辅助冷却单元,此种形式在提供外部能量后,将使得核酸扩增反应液30逐渐升温,在反应中仍持续保持在冷却温度,因此,核酸扩增反应效率较下述的辅助冷却单元差,但整体操作时间仍比传统的聚合酶链锁反应之核酸扩增反应短。
147.2.核酸扩增反应液30与外部辅助冷却单元13共同形成辅助冷却单元,外部辅助冷却单元13设置在反应单元10的周围(如:图5所示),且外部辅助冷却单元13持续对反应单元10的周围提供冷却温度,使得反应单元10内的核酸扩增反应液30的温度下降并维持冷却温度,而外部辅助冷却单元13更可以温度侦测单元14(例如:k-type热电偶)实时侦测外部辅助冷却单元13的温度变化,并实施温度的反馈控制,使得反应单元10内部的核酸扩增反应液30持续处于冷却温度,而可快速进行核酸扩增反应。
148.又,外部辅助冷却单元13可选用具有大比热容性质的冰或高分子聚合吸水树脂(如羧甲基纤维素(carboxymethyl cellulose)、致冷芯片(如:珀尔帖致冷器(peltier cooler))。外部辅助冷却单元13亦可选用水(0.5毫升(ml)~1ml)或者可选用含有例如硝酸铵(莫耳溶解热(δhsol)=26.2千焦耳(kj))、尿素(莫耳溶解热δhsol=15kj)藉其晶体溶于水产生的化学吸热反应。
149.请参阅图3,能量激发单元12以接触式或非接触式的能量传递方式,直接且有效率地将外部能量提供到固相载体40转换成热能,当此能量激发单元12停止提供能量到固相载体40的瞬间,辅助冷却单元提供的冷却温度用来快速消散固相载体40的热量,藉由前述能量激发单元12与辅助冷却单元两者间之交互作用与调控,本发明可以迅速地在固相载体40的周围原位环境50,形成核酸扩增反应所需的温度(热)循环,并在固相载体40的表面以原位核酸扩增的方式完成核酸扩增反应。
150.在本发明中,接触式激发系为电热产热,电能传输可以电子线路与感应磁通量来进行电能传输(无线充电),电热产热系可为焦耳加热(joule heating)、热电效应(thermoelectric heating)与表面声波(surface acoustic waves;saws)产热。
151.在本发明中,非接触式激发固相载体40的方式,优先选用电浆子加热方式,如图3所示,能量激发单元12是由整合式驱动器11(例如:包含控制操作能量激发单元12的计算机与labview驱动软件)所驱动,藉此控制能量激发单元12(例如:红外线光纤耦合镭射)激发输出的能量与其开启/关闭的时序,使反应单元10中之固相载体40产生区域热辐射场变化。
152.再者,能量激发单元12以非接触式激发固相载体40的方式,可以选用自光热激发加热,如图5所示,例如能量激发单元12系为镭射准直器121与镭射发射器122所组成或led二极管光源,或能量激发单元12系为磁变激发加热的方式(例如:高频磁场产生器),本发明实际实施时并不加以限制。能量激发单元12主要针对固相载体40本身与附近区域的原位环境50(距离以数百纳米(nm)至数百微米(μm)为单位)进行加热。
153.在本发明中,快速核酸扩增系统更包括温度侦测单元14(例如:k-type热电偶)侦测外部辅助冷却单元13的温度反馈;核酸扩增反应在辅助冷却单元与上述固相载体40之能量激发单元12加热的平衡控制下,快速实现聚合酶链式反应所需之温度(热)循环,并经由此来快速完成核酸扩增反应。
154.在本发明中,快速核酸扩增系统更进一步包括操作单元15,操作单元15系可选用永久磁铁、电磁铁或其组合,本发明并不加以限制;可以藉由操作单元15进行简单的磁力操作,对反应单元10中的固相载体40进行纯化与浓缩(富集),这将有助于后续对固相载体40上结合的扩增反应物60的检测与分析工作(例如:增强对扩增反应物60的检测信号),本发明并不加以限制。如图6所示,在后续浓缩(富集)扩增反应物60的操作上,经由操作单元15简单的以磁力吸住具有磁性的固相载体40,即可使得固相载体40与核酸扩增反应液30分离,此纯化分离不仅可以去除后端核酸分子检测的干扰物质(例如:非特异性扩增的核酸产物或游离的引物301与聚合酶302等),此外透过此具浓缩(富集)的操作,可进一步提升后续核酸分子检测的功效(例如:检测灵敏度)。
155.在此必须特别说明,本发明可以简化控温设备,仅以单一能量激发单元12与外部能源校正器16达到温度控制,其中外部能源校正器可为光强度计,藉由控制能量激发单元12的能量强度与能量激发时间达到控制固相载体40周遭的温度,使得全部的固相载体40的周遭产生原位环境50,本发明可以减少如gna专利us9,382,583b2发明专利公开号(发明名称:method for the amplification of nucleic acids using heat transfer for nanoparticles)中所揭露以二维镜面扫描仪偏转镭射在两个维度,将镭射激光选择性与特异性以10纳秒至500毫秒聚焦在pcr样品中一部份的纳米颗粒上的步骤。
156.本发明之一实施例中,待测物20为系为游离性脱氧核糖核酸或核糖核酸物质或是待测物20所释出的生物物质21,而固相载体40系为扩增本体42,请参阅图7(a)所示,各扩增配体71系连接扩增本体42的表面,扩增配体71结合待测物20或生物物质21。请参阅图7(b)所示,当外部能源激发固相载体40而产生原位环境50,利用核酸扩增反应液30中的聚合酶302,在扩增配体71上进行第一次核酸扩增反应产生扩增反应物60。请参阅图7(c)所示,短暂外部能源关闭,固相载体40周遭热力场迅速地被辅助冷却单元冷却,而使得原位环境50消散,请参阅图7(d)所示,再次将外部能源激发开启再度产生原位环境50发生变性反应,使得待测物20与扩增反应物60分离。请参阅图7(e)所示,短暂外部能源关闭,核酸扩增反应液30中的游离状态之具有荧光标记3011的引物301与扩增反应物60结合,原先待测物20则再与固相载体40上的另一个扩增配体71结合。
157.请参阅图7(f)~(g)所示,外部能源激发开启,聚合酶302以待测物20或生物物质21固定于固相载体40上之扩增配体71上的扩增反应物60为模板,再进行一次核酸扩增反应,并于产生扩增反应物60,图7(h)~(k)则是上述能量激发单元12的激发开启、关闭的另一循环,进行另一次核酸扩增反应,图7(l)系经由多次的循环,固相载体40上乘载的扩增反应物60到达饱和。
158.本发明之一实施例中,以「光热」激发固相载体40而言,固相载体40的表面优选用纳米金壳403,纳米金壳403内包含磁性内核,纳米金壳403和磁性内核401间有支撑层402,以下统称为「纳米金磁壳」,又光热激发系为镭射、led阵列任一或二者之组合,优选的外在能源即为镭射,镭射波长以可见光谱至近红外线光谱(380nm~1.4μm)为主要范围,另外,不同浓度的纳米金磁壳悬浮液都显示其具有吸收近红外线光谱区(750nm~1.4μm)的特性,更佳者在808nm镭射激发下,可使纳米金磁壳表面产生局域表面电浆共振效应(localized surface plasmon resonance,lspr),藉此产生电浆子加热效应。
159.在本发明之另一实施例中,以「磁变」激发固相载体40而言,固相载体40包括磁性
内核401,固相载体40在外加交流磁场下,感应热效应主要归因纳米结构的磁化反转的包含尼尔弛豫机制(n
é
el relaxation;固相载体40的磁矩旋转)与布朗弛豫机制(brown relaxation;固相载体40在水介质中的物理旋转),此种加热能力取决于特性纳米结构,如平均尺寸、构型、磁化强度和磁各向异性,以及外加交变磁场的振幅(hac)和频率(f),其中交变磁场系以交变磁场产生器所形成,交变磁场的振幅和频率系以各固相载体40产生核酸扩增所需温度需间的场域条件设定。进一步而言,交变磁场的振幅为0.5~550千安培/公尺(ka/m)和交变磁场的频率为3~3,500千赫兹(khz)。
160.进一步而言,固相载体40可以是稳定的胶体单相磁性固相载体40以悬浮液形式分散在核酸扩增反应液30中,其中单相系指单一分散悬浮液,且当固相载体40尺寸达到纳米级时,会与其表面的电位形成稳定的胶体单相溶液;固相载体40可以是强磁或超顺磁性氧化铁固相载体40(superparamagnetic iron oxide nanoparticles;spions),特别是磁铁矿(fe3o4)、磁赤铁矿(γ-fe2o3),或是尖晶石结构的铁氧体纳米材料含miife2o4的尖晶石铁氧体(其中mii=co2 、ni2 、zn2 、mn2 等),过渡金属类的添加,例如:ni、co等拌入铁氧体纳米材料,可以获得较大的饱和度磁化值、稳定的有效磁向异性(the effective magnetic anisotropy;keff)与更强的磁化损失在外在的交变磁场下。
161.而以磁变激发的固相载体40尺寸介于8~1,000nm,构型除常见的球型(sphere),也包含如立方体型式(nanocube)、八面体(nanoctahedron)、棒状(rod)、圆盘状(disk)、空心球体(hollow sphere)、星形(star)或四足(tetrapod)等,不限于此形式。而外加交变磁场的振幅(hac)和频率(f),广泛的频率(3~3,500khz)和场振幅(0.5~550ka/m)可用固相载体40产生核酸扩增所需温度需间的场域条件设定。
162.在上述的各实施例中,固相载体40的多功能本体41、富集本体或扩增本体42的表面进一步包括填充物质,填充物质系用于防止固相载体40聚集、增加水溶的稳定性与抑制聚合酶吸附,填充物质亦防止非专一性的蛋白质和引物301的吸附固相载体40,填充物质系可为以分子量5~10千道耳顿(kda)的聚乙二醇(polyethylene glycol,peg)72与牛血清蛋白(bovine serum albumin,bsa)73,富集配体或扩增配体71则以交联剂(crosslinker)与填充物质所提供的官能基形成稳定的共价键结,在本实施例中优选羧基与胺基、硫醇基的交联的共价键结。
163.如图8所示,本发明所称之核酸扩增反应方法,系可为水冷式珠上聚合酶链式反应或在水冷式珠上环介导等温扩增反应两种反应,其中水冷式系指以如前述之辅助冷却单元进行降温,珠上系指于固相载体40上进行原位核酸扩增反应,系包括下列步骤:
164.步骤s10,将一样品与复数个固相载体40混合,其中样品中含有至少一待测物20,令该复数个固相载体40捕捉至少一待测物20,接续进行步骤s20。
165.步骤s20,于一反应单元10中,使用操作单元15来清洗与除去不纯物、并浓缩(富集)待测物20,若该至少一待测物为一游离性脱氧核糖核酸或核糖核酸物质,则直接进入步骤s51,若否则续行步骤s30。
166.步骤s30,至少一能量激发单元12提供一外在能源予以该复数固相载体40,使该复数个固相载体40的温度上升至可裂解待测物20的裂解温度(例如:80~95℃),接续进行步骤s40。
167.步骤s40,该至少一待测物20裂解释出一生物物质21(例如:脱氧核糖核酸或核糖
核酸),接续进行步骤s50。
168.步骤s50,控制能量激发单元12以提供一外在能源予以该复数固相载体40直至达到一核酸杂合温度,使该复数个固相载体40与该至少一生物物质21结合,并透过该操作单元15来纯化分离与富集该复数个固相载体40,接续进行步骤s60。
169.步骤s51,控制能量激发单元12以提供一外在能源予以该复数固相载体40直至达到一核酸杂合温度,使该复数个固相载体40与该至少一待测物20结合,并透过该操作单元15来纯化分离与富集该复数个固相载体40,接续进行步骤s60。
170.步骤s60,加入已经预冷的核酸扩增反应液30(预冷的核酸扩增反应液30的温度介于-10~4℃)于反应单元10中,并使其与外部辅助冷却单元13结合,若进行水冷式珠上聚合酶链式反应则直接进入步骤s70,若进行水冷式珠上环介导等温扩增反应则直接进入步骤s71。
171.步骤s70,控制能量激发单元12提供外在能源予以该复数固相载体40,使固相载体40之原位环境50达到聚合酶链式反应所需之核酸变性(90~95℃)与引物黏合/聚合酶延伸(60~65℃)温度,透过至少一酵素于该复数固相载体40上进行原位核酸扩增反应,若要进入检测阶段,接续进行步骤s80。
172.步骤s71,控制能量激发单元12提供外在能源予以该复数固相载体40,使其表面周遭之原位环境50达到环介导等温扩增反应所需之温度(60~65℃),透过至少一酵素于该复数固相载体40上进行原位核酸扩增反应,若要进入检测阶段,接续进行步骤s80。
173.步骤s80,透过操作单元15,分离上述的扩增本体42与上清液。
174.步骤s90,透过一侦测模块17来辨识位于扩增本体42上的扩增反应物60上的信号变化,藉由侦测扩增反应物60上的核酸标记产生的色彩变化、发光变化或其组合。
175.在一实施例中,本发明所述之水冷式珠上环介导等温扩增反应(water cooling on-bead loop-mediated isothermal amplification),其中固相载体40系为表面导入至少一对特异性的引物301作为扩增配体71的扩增本体42(图9(a)所示),在本实施例中至少一对特异性引物301系包括三对引物301(fip、bip、lf、lb、b3及f3),使其在扩增本体42上进行水冷式珠上环介导等温扩增反应,关闭外部能源时,扩增本体42上的特异性引物301会藉由dna杂合捕捉目标的核酸序列,该核酸序列系为待测物20或生物物质21(图9(b)所示),外部能源开启时,扩增本体42产生适合进行环介导等温扩增反应的温度区间,经由聚合酶302进行初步延伸(图9(c)所示),接着再关闭外部能源时,迅速降温使环介导等温扩增反应停止(图9(d)所示),图9(b)~图9(d)步骤循环经由多次的循环,扩增本体42上乘载的扩增反应物60到达饱(图9(e)所示)。完成反应后,后续除了扩增本体42本身可经由操作单元15进行浓缩(富集)和纯化所扩增的扩增反应物60,这项藉由扩增本体42的纯化分离操作,亦辅助专一性检测(lamp/rt-lamp)反应的扩增反应物60。欲扩增之核酸片段仅含在fip和bip的3'端之间真阳性(true positive)的扩增片段,以提升对lamp/rt-lamp产物侦测的特异性,降低伪阳性的发生。
176.此外,根据gna biosolutions公司的美国发明专利us9,382,583b2公开号所揭露,光热固相载体40“局部加热”的发生系基于下述条件,当能量激发的间隔更短或等于临界激发间隔t1,其中临界激发间隔t1可以下列方程式表示:
[0177][0178]
t1:代表热量从一个纳米颗粒以平均纳米颗粒距离扩散到下一个纳米颗粒所需的时间;
[0179]
s1:则代表比例因子,s1为当固相载体40照射临界激发间隔t1时,产生热力场热流扩散的距离的量度,当处于固相载体40的局部加热时,s1小于或等于1;
[0180]
|x|则代表平均每个固相载体40彼此间的距离;
[0181]
d则代表固相载体40之间介质的热扩散系数。
[0182]
根据前述专利所揭露的条件,操作上必须以二维镜像扫描仪,以10纳秒(nanosecond,ns)至500毫秒(millisecond,ms)的频率,将光线扫过含有光热粒子的核酸扩增反应液30,因此前述专利在整体实施上,必需准确地控制上述动作,以便精确地控制光热粒子之曝光时间,系实施该项技术的成功关键因素。
[0183]
反观,本发明则以比较容易实施的方法,来控制固相载体40接受外部能量激发,而产生区域热辐射场现象,首先本发明系使用核酸扩增反应液30中悬浮的固相载体40,其固相载体40的总体积与核酸扩增反应液30体积的比例为1:200至1:1
×
109,其中优选的体积比例为1:1
×
104至1:1
×
108,这意味着上述的固相载体40间的距离|x|与s1热力场热流扩散的距离,这两项数值都明显的提高,因此操作上可以用比较长的临界激发间隔t1,来照射激发固相载体40以产生区域加热现象。
[0184]
再者,核酸扩增反应液30放置在外部辅助冷却单元13,而外部辅助冷却单元13提供一冷却温度环境,来大幅局限固相载体40所产生的原位环境50,使其在均匀分散的理想状态不会与其它固相载体40所产生的原位环境50重叠。藉此,本发明可以不需控制能量激发单元12与反应单元10的相对移动关系,且可以用相对长的激发时间(一秒至数十秒间)来激发反应单元10中之全部的悬浮或固定化之固相载体40,另外每次驱动能量激发单元12,并未有移动能量激发单元12与反应单元10的相对位置,此特性也造成本发明与gna biosolutions公司美国发明专利(us 9,382,583 b2公开号)的明显差异。
[0185]
又,本发明所述的固相载体40,由于其高体表面积率(如前述),其不仅可当作待测物20的扩增反应物60分离的高效载台之外,也可藉由这些固相载体40,来除去待测物20中可能存在的核酸扩增反应抑制物,另外,在固相载体40表面所形成的原位环境50进行原位核酸扩增反应,由于固相载体40表面能承载固定化的扩增反应物60的空间有所侷限,因此,在相对短的操作时间下(或是相对较少的核酸放大循环次数下),固相载体40表面的扩增反应物60即可达到饱和状态,这将有助于后续的扩增反应物60的检测工作。
[0186]
请参阅图10(a)及图10(b)所示,本发明实施例中,固相载体40选用的纳米金磁壳具有良好的光热转化特性与稳定性,镭射光波长介于780~1,000nm之间的光能吸收效果较佳,较佳的为800~950nm之间。在本实施例中,在微量核酸扩增反应液30(20μl)加入纳米金磁壳,形成微量单相纳米金磁壳悬浮液,其中纳米金磁壳悬浮液之浓度为2.9
×
10
10
粒子数/毫升,并选择在808nm镭射进行光热转化与稳定性实验,由图10(a)所示,以整合式驱动器11驱使808nm的光纤耦合镭射,以连续10次的镭射循环周期(镭射功率:400毫瓦(mw)/0.16平方公分(cm2);先开启60秒;再关闭120秒)激发此微量单相纳米金磁壳悬浮液,此微量单相纳米金磁壳悬浮液之光热转换最高温度可达62.29
±
1.06℃,其变异系数为1.70%,此结果
说明此纳米金磁壳具有稳定的光热转换特性,不会因为高功率镭射照射而造成固相载体40之构型改变。如图10(b)所示,以不同功率的808nm镭射对如图10(a)之微量单相纳米金磁壳悬浮液进行激发,使用的不同功率包含200mw/0.16cm2、250mw/0.16cm2、300mw/0.16cm2、400mw/0.16cm2、500mw/0.16cm2、600mw/0.16cm2及700mw/0.16cm2,另外包含一未含有纳米金磁壳之空白样品溶液以1瓦(w)/0.16cm2镭射激发作为对照组,微量单相纳米金磁壳悬浮液经镭射进行局部光热加热至稳定状态的微尺度直接测量的温度,结果说明纳米金磁壳具有良好的光热转换特性,其光热转换至稳定状态的温度与输入的镭射功率成正比关系。
[0187]
请参阅图11(a)及图11(b)所示,本发明实施例,将微量纳米金磁壳悬浮液(20μl)以微尺度的方式量测纳米金磁壳悬浮液经光热加热至稳定状态的温度,建立镭射功率强度与纳米金磁壳周遭微尺度环境温度的关系图,藉由微尺度的量测推估纳米金磁壳原位环境50的温度区域与镭射瓦数之间关系。图11(a)为以20μl浓度为2.9
×
10
10
粒子数/毫升的纳米金磁壳悬浮液进行测试,依照图10(b)所述之不同的镭射功率照射下,光热转换温度的微尺度直接测量,建立不同镭射功率照射下,纳米金磁壳的稳定状态下的光热转升温曲线(其线性方程式为y=0.0778x 44.126;r2=0.9104)。图11(a)之上方框选的温度区域,系细胞裂解、及dna变性所需的温度区间(85~95℃);图11(a)之下方框选的温度区域,系环介导等温扩增反应(lamp)之引物黏合与聚合酶延伸操作所需的温度区间(55~65℃)。图11(b)为在不同的808nm镭射功率(200mw/0.16cm2,250mw/0.16cm2,400m w/0.16cm2)下,纳米金磁壳悬浮液在稳定状态下的反应单元10之红外线热成像图,图11(b)上部图为空白样品溶液以808nm镭射功率(200mw/0.16cm2,250mw/0.16cm2,400mw/0.16cm2)照射之结果图,温度介于27.9~29℃之间,而含有纳米金磁壳悬浮液在200mw/0.16cm2镭射激发至稳定状态下中心温度为51.6℃,250mw/0.16cm2镭射激发至稳定状态下中心温度为63.9℃,400mw/0.16cm2镭射激发至稳定状态下中心温度为79.1℃。
[0188]
请参阅图12(a)及图12(b),系本发明中关于辅助冷却单元的一实施例,在对含有单相纳米金磁壳之核酸扩增反应液30进行100次的镭射激发循环(一个循环周期:先400mw/0.16cm2照射1.25秒;再关闭0.5秒;接着150mw/0.16cm2照射7.5秒)下,含有单相纳米金磁壳悬浮的核酸扩增反应液30的温度变化,图12(a)为本实施例辅助冷却单元机构组成,其包含大体积的核酸扩增反应液30(100μl)、与其外部辅助冷却单元13,在此实施例中,外部辅助冷却单元13选用比热容大的冰(体积550μl的水冻结成的冰),使其围绕在装有核酸扩增反应液30的反应单元10的周遭,用以辅助与维持核酸扩增的反应单元10内的核酸扩增反应液30的温度在冷却温度(2~10℃)。图12(b)系评估固定的纳米金磁壳的粒子数(5.8
×
108粒子数)下,使用不同核酸扩增反应液30体积(20μl与100μl)来分散悬浮上述纳米金磁壳,并以是否使用如图12(a)之外部辅助冷却单元13进行分组,并加入只含核酸扩增反应液之空白样品溶液作为对照组,探讨对上述分组进行100次的外部镭射激发循环周期(一个循环周期:先400mw/0.16cm2,照射1.25秒;再关闭0.5秒;接着以150mw/0.16cm2照射7.5秒)后,各分组之核酸扩增反应液30的温度变化,同时并评估在多少次数的外部镭射激发循环下,上述的操作条件组合是否能使核酸扩增反应液30的温度维持在冷却温度(2~10℃),且其温度的变动不会明显随着外部镭射激发循环次数的变动而改变;其中分组包含100μl纳米金磁壳悬浮液加外部辅助冷却单元、100微升空白样品溶液加外部辅助冷却单元13、100微升纳米金磁壳悬浮液无外部辅助冷却单元及20微升纳米金磁壳悬浮液无外部辅助冷却单元,其
中该镭射循环周期系对应右侧的y轴,右侧y轴系镭射功率(mw);此实施例中结果显示(图12(b)),当使用100μl核酸扩增反应液30来分散悬浮单相纳米金磁壳,以及使用外部辅助冷却单元13(冰的体积:550μl)时,在65次外部镭射激发循环(一个循环周期:400mw/0.16cm2,照射1.25秒;关闭0.5秒;150mw/0.16cm2照射7.5秒)下,对应左侧y轴,左侧y轴系核酸扩增反应液30的温度(℃),都维持在冷却温度(2~10℃),这结果也显示在此设计及操作条件下,纳米金磁壳受到镭射激发的加热方式是属于“局部加热”模式,即加热仅侷限于原位环境50中,而整体核酸扩增反应液30的平均温度仍维持在冷却温度(2~10℃)。
[0189]
图13(a)及图13(b)系本发明一实施例,以免疫侧向流试纸条171侦测水冷式珠上聚合酶链式反应产生的扩增反应物60。如图13(a)所示,在完成以镭射激发进行水冷式珠上聚合酶链式反应,经由具有磁力的操作单元15纯化和浓缩(富集)纳米金磁壳,其中纳米金磁壳上结合经原位核酸扩增反应产生的扩增反应物60,可去除非专一性核酸扩增反应产生的核酸分子产物及核酸扩增反应液30内的其他物质(例如:引物301、聚合酶302等),同时可浓缩(富集)经专一性的原位核酸扩增反应产生的扩增反应物60。重新以tbst缓冲液来悬浮所纯化与浓缩的纳米金磁壳后,以免疫侧向流试纸条171进行快速侦测,如图13(a)和图13(b)所示,纳米金磁壳上结合的扩增反应物60,其中扩增反应物60上又结合核酸标记,其中本实施例之核酸标记为具有异硫氰酸荧光素(fluorescein isothiocyanate,fitc)标记的引物301,接下来藉由侧向流试纸条上结合于测试线(test line)1711上的抗异硫氰酸荧光素抗体,来辨识并捕捉结合扩增反应物60并带有核酸标记的纳米金磁壳,形成视觉可检视的标记(例如:在测试线1711形成一条线),此反应可以在3~5分钟内完成,控制线系作为常规免疫侧向流试纸条171之质量管制之用途。
[0190]
图14(a)及图14(b)系本发明另一实施例,系以电浆子热传感技术,来判读免疫侧向流试纸条171的检测结果(如图13(b)所述),此技术可以增加传统免疫侧向流试纸条171检测的灵敏度。如图14(a)所示,纳米金磁壳上的扩增反应物60上结合异硫氰酸荧光素(fitc)标记的引物301,接下来由侧向流试纸条上结合于测试线1711上的抗异硫氰酸荧光素抗体,来辨识并捕捉结合扩增反应物60并带有核酸标记的引物301的纳米金磁壳,纳米金磁壳经由镭射复合红外线热感应器172的激发而产生热(场)源,此热(场)源并进一步被以热成像方式呈现,藉此电浆子热传感技术可以增加免疫侧向流试纸条171检测结果判读的灵敏度。如图14(b)为将图13(b)以电浆子热传感分析免疫侧向流试纸条171,以侦测核酸扩增的检测结果,但无固相载体40在测试线1711被捕捉之阴性反应示意图。
[0191]
请参阅图15(a)及图15(b),系本发明一实施例,以808nm镭射以镭射循环周期(一个循环周期:先400mw/0.16cm2照射1.25秒,再150mw/0.16cm2照射7.5秒)针对大肠杆菌(e.coli atcc:35218)之malb基因(malb gene)片段,其中malb基因片段系常规检测大肠杆菌之聚合酶链式反应的检测标的,进行水冷式珠上聚合酶链式反应,在不同镭射循环周期次数(10~50次循环周期)下,于纳米金磁壳上进行原位核酸扩增反应,完成后以免疫侧向流试纸条171和尿素洋菜胶体电泳,依序分析检测水冷式珠上聚合酶链式反应在固相载体40与核酸扩增反应液30进行核酸扩增的结果。如图15(a)所示,以免疫侧向流试纸条171检测不同镭射循环周期测试(10~50次循环周期),纳米金磁壳上的原位核酸扩增反应会随着镭射循环周期的次数增加,在免疫侧向流试纸条171上的测试线1711信号强度也逐渐增加,这说明在短时间的镭射循环周期所形成的超扩增(super amplification),即可以藉由增
加镭射循环周期的次数,补足核酸扩增反应的循环周期中出现低量核酸扩增缺失的问题。如图15(b)所示,以尿素洋菜胶制成的变性洋菜胶体进行电泳,来分析经操作单元15分离完成原位核酸扩增反应的纳米金磁壳后剩余的上清液,此上清液经dna沉淀方式收集含有的dna后,经高浓度尿素加热处理先使dna变性,再进行尿素洋菜胶体电泳分析,观察是否有扩增反应物60残留在上清液中,其中纯化的malb-fitc片段系为标记fitc之malb基因片段之扩增产物,系作为扩增反应物60之阳性对照组,b3-fitc标定引物系为标记fitc之b3引物,系作为引物之阳性对照组,结果显示在经过不同镭射循环周期(10~30次循环周期)后分离出的上清液中,只有检测到游离状的引物301,并无扩增反应物60的存在,这结果也间接证明核酸扩增的反应系发生在纳米金磁壳上;其中图15(b)中添加dna分子量标准(dna ladder),系用于作为dna分子量大小对照依据,dna分子量标准皆系以「l」表示;另外图15(b)未经加热变性处理系以「n」表示,经加热变性则以「d」表示。
[0192]
请参阅图16(a)及图16(b),系本发明一实施例中,在简单样品的条件下,比较传统的聚合酶链式反应,以及808nm镭射激发进行水冷式珠上聚合酶链式反应在核酸扩增与检测效能上之差异,如图16(a)的上部图,确认在传统的聚合酶链式反应的灵敏度,分别使用0、10、102、103、104、105及106拷贝数之大肠杆菌的malb基因片段进行相同的40个热循环(一个热循环:先95℃,15秒;再60℃,30秒)的操作设定下,再以洋菜胶体电泳进行灵敏度测试,结果显示传统的检测聚合酶链式反应对于检测简单样品的灵敏度介于10至102拷贝数(copy number)的malb基因片段;另外如图16(a)之下部图系确认传统的聚合酶链式反应的特异性,其中系使用下列所述之对照组和微生物菌株之基因体dna(genomic dna)作为个别样品,最左侧系为dna分子量标准,其他系为简单样品,简单样品由左至右分别为无核酸模板对照组(no template control,ntc)、鲍曼氏不动杆菌(acinetobacter baumannii)、绿脓杆菌(pseudomonas aeruginosa)、肺炎杆菌(klebsiella pneumoniae)、表皮葡萄球菌(staphylococcus epidermidis)、金黄色葡萄球菌(staphylococcus aureus,美国典型培养物保藏中心(atcc):baa977)、无乳链球菌(streptococcus agalactiae)、粪肠球菌(enterococcus faecalis)、脓肿分枝杆菌(mycobacterium abscessus)、白色念珠菌(candida albicans)、黑曲霉(aspergillus niger)及大肠杆菌(escherichia coli,atcc:35218),为清楚标示16(a)下部图中各个简单样品,由左至右系以1~12依序编号,各个简单样品皆以大肠杆菌之malb基因片段作为检测标的,搭配洋菜胶体电泳来进行灵敏度测试和特异性测试,仅大肠杆菌的样品呈现检测信号;其中图16(a)之上部图及图16(a)之下部图皆添加dna分子量标准,系用于作为dna分子量大小对照依据,dna分子量标准皆系以「l」表示。相同地,如图16(b)所示,在水冷式珠上聚合酶链式反应中,使用相同大肠杆菌的malb基因片段检测,由左至右分别添加分别包含0、1、10、102、103、104个拷贝数的大肠杆菌的的之malb基因片段),分别相当于0、0.00675、0.0675、0.675、6.75、67.5皮克(picogram,pg)的大肠杆菌的malb基因片段,透过使用免疫侧向流试纸条171上在测试线1711上结合有抗异硫氰酸荧光素抗体,来检测纳米金磁壳上结合的malb基因片段的扩增反应物60上所结合的具有异硫氰酸荧光素标记的引物301,结果显示其检测的灵敏度也介于10至102个拷贝数。
[0193]
请参阅图17(a)及图17(b),其显示在复杂样品的条件下,比较传统的聚合酶链式反应,以及808nm镭射激发进行水冷式珠上聚合酶链式反应在核酸扩增与检测效能上之差异,其中复杂样品包含前述简单样品之大肠杆菌(escherichia coli,atcc:35218)的基因
体dna,以及其他5种人类常见的致病性微生物菌株的基因体dna混合物,包含鲍曼氏不动杆菌(acinetobacter baumannii)、绿脓杆菌(pseudomonas aeruginosa)、金黄色葡萄球菌(staphylococcus aureus,atcc:baa977)、无乳链球菌(streptococcus agalactiae)及粪肠球菌(enterococcus faecalis),其中起始分别加入0、1、10、102、103、104、105及106个拷贝数的大肠杆菌的基因体dna作为分组,另外在各分组中皆加入106个拷贝数的上述5种人类常见的致病性微生物菌株的基因体dna混合物,相当于6.75纳克(nanogram,ng)的上述5种人类常见的致病性微生物菌株的基因体dna的混合物,如图17(a)所示,在传统的聚合酶链式反应检测中,使用复杂样品,在相同40个热循环(一个热循环:先95℃,15秒;再60℃,30秒)的操作设定下,针对malb基因进行核酸扩增与检测的灵敏度测试,结果显示传统的聚合酶链式反应检测的灵敏度降低至105拷贝数才可达到专一性的辨识,检测的灵敏度明显降低。然而,如图17(b)所示,本发明实施例之以镭射激发进行水冷式珠上聚合酶链式反应,分别加入10、102、103、104个拷贝数的大肠杆菌的基因体dna作为分组,分别相当于0.0675、0.675、6.75、67.5皮克的大肠杆菌的基因体dna,另外在各分组中皆加入106个拷贝数的上述5种人类常见的致病性微生物菌株的基因体dna的混合物,相当于6.75奈克的上述5种人类常见的致病性微生物菌株的基因体dna的混合物,并在后续使用免疫侧向流试纸条171来检测纳米金磁壳上所扩增之核酸分子,在如上述复杂样品的条件下,其检测的灵敏度仍然维持在10至102拷贝数,这结果说明镭射激发进行水冷式珠上聚合酶链式反应之核酸扩增与检测的灵敏度不会受到复杂的核酸待测物20而有所影响。
[0194]
请参阅图18(a)及18(b),系本发明一实施例中利用混合富集本体及扩增本体42之悬浮液进行实验,其中富集本体和扩增本体42皆为纳米金磁壳,富集本体系用于捕捉大肠杆菌,并透过具有磁力的操作单元15进行纯化分离,再对富集本体上捕捉的待测物20进行光热裂解,其中待测物20为大肠杆菌(escherichia coli,atcc:35218)之混合液,使大肠杆菌释出生物物质21,扩增本体42则用来捕捉大肠杆菌释出的生物物质21。在另一实施例中,则系使用仅含扩增本体42之悬浮液和大肠杆菌进行反应。具体而言,混合富集本体及扩增本体42之悬浮液,富集本体上具有可专一性地辨识大肠杆菌之o抗原与k抗原的抗体作为富集配体,扩增本体42上则具有可专一性地杂合大肠杆菌特有的malb基因片段的f3引物301(malb f3 primer)作为扩增配体71,在一实施例中,将20μl的混合富集本体及扩增本体42之悬浮液,与1μl的大肠杆菌的混合液及19μl含有1%bsa的tbst缓冲液进行混合,其中1μl的大肠杆菌的混合液含有8
×
103菌落形成单位(colony-forming unit,cfu),在室温(25℃)下混合反应20分钟后,透过具有磁力的操作单元15对富集本体和扩增本体42进行纯化和浓缩后,以tbst缓冲液冲洗,完成冲洗后再使用操作单元15浓缩并去除掉冲洗用的tbst缓冲液,接着将完成冲洗的富集本体和扩增本体42重新悬浮于20μl的tbst缓冲液,借以达到低背景且高特异地捕捉大肠杆菌;在另一实施例中,将上述步骤之混合富集本体及扩增本体42之悬浮液,替换为仅含扩增本体42之悬浮液进行相同步骤,借以确认不包含富集本体的状况下,捕获大肠杆菌的效率。如图18(a)的上部图显示,其中编号1之培养皿表示取1微升的大肠杆菌(od600=0.01)涂抹培养皿的培养结果示意图;其中编号2表示取0.1微升的大肠杆菌(od600=0.01)涂抹培养皿的培养结果示意图,总计培养出238个大肠杆菌的菌落;其中编号3表示取1微升仅含扩增本体42之悬浮液涂抹培养皿的培养结果示意图,未培养出大肠杆菌的菌落;其中编号4表示取19微升仅含扩增本体42之悬浮液涂抹培养皿的培
养结果示意图,培养出1个大肠杆菌的菌落;其中编号5表示取19微升混合富集本体及扩增本体42之悬浮液涂抹培养皿的培养结果示意图,培养出3个大肠杆菌的菌落;其中编号6表示取19微升混合富集本体及扩增本体42之悬浮液涂抹培养皿的培养结果示意图,培养出83个大肠杆菌的菌落;由图18(a)结果可得知,若以仅含扩增本体之悬浮液进行本实施例之上述步骤,则无法有效捕获大肠杆菌,而若以混合富集本体及扩增本体42之悬浮液进行本实施例之上述步骤,可有效捕获大肠杆菌;如图18(a)的下部图所示,将含有捕捉到大肠杆菌的富集本体的悬浮液以808nm镭射激发,在不同的镭射功率持续激发5分钟,其中镭射功率分组包含0mw/0.16cm2、300mw/0.16cm2、400mw/0.16cm2及500mw/0.16cm2,各组分1μl别之含有捕捉到大肠杆菌的富集本体的悬浮液,再将其涂布在lb固态培养基,藉由菌体生成的方式判断光热裂解大肠杆菌的效率,若无法生成新的菌体已被裂解,结果显示以400mw/0.16cm2持续激发5分钟即可使大肠杆菌裂解。如图18(b)所示,将大肠杆菌(atcc:35218)光热裂解释出的生物物质21,经由扩增配体71捕捉生物物质21中含有的malb基因片段,并经由镭射激发进行水冷式珠上聚合酶链式反应,再使用免疫侧向流试纸条171进行评估,结果显示在400mw/0.16cm2持续5分钟激发进行光热裂解下,成功使大肠杆菌光热烈解并释出生物物质21,其中生物物质21中包含的malb基因片段被扩增本体42捕捉并经由镭射激发进行水冷式珠上聚合酶链式反应,可以在免疫侧向流试纸条171上之测试线1711上侦测到信号。
[0195]
请参阅图19(a)及图19(b),系本发明一实施例中混合富集本体及扩增本体42之悬浮液进行实验,其中富集本体系为纳米金磁壳,其中富集配体系为可专一性地辨识大肠杆菌之o抗原与k抗原的抗体,其中扩增本体42系为纳米金磁壳,其中扩增配体71系为可识别malb基因片段之f3引物301(malb f3 primer),并以不同菌落形成单位的大肠杆菌(escherichia coli,atcc:35218)作为待测物20,其中不同菌落形成单位系以600nm波长之吸光度测定并进行分组,包含0cfu、8cfu、8
×
10cfu、8
×
102cfu及8
×
103cfu,评估镭射激发进行水冷式珠上聚合酶链式反应,再进行免疫侧向流试纸条171检测,测试免疫侧向流试纸条171之灵敏度与整体流程所需的时间。如图19(a)所示,此整合平台整体操作的流程包含四个关键程序,分别为「针对目标待测物20的捕捉与浓缩」、「光热裂解待测物并捕捉释出的生物物质21」、「以镭射激发进行水冷式珠上聚合酶链式反应」,以及「免疫侧向流试纸条171检测」。
[0196]
「针对目标待测物20的捕捉与浓缩」步骤中,系将5μl富集本体之悬浮液、15μl的扩增本体42之悬浮液、1μl待测物20及19μl含有1%牛血清蛋白的tbst缓冲液混合反应,于25℃摇晃(shaking)混合20分钟,让扩增本体42上的扩增配体71捕捉大肠杆菌,接着再使用具有磁力的操作单元15浓缩(富集)本体和扩增本体42并移除上清液,并以tbst缓冲液冲洗去除杂质并移除tbst缓冲液,可在25分钟内完成。
[0197]
「光热裂解待测物并捕捉释出的生物物质21」步骤中,系将完成「针对目标待测物20的捕捉与浓缩」步骤经tbst缓冲液冲洗后的富集本体和扩增本体42以20μl的tbst缓冲液重新悬浮(resuspend),并以808nm镭射以400mw持续照射5分钟进行光热裂解,使待测物20释出生物物质21由扩增配本体上的扩增配体71捕捉,接着再使用具有磁力的操作单元15浓缩富集本体和扩增本体42并移除上清液,之后加入100μl的核酸扩增反应液30重新悬浮。
[0198]
「以镭射激发进行水冷式珠上聚合酶链式反应」步骤中,系将完成「光热裂解待测物并捕捉释出的生物物质21」步骤的以核酸扩增反应液30体重新悬浮的富集本体和扩增本
体42,以808nm镭射进行40次镭射循环周期(一个循环周期:先400mw/0.16cm2照射1.25秒,再150mw/0.16cm2照射7.5秒)以完成水冷式珠上聚合酶链式反应,接着再使用具有磁力的操作单元15浓缩富集本体和扩增本体42并移除上清液,之后加入20μl的tbst缓冲液重新悬浮,可在6分钟内完成。
[0199]
「免疫侧向流试纸条171检测」步骤中,系将完成「以镭射激发进行水冷式珠上聚合酶链式反应」步骤并以tbst缓冲液重新悬浮的富集本体和扩增本体42进行免疫侧向流试纸条171进行检测,可以肉眼直接观察免疫侧向流试纸条171上的测试线1711的信号反应,或使用镭射复合红外线热感应器172进行检测,可在3至5分钟完成。整体流程可在45分钟内完成。
[0200]
如图19(b)所示,系将完成图19(a)的各个步骤,完成镭射激发进行水冷式珠上聚合酶链式反应并以免疫侧向流试纸条171检测,结果显示在8cfu的组别免疫侧向流试纸条171即能以视觉观测到信号反应,代表检测的灵敏度落在每个反应中含有8cfu的大肠杆菌。
[0201]
请参阅图20(a)、图20(b)及图20(c),系本发明另一实施例电浆子热传感结合免疫侧向流试纸条171与一般免疫侧向流试纸条171检测灵敏度的效能比较。如图19(b)所示之免疫侧向流试纸条171中于测试线1711的影像,以影像分析软件(image j)进行像素强度分析,其影像量化的结果如图20(a)所示,测试的大肠杆菌菌落形成单位分别为0cfu、8cfu、8
×
10cfu、8
×
102cfu及8
×
103cfu,虽然影像分析检测的灵敏度落在每个反应中含有8cfu的大肠杆菌,但反应中含有8cfu~8
×
10cfu的大肠杆菌的检视较难以目视方式辨别与判定,在本发明实施例揭露整合电浆子热传感结合免疫侧向流试纸条171的方式则可以大幅提高判别率,如图20(b)所示,系对免疫侧向流试纸条171分别以24mw与140mw的808nm镭射能量激发,以镭射复合红外线热感应器172对焦在测试线1711上侦测呈现的热成像图;如图20(c)所示系图20(b)在以24mw与140mw的808nm镭射能量激发后呈现之进行热成像测定温度,在扣除环境中的背景温度(18.2℃)后所得之上升之温度差(
△
t(℃))的量化图表,并且将0cfu组别测得上升之温度差的平均值加上三个标准差作为侦测极限的分界,高于该之温度差则判定为阳性,结果显示分别以24mw与140mw的808nm镭射功率激发下,其热成像的上升之温度差清楚地显示不论是以24mw或140mw的808nm镭射功率激发,检测的灵敏度皆落在每个反应中含有8cfu的大肠杆菌。
[0202]
为了进一步了解不同冷却温度区间进行聚合酶链式反应时,对镭射激发进行水冷式珠上聚合酶链式反应的效能的影响,以有无附上冰袋(ice pack)、冰袋是否加大、核酸扩增反应液30体积进行分组,测试不同条件下核酸扩增反应液30上升之温度差(
△
t(℃)),各组别之纳米金磁壳皆为2.8
×
108个粒子数,组别包括o1(有冰袋,100μl核酸扩增反应液30)、o2(有冰袋,100μl核酸扩增反应液30)、non-1(无冰袋,100μl核酸扩增反应液30)、non-2(无冰袋,100μl核酸扩增反应液30)、non(2x)-1(无冰袋,200μl核酸扩增反应液30)、non(2x)-2(无冰袋,200μl核酸扩增反应液30)、e1(有加大冰袋,100μl核酸扩增反应液30)、e2(有加大冰袋,100μl核酸扩增反应液30),其中冰袋系为550μl的水冻结成冰,其中加大冰袋系为2,200μl的水冻结成冰,各分组执行镭射激发进行水冷式珠上聚合酶链式反应后,经珠式酶联免疫吸附分析法(bead-based elisa)量化,评估组别的核酸扩增反应液30对镭射激发进行水冷式珠上聚合酶链式反应效能的影响,请参阅图21(a),系以190nm的纳米金磁壳悬浮液,在如上述分组的不同起始温度,以镭射循环周期(先690mw照射1.25秒,再360mw照
射7.5秒)循环50次,并以热电偶实时侦测核酸扩增反应液30的温度变化。请参阅图21(b),经珠式酶联免疫吸附分析法(bead-based elisa)量化,分析各分组的核酸扩增反应液30对镭射激发进行水冷式珠上聚合酶链式反应效能的评估,左侧的y轴对应散布线,代表如图21(b)所示之核酸扩增反应液30在执行镭射激发进行水冷式珠上聚合酶链式反应后的上升温度变化量之散布线图,其中o1上升之温度差为11.2℃(由3.8℃升温至~15℃),其中o2上升之温度差为10.1℃(由2.1℃升温至~12.2℃),其中non-1上升之温度差为16.8℃(由13.5℃升温至~30.3℃),其中non-2上升之温度差为20.1℃(由12.6℃升温至~32.7℃),其中non(2x)-1上升之温度差为14.2℃(由17.2℃升温至~31.4℃),其中non(2x)-2上升之温度差为14.8℃(由17.5℃升温至~32.3℃),其中e1上升之温度差为9.8℃(由1.1℃升温至~10.9℃),其中e2上升之温度差为6.7℃(由-8.7℃升温至~-2℃);右侧的y轴对应直方图,代表以珠式酶联免疫吸附分析法的450nm的吸光值,量化评估808nm镭射激发水冷式珠上聚合酶链式反应效能,其中o1之吸光值为0.147,其中o2上升之吸光值为0.168,其中non-1之吸光值为0.132,其中non-2之吸光值为0.120,其中non(2x)-1之吸光值为0.128,其中non(2x)-2之吸光值为0.138,其中e1之吸光值为0.148,其中e2之吸光值为0.195,吸光值的数值越大,代表整体核酸扩增效能愈好。
[0203]
本发明实施例,镭射激发水冷式珠上聚合酶链式反应,其中以镭射循环周期控制固相载体40周遭的温度循环过程,包括复数次循环反应期间,各循环反应期间依序包括核酸分子变性反应次期间、引物黏合次期间及聚合酶延伸次期间,用于使核酸分子变性反应次期间为0.5~5秒,较佳的为1~2.5秒,镭射功率为400~800mw,核酸分子变性反应次期间的温度为85~95℃,较佳为95℃。引物黏合次期间与聚合酶延伸次期间为2~15秒,较佳为5~15秒,镭射功率为100~400mw,引物黏合次期间及聚合酶延伸次期间的温度为55~65℃,较佳为60℃。又每次循环反应期间的循环时间为镭射照射循环周期过程的时间为5~15分钟。
[0204]
本发明系一种核酸检测方法,前述的各固相载体40具有磁性,且在各固相载体40上完成原位核酸扩增产生扩增反应物60后,以下列步骤进行核酸检测:
[0205]
使用操作单元15,辅助纯化分离、浓缩各固相载体40上产生的扩增反应物60;
[0206]
使用侦测模块17辨识位于各固相载体40上的各扩增反应物60上产生的光学变化、热传感变化、电化学变化、磁性变化或电质量变化的其中之一或任二者以上之组合。
[0207]
在本发明中,各扩增反应物60产生的光学变化的方法,包含于扩增反应物60结合带有核酸标记的引物301,并使用光度计侦测光强度,其中核酸标记系可为荧光标记3011,可经由荧光光度计侦测荧光标记3011产生的荧光强度,或扩增反应物60使用酶联免疫吸附分析法检测产生的光学变化或化学发光变化,或者固相载体40与扩增反应物60结合产生的光谱变化。
[0208]
在本发明中,扩增反应物60上产生的光学变化的方法,系以核酸侧向流试纸条检测或免疫侧向流试纸条171检测产生的光学变化,更进一步辅以热传感侦测、表面等离子共振图谱或其组合,以加强该核酸侧向流试纸条检测或免疫侧向流试纸条171检测的灵敏度。
[0209]
在本发明中,扩增反应物60上产生磁性变化的方法,包含交流磁导入仪检测与巨磁阻检测或任二者组合。
[0210]
在本发明中,扩增反应物60上产生电化学式变化的方法,包含酶联免疫吸附分析
法耦合的电化学法侦测、电阻抗谱(eis)检测或前述二者之组合。
[0211]
在本发明中,扩增反应物60上产生电质量变化的方法系为石英晶体微天平(quartz crystal microbalance,qcm)。
[0212]
据上所述,本发明使用多种试验证明:外部能量激发于固相载体40上迅速的冷热温度循环过程,以及后端快速固相载体40上原位核酸扩增反应产生的扩增反应物60的检测,包含外部能量激发在固相载体40适用于核酸扩增所需温度需间的建立,外部能量激最适与最短(能量的输出与照射的频率周期)的探讨,都证明了本案可以在快速且稳定的状态下完成扩增核酸的目的与后端的检测,另外,在待测物20的检体前处理方面,也提供可以操作的施作例,并且可与后端的快速核酸扩增与检测连结,以达到快速核酸检测之目的。因此,本发明可应用于以核酸检测为基础的的定点照护检验(point of care testing,poct)。整结而言,本发明具有下列的优点:
[0213]
1.使用具高体表面积率的固相载体40,可以根据应用目的,来弹性地功能化其表面的配体的组合(例如:抗体、核酸适配体、寡核苷酸、蛋白质、多糖类或其组合)。
[0214]
2.可藉控制外部能量激发的条件与低温反应液间之关系,本发明能在固相载体40表面的原位环境50,迅速创造细胞的原位裂解、目标核酸捕抓、与原位核酸扩增反应所需之温度条件。
[0215]
3.由于上述之固相载体40表面的原位环境50,原位核酸扩增反应仅侷限于固相载体40的表面上。固相载体40周遭之冷却温度的核酸扩增反应液30,不仅提供固相载体40迅速冷却外,周遭的处于冷却温度的溶液环境,也会抑制非目标核酸之扩增反应,此特性将有利于核酸扩增与检测(既核酸分子检测)之特异性。此外,这项技术特性亦能形成核酸扩增与检测之物理性(例如:温度场)区隔,而形成类似虚拟乳化聚合酶链式反应或微滴式数字聚合酶链式反应(droplet digital pcr,ddpcr)的核酸扩增与检测形式,这现象使核酸扩增与检测反应,不易受待测物20核酸的复杂度而有所影响。
[0216]
4.整体低温的核酸扩增反应液30,可大幅改善传统微型化核酸扩增设备中,核酸扩增反应液30蒸发及气泡产生的技术问题。
[0217]
5.本发明可以超快速的方式,实现核酸扩增反应所需的温度(热)循环,加上原位的固相核酸扩增反应,以及后续扩增核酸分子的纯化分离与浓缩,这些使得整体核酸扩增与检测的时间大幅减少。
[0218]
6.本发明大幅简化控温设备仪器。
[0219]
7.简化待测物20前处理与扩增反应物60之侦测:磁性的固相载体40可应用于待测物20、生物物质21、扩增反应物60等的纯化与浓缩(富集),此外,固相载体40亦可用于后续使用免疫侧向流试纸条171,来进行扩增核酸检测之信号物质(例如:可目视之图象或透过电浆子热传感检测之热影像),这分别将有助于待测物20前处理与扩增反应物60之收集与检测。
[0220]
以上对本发明的简述,目的在于对本发明之数种面向和技术特征作一基本说明。发明简述并非对本发明的详细表述,因此其目的不在特别列举本发明的关键性或重要元件,也不是用来界定本发明的范围,仅为以简明的方式呈现本发明的数种概念而已。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。