1.本发明属于分析检测技术领域,具体涉及基于表面增强拉曼散射技术的急性心肌梗死分泌标志物脑钠肽检测装置及方法。
背景技术:
2.以急性心肌梗死(acute myocardial infarction,ami)为代表的心血管疾病发病率呈逐年升高趋势,ami有起病急、病情演变快、随时有心律失常而导致心源性猝死,其致死率、致残率高,属于心血管危急症。目前ami已超过肺癌成为死亡率最高的主要疾病。
3.目前国际上ami临床生化检测的最快速度是肌红蛋白和肌钙蛋白的检测,常规需要20分钟。上海川至生物技术有限公司研制生产的“肌钙蛋白i快速检测卡”可实现15分钟目视观察检测结果。15~20分钟的检测时间相比生命流逝的极速而言,还是不够快。医院采用的急性心肌梗死检测方案仍存在一些缺陷。例如,几种免疫分析技术,包括荧光检测、化学发光、电化学检测等,已被用于同时定量患者血清中的肌红蛋白(mb),肌钙蛋白(tnt),肌酸激酶同工酶(ck-mb) 和脑钠肽前体(pro-bnp)四项,其中脑钠肽前体(pro-bnp)一般简称为脑钠肽(bnp)。由于急性心肌梗死患者的抢救时间非常关键,国家卫健委对心肌梗死标志物的检测时间希望能够降低。因此如何快速实现对ami标志物分子的指纹识别对医学救治起到非常关键的作用。
4.脑钠肽(brainnatriuretic peptidebnp)又称b型利钠肽(b-type natriureticpeptide)、脑利钠肽,是继心钠肽(anp)后利钠肽系统的又一成员,它首先是由日本学者sudoh等于1988年从猪脑分离出来因而得名,主要来源于心室。bnp具有重要的病理生理学意义,可以促进排钠、排尿,具较强的舒张血管作用,可对抗肾素
‑ꢀ
血管紧张素-醛固酮系统(raas)的缩血管作用,同anp一样是人体抵御容量负荷过重及高血压的一个主要内分泌系统心功能障碍能够极大地激活利钠肽系统,心室负荷增加导致bnp释放。目前,虽然脑钠肽含量在ami诊断中有很高的价值, 但脑钠肽水平的测定并没有得到很好的普及,主要原因是检测方法的制约。脑钠肽检测的方法学研究一直是脑钠肽研究的热点。检测脑钠肽的主要方法有免疫放射分析法(rima),免疫荧光法等,rima法由于半衰期短、检测时间长不适合于ami的急性诊断和小样本检测。biosite公司推出的免疫荧光法测定脑钠肽水平, 达到了快速检测的目的,但需专门的荧光分析仪,成本很高,不适合发展中国家。 bayer diagnostics公司、abbott公司也推出了脑钠肽测定试剂,但成本均较高。
5.拉曼散射效应由印度科学家c.v.raman在1928年发现,主要基于入射光和物质的非弹性散射,使得入射光失去部分能量(取决于分子本身的结构),从而识别分子的指纹信息。相比其他的检测方法(如荧光检测),无需样品处理、水不敏感(医学生物检测尤其有用)及微区微量检测、几秒中内完成等特点,在疾病标志物分子的快速指纹检测有重要的应用前景。但根据量子力学选择定律,拉曼效应的散射截面只有荧光信号的百亿分之一,信号非常弱。随着微纳光学的发展,人们发现金属微纳结构的费米能级附近导带上的自由电子与入射光相互耦合,表面自由电子集体相干涨落会形成一种局域的电磁模式,将入射光场能
量汇聚在亚波长的空间范围内,在金属表面附近形成局域增强电磁场,利用此增强电磁场会显著的提高位于金属表面附近分子的拉曼散射的强度,实现表面增强拉曼 (surface-enhanced raman scattering,sers)检测。sers技术的出现为ami血清中bnp的快速检测、微量检测乃至单分子检测(早期预警及早期诊断的需要)提供了一种有效的途径。
6.在金属微纳结构表面等离激元光学效应的sers应用中,如何调控局域光场的激发并获得较强的局域光场态密度,对于其增强sers的效率至关重要。相比单个纳米结构的共振激发,金属耦合结构由于结构之间存在间隙等离激元耦合效应而会产生更强的局域光场,因而受到广泛关注。1999年武汉大学徐红星院士针对sers单分子检测的实验现象(phys.rev.lett.,1999,83(21):4357-4360),首次发现是由ag纳米粒子之间超小间隙中的耦合电磁场引起的,场增强可达103倍以上,使sers增强因子达到10
12
,从而解释了sers的单分子检测现象。近年来,英国伯明翰大学张霜等利用卷曲纳米碗结合介质、金纳米粒子沉积得到金耦合结构,实现了宽频段的单分子sers检测(nat.commun.,2018,9(1):5248-5255)。
7.基于上述sers增强物理机制,目前,sers应用于ami中标志物bnp分子的检测同时需要解决两方面的难题:第一,如何实现bnp的高敏感性和特异性检测:病人血清中除了存在bnp分子外,还存在几千种以上的其它生物蛋白等,如何在血清中只检测待测的标志物分子;第二,如何实现ami标志物bnp的快速检测:这对于ami的早期诊断、早期预警非常重要。高选择性检测要求金属结构可以捕获分子,高灵敏度检测要求被捕获的分子处于金属结构中增强电磁场区域,两者同时实现是基于sers的心血管疾病标志物bnp分子检测应用的关键。
8.我们在前期结合ebl、光刻及纳米压印等技术实现了具有结构单元精确可调的柔性金属纳米手指阵列有序结构(acs nano,2017,11(6):5836-5843;small, 2018,14:1801146-1801155;zl201710825180.0;zl201910666854.6)。这种金属纳米手指阵列可通过滴定溶剂,利用其挥发过程中的表面张力,会使靠的很近的柔性纳米手指之间相互坍塌靠在一起。通过这种技术,可以结合bnp抗体修饰技术事先连接到au表面,通过坍塌,然后靠在一起形成au纳米手指/bnp抗体/au 纳米手指耦合结构,由于bnp抗体的空间纵向尺寸在亚纳米级,因此形成的耦合结构可实现量子等离激元调控下的增强电磁场;在这种耦合结构中,抗体分子作为耦合结构间隙层,既可以捕获心血管疾病标志物bnp分子,又可以局域标志物 bnp分子在间隙层中,由于耦合增强电磁场主要分布在间隙层中,因此可同时实现bnp分子的高选择性和高灵敏性sers检测。具体应用中,通过把血清滴入事先置入生物载波片的纳米手指耦合结构衬底,可实现在液体血清环境下特定心血管疾病标志物分子的高选择性和高灵敏度测量,检测时间为5秒左右,远小于目前医院标准的bnp检测时间(10-15分钟)。
技术实现要素:
9.为解决现有技术的不足,提供一种ami标志物分子bnp的高选择性和高灵敏性检测要求的表面增强拉曼基底的制备方法,属于分析检测技术领域。这种方法制备简便合理,可大批量、低成本制备,针对bnp监测,可实现ami病人血清中的bnp的高选择性和高灵敏度检测,并可应用于装载于救护车中手持式拉曼等便携设备。利用柔性au纳米手指阵列有序结构,通过与bnp抗体分子结合,首先构筑au纳米手指/bnp抗体分子/au纳米手指耦合结构,由
于抗体的空间纵向尺寸在亚纳米级,因此形成的耦合结构可实现量子等离激元调控下的增强电磁场;其次,利用此耦合结构中的抗体与bnp分子特异相互作用,从病人血清中直接捕获和局域bnp分子到sers增强衬底表面,利用bnp分子中有别于抗体分子对应的 sers特征峰,实现bnp分子的高选择性和高灵敏度定量检测。
10.为实现上述目的,本发明采用以下技术方案:
11.基于表面增强拉曼散射技术的脑钠肽检测装置,其特征在于它是由以下步骤制备而得:
12.1)采用纳米压印、au薄膜沉积及反应离子束刻蚀制备au纳米手指有序阵列结构;
13.2)将对应bnp的抗体分子溶液滴加在步骤1制备的au纳米手指有序阵列结构上进行孵育,时间为8小时,使得抗体分子与au结合;
14.3)将步骤2孵育好的au纳米手指有序阵列结构拿出,室温及空气环境下自然干燥后,用超纯水冲洗去未连接且多余的bnp抗体分子,再用超纯水浸泡 30分钟,取出在自然条件下干燥;
15.4)在溶液挥发过程中,微表面张力使得相邻六个或更多个纳米手指相互靠在一起,形成以六聚体或多聚体为结构单元的坍塌au手指阵列结构,手指结构之间形成2倍bnp抗体尺寸大小的亚纳米间隙,可产生量子等离激元调控的增强耦合电磁场,此外,抗体分子分布在au纳米手指表面,可捕获bnp分子到耦合电磁场中。
16.本发明还采用了如下的技术方案:
17.基于表面增强拉曼散射技术的脑钠肽检测方法,其特征在于采用前述的检测装置,并增加以下步骤:
18.5)将步骤4得到的基于au纳米手指闭合阵列结构的sers增强衬底放入生物载波片里,接着滴入血清,盖上载波片,静置5分钟,这时,bnp分子会被捕获并局域在手指表面;
19.6)通过拉曼光谱仪直接聚焦步骤5中纳米手指阵列表面,只对bnp和抗体分子进行拉曼检测,可直接获得抗体及bnp的特征峰,通过bnp的指纹特征峰1001cm-1
、1453cm-1
、1657cm-1
来实现对bnp的指纹识别检测。
20.上述步骤1中au纳米手指有序阵列结构中的单个纳米手指的高度为350纳米,包括300纳米的聚合物柱子及上面50纳米的au,直径为75纳米,相邻手指之间的距离为110纳米,目的是在后续的坍塌过程形成六聚体耦合结构。
21.上述步骤2中的孵育时间为8小时。
22.上述步骤5中的静置时间为5分钟。
23.本发明基于柔性au纳米手指阵列结构结合抗体修饰技术,构筑了以亚纳米级抗体大小的超小间隙的耦合结构,利用bnp与对应抗体相互作用,实现bnp 分子的捕获和局域在au纳米手指表面,直接对au手指表面进行光学聚焦,通过bnp分子的拉曼特征峰实现血清中bnp分子的高灵敏度和高特异性检测,检测时间为5秒。在我们的设计中,由于抗体的纵向尺寸处于亚纳米级,当纳米手指靠在一起时,单个纳米的手指的局域表面等离激元偶极模式会相互耦合,形成成键和反键的2种耦合模式,其中成键的耦合模式会引发超强的局域增强电磁场,在我们的设计中,这种局域增强电磁场的增强因子为109量级以上,可达到单分子层次sers灵敏度。此外,我们在柔性au纳米手指阵列结构制备中,通过设计合适的尺寸及周期,可实现以六聚体及多聚体为结构单元的耦合结构,这种多聚体结构具有更多的耦合热
点区域。
24.在bnp抗体溶液挥发过程中,由于特定的纳米手指尺寸设计,微表面张力使得相邻六个纳米手指或更多相互靠在一起,形成以六聚体或多聚体为结构单元的坍塌手指阵列结构,六聚体的耦合结构可获得较多的耦合热点;在形成的坍塌手指阵列结构中,手指之间的间隙是由2倍bnp抗体的尺寸决定,处于亚纳米级。因此,在au手指之间,形成了量子等离激元调控的增强电磁场,使得sers 的增强因子达到109量级;在这种耦合结构中,抗体分子作为耦合结构间隙层,既可以捕获bnp,又可以局域bnp在间隙层中,由于耦合增强电磁场主要分布在间隙层中,因此可同时实现bnp的高选择性和高灵敏性sers检测。通过把血清滴入事先置入生物载波片的au纳米手指/bnp抗体/au纳米手指耦合结构衬底,直接对au手指表面进行光学聚焦,可实现5秒内液体血清环境下特定bnp 的高选择性和高灵敏度测量。
25.本发明的有益效果:
26.1、通过au柔性纳米手指与抗体孵化技术相结合,在微毛细管力的作用下,得到间隙大小均匀的亚纳米级抗体间隙,间隙大小是由两倍的抗体纵向尺寸决定的,而不是纳米压印的分辨率决定的,具有间隙大小保护的特性。
27.2、由于抗体亚纳米纵向尺寸特性,使得耦合电磁场可实现在量子等离激元参与下的电磁场增强,增强倍数可实现单分子层次的sers检测。
28.3、由于抗体除了作为间隙层外,还起到在血清中捕获和局域bnp分子的作用,这样可在后续的拉曼检测中,在液体环境下,直接测量bnp的拉曼信号,可避免血清中其他蛋白的影响,同时考虑到增强的局域电场,可实现bnp的高灵敏性和高选择性探测。由于拉曼检测时间很短,可大大降低bnp的检测时间。
附图说明
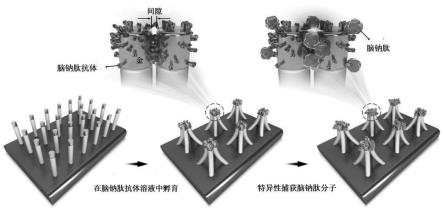
29.图1为基于au柔性纳米手指阵列结构的汞急性心肌梗死分泌标志物脑钠肽检测方法示意图,首先滴定bnp抗体溶液到au柔性纳米手指上,然后通过坍塌效应,形成以bnp抗体为间隙层的au纳米手指/bnp抗体/au纳米手指耦合结构,最后通过滴入含有bnp分子血清到耦合结构中,抗体会特异性捕获bnp并把它局域在耦合电磁场中,实现sers的高灵敏度和高选择性测量。
30.图2:本发明所述的纳米压印制备的au柔性纳米手指有序阵列经过bnp抗体溶液修饰并干燥后形成的耦合结构阵列,包括六聚体及多聚体的扫描电镜图片 (sem)。
31.图3为bnp抗体和抗原分别滴在金膜后,抗体与抗原拉曼扫描结果,可以标定抗体抗原的特征峰。
32.图4自下而上为金纳米手指的光谱图、bnp抗原的光谱图、bnp抗原滴在金纳米手指的光谱图。金纳米手指阵列结构可以测出bnp信号。
33.图5自下而上为bnp滴在抗体与金纳米手指结合的体系上的拉曼光谱、清洗后的拉曼谱;病人血清滴在抗体与金纳米手指结合的体系上的拉曼光谱、清洗后的拉曼谱。在血清中可以检测出bnp的信号。
具体实施方式
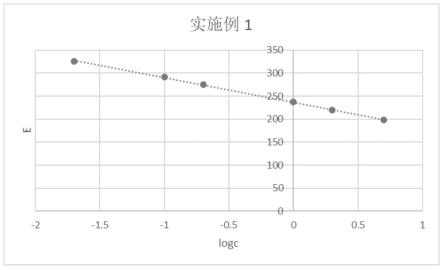
34.实施例1
35.au纳米手指/bnp抗体/au纳米手指耦合结构的制备方法,包括以下步骤:
36.步骤1:采用纳米压印、au薄膜沉积及反应离子束刻蚀制备au纳米手指有序阵列结构,单个纳米手指的高度为350纳米,包括300纳米的聚合物柱子及上面50纳米的au,直径为75纳米,相邻手指之间的距离为110纳米;
37.步骤2:将脑钠肽(bnp)抗体从-20℃冰柜取出,常温融化后,用10ul的移液枪量取1ul的抗体;
38.步骤3:在通过步骤1得到的金属纳米手指阵列结构上滴上步骤2中的抗体孵育8小时。在孵育的过程中放在4℃的冰箱保存,在自然条件下挥发,形成 au纳米手指闭合阵列结构,具体为au纳米手指/bnp抗体/au纳米手指,这里 bnp抗体作为间隙层。
39.步骤4:将步骤3得到的衬底用去离子水清洗一次,去除多余抗体,再在常温下自然晾干,具体见图2所示,最终形成六聚体及多聚体结构;
40.实施例2
41.基于au纳米手指/bnp抗体/au纳米手指耦合结构的bnp分子的高选择性和高灵敏度定量检测,包括以下步骤:
42.步骤1:在两块25nm厚的金膜上分别滴上抗体和浓度为104的脑钠肽,并 进行拉曼检测,标定特征峰。具体如图3所示。脑钠肽的峰位在2100cm-1
、2200cm-1
处。
43.步骤2:在金纳米手指阵列上滴上浓度为104pg/ml的脑钠肽,孵育5分钟,再对其进行拉曼检测,将其与干净金纳米手指阵列的拉曼谱和金膜上滴脑钠肽的拉曼谱进行对比,得出的拉曼谱见图4所示,可见我们的金纳米手指阵列是可以测出脑钠肽的。
44.步骤3:在通过步骤2得到的金纳米手指阵列结构上滴上浓度为10pg/ml脑钠肽,放在常温下结合一小时,进行拉曼检测,再用去离子水清洗表面多余的脑钠肽,在室温下晾干,再进行拉曼检测。
45.步骤4:在通过步骤2得到的另一块金属纳米手指阵列结构上滴上处理过的人类血清(脑钠肽含量1.451pg/ml),在常温下结合一小时,进行拉曼检测,并用去离子水进行清洗再进行拉曼检测。
46.步骤5:将步骤3和步骤4得到的四条拉曼谱放在一张图里进行比较,具体如图5所示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。