一种猪a型塞内卡病毒中和性抗体、竞争elisa检测试剂盒及检测方法
技术领域
1.本发明属于生物技术领域,涉及一种猪a型塞内卡病毒中和性抗体,利用上述抗体制备的竞争elisa检测试剂盒及相应检测方法。
背景技术:
2.猪塞内卡病毒病是由a型塞内卡病毒(senecavirus a,sva)引起猪特发的类口蹄疫症状的新发水疱性传染病。发病猪主要临床表现为口、鼻及蹄冠部发生水疱性损伤,甚至出现跛行、厌食、仔猪腹泻甚至急性死亡等现象,临床上与其它水疱性动物疫病如口蹄疫病毒、猪水泡病毒、水泡性口炎病毒、猪水疱疹病毒难以诊别,已对全球猪产业带来了潜在威胁。pcr方法和血清学方法是实验室常用的疫病诊断技术,建立血清学elsia中和性抗体检测方法既可以了解病原的感染状况,也可以用于疫苗免疫效果评价。因此,建立猪塞内卡病毒病中和性抗体elisa检测方法对防控该病具有重要价值。
3.sva是一种单股正链的rna病毒,属于小核糖核酸病毒科、塞内卡病毒属的唯一成员,sva基因组长约7.2kb,拥有唯一的开放阅读框(orf),orf两侧为5
′
非翻译区和3
′
非翻译区。该病毒于2002年首次从per.c6细胞培养物中被鉴定,命名为svv-001株,其完整基因组序列于2008年测定完成。2007年,美国明尼苏达州从加拿大引进的猪中发现了水泡病变,鉴定病原为sva感染所致。从2012年开始,多个国家陆续报道猪塞内卡疫情,且各国之间的流行毒株同源性极高。因此,许多国家非常重视监测猪塞内卡病毒病的发生和发展,诸多学者投入防控技术的研究。
4.elisa方法是血清学检测的主要方法,目前已经建立了包被不同sva结构蛋白抗原的间接elisa检测方法,如申水莹、闫若潜等使用sva的vp3蛋白作为包被抗原建立了间接elisa检测方法,该方法虽然特异性强、敏感性好,但检测效果相比中和试验较差;dvorak等在2017年已通过间接elisa证实了vp2作为包被抗原更敏感,敏感性为84%。申珊、许立阳等也建立了关于sva vp2蛋白的间接elisa方法来检测抗原,敏感性为96%;gimenez等使用vp1作为包被抗原,建立间接elisa方法,该方法的灵敏度为93%,特异性为99%;melissa goolia等使用sva单克隆抗体建立的竞争elisa(celisa)法则具有更高的灵敏度,达到96.9%,但所用抗体为鼠源单抗,而且价格昂贵,购买不便;bai manyuan等利用大肠杆菌表达的sva病毒样颗粒作为捕获抗原,并用其免疫兔制备特异性酶标竞争抗体而建立了竞争elisa检测方法,特异性和敏感性分别为100%和94%,且与biostone asurdx
™ꢀ
senecavirus a (sva) antibody test kit 和间接免疫荧光方法的符合率分别为90.0%和94.2%。上述elisa方法均用于检测sva特异性的抗体,但动物体发挥抗病毒保护作用的主要是中和性抗体。因此,建立sva中和性抗体的elsia检测方法用于感染或者免疫动物中和性抗体水平的评价,对防控猪塞内卡病毒病有着重要意义。
技术实现要素:
5.本发明的目的在于针对现有技术存在的问题,提供一种猪a型塞内卡病毒中和性抗体1m5和1m25。
6.本发明的另一目的在于提供一种利用上述抗体制备的猪a型塞内卡病毒竞争elisa检测试剂盒。
7.本发明的再一目的在于提供一种利用上述试剂盒的猪a型塞内卡病毒竞争elisa检测方法。
8.为此,本发明采用如下技术方案:一种猪a型塞内卡病毒中和性单克隆抗体1m5,所述单克隆抗体1m5包括如下轻链和重链可变区氨基酸序列:1m5抗体轻链:atmawtvlligllavgsgvdsqtviqepamsvslggtvtltcafssgsvttnnyprwfqqtpgqpprqliyqtnsrptgvpsrfsgaisgnkatltitgaqaedeadyfcalytspatvfgggthltvlgqpkaaptvnlfppsseelgtnk1m5抗体重链:atmefrlnwvvlfallqgvqgeeklvesggglvqpggslrlscvgsgftfsstrinwvrqapgkglewlasistdggitgytdsvkgrftisrdnsqntaylqinslrsedtaryycatgcasgcggywgwgpgvevv。
9.一种猪a型塞内卡病毒中和性单克隆抗体1m25,所述猪a型塞内卡病毒中和性单克隆抗体1m25包括如下轻链和重链可变区氨基酸序列:1m25抗体轻链:atmawtvlligllavgsgvdsqtviqepamsvslggtvtltcafssgsvtssnypgwfqqtpgqpprtviystknrptgvpsrfsgaisgnkatltitgaqaedeadyfcamdkgsgtyivlfgggthltvlgqpkaaptvnlfppsseelgtnk1m25抗体重链:atmefrlnwvvlfallqgvqgeeklvesggglvqpggslrlscvasgftfssydvewvrqapgkglewlaytdfsgtdtyyadsvkgrftisrdnsqntaylqmnslrtedtaryycetggfrscvgsgcslwgpgvevvv。
10.一种猪a型塞内卡病毒中和性抗体竞争elisa检测试剂盒,所述试剂盒包括:包被有猪a型塞内卡病毒中和性单克隆抗体1m5并捕获抗原的反应板,生物素标记的猪a型塞内卡病毒中和性单克隆抗体1m25,阳性对照血清,阴性对照血清,血清稀释液,底物溶液,终止液,洗涤液。
11.所述检测试剂盒反应板的制备过程如下:(1)包被:用碳酸盐缓冲溶液(ph值9.6)稀释猪a型塞内卡病毒中和性单克隆抗体1m5至终浓度2μg/ml,然后加入酶标板中,每孔100μl,封口膜封口后于2-8℃条件下过夜包被;(2)捕获抗原: pbst溶液洗涤酶标板3次后,将猪a型塞内卡病毒抗原使用pbs溶液稀释至 0.5μg/ml,按100μl/孔加入酶标板中,置于室温下孵育2h,然后用pbst溶液洗涤3次;(3)封闭:用含2%bsa和5%蔗糖的pbst溶液作为封闭液,按100μl/孔加入,置于室温下孵育1h或者2-8℃过夜,pbst溶液洗涤酶标板3次,吸干残液,吹干酶标板后,加干燥剂密
封,即为试剂盒反应板;所述试剂盒反应板于2-8 ℃冷藏保存,每个试剂盒配装两块反应板。
12.所述生物素标记的猪a型塞内卡病毒中和性单克隆抗体1m25的制备过程如下:(1)使用截留量100 kda的超滤管将猪a型塞内卡病毒中和性单克隆抗体1m25置换至pbs缓冲液中,3000 r/min离心10 min,得到抗体存储缓冲液;(2)按180 μl灭菌超纯水加入1 mg生物素的比例,将生物素充分振荡溶解;按生物素稀释液:抗体存储缓冲液=1:10的体积比将稀释后的生物素加入抗体存储缓冲液中,冰上孵育3h;(3)将加入生物素的抗体存储缓冲液装入透析袋中,用pbs溶液进行透析置换,测定抗体浓度后加入等体积100%甘油,-70 ℃保存。
13.检测试剂盒中,所述血清稀释液为0.01mol/l的pbs(磷酸盐)缓冲液。所述底物溶液为tmb溶液;所述终止液为0.3 mol/l的h2so4溶液;所述洗涤液为pbst溶液。
14.一种猪a型塞内卡病毒中和性抗体竞争elisa检测方法,包括如下步骤:(1)取出试剂盒反应板,每孔加入45μl血清稀释液,然后分别加入待测血清、阴性对照血清、阳性对照血清与作为空白对照的血清稀释液,其中,待测血清加1孔,阴性对照血清、阳性对照血清与作为空白对照的血清稀释液各加两孔,每孔5μl;然后用血清稀释液按1:100比例稀释浓度为4μg/ml的生物素标记的猪a型塞内卡病毒中和性单克隆抗体1m25,向反应板中每孔加入50μl经稀释的单克隆抗体1m25,轻振混匀,37℃作用30min;(2)用洗涤液pbst溶液洗涤反应板5次,最后一次拍干;(3)用血清稀释液稀释辣根过氧化酶标记链菌素streptavidin-hrp,稀释比例1:30000,按100μl/孔加入反应板各孔,37℃孵育15min;然后用洗涤液pbst溶液洗涤反应板5次;(4)向反应板中每孔加入100μl的底物溶液,37 ℃避光孵育10~15min;(5)向反应板中每孔加入100μl的终止液,轻振混匀,于10min内用酶标仪读取450nm吸光值od 450nm
;(6)计算阻断率pi:阻断率pi=(1-样品od
450nm
值/空白对照od 450nm
值)
×
100%;(7)结果判定:是否存在猪a型塞内卡病毒中和性抗体,通过计算每个血清样品的pi值进行判定:pi值大于或等于45%,判为猪a型塞内卡病毒中和性抗体阳性;pi值小于45%,判为猪a型塞内卡病毒抗体阴性。
15.检测结果成立的条件为:空白对照od
450nm
值-阳性对照od
450nm
值≥1.0,且阳性对照阻断率pi应不低于70%,阴性对照阻断率pi应小于25%。
16.研究表明sva感染猪第五天开始就能够诱导产生特异性的中和性抗体,4周就能达到很高的中和性抗体水平。本发明利用单个b细胞抗体技术成功筛选出了猪源sva中和性抗体,并使用一株中和性抗体包被elsia反应板捕获抗原,另一株中和性抗体使用生物素标记作为竞争抗体,建立一种检测塞内卡病毒中和性抗体的竞争elisa方法(celisa),并研制其试剂盒,主要用于流行病学监测和疫苗免疫效力评估,为猪塞内卡病的防控提供更高效的诊断生物制品,具有重要科学意义。
17.本发明的有益效果在于:(1)本发明利用sva中和性抗体用于elisa检测,相比sva特异性抗体,中和性抗体
更能准确反应sva感染或者疫苗免疫水平;(2)经实验检验,本发明试剂盒和检测方法具有良好的特异性、敏感性、重复性和稳定性;(3)检测操作简便,检测周期短,单次检测时间约为90min。
附图说明
18.图1为纯化后的sva中和性抗体1m5和1m25 的sds-page电泳图;图2为纯化后的sva抗原纯化透射电镜图;图3为纯化后的sva抗原sds-page电泳图;图4为非免疫健康猪血清与感染猪血清的pi值分布范围图;图5为roc曲线统计分析;图6为youden's指数分析;图7为本发明方法特异性试验结果;图8为本发明方法敏感性试验结果(采用牛羊健康血清测试);图9为本发明方法敏感性试验结果(采用其他猪病毒阳性血清测试);注:图8和9中,x轴上0为sva感染前采血,5、7、9分别为感染后第5、7、15天采血,11、13、15、16是感染25天后再用疫苗免疫后第2、6、30、35天采血;图10为本发明方法稳定性试验结果。
具体实施方式
19.以下通过具体实施例对本发明中和性抗体、检测试剂盒及检测方法进行进一步说明。
20.实施例1猪a型塞内卡病毒中和性单克隆抗体1m5、1m25的制备及鉴定猪a型塞内卡病毒中和性单克隆抗体1m5的阳性质粒pcdna3.4/1m5h与pcdna3.4/1m5l的 c端均带有6个his标签,经鉴定该株抗体为sva中和性抗体,其包含的轻链和重链可变区氨基酸序列分别如下:1m5l(1m5抗体轻链):atmawtvlligllavgsgvdsqtviqepamsvslggtvtltcafssgsvttnnyprwfqqtpgqpprqliyqtnsrptgvpsrfsgaisgnkatltitgaqaedeadyfcalytspatvfgggthltvlgqpkaaptvnlfppsseelgtnk1m5h(1m5抗体重链):atmefrlnwvvlfallqgvqgeeklvesggglvqpggslrlscvgsgftfsstrinwvrqapgkglewlasistdggitgytdsvkgrftisrdnsqntaylqinslrsedtaryycatgcasgcggywgwgpgvevv。
21.猪a型塞内卡病毒中和性单克隆抗体1m25的阳性质粒pcdna3.4/1m25h与pcdna3.4/1m25l的 c端也均带有6个his标签,经鉴定该株抗体为sva中和性抗体,其包含的轻链和重链可变区氨基酸序列分别如下:1m25l(1m25抗体轻链):atmawtvlligllavgsgvdsqtviqepamsvslggtvtltcafssgsvtssnypgwfqqtpgqpprtv
iystknrptgvpsrfsgaisgnkatltitgaqaedeadyfcamdkgsgtyivlfgggthltvlgqpkaaptvnlfppsseelgtnk1m25h(1m25抗体重链):atmefrlnwvvlfallqgvqgeeklvesggglvqpggslrlscvasgftfssydvewvrqapgkglewlaytdfsgtdtyyadsvkgrftisrdnsqntaylqmnslrtedtaryycetggfrscvgsgcslwgpgvevvv。
22.sva猪源单克隆抗体1m5和1m25的表达和纯化(1)质粒大量制备按照常规方法将单克隆抗体1m5和1m25的阳性质粒pcdna3.4/1m5、pcdna3.4/1m25分别转染dh5α感受态细胞,挑取单个菌落接种lb培养基培养,使用无内毒素质粒大提试剂盒(购自天根生化科技(北京)有限公司)制备抗体轻链和重链表达质粒,并测定质粒浓度。
23.(2)抗体表达与纯化1m5和1m25抗体的表达与纯化过程相同,具体为:使用expifectamine cho转染试剂盒(invitrogen)将抗体的轻链和重链质粒按照3:2的质量比例(30ug:20ug/30ml)转染至6
×
106/ml cho-s细胞,转染至18h后补加增强剂150μl和其他饲养成份6μl,37℃、8%co2条件下悬浮培养8~10d后收样,1000rpm转速2~8℃条件下离心30分钟除去细胞碎片,收集上清,用akta蛋白层析系统纯化目的蛋白。用sds-page电泳检测表达抗体的纯度和大小。经pbs多次置换后,使用peg6000包埋2~4小时,浓缩至2~4ml,浓度不低于1mg/ml,吸光值od
280nm
测定最终抗体浓度,分装100μl/管保存至-70℃以下备用。
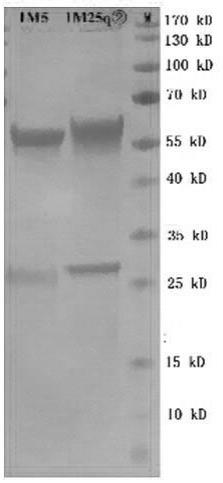
24.sva猪源单克隆抗体1m5和1m25的鉴定将单克隆抗体1m5和1m25的轻链与重链质粒分别按照质量比3:2转染cho细胞,离心收集细胞上清后,利用his标签的钴离子纯化柱纯化,还原性sds-page显示重链大小约60 kd,轻链约30 kd,与预期大小一致,见图1。说明成功表达并纯化获得了sva猪源单克隆抗体1m5和1m25。
25.实施例2猪a型塞内卡病毒抗原的制备(1)病毒繁殖取-70℃条件下保存的sva hn/11/2017低代次毒株,按照1moi病毒量接种长满单层的bhk-21细胞,约24~36h后收获病毒,制备约1l病毒。
26.(2)病毒灭活及检验病毒灭活:在病毒液中加入终浓度为3mmol/l bei,置于28~30℃,转速120rmp条件下灭活病毒30h后,加硫代硫酸钠终质量浓度至4%阻断灭活反应,取样2ml进行灭活检验。
27.病毒灭活检验:取灭活样品以10%的比例接种长满单层的bhk-21细胞,盲传三代,观察每代细胞的生长状态,均应不出现致细胞病变效应(cpe);(3)病毒纯化灭活检验合格的病毒液中加入1% triton 100x在室温下震荡10分钟,然后在2~8℃、8000rpm条件下离心45min,除去细胞碎片;收集上清,加入8% peg6000(质量体积比)和4% nacl(质量体积比),2~8℃搅拌过夜使病毒沉淀,次日以10000rpm离心1h,弃上清,将病
毒重悬至20ml net溶液(100mmol/l nacl,1mmol/l edta,50mmol/l tris-hcl ,ph 7.6)中,将它们添加到预制的蔗糖梯度离心管中(质量浓度15%、25%、35% 和 45%,浓度由低往高从底部缓慢加入),以35000rpm,2~8 ℃条件离心 3.5h。
28.(4)收获病毒粒子从上样蔗糖梯度管中由上至下,以0.5ml顺序依次取样,经吸光值od
260nm
检测含病毒颗粒层,并用透射电镜检测病毒粒子的形态,用sds-page电泳进行病毒蛋白大小分析;在2~8℃条件下用ph值7.4的pbs溶液稀释含病毒粒子的糖溶液,利用100kd的超滤管除去蔗糖,置换病毒粒子中的糖份,余留1-2ml即为纯化的病毒抗原,用吸光值od
280nm
测定最终抗原浓度,分装100μl/管保存至-70℃以下备用。
29.猪a型塞内卡病毒抗原纯化结果检测sva bf7代细胞毒按照1 moi接种bhk-21细胞,30~36小时能够完全病变,测病毒毒价tcid50约为 109/ml;经负染后透射电镜观察到大小为20-30nm球形粒子,其形态结构和大小预期相符(见图2);纯化的病毒粒子经sds-page电泳可见与病毒衣壳蛋白vp0(vp2和vp4)、vp1、vp3大小一致的条带,分别约为39kd、29kd、26kd(见图3)。由此可见,sva用bhk-21细胞繁殖后,使用终浓度不低于3mmol/l的bei能够完全灭活病毒, peg法能够纯化出完整的病毒粒子。
30.实施例3猪塞内卡病毒中和性抗体竞争elisa检测方法的建立过程(1)抗原、抗体最佳工作浓度的确定将单克隆抗体1m5分别以0.5、1、2、3 g/ml 包被酶标板,然后捕获不同浓度(0.3、0.5、1和2μg/ml)的sva全病毒粒子抗原作为检测反应板,在不同反应条件下进行抗体包被和抗原捕获,检测阳性对照血清,利用棋盘法确定包被抗体和捕获抗原的最佳工作浓度和反应条件;待确定反应板最佳包被抗体和捕获抗原反应使用量和作用条件后,加入不同稀释度(1:15000、1:20000、1:25000和1:30000)生物素标记单克隆抗体bio-1m25(浓度0.855mg/ml),并检测阳性(p)、阴性(n)血清样本与pbs空白对照(b),最后用辣根过氧化物酶标记的亲和素(streptavidin-hrp)孵育后用底物tmb显色,计算出阴性、阳性对照血清od
450nm
值,按照阳性对照血清与阴性对照血清差异最大的反应条件,为竞争抗体1m25的最佳工作浓度。
31.(2)最佳血清稀释度的确定在确定抗原与抗体的最适工作浓度之后,将标准阴、阳性血清按1:4、1:6、1:8、1:10和1:12稀释后进行竞争elisa检测。对获得的阻断率进行比较,取阴、阳性血清的阻断率差异最大的稀释度作为最佳血清稀释度。
32.(3)加入血清后反应时间的选择设定了以下几个反应条件:
①
37℃反应30 min ;
②
37℃反应45 min;
③
37℃反应60 min。对各反应条件下的阳性对照血清阻断率进行对比分析,取阻断率达最大时的最短作用时间为最佳反应条件。
33.(4)判定标准确定根据背景清楚的临床健康非免疫猪血清与感染猪血清样本的检测结果来确定本方法的判定标准。共检测462份非免疫健康猪血清;感染猪血清102份;一免后第2、3、4周猪
血清各2份,共6份;二免后第1~5周血清各2份,共10份。阻断率(pi)=(1-测试样本od
450nm
/阴性对照平均od
450nm
)
×
100%。统计感染和免疫动物与健康阴性动物血清样本阻断率分布区间,确定该elisa方法判定标准。
34.(5)特异性、敏感性、重复性、稳定性检测为了确定该方法的特异性、敏感性和重复性,根据确定的最佳抗体抗原反应浓度、反应条件及判定标准,检测不同来源的血清样本,绘制roc曲线和youden's指数,并结合中和试验结果确定本方法的特异性、敏感性,血清包括:(1)sva感染不同时间血清,免疫不同时间的血清;(2)口蹄疫病毒(fmdv)、猪蓝耳病病毒(prrsv)、猪瘟病毒(csfv)、猪伪狂犬病毒(prv)、猪圆环病毒2型(pcv2)、仔猪流行性腹泻病毒(pedv)的猪阳血清;(3)非免疫健康牛和羊的血清。使用sva感染血清、免疫血清、阴性血清进行重复检验3次,观察检测结果,分析该方法的重复性。在37℃条件下进行破坏性试验,观察其稳定性。
35.猪塞内卡病毒中和性抗体竞争elisa检测方法的建立结果(1)包被抗体和捕获抗原最佳工作浓度按照不同浓度的包被抗体和捕获抗原制备的反应板,以阳性对照血清od
450nm
值趋于稳定,且接近2时为包被抗体和捕获抗原的最佳使用量。根据表1中阳性血清的od值,确定捕获抗体1m5的最佳包被浓度为2μg/ml,抗原的最佳捕获量为0.5μg/ml;经摸索不同条件下包被抗体和捕获抗原最佳效果,最后确定抗体在2~8℃条件过夜包被,次日用pbst洗涤3次后,加抗原后置室温下孵育2h,在同上洗涤,使用含2%bsa和5%蔗糖的pbst溶液进行封闭,室温孵育1h或者2~8℃过夜,同上洗涤3次,吸干残液后密封保存于2~8℃条件下。
36.表 包被抗体和捕获抗原sva的最佳工作浓度(2)竞争抗体最佳工作浓度和反应条件按照生物素标记试剂盒说明书制备了生物素标记的sva抗体1m25,测定浓度后稀释了4个稀释度加入前述制备的反应板,50μl/孔,同时加入血清样本和pbs空白对照50μl/孔,分别置于室温和37℃条件下作用不同时间后,用pbst洗涤3次后,与streptavidin-hrp(1:30000)作用后加底物tmb显色,确定最佳反应时间后进行终止反应。以阳性和阴性对照血清od
450nm
值差异最大,且阴性对照血清od值约为2.0时的酶标抗体稀释度为最适工作浓度,即生物素标记竞争抗体1m25(浓度0.855mg/ml)按照1:20000稀释时为最佳工作浓度,反应条件为37℃下孵育30min(见表2)。
37.表2 竞争抗体的最佳工作浓度
(3)血清最佳稀释度和作用时间将3份阴性血清(n1~n3)和3份阳性血清(p1~p3)按不同稀释度和作用时间进行检测,结果见表3和表4。根据阴阳性血清的od值和阻断率,最终确定血清样本按1:10稀释,37℃条件下作用30min。
38.表3 不同稀释度血清的检测结果表4 血清样本的作用时间(4)elisa 方法临界值的确定通过检测血清背景清楚的样本,确定该竞争elisa方法的判定标准。根据非免疫健康猪血清与感染猪血清的pi值分布范围(见图4),结合roc曲线统计分析和youden's指数(见图5和6),确定该方法判断标准为阳性样本pi ≥ 45%、阴性样本pi《45%。敏感性为98.04%(93.13~99.65%),特异性为100%(99.18~100%)。
39.效果评价:(1)特异性试验为了确定该方法是否与临床上常见猪病毒prrsv、pcv2、pedv、csfv、fmdv、prv抗体阳性血清发生交叉反应,经检测结果表明pi低于45%(见图7)。因此,建立的 sva中和性抗体竞争 elisa方法与牛羊健康血清和其他6 种猪重要病毒病抗体阳性血清均无交叉反应,表明该方法具有良好的特异性。
40.(6)敏感性试验使用制备sva特异性单个b细胞时感染第5、7、15天的猪血清,感染25天后使用同样毒株灭活疫苗免疫后第2、6、30、35天的猪血清,与中和试验结果比较,进一步确定该方法的敏感性。根据细胞微量中和试验和本方法的检测结果(见图8和9),从感染后第5天就能检测到中和性抗体,并随着感染天数中和性抗体水平显著升高,感染24天未见中和性抗体下降,为了获得sva高致敏的b细胞,感染第25天使用同毒株灭活疫苗进行了超级量免疫,免疫第2天抗体阻断率有所下降,这可能是抗原与部分抗体发生了中和造成的,但是随后抗体水平发生了明显的剧增,直至2个月中和性抗体水平依然达到了1:8000以上,该方法检测的pi逼近了100%,可见为非常强的阳性血清。两种方法检测sva中和性抗体的结果一致,说明本研究建立的sva中和性抗体检测方法可靠,敏感性高的特点。
41.(7)重复性试验用三个批次1m5包被并捕获sva的反应板进行c-elisa试验,同时用同一批次的反应板在三个不同的时间点进行试验,每份样品重复三次,计算出阻断率,求平均值,并计算标准差和变异系数。从批内和批间的反应板检测样品表5 批内和批间的重复性检验结果注:a :阻断率;b:阻断率平均值;c:标准偏差;d :变异系数;样品1~3号为sva阳性血清,4~6号为sva阴性血清,7~9为sva免疫血清。
42.结果表明(见表5),各样品的阻断率基本一致,标准偏差小于10%,变异系数小于1%,说明该elisa 方法具有良好的重复性。
43.(8)稳定性试验判断该试剂盒检测能力是否稳定,最为关键的是制备的反应板是否稳定。将制备好的反应板置于37℃条件下进行破坏性试验,观察其稳定性,连续放置了7周,每周检测3份sva阳性血清、3份阴性血清,并用pbs设空白对照,分析阳性血清、阴性血清和空白对照孔吸光值od
450nm
平均值,测定反应板的稳定性。由图10统计分析结果可以看出,该方法制备的反应板非常稳定。
44.实施例4检测试剂盒的制备1.所述检测试剂盒包括:包被有猪a型塞内卡病毒中和性单克隆抗体1m5并捕获抗原的反应板,生物素标记
的猪a型塞内卡病毒中和性单克隆抗体1m25,阳性对照血清,阴性对照血清,血清稀释液,底物溶液,终止液,洗涤液。
45.2.试剂盒反应板的制备过程如下:(1)包被:用碳酸盐缓冲溶液(na2co
3 /nahco3,ph值9.6)稀释猪a型塞内卡病毒中和性单克隆抗体1m5至终浓度2μg/ml,然后加入酶标板中,每孔100μl,封口膜封口后于2-8℃条件下过夜包被;(2)捕获抗原:每孔加约300μl洗涤液pbst洗涤酶标板3次后,将实施例2制备的猪a型塞内卡病毒抗原使用pbs溶液稀释至 0.5μg/ml,按100μl/孔加入酶标板中,置室温下孵育2h后,同前洗涤3次;(3)封闭:用含2%bsa和5%蔗糖的pbst溶液作为封闭液,按100μl/孔加入,置室温孵育1h或者2~8℃过夜,同前洗涤3次,吸干残液,吹干酶标板后,加干燥剂密封,即为试剂盒反应板。
46.反应板2~8 ℃冷藏保存,每个试剂盒配装两块反应板。
47.3.生物素标记的单克隆抗体1m25的制备按如下程序进行:(1)使用截留量100 kda超滤管把猪a型塞内卡病毒中和性单克隆抗体1m25置换至pbs缓冲液中,3000 r/min离心10 min,得到抗体存储缓冲液;(2)按180 μl灭菌超纯水加入1 mg生物素的比例,将生物素充分振荡稀释溶解;按生物素稀释液:抗体存储缓冲液=1:10的体积比将稀释后的生物素加入抗体存储缓冲液中,具体为添加50 μl生物素稀释液至500μl抗体中,冰上孵育3h;(3)将加入生物素的抗体存储缓冲液装入透析袋中,用pbs溶液进行透析置换,以去除抗体中残留的咪唑和其他盐类物质,测定抗体浓度后加入等体积100%甘油,-70 ℃保存。
48.每个试剂盒配装1管, 300 μl/管。
49.4. pbst洗涤液(25
×
)制备于500 ml超纯水中加入nacl 200 g、kcl 5 g、na2hpo4•
12h2o 72.5 g、kh2po
4 5 g和12.5 ml吐温20,调ph值为7.4,补超纯水定容至1000 ml,高压灭菌(10 pa,15 min),室温存放备用;每盒配装1瓶,50 ml/瓶。
50.5.底物溶液单组份3, 3
ʹ
, 5, 5
ʹ-四甲基联苯胺(tmb)底物溶液为购买的商品化试剂(biofx),直接分装使用,每盒配装1瓶,25 ml/瓶。
51.6.终止液浓度为0.3 mol/l的h2so4溶液,利用超纯水稀释分析纯浓硫酸配制,每盒配装1瓶,25 ml/瓶。
52.7.阳性对照血清采自sva攻毒后45天康复猪,经检测sva中和性抗体为阳性,经无菌过滤后加防腐剂分装保存备用,每盒配装1管,0.5 ml/管。
53.8.阴性对照血清采自sva非免疫健康猪,经检测sva中和性抗体为阴性,经无菌过滤后加防腐剂分
装保存备用,每盒配装1管,0.5 ml/管。
54.9. 血清稀释液所述血清稀释液采用0.01mol/l的pbs(磷酸盐)缓冲液。
55.10.其他物品:一次性封板膜4片和1份使用说明书。
56.实施例5猪塞内卡病毒中和性抗体竞争elisa检测方法将2~8℃保存的试剂盒取出室温下平衡,然后按以下程序操作:(1)取出试剂盒反应板,每孔加入45μl血清稀释液,然后分别加入待测血清、阴性对照血清、阳性对照血清与作为空白对照的血清稀释液,其中,待测血清加1孔,阴性对照血清、阳性对照血清与作为空白对照的血清稀释液各加两孔,每孔5μl;然后,用血清稀释液按1∶100比例稀释浓度为4μg/ml的生物素标记的猪a型塞内卡病毒中和性单克隆抗体1m25,向反应板中每孔加入50μl经稀释的单克隆抗体1m25,轻振混匀,37℃作用30min;(2)用1
×
pbst洗涤液洗涤反应板5次,最后一次拍干;(3)用血清稀释液稀释辣根过氧化酶标记链菌素streptavidin-hrp,稀释比例1:30000,按100μl/孔每孔加入反应板,37℃孵育15min;然后pbst洗涤液洗反应板5次;(4)向反应板中每孔加入100μl的底物tmb溶液,37 ℃避光孵育10~15min;(5)向反应板中每孔加入100μl的终止液,轻振混匀,于10min内用酶标仪读450nm吸光值od 450nm
;(6)阻断率计算:阻断率(pi)=(1-样品od
450nm
值/空白对照od 450nm
值)
×
100%;(7)结果判定:是否存在sva中和性抗体,通过计算每个血清样品的pi值判定:pi值大于或等于45%,判为sva中和性抗体阳性;pi值小于45%,判为sva抗体阴性。
57.检测结果成立的条件:空白对照od
450nm
值-阳性对照od
450nm
值≥1.0,且阳性对照阻断率应不低于70%,阴性对照阻断率应小于25%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。