1.本发明属于神经科学领域;更具体地,本发明涉及一种灵长类药物成瘾性评估的方法与应用。
背景技术:
2.药物成瘾是一种慢性复发性脑疾病,以强迫性、失去控制地用药行为和反复发生的复吸行为为,主要特征。个体反复使用成瘾性物质将产生躯体和(或)精神依赖。药物成瘾已成为困扰人类健康和社会发展的重大公共卫生和社会问题。
3.药物成瘾性的科学评估,有助于预防药物滥用、实现合理用药,也是新药从基础研究转化至临床应用必不可少的一步。目前研究药物成瘾最有效的动物模型是自身给药模型,常用的模式动物是大、小鼠。由于啮齿类动物在药物成瘾相关脑区的解剖结构、投射环路、神经递质及受体系统等与灵长类存在明显差异,导致啮齿类动物模型在成瘾研究成果的推广和转化方面存在明显的局限性。非人灵长类动物在解剖结构、发育及功能上与人类神经系统高度相似。因此,非人灵长类动物自身给药模型是评估灵长类药物成瘾性的最佳模型。
4.但是,目前国内外尚缺乏标准的、被广泛接受的灵长类动物药物成瘾性评估的方法。本领域人员发现,开发此类方法的难点是多方面的,主要包括非人灵长类动物的习性不易于捉摸、使得一些研究模型难于获得稳定的结果;缺乏典型的、高效率的监测指标等。
5.综上,本领域亟待开发新型的用于非人灵长类动物药物成瘾性评估的方法,以期通过可控的、标准化的方式,进行非人灵长类动物的药物成瘾性评估,开发相对稳定可靠的评估技术。
技术实现要素:
6.本发明的目的在于提供一种灵长类药物成瘾性评估的方法与应用。
7.在本发明的第一方面,提供一种灵长类药物成瘾性评估的方法,所述方法包括:(1)提供灵长类药物成瘾性评估装置,所述装置包括:容纳受试动物的操作箱主体以及动物固定系统;所述操作箱主体中包括:交互模块,输入模块,输出模块,奖赏模块,监控模块,生命体征监测模块,记录-控制模块;所述交互模块用于与动物交互,包括交互面板,其上设置输入模块、输出模块、奖赏模块或监控模块的部分组件(动物交互相关组件);所述奖赏模块包括:固体奖赏子模块、液体奖赏子模块、自动给药子模块;(2)利用(1)的装置,对灵长类动物进行奖赏或给药,分析或评估(包括定性分析/评估或定量分析/评估)药物对动物的成瘾性情况。
8.在一个优选例中,所述方法以所述输入模块接收动物的行为信息。
9.在另一优选例中,所述方法以所述输出模块向动物传递刺激信号。
10.在另一优选例中,所述方法以所述奖赏模块给予动物奖赏。
11.在另一优选例中,所述方法以所述监控模块进行动物监控,较佳地包括监控动物
的行为和/或头面部表现。
12.在另一优选例中,所述方法以所述生命体征监测模块进行动物生命体征监测。
13.在另一优选例中,所述方法以所述记录-控制模块获取、记录、分析和/或传递所述输入模块、输出模块、奖赏模块、监控模块、生命体征监测模块的信息。
14.在另一优选例中,所述方法中,(2)中包括:(a)将动物置于(1)的装置的动物固定系统中,训练动物,建立其对输入模块的不同操作与获得固体奖赏物或液体奖赏物之间的相互关联,形成动物操作性反应条件反射;(b)利用自动给药子模块给药于动物,以药物替换奖赏模块中的固体奖赏物或液体奖赏物之一,观测动物的对于奖赏物和药物的反应,确定药物对动物的成瘾性。
15.在另一优选例中,所述液体包括果汁、糖水等。
16.在另一优选例中,所述固体奖赏物包括但不限于颗粒状、粉末状或丸状的食物。
17.在另一优选例中,所述输入模块包括压杆模块,其包括左压杆和右压杆,分别位于所述交互面板垂直中线左侧和右侧;在(a)中训练动物时,建立其对输入模块中左压杆和右压杆的不同操作与获得固体奖赏物或液体奖赏物之间的相互关联,形成动物操作性条件反射;在(b)中,以药物替换奖赏模块中的固体奖赏物或液体奖赏物之一后,观测动物对于左压杆和右压杆的操作变化,以确定其对于奖赏物和药物的反应;所述输入模块的左压杆与右压杆与记录-控制模块可操作性连通,传递压杆次数和单次按压时长数据。
18.在另一优选例中,所述压杆模块包括压杆盒、压杆板、微动开关、条形盒测力计,所述压杆盒设置于交互面板上,所述条形盒测力计和微动开关位于压杆盒内,所述压杆板穿过压杆盒的前壁伸入压杆盒内、与条形盒测力器及微动开关相联动,所述动物通过按压压杆板进而启动微动开关,通过条形盒测力计测量和调节所需按压力大小。
19.在另一优选例中,所述微动开关设置于微动开关托板上,所述微动开关托板位于压杆板的盒内部分的下方;所述微动开关与记录-控制模块可操作性连通,用于传递压杆次数和单次按压时长数据。
20.在另一优选例中,所述条形盒测力计轴下缘与所述微动开关之间的垂直距离用于调节压杆阻力大小,通过调节压杆阻力调节获取奖励难度;较佳地,其阻力大小可调范围为0-10n。
21.在另一优选例中,所述输出模块包括提示灯、喇叭、吹气(air-puff)模块;在(a)中训练动物时,建立其对输入模块中左压杆和右压杆的不同操作与获得固体奖赏物或液体奖赏物之间的相互关联的同时,还建立其对于提示灯、声音和/或空气流的相互关联;在(b)中,以药物替换奖赏模块中的固体奖赏物或液体奖赏物之一后,相应的提示灯、声音和/或空气流的相互关联性不变,或在保持关联性的情况下变化刺激形式,以让动物建立新奖励与新刺激之间的条件反射;较佳地,所述刺激形式包括(但不限于):提示灯闪烁频率、声音频率。
22.在另一优选例中,所述提示灯包括至少一左提示灯和至少一右提示灯、分置于所述交互面板垂直中线左侧和右侧,以及至少一上提示灯(较佳地其靠近交互面板的上缘);较佳地,所述左提示灯和右提示灯分别位于左压杆和右压杆的上方;更佳地,所述左提示灯和右提示灯的颜色不同(如选自红色或绿色);更佳地,当动物按压左压杆或右压杆至设定量时给予奖赏物或药物时,相应压杆上方的提示灯(左提示灯或右提示灯)亮起,当左提示
灯或右提示灯亮起时所述上提示灯关闭。
23.在另一优选例中,所述喇叭位于操作箱主体的内壁或交互面板上;较佳地,所述喇叭在动物获取奖赏物或药物时响起。
24.在另一优选例中,所述吹气(air-puff)模块位于操作箱主体的壁上,通过管道连通至位于操作箱主体内部的动物面部前;较佳地,其与所述记录-控制模块可操作性连通,控制向所述动物面部递送预设特定时长、速度和流量的空气流刺激;较佳地,所述空气流在动物获取奖赏物或药物时发生。
25.在另一优选例中,所述奖赏模块的固体奖赏子模块、液体奖赏子模块、自动给药子模块分别与所述记录-控制模块可操作性连通,控制对动物投喂固、液体奖励或自动进行药物给药。
26.在另一优选例中,所述固体奖赏子模块包含颗粒泵、管道与食槽,颗粒泵位于操作箱主体外部,通过管道连通位于操作箱主体内的食槽;较佳地,其与所述记录-控制模块可操作性连通,控制对动物递送预设固体食物量或药物颗粒量;较佳地,所述食槽位于交互面板上。
27.在另一优选例中,所述液体奖赏子模块包含位于操作箱主体外部的注射泵/蠕动泵,其通过管道连通至位于操作箱主体内部的动物口部;较佳地,其与所述记录-控制模块可操作性连通,控制向所述动物递送预设液体量。
28.在另一优选例中,所述自动给药子模块包含位于操作箱主体外部的注射泵/蠕动泵,其通过管道连通至位于操作箱主体内部的动物体;较佳地,其与所述记录-控制模块可操作性连通,控制向所述动物注射预设量的药;更佳地,所述注射为静脉注射。
29.在另一优选例中,所述监控模块包括:行为监控子模块和头面部监控子模块;较佳地,在(a)中训练动物时或在(b)中以药物替换奖赏模块中的固体奖赏物或液体奖赏物之一后,包括对动物进行行为监控和头面部监控;较佳地,还包括通过监控动物行为和头面部表情,决定方法的继续与否、奖赏物给予量和/或药物给予量。
30.在另一优选例中,所述行为监控子模块位于操作箱主体内。
31.在另一优选例中,所述头面部监控子模块位于交互面板上。
32.在另一优选例中,述行为监控子模块或头面部监控子模块为摄像头。
33.在另一优选例中,所述生命体征监测模块包括测温模块(如红外线测温仪),其与所述记录-控制模块可操作性连通,输送动物体温信息;较佳地,在(a)中训练动物时或在(b)中以药物替换奖赏模块中的固体奖赏物或液体奖赏物之一后,还包括进行动物的体温测定。
34.在另一优选例中,所述测温模块位于操作箱主体外,通过位于操作箱主体壁上的探头孔实施测温。
35.在另一优选例中,所述输入模块包括触摸屏模块,其位于交互面板上;较佳地,所述触摸屏模块位于交互面板中央;所述触摸屏模块与记录-控制模块可操作性连通,传递动物对于触摸屏的操作信息。
36.在另一优选例中,所述交互模块的交互面板上设置:输入模块中的压杆模块和触摸屏模块、输出模块中的提示灯、奖赏模块中的固体奖赏子模块及监控模块的头面部监控子模块。
37.在另一优选例中,所述的操作箱主体内,还包括选自下组的组件:照明组件;温度探头,用于测量和/或监控操作箱主体内温度;和/或,换风口。
38.在另一优选例中,所述动物固定系统为灵长类动物座椅组件;较佳的,该座椅组件限制动物每次操作仅能进行某侧前肢操作同侧压杆(不能操作对侧压杆);较佳地该组件包括一个支架,两侧侧板,前、后面板及一底座,它们之间相互围接,形成适于灵长类动物的座位空间;较佳地,通过所述固定动物双侧前肢臂部的固定组件,实现动物某侧前肢仅能触碰同侧压杆。
39.在另一优选例中,(a)中,使用固定比率(fixed ratio,fr)强化程序训练动物。
40.在另一优选例中,(b)中,还包括制作动物对药物的剂量-反应曲线。
41.在另一优选例中,所述的给药包括给予不同剂量梯度的药物。
42.在另一优选例中,所述液体奖赏模块的奖赏物为非人灵长类动物喜爱的液体食物(较佳地为果汁),且(b)中以药物替换赏模块中的固体奖赏物;较佳地,当动物对于药物的选择百分比高于所述液体奖赏时(即选择药物的百分比超过50%时),进行待测药物成瘾性的分析或评估。
43.在另一优选例中,所述的分析或评估包括(但不限于):自身给药强化训练;药物奖赏效应评估;药物行为失控效应评估;药物渴求程度评估;药物耐受效应评估;药物有害性使用程度评估。
44.在另一优选例中,所述灵长类动物为非人灵长类动物;较佳地,所述灵长类动物包括(但不限于):猴、长臂猿、猩猩;更佳地,所述的猴包括选自下组的猴:恒河猴、食蟹猴、日本猕猴、绿猴、绒猴、松鼠猴。
45.在另一优选例中,所述支架由四根垂直向上分别紧固于基座四角的圆/方形立柱,以及多根横向圆/方管拼接而成,相连圆/方管之间通过一可拆卸的扣夹器(管与管之间的连接组件)固定。
46.在另一优选例中,所述座椅组件还包括用于固定所述灵长类动物颈部的上面板,其通过夹持器(连接组件)安装在所述支架顶部。
47.在另一优选例中,所述座椅组件还包括一固定动物双侧前肢臂部的固定组件,其通过扣夹器固定在支架中部,且位于所述灵长类动物座位组件上方。
48.在另一优选例中,所述侧板和面板通过可拆卸夹持器(连接组件)固定于座位组件。
49.在另一优选例中,所述前、后面板为单开门。
50.在另一优选例中,所述的操作箱主体的内底部,还设置有滑轨,所述动物固定系统设置有与之相匹配的滑轮,从而所述动物固定系统可沿着滑轨移动。
51.在另一优选例中,所述操作箱主体的箱体的长500~1200mm,宽为500~1200mm,高为1000~2000mm;较佳地长为650~1000mm,宽为650~1000mm,高为1200~1800mm;更佳地长为700~900mm,宽为700~900mm,高为1350~1650mm。
52.在另一优选例中,所述操作箱主体包括至少一扇操作箱门;较佳地,其设置为单门;更佳地,该操作箱门正对于所述交互面板的正面。
53.在另一优选例中,所述的操作箱主体的底部还设置有滑轮,从而操作箱主体可被移动。
54.在另一优选例中,所述的操作箱主体包括隔音材料,或其由隔音材料制备而成。
55.在本发明的另一方面,提供所述的灵长类药物成瘾性评估的方法的应用,包括但不限于用于:灵长类动物自身给药强化训练;灵长类动物药物奖赏效应评估;灵长类动物药物行为失控效应评估;灵长类动物药物渴求程度评估;灵长类药物耐受效应评估;灵长类药物有害性使用程度评估;和/或,灵长类动物条件反射训练。
56.本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
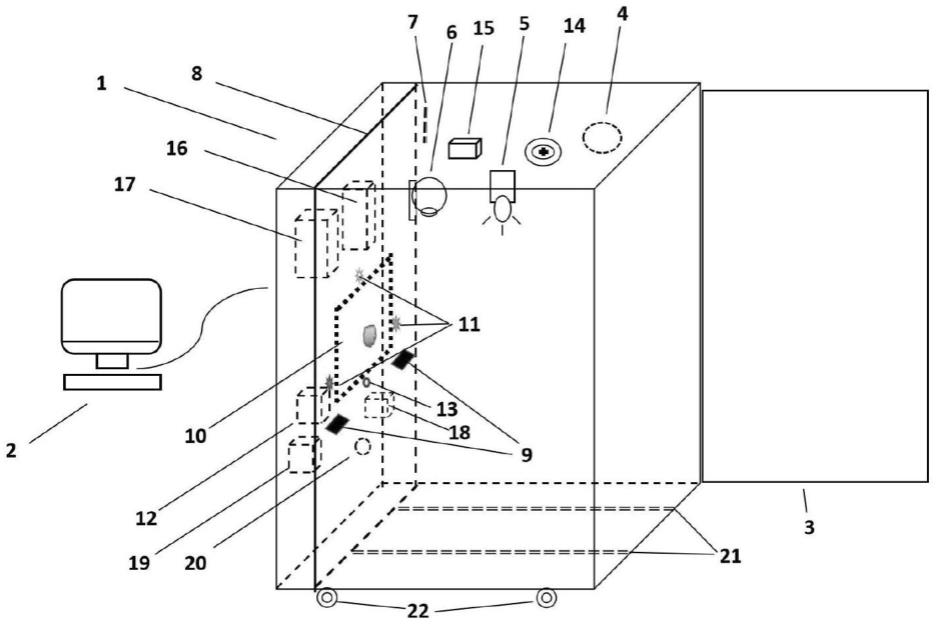
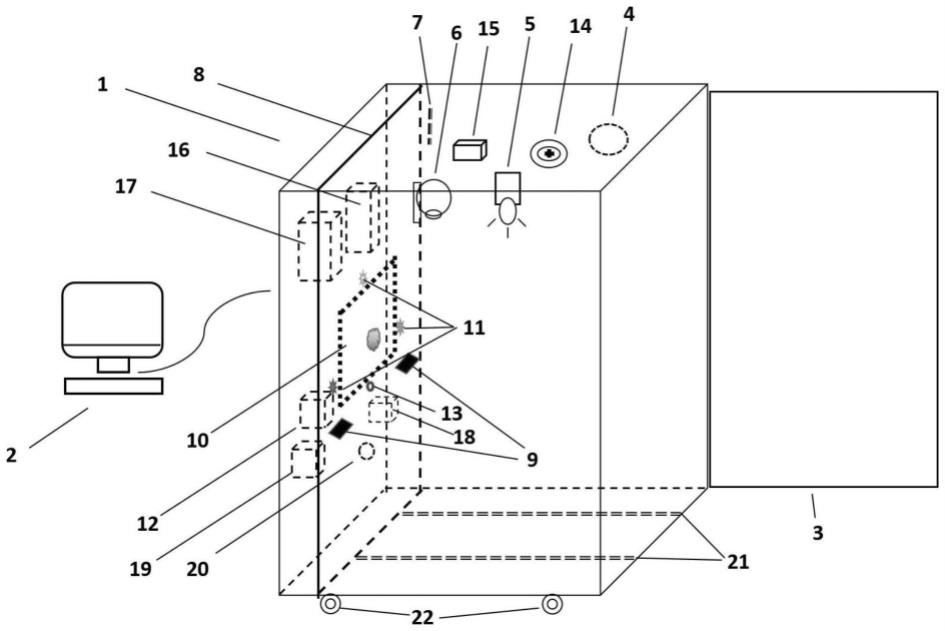
57.图1、本发明的方法所运用的灵长类动物成瘾性评估装置的一个实施例的透视图。
58.图2、本发明交互面板一个实施例的结构示意图。
59.图3、本发明压杆模块一个实施例的结构示意图。
60.图4、本发明的方法所运用的灵长类动物成瘾性评估装置的一个实施例的前视图。
61.图5、本发明的方法所运用的灵长类动物成瘾性评估装置的一个实施例的后视图。
62.图6a~j、本发明实施例2食蟹猴对甲基苯丙胺成瘾性评估的结果。
63.图7a~j、本发明实施例3恒河猴对甲基苯丙胺成瘾性评估的结果。
64.图8a~c、本发明实施例4食蟹猴对生理盐水成瘾性评估的结果。图中,mg/kg/inj、ug/kg/inj指每kg动物体重每次注射的mg或ug量。
65.图9a~c、本发明实施例5恒河猴对生理盐水成瘾性评估的结果。图中,mg/kg/inj、ug/kg/inj指每kg动物体重每次注射的mg或ug量。
66.各附图标记说明如下:1-操作箱主体,2-记录-控制模块(计算机记录与控制模块),3-操作箱门,4-换风口,5-照明组件(如照明灯),6-行为监控子模块(如摄像头),7-温度探头,8-交互面板,9-压杆模块,10-触摸屏模块,11-提示灯,12-固体奖赏子模块,13-头面部监控子模块,14-喇叭(蜂鸣器),15-吹气(air-puff)模块,16-液体奖赏子模块,17-自动给药子模块,18-食槽,19-测温模块(如红外线测温仪),20-探头孔(如红外线探头孔),21-滑轨,22-滑轮,23-压杆盒,24-压杆板,25-微动开关,26-条形盒测力计,27-微动开关托板。
具体实施方式
67.本发明人经过深入的研究,揭示了一种用于灵长类动物药物成瘾性评估的方法,通过设计含有交互模块、输入模块、输出模块、奖赏模块、监控模块、生命体征监测模块以及记录-控制模块的装置,利用该装置分析和评估灵长类动物药物成瘾性。本发明人经过针对的灵长类动物的深入研究观察,将各个组件进行有机地组合设置、分配于合适的位置,从而可实现客观、稳定、准确的动物药物成瘾性评估。
68.如本发明所用,所述的“操作性连通”是指属于本发明的装置(评估体系)中的两种或多种元件(组件)之间可以实现互通,如实现信息传递、信号发送和接收、信号反馈、信号存储、数据加工/分析等,实现有序运行。例如,可通过电缆实现所述“操作性连通”。
69.如发明所用,所述的“灵长类动物”包括非人灵长类动物;较佳的包括选自下组的动物:猴,长臂猿、猩猩;较佳地,所述的猴包括选自下组的猴:恒河猴、食蟹猴、日本猕猴、绿
猴、绒猴、松鼠猴。
70.如本发明所用,所述的“动物交互相关组件”是指适于集成于所述交互面板上的,便于与动物互动的本发明的装置中的组件;较佳地,其包括:输入模块中的压杆模块和触摸屏模块、输出模块中的提示灯、奖赏模块中的固体奖赏子模块和/或监控模块的头面部监控子模块。
71.药物成瘾性评估的装置
72.本发明供一种评估灵长类动物药物成瘾性的装置,所述装置包括交互模块,输入模块,输出模块,奖赏模块,监控模块,生命体征监测模块以及记录-控制模块;较佳地,所述装置还包括适用于灵长类动物的动物固定系统。
73.(1)灵长类动物自身给药系统组件
74.本发明的装置包括灵长类动物自身给药系统组件,该组件包括操作箱主体、交互模块、输入模块、输出模块、记录-控制模块(较佳地为计算机记录-控制模块)、奖赏模块、监控模块与生命体征监测模块。
75.本发明的操作箱主体的内部用于容纳灵长类动物,内部设有测试动物行为、认知等的实验器材。所述的操作箱主体可设置为至少包含一扇操作箱门。在本发明的优选方式中,所述其操作箱门为单开门设计,该设计相对于多门和/或多开门设计在结构上更简单,成本低廉,隔音效果更好,能够有效减少外界对实验的干扰。
76.在本发明的优选方式中,本发明的操作箱主体的箱体壁设有换风口,内部装有照明组件(如照明灯)、行为监控模块(摄像头)和温度探头,以监控和调控箱内温度,为所述灵长类动物提供舒适的实验环境。
77.本发明人经过研究观测非人灵长类动物的生活习性,设计了适宜于非人灵长类动物的操作箱主体尺寸。在本发明的优选方式中,所述操作箱主体的箱体的长500~1200mm,宽为500~1200mm,高为1000~2000mm;较佳地长为650~1000mm,宽为650~1000mm,高为1200~1800mm;更佳地为长700~900mm,宽为700~900mm,高为1350~1650mm。这样的内部空间可有效地避免灵长类动物因空间问题引发的焦虑、紧张、不安情绪,可获得较为理想、稳定的实验测试结果。
78.在本发明的优选方式中,本发明的操作箱主体包含有隔音材料,或者主要由隔音材料制备获得。
79.本发明所述的交互模块用于实现所述灵长类动物与灵长类动物自身给药系统组件之间交互,包括交互面板上的实验器材和箱主体内的实验器材,该模块可通过电缆与记录-控制模块相连。在本发明的优选方式中,所述交互面板位于所述操作箱主体的远离箱门的面(即箱门正对面)。在本发明的优选方式中,面板材质可以为不锈钢材料。
80.在本发明的优选方式中,本发明所述的交互面板上设有输入模块中的压杆模块和触摸屏模块、输出模块中的提示灯、奖赏模块中的固体奖子模块、监控模块中的头面部监控子模块。交互面板上的实验器材可通过电缆与记录-控制模块相连。
81.在本发明的优选方式中,输入模块包括压杆模块和触摸屏模块。所述压杆模块包括左压杆和右压杆,分别位于交互面板垂直中线偏左侧和偏右侧。所述压杆模块包括压杆盒、压杆板、微动开关、条形盒测力计与微动开关托板。优选地,所述压杆盒通过安装(例如通过螺栓安装)于所述交互面板,所述条形盒测力计通过安装(例如通过螺栓安装)于所述
压杆盒,所述压杆板通过条形盒测力计安装于所述压杆盒内,并与所述微动开关相连。所述条形盒测力计能够实现所述压杆板的复位,所述压杆板部分露出于交互面板,所述压杆板露出部分位于所述箱体内,供所述灵长类动物按压。优选地,所述微动开关托板通过安装(例如通过螺栓安装)于所述压杆盒内,位于所述压杆板下方。优选地,所述微动开关安装于所述微动开关托板,且与记录-控制模块(较佳地为计算机记录与控制模块)相连,用于传递压杆次数和单次按压时长。所述条形盒测力计轴下缘与所述微动开关之间的垂直距离可用于调节压杆阻力大小,其阻力大小可调范围为0-10n,该范围依据非人灵长类动物前肢力量强弱设定。通过调节压杆阻力调节获取奖励难度,不仅有助于压杆操作的学习,还将提供一种直观且可靠的量化获取奖励动机的指标。本发明人首次进行这种压杆阻力可调功能设计,这在本领域中没有报导和披露。
82.在本发明的优选方式中,所述触摸屏模块位于交互面板中央且在所述双侧压杆之间。本发明人首次将所述触摸屏模块应用于非人灵长类动物的成瘾性评估,与应用压杆模块的单一输入模块的评估方式相比,这一设计增添了新的基于视觉的直观输入方式,该输入方式实现了视觉刺激样式和空间位置的多样化,与压杆模块组合可实现任务复杂度和难度的调节。同时基于触屏模块设计的经典实验范式可用于动态监测受试动物的认知能力与运动能力状态,该方面对于动物行为检测非常重要,尤其涉及毒品等能够引起急性认知和运动能力发生改变的成瘾性物质的摄入。
83.所述触摸屏是本发明人针对灵长类动物进行深入行为分析后优化设置的。所述触摸屏输出的视觉刺激具有空间位置和样式多样化的优势。所述触摸屏模块的运用,与不设置触摸屏模块的装置相比具有显著的优势,其满足了当前灵长类动物研究面临的输出多样化的实际需求。
84.在本发明的优选方式中,所述输出模块包括提示灯、喇叭、吹气(air-puff)模块。所述的输出模块也可配合以触摸屏模块的视觉刺激输出。
85.在本发明的优选方式中,所述提示灯包含位于交互面板上竖直中线偏左的左提示灯与偏右的右提示灯、竖直中线上且靠近所述交互面板上缘的上提示灯。所述提示灯用于实现对灵长类动物的光刺激;优选地,左、右提示灯分别位于所述左、右压杆正上方,例如为红或绿色中的一种,但两者颜色不同;应理解,只要左右颜色不同,其他颜色的灯也是可以的;上提示灯位于所述触摸屏模块的正上方,其一般与左右提示灯颜色不同,优选地为白色。
86.所述喇叭的位置没有特别的限制,可以位于操作箱壁,也可以位于交互面板,用于输出声音刺激。
87.在本发明的优选方式中,所述吹气(air-puff)模块位于操作箱外,可产生特定时长、速度和流量的空气流,通过连接管道实现对所述灵长类动物面部的气流刺激。
88.本发明所述的记录-控制模块位于所述箱体外,可通过电缆与实验仪器相连,用于记录输入模块、监控模块和生命体征监测模块的数据数据输入、同时控制奖赏模块与输出模块的运行。
89.在本发明的优选方式中,所述的奖赏模块包含固体奖赏子模块、液体奖赏子模块、自动给药(如静脉注射)子模块,可通过电缆与记录-控制模块相连,实现控制对所述灵长类动物进行投喂固、液体奖励或自动给予药物。优选地,所述固体奖赏子模块包含颗粒泵、管
道与食槽,颗粒泵和管道,位于所述箱体外部,并由所述的记录-控制模块控制,向所述灵长类动物递送预设固体食物量或药物颗粒量。优选地,所述食槽位于交互面板中央。优选地,所述液体奖赏子模块包含注射泵/蠕动泵与管道,位于所述箱体外部,注射泵/蠕动泵通过管道连至所述灵长类动物口部,并由所述的记录-控制模块控制,向所述灵长类动物递送预设液体量。所述自动给药子模块包含注射泵/蠕动泵与管道,位于所述箱体外部,注射泵/蠕动泵通过管道连至所述灵长类动物体内,并由所述的记录-控制模块控制,向所述灵长类动物体力注射预设药量。本发明中,首次提出运用该三种奖赏子模块来进行动物的训练和评估,可实现多元化的动物训练以及给药评估。
90.在本发明的优选方式中,所述的监控模块包括位于箱体壁上的行为监控子模块和位于交互面板上的头面部监控子模块。优选地,所述行为监控子模块用于监控所述灵长类动物的所有行为,所述头面部监控子模块用于监控所述灵长类动物头部运动和面部表情(反映情绪,如快乐、愤怒、悲哀、恐惧等)。头部运动和面部表情的数据不仅作为实验数据的一部分,还将作为控制实验进程的重要参数,如实验过程中监测到所述灵长类动物面部出现恐惧表情,记录-控制模块将立即终止该次实验程序。
91.在本发明的优选方式中,生命体征监测模块位于所述操作箱外部,包括测温模块(如红外线测温仪)和所述操作箱壁上的探头孔。所述测温模块(如红外线测温仪)可实时动态监测所述灵长类动物的体温,该数据不仅作为实验数据的一部分,还将作为控制实验进程的重要参数,如所述灵长类动物在实验过程中体温超出正常值范围时,记录-控制模块将立即终止该次实验程序。本发明首次提出生命体征监测模块的运用,将之有机结合于整体的评估体系中。
92.在本发明的优选方式中,所述自动给药模块还包括管线,所述管线一端位于所述灵长类动物的体表皮肤内,另一端与所述注射泵连接。
93.在本发明的优选方式中,所述操作箱体底部设有滑轨,可用于推入或拉出所述灵长类动物固定系统,所述操作箱有滑轮。
94.(2)动物固定系统
95.本发明的装置中,还包括动物固定系统,以配合进行动物的训练和/或动物的用药评估。
96.在本发明的优选方式中,所述动物固定系统为座椅组件,其包括一个支架、两侧板、前后面板及一底座围接而成的可供所述灵长类动物进入其中的座位空间。优选地,所述支架由四根垂直向上分别紧固于基座四角的圆/方形立柱,以及多根横向圆/方管拼接而成,相连圆/方管之间通过一可拆卸的扣夹器(管与管之间的连接组件)固定。优选地,所述座椅组件还包括用于固定所述灵长类动物颈部的上面板,其通过所述夹持器安装在所述支架顶部。优选地,所述座椅组件还包括一灵长类动物座位组件,其通过所述扣夹器固定在支架下部,且位于所述基座上方。优选地,所述座椅组件还包括一所述灵长类动物双侧前肢臂部固定组件,其通过所述扣夹器固定在支架中部,且位于所述座位组件上方。优选地,所述侧板和面板通过可拆卸夹持器固定于所述座位组件;所述前、后面板为单开门,分别用于所述灵长类动物进出和实验人员对所述灵长类动物背部进行实验相关操作。本发明所述灵长类动物座椅组件结构简单、牢固,安装、调节与拆卸方便,可对所述灵长类动物颈部的固定高度和倾斜角度进行调整、可对所述灵长类动物前肢臂部进行三个方向(前后、左右及上
下)调整,可对所述灵长类动物座位的高度进行调整,允许所述灵长类动物前肢自由运动以方便压杆、触屏等实验操作,允许实验人员对所述灵长类动物背部进行操作,进而便于安全可靠地进行相关实验研究。所述灵长类动物座椅组件通过所述操作箱体底部设有的滑轨推入或拉出所述操作箱。所述灵长类动物座椅组件具有良好的通用性,适用于各种年龄与体型的灵长类动物的科学研究实验。
97.评估药物成瘾性的方法
98.本发明提供了一种灵长类药物成瘾性评估的方法,包括:提供前述的灵长类药物成瘾性评估装置;以及,利用该装置对灵长类动物进行奖赏或给药,分析或评估(包括定性分析/评估或定量分析/评估)药物对动物的成瘾性情况。
99.作为本发明的一种优选方式,所述评估药物成瘾性的方法包含以下述步骤:
100.(1)建立灵长类动物对自然奖赏物的操作性条件反射:灵长类动物置于灵长类动物座椅组件并置于所述灵长类动物自身给药系统组件内,训练其按压交互面板上的左、右侧压杆,当按压左侧压杆时给予一次固体奖赏食物奖励(固体颗粒,例如外形与药丸类似),同时呈现声音和红/绿灯光的刺激;当按压右侧压杆时给予一次果汁奖励,同时呈现声音和绿/红灯光的刺激。记录每种奖励的选择百分比与双侧压杆的按压次数。当出现日选择比例稳定后(判断标准后述),进入下一步。
101.(2)评估待测药品的奖赏效应:a.设置待测药品的剂量梯度(一般选择5个梯度,第一个剂量为零,第三个剂量为该药品在临床或动物研究中的最佳使用剂量,第二个为第三个的三分之一,第四个为第三个的三倍,第五个为第四个的三倍);b.将待测药物替代原先固体或液体奖励(若待测药物为固体药丸,选择右侧压杆关联,即按压右侧压杆特定次数(即fr值,一般选择20或30)时,将给予药丸而非原先的果汁作为奖赏物;同理若药物为液体,则选择左侧压杆与之关联,若药物需静脉给药,则随机选择左或右侧压杆与之关联);c.每只灵长类动物每天的最大测试时长为120分钟,包括五个时长均为20分钟的block(block数量等于药物的剂量梯度数目),每个block内最大奖励次数为10,当达到最大奖励时,该block将被提前结束,block之间间隔5分钟。五个block之间的区别仅在于单次给予待测药物的剂量不同,block1到block5药物剂量递增,单个block内剂量不变;d.允许灵长类动物在待测药物和自然奖赏物之间自由选择,并统计各自的选择百分比及压杆次数;e.当满足连续三天选择百分比和压杆次数的数据变化在20%范围里时,该步骤结束。
102.(3)待测药物成瘾行为的评估:a)评估行为失控效应:a.当所述步骤(2)中不同剂量待测药物的选择百分比有差异,且最大值超过50%的情况下,进入步骤(3),且选择压杆频率最高的剂量(即所述灵长类动物愿意为该剂量付出更多的压杆操作)作为评估其行为失控效应的使用剂量;b.继续让灵长类动物在待测药物和自然奖赏物之间自由选择,此时单日测试时间仍为最长120分钟,但不分block,且单次给药剂量恒定,最大奖励次数为85(根据药物的安全剂量上线来定),达到该次数时当日测试结束;c.该阶段trial之间的间隔设为1分钟;d.fr值根据前一日某侧压杆按压次数与获得相应奖励次数比值来计算,fr初始值可根据实际情况人为设定,当日fr不变;e.每日120分钟的检测前增加一个10分钟的渴求检测任务,此10分钟内,所述灵长类动物压杆操作不会产生任何奖励和声、光刺激等输出,但压杆行为仍被记录。f.评估结束条件:当fr值超过其急速增大之前三天平均值的三倍时,或fr值呈现“s”形增加时将提前终止评估,该阶段最大时长为4周。b)评估戒断反应(渴求程
度):检测任务范式与步骤(3a)相似,区别仅在于:fr值恒定与无任何奖励和声、光等输出。通过灵长类动物对待测药物关联侧压杆的按压次数来量化其对待测药物的渴求程度。c)评估复吸行为:检测小剂量待测药物的摄入与线索(cue)的呈现是否能引起灵长类动物重新按压待测药物关联侧压杆及按压量。d)评估有害性使用:通过记录所述灵长类动物体重的变化,来反映待测药物的有害性使用。
103.(4)量化灵长类对待测药物的成瘾性:分别对所述奖赏效应、行为失控效应、渴求程度、复吸行为和有害性使用进行量化。其中,a.奖赏效应分值根据最高响应剂量对应的选择百分比数值来计算,0-25%记为0分,25%-50%记为1分,50%-75%记为2分,75%-100%记为3分。b.行为失控效应分值根据单日用药量增加幅度与fr值增加幅度计算,检测结束时单日用药剂量为步骤(3)起始三天剂量平均值的1-1.25倍记为0分,1.25-2倍记为1分,2-3倍记为2分,3倍以上记为3分;检测结束时fr值为其急速增大之前三天平均值的1-1.25倍记为0分,1.25-2倍记为1分,2-3倍记为2分,3倍以上记为3分。c.渴求程度分值根据戒断期压杆次数与最后一次用药当日的压杆次数比值来计算,1倍以下记为0分,1-1.5倍记为1分,1.5-2倍记为2分,2倍以上记为3分。d.复吸行为分值根据复吸行为检测期间压杆次数与最后一次用药当日的压杆次数比值来计算,0-0.25倍记为0分,0.25-0.5倍记为1分,0.5-0.75倍记为2分,0.75倍以上记为3分。e.有害性使用方面,体重不降低或降低10%以内记为0分,10-15%记为1分,15-20%记为2分,20%以上记为3分。上述指标总分18分(0为无成瘾性,1-6分为低成瘾性,7-12分为中成瘾性,13-18为高成瘾性)。
104.(5)评估流程控制:当奖赏效应分值低于2分时,终止评估;失控效应评估阶段,当fr值增加项得分为3分时,或fr值呈现“s”形增加时终止该阶段,经入下一阶段,该阶段最大时长为4周;戒断期检测时间点为强制停药第2天(根据药物半衰期确定)和第15天,计算两天的平均值。
105.所述灵长类药物成瘾性的评估方法通过创造性地使用非人灵长类动物模型替代传统使用的啮齿类动物模型来评估灵长类的药物成瘾性,解决了当前对灵长类成瘾性评估的迫切需求;具有操作简单、结果可靠的优点,同时具有良好的通用性,可用于不同类型(如固体药物、液体药物)和不同给药方式(如口服、静脉注射)药物的成瘾性评估,将有助于预防药物滥用、实现合理用药、推进新药从基础研究转化至临床应用。
106.本发明方法的应用
107.本发明还提供了上述灵长类药物成瘾性评估方法的用途。本发明动物模型能提供包括但不限于下述几种动物训练方案:
108.(1)灵长类动物自身给药强化训练
109.灵长类动物坐在所述灵长类动物座椅组件上完成自身给药任务,灵长类动物按压左、右侧压杆中一侧压杆特定次数即可获得一次奖赏物(奖赏物可以是固体食物、液体果汁与水等自然奖赏物,也可以是成瘾性药物如海洛因、冰毒),按压另外一侧压杆则不能获取奖赏物,给予奖赏物的同时呈现声、光刺激。开始时灵长类动物随机压杆,经过一段时间的训练,灵长类动物奖赏物关联侧压杆的按压有效率和频率都大大提升,由此反映奖赏物的强化效应。训练期间,需要设置单次给予奖赏物的剂量梯度以便全面评估该奖赏物的强化效应,同时须限定单日最大奖赏物获取次数以防止药物的过量摄入。训练成功的标准为:灵长类动物的单日奖赏物获取次数和压杆量在连续3天内变化在
±
20%范围内。当日训练任
务终止条件:a.达训练任务最大时长,如120分钟;b.提前达到最大奖赏次数;c.连续30分钟无任何压杆操作;d.灵长类动物面部出现恐惧等情绪;e.灵长类动物体温超出正常范围。
110.(2)评估灵长类动物药物奖赏效应
111.首先,建立灵长类动物对自然奖赏物的操作性条件反射:灵长类动物置于所述灵长类动物座椅组件并置于所述灵长类动物自身给药系统组件内,训练其按压所述交互面板上的左、右侧压杆,当按压左侧压杆时给予一次食物奖励(固体颗粒,外形与药丸类似),同时呈现声音和红/绿灯光的刺激;当按压右侧压杆时给予一次果汁奖励,同时呈现声音和绿/红灯光的刺激。记录每种奖励的选择百分比与双侧压杆的按压次数。其次,当出现日选择比例稳定后(判断标准后述),进行以下步骤:a.设置待测药品的剂量梯度(一般选择5个梯度,第一个剂量为零,第三个剂量为该药品在临床或动物研究中的最佳使用剂量,第二个为第三个的三分之一,第四个为第三个的三倍,第五个为第四个的三倍);b.将待测药物替代原先固体或液体奖励(若待测药物为固体药丸,选择右侧压杆关联,即按压右侧压杆固定次数(即固定比率(fr)值)时,将给予一次药丸而非原先的果汁作为奖赏物;同理若药物为液体,则选择左侧压杆与之关联,若药物需静脉给药,则随机选择左或右侧压杆与之关联);c.每只灵长类动物每天的最大测试时长为120分钟,包括五个时长均为20分钟的block(block数量等于药物的剂量梯度数目),每个block内最大奖励次数为10次,当达到最大奖励时,该block将被提前结束,两个block之间间隔5分钟。五个block之间的区别仅在于单次给予待测药物的剂量不同,block1到block5药物剂量递增,单个block内剂量不变;d.允许灵长类动物在待测药物和自然奖赏物之间自由选择,并统计各自的选择百分比,及压杆次数;e.当满足连续三天选择百分比和压杆次数的数据变化在20%范围里时,评估结束。
112.(3)评估灵长类动物药物行为失控效应
113.a.绘制待测药物的剂量反应曲线,选择压杆频率最高的剂量(即所述灵长类动物愿意为该剂量付出更多的压杆操作)作为评估其行为失控效应的使用剂量;b.让灵长类动物在待测药物和自然奖赏物之间自由选择,此时单日最大训练时长为120分钟,最大奖励次数根据药物的安全剂量上线来定,达到最大值时当日训练结束;c.该阶段trial之间的间隔设为1分钟;d.fr值根据前一日某侧压杆按压次数与获得相应奖励次数比值来计算,fr初始值可根据实际情况人为设定,当日fr不变;e.每日120分钟的检测前增加一个10分钟的渴求检测任务,此10分钟内,所述灵长类动物压杆操作不会产生任何奖励和声、光刺激等输出,但压杆行为仍被记录。评估结束条件:当fr值超过其急速增大之前三天平均值的三倍时,或fr值呈现“s”形增加时将提前终止评估,否则直至最大时长(4周)。
114.(4)评估灵长类动物药物渴求程度
115.重复摄入待测药物一段时期后,停止给药,进行灵长类动物对待测药物渴求程度的评估。评估任务与所述评估灵长类动物药物行为失控效应的方法类似,区别仅在于:fr值恒定且压杆操作不会获得任何奖赏物与药物、及呈现声、光等输出。通过灵长类动物对待测药物关联侧压杆的按压量来量化其对待测药物的渴求程度。
116.(5)评估灵长类药物耐受效应
117.在所述灵长类动物自身给药强化训练、评估灵长类动物药物奖赏效应或评估灵长类动物药物行为失控效应的过程中记录单日待测药物摄入量,并分析其随时间的变化规律,以评估灵长类对待测药物的耐受效应。
118.(6)评估灵长类药物有害性使用程度
119.在所述灵长类动物自身给药强化训练、评估灵长类动物药物奖赏效应或评估灵长类动物药物行为失控效应的过程中记录单日待测药物摄入量及当日体重与进食量,并分析其随时间的变化规律,回归分析体重/进食量与累计待测药物摄入量之间的联系,以评估灵长类对待测药物的有害性使用程度。
120.利用本发明的方法,能进行包括但不限于以下几种成瘾相关的动物训练方案:
121.(1)各类成瘾类药物,如吗啡、海洛因、可卡因、甲基苯丙胺等灵长类动物的成瘾模型的训练,包括自身给药、觅药行为的强弱等;
122.(2)各类成瘾类药物,如吗啡、海洛因、可卡因、甲基苯丙胺等灵长类动物的成瘾模型的戒断训练,观察急/慢性戒断症状等;
123.(3)各类成瘾类药物,如吗啡、海洛因、可卡因、甲基苯丙胺等灵长类动物的成瘾模型的消退训练,包括自然消退、药物/物理干预等手段的加速/减慢消退等;
124.(4)各类成瘾类药物,如吗啡、海洛因、可卡因、甲基苯丙胺等灵长类动物的成瘾模型的复吸,包括药物诱发、线索诱发、环境诱发等。
125.利用本发明能进行以下几种临床在用相关药物的动物训练方案:
126.(1)对能够口服(固体药丸、药片等、液体药液)或静脉给药的抗生素类药物,评估其在灵长类的成瘾性、耐受性等;
127.(2)对能够口服(固体药丸、药片等、液体药液)或静脉给药的心血管系统疾病、神经/精神类疾病、免疫系统疾病、泌尿系统疾病、呼吸系统疾病、消化系统疾病、血液系统疾病、生殖系统疾病、肿瘤疾病等治疗药物,评估其在灵长类的成瘾性、耐受性等;
128.(3)对能够口服(固体药丸、药片等、液体药液)或静脉给药的镇静催眠类药物,评估其在灵长类的成瘾性、耐受性等。
129.利用本发明能进行以下几种临床转化前相关药物的动物训练方案:
130.(1)对能够口服(固体药丸、药片等、液体药液)或静脉给药的抗生素类药物,评估其在灵长类的成瘾性、耐受性等;
131.(2)对能够口服(固体药丸、药片等、液体药液)或静脉给药的心血管系统疾病、神经/精神类疾病、免疫系统疾病、泌尿系统疾病、呼吸系统疾病、消化系统疾病、血液系统疾病、生殖系统疾病、肿瘤疾病等治疗药物,评估其在灵长类的成瘾性、耐受性等;
132.(3)对能够口服(固体药丸、药片等、液体药液)或静脉给药的镇静催眠类药物,评估其在灵长类的成瘾性、耐受性等。
133.利用本发明能进行以下几种食品相关的动物训练方案:评估灵长类对固体、液体食物的成瘾性、耐受性等。
134.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
135.本发明的描述中,需要理解的是,术语“中心”、“横向”、“纵向”、“前”、“后”、“左”、“右”、“上”、“下”、“垂直”、“水平”、“顶”、“底”、“内”、“外”等指示方位或位置关系为基于附图所示的方位或位置关系,仅是为了方便描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的构造和操作,因此不能理解为对本发明保护
范围的限制。
136.实施例1、灵长类动物药物成瘾性评估的装置
137.本发明中,用于进行实验测试的灵长类动物药物成瘾性评估的装置如图1、图4~图5,该装置包括可容纳受试动物的操作箱主体1;所述操作箱主体1中包括:交互模块,输入模块,输出模块,奖赏模块,监控模块,生命体征监测模块,基于计算机的记录-控制模块2。所述交互模块包括交互面板8,其上设置:输入模块中的压杆模块9和触摸屏模块10,输出模块中的提示灯11,奖赏模块中的固体奖赏子模块12,及监控模块的头面部监控子模块13;设置于所述交互模块上的多个子模块与记录-控制模块2通过电缆连通。
138.所述输入模块包括压杆模块9,其包括左压杆和右压杆,分别位于所述交互面板垂直中线左侧和右侧。所述压杆模块包括压杆盒23、压杆板24、微动开关25、条形盒测力计26,所述压杆盒设置于交互面板上,所述条形盒测力计26和微动开关25位于压杆盒23内,所述压杆板24穿过压杆盒23的前壁伸入压杆盒23内、与条形盒测力计26及微动开关相联动,所述动物通过按压压杆板24进而启动微动开关25,通过条形盒测力计26测量和调节所需按压力大小(图2~图3)。所述微动开关25设置于微动开关托板27上,所述微动开关托板27位于压杆板24的盒内部分的下方;所述微动开关25与记录-控制模块2通过电缆连通,用于传递压杆次数和单次按压时长数据。所述条形盒测力计轴下缘与所述微动开关之间的垂直距离用于调节压杆阻力大小,通过调节压杆阻力调节获取奖励难度。
139.所述输入模块包括触摸屏模块10,其位于交互面板8中央、压杆模块9的左压杆和右压杆之间。
140.所述输出模块包括提示灯11、喇叭14、吹气(air-puff)模块15。所述提示灯包括一左提示灯和一右提示灯、分置于所述交互面板垂直中线左侧和右侧,以及一上提示灯,其靠近交互面板的上缘。所述左提示灯和右提示灯分别位于左压杆和右压杆的上方。所述左提示灯和右提示灯的颜色不同,分别为红色、绿色,所述上提示灯为白色。
141.所述喇叭14位于操作箱主体1的内壁。
142.所述吹气(air-puff)模块15位于操作箱主体1的壁上,可向操作箱主体1内通入特定时长、速度和流量的空气流。
143.所述奖赏模块包含固体奖赏子模块12、液体奖赏子模块16、自动给药子模块17。较佳地,其与所述记录-控制模块2通过电缆连通,控制对动物投喂固、液体奖励或自动进行药物给药。所述固体奖赏子模块12包含颗粒泵、管道与食槽,颗粒泵位于操作箱主体1外部,通过管道连通位于操作箱主体内1的食槽18;较佳地,其与所述记录-控制模块2通过电缆连通,控制对动物递送预设固体食物量或药物颗粒量,所述食槽位于交互面板8上。所述液体奖赏子模块16包含位于操作箱主体1外部的注射泵/蠕动泵,其通过管道连通至位于操作箱主体1内外部的动物口部,其与所述记录-控制模块2通过电缆连通,控制向所述动物递送预设液体量。所述自动给药子模块17包含位于操作箱主体外部的注射泵/蠕动泵,其通过管道连通至位于操作箱主体1内部的动物体,其与所述记录-控制模块2通过电缆连通,控制向所述动物注射预设量的药。
144.所述监控模块包括:行为监控子模块6和头面部监控子模块13。所述行为监控子模块6位于操作箱主体1内,所述头面部监控子模块13位于交互面板8上。所述行为监控子模块或头面部监控子模块为摄像头。
145.所述生命体征监测模块包括测温模块(红外线测温仪)19,其与所述记录-控制模块2通过电缆连通,输送动物体温信息。所述测温模块19位于操作箱主体1外,通过位于操作箱主体1壁上的探头孔20实施测温。
146.所述的操作箱主体1内,还包括组件:照明组件(照明灯)5;温度探头7,用于测量和/或监控操作箱主体内温度;换风口4。
147.所述的操作箱主体1的内底部,还设置有滑轨21,可与设置有滑轮的动物固定系统相匹配,从而便于所述动物固定系统可沿着滑轨移动。
148.所述操作箱主体1包括一扇操作箱门3,其为单门,该操作箱门正对于所述交互面板的正面。
149.所述操作箱主体的箱体的长800mm,宽为800mm,高为1500mm。
150.所述的操作箱主体1的底部还设置有滑轮22,从而操作箱主体1可被移动。
151.所述的操作箱主体1包围有隔音材料,以避免内部动物受到干扰。
152.本发明的操作箱主体1中,还包括灵长类动物座椅组件;其包括一个支架,两侧侧板,前、后面板及一底座,它们之间相互围接,形成适于灵长类动物的座位空间。所述支架由四根垂直向上分别紧固于基座四角的圆/方形立柱,以及多根横向圆/方管拼接而成,相连圆/方管之间通过一可拆卸的扣夹器(管与管之间的连接组件)固定;所述座椅组件还包括用于固定所述灵长类动物颈部的上面板,其通过夹持器安装在所述支架顶部;所述座椅组件还包括一固定动物双侧前肢臂部的固定组件,其通过扣夹器固定在支架中部,且位于所述灵长类动物座位组件上方;所述侧板和面板通过可拆卸夹持器固定于座位组件;所述前、后面板为单开门。
153.实施例2、食蟹猴的训练及其用药(甲基苯丙胺)评估
154.本实施例中,以食蟹猴为动物模型,利用前述实施例1的装置进行训练及其用药评估。
155.1、建立食蟹猴对自然奖赏物的操作性条件反射
156.利用食蟹猴对环境探索的本能、对果汁的喜爱与压杆操作后立即得到一次自然奖赏物的程序设定,建立食蟹猴的压杆操作与自然奖赏物之间的关联即操作性条件反射(operant conditioning)。食蟹猴坐在灵长类动物座椅组件上完成任务训练,两侧前肢有同等机会按压杠杆,但所述灵长类动物座椅组件的特殊结构决定了食蟹猴某侧前肢只能按压同侧压杆,而无法按压对侧压杆。当食蟹猴按压左侧压杆时给予一次食物奖励(固体颗粒,外形与药丸类似),当按压右侧压杆时给予一次果汁(液体)奖励。记录每种奖励的选择百分比与双侧压杆的按压次数。
157.该阶段的行为训练使用固定比率(fixed ratio,fr)强化程序。训练过程中,本发明人逐步把fr值增加至某一固定值,此处以30为例(递增序列:1,3,5,8,13,20,30)。每周训练5天,每天训练2小时,提前终止训练任务的条件:自然奖赏物给予次数达最大值(85次)与连续30min无压杆操作。单个trial的流程与参数设定如下:trial开始时白色室灯亮起,若食蟹猴左侧压杆的次数达规定值,立即给予一次固体奖励,奖励给予期间室灯灭,左侧压杆正上方红色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),奖励给完trial结束。若食蟹猴右侧压杆的次数达规定值,立即给予一次果汁奖励(2ml),果汁给予期间室灯灭,右侧压杆正上方绿色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各
500ms),果汁给完trial结束。接着进入60s time-out阶段,该阶段和奖励给予期间食蟹猴的压杆操作不计作获取果汁的有效压杆次数,但仍被软件记录。
158.满足以下两个条件时可认为食蟹猴对自然奖赏物的操作性条件反射建立成功,方开始后续实验:1)在fr30时,奖励给予量连续3天稳定(数据变化在均值的10%范围内);2)奖励给予和time-out阶段无压杆。
159.对多批次的食蟹猴进行实验,部分食蟹猴的学习曲线如图6a。结果显示,利用本发明的装置和方法,食蟹猴能够在平均10~15天时间内建立稳定的操作性条件反射。
160.图6b为30min内食蟹猴的压杆次数随时间的累计图。结果显示,利用本发明的装置和方法,食蟹猴能够在平均10~15天时间内达到以下目标:1)trial开始后奖赏物关联侧压杆的高频按压;2)奖励给予和time-out阶段的无按压操作。
161.2、评估甲基苯丙胺对食蟹猴的奖赏效应
162.(a)食蟹猴静脉插管手术实验
163.根据人类使用待测药物的方式,确定食蟹猴的摄入方式。此处以静脉给药为例进行阐述。在动物股或颈静脉长期埋置滞留管并将注射端头引至背部皮下,以便长期给药。手术过程简要描述如下:全身麻醉状态下,于股静脉或颈静脉上方切开皮肤2cm,分离静脉血管,穿刺针插入血管,然后将植入式静脉插管沿穿刺针导入静脉血管约8-10cm,固定血管和静脉插管。将静脉插管另一端沿皮下穿行至背部,切开3cm皮肤,连接静脉导管和注射腔体,缝合两处切口。术中实时监测实验动物生理指标。术后护理:手术后由专业动物技术人员进行日常护理,术后前三天,每天都注射一次到两次的镇痛药以及抗生素,第七天进行第一次大清创,对手术部位及周围进行清理,并拆除缝合线,七天以后保证2天一次频率的清创工作。待术后完全恢复后,方可继续。
164.(b)绘制食蟹猴甲基苯丙胺的剂量-反应曲线
165.根据前期测试结果,将甲基苯丙胺的单次注射剂量设为0、3.2、10、32、100μg/kg共5个剂量梯度,并将甲基苯丙胺替代原先固体奖励即与左侧压杆关联。每只食蟹猴每天的最大测试时长为120分钟,包括五个时长均为20分钟的block,每个block内最大奖励次数为10,当达到最大奖励时,该block将被提前结束,block之间间隔5分钟。五个block之间的区别仅在于单次给予待测药物的剂量不同,block1到block5药物剂量递增,单个block内剂量不变。单个trial的流程与参数设定如下:trial开始时白色室灯亮起,若食蟹猴左侧压杆的次数达规定值,立即给予一次甲基苯丙胺,给予期间室灯灭,左侧压杆正上方红色led灯闪烁(不同甲基苯丙胺剂量对应的灯闪烁频率不同,当剂量为“0μg/kg”时开与关各500ms,当剂量为“3.2μg/kg”时开与关各400ms,当剂量为“10μg/kg”时开与关各300ms,当剂量为“32μg/kg”时开与关各200ms,当剂量为“100μg/kg”时开与关各100ms)和蜂鸣器断续发声(不同甲基苯丙胺剂量对应的发声频率不同,当剂量为“0μg/kg”时开与关各500ms,当剂量为“3.2μg/kg”时开与关各400ms,当剂量为“10μg/kg”时开与关各300ms,当剂量为“32μg/kg”时开与关各200ms,当剂量为“100μg/kg”时开与关各100ms),奖励给完trial结束。若食蟹猴右侧压杆的次数达规定值,立即给予一次果汁奖励(2ml),果汁给予期间室灯灭,右侧压杆正上方绿色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),果汁给完trial结束。允许灵长类动物在待测药物和自然奖赏物之间自由选择,并统计各自的选择百分比,及压杆次数;e.当满足连续三天选择百分比和压杆次数的数据变化在20%范围里时,该步骤
结束。根据食蟹猴对不同剂量梯度的压杆行为及单日摄药量,绘制剂量-反应曲线。并根据该曲线,选择响应最大的剂量作为后续评估用剂量。
166.图6c为五种甲基苯丙胺剂量条件下食蟹猴对甲基苯丙胺和果汁的选择百分比图。结果显示,利用本发明的装置和方法,能够全面、客观和准确地评估出甲基苯丙胺对食蟹猴的奖赏效应值(相对于果汁)。
167.图6d为五种甲基苯丙胺剂量条件下食蟹猴对甲基苯丙胺关联侧压杆的按压频率图。结果显示,利用本发明的装置和方法,能够在食蟹猴上客观、准确地评估出甲基苯丙胺的剂量效应,并获得最大响应剂量。
168.3、待测药物成瘾行为的评估
169.(a)评估行为失控效应
170.a.当上述步骤2中不同剂量甲基苯丙胺的选择百分比有差异,且最大值超过50%的情况下,进入本步骤3,且选择压杆频率最高的剂量作为评估其行为失控效应的使用剂量;
171.b.继续让食蟹猴在甲基苯丙胺和果汁之间自由选择,此时单日测试时间仍为最长120分钟,但不分block,且单次给药剂量恒定,最大奖励次数为根据药物的安全剂量上线来定,达到该次数时当日测试结束;
172.c.该阶段trial之间的间隔设为1分钟;
173.d.fr值根据前一日某侧压杆按压次数与获得相应奖励次数比值来计算,fr初始值可根据实际情况人为设定,当日fr不变;
174.e.每日120分钟的检测前增加一个10分钟的渴求检测任务,此10分钟内,食蟹猴压杆操作不会产生任何奖励和声、光刺激等输出,但压杆行为仍被记录。
175.f.评估结束条件:当fr值超过其急速增大之前三天平均值的三倍时,或fr值呈现“s”形增加时将提前终止评估,该阶段最大时长为4周。
176.(b)评估戒断反应(渴求程度):
177.检测任务范式与步骤3(a)相似,区别仅在于:fr值恒定与无任何奖励和声、光等输出。通过食蟹猴对待测药物关联侧压杆的按压次数来量化其对甲基苯丙胺的渴求程度。
178.(c)评估复吸行为
179.检测小剂量甲基苯丙胺的摄入与线索(cue)的呈现是否能引起食蟹猴重新按压甲基苯丙胺关联侧压杆及按压量。
180.(d)评估有害性使用:
181.通过记录食蟹猴体重的变化,来反映待测药物的有害性使用。
182.图6e为食蟹猴对甲基苯丙胺和果汁选择百分比随时间的变化图。结果显示,利用本发明的装置和方法,食蟹猴能够在平均3~5天内达到客观、稳定的甲基苯丙胺选择百分比。
183.图6f为食蟹猴单日甲基苯丙胺摄入量随时间的变化图。结果显示,利用本发明的装置和方法,能够客观、准确地评估食蟹猴对甲基苯丙胺使用量的失控效应。
184.图6g为fr值随训练天数的变化图。结果显示,利用本发明的装置和方法,能够客观、准确地评估出食蟹猴对甲基苯丙胺使用行为的失控效应。
185.图6h为戒断期食蟹猴对甲基苯丙胺的渴求程度图。结果显示,利用本发明的装置
和方法,能够客观、准确地评估出食蟹猴对甲基苯丙胺的渴求程度。
186.图6i为食蟹猴对甲基苯丙胺的复吸数据图。结果显示,利用本发明的装置和方法,能够客观、准确地评估出食蟹猴对甲基苯丙胺的复吸行为。
187.图6j食蟹猴体重随甲基苯丙胺摄入时长的变化图。结果显示,利用本发明的装置和方法,能够客观、准确地评估食蟹猴对甲基苯丙胺的有害性使用效应。
188.4、量化食蟹猴对甲基苯丙胺的成瘾性
189.分别对所述奖赏效应、行为失控效应、渴求程度、复吸行为和有害性使用进行量化。
190.(a)奖赏效应
191.奖赏效应分值根据甲基苯丙胺的最高响应剂量对应的选择百分比数值来计算,具体为0-25%记为0分,25%-50%记为1分,50%-75%记为2分,75%-100%记为3分)。本实施例中该项分值为3分。
192.(b)行为失控效应
193.行为失控分值根据单日用药量增加幅度与fr值增加幅度计算,检测结束时单日用药剂量为步骤3起始三天剂量平均值的1-1.25倍记为0分,1.25-2倍记为1分,2-3倍记为2分,3倍以上记为3分。据此标准,本实施例中该项分值为3分;检测结束时fr值为其急速增大之前三天平均值的1-1.25倍记为0分,1.25-2倍记为1分,2-3倍记为2分,3倍以上记为3分,本实施例中该项分值为3分。
194.(c)渴求程度
195.渴求程度分值根据戒断期压杆次数与最后一次用药当日的压杆次数比值来计算,1倍以下记为0分,1-1.5倍记为1分,1.5-2倍记为2分,2倍以上记为3分。本实施例中该项分值为2分。
196.(b)复吸行为
197.复吸分值根据复吸行为检测期间压杆次数与最后一次用药当日的压杆次数比值来计算,0-0.25倍记为0分,0.25-0.5倍记为1分,0.5-0.75倍记为2分,0.75倍以上记为3分。本实施例中该项分值为3分。
198.(c)有害性使用
199.有害性使用方面,体重不降低或降低10%以内记为0分,10-15%记为1分,15-20%记为2分,20%以上记为3分。本实施例中该项分值为2分。
200.上述指标总分18分(0为无成瘾性,1-6分为低成瘾性,7-12分为中成瘾性,13-18为高成瘾性)。本实施例中上述指标分值为16分,属高成瘾性。
201.实施例3、恒河猴的训练及其用药(甲基苯丙胺)评估
202.本实施例中,以恒河猴为动物模型,利用前述实施例1的装置进行训练及其用药评估。
203.1、建立恒河猴对自然奖赏物的操作性条件反射
204.利用恒河猴对环境探索的本能、对果汁的喜爱与压杆操作后立即得到一次自然奖赏物的程序设定,建立恒河猴的压杆操作与自然奖赏物之间的关联即操作性条件反射。恒河猴坐在灵长类动物座椅组件上完成任务训练,两侧前肢有同等机会按压杠杆,但所述灵长类动物座椅组件的特殊结构决定了恒河猴某侧前肢只能按压同侧压杆,而无法按压对侧
压杆。当恒河猴按压左侧压杆时给予一次食物奖励(固体颗粒,外形与药丸类似),当按压右侧压杆时给予一次果汁奖励。记录每种奖励的选择百分比与双侧压杆的按压次数。
205.该阶段的行为训练使用固定比率(fr)强化程序。训练过程中本发明人逐步把fr值增加至某一固定值,此处以30为例(递增序列:1,3,5,8,13,20,30)。每周训练5天,每天训练2小时,提前终止训练任务的条件:自然奖赏物给予次数达最大值(85次)与连续30min无压杆操作。单个trial的流程与参数设定如下:trial开始时白色室灯亮起,若恒河猴左侧压杆的次数达规定值,立即给予一次固体奖励,奖励给予期间室灯灭,左侧压杆正上方红色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),奖励给完trial结束。若恒河猴右侧压杆的次数达规定值,立即给予一次果汁奖励(2ml),果汁给予期间室灯灭,右侧压杆正上方绿色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),果汁给完trial结束。接着进入60s time-out阶段,该阶段和奖励给予期间恒河猴的压杆操作不计作获取果汁的有效压杆次数,但仍被软件记录。满足以下两个条件时方开始后续实验:1)在fr30时,奖励给予量连续3天稳定(数据变化在均值的10%范围内);2)奖励给予和time-out阶段无压杆。
206.对多批次的恒河猴进行实验,部分恒河猴的学习曲线如图7a。结果显示,利用本发明的装置和方法,恒河猴能够在约7~16天时间内建立稳定的操作性条件反射。
207.图7b为30min内食蟹猴的压杆次数随时间的累计图。结果显示,利用本发明的装置和方法,恒河猴猴能够在平均7~16天时间内达到以下目标:1)trial开始后奖赏物关联侧压杆的高频按压;2)奖励给予和time-out阶段的无按压操作。
208.2、评估甲基苯丙胺对恒河猴的奖赏效应
209.(a)恒河猴静脉插管手术实验
210.根据人类使用待测药物的方式,确定恒河猴的摄入方式。此处以静脉给药为例进行阐述。在动物股或颈静脉长期埋置滞留管并将注射端头引至背部皮下,以便长期给药。该手术由经验丰富的兽医完成。手术过程简要描述如下:全身麻醉状态下,于股静脉或颈静脉上方切开皮肤2cm,分离静脉血管,穿刺针插入血管,然后将植入式静脉插管沿穿刺针导入静脉血管约8-10cm,固定血管和静脉插管。将静脉插管另一端沿皮下穿行至背部,切开3cm皮肤,连接静脉导管和注射腔体,缝合两处切口。术中实时监测实验动物生理指标。术后护理:手术后将有专业动物技术人员进行日常护理,术后前三天,每天都会注射一次到两次的镇痛药以及抗生素,第七天进行第一次大清创,对手术部位及周围进行清理,并拆除缝合线,七天以后保证2天一次频率的清创工作。待术后完全恢复后,方可继续。
211.(b)绘制恒河猴甲基苯丙胺的剂量-反应曲线
212.根据前期实验数据,将甲基苯丙胺的单次注射剂量设为0、3.2、10、32、100μg/kg共5个剂量梯度,并将甲基苯丙胺替代原先固体奖励即与左侧压杆关联。每只恒河猴每天的最大测试时长为120分钟,包括五个时长均为20分钟的block,每个block内最大奖励次数为10,当达到最大奖励时,该block将被提前结束,block之间间隔5分钟。五个block之间的区别仅在于单次给予待测药物的剂量不同,block1到block5药物剂量递增,单个block内剂量不变。单个trial的流程与参数设定如下:trial开始时白色室灯亮起,若恒河猴左侧压杆的次数达规定值,立即给予一次甲基苯丙胺,给予期间室灯灭,左侧压杆正上方红色led灯闪烁(不同甲基苯丙胺剂量对应的灯闪烁频率不同,当剂量为“0μg/kg”时开与关各500ms,当
剂量为“3.2μg/kg”时开与关各400ms,当剂量为“10μg/kg”时开与关各300ms,当剂量为“32μg/kg”时开与关各200ms,当剂量为“100μg/kg”时开与关各100ms)和蜂鸣器断续发声(不同甲基苯丙胺剂量对应的发声频率不同,当剂量为“0μg/kg”时开与关各500ms,当剂量为“3.2μg/kg”时开与关各400ms,当剂量为“10μg/kg”时开与关各300ms,当剂量为“32μg/kg”时开与关各200ms,当剂量为“100μg/kg”时开与关各100ms),奖励给完trial结束。若恒河猴右侧压杆的次数达规定值,立即给予一次果汁奖励(2ml),果汁给予期间室灯灭,右侧压杆正上方绿色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),果汁给完trial结束。允许灵长类动物在待测药物和自然奖赏物之间自由选择,并统计各自的选择百分比,及压杆次数;e.当满足连续三天选择百分比和压杆次数的数据变化在20%范围里时,该步骤结束。根据恒河猴对不同剂量梯度的压杆行为及单日摄药量,绘制剂量-反应曲线。并根据该曲线,选择相应最大的剂量作为后续评估用剂量。
213.图7c为五种甲基苯丙胺剂量条件下恒河猴对甲基苯丙胺和果汁的选择百分比图。结果显示,利用本发明的装置和方法,能够全面、客观和准确地评估出甲基苯丙胺对恒河猴的奖赏效应值(相对于果汁)。
214.图7d为五种甲基苯丙胺剂量条件下恒河猴对甲基苯丙胺关联侧压杆的按压频率图。结果显示,利用本发明的装置和方法,能够在恒河猴上客观、准确地评估出甲基苯丙胺的剂量效应,并获得最大响应剂量。
215.3、待测药物成瘾行为的评估
216.(a)评估行为失控效应
217.a.当上述步骤2中不同剂量甲基苯丙胺的选择百分比有差异,且最大值超过50%的情况下,进入本步骤3,且选择压杆频率最高的剂量作为评估其行为失控效应的使用剂量;
218.b.继续让恒河猴在甲基苯丙胺和果汁之间自由选择,此时单日测试时间仍为最长120分钟,但不分block,且单次给药剂量恒定,最大奖励次数为根据药物的安全剂量上线来定,达到该次数时当日测试结束;
219.c.该阶段trial之间的间隔设为1分钟;
220.d.fr值根据前一日某侧压杆按压次数与获得相应奖励次数比值来计算,fr初始值可根据实际情况人为设定,当日fr不变;
221.e.每日120分钟的检测前增加一个10分钟的渴求检测任务,此10分钟内,恒河猴压杆操作不会产生任何奖励和声、光刺激等输出,但压杆行为仍被记录;
222.f.评估结束条件:当fr值超其急速增大之前三天平均值的三倍时,或fr值呈现“s”形增加时将提前终止评估,该阶段最大时长为4周。
223.a)评估戒断反应(渴求程度):
224.检测任务范式与步骤3(a)相似,区别仅在于:fr值恒定与无任何奖励和声、光等输出。通过恒河猴对待测药物关联侧压杆的按压次数来量化其对甲基苯丙胺的渴求程度。
225.b)评估复吸行为:
226.检测小剂量甲基苯丙胺的摄入与线索(cue)的呈现是否能引起恒河猴重新按压甲基苯丙胺关联侧压杆及按压量。
227.c)评估有害性使用:
228.通过记录恒河猴体重的变化,来反映待测药物的有害性使用。
229.图7e为恒河猴对甲基苯丙胺和果汁选择百分比随时间的变化图。结果显示,利用本发明的装置和方法,恒河猴能够在平均3~8天内达到客观、稳定的甲基苯丙胺选择百分比。
230.图7f为恒河猴单日甲基苯丙胺摄入量随时间的变化图。结果显示,利用本发明的装置和方法,能够客观、准确地评估恒河猴对甲基苯丙胺使用量的失控效应。
231.图7g为fr值随训练天数的变化图。结果显示,利用本发明的装置和方法,能够客观、准确地评估出恒河猴对甲基苯丙胺使用行为的失控效应。
232.图7h为戒断期恒河猴对甲基苯丙胺的渴求程度图。结果显示,利用本发明的装置和方法,能够客观、准确地评估出恒河猴对甲基苯丙胺的渴求程度。
233.图7i为恒河猴对甲基苯丙胺的复吸数据图。结果显示,利用本发明的装置和方法,能够客观、准确地评估出恒河猴对甲基苯丙胺的复吸行为。
234.图7j恒河猴体重随甲基苯丙胺摄入时长的变化图。结果显示,利用本发明的装置和方法,能够客观、准确地评估恒河猴对甲基苯丙胺的有害性使用效应。
235.3、量化恒河猴对甲基苯丙胺的成瘾性
236.分别对所述奖赏效应、行为失控效应、渴求程度、复吸行为和有害性使用进行量化。
237.a)奖赏效应
238.奖赏效应分值根据甲基苯丙胺的最高响应剂量对应的选择百分比数值来计算,具体为0-25%记为0分,25%-50%记为1分,50%-75%记为2分,75%-100%记为3分)。本实施例中该项分值为3分。
239.b)行为失控效应
240.行为失控分值根据单日用药量增加幅度与fr值增加幅度计算,检测结束时单日用药剂量为步骤3起始三天剂量平均值的1-1.25倍记为0分,1.25-2倍记为1分,2-3倍记为2分,3倍以上记为3分。据此标准,本实施例中该项分值为0分;检测结束时fr值为其急速增大之前三天平均值的1-1.25倍记为0分,1.25-2倍记为1分,2-3倍记为2分,3倍以上记为3分,本实施例中该项分值为3分。
241.c)渴求程度
242.渴求程度分值根据戒断期压杆次数与最后一次用药当日的压杆次数比值来计算,1倍以下记为0分,1-1.5倍记为1分,1.5-2倍记为2分,2倍以上记为3分。本实施例中该项分值为2分。
243.d)复吸行为
244.复吸分值根据复吸行为检测期间压杆次数与最后一次用药当日的压杆次数比值来计算,0-0.25倍记为0分,0.25-0.5倍记为1分,0.5-0.75倍记为2分,0.75倍以上记为3分。本实施例中该项分值为3分。
245.e)有害性使用
246.有害性使用方面,体重不降低或降低10%以内记为0分,10-15%记为1分,15-20%记为2分,20%以上记为3分。本实施例中该项分值为2分。
247.上述指标总分18分(0为无成瘾性,1-6分为低成瘾性,7-12分为中成瘾性,13-18为
高成瘾性)。本实施例中上述指标分值为13分,属高成瘾性。
248.实施例4、食蟹猴的训练及其用药(生理盐水)评估
249.本实施例中,以食蟹猴为动物模型,利用前述实施例1的装置进行训练及其用药(生理盐水)评估。
250.1、建立食蟹猴对自然奖赏物的操作性条件反射
251.利用食蟹猴对环境探索的本能、对果汁的喜爱与压杆操作后立即得到一次自然奖赏物的程序设定,建立食蟹猴的压杆操作与自然奖赏物之间的关联即操作性条件反射。食蟹猴坐在灵长类动物座椅组件上完成任务训练,两侧前肢有同等机会按压杠杆,但所述灵长类动物座椅组件的特殊结构决定了食蟹猴某侧前肢只能按压同侧压杆,而无法按压对侧压杆。当食蟹猴按压左侧压杆时给予一次食物奖励(固体颗粒,外形与药丸类似),当按压右侧压杆时给予一次果汁奖励。记录每种奖励的选择百分比与双侧压杆的按压次数。
252.该阶段的行为训练使用固定比率(fr)强化程序。训练过程中本发明人逐步把fr值增加至某一固定值,此处以30为例(递增序列:1,3,5,8,13,20,30)。每周训练5天,每天训练2小时,提前终止训练任务的条件:自然奖赏物给予次数达最大值(85次)与连续30min无压杆操作。单个trial的流程与参数设定如下:trial开始时白色室灯亮起,若食蟹猴左侧压杆的次数达规定值,立即给予一次固体奖励,奖励给予期间室灯灭,左侧压杆正上方红色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),奖励给完trial结束。若食蟹猴右侧压杆的次数达规定值,立即给予一次果汁奖励(2ml),果汁给予期间室灯灭,右侧压杆正上方绿色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),果汁给完trial结束。接着进入60s time-out阶段,该阶段和奖励给予期间食蟹猴的压杆操作不计作获取果汁的有效压杆次数,但仍被软件记录。
253.满足以下两个条件时方开始后续实验:1)在fr30时,奖励给予量连续3天稳定(数据变化在均值的10%范围内);2)奖励给予和time-out阶段无压杆。
254.2、评估生理盐水对食蟹猴的奖赏效应
255.(a)食蟹猴静脉插管手术实验
256.根据人类使用待测药物的方式,确定食蟹猴的摄入方式。此处以静脉给药为例进行阐述,若为口服或其他摄药方式可略过此步。在动物股或颈静脉长期埋置滞留管并将注射端头引至背部皮下,以便长期给药。该手术由经验丰富的兽医完成。手术过程简要描述如下:全身麻醉状态下,于股静脉或颈静脉上方切开皮肤2cm,分离静脉血管,穿刺针插入血管,然后将植入式静脉插管沿穿刺针导入静脉血管约8-10cm,固定血管和静脉插管。将静脉插管另一端沿皮下穿行至背部,切开3cm皮肤,连接静脉导管和注射腔体,缝合两处切口。术中实时监测实验动物生理指标。术后护理:手术后将有专业动物技术人员进行日常护理,术后前三天,每天都会注射一次到两次的镇痛药以及抗生素,第七天进行第一次大清创,对手术部位及周围进行清理,并拆除缝合线,七天以后保证2天一次频率的清创工作。待术后完全恢复后,方可继续。
257.(b)绘制食蟹猴生理盐水的剂量-反应曲线
258.根据前期测试结果,将生理盐水的单次注射剂量设为0、0.1、0.3、1、3mg/kg共5个剂量梯度,并将生理盐水替代原先固体奖励即与左侧压杆关联。每只食蟹猴每天的最大测试时长为120分钟,包括五个时长均为20分钟的block,每个block内最大奖励次数为10,当
达到最大奖励时,该block将被提前结束,block之间间隔5分钟。五个block之间的区别仅在于单次给予待测药物的剂量不同,block1到block5药物剂量递增,单个block内剂量不变。单个trial的流程与参数设定如下:trial开始时白色室灯亮起,若食蟹猴左侧压杆的次数达规定值,立即给予一次生理盐水,给予期间室灯灭,左侧压杆正上方红色led灯闪烁(不同生理盐水剂量对应的灯闪烁频率不同,当剂量为“0mg/kg”时开与关各500ms,当剂量为“0.1mg/kg”时开与关各400ms,当剂量为“0.3mg/kg”时开与关各300ms,当剂量为“1mg/kg”时开与关各200ms,当剂量为“3mg/kg”时开与关各100ms)和蜂鸣器断续发声(不同生理盐水剂量对应的发声频率不同,当剂量为“0mg/kg”时开与关各500ms,当剂量为“0.1mg/kg”时开与关各400ms,当剂量为“0.3mg/kg”时开与关各300ms,当剂量为“1mg/kg”时开与关各200ms,当剂量为“3mg/kg”时开与关各100ms),奖励给完trial结束。若食蟹猴右侧压杆的次数达规定值,立即给予一次果汁奖励(2ml),果汁给予期间室灯灭,右侧压杆正上方绿色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),果汁给完trial结束。允许灵长类动物在待测药物和自然奖赏物之间自由选择,并统计各自的选择百分比,及压杆次数;e.当满足连续三天选择百分比和压杆次数的数据变化在20%范围里时,该步骤结束。根据食蟹猴对不同剂量梯度的压杆行为及单日摄药量,绘制剂量-反应曲线。并根据该曲线,选择相应最大的剂量作为后续评估用剂量。
259.图8a为五种生理盐水剂量条件下食蟹猴对生理盐水和果汁的选择百分比图。结果显示,利用本发明的装置和方法,能够全面、客观、准确、真实地评估出生理盐水对食蟹猴的奖赏效应值(相对于果汁)。
260.图8b为五种生理盐水剂量条件下食蟹猴对生理盐水关联侧压杆的按压频率图。结果显示,利用本发明的装置和方法,能够在食蟹猴上客观、准确、真实地评估出生理盐水的剂量效应。
261.图8c为食蟹猴对生理盐水和果汁选择百分比随时间的变化图。结果显示,利用本发明的装置和方法,食蟹猴能够在平均3~5天内达到客观、稳定的生理盐水选择百分比。
262.3、待测药物成瘾行为的评估
263.(a)评估行为失控效应
264.a.当前述步骤2中不同剂量生理盐水的选择百分比有差异,且最大值超过50%的情况下,进入本步骤3,且选择压杆频率最高的剂量作为评估其行为失控效应的使用剂量。
265.4、量化食蟹猴对生理盐水的成瘾性
266.分别对所述奖赏效应、行为失控效应、渴求程度、复吸行为和有害性使用进行量化。
267.(a)奖赏效应
268.奖赏效应分值根据生理盐水的最高响应剂量对应的选择百分比数值来计算,具体为0-25%记为0分,25%-50%记为1分,50%-75%记为2分,75%-100%记为3分)。本实施例中该项分值为0分。
269.(b)行为失控效应
270.根据所述方法,本实施例中该项分值为0分。
271.(c)渴求程度
272.根据所述方法,本实施例中该项分值为0分。
273.(d)复吸行为
274.根据所述方法,本实施例中该项分值为0分。
275.(e)有害性使用
276.根据所述方法,本实施例中该项分值为0分。
277.上述指标总分18分(0为无成瘾性,1-6分为低成瘾性,7-12分为中成瘾性,13-18为高成瘾性)。本实施例中上述指标分值为0分,属无成瘾性。
278.实施例5、恒河猴的训练及其用药(生理盐水)评估
279.本实施例中,以恒河猴为动物模型,利用前述实施例1的装置进行训练及其用药(生理盐水)评估。
280.1、建立恒河猴对自然奖赏物的操作性条件反射
281.利用恒河猴对环境探索的本能、对果汁的喜爱与压杆操作后立即得到一次自然奖赏物的程序设定,建立恒河猴的压杆操作与自然奖赏物之间的关联即操作性条件反射。恒河猴坐在灵长类动物座椅组件上完成任务训练,两侧前肢有同等机会按压杠杆,但所述灵长类动物座椅组件的特殊结构决定了恒河猴某侧前肢只能按压同侧压杆,而无法按压对侧压杆。当恒河猴按压左侧压杆时给予一次食物奖励(固体颗粒,外形与药丸类似),当按压右侧压杆时给予一次果汁奖励。记录每种奖励的选择百分比与双侧压杆的按压次数。
282.该阶段的行为训练使用固定比率(fr)强化程序。训练过程中本发明人逐步把fr值增加至某一固定值,此处以30为例(递增序列:1,3,5,8,13,20,30)。每周训练5天,每天训练2小时,提前终止训练任务的条件:自然奖赏物给予次数达最大值(85次)与连续30min无压杆操作。单个trial的流程与参数设定如下:trial开始时白色室灯亮起,若恒河猴左侧压杆的次数达规定值,立即给予一次固体奖励,奖励给予期间室灯灭,左侧压杆正上方红色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),奖励给完trial结束。若恒河猴右侧压杆的次数达规定值,立即给予一次果汁奖励(2ml),果汁给予期间室灯灭,右侧压杆正上方绿色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),果汁给完trial结束。接着进入60s time-out阶段,该阶段和奖励给予期间恒河猴的压杆操作不计作获取果汁的有效压杆次数,但仍被软件记录。满足以下两个条件时方开始后续实验:1)在fr30时,奖励给予量连续3天稳定(数据变化在均值的10%范围内);2)奖励给予和time-out阶段无压杆。
283.2、评估生理盐水对恒河猴的奖赏效应
284.(a)恒河猴静脉插管手术实验
285.根据人类使用待测药物的方式,确定恒河猴的摄入方式。此处以静脉给药为例进行阐述,若为口服或其他摄药方式可略过此步。在动物股或颈静脉长期埋置滞留管并将注射端头引至背部皮下,以便长期给药。该手术由经验丰富的兽医完成。手术过程简要描述如下:全身麻醉状态下,于股静脉或颈静脉上方切开皮肤2cm,分离静脉血管,穿刺针插入血管,然后将植入式静脉插管沿穿刺针导入静脉血管约8-10cm,固定血管和静脉插管。将静脉插管另一端沿皮下穿行至背部,切开3cm皮肤,连接静脉导管和注射腔体,缝合两处切口。术中实时监测实验动物生理指标。术后护理:手术后将有专业动物技术人员进行日常护理,术后前三天,每天都会注射一次到两次的镇痛药以及抗生素,第七天进行第一次大清创,对手术部位及周围进行清理,并拆除缝合线,七天以后保证2天一次频率的清创工作。待术后完
全恢复后,方可继续。
286.(b)绘制恒河猴生理盐水的剂量-反应曲线
287.根据已有的文献报道,将生理盐水的单次注射剂量设为0、0.1、0.3、1、3mg/kg共5个剂量梯度,并将生理盐水替代原先固体奖励即与左侧压杆关联。每只恒河猴每天的最大测试时长为120分钟,包括五个时长均为20分钟的block,每个block内最大奖励次数为10,当达到最大奖励时,该block将被提前结束,block之间间隔5分钟。五个block之间的区别仅在于单次给予待测药物的剂量不同,block1到block5药物剂量递增,单个block内剂量不变。单个trial的流程与参数设定如下:trial开始时白色室灯亮起,若恒河猴左侧压杆的次数达规定值,立即给予一次生理盐水,给予期间室灯灭,左侧压杆正上方红色led灯闪烁(不同生理盐水剂量对应的灯闪烁频率不同,当剂量为“0mg/kg”时开与关各500ms,当剂量为“0.1mg/kg”时开与关各400ms,当剂量为“0.3mg/kg”时开与关各300ms,当剂量为“1mg/kg”时开与关各200ms,当剂量为“3mg/kg”时开与关各100ms)和蜂鸣器断续发声(不同生理盐水剂量对应的发声频率不同,当剂量为“0mg/kg”时开与关各500ms,当剂量为“0.1mg/kg”时开与关各400ms,当剂量为“0.3mg/kg”时开与关各300ms,当剂量为“1mg/kg”时开与关各200ms,当剂量为“3mg/kg”时开与关各100ms),奖励给完trial结束。若恒河猴右侧压杆的次数达规定值,立即给予一次果汁奖励(2ml),果汁给予期间室灯灭,右侧压杆正上方绿色led灯闪烁(开与关各500ms)和蜂鸣器断续发声(开与关各500ms),果汁给完trial结束。允许灵长类动物在待测药物和自然奖赏物之间自由选择,并统计各自的选择百分比,及压杆次数;e.当满足连续三天选择百分比和压杆次数的数据变化在20%范围里时,该步骤结束。根据恒河猴对不同剂量梯度的压杆行为及单日摄药量,绘制剂量-反应曲线。并根据该曲线,选择相应最大的剂量作为后续评估用剂量。
288.图9a为五种生理盐水剂量条件下恒河猴对生理盐水和果汁的选择百分比图。结果显示,利用本发明的装置和方法,能够全面、客观、准确、真实地评估出生理盐水对恒河猴的奖赏效应值(相对于果汁)。
289.图9b为五种生理盐水剂量条件下恒河猴对生理盐水关联侧压杆的按压频率图。结果显示,利用本发明的装置和方法,能够在恒河猴上客观、准确、真实地评估出生理盐水的剂量效应。
290.图9c为恒河猴对生理盐水和果汁选择百分比随时间的变化图。结果显示,利用本发明的装置和方法,恒河猴能够在平均2~4天内达到客观、稳定的生理盐水选择百分比。
291.3、待测药物成瘾行为的评估
292.(a)评估行为失控效应
293.a.当所述步骤2中不同剂量生理盐水的选择百分比有差异,且最大值超过50%的情况下,进入步骤3,且选择压杆频率最高的剂量作为评估其行为失控效应的使用剂量。
294.4、量化恒河猴对生理盐水的成瘾性
295.分别对所述奖赏效应、行为失控效应、渴求程度、复吸行为和有害性使用进行量化。
296.(a)奖赏效应
297.奖赏效应分值根据生理盐水的最高响应剂量对应的选择百分比数值来计算,具体为0-25%记为0分,25%-50%记为1分,50%-75%记为2分,75%-100%记为3分)。本实施例
中该项分值为0分。
298.(b)行为失控效应
299.根据所述方法,本实施例中该项分值为0分。
300.(c)渴求程度
301.根据所述方法,本实施例中该项分值为0分。
302.(d)复吸行为
303.根据所述方法,本实施例中该项分值为0分。
304.(e)有害性使用
305.根据所述方法,本实施例中该项分值为0分。
306.上述指标总分18分(0为无成瘾性,1-6分为低成瘾性,7-12分为中成瘾性,13-18为高成瘾性)。本实施例中上述指标分值为0分,属无成瘾性。
307.在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。