一种利用i型crispr-cas系统同时实现基因编辑和转录调控的方法
技术领域
1.本发明属于生物技术领域,具体涉及一种利用i型crispr-cas系统同时实现基因编辑和转录调控的方法。
背景技术:
2.crispr-cas系统作为基因编辑工具获得了广泛的应用,也被开发用于转录调控。i型crispr-cas系统分布最为广泛。i型crispr-cas系统进行基因编辑的原理是,grna与cascade效应物结合,识别靶序列后会招募cas3核酸内切酶对靶标进行切割,产生双链断裂(double strand break,dsb),激活非同源末端连接或同源重组修复机制,从而在靶基因中引入突变或者对靶基因进行精确编辑。而要对靶基因进行转录调控,通常需要敲除cas3蛋白或者突变其活性位点,防止cas3对靶基因的切割。在失去cas3内切酶活性时,grna与cascade效应物会与靶标dna结合,虽然无法对靶标进行切割降解,但效应物的结合会阻止rna聚合酶的结合或者转录延伸等过程,从而实现转录调控的功能。因此,过去利用一个crispr-cas系统无法同时完成基因编辑和转录调控。
技术实现要素:
3.本发明的目的是提供一种利用i型crispr-cas系统同时实现基因编辑和转录调控的方法。
4.本发明提供了一种对目的生物的基因甲进行转录调控并且对其基因乙进行基因编辑的方法,包括如下步骤:利用i型crispr-cas系统甲对基因甲进行转录调控并且利用i型crispr-cas系统乙对基因乙进行基因编辑;
5.i型crispr-cas系统甲的目标基因为基因甲且为改造后的i型crispr-cas系统;改造后的i型crispr-cas系统指的是将现有技术中的i型crispr-cas系统的grna进行改造后的i型crispr-cas系统;对grna的改造为用spacer截短体取代现有技术中的i型crispr-cas系统的grna中的spacer;
6.i型crispr-cas系统乙的目标基因为基因乙且为现有技术中的i型crispr-cas系统。
7.为了便于区分,将i型crispr-cas系统甲的grna称为grna甲,将i型crispr-cas系统乙的grna称为grna乙。
8.i型crispr-cas系统甲和i型crispr-cas系统乙可共用cascade效应物、cas3核酸内切酶。
9.所述对基因乙进行基因编辑可为对基因乙进行精确基因编辑,例如突变、插入、缺失等。
10.示例性的,所述生物为具有内源i型crispr-cas系统的生物。所述方法可通过在所述生物中导入编码grna甲的dna分子和编码grna乙的dna分子实现。编码grna甲的dna分子
和编码grna乙的dna分子可通过同一质粒导入所述生物。所述质粒中还具有对基因乙进行基因编辑所需的donor片段。
11.示例性的,所述生物为不具有内源i型crispr-cas系统的生物。所述方法可通过在所述生物中导入编码grna甲的dna分子、编码grna乙的dna分子、编码cascade效应物的dna分子和编码cas3核酸内切酶的dna分子实现。各个dna分子可通过同一质粒导入所述生物,可以通过多个质粒导入所述生物。质粒中还具有对基因乙进行基因编辑所需的donor片段。
12.本发明还提供了一种用于对目的生物的基因甲进行转录调控并且对其基因乙进行基因编辑的试剂盒,包括i型crispr-cas系统甲和i型crispr-cas系统乙;
13.i型crispr-cas系统甲的目标基因为基因甲且为改造后的i型crispr-cas系统;改造后的i型crispr-cas系统指的是将现有技术中的i型crispr-cas系统的grna进行改造后的i型crispr-cas系统;对grna的改造为用spacer截短体取代现有技术中的i型crispr-cas系统的grna中的spacer;
14.i型crispr-cas系统乙的目标基因为基因乙且为现有技术中的i型crispr-cas系统。
15.为了便于区分,将i型crispr-cas系统甲的grna称为grna甲,将i型crispr-cas系统乙的grna称为grna乙。
16.i型crispr-cas系统甲和i型crispr-cas系统乙可共用cascade效应物、cas3核酸内切酶。
17.所述对基因乙进行基因编辑可为对基因乙进行精确基因编辑,例如突变、插入、缺失等。
18.所述试剂盒包括grna甲和grna乙。
19.对于另一种形式,所述试剂盒包括制备grna甲和grna乙的生物材料,例如编码grna甲的dna分子和编码grna乙的dna分子,例如编码grna甲和grna乙的dna分子,例如具有编码grna甲的dna分子的重组质粒和具有编码grna乙的dna分子的重组质粒,例如具有编码grna甲和grna乙的dna分子的重组质粒。
20.所述试剂盒还可包括cascade效应物或编码cascade效应物的dna分子或具有编码cascade效应物的dna分子的重组质粒。
21.所述试剂盒还包括cas3核酸内切酶或编码cas3核酸内切酶的dna分子或具有编码cas3核酸内切酶的dna分子的重组质粒。
22.本发明还保护一种对目的生物的目标基因进行转录调控的方法,包括如下步骤:
23.利用改造后的i型crispr-cas系统对目标基因进行转录调控;
24.改造后的i型crispr-cas系统指的是将现有技术中的i型crispr-cas系统的grna进行改造后的i型crispr-cas系统;对grna的改造为用spacer截短体取代现有技术中的i型crispr-cas系统的grna中的spacer。
25.将改造后的i型crispr-cas系统的grna称为改造后grna。
26.示例性的,所述生物为具有内源i型crispr-cas系统的生物。所述方法可通过在所述生物中导入编码改造后grna的dna分子实现。
27.示例性的,所述生物为不具有内源i型crispr-cas系统的生物。所述方法可通过在所述生物中导入编码改造后grna的dna分子、编码cascade效应物的dna分子和编码cas3核
酸内切酶的dna分子实现。各个dna分子可通过同一质粒导入所述生物,可以通过多个质粒导入所述生物。
28.本发明还保护一种对目的生物的目标基因进行转录调控的试剂盒,包括改造后的i型crispr-cas系统;
29.改造后的i型crispr-cas系统指的是将现有技术中的i型crispr-cas系统的grna进行改造后的i型crispr-cas系统;对grna的改造为用spacer截短体取代现有技术中的i型crispr-cas系统的grna中的spacer。
30.将改造后的i型crispr-cas系统的grna称为改造后grna。
31.所述试剂盒包括改造后grna。
32.对于另一种形式,所述试剂盒包括制备改造后grna的生物材料,例如编码改造后grna的dna分子,例如具有编码改造后grna的dna分子的重组质粒。
33.所述试剂盒还可包括cascade效应物或编码cascade效应物的dna分子或具有编码cascade效应物的dna分子的重组质粒。
34.所述试剂盒还包括cas3核酸内切酶或编码cas3核酸内切酶的dna分子或具有编码cas3核酸内切酶的dna分子的重组质粒。
35.现有技术中的i型crispr-cas系统由cascade效应物、cas3核酸内切酶和grna组成。grna与cascade效应物结合,识别靶序列后招募cas3核酸内切酶对靶标进行切割。
36.spacer即grna中特异性结合靶序列的区段。
37.spacer即grna中通过碱基互补配对特异性结合靶序列的区段。
38.所述靶序列为目的基因中与pam相邻且位于其下游的序列。
39.以上任一所述spacer截短体是将现有技术中的i型crispr-cas系统的grna中的spacer中靶向pam的远端部分截短得到的。
40.所述进行转录调控为抑制基因表达。
41.示例性的,所述i型crispr-cas系统可为i-b型crispr-cas系统。
42.相应的,spacer长度为31-72nt。相应的,spacer截短体的长度为16-28nt。优选的,spacer截短体的长度为20-28nt。
43.示例性的,以上任一所述改造后grna包括如下区段:上游repeat片段、spacer截短体和下游repeat片段。示例性的,以上任一所述改造后grna由如下区段组成:上游repeat片段、spacer截短体和下游repeat片段。示例性的,上游repeat片段为序列表的序列2中第81-88位核苷酸所示的dna对应的rna。示例性的,下游repeat片段为序列表的序列2中第105-126位核苷酸所示的dna对应的rna。
44.示例性的,以上任一所述grna甲包括如下区段:上游repeat片段、spacer截短体和下游repeat片段。示例性的,以上任一所述grna甲由如下区段组成:上游repeat片段、spacer截短体和下游repeat片段。示例性的,上游repeat片段为序列表的序列2中第81-88位核苷酸所示的dna对应的rna。示例性的,下游repeat片段为序列表的序列2中第105-126位核苷酸所示的dna对应的rna。
45.示例性的,以上任一所述grna乙包括如下区段:上游repeat片段、spacer和下游repeat片段。示例性的,以上任一所述grna乙由如下区段组成:上游repeat片段、spacer和下游repeat片段。示例性的,上游repeat片段为序列表的序列2中第81-88位核苷酸所示的
dna对应的rna。示例性的,下游repeat片段为序列表的序列2中第105-126位核苷酸所示的dna对应的rna。
46.示例性的,以上任一所述编码改造后grna的dna分子包括如下区段:repeat的编码dna、spacer截短体的编码dna和repeat的编码dna。示例性的,以上任一所述编码改造后grna的dna分子由如下区段组成:repeat的编码dna、spacer截短体的编码dna和repeat的编码dna。repeat的编码dna如序列表的序列2中第59-88位核苷酸所示。
47.示例性的,以上任一所述编码grna甲的dna分子包括如下区段:repeat的编码dna、spacer截短体的编码dna和repeat的编码dna。示例性的,以上任一所述编码grna甲的dna分子由如下区段组成:repeat的编码dna、spacer截短体的编码dna和repeat的编码dna。repeat的编码dna如序列表的序列2中第59-88位核苷酸所示。
48.示例性的,以上任一所述编码grna乙的dna分子包括如下区段:repeat的编码dna、spacer的编码dna和repeat的编码dna。示例性的,以上任一所述编码grna乙的dna分子由如下区段组成:repeat的编码dna、spacer的编码dna和repeat的编码dna。repeat的编码dna如序列表的序列2中第59-88位核苷酸所示。
49.示例性的,所述i型crispr-cas系统可为西班牙盐盒菌的crispr-cas系统。
50.示例性的,所述i型crispr-cas系统可为西班牙盐盒菌hh dlcr菌株的crispr-cas系统。
51.示例性的,所述pam可为ttc。
52.示例性的,以上任一所述生物具体可为微生物或植物。
53.对于本发明的实施例来说,所述生物具体可为西班牙盐盒菌。
54.本发明首次公开了一种利用i型crispr-cas系统同时实现基因编辑和转录调控两种功能的方法。当grna中spacer为野生型长度或者更长,crispr-cas系统可以实现对靶标的基因编辑;当改造grna使spacer缩短,不需要敲除或突变cas3,crispr-cas系统可以实现对靶基因不同程度的转录抑制,但不会对靶标进行切割。此外,由于同一基因不同靶位点也有不同的抑制强度,结合这两个因素,可以构建梯度更丰富的转录抑制库。在本发明中,该系统还可以一次靶向多个位点,通过改变相应spacer长度,分别实现基因编辑或不同程度的转录抑制。
55.在本发明中,不需要敲除或突变cas3,仅通过改变grna中spacer的长度,可以同时实现基因编辑和不同程度的转录抑制。
附图说明
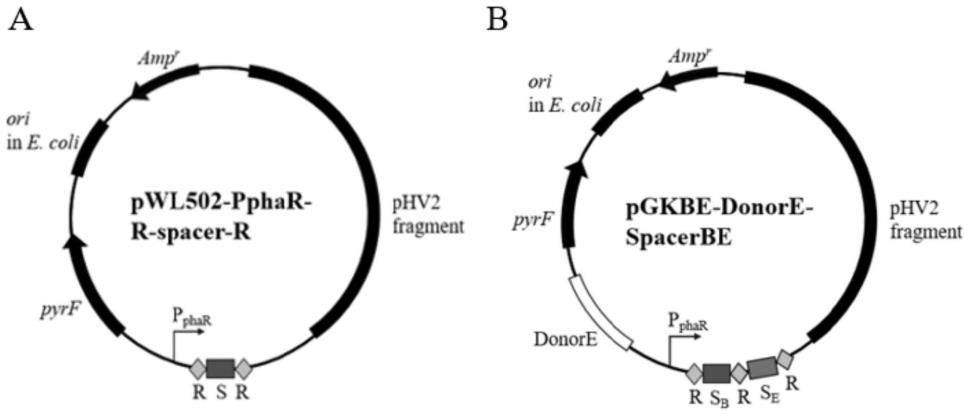
56.图1为重组质粒的结构示意图。
57.图2为实施例1的步骤三、步骤四和步骤五的结果。
58.图3为实施例1的步骤六的结果。
59.图4为实施例2的结果。
具体实施方式
60.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术
人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
61.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例中的各个质粒,均已进行测序验证。
62.如无特殊说明,以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
63.hh dlcr菌株,全称为西班牙盐盒菌hh dlcr菌株,是将西班牙盐盒菌(haloarcula hispanica)atcc 33960菌株敲除pyrf基因及crispr序列得到的。敲除pyrf基因造成营养缺陷,质粒pwl502(或其衍生质粒)中具有该基因从而使转化成功的菌株回补为非营养缺陷的菌株;敲除crispr序列可去除本底影响。记载hh dlcr菌株的文献(hh dlcr菌株即文献中的
△
cr菌株):rui w,ming l,luyao g,et al.dna motifs determining the accuracy of repeat duplication during crispr adaptation in haloarcula hispanica[j].nuclc acids research,2016(9):4266-4277.。
[0064]
质粒pwl502(plasmid pwl502)、质粒pgk(pgk plasmid)、质粒pgkbe(pgkbe plasmid),均记载于如下文献:cheng,f.,gong,l.,zhao,d.,yang,h.,zhou,j.,li,m.,and xiang,h.(2017).harnessing the native type i-b crispr-cas for genome editing in a polyploid archaeon.j genet genomics 44,541-548。质粒pgk和质粒pgkbe均为质粒pwl502的衍生质粒。
[0065]
30%人工盐水(30%sw):称取氯化钠240g,六水合氯化镁30g,七水合硫酸镁35g,氯化钾7g,无水氯化钙0.555g(用5ml蒸馏水溶解);各组分先加入蒸馏水搅拌溶解后,再缓慢加入氯化钙溶液,然后定容至1l。
[0066]
bss-ls溶液:称取氯化钠5.58g,氯化钾0.201g,蔗糖15g,加入蒸馏水搅拌溶解,定容至95ml;115℃,30min高压蒸汽灭菌;然后再加入5ml灭菌的tris-cl(1m,ph8.2)。
[0067]
bss-ls/gly
溶液:称取氯化钠5.58g,氯化钾0.201g,蔗糖15g,量取15ml甘油,加入蒸馏水搅拌溶解,定容至95ml;115℃,30min高压蒸汽灭菌;然后再加入5ml灭菌的tris-cl(1m,ph8.2)。
[0068]
ubss-ls溶液:称取氯化钠5.58g,氯化钾0.201g,蔗糖15g,加入蒸馏水搅拌溶解,定容至100ml;用tris碱或naoh调ph至7.0-7.5;115℃,30min高压蒸汽灭菌。
[0069]
60%peg600溶液:取600μl的peg600与400μl ubss-ls溶液充分混匀。
[0070]
as-168培养基:称取氯化钠200g,七水合硫酸镁20g,氯化钾2g,柠檬酸三钠3g,酸水解酪素5g,酵母抽提物5g,谷氨酸钠1.8g,七水合硫酸亚铁微量及四水合氯化锰微量,加入蒸馏水搅拌溶解,定容至1l;用naoh调ph至7.0-7.2;115℃,30min高压蒸汽灭菌。固体培养基多加入1.2%的琼脂粉。
[0071]
as-168sy培养基:as-168培养基配方中减去酵母抽提物组分。
[0072]
23%mgm复苏培养基:量取30%人工盐水76.7ml,称取酵母抽提物0.1g,大豆蛋白胨0.5g,蔗糖15g,加入蒸馏水搅拌溶解,定容至100ml;用tris碱或naoh调ph至7.5;115℃,30min高压蒸汽灭菌。
[0073]
实施例1、
[0074]
西班牙盐盒菌的crtb基因,如序列表的序列1所示,编码八氢番茄红素合成酶(hah_2563)。敲除该基因,将阻断类胡萝卜素的表达,使菌体由红色变为白色。
[0075]
cascade效应物和cas3核酸内切酶均为西班牙盐盒菌的内源物。
[0076]
本实施例中针对西班牙盐盒菌的crtb基因,利用其自身i-b型crispr-cas系统,通过采用具有不同长度的spacer的grna,可以实现对crtb基因不同程度的转录抑制而不对其进行切割。
[0077]
一、构建用于表达具有不同长度spacer的grna的质粒
[0078]
1、7种pphar-r-spacer-r片段的制备
[0079]
本实验室前期已构建了靶向西班牙盐盒菌dlcr菌株crtb基因的grna表达质粒pwl502-pphar-r-c1-r(即质粒pgk),其中具有pphar-r-c1-r片段。pphar-r-c1-r片段如序列表的序列9所示。序列表的序列9中,第59-88位核苷酸编码repeat,第89至124位核苷酸编码spacer,第125-154位核苷酸编码repeat。pphar-r-c1-r片段表达的grna的spacer长度为36nt(靶向序列1所示crtb基因的第269-304位,pam序列为ttc)。
[0080]
在pphar-r-c1-r片段的基础上对spacer编码区进行截短,得到7种pphar-r-spacer-r片段,依次命名为pphar-r-spacer16-r片段(表达的grna的spacer长度为16bp),pphar-r-spacer20-r片段(表达的grna的spacer长度为20bp),pphar-r-spacer24-r片段(表达的grna的spacer长度为24bp),pphar-r-spacer28-r片段(表达的grna的spacer长度为28bp),pphar-r-spacer30-r片段(表达的grna的spacer长度为30bp),pphar-r-spacer31-r片段(表达的grna的spacer长度为31bp),pphar-r-spacer32-r片段(表达的grna的spacer长度为32p)。
[0081]
pphar-r-spacer16-r片段如序列表的序列2所示。序列表的序列2中,第59-88位核苷酸编码repeat,第89至104位核苷酸编码spacer,第105-134位核苷酸编码repeat。pphar-r-spacer16-r片段表达的grna的spacer长度为16nt(靶向序列1所示crtb基因的第269-284位,pam序列为ttc)。
[0082]
pphar-r-spacer20-r片段如序列表的序列3所示。序列表的序列3中,第59-88位核苷酸编码repeat,第89至108位核苷酸编码spacer,第109-138位核苷酸编码repeat。pphar-r-spacer20-r片段表达的grna的spacer长度为20nt(靶向序列1所示crtb基因的第269-288位,pam序列为ttc)。
[0083]
pphar-r-spacer24-r片段如序列表的序列4所示。序列表的序列4中,第59-88位核苷酸编码repeat,第89至112位核苷酸编码spacer,第113-142位核苷酸编码repeat。pphar-r-spacer24-r片段表达的grna的spacer长度为24nt(靶向序列1所示crtb基因的第269-292位,pam序列为ttc)。
[0084]
pphar-r-spacer28-r片段如序列表的序列5所示。序列表的序列5中,第59-88位核苷酸编码repeat,第89至116位核苷酸编码spacer,第117-146位核苷酸编码repeat。pphar-r-spacer28-r片段表达的grna的spacer长度为28nt(靶向序列1所示crtb基因的第269-296位,pam序列为ttc)。
[0085]
pphar-r-spacer30-r片段如序列表的序列6所示。序列表的序列6中,第59-88位核苷酸编码repeat,第89至118位核苷酸编码spacer,第119-148位核苷酸编码repeat。pphar-r-spacer30-r片段表达的grna的spacer长度为30nt(靶向序列1所示crtb基因的第269-298位,pam序列为ttc)。
[0086]
pphar-r-spacer31-r片段如序列表的序列7所示。序列表的序列7中,第59-88位核
苷酸编码repeat,第89至119位核苷酸编码spacer,第120-149位核苷酸编码repeat。pphar-r-spacer31-r片段表达的grna的spacer长度为31nt(靶向序列1所示crtb基因的第269-299位,pam序列为ttc)。
[0087]
pphar-r-spacer32-r片段如序列表的序列8所示。序列表的序列8中,第59-88位核苷酸编码repeat,第89至120位核苷酸编码spacer,第121-150位核苷酸编码repeat。pphar-r-spacer32-r片段表达的grna的spacer长度为32nt(靶向序列1所示crtb基因的第269-300位,pam序列为ttc)。
[0088]
2、重组质粒的构建
[0089]
将pphar-r-spacer16-r片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pwl502-pphar-r-spacer16-r。
[0090]
将pphar-r-spacer20-r片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pwl502-pphar-r-spacer20-r。
[0091]
将pphar-r-spacer24-r片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pwl502-pphar-r-spacer24-r。
[0092]
将pphar-r-spacer28-r片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pwl502-pphar-r-spacer28-r。
[0093]
将pphar-r-spacer30-r片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pwl502-pphar-r-spacer30-r。
[0094]
将pphar-r-spacer31-r片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pwl502-pphar-r-spacer31-r。
[0095]
将pphar-r-spacer32-r片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pwl502-pphar-r-spacer32-r。
[0096]
以上七种重组质粒和质粒pgk统称为重组质粒pwl502-pphar-r-spacer-r。重组质粒pwl502-pphar-r-spacer-r的结构示意图见图1的a。
[0097]
二、转化hh dlcr菌株
[0098]
待转化质粒分别为重组质粒pwl502-pphar-r-spacer16-r、重组质粒pwl502-pphar-r-spacer20-r、重组质粒pwl502-pphar-r-spacer24-r、重组质粒pwl502-pphar-r-spacer28-r、重组质粒pwl502-pphar-r-spacer30-r、重组质粒pwl502-pphar-r-spacer31-r、重组质粒pwl502-pphar-r-spacer32-r、质粒pgk或质粒pwl502。
[0099]
1、菌的培养与活化
[0100]
从含50mg/l尿嘧啶的固体as-168培养基平板上用牙签挑取hh dlcr菌株单克隆,接种于含50mg/l尿嘧啶的液体as-168培养基中,37℃、200rpm振荡培养至对数期(菌体呈红色),然后以1:30的体积比转接于新鲜的含50mg/l尿嘧啶的液体as-168培养基中,37℃、200rpm振荡培养20-24h(此时,菌体呈微红色,od
600nm
值约为1)。
[0101]
2、转化(所有操作均在室温下进行)
[0102]
完成步骤1后,取1ml菌液于灭菌的ep管中,6000rmp离心3min,弃上清;然后加入200μl bss-ls溶液,用移液枪轻轻吹匀,6000rmp离心3min,弃上清;然后加入100μl bss-ls/gly
溶液,用移液枪轻轻吹匀,然后加入10μl ph8.0、0.5m的edta缓冲液,用手轻轻拍打ep管壁,混匀后室温下放置10分钟(形成原生质体);然后加入5μl待转化质粒(dna含量约为
500微克)(阴性对照加等体积的ddh2o),用手轻轻拍打ep管壁,混匀后室温下放置5分钟;然后加入115μl 60%peg600溶液,迅速上下颠倒ep管多次,直到溶液变得透亮、均一,然后室温放置20-30min;然后加入1ml的23%mgm复苏培养基,上下颠倒ep管混匀溶液,6000rmp离心3min,弃上清;然后加入0.5ml的23%mgm复苏培养基悬浮菌体,37℃、200rmp振荡培养过夜。
[0103]
3、涂板
[0104]
完成步骤2后,取菌液,采用23%mgm复苏培养基进行10倍梯度稀释,分别得到10
1-103倍稀释液,将原菌液与各个稀释液分别涂布于固体as-168sy培养基平板。
[0105]
4、生长
[0106]
(1)将完成步骤3的平板于37℃静置1天,待液体被平板彻底吸收后,再置于封口的塑料袋中,42℃倒置培养3-5天,此时可以看到转化子,统计转化效率(结果见步骤三)。如果靶标被切割,染色体断裂,重组菌死亡,无法观察到转化子。
[0107]
(2)将转化子划线接种于固体as-168sy培养基平板,在42℃培养箱中倒置培养2天,然后观察转化子颜色(结果见步骤四)并进行分子检测(结果见步骤五和步骤六)。
[0108]
三、转化效率统计
[0109]
每种待转化质粒设置3个重复处理。记录不同稀释倍数相应平板上的转化子的数量,转化子数量在30-300之间为有效数据。计算每种待转化质粒的转化效率(每微克质粒的转化子个数),根据统计的数据制作柱形图。
[0110]
结果见图2的a。图中,16bp对应重组质粒pwl502-pphar-r-spacer16-r、20bp对应重组质粒pwl502-pphar-r-spacer20-r、24bp对应重组质粒pwl502-pphar-r-spacer24-r、28bp对应重组质粒pwl502-pphar-r-spacer28-r、30bp对应重组质粒pwl502-pphar-r-spacer30-r、31bp对应重组质粒pwl502-pphar-r-spacer31-r、32bp对应重组质粒pwl502-pphar-r-spacer32-r、36bp对应质粒pgk。
[0111]
结果表明:spacer长度为31bp、32bp和36bp时,spacer的干扰能力强,转化子数量很少;spacer长度为16bp、20bp、24bp、28bp和30bp时,转化效率与pwl502质粒在同一个数量级。从以上结果可以推测,缩短grna中spacer后(spacer长度不超过30bp),crispr系统对靶标没有切割。
[0112]
四、转化子颜色分析
[0113]
对各个待转化质粒进行上述步骤得到的转化子进行颜色观察,结果见图2的b(对应关系同图2的a)。结果表明,spacer长度为16bp时,转化子颜色为较深的红色,与pwl502相同,说明其crtb基因表达几乎没有受到抑制。而spacer长度为20bp、24bp、28bp或30bp时,转化子颜色随着spacer缩短逐渐变浅,其中28bp和30bp转化子颜色为白色,表明crtb基因表达受到强烈抑制。以上结果表明,本发明实现了对靶基因不同程度的转录抑制。
[0114]
五、转化子crtb基因突变分析
[0115]
为了验证crtb基因靶位点是否被cas3蛋白切割而发生编辑,利用test-f1/test-r1组成的引物对(靶序列包括crtb基因序列)对spacer长度为24bp或28bp、30bp的质粒相应的多个转化子进行pcr扩增,对pcr产物进行琼脂糖凝胶电泳和测序。
[0116]
test-f1:gcccagacgggcgacattct;
[0117]
test-r1:gaccatcgcggtctgcaaga。
[0118]
结果见图2c和2d。图2c中,-代表hh dlcr菌株,1-10代表不同转化子。结果表明,对于spacer长度为24bp或28bp的质粒,与出发菌株hh dlcr相比各个转化子crtb基因长度没有变化且测序结果表明,各个转化子crtb基因序列没有发生突变。而对于spacer长度为30bp的质粒,部分转化子crtb基因有约1kb的缺失,表明cas3蛋白对靶标有一定的切割。以上结果进一步表明,通过缩短grna的spacer长度至不超过28bp,可以防止cas3蛋白对靶标的切割。
[0119]
六、qrt-pcr定量分析转化子crtb基因转录情况
[0120]
取转化子,提取总rna,反转录得到cdna。以cdna为模板,以7s基因为内参基因,在viiatm7 real-time pcr system上进行real time pcr反应,检测crtb基因的相对表达水平。用于检测crtb基因的引物对为crtb qf/crtb qr组成的引物对。用于检测7s基因的引物对为7sf/7sr组成的引物对。
[0121]
crtb qf(正向引物):cgatacagcaggagaccg;
[0122]
crtb qr(反向引物):catcgcgtcgatgaagac。
[0123]
7sf(正向引物):tcgatggtccgctgctcac;
[0124]
7sr(反向引物):gggggcgtccggtctga。
[0125]
反应体系:kapa sybr fast qpcr master mix(2x)10μl,正向引物(10μm)1μl,反向引物(10μm)1μl,模板5μl(dna含量约为3000ng),dye 0.4μl,ddh2o 2.6μl。
[0126]
反应条件:95℃5min;95℃15s,54℃25s,72℃35s,40个循环。
[0127]
对得到的数据进行统计分析,绘制柱形图。结果见图3。图中,spacer-16bp对应重组质粒pwl502-pphar-r-spacer16-r、spacer-20bp对应重组质粒pwl502-pphar-r-spacer20-r、spacer-24bp对应重组质粒pwl502-pphar-r-spacer24-r、spacer-28bp对应重组质粒pwl502-pphar-r-spacer28-r、spacer-30bp对应重组质粒pwl502-pphar-r-spacer30-r。
[0128]
结果表明,spacer长度为16bp、20bp、24bp、28bp和30bp时,转化子菌株中crtb基因表达量有不同程度的变化,且随着spacer的缩短,抑制强度减弱。其中spacer长度为24bp、28bp和30bp时,crtb基因表达量有接近一个数量级的明显下调。说明随着spacer长度的改变,本发明实现了对靶基因不同程度的抑制。
[0129]
综合实施例1中的结果,本发明在不敲除cas3蛋白的情况下,利用西班牙盐盒菌hh dlcr菌株i-b型crispr-cas系统和包含不同长度spacer的grna,可以实现对靶基因(crtb基因)不同程度的转录调控;且不改变靶标位点的序列,即不对靶位点进行切割。
[0130]
实施例2、
[0131]
利用西班牙盐盒菌hh dlcr菌株i-b型crispr-cas系统对cdc6e和crtb基因同时分别进行编辑和转录调控。crtb基因如序列表的序列1所示。cdc6e基因如序列表的序列10所示。
[0132]
一、编辑和转录调控质粒pgkbe-donore-spacerbe的构建
[0133]
1、donore-spacerbe片段的制备
[0134]
已有靶向西班牙盐盒菌dlcr菌株的cdc6e基因和crtb基因的敲除质粒pgkbe,表达具有两个spacer的grna且含有敲除crtb基因的所需的donor序列和敲除cdc6e基因所需的donor序列。两个spacer即靶向crtb基因的spacer(sb)和靶向cdc6e基因的spacer(se)。质粒
pgkbe表达的grna中,sb的长度为36nt(靶向序列1所示crtb基因的第269-304位,pam序列为ttc),se的长度为36nt(靶向序列10所示cdc6e基因的第385-420位,pam序列为ttc)。
[0135]
donore-spacerbe-18bp片段如序列表的序列11所示。序列表的序列11中,第10-682位核苷酸为敲除cdc6e基因所需的donore区段,第732-761位核苷酸编码repeat,第762-779位核苷酸编码靶向crtb基因的spacer,第780-809位核苷酸编码repeat,第810-845位核苷酸编码靶向cdc6e基因的spacer,第846-875位核苷酸编码repeat。靶向crtb基因的spacer的长度为18nt(靶向序列1所示crtb基因的第269-286位,pam序列为ttc),靶向cdc6e基因的spacer的长度为36nt(靶向序列10所示cdc6e基因的第385-420位,pam序列为ttc)。
[0136]
donore-spacerbe-24bp片段如序列表的序列12所示。序列表的序列12中,第10-682位核苷酸为敲除cdc6e基因所需的donore区段,第732-761位核苷酸编码repeat,第762-785位核苷酸编码靶向crtb基因的spacer,第786-815位核苷酸编码repeat,第816-851位核苷酸编码靶向cdc6e基因的spacer,第852-881位核苷酸编码repeat。靶向crtb基因的spacer的长度为24nt(靶向序列1所示crtb基因的第269-292位,pam序列为ttc),靶向cdc6e基因的spacer的长度为36nt(靶向序列10所示cdc6e基因的第385-420位,pam序列为ttc)。
[0137]
donore-spacerbe-28bp片段如序列表的序列13所示。序列表的序列13中,第10-682位核苷酸为敲除cdc6e基因所需的donore区段,第732-761位核苷酸编码repeat,第762-789位核苷酸编码靶向crtb基因的spacer,第790-819位核苷酸编码repeat,第820-855位核苷酸编码靶向cdc6e基因的spacer,第856-885位核苷酸编码repeat。靶向crtb基因的spacer的长度为28nt(靶向序列1所示crtb基因的第269-296位,pam序列为ttc),靶向cdc6e基因的spacer的长度为36nt(靶向序列10所示cdc6e基因的第385-420位,pam序列为ttc)。
[0138]
2、重组质粒的构建
[0139]
将donore-spacerbe-18bp片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pgkbe-donore-spacerbe-18bp。
[0140]
将donore-spacerbe-24bp片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pgkbe-donore-spacerbe-24bp。
[0141]
将donore-spacerbe-28bp片段进行bamhi和kpni双酶切,然后与bamhi和kpni双酶切后的质粒pwl502连接,得到重组质粒pgkbe-donore-spacerbe-28bp。
[0142]
以上三种重组质粒和质粒pgkbe统称为重组质粒pgkbe-donore-spacerbe。重组质粒pgkbe-donore-spacerbe的结构示意图见图1的b。
[0143]
二、转化hh dlcr菌株
[0144]
待转化质粒分别为重组质粒pgkbe-donore-spacerbe-18bp、重组质粒pgkbe-donore-spacerbe-24bp、重组质粒pgkbe-donore-spacerbe-28bp、质粒pgkbe或质粒pwl502。
[0145]
方法同实施例1的步骤二。
[0146]
三、转化效率分析
[0147]
同实施例1的步骤三。
[0148]
结果见图4的a。图中,18bp对应重组质粒pgkbe-donore-spacerbe-18bp、24bp对应重组质粒pgkbe-donore-spacerbe-24bp、28bp对应重组质粒pgkbe-donore-spacerbe-28bp。
[0149]
结果表明,相比于pgkbe质粒的转化效率,pgkbe-donore-spacerbe质粒的转化效率高出1个数量级,且crtb基因的spacer长度为18bp、24bp和28bp时转化效率没有明显差异。
[0150]
四、转化子颜色分析
[0151]
同实施例1的步骤四。
[0152]
结果见图4的b(对应关系同图4的a)。结果显示,spacer长度为18bp时,转化子颜色为较深的红色,与pwl502相似,说明其crtb基因表达几乎没有受到抑制。而spacer长度为24bp和28bp时,转化子颜色均为白色,表明crtb基因表达受到强烈抑制。
[0153]
五、转化子cdc6e和crtb基因突变分析
[0154]
为了验证cdc6e和crtb基因靶位点是否被编辑,利用test-f1/test-r1组成的引物对(靶序列包括crtb基因序列)或者test-f2/test-r2组成的引物对(靶序列包括cdc6e基因)对spacer长度为24bp或28bp的质粒相应的转化子进行pcr扩增,对pcr产物进行琼脂糖凝胶电泳和测序。
[0155]
test-f2:cgtgcgcattccggtcatct;
[0156]
test-r2:ggtcgacgaacgtcactgta。
[0157]
结果见图4c。图4c中,-代表hh dlcr菌株, 代表pgkbe质粒得到的转化子,1-10代表重组质粒pgkbe-donore-spacerbe-24bp得到的不同转化子或重组质粒pgkbe-donore-spacerbe-28bp得到的不同转化子。
[0158]
结果表明,与出发菌株hh dlcr相比各个转化子crtb基因长度没有变化,且测序结果表明,各个重组质粒得到的转化子的crtb基因序列没有发生突变,cdc6e基因长度变短被成功敲除。
[0159]
综合实施例2中的结果,本发明在不敲除或突变cas3蛋白的情况下,利用西班牙盐盒菌hh dlcr菌株i-b型crispr-cas系统可以实现对两个不同基因同时分别进行基因编辑和转录调控,且效率都很高。
[0160]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
