治疗高苯丙氨酸血症的方法
背景技术:
1.苯丙酮尿症 (pku) 是一种先天性代谢错误,主要由苯丙氨酸羟化酶 (pah)基因中的突变引起。pah的基因突变导致催化活性降低,造成高苯丙氨酸血症 (hpa)。pah基因中有许多不同的突变(》400),导致产生的酶量和/或酶活性的表型变异。患有严重形式pku的受试者具有完全缺乏或深度缺乏的pah酶活性,并且典型地具有非常高的血液苯丙氨酸(phe)水平(》1200 微摩尔/升)。pah活性的部分缺乏导致血液苯丙氨酸升高程度较低,例如,约360-1200微摩尔/升。高水平的苯丙氨酸对大脑有毒性。如果不治疗,则会发生严重和不可逆的智力障碍。随着几乎普遍采用新生儿筛查,pku在出生时就被诊断。它已经在所有的人种群中被描述,并且估计在每10,000个出生中发生大约1个。
2.目前,pku尚无治愈方法。初始治疗由下述组成:迅速建立补充有专门设计的医疗食物的苯丙氨酸饮食限制。对于年长的儿童、青少年和成人而言,顺从限制性饮食可能是困难的。四氢生物蝶呤(bh4)补充已被证明在约30%pku患者中临床上有意义地降低苯丙氨酸血浆浓度。bh4是pah将phe转化为酪氨酸(tyr)的必需辅因子。由bh4补充所致的细胞内bh4增加已显示改善pah的功能,导致血浆苯丙氨酸的减少。kuvan
®ꢀ
(沙丙蝶呤二盐酸盐),bh4的合成制剂,是在数个国家已被批准的药品,被用于治疗四氢生物蝶呤反应性成人和小儿患者(患有pku)的高苯丙氨酸血症(hpa)。但是,利用饮食苯丙氨酸限制和/或bh4补充的控制是次优的,大多数患者维持升高的苯丙氨酸血浆浓度。治疗pku的另一种方法,仅批准用于成年患者的培伐利酶-pqpz(pegvaliase-pqpz),包括通过每日注射来给药苯丙氨酸代谢酶;但是,该方法遭受由于过敏反应和其它副作用导致的可能的并发症,并且许多患者尽管治疗也维持升高的苯丙氨酸水平。因此,需要治疗pku的其它方法。
技术实现要素:
3.本发明的特征在于通过给药墨蝶呤或其药学上可接受的盐来降低有需要的受试者的血液苯丙氨酸浓度的方法。本发明人已经发现墨蝶呤在降低血液苯丙氨酸浓度方面是有效的。特别地,本发明人已经发现,墨蝶呤在将血液苯丙氨酸浓度降低至与健康受试者相同的水平方面和/或在降低对利用沙丙蝶呤二盐酸盐和/或培伐利酶-pqpz的先前的治疗没有反应的受试者的血液苯丙氨酸浓度方面是有效的。
4.在一个方面,本发明的特征在于降低受试者(例如,患有高苯丙氨酸血症的受试者、患有由苯丙酮尿症导致的高苯丙氨酸血症的受试者、患有苯丙酮尿症的受试者、患有四氢生物蝶呤反应性苯丙酮尿症的受试者、或患有墨蝶呤反应性苯丙酮尿症的受试者)中的苯丙氨酸水平(例如,血液苯丙氨酸浓度)的方法。该方法包括给药有效量的墨蝶呤或其药学上可接受的盐。
5.在一个方面,本发明的特征在于治疗有需要的受试者中的高苯丙氨酸血症(例如,由苯丙酮尿症如四氢生物蝶呤反应性苯丙酮尿症、或患有墨蝶呤反应性苯丙酮尿症的受试者引起的高苯丙氨酸血症)的方法。该方法包括给药有效量的墨蝶呤或其药学上可接受的盐。
6.在一个方面,本发明的特征在于治疗有需要的受试者中的苯丙酮尿症(例如,四氢生物蝶呤反应性苯丙酮尿症、或患有墨蝶呤反应性苯丙酮尿症、经典苯丙酮尿症和/或非经典苯丙酮尿症的受试者)的方法。该方法包括给药有效量的墨蝶呤或其药学上可接受的盐。
7.在本文所述的任何方法的一些实施方案中,所述受试者具有大于120 微摩尔/升(例如,大于200 微摩尔/升、大于300 微摩尔/升、大于360 微摩尔/升、大于400 微摩尔/升、大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、大于1100 微摩尔/升、或大于1200 微摩尔/升)的血液苯丙氨酸浓度 (例如,未受控制的苯丙氨酸血液浓度)。在本文所述的任何方法的一些实施方案中,所述受试者具有120-360 微摩尔/升、360-600 微摩尔/升、600-1200 微摩尔/升、或大于1200 微摩尔/升的血液苯丙氨酸浓度(例如,未受控制的苯丙氨酸血液浓度)。
8.在本文所述的任何方法的一些实施方案中,在现有管理如苯丙氨酸限制饮食和/或利用沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)的治疗中,所述受试者具有大于400 微摩尔/升 (例如,大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、大于1100 微摩尔/升、或大于1200 微摩尔/升)的血液苯丙氨酸浓度(例如,未受控制的苯丙氨酸血液浓度)。在一些实施方案中,利用沙丙蝶呤的治疗包括给药5-20 mg/kg的沙丙蝶呤或其药学上可接受的盐。
9.在本文所述的任何方法的一些实施方案中,受试者对利用沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)的治疗没有反应。在一些实施方案中,在给药沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)时,受试者的血液血浆浓度降低小于15-30%在一些实施方案中,在给药沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)时,受试者的血液血浆浓度降低小于30%。在一些实施方案中,在给药沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)时,受试者的血液血浆浓度降低小于20%。在一些实施方案中,在给药沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)时,受试者的血液血浆浓度降低小于15%。例如,在给药至少约10 mg/kg (例如,至少约15 mg/kg、至少约20 mg/kg)的沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)至少8天(例如,至少14天、至少21天、至少28天、至少30天)时,受试者的血液血浆浓度降低小于30%。在一些实施方案中,在给药沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)后,受试者的血液血浆浓度为大于120 微摩尔/升(例如,大于200 微摩尔/升、大于300 微摩尔/升、大于360 微摩尔/升、大于400 微摩尔/升、大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、大于1100 微摩尔/升、或大于1200 微摩尔/升) 。例如,在给药至少约10 mg/kg (例如,至少约15 mg/kg、至少约20 mg/kg)的沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)至少8天(例如,至少14天、至少21天、至少28天、至少30天)后,受试者的血液血浆浓度为大于120 微摩尔/升(例如,大于200 微摩尔/升、大于300 微摩尔/升、大于360 微摩尔/升、大于400 微摩尔/升、大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、
大于1100 微摩尔/升、或大于1200 微摩尔/升)。
10.在本文所述的任何方法的一些实施方案中,所述受试者对利用培伐利酶-pqpz的治疗没有反应。在一些实施方案中,在给药培伐利酶-pqpz后,受试者的血液血浆浓度降低小于20%。例如,在给药至少约20 mg每天一次 (例如,至少约30 mg每天一次、至少约40 mg每天一次)的培伐利酶-pqpz至少16周(例如,至少18周、至少20周、至少22周、至少24周)时,受试者的血液血浆浓度降低小于30%、或小于20%。在一些实施方案中,在给药培伐利酶-pqpz后,受试者的血液血浆浓度为大于120 微摩尔/升 (例如,大于200 微摩尔/升、大于300 微摩尔/升、大于360 微摩尔/升、大于400 微摩尔/升、大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、大于1100 微摩尔/升、或大于1200 微摩尔/升)。例如,在给药至少约20 mg (例如,至少约30 mg、至少约40 mg)的培伐利酶-pqpz至少16周(例如,至少18周、至少20周、至少22周、至少24周)后,受试者的血液血浆浓度为大于120 微摩尔/升 (例如,大于200 微摩尔/升、大于300 微摩尔/升、大于360 微摩尔/升、大于400 微摩尔/升、大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、大于1100 微摩尔/升、或大于1200 微摩尔/升)。
11.在本文所述的任何方法的一些实施方案中,所述受试者由于不良反应(例如,过敏反应、注射部位反应、关节痛、超敏反应、头痛、持续至少14天的全身性皮肤反应、瘙痒、恶心、腹痛、口咽疼痛、呕吐、咳嗽、腹泻和/或疲劳)和/或耐受性而停止了利用培伐利酶-pqpz的治疗。
12.在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至小于600 微摩尔/升。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至小于360 微摩尔/升。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至小于120 微摩尔/升。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至120-360 微摩尔/升。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至360-600 微摩尔/升。
13.在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至小于600 微摩尔/升的量。在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至小于360 微摩尔/升的量。在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至小于120 微摩尔/升的量。在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至120-360 微摩尔/升的量。在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至360-600 微摩尔/升的量。
14.在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将
受试者的血液苯丙氨酸浓度降低至少10% (例如,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、或者约10%-约30%、约20%-约40%、约30%-约50%、约40%-约60%、约50%-约70%、约60%-约80%、或约70%-约90%)。该降低可在给药至少1周(例如,在2周、3周、4周、5周、6周)后确定。
15.在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至少10% (例如,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、或者约10%-约30%、约20%-约40%、约30%-约50%、约40%-约60%、约50%-约70%、约60%-约80%、或约70%-约90%)的量。
16.在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至小于600 微摩尔/升,其中苯丙氨酸消耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至小于360 微摩尔/升,其中苯丙氨酸消耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至小于120 微摩尔/升,其中苯丙氨酸消耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至120-360 微摩尔/升,其中苯丙氨酸消耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至360-600 微摩尔/升,其中苯丙氨酸消耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或
者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。
17.在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至小于600 微摩尔/升,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。在任何前述方法的一些实施方案中,给药墨蝶呤或其任何药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至小于360 微摩尔/升,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其任何药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至小于120 微摩尔/升,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其任何药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至120-360 微摩尔/升,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其任何药学上可接受的盐将受试者的血液苯丙氨酸浓度降低至360-600 微摩尔/升,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。
18.在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐将受试者的血液苯丙氨酸浓度比墨蝶呤或其药学上可接受的盐的给药之前的血液苯丙氨酸浓度降低至少20% (例如,至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%)。
19.在本文所述的任何方法的一些实施方案中,给药墨蝶呤或其药学上可接受的盐在给药10小时内在受试者的血浆中产生至少50 ng/ml的bh4浓度 (例如,至少60 ng/ml、至少100 ng/ml、至少200 ng/ml、至少400 ng/ml、至少600 ng/ml、至少1000 ng/ml或至少2000 ng/ml、或者50 ng/ml
ꢀ‑ꢀ
100 ng/ml、60 ng/ml-400 ng/ml、200 ng/ml-600 ng/ml、400 ng/ml-1000 ng/ml、或600 ng/ml
ꢀ‑ꢀ
1500 ng/ml)。
20.在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至小于600 微摩尔/升的量,其中苯丙氨酸消
耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至小于360 微摩尔/升的量,其中苯丙氨酸消耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至小于120 微摩尔/升的量,其中苯丙氨酸消耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至120-360 微摩尔/升的量,其中苯丙氨酸消耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至360-600 微摩尔/升的量,其中苯丙氨酸消耗量为至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天或至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)。
21.在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至小于600 微摩尔/升的量,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的
盐是足以将受试者的血液苯丙氨酸浓度降低至小于360 微摩尔/升的量,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至小于120 微摩尔/升的量,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至120-360 微摩尔/升的量,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。在本文所述的任何方法的一些实施方案中, 有效量的墨蝶呤或其药学上可接受的盐是足以将受试者的血液苯丙氨酸浓度降低至360-600 微摩尔/升的量,其中天然蛋白质摄入量为大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或者约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)。
22.在本文所述的任何方法的一些实施方案中,有效量是足以将受试者的血液苯丙氨酸浓度比墨蝶呤或其药学上可接受的盐的给药之前的血液苯丙氨酸浓度降低至少20%(例如,至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%)的量。
23.在本文所述的任何方法的一些实施方案中,有效量是足以在给药墨蝶呤或其药学上可接受的盐10小时内在受试者的血浆中产生至少50 ng/ml的bh4浓度 (例如,至少60 ng/ml、至少100 ng/ml、至少200 ng/ml、至少400 ng/ml、至少600 ng/ml、至少1000 ng/ml或至少2000 ng/ml、或者50 ng/ml-100 ng/ml、60 ng/ml-400 ng/ml、200 ng/ml-600 ng/ml、400 ng/ml-1000 ng/ml、或600 ng/ml-1500 ng/ml)的量(例如,每剂量2.5 mg/kg-100 mg/kg)。
24.在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐是每剂量约2.5 mg/kg-100 mg/kg(例如,约20 mg/kg
ꢀ‑ꢀ
约60 mg/kg、或约20 mg/kg、约30 mg/kg、约40 mg/kg、约50 mg/kg、约60 mg/kg)。
25.在本文所述的任何方法的一些实施方案中,在进食情况下给药有效量的墨蝶呤或其药学上可接受的盐。在本文所述的任何方法的一些实施方案中,有效量是足以在进食状况下给药10小时内在受试者的血浆中产生至少50 ng/ml的bh4浓度 (例如,至少60 ng/ml、至少100 ng/ml、至少200 ng/ml、至少400 ng/ml、至少600 ng/ml、至少1000 ng/ml或至少2000 ng/ml、或者 50 ng/ml-100 ng/ml、60 ng/ml-400 ng/ml、200 ng/ml-600 ng/ml、400 ng/ml-1000 ng/ml、或 600 ng/ml-1500 ng/ml)的量(例如,每剂量2.5 mg/kg-100 mg/
kg)。在一些实施方案中,有效量包括比足以在不进食状况下给药墨蝶呤或其药学上可接受的盐10小时内在受试者的血浆中产生至少50 ng/ml (例如,至少60 ng/ml、至少100 ng/ml、至少200 ng/ml、至少400 ng/ml、至少600 ng/ml、至少1000 ng/ml或至少2000 ng/ml、或者50 ng/ml-100 ng/ml、60 ng/ml-400 ng/ml、200 ng/ml-600 ng/ml、400 ng/ml-1000 ng/ml、或 600 ng/ml-1500 ng/ml)的最大bh4血浆浓度(cmax)的量低至少5% (至少10%、至少20%、至少50%、至少70%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%、或至少150%)的剂量。
26.在本文所述的任何方法的一些实施方案中,对受试者的给药发生在食用食物前小于30分钟或在食用食物后,例如,临食用食物前或食用后至多1小时。在一些实施方案中,对受试者的给药基本上与食物同时进行。在本文所述的任何方法的一些实施方案中,食物是高蛋白食物。在本文所述的任何方法的一些实施方案中,食物是高脂肪食物(例如,至少25、30、40或50%的卡路里来自脂肪)。在本文所述的任何方法的一些实施方案中,食物是高蛋白和高脂肪食物。在一些实施方案中,食物是高卡路里食物 (例如,食物包括至少100卡路里,例如,至少200卡路里、至少300卡路里、至少400卡路里、至少500卡路里,例如,500-1500或800-1000卡路里)。在本文所述的任何方法的一些实施方案中, 食物是膳食,例如,早餐、中餐或晚餐。
27.在本文所述的任何方法的一些实施方案中,与在不进食情况下给药(例如,发生在食用食物后大于2小时直至食用另外的食物前30 分钟)相比,在进食情况下给药(例如,发生在食用食物前小于30分钟、或在食用食物后,例如,临食用食物前直至食用后1小时)导致bh4的cmax增加(例如,至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%或至少150%)。
28.在本文所述的任何方法的一些实施方案中,与在不进食情况下给药(例如,发生在食用食物前小于30分钟或在食用食物后,例如,临食用食物前直至食用后1小时)相比,与在进食情况下给药(例如,发生在食用食物前小于30分钟或在食用食物后,例如,临食用食物前直至食用后1小时)导致bh4的产生程度和所得血浆暴露(auc
0-last
)增加(例如,至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%、或至少150%)。
29.在本文所述的任何方法的一些实施方案中,墨蝶呤或其药学上可接受的盐以与所食用食物分开的组合物的形式提供(例如,墨蝶呤未被整合至食物产品中)。在本文所述的任何方法的一些实施方案中,食物的食用发生在给药墨蝶呤或其药学上可接受的盐之前(例如,食物的食用发生在给药墨蝶呤前1小时至临给药前)。在本文所述的任何方法的一些实施方案中,食物的食用发生在给药墨蝶呤或其药学上可接受的盐后(例如,食物的食用发生在给药后即刻至给药后30分钟)。
30.在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐以两个相等的剂量给药(例如,一天的不同时间的两个剂量)。在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐以两个60 mg/kg剂量给药(例如,在早晨的1个60 mg/kg剂量和在晚上的1个60 mg/kg剂量)。在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐以两个40 mg/kg剂量给药(例如,在早
晨的1个40 mg/kg剂量和在晚上的1个40 mg/kg剂量)。在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐以两个30 mg/kg剂量给药(例如,在早晨的1个30 mg/kg剂量和在晚上的1个30 mg/kg剂量)。在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐以两个20 mg/kg剂量给药(例如,在早晨的1个20 mg/kg剂量和在晚上的1个20 mg/kg剂量)。在本文所述的任何方法的一些实施方案中,有效量的墨蝶呤或其药学上可接受的盐以两个10 mg/kg剂量给药(例如,在早晨的1个10 mg/kg剂量和在晚上的1个10 mg/kg剂量)。
31.在本文所述的任何方法的一些实施方案中,与给药了至少10 mg/kg (例如,至少15 mg/kg、至少20 mg/kg)沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)的受试者相比,不良事件的风险(例如,头痛、鼻漏、咽喉疼痛、腹泻、呕吐、咳嗽和/或鼻塞)降低。在本文所述的任何方法的一些实施方案中,与给药了至少20 mg/kg 沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)的受试者相比,不良事件的风险 (例如,头痛、鼻漏、咽喉疼痛、腹泻、呕吐、咳嗽和/或鼻塞)降低。
32.在本文所述的任何方法的一些实施方案中,受试者是儿童(例如,受试者小于18岁、小于17岁、小于16岁、小于15岁、小于14岁、小于13岁、小于12岁、小于11岁、小于10岁、小于9岁、小于8岁、小于7岁、小于6岁、小于5岁、小于4岁、小于3岁、小于2岁、小于1岁)。在本文所述的任何方法的一些实施方案中,受试者是成人(例如,受试者大于18岁)。
33.在本文所述的任何方法的一些实施方案中,受试者已被诊断患有四氢生物蝶呤反应性苯丙酮尿症。在本文所述的任何方法的一些实施方案中,受试者已被诊断患有墨蝶呤反应性pku所致的高苯丙氨酸血症。
34.在本文所述的任何方法的一些实施方案中,受试者正在接受苯丙氨酸限制饮食 (例如,受试者正在接受包括牛奶替代品或配方如phenyl-free 2和测定量的水果、蔬菜、面包、意大利面和谷物的饮食)。在本文所述的任何方法的一些实施方案中,受试者具有小于3000 mg/天 (例如,小于2500 mg/天、小于2000 mg/天、小于1500 mg/天、小于1000 mg/天、小于500 mg/天)的中值苯丙氨酸摄入量。
35.在本文所述的任何方法的一些实施方案中,受试者未在接受苯丙氨酸限制饮食(例如,受试者具有大于1000 mg/天(例如,大于1500 mg/天、大于2000 mg/天、大于2500 mg/天、大于3000 mg/天)的中值苯丙氨酸摄入量。
36.在本文所述的任何方法的一些实施方案中,受试者的饮食中的小于25%(例如,小于20%、小于15%、小于10%、或小于5%)的蛋白是天然蛋白。在本文所述的任何方法的一些实施方案中,受试者的饮食中的大于25%(例如,大于30%、大于40%、大于50%、大于60%、大于70%、大于80%、大于90%、大于95%、大于99%)的蛋白是天然蛋白。在本文所述的任何方法的一些实施方案中,受试者具有小于10 g/天 (例如,小于5 g/天、或约5 g/天-约10 g/天)的天然蛋白质摄入量。在本文所述的任何方法的一些实施方案中, 受试者具有大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)的天然蛋白质摄入量。
37.在本文所述的任何方法的一些实施方案中,墨蝶呤或其药学上可接受的盐被配制
为悬浮液用口服粉末。在本文所述的任何方法的一些实施方案中,墨蝶呤或其药学上可接受的盐以在调味悬浮介质(例如,medisca
®
oral mix)中的悬浮液的形式给药。
38.在本文所述的任何方法的一些实施方案中,该给药产生受试者的神经认知功能的增加(例如,执行功能增加、焦虑减少、注意力缺陷/多动障碍症状减少和/或脑雾情况减少)。在一些实施方案中,该给药产生执行功能增加,例如,如通过评估所测定,该评估诸如:执行障碍综合征的行为评估 (bads)、执行功能的行为分级清单 (brief或mini-brief)、barkley执行功能缺陷量表(bdefs)、行为控制障碍量表(bds)、aseba儿童行为检查表(cblc)、综合执行功能清单(cefi)、cogscreen、持续性操作任务(cpt)、受控口头词语联想测试(cowat)、d2注意力测试、delis-kaplan执行功能系统(d-kefs)、数字警觉测试、图像流畅性测试、哈氏分类测试、hayling和brixton测试、爱荷华博弈任务、kaplan baycrest神经认知评估(kbna)、kaufman短神经心理评估、精神混乱量表、同步听觉系列加法测试(pasat)、苯丙酮尿症
–
生活质量(pku-qol)、rey-osterrieth复杂图形、ruff图像流畅性测试、字色混淆任务、执行控制任务、注意力变量测试(t.o.v.a.)、伦敦塔测试、连线测试(tmt)或连线a & b、威斯康辛卡片分类测试(wcst)、或符号数字模式测试。在本文所述的任何方法的一些实施方案中,该给药产生执行功能增加,例如,如通过剑桥自动化成套神经心理测试(cantab)评估所测定,例如,通过测量反应时间、空间跨度、空间工作记忆、快速数字信息处理、持续注意力和/或停止信号任务。在本文所述的任何方法的一些实施方案中,该给药产生注意力和/或情绪的改善,例如,如通过adhd-rs 5量表(或其疏忽评估)和/或概况情绪状态(poms)量表所测量。
39.在本文所述的任何方法的一些实施方案中,有效量是足以产生受试者的神经认知功能的增加(例如,执行功能增加、焦虑减少、注意力缺陷/多动障碍症状减少和/或脑雾情况减少)的量。在一些实施方案中,有效量是足以产生执行功能增加的量,例如,所述执行功能增加如通过评估所测定,该评估诸如:执行障碍综合征的行为评估 (bads)、执行功能的行为分级清单 (brief或mini-brief)、barkley执行功能缺陷量表 (bdefs)、行为控制障碍量表(bds)、aseba儿童行为检查表(cblc)、综合执行功能清单(cefi)、cogscreen、持续性操作任务(cpt)、受控口头词语联想测试(cowat)、d2注意力测试、delis-kaplan执行功能系统 (d-kefs)、数字警觉测试、图像流畅性测试、哈氏分类测试、hayling和brixton测试、爱荷华博弈任务、kaplan baycrest神经认知评估(kbna)、kaufman短神经心理评估、精神混乱量表、同步听觉系列加法测试 (pasat)、苯丙酮尿症
–
生活质量(pku-qol)、rey-osterrieth复杂图形、ruff图像流畅性测试、字色混淆任务、执行控制任务、注意力变量测试(t.o.v.a.)、伦敦塔测试、连线测试(tmt)或连线a & b、威斯康辛卡片分类测试(wcst)、或符号数字模式测试。在一些实施方案中,有效量是足以产生执行功能增加的量,该执行功能增加例如如通过剑桥自动化成套神经心理测试(cantab)评估所测定,例如,通过测量反应时间、空间跨度、空间工作记忆、快速数字信息处理、持续注意力和/或停止信号任务。在本文所述的任何方法的一些实施方案中,有效量是足以产生注意力和/或情绪的改善的量,该注意力和/或情绪的改善例如如通过adhd-rs 5量表(或其疏忽评估)和/或概况情绪状态(poms)量表所测量。
40.在本文所述的任何方法的一些实施方案中,该给药产生睡眠质量的增加和/或与睡眠剥夺相关的症状的减轻。在本文所述的任何方法的一些实施方案中,有效量是足以产
生睡眠质量的增加和/或与睡眠剥夺相关的症状的减轻的量。
41.定义在本技术中,除非从上下文中另外清楚地看出,否则(i) 术语“一个”可理解为是指“至少一个”;(ii)术语“或”可理解为是指“和/或”;(iii)术语“包含”和“包括”可理解为涵盖逐项列出的组分或步骤,无论它们是单独存在还是与一个或多个另外组分或步骤一起存在;以及(iv)术语“大约”可理解为允许标准偏差,如本领域普通技术人员将理解的那样;以及(v) 在提供范围的情况下,包括端点。
42.应当理解,本文中所述的化合物、组合物、制剂和治疗方法的描述包括“包含实施方案”、“由实施方案组成”和“基本上由实施方案组成”。在一些实施方案中,对于本文中所述的所有组合物以及使用本文中所述组合物的所有方法而言,组合物可以包含所列出组分或步骤,或者可以“基本上由所列出的组分或步骤组成”。当组合物被描述为“基本上由所列出的组分组成”,该组合物含有所列出的组分,并且可以含有不实质上影响所治疗病症的其它组分,但是不含有除了明确列出的那些组分之外的任何实质上影响所治疗病症的其它组分;或者,如果组合物确实含有除了所列出的那些之外的实质上影响所治疗病症的额外组分,该组合物也不含有足以实质上影响所治疗病症的浓度或量的该额外组分。当方法被描述为“基本上由所列出的步骤组成”时,该方法含有所列出的步骤,并且可以含有不实质上影响所治疗病症的其它步骤,但是该方法不含有除了明确列出的那些步骤之外的实质上影响所治疗病症的其它步骤。作为非限制性的具体实例,当组合物被描述为“基本上由一种组分组成”,该组合物可以另外含有任意量的药学上可接受的载体、介质或稀释剂以及不实质上影响所治疗病症的其它此类组分。
43.除非从上下文中另外清楚地看出,本文含有的对墨蝶呤的所有提及是指墨蝶呤或墨蝶呤的药学上可接受的盐。
44.如本文所使用,术语“约”表示在该术语“约”之后的值的
±
10%范围内的值。本文中提及的“约”数值或参数包括(和描述)针对该数值或参数本身的变化。例如,提及“约x”的描述包括“x”的描述,如本文所使用,术语“给药”是指将组合物(例如,化合物或包含本文所述化合物的制剂)对受试者或系统给药。对动物受试者(例如,对人)的的给药可以通过任何合适的途径。例如,在一些实施方案中,给药可以是支气管的(包括通过支气管滴注)、口腔的、肠内的、皮间的、动脉内的、皮内的、胃内的、髓内的、肌内的、鼻内的、腹膜内的、鞘内的、静脉内的、心室内的、粘膜的、鼻的、口服的、直肠的、皮下的、舌下的、局部的、气管的(包括通过气管内滴注)、经皮的、阴道的、以及玻璃体的。
[0045]“测定苯丙氨酸的水平”是指通过本领域已知的方法直接或间接检测苯丙氨酸。“直接测定”是指进行处理(例如,对样品进行测定或测试或者“分析样品”,如本文中所限定术语那样) 以获得物理实体或数值。“间接测定”是指从另一方或源(例如,直接获得了物理实体或数值的第三方实验室)接受物理实体或数值。测量苯丙氨酸水平的方法通常包括但不限于荧光测定,其中,苯丙氨酸的反应副产物与荧光探针反应。
[0046]
化合物的“有效量”可以根据个体的疾病状态、年龄、性别和重量以及化合物引起期望反应的能力等因素而不同。治疗有效量涵盖其中化合物的治疗有益效果胜过其任何毒性或有害效果的量。有效量还涵盖足以赋予益处、例如临床益处的量。
[0047]
如本文所使用,术语“对先前疗法没有反应”是指尽管利用疗法治疗,但其病况保
持稳定、变得更坏、或改善小于特定疗法(例如,如fda批准的疗法标签上所记载)的接受标准的受试者。
[0048]
如本文所使用,术语“食物”是指具有足够的体积和脂肪含量的固体食物,其在胃中不会快速溶解和吸收。例如,膳食,如早餐、中餐或晚餐。如本文所使用,术语“在进食情况下”是指在吃(例如,吃膳食)之前约30分钟至吃之后约2小时之间给药组合物。术语“不进食状况”、“禁食”或“空腹”是指在食用另外的固体食物之前至少约2小时至约30分钟没有食用固体食物的情况。
[0049]
如本文所使用,术语“高苯丙氨酸血症”是指其中与健康受试者相比,受试者血液中的苯丙氨酸水平升高的医学状况。例如,在一些实施方案中,如果受试者血液中的苯丙氨酸浓度大于60微摩尔/升,则认为受试者具有高苯丙氨酸血症。在一些实施方案中,如果受试者血液中的苯丙氨酸浓度大于120 微摩尔/升(例如,120 微摩尔/升-2400 微摩尔/升),则认为受试者具有高苯丙氨酸血症。
[0050]“水平”是指与参照相比苯丙氨酸的水平。该参照可以是如本文中所定义的任何有用的参照,例如,给药前的受试者中的水平,即,基线水平。苯丙氨酸的“降低的水平”或“增加的水平”是指与参照相比苯丙氨酸水平的降低或增加(例如,降低或增加约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约100%、约150%、约200%、约300%、约400%、约500%、或更多;与参照相比降低或增加大于约10%、约15%、约20%、约50%、约75%、约100%、或约200%;降低或增加小于约0.01倍、约0.02倍、约0.1倍、约0.3倍、约0.5倍、约0.8倍、或更少;或者增加大于约1.2倍、约1.4倍、约1.5倍、约1.8倍、约2.0倍、约3.0倍、约3.5倍、约4.5倍、约5.0倍、约10倍、约15倍、约20倍、约30倍、约40倍、约50倍、约100倍、约1000倍、或更多)。苯丙氨酸的水平可以以质量/体积(例如,g/dl、mg/ml、μg/ml、ng/ml)、浓度/体积(例如,纳摩尔/升、微摩尔/升、毫摩尔/毫升)、或相对于样品中的总氨基酸的百分比来表示。
[0051]“天然蛋白”是指来自天然来源的蛋白质(例如,动物、植物或真菌),其包括phe。
[0052]
如本文所使用,术语“药物组合物”表示含有与药学上可接受的赋形剂一起配制的本文所述的化合物的组合物。可以配制药物组合物,例如用于以单位剂型口服给药(例如,片剂、胶囊、囊片(caplet)、胶囊锭(gel cap)、悬浮液、溶液或糖浆);用于局部给药(例如,作为乳膏剂、凝胶、洗剂或软膏);用于静脉内给药(例如,作为不含颗粒栓并且在适合静脉内使用的溶剂体系中的无菌溶液);或以任何其他药学上可接受的制剂的形式。
[0053]
如本文所使用,术语“药学上可接受的盐”意指在合理的医学判断范围内适用于与人和动物的组织接触而没有不适当的毒性、刺激性、过敏反应并且与合理的效益/风险比相称的任何盐。药学上可接受的盐是本领域中公知的。例如,药学上可接受的盐描述在:berge等,j. pharmaceutical sciences 66:1-19, 1977和pharmaceutical salts: properties, selection, and use, (p.h. stahl和c.g. wermuth编), wiley-vch, 2008中。该盐可以在本文所述的化合物的最终分离和纯化期间原位制备,或者单独地通过使游离碱基团与合适的有机酸反应而制备。
[0054]
通常,将化合物制备成或用作药学上可接受的盐,该药学上可接受的盐作为药学上可接受的酸的加成产物而制备。合适的药学上可接受的酸和制备合适的盐的方法是本领域公知的。盐可以由药学上可接受的无毒酸制备,所述酸包括无机酸和有机酸。
[0055]
代表性的酸加成盐包括乙酸盐、己二酸盐、海藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐(benzenesulfonate)、苯甲酸盐、 苯磺酸盐(besylate)、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、龙胆酸盐、葡庚糖酸盐、甘油磷酸盐、乙醇酸盐、半硫酸盐、庚糖酸盐、己酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖醛酸盐(lactobionate)、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、特戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐、十一烷酸盐和戊酸盐。
[0056]“降低血液苯丙氨酸浓度”是指降低受试者的血液和/或血浆中苯丙氨酸的水平。苯丙氨酸的水平可以使用本领域已知的任何方法来测量,例如,受试者血液中苯丙氨酸的浓度可以通过干血斑或血浆分析来测量。
[0057]“墨蝶呤反应性苯丙酮尿症”是指受试者在用墨蝶呤或其药学上可接受的盐治疗长达1个月后表现出血液苯丙氨酸从基线降低的苯丙酮尿症。
[0058]
如本文所使用,术语“实质上不含”是指显示完全或接近完全程度或者所关注化合物或化合物类型的不存在程度的定性状况。生物领域的普通技术人员将理解,生物和化学现象如果有也很少地可以毫无疑问地被确定为零,例如,由于任何测量中的固有误差。因此,术语“实质上不含”在本文中用于捕获许多生物和化学测量中固有的潜在的完整性缺乏。
[0059]
如本文所使用,术语“受试者”或“患者”是指可以出于例如实验、诊断、预防和/或治疗目的而对其给药本发明所述化合物或组合物的任何生物体。典型的受试者包括任何动物(例如,哺乳动物,如小鼠、大鼠、兔、非人灵长类动物和人)。受试者可寻求或需要治疗、要求治疗、正接受治疗、将来接受治疗,或者可为受到针对特定疾病或病况的受过专业训练者照顾的人或动物。
[0060]
如本文所使用,术语“治疗”是指治疗性治疗和预防的或预防性的措施,其中目的是预防或减缓(减轻)不期望的生理学病况、病症或疾病,或获得有益的或期望的临床结果。有益的或期望的临床结果包括但不限于:症状的减轻;病况、病症或疾病的程度的减轻;病况、病症或疾病的稳定的状态(即不恶化);病况、病症或疾病进展的延迟开始或减慢;病况、病症或疾病状态的改善或缓解(部分的或完全的),不论是可检测的还是不可检测的;至少一种可测量的物理参数的改善,患者不一定可辨别;或病况、病症或疾病的改进或改善。治疗包括引起临床上显著的反应,而没有过度的副作用水平。治疗也包括与如果不接受治疗所预期的存活相比延长的存活。
[0061]
除非另有定义,否则本文使用的所有技术和科学术语具有本发明所属领域的普通技术人员所通常理解的相同含义。本文描述了用于本公开的方法和材料;也可使用本领域已知的其它合适的方法和材料。材料、方法和实例仅是说明性的,且无意为限制性的。本文提及的所有出版物、专利申请、专利、序列、数据库条目和其它参考文献均通过引用整体并入本文。在冲突的情况下,以本说明书(包括定义)为准。
[0062]
本发明的一个或多个实施方案的细节在以下描述中阐述。本发明的其它特点、目的和优点将从说明书和权利要求书中显而易见。
附图说明
[0063]
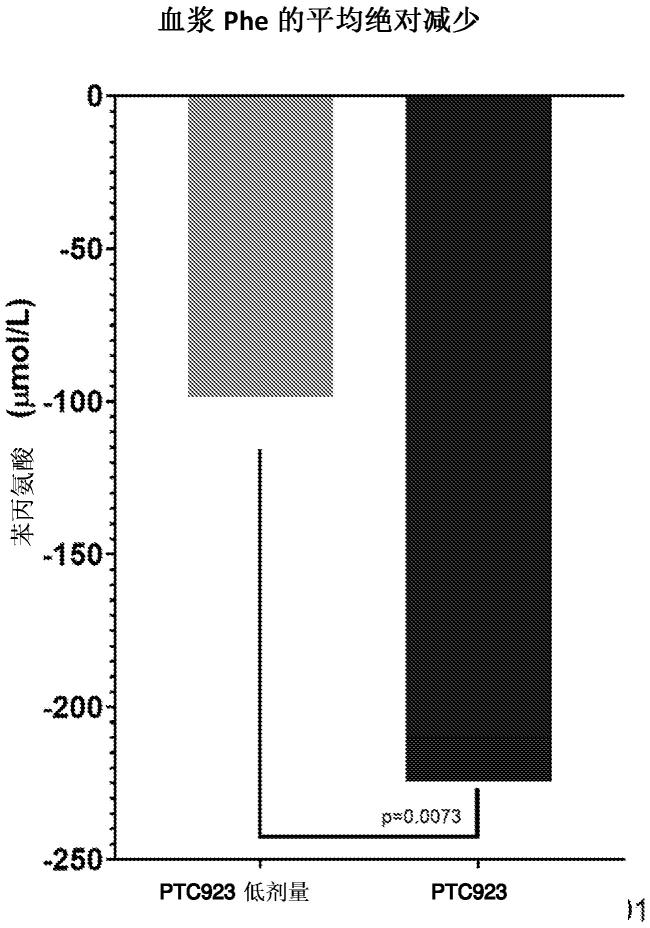
图1是说明在用ptc923低剂量和ptc923治疗后血浆苯丙氨酸浓度的平均绝对减少的图。
[0064]
图2是说明6个治疗顺序的图表,其中患者被随机分配。
[0065]
图3是说明在用沙丙蝶呤、ptc923低剂量和ptc923治疗后血液苯丙氨酸浓度相对于基线的平均绝对变化的图。
[0066]
图4是说明在用沙丙蝶呤、ptc923低剂量和ptc923治疗3天后,血液苯丙氨酸浓度相对于基线的平均绝对变化的图。
[0067]
图5是说明在用沙丙蝶呤和ptc923治疗后,各受试者的血液苯丙氨酸浓度的绝对变化的图。
[0068]
图6是说明经典pku受试者在用沙丙蝶呤和ptc923治疗后血液苯丙氨酸浓度的平均绝对变化的图。
[0069]
图7是说明在用沙丙蝶呤、ptc923低剂量和ptc923治疗后,灵敏度分析群体中血液苯丙氨酸浓度的平均绝对变化的图。
[0070]
图8是说明与用沙丙蝶呤治疗相比,用ptc923治疗的反应者的百分比增加的图。
[0071]
详细说明本发明人已经发现墨蝶呤在降低血液苯丙氨酸浓度方面出人意料地有效。特别地,本发明人已经发现墨蝶呤在将血液苯丙氨酸浓度降低至与健康受试者相同的水平方面是有效的,和/或在对利用沙丙蝶呤二盐酸盐和/或培伐利酶-pqpz的先前治疗没有反应的受试者中是有效的。因此,本发明的特征在于通过给药墨蝶呤或其药学上可接受的盐来降低受试者中的血液苯丙氨酸浓度的方法。
[0072]
墨蝶呤墨蝶呤进入细胞并通过墨蝶呤还原酶转化成7,8-二氢生物蝶呤。然后经由通过二氢叶酸还原酶的还原将7,8-二氢生物蝶呤转化成bh4。
[0073]
墨蝶呤具有结构:。
[0074]
墨蝶呤或其药学上可接受的盐可以配制成药物组合物。在一些实施方案中,本发明的药物组合物包括按总重量计20-30%的墨蝶呤或其盐,例如,约20%、22%、25%、27%或30%。在一些实施方案中,药物组合物包括按总重量计大于20%的墨蝶呤,例如,大于25%、大于30%、大于40%、大于50%、大于60%、大于70%、大于80%或大于90%。在一些实施方案中,药物组合物包括按总重量计小于20%的墨蝶呤,例如,小于20%、小于15%、小于10%或小于5%。
[0075]
在一些实施方案中,本发明的特征在于药物组合物,其包括墨蝶呤或其盐,以及按总重量计小于10%的抗氧化剂,例如,约9%、7%、5%、3%、1%、0.5%、0.25%、0.1%或没有抗氧化剂。抗氧化剂可以是抗坏血酸。在一些实施方案中,墨蝶呤或其药学上可接受的盐与抗氧化
剂的重量比为1:1,或者为大于1:1,例如,2:1、5:1、7:1或10:1。药物组合物可以包括按总重量计20-30%的墨蝶呤或其药学上可接受的盐,例如,约20%、22%、25%、27%或30%。药物组合物可以进一步包括分散剂,例如,交联羧甲基纤维素钠。药物组合物可以包括按总重量计0.1-1.5%的分散剂,例如,0.1%、0.5%、1%或1.5%。在一些实施方案中,药物组合物包括至少一个抗结块剂,例如,胶态二氧化硅或微晶纤维素。药物组合物可以包括按总重量计65-75%的抗结块剂,例如,约65%、67%、70%、73%或75%。在一些实施方案中,药物组合物包括胶态二氧化硅和微晶纤维素两者。在一些实施方案中,药物组合物包括按总重量计60-65%的微晶纤维素和按总重量计5-7%的胶态二氧化硅。在一些实施方案中,将墨蝶呤的结晶形式配制成尺寸小于140
ꢀµ
m的颗粒,例如,约120
ꢀµ
m、110
ꢀµ
m、100
ꢀµ
m、90
ꢀµ
m、80
ꢀµ
m、70
ꢀµ
m、60
ꢀµ
m、50
ꢀµ
m、40
ꢀµ
m、30
ꢀµ
m、20
ꢀµ
m、10
ꢀµ
m或5
ꢀµ
m。在一些实施方案中,药物组合物包括按总重量计小于1%的杂质,如乳酰蝶呤,例如,该组合物包括小于0.9%、小于0.8%、小于0.7%、小于0.6%、小于0.5%、小于0.4%、小于0.3%或小于0.2%。
[0076]
在一些实施方案中,墨蝶呤是墨蝶呤的盐,例如,与硫酸、对甲苯磺酸、甲磺酸、苯磺酸、丙二酸、酒石酸(例如,l-酒石酸)、磷酸、龙胆酸、富马酸、乙醇酸、乙酸或烟酸的盐。
[0077]
在一些实施方案中,墨蝶呤或其药学上可接受的盐是结晶形式。结晶墨蝶呤游离碱或墨蝶呤的盐的结晶形式可以作为无水物(例如,不具有任何结合水或溶剂或水合或溶剂化)或作为水合物、部分水合物(例如,半水合物、倍半水合物等)、作为二水合物、三水合物等存在,其中所述结晶形式结合水合水或与墨蝶呤或其盐的结晶形式缔合的溶剂分子。在一个实施方案中,结晶墨蝶呤作为一水合物或作为半水合物存在。
[0078]
在一些实施方案中,墨蝶呤以结晶形式存在,例如,如wo 2018/102314和wo 2018/102315中所描述,其结晶形式通过引用整体并入本文中。
[0079]
在一些实施方案中,墨蝶呤的结晶形式的特征在于通过用cu kα x射线照射获得的x射线粉末衍射图,该衍射图具有至少在9.7
°±
0.5,例如,9.7
ꢀ°±
0.2,10.2
°±
0.5,例如,10.2
°±
0.2,和11.3
°±
0.5,例如,11.3
°±
0.2处的以2θ表示的峰。在其它实施方案中,墨蝶呤的结晶形式的特征在于通过用cu kα x射线照射获得的x射线粉末衍射图,该衍射图具有至少在9.7
°±
0.5,例如,9.7
°±
0.2,10.2
°±
0.5,例如,10.2
°±
0.2,11.3
°±
0.5,例如,11.3
°±
0.2,14.0
°±
0.5,例如,14.0
°±
0.2,14.6
°±
0.5,例如,14.6
°±
0.2,19.9
°±
0.5,例如,19.9
°±
0.2,22.2
°±
0.5,例如,22.2
°±
0.2,25.3
°±
0.5,例如,25.3
°±
0.2,和32.4
°±
0.5,例如,32.4
°±
0.2处的以2θ表示的峰。在该结晶形式的基本上纯的形式中,可以在如表1中所示的折射角2θ处观察到峰。或者或另外,该结晶形式的特征在于dsc曲线在71.6℃和233.4℃显示两个吸热。表1
。
[0080]
在一些实施方案中,墨蝶呤的结晶形式在8.4
°±
0.5,例如,8.4
°±
0.2,16.9
°±
0.5,例如,16.9
ꢀ°±
0.2,或25.4
°±
0.5,例如,25.4
°±
0.2的衍射角2θ (
°
)处具有至少1个峰(例如,1、2或3个峰),如通过用cu kα x-射线照射的x射线衍射法所测量或由x射线衍射法所计算。在一些实施方案中,墨蝶呤的结晶形式在8.4
°±
0.5,例如,8.4
°±
0.2,14.9
°±
0.5,例如,14.9
°±
0.2,16.9
°±
0.5,例如,16.9
°±
0.2,25.4
°±
0.5,例如,25.4
°±
0.2,和34.1
°±
0.5,例如,34.1
°±
0.2的衍射角2θ (
°
)处具有至少1个峰(例如,1、2、3、4或5个),如通过用cu kα x-射线照射的x射线衍射法所测量或由x射线衍射法所计算。在该结晶形式的基本上纯的材料中,可以在如表2中所示的折射角2θ处观察到峰。或者或另外,该结晶形式的特征在于dsc曲线显示在195.2℃的熔融事件。表2。
[0081]
在一些实施方案中,墨蝶呤的结晶形式在5.7
°±
0.5,例如,5.7
°±
0.2,7.8
°±
0.5,例如,7.8
°±
0.2,或25.4
°±
0.5,例如,25.4
°±
0.2的衍射角2θ (
°
)处具有至少1个峰(例如,1、2或3个峰),如通过用cu kα x-射线照射的x射线衍射法所测量或由x射线衍射法所计算。在一些实施方案中,墨蝶呤的结晶形式在5.7
°±
0.5,例如,5.7
°±
0.2,7.8
°±
0.5,例如,7.8
°±
0.2,9.1
°±
0.5,例如,9.1
°±
0.2,11.5
°±
0.5,例如,11.5
°±
0.2,15.3
°±
0.5,例如,15.3
°±
0.2,16.0
°±
0.5,例如,16.0
°±
0.2,20.1
°±
0.5,例如,20.1
°±
0.2,25.4
°±
0.5,例如,25.4
°±
0.2,和26.6
°±
0.5,例如,26.6
°±
0.2的衍射角2θ (
°
)处具有至少1个峰(例如,1、2、3、4、5、6、7、8或9个峰),如通过用cu kα x-射线照射的x-射线衍射法所测量或由x射线衍射法所计算。在该结晶形式的基本上纯的材料中,可以在如表3中所示的折射角2θ处观察到峰。或者或另外,该结晶形式的特征在于dsc曲线在58.3℃、101.8℃、129.8℃、156.5℃和168.3℃显示五个吸热峰。表3。
[0082]
在一些实施方案中,墨蝶呤的结晶形式在8.9
°±
0.5,例如,8.9
°±
0.2,10.3
°±
0.5,例如,10.3
°±
0.2,或26.0
°±
0.5,例如,26.0
°±
0.2的衍射角2θ (
°
)处具有至少一个峰(例如,1、2或3个峰),如通过用cu kα x-射线照射的x射线衍射法所测量或由x射线衍射法所计算。在一些实施方案中,墨蝶呤的结晶形式在8.9
°±
0.5,例如,8.9
°±
0.2,10.3
°±
0.5,例如,10.3
°±
0.2,10.9
°±
0.5,例如,10.9
°±
0.2,17.8
°±
0.5,例如,17.8
°±
0.2,24.9
°±
0.5,例如,24.9
°±
0.2,26.0
°±
0.5,例如,26.0
°±
0.2,26.7
°±
0.5,例如,26.7
°±
0.2,26.8
°±
0.5,例如,26.8
°±
0.2,和28.3
°±
0.5,例如,28.3
°±
0.2的衍射角2θ (
°
)处具有至少1个峰(例如,1、2、3、4、5、6、7、8或9个峰),如通过用cu kα x-射线照射的x-射线衍射法所测量或由x射线衍射法所计算。在该结晶形式的基本上纯的材料中,可以在如表4中所
示的折射角2θ处观察到峰。或者或另外,该结晶形式的特征在于dsc曲线在42.7℃、66.3℃和232.9℃显示三个吸热。表4。
[0083]
在一些实施方案中,墨蝶呤的结晶形式在4.7
°±
0.5,例如,4.7
°±
0.2,7.4
°±
0.5,例如,7.4
°±
0.2,或26.2
°±
0.5,例如,26.2
°±
0.2的衍射角2θ (
°
)处具有至少1个峰(例如,1、2或3个峰),如通过用cu kα x-射线照射的x射线衍射法所测量或由x射线衍射法所计算。在一些实施方案中,墨蝶呤的结晶形式在4.7
°±
0.5,例如,4.7
°±
0.2,7.4
°±
0.5,例如,7.4
°±
0.2,9.5
°±
0.5,例如,9.5
°±
0.2,11.3
°±
0.5,例如,11.3
°±
0.2,15.6
°±
0.5,例如,15.6
°±
0.2,16.4
°±
0.5,例如,16.4
°±
0.2,26.2
°±
0.5,例如,26.2
°±
0.2,或27.2
°±
0.5,例如,27.2
°±
0.2的衍射角2θ (
°
)处具有至少一个峰(例如,1、2、3、4、5、6、7或8个峰),如通过用cu kα x-射线照射的x射线衍射法所测量或由x射线衍射法所计算。在该结晶形式的基本上纯的材料中,可以在如表5中所示的折射角2θ处观察到峰。或者或另外,该结晶形式的特征在于dsc曲线在82.8℃和179.8℃显示吸热峰。表5
。
[0084]
在一些实施方案中,墨蝶呤的结晶形式在6.0
°±
0.5,6.0
ꢀ°±
0.2 10.6
°±
0.5,10.6
ꢀ°±
0.2,12.1
°±
0.5,例如,12.1
°±
0.2,15.9
°±
0.5,例如,15.9
°±
0.2,20.9
°±
0.5,例如,20.9
°±
0.2,或24.6
°±
0.5,例如,24.6
°±
0.2的衍射角2θ (
°
)处具有至少一个峰(例如,1、2、3、4、5或6个峰),如通过用cu kα x-射线照射的x射线衍射法所测量或由x射线衍射法所计算。在一些实施方案中,墨蝶呤的结晶形式在6.0
°±
0.5,例如,6.0
°±
0.2,10.6
°±
0.5,例如,10.6
°±
0.2,12.1
°±
0.5,例如,12.1
°±
0.2,15.9
°±
0.5,例如,15.9
°±
0.2,18.1
°±
0.5,例如,18.1
°±
0.2,20.9
°±
0.5,例如,20.9
°±
0.2,22.1
°±
0.5,例如,22.1
°±
0.2,24.6
°±
0.5,例如,24.6
°±
0.2,26.1
°±
0.5,例如,26.1
°±
0.2,28.1
°±
0.5,例如,28.1
°±
0.2,28.9
°±
0.5,例如,28.9
°±
0.2,32.1
°±
0.5,例如,32.1
°±
0.2,或37.0
°±
0.5,例如,37.0
°±
0.2的衍射角2θ (
°
)处具有至少一个峰(例如,1、2、3、4、5、6、7、8、9、10、11、12或13个峰),如通过用cu kα x-射线照射的x-射线衍射法所测量或由x射线衍射法所计算。在该结晶形式的基本上纯的形式中,可以在如表6中所示的折射角2θ处观察到峰。或者或另外,该结晶形式的特征在于dsc曲线在112.9℃和195.8℃显示2个吸热峰。表6。
[0085]
在一些实施方案中,墨蝶呤的结晶形式在10.0
°±
0.5,例如,10.0
°±
0.2,10.6
°±
0.5,例如,10.6
°±
0.2,或25.7
°±
0.5,例如,25.7
°±
0.2的衍射角2θ (
°
)处具有至少1个峰(例如,1、2或3个峰),如通过用cu kα x-射线照射的x射线衍射法所测量或由x射线衍射法所计算。在一些实施方案中,墨蝶呤的结晶形式在10.0
°±
0.5,例如,10.0
°±
0.2,10.6
°±
0.5,例如,10.6
°±
0.2,11.2
°±
0.5,例如,11.2
°±
0.2,15.3
°±
0.5,例如,15.3
°±
0.2,15.9
°±
0.5,例如,15.9
°±
0.2,22.8
°±
0.5,例如,22.8
°±
0.2,24.4
°±
0.5,例如,24.4
°±
0.2,25.0
°±
0.5,例如,25.0
°±
0.2,25.7
°±
0.5,例如,25.7
°±
0.2,或26.6
°±
0.5,例如,26.6
°±
0.2的衍射角2θ (
°
)处具有至少一个峰(例如,1、2、3、4、5、6、7、8、9或10个),如通过用cu kα x-射线照射的x-射线衍射法所测量或由x射线衍射法所计算。在该结晶形式的基本上纯的材料中,可以在如表7中所示的折射角2θ处观察到峰。表7。
[0086]
在一些实施方案中,墨蝶呤盐酸盐的结晶形式在7.8
°±
0.5,例如,7.8
°±
0.2,12.9
°±
0.5,例如,12.9
°±
0.2,或26.2
°±
0.5,例如,26.2
°±
0.2的衍射角2θ (
°
)处具有至少一个峰(例如,1、2或3个峰),如通过用cu kα x-射线照射的x射线衍射法所测量或由x射线衍射法所计算。在一些实施方案中,在7.8
°±
0.5,例如,7.8
°±
0.2的衍射角2θ处观察到墨蝶呤盐酸盐的结晶形式的x射线衍射图中的最强峰。在该墨蝶呤的结晶盐酸盐的基本纯的材料中,可以在如表8中所示的衍射角2θ处观察到峰。或者或另外,该墨蝶呤的结晶盐酸盐的特征在于dsc曲线在225.9℃显示吸热。表8
。
[0087]
在一些实施方案中,墨蝶呤的结晶形式1甲磺酸盐的特征在于,至少在7.8
°±
0.5,例如,7.8
°±
0.2,23.5
°±
0.5,例如,23.5
°±
0.2,和29.0
°±
0.5,例如,29.0
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在23.5
°±
0.5,例如,23.5
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶形式1甲磺酸盐的基本纯的材料中,可以在如表9所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶形式1甲磺酸盐的特征在于dsc曲线在186.0℃和229.1℃显示两个吸热。表9。
[0088]
在一些实施方案中,墨蝶呤的结晶形式2甲磺酸盐的特征在于,至少在7.9
°±
0.5,例如,7.9
°±
0.2,23.4
°±
0.5,例如,23.4
°±
0.2,和28.9
°±
0.5,例如,28.9
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在23.5
°±
0.5,例如,23.5
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶形式2甲磺酸盐的基本纯的材料中,可以在如表10所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶形式2甲磺
酸盐的特征在于dsc曲线在75.5℃、182.6℃和234.9℃显示3个吸热。表10。
[0089]
在一些实施方案中,墨蝶呤的结晶形式3甲磺酸盐的特征在于,至少在21.7
°±
0.5,例如,21.7
°±
0.2,26.0
°±
0.5,例如,26.0
°±
0.2,和28.9
°±
0.5,例如,28.9
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在26.0
°±
0.5,例如,26.0
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶形式3甲磺酸盐的基本纯的材料中,可以在如表11所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶形式3甲磺酸盐的特征在于dsc曲线在195.1℃和240.1℃显示两个吸热。表11。
[0090]
在一些实施方案中,墨蝶呤的结晶烟酸盐的特征在于,至少在9.5
°±
0.5,例如,9.5
°±
0.2,9.9
°±
0.5,例如,9.9
°±
0.2,和24.5
°±
0.5,例如,24.5
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在24.5
°±
0.5,例如,24.5
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶烟酸盐的基本纯的材料中,可以在如
表12所示的折射角2θ处观察到峰。或者或另外,该墨蝶呤的结晶烟酸盐的特征在于dsc曲线在221.9℃显示吸热。表12。
[0091]
在一些实施方案中,墨蝶呤的结晶对-甲苯磺酸盐的特征在于,至少在6.5
°±
0.5,例如,6.5
°±
0.2,15.1
°±
0.5,例如,15.1
°±
0.2,和23.4
°±
0.5,例如,23.4
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在6.5
°±
0.5,例如,6.5
°±
0.2的衍射角2θ处观察到。在墨蝶呤的对-甲苯磺酸盐的基本纯的材料中,可以在如表13所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶对-甲苯磺酸盐的特征在于dsc曲线在77.2℃、202.4℃和260.2℃显示3个吸热。表13。
[0092]
在一些实施方案中,墨蝶呤的结晶苯磺酸酸盐的特征在于,至少在6.5
°±
0.5,例如,6.5
°±
0.2,14.8
°±
0.5,例如,14.8
°±
0.2,和19.6
°±
0.5,例如,19.6
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在6.5
°±
0.5,例如,6.5
°±
0.2的衍射角2θ处观察到。在墨蝶呤的苯磺酸盐的基本纯的材料中,可以
在如表14所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶苯磺酸盐的特征在于dsc曲线在202.3℃和265.5℃显示两个吸热。表14。
[0093]
在一些实施方案中,墨蝶呤的结晶磷酸盐的特征在于,至少在16.6
°±
0.5,例如,16.6
°±
0.2,22.2
°±
0.5,例如,22.2
°±
0.2,和25.6
°±
0.5,例如,25.6
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在25.6
°±
0.5,例如,25.6
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶磷酸盐的基本纯的材料中,可以在如表15所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶磷酸盐的特征在于dsc曲线在125.9℃、152.1℃和157.6℃显示3个吸热。表15。
[0094]
在一些实施方案中,墨蝶呤的结晶丙二酸盐的特征在于,至少在6.9
°±
0.5,例如,6.9
°±
0.2,22.7
°±
0.5,例如,22.7
°±
0.2,和23.8
°±
0.5,例如,23.8
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在6.9
°±
0.5,例如,6.9
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶丙二酸盐的基本纯的材料中,可以在如表16所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶丙二酸盐的特征在于dsc曲线在115.8℃显示熔化事件。表16
。
[0095]
在一些实施方案中,墨蝶呤的结晶l-酒石酸盐的特征在于,至少在7.3
°±
0.5,例如,7.3
°±
0.2,14.2
°±
0.5,例如,14.2
°±
0.2,和21.8
°±
0.5,例如,21.8
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在6.9
°±
0.5,例如,6.9
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶l-酒石酸盐的基本纯的材料中,可以在如表17所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶l-酒石酸盐的特征在于dsc曲线在97.2℃和160.6℃显示两个吸热。表17。
[0096]
在一些实施方案中,墨蝶呤的结晶龙胆酸盐的特征在于,至少在7.1
°±
0.5,例如,7.1
°±
0.2,8.7
°±
0.5,例如,8.7
°±
0.2,和26.7
°±
0.5,例如,26.7
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在7.1
°±
0.5,例如,7.1
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶龙胆酸盐的基本纯的材料中,可以在如表18所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶龙胆酸盐的特征在于dsc曲线在70.5℃、128.2℃和184.7℃显示3个吸热。表18
。
[0097]
在一些实施方案中,墨蝶呤的结晶富马酸盐的特征在于,至少在11.3
°±
0.5,例如,11.3
°±
0.2,24.0
°±
0.5,例如,24.0
°±
0.2,和28.2
°±
0.5,例如,28.2
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在至少24.0
°±
0.5,例如,24.0
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶富马酸盐的基本纯的材料中,可以在如表19所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶富马酸盐的特征在于dsc曲线在114.3℃和229.7℃显示两个吸热。表19。
[0098]
在一些实施方案中,墨蝶呤的结晶乙醇酸盐的特征在于,至少在7.6
°±
0.5,例如,7.6
°±
0.2,10.7
°±
0.5,例如,10.7
°±
0.2,和24.0
°±
0.5,例如,24.0
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在7.6
°±
0.5,例如,7.6
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶乙醇酸盐的基本纯的材料中,可以在如表20所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶乙醇酸盐的特征在于dsc曲线在133.9℃和147.7℃显示两个吸热。
表20。
[0099]
在一些实施方案中,墨蝶呤的结晶乙酸盐的特征在于,至少在6.2
°±
0.5,例如,6.2
°±
0.2,12.0
°±
0.5,例如,12.0
°±
0.2,和18.1
°±
0.5,例如,18.1
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在至少6.2
°±
0.5,例如,6.2
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶乙酸盐的基本纯的材料中,可以在如表21所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶乙酸盐的特征在于dsc曲线在146.1℃和175.4℃显示两个吸热。表21。
[0100]
在一些实施方案中,墨蝶呤的结晶形式1硫酸盐的特征在于,至少在5.1
°±
0.5,例如,5.1
°±
0.2,7.8
°±
0.5,例如,7.8
°±
0.2,和23.0
°±
0.5,例如,23.0
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在5.1
°±
0.5,例如,5.1
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶形式1硫酸盐的基本纯的材料中,可以在如表22所示的折射角2θ处观察到峰。或者或另外,墨蝶呤的结晶形式1硫酸盐的特征在于dsc曲线在94.5℃、158.3℃和209.9℃显示3个吸热。表22
。
[0101]
在一些实施方案中,墨蝶呤的结晶形式2硫酸盐的特征在于,至少在7.8
°±
0.5,例如,7.8
°±
0.2,8.8
°±
0.5,例如,8.8
°±
0.2,和24.1
°±
0.5,例如,24.1
°±
0.2的衍射角2θ处观察到的x射线衍射图中的峰。在一些实施方案中,x射线衍射图中的最强峰在8.8
°±
0.5,例如,8.8
°±
0.2的衍射角2θ处观察到。在墨蝶呤的结晶形式2硫酸盐的基本纯的材料中,可以在如表23所示的折射角2θ处观察到峰。表23。
[0102]
本发明可以使用包括药学上可接受的赋形剂和有效量的墨蝶呤或其药学上可接受的盐的药物组合物。墨蝶呤及其盐的药物组合物的实例可见于wo 2019/046849和wo 2019/232120中。其组合物通过引用整体并入本文中。
[0103]
药学上可接受的赋形剂可以是任何常规使用的赋形剂,并且仅受化学-物理考虑因素如溶解度、以及给药途径的限制。本领域技术人员将理解,除了下述药物组合物之外,墨蝶呤还可以被配制成包合复合物,例如环糊精包合复合物,或脂质体。
[0104]
本文所述的药学上可接受的赋形剂,例如介质、佐剂、赋形剂或稀释剂,是本领域
技术人员熟知的并且容易为公众所获得的。优选地,药学上可接受的赋形剂对墨蝶呤是化学惰性的,并且在使用条件下没有有害的副作用或毒性。
[0105]
增加胃和/或前肠滞留时间的制剂胃滞留药物递送是一种药物制剂被设计为在胃内停留更长时间,例如直到药物释放完成的方法。
[0106]
生物粘附剂型利用能够粘附到表面并导致药物的受控释放的聚合物。生物粘附性聚合物可以是阴离子型(例如,羧甲基纤维素、海藻酸、聚丙烯酸、果胶、角叉菜胶、聚卡波非或卡波姆);阳离子型(例如,壳聚糖、聚赖氨酸或聚凝胺);或非离子型(例如聚乙二醇、聚乙烯吡咯烷酮、葡聚糖或羟丙基甲基纤维素)。
[0107]
高密度剂型被设计成在胃中位于比幽门括约肌低的水平上,从而避免排空。适合于高密度剂型的赋形剂包括铁粉、硫酸钡、氧化锌和氧化钛。
[0108]
可膨胀剂型被设计成在胃中膨胀至大于幽门括约肌,从而避免排空。例如,包括药物核心、可溶胀水状胶体和外部半透性聚合物的剂型适合于可膨胀剂型。
[0109]
类似于可膨胀剂型,超多孔水凝胶剂型被设计成在胃中膨胀至大于幽门括约肌。超多孔水凝胶剂型可以包含聚合物,例如交联羧甲基纤维素钠。
[0110]
漂浮剂型被设计成具有比胃液低的密度。漂浮剂型可以包括组合物,所述组合物包含离子交换树脂、浮筏体系、可充气室、泡腾混合物、可溶胀水状胶体或多颗粒体系。
[0111]
抗氧化剂墨蝶呤在暴露于空气时易于快速氧化。因此,本发明的药物组合物可以包含抗氧化剂。所述抗氧化剂可以使墨蝶呤的氧化降解最小化。抗氧化剂的实例包括但不限于抗坏血酸、生育酚、视黄醇、抗坏血酸棕榈酸酯、n-乙酰基半胱氨酸、谷胱甘肽、乙二胺四乙酸、亚硫酸氢钠、偏亚硫酸氢钠、硫脲、丁基化羟基甲苯、丁基化羟基茴香醚和维生素e。在一些实施方案中,本发明的药物组合物包含抗坏血酸、生育酚、视黄醇、抗坏血酸棕榈酸酯、n-乙酰基半胱氨酸、谷胱甘肽、丁基化羟基甲苯和/或丁基化羟基茴香醚作为抗氧化剂。
[0112]
在一些实施方案中,药物组合物包含以重量计小于10%,例如小于9%、小于8%、小于7%、小于6%、小于5%、小于4%、小于3%、小于2%、小于1%的抗氧化剂,或基本上不含抗氧化剂。在一些实施方案中,药物组合物包含以总重量计2-9%,例如2-4%、3-5%、4-6%、5-7%、6-8%或7-9%的抗氧化剂。在一些实施方案中,药物组合物包含5-100%的usp最大日剂量的抗氧化剂,例如,在一些实施方案中,药物组合物包含约5%、10%、15%、20%、30%、40%、50%、60%、70%、80%、90%或100%的usp最大日剂量的抗氧化剂。在一些实施方案中,墨蝶呤与抗氧化剂的比率以重量计为至少1:1,例如2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1或10:1。
[0113]
分散剂在一些实施方案中,本发明的药物组合物包含至少一种分散剂。所述分散剂可以引起制剂中的颗粒分离,例如,在与水分接触时释放其药物物质。 分散剂的实例包括但不限于交联聚乙烯吡咯烷酮、羧甲基纤维素(例如交联羧甲基纤维素盐,例如交联羧甲基纤维素钠)、淀粉(例如羟基乙酸淀粉钠)或海藻酸。在一些实施方案中,药物组合物中的分散剂是羧甲基纤维素,例如交联羧甲基纤维素的药学上可接受的盐。在一些实施方案中,药物组合物可以包含以总重量计0.1-1.5%,例如约0.1%、0.5%、1%或1.5%的分散剂。在一些实施方案中,药物组合物包含以总重量计小于1.5%,例如小于1%、小于0.5%或小于0.1%的分散剂。
[0114]
防结块剂在一些实施方案中,本发明的药物组合物包含至少一种抗结块剂。在一些实施方案中,药物组合物包含至少两种抗结块剂。示例性抗结块剂包括胶体二氧化硅、微晶纤维素、磷酸三钙、微晶纤维素、硬脂酸镁、碳酸氢钠、亚铁氰化钠、亚铁氰化钾、亚铁氰化钙、磷酸钙、硅酸钠、胶体二氧化硅、硅酸钙、三硅酸镁、滑石粉、铝硅酸钠、硅酸铝钾、铝硅酸钙、膨润土、硅酸铝、硬脂酸和聚二甲基硅氧烷。在一些实施方案中,所述至少一种抗结块剂是胶体二氧化硅或微晶纤维素。在一些实施方案中,药物组合物可以包含以总重量计65-75%,例如约65%、67%、70%、73%或75%的抗结块剂。在一些实施方案中,药物组合物包括胶态二氧化硅和微晶纤维素两者。在一些实施方案中,药物组合物包括按总重量计60-65%的微晶纤维素和按总重量计5-7%的胶态二氧化硅。
[0115]
给药介质在一些实施方案中,在给药之前将本发明的药物组合物与给药介质组合,例如粘度为大约50-1750厘泊(cp)的给药介质。可以使用的一种类型的悬浮剂是甘油和蔗糖在水中的组合(例如,在水中含有2.5%甘油和27%蔗糖的medisca
®
口服混合物)。可以在将要给药之前将适量的组合物添加到给药介质混合物中,并搅拌以悬浮组合物。
[0116]
其他悬浮剂也可以用作给药介质。示例性悬浮剂包括琼脂、海藻酸、羧甲基纤维素钠、角叉菜胶、糊精、明胶、瓜尔胶、羟乙基纤维素、羟丙基纤维素、羟丙甲纤维素、甲基纤维素、聚乙二醇、聚维酮、黄蓍胶、黄原胶或本领域已知的其他悬浮剂。
[0117]
剂量墨蝶呤或其药学上可接受的盐可以以任何合适的剂量使用。合适的剂量和剂量方案可以通过常规的范围确定技术来确定。通常,治疗以小于最佳剂量的较小剂量开始。此后,以小增量增加剂量,直到达到在这样的情况下的最佳效果。为了方便起见,如果需要,则总日剂量可以分开并且在一天内分部分给药。在适当的剂量下且在适当给药某些化合物时,本发明提供了宽范围的反应。典型地,剂量范围为约2.5至约150 mg/kg正治疗的受试者体重/天,例如,60 mg/kg/天。例如,在实施方案中,墨蝶呤或其药学上可接受的盐可以每天一次或多次,给药约20 mg/kg
ꢀ‑ꢀ
约150 mg/kg、约20 mg/kg
ꢀ‑ꢀ
约60 mg/kg、约40 mg/kg
ꢀ‑ꢀ
约100 mg/kg、约100 mg/kg
ꢀ‑ꢀ
约150 mg/kg、约60 mg/kg
ꢀ‑ꢀ
约120 mg/kg、约80 mg/kg
ꢀ‑ꢀ
约100 mg/kg、约40 mg/kg
ꢀ‑ꢀ
约60 mg/kg、约2.5 mg/kg
ꢀ‑ꢀ
约20 mg/kg、约2.5 mg/kg
ꢀ‑ꢀ
约10 mg/kg、或约2.5 mg/kg
ꢀ‑ꢀ
约5 mg/kg的受试者体重/天,以获得期望的治疗效果。
[0118]
在一些实施方案中,墨蝶呤或其药学上可接受的盐可以配制成单位固体口服剂型,如颗粒剂。在这些实施方案中,每个单位固体口服剂型例如小袋可以包含任何合适量的墨蝶呤或其药学上可接受的盐。例如,各固体口服剂型可以包含约2.5 mg、约5 mg、约10 mg、约20 mg、约30 mg、约40 mg、约50 mg、约60 mg、约70 mg、约80 mg、约90 mg、约100 mg、约125 mg、约150 mg、约175 mg、约200 mg、约225 mg、约250 mg、约275 mg、约300 mg、约325 mg、约350 mg、约375 mg、约400 mg、约425 mg、约450 mg、约475 mg、约500 mg、约750 mg、约1 g、约1.25 g、或约1.5 g。
[0119]
墨蝶呤或其药学上可接受的盐可用于制备液体制剂,例如溶液、悬浮液或乳液的形式。适于口服给药的制剂包括但不限于:(a)胶囊、小袋、片剂、锭剂和糖锭,各自含有预定量的作为固体或颗粒的活性成分;(b)粉末;(c)液体溶液,例如溶解在稀释剂(例如水、盐水
或橙汁)中的有效量的化合物;(d)在适当液体中的悬浮液;和(e)合适的乳液。优选固体口服剂型,例如胶囊形式、片剂形式和粉末形式。胶囊形式可以是普通的硬壳或软壳明胶类型的胶囊形式,其含有例如表面活性剂、润滑剂和惰性填充剂,例如乳糖、蔗糖、磷酸钙和玉米淀粉。片剂形式可以包含乳糖、蔗糖、甘露醇、玉米淀粉、马铃薯淀粉、海藻酸、微晶纤维素、阿拉伯胶、明胶、瓜尔胶、胶体二氧化硅、交联羧甲基纤维素钠、滑石、硬脂酸镁、硬脂酸钙、硬脂酸锌、硬脂酸以及其他赋形剂、着色剂、稀释剂、缓冲剂、崩解剂、润湿剂、防腐剂、调味剂和药理学相容的赋形剂中的一种或多种。锭剂形式可以包含在调味剂(通常是蔗糖和阿拉伯胶或黄蓍胶)中的活性成分,以及包含在惰性基质(例如明胶和甘油,或蔗糖和阿拉伯胶)中的活性成分的含片、乳液、凝胶等,其除了活性成分之外,还包含本领域已知的那些赋形剂。
[0120]
适合口服和/或肠胃外施用的制剂包括水性和非水性等渗无菌注射溶液(其可以含有抗氧化剂、缓冲剂、抑菌剂和使制剂与预期接受者的血液等渗的溶质)以及水性和非水性无菌悬浮液(其可以包含悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂)。所述化合物可以在药物赋形剂中的生理学上可接受稀释剂中施用,如无菌液体或液体混合物,包括水、盐水、水性右旋糖和相关糖溶液、醇如乙醇、苄醇或十六醇、二醇如丙二醇或聚乙二醇以及其他聚乙烯醇、甘油缩酮如2,2-二甲基-1,3-二氧戊环-4-甲醇、醚如聚(乙二醇) 400、油、脂肪酸、脂肪酸酯或甘油酯、或乙酰化的脂肪酸甘油酯,加入或不加入药学上可接受的表面活性剂如皂或洗涤剂、悬浮剂如果胶、卡波姆、甲基纤维素、羟丙基甲基纤维素或羧甲基纤维素、或乳化剂和其他药物佐剂。
[0121]
本发明的特点在于口服耐受的配方的药物组合物,其含有治疗有效量的墨蝶呤和小于10%的抗氧化剂。在一些实施方案中,药物组合物是分散在药学上可接受的赋形剂中的颗粒制剂,例如,组合物可以混合到水中并由受试者摄取(例如,在5至10分钟的过程中)。在本发明中使用的合适制剂可见于remington’s pharmaceutical sciences, mack publishing company, philadelphia, pa, 第22版,2010中。任何常规的赋形剂除非与活性成分不相容,否则预期将其用于药物组合物中。此外,对于动物(例如人)施用,应当理解,制剂应当满足如fda生物标准办公室所要求的无菌性、致热原性、一般安全性和纯度标准。
[0122]
用于口服给药的固体剂型口服使用的制剂包括含有与无毒的药学上可接受的赋形剂混合的活性成分的颗粒,并且这类制剂是本领域技术人员已知的(例如,美国专利号:5,817,307、5,824,300、5,830,456、5,846,526、5,882,640、5,910,304、6,036,949、6,036,949、6,372,218,其通过引用结合到本文中)。赋形剂可以是例如惰性稀释剂或填充剂(例如,蔗糖、山梨醇、糖、甘露醇、微晶纤维素、淀粉(包括马铃薯淀粉)、碳酸钙、氯化钠、乳糖、磷酸钙、硫酸钙或磷酸钠);成粒和崩解剂(例如,纤维素衍生物,包括微晶纤维素,淀粉,包括马铃薯淀粉,交联羧甲基纤维素钠,海藻酸盐,或海藻酸);粘合剂(例如蔗糖、葡萄糖、山梨醇、阿拉伯胶、海藻酸、海藻酸钠、明胶、淀粉、预胶化淀粉、微晶纤维素、硅酸铝镁、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、聚乙烯吡咯烷酮或聚乙二醇);和润滑剂、助流剂、抗粘剂(例如硬脂酸镁、硬脂酸锌、硬脂酸、二氧化硅、氢化植物油或滑石)和抗结块剂(例如胶体二氧化硅、微晶纤维素、磷酸三钙、微晶纤维素、硬脂酸镁、碳酸氢钠、亚铁氰化钠、亚铁氰化钾、亚铁氰化钙、磷酸钙、硅酸钠、胶体二氧化硅、硅酸钙、三硅酸镁、滑石粉、铝硅酸钠、硅酸铝
钾、铝硅酸钙、膨润土、硅酸铝、硬脂酸、聚二甲基硅氧烷)。其他药学上可接受的赋形剂可以是着色剂、调味剂、增塑剂、保湿剂和缓冲剂。在一些实施方案中,赋形剂(例如,调味剂)与组合物一起包装。在一些实施方案中,赋形剂(例如,调味剂)与组合物分开包装(例如,在给药前与组合物合并)。
[0123]
本发明的固体组合物可以包括适于保护组合物免受不希望的化学变化(例如,在活性物质释放之前的化学降解)的包衣。可以以与上文的encyclopedia of pharmaceutical technology中所述的类似方式将包衣应用在固体剂型上。
[0124]
粉末和颗粒可以使用上述成分以常规方式使用例如混合器、流化床设备、熔融凝固设备、转子造粒机、挤出/滚圆机或喷雾干燥设备制备。
[0125]
治疗方法墨蝶呤可作为有用的治疗剂用于与血液苯丙氨酸浓度升高相关的疾病,例如高苯丙氨酸血症或苯丙酮尿症。如本文中所述,可以治疗这些疾病的各种形式,例如,由苯丙酮尿症、四氢生物蝶呤反应性苯丙酮尿症、墨蝶呤反应性苯丙酮尿症、经典苯丙酮尿症或非经典苯丙酮尿症引起的高苯丙氨酸血症。因此,根据本发明的各种形式的墨蝶呤或其盐可以以有效量对受试者给药以获得对疾病、病症或病况的治疗或改善。
[0126]
通过本文中的方法治疗的受试者典型地具有大于120 微摩尔/升(例如,大于200 微摩尔/升、大于300 微摩尔/升、大于360 微摩尔/升、大于400 微摩尔/升、大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、大于1100 微摩尔/升或大于1200 微摩尔/升)的血液苯丙氨酸浓度(例如,未受控制的苯丙氨酸血液浓度)。受试者还可以通过具有120-360 微摩尔/升、360-600 微摩尔/升、600-1200 微摩尔/升、或大于1200 微摩尔/升的血液苯丙氨酸浓度 (例如,未受控制的苯丙氨酸血液浓度)来分层。
[0127]
在现有疗法(例如苯丙氨酸限制饮食、沙丙蝶呤或培伐利酶-pqpz)下血液苯丙氨酸降低不足的受试者也可以通过本文中所述的方法来治疗。例如,通过除墨蝶呤之外的疗法治疗的受试者在现有管理中可以具有大于120 微摩尔/升 (例如,大于200 微摩尔/升、大于300 微摩尔/升、大于360 微摩尔/升、大于400 微摩尔/升、大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、大于1100 微摩尔/升、或大于1200 微摩尔/升)的血液苯丙氨酸浓度。
[0128]
给药墨蝶呤或其药学上可接受的盐可以将受试者的血液苯丙氨酸浓度降低至小于600 微摩尔/升,例如,小于360 微摩尔/升或小于120 微摩尔/升,如120-360 微摩尔/升或360-600 微摩尔/升。或者或另外,给药墨蝶呤可以将受试者的例如墨蝶呤的给药前的血液苯丙氨酸浓度降低至少10%(例如,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或约10%-约30%、约20%-约40%、约30%-约50%、约40%-约60%、约50%-约70%、约60%-约80%、或约70%-约90%)。该降低可在给药至少1周(例如,在2周、3周、4周、5周、6周、至少约2周、至少约3周、至少约4周、至少约5周、至少约6周)后确定。给药墨蝶呤还可以在受试者的血浆中在给药10小时内产生至少50 ng/ml的bh4浓度 (例如,至少60 ng/ml、至少100 ng/ml、至少200 ng/ml、至少400 ng/ml、至少600 ng/ml、至少1000 ng/ml、或至少
2000 ng/ml、或者50 ng/ml-100 ng/ml、60 ng/ml-400 ng/ml、200 ng/ml-600 ng/ml、400 ng/ml-1000 ng/ml、或者 600 ng/ml-1500 ng/ml)。
[0129]
受试者可能对利用沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)或培伐利酶-pqpz的治疗没有反应。例如,在给药培伐利酶-pqpz后,受试者的血液血浆浓度可以降低小于20%。例如,在给药至少约10 mg/kg (例如,至少约15 mg/kg、至少约20 mg/kg)的沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)时,受试者的血液血浆浓度降低小于30%,或者在给药至少约20 mg每天一次培伐利酶-pqpz至少8天(例如,至少14天、至少21天、至少28天、至少30天)后,受试者的血液血浆浓度降低小于20%。在一些实施方案中,给药例如至少约10 mg/kg (例如,至少约15 mg/kg、至少约20 mg/kg)的沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)时,受试者的血液血浆浓度降低小于15-30%。在一些实施方案中,给药例如至少约10 mg/kg (例如,至少约15 mg/kg、至少约20 mg/kg)的沙丙蝶呤或其药学上可接受的盐 (例如,沙丙蝶呤二盐酸盐)时,受试者的血液血浆浓度降低小于30%。在一些实施方案中,给药例如至少约10 mg/kg (例如,至少约15 mg/kg、至少约20 mg/kg)的沙丙蝶呤或其药学上可接受的盐 (例如,沙丙蝶呤二盐酸盐)时,受试者的血液血浆浓度降低小于20%。在一些实施方案中,给药例如至少约10 mg/kg (例如,至少约15 mg/kg、至少约20 mg/kg)的沙丙蝶呤或其药学上可接受的盐 (例如,沙丙蝶呤二盐酸盐)时,受试者的血液血浆浓度降低小于15%。在一些实施方案中,在给药沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)至少8天(例如,至少14天、至少21天、至少28天、至少30天)或者至少约20 mg每天一次培伐利酶-pqpz至少16周(例如,至少18周、至少20周、至少22周、至少24周)后,受试者的血液血浆浓度大于120 微摩尔/升(例如,大于200 微摩尔/升、大于300 微摩尔/升、大于360 微摩尔/升、大于400 微摩尔/升、大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、大于1100 微摩尔/升、或大于1200 微摩尔/升)。 例如,在给药至少约10 mg/kg (例如,至少约15 mg/kg、至少约20 mg/kg)的沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)至少8天(例如,至少14天、至少21天、至少28天、至少30天)或者至少约20 mg每天一次培伐利酶-pqpz至少16周(例如,至少18周、至少20 周、至少22 周、至少24周)后,受试者的血液血浆浓度大于120 微摩尔/升(例如,大于200 微摩尔/升、大于300 微摩尔/升、大于360 微摩尔/升、大于400 微摩尔/升、大于450 微摩尔/升、大于500 微摩尔/升、大于550 微摩尔/升、大于600 微摩尔/升、大于650 微摩尔/升、大于700 微摩尔/升、大于800 微摩尔/升、大于900 微摩尔/升、大于1000 微摩尔/升、大于1100 微摩尔/升、或大于1200 微摩尔/升)。
[0130]
由于不良反应(例如,过敏反应、注射部位反应、关节痛、超敏反应、头痛、持续至少14天的全身性皮肤反应、瘙痒、恶心、腹痛、口咽疼痛、呕吐、咳嗽、腹泻和/或疲劳)而停止利用培伐利酶-pqpz的治疗后,也可以对受试者给药墨蝶呤。与给药了至少10 mg/kg (例如,至少15 mg/kg、至少20 mg/kg)沙丙蝶呤或其药学上可接受的盐(例如,沙丙蝶呤二盐酸盐)和/或耐受性受试者相比,可以降低不良事件(例如,头痛、鼻漏、咽喉疼痛、腹泻、呕吐、咳嗽和/或鼻塞)的风险。
[0131]
在一些实施方案中,受试者正在接受苯丙氨酸限制饮食 (例如,受试者正在接受包括牛奶替代品或配方如phenyl-free 2和测定量的水果、蔬菜、面包、意大利面和谷物的
饮食)。在一些实施方案中,受试者未在接受苯丙氨酸限制饮食 (例如,受试者未在接受包括牛奶替代品或配方如phenyl-free 2和测定量的水果、蔬菜、面包、意大利面和谷物的饮食)。在一些实施方案中,受试者具有小于3000 mg/天 (例如,小于2500 mg/天、小于2000 mg/天、小于1500 mg/天、小于1000 mg/天、小于500 mg/天)的中值苯丙氨酸摄入量。利用墨蝶呤的治疗可以允许与苯丙氨酸消耗或天然蛋白质消耗相结合的血液苯丙氨酸浓度的降低(例如,低于600、360、或120 微摩尔/升)。例如,受试者可以以至少约1000 mg/天 (例如,至少约1100 mg/天、至少约1200 mg/天、至少约1300 mg/天、至少约1400 mg/天、至少约1500 mg/天、至少约1600 mg/天、至少约1700 mg/天、至少约1800 mg/天、至少约1900 mg/天、或者至少约2000 mg/天、或者1000 mg/天-1400 mg/天、1200 mg/天-1600 mg/天、1300 mg/天-1700 mg/天、1600 mg/天-2000 mg/天、1800 mg/天-2400 mg/天、2000 mg/天-3000 mg/天、3000 mg/天-4000 mg/天、4000-5000 mg/天)消耗苯丙氨酸。在一些实施方案中,受试者的饮食中小于25% (例如,小于20%、小于15%、小于10%或小于5%)的蛋白是天然蛋白,或者受试者的饮食中大于25% (例如,大于30%、大于40%、大于50%、大于60%、大于70%、大于80%、大于90%、大于95%、大于99%)的蛋白是天然蛋白。在一些实施方案中, 受试者具有大于10 g/天 (例如,大于20 g/天、大于30 g/天、大于40 g/天、大于50 g/天、大于60 g/天、大于70 g/天、大于80 g/天、或约10 g/天-约30 g/天、约20 g/天-约40 g/天、约30 g/天-约50 g/天、约40 g/天-约60 g/天、约50 g/天-约70 g/天、约60 g/天-约80 g/天)的天然蛋白质摄入量。在本文所述的任何方法的一些实施方案中,受试者具有小于10 g/天 (例如,小于5 g/天、或约5 g/天-约10 g/天)的天然蛋白质摄入量。
[0132]
在一些实施方案中,受试者具有pku,pku定义为任何先前血液phe测量值 》360
ꢀµ
mol/l加上至少一次测量值 》450
ꢀµ
mol/l,或3次最近的血液phe测量值的平均值 》450
ꢀµ
mol/l。在一些实施方案中,受试者不具有pku,pku定义为任何先前血液phe测量值 》360
ꢀµ
mol/l加上至少一次测量值 》450
ꢀµ
mol/l,或3次最近的血液phe测量值的平均值 》450
ꢀµ
mol/l。在一些实施方案中,受试者具有经典的pku,该pku定义为至少1,200
ꢀµ
mol/l的血液phe的任何文献记载的历史测量值。在一些实施方案中,受试者不具有经典的pku,该pku定义为至少1,200
ꢀµ
mol/l的血液phe的任何文献记载的历史测量值。
[0133]
在一些实施方案中,受试者是儿童(例如,受试者小于18岁、小于17岁、小于16岁、小于15岁、小于14岁、小于13岁、小于12岁、小于11岁、小于10岁、小于9岁、小于8岁、小于7岁、小于6岁、小于5岁、小于4岁、小于3岁、小于2岁、小于1岁)。在一些实施方案中,受试者是成人(例如,受试者大于18岁)。
[0134]
在一些实施方案中,该治疗可以增加受试者的神经认知功能(例如,执行功能增加、焦虑减少、注意力缺陷/多动障碍症状减少和/或脑雾情况减少)。执行功能的变化可以通过评估测定,该评估诸如:执行障碍综合征的行为评估(bads)、执行功能的行为分级清单 (brief或mini-brief)、barkley执行功能缺陷量表(bdefs)、行为控制障碍量表(bds)、aseba儿童行为检查表(cblc)、综合执行功能清单(cefi)、cogscreen、持续性操作任务(cpt)、受控口头词语联想测试(cowat)、d2注意力测试、delis-kaplan执行功能系统(d-kefs)、数字警觉测试、图像流畅性测试、哈氏分类测试、hayling和brixton测试、爱荷华博弈任务、kaplan baycrest神经认知评估(kbna)、kaufman短神经心理评估、精神混乱量表、同步听觉系列加法测试(pasat)、苯丙酮尿症
–
生活质量(pku-qol)、rey-osterrieth复杂图
形、ruff图像流畅性测试、字色混淆任务、执行控制任务、注意力变量测试(t.o.v.a.)、伦敦塔测试、连线测试(tmt)或连线a & b、威斯康辛卡片分类测试(wcst)、符号数字模式测试、或剑桥自动化成套神经心理测试(cantab)评估,例如,通过测量反应时间、空间跨度、空间工作记忆、快速数字信息处理、持续注意力和/或停止信号任务。治疗可以产生注意力和/或情绪的改善,例如,如通过adhd-rs 5量表(或其疏忽评估)和/或概况情绪状态(poms)量表所测量。治疗可以产生睡眠质量的增加和/或与睡眠剥夺相关的症状的减轻。
[0135]
墨蝶呤可以在进食情况下给药或不在进食情况下给药。不受理论束缚,在进食情况下给药墨蝶呤例如通过降低墨蝶呤的吸收速率而导致bh4血浆暴露的增加。如果给药的墨蝶呤被快速吸收,例如,通过空腹给药,则细胞中的墨蝶呤还原酶和/或二氢叶酸还原酶可以在高于v
max
下变得饱和,导致给药的墨蝶呤的至少一部分离开细胞而未被还原为7,8-二氢生物蝶呤和随后还原为bh4。然后,这种过量的墨蝶呤可以被排泄,而从不转化成bh4,导致与在进食的情况下给药墨蝶呤相比,血浆中的bh4水平更低,这降低了墨蝶呤的吸收速率或延长了墨蝶呤的吸收,并且导致反应速率低于、处于或略高于墨蝶呤还原酶和/或二氢叶酸还原酶的底物饱和的v
max
。在进食情况下给药墨蝶呤出乎意料地导致与在不进食的情况下给药相比最大bh4血浆浓度(cmax)和暴露程度的增加,所述暴露程度通过从bh4的零时间至最后浓度的浓度时间曲线下面积(auc
0-last
)测量。例如,有效量的墨蝶呤是足以在进食情况下给药10小时内在受试者的血浆中产生至少50 ng/ml的bh4浓度 (例如,至少60 ng/ml、至少100 ng/ml、至少200 ng/ml、至少400 ng/ml、至少600 ng/ml、至少1000 ng/ml、或至少2000 ng/ml、或者 50 ng/ml-100 ng/ml、60 ng/ml-400 ng/ml、200 ng/ml-600 ng/ml、400 ng/ml-1000 ng/ml、或者 600 ng/ml-1500 ng/ml)的量(例如,每剂量2.5 mg/kg-100 mg/kg)。有效量包括比足以在不进食状况下给药墨蝶呤10小时内在受试者的血浆中产生至少50 ng/ml (例如,至少60 ng/ml、至少100 ng/ml、至少200 ng/ml、至少400 ng/ml、至少600 ng/ml、至少1000 ng/ml或至少2000 ng/ml、或者50 ng/ml-100 ng/ml、60 ng/ml-400 ng/ml、200 ng/ml-600 ng/ml、400 ng/ml-1000 ng/ml、或 600 ng/ml-1500 ng/ml)的最大bh4血浆浓度(cmax)的量低至少5% (至少10%、至少20%、至少50%、至少70%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%、或至少150%)的剂量。
[0136]
在本文所述的任何方法的一些实施方案中,食物是高蛋白食物。在本文所述的任何方法的一些实施方案中,食物是高脂肪食物(例如,至少25、30、40或50%的卡路里来自脂肪)。在本文所述的任何方法的一些实施方案中,食物是高蛋白和高脂肪食物。在一些实施方案中,食物是高卡路里食物 (例如,食物包括至少100卡路里,例如,至少200卡路里、至少300卡路里、至少400卡路里、至少500卡路里,例如,500-1500或800-1000卡路里)。在本文所述的任何方法的一些实施方案中, 食物是膳食,例如,早餐、中餐或晚餐。墨蝶呤可以以与所食用食物分开的组合物来提供(例如,墨蝶呤未被整合至食物产品中)。
[0137]
对受试者的给药可以发生在食用食物前小于30分钟或在食用食物后,例如,临食用食物前直至食用后1小时,例如基本上与食物同时。与在不进食情况下给药(例如,发生在食用食物后大于2小时直至食用另外的食物前30 分钟)相比,在进食情况下给药(例如,发生在食用食物前小于30 分钟、或在食用食物后,例如,临食用食物前直至食用1小时后)可能导致bh4的cmax或者bh4的产生程度和所得血浆暴露 (auc
0-last
)的增加(例如,至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少
100%、至少110%、至少120%、至少130%、至少140%、或至少150%)。
[0138]
对受试者给药的本发明组合物的实际剂量可以通过物理和生理因素(例如体重、病况的严重程度、所治疗疾病的类型、先前或同时的治疗干预、受试者的特发病)和给药途径来确定。根据剂量和给药途径,优选剂量和/或有效量的给药次数可以根据受试者的反应而变化。在任何情况下,负责给药的从业者将确定组合物中活性成分的浓度和用于个体受试者的适当剂量。
[0139]
在一些实施方案中,受试者接受每剂量约2.5 mg/kg-120 mg/kg(例如,约20 mg/kg
ꢀ‑ꢀ
约60 mg/kg、或约20 mg/kg、约30 mg/kg、约40 mg/kg、约50 mg/kg、约60 mg/kg)。受试者可以在治疗期间每天1次、每天2次或每天3次接受包含墨蝶呤的药物组合物。在一些实施方案中,除了补充bh4(如果他们正在服用bh4)外,受试者继续他们目前的其它高苯丙氨酸血液浓度治疗(例如,苯丙氨酸限制饮食)。在一些实施方案中,受试者可能不允许服用任何已知抑制叶酸合成的药物(例如,甲氨蝶呤、培美曲塞或三甲曲沙)。墨蝶呤或其药学上可接受的盐可以以两个相等的剂量(例如,一天的不同时间的两个剂量)给药,例如两个60 mg/kg剂量(例如,早上一个60 mg/kg剂量和晚上一个60 mg/kg剂量)、两个40 mg/kg剂量(例如,早上一个40 mg/kg剂量和晚上一个40 mg/kg剂量)、两个30 mg/kg剂量(例如,早上一个30 mg/kg剂量和晚上一个30 mg/kg剂量)、两个20 mg/kg剂量(例如,早上一个20 mg/kg剂量和晚上一个20 mg/kg剂量)、或两个10 mg/kg剂量(例如,早上一个10 mg/kg剂量和晚上一个10 mg/kg剂量)。
[0140]
在一些实施方案中,服用bh4的受试者中止bh4的给药(即,bh4洗脱,例如在开始墨蝶呤治疗之前或同时)。可以在用本发明的药物组合物治疗之前的7、5、3和1天的bh4洗脱期间或直到bh4洗脱期间的任何时间点处血液phe水平>360
ꢀµ
mol/l时获得用于phe浓度的血液样品。在一些实施方案中,测试给药前血液样品的墨蝶呤、phe、bh4和酪氨酸 (tyr)。
[0141]
等同物和范围本领域技术人员将认识到或者能够使用不超过常规的实验确定根据本文中所述的本发明的具体实施方案的许多等同物。本发明的范围并不意欲限于以上描述,而是如所附权利要求书所阐述。
[0142]
此外,应当理解,落入现有技术范围内的本发明的任何特定实施方案可以明确地从任何一个或多个权利要求中排除。由于这类实施方案被认为是本领域普通技术人员已知的,因此即使在此没有明确地阐述排除,也可以将它们排除。本发明的组合物的任何特定实施方案(例如,任何化合物;任何生产方法;任何使用方法;等)都可以出于任何原因而从任何一项或多项权利要求中排除,无论是否与现有技术的存在有关。
实施例
[0143]
实施例1.食物对墨蝶呤给药的影响的评价方法:受试者在禁食状态和进食状态下间隔1周接受2次口服剂量的墨蝶呤(10 mg/kg)。在第8天接受其第二口服剂量的墨蝶呤之前30分钟开始,给受试者喂食标准的高脂肪(大约50%的膳食总热量)和高卡路里(大约800至1000卡路里)膳食。
[0144]
pk分析的取样发生在第1天和第8天给药前(给药之前30分钟内)和在第1天和第8天给药之后0.5小时、1小时、2小时、4小时、8小时、12小时和24小时。
[0145]
通过mng labs分析墨蝶呤和bh4的血液浓度。
[0146]
通过腰椎穿刺在第1天(给药之前)和第7天(即每日给药7天后)从如由血液分析所测定的最大观察血浆bh4浓度(tmax)的时间起大约30分钟收集选择的受试者的脑脊液(csf)。通过mng labs分析脑脊液(csf)。提供描述性统计学以表征在第1天样品结果和第7天样品结果之间神经递质代谢的任何变化。
[0147]
结果:如下表24和25以及图1所示,令人惊奇地,与给药之前禁食的受试者相比,给药之前进食时受试者血浆中的bh4的cmax高得多。此外,当在进食状态下给药墨蝶呤时,相对于禁食状态下给药墨蝶呤,血浆墨蝶呤浓度降低,但bh4浓度增加(图1)。血浆墨蝶呤的几何平均比率(禁食/进食,90% ci)对于auc
last
为1.29 (0.84至2.00),且对于c
max
为1.57 (1.21至2.0)。血浆bh4的相应比率(90% ci)对于auc0–
inf
为0.58 (0.47至0.71),且对于c
max
为0.55 (0.45至0.68)。与禁食状态下给药墨蝶呤相比,当在进食状态下给药墨蝶呤时,如通过auc
0-inf
和auc
last
所测量的bh4总暴露增加了1.7倍。表24.禁食受试者的血浆中bh4浓度的总结。表25.进食受试者的血浆中bh4浓度的总结。
[0148]
此外,如下表26和27所示,令人惊讶地,与给药之前禁食的受试者相比,给药之前进食时受试者血浆中的墨蝶呤的cmax低得多。表26.禁食受试者的血浆中墨蝶呤浓度的总结表27.进食受试者的血浆中墨蝶呤浓度的总结
。
[0149]
实施例2.进食受试者和禁食受试者中不良事件的比较方法:12受试者在禁食条件下给予单剂量(10 mg/kg)的墨蝶呤,然后在进食条件下7天后给予。使用不良事件(ae)的标准定义。全因ae是在任何时间发生的那些;治疗-紧急不良事件(teae)是在研究治疗的给药时或给药后发生的那些。与研究药物相关的teae基于研究者的意见。严重ae定义为威胁生命或导致死亡、住院或现有住院的延长,或者是持续或显著的失能/无能或进行正常生命功能的能力的实质性破坏,或先天性异常/出生缺陷。
[0150]
结果:如表28中所示,令人惊奇地,与禁食的受试者相比,当向进食的受试者给药墨蝶呤时,不良事件的发生率降低。表28.禁食条件和进食条件下不良事件的比较。
[0151]
实施例3.给药多剂量墨蝶呤的药代动力学分析方法:将三组八名进食受试者各自随机分组,以6:2的比率接受每日一次的墨蝶呤或安慰剂,持续7天。还使用了前哨剂量策略来给药最高剂量的墨蝶呤。
[0152]
结果:墨蝶呤和bh4的血浆-时间浓度在用墨蝶呤治疗1天和7天之后是相似的,没有药物积累。药代动力学数据示于下表29中。
[0153]
表29.多次给药墨蝶呤的药代动力学数据的总结
。
[0154]
实施例4.通过给药墨蝶呤降低pku患者的苯丙氨酸血液浓度在筛选合格性之后,开始7天的磨合期。然后患者接受7天的每天一次口服治疗,其中以随机顺序使用ptc923 20 mg/kg/天 (“低剂量”)、ptc923 60 mg/kg/天、或沙丙蝶呤二盐酸盐。ptc923 (以前称为cnsa-001)是口服墨蝶呤。将各患者随机分配到6个治疗顺序中的一个(图2)。6个不同治疗顺序的随机化旨在使延滞效应、治疗期效应、患者疲劳和血液phe水平的自然波动最小化。每个有效治疗期间隔7天的洗脱期。要求患者维持其通常的研究前饮食,包括如果处方的话消耗氨基酸混合物,并且在整个研究中由代谢营养学家监测。
[0155]
在随机化前7、5、3和1天采集用于测量phe的血样。在治疗期间,在给药前第1天和给药后第3、5和7天取血。在洗脱期,在第1、3、5和7天取血测量phe。所有样品均在禁食条件下或不早于餐后3小时和在一天的相同时间采集。在中央生物分析实验室(agilex biolabs pty ltd),使用经由利用mitra
®
4-取样器抓斗(sampler clamshell)的体积吸收微量取样(vams
®
)的经验证的干血取样lc-ms-ms技术,测量血液phe。
[0156]
将24名患者随机化:所有均完成了研究并被纳入功效和安全性群体中。患者的平均年龄为26岁,平均体重为69 kg(表30)。三分之二的患者是女性(67%)。所有患者均未接受沙丙蝶呤治疗。二十四名患者中的十一名(46%)具有经典pku,该pku定义为至少1,200
ꢀµ
mol/l的血液phe的任何文献记载的历史测量值。列出了用于管理pku的包括氨基酸的补充物,如在研究前13名患者(54%)和在研究期间14名患者(58%)所接受的。表30.患者人口统计。
[0157]
所有患者均以低蛋白、phe限制饮食进入研究,并且被指示在整个研究过程中不改变其每日蛋白摄入。在基线,三组的平均[sd]每日饮食phe摄入相似(ptc923 60 mg/kg 2,550 [1,371] mg; ptc923 20 mg/kg 2,265 [946] mg; 沙丙蝶呤二盐酸盐 20 mg/kg 2,510 [1,395] mg)。所有组的每日饮食phe摄入到第7天的平均变化均增加,分别是19 [1,260] mg、650 [1,262] mg、和523 [1,132] mg。
[0158]
监测ptc923安全性,并使用监管活动医学词典(meddra
®
)21.0版编码不良事件 (aes)。治疗-紧急不良事件 (teaes)定义为在研究药物的首次给药时或之后开始的ae。teae与目前正在接受的研究治疗或其发病前的最后一次研究治疗相关。在研究者的判断中,治疗相关的teae可能、或许或者明确与治疗相关。严重ae (sae)定义为导致死亡、威胁生命的ae、住院病人住院或现有住院的延长、持续或显著的失能/无能或进行正常生命功能的能力的实质性破坏、或先天性异常/出生缺陷。
[0159]
结果:ptc923在任何剂量下均使血液phe显著地由基线降低(表31)。ptc923 60 mg/kg在降低血液phe方面明显比沙丙蝶呤二盐酸盐 20 mg/kg更有效(p=0.0098)。ptc923 20 mg/kg对血液phe的效果在数值上大于沙丙蝶呤二盐酸盐 20 mg/kg,如图1所示,ptc923低剂量导致约100 微摩尔/升的血浆苯丙氨酸的平均绝对减少,ptc923导致大于200 微摩尔/升的血浆苯丙氨酸的平均绝对减少。表31.血液phe的平均变化。
[0160]
自基线血液phe水平的最小二乘平均(lsm)变化(se)为:ptc923 60 mg/kg为
–
206.4 (41.8)
ꢀµ
mol/l (p《0.0001),ptc923 20 mg/kg为
–
146.9 (41.8)
ꢀµ
mol/l (p=0.0010)和沙丙蝶呤二盐酸盐为
–
91.5 (41.7)
ꢀµ
mol/l (p=0.0339) (图3)。ptc923的效果
似乎是剂量相关的。
[0161]
实现血液phe 《360
ꢀµ
mol/l的患者的比例为:随机分配到ptc923 60 mg/kg的患者12/24 (50%),随机分配到ptc923 20 mg/kg的患者11/24 (46%),和随机分配到沙丙蝶呤二盐酸盐的患者10/24 (42%)。在ptc923的任一剂量中实现了血液phe 《360
ꢀµ
mol/l的患者的比例为13/24 (54%)。
[0162]
血液phe在研究治疗中迅速下降。治疗开始后(第3天)血液phe中自基线到第1次phe测量值的最小二乘平均变化(se; p值)为:ptc923 60 mg/kg为
–
206.6 (36.6; p《0.0001)
ꢀµ
mol/l;ptc923 20 mg/kg为
–
167.5 (36.6; p《0.0001)
ꢀµ
mol/l;和沙丙蝶呤二盐酸盐为
–
72.3 (36.6; p=0.0543)
ꢀµ
mol/l。ptc923剂量相对于沙丙蝶呤二盐酸盐在第3天的血液phe减少的平均变化均显著更大(ptc923 60 mg/kg和ptc923 20 mg/kg的lsm差分别为:
–
131.3 [se 33.8; p=0.0007]和
–
95.2 [se 33.7; p=0.0135]) (图4)。
[0163]
如图5所示,在研究中,与沙丙蝶呤二盐酸盐相比,ptc923导致更优异的血液苯丙氨酸浓度的降低。
[0164]
11名患有经典pku的患者中的血液phe的最小二乘平均变化(se; p值)为:ptc923 60 mg/kg为
–
150.8 (63.1; p=0.0287)
ꢀµ
mol/l,ptc923 20 mg/kg为
–
71.5 (61.8; p=0.2629)
ꢀµ
mol/l,和沙丙蝶呤二盐酸盐为
–
2.8 (62.0; p=0.9640)
ꢀµ
mol/l(表31)。ptc923 60 mg/kg与沙丙蝶呤二盐酸盐之间的比较接近统计学显著性(lsm差为
–
148.0 [se 63.0; p=0.0566]
ꢀµ
mol/l) (图6)。
[0165]
进行灵敏度分析,排除了基线血液phe 《300
ꢀµ
mol/l的患者的治疗期。灵敏度分析群体中的血液phe中自基线的最小二乘平均变化(se; p值)为:ptc923 60 mg/kg为
–
226.9 (44.2; p《0.0001)
ꢀµ
mol/l,ptc923 20 mg/kg为
–
167.8 (45.2; p=0.0007)
ꢀµ
mol/l,和沙丙蝶呤二盐酸盐 20 mg/kg为
–
105.5 (43.7; p=0.0211)
ꢀµ
mol/l。ptc923 60 mg/kg相对于沙丙蝶呤二盐酸盐的平均血液phe降低显著更大(lsm差为-121.4 [se 42.9]
ꢀµ
mol/l, p=0.0146) (图7)。
[0166]
还在19名基线phe ≥300
ꢀµ
mol/l的患者的所有治疗期中进行了辅因子应答分析。19名中的12名患者(在任何治疗组中) (63%)显示出≥20%的血液phe降低。该组12名应答者的血液phe中自基线的最小二乘平均变化(se; p值)为:ptc923 60 mg/kg为
–
322.2 (60.0; p《0.0001)
ꢀµ
mol/l;ptc923 20 mg/kg为
–
234.8 (61.2; p=0.0011)
ꢀµ
mol/l;和沙丙蝶呤二盐酸盐为
–
139.70 (58.6; p=0.0277)
ꢀµ
mol/l。ptc923 60 mg/kg相对于沙丙蝶呤二盐酸盐的血液phe降低的平均变化显著更大(lsm差为-182.5 [se 62.0]
ꢀµ
mol/l, p=0.0158) (图8)。用ptc923治疗显示血液phe降低≥20%的患者的数量比用沙丙蝶呤治疗的患者的数量高50%。用ptc923 60mg/kg治疗并显示phe自基线降低至少30%的患者中的绝对平均百分比变化和绝对phe降低分别为
–
72.5%和
–
485.3
ꢀµ
mol/l。
[0167]
相似数量的患者(ptc923 60 mg/kg/ptc923 20 mg/kg/沙丙蝶呤二盐酸盐)报告了任何不良事件 (ae; 29%/25%/21%)、严重ae (0%/4%/0%)、或治疗相关的ae (13%/0%/0%)。头痛是最常见的全因ae (17%/4%/4%),并且在所有情况中均是短暂的。
[0168]
在≥1名患者中没有其他个体ae发生。大多数ae的严重程度是轻微的(19/22,全部ae的86%)。2名患者报告了中度严重ae(结膜炎、痛经),1名患者报告了重度ae (胃肠反流病);这3例中度至重度ae没有一种与治疗相关。没有sae,没有因ae而中断的患者。生命体征
和ecg参数的变化通常很小,并且在治疗组之间是可比较的。
[0169]
该研究的主要目的是评估ptc923的功效,其测量为自基线的平均血液phe变化。功效群体由随机的所有患者组成,这些患者在治疗前和至少一个治疗期的治疗第3、5和7天进行了血液phe测量。安全性群体由随机的所有患者组成,这些患者接受了任何剂量的研究治疗。样品量计算基于沙丙蝶呤的所有参与者、安慰剂对照的监管研究,其中观察到的血液phe的平均减少为99
ꢀµ
mol/l,标准偏差为220
ꢀµ
mol/l,且假设血液phe中的真实平均减少为300
ꢀµ
mol/l(80%效能,使用0.05的双侧α)。
[0170]
通过测量血液phe中自基线的平均变化(计算为每个治疗期的第3、5和7天的测量平均值)来评价对ptc923的反应。每个治疗期的第1天给药前血液phe浓度作为该期间个体患者的特定基线。
[0171]
使用用于重复测量的线性混合模型(mmrm)对每个治疗期的血液phe中自基线的变化进行建模。功效模型包括每个治疗期、治疗组、序列、周期的基线的固定效应以及每个序列内的随机受试者效应,其具有一阶自回归ar (1)协方差结构。不包括非计划的协变量。
[0172]
通过用dunnet’s多重比较调整方法计算最小二乘平均值,在每次ptc923治疗和沙丙蝶呤治疗之间进行phe中自基线的变化的成对比较。对于每个成对比较,计算血液phe水平中的估计变化、它们的标准误差(se)和相关的p值。使用dunnet’s调整方法来解释测试组与对照组的多重比较。这种调整确保了在零假设下的总体i型错误率被保持,尽管多个测试组与单个对照组比较。
[0173]
计算每个治疗的血液phe的总平均变化,并测定标准偏差(sd)。
[0174]
预先指定的灵敏度分析排除了基线phe《 300
ꢀµ
mol/l的治疗期,应答者分析考察了基线≥300
ꢀµ
mol/l的患者,这些患者对沙丙蝶呤和/或ptc923治疗应答 ≥20%降低。
[0175]
使用sas v. 9.4分析数据。
[0176]
总结:令人惊讶地,ptc923导致在降低血液苯丙氨酸浓度方面相对于沙丙蝶呤二盐酸盐具有统计学上显著的优势,尽管该研究仅纳入24名受试者。进而,约45%的经典pku受试者对ptc923作出反应,其中苯丙氨酸水平降低至少20%。这是令人惊讶的,因为历史上只有约10%的经典pku受试者对沙丙蝶呤二盐酸盐治疗有反应。相比于沙丙蝶呤二盐酸盐,ptc923还具有令人惊讶地高的应答者总体水平。与用沙丙蝶呤二盐酸盐治疗相比,对ptc923响应的受试者比对沙丙蝶呤二盐酸盐响应的受试者多60%,并且3-4倍的受试者数被标准化,即具有小于120 微摩尔/升的第7天血液苯丙氨酸浓度。实际上,与接受沙丙蝶呤二盐酸盐的受试者相比,接受ptc923的受试者达到标准化的血液苯丙氨酸浓度即小于120 微摩尔/升的可能性为13.45倍。具体地,相比于沙丙蝶呤二盐酸盐的15.4%,用ptc923治疗的非经典受试者的46%被标准化。用ptc923治疗的受试者也报告了睡眠质量的改善和更好的注意力。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。