用于检测核酸的测定和方法
交叉引用
1.本技术要求于2019年6月18日提交的美国临时申请号:62/863,178、于2019年7月26日提交的美国临时申请号:62/879,325、于2019年 8月1日提交的美国临时申请号:62/881,809、于2019年12月6日提交的美国临时申请号:62/944,926、和于2020年3月5日提交的美国临时申请号:62/985,850的优先权和权益,其各自的全部内容通过引用并入本文。
背景技术:
2.许多传染病很容易从一个个体或环境传播到另一个体。这些疾病可能包括但不限于流感。患有流感的个体可能会出现不良后果。对疾病的检测,尤其是在感染的早期阶段,可以提供治疗或干预方面的指导,从而减缓疾病的进展或传播。
技术实现要素:
3.在多个方面,本公开内容提供了一种用于检测靶核酸的微流体盒,其包括:与阀流体连接的扩增腔室;与所述阀流体连接的检测腔室,其中所述阀与样品计量通道连接;经由阻力通道与所述检测腔室流体连接的检测试剂腔室,所述检测试剂腔室包含可编程核酸酶、指导核酸和经标记的检测核酸,其中所述经标记的检测核酸能够在所述指导核酸与靶核酸的区段结合后被切割。
4.在一些方面,所述样品计量通道控制在通道或腔室中分配的液体体积。在一些方面,所述样品计量通道与所述检测腔室流体连接。在一些方面,所述阻力通道具有蛇形路径、角形路径或迂回路径。在一些方面,所述阀是旋转阀、气动阀、液压阀、弹性阀。在一些方面,所述阻力通道与所述阀流体连接。在一些方面,所述阀包括壳体,所述壳体包括“基底”或“包覆成型件(over-mold)”。在一些方面,所述阀由螺线管致动。在一些方面,所述阀由手动、磁力、电力、热、双稳态电路、压电材料、电化学、相变、流变、气动、止回阀、毛细管作用或它们的任何组合控制。在一些方面,所述旋转阀流体连接至少 3个、至少4个或至少5个腔室。
5.在一些方面,所述微流体盒还包括与所述扩增腔室流体连接的扩增试剂腔室。在一些方面,所述微流体盒还包括与所述扩增试剂腔室流体连接的样品腔室。在一些方面,所述微流体盒还包括与所述样品腔室连接的样品入口。在一些方面,所述样品入口是可密封的。在一些方面,所述样品入口在所述样品周围形成密封。
6.在一些方面,所述样品腔室包含裂解缓冲液。在一些方面,所述微流体盒还包括与所述样品腔室流体连接的裂解缓冲液储存腔室。在一些方面,所述裂解缓冲液储存腔室包含裂解缓冲液。在一些方面,所述裂解缓冲液是双重裂解/扩增缓冲液。
7.在一些方面,所述裂解缓冲液储存腔室通过第二阀与所述样品腔室流体连接。在一些方面,所述样品腔室通过所述扩增试剂腔室与所述扩增腔室流体连接。在一些方面,所述样品腔室通过所述扩增腔室与所述扩增试剂腔室流体连接。在一些方面,所述微流体盒被配置成在所述扩增试剂腔室和扩增腔室之间双向引导流体。在一些方面,所述检测试剂
腔室与所述扩增腔室流体连接。在一些方面,所述扩增腔室通过所述检测试剂腔室与所述检测腔室流体连接。在一些方面,包括位于所述检测腔室上方的试剂端口,所述试剂端口被配置成将流体从所述检测试剂腔室输送至所述检测腔室。在一些方面,所述扩增腔室通过所述检测腔室与所述检测试剂腔室流体连接。
8.在一些方面,所述阻力通道被配置成减少回流至所述检测腔室和所述检测试剂腔室。在一些方面,所述样品计量通道被配置成将预定体积的流体从所述检测试剂腔室引导至所述检测腔室。在一些方面,所述扩增腔室和检测腔室是热隔绝的。在一些方面,所述检测试剂腔室与所述检测腔室流体连接。在一些方面,所述检测试剂腔室经由第二阻力通道与所述检测腔室流体连接。在一些方面,所述阻力通道或所述第二阻力通道是蛇形阻力通道。在一些方面,所述阻力通道或所述第二阻力通道包括至少两个发夹。在一些方面,所述阻力通道或所述第二阻力通道包括至少一个、至少2个、至少3个或至少4个直角。
9.在一些方面,所述扩增腔室包括可密封的样品入口。在一些方面,所述样品入口被配置成在拭子周围形成密封。在一些方面,微流体盒被配置成与第一泵连接以将流体从所述扩增腔室泵送至所述检测腔室。在一些方面,微流体盒被配置成与第二泵连接以将流体从所述检测试剂腔室泵送至所述检测腔室。在一些方面,第一泵或第二泵是气动泵、蠕动泵、液压泵或注射泵。在一些方面,所述扩增腔室与被配置成接收气动压力的端口流体连接。在一些方面,所述扩增腔室通过通道与所述端口流体连接。在一些方面,所述扩增试剂腔室与被配置成接收气动压力的第二端口连接。在一些方面,所述扩增试剂腔室通过第二通道与所述第二端口流体连接。
10.在一些方面,所述微流体盒被配置成与第三泵连接以将流体从所述扩增试剂腔室泵送至所述扩增腔室。在一些方面,所述第三泵是气动泵、蠕动泵、液压泵或注射泵。在一些方面,所述检测试剂腔室与被配置成接收气动压力的端口连接。在一些方面,所述检测试剂腔室通过第三通道与第三端口流体连接。
11.在一些方面,所述微流体盒被配置成与第四泵连接以将流体从所述检测试剂腔室泵送至所述检测腔室。在一些方面,所述第四泵是气动泵、蠕动泵、液压泵或注射泵。
12.在一些方面,所述微流体盒还包括被配置成与气体歧管耦合的多个端口,其中所述多个端口被配置成接收气动压力。在一些方面,所述微流体盒的任一腔室与多个端口连接。在一些方面,所述阀在施加电流电信号后打开。
13.在一些方面,所述检测试剂腔室呈圆形。在一些方面,所述检测试剂腔室呈细长形。在一些方面,所述检测试剂腔室呈六边形。在一些方面,所述阻力通道的区域被模制成在垂直于所述净流动方向的方向上引导流动。在一些方面,所述阻力通道的区域被模制成在垂直于由所述阻力通道的两端限定的轴线的方向上引导流动。在一些方面,所述阻力通道的区域被模制成沿所述微流体盒的z轴线引导流动。在一些方面,所述阀经由扩增混合物分流器与两个检测腔室流体连接室。在一些方面,所述阀通过扩增混合物分流器与3、4、5、6、7、8、9 或10个检测腔室流体连接。
14.在一些方面,所述微流体盒还包括与所述检测试剂腔室和所述检测腔室流体连接的第二阀。在一些方面,所述检测腔室具有疏水性 ptfe通口。在一些方面,所述检测腔室包括光学透明表面。
15.在一些方面,所述扩增腔室被配置成容纳10μl至500μl的流体。在一些方面,所述
扩增试剂腔室被配置成容纳10μl至500μl的流体。在一些方面,所述微流体盒被配置成接纳2μl至100μl的包含核酸的样品。在一些方面,所述扩增试剂腔室包含5至200μl扩增缓冲液。在一些方面,所述扩增腔室包含45μl扩增缓冲液。在一些方面,所述检测试剂腔室储存5至200μl的含有所述可编程核酸酶、所述指导核酸和所述经标记的检测核酸的流体。
16.在一些方面,所述微流体盒包括2、3、4、5、6、7或8个检测腔室。在一些方面,所述2、3、4、5、6、7或8个检测腔室与单个样品腔室流体连接。在一些方面,所述检测腔室容纳多达100μl、200μl、 300μl或400μl的流体。
17.在一些方面,所述微流体盒包括5-7层。在一些方面,所述盒包括如图130b所示的层。在一些方面,所述微流体盒还包括被配置成适配滑动鲁尔尖端的样品入口。在一些方面,所述滑动鲁尔尖端适合于安装容纳样品的注射器。在一些方面,所述样品入口能够被气密密封。
18.在一些方面,所述微流体盒还包括滑动阀。在一些方面,所述滑动阀将所述扩增试剂腔室与所述扩增腔室连接。在一些方面,所述滑动阀将所述扩增腔室与所述检测试剂腔室连接。在一些方面,所述滑动阀将所述扩增试剂腔室与所述检测腔室连接。
19.在多个方面,本公开内容提供了一种歧管,其被配置成接纳所述微流体盒。在一些方面,所述歧管包括被配置成将流体泵入所述检测腔室的泵、被配置成照亮所述检测腔室的照明源、被配置成检测由所述经标记的检测核酸产生的可检测信号的检测器、和被配置成加热所述扩增腔室的加热器。在一些方面,所述歧管还包括被配置成加热所述检测腔室的第二加热器。
20.在一些方面,所述照明源是广谱光源。在一些方面,所述照明源光产生带宽小于5nm的照明。在一些方面,所述照明源是发光二极管。在一些方面,所述发光二极管产生白光、蓝光或绿光。
21.在一些方面,所述可检测信号是光。在一些方面,所述检测器是照相机或光电二极管。在一些方面,所述检测器的检测带宽小于100 nm、小于75nm、小于50nm、小于40nm、小于30nm、小于20nm、小于10nm或小于5nm。
22.在一些方面,所述歧管还包括被配置成位于所述检测腔室和所述检测器之间的滤光器。在一些方面,所述扩增腔室包含扩增试剂。在一些方面,所述扩增试剂腔室包含扩增试剂。在一些方面,所述扩增试剂包含引物、聚合酶、dntp、扩增缓冲液。在一些方面,所述扩增腔室包含裂解缓冲液。在一些方面,所述扩增试剂腔室包含裂解缓冲液。在一些方面,所述扩增试剂包含逆转录酶。在一些方面,所述扩增试剂包含热循环扩增试剂。在一些方面,所述扩增试剂包含等温扩增试剂。在一些方面,所述扩增试剂包含用于以下项的试剂:转录介导的扩增(tma)、解旋酶依赖性扩增(hda)、环状解旋酶依赖性扩增(chda)、链置换扩增(sda)、环介导的扩增(lamp)、指数扩增反应(expar)、滚环扩增(rca)、连接酶链反应(lcr)、简单方法扩增rna靶标(smart)、单引物等温扩增(spia)、多置换扩增(mda)、基于核酸序列的扩增(nasba)、铰链引发的引物依赖性核酸扩增(hip)、切口酶扩增反应(near)或改进的多置换扩增(imda)。在一些方面,所述扩增试剂包含用于环介导的扩增(lamp)的试剂。
23.在一些方面,所述裂解缓冲液和所述扩增缓冲液是单一缓冲液。在一些方面,所述裂解缓冲液储存腔室包含裂解缓冲液。在一些方面,所述裂解缓冲液的ph值为ph 4至ph 5。
24.在一些方面,所述微流体盒还包含逆转录试剂。在一些方面,所述逆转录试剂包含
逆转录酶、引物和dntp。在一些方面,所述可编程核酸酶包含ruvc催化结构域。在一些方面,所述可编程核酸酶是 v型crispr/cas效应蛋白。在一些方面,所述v型crispr/cas效应蛋白是cas12蛋白。在一些方面,所述cas12蛋白包含cas12a多肽、cas12b多肽、cas12c多肽、cas12d多肽、cas12e多肽、c2c4 多肽、c2c8多肽、c2c5多肽、c2c10多肽和c2c9多肽。在一些方面,所述cas12蛋白与seq id no:27-seq id no:37中任一项具有至少 80%、至少85%、至少90%、至少92%、至少95%、至少97%或至少 99%序列同一性。在一些方面,所述cas12蛋白选自seq id no: 27-seq id no:37。
25.在一些方面,所述v型crispr/cas效应蛋白是cas14蛋白。在一些方面,所述cas14蛋白包含cas14a多肽、cas14b多肽、cas14c多肽、cas14d多肽、cas14e多肽、cas14f多肽、cas14g多肽、cas14h 多肽、cas14i多肽、cas14j多肽或cas14k多肽。在一些方面,所述 cas14蛋白与seq id no:38-seq id no:129中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%或至少99%序列同一性。在一些方面,所述cas14蛋白选自seq id no:38-seqid no:129。
26.在一些方面,所述v型crispr/cas效应蛋白是casф蛋白。在一些方面,所述casф蛋白与seq id no:274-seq id no:321中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少 97%或至少99%序列同一性。在一些方面,所述casф蛋白选自seq idno:274-seq id no:321。
27.在一些方面,所述微流体盒还提供用于体外转录扩增的冠状病毒靶核酸的一个或多个腔室。在一些方面,所述体外转录包括使所述扩增的冠状病毒靶核酸与用于体外转录的试剂接触。在一些方面,所述用于体外转录的试剂包含rna聚合酶、ntp和引物。
28.在一些方面,所述可编程核酸酶包含hep切割结构域。在一些方面,所述可编程核酸酶是vi型crispr/cas效应蛋白。在一些方面,所述vi型crispr/cas效应蛋白是cas13蛋白。在一些方面,所述 cas13蛋白包含cas13a多肽、cas13b多肽、cas13c多肽、cas13c多肽、cas13d多肽或cas13e多肽。在一些方面,所述cas13蛋白与seqid no:130-seq id no:137中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%或至少99%序列同一性。在一些方面,所述cas13蛋白选自seq id no:130-seq id no:137。
29.在一些方面,所述靶核酸来自病毒。在一些方面,所述病毒包含呼吸道病毒。在一些方面,所述呼吸道病毒是上呼吸道病毒。在一些方面,所述病毒包含流感病毒。在一些方面,所述病毒包含冠状病毒。
30.在一些方面,所述冠状病毒靶核酸来自sars-cov-2。在一些方面,所述冠状病毒靶核酸来自n-基因、e-基因或其组合。在一些方面,所述冠状病毒靶核酸具有seq id no:333-seq id no:338中任一项的序列。在一些方面,所述流感病毒包含甲型流感病毒、乙型流感病毒或其组合。在一些方面,所述多个靶序列包含来自甲型流感病毒、乙型流感病毒和第三病原体的序列。
31.在一些方面,所述指导核酸是指导rna。在一些方面,所述指导核酸与seq id no:323-seq id no:328中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、或至少99%序列同一性。在一些方面,所述指导核酸选自seq id no:323-seq idno:328中的任一项。在一些方面,所述微流体盒包含对照核酸。在一些方面,所述对照核酸在所述检测腔室中。在一些方面,所述对照核酸是rnasep。在一些方面,所述对照核酸具有
seq id no:379的序列。
32.在一些方面,所述指导核酸与seq id no:330-seq id no:332中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%或至少99%序列同一性。在一些方面,所述指导核酸选自 seq id no:330-seq id no:332中的任一项。在一些方面,所述指导核酸靶向多个靶序列。
33.在一些方面,所述微流体盒包含针对病毒平铺的多个指导序列。在一些方面,所述经标记的检测核酸包含单链报道分子,所述单链报道分子包含检测部分。在一些方面,所述检测部分是荧光团、fret 对、荧光团/猝灭剂对或电化学报道分子。在一些方面,所述电化学报道分子包含图149中所示的种类。在一些方面,经标记的检测子在所述检测核酸切割后产生可检测信号。在一些方面,所述可检测信号是比色信号、荧光信号、电流信号或电位信号。
34.在多个方面,本公开内容提供了一种检测靶核酸的方法,所述方法包括:提供受试者的样品;将样品添加至微流体盒中;将可检测信号与存在或不存在靶核酸相关联;和任选地定量所述可检测信号,从而定量所述样品中存在的所述靶核酸的量。
35.在一些方面,所述微流体盒可用于检测靶核酸的方法中。在一些方面,所述系统可用于检测靶向核酸的方法中。在一些方面,可编程核酸酶可用于检测靶核酸的方法中。在一些方面,所述组合物可用于检测靶标核酸的方法中。在一些方面,dna激活的可编程rna核酸酶可用于测定样品中病毒的靶脱氧核糖核酸的方法中。在一些方面, dna激活的可编程rna核酸酶可用于测定样品中病毒的靶核糖核酸的方法。在一些方面,可编程核酸酶可用于检测样品中的靶核酸的方法中。
36.在多个方面,本公开内容提供了一种用于检测靶核酸的系统,所述系统包含:靶向来自病毒的靶序列的指导核酸;在与指导核酸和靶序列复合时能够被激活的可编程核酸酶;和报道分子,其中所述报道分子能够被激活的核酸酶切割,从而产生可检测信号。
37.在一些方面,所述报道分子包含单链报道分子,所述单链报道分子包含检测部分。在一些方面,所述病毒包含流感病毒。在一些方面,所述流感病毒包含甲型流感病毒、乙型流感病毒或其组合。在一些方面,所述病毒包含呼吸道病毒。在一些方面,所述呼吸道病毒是上呼吸道病毒。在一些方面,所述指导核酸靶向多个靶序列。
38.在一些方面,所述系统包含多个针对病毒平铺的指导序列。在一些方面,所述多个靶序列包含来自甲型流感病毒、乙型流感病毒和第三病原体的序列。在一些方面,单链报道分子在5’末端包含检测部分。在一些方面,单链报道分子包含生物素-dt/fam部分或生物素
ꢀ‑
dt/rox部分。在一些方面,单链报道分子在3’末端包含能够与基底缀合的化学功能柄。
39.在一些方面,基底是磁珠。在一些方面,基底是反应腔室的表面。在一些方面,反应腔室的下游是测试线。在一些方面,测试线包含链霉亲和素。在一些方面,测试线的下游是流动对照线。在一些方面,流动对照线包含抗igg抗体。在一些方面,抗igg抗体包含抗兔igg 抗体。
40.在一些方面,激活的核酸酶能够切割单链报道分子并释放生物素
ꢀ‑
dt/fam部分或生物素-dt/rox部分。在一些方面,生物素-dt/fam 部分能够结合在测试线的链霉亲和素。在一些方面,报道分子是电活性报道分子。在一些方面,电活性报道分子包含生物素和亚甲蓝。在一些方面,报道分子是酶-核酸。在一些方面,酶-核酸是转化酶。在一些方面,酶-核酸
的酶是空间位阻酶。
41.在一些方面,在酶-核酸的核酸切割时,酶具有功能性。在一些方面,可检测信号是比色信号、荧光信号、电流信号或电位信号。
42.在多个方面,本公开内容提供了一种检测样品中靶核酸的方法,包括:使样品与靶向靶序列的指导核酸;在与指导核酸和靶序列复合时能够被激活的可编程核酸酶;和报道分子接触,其中所述报道分子能够被激活的核酸酶切割,从而产生可检测信号。
43.在一些方面,所述靶核酸来自外源病原体。在一些方面,所述外源病原体包含病毒。在一些方面,所述病毒包含流感病毒。在一些方面,所述流感病毒包含甲型流感病毒、乙型流感病毒或其组合。在一些方面,所述病毒包含呼吸道病毒。在一些方面,所述呼吸道病毒是上呼吸道病毒。
44.在一些方面,可检测信号表明样品中存在病毒。在一些方面,所述方法进一步包括诊断从其采集样品的受试者带有病毒。在一些方面,所述受试者是人。在一些方面,所述样品是口腔拭子、鼻拭子或尿液。在一些方面,所述报道分子包含单链报道分子,所述单链报道分子包含检测部分。在一些方面,所述指导核酸靶向多个靶序列。
45.在一些方面,所述系统包含针对病毒平铺的多个指导序列。在一些方面,多个靶序列包含来自甲型流感病毒、乙型流感病毒和第三病原体的序列。在一些方面,单链报道基因在5’末端包含检测部分。在一些方面,单链报道分子包含生物素-dt/fam部分或生物素-dt/rox 部分。在一些方面,单链报道分子在3’末端包含能够与基底缀合的化学功能柄。在一些方面,基底是磁珠。
46.在一些方面,基底是反应腔室的表面。在一些方面,反应腔室的下游是测试线。在一些方面,测试线包含链霉亲和素。在一些方面,测试线的下游是流动对照线。在一些方面,流动对照线包含抗igg抗体。在一些方面,抗igg抗体包括抗兔igg抗体。
47.在一些方面,激活的核酸酶能够切割单链报道分子并释放生物素
ꢀ‑
dt/fam部分或生物素-dt/rox部分。在一些方面,生物素-dt/fam 部分能够结合在测试线的链霉亲和素。在一些方面,报道分子是电活性报道分子。在一些方面,电活性报道分子包含生物素和亚甲蓝。在一些方面,报道分子是酶-核酸。在一些方面,酶-核酸是转化酶。在一些方面,酶-核酸的酶是空间位阻酶。在一些方面,在酶-核酸的核酸切割时,酶具有功能性。在一些方面,可检测信号是比色信号、荧光信号、电流信号或电位信号。在一些方面,在任何上述系统中,所述呼吸道病毒是下呼吸道病毒。在一些方面,在任何上述方法中,所述呼吸道病毒是下呼吸道病毒。
48.在一些方面,所述组合物包含dna激活的可编程rna核酸酶;和包含与靶脱氧核糖核酸的区段反向互补的区段的指导核酸,其中 dna激活的可编程rna核酸酶与指导核酸结合以形成复合体。在一些方面,所述组合物还包含rna报道分子。在一些方面,所述组合物还包含来自病毒的靶脱氧核糖核酸。在一些方面,所述靶脱氧核糖核酸是核酸的扩增子。在一些方面,其中所述核酸是脱氧核糖核酸或核糖核酸。在一些方面,dna激活的可编程rna核酸酶是vi型 crispr/cas酶。在一些方面,dna激活的可编程rna核酸酶是cas13。在一些方面,dna激活的可编程rna核酸酶是cas13a。在一些方面, cas13a是lbu-cas13a或lwa-cas13a。在一些方面,所述组合物的ph 值为ph 6.8至ph 8.2。在一些方面,靶脱氧核糖核酸在3’末端缺失鸟嘌呤。在一些方面,靶脱氧核糖核酸是单链脱氧核糖核酸。在一些方面,所述组合
物还包含支持介质。在一些方面,所述组合物还包含横向流动测定装置。在一些方面,所述组合物还包含被配置用于荧光检测的装置。在一些方面,所述组合物还包含第二指导核酸和dna 激活的可编程dna核酸酶,其中所述第二指导核酸包含与包含指导核酸的第二靶脱氧核糖核酸的区段反向互补的区段。在一些方面,所述组合物还包含dna报道分子。在一些方面,dna激活的可编程 dna核酸酶是v型crispr/cas酶。在一些方面,dna激活的可编程dna核酸酶是cas12。在一些方面,所述cas12是cas12a、cas12b、 cas12c、cas12d或cas12e。在一些方面,dna激活的可编程dna 核酸酶是cas14。在一些方面,所述cas14是cas14a、cas14b、cas14c、 cas14d、cas14e、cas14f、cas14g或cas14h。
49.在一些方面,一种测定样品中病毒的靶脱氧核糖核酸的方法,所述方法包括使所述样品与包含指导核酸和dna激活的可编程rna核酸酶的复合体接触,其中所述指导核酸包含与所述靶脱氧核糖核酸的区段反向互补的区段,和
50.测定通过切割多个rna报道分子中的至少一些rna报道分子产生的信号。在一些方面,测定来自样品中病毒的靶核糖核酸的方法包括:扩增样品中的核酸以产生靶脱氧核糖核酸;使所述靶脱氧核糖核酸与包含指导核酸和dna激活的可编程rna核酸酶的复合体接触,其中所述指导核酸包含与所述靶脱氧核糖核酸的区段反向互补的区段,和测定通过切割多个rna报道基因中的至少一些rna报道基因产生的信号。在一些方面,dna激活的可编程rna核酸酶是vi型 crispr核酸酶。在一些方面,dna激活的可编程rna核酸酶是cas13。在一些方面,所述cas13是cas13a。在一些方面,所述cas13a是 lbu-cas13a或lwa-cas13a。在一些方面,多个报道分子中的至少一些rna报道分子的切割在ph 6.8至ph 8.2下发生。在一些方面,靶脱氧核糖核酸在3’末端缺失鸟嘌呤。在一些方面,靶脱氧核糖核酸是单链脱氧核糖核酸。在一些方面,靶脱氧核糖核酸是核糖核酸的扩增子。在一些方面,靶脱氧核糖核酸或核糖核酸来自生物体。在一些方面,所述生物体是病毒、细菌、植物或动物。在一些方面,所述靶脱氧核糖核酸通过核酸扩增方法产生。在一些方面,所述核酸扩增方法是等温扩增。在一些方面,所述核酸扩增方法是热扩增。在一些方面,所述核酸扩增方法是重组酶聚合酶扩增(rpa)、转录介导的扩增 (tma)、链置换扩增(sda)、解旋酶依赖性扩增(hda)、环介导的扩增(lamp)、滚环扩增(rca)、单引物等温扩增(spia)、连接酶链反应(lcr)、简单方法扩增rna靶标(smart)、或改进的多置换扩增(imda)、或基于核酸序列的扩增(nasba)。在一些方面,所述信号是荧光、发光、比色、电化学、酶促、量热、光学、电流或电位信号。在一些方面,所述方法进一步包括使样品与第二指导核酸和dna激活的可编程dna核酸酶接触,其中所述第二指导核酸包含与包含指导核酸的第二靶脱氧核糖核酸的区段反向互补的区段。在一些方面,所述方法进一步包括测定通过切割多个dna 报道分子中的至少一些dna报道分子产生的信号。在一些方面,dna 激活的可编程dna核酸酶是v型crispr核酸酶。在一些方面,dna 激活的可编程dna核酸酶是cas12。在一些方面,所述cas12是 cas12a、cas12b、cas12c、cas12d或cas12e。在一些方面,dna激活的可编程dna核酸酶是cas14。在一些方面,所述cas14是cas14a、 cas14b、cas14c、cas14d、cas14e、cas14f、cas14g或cas14h。在一些方面,所述指导核酸包含crrna。在一些方面,所述指导核酸包含 crrna和tracrrna。在一些方面,在切割至少一些rna报道分子之前存在信号。在一些方面,在切割至少一些rna报道分子之前不存在信号。在一些方面,所述样品包含血液、血清、血浆、唾液、尿液、粘膜样品、腹膜样品、脑脊液、胃分泌物、鼻分泌物、痰、咽溢泌物、尿道或阴道分泌物、溢泌物、积液或组织。在
一些方面,所述方法在支持介质上进行。在一些方面,所述方法在横向流动测定装置上进行。在一些方面,所述方法在被配置用于荧光检测的装置上进行。
51.在多个方面,本公开内容提供了一种设计用于扩增靶核酸的多个引物的方法,所述方法包括:提供靶核酸,在本文中指导核酸与靶核酸杂交并且其中至少60%的靶核酸序列在f1c区和b1区之间或在f1 和b1c区之间;和设计多个引物,其包含:i)包含f2区序列5’的f1c 区序列的正向内部引物;ii)包含b2区序列5’的b1c区序列的反向内部引物;iii)包含f3区序列的正向外部引物;和iv)包含b3区序列的反向外部引物。
52.在多个方面,本公开内容提供了一种检测样品中靶核酸的方法,所述方法包括:使样品与以下项接触:多个引物,其包含:i)包含与对应于f2区的序列5’的f1c区对应的序列的正向内部引物;ii)包含与对应于b2区的序列5’的b1c区对应的序列的反向内部引物;iii) 包含对应于f3区的序列的正向外部引物;和iv)包含对应于b3区的序列的反向外部引物;指导核酸,其中所述指导核酸与所述靶核酸杂交,并且其中至少60%的靶核酸序列在f1c区和b1区之间或在f1 区和b1c区之间;报道分子;以及当与指导核酸复合时切割报道分子的可编程核酸酶;和
53.测量由所述报道分子的切割产生的可检测信号,其中所述测量提供样品中靶核酸的检测。
54.在一些方面,在f1c区和b1区之间的序列或在b1c区和f1区之间的序列与指导核酸序列至少50%反向互补。在一些方面,指导核酸序列与不超过50%的正向内部引物、反向内部引物或其组合反向互补。在一些方面,指导核酸不与正向内部引物和反向内部引物杂交。
55.在一些方面,前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是靶核酸的3’。在一些方面,前间区序列邻近基序(pam) 或前间区序列侧翼位点(pfs)是b1区的3’和f1c区的5’,或前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是f1区的3’和b1c区的5’。在一些方面,靶核酸的3’末端在f3c区的5’末端的5’,或靶核酸的3’末端在b3c区的5’末端的5’。在一些方面,靶核酸的3’末端在f2c区的5’末端的5’,或靶核酸的3’末端在b2c区的5’末端的5’。在一些方面,靶核酸在f1c区和b1区之间并且靶核酸的3’末端在f2c区的3’末端的5’,或其中靶核酸在b1c区和f1区之间并且靶核酸的3’末端在b2c区的3’末端的5’。
56.在一些方面,所述指导核酸具有与不超过50%的正向内部引物、反向内部引物、正向外部引物、反向外部引物或其任何组合反向互补的序列。在一些方面,所述指导核酸序列不与正向内部引物、反向内部引物、正向外部引物、反向外部引物或其任何组合杂交。
57.在一些方面,所述指导核酸序列具有与不超过50%的f3c区、f2c 区、f1c区、b1c区、b2c区、b3c区或其任何组合的序列反向互补的序列。在一些方面,所述指导核酸序列不与f3c区、f2c区、f1c 区、b1c区、b2c区、b3c区或其任何组合的序列杂交。
58.在多个方面,本公开内容提供了一种设计用于扩增靶核酸的多个引物的方法,所述方法包括:提供包含与指导核酸杂交的在b2区和 b1区之间或在f2区和f1区之间的序列的靶核酸;和设计多个引物,其包含:i)包含f2区序列5’的f1c区序列的正向内部引物;ii)包含b2区序列5’的b1c区序列的反向内部引物;iii)包含f3区序列的正向外部引物;和iv)包含b3区序列的反向外部引物。
59.在多个方面,本公开内容提供了一种设计用于扩增靶核酸的多个引物的方法,所述方法包括:提供包含与指导核酸杂交的在f1c区和 f2c区之间或在b1c区和b2c区之间的
序列的靶核酸;和设计多个引物,其包含:i)包含f2区序列5’的f1c区序列的正向内部引物;ii) 包含b2区序列5’的b1c区序列的反向内部引物;iii)包含f3区序列的正向外部引物;和iv)包含b3区序列的反向外部引物。
60.在多个方面,本公开内容提供了一种检测样品中的靶核酸的方法,所述方法包括:使所述样品与以下项接触:多个引物,其包含:i)包含与对应于f2区的序列5’的f1c区对应的序列的正向内部引物;ii) 包含与对应于b2区的序列5’的b1c区对应的序列的反向内部引物; iii)包含对应于f3区的序列的正向外部引物;和iv)包含对应于b3 区的序列的反向外部引物;指导核酸,其中所述靶核酸包含与所述指导核酸杂交的在b2区和b1区之间或在f2区和f1区之间的序列;报道分子;以及当与指导核酸复合时切割报道分子的可编程核酸酶;和测量由所述报道分子的切割产生的可检测信号,其中所述测量提供样品中靶核酸的检测。
61.在多个方面,本公开内容提供了一种检测样品中靶核酸的方法,所述方法包括:使样品与以下项接触:多个引物,其包含:i)包含与对应于f2区的序列5’的f1c区对应的序列的正向内部引物;ii)包含与对应于b2区的序列5’的b1c区对应的序列的反向内部引物;iii) 包含对应于f3区的序列的正向外部引物;和iv)包含对应于b3区的序列的反向外部引物;指导核酸,其中所述靶核酸包含与所述指导核酸杂交的在f1c区和f2c区之间或在b1c区和b2c区之间的序列;报道分子;以及当与指导核酸复合时切割报道分子的可编程核酸酶;和测量由所述报道基因的切割产生的可检测信号,其中所述测量提供样品中靶核酸的检测。
62.在一些方面,前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是b2区的3’和b1区的5’,或前间区序列邻近基序(pam) 或前间区序列侧翼位点(pfs)是f2区的3’和f1区的5’。在一些方面,前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是 b1c区的3’和b2c区的5’,或前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是f1c区的3’和f2c区的5’。
63.在一些方面,前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是靶核酸的3’。在一些方面,pam和pfs在f1c区5’末端的5’、b1c区5’末端的5’、f3区3’末端的3’、b3区3’末端的3’、 f2区3’末端的3’、b2区3’末端的3’或其任何组合。
64.在一些方面,pam和pfs不与f2区、b3区、f1c区、f2区、b1c 区、b2区或其任何组合重叠。在一些方面,pam和pfs不与正向内部引物、反向内部引物、正向外部引物、反向外部引物或其任何组合杂交。
65.在一些方面,多个引物还包含环正向引物。在一些方面,多个引物还包含环反向引物。在一些方面,环正向引物在f1c区和f2c区之间。在一些方面,环反向引物在b1c区和b2c区之间。
66.在一些方面,靶核酸包含单核苷酸多态性(snp)。在一些方面,单核苷酸多态性(snp)包含herc2 snp。在一些方面,单核苷酸多态性(snp)与癌症风险增加或降低相关。在一些方面,靶核酸包含单核苷酸多态性(snp),并且其中在与包含单核苷酸多态性(snp) 的靶核酸100%互补的指导核酸存在下的可检测信号比在与包含单核苷酸多态性(snp)的靶核酸小于100%互补的指导核酸存在下的可检测信号更高。
67.在一些方面,多个引物和指导核酸一起存在于包含靶核酸的样品中。在一些方面,
使样品与多个引物接触导致扩增靶核酸。在一些方面,样品与指导核酸的扩增和接触同时发生。在其他方面,样品与指导核酸的扩增和接触在不同时间发生。在一些方面,所述方法进一步包括提供聚合酶、datp、dttp、dgtp、dctp或其任何组合。
68.在一些方面,所述靶核酸来自病毒。在一些方面,所述病毒包含流感病毒、呼吸道合胞病毒或其组合。在其他方面,所述流感病毒包含甲型流感病毒、乙型流感病毒或其组合。在一些方面,所述病毒包含呼吸道病毒。在其他方面,所述呼吸道病毒是上呼吸道病毒。
69.在一些方面,所述系统还包含正向内部引物、反向内部引物、正向外部引物、反向外部引物、环正向引物、环反向引物或其任何组合。在一些方面,所述方法进一步包括使样品与正向内部引物、反向内部引物、正向外部引物、反向外部引物、环正向引物、环反向引物或其任何组合接触。在一些方面,所述方法进一步包括用正向内部引物、反向内部引物、正向外部引物、反向外部引物、环正向引物、环反向引物或其任何组合扩增靶脱氧核糖核酸。在一些方面,所述扩增包括使样品与正向内部引物、反向内引物、正向外部引物、反向外部引物、环正向引物、环反向引物或其任何组合接触。援引并入
70.本说明书中提及的所有出版物、专利和专利申请都通过引用并入本文,其程度如同特别地和单独地指出要通过引用并入每一个出版物、专利或专利申请。
附图说明
71.本专利或申请文件包含至少一张彩色附图。在提出请求和支付必要费用后,专利局将提供带有彩色附图的本专利或专利申请公开的副本。本公开内容的新颖特征在所附权利要求中具体阐述。通过参考以下对其中利用到本公开内容的原理的说明性实施方案加以阐述的详细描述以及附图,将会获得对本公开内容的特征和优点的更好理解,在这些附图中:
72.图1示出了说明crispr-cas反应的工作流程的示意图。工作流程中显示的步骤1是样品制备。工作流程中显示的步骤2是核酸扩增。工作流程中显示的第3步是cas反应温育。工作流程中显示的步骤4 是检测(读出)。不必要的步骤显示为椭圆形的圆圈。如果将检测和读出结合到crispr反应中,步骤1和2不是必要的,步骤3和4可以同时进行。
73.图2示出了可以在图1的工作流程示意图的步骤1中使用的用于样品制备的示例性流体装置。此图所示的样品制备流体装置可以处理不同类型的生物样品:手指刺血、尿液、或粪便拭子、面颊拭子或其他收集物拭子。
74.图3示出了cas反应的三个示例性流体装置,其中荧光或电化学读出可以在图1的工作流程示意图的步骤2至步骤4中使用。该图示出了该装置执行图1的工作流程示意图的步骤2至4的三个重复。
75.图4示出了可以使用的读出过程的示意图,包括(a)荧光读出和 (b)电化学读出。
76.图5示出了用于在比色或电化学/血糖仪读出情况下的偶联的转化酶/cas反应的示例性流体装置。该图示出了用于使与转化酶偶联的cas反应小型化的流体装置。在底部的分解视图中描绘了表面修饰和读出过程,包括(a)使用dns或其他化合物的光学读出,以及(b) 电化学读出(电化学分析仪或血糖仪)。
77.图6a示出了评估用于检测效率的针对rsv的grna面板。减去背景的行中较深的正
方形表示检测rsv靶核酸的效率更高。
78.图6b示出了grna池相对于减去背景的荧光的图像。
79.图7示出了本公开内容的样品制备装置的各个部分。
80.图8示出了使用样品处理装置的样品工作流程。
81.图9示出了用于从剩余临床样品中提取甲型流感rna的提取缓冲液。
82.图10显示低ph条件允许快速提取甲型流感基因组rna。
83.图11示出了rt-rpa在通过cas12a检测甲型流感、乙型流感和人类呼吸道合胞病毒(rsv)的病毒rna中的应用。左图示出了工作流程,包括提供dna/rna、rpa/rt-rpa和cas12a检测。右图示出了通过荧光随时间测量的cas12a检测结果。
84.图12示出了rt-rpa结合ivt反应的应用,该ivt反应使得能够使用cas13a检测病毒rna。左图示出了工作流程,包括提供 dna/rna、rpa/rt-rpa、体外转录和cas13a检测。右图示出了每种测试条件下通过荧光测量的cas13a检测结果。
85.图13示出了使用rt-rpa-ivt“两锅法”反应从rna病毒中通过 cas13a检测到的rna的产生。左边的示意图显示了工作流程,该工作流程包括提供dna/rna、第一反应中包含rpa/rt-rpa的“双锅”反应和体外转录,以及第二反应中的cas13a检测。右图示出了每种测试条件下通过荧光测量的cas13a检测结果。
86.图14示出了各种缓冲液对一锅法cas13a测定的性能的影响。左图示出了工作流程,包括提供dna/rna和rpa/rt-rpa、体外转录和cas13a检测。右图示出了每种测试条件下通过荧光测量的cas13a 检测结果。
87.图15示出了使用一锅法cas13a测定从感染山羊的小反刍动物 (peste des petits ruminants,ppr)病毒中特异性检测病毒rna。左图示出了工作流程,包括提供dna/rna和rpa/rt-rpa、体外转录和cas13a检测。右图示出了在测试条件下通过荧光随时间测量的 cas13a检测结果。
88.图16示出了使用一锅法cas13a测定在40℃下对乙型流感的特异性检测。将40fm病毒rna添加到反应中。左图示出了工作流程,包括提供dna/rna和rpa/rt-rpa、体外转录和cas13a检测。右图示出了每种测试条件下通过荧光测量的cas13a检测结果。
89.图17示出了在40℃、存在和不存在称为通用运输介质(utm copan) 的通用病毒运输介质的情况下,一锅法cas13a测定对于检测来自乙型流感病毒的rna的耐受性。左图示出了工作流程,包括提供 dna/rna和rpa/rt-rpa、体外转录和cas13a检测。右图示出了每种测试条件下cas13a随时间的检测结果。
90.图18示出了在不同温度下的一锅法cas13a检测测定。
91.图18a示出了包括提供dna/rna和包含rpa/rt-rpa、体外转录和cas13a检测的一锅法反应的工作流程的示意图。
92.图18b示出了在不同温度下cas13a检测甲型流感rna的图。
93.图18c示出了在不同温度下cas13a检测乙型流感rna的图。
94.图18d示出了在不同温度下cas13a检测人rsvrna的图。
95.图19示出了使用源自普通猛犸象(mammuthus primigenius,woolymammoth(长毛猛犸象))线粒体的dna序列优化lamp反应用于检测内部扩增对照。
96.图19a示出了包括提供dna/rna、lamp/rt-lamp和cas12a 检测的工作流程的示意
图。
97.图19b示出了使用源自普通猛犸象的dna序列进行内部扩增对照的lamp反应的得到结果的时间,如通过荧光定量的。
98.图19c示出了来自68℃温度反应的lamp扩增子在37℃的cas12a 特异性检测。
99.图20示出了对作为rnase p组分的人pop7基因(seq id no:379, ggagtattgaatagttgggaattggaacccctccagggggaac caaacattgtcgttcagaagaagacaaagagagattgaaatga agctgttgatttcaacacacaaattctggtggtagatgaaagca aagcaagtaagtttctccgaatccctagtcaactggaggtaga gacggactgcgcaggttaactacagctcccagcatgcctgagg ggcgggctcagcggctgcgcagactggcgcgcgcggacggtca tgggacttcagcatggcggtgtttgcagatttggacctgcgagc gggttctgacctgaaggctctgcgcggacttgtggagacagcc gctcaccttggctattcagttgttgctatcaatcatatcgttgac tttaaggaaaagaaacaggaaattgaaaaaccagtagctgttt ctgaactcttcacaactttgccaattgtacagggaaaatcaaga ccaattaaaattttaactagattaacaattattgtctcggatcc atctcactgcaatgttttgagagcaacttcttcaagggcccggc tctatgatgttgttgcagtttttccaaagacagaaaagcttttt catattgcttgcacacatttagatgtggatttagtctgcataac tgtaacagagaaactaccattttacttcaaaagacctcctatta atgtggcgattgaccgaggcctggcttttgaacttgtctatagc cctgctatcaaagactccacaatgagaaggtatacaatttccag tgccctcaatttgatgcaaatctgcaaaggaaagaatgtaatta tatctagtgctgcagaaaggcctttagaaataagagggccata tgacgtggcaaatctaggcttgctgtttgggctctctgaaagtg acgccaaggctgcggtgtccaccaactgccgagcagcgcttctc catggagaaactagaaaaactgcttttggaattatctctacagt gaagaaacctcggccatcagaaggagatgaagattgtcttcca gcttccaagaaagccaagtgtgagggctgaaaagaatgcccca gtctctgtcagcactcccttcttcccttttatagttcatcagcca caacaaaaataaaacctttgtgtgatttactgttttcatttgga gctagaaatcaatagtctataaaaacagttttacttgcaatcca ttaaaacaacaaacgaaacctagtgaagcatctttttaaaagg ctgccagcttaatgaatttagatgtactttaagagagaaagact ggttatttctcctttgtgtaagtgataaacaacagcaaatatac ttgaataaaatgtttcaggtatttttgtttcattttgtttttgag atagggtctttgttgctcaggctggagtacagtggcataatcac agctcactgcaacctcaatcctgggctcaagtgatcctcccgct tcagcctctcaagcagcgggaactacaggtgtgcactaccaca cctggctattttttttttttttttttttttcccttgtagagacatg gtctcactatgttgctgaggctggtctcaaactcctaggatcaa gccatcctcccgctttggcctcctaaagtgctgggattacatga gccaccacatgcagccagatgtttgaatattttaagagcttctt tcgaaagtttcttgttcatactcaaatagtagttattttgaaga tattcaaacttatattgaagaagtgactttagttcctcttgtttt aagcttctttcatgtattcaaatcagcatttttttctaagaaatt gctatagaatttgtggaaggagagaggatacacatgtaaaatt acatctggtctcttccttcactgcttcatgcctacgtaaggtctt tgaaataggattccttacttttagttagaaacccctaaaacgct aatattgattttcctgatagctgtattaaaaatagcaaagcatc ggactga)的lamp和cas12特异性检测的优化。
100.图20a示出了包括提供dna/rna、lamp/rt-lamp和cas12a 检测的工作流程的示意图。
101.图20b示出了在不同温度下对rna酶p pop7进行 lamp/rt-lamp反应的得到结果的时间,如通过荧光定量的。
102.图20c示出了三幅图,示出了来自68℃温度反应的 lamp/rt-lamp扩增子在37℃下的cas12a特异性检测。
103.图21示出了针对甲型流感病毒的三种不同rt-lamp扩增子的特异性检测。左侧是工作流程的示意图,包括提供dna/rna、 lamp/rt-lamp和cas12a检测。右图示出了每种测试条件下通过荧光随时间测量的cas12a检测结果。
104.图22示出了用于特异性检测乙型流感(ibv)rt-lamp扩增子的最佳crrna的鉴定。左侧是工作流程的示意图,包括提供 dna/rna、lamp/rt-lamp和cas12a检测。右图示出了每种测试条件下(iav是甲型流感病毒,ibv是乙型流感病毒,ntc是无模板对照)通过荧光随时间测量的cas12a检测结果。
105.图23示出了1%琼脂糖凝胶的结果,带显示出rt-lamp反应的产物。
106.图24示出了来自针对甲型流感和乙型流感的多重rt-lamp反应的扩增子之间的cas12a区分。
107.图24a示出了工作流程的示意图,包括提供病毒rna、多重rt-lamp和cas12a甲型流感检测或cas12a乙型流感检测。
108.图24b示出了在60℃下30分钟的多重rt-lamp扩增后 rt-lamp扩增子的cas12a检测。
109.图24c示出了iav和ibv的10,000个病毒基因组拷贝的 rt-lamp扩增子在37℃下cas12a检测30分钟时的减去背景的荧光。
110.图25示出了在60℃下30分钟的多重rt-lamp扩增后,针对甲型流感、乙型流感和普通猛犸象(长毛猛犸象)线粒体内部扩增对照序列的三重复用rt-lamp反应之间的cas12a区分。最上方是工作流程示意图,包括提供病毒rna、多重rt-lamp和cas12a甲型流感检测或cas12a乙型流感检测或cas12内部扩增对照检测。底部图示出了每种测试条件下通过荧光随时间测量的cas12检测结果。
111.图26示出了lamp和rt-lamp引物设计的示意图。
112.图26a示出了说明在lamp和rt-lamp中使用的引物的身份的示意图。在某些lamp和rt-lamp设计中,引物lf和lb是任选的,但通常会提高反应效率。
113.图26b示出了说明在多种lamp引物中t7启动子的位置和取向的示意图。
114.图27显示t7启动子可以包含在甲型流感的f3或b3引物(外部引物)或fip或bip引物上。
115.图27a示出了工作流程的示意图,包括提供dna/rna、 lamp/rt-lamp、体外转录和cas13a检测。
116.图27b示出了使用不同的引物集对甲型流感进行rt-lamp反应的得到结果的时间,如通过荧光定量的。
117.图27c示出了使用不同的引物集在37℃下进行10分钟的针对甲型流感的rt-lamp反应产物采用t7 rna聚合酶的体外转录 (ivt)。
118.图28示出了cas12对甲型流感的rt-siba扩增子的检测。左侧是工作流程示意图,包括提供dna/rna、siba/rt-siba和cas12a 检测。右图示出了每种测试条件下通过荧光测量的cas12a检测。
119.图29示出了具有典型报道分子的millenia市售条的布局。
120.图30示出了具有扩增子的milenia hybriddetect 1条的布局。
121.图31示出了具有标准cas报道分子的milenia hybriddetect 1 条的布局。
122.图32示出了修饰的cas报道分子,其包含与fam分子(显示为绿色起点)结合的生物素-dt(显示为粉红色六边形)的dna接头。
123.图33示出了具有修饰的cas报道分子的milenia hybriddetect 条的布局。
124.图34示出了单个靶标测定形式(左)和多重测定形式(右)的实例。
125.图35示出了使用前的测定(上)、具有阳性结果的测定(左中),具有阴性结果的测定(右中)和测试失败(下)的另一种变型。
126.图36示出了栓系的横向流动cas报道分子的一种设计。
127.图37示出了使用磁珠采用栓系的切割报道分子进行crispr诊断的工作流程。
128.图38示出了在到达反应腔室之前被链霉亲和素-生物素过滤的酶-报道分子系统的示意图。
129.图39示出了用于检测靶核酸的转化酶-核酸。将固定在磁珠上的转化酶核酸添加到包含cas蛋白、指导rna和靶核酸的样品反应中。靶标识别激活cas蛋白以切割转化酶-核酸的核酸,从而从固定的磁珠上释放出转化酶。将该溶液转移到含有蔗糖和dns试剂的“反应混合物”中,并且当转化酶将蔗糖转化为葡萄糖时,溶液的颜色从黄色变为红色,或者可以将该溶液转移到手持式血糖仪装置进行数字读出。
130.图40示出了用于两锅法detectr测定的一种布局。在这种布局中,拭子收集盖密封了拭子储存室。拭子储存室的顺时针方向是容纳扩增反应混合物的腔室。容纳扩增反应混合物的腔室的顺时针方向是容纳detectr反应混合物的腔室。容纳detectr反应混合物的腔室的顺时针方向是检测区域。检测区域的顺时针方向是ph平衡孔。示出了盒孔盖,并且其密封了包含各种试剂混合物的所有孔。盒本身在示意图的底部显示为方形层。右侧是仪器移液泵的示意图,该泵驱动每个腔室/孔中的流体并连接到整个盒。盒下方是与仪器对接的旋转阀。
131.图41示出了图40的两锅法detectr测定中各种反应的一种工作流程。首先,如左上图所示,可以将拭子插入200ul拭子腔室并混合。在左中图中,将阀顺时针旋转至“拭子腔室位置”,并取出1ul 样品。在左下图中,将阀顺时针旋转至“扩增反应混合物”位置,并分配和混合1ul样品。在右上图中,从“扩增反应混合物”中吸取2ul样品。在中上图中,将阀顺时针旋转至“detectr”位置,分配和混合样品,并吸取20ul样品。最后,在右下图中,将阀顺时针旋转至检测区位置并分配20ul样品。
132.图42示出了对图41中所示的工作流程的修改,这也与本公开内容的方法和系统一致。左侧是图41的右上方所示的图。右侧是修改后的图,其中存在在拭子裂解腔室逆时针方向的第一扩增腔室和在拭子裂解腔室顺时针方向的第二扩增腔室。另外,在扩增腔室#2的顺时针方向上有两组,或分别标记为“双重detectr腔室#2”和“双重 detectr腔室#1”的“双重”detectr腔室。
133.图43示出了用于图42中所示的修改布局的工作流程的分解。具体而言,从容纳200ul样品的拭子裂解腔室中,可将20ul样品移至扩增腔室#1,并将20ul样品移至扩增腔室#2。在#1扩增腔室中扩增后,可将20ul样品移至双重detectr腔室#1a,并可将20ul样品移至双重detectr腔室#1b。另外,在扩增腔室#2中进行扩增后,可以将20ul样品移至双重detectr腔室#2a,并将20ul样品移至双重detectr腔室#2b。
134.图44示出了对图43和图42中所示的盒的改进。
135.图45示出了图44的盒的俯视图。与图40-41的布局和工作流程相比,该布局和工作流程具有重复。
136.图46示出了两锅法detectr测定的布局。顶部显示的是气动泵,它与盒对接。中间显示的是盒的俯视图,示出了带有储器的顶层。底部显示的是包含样品的滑动阀和指向左侧裂解腔室,接着是右侧的扩增腔室和更右侧的detect腔室的箭头。
137.图47示出了本文公开的detectr测定与金标准基于pcr的检测靶核酸的方法的比较。顶部显示的流程图示出了样品制备评估从粗(左)到纯(右)的梯度。将粗样品变成纯样品的样品制备步骤包括裂解、结合、洗涤和洗脱。本文公开的detectr测定可能仅需要裂解的样品制备步骤,产生粗样品。另一方面,基于pcr的方法可能需要裂解、结合、洗涤和洗脱,产生非常纯的样品。
138.图48示出了rt-lamp dna扩增子的cas13a检测。
139.图48a示出了工作流程的示意图,包括提供dna/rna、 lamp/rt-lamp和cas13a检测。
140.图48b示出了通过第一引物集对rt-lamp dna扩增子的 cas13a特异性检测,如通过y轴上减去背景的荧光所测量的。
141.图48c示出了通过第二引物集对rt-lamp dna扩增子的 cas13a特异性检测,如通过y轴上减去背景的荧光所测量的。
142.图49a示出了使用2.5nm rna、单链dna(ssdna)或双链 (dsdna)作为靶核酸的cas13检测测定,其中通过每个测试的靶标的荧光来测量检测。
143.图49b示出了使用2.5nm rna、ssdna和dsdna作为靶核酸的cas12检测测定,其中通过每个测试的靶标的荧光来测量检测。
144.图49c示出了cas13和cas12对不同浓度的rna、ssdna和 dsdna靶标的性能,其中通过每个测试的靶标的荧光来测量检测。
145.图50示出了使用2.5nm ssdna靶标与170nm的各种报道分子底物的lbucas13a检测测定,其中通过所测试的每种报道分子底物的荧光来测量检测。
146.图51a示出了使用10nm或0nm rna靶标的lbucas13a(seqid no:131)和lwacas13a(seq id no:137)的cas13检测测定的结果,其中通过报道分子随时间的切割而产生的荧光来测量检测。
147.图51b示出了使用10nm或0nm ssdna靶的lbucas13a(seqid no:131)和lwacas13a(seq id no:137)的cas13检测测定的结果,其中通过报道分子随时间的切割而产生的荧光来测量检测。
148.图52示出了在ph范围在6.8至8.2之间的缓冲液中使用1nmrna(左)或ssdna(右)靶标的lbucas13a(seq id no:131)检测测定。
149.图53a示出了沿靶序列以1个核苷酸间隔平铺的(tiled)指导 rna(grna)。
150.图53b示出了使用0.1nm rna或2nm ssdna靶标以及以1 个核苷酸间隔平铺的grna和脱靶grna的lbucas13a(seq id no: 131)检测测定。
151.图53c示出了来自图97b的数据,按靶ssdna的性能排序。
152.图53d示出了grna对于靶rna的3’末端上的每个核苷酸的性能。
153.图53e示出了grna对于靶ssdna的3’末端上的每个核苷酸的性能。
154.图54a示出了使用来自各种lamp等温核酸扩增反应的1μl 靶dna扩增子的lbucas13a检测测定。
155.图54b示出了使用不同量的pcr反应作为靶dna的lbucas13a(seq id no:131)检测测定。
156.图55示出了用于detectr测定的气动阀装置布局。
157.图55a示出了气动阀装置的示意图。移液泵抽吸并分配样品。空气歧管连接到气动泵,以打开和关闭常闭阀。气动装置将流体从一个位置移动到另一位置。与其他装置设计相比,气动设计减少了通道串扰。
158.图55b示出了用于图55a所示的气动阀装置中的盒的示意图。示出了阀配置。常闭阀(一个这种阀用箭头表示)在通道顶部包括弹性密封件,以在不使用腔室时将每个腔室与系统的其余部分隔离。气动泵根据需要使用空气来打开和关闭阀,以将流体移动到盒内的必要腔室中。
159.图56示出了用于图55a中所示的气动阀装置的阀电路布局。如(i.)所示,将样品置于样品孔中,同时关闭所有阀。样品在样品孔中裂解。如(ii.)所示,通过打开第一振动阀,并使用移液泵将样品吸出,将裂解的样品从样品腔室移至第二腔室。然后,如(iii.)所示,通过关闭第一振动阀并打开第二振动阀,将样品移至第一扩增腔室,在第一扩增腔室样品与扩增混合物混合。如(iv.)所示,样品与扩增混合物混合后,通过关闭第二振动阀并打开第三振动阀,将样品移至随后的腔室。如(v.)所示,通过关闭第三振动阀并打开第四振动阀,将样品移至detectr腔室。如(vi.)所示,通过打开和关闭不同系列的振动阀,可以使样品移动通过不同系列的腔室。所需腔室系列中单个阀的致动可防止通道之间的交叉污染。
160.图57示出了滑动阀装置的示意图。通道的偏移节距允许单独地抽吸和分配到每个孔中,并有助于减轻扩增腔室与相应腔室之间的串扰。
161.图58示出了通过图57中所示的滑动阀装置的样品运动的图。在初始关闭位置(i.),将样品加载到样品孔中并裂解。然后由仪器启动滑动阀,并使用移液泵将样品加载到每个通道中,该移液泵将适当的体积分配到通道(ii.)中。通过启动滑动阀将样品输送至扩增腔室,并用移液泵混合(iii.)。将来自扩增腔室的样品吸入每个通道(iv),然后通过启动滑动阀和移液泵将其分配并混合到每个detectr腔室中(v.)。
162.图59示出了本公开内容的气动阀装置的盒的顶层的示意图,突出了合适的尺寸。示意图示出了一个2英寸乘1.5英寸的盒。
163.图60示出了本公开内容的气动阀装置的盒的适于电化学尺寸的改进的顶层的示意图。在此示意图中,在检测腔室(在最右边的4 个腔室)中示出了三条线。这三条线表示接线(或“金属引线”),该接线在一次性盒中共模制、3d打印或手动装配以形成三电极系统。
164.图61示出了设计用于靶核酸序列的环介导的等温扩增(lamp) 的引物的示意图。由“c”表示的区域与未由“c”表示的相应区域反向互补 (例如,区域f3c与区域f3反向互补)。
165.图62示出了对应于lamp引物或与lamp引物退火的核酸序列、或指导rna序列、或包含前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)的核酸序列、以及用于通过lamp和detectr 进行扩增和检测的靶核酸序列的各个区域的示例性配置的示意图。
166.图62a示出了指导rna(grna)相对于对应于lamp引物或与lamp引物退火的核酸序
列的各个区域的示例性排列的示意图。在这种排列中,指导rna与位于f1c区(即与f1区反向互补的区域) 和b1区之间的靶核酸序列反向互补。
167.图62b示出了指导rna序列相对于对应于lamp引物或与 lamp引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,指导rna与位于f1c区和b1区之间的靶核酸序列部分反向互补。例如,靶核酸包含与指导核酸的至少60%反向互补的在f1c 区和b1区之间的序列。在该排列中,指导rna不与图40所示的正向内部引物或反向内部引物反向互补。
168.图62c示出了指导rna相对于对应于lamp引物或与lamp 引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,指导rna与位于b1区和b2区之间的环区域内的靶核酸序列杂交。正向内部引物、反向内部引物、正向外部引物和反向外部引物序列不包含pam或pfs也不与pam或pfs反向互补。
169.图62d示出了指导rna相对于对应于lamp引物或与lamp 引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,指导rna与位于f2c区和f1c区域之间的环区域内的靶核酸序列杂交。引物序列不包含pam或pfs也不与pam或pfs反向互补。
170.图63分别示出了对应于lamp引物或与lamp引物退火的核酸序列、或指导rna序列、或包含前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)的核酸序列、以及用于组合的lamp和 detectr进行扩增和检测的靶核酸序列的各个区域的示例性配置的示意图。在右侧,示意图还显示了使用lamp扩增和指导rna序列检测靶核酸序列存在的相应荧光数据,其中荧光信号是detectr反应的输出并指示存在靶核酸。
171.图63a示出了对应于lamp引物或与lamp引物退火的核酸序列的各个区域的排列以及三种指导rna(grna1、grna2和grna3) 相对于lamp引物(左侧)的位置的示意图。grna1与b2c区重叠,因此与b2区反向互补。grna2与b1区重叠,因此与b1c区反向互补。grna3与b3区部分重叠并与b2区部分重叠,因此与b3c区部分反向互补并与b2c区部分反向互补。互补区域(b1、b2c、b3c、 f1、f2c和f3c)未绘出,但对应于图40中所示的区域。右侧是在存在10,000个靶核酸基因组拷贝或0个靶核酸基因组拷贝的情况下 detectr反应的荧光图。
172.图63b示出了对应于lamp引物或与lamp引物退火的核酸序列的各个区域的排列以及三种指导rna(grna1、grna2和grna3) 相对于lamp引物(左侧)的位置的示意图。grna1与b1c区重叠,因此与b1区反向互补。grna2与lf区重叠,因此与lfc区反向互补。grna 3与b2区部分重叠并与lbc区部分重叠,因此与b2c区部分反向互补并与lb区部分反向互补。右侧是在存在10,000个靶核酸基因组拷贝或0个靶核酸基因组拷贝的情况下detectr反应的荧光图。
173.图63c示出了对应于lamp引物或与lamp引物退火的核酸序列的各个区域的排列以及三种指导rna(grna1、grna2和grna3) 相对于lamp引物(左侧)的位置的示意图。grna1与b1c区重叠,因此与b1区反向互补。grna2与lf区部分重叠并与f2c区部分重叠,因此与lfc区部分反向互补并与f2区部分反向互补。grna3与 b2重叠,因此与b2c区反向互补。右侧是在存在10,000个靶核酸基因组拷贝或0个靶核酸基因组拷贝的情况下detectr反应的荧光图。
174.图64a示出了对应于lamp引物或与lamp引物退火的核酸序列或指导rna序列、或包含前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)的核酸序列、以及用于图63a中所示的lamp 和detectr测定的靶核酸序列的各个区域的排列和序列的详细分解。
175.图64b示出了对应于lamp引物或与lamp引物退火的核酸序列或指导rna序列、或包含前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)的核酸序列、以及用于图63b中所示的lamp 和detectr测定的靶核酸序列的各个区域的排列和序列的详细分解。
176.图64c示出了对应于lamp引物或与lamp引物退火的核酸序列或指导rna序列、或包含前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)的核酸序列、以及用于图63c中所示的lamp 和detectr测定的靶核酸序列的各个区域的排列和序列的详细分解。
177.图65示出了使用dna结合染料检测的逆转录lamp (rt-lamp)反应的结果时间。
178.图66示出了来自与rt-lamp反应产物温育五分钟后的 detectr反应的荧光信号。图65中的lamp引物集#1-6被设计用于与指导rna#2(seq id no:250)一起使用,并且lamp引物集 #7-10被设计用于与指导rna#1(seq id no:249)一起使用。
179.图67示出了在用lamp引物集1、2、4、5、6、7、8、9、10 或阴性对照进行rt-lamp扩增后,使用syto 9(dna结合染料) 检测来自甲型流感病毒(iav)的序列。
180.图68示出了rt-lamp扩增后乙型流感病毒(ibv)靶序列扩增的时间。在存在增加浓度的靶序列(每个反应的靶序列的0、100、 1000、10,000或100,000个基因组拷贝)的情况下,使用syto 9检测扩增。
181.图69示出了在用不同引物集进行lamp扩增后iav靶序列扩增的时间。
182.图70示出了在用lamp引物集1、2、4、5、6、7、8、9、10 或阴性对照进行rt-lamp扩增后使用detectr检测来自甲型流感病毒(iav)的靶核酸序列。每个引物集进行十次反应。detectr 信号作为反应中存在的靶序列量的函数进行测量。
183.图71示出了设计用于靶核酸序列的lamp扩增和靶核酸序列中单核苷酸多态性(snp)检测的引物的方案。在示例性排列中,靶核酸的snp位于f1c区和b1区之间。
184.图72示出了lamp引物、指导rna序列、前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)、以及用于靶核酸的lamp 扩增和使用detectr检测靶核酸的方法中的具有snp的靶核酸的示例性排列的示意图。
185.图72a示出了指导rna相对于对应于lamp引物或与lamp 引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,靶核酸的pam或pfs位于f1c区和b1区之间。整个指导rna 序列可以位于f1c区和b1c区之间。snp显示为位于与指导rna杂交的靶核酸序列内。
186.图72b示出了指导rna序列相对于对应于lamp引物或与 lamp引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,靶核酸的pam或pfs位于f1c区和b1区之间,并且靶核酸包含f1c区和b1区之间的序列,该序列与指导核酸的至少60%反向互补。在该实例中,指导rna不与正向内部引物或反向内部引物反向互补。snp显示为位于与指导rna杂交的靶核酸序列内。
187.图72c示出了指导rna序列相对于对应于lamp引物或与 lamp引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,靶核酸的pam或pfs位于f1c区和b1区之间,并且整个指导rna序列位于f1c区和b1区之间。snp显示为位于与指导 rna杂交的靶核酸序列内。
188.图73示出了包含两个pam位点和herc2 snp的核酸的示例性序列。
189.图74示出了detectr反应的结果,该detectr反应在lamp 扩增后检测相对于第一
pam位点的第9位或相对于第二pam位点的第14位处的herc2 snp。指示靶序列的检测的荧光信号在存在包含 herc2中的g等位基因或a等位基因的靶序列的情况下随时间测量。使用指导rna(仅crrna)检测靶序列以检测a等位基因或g等位基因。
190.图75示出了靶核酸序列的lamp扩增后来自detectr反应的荧光热图。detectr反应使用a等位基因(seq id no:255,“r570 a snp”)或g snp等位基因(seq id no:256,“r571 g snp”)特异性的指导rna(仅crrna)区分两个herc2等位基因。detectr 反应中的高荧光值表示阳性检测。
191.图76示出了通过lamp对靶核酸的组合lamp扩增和通过 detectr对靶核酸的检测。通过用红色led照亮样品,用detectr 目测进行检测。每个反应均包含靶核酸序列,该序列包含蓝眼表型 (“蓝眼”)或棕眼表型(“棕眼”)的snp等位基因。样品“棕色*”和“蓝色*”分别是a等位基因阳性对照和g等位基因阳性对照。棕眼表型 (“br”)或蓝眼表型(“bl”)的指导rna用于每个lamp detectr 反应。
192.图77示意性地示出了使用逆转录和环介导的等温扩增 (rt-lamp)制备和检测样品中是否存在sars-cov-2(“2019-ncov”) 的步骤,并且cas12示意性地示出了制备和检测是否存在 sars-cov-2(“2019-ncov”)反应的步骤。
193.图78示出了使用不同引物集(“2019-ncov-集1”至“2019-ncov
‑ꢀ
集12”)扩增并使用lbcas12a和针对sars-cov-2的n-基因的grna 检测的sars-cov-2n-基因的detectr测定结果。
194.图79示出了针对0fm和5fm样品在图78中绘制的detectr 反应的各个迹线。在每个图中,未见超出基线的0fm迹线,表明几乎没有或没有非特异性检测。
195.图80示出了对含有n-基因、e-基因或无靶标(“ntc”)并使用针对sars-cov-2的e-基因的引物集(“2019-ncov-e-集13”至“2019-ncov-e-集20”)或针对sars-cov-2的n-基因的引物集 (“2019-ncov-n-集21”至“2019-ncov-n-集24”)扩增的样品的 detectr反应的结果时间。用于特异性检测sars-cov-2e-基因的最佳引物集是sars-cov-2-e-集14。
196.图81示出了使用引物集1(“2019-ncov-集1”)扩增并使用 lbcas12a和针对sars-cov-2的n-基因的grna (“r1763-cdc-n2-sars-cov-2”)或针对sars-cov n-基因的grna (“r1766-cdc-n2-sars”)检测的sars-cov-2n-基因的detectr 测定结果。
197.图82示出了在使用针对sars-cov-2的n-基因的引物集 (“2019-ncov-n-集1”)扩增的detectr反应中确定sars-cov-2 检测限的detectr反应的结果。检测到含有15,000、4,000、1,000、 500、200、100、50、20或0个拷贝的sars-cov-2n-基因靶核酸的样品。n-基因rna的凝胶如下所示。
198.图83示出了使用pop7样品引物集对rnase p的扩增。使用 lamp扩增样品。使用针对rnase p(“r779”)和cas12变体(seq idno:37)的grna进行detectr反应。样品包含hela总rna或 hela基因组dna。
199.图84示出了多路复用detectr反应的结果时间。样品含有 sars-cov-2的体外转录的n-基因(“n-基因ivt”)、sars-cov-2 的体外转录的e-基因(“e-基因ivt”)、hela总rna、或无靶标(“ntc”)。使用针对sars-cov-2n-基因(“集1”)、sars-cov-2e-基因(“集 14”)或rnase(“rnasep”)的一个或多个引物集扩增样品。
200.图85示出了使用针对sars-cov-2n-基因(“集1”)、 sars-cov-2e-基因(“集14”)或
rnase p(“rnasep”)的不同引物集组合进行多路复用detectr反应的结果时间。测试了含有 sars-cov-2体外转录的n-基因(左图,“n-基因ivt”)或sars-cov-2 体外转录的e-基因(右图,“e-基因ivt”)的样品。
201.图86示出了使用来自图84和图85的表现最佳的引物集组合的多路复用detectr反应的结果时间。
202.图87a示意性地示出了用于检测sars-cov-2的n-2基因的 cdc-n2靶位点的序列。
203.图87b示意性地示出了sars-cov-2n-基因(“n-sarbeco”)靶位点的区域的序列。
204.图88示出了确定针对sars-cov-2的n-基因(“r1763”)、sars-cov的n-基因(“r1766”)或sarbeco冠状病毒的n-基因 (“r1767”)的grna对含有sars-cov-2的n-基因(“n-2019-ncov”)、 sars-cov的n-基因(“n-sars-cov”)或蝙蝠-sl-cov45的n-基因 (“n-蝙蝠-sl-cov45”)的样品的灵敏度的detectr测定的结果。
205.图89示意性地示出了sars-cov-2e-基因(“e-sarbeco”)靶位点的区域的序列。
206.图90示出了确定针对冠状病毒n-基因的两种grna对含有 sars-cov-2的e-基因(“e-2019-ncov”)、sars-cov的e-基因 (“e-sars-cov”)、蝙蝠-sl-cov45的e-基因(“e-蝙蝠-sl-cov45”) 或蝙蝠-sl-cov21的e-基因(“e-蝙蝠-sl-cov21”)的样品的灵敏度的detectr测定的结果。
207.图91示出了使用cas12变体(seq id no:37)检测是否存在 sars-cov-2n-基因靶rna的横向流动detectr反应的结果。显示了横向流动测试条。测试了含有(“ ”)或不含(
“‑”
)体外转录的 sars-cov-2n-基因rna(“n-基因ivt”)的样品。顶部的一组水平线(表示为“测试”)表示detectr反应的结果。
208.图92示意性地示出了使用可编程核酸酶检测靶核酸。简而言之,具有反式侧链切割活性的cas蛋白在结合指导核酸和与指导核酸区域反向互补的靶序列后被激活。激活的可编程核酸酶切割报道核酸,从而产生可检测信号。
209.图93示意性地示出了样品中是否存在靶核酸的检测。样品中的选择核酸使用等温扩增进行扩增。扩增的样品与可编程核酸酶、指导核酸和报道核酸接触,如图17所示。如果样品含有靶核酸,则产生可检测信号。
210.图94示出了检测样品中是否存在sars-cov-2(“2019-ncov”) rna的detectr横向流动反应的结果。rnase p的检测用作样品质量对照。样品在体外转录和扩增(左)并使用cas12可编程核酸酶进行检测(右)。使用cas12可编程核酸酶和针对sars-cov-2的grna 对含有(“ ”)或缺乏(
“‑”
)体外转录的sars-cov-2rna(“2019-ncovivt”)的样品进行测定,持续0分钟或5分钟。该反应对含有 sars-cov-2的样品灵敏。
211.图95示出了使用lbcas12a可编程核酸酶(seq id no:27)确定患者样品中是否存在sars-cov-2的detectr反应的结果。
212.图96示出了检测患者样品中是否存在sars-cov-2的横向流动 detectr反应的结果。使用针对sars-cov-2的grna或针对rnasep的grna检测样品。
213.图97示出了使用逆转录和环介导的等温扩增(rt-lamp)以及cas12检测对冠状病毒进行检测的技术说明和测定条件。
214.图98示出了使用lbcas12a评价用于检测sars-cov-2的多种 grna的detectr测定的结果。使用引物集扩增靶核酸序列以扩增 sars-cov-2e-基因(“2019-ncov-e-集13”至“2019-ncov-e-集20”) 或sars-cov-2n-基因(“2019-ncov-n-集21”至“2019-ncov-n-集24”)。
215.图99示出了评价多种grna在区分三种不同冠状病毒株 sars-cov-2(“covid-2019”)、sars-cov或蝙蝠-sl-cov45中的效用的detectr测定的结果。对包含sars-cov-2(“n-2019-ncov”)、 sars-cov(“n-sars-cov”)或蝙蝠-sl-cov45(“n-蝙蝠-sl-cov45”) 的样品进行测试。
216.图100示出了评价多种grna在区分三种不同冠状病毒株 sars-cov-2(“covid-2019”)、sars-cov或蝙蝠-sl-cov45中的效用的detectr测定的结果。对包含sars-cov-2(“n-2019-ncov”)、 sars-cov(“n-sars-cov”)或蝙蝠-sl-cov45(“n-蝙蝠-sl-cov45”) 的样品进行测试。
217.图101示出了评价lamp引物集在sars-cov-2靶标多重扩增中的效用的detectr测定结果。使用针对sars-cov-2n-基因(“集1”)或sars-cov-2e-基因(“集14”)或rnase p(“rnasep”)的一个或多个引物集扩增样品。
218.图102示出了评价rt-lamp扩增反应对常见样品缓冲液的灵敏度的detectr测定结果。在通用转运培养基(utm,上图)或 dna/rna shield缓冲液(下图)中以不同的缓冲液稀释度(从左至右:1
×
、0.5
×
、0.25
×
、0.125
×
或无缓冲液)测量反应。
219.图103示出了确定sars-cov-2(致covid-19感染的病毒) 的detectr测定检测限(lod)的detectr测定结果。
220.图104示出了评价针对sars-cov-2n-基因(“r1763-n-基因”) 的grna在使用lbcas12a可编程核酸酶(seq id no:27)的2路复用rt-lamp反应中的靶标特异性的detectr测定结果。
221.图105示出了评价针对sars-cov-2的n-基因(“r1763-n-基因”)或sars-cov-2的e-基因(“r1765-e-基因”)的grna在使用 lbcas12a可编程核酸酶(seq id no:27)的3路复用rt-lamp反应中的靶标特异性的detectr测定结果。
222.图106示出了与pcrd横向流动装置相容的检测核酸的设计。提供了示例性相容检测核酸rep072、rep076和rep100(左)。这些检测核酸可用于pcrd横向流动装置(右)以检测是否存在靶核酸。右上示意图示出了当与不含靶核酸的样品接触时产生的示例性条带配置。右下示意图示出了当与包含靶核酸的样品接触时产生的示例性条带配置。
223.图107a示出了基因组图谱,表明冠状病毒基因组内的e(包膜) 基因和n(核蛋白)基因区的位置。引物和探针相对于e和n基因区的相应区域或退火区域显示在各自基因区下方。rt-lamp引物由黑色矩形表示,fip引物(灰色)的f1c和b1c半数的结合位置由带虚线边框的条纹矩形表示。在世界卫生组织(who)和疾病控制中心 (cdc)使用的测试中扩增的区域分别表示为“who e扩增子”和“cdc n2扩增子”。
224.图107b示出了使用lbcas12a可编程核酸酶(seq id no:27) 评价针对多种冠状病毒株(sars-cov-2、sars-cov或蝙蝠
ꢀ‑
sl-covzc45)的n-基因或e-基因的grna的特异性或广泛检测效用的detectr测定结果。测定中使用的n-基因grna(左,“n-基因”)对sars-cov-2具有特异性,而e-基因grna能够检测3种sars 样冠状病毒(右,“e-基因”)。靶向sars-cov和蝙蝠冠状病毒的单独n基因grna未检测到sars-cov-2(中,“n-基因相关物种变体”)。
225.图107c示出了冠状病毒detectr测定中使用的示例性实验室设备。除了适当的生
物安全防护设备外,所使用的设备还包括样品收集装置、微量离心管、设置为37℃和62℃的加热块、移液器和吸头以及横向流动条。
226.图107d示出了用于检测受试者中冠状病毒的detectr测定的示例性工作流程。常规rna提取或样品基质可用作detectr的输入(用于ne基因、en基因和rnase p的lamp预扩增和基于cas12 的检测),可通过荧光读取器或横向流动条进行可视化。
227.图107e示出了横向流测试条(左),表明sars-cov-2n-基因的阳性测试结果(左,上)和sars-cov-2n-基因的阴性测试结果 (左,下)。表(右)示出了测试是否存在rnase p(阳性对照)、 sars-cov-2n-基因和冠状病毒e-基因的基于横向流动条的冠状病毒诊断测定的可能测试指标和相关结果。
228.图108a示出了在存在靶核酸(上图)的情况下,cas12可编程核酸酶对用fam和生物素标记的检测核酸的切割。横向流动测试条 (下图)的示意图示出了指示测试样品中靶核酸存在(“阳性”)或不存在(“阴性”)的标记。完整的fam生物素化报道分子流向对照捕获线。识别匹配的靶标后,cas-grna复合体切割报道分子,然后流向靶标捕获线。
229.图108b示出了使用lbcas12a的detectr测定的结果,以确定反应时间对含有0fm sars-cov-2rna或5fm sars-cov-2rna 的样品的影响。lbcas12a检测测定对10分钟内饱和的sars-cov-2 n-基因的rt-lamp扩增子的荧光信号。rt-lamp扩增子从2μl的 5fm或0fm sars-cov-2n-基因ivt rna中通过在62℃下扩增20 分钟产生。
230.图108c示出了对应于图108b中通过detectr测定的样品的横向流动测试条测定样品。对于含有0fm sars-cov-2rna(
“‑”
) 或5fm sars-cov-2rna(“ ”)的样品,以反应时间的函数显示对应于对照(c)或测试(t)的条带。相同rt-lamp扩增子上的lbcas12a 在5分钟内通过横向流动测定产生可见信号。
231.图108d示出了使用lbcas12a(中)或cdc方案(左)进行的 detectr测定的结果用于确定sars-cov-2的检测限。信号显示为每次反应的病毒基因组拷贝数的函数。显示0拷贝/μl和10拷贝/μl (右)的测定的代表性横向流动结果。
232.图108e示出了患者样品detectr数据。来自6名covid-19 感染患者(n=11,5次重复)和12名感染流感或4种季节性冠状病毒(hcov-229e、hcov-hku1、hcov-nl63、hcov-oc43)中的一种的患者(n=12)的临床样品使用sars-cov-2detectr(阴影框) 进行分析。使用imagej定量来自横向流动条的信号强度,并归一化为n基因、e基因或rnase p集内的最高值,阳性阈值高于背景五个标准偏差。sars-cov-2测试的最终确定基于图107e中的解释矩阵。 flua表示甲型流感,flub表示乙型流感。hcov表示人冠状病毒。
233.图108f示出了在covid-19患者(sars-cov-2阳性,“患者1”)、缺乏靶核酸的无靶标对照样品(“ntc”)和含有靶核酸(“pc”)的阳性对照样品中检测sars-cov-2的横向流动测试条。对所有三个样品中是否存在sars-cov-2n-基因、sars-cov-2e-基因和rnase p进行测试。
234.图108g示出了sars-cov-2detectr测定的性能特征。使用 sars-cov-2detectr测定的荧光版本评价了83个临床样品(41 个covid-19阳性,42个阴性)。由于测定质量对照失败,省略了一个样品(covid19-3)。阳性和阴性检测基于图32e中描述的标准。fm 表示飞摩尔;ntc表示无模板对照;ppa表示阳性预测一致性;npa 表示阴性预测一致性。
235.图109示出了比较使用本公开内容的rt-lamp的sars-cov-2 detectr测定与使用
定量逆转录聚合酶链反应(qrt-pcr)检测方法的sars-cov-2测定的表格。detectr rt-lamp测定中的n-基因靶标与qrt-pcr测定中检测到的n-基因n2扩增子相同。
236.图110a示出了在不同缓冲条件下rt-lamp扩增的时间。结果时间计算为荧光值是实验最大值的三分之一时的时间。扩增失败的反应报告为20分钟的值,并标记为“无扩增”。确定靶标对照质粒在水、 10%磷酸盐缓冲盐水(pbs)或10%通用转运培养基(utm)中的不同起始浓度的结果时间。结果时间越短表示扩增越快。
237.图110b示出了用于确定sars-cov-2的n-基因、sars-cov-2 的e-基因和rnase p在5%utm、5%pbs或水中的扩增效率的 rt-lamp测定的结果。对含有0.5fm体外转录的n-基因、0.5fm体外转录的e-基因和0.8ng/μl hela总rna(“n e 总rna”)或无靶标对照(“ntc”)的样品进行测试。
238.图110c示出了直接从在pbs中的鼻拭子扩增rna。结果时间作为pbs浓度的函数进行测量。鼻拭子(“鼻拭子”)加标hela总rna (左,“总rna:0.08ng/ul”)或水(右,“总rna:0ng/ul”)。将不含鼻拭子(“无拭子”)的样品作为对照品进行比较。
239.图111a示出了通过lbcas12a(seq id no:27)检测 sars-cov-2n-基因(n=6)产生的原始荧光曲线。曲线显示在少于20分钟内饱和。
240.图111b示出了使用lbcas12a检测的sars-cov-2n-基因的 detectr测定的检测限,如从图111a中所示的原始荧光迹线所确定。随着sars-cov-2n-基因浓度(每ml拷贝数)的降低,测量荧光强度。
241.图111c示出了从图111a中所示的原始荧光迹线确定的 detectr测定检测限的结果时间。结果时间越短表示扩增和检测越快。
242.图112a示出了使用lbcas12a确定反应时间对含有0fmsars-cov-2rna或5fm sars-cov-2rna的样品的影响的 detectr测定的结果。
243.图112b示出了对应于图112a中通过detectr测定的样品的横向流动测试条测定样品。以反应时间的函数显示含有0fmsars-cov-2rna(
“‑”
)或5fm sars-cov-2rna(“ ”)的样品的对应于对照(c)或测试(t)的条带。
244.图113示出了用于确定grna对不同人冠状病毒株的交叉反应性的detectr测定的结果。对含有sars-cov-2n-基因、sars-covn-基因、蝙蝠-sl-covzc45 n-基因、sars-cov-2e-基因、sars-cove-基因、或蝙蝠-sl-covzc45 e-基因的体外转录的rna的样品,或对cov-hku1、cov-299e、cov-oc43或cov-nl63呈阳性的临床样品进行测试。hela总rna被测试作为rnase p的阳性对照,而缺乏靶核酸(“ntc”)的样品被测试作为阴性对照。
245.图114a示出了三种冠状病毒株的n-基因grna靶向的靶位点的序列比对。n基因grna#1与cdc-n2扩增子相容,n基因grna #2与who n-sarbeco扩增子相容。
246.图114b示出了三种冠状病毒株的e-基因grna靶向的靶位点的序列比对。测试的两个e基因grna(e基因grna#1和e基因grna#2)与who e-sarbeco扩增子相容。
247.图115a-图115c示出了关于covid-19感染患者样品的 detectr动力学曲线。使用两种不同的基因n2和e以及样品输入对照rnase p对来自5名患者(covid19-1至covid19-10)的10 个鼻拭子样品进行sars-cov-2检测。图115a示出了使用标准扩增和检测条件,10名患者中有9名产生了表明存在sars-cov-2e-基因的稳健荧光曲线(20分钟扩增,10分钟内发出信号)。图115b示出了sars-cov-2n-基因需要延长扩增时间才能使10名患者中有8名产
生强荧光曲线(30分钟扩增,10分钟内发出信号)。图115c示出了作为样品输入对照,rnase p对于22个总测试样品中的17个呈阳性(20分钟扩增,10分钟内发出信号)。
248.图116示出了sars-cov-2的detectr分析可在约30min内识别下至10个病毒基因组(20min扩增,10min detectr)。重复的lamp反应扩增20min,然后进行lbcas12a detectr分析。
249.图117示出了图116中提供的lbcas12a detectr分析在5分钟时的原始荧光。sars-cov-2n-基因的检测限被确定为每次反应10 个病毒基因组(n=6)。
250.图118示出了10个covid-19感染患者样品和12个其他病毒性呼吸道感染患者样品的横向流动detectr结果。使用两种不同的基因n2和e以及相同样品输入对照rnase p,对来自6名患者 (covid19-1至covid19-5)的10个样品(其中一个鼻咽拭子(a) 和一个口咽拭子(b))进行sars-cov-2测试。根据图119中提供的指导分析结果。
251.图119示出了用于解释sars-cov-2detectr横向流动结果的说明。
252.图120a-图120c示出了对11个covid-19感染患者样品和12 个其他病毒性呼吸道感染患者样品进行的荧光detectr动力学曲线。使用两种不同的基因n2和e以及样品输入对照rnase p对来自6名患者(covid19-1至covid19-6)的10个鼻咽/口咽拭子样品进行了 sars-cov-2测试。
253.图120a示出了使用标准扩增和检测条件测试的样品,12个 covid-19阳性患者样品中有10个产生表明存在sars-cov-2e基因的稳健荧光曲线(20分钟扩增,10分钟内发出信号)。其他12个病毒性呼吸道临床样品均未检测到e基因信号。
254.图120b示出了对12个covid-19阳性患者样本中的10个使用为了产生强荧光曲线(30分钟扩增,10分钟内发出信号)的延长扩增时间测试存在sars-cov-2n基因的样品。在其他12个病毒性呼吸道临床样品中未检测到n基因信号。
255.图120c示出了对应于样品输入对照rnase p的图。
256.图121示出了临床样品的sars-cov-2detectr测定结果的热图,并显示了测试解释。对24个临床样品(12个covid-19阳性) 的sars-cov-2detectr通过imagej gel analyzer工具定量的横向流动sars-cov-2detectr测定结果(上图)显示98.6%(71/72条) 与荧光形式的测定结果(下图)一致。两种测定均以30分钟扩增运行,cas12反应信号在10分钟时获取。橙色(下图,第4列)用( ) 表示假定阳性。
257.图122示出了临床样品的sars-cov-2detectr测定结果的热图,并显示了测试解释。上图显示了对另外30个covid-19阳性临床样品(27个阳性,1个假定阳性,2个阴性)进行荧光sars-cov-2 detectr测定的结果。橙色( )表示的假定阳性(上图,第9列)。下图显示了对另外30个covid-19阴性临床样品(0个阳性,30个阴性)进行荧光sars-cov-2detectr测定的结果。
258.图123示出了使用不同引物集对rnase p pop7进行rt-lamp 扩增的结果时间。确定用引物集1-10扩增的样品的结果时间。引物集1对应于seq id no:360-seq id no:365,并且引物集9对应于 seq id no:366-seq id no:371。
259.图124示出了对使用rt-lamp用引物集1或引物集9扩增并用r779、r780或r1965 grna检测的rnase p pop7进行的detectr 反应随时间的原始荧光。detectr反应在37℃下进行90分钟。r779 在无背景(虚线)的情况下检测到由引物集1产生的扩增子。
260.图125a示出了在含有10倍稀释的总rna的样品中的rnase p pop7检测的结果时间,这些样品使用rt-lamp和引物集1或引物集9扩增。扩增在60℃下进行30分钟。
261.图125b示出了图125a中所示的rnase p pop7扩增子的 detectr反应,并使用grna 779(seq id no:330)或grna 1965 (seq id no:331)检测。使用grna 779检测使用引物集1扩增的样品,使用grna 1965检测使用引物集9扩增的样品。detectr反应在37℃下进行90分钟。
262.图126a和图126b示出了设计用于detectr测定的盒的照片。
263.图127a和图127b是图126a中所示盒的示意图。
264.图128a-图128d示出了设计用于detectr测定的盒的示意图。图128a示出了具有圆形试剂储存孔和z方向高阻力蛇形路径的盒。图128b示出了具有细长形试剂储存孔和z方向高阻力蛇形路径的盒。图128c示出了具有圆形试剂储存孔和xy方向高阻力蛇形路径的盒。图128d示出了具有细长形试剂储存孔和xy方向高阻力蛇形路径的盒。
265.图129a-图129d显示了设计用于detectr测定的盒的示意图。图129a示出了具有用于样品计量的蛇形阻力通道的盒,该蛇形阻力通道在与样品计量通道不同的平面或层上是蛇形的。图129b示出了具有用于样品计量的蛇形阻力通道的盒,该蛇形阻力通道在与样品计量通道相同的平面或层上是蛇形的。图129c示出了具有用于样品计量的直角艰难路径阻力路径和在与样品计量通道不同的平面或层上的detectr样品计量入口的盒。图129d示出了具有用于样品计量的直角艰难路径阻力路径以及在与样品计量通道相同的平面或层上的detectr样品计量入口的盒。
266.图130a示出了设计用于detectr测定的盒的特征。
267.图130b示出了用于生产本公开内容的盒的生产方案(左和中) 和用于检测盒中样品的读出装置(右)。
268.图131a示出了用于加热本公开内容的盒的区域的盒歧管的示意图。盒歧管具有集成加热区,带有集成供气连接和用于供气接口的集成o形环槽。盒歧管包含绝缘区以将扩增温度区与检测温度区热分离并保持扩增腔室和盒的检测腔室的适当温度。
269.图131b示出了用于产生本文所述的盒的两种产生方法。在第一种产生方法(左)中,使用多层的二维(2d)层压生产盒。在第二种生产方法(右)中,将包含综合复杂特征的零件注塑成型并通过层压密封。
270.图131c示出了具有用于将盒与注射器耦合的鲁尔滑动适配器的盒的示意图。适配器可以与滑动鲁尔尖端形成紧密适配的密封。适配器被配置成与本文公开的任何盒一起起作用。
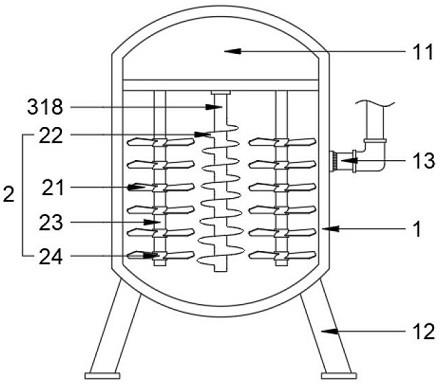
271.图132a和图132b显示了与微流体盒一起使用的集成流动池的示意图。集成流动池包含三个区域,即裂解区、扩增区和检测区。裂解区的长度足以容纳微流体芯片样品裂解流动池。裂解流动池可以与本文公开的盒上的扩增腔室和检测腔室组合。
272.图133示出了本公开内容的盒上的入口通道的详细信息。
273.图134示出了使用本公开内容的微流体盒进行detectr测定的工作流程。盒(“芯片”)加载样品和反应溶液。将扩增腔室(“lamp 腔室”)加热至60℃,并将样品在扩增腔室中温育30分钟。将扩增的样品(“lamp扩增子”)泵送至detectr反应腔室,并将detectr 试剂泵送至detectr反应腔室。将detectr反应腔室加热至37 ℃,并将样品温育30分钟。实时测量
detectr反应腔室中的荧光以产生定量结果。
274.图135示出了与本文公开的盒相容的盒歧管的系统电子结构的示意图。电子器件被配置成将盒的第一区域加热至37℃并且将盒的第二区域加热至60℃。
275.图136a和图136b示出了用于加热和检测本公开内容的盒的盒歧管的示意图。歧管被配置成用来接纳盒,促进detectr反应,并读取detectr反应产生的荧光。
276.图137a示出了盒中荧光样品的实例,并用盒歧管照明。在60 ℃下进行30分钟扩增步骤和在37℃下进行30分钟检测步骤后,阳性对照孔含有试剂和扩增样品。空孔用作假阴性样品。
277.图137b示出了用于加热和检测本公开内容的盒的盒歧管。
278.图137c示出了用于加热和检测本公开内容的盒的盒歧管。
279.图138a和图138b示出了在由本公开内容的歧管促进的微流体盒的检测腔室中产生的荧光。
280.图139a、图139b、图140a和图140b示出了加热至60℃的扩增腔室(图139a和图140a)或加热至37℃的detectr腔室(图 139b和图140b)的热测试总结。
281.图141a示出了在读板器上以100的增益运行的detectr结果,使用来自微流体盒的lamp产物作为输入。使用单个非模板对照 (ntc)重复运行样品。
282.图141b示出了使用来自微流体芯片的样品在读板器上运行的三种lamp产物。lamp反应按照芯片运行的顺序编号(lamp_1 首先运行,等等)。供体对于snp a是纯合的,因此crrna 570首先出现。atto 488用作荧光标准品。
283.图142a示出了加载的微流体芯片的图像。
284.图142b示出了lamp扩增30分钟后在读板器上测量的detectr反应结果。
285.图143a、图143b、图143c和图143d示出了冠状病毒 detectr反应的结果。具有输入至lamp的10个拷贝的两个反应腔室产生快速增加的detectr信号。所有ntc均为阴性。将10个拷贝输入至lamp时,detectr信号在反应过程中逐渐增加,如下图143c中的光电二极管测量所示。图143d中的阴性对照表明无污染。
286.图144a、图144b、图144c和图144d示出了重复冠状病毒 detectr反应的结果。
287.图145a、图145b、图146a、图146b和图146c示出了微流体盒中乙型流感病毒detectr反应的光电二极管测量结果。
288.图147示出了一系列detectr试剂的荧光结果,这些试剂在玻璃毛细管中已储存7个月。
289.图148提供了自旋通过柱的设计以及使用该自旋通过柱进行顺序扩增和detectr反应的方法。
290.图149提供了用于构建电化学可检测核酸的三种试剂的结构: (a)二茂铁标记的胸苷、(b)6-羧基荧光素和(c)生物素标记的磷酸盐。
291.图150提供了用于注塑成型盒的设计,该盒包含样品输入腔室和多个腔室,在这些腔室中样品的部分可以经历扩增和检测反应。
292.图151提供了包括检测器二极管阵列和加热面板的装置的设计,该装置能够利用图150中所示的注塑成型盒。
293.图152和图153示出了对经历不同双重裂解扩增缓冲液的样品进行的一系列
detectr反应的荧光数据。
294.图154小图(a)提供了用于对样品进行多重扩增和detectr 反应的注塑成型盒的设计。小图(b)提供了被配置成利用注塑成型盒并测量来自在盒中进行的detectr反应的荧光的装置的设计。
295.图155提供了利用图154中所示的注塑成型盒和装置用于对样品进行平行扩增和detectr反应的方法。
296.图156示出了来自图154中的注塑成型盒和装置的二极管阵列和加载染料的反应隔室。
297.图157示出了注塑成型盒的可能设计,该盒包括与5个扩增腔室连接的一个样品腔室,和与每个扩增腔室连接的2个检测腔室。因此,该装置能够对单个样品进行10次平行detectr反应。
298.图158示出了可能的注塑成型盒设计,该盒包括与4个扩增腔室连接的一个样品腔室,和与每个扩增腔室连接的2个检测腔室。注塑成型盒包括一系列阀和泵或端口,用于控制整个盒的流动的歧管的泵送。
299.图159示出了可能的注塑成型盒设计,该盒包括与4个扩增腔室连接的一个样品腔室,与每个扩增腔室连接的2个检测腔室,和与样品腔室连接的试剂腔室。
300.图160提供了注塑成型盒设计的俯视图,其中试剂腔室位于通向扩增腔室和检测腔室的流动路径中。
301.图161示出了注塑成型盒设计的一部分,其具有能够通过单个旋转阀连接至多个试剂腔室和扩增腔室的样品腔室。
302.图162示出了注塑成型盒设计的一部分,其中滑动阀连接多个隔室。小图a-c示出了能够采用滑动阀的不同位置。
303.图163小图a示出了用于具有壳体的注塑成型盒的可能设计。小图b提供了小图a中所示设计的物理模型。
304.图164小图a提供了具有壳体的注塑成型盒的设计的自底向上视图。小图b提供了注塑成型盒顶部的视图。
305.图165提供了具有滑动阀的注塑成型盒的多个视图。
306.图166提供了具有通向透明反应腔室的多个试剂孔的注塑成型盒的一部分的两个视图。
307.图167小图a-b提供了注塑成型盒设计的俯视图。小图c显示了注塑成型盒的物理模型图。
308.图168示出了容纳在包含二极管阵列的装置中的注塑成型盒的图。
309.图169示出了用于控制装置的图形用户界面,该装置包含注塑成型盒和用于检测的二极管阵列。
310.图170示出了使用8二极管检测器阵列、8腔室注塑成型盒和染料的一系列荧光实验的结果。
311.图171示出了一系列herc2靶向detectr反应和缓冲液对照的荧光结果,使用8二极管检测器阵列测量。
312.图172示出了插入装置中的注塑成型盒,具有包含detectr 反应的8个腔室。
313.图173示出了在不同裂解条件下使用lamp扩增seracare靶核酸的结果。样品在含有缓冲液(上图)或病毒裂解缓冲液(“vlb”,下图)的低ph缓冲液中扩增。缓冲液不含还原剂(“对照”,第1和4 列),含有还原剂b(第2和5列)或还原剂a(第3和6列)。样品在室温(左图)或95℃(右图)下温育5分钟。每次反应样品不含靶标(“ntc”),含有2.5、25或250个拷贝。在25μl反应中使用5 μl样品进行测定,重复三次。
314.图174示出了在不同裂解条件下使用lamp扩增seracare标准靶核酸的结果。样品在含有缓冲液(左图)或病毒裂解缓冲液(“vlb”,右图)的低ph缓冲液中扩增。缓冲液不含还原剂(“对照”),含有还原剂b或还原剂a。样品在室温(上图)或95℃(下图)下温育5 分钟。每次反应样品不含靶标(“ntc”),含有1.5、2.5、15、25、 150或250个拷贝。在15μl反应中使用3μl样品或在25μl反应中使用5μl样品进行测定,重复三次。
315.图175示出了在存在六种不同病毒裂解缓冲液(“vlb”、“vlb-d”、“vlb-t”、“缓冲液”、“缓冲液-a”和“缓冲液-b”)的情况下 sars-cov-2n基因(“n”)和rnase p样品输入对照核酸(“rp”)的扩增。缓冲液-a含有具有还原剂a的缓冲液,缓冲液-b含有具有还原剂b的缓冲液。阴影方块表示扩增速率,阴影更深表示扩增更快。在95℃(“95c”)或室温(“rt”)下对高、中或低滴度covid-19阳性患者样品(分别为“16.9”、“30.5”和“33.6”)进行扩增。样品重复测量两次。
316.图176示出了用电活性报道核酸进行的detectr反应的方波伏安法结果。在detectr反应开始后立即(0分钟)收集和在33 分钟收集结果。
317.图177示出了用电活性报道核酸进行的detectr反应的循环伏安法结果。在detectr反应开始后立即(0分钟)收集和在26 分钟收集结果。
具体实施方式
318.本公开内容提供了用于快速测试的各种装置、系统、流体装置和试剂盒,它们可以通过使用可编程核酸酶快速评估样品中是否存在靶核酸,该可编程核酸酶与流体系统的功能化表面相互作用以产生可检测信号。特别地,本文提供了用于快速实验室测试的各种装置、系统、流体装置和试剂盒,它们可以快速评估生物样品中是否存在靶核酸。靶核酸可以来自病毒。例如,本文公开的用于快速实验室测试的装置、系统流体装置和试剂盒可以评估样品中是否存在来自流感病毒株的靶核酸。流感可以是甲型流感或乙型流感。病毒可以是冠状病毒。本文提供的组合物和方法公开了可用于本文提供的系统、流体装置和试剂盒中以检测来自流感或另一种病毒(例如另一种呼吸道病毒(例如冠状病毒))的靶核酸的可编程核酸酶。在一些实施方案中,靶核酸可以来自上呼吸道病毒。在一些实施方案中,本文提供的是可以对多于一种独特的靶核酸序列进行多路复用检测的装置、系统、流体装置和试剂盒。例如,本文提供的装置、系统、流体装置、试剂盒和可编程核酸酶可用于对来自一种或多种病毒的靶核酸进行多路复用检测。在特定实施方案中,本文提供的装置、系统、流体装置、试剂盒和可编程核酸酶可用于甲型流感和乙型流感的多路复用检测。在一些实施方案中,本文提供的装置、系统、流体装置、试剂盒和可编程核酸酶可用于甲型流感、乙型流感和一种或多种其他病毒(例如冠状病毒、rsv或另一种呼吸道病毒,例如上呼吸道病毒)的多路复用检测。
319.本文公开的系统和可编程核酸酶可用作本文公开的任意疾病 (例如,rsv、脓毒
症、流感)的伴随诊断,或者可以用于试剂盒、床旁诊断或非处方诊断。该系统可以用作床旁诊断或实验室测试以检测靶核酸,从而检测从其取样的受试者的状况。该系统可用于确定在从其取样的受试者中是否存在目标基因(例如,与疾病状态相关的基因)。该系统可用于确定从其取样的受试者中是否存在病原体(例如,病毒或细菌)。该系统可以在各种场所或地点中使用,例如在实验室、医院、医师办公室/实验室(pol)、诊所、偏远场所或家庭中。有时,本公开内容提供了用于消费者遗传用途或非处方用途的各种装置、系统、流体装置和试剂盒。
320.本文公开了用于检测样品中靶核酸存在的装置、系统、流体装置、试剂盒和方法。靶核酸可以是与疾病状态相关的基因或基因的一部分。靶核酸可以是来自病原体(例如,病毒或细菌)的核酸。用于检测样品中存在靶核酸的装置、系统、流体装置、试剂盒和方法可用于快速实验室测试以检测目标靶核酸(例如,来自流感、冠状病毒或其他病原体的靶核酸,或与目标基因相对应的靶核酸)。特别地,本文提供了装置、系统、流体装置和试剂盒,其中快速测试可以在单个系统中进行。靶核酸可以是导致样品中的疾病的病毒或细菌或其他物剂的核酸的一部分。靶核酸可以是来自样品中的任何生物体的rna 或dna的一部分。在一些实施方案中,本文公开的可编程核酸酶被 rna或dna激活以启动rna报道分子的反式切割活性。在一些情况下,本文公开的可编程核酸酶与靶rna结合以启动rna报道分子的反式切割,并且该可编程核酸酶可以称为rna激活的可编程rna 核酸酶。在一些情况下,本文公开的可编程核酸酶与靶dna结合以启动rna报道分子的反式切割,并且该可编程核酸酶可以被称为 dna激活的可编程rna核酸酶。在一些情况下,本文公开的可编程核酸酶能够被靶rna或靶dna激活。例如,本文公开的cas13,例如cas13a,被靶rna核酸或靶dna核酸激活,以反式并列切割rna 报道分子。在一些实施方案中,cas13与靶ssdna结合,从而启动 rna报道分子的反式切割。样品中靶核酸的检测可以指示样品中疾病的存在,并且可以提供信息以采取行动来减少疾病向受疾病影响的环境中或在携带疾病的个体附近的个体的传播。样品中靶核酸的检测可能表明存在为致病细菌提供抗生素耐药性的疾病突变,例如提供对致病细菌的抗生素耐药性的单核苷酸多态性(snp)。可编程核酸酶促进靶核酸的检测。可编程核酸酶可以在指导核酸与靶核酸结合之后变得激活,其中被激活的可编程核酸酶可以切割靶核酸并且可以具有反式切割活性,其还可以被称为“附带(collateral)”或“反式附带 (transcollateral)”切割。反式切割活性可以是通过激活的可编程核酸酶对附近单链核酸的非特异性切割,例如具有检测部分的检测核酸的反式切割。一旦检测核酸被激活的可编程核酸酶切割,检测部分就可以从报道分子释放或分离,并产生固定在支持介质上的可检测信号。检测部分通常是荧光团、染料、多肽或核酸中的至少一种。有时,检测部分与要固定的支持介质上的捕获分子结合。可检测信号可以在支持介质上可视化,以评估与病痛(例如疾病)相关的靶核酸的存在或水平。可编程核酸酶可以是具有反式切割活性的crispr-cas(成簇的规则间隔的短回文重复序列-crispr相关)核蛋白复合体,其可以通过指导核酸与靶核酸的结合而被激活。
321.在一个方面,本文描述了用于检测靶核酸的系统。该系统可以包含支持介质;靶向靶序列的指导核酸;能够在与指导核酸和靶序列复合时被激活的可编程核酸酶;和包含检测部分的单链检测核酸,其中该检测核酸能够被激活的核酸酶切割,由此产生第一可检测信号。
322.在另一方面,本文描述了用于检测靶核酸的系统,该系统包含试剂腔室和用于检测第一可检测信号的支持介质。该试剂腔室包含靶向靶序列的指导核酸;能够在与指导核酸和靶序列复合时被激活的可编程核酸酶;和包含检测部分的单链检测核酸,其中该检测核酸能够被激活的核酸酶切割,由此产生第一可检测信号。
323.本文还描述了一种检测样品中的靶核酸的方法,包括使样品接触靶向靶序列的指导核酸、能够在与指导核酸和靶序列复合时被激活的可编程核酸酶、包含检测部分的单链检测核酸,其中该检测核酸能够被激活的核酸酶切割,由此产生第一可检测信号;以及使用支持介质呈现第一可检测信号。
324.本文还描述了用于检测靶核酸(例如,来自流感、冠状病毒或与疾病状态相关的基因)的crispr-cas诊断的测定的各种设计。本文公开的横向流动测定的设计和形式可以包括新的cas报道分子,其可以被束缚在横向流动条本身上游的反应腔室的表面上。本文公开的测定设计提供了显著的优点,因为它们使假阳性的几率最小化,因此可以改善对靶核酸的灵敏度和特异性。
325.本文还描述了用于检测靶核酸的试剂盒(例如,来自流感、冠状病毒或与疾病状态相关的基因)。该试剂盒可以包含支持介质;靶向靶序列的指导核酸;能够在与指导核酸和靶序列复合时被激活的可编程核酸酶;和包含检测部分的单链检测核酸,其中该检测核酸能够被激活的核酸酶切割,由此产生第一可检测信号。
326.可以测试来自个体的生物样品或环境样品以确定个体是否患有传染病。可以测试生物样品以检测是否存在来自病毒(例如,流感病毒、冠状病毒或呼吸道合胞病毒)的至少一种靶核酸。可以测试生物样品以检测是否存在来自细菌的至少一种靶核酸。来自导致所检测疾病的病原体的至少一种靶核酸还可以指示病原体是野生型的或包含赋予治疗(例如抗生素治疗)耐药性的突变。在一些实施方案中,可以测试来自个体的生物样品或环境样品以确定个体是否具有与疾病状态相关的基因或基因突变。将来自个体或环境的样品施加到本文所述的试剂。样品与试剂之间的反应可以在试剂盒中提供的试剂腔室中或试剂盒中提供的支持介质上进行。如果样品中存在靶核酸,则靶核酸与指导核酸结合以激活可编程核酸酶。激活的可编程核酸酶切割检测核酸并产生可在支持介质上可视化的可检测信号。如果样品中靶核酸不存在或低于检测阈值,则指导核酸保持未结合状态,可编程核酸酶保持灭活状态,并且检测核酸保持未切割状态。在样品与试剂接触达预定时间之后,将经反应的样品放置在支持介质的样品垫上。通过将支持介质浸入试剂腔室中,将经反应的样品施加到样品垫,或者如果试剂最初放置在支持介质上,则允许样品运输,从而可以将样品放置在样品垫上。随着经反应的样品和试剂沿着支持介质移动到检测区域,并且在施加经反应的样品后经过预定的时间后,阳性对照标记可以在检测区域中可视化。如果样品中呈靶核酸阳性,则还可以可视化可检测信号的测试标记。可以通过肉眼或使用移动装置将检测区域中的结果可视化。在一些情况下,个体可以打开移动应用程序以在具有相机的移动装置上读取测试结果,并使用移动装置的相机和移动应用程序的图形用户界面(gui)来拍摄支持介质的图像,包括壳体上的检测区域、条形码、参考色标和基准标记。移动应用程序可以识别该测试,将图像中的检测区域可视化,并进行分析以确定导致疾病的靶核酸的存在与否或水平。移动应用程序可以将测试结果呈现给个体,将测试结果存储在移动应用程序中,或者与远程设备通信并传输测试结果的数据。
327.本文所述的此类装置、系统、流体装置、试剂盒和方法可允许在偏远地区或资源匮乏的环境中检测靶核酸无需专用扩增设备,进而检测病毒感染(例如流感病毒感染、冠状病毒或呼吸道合胞病毒)、细菌感染或与靶核酸相关的疾病状态。而且,本文所述的此类装置、系统、流体装置、试剂盒和方法可允许在医疗诊所或医生办公室检测靶核酸,进而检测与靶核酸相关的病原体和疾病,而无需专业设备。在一些情况下,这提供了床旁测试,以便用户在家中轻松地测试疾病或感染或在医疗服务提供者的办公室中快速测试疾病或感染。由于许多原因,对于家庭测试而言,在一个小时内(例如15至60分钟)内给出结果的测定是特别理想的。抗病毒药在最初的48小时内给予可能是最有效的,并且可以改善抗病毒药物管理。因此,本文公开的能够在一个小时内给出结果的系统和测定将允许在最佳时间递送抗病毒疗法。另外,本文提供的系统和测定能够提供快速的诊断和结果,可以帮助将患者留在家里或送回家中,改善全面的疾病监测,并防止感染的传播。在其他情况下,这提供了一种测试,其可以在实验室中用于检测来自受试者的样品中的靶核酸。特别地,本文提供了装置、系统、流体装置和试剂盒,其中快速实验室测试可以在单个系统中进行。在一些情况下,这对于在发展中国家检测疾病、作为一种全球医疗保健工具来检测疾病的传播或治疗的功效、或提供病毒感染(例如流感)的早期检测可能很有价值。
328.本文所述的一些方法使用编辑技术,例如使用编辑酶或可编程核酸酶和指导核酸的技术来检测靶核酸。可以通过靶核酸来激活编辑技术中的编辑酶或可编程核酸酶,之后,激活的编辑酶或激活的可编程核酸酶可以切割附近的单链核酸,例如具有检测部分的检测核酸。可以通过等温扩增来扩增靶核酸(例如,来自诸如流感的病毒的靶核酸),然后可以使用编辑技术来检测该标志物。在一些情况下,编辑技术可以包括编辑酶或可编程核酸酶,当被激活时,该酶切割附近的 rna或dna作为检测结果的读出。在一些情况下,本文所述的方法包括获得无细胞dna样品、扩增来自样品的dna、使用编辑技术切割检测核酸,以及读取编辑技术的输出。在其他情况下,该方法包括从患者获得流体样品而不扩增该流体样品的核酸,使用编辑技术切割检测核酸,以及检测该核酸。该方法还可包括使用单链检测dna,使用激活的编辑酶切割单链检测dna,其中如通过颜色变化测量的,编辑酶切割至少50%的单链检测dna群体。许多样品、指导核酸、可编程核酸酶或编辑酶、支持介质、靶核酸、单链检测核酸和试剂与本文公开的装置、系统、流体装置、试剂盒和方法一致。
329.本文还公开了检测核酸和使用该检测核酸检测靶核酸的方法。通常,检测核酸是蛋白质-核酸。例如,测定样品中的靶核酸的方法包括使样品与包含指导核酸和可编程核酸酶的复合体接触,所述指导核酸包含与靶核酸的区段反向互补的区段或部分,所述可编程核酸酶在包含与靶核酸的区段或部分结合的指导核酸的区段或部分的复合体形成后表现出与序列无关的切割;以及测定指示蛋白质-核酸群体中的至少一些蛋白质-核酸的切割的信号,其中所述信号指示样品中存在靶核酸,并且其中不存在信号或存在接近背景的信号则指示样品中不存在靶核酸。蛋白质-核酸通常是酶-核酸或酶底物-核酸。有时,蛋白质-核酸附接至固体支持物。核酸可以是dna、rna或dna/rna 杂合体。本文所述的方法使用可编程核酸酶,例如crispr/cas系统,以检测靶核酸。例如,测定样品中的靶核酸的方法包括:a)使样品与包含指导核酸和可编程核酸酶的复合体接触,所述指导核酸包含与靶核酸的区段反向互补的区段,所述可编程核酸酶在包含与靶核酸的区段结合的指导核酸的区段的复合体形成后表现出与序列无关的切割;b)使复合体与底物接触;c)使底物与试剂接触,所述试剂
与切割的底物差异地反应;以及d)测定指示底物切割的信号,其中所述信号指示样品中存在靶核酸,并且其中不存在信号或存在接近背景的信号则指示样品中不存在靶核酸。底物通常是酶-核酸。底物有时是酶底物-核酸。
330.蛋白质-核酸的切割产生信号。例如,蛋白质-核酸的切割产生量热信号、电位信号、安培信号、光学信号或压电信号。各种装置可用于检测这些不同类型的信号,该信号指示样品中是否存在靶核酸。样品
331.许多样品与本文公开的装置、系统、流体装置、试剂盒和方法一致。这些样品例如与本文公开的用于检测样品内的靶核酸的流体装置一致,其中该流体装置可包括用于样品制备、样品内靶核酸的扩增、与可编程核酸酶混合以及检测由流体系统本身内的可编程核酸酶切割检测核酸而产生的可检测信号的多个泵、阀、储器和腔室。这些样品可以包含用于检测病痛(诸如疾病、病原体或病毒,例如流感)靶核酸。通常,可以获取来自个体或动物的样品或环境样品以测试是否存在疾病或任何感兴趣的突变。来自个体的生物样品可以是血液、血清、血浆、唾液、尿液、粘膜样品、腹膜样品、脑脊液、胃分泌物、鼻分泌物、痰、咽溢泌物、尿道或阴道分泌物、溢泌物、积液或组织。在应用于本公开内容的检测系统之前,可以将组织样品解离或液化。样品可以包含一种或多种靶核酸,用于检测病痛(例如疾病、癌症或遗传病),或遗传信息(例如用于表型分析、基因分型或确定血统) 的靶核酸,并且与本文所述的试剂和支持介质相容。通常,可以从可发现核酸的任何地方取样。样品可以取自个体/人、非人动物或作物,或者可以获取环境样品,以测试是否存在疾病、病毒、病原体、癌症、遗传病或任何目标突变或病原体。生物样品可以是血液、血清、血浆、肺液、呼出气冷凝液、唾液、唾沫、尿液、粪便、排泄物、粘液、淋巴液、腹膜样品、脑脊液、羊水、母乳、胃分泌物、身体排出物、溃疡分泌物、脓液、咽溢泌物、尿道分泌物/粘液、阴道分泌物/粘液、肛门分泌物/粘液、精液、泪液、溢泌物、积液、组织液、间质液(例如,肿瘤间质液)、囊液、组织,或者,在一些实例中,它们的组合。样品可以是来自动物(例如人、动物、家畜、宠物等)或植物的体液抽吸物。组织样品可以来自可能被病原体感染或影响的任何组织(例如,疣、肺组织、皮肤组织等)。组织样品(例如,来自动物、植物或人)可以在应用于本公开内容的检测系统之前被解离或液化。样品可以来自植物(例如,作物、水培种植的作物或植物,和/或室内植物)。植物样品可以包括来自组织(例如,根、叶、茎、树干等)的细胞外液。样品可以从植物周围的环境(例如水培液/水或土壤)中采集。来自环境的样品可以是土壤、空气或水。在一些情况下,环境样品作为来自感兴趣表面的拭子获取,或直接从感兴趣的表面获取。在一些情况下,将原始样品施加至检测系统。在一些情况下,在施加至检测系统之前,将样品用缓冲液或流体稀释,或浓缩,或者纯净地施加至检测系统。有时,样品容纳在不超过20μl中。在一些情况下,样品容纳在不超过1、5、10、15、20、25、30、35 40、45、50、55、60、 65、70、75、80、90、100、200、300、400、500μl,或1μl至500μl 的任意值中。有时,样品容纳在超过500μl中。
332.在一些情况下,样品取自单细胞真核生物体;植物或植物细胞;藻细胞;真菌细胞;动物细胞、组织或器官;无脊椎动物的细胞、组织或器官;脊椎动物如鱼、两栖动物、爬行动物、鸟和哺乳动物的细胞、组织、流体或器官;哺乳动物如人,非人类灵长动物、有蹄类动物、猫、牛、绵羊和山羊的细胞、组织、流体或器官。在一些情况下,样品取自线虫、原生动物、蠕虫或疟疾寄生虫。在一些情况下,样品包含来自真核细胞、哺乳动物细胞、人类细胞、原核细
胞或植物细胞的细胞裂解物的核酸。在一些情况下,样品包含从细胞表达的核酸。
333.用于疾病测试的样品可以包含可以与本文所述试剂的指导核酸结合的至少一个靶序列。在一些情况下,靶序列是核酸的一部分。核酸可以来自基因组基因座、转录的mrna或逆转录的cdna。核酸部分的长度可以为5至100、5至90、5至80、5至70、5至60、5至 50、5至40、5至30、5至25、5至20、5至15或5至10个核苷酸。核酸部分的长度可以为5、6、7、8、9、10、11、12、13、14、15、 16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、 31、32、33、34、35、36、37、38、39、40、45、50、60、70、80、 90或100个核苷酸。靶序列可以与指导核酸反向互补。
334.在一些情况下,靶序列是导致样品中的疾病的病毒或细菌或其他物剂的核酸的一部分。在一些情况下,靶序列是样品中来自性传播感染或传染病的核酸的一部分。在一些情况下,靶序列是样品中来自上呼吸道感染、下呼吸道感染或传染病的核酸的一部分。在一些情况下,靶序列是样品中来自医院获得性感染或传染病的核酸的一部分。在一些情况下,靶序列是ssrna。这些靶序列可以来自疾病,该疾病可以包括但不限于流感病毒(包括甲型流感病毒(iav)或乙型流感病毒(ibv))、鼻病毒、感冒病毒、呼吸道病毒、上呼吸道病毒、下呼吸道病毒或呼吸道合胞病毒。病原体包括病毒、真菌、蠕虫、原生动物和寄生虫。病原性病毒包括但不限于流感病毒等。病原体包括,例如,结核分枝杆菌(mycobacterium tuberculosis)、无乳链球菌 (streptococcus agalactiae)、耐甲氧西林金黄色葡萄球菌 (methicillin-resistant staphylococcus aureus)、侵肺军团菌(legionellapneumophila)、酿脓链球菌(streptococcus pyogenes)、大肠杆菌 (escherichia coli)、脑膜炎奈瑟氏球菌(neisseria meningitidis)、肺炎球菌(pneumococcus)、乙型流感嗜血杆菌(hemophilus influenzaeb)、流感病毒、呼吸道合胞病毒(rsv)、肺炎支原体(m.pneumoniae)、中间链球菌(streptococcus intermdius)、肺炎链球菌(streptococcuspneumoniae)和酿脓链球菌(streptococcus pyogenes)。通常,靶核酸包含来自病毒或细菌或导致样品中可发现的疾病的其他因子的序列。病原性病毒包括但不限于流感病毒;呼吸道合胞病毒;冠状病毒、 ssrna病毒、呼吸道病毒、上呼吸道病毒、下呼吸道病毒或鼻病毒。病原体包括,例如,结核分枝杆菌、无乳链球菌、侵肺军团菌、酿脓链球菌、乙型流感嗜血杆菌流感病毒、呼吸道合胞病毒(rsv)或结核分枝杆菌。
335.在一些情况下,靶序列是来自病毒或细菌或导致样品中的疾病的其他试剂的核酸的一部分。在一些情况下,靶序列是样品中来自性传播感染或传染病的核酸的一部分。在一些情况下,靶序列是样品中来自上呼吸道感染、下呼吸道感染或传染病的核酸的一部分。在一些情况下,靶序列是样品中来自医院获得性感染或传染病的核酸的一部分。在一些情况下,靶序列是样品中来自脓毒症的核酸的一部分。这些疾病可以包括但不限于呼吸道病毒(例如,covid-19、sars、 mers、流感等)人类免疫缺陷病毒(hiv)、人类乳头瘤病毒(hpv)、衣原体、淋病、梅毒、滴虫病、性传播感染、疟疾、登革热、埃博拉病毒、基孔肯雅病和利什曼病。病原体包括病毒、真菌、蠕虫、原生动物、疟疾寄生虫、疟原虫属寄生虫、弓形虫属寄生虫和血吸虫属寄生虫。蠕虫包括蛔虫、心丝虫和吞噬线虫、吸虫、棘头虫和绦虫。原生动物感染包括来自贾第虫属种(giardia spp.)、滴虫属种 (trichomonas spp.)、非洲锥虫病、阿米巴痢疾、巴贝虫病、小袋虫痢疾、南美锥虫病、球虫病、疟疾和弓形虫病的感染。诸如寄生虫/ 原生动物病原体之类的病原体的示例包括但不限于:恶性疟原虫 (plasmodium falciparum)、间日疟原虫(p.vivax)、克氏锥虫 (trypanosoma cruzi)和鼠弓形虫
(toxoplasma gondii)。真菌病原体包括但不限于新型隐球菌(cryptococcus neoformans)、荚膜组织胞浆菌(histoplasma capsulatum)、粗球孢子菌(coccidioides immitis)、皮炎芽生菌(blastomyces dermatitidis)、砂眼衣原体(chlamydiatrachomatis)和白色假丝酵母(candida albicans)。病原性病毒包括但不限于免疫缺陷病毒:呼吸道病毒(例如,腺病毒、副流感病毒、严重急性呼吸综合征(sars)、冠状病毒、mers)、胃肠道病毒(例如,诺如病毒、轮状病毒、一些腺病毒、星状病毒)、发疹病毒(例如,引起麻疹的病毒、引起风疹的病毒、引起水痘/带状疱疹的病毒、引起玫瑰疹的病毒、引起天花的病毒、引起第五病的病毒、基孔肯雅病毒感染);肝病毒性疾病(例如,甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎、戊型肝炎);皮肤病毒性疾病(例如疣(包括生殖器、肛门)、疱疹(包括口腔、生殖器、肛门)、传染性软疣);出血性病毒性疾病(例如埃博拉病毒、拉沙热、登革热、黄热病、马尔堡出血热、克里米亚-刚果出血热);神经系统病毒(例如,脊髓灰质炎、病毒性脑膜炎、病毒性脑炎、狂犬病)、性传播病毒(例如,hiv、 hpv等)、免疫缺陷病毒(例如,hiv);流感病毒;登革热;西尼罗病毒;疱疹病毒;黄热病病毒;丙型肝炎病毒;甲型肝炎病毒;乙型肝炎病毒;乳头瘤病毒;等等。病原体包括例如hiv病毒、结核分枝杆菌(mycobacterium tuberculosis)、肺炎克雷伯菌(klebsiellapneumoniae)、鲍曼不动杆菌(acinetobacter baumannii)、洋葱伯克霍尔德菌(burkholderia cepacia)、无乳链球菌(streptococcusagalactiae)、耐甲氧西林金黄色葡萄球菌(methicillin-resistantstaphylococcus aureus)、侵肺军团菌(legionella pneumophila)、酿脓链球菌(streptococcus pyogenes)、大肠杆菌(escherichia coli)、淋病奈瑟氏球菌(neisseria gonorrhoeae)、脑膜炎奈瑟氏球菌 (neisseria meningitidis)、肺炎球菌(pneumococcus)、新型隐球菌 (cryptococcus neoformans)、荚膜组织胞浆菌(histoplasmacapsulatum)、乙型流感嗜血杆菌(hemophilus influenzae b)、苍白密螺旋体(treponema pallidum)、莱姆病螺旋体、铜绿假单胞菌 (pseudomonas aeruginosa)、麻风分枝杆菌(mycobacterium leprae)、流产布鲁氏菌(brucella abortus)、狂犬病病毒、流感病毒、巨细胞病毒、单纯疱疹病毒i、单纯疱疹病毒ii、人血清细小病毒样病毒、呼吸道合胞病毒(rsv)、生殖器支原体(m.genitalium)、阴道鞭毛虫(t.vaginalis)、水痘带状疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、麻疹病毒、腺病毒、人类t细胞白血病病毒、爱泼斯坦-巴尔病毒、鼠白血病病毒、腮腺炎病毒、水疱性口炎病毒、辛德比斯病毒、淋巴细胞性脉络膜脑膜炎病毒、疣病毒、蓝舌病毒、仙台病毒、猫白血病病毒、呼肠孤病毒、脊髓灰质炎病毒、猿猴病毒40、小鼠乳腺肿瘤病毒、登革热病毒、风疹病毒、西尼罗河病毒、恶性疟原虫、间日疟原虫、鼠弓形虫、让氏锥虫(trypanosoma rangeli)、克鲁氏锥虫 (trypanosoma cruzi)、罗得西亚锥虫(trypanosoma rhodesiense)、布氏锥虫(trypanosoma brucei)、曼氏血吸虫(schistosoma mansoni)、日本血吸虫(schistosoma japonicum)、牛巴贝虫(babesia bovis)、艾美球虫(eimeria tenella)、旋盘尾丝虫(onchocerca volvulus)、热带利什曼原虫(leishmania tropica)、结核分枝杆菌、旋毛虫 (trichinella spiralis)、小泰勒虫(theileria parva)、胞状绦虫(taeniahydatigena)、羊绦虫(taenia ovis)、牛肉绦虫(taenia saginata)、细粒棘球绦虫(echinococcus granulosus)、科氏中殖孔绦虫 (mesocestoides corti)、关节炎支原体(mycoplasma arthritidis)、猪鼻炎支原体(m.hyorhinis)、口腔支原体(m.orale)、精氨酸支原体(m.arginini)、莱氏无胆甾原体(acholeplasma laidlawii)、唾液支原体
(m.salivarium)、肺炎支原体(m.pneumoniae)、阴沟肠杆菌(enterobacter cloacae)、克雷伯产气杆菌(kiebsiella aerogenes)、普通变形杆菌(proteus vulgaris)、粘质沙雷氏菌(serratia macesens)、粪肠球菌(enterococcus faecalis)、屎肠球菌(enterococcus faecium)、中间链球菌(streptococcus intermdius)、肺炎链球菌(streptococcuspneumoniae)和酿脓链球菌(streptococcus pyogenes)。通常靶序列包含来自导致可见于样品中的疾病的病毒或细菌或其他物剂的序列。在一些情况下,靶核酸是来自以下至少之一中的来自基因组基因座的核酸、从基因座转录的mrna或逆转录的cdna的一部分:人类免疫缺陷病毒(hiv)、人类乳头瘤病毒(hpv)、衣原体、淋病、梅毒、滴虫、性传播感染、疟疾、登革热、埃博拉、基孔肯雅病和利什曼病。病原体包括病毒、真菌、蠕虫、原生动物、疟疾寄生虫、疟原虫属寄生虫、弓形虫属寄生虫和血吸虫属寄生虫。蠕虫包括蛔虫、心丝虫和吞噬线虫、吸虫、棘头虫和绦虫。原生动物感染包括来自贾第虫属种、滴虫属种、非洲锥虫病、阿米巴痢疾、巴贝虫病、小袋虫痢疾、南美锥虫病、球虫病、疟疾和弓形虫病的感染。诸如寄生虫/原生动物病原体之类的病原体的示例包括但不限于:恶性疟原虫、间日疟原虫、克氏锥虫和鼠弓形虫。真菌病原体包括但不限于新型隐球菌、荚膜组织胞浆菌、粗球孢子菌、皮炎芽生菌、砂眼衣原体和白色假丝酵母。病原性病毒包括但不限于免疫缺陷病毒(例如,hiv);流感病毒;登革热;西尼罗病毒;疱疹病毒;黄热病病毒;丙型肝炎病毒;甲型肝炎病毒;乙型肝炎病毒;乳头瘤病毒;等等。病原体包括例如 hiv病毒、结核分枝杆菌、无乳链球菌、耐甲氧西林金黄色葡萄球菌、侵肺军团菌、酿脓链球菌、大肠杆菌、淋病奈瑟氏球菌、脑膜炎奈瑟氏球菌、肺炎球菌、新型隐球菌、荚膜组织胞浆菌、乙型流感嗜血杆菌、苍白密螺旋体、莱姆病螺旋体、铜绿假单胞菌、麻风分枝杆菌、流产布鲁氏菌、狂犬病病毒、流感病毒、巨细胞病毒、单纯疱疹病毒 i、单纯疱疹病毒ii、人血清细小病毒样病毒、呼吸道合胞病毒(rsv)、生殖器支原体、阴道鞭毛虫、水痘带状疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、麻疹病毒、腺病毒、人类t细胞白血病病毒、爱泼斯坦
ꢀ‑
巴尔病毒、鼠白血病病毒、腮腺炎病毒、水疱性口炎病毒、辛德比斯病毒、淋巴细胞性脉络膜脑膜炎病毒、疣病毒、蓝舌病毒、仙台病毒、猫白血病病毒、呼肠孤病毒、脊髓灰质炎病毒、猿猴病毒40、小鼠乳腺肿瘤病毒、登革热病毒、风疹病毒、西尼罗河病毒、恶性疟原虫、间日疟原虫、鼠弓形虫、让氏锥虫、克鲁氏锥虫、罗得西亚锥虫、布氏锥虫、曼氏血吸虫、日本血吸虫、牛巴贝虫、艾美球虫、旋盘尾丝虫、热带利什曼原虫、结核分枝杆菌、旋毛虫、小泰勒虫、胞状绦虫、羊绦虫、牛肉绦虫、细粒棘球绦虫、科氏中殖孔绦虫、关节炎支原体、猪鼻炎支原体、口腔支原体、精氨酸支原体、莱氏无胆甾原体、唾液支原体和肺炎支原体。在一些情况下,靶序列是来自基因组基因座、转录的mrna或从样品中细菌或导致疾病的其他病原因子(其包括赋予对治疗的抗性的突变,例如赋予对抗生素治疗的抗性的单核苷酸突变)的基因座逆转录的cdna的核酸的一部分。
336.用于癌症测试或癌症风险测试的样品可以包含可以与本文所述试剂的指导核酸结合的至少一个靶核酸区段。在一些情况下,靶核酸区段是来自以下基因的核酸的一部分:与癌症相关的突变的基因、其过表达与癌症有关的基因、抑癌基因、癌基因、检查点抑制剂基因、与细胞生长相关的基因、与细胞代谢相关的基因或与细胞周期相关的基因。有时,靶核酸编码癌症生物标志物,例如前列腺癌生物标志物或非小细胞癌。在一些情况下,该测定可用于检测可预测癌症(例如肺癌、宫颈癌,在一些情况下,癌症可以是由病毒引起的癌症)的靶核酸中的“热点”。导致人类癌症的病毒的一些非限制性示例包括爱泼斯坦-巴尔病毒
(例如,伯基特淋巴瘤、霍奇金病和鼻咽癌);乳头瘤病毒(例如,宫颈癌、肛门癌、口咽癌、阴茎癌);乙型和丙型肝炎病毒(例如肝细胞癌);人类成人t细胞白血病病毒1型(htlv-1) (例如,t细胞白血病);和梅克尔细胞多瘤病毒(例如,梅克尔细胞癌)。本领域技术人员将认识到病毒可以引起或促成其他类型的癌症。在一些情况下,靶核酸是与血热相关的核酸的一部分。在一些情况下,靶核酸区段是来自基因组基因座、从基因座转录的mrna或逆转录的cdna的核酸的一部分,该基因座是以下至少一个:alk、apc、atm、axin2、bap1、bard1、blm、bmpr1a、brca1、brca2、brip1、casr、cdc73、cdh1、cdk4、cdkn1b、cdkn1c、 cdkn2a、cebpa、chek2、ctnna1、dicer1、dis3l2、egfr、 epcam、fh、flcn、gata2、gpc3、grem1、hoxb13、hras、 kit、max、men1、met、mitf、mlh1、msh2、msh3、msh6、 mutyh、nbn、nf1、nf2、nthl1、palb2、pdgfra、phox2b、 pms2、pold1、pole、pot1、prkar1a、ptch1、pten、rad50、 rad51c、rad51d、rb1、recql4、ret、runx1、sdha、sdhaf2、 sdhb、sdhc、sdhd、smad4、smarca4、smarcb1、smarce1、 stk11、sufu、terc、tert、tmem127、tp53、tsc1、tsc2、 vhl、wrn和wt1。
337.用于遗传病测试的样品可以包含可以与本文所述试剂的指导核酸结合的至少一个靶核酸区段。在一些实施方案中,遗传病是血友病、镰状细胞性贫血、β-地中海贫血,杜氏肌营养不良、严重联合免疫缺陷或囊性纤维化。在一些情况下,靶核酸区段是来自以下基因的核酸的一部分:具有与遗传病相关的突变的基因、其过表达与遗传病相关的基因、与导致遗传病的异常细胞生长相关的基因,或与导致遗传病的异常细胞代谢相关的基因。在一些情况下,靶核酸区段是来自基因组基因座、从基因座转录的mrna或逆转录的cdna的核酸的一部分,该基因座是以下至少一个:cftr、fmr1、smn1、abcb11、 abcc8、abcd1、acad9、acadm、acadvl、acat1、acox1、 acsf3、ada、adamts2、adgrg1、aga、agl、agps、agxt、 aire、aldh3a2、aldob、alg6、alms1、alpl、amt、aqp2、 arg1、arsa、arsb、asl、asns、aspa、ass1、atm、atp6v1b1、 atp7a、atp7b、atrx、bbs1、bbs10、bbs12、bbs2、bckdha、 bckdhb、bcs1l、blm、bsnd、capn3、cbs、cdh23、cep290、 cerkl、chm、chrne、ciita、cln3、cln5、cln6、cln8、 clrn1、cngb3、col27a1、col4a3、col4a4、col4a5、col7a1、cps1、cpt1a、cpt2、crb1、ctns、ctsk、cyba、cybb、cyp11b1、 cyp11b2、cyp17a1、cyp19a1、cyp27a1、dbt、dclre1c、dhcr7、 dhdds、dld、dmd、dnah5、dnai1、dnai2、dysf、eda、 eif2b5、emd、ercc6、ercc8、esco2、etfa、etfdh、ethe1、 evc、evc2、eys、f9、fah、fam161a、fanca、fancc、fancg、 fh、fkrp、fktn、g6pc、gaa、galc、galk1、galt、gamt、 gba、gbe1、gcdh、gfm1、gjb1、gjb2、gla、glb1、gldc、 gle1、gne、gnptab、gnptg、gns、grhpr、hadha、hax1、 hba1,、hba2、hbb、hexa、hexb、hgsnat、hlcs、hmgcl、 hoga1、hps1、hps3、hsd17b4、hsd3b2、hyal1、hyls1、ids、 idua、ikbkap、il2rg、ivd、kcnj11、lama2、lama3、lamb3、 lamc2、lca5、ldlr、ldlrap1、lhx3、lifr、lipa、loxhd1、 lpl、lrpprc、man2b1、mcoln1、med17、mesp2、mfsd8、 mks1、mlc1、mmaa、mmab、mmachc、mmadhc、mpi、 mpl、mpv17、mthfr、mtm1、mtrr、mttp、mut、myo7a、 naglu、nags、nbn、ndrg1、ndufaf5、ndufs6、neb、npc1、 npc2、nphs1、nphs2、nr2e3、ntrk1、oat、opa3、otc、pah、 pc、pcca、pccb、pcdh15、pdha1、pdhb、pex1、pex10、pex12、 pex2、pex6、pex7、pfkm、phgdh、pkhd1、pmm2、pomgnt1、 ppt1、prop1、prps1、psap、pts、pus1、pygm、rab23、rag2、 rapsn、rars2、rdh12、rmrp、rpe65、rpgrip1l、rs1、rtel1、 sacs、samhd1、sepsecs、sgca、sgcb、sgcg、sgsh、slc12a3、 slc12a6、slc17a5、slc22a5、slc25a13、slc25a15、slc26a2、 slc26a4、slc35a3、slc37a4、slc39a4、slc4a11、slc6a8、 slc7a7、smarcal1、smpd1、star、
sumf1、tat、tcirg1、 tecpr2、tfr2、tgm1、th、tmem216、tpp1、trmu、tsfm、 ttpa、tymp、ush1c、ush2a、vps13a、vps13b、vps45、vrk1、vsx2、wnt10a、xpa、xpc和zfyve26。
338.在一些实施方案中,靶核酸序列包含导致植物(例如作物)中的疾病的病毒、细菌或其他病原体的核酸序列。本公开内容的方法和组合物可用于治疗或检测植物中的疾病。例如,本公开内容的方法可用于靶向植物中的病毒核酸序列。本公开内容的可编程核酸酶可以切割病毒核酸。在一些实施方案中,靶核酸序列包含导致植物(例如作物) 中的疾病的病毒或细菌或其他试剂(例如任何病原体)的核酸序列。在一些实施方案中,靶核酸包含在使用本文公开的组合物、系统和方法通过可编程核酸酶检测之前使用逆转录酶从rna逆转录的dna。在一些情况下,靶核酸是来自导致植物(例如作物)中的疾病的病毒或细菌或其他试剂的核酸的一部分。在一些情况下,靶核酸是来自基因组基因座的核酸的一部分,或任何dna扩增子,例如逆转录的 mrna或来自基因座的cdna、转录的mrna、或来自导致植物(例如作物)中的疾病的病毒或细菌或其他试剂(例如任何病原体)的基因座的逆转录cdna。感染植物的病毒可以是rna病毒。感染植物的病毒可以是dna病毒。本公开内容可靶向的病毒的非限制性示例包括烟草花叶病毒(tmv)、番茄斑萎病毒(tswv)、黄瓜花叶病毒(cmv)、马铃薯病毒y(pvy)、花椰菜花叶病毒(camv)(rt 病毒)、李痘病毒(ppv)、雀麦花叶病毒(bmv)和马铃薯病毒x (pvx)。
339.植物可以是单子叶植物。植物可以是双子叶植物。双子叶植物目的非限制性示例包括木兰目(magniolales)、八角目(illiciales)、樟目(laurales)、胡椒目(piperales)、马兜铃目(aristochiales)、睡莲目(nymphaeales)、毛茛目(ranunculales)、罂粟目(papeverales)、瓶子草目(sarraceniaceae)、昆栏树目(trochodendrales)、金缕梅目(hamamelidales)、杜仲目(eucomiales)、塞子木目(leitneriales)、杨梅目(myricales)、壳斗目(fagales)、木麻黄目(casuarinales)、石竹目(caryophyllales)、肉穗果目(batales)、蓼目(polygonales)、白花丹目(plumbaginales)、五桠果目(dilleniales)、山茶目(theales)、锦葵目(malvales)、荨麻目(urticales)、玉蕊目(lecythidales)、堇菜目(violales)、杨柳目(salicales)、白花菜目(capparales)、杜鹃花目(ericales)、岩梅目(diapensales)、柿树目(ebenales)、报春花目(primulales)、蔷薇目(rosales)、豆目(fabales)、川苔草目(podostemales)、小二仙草目(haloragales)、桃金娘目 (myrtales)、山茱萸目(cornales)、山龙眼目(proteales)、檀香目(san tales)、大花草目(rafflesiales)、卫矛目(celastrales)、大戟目(euphorbiales)、鼠李目(rhamnales)、无患子目(sapindales)、胡桃目(juglandales)、牻牛儿苗目(geraniales)、远志目(polygalales)、伞形目(umbellales)、龙胆目(gentianales)、花荵目(polemoniales)、唇形目(lamiales)、车前目(plantaginales)、玄参目(scrophulariales)、桔梗目(campanulales)、茜草目(rubiales)、川续断目(dipsacales) 和菊目(asterales)。
340.单子叶植物目的非限制性示例包括泽泻目(alismatales)、水鳖目(hydrocharitales)、茨藻目(najadales)、霉草目(triuridales)、鸭跖草目(commelinales)、谷精草目(eriocaulales)、帚灯草目 (restionales)、禾本目(poales)、灯芯草目(juncales)、莎草目 (cyperales)、香蒲目(typhales)、凤梨目(bromeliales)、姜目 (zingiberales)、槟榔目(arecales)、环花目(cyclanthales)、露兜树目(pandanales)、天南星目(arales)、百合目(lilliales)和兰花蕉目(orchid ales)。植物可以属于以下目,
例如,裸子植物目 (gymnospermae)、松柏目(pinales)、银杏目(ginkgoales)、苏铁目(cycadales)、南洋杉目(araucariales)、柏目(cupressales) 和买麻藤目(gnetales)。
341.植物的非限制性示例包括植物作物、水果、蔬菜、谷物、大豆、玉米(corn)、玉蜀黍(maize)、小麦、种子、番茄、稻、木薯、甘蔗、南瓜、干草、马铃薯、棉、大麻、烟草、开花植物、针叶树、裸子植物、蕨类植物、石松、角草、地钱、苔藓、小麦、玉米、稻、小米、大麦、番茄、苹果、梨、草莓、橙、金合欢、胡萝卜、马铃薯、甜菜、山药、莴苣、菠菜、向日葵、油菜籽、拟南芥、苜蓿、苋菜、苹果、杏、朝鲜蓟、白蜡树、芦笋、鳄梨、香蕉、大麦、豆类、甜菜、桦木、山毛榉、黑莓、蓝莓、西兰花、孢子甘蓝、卷心菜、油菜、哈密瓜、胡萝卜、木薯、花椰菜、雪松、谷物、芹菜、栗子、樱桃、大白菜、柑橘、小柑橘(clementine)、三叶草、咖啡、玉米、棉花、豇豆、黄瓜、柏树、茄子、榆树、菊苣、桉树、茴香、无花果、冷杉、天竺葵、葡萄、葡萄柚、花生、灌木樱桃、胶铁杉、山核桃、羽衣甘蓝、猕猴桃、苤蓝、落叶松、莴苣、韭菜、柠檬、酸橙、刺槐、松树、铁线蕨、玉米、芒果、枫树、甜瓜、小米、蘑菇、芥末、坚果、橡树、燕麦、油棕、秋葵、洋葱、橙、观赏植物或花或树、木瓜、棕榈、欧芹、欧洲防风草、豌豆、桃子、花生、梨、泥炭植物(peat)、胡椒、柿子、木豆、松树、菠萝、车前草、李子、石榴、马铃薯、南瓜、菊苣、萝卜、油菜籽、覆盆子、稻、黑麦、高粱、红花、黄华柳、大豆、菠菜、云杉、南瓜、草莓、甜菜、甘蔗、向日葵、甘薯、甜玉米、柑橘、茶、烟草、番茄、树、黑小麦、草坪草、红萝卜、藤蔓、核桃、豆瓣菜、西瓜、小麦、山药、紫衫和西葫芦。植物可以包括藻类。
342.样品可用于鉴定疾病状态。例如,样品是本文所述的任何样品,并且是从受试者获得的,用于鉴定受试者的疾病状态。有时,方法包括从受试者获得血清样品;并鉴定受试者的疾病状态。
343.在一些情况下,靶核酸是单链核酸。替代地或组合地,靶核酸是双链核酸,并且在与试剂接触之前或之后被制备成单链核酸。靶核酸可以是rna、dna、合成核酸或在生物或环境样品中发现的核酸。靶核酸包括但不限于mrna、rrna、trna、非编码rna、长非编码rna和微小rna(mirna)。在一些情况下,靶核酸是mrna。在一些情况下,靶核酸来自本文所述的病毒、寄生虫或细菌。在一些情况下,靶核酸由本文所述的基因转录。
344.许多靶核酸与本文公开的方法和组合物一致。本文描述的一些方法可以检测作为靶核酸群体,以各种浓度或量存在于样品中的靶核酸。在一些情况下,样品具有至少2个靶核酸。在一些情况下,样品具有至少3、5、10、20、30、40、50、100、200、300、400、500、600、 700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、 9000或10000个靶核酸。在一些情况下,该方法检测以每101个非靶核酸、102个非靶核酸、103个非靶核酸、104个非靶核酸、105个非靶核酸、106个非靶核酸、107个非靶核酸、108个非靶核酸、109个非靶核酸或10
10
个非靶核酸至少一个拷贝存在的靶核酸。
345.许多靶核酸群体与本文所述的方法和组合物一致。本文所述的一些方法可以检测以不同浓度或量存在于样品中的两个或更多个靶核酸群体。在一些情况下,样品具有至少2个靶核酸群体。在一些情况下,样品具有至少3、4、5、6、7、8、9、10、20、30、40或50个靶核酸群体。在一些情况下,该方法检测以每101个非靶核酸、102个非靶核酸、103个非靶核酸、104个非靶核酸、105个非靶核酸、106个非靶核酸、107个非靶核酸、108个非靶核酸、109个非靶核酸或10
10
个非靶核酸至少一个拷贝存在的靶核酸群体。靶核酸群体可以以不同的浓度或量存在于样品中。
346.任何上文公开样品均与本文公开的系统、测定和可编程核酸酶一致,并且可用作本文公开的任意疾病(例如,甲型流感、乙型流感、 rsv)的伴随诊断,或者可以用于试剂盒、床旁诊断或非处方诊断。试剂许多试剂与本文公开的装置、系统、流体装置、试剂盒和方法一致。这些试剂一致地用于本文公开的各种流体装置中,用于检测样品内的靶核酸(例如,甲型流感病毒或乙型流感病毒),其中该流体装置可包括用于样品制备、样品内靶核酸的扩增、与可编程核酸酶混合以及检测由流体系统本身内的可编程核酸酶切割检测核酸而产生的可检测信号的多个泵、阀、储器和腔室。这些试剂与本文所述用于检测病痛(例如,疾病)的样品、流体装置和支持介质相容。本文所述的用于检测疾病(例如,流感或rsv)的试剂包括靶向指示疾病的靶核酸区段的指导核酸。指导核酸与单链靶核酸结合,该单链靶核酸包含导致本文所述疾病的病毒或细菌或其他物剂的核酸的一部分。指导核酸可以与单链靶核酸结合,该单链靶核酸包含导致本文所述疾病的细菌或其他物剂的核酸的一部分并且还包含突变,如单核苷酸多态性 (snp),该突变可以赋予对治疗如抗生素治疗的耐受性。指导核酸与单链靶核酸结合,该单链靶核酸包含来自流感病毒(例如,甲型流感或乙型流感)的核酸的一部分。指导核酸与靶核酸互补。指导核酸通常与靶核酸特异性结合。靶核酸可以是rna、dna或合成核酸。
347.本文公开了测定如本文所述的靶核酸的方法。例如,测定样品中的靶核酸的方法包括使样品与包含指导核酸和可编程核酸酶的复合体接触,该指导核酸包含与靶核酸的区段反向互补的区段,该可编程核酸酶在形成包含与靶核酸的区段结合的指导核酸的区段的复合体后表现出序列非依赖的切割;以及测定指示蛋白质-核酸群体中的至少一些蛋白质-核酸切割的信号,其中该信号指示样品中存在靶核酸并且其中不存在信号指示样品中不存在靶核酸。作为另一个实例,测定样品中靶核酸的方法,例如,包括:a)使样品与包含指导核酸和可编程核酸酶的复合体接触,该指导核酸包含与靶核酸的区段反向互补的区段,该可编程核酸酶在形成包含与靶核酸的区段结合的指导核酸的区段的复合体后表现出序列非依赖的切割;b)使复合体与底物接触;c)使底物与试剂接触,该试剂与切割底物差异地发生反应;和d)测定指示底物切割的信号,其中该信号指示样品中存在靶核酸,并且其中不存在信号指示样品中不存在靶核酸。通常,底物是酶-核酸。底物有时是酶底物-核酸。
348.本文所述的可编程核酸酶可相容用于本文所述的装置(例如,气动阀装置、滑动阀装置、旋转阀装置或横向流动装置)中并且可以与本文公开的组合物(例如,指导核酸、用于体外转录的试剂、用于扩增的试剂、用于逆转录的试剂、报道分子或其任何组合)结合使用,以进行高效、快速且准确的反应来检测样品中是否存在靶核酸(例如, detectr反应)。可编程核酸酶可以包括能够在与指导核酸和靶核酸复合时被激活的可编程核酸酶。可编程核酸酶可以在指导核酸与靶核酸结合之后变得激活,其中被激活的可编程核酸酶可以切割靶核酸并且可以具有反式切割活性。反式切割活性可以是通过激活的可编程核酸酶对附近单链核酸的非特异性切割,例如具有检测部分的检测核酸的反式切割。一旦检测核酸被激活的可编程核酸酶切割,检测部分就可以从检测核酸释放并且可以产生信号。信号可以是量热、电位、安培、光学(例如荧光,比色等)或压电信号。通常,在检测核酸切割之前信号便存在,并且在检测核酸切割之后,信号改变。有时,在检测核酸切割之前不存在信号,并且在检测核酸切割之后,信号存在。可检测信号可以固定在支持介质上以供检测。可编程核酸酶可以
是具有反式切割活性的crispr-cas(成簇的规则间隔的短回文重复序列
ꢀ‑
crispr相关)核蛋白复合体,其可以通过指导核酸与靶核酸的结合而被激活。crispr-cas核蛋白复合体可以包含与指导核酸复合的cas 蛋白(也称cas核酸酶),其也可以被称为crispr酶。指导核酸可以是crispr rna(crrna)。指导核酸有时包含crrna和反式激活 crrna(tracrrna)。
349.用于检测修饰的靶核酸的crispr/cas系统可以包括crispr rna(crrna)、反式激活crrna(tracrrna)、cas蛋白和检测核酸。
350.指导核酸可以包含与靶核酸的序列反向互补的序列。指导核酸可以是crrna。指导核酸有时包含crrna和tracrrna。指导核酸可以与靶核酸特异性结合。在一些情况下,指导核酸不是天然存在的,并且是通过原本分开的序列区段的人工组合而制得。通常,人工组合是通过化学合成、基因工程化技术或分离的核酸区段的人工操作来进行的。靶核酸可以被设计和制成提供期望的功能。在一些情况下,指导核酸的靶向区域的长度为20个核苷酸。指导核酸的靶向区域的长度可以为至少10、11、12、13、14、15、16、17、18、19、20、21、22、 23、24、25、26、27、28、29或30个核苷酸。在一些情况下,指导核酸的靶向区域的长度为10、11、12、13、14、15、16、17、18、19、 20、21、22、23、24、25、26、27、28、29或30个核苷酸。在一些情况下,指导核酸的靶向区域的长度为恰好或约12个核苷酸(nt)至约80nt、12nt至约50nt、约12nt至约45nt、约12nt至约40nt、约12nt至约35nt、约12nt至约30nt、约12nt至约25nt、约12nt 至约20nt、约12nt至约19nt、约19nt至约20nt、约19nt至约25nt、约19nt至约30nt、约19nt至约35nt、约19nt至约40nt、约19nt 至约45nt、约19nt至约50nt、约19nt至约60nt、约20nt至约25nt、约20nt至约30nt、约20nt至约35nt、约20nt至约40nt、约20nt 至约45nt、约20nt至约50nt或约20nt至约60nt。应当理解,多核苷酸的序列不必与其可特异性杂交或可杂交或特异性结合的靶核酸的序列100%互补。指导核酸可以具有在核酸残基5至20的区域中包含至少一个尿嘧啶的序列,该序列与靶核酸中的修饰可变区域反向互补。在一些情况下,指导核酸具有在核酸残基5至9、10至14或15 至20的区域中包含至少一个尿嘧啶的序列,该序列与靶核酸中的修饰可变区域反向互补。指导核酸可以具有在核酸残基5至20的区域中包含至少一个尿嘧啶的序列,该序列与靶核酸中的甲基化可变区域反向互补。在一些情况下,指导核酸具有在核酸残基5至9、10至14 或15至20的区域中包含至少一个尿嘧啶的序列,该序列与靶核酸中的甲基化可变区域反向互补。
351.指导核酸可以选自已经相对于感染株或感兴趣基因组基因座的核酸序列平铺的一组指导核酸。指导核酸可以选自已经相对于甲型流感或乙型流感毒株的核酸序列平铺的一组指导核酸。通常,已经相对于感染株或感兴趣基因组基因座的核酸平铺的指导核酸可以合并 (pooled)以用于本文所述的方法。通常,这些指导核酸被合并用于在单个测定中检测靶核酸。相对于单个靶核酸平铺的指导核酸的合并可以增强使用本文所述的方法对靶核酸的检测。相对于单个靶核酸平铺的指导核酸的合并可以确保使用本文所述的方法在单个反应内对靶核酸的广泛覆盖。例如,平铺是沿着靶核酸顺序进行的。平铺有时是沿着靶核酸重叠的。在一些情况下,平铺包括沿着靶核酸平铺的指导核酸之间的间隙。在一些情况下,指导核酸的平铺是非顺序的。通常,用于检测靶核酸的方法包括使靶核酸接触指导核酸池和可编程核酸酶,其中所述指导核酸池中的指导核酸具有选自与靶核酸的核酸对应的一组平铺的指导核酸的序列;以及测定因切割检测核酸群体中的至少一些检测核酸而产生的信号。指导核酸的合并可以确保在单个反应内对靶物种的广谱鉴定或广泛覆盖。这可以在可
能由多种生物体引起的疾病或适应症如脓毒症中特别有用。
352.本文描述了包含可编程核酸酶的试剂,该可编程核酸酶在与指导核酸和靶核酸区段复合时能够被激活。可编程核酸酶可以能够与指导核酸和靶序列复合时被激活。可编程核酸酶可以在指导核酸与其靶核酸结合后被激活并降解其环境中的非特异性核酸。可编程核酸酶一旦被激活便具有反式切割活性。可编程核酸酶可以是cas蛋白(也可互换地称为cas核酸酶)。crrna和cas蛋白可以形成crispr酶。
[0353]“同一性百分比”和“同一性%”可以指两个序列(核苷酸或氨基酸) 在比对中的相同位置具有相同残基的程度。例如,“氨基酸序列与seq id no:y具有x%同一性”可以指该氨基酸序列与seq id no:y的同一性%,并详细说明为氨基酸序列中x%的残基与seq id no:y中公开的序列的残基相同。通常,可以使用计算机程序来进行这种计算。比较和比对序列对的说明性程序包括align(myers和miller,computappl biosci.1988年3月;4(1):11-7)、fasta(pearson和lipman, proc natl acad sci u s a.1988年4月;85(8):2444-8;pearson,methodsenzymol.1990;183:63-98)和空位blast(altschul等人,nucleic acidsres.1997年9月1日;25(17):3389-40)、blastp、blastn或gcg (devereux等人,nucleic acids res.1984年1月11日;12(1pt 1):387-95)。
[0354]
若干可编程核酸酶与本公开内容的方法和装置一致。例如, crispr/cas酶是用于本文公开的方法和系统的可编程核酸酶。 crispr/cas酶可以包括任何已知类别和种类的crispr/cas酶。本文公开的可编程核酸酶包括1类crispr/cas酶,如i型、iv型或iii 型crispr/cas酶。本文公开的可编程核酸酶还包括2类crispr/cas 酶,如ii型、v型和vi型crispr/cas酶。包含在本文公开的若干装置(例如,微流体装置,如气动阀装置或滑动阀装置或横向流动测定)及其使用方法中的优选可编程核酸酶包括v型或vi型 crispr/cas酶。
[0355]
在一些实施方案中,v型crispr/cas酶是可编程的cas12核酸酶。v型crispr/cas酶(例如,cas12或cas14)缺少hnh域。本公开内容的cas12核酸酶经由单个催化ruvc域来切割核酸。ruvc 域在核酸酶或该蛋白质的“nuc”叶内,并且cas12核酸酶还包含识别或“rec”叶。rec和nuc叶通过桥螺旋体连接,并且cas12蛋白另外包含用于pam识别的两个域,被称为pam相互作用(pi)域和楔形(wed)域。(murugan等人,mol cell.2017年10月5日;68(1):15
–ꢀ
25)。可编程的cas12核酸酶可以是cas12a(也称为cpf1)蛋白、cas12b蛋白、cas12c蛋白、cas12d蛋白或cas12e蛋白。在一些情况下,合适的cas12蛋白包含与seq id no:27-seq id no:37中任一项具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%氨基酸序列同一性的氨基酸序列。表1-cas12蛋白质序列
[0356]
替代地,v型crispr/cas酶是可编程的cas14核酸酶。本公开内容的cas14蛋白包括3个部分ruvc域(ruvc-i、ruvc-ii和ruvc-iii,本文中也称为子域),它们相对于cas14蛋白的一级氨基酸序列是非连续的,但一旦产生蛋白质并折叠,便形成ruvc域。天然存在的cas14 蛋白用作核酸内切酶,催化靶核酸中的特定序列处的切割。可编程的 cas14核酸酶可以是cas14a蛋白、cas14b蛋白、cas14c蛋白、cas14d 蛋白、cas14e蛋白、cas14f蛋白、cas14g蛋白、cas14h蛋白或cas14u 蛋白。在一些情况下,合适的cas14蛋白包含与seq id no:38-seqid no:129中任一项具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%氨基酸序列同一性的氨基酸序列。表2-cas14蛋白质序列
[0357]
在一些实施方案中,v型crispr/cas酶是casф核酸酶。casф多肽可以充当核酸内切酶的功能,在靶核酸中的特定序列处催化切割。本公开内容的可编程casф核酸酶可以在ruvc结构域中具有单个活性位点,该活性位点能够催化前crrna加工和核酸的切口或切割。这种紧密的催化位点可以使可编程casф核酸酶特别有利于基因组工程和基因组操作的新功能。
[0358]
表3提供了可用于本公开内容的组合物和方法的说明性casф多肽的氨基酸序列。表3-casф氨基酸序列
[0359]
在一些实施方案中,本公开内容的任何可编程casф核酸酶(例如,seq id no:274-seq id no:321或其片段或变体中的任一个) 可以包括核定位信号(nls)。在一些情况下,所述nls可以具有 krpaatkkagqakkkkef(seq id no:322)的序列。
[0360]
casф多肽或其变体可以包含与seq id no:274-seq id no:321 中的任一个具有
至少70%、至少75%、至少80%、至少85%、至少 90%、至少92%、至少95%、至少97%、至少99%或100%序列同一性。
[0361]
在一些实施方案中,vi型crispr/cas酶是可编程的cas13核酸酶。cas13蛋白的通用架构包括n末端域和由两个螺旋域分开的两个 hepn(高级真核生物和原核生物核苷酸结合)域(liu等人,cell 2017 年1月12日;168(l-2):121-134.el2)。hepn域各自包含ar-x
4-h基序。cas13蛋白所共享的特征包括,在指导核酸的crrna与靶核酸结合时,蛋白质经历构象变化以使hepn域在一起,并形成催化活性的 rna酶(tambe等人,cell rep.2018年7月24日;24(4):1025
–
1036)。因此,两个可激活的hepn域是本公开内容的可编程cas13核酸酶的特征。然而,也与本公开内容一致的可编程cas13核酸酶包括cas13 核酸酶,其在hepn域中包含增强cas13蛋白的切割效率的突变或使 hepn域催化失活的突变。与本公开内容一致的可编程cas13核酸酶还包含催化性cas13核酸酶。
[0362]
可编程的cas13核酸酶可以是cas13a蛋白(也称为“c2c2”)、 cas13b蛋白、cas13c蛋白、cas13d蛋白或cas13e蛋白。示例性c2c2 蛋白在seq id no:130-seq id no:137中列出。在一些情况下,主题c2c2蛋白与seq id no:130-seq id no:137中任一项的氨基酸序列具有80%或更大(例如,85%或更大、90%或更大、95%或更大、 98%或更大、99%或更大、99.5%或更大或100%)的氨基酸序列同一性。在一些情况下,合适的c2c2多肽包含的氨基酸序列与seq id no: 130的斯氏李斯特杆菌c2c2氨基酸序列具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%的氨基酸序列同一性。在一些情况下,合适的c2c2多肽包含的氨基酸序列与seq id no:131的口腔纤毛菌c2c2氨基酸序列具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%的氨基酸序列同一性。在一些情况下,合适的c2c2多肽包含的氨基酸序列与seq id no:133的荚膜红细菌c2c2氨基酸序列具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%的氨基酸序列同一性。在一些情况下,合适的c2c2多肽包含的氨基酸序列与seq id no:134的鸡肉杆菌(carnobacterium gallinarum)c2c2氨基酸序列具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%的氨基酸序列同一性。在一些情况下,合适的c2c2多肽包含的氨基酸序列与seq id no:135的解半纤植雪菌(herbinix hemicellulosilytica)c2c2氨基酸序列具有至少80%、至少85%、至少 90%、至少95%、至少98%、至少99%或100%的氨基酸序列同一性。在一些情况下,c2c2蛋白包含与seq id no:131的口腔纤毛菌(lbu) c2c2氨基酸序列具有80%或更大氨基酸序列同一性的氨基酸序列。在一些情况下,c2c2蛋白是口腔纤毛菌(lbu)c2c2蛋白(例如,参见seq id no:131)。在一些情况下,c2c2蛋白包含seq id no: 130-131和seq id no:133-137中任一项的氨基酸序列。在一些情况下,用于本公开内容的方法的c2c2蛋白不是沙氏纤毛菌(lsh)c2c2 蛋白。在一些情况下,用于本公开内容的方法的c2c2蛋白不是与seq id no:132的lsh c2c2多肽具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%氨基酸序列同一性的c2c2 多肽。其他cas13蛋白质序列在seq id no:130
–
seq id no:147 中列出。表4-cas13蛋白质序列
[0363]
可编程核酸酶可以是cas13。cas13有时可以是cas13a、cas13b、 cas13c、cas13d或cas13e。在一些情况下,可编程核酸酶可以是mad7 或mad2。在一些情况下,可编程核酸酶可以是cas12。cas12有时可以是cas12a、cas12b、cas12c、cas12d或cas12e。在一些情况下,可编程核酸酶可以是csm1、cas9、c2c4、c2c8、c2c5、c2c10、c2c9 或casz。csm1有时也可以称为smcms1、micms1、obcms1或sucms1。 cas13a有时也可以称为c2c2。casz有时也可以称为cas14a、cas14b、 cas14c、cas14d、cas14e、cas14f、cas14g或cas14h。可编程核酸酶有时可以是v型crispr-cas系统。在一些情况下,可编程核酸酶有时可以是vi型crispr-cas系统。
可编程核酸酶有时可以是iii型 crispr-cas系统。在一些情况下,可编程核酸酶可以来自沙氏纤毛菌(leptotrichia shahii,lsh)、斯氏李斯特杆菌(listeria seeligeri, lse)、口腔纤毛菌(leptotrichia buccalis,lbu)、维氏纤毛菌 (leptotrichia wadeu,lwa)、荚膜红细菌(rhodobacter capsulatus, rca)、herbinix hemicellulosilytica(hhe)、浅红慢生盐场菌 (paludibacter propionicigenes,ppr)、毛螺科菌(lachnospiraceaebacterium,lba)、直肠真杆菌([eubacterium]rectale,ere)、listerianewyorkensis(lny)、嗜胺梭菌(clostridium aminophilum,cam)、普氏菌属(prevotella sp.,psm)、犬咬二氧化碳嗜纤维菌 (capnocytophaga canimorsus,cca)、毛螺科菌(lba)、动物溃疡伯格菌(bergeyella zoohelcum,bzo)、中间普雷沃菌(prevotellaintermedia,pin)、颊普雷沃菌(prevotella buccae,pbu)、另枝菌属(alistipes sp.,asp)、鸭疫里默氏杆菌(riemerella anatipestifer, ran)、橙色普雷沃菌(prevotella aurantiaca,pau)、解糖普雷沃菌 (prevotella saccharolytica,psa)、中间普雷沃菌(pin2)、犬咬二氧化碳嗜纤维菌(cca)、古卟啉单胞菌(porphyromonas gulae,pgu)、普雷沃菌属(prevotella sp.,psp)、牙龈卟啉单胞菌(porphyromonasgingivalis,pig)、中间普雷沃菌(pin3)、意大利肠球菌(enterococcusitalicus,ei)、唾液乳杆菌(lactobacillus salivarius,ls)或嗜热栖热菌(thermus thermophilus,tt)中的至少一种。cas13有时是 lbucas13a、lwacas13a、lbacas13a、hhecas13a、pprcas13a、erecas13a、 camcas13a或lshcas13a中的至少一种。crispr酶的反式切割活性可以在crrna与靶核酸复合时被激活。crispr酶的反式切割活性可以在包含tracrrna和crrna的指导核酸与靶核酸复合时被激活。靶核酸可以是rna或dna。
[0364]
在一些实施方案中,本文公开的可编程核酸酶是rna激活的可编程rna核酸酶。在一些实施方案中,本文公开的可编程核酸酶是 dna激活的可编程rna核酸酶。在一些实施方案中,可编程核酸酶能够被靶rna激活以启动rna报道分子的反式切割并且能够被靶 dna激活以启动rna报道分子的反式切割,例如vi型crispr/cas 酶(例如,cas13)。例如,本公开内容的cas13a可以被靶rna激活以启动cas13a切割rna报道分子的反式切割活性并且可以被靶 dna激活以启动cas13a切割rna报道分子的反式切割活性。rna 报道分子可以是基于rna的报道分子。在一些实施方案中,cas13a 识别并检测ssdna,以启动rna报道分子的反式切割。在指导核酸与靶dna杂交后,多种cas13a分离物可以识别靶dna、被靶dna 激活并检测靶dna,包括ssdna。例如,lbucas13a和lwacas13a 二者都可以被靶dna激活以并列切割rna报道分子。因此,vi型 crispr/cas酶(例如,cas13,如cas13a)可以是dna激活的可编程rna核酸酶,并且因此可以用于使用本文所述的方法检测靶dna。 dna激活的可编程rna核酸酶检测ssdna可以是在多个ph值下是稳健的。例如,通过cas13的靶ssdna检测可以在宽范围的ph条件下(例如ph 6.8到ph 8.2)表现出一致的切割。相反,通过cas13 的靶rna检测在7.9到8.2的ph值下表现出高切割活性。在一些实施方案中,也能够成为rna激活的可编程rna核酸的dna激活的可编程rna核酸酶的dna靶向偏好与其rna靶向偏好不同。例如,cas13a的最佳ssdna靶标与cas13a的最佳rna靶标具有不同的性质。作为一个示例,ssdna上的grna表现可能不一定与rna上的同一grna的表现相关。作为另一个示例,无论在靶rna序列上的 3’位置处的靶核苷酸身份如何,grna均可以高水平表现。在一些实施方案中,在靶ssdna序列上的3’位置处不存在g的情况下,grna 可以高水平表现。另外,通过本文公开的cas13检测的靶dna可以直接来自生物体,或可以通过核酸扩增方法(如pcr和lamp或本文所述的任何扩增
方法)间接产生。通过dna激活的可编程rna核酸酶(如cas13a)灵敏地检测靶dna(如靶ssdna)的关键步骤可以包括:(1)产生或分离浓度高于每个反应约0.1nm的dna以供体外诊断,(2)选择具有适当序列特征的靶序列以实现dna检测,因为这些特征与rna检测所需的特征不同,和(3)增强dna检测的缓冲液组合物。通过dna激活的可编程rna核酸酶对靶dna的检测可以连接至多种读出,包括荧光、横向流、电化学或本文所述的任何其他读出。采用dna报道分子和rna报道分子的可编程dna 核酸酶(如v型crispr-cas蛋白)与dna激活的可编程rna核酸酶(如vi型蛋白)的多路复用可以分别实现靶ssdna或靶dsdna 与靶ssdna的组合的多路复用检测。具有不同rna报道分子切割偏好的不同的rna激活的可编程rna核酸酶的多路复用可以实现另外的多路复用。用于产生ssdna以用于基于dna激活的可编程rna 核酸酶的诊断的方法可以包括(1)不对称pcr,(2)不对称等温扩增,如rpa、lamp、sda等,(3)用于产生短ssdna分子的near,以及(4)通过逆转录酶将rna靶标转化为ssdna,随后进行rna 酶h消化。因此,dna激活的可编程rna核酸酶检测靶dna与本文公开的多种系统、试剂盒、组合物、试剂盒方法相容。例如,通过 cas13a的靶ssdna检测可以用于本文公开的detectr测定。
[0365]
本文所述的试剂包含含有检测部分的单链检测核酸,其中该检测核酸能够被激活的核酸酶切割,由此产生第一可检测信号。如本文所用,检测核酸与报道分子或报道分子可互换使用。在一些情况下,检测核酸是包含脱氧核糖核苷酸的单链核酸。在其他情况下,检测核酸是包含核糖核苷酸的单链核酸。检测核酸可以是包含至少一个核糖核苷酸和至少一个脱氧核糖核苷酸的单链核酸。在一些情况下,检测核酸是在内部位置包含至少一个核糖核苷酸残基作为切割位点的单链核酸。在一些情况下,检测核酸在内部位置包含至少2、3、4、5、6、 7、8、9或10个核糖核苷酸残基。核糖核苷酸残基有时是连续的。替代地,核糖核苷酸残基间插在非核糖核苷酸残基之间。在一些情况下,检测核酸仅具有核糖核苷酸残基。在一些情况下,检测核酸仅具有脱氧核糖核苷酸残基。在一些情况下,检测核酸包含对本文所述的可编程核酸酶的切割具有耐受性的核苷酸。在一些情况下,检测核酸包含合成核苷酸。在一些情况下,检测核酸包含至少一个核糖核苷酸残基和至少一个非核糖核苷酸残基。在一些情况下,检测核酸的长度为 5-20、5-15、5-10、7-20、7-15或7-10个核苷酸。在一些情况下,检测核酸包含至少一个尿嘧啶核糖核苷酸。在一些情况下,检测核酸包含至少两个尿嘧啶核糖核苷酸。检测核酸有时仅具有尿嘧啶核糖核苷酸。在一些情况下,检测核酸包含至少一个腺嘌呤核糖核苷酸。在一些情况下,检测核酸包含至少两个腺嘌呤核糖核苷酸。在一些情况下,检测核酸仅具有腺嘌呤核糖核苷酸。在一些情况下,检测核酸包含至少一个胞嘧啶核糖核苷酸。在一些情况下,检测核酸包含至少两个胞嘧啶核糖核苷酸。在一些情况下,检测核酸包含至少一个鸟嘌呤核糖核苷酸。在一些情况下,检测核酸包含至少两个鸟嘌呤核糖核苷酸。检测核酸可以包含仅未修饰的核糖核苷酸、仅未修饰的脱氧核糖核苷酸或其组合。在一些情况下,检测核酸的长度为5至12个核苷酸。在一些情况下,检测核酸的长度为至少2、3、4、5、6、7、8、9、10、 11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸。在一些情况下,检测核酸的长度为 2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、 19、20、21、22、23、24、25、26、27、28、29或30个核苷酸。对于通过包含cas13的可编程核酸酶的切割,检测核酸的长度可以为5、 8或10个核苷酸。对于通过包含cas12的可编程核酸酶的切割,检测核酸的长度可以为10个核苷酸。
[0366]
单链检测核酸包含能够产生第一检测信号的检测部分。检测核酸有时包含能够产
生信号的蛋白质。信号可以是量热、电位、安培、光学(例如荧光,比色等)或压电信号。在一些情况下,检测部分在切割位点的一侧。任选地,猝灭部分在切割位点的另一侧。猝灭部分有时是荧光猝灭部分。在一些情况下,猝灭部分在切割位点的5’处,而检测部分在切割位点的3’处。在一些情况下,检测部分在切割位点的 5’处,而猝灭部分在切割位点的3’处。猝灭部分有时在检测核酸的5’末端。检测部分有时在检测核酸的3’末端。在一些情况下,检测部分在检测核酸的5’末端。在一些情况下,猝灭部分在检测核酸的3’末端。在一些情况下,单链检测核酸是能够产生第一可检测信号的至少一个单链核酸群体。在一些情况下,单链检测核酸是能够产生第一可检测信号的单链核酸群体。任选地,存在超过一个单链检测核酸群体。在一些情况下,存在2、3、4、5、6、7、8、9、10、11、12、13、14、 15、20、30、40、50或大于50,或在列表范围内的任何数目的能够产生可检测信号的不同单链检测核酸群体。表5-示例性的单链检测核酸
/56-fam/:5
′
6-荧光素(integrated dna technologies)/3iabkfq/:3
′
iowa black fq(integrated dna technologies)
/5ird700/:5
′
irdye 700(integrated dna technologies)/5tye665/:5
′
tye 665(integrated dna technologies)/5alex594n/:5
′
alexa fluor 594(nhs酯)(integrated dna technologies)/5atto633n/:5
′
atto tm 633(nhs酯)(integrated dna technologies)/3irqc1n/:3
′
irdye qc-1猝灭剂(li-cor)/3iabrqsp/:3
′
iowa black rq(integrated dna technologies)ru:尿嘧啶核糖核苷酸rg:鸟嘌呤核糖核苷酸*该表格将检测部分和猝灭部分称为其商品名,并标识了其来源。但是,也可以使用其他来源中具有相似功能的替代物、仿制品或非商标部分。
[0367]
检测部分可以是近红外荧光团。检测部分可以是发射500nm至 720nm范围内的荧光的荧光团。检测部分可以是发射500nm至720 nm范围内的荧光的荧光团。在一些情况下,检测部分发射波长为700 nm或更高的荧光。在其他情况下,检测部分发射约660nm或约670 nm的荧光。在一些情况下,检测部分发射500至520、500至540、 500至590、590至600、600至610、610至620、620至630、630 至640、640至650、650至660、660至670、670至680、6890至690、 690至700、700至710、710至720或720至730nm。检测部分可以是发射与6-荧光素、irdye 700、tye 665、alexa fluor或atto tm 633(nhs酯)在相同范围内的荧光的荧光团。检测部分可以是荧光素亚酰胺、6-荧光素、irdye 700、tye 665、alexa fluor 594或attotm 633(nhs酯)。检测部分可以是发射与6-荧光素(integrated dna technologies)、irdye 700(integrated dna technologies)、tye 665 (integrated dna technologies)、alexa fluor 594(integrated dnatechnologies)或atto tm 633(nhs酯)(integrated dnatechnologies)在相同范围内的荧光的荧光团。检测部分可以是荧光素亚酰胺、6-荧光素(integrated dna technologies)、irdye 700 (integrated dna technologies)、tye 665(integrated dnatechnologies)、alexa fluor 594(integrated dna technologies)或 atto tm 633(nhs酯)(integrated dna technologies)。本文所述的任何检测部分均可以来自任何市售来源,可以是具有所列出的检测部分的相似功能、通用名或非商品名的替代物。
[0368]
检测部分可以基于待测试的样品类型而选用。例如,为近红外荧光团的检测部分与尿液样品一起使用。作为另一示例,具有在520nm 左右进行发射的荧光团的seq id no:1被用于测试非尿液样品,而具有具有发射700nm左右的荧光的荧光团的seq id no:8被用于测试尿液样品。
[0369]
猝灭部分可以基于其猝灭检测部分的能力来选择。猝灭部分可以是非荧光的荧光猝灭剂。猝灭部分可以猝灭发射500nm至720nm范围内的荧光的检测部分。猝灭部分可以猝灭发射500nm至720nm范围内的荧光的检测部分。在一些情况下,猝灭部分猝灭发射波长为700 nm或更高的荧光的检测部分。在其他情况下,猝灭部分猝灭发射约 660nm或约670nm的荧光的检测部分。在一些情况下,猝灭部分猝灭发射500至520、500至540、500至590、590至600、600至610、 610至620、620至630、630至640、640至650、650至660、660 至670、670至680、6890至690、690至700、700至710、710至720 或720至730nm范围内的荧光的检测部分。猝灭部分可以猝灭荧光素亚酰胺、6-荧光素、irdye 700、tye 665、alexa fluor 594或atto
tm 633(nhs酯)。猝灭部分可以是iowa black rq、iowa black fq 或irdye qc-1quencher。猝灭部分可以猝灭荧光素亚酰胺、6-荧光素(integrated dna technologies)、irdye 700(integrated dnatechnologies)、tye 665(integrated dna technologies)、alexa fluor 594(integrated dna technologies)或atto tm 633(nhs酯) (integrated dna technologies)。猝灭部分可以是iowa black rq (integrated dna technologies)、iowa black fq(integrated dnatechnologies)或irdye qc-1猝灭剂(licor)。本文所述的任何猝灭部分均可以来自任何市售来源,可以是具有所列出的猝灭部分的相似功能、通用或非商品名的替代物。
[0370]
由检测部分的释放而产生的可检测信号表明,由可编程核酸酶的切割已经发生并且样品含有靶核酸。在一些情况下,检测部分包含荧光染料。检测部分有时包含荧光共振能量转移(fret)对。在一些情况下,检测部分包含近红外(ir)染料。在一些情况下,检测部分包含紫外(uv)染料。替代地或组合地,检测部分包含多肽。检测部分有时包含生物素。检测部分有时包含抗生物素蛋白或链霉亲和素的至少一种。在一些情况下,检测部分包含多糖、聚合物或纳米颗粒。在一些情况下,检测部分包含金纳米颗粒或乳胶纳米颗粒。
[0371]
检测部分可以是能够产生量热、电位、安培、光学(例如荧光,比色等)或压电信号的任何部分。检测核酸有时是蛋白质-核酸,其能够在核酸被切割后产生量热、电位、安培、光学(例如荧光,比色等)或压电信号。蛋白质-核酸可以包含核酸组分和蛋白质或肽组分。在一些实施方案中,蛋白质-核酸可以包含与蛋白质或肽融合的核酸。量热信号通常是在检测核酸被切割后产生的热量。量热信号通常是在检测核酸被切割后吸热的热量。例如,电位信号是在检测核酸被切割后产生的电位。安培信号可以是在检测核酸被切割后产生的电子运动。通常,信号是光信号,如比色信号或荧光信号。例如,光学信号是在检测核酸被切割后产生的光输出。光学信号有时是检测核酸被切割前后的光吸收变化。通常,压电信号是检测核酸被切割前后的质量变化。
[0372]
蛋白质-核酸通常是酶-核酸。酶在存在于酶-核酸中时可能在空间上受阻,而在从核酸切割后具有功能性。通常,酶是与底物产生反应的酶。酶可以是转化酶。通常,转化酶的底物是蔗糖和dns试剂。
[0373]
有时蛋白质-核酸是底物-核酸。通常底物是与酶产生反应的底物。
[0374]
蛋白质-核酸可以附接至固体支持物上。例如,固体支持物可以是表面。表面可以是电极。固体支持物有时是珠粒。珠粒通常是磁珠。切割时,蛋白质从固体释放并且与其他混合物相互作用。例如,蛋白质是酶,并且在酶-核酸的核酸被切割后,酶流过腔室进入包含底物的混合物中。当酶与酶底物相遇时,发生反应,例如比色反应,然后检测该反应。作为另一示例,蛋白质是酶底物,并且在酶底物-核酸的核酸被切割后,酶流过腔室进入包含酶的混合物中。当酶底物与酶相遇时,发生反应,例如量热反应,然后检测该反应。
[0375]
在一些实施方案中,报道分子包含与亲和分子缀合的核酸和与荧光团缀合的亲和分子(例如,核酸-亲和分子-荧光团)或与荧光团缀合的核酸和与亲和分子缀合的荧光团(例如,核酸-荧光团-亲和分子)。在一些实施方案中,接头将核酸缀合至亲和分子。在一些实施方案中,接头将亲和分子缀合至荧光团。在一些实施方案中,接头将核酸缀合至荧光团。接头可以是本领域已知的任何合适的接头。在一些实施方案中,报道分子的核酸可以直接缀合至亲和分子,并且亲和分子可以直接缀合至荧光团,或者核酸可以直接缀合至荧光
团并且荧光团可以直接缀合至亲和分子。在这种情况下,“直接缀合”是指两个彼此直接缀合的部分之间不存在居间的分子、多肽、蛋白质或其他部分。例如,如果报道分子包含直接缀合至亲和分子的核酸和直接缀合至荧光段的亲和分子,则核酸与亲和分子之间不存在居间的部分并且亲和分子与荧光团之间不存在居间的部分。亲和分子可以是生物素、抗生物素蛋白、链霉亲和素或任何类似的分子。
[0376]
在一些情况下,报道分子包含底物-核酸。当如在底物-核酸中一样存在时,可以将底物与其同源酶隔离,但是随后在切割时从核酸中释放,其中释放的底物可以与同源酶接触以产生可检测信号。通常,底物是蔗糖并且同源酶是转化酶,并且dns试剂可用于监测转化酶活性。
[0377]
本文公开的装置和方法的主要优势是针对未扩增或扩增的样品中的总核酸(不包括报道分子的核酸)设计过量的报道分子。总核酸可以包括靶核酸和非靶核酸,不报告报道分子的核酸。非靶核酸可以来自经裂解或未经裂解的原始样品。非靶核酸还可以是扩增的副产物。因此,非靶核酸可包括来自经裂解或未经裂解的原始样品以及来自扩增的样品的非靶核酸。由于存在大量非靶核酸,激活的可编程核酸酶的结合和切割报道分子序列的能力可能受抑制。这是因为激活的可编程核酸酶并行地切割任何核酸。如果存在大量总核酸,它们对可编程核酸酶的竞争力可能大于报道分子。本文公开的装置和方法被设计成相对于总核酸具有过量的报道分子,使得来自切割反应(例如, detectr反应)的可检测信号是特别突出的。在一些实施方案中,相对于总核酸,报道分子以至少1.5倍、至少2倍、至少3倍、至少 4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少 10倍、至少11倍、至少12倍、至少13倍、至少14倍、至少15倍、至少16倍、至少17倍、至少18倍、至少19倍、至少20倍、至少 30倍、至少40倍、至少50倍、至少60倍、至少70倍、至少80倍、至少90倍、至少100倍、1.5倍至100倍、2倍至10倍、10倍至20 倍、20倍至30倍、30倍至40倍、40倍至50倍、50倍至60倍、60 倍至70倍、70倍至80倍、80倍至90倍、90倍至100倍、1.5倍至 10倍、1.5倍至20倍、10倍至40倍、20倍至60倍或10倍至80倍过量存在。
[0378]
本文公开的装置和方法的第二重要优势是设计了包含指导核酸、可编程核酸酶和报道分子的过量体积,其接触包含具有感兴趣靶核酸的样品的较小体积。包含样品的较小体积可以是未裂解的样品、裂解的样品,或已经历逆转录、扩增和体外转录的任何组合的裂解样品。粗样品、未裂解样品、裂解样品或裂解并扩增的样品中存在的各种试剂,如缓冲剂、硫酸镁、盐、ph、还原剂、引物、dntp、ntp、细胞裂解物、非靶核酸、引物或其他组合,可以抑制可编程核酸酶发现并切割报道分子的核酸的能力。这可能是由于并非报道分子的核酸对可编程核酸酶的竞争力大于报道分子的核酸。替代地,样品中的各种试剂可能直接抑制可编程核酸酶的活性。因此,本文提供的使包含指导核酸、可编程核酸酶和报道分子的过量体积与包含具有感兴趣靶核酸的样品的较小体积接触的装置和方法通过确保可编程核酸酶能够找到并切割报道分子的核酸来更好地检测靶核酸。在一些实施方案中,包含指导核酸、可编程核酸酶和报道分子的体积(可以称为“第二体积”)比包含样品的体积(可以称为“第一体积”)大4倍。在一些实施方案中,包含指导核酸、可编程核酸酶和报道分子的体积(可以称为“第二体积”)比包含样品的体积(可以称为“第一体积”)大至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少11倍、至少12倍、至少13 倍、至少14倍、至少15倍、至少16倍、至少17倍、至少18倍、至少19倍、至少20倍、至少30
倍、至少40倍、至少50倍、至少 60倍、至少70倍、至少80倍、至少90倍、至少100倍、1.5倍至 100倍、2倍至10倍、10倍至20倍、20倍至30倍、30倍至40倍、 40倍至50倍、50倍至60倍、60倍至70倍、70倍至80倍、80倍至 90倍、90倍至100倍、1.5倍至10倍、1.5倍至20倍、10倍至40 倍、20倍至60倍或10倍至80倍。在一些实施方案中,包含样品的体积是至少0.5ul、至少1ul、至少1ul、至少2ul、至少3ul、至少4ul、至少5ul、至少6ul、至少7ul、至少8ul、至少9ul、至少10ul、至少11ul、至少12ul、至少13ul、至少14ul、至少 15ul、至少16ul、至少17ul、至少18ul、至少19ul、至少20ul、至少25ul、至少30ul、至少35ul、至少40ul、至少45ul、至少 50ul、至少55ul、至少60ul、至少65ul、至少70ul、至少75ul、至少80ul、至少85ul、至少90ul、至少95ul、至少100ul、0.5 ul至5ul ul、5ul至10ul、10ul至15ul、15ul至20ul、20ul 至25ul、25ul至30ul、30ul至35ul、35ul至40ul、40ul至 45ul、45ul至50ul、10ul至20ul、5ul至20ul、1ul至40ul、 2ul至10ul或1ul至10ul。在一些实施方案中,包含可编程核酸酶、指导核酸和报道分子的体积是至少10ul、至少11ul、至少12ul、至少13ul、至少14ul、至少15ul、至少16ul、至少17ul、至少 18ul、至少19ul、至少20ul、至少21ul、至少22ul、至少23ul、至少24ul、至少25ul、至少26ul、至少27ul、至少28ul、至少 29ul、至少30ul、至少40ul、至少50ul、至少60ul、至少70ul、至少80ul、至少90ul、至少100ul、至少150ul、至少200ul、至少250ul、至少300ul、至少350ul、至少400ul、至少450ul、至少500ul、10ul至15ul ul、15ul至20ul、20ul至25ul、25 ul至30ul、30ul至35ul、35ul至40ul、40ul至45ul、45ul 至50ul、50ul至55ul、55ul至60ul、60ul至65ul、65ul至 70ul、70ul至75ul、75ul至80ul、80ul至85ul、85ul至90 ul、90ul至95ul、95ul至100ul、100ul至150ul、150ul至 200ul、200ul至250ul、250ul至300ul、300ul至350ul、350 ul至400ul、400ul至450ul、450ul至500ul、10ul至20ul、 10ul至30ul、25ul至35ul、10ul至40ul、20ul至50ul、18 ul至28ul或17ul至22ul。
[0379]
报道分子可以是杂合核酸报道分子。杂合核酸报道分子包含具有至少一个核糖核苷酸和至少一个脱氧核糖核苷酸的核酸。在一些实施方案中,杂合核酸报道分子的核酸可以是任何的长度并且可以具有 dna和rna的任意混合物。例如,在一些情况下,dna的较长延伸可以被少量核糖核苷酸中断。替代地,rna的较长延伸可以被少量脱氧核糖核苷酸中断。替代地,核酸中的每隔一个碱基可以在核糖核苷酸与脱氧核糖核苷酸之间交替。杂合核酸报道分子的主要优势是相比于纯rna核酸报道分子而言稳定性增加。例如,相比于纯dna 或纯rna报道分子,杂合核酸报道分子可以在溶液中更稳定,被冻干或玻璃化。
[0380]
报道分子可以被冻干或玻璃化。报道分子可以悬浮在溶液中或固定在表面上。例如,报道分子可以固定在本文公开的装置中的腔室的表面上。在一些情况中,报道分子固定在本文公开的装置的腔室中的珠粒如磁珠上,其中珠粒通过置于腔室下方的磁体而保持在位。
[0381]
另外,靶核酸可以在与指导核酸(例如,crispr酶的crrna) 结合之前扩增。该扩增可以是pcr扩增或等温扩增。样品的该核酸扩增可以改善检测靶rna的灵敏度、特异性或准确性中的至少一项。用于核酸扩增的试剂可以包括重组酶、寡核苷酸引物、单链dna结合(ssb)蛋白和聚合酶。核酸扩增可以是转录介导的扩增(tma)。核酸扩增可以是解旋酶依赖性扩增(hda)或环状解旋酶依赖性扩增 (chda)。在另外的情况下,核酸扩增是链置换扩增(sda)。核酸扩增可以是重组酶聚合酶扩增(rpa)。核酸扩增可以是环介导的扩增(lamp)或指数扩增反应(expar)中的至少一种。在一些情况下,核酸扩增是通过滚环扩增(rca)、连接
酶链反应(lcr)、扩增rna靶标的简单方法(smart)、单引物等温扩增(spia)、多置换扩增(mda)、基于核酸序列的扩增(nasba)、铰链引发的引物依赖性核酸扩增(hinge-initiated primer-dependent amplificationof nucleic acids,hip)、切口酶扩增反应(near)或改进的多置换扩增(imda)。核酸扩增可以进行不超过1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、 50或60分钟。核酸扩增反应有时在20-45℃左右的温度下进行。核酸扩增反应可以在不超过20℃、25℃、30℃、35℃、37℃、40℃、45 ℃的温度下进行。核酸扩增反应可以在至少20℃、25℃、30℃、35 ℃、37℃、40℃、45℃的温度下进行。
[0382]
本文公开了测定如本文所述的靶核酸的方法,其中检测信号。例如,测定样品中的靶核酸的方法包括使样品与包含指导核酸和可编程核酸酶的复合体接触,该指导核酸包含与靶核酸的区段反向互补的区段,该可编程核酸酶在形成包含与靶核酸的区段结合的指导核酸的区段的复合体后表现出序列非依赖的切割;以及测定指示蛋白质-核酸群体中的至少一些蛋白质-核酸裂解的信号,其中该信号指示样品中存在靶核酸并且其中不存在信号指示样品中不存在靶核酸。作为另一个实例,测定样品中靶核酸的方法,例如,包括:a)使样品与包含指导核酸和可编程核酸酶的复合体接触,该指导核酸包含与靶核酸的区段反向互补的区段,该可编程核酸酶在形成包含与靶核酸的区段结合的指导核酸的区段的复合体后表现出序列非依赖的切割;b)使复合体与底物接触;c)使底物与试剂接触,该试剂与切割底物差异地发生反应;和d)测定指示底物切割的信号,其中该信号表明样品中存在靶核酸,并且其中不存在信号表明样品中不存在靶核酸。通常,底物是酶-核酸。有时,底物是酶底物-核酸。
[0383]
可编程核酸酶可以包括能够在与指导核酸和靶核酸复合时被激活的可编程核酸酶。可编程核酸酶可以在指导核酸与靶核酸结合之后变得激活,其中被激活的可编程核酸酶可以切割靶核酸并且可以具有反式切割活性。反式切割活性可以是通过激活的可编程核酸酶对附近核酸的非特异性切割,例如具有检测部分的检测核酸的反式切割。一旦检测核酸被激活的可编程核酸酶切割,检测部分就可以从检测核酸释放并且可以产生信号。该信号可以固定在支持介质上以供检测。该信号可以被可视化以评估靶核酸是否包含修饰。
[0384]
通常,信号是比色信号或肉眼可见的信号。在一些情况下,信号是荧光、电、化学、电化学或磁信号。信号可以是量热、电位、安培、光学(例如荧光,比色等)或压电信号。在一些情况下,可检测信号是比色信号或肉眼可见的信号。在一些情况下,可检测信号是荧光、电、化学、电化学或磁信号。在一些情况下,第一检测信号由检测部分与检测区域中的捕获分子的结合产生,其中该第一检测信号表明样品包含靶核酸。有时该系统能够检测超过一种类型的靶核酸,并且该系统包含超过一种类型的指导核酸和超过一种类型的检测核酸。在一些情况下,可检测信号由切割事件直接产生。替代地或组合地,可检测信号由信号事件间接产生。可检测信号有时不是荧光信号。在一些情况下,可检测信号是比色信号或基于颜色的信号。在一些情况下,检测的靶核酸是基于其在支持介质的检测区域上的空间位置而鉴定的。在一些情况下,第二可检测信号与产生的第一信号在空间上不同的位置产生。
[0385]
在一些情况下,对于检测样品中单链靶核酸的主题方法,检测阈值小于或等于10nm。术语“检测阈值”用于描述样品中为了进行检测而必须存在的最小量的靶核酸。例如,当检测阈值为10nm时,当靶核酸以10nm或更高的浓度存在于样品中时,可以检测到信号。在一些情况下,检测阈值小于或等于5nm、1nm、0.5nm,0.1nm、 0.05nm、0.01nm、0.005nm、
0.001nm、0.0005nm、0.0001nm、0.00005nm、0.00001nm、10pm、1pm、500fm、250fm、100fm、 50fm、10fm、5fm、1fm、500fm、250fm、100fm、50fm、10fm、 5fm、1fm、500埃摩尔(am)、100am、50am、10am或1am。在一些情况下,检测阈值范围为1am至1nm、1am至500pm、1am 至200pm、1am至100pm、1am至10pm、1am至1pm、1am至 500fm、1am至100fm、1am至1fm、1am至500am、1am至100am、1am至50am、1am至10am、10am至1nm、10am至 500pm、10am至200pm、10am至100pm、10am至10pm、10am 至1pm、10am至500fm、10am至100fm、10am至1fm、10am 至500am、10am至100am、10am至50am、100am至1nm、100 am至500pm、100am至200pm、100am至100pm、100am至10 pm、100am至1pm、100am至500fm、100am至100fm、100am 至1fm、100am至500am、500am至1nm、500am至500pm、 500am至200pm、500am至100pm、500am至10pm、500am至 1pm、500am至500fm、500am至100fm、500am至1fm、1fm 至1nm、1fm至500pm、1fm至200pm、1fm至100pm、1fm 至10pm、1fm至1pm、10fm至1nm、10fm至500pm、10fm 至200pm、10fm至100pm、10fm至10pm、10fm至1pm、500fm 至1nm、500fm至500pm、500fm至200pm、500fm至100pm、 500fm至10pm、500fm至1pm、800fm至1nm、800fm至500pm、 800fm至200pm、800fm至100pm、800fm至10pm、800fm至1 pm、1pm至1nm、1pm至500pm、1pm至200pm、1pm至100 pm或1pm至10pm。在一些情况下,检测阈值范围为800fm至100 pm、1pm至10pm、10fm至500fm、10fm至50fm、50fm至100 fm、100fm至250fm或250fm至500fm。在一些情况下,样品中检测到单链靶核酸的最小浓度的范围为1am至1nm、10am至1nm、 100am至1nm、500am至1nm、1fm至1nm、1fm至500pm、1 fm至200pm、1fm至100pm、1fm至10pm、1fm至1pm、10fm 至1nm、10fm至500pm、10fm至200pm、10fm至100pm、10fm 至10pm、10fm至1pm、500fm至1nm、500fm至500pm、500fm 至200pm、500fm至100pm、500fm至10pm、500fm至1pm、 800fm至1nm、800fm至500pm、800fm至200pm、800fm至100 pm、800fm至10pm、800fm至1pm、1pm至1nm、1pm至500 pm、1pm至200pm、1pm至100pm或1pm至10pm。在一些情况下,样品中可检测到单链靶核酸的最小浓度的范围为1am至100 pm。在一些情况下,样品中可检测到单链靶核酸的最小浓度的范围为1fm至100pm。在一些情况下,样品中可检测到单链靶核酸的最小浓度的范围为10fm至100pm。在一些情况下,样品中可检测到单链靶核酸的最小浓度的范围为800fm至100pm。在一些情况下,样品中可检测到单链靶核酸的最小浓度的范围为1pm至10pm。在一些情况下,本文所述的装置、系统、流体装置、试剂盒和方法检测包括多种核酸(例如多种非靶核酸)的样品中的靶单链核酸,其中靶单链核酸的浓度低至1am、10am、100am、500am、1fm、10fm、 500fm、800fm、1pm、10pm、100pm或1pm。
[0386]
在一些情况下,本文所述的装置、系统、流体装置、试剂盒和方法检测样品中的靶单链核酸,其中样品与试剂接触预定时间长度,该预定时间长度足以发生反式切割或切割反应完成。在一些情况下,本文所述的装置、系统、流体装置、试剂盒和方法检测样品中的靶单链核酸,其中样品与试剂接触不超过60分钟。有时,样品与试剂接触不超过120分钟、110分钟、100分钟、90分钟、80分钟、70分钟、 60分钟、55分钟、50分钟、45分钟、40分钟、35分钟、30分钟、 25分钟、20分钟、15分钟、10分钟、5分钟、4分钟、3分钟、2分钟或1分钟。有时,样品与试剂接触至少120分钟、110分钟、100 分钟、90分钟、80分钟、70分钟、60分钟、55分钟、50分钟、45 分钟、40分钟、35分钟、30分钟、25分钟、20分钟、15分钟、10 分钟、5分钟。在一些情况下,本文所述的装置、系统、流体装置、试剂盒和方法可以在不到10小时、不到9小时、不到8小时、不到7 小时、不到6小时、不到5小时、不到4小时、不到3小时、不到2 小时、不到1小时、不到50分钟、不到45分钟、不到40分钟、不到35分钟、不到30分钟、不到25分钟、不到20分
钟、不到15分钟、不到10分钟、不到9分钟、不到8分钟、不到7分钟、不到6 分钟或不到5分钟内检测样品中的靶核酸。
[0387]
当指导核酸与靶核酸结合时,可以启动可编程核酸酶的反式切割活性,并且可以切割检测核酸,从而检测荧光。本文所述的一些方法可以是测定样品中靶核酸的方法,包括使样品与复合体接触,该复合体包括指导核酸和可编程核酸酶,该指导核酸包括与靶核酸的区段反向互补的区段,该可编程核酸酶在形成包括与靶核酸的区段结合的指导核酸的区段的复合体后表现出与序列无关的切割;以及测定指示蛋白质-核酸群体中至少一些蛋白质-核酸的切割的信号,其中该信号指示样品中存在靶核酸,且其中不存在该信号或存在接近背景的信号指示样品中不存在靶核酸。使用可编程核酸酶对检测核酸的切割可以以50%的效率进行切割,这通过信号变化来测量,作为非限制性实施例,该信号变化为比色、电位、电流、光(例如荧光,比色等)或压电。本文所述的一些方法可以是一种检测样品中的靶核酸的方法,该方法包括将包含靶核酸的样品与靶向靶核酸区段的指导核酸、当指导核酸和靶核酸区段复合时能够被激活的可编程核酸酶、包括检测部分的单链检测核酸接触,其中该检测核酸能够被激活的可编程核酸酶切割,从而产生第一可检测信号,使用通过颜色变化测量的切割的可编程核酸酶切割单链检测核酸,并在支持介质测量第一可检测信号。使用可编程核酸酶切割单链检测核酸可以以50%的效率进行切割,所述效率通过颜色变化所测量。在一些情况下,通过颜色变化所测量的切割效率至少为40%、50%、60%、70%、80%、90%或95%。颜色变化可以是可检测的比色信号或肉眼可见的信号。颜色变化可以测量为第一可检测信号。第一个可检测信号可以在包含靶核酸的样品与靶向靶核酸区段的指导核酸、当指导核酸和靶核酸区段复合时能够被激活的可编程核酸酶、包括检测部分的单链检测核酸接触的5分钟内检测到。第一可检测信号可以在接触样品1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45,50、55、60、70、 80、90、100、110或120分钟内检测到。
[0388]
在一些情况下,本文所述的装置、系统、流体装置、试剂盒和方法用可编程核酸酶和单链检测核酸来检测样品中的靶单链核酸,其中样品与试剂接触预定时间长度,该预定时间长度足以反式切割单链检测核酸。例如,可编程核酸酶是lbucas13a,其检测靶核酸,并且单链检测核酸包含两个相邻的尿嘧啶核苷酸,具有在切割后检测到的绿色可检测部分。作为另一个实例,可编程核酸酶是lbacas13a,其检测靶核酸,并且单链检测核酸包含两个相邻的腺嘌呤核苷酸,具有在切割后检测到的红色可检测部分。
[0389]
在一些情况下,本文所述的装置、系统、流体装置、试剂盒和方法用两种不同的可编程核酸酶和两种不同的单链检测核酸来检测样品中两种不同的靶单链核酸,其中样品与试剂接触预定时间长度,该预定时间长度足以反式切割至少两种单链检测核酸。例如,第一可编程核酸酶是lbucas13a,其被第一单链靶核酸激活,并且在激活后,切割第一单链检测核酸,该第一单链检测核酸包括两个相邻的尿嘧啶核苷酸,具有在切割后检测到的绿色可检测部分,第二可编程核酸酶是lbacas13a,其被第二单链靶核酸激活,并且在激活后,切割第二单链检测核酸,该第二单链检测核酸包括两个相邻的腺嘌呤核苷酸,具有在切割后检测到的红色可检测部分。在一些情况下,两种可编程核酸酶的激活均切割其各自的单链核酸,例如lbucas13a,其切割第一单链检测核酸,该第一单链检测核酸包括两个相邻的尿嘧啶核苷酸,具有在切割后检测到的绿色可检测部分;lbacas13a,其切割第二单链检测核酸的核酸,该第二单链检测核酸包括两个相邻的腺嘌呤核苷酸,具有在切割后检测到的红色
5至400、5至500、25至50、25至75、25至100、50至100、50 至150、50至200、50至250、50至300、100至200、100至250、100至300或150至250mm ph 7.5的咪唑。缓冲液可以包含0至500、 0至400、0至300、0至250、0至200、0至150、0至100、0至75、 0至50、0至25、0至20、0至10、0至5、5至10、5至15、5至 20、5至25,至30、5至40、5至50、5至75、5至100、5至150、5 至200、5至250、5至300、5至400、5至500、25至50、25至75、 25至100、50至100、50 150、50至200、50至250、50至300、100 至200、100至250、100至300或150至250mm的kcl。在其他情况下,缓冲液包含0至100、0至75、0至50、0至25、0至20、0 至10、0至5、5至10、5至15、5至20、5至25、至30、5至40、 5至50、5至75、5至100、10至20、10至30、10至40、10至50、 15至20、15至25、15至30、15至4、15至50、20至25、20至30、 20至40或20至50mm的mgcl2。在一些情况下,缓冲液包含0至 100、0至75、0至50、0至25、0至20、0至10、0至5、5至50、 5至75、5至100、10至20、10至50、10至75、10至100、25至 50、25至75、25至100、50至75或50至100ug/ml的bsa。在一些情况下,缓冲液包含0至1、0至0.5、0至0.25、0至0.01、0至 0.05、0至0.025、0至0.01、0.01至0.025、0.01至0.05、0.01至0.1、 0.01至0.25、0.01、至0.5、0.01至1、0.025至0.05、0.025至0.1、 0.025至0.5、0.025至1、0.05至0.1、0.05至0.25、0.05至0.5、0.05 至0.75、0.05至1、0.1至0.25、0.1至0.5或0.1至1%的igepal ca-630。缓冲液可以包含0至25、0至20、0至10、0至5、5至10、5至15、 5至20、5至25、5至30%的甘油。
[0394]
本公开内容的缓冲液可以包括病毒裂解缓冲液。病毒裂解缓冲液可以裂解病毒样品(例如,从疑似感染冠状病毒的个体采集的样品) 中的冠状病毒衣壳,释放病毒基因组。病毒裂解缓冲液可以与病毒基因组靶区域的扩增(例如,rt-lamp扩增)相容。病毒裂解缓冲液可以与检测相容(例如,本文公开的detectr反应)。具有裂解病毒功能并且与扩增、检测或两者相容的病毒裂解缓冲液可以是双重裂解缓冲液。具有裂解病毒功能并且与扩增相容的病毒裂解缓冲液可以是双重裂解/扩增缓冲液。具有裂解病毒功能并且与检测相容的病毒裂解缓冲液可以是双重裂解/检测缓冲液。样品可以在一步样品制备方法中制备,该方法包括将样品悬浮在与扩增、检测(例如,detectr 反应)或两者相容的病毒裂解缓冲液中。与扩增(例如,rt-lamp 扩增)、检测(例如,detectr)或两者相容的病毒裂解缓冲液可以包含缓冲液(例如,tris-hcl、磷酸盐或hepes)、还原剂(例如, n-乙酰半胱氨酸(nac)、二硫苏糖醇(dtt)、β-巯基乙醇(bme) 或三(2-羧乙基)膦(tcep))、螯合剂(例如,edta或egta)、去污剂(例如,脱氧胆酸盐,np-40(ipgal),triton x-100,或tween 20)、盐(例如,乙酸铵、乙酸镁、乙酸锰、乙酸钾、乙酸钠、氯化铵、氯化钾、氯化镁、氯化锰、氯化钠、硫酸铵、硫酸镁、硫酸锰、硫酸钾或硫酸钠)或其组合。例如,病毒裂解缓冲液可以包含缓冲液和还原剂,或病毒裂解缓冲液可以包含缓冲液和螯合剂。病毒裂解缓冲液可以在低ph值下配制。例如,病毒裂解缓冲液可以在约ph 4 至约ph 5的ph值下配制。在一些实施方案中,病毒裂解缓冲液可以在约ph 4至约ph 8.8的ph值下配制。在一些实施方案中,病毒裂解缓冲液可以在约ph 4至约ph 9的ph值下配制。病毒裂解缓冲液还可以包含防腐剂(例如,proclin 150)。在一些实施方案中,病毒裂解缓冲液可以包含扩增反应的激活剂。例如,缓冲液可以包含引物、 dntp或镁(例如,mgso4、mgcl2或mgoac)或其组合,以激活扩增反应。在一些实施方案中,可以在冠状病毒裂解后将激活剂(例如,引物、dntp或镁)添加到缓冲液中以启动扩增反应。
[0395]
病毒裂解缓冲液可以包含约3.5、约3.6、约3.7、约3.8、约3.9、约4、约4.1、约4.2、约4.3、约4.4、约4.5、约4.6、约4.7、约4.8、约4.9、约5、约5.1、约5.2、约5.3、约5.4、约5.5、
0.55%至0.65%、0.60%至0.70%、0.65%至0.75%、0.70%至0.80%、 0.75%至0.85%、0.80%至0.90%、0.85%至0.95%、0.90%至1.00%、 0.95%至1.10%、1.00%至1.20%、1.10%至1.30%、1.20%至1.40%、 1.30%至1.50%、1.40%至1.60%、1.50%至2.00%、2.00%至2.50%、 2.50%至3.00%、3.00%至3.50%、3.50%至4.00%、4.00%至4.50%、或4.50%至5.00%的去污剂(例如,脱氧胆酸盐、np-40(ipgal)、 triton x-100或tween 20)。
[0400]
裂解反应可以在一定温度范围内进行。在一些实施方案中,裂解反应可以在约室温下进行。在一些实施方案中,裂解反应可以在约 95℃下进行。在一些实施方案中,裂解反应可以在1℃至10℃、4℃至8℃、10℃至20℃、15℃至25℃、15℃至20℃、18℃至25℃、18℃至95℃、20℃至37℃、25℃至40℃、35℃至45℃、40℃至60℃、50℃至70℃、60℃至80℃、70℃至90℃、80℃至95℃、或90℃至99℃下进行。在一些实施方案中,裂解反应可以进行约5分钟、约15分钟、或约30分钟。在一些实施方案中,裂解反应可以进行2分钟至5 分钟、3分钟至8分钟、5分钟至15分钟、10分钟至20分钟、15分钟至25分钟、20分钟至30分钟、25分钟至35分钟、30分钟至40 分钟、35分钟至45分钟、40分钟至50分钟、45分钟至55分钟、50 分钟至60分钟、55分钟至65分钟、60分钟至70分钟、65分钟至 75分钟、70分钟至80分钟、75分钟至85分钟、或80分钟至90分钟。
[0401]
许多检测装置和方法与本文公开的方法一致。例如,可以测量或检测比色、电位、电流、光学(例如荧光、比色等)或压电信号的任何装置。通常,比色信号为切割检测核酸后产生的热量。通常,比色信号为切割检测核酸后吸收的热量。电位信号为例如切割检测核酸后产生的电势。电流信号可以是切割检测核酸后产生的电子运动。通常,该信号是光学信号,例如比色信号或荧光学信号。光学信号为例如切割检测核酸后产生的光输出。有时,光学信号是在切割检测核酸前后的吸光度变化。通常,压电信号是在切割检测核酸前后的质量变化。有时,检测核酸是蛋白质-核酸。通常,蛋白质-核酸是酶-核酸。
[0402]
来自完成的测定的检测区域的结果可以以各种方式例如通过血糖仪来检测和分析。在一些情况下,检测区域中的阳性对照斑点和检测斑点是肉眼可见的,并且结果可以由用户读取。在一些情况下,根据信号的类型,通过成像装置或其他装置使检测区域中的阳性对照斑点和检测斑点可视化。通常,成像装置是数码相机,例如移动装置上的数码相机。移动装置可以具有软件程序或移动应用程序,其可以捕获支持介质的图像、识别正在执行的测定、检测检测区域和检测斑点、提供检测斑点的图像特性、分析检测斑点的图像特性、以及提供结果。替代地或组合地,成像装置可捕获荧光、紫外线(uv)、红外线(ir) 或可见光波长信号。成像装置可具有激发源以提供激发能量并捕获发射的信号。在一些情况下,激发源可以是相机闪光灯和任选地滤光器。在一些情况下,成像装置与放置在支持介质上的成像盒一起使用,以产生暗室来改善成像。成像盒可以是在成像之前可以装入成像装置的纸板盒。在一些情况下,成像盒具有光学透镜、反射镜、滤光器或其他光学元件,以帮助产生更聚焦的激发信号或捕获更聚焦的发射信号。通常,成像盒和成像装置是小型的、手持式的和便携式的,以便于在远程或资源匮乏的环境中运输和使用测定。
[0403]
本文所述的测定可通过移动应用程序(app)或软件程序可视化和分析。使用移动应用程序或程序的图形用户界面(gui),个体可以使用移动装置上的相机拍摄支持介质的图像,包括壳体上的检测区域、条形码、参考色标和基准标记(fiduciary marker)。程序或
移动应用程序读取测试类型的条形码或可识别标记,定位基准标记以定向样品,并读取可检测信号,与参考色标比较,并确定靶核酸的存在或不存在,这指示存在导致疾病的基因、病毒或病原体。移动应用程序可以将测试结果呈现给个体。移动应用程序可以将检验结果存储在移动应用程序中。移动应用程序可以与远程设备通信并传输测试结果的数据。测试结果可以由包括医疗保健专业人员在内的其他个体从远程装置远程查看。远程用户可以访问结果,并使用该信息来建议治疗、干预和清理环境的措施。靶核酸中突变的检测
[0404]
本文公开了测定本文所述的靶核酸的方法,该方法可用于检测靶核酸中的突变。例如,一种测定样品中靶核酸的方法包括使样品与复合体接触,该复合体包括指导核酸和可编程核酸酶,该指导核酸包括与靶核酸的区段反向互补的区段,该可编程核酸酶在包括与靶核酸的区段结合的指导核酸的区段的复合体形成后表现出与序列无关的切割;以及测定指示蛋白质-核酸群体中至少一些蛋白质-核酸的切割的信号,其中该信号指示样品中存在靶核酸,且其中不存在该信号或存在接近背景的信号指示样品中不存在靶核酸。信号的检测可以指示靶核酸的存在。有时,靶核酸包含突变。通常,该突变是单核苷酸突变。作为另一个实例,一种测定样品中靶核酸的方法例如包括:a)使样品与复合体接触,该复合体包括指导核酸和可编程核酸酶,该指导核酸包括与靶核酸的区段反向互补的区段,该可编程核酸酶在包括与靶核酸的区段结合的指导核酸的区段的复合体形成后表现出与序列无关的切割;b)使复合体与底物接触;c)使底物与试剂接触,该试剂与切割的底物差异地发生反应;d)测定指示底物切割的信号,其中该信号指示样品中存在靶核酸;且其中不存在该信号或存在接近背景的信号指示样品中不存在靶核酸。通常,底物是酶-核酸。有时,底物是酶底物-核酸。
[0405]
本文所述的方法可用于识别靶核酸中的突变。该方法可用于识别影响基因表达的靶核酸的单核苷酸突变。影响基因表达的突变可以是基因内靶核酸的单核苷酸突变、包括与基因表达相关的rna的靶核酸的单核苷酸突变或包括与基因表达调节相关的核酸的单核苷酸突变的靶核酸,例如rna或基因的启动子、增强子或阻遏物。通常,突变状态用于诊断或识别与靶核酸突变相关的疾病。具有突变的靶核酸的检测可应用于许多领域,例如临床、诊断、作为研究工具的实验室以及农业应用。通常,该突变是单核苷酸突变。该突变可能导致病毒(例如甲型流感病毒或乙型流感病毒)的突变毒株。疾病检测
[0406]
本文公开了测定本文所述的靶核酸的方法,该方法可用于疾病检测。例如,测定样品中靶核酸(例如,来自流感病毒)的方法包括使样品与包含指导核酸和可编程核酸酶的复合体接触,该指导核酸包含与靶核酸的区段反向互补的区段,该可编程核酸酶在形成包含与靶核酸的区段结合的指导核酸的区段的复合体后表现出序列非依赖的切割;以及测定指示蛋白质-核酸群体中的至少一些蛋白质-核酸裂解的信号,其中该信号表明样品中存在靶核酸,并且其中不存在信号表明样品中不存在靶核酸。信号的检测可以指示存在靶核酸。有时,靶核酸包含突变。通常,突变是单核苷酸突变。作为另一个实例,测定样品中靶核酸的方法,例如,包括:a)使样品与包含指导核酸和可编程核酸酶的复合体接触,该指导核酸包含与靶核酸的区段反向互补的区段,该可编程核酸酶在形成包含与靶核酸的区段结合的指导核酸的区段的复合体后表现出序列非依赖的切割;b)使复合体与底物接触;c)使底物与试
剂接触,该试剂与切割底物差异地发生反应;和 d)测定指示底物切割的信号,其中该信号表明样品中存在靶核酸,并且其中不存在信号表明样品中不存在靶核酸。通常,底物是酶-核酸。有时,底物是酶底物-核酸。
[0407]
本文所述的方法可用于识别来自细菌、病毒或微生物的靶核酸中的突变。该方法可用于识别影响基因表达的靶核酸的突变。影响基因表达的突变可以是基因内靶核酸的突变、包括与基因表达相关的 rna的靶核酸的突变或包括与基因表达调节相关的核酸的突变的靶核酸,例如rna或基因的启动子、增强子或阻遏物。有时,使用目标核酸突变的状态来确定细菌、病毒或微生物的致病性或治疗抗性,例如对抗生素治疗的抗性。通常,突变的状态用于诊断或识别与细菌、病毒或微生物中的靶核酸突变相关的疾病。通常,该突变是单核苷酸突变。作为研究工具、即时护理(point-of-care)或非处方药 (over-the-counter)的检测
[0408]
本文公开了测定如本文所述的靶核酸(例如,来自流感病毒) 的方法,其可用作研究工具,并可作为试剂盒提供。例如,测定样品中靶核酸的方法包括使样品与包含指导核酸和可编程核酸酶的复合体接触,该指导核酸包含与靶核酸的区段反向互补的区段,该可编程核酸酶在形成包含与靶核酸的区段结合的指导核酸的区段的复合体后表现出序列非依赖的切割;以及测定指示蛋白质-核酸群体中的至少一些蛋白质-核酸裂解的信号,其中该信号指示样品中存在靶核酸,并且其中不存在信号指示样品中不存在靶核酸。信号的检测可以指示靶核酸的存在。有时,靶核酸包含突变。通常,该突变是单核苷酸突变。作为另一个实例,一种测定样品中靶核酸的方法例如包括:a)使样品与复合体接触,该复合体包括指导核酸和可编程核酸酶,该指导核酸包括与靶核酸的区段反向互补的区段,该可编程核酸酶在包括与靶核酸的区段结合的指导核酸的区段的复合体形成后表现出与序列无关的切割;b)使复合体与底物接触;c)使底物与试剂接触,该试剂与切割的底物差异地发生反应;d)测定指示底物切割的信号,其中该信号指示样品中存在靶核酸;且其中不存在该信号或存在接近背景的信号指示样品中不存在靶核酸。通常,底物是酶-核酸。有时,底物是酶底物-核酸。
[0409]
本文所述的方法可用于识别靶核酸中的单个核苷酸突变。该方法可用于识别影响基因表达的靶核酸的突变。影响基因表达的突变可以是基因内靶核酸的单核苷酸突变、包括与基因表达相关的rna的靶核酸的突变或包括与基因表达调节相关的核酸的突变的靶核酸,例如rna或基因的启动子、增强子或阻遏物。通常,该突变是单核苷酸突变。
[0410]
试剂盒或研究工具可用于在实验室环境中检测任何数量的靶核酸、突变或本文公开的其他适应症。试剂盒可作为用于开箱仪器(openbox instrumentation)的试剂包而提供。
[0411]
在其他实施方案中,任何系统、测定形式、cas报道分子、可编程核酸酶或其他试剂都可以用于即时护理(poc)测试,所述测试可以在分散的地点(例如医院、pol或诊所)进行。这些即时护理测试可用于诊断本文公开的任何适应症,例如流感或链球菌感染,或可用于测量靶核酸(例如,egfr)中特定突变的存在或不存在。poc 测试可以作为具有可消耗测试卡的小型仪器来提供,其中测试卡是本文公开的任何测定形式(例如,横向流动测定)。
[0412]
仍在其他实施方案中,任何系统、测定形式、cas报道分子、可编程核酸酶或其他试
剂可以以非处方(otc)、无读取器形式使用,其可以在远程地点或家庭中使用以诊断一系列适应症(例如流感)。这些适应症包括甲型流感、乙型流感、链球菌感染或ct/ng感染。 otc产品可以包括可消耗测试卡,其中,该测试卡是本文公开的任何测定形式(例如,横向流动测定)。在otc产品中,测试卡可以可视化或使用移动电话来解释。支持介质
[0413]
许多支持介质与本文公开的装置、系统、流体装置、试剂盒和方法一致。这些支持介质,例如,与本文公开的用于检测样品中的靶核酸(例如,来自流感病毒)的流体装置一致,其中流体装置可以包括多个泵、阀、储器和腔室,用于样品制备、样品中靶核酸的扩增、与可编程核酸酶混合以及检测由流体系统本身内的可编程核酸酶切割检测核酸产生的可检测信号。这些支持介质与本文所述的样品、试剂和流体装置相容,用于检测病痛,例如病毒感染,例如来自甲型流感或乙型流感的感染。本文所述的支持介质可以提供呈现试剂和样品之间活性的结果的方式。支持介质提供以可检测形式呈现可检测信号的介质。任选地,支持介质将可检测信号集中至检测区域中的检测点以增加测定的灵敏度、特异性或准确度。支持介质可以呈现测定结果并指示是否存在靶核酸靶向的目标疾病。支持介质上的结果可以通过肉眼或机器读取。支持介质有助于稳定由支持介质表面上的切割的检测分子产生的可检测信号。在一些情况下,支持介质是横向流动测定条。在一些情况下,支持介质是pcr板。pcr板可以有96个孔或384 个孔。pcr板可具有96孔板或384孔板的孔子集数。96孔pcr板的孔子集数是,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、 14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、 45、50、55、60、65、70、75、80、85、90或95孔。例如,pcr子集板可以具有4个孔,其中一个孔的大小为96孔pcr板的孔的大小 (例如,4孔pcr子集板,其中这些孔的大小为96孔pcr板的孔的大小)。384孔pcr板的孔的子集数是,例如,1、2、3、4、5、6、 7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、 23、24、25、30、32、35、40、45、50、55、60、64、65、70、75、80、85、90、95、100、110、120、128、130、140、150、160、170、 180、190、200、220、240、256、260、280、300、320、340、360 或380孔。例如,pcr子集板可以具有20个孔,其中一个孔的大小为384孔pcr板的孔的大小(例如,20孔pcr子集板,其中这些孔的大小为384孔pcr板的孔的大小)pcr板或pcr子集板可与荧光读取器、可见光读取器或其他成像装置配对。通常,成像装置是数码相机,例如移动装置上的数码相机。所述移动装置可以具有软件程序或移动应用程序,所述软件程序或移动应用程序可以捕获pcr板或 pcr子集板的图像,识别正在执行的分析,检测单个孔和其中的样品,提供包含所述分析样品的单个孔的图像特性,分析单个孔内容物的图像特性,并提供结果。
[0414]
支持介质具有至少一个专用分区或区域来呈现可检测信号。所述区域包括样品垫区域、核酸扩增区域、缀合垫区域、检测区域和收集垫区域中的至少一个。在一些情况下,这些区域完全重叠、部分重叠或串联重叠并且仅在区域的边缘处接触,其中这些区域与其相邻区域流体连通。在一些情况下,支持介质具有位于其他区域上游的样品垫;具有用于具体标记检测部分的装置的缀合垫区域;位于样品垫下游的检测区域;以及至少一个限定与样品垫流体连接的流径的矩阵。在一些情况下,支持介质具有延伸的基底层,在其上放置各种分区或区域。延伸基底层可为分区提供机械支撑。
[0415]
本文描述了提供区域以将样品施加到支持介质的样品垫。可在样品垫的顶部通过滴管或移液管、在样品垫区域顶部通过倾倒或分配样品,或通过将样品垫浸入容纳样品的
试剂腔室而将样品施加到支持介质上。当试剂放置在支持介质上时,可在与试剂反应之前将样品施加到样品垫上;或在将样品施加到样品垫上之前使样品与试剂反应。样品垫区域可以将反应的试剂和样品转移到支持介质的其他分区。反应试剂和样品的转移可通过毛细管作用、扩散、对流或泵辅助的主动传输来进行。在一些情况下,支持介质与微流体通道集成或被微流体通道覆盖以促进流体传输。
[0416]
滴管或移液管可分配预定体积。在一些情况下,预定体积可在约1μl至约1000μl、约1μl至约500μl、约1μl至约100μl或约1μl 至约50μl的范围内。在一些情况下,预定体积可为至少1μl、2μl、 3μl、4μl、5μl、6μl、7μl、8μl、9μl、10μl、25μl、50μl、75μl、 100μl、250μl、500μl、750μl或1000μl。预定体积可不超过5μl、 10μl、25μl、50μl、75μl、100μl、250μl、500μl、750μl或1000μl。滴管或移液管可用完丢弃或一次性使用。
[0417]
任选地,也可在样品垫上施加缓冲液或流体,以有助于驱动样品沿支持介质移动。在一些情况下,缓冲液或流体的体积可在约1μl 至1000μl、至1μl至500μl、至1μl至100μl或约1μl至50μl的范围内。在一些情况下,缓冲液或流体的体积可为至少1μl、2μl、3 μl、4μl、5μl、6μl、7μl、8μl、9μl、10μl、25μl、50μl、75μl、 100μl、250μl、500μl、750μl或1000μl。缓冲液或流体的体积可不超过5μl、10μl、25μl、50μl、75μl、100μl、250μl、500μl、750μl 或1000μl。在一些情况下,缓冲液或流体可具有如下比率:样品与缓冲液或流体的比率至少为1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、 1:9或1:10。
[0418]
样品垫可由各种材料制成,这些材料将大部分应用的反应试剂和样品转移到后续区域。样品垫可包括纤维素纤维过滤器、编织网、多孔塑料膜、玻璃纤维过滤器、氧化铝涂层膜、硝化纤维素、纸、聚酯过滤器或基于聚合物的基质。用于样品垫区域的材料可以是亲水性的并且具有低的非特异性结合。用于样品垫的材料范围为约50μm至约1000μm、约50μm至约750μm、约50μm至约500μm或约100μm 至约500μm。
[0419]
样品垫可采用化学物质处理,以改善在支持介质上呈现的反应结果。样品垫可经处理以加强样品中核酸的提取,控制反应试剂和样品或缀合物至支持介质的其他区域的运输,或者增强被切割的检测部分与缀合物表面的缀合物结合分子的结合或检测区域中捕获分子的结合。这些化学物质可包括去垢剂、表面活性剂、缓冲液、盐、增粘剂或多肽。在一些情况下,该化学物质包括牛血清白蛋白。
[0420]
本文描述了提供支持介质上的区域的缀合垫,所述区域包含由缀合物结合分子涂覆在其表面上的缀合物,所述缀合物结合分子可与来自切割的检测分子的检测部分结合或与对照分子结合。缀合垫可以由各种材料制成,这些材料有助于缀合物结合分子与来自切割的检测分子的检测部分结合,并将大部分共轭结合的检测部分转移到后续区域。缀合垫可包括与样品垫或其他分区相同的材料,或与样品垫不同的材料。缀合垫可包括玻璃纤维过滤器、多孔塑料膜、氧化铝涂层膜、纸、纤维素纤维过滤器、编织网、聚酯过滤器或基于聚合物的基质。用于缀合垫区域的材料可以是亲水性的,具有低的非特异性结合,或者在整个缀合垫具有一致的流体流动特性。在一些情况下,缀合垫的材料范围约为50μm至约1000μm、约50μm至约750μm、约50μm 至约500μm或约100μm至约500μm。
[0421]
本文进一步描述了放置在缀合垫上并且固定在缀合垫上直到将样品施加到支持介质上的缀合物。所述缀合物可以包含纳米颗粒、金纳米颗粒、乳胶纳米颗粒、量子点、化学发光纳米颗粒、碳纳米颗粒、硒纳米颗粒、荧光纳米颗粒、脂质体或树状大分子。缀合物的表
面可被缀合物结合分子包覆,该缀合物结合分子与来自切割的检测分子的检测部分结合。
[0422]
本文描述的缀合物结合分子覆盖缀合物的表面,并可以与检测部分结合。缀合物结合分子选择性地与从检测核酸中切割的检测部分结合。一些合适的缀合物结合分子包括抗体、多肽或单链核酸。在一些情况下,缀合物结合分子与染料和荧光团结合。一些与染料或荧光团结合的这样的缀合物结合分子可以使其信号猝灭。在一些情况下,缀合物结合分子是单克隆抗体。在一些情况下,抗体(也称为免疫球蛋白)包括任何同种型、可变区、恒定区、fc区、fab片段、f(ab')2 片段和fab'片段。或者,缀合物结合分子是特异性地结合检测部分的非抗体化合物。有时,缀合物结合分子是能与检测部分结合的多肽。有时,缀合物结合分子是抗生物素蛋白或结合生物素的多肽。有时,缀合物结合分子是结合检测部分的核酸。
[0423]
可以选择缀合物的直径以提供所需的表面体积比。在一些实例中,高表面积体积比可允许每总体积的缀合物中有更多可用于与检测部分结合的缀合物结合分子。在一些情况下,缀合物的直径可在约1 nm至1000nm、约1nm至500nm、约1nm至100nm或约1nm至 50nm范围内。在一些情况下,缀合物的直径可以为至少1nm、2nm、 3nm、4nm、5nm、6nm、7nm、8nm、9nm、10nm、15nm、20nm、 25nm、30nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm、 65nm、70nm、75nm、80nm、85nm、90nm、95nm、100nm、200 nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm 或1000nm。在一些情况下,缀合物的直径可以为不超过1nm、2nm、 3nm、4nm、5nm、6nm、7nm、8nm、9nm、10nm、15nm、20nm、 25nm、30nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm、 65nm、70nm、75nm、80nm、85nm、90nm、95nm、100nm、200 nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm 或1000nm。
[0424]
可定制缀合物结合分子与缀合物的比率以实现缀合物结合分子与检测部分之间的期望结合性质。在一些情况下,缀合物结合分子与缀合物的摩尔比至少是1:1、1:5、1:10、1:20、1:30、1:40、1:50、1:60、 1:70、1:80、1:90、1:100、1:110、1:120、1:130、1:140、1:150、1:160、 1:170、1:180、1:190、1:200、1:250、1:300、1:350、1:400、1:450或1:500。在一些情况下,缀合物结合分子与缀合物的质量比为至少1:1、 1:5、1:10、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90、1:100、 1:110、1:120、1:130、1:140、1:150、1:160、1:170、1:180、1:190、 1:200、1:250、1:300、1:350、1:400、1:450或1:500。在一些情况下,每个缀合物的缀合物结合分子数为至少1、10、50、100、500、1000、 5000或10000。
[0425]
缀合物结合分子可以通过各种方法与缀合物结合。有时,缀合物结合分子可以通过被动结合的方式与缀合物结合。一些这样的被动结合包括吸附、吸收、疏水相互作用、静电相互作用、离子结合或表面相互作用。在一些情况下,缀合物结合分子可与缀合物共价结合。有时,通过edc/nhs化学或硫醇化学促进缀合物结合分子与缀合物的共价结合。
[0426]
本文描述的是支持介质上的检测区域,其提供用于呈现测定结果的区域。检测区域可以由各种材料制成,这些材料有助于将与缀合物结合的来自切割的检测分子的检测部分与对检测部分具有特异性的捕获分子的结合。检测垫可包括与其他分区相同的材料或与其他分区不同的材料。检测区域可包括硝化纤维素、纸、纤维素、纤维素纤维过滤器、玻璃纤维过滤器、多孔塑料膜、氧化铝涂层膜、编织网、聚酯过滤器或基于聚合物的基质。检测区域通常可以包含硝化纤维素。用于区域垫区域的材料可以是亲水性的,具有低的非特异性结合,或者在整个区域垫具有一致的流体流动特性。缀合垫的材料范围约为10 μm至约1000μ
m、约10μm至约750μm、约10μm至约500μm或约10μm至约300μm。
[0427]
检测区域包括至少一个具有高密度的捕获分子的捕获区域和至少一个具有高密度的阳性对照捕获分子的区域,所述高密度的捕获分子能够结合来自切割的检测分子的检测部分。具有高密度捕获分子或阳性对照捕获分子的捕获区域可以是线、圆、椭圆、矩形、三角形、加号或任何其他形状。在一些情况下,检测区域包括多于一个的捕获区域,所述捕获区域具有高密度的多于一个捕获分子,其中每个捕获区域包括一种类型的捕获分子,其特异性地与来自切割的检测分子的一种类型的检测部分结合并且不同于其他捕获区域中的捕获分子。具有不同捕获分子的捕获区域可以彼此完全重叠、部分重叠或在空间上分离。在一些情况下,捕获区域可重叠并产生与由单个捕获区域产生的可检测信号不同的组合的可检测信号。通常,阳性对照斑点在空间上不同于任何检测斑点。
[0428]
本文所述的捕获分子可以与检测部分结合并且可以固定在检测区域的检测斑点中。一些合适的捕获分子包括抗体、多肽或单链核酸。在一些情况下,捕获分子结合染料和荧光团。一些与染料或荧光团结合的这样的捕获分子可以使其信号猝灭。有时,捕获分子是与染料或荧光团结合的抗体,可以使其信号猝灭。在一些情况下,捕获分子是单克隆抗体。在一些情况下,抗体(也称为免疫球蛋白)包括任何同种型、可变区、恒定区、fc区、fab片段、f(ab')2片段和fab'片段。或者,捕获分子是特异性结合检测部分的非抗体化合物。有时,捕获分子是能与检测部分结合的多肽。在一些情况下,来自切割的检测分子的检测部分具有与检测部分结合的缀合物,并且缀合物-检测部分复合体可结合到检测区域上对检测部分具有特异性的捕获分子。有时,捕获分子是能与检测部分结合的多肽。有时,捕获分子是抗生物素蛋白或结合生物素的多肽。有时,捕获分子是结合检测部分的核酸。
[0429]
本文所述的检测区域包括至少一个具有高密度阳性对照捕获分子的区域。检测区域中的阳性对照斑点提供测定验证并确认测定完成。如果通过本文所述的可视化方法检测不到阳性对照斑点,则测定无效,应使用新系统或试剂盒再次进行。阳性对照捕获分子与缀合物、缀合物结合分子或检测部分中的至少一种结合,并固定在检测区域中的阳性对照斑点中。一些合适的阳性对照捕获分子包括抗体、多肽或单链核酸。在一些情况下,阳性对照捕获分子与缀合物结合分子结合。一些与染料或荧光团结合的这样的阳性对照捕获分子可以使其信号猝灭。有时,阳性对照捕获分子是与染料或荧光团结合的抗体,可以使其信号猝灭。在一些情况下,阳性对照捕获分子是单克隆抗体。在一些情况下,抗体包括任何同种型、可变区、恒定区、fc区、fab片段、 f(ab')2片段和fab'片段。或者,阳性对照捕获分子是与检测部分特异性结合的非抗体化合物。有时,阳性对照捕获分子是可与缀合物、缀合物结合分子或检测部分中的至少一种结合的多肽。在一些情况下,未与检测部分结合的缀合物与阳性对照捕获分子结合,所述阳性对照捕获分子对缀合物、缀合物结合分子的至少一种具有特异性。
[0430]
本文所述试剂盒或系统还可包括阳性对照样品,以确定可编程核酸酶、指导核酸或单链检测核酸中至少一种的活性。通常,阳性对照样品包含与指导核酸结合的靶核酸。阳性对照样品以与测试样品相同的方式与试剂接触,并使用支持介质进行可视化。阳性对照样品的阳性对照斑点和检测斑点的可视化提供了试剂和测定的验证。
[0431]
用于检测本文所述的靶核酸的试剂盒或系统还可以包含用于样品蛋白酶处理的试剂。所述样品可以在扩增前或检测可检测信号前用蛋白酶(如蛋白酶k)处理。通常,蛋白
酶处理不超过15分钟。有时,蛋白酶处理不超过1、5、10、15、20、25、30分钟或更长时间,或1至30分钟之间的任意值。
[0432]
用于检测本文所述的靶核酸的试剂盒或系统还包括用于样品中的靶核酸的核酸扩增的试剂。等温核酸扩增允许在偏远地区或资源匮乏的环境中使用试剂盒或系统而无需专用扩增设备。通常,用于核酸扩增的试剂包含重组酶、寡核苷酸引物、单链dna结合(ssb)蛋白和聚合酶。有时,样品的核酸扩增提高了检测靶核酸的测定中的灵敏度、特异性或准确性的至少一种。在一些情况下,核酸扩增在支持介质上的核酸扩增区域中进行。替代地或组合地,在试剂腔室中执行核酸扩增,并且将所得到的样品施加在支持介质上。有时,核酸扩增是等温核酸扩增。在一些情况下,核酸扩增是转录介导的扩增(tma)。核酸扩增是解旋酶依赖性扩增(hda)或在其他情况下是环状解旋酶依赖性扩增(chda)。在其他情况下,核酸扩增是链置换扩增(sda)。在一些情况下,核酸扩增通过重组酶聚合酶扩增(rpa)进行。在一些情况下,核酸扩增通过环介导的扩增(lamp)或指数式扩增反应 (expar)中的至少一个进行。在一些情况下,核酸扩增通过滚环扩增(rca)、连接酶链反应(lcr)、扩增rna靶标的简单方法(smart)、单引物等温扩增(spia)、多置换扩增(mda)、基于核酸序列的扩增(nasba)、铰链引发的引物依赖性核酸扩增(hip)、切口酶扩增反应(near)或改进的多置换扩增(imda)进行。通常,核酸扩增进行不超过1、2、3、4、5、6、7、8、9、10、11、12、13、 14、15、16、17、18、19、20、25、30、40、50或60分钟,或在1 至60分钟之间的任意值。有时,核酸扩增反应在20-45℃左右进行。在一些情况下,核酸扩增反应在不高于20℃、25℃、30℃、35℃、37℃、 40℃、45℃或20℃至45℃的任意值的温度下进行。在一些情况下,核酸扩增反应在至少20℃、25℃、30℃、35℃、37℃、40℃或45℃、或20℃至45℃的任意值的温度下进行。
[0433]
有时,执行本文所述方法的总时间不超过3小时、2小时、1 小时、50分钟、40分钟、30分钟、20分钟或从3小时至20分钟的任意值。通常,从原始样品中检测核酸的方法包括:蛋白酶处理样品不超过15分钟,扩增(也可称为预扩增)样品不超过15分钟,使样品经历可编程核酸酶介导的检测,以及分析核酸酶介导的检测。进行此方法的总时间有时不超过3小时、2小时、1小时、50分钟、40分钟、30分钟、20分钟、从3小时至20分钟的任意值。通常,蛋白酶处理是蛋白酶k。通常扩增是热循环扩增。有时扩增是等温扩增。
[0434]
本文描述了收集垫区域,其提供用于收集向支持介质下方流动的样品的区域。收集垫通常放置在检测区域的下游,并且包括吸收性材料。收集垫可通过从支持介质的其他区域收集和移动样品来增加进入支持介质的样品的总体积。这种增加的体积可用于洗去检测区域中未结合的缀合物,以降低背景并增强测定灵敏度。当支持介质的设计不包括收集垫时,支持介质中分析的样品体积可由支持介质的床体积确定。收集垫可为样品体积提供贮存器,并且可有助于为样品向支持介质下方流动提供毛细管力。
[0435]
收集垫可由各种高吸收性且能保留流体的材料制成。通常收集垫包括纤维素过滤器。在一些情况下,收集垫包括纤维素、棉花、编织网、基于聚合物的基质。收集垫的尺寸通常是收集垫的长度,可以调整以改变支持介质吸收的总体积。
[0436]
本文描述的支持介质在支持介质的边缘周围可以有屏障。通常,屏障是一种疏水屏障,有助于在支持介质内维持样品或有助于样品在支持介质中流动。通常,样品在疏水屏障中的传输速率远低于通过支持介质区域的传输速率。在一些情况下,通过在支持介质边缘周围接触疏水材料来制备疏水屏障。有时,疏水屏障包括蜡、聚二甲基硅氧烷、橡胶或硅
树脂中的至少一种。
[0437]
支持介质上的任何区域都可以用化学物质处理,以提高支持介质上检测斑点和阳性对照斑点的可视性。该区域可经处理以强样品中核酸的提取,以控制反应试剂和样品或缀合物至支持介质的其他区域的运输,或增强切割的检测部分与缀合物表面上的缀合物结合分子或检测区域中的捕获分子的结合。所述化学物质可以包含去垢剂、表面活性剂、缓冲液、盐、增粘剂或多肽。在一些情况下,该化学物质包含牛血清白蛋白。在一些情况下,化学物质或物理试剂会增强样品的流动性,使整个区域宽度上的流动更加均匀。在一些情况下,化学物质或物理试剂在整个区域宽度上提供更均匀的样品混合。在一些情况下,化学物质或物理试剂控制流速为更快或更慢,以提高测定性能。有时,测定的性能通过以下至少一种方式来测量:较短的测定时间、较长的切割活动时间、较长或较短的与缀合物的结合时间、灵敏度、特异性或准确性。多路复用
[0438]
本文所述的装置、系统、流体装置、试剂盒和方法可以以多种方法多路复用。这些多路复用方法例如与本文公开的用于检测样品内的靶核酸的流体装置一致,其中该流体装置可包括用于样品制备、样品内靶核酸的一个或多于一个序列的扩增、与可编程核酸酶混合以及检测由流体系统本身内的可编程核酸酶切割检测核酸而产生的可检测信号的多个泵、阀、储器和腔室。
[0439]
与本公开内一致的方法包括测定样品中的靶核酸的多路复用方法。多路复用方法包括使样品接触包含指导核酸和可编程核酸酶的复合体,所述指导核酸包含与靶核酸的区段反向互补的区段,所述可编程核酸酶在包含与靶核酸的区段结合的指导核酸的区段的复合体形成后表现出与序列无关的切割;以及测定指示蛋白质-核酸群体中的至少一些蛋白质-核酸的切割的信号,其中所述信号指示样品中存在靶核酸,并且其中不存在信号则指示样品中不存在靶核酸。作为另一示例,测定样品中的靶核酸的多路复用方法包括:a)使样品接触包含指导核酸和可编程核酸酶的复合体,所述指导核酸包含与靶核酸的区段反向互补的区段,所述可编程核酸酶在包含与靶核酸的区段结合的指导核酸的区段的复合体形成后表现出与序列无关的切割;b)使复合体与底物接触;c)使底物与试剂接触,所述试剂与切割的底物差异地反应;以及d)测定指示底物切割的信号,其中所述信号指示样品中存在靶核酸,并且其中不存在信号则指示样品中不存在靶核酸。底物通常是酶-核酸。底物有时是酶底物-核酸。
[0440]
多路复用可以是空间多路复用,其中多个不同的靶核酸在同时处理,但反应是空间上分开的。通常,使用相同可编程核酸酶,但使用不同指导核酸来检测多个靶核酸。多个靶核酸有时使用不同的可编程核酸酶来检测。有时,多路复用可以是单个反应多路复用,其中在单个反应体积中检测多个不同靶酸。通常,在单个反应多路复用中使用至少两种不同的可编程核酸酶。例如,可以通过将多种类的检测核酸固定在流体系统内以实现在单个流体系统内检测多个靶核酸,从而实现多路复用。多路复用允许在一个试剂盒或系统中检测多个靶核酸。在一些情况下,多个靶核酸包含针对病毒(例如流感病毒)的不同靶核酸。在一些情况下,多个靶核酸包含与流感和另一种疾病(例如败血症或呼吸道感染,例如上呼吸道病毒)相关的不同靶核酸。针对一种疾病的多路复用提高了测定的灵敏度、特异性或准确性的至少一种,从而检测样品中疾病的存在。在一些情况下,多个靶核酸包括指向导致超过一
种疾病的不同病毒、细菌或病原体的不同靶核酸。在一些情况下,多路复用允许区分多个靶核酸,例如,包含导致疾病的同一细菌或病原体的不同基因型(例如,细菌或病原体的野生型基因型,和包含突变的细菌或病原体的基因型,该突变是例如单核苷酸多态性 (snp),其可以赋予对治疗(例如抗生素治疗)的耐受性)的靶核酸。例如,多路复用包括有包括使用第一可编程核酸酶确定微生物物种和使用第二可编程核酸酶确定微生物中的抗生素耐药性模式的单个测定的测定方法。有时,多路复用允许区分不同流感毒株的多个靶核酸,例如甲型流感和乙型流感。通常,多路复用允许区分多个靶核酸,例如,包含不同基因型(例如,野生型基因型和snp基因型) 的靶核酸。针对多种病毒感染的多路复用提供测试来自单个样品的多种疾病的能力。例如,在新患者的广泛检测中或在流行病学调查中,针对多种疾病的多路复用可能很有价值。通常,多路复用用于鉴定脓毒症或其他与多种病原体有关的疾病中的细菌病原体。
[0441]
而且,来自多路复用的信号可以被定量。例如,用于疾病组的定量的方法包括在来自样品的多个等分中测定多个独特靶核酸,在样品的第二等分中测定对照核酸对照,以及通过测量因切割检测核酸而产生的信号来定量多个独特靶核酸的多个信号,与第二等分中产生的信号比较。通常,所述多个独特靶核酸来自样品中的多个病毒。有时,对于产生多个信号的多个独特靶核酸,多个信号的定量与多个独特靶核酸的浓度相关。疾病组可以是任何传染病,例如流感。
[0442]
本文所述的装置、系统、流体装置、试剂盒和方法可以通过试剂和支持介质的各种配置来多路复用。在一些情况下,试剂盒或系统被设计成具有装在单个壳体内的多个支持介质。有时,容纳在单个壳体内的多个支持介质共享单个样品垫。单个样品垫可以连接至各种设计(如分枝或径向形成)的支持介质。替代地,多个支持介质中的每一个具有其自身的样品垫。在一些情况下,试剂盒或系统被设计成具有装在壳体中的单个支持介质,其中该支持介质包含用于检测多个靶核酸的多个检测斑点。有时,用于多路复用测定的试剂包含多种指导核酸、多种可编程核酸酶和多种单链检测核酸,其中一种指导核酸、一种可编程核酸酶和一种单链检测核酸的组合检测一种靶核酸并且可以提供在检测区域上的检测斑点。在一些情况下,被配置成检测一种靶核酸的指导核酸、可编程核酸酶和单链检测核酸的组合在单个试剂腔室中与至少一个其他组合相混合。在一些情况下,被配置成检测一种靶核酸的指导核酸、可编程核酸酶和单链检测核酸的组合在单个支持介质上与至少一个其他组合相混合。当这些试剂组合与样品接触时,多种靶核酸的反应同时在同一介质或试剂腔室中发生。有时,将该反应的样品施加至本文所述的多路复用支持介质。
[0443]
在一些情况下,被配置成检测一种靶核酸的指导核酸、可编程核酸酶和单链检测核酸的组合在其自身的试剂腔室或其自身的支持介质中提供。在这种情况下,装置、试剂盒或系统中提供多个试剂腔室或支持介质,其中一个试剂腔室被设计成检测一种靶核酸。在这种情况下,使用多个支持介质来检测感兴趣的病毒感染,或其他疾病的组。
[0444]
在一些情况下,多路复用的装置、系统、流体装置、试剂盒和方法在单个反应中检测至少2种不同的靶核酸。在一些情况下,多路复用的装置、系统、流体装置、试剂盒和方法在单个反应中检测至少 3种不同的靶核酸。在一些情况下,多路复用的装置、系统、流体装置、试剂盒和方法在单个反应中检测至少4种不同的靶核酸。在一些情况下,多路复用的装置、系统、流体装置、试剂盒和方法在单个反应中检测至少5种不同的靶核酸。在一些情况
下,多路复用的装置、系统、流体装置、试剂盒和方法在单个反应中检测至少6、7、8、9 或10种不同的靶核酸。在一些情况下,多路复用的试剂盒在单个试剂盒中检测至少2种不同的靶核酸。在一些情况下,多路复用的试剂盒在单个试剂盒中检测至少3种不同的靶核酸。在一些情况下,多路复用的试剂盒在单个试剂盒中检测至少4种不同的靶核酸。在一些情况下,多路复用的试剂盒在单个试剂盒中检测至少5种不同的靶核酸。在一些情况下,多路复用的试剂盒在单个试剂盒中检测至少6、7、8、 9或10种不同的靶核酸。壳体
[0445]
可以以与本文所公开的装置、系统、流体装置、试剂盒和方法一致的多种方式来容纳本文所述的支持介质。例如,用于支持介质的壳体与本文公开的用于检测样品内靶核酸的流体装置一致,其中流体装置可包括用于样品制备、样品内靶核酸扩增、与可编程核酸酶混合、检测流体系统本身内可编程核酸酶切割检测核酸产生的可检测信号的多个泵、阀、储器和腔室。例如,这些流体装置可包括支持介质,以引导流体从一个腔室流向另一个腔室,其中整个流体装置被包裹在本文所述的壳体内。通常,本文所述的支持介质被包裹在壳体中以保护支持介质免受污染和解体。所述壳体可以由多于一个部件构成并组装起来以包裹所述支持介质。在一些情况下,单个壳体可以容纳多于一个的支持介质。壳体可以由纸板、塑料、聚合物或为支持介质提供机械保护的材料制成。通常,用于壳体的材料是惰性的,或者不与支持介质或放置在支持介质上的试剂反应。壳体可具有上部,所述上部在就位时暴露样品垫以接收所述样品,并且在检测区域上方具有开口或窗口以允许读取横向流动测定的结果。壳体的内表面上可能有导针,所述导针放置在支持介质周围和支持介质上,以帮助将隔室和支持介质固定在壳体内的适当位置。在一些情况下,壳体包裹整个支持介质。或者,支持介质的样品垫不被包裹,并且保持暴露以便于接收样品,而支持介质的其余部分被包裹在壳体中。
[0446]
壳体和包裹在壳体内的支持介质的尺寸可以是小型的、便携式的和手持式的。壳体和支持介质的小尺寸将有助于在偏远地区或资源匮乏的环境中运输和使用测定。在一些情况下,壳体的长度不超过30 cm、25cm、20cm、15cm、10cm或5cm。在一些情况下,壳体的长度至少为1cm、5cm、10cm、15cm、20cm、25cm或30cm。在一些情况下,壳体的宽度不超过30cm、25cm、20cm、15cm、10cm、 5cm、4cm、3cm、2cm或1cm。在一些情况下,壳体的宽度至少为1cm、2cm、3cm、4cm、5cm、10cm、15cm、20cm、25cm或 30cm。在一些情况下,壳体的高度不超过10cm、9cm、8cm、7cm、 6cm、5cm、4cm、3cm、2cm或1cm。在一些情况下,壳体的高度至少为1cm、2cm、3cm、4cm、5cm、6cm、7cm、8cm、9cm 或10cm。通常,壳体为矩形。
[0447]
壳体可以包括多于一个器件。壳体可以包含包覆成型件。壳体可以将腔室、通道、隔室或阀与周围环境密封。壳体可以包含可密封材料,例如能够激光粘合的聚碳酸酯。壳体可以包含刚性材料。壳体可以包含柔性材料。壳体可以包含连接器或适配器。一组连接器或适配器可以具有严格公差。一组连接器或适配器可以具有不严格公差。
[0448]
在一些情况下,壳体在上盖的外表面上提供了额外的信息,以便于识别测试类型、可视化检测区域和分析结果。外壳上部可具有识别标签,包括但不限于条形码、qr码、识别标签或其他可视觉识别的标签。在一些情况下,识别标签由移动装置上的相机成像,并且对图像进行分析以识别正在检验的疾病。检验的正确识别对于准确地可视化和分析结果非常重要。在一些情况下,外壳上部具有基准标记,以使检测区域定向,以将阳性对照斑点和检
测斑点区分开。在一些情况下,外壳上部有一个颜色参考指南。当使用颜色参考指南对检测区域成像时,可以将使用基准标记定位的检测斑点与阳性对照斑点和颜色参考指南进行比较,以确定检测斑点的各种图像特性,例如斑点的颜色、颜色强度和大小。在一些情况下,颜色参考指南有红色、绿色、蓝色、黑色和白色。在一些情况下,与颜色参考指南中至少两种参考颜色进行比较,可以将检测斑点的图像归一化为颜色参考指南中的至少一种参考颜色,并生成检测斑点的值。有时,与至少两种参考颜色的比较是与标准参考比例尺的比较。在一些情况下,检测斑点的图像在一些情况下在分析之前经历变换或滤波。对检测斑点的图像特性的分析可以提供有关测定所针对的靶核酸的存在或不存在以及与靶核酸相关的疾病的信息。在一些情况下,分析提供了样品中是否存在靶核酸的定性结果。在一些情况下,分析提供了样品中存在的靶核酸水平的半定量或定量结果。可通过在点/孔中设置一组标准并将测试样品与标准范围进行比较来进行定量。一种更为半定量的方法可以通过计算两个点/孔的颜色强度进行比较,并测量一个点/孔是否比另一个更强烈。有时,定量是循环核酸的定量。循环核酸可以包含靶核酸。例如,循环核酸定量的方法包括测定第一等分样品中的循环核酸的靶核酸,测定第二等分样品中的对照核酸,以及通过测量因切割检测核酸而产生的信号来定量第一等分中的靶核酸。有时,循环rna定量的方法包括测定第一等分样品中循环rna的靶核酸,测定第二等分样品中的对照核酸,以及通过测量因切割检测核酸而产生的信号来定量第一等分中的靶核酸靶标。通常,输出包括每秒钟的荧光。有时,反应速率与输出信号和靶核酸浓度呈对数线性关系。在一些情况下,信号输出与靶核酸浓度相关。有时,循环核酸是dna。检测/可视化装置
[0449]
许多检测或可视化装置和方法与本文公开的装置、系统、流体装置、试剂盒和方法一致。例如,检测/可视化方法与本文公开的用于检测样品内靶核酸的流体装置一致,其中流体装置可包括用于样品制备、样品内靶核酸的扩增、与可编程核酸酶混合、检测流体系统本身内可编程核酸酶切割检测核酸产生的可检测信号的多个泵、阀、储器和腔室。例如,流体装置可包括温育和检测腔室或独立检测腔室,其中产生用于检测/可视化的比色、荧光、电化学或电化学发光学信号。有时,为检测而产生的信号是量热、电位、安培、光学(例如荧光、比色等)或压电信号。量热信号通常是切割检测核酸后产生的热量。有时,量热信号是在切割检测核酸后被吸收的热。例如,电位信号是切割检测核酸后产生的电势。安培信号可以是切割检测核酸后产生的电子运动。通常,信号是光学信号,例如比色信号或荧光信号。例如,光学信号是在检测核酸切割之后产生的光输出。有时,光学信号是切割检测核酸前后的吸光度的变化。通常,压电信号是切割检测核酸前后的质量变化。有时,检测核酸是蛋白质-核酸。通常,蛋白质-核酸是一种酶-核酸。如下所述,检测/可视化可以使用各种方法进行分析。来自一个完整测定的检测区域的结果可以以各种方式可视化和分析。在一些情况下,检测区域中的阳性对照斑点和检测斑点是肉眼可见的,并且用户可以读取结果。在一些情况下,通过成像装置使检测区域中的阳性对照斑点和检测斑点可视化。通常,成像装置是数码相机,例如移动装置上的数码相机。移动装置可以具有软件程序或移动应用程序,其可以捕获支持介质的图像、识别正在执行的分析、测定检测区域和检测斑点、提供检测斑点的图像特性、分析检测斑点的图像特性并提供结果。替代地或组合地,成像装置可以捕获荧光、紫外(uv)、红外(ir)或可见波长信号。成像装置可以具有激发源以提供激发能量并捕获发射
的信号。在一些情况下,激发源可以是相机闪光灯和任选的滤光器。在一些情况下,成像装置与放置在支持介质上的成像盒一起使用,以产生暗室来改善成像。成像盒可以是在成像之前可以装入成像装置的纸板盒。在一些情况下,成像盒具有光学透镜、反射镜、滤光器或其他光学元件,以帮助产生更聚焦的激发信号或捕获更聚焦的发射信号。通常,成像盒和成像装置是小型的、手持的和便携式的,以便于在远程或资源匮乏的环境中运输和使用测定。
[0450]
在一些情况下,检测或可视化可以包括通过二极管产生光。在一些情况下,二极管可以产生可见光。在一些情况下,二极管可以产生红外光。在一些情况下,二极管可以产生紫外光。在一些情况下,二极管可以产生不同波长或光谱的光。二极管可以产生宽光谱或窄光谱的光。二极管可以产生覆盖大部分可见光谱的白光。二极管可以产生特定波长的光(例如,大体上gaussian或lorentzian波长vs围绕特定波长为中心的强度分布)。在一些情况下,二极管产生的光的带宽可以定义为类gaussian或类lorentzian带的半高强度全宽。一些二极管产生具有窄发射带宽的光。二极管可以产生小于1nm带宽的光。二极管可以产生小于5nm带宽的光。二极管可以产生小于10nm带宽的光。二极管可以产生小于20nm带宽的光。二极管可以产生小于 30nm带宽的光。二极管可以产生小于50nm带宽的光。二极管可以产生小于100nm带宽的光。二极管可以产生小于150nm带宽的光。二极管可以产生小于200nm带宽的光。
[0451]
在一些情况下,检测或可视化可以包括通过二极管(例如,光电二极管)进行的光检测。二极管产生的电流可用于确定吸收光的特性,包括偏振、波长、强度、行进方向、原点或其任何组合。在一些情况下,检测或可视化可以包括通过相机(例如,电荷耦合器件(ccd) 检测器)或金属氧化物半导体(mos)探测器)进行的光检测。检测器(例如,光电二极管、ccd检测器或mos检测器)可以被配置成检测光的带宽。在一些情况下,检测器检测到的光的带宽可以定义为类gaussian或类lorentzian带的半高强度全宽。在一些情况下,由检测器检测到的光的带宽可因位于样品和检测器之间的发射滤光器而变窄。发射滤光器可以是长通滤光器。发射滤光器可以是带通滤光器。发射滤光器可以是陷波滤光器。在一些实施方案中,检测器检测到的光的带宽可以小于约300nm、小于约200nm、小于约100nm、小于约75nm、小于约50nm、小于约40nm、小于约30nm、小于约20nm、小于约10nm、或小于约5nm。
[0452]
在一些情况下,二极管阵列可用于激发和检测来自样品的荧光。在一些情况下,装置可以包括发光二极管和检测器二极管,其定位成照亮和检测来自样品的特定部分的光。在一些情况下,装置可以包括发光二极管和检测器二极管,其定位成照亮和检测来自特定样品隔室或腔室的光。
[0453]
本文所述的测定可通过移动应用程序(app)或软件程序可视化和分析。使用应用程序或程序的图形用户界面(gui),个体可以使用移动装置上的相机拍摄支持介质的图像,包括壳体上的检测区域、条形码、参考色标和基准标记。程序或应用程序读取测试类型的条形码或可识别标签,定位基准标记以定向样品,读取可检测信号,与参考色标比较,并确定靶核酸的存在或不存在,这指示存在导致疾病的基因、病毒或药剂。移动应用程序可以将测试结果呈现给个体。移动应用程序可以将测试结果存储在移动应用程序中。移动应用程序可以与远程设备通信并传输测试结果的数据。测试结果可以由另一个体(包括医疗专业人员)从远程设备远程查看。远程用户可以访问结果,并使用这些信息来建议治疗、干预和清理环境的操作。
制备
[0454]
支持介质可以用多种材料和试剂来组装。试剂可被分配或涂覆到支持介质的材料的表面上。支持介质的材料可以层压到背衬板上,背衬板可以为单片式的或被切割成单独的测试条。该装置可通过完全手动、批量式处理;或完全自动化、在线连续处理;或两种处理方法的组合来制造。批量处理方法可以从用于支持介质的每种材料的片材或卷材开始。支持介质的各个分区可单独处理用于分配和干燥,并且最终支持介质可用独立制备的分区组装并切割。与设备成本较高、自动化程度较高的在线处理相比,批量处理方案可能具有较低的设备成本,并且人工成本较高。在一些情况下,由于减少了资本投资,批量处理可能是少量生产的首选。在一些情况下,由于缩短了生产时间,自动化在线处理可能是大量生产的首选。这两种方法都可以扩展到生产级别。
[0455]
在一些情况下,使用各种仪器(包括带有分配器的xyz方向运动系统、浸渍罐、干燥炉、手动或半自动层压机,以及用于将卷材料或板料切割到适当长度和宽度以进行层压的切割方法)来制备支持介质。为了分配缀合物分区的缀合物结合分子以及检测分区的捕获分子,可以使用带有分配器的xyz方向运动系统。在一些实施方案中,分配器可以通过接触方法或非接触方法进行分配。
[0456]
在自动化或半自动化制备支持介质时,支持介质可由每个分区的膜的卷材制备,这些膜的卷材按序排布成最终组装顺序,并从卷材中展开。例如,膜可以从左至右从样品垫区域排布到收集垫区域,其中一个膜对应于支持介质上的一个区域,所有膜都可以排布到粘合卡纸上。分配器将试剂、缀合物、检测分子和膜的其他处理剂放置到膜上。所分配的流体在低湿度室内通过热或冷冻干燥将分配的液体干燥到膜上,以稳定分配的分子。将膜切成条,放入壳体中并包装。流体装置中靶核酸的检测
[0457]
本文公开了用于检测生物样品中的感兴趣的靶核酸的各种流体装置。下文详细描述的流体装置可用于监测样品中靶核酸与可编程核酸酶的反应,从而允许检测所述靶核酸。本文公开的所有样品和试剂与下文公开的流体装置相容。任何可编程核酸酶例如本文所述的任何 cas核酸酶都可与下文公开的流体装置相容使用。本文公开的支持介质和壳体也可与下文公开的流体装置相容使用。如贯穿本公开内容所描述的多路复用检测可以在本文公开的流体装置内进行。本文公开的用于检测和可视化的组合物和方法也相容于用于下文描述的流体系统。
[0458]
在下文描述的流体系统中,可以监测任何可编程核酸酶(例如 crispr-cas)反应。例如,本文公开的任何可编程核酸酶可用于切割报道分子以产生检测信号。在一些情况下,可编程核酸酶是cas13。有时,cas13是cas13a、cas13b、cas13c、cas13d或cas13e。在一些情况下,可编程核酸酶是mad7或mad2。在一些情况下,可编程核酸酶是cas12。有时,cas12是cas12a、cas12b、cas12c、cas12d 或cas12e。在一些情况下,可编程核酸酶是csm1、cas9、c2c4、c2c8、 c2c5、c2c10、c2c9或casz。有时,csm1也称为smcms1、micms1、 obcms1或sucms1。有时cas13a也称为c2c2。有时,casz也称为 cas14a、cas14b、cas14c、cas14d、cas14e、cas14f、cas14g或cas14h。有时,可编程核酸酶是v型crispr-cas系统。在一些情况下,可编程核酸酶是vi型crispr-cas系统。有时,可编程核酸酶是iii型 crispr-cas系统。在一些情况下,可编程核酸酶来自以下至少一种:沙氏纤毛菌(leptotrichia shahii,
lsh)、斯氏李斯特杆菌(listeria seeligeri,lse)、口腔纤毛菌(leptotrichia buccalis,lbu)、韦德纤毛菌(leptotrichia wadeu,lwa)、荚膜红细菌(rhodobacter capsulatus, rca)、半纤维素分解贺氏菌(herbinix hemicellulosilytica,hhe)、浅红慢生盐场菌(paludibacter propionicigenes,ppr)、毛螺科菌 (lachnospiraceae bacterium,lba)、直肠真杆菌([eubacterium] rectale,ere)、纽约尔肯氏利斯特氏菌(listeria newyorkensis,lny)、氨基梭菌(clostridium aminophilum,cam)、普雷沃菌属(prevotellasp.,psm)、犬咬嗜二氧化碳菌(capnocytophaga canimorsus,cca)、毛螺科菌(lachnospiraceae bacterium,lba)、动物溃疡伯格菌 (bergeyella zoohelcum,bzo)、中间普雷沃菌(prevotella intermedia, pin)、颊普雷沃菌(prevotella buccae,pbu)、阿利斯泰尔斯氏菌属 (alistipes sp.,asp)、鸭疫里默氏杆菌(riemerella anatipestifer,ran)、桔红色普雷沃菌(prevotella aurantiaca,pau)、解糖普雷沃菌 (prevotella saccharolytica,psa)、中间普雷沃菌(prevotella intermedia, pin2)、犬咬嗜二氧化碳菌(capnocytophaga canimorsus,cca)、古拉斑单胞菌(porphyromonas gulae,pgu)、普雷沃菌属(prevotella sp., psp)、牙龈卟啉单胞菌(porphyromonas gingivalis,pig)、中间普雷沃菌(prevotella intermedia,pin3)、意大利肠球菌(enterococcusitalicus,ei)、唾液乳杆菌(lactobacillus salivarius,ls)或者嗜热栖热菌(thermus thermophiles,tt)。有时,cas13至少是以下之一: lbucas13a、lwacas13a、lbacas13a、hhecas13a、pprcas13a、erecas13a、 camcas13a或lshcas13a。
[0459]
用于检测流体装置内的样品中的靶核酸的方法的工作流程可以包括样品制备、核酸扩增、与可编程核酸酶温育和/或检测(读出)。图1示出了说明可编程核酸酶反应的工作流程的示意图。工作流程中示出的步骤1是样品制备,工作流程中示出的步骤2是核酸扩增。工作流程中示出的步骤3是可编程核酸酶温育。工作流程中示出的步骤4是检测(读出)。非必要的步骤示出为椭圆形的圆。如果可编程核酸酶活性的温育和检测在同一腔室内,则步骤1和2是任选的,步骤 3和4可以同时进行。样品制备和扩增可以在本文所述的流体装置内进行,或者可替代地,可以在引入流体装置之前进行。如上所述,任何核酸扩增的样品制备是任选的,并且可以被排除。在进一步情况下,可以顺序(一个接一个)或同步(同时)执行可编程核酸酶反应的温育和检测(读出)。在一些实施方案中,样品制备和/或扩增可以在第一流体装置内进行,然后可以将样品转移至第二流体装置以进行步骤 3和4,以及任选地,进行步骤2。
[0460]
与本文提供的组合物和方法相容的工作流程和系统包括一锅法反应(one-pot reaction)和两锅法反应(two-pot reaction)。在一锅法反应中,扩增、逆转录、扩增和逆转录、或扩增和体外转录以及检测可以在一个腔室中同时进行。换句话说,在一锅法反应中,逆转录、扩增和体外转录的任何组合可以在与检测相同的反应中进行。在两锅法反应中,逆转录、扩增和体外转录的任何组合可以在第一反应中进行,然后在第二个反应中进行检测。一锅法或两锅法反应可以在本文公开的装置的任何腔室中进行。
[0461]
用于样品制备的流体装置可以称为过滤装置。在一些实施方案中,用于样品制备的过滤装置类似于注射器,或者包括与注射器相似的功能元件。例如,用于样品制备的过滤装置的功能元件包括用于收集液体样品的窄尖端。液体样品可以包括血液、唾液、尿液或任何其他生物液体。液体样品还可以包括液体组织匀浆。用于收集液体样品的尖端可以由玻
璃、金属、塑料或其他生物相容性材料制成。尖端可以用玻璃毛细管代替,玻璃毛细管可以用作计量设备,以用于计量添加到流体装置下游的生物样品的量。对于一些样品,例如血液,毛细管可能是样品制备所需的唯一流体装置。用于样品制备的过滤装置的另一个功能性元件可以包括通道,该通道可以携带从nl到ml的体积,含有与该过程下游的可编程核酸酶反应相容的裂解缓冲液。通道可以由金属、塑料或其他生物相容性材料制成。该通道可以足够大以容纳整个粪便、口腔、鼻或其他生物样品收集拭子。过滤装置可以进一步包含试剂溶液,该溶液将裂解每种类型的样品中的细胞并释放核酸,以使可编程核酸酶可接近它们。溶液的活性成分可以是促溶剂、去污剂、盐,并且可以具有高重量克分子渗透压浓度、离子强度和ph 值。促溶剂或离液剂是破坏诸如蛋白质、dna或rna的大分子中的三维结构的物质。一个实例方案包括4m异硫氰酸胍、25mm柠檬酸钠、2h20、0.5%(w/v)十二烷基肌氨酸钠和0.1mβ-巯基乙醇),但也可以使用不同细胞靶标的许多商业缓冲液。碱性缓冲液也可用于具有硬壳的细胞,特别地用于环境样品。诸如十二烷基硫酸钠(sds) 和十六烷基三甲基溴化铵(ctab)的去污剂也可用于化学裂解缓冲液。除前述的化学诱导的细胞裂解外,细胞裂解还可通过物理、机械、热或酶方法来执行。根据样品的类型,设备可以包括更复杂的结构,例如纳米级倒钩、纳米线、装置的单独腔室中的超声处理能力、集成激光器、集成加热器(例如珀耳帖型加热器或薄膜平面加热器)和/ 或用于电裂解的微毛细管探针。本文描述的任何实例都可以用于该工作流程。例如,样品可以包括从正在测试目标状况的受试者中收集的液体样品。图2示出了用于样品制备的示例性流体或过滤装置,其可以在图1的工作流程示意图的步骤1中使用。该图中示出的样品制备流体装置可以处理不同类型的生物样品:手指刺血、尿液或具有粪便、面颊或其他收集物的拭子。
[0462]
流体装置可以用于执行图1的步骤2-4中(核酸扩增、可编程核酸酶反应培养、检测(读出))的任何一个或其任何组合。图3示出了用于具有荧光或电化学读出的可编程核酸酶反应的示例性流体装置,其可用于图1的工作流程示意图的步骤2至步骤4。此图显示该装置进行三次重复的图1的工作流程示意图的步骤2至4。顶部是该流体装置的一种变型,其执行可编程核酸酶反应温育和检测(读出) 步骤,但不进行扩增。中间示出了所述流体装置的另一种变型,包括具有扩增的单腔室反应。底部示出了所述流体装置的另一种变型,包括具有扩增的双腔室反应。图4示出了概括了可用于检测反应的荧光和电化学过程的分解图。
[0463]
流体装置可以包括多个腔室和腔室类型。流体装置可以包括多个腔室,这些腔室被配置成容纳具有试剂的样品并且处于有助于特定类型反应的条件下。这种腔室可以设计成便于检测反应或反应物质 (例如,通过具有透明表面以便可以通过外部荧光计监测腔室的内容物,或通过具有能够进行电位分析的电极)。流体装置可以包括扩增腔室,其可以被设计成在适合扩增反应的条件(例如,温度)下容纳样品和试剂。流体装置可以包括检测腔室,其可以被设计成在适合检测反应(例如,比色反应或detectr反应)的条件下容纳具有试剂的样品。流体装置还可以包括被设计用于储存或转移试剂的腔室。例如,流体装置可以包括被设计用于容纳用于扩增反应(例如,lamp) 的试剂的扩增试剂腔室或检测试剂腔室,其被设计用于保持能够检测是否存在物质的反应(例如,detectr反应)的试剂。流体装置可以包括配置用于多种目的的腔室(例如,腔室可配置用于储存试剂,容纳用于两种不同类型反应的两种类型的样品,并有助于荧光检测)。
[0464]
流体装置可以包括样品入口(术语“样品入口”在本文中可与样品入口端口和样品
收集端口互换使用),其通向流体装置内的内部空间,例如腔室或流体通道。样品入口可以通向流体装置内的腔室。样品入口可以能够密封。样品入口可以被密封,从而防止流体通过样品入口。在一些情况下,样品入口围绕被设计用于输送样品的第二装置密封,从而将样品入口与周围环境密封。例如,样品入口可以能够围绕拭子或注射器密封。样品入口还可以被配置成容纳以下:盖或覆盖或密封样品入口的其他机件。样品入口可以包括可弯曲或可破裂的部件。例如,样品入口可以包括在样品插入时破裂的密封件。在一些情况下,样品入口内的密封件在破裂时释放试剂。样品入口可以包括多个腔室或隔室。例如,样品入口可以包括由可破裂的塑料密封件隔开的上隔室和下隔室。样品插入时密封件可破裂,将内容物(例如,裂解缓冲液或扩增缓冲液)从上部容器释放至下部容器中,它可以与样品混合并洗脱至流体装置内的单独隔室(例如样品隔室)中。
[0465]
在一些实施方案中,流体装置可以是气动装置。气动装置可包括通过一个或多个气动阀连接到一个或多个检测腔室的一个或多个样品腔室。任选地,气动装置还可包括在一个或多个样品腔室与一个或多个检测腔室之间的一个或多个扩增腔室。一个或多个扩增腔室可通过一个或多个气动阀连接到一个或多个样品腔室和一个或多个检测腔室。气动阀可以由pdms或任何其他合适的材料制成。气动阀可以包括垂直于微流体通道的通道,该微流体通道连接腔室,且当阀打开时允许流体在腔室之间流过。在一些实施方案中,当通过垂直于微流体通道的通道施加气压时,通道向下偏转。在一些实施方案中,流体装置可以是滑动阀装置。滑动阀装置可以包括具有一个或多个通道的滑动层和具有一个或多个样品腔室和一个或多个检测腔室的固定层。任选地,固定层可以进一步包括一个或多个扩增腔室。在一些实施方案中,滑动层为上层并且固定层为下层。在其他实施方案中,滑动层为下层并且固定层为上层。滑动阀装置可以进一步包括具有与样品腔室中的开口对齐的开口的一个或多个侧通道,具有与扩增腔室中的开口对齐的开口的侧通道,或具有与检测腔室中的开口对齐的开口的侧通道。在一些实施方案中,侧通道与混合腔室连接以允许流体在腔室之间转移。在一些实施方案中,滑动阀装置包括用于在装置中混合、抽吸和分配流体的气动泵。
[0466]
在一些实施方案中,流体装置可以包括滑动阀。滑动阀可以能够采用多个位置,这些位置连接装置中的不同通道或隔室。在一些情况下,滑动装置包括可以同时连接多个不同通道或隔室的多组通道。例如,包括10个扩增腔室、10个试剂腔室和1个样品腔室的装置可以包括滑动阀,该滑动阀可以采用通过10个单独的通道将样品腔室与10个扩增腔室连接的第一位置,以及可以将10个扩增腔室与10 个试剂腔室单独连接的第二位置。滑动阀可以能够通过装置或计算机进行自动控制。滑动阀可以包括传输流体通道,其可以具有在滑动阀处于第一位置时对第一腔室或流体通道开放的第一端和被阻塞的第二端,并且可以具有在滑阀处于第二位置时被阻塞的第一端和向第二腔室或流体通道开放的第二端。滑动阀可以被设计成将来自两个或更多个腔室或通道的流动组合成单个腔室或通道。滑动阀可以被设计成将来自单个腔室或通道的流动分成两个或更多个单独的腔室或流体通道。
[0467]
芯片(也称为流体装置)可以由多种不同的材料制成。可以使用的示例性的材料包括塑料聚合物例如聚甲基丙烯酸酯(pmma)、环烯烃聚合物(cop)、环烯烃共聚物(coc)、聚乙烯(pe)、高密度聚乙烯(hdpe)、聚丙烯(pp);玻璃;和硅。芯片的特征件可以通过各种工艺来制造。例如,特征件可以(1)使用注塑成型进行压花,(2)使用计算机数控(cnc)微加工或非接触式激光钻孔 (借助于co2激光源)进行微铣削或微雕刻;(3)增材制造和/或(4) 光刻方
法。芯片可以包括热隔绝芯片不同部分的材料或材料组合(例如,两个流体通道或反应腔室可以通过在它们之间插入材料来热隔绝)。
[0468]
设计可以包括由多个泵操作的多个输入端口。例如,该设计可以包括由三(3)个泵操作的多达三(3)个输入端口,在图3标记为p1-p3。这些泵可以通过使用低压或高压的外部注射泵来操作。泵可以是无源的和/或有源的(气动的、压电的、布莱叶盲文针的、电渗的、声学的、气体渗透的或其他)。
[0469]
这些端口可以连接到气压泵,可以将空气或气体泵入微流体通道中,以控制流体注入到流体装置。至少三个储器可以连接到装置,每个储器包含以下缓冲液:(1)样品,其可以是包含在单独的流体装置中处理过的纯化核酸的溶液,或纯样品(血液、唾液、尿液、粪便和/或痰液);(2)扩增标准混物,其根据所使用的方法而变化,其中该方法可以包括环介导的等温扩增(lamp)、链置换扩增(sda)、重组酶聚合酶扩增(rpa)、解旋酶依赖性扩增(hda)、多置换扩增(mda)、滚环扩增(rca)和基于核酸序列的扩增(nasba)、转录介导的扩增(tma)、环状解旋酶依赖性扩增(chda)、指数扩增反应(expar)、连接酶链反应(lcr)、简单方法扩增rna 靶标(simple method amplifying rna target,smart)、单引物等温扩增(spia)、铰链引发的引物依赖性核酸扩增(hip)、切口酶扩增反应(near)或改进的多置换扩增(imda)中的任一种;和(3) 预复合的可编程核酸酶混合物,其包括一个或多个可编程核酸酶和引导寡核苷酸。核酸扩增的方法也可以是聚合酶链反应(pcr),其包括不同水平的温育温度循环,因此不被定义为等温。通常,用于核酸扩增的试剂包括重组酶、寡核苷酸引物、单链dna结合(ssb)蛋白和聚合酶。有时,样品的核酸扩增提高了检测靶核酸中测定的灵敏度、特异性或准确性中的至少一种。在一些情况下,在支持介质上的核酸扩增区中进行核酸扩增。替代地或组合地,核酸扩增在试剂腔室中执行,并且将得到的样品施加到支持介质上。有时,核酸扩增是等温核酸扩增。核酸酶与指导探针(可编程核酸酶)和报告探针的复合体形成可以在芯片外发生。在流体路径的末端描绘了用于输出最终反应产物的附加端口,该附加端口由与p1-p3所述的类似的泵操作。因此,可以收集反应产物以供另外的处理和/或表征,例如测序。
[0470]
装置可以包括多个腔室、流体通道和阀。装置可以包括多种类型的腔室、流体通道、阀或其任何组合。装置可以包括不同数量的腔室、流体通道和阀。例如,装置可以包括一个样品腔室、将样品腔室与10个单独的扩增反应腔室连接的旋转阀,以及控制从10个扩增反应腔室流入30个单独的检测腔室的两个滑动阀。旋转阀可以连接2 个或更多个腔室或流体通道。旋转阀可以连接3个或更多个腔室或流体通道。旋转阀可以连接4个或更多个腔室或流体通道。旋转阀可以连接5个或更多个腔室或流体通道。旋转阀可以连接8个或更多个腔室或流体通道。旋转阀可以连接10个或更多个腔室或流体通道。旋转阀可以连接15个或更多个腔室或流体通道。旋转阀可以连接20个或更多个腔室或流体通道。
[0471]
流体装置可以包括多个通道。流体装置可以包括多个通道,这些通道包括多个尺寸和特性。流体装置可以包括具有相同长度的两个通道。流体装置可以包括提供相同阻力的两个通道。流体装置可以包括两个相同的通道。
[0472]
流体装置可以包括毫通道(millichannel)。毫通道的宽度可以为100至200mm。毫通道的宽度可以为50至100nm。毫通道的宽度可以为20至50nm。毫通道的宽度可以为10至20nm。毫通道的宽度可以为1至10nm。流体装置可以包括微通道。微通道的宽度可以为800至
990μm。微通道的宽度可以为600至800μm。微通道的宽度可以为400至600μm。微通道的宽度可以为200至400μm。微通道的宽度可以为100至200μm。微通道的宽度可以为50至100μm。微通道的宽度可以为30至50μm。微通道的宽度可以为20至30μm。微通道的宽度可以为10至20μm。微通道的宽度可以为5至10μm。微通道的宽度可以为1至5μm。流体装置可以包括纳米通道。纳米通道的宽度可以为800至990nm。纳米通道的宽度可以为600至800 nm。纳米通道的宽度可以为400至600nm。纳米通道的宽度可以为 200至400nm。纳米通道的宽度可以为1至200nm。通道可以具有相当的高度和宽度。通道的宽度可以比高度更宽,或宽度比高度更窄。通道的宽度可以是其高度的1.1、1.2、1.3、1.4、1.5、2、3、4、5、 10、20、30、40、50、100、500、1000或更多倍。通道的宽度可以是其高度的0.9、0.8、0.7、0.6、0.5、0.25、0.1、0.05、0.01、0.005、 0.001倍。通道的宽度可以小于其高度的0.001倍。通道可以具有不统一的尺寸。通道可以在沿其长度的不同点具有不同的尺寸。通道可以分成2个或更多个单独的通道。通道可以是直的,或可以具有弯曲、曲线、转弯、角度或非线性形状的其他特征。通道可以包括一个回路或多个回路。
[0473]
流体装置可以包括阻力通道。相对于流体装置内的其他通道,阻力通道可以是具有慢流速的通道。相对于流体装置内的其他通道,阻力通道可以是具有低体积流速的通道。相对于流体装置中的其他通道,阻力通道可以为样品流动提供更大的阻力。阻力通道可以防止或限制样品回流。阻力通道可以通过限制湍流来防止或限制装置内的多个样品之间的交叉污染。阻力通道可有助于流体装置内的流动稳定性。阻力通道可以限制流体装置的多个部分之间的流速差异。阻力通道可以稳定装置内的流速,并使随时间的流动变化最小化。
[0474]
流体装置中的液体流动可以用多个微型阀来控制。例如,该流体装置中的液体流量可以使用多达四(4)个微型阀来控制,在图3标记为v1-v4。这些阀可以是电动微型阀、气动微型阀、真空微型阀、毛细管微型阀、夹管微型阀(pinch microvalve)、相变微型阀、爆破微型阀。
[0475]
从各p1-p4中流入和流出流体通道的流量通过标记为v1-v4的阀来控制。根据装置的整体尺寸,泵入端口的流体的量可能从nl到 ml不等。
[0476]
在如图3中示出的装置2.1版中,无需扩增。分别在p1和p2 添加样品和预复合的可编程核酸酶混合物后,试剂可以在蛇形通道 s1中混合,然后通向腔室c1,在腔室c1混合物可以在所需的温度和时间下温育。图4中描述了可以在c1中同时进行读出。c1中的温度调节可使用由例如卡普顿(kapton)或其他类似材料制造的薄膜平面加热器来进行,并由比例积分微分(pid)控制。
[0477]
在如图3所示的装置2.2版中,分别在p1、p2和p3中添加样品、扩增混合物以及预复合的可编程核酸酶混合物后,试剂可以在蛇形通道s1中混合,然后通向腔室c1,在腔室c1,根据所用方法的条件,混合物在有效扩增所需的温度和时间下温育。图4中描述了可以在c1中同时进行读出。如前所述,可以实现温度调节。
[0478]
在如图3所示的装置2.3版中,扩增和可编程核酸酶反应在单独的腔室中进行。预复合的可编程核酸酶混合物使用泵p3从c1泵送到扩增的混合物中。流体流量由阀v3控制,并引入到蛇形混合器s2 中,然后在腔室c2中温育所需温度,例如在37℃下温育90分钟。
[0479]
在检测步骤(如图1的工作流程图中的步骤4所示的)中, cas-grna复合体结合至来自扩增样品的其匹配核酸靶标,并被激活为非特异性核酸酶,该酶切割基于核酸的报道
分子以产生信号读出。在不存在匹配核酸靶标的情况下,cas-grna复合体不切割基于核酸的报道分子。cas反应的实时检测可以通过以下三种方法实现:(1) 荧光,(2)电化学检测,和(3)电化学发光。下面描述所有三种方法,且这些过程的示意图如图4所示。信号的检测可以通过多种方法来实现,作为非限制性示例,该方法可以检测量热信号、电位信号、电流信号、光学(例如荧光、比色等)信号或压电信号。
[0480]
图4示出了可以与流体装置(例如,图3的流体装置)结合使用的读出过程的示意图,包括(a)荧光读出和(b)电化学读出。切割的报告寡核苷酸发出的荧光可以使用位于检测腔室和温育腔室正上方的荧光计来监测。荧光计可以是可商购的仪器、移动电话或智能电话的光学传感器或者是定制的光学阵列,该光学阵列包括荧光激发装置,例如co2、其他、激光和/或发光二极管(led);以及荧光检测装置,例如光电二极管阵列、光电晶体管或其他。
[0481]
荧光检测和激发可以是多路复用的,例如,其中荧光检测包括在温育腔室和检测腔室(c1或c2)中激发和检测的一种以上的荧光团。荧光计本身可以是多通道的,其中检测和激发不同波长的光,也可以串联使用一个以上的荧光计,并且它们在温育腔室和检测腔室 (c1和c2)上方的位置可以通过机械装置来改变,例如使用微控制器或宏控制器和致动器(电动、电子和/或压电)的机动化机构。
[0482]
本文描述了两种电化学检测变型,在温育腔室和检测腔室(c1 或c2)中使用集成的工作电极、对电极和参比电极:
[0483]
信号增加。由可编程核酸酶催化的切割反应的进程可以使用链霉亲和素-生物素偶联反应来检测。检测腔室和温育腔室的顶表面可以用与生物素部分缀合的核酸分子(ssrna、ssdna或ssrna/dna 杂合分子)功能化。检测腔室和温育腔室的底表面用作电极,包括工作区、参比区和对区,由碳、石墨烯、银、金、铂、掺硼金刚石、铜、铋、钛、锑、铬、镍、锡、铝、钼、铅、钽、钨、钢、碳钢、钴、氧化铟锡(ito)、氧化钌、钯、镀银铜、碳纳米管或其他金属制成(或丝网印刷)。检测腔室和温育腔室的底表面可以涂覆有链霉亲和素分子。在不存在任何生物素分子的情况下,通过连接的电化学分析仪(商业或定制)测得的电流是低的。当预复合的可编程核酸酶与扩增的靶标流在检测腔室和温育腔室中混合,并在较高温度(例如37℃)下激活时,单链核酸(ssna)接头的切割会释放出生物素分子,该生物素分子可扩散到检测腔室和温育腔室的、涂覆链霉亲和素的底表面上。由于生物素和链霉亲和素分子的相互作用,电流的增加被耦合的电化学分析仪读取。
[0484]
在一些情况下,报道分子切割可以增加电化学信号(例如,来自方波或循环伏安图的电位信号)的强度。报道分子切割可以增加报道分子中电活性部分的扩散常数,这可以导致电化学信号的增加。因此,在一些情况下,电化学信号的增加与跨侧向的报道分子切割程度成正比。
[0485]
一些detectr实验可以对切割的报道分子浓度的微小变化具有灵敏度,从而可以检测或区分低浓度的靶核酸。电化学detectr 测定(利用电化学检测的detectr测定)可以能够检测小于100nm 的靶核酸。电化学detectr测定可以能够检测小于10nm的靶核酸。电化学detectr测定可以能够检测小于1nm的靶核酸。电化学 detectr测定可以能够检测小于100pm的靶核酸。电化学 detectr测定可以能够检测小于10pm的靶核酸。电化学detectr 测定可以能够检测小于1pm的靶核酸。电化学detectr测定可以能够检测小于100fm的靶核酸。
电化学detectr测定可以能够检测小于50fm的靶核酸。电化学detectr测定可以能够检测小于10 fm的靶核酸。电化学detectr测定可以能够检测小于1fm的靶核酸。在一些情况下,电化学检测可以比荧光检测更灵敏。在一些情况下,使用电化学检测的detectr测定可以比使用荧光检测的 detectr测定具有更低的检测限。
[0486]
在一些情况下,电化学detectr反应可能需要低报道分子浓度。在一些情况下,电化学detectr反应可能需要低报道分子浓度。电化学detectr反应可能需要小于10μm的报道分子。电化学 detectr反应可能需要小于1μm的报道分子。电化学detectr 反应可能需要小于100nm的报道分子。电化学detectr反应可能需要小于10nm的报道分子。电化学detectr反应可能需要小于1 nm的报道分子。电化学detectr反应可能需要小于100pm的报道分子。电化学detectr反应可能需要小于10pm的报道分子。电化学detectr反应可能需要小于1pm的报道分子。
[0487]
除了生物素-链霉亲和素激发之外,还可以使用使用富集的其他类型的信号扩增。非限制性示例是:(1)谷胱甘肽、谷胱甘肽s-转移酶,(2)麦芽糖、麦芽糖结合蛋白,(3)几丁质、几丁质结合蛋白。
[0488]
信号降低。可编程核酸酶切割反应的进程可以通过记录二茂铁 (fc)或其它电活性介体部分所产生的电流的降低来监测,二茂铁(fc) 或其它电活性介体部分与固定在检测腔室和温育腔室的底表面上的核酸分子(ssrna、ssdna或ssrna/dna杂交分子)的单个核苷酸缀合。在不存在扩增靶标的情况下,可编程核酸酶复合体保持无活性,并且记录了由电活性部分引起的高电流。当具有导向物的可编程核酸酶复合体在检测腔室和温育腔室中流动并在37℃下被匹配核酸靶标激活时,可编程核酸酶复合体非特异性降解固定化的fc-缀合的核酸分子。该切割反应减少了电活性分子的数量,因此导致记录电流的降低。
[0489]
电化学检测也可以是多路复用的。这可以通过在检测腔室和温育腔室(c1或c2)中添加一个或多个工作电极来实现。电极可以是普通的,也可以是改进的,如上文的单一电化学检测方法所述。
[0490]
结合光学和电化学读出方法的电化学发光。光学信号可以通过化合物(例如三丙胺(tpa))的发光来产生,该化合物由作为电活性产物(例如,联吡啶钌,[ru(py)3]2 )的氧化产物而产生。
[0491]
多种不同的可编程核酸酶蛋白可以通过以下方式进行多路复用: (1)对于每种蛋白,单独的流体路径(通道的平行性),与相同样品混合,或(2)转换到数字(两相)微流体,其中每个单独的液滴包含单独的反应混合物。液滴可以由水和油的单乳剂或复乳剂来产生。乳剂与可编程核酸酶反应相容,并具有光学惰性。
[0492]
图5示出了用于在比色或电化学/血糖仪读出的情况下的偶联的转化酶/cas反应的示例性流体装置。该图显示了用于使与酶转化酶耦合的cas反应小型化的流体装置。在底部的分解视图中描述了表面修饰和读出过程,包括(a)使用dns或其他化合物的光学读出,以及(b)电化学读出(电化学分析仪或血糖仪)。本文描述了cas反应与酶转化酶(ec 3.2.1.26)或蔗糖酶或β-呋喃果糖苷酶的耦合。该酶催化蔗糖分解为果糖和葡萄糖。
[0493]
以下方法可用于将cas反应的读出与转化酶活性耦合:
[0494]
使用相机、独立式或集成式移动电话光学传感器的比色法。果糖和葡萄糖的量与比色反应有关。两个实例为:(a)3,5-二硝基水杨酸(dns),以及(b)甲月替染料噻唑蓝。颜色
变化可以使用ccd 相机或移动电话的图像传感器来监测。对于这种方法,我们使用图5 中描述的流体装置的变型。改进是使用照相机,而不是c3上方的荧光计。
[0495]
使用常规血糖仪或电化学分析仪的电流分析法。可以使用图3 描述的流体装置的一种变型,例如可以增加一个以上的温育腔室c3。反应方案中增加了一个额外的步骤,该步骤在腔室c2中进行。腔室表面的顶部涂覆有与酶转化酶(inv)缀合的单链核酸。靶标活化的可编程核酸酶的复合体在c2中从寡核苷酸(ssrna、ssdna或 ssrna/dna杂合分子)中切割转化酶,然后转化酶可用于催化泵p4 注入的蔗糖的水解,并由阀v4控制。该混合物在蛇形混合器s3中混合,且在腔室c3中,如前所述,可以电化学比色检测产生的葡萄糖。葡萄糖氧化酶在c3的表面干燥,并催化葡萄糖氧化为过氧化氢和d
‑ꢀ
葡萄糖酸-δ-内酯。
[0496]
许多不同的装置与使用本文公开的方法和组合物检测靶核酸相容。在一些实施方案中,该装置是本文公开的任何微流体装置。在其他实施方案中,该装置是连接至反应腔室的横向流动测定条。在另外的实施方案中,横向流动测试条可以连接到样品制备装置。
[0497]
在一些实施方案中,流体装置可以是气动装置。气动装置可包括通过一个或多个气动阀连接到一个或多个检测腔室的一个或多个样品腔室。任选地,气动装置还可进一步包括在一个或多个样品腔室与一个或多个检测腔室之间的一个或多个扩增腔室。一个或多个扩增腔室可通过一个或多个气动阀连接一个或多个样品腔室和一个或多个检测腔室。气动阀可以由pdms或任何其他合适的材料制成。气动阀可以包括垂直于微流体通道的通道,该微流体通道连接腔室,且当阀打开时允许流体在腔室之间流过。在一些实施方案中,通道在施加正气压或负气压时向下偏转,并且穿过垂直于微流体通道的通道。
[0498]
在一些实施方案中,流体装置可以是滑动阀装置。滑动阀装置可包括具有一个或多个通道的滑动层和具有一个或多个样品腔室和一个或多个检测腔室的固定层。任选地,固定层可以进一步包括一个或多个扩增腔室。在一些实施方案中,滑动层是上层,固定层是下层。在其他实施方案中,滑动层是下层,固定层是上层。在一些实施方案中,上层是由包括聚甲基丙烯酸酯(pmma)、环烯烃聚合物(cop)、环烯烃共聚物(coc)、聚乙烯(pe)、高密度聚乙烯(hdpe)、聚丙烯(pp)的塑料聚合物;玻璃;或硅制成。在一些实施方案中,下层是由包括聚甲基丙烯酸酯(pmma)、环烯烃聚合物(cop)、环烯烃共聚物(coc)、聚乙烯(pe)、高密度聚乙烯(hdpe)、聚丙烯(pp)的塑料聚合物;玻璃;或硅制成。滑动阀装置可进一步包括以下中一个或多个:具有与样品腔室中的开口对齐的开口的侧通道、具有与扩增腔室中的开口对齐的开口的侧通道或具有与检测腔室中的开口对齐的开口的侧通道。在一些实施方案中,侧通道连接到混合腔室,以允许流体在腔室之间转移。在一些实施方案中,滑动阀装置包括用于混合、抽吸和分配装置中的流体的气动泵。
[0499]
气动阀装置。一种特别适合于进行本文所述的detectr反应的微流体装置是一种包括气动阀(也称为“振动阀”)的装置。气动阀可以通过例如来自空气歧管的空气流来关闭和打开。气动阀的打开可以导致包括气动阀的通道的向下偏转,其随后可以向下偏转并封闭包括气动阀的通道下方的微流体通道。这可能导致微流体通道中的流体流动的停止。当空气歧管关闭时,通过包含振动阀的通道的空气流停止,并且包含振动阀的通道下方的微流体通道“打开”,流体可以流过。在一些实施方案中,包括气动阀的通道可以在承载目标流体的微流体通道的上方或下方。在一些实施方案中,包括气动阀的通道可以平行或垂直于承载目标流体的微流体通道。气动阀可以由夹有软硅树脂层的两个硬质热塑性塑料层制
成。
[0500]
与本文公开的组合物和方法相容的一个示例性布局在图55和图55中示出。在一些实施方案中,该装置包括样品腔室和检测腔室,其中该检测腔室通过气动阀流体连接至样品腔室,并且其中该检测腔室包括本公开内容的任何可编程核酸酶。任选地,该装置还可以包括扩增腔室,该扩增腔室在从样品腔室到检测腔室的流体路径之间,通过气动阀连接到样品腔室,并且另外通过气动阀连接到检测腔室。在一些实施方案中,气动阀由pdms或用于形成微流体阀的任何其他材料制成。在一些实施方案中,样品腔室具有用于插入样品的端口。可以使用拭子插入样品。样品腔室可以具有用于裂解样品的缓冲液。样品腔室可以在腔室和通向扩增腔室或检测腔室的流体通道之间具有过滤器。样品腔室可具有用于插入样品的开口。样品可以在样品腔室中温育30秒至10分钟。在此之前,空气歧管可以打开,推动空气通过气动阀,并保持样品腔室、与扩增腔室或检测腔室之间的流体通道关闭。在此阶段,可以关闭空气歧管,使得没有空气流过气动阀,允许微流体通道打开,并允许流体从样品腔室流向下一个腔室(例如,扩增腔室或检测腔室)。在具有扩增腔室的装置中,裂解的样品从样品腔室流入扩增腔室。否则,裂解的样品将从样品腔室流入检测腔室。在此阶段,空气歧管重新打开,以推动空气通过气动阀并封闭微流体通道。扩增腔室中容纳用于扩增样品中的靶核酸,并任选地对样品中的靶核酸进行逆转录的各种试剂。这些试剂可包括正向引物和反向引物、脱氧核苷酸三磷酸、逆转录酶、t7启动子、t7聚合酶或其任何组合。使样品在扩增腔室中温育5分钟至40分钟。如上所述,将扩增的和任选的逆转录的样品移入检测腔室:空气歧管关闭,停止通过气动阀的空气流动并打开微流体通道。检测腔室可包括本文公开的任何可编程核酸酶、具有与靶核酸的一部分反向互补的部分的指导rna,以及本文公开的任何报道分子。在一些实施方案中,检测腔室可以包含多个指导rna。多个指导rna可以具有相同的序列,或者多个指导rna中的一个或多个可以具有不同的序列。在一些实施方案中,多个指导rna具有与靶核酸的一部分反向互补的部分,该部分不同于多个指导rna的第二rna。多个指导rna可以包含至少5个、至少10个、至少15个、至少20个或至少50个指导rna。将样品移入检测腔室后,detectr反应可以进行1分钟至20分钟。在指导rna与靶核酸杂交后,可编程核酸酶被激活并开始并行地切割报道分子,如本公开中其他地方所述,该报道分子具有核酸和能够检测切割的一个或多个分子。该检测腔室可以与用于读出信号的装置对接。例如,在切割时产生比色或荧光学信号的情况下,可以将检测腔室耦合到分光光度计或荧光读取器。在产生电化学信号的情况下,检测腔室可具有连接到读出装置(例如血糖仪)的一至10根金属引线,如图60所示。图59示出了本公开内容的气动阀装置的盒的顶层的示意图,突出了合适的尺寸。该示意图示出了一个2英寸乘1.5英寸的盒。图60示出了本公开内容的气动阀装置的盒的适于电化学尺寸的改进的顶层的示意图。在该示意图中,检测腔室(最右边4个腔室)中示出了三条线。这三条线表示接线(或“金属引线”),该接线在一次性盒中共同模制、3d打印或手动装配以形成三电极系统。电极称为工作电极、对电极和参比电极。电极也可以丝网印刷在盒上。所使用的金属可以是碳、金、铂或银。气动阀装置的主要优点在于,连接装置的各个腔室的气动阀防止了腔室之间的回流,从而减少了污染。防止回流和防止样品污染对于本文所述的应用尤其重要。样品污染可导致假阳性或通常会混淆靶核酸的检测极限。作为另一个实例,本文公开的气动阀对于用于多路复用检测的装置和方法特别有利。在多路复用测定中,其中测定两种或多种靶核酸,避免回流和污染尤其重要。在
多路复用测定中,腔室之间的回流会导致不同的指导核酸或不同可编程核酸酶的交叉污染,并可能导致错误的结果。因此,与其他装置布局相比,设计为最小化或完全避免回流的气动阀装置在执行本文公开的检测方法中特别优越。
[0501]
图55示出了用于detectr测定的气动阀装置布局。图55a 示出了气动阀装置的示意图。移液泵抽吸并分配样品。空气歧管连接到气动泵,以打开和关闭常闭阀。气动装置将流体从一个位置移动到下一位置。与其他装置设计相比,气动阀装置设计具有减少的通道串扰。图55b示出了在图55a所示的气动阀装置中使用的盒的示意图。示出了阀的配置。常闭阀(一个这样的阀用箭头表示)包括在通道顶部上的弹性密封,以在腔室不使用时将每个腔室与系统的其余部分隔离。气动泵根据需要使用空气来打开和关闭阀,以将流体移动到盒内的必要腔室中。图56示出了图55a所示的气动阀装置的阀电路布局。如(i.)所示,将样品置于样品孔中,同时关闭所有阀。样品在样品孔中裂解。如(ii.)所示,通过打开第一振动阀,并使用移液泵将样品吸出,将裂解的样品从样品腔室移至第二腔室。然后,如(iii.)所示,通过关闭第一振动阀并打开第二振动阀,将样品移至第一扩增腔室,在第一扩增腔室样品与扩增混合物混合。如(iv.)所示,样品与扩增混合物混合后,通过关闭第二振动阀并打开第三振动阀将样品移至随后的腔室。如(v.)所示,通过关闭第三振动阀并打开第四振动阀将样品移至 detectr腔室。如(vi.)所示,通过打开和关闭不同系列的振动阀,可以使样品移动通过不同系列的腔室。所需腔室系列中的单个阀的致动防止通道之间的交叉污染。在一些实施方案中,滑动阀装置的表面积为5cm
×
5cm、5
×
6cm、6
×
7cm、7
×
8cm、8
×
9cm、9
×
10cm、10
×
11 cm、11
×
12cm、6
×
9cm、7
×
10cm、8
×
11cm、9
×
12cm、10
×
13cm、 11
×
14cm、12
×
11cm、约30平方厘米、约35平方厘米、约40平方厘米、约45平方厘米、约50平方厘米、约55平方厘米、约60平方厘米、约65平方厘米、约70平方厘米、约75平方厘米、约25平方厘米、约20平方厘米、约15平方厘米、约10平方厘米、约5平方厘米、1至100平方厘米、5至10平方厘米、10至15平方厘米、15 至20平方厘米、20至25平方厘米、25至30平方厘米、30至35平方厘米、35至40平方厘米、40至45平方厘米、45至50平方厘米、 5至90平方厘米、10至0平方厘米、15至5平方厘米、20至10平方厘米或25至15平方厘米。
[0502]
滑动阀装置。一种特别适合于进行本文所述的detectr反应的微流体装置是一种滑动阀装置。滑动阀装置可以具有滑动层和固定层。滑动层可以在顶部,固定层可以在底部。或者,滑动层可以在底部,固定层可以在顶部。在一些实施方案中,滑动阀具有通道。通道可以在一端具有与腔室中的开口交互的开口,通道还可以在另一端具有与侧通道中的开口交互的开口。在一些实施方案中,滑动层具有多于一个的开口。在一些实施方案中,固定层包括样品腔室、扩增腔室和检测腔室。样品腔室、扩增腔室和检测层均可以在腔室的底部具有开口。例如,样品腔室可以具有用于插入样品的开口。当腔室中的开口与通道中的开口对齐时,流体可以从腔室流入通道。进一步地,当通道中的开口随后与侧通道中的开口对齐时,流体可以从通道流入侧通道。侧通道可以进一步流体地连接到混合腔室或端口,其中用于混合流体的仪器(例如,移液泵)插入该端口。开口的对齐可以通过物理移动或自动致动滑动层沿着固定层的长度滑动来实现。在一些实施方案中,上述气动阀可以在任何位置添加至滑动阀装置,以控制流体从一个腔室流入另一个腔室。滑动阀装置也可以具有多层。例如,滑动阀可具有2、3、4、5、6、7、8、9、10或更多层。
[0503]
图46示出了用于detectr测定的布局。顶部示出的是气动泵,其与盒连接。中间示
出的是盒的俯视图,示出了具有储器的顶层。底部示出的是滑动阀,包含样品和指向左侧裂解腔室的箭头,然后是右侧的扩增腔室,更右侧是detect腔室。图57示出了滑动阀装置的示意图。通道的偏移量允许分别抽吸和分配到各孔中,并有助于减轻扩增腔室和相应腔室之间的串扰。图58示出了通过图57所示的滑动阀装置的样品运动的示意图。在初始关闭位置(i.),将样品装载至样品孔中并裂解。然后由仪器致动滑动阀,并使用移液泵将样品装载到每个通道中,移液泵将适当的体积分配到通道中(ii.)。样品通过致动滑动阀输送至扩增腔室,并用移液泵混合(iii.)。来自扩增腔室的样品被抽吸至各通道(iv.),然后通过致动滑动阀和移液泵分配并混合到各 detectr腔室中(v.)。在一些实施方案中,滑动阀装置的表面积为5 cm
×
8cm、5
×
6cm、6
×
7cm、7
×
8cm、8
×
9cm、9
×
10cm、10
×
11cm、 11
×
12cm、6
×
9cm、7
×
10cm、8
×
11cm、9
×
12cm、10
×
13cm、11
×
14 cm、12
×
11cm、约30平方厘米、约35平方厘米、约40平方厘米、约45平方厘米、约50平方厘米、约55平方厘米、约60平方厘米、约65平方厘米、约70平方厘米、约75平方厘米、约25平方厘米、约20平方厘米、约15平方厘米、约10平方厘米、约5平方厘米、1 至100平方厘米、5至10平方厘米、10至15平方厘米、15至20平方厘米、20至25平方厘米、25至30平方厘米、30至35平方厘米、 35至40平方厘米、40至45平方厘米、45至50平方厘米、5至90 平方厘米、10至0平方厘米、15至5平方厘米、20至10平方厘米或 25至15平方厘米。
[0504]
横向流动装置。在一些实施方案中,本公开内容的装置包括腔室和横向流动条。图32-图33示出了用于横向流动条和相应的合适报道分子的特别有利的布局。图32示出了修饰的cas报道分子,其包含结合至fam分子(显示为绿色起点)的生物素-dt(显示为粉红色六边形)的dna接头。图33示出了具有修饰的cas报道分子的mileniahybriddetect条的布局。这种特定的布局在现阳性结果的情况下、通过产生更高的信号来改善测试结果,同时还最小化假阳性。在这种测定布局中,报道分子包括附接在核酸之一的生物素和荧光团。核酸可以与生物素分子直接缀合然后与荧光团缀合,或者与荧光团直接缀合然后与生物素缀合。可以使用其他亲和分子(包括本文所述的亲和分子)来代替生物素。本文公开的任何荧光团也可用于报道分子中。报道分子可以悬浮在溶液中或固定在cas腔室的表面上。或者,报道分子可以固定在反应腔室中的珠粒(例如磁珠)上,其中报道分子通过放置在反应腔室下方的磁铁而保持在适当位置。当报道分子被激活的可编程核酸酶切割时,切割的生物素-荧光团在第一线处累积,其包括链霉亲和素(或其他捕获分子,如谷胱甘肽-s-转移酶、麦芽糖结合蛋白、几丁质结合蛋白)。位于样品垫上并使用追踪缓冲液流到条上的金纳米颗粒涂覆有抗荧光团抗体,允许金纳米颗粒在第一线结合并累积。纳米颗粒另外在第二线累积,该第二线涂覆有抗体(例如,抗兔抗体),该抗体针对涂覆在金纳米颗粒(例如,兔、抗fam)上的抗体。在阴性结果的情况下,报道分子不会被切割,也不会在横向流动条上流动。因此,纳米颗粒仅在第二条线处结合并累积。横向流动条上的多路复用可以通过使用两个报道分子(例如,生物素-fam 报道分子和生物素-dig报道分子)来执行。将抗fam抗体和抗dig 抗体在两个不同区域涂覆到横向流动条上。抗生物素抗体涂覆在金纳米颗粒上。首先从报道分子的核酸产生生物素-dntp,然后缀合荧光团而使得荧光团直接缀合至亲和分子(例如,生物素)。在一些实施方案中,横向流动条包括多层。
[0505]
在一些实施方案中,上述横向流动条可以额外地与样品制备装置连接,如图7和图8所示。图7示出了本公开内容的样品制备装置的各个部分。该图的a部分显示了单个腔室样
品提取装置:(a)插入物固定样品收集装置,并调节样品提取和将样品分配到另一反应装置或检测装置之间的步骤,(b)单个腔室包含提取缓冲液。该图的b部分示出了用在核酸分配时进一步纯化核酸的材料填充分配腔室是一种选项:(a)插入物固定样品收集装置,并调节样品提取和核酸扩增的“阶段”。每组凹槽(红色、蓝色和绿色)与前一组凹槽偏移90
°
,(b) 反应模块包含由基底分隔开的多个腔室,这些腔室允许进行独立的反应。(例如,i.核酸分离腔室,ii.核酸扩增腔室和iii.detectr反应腔室或分配腔室)。每个腔室都有凹槽(黑色),其防止插入物在非故意90
°
转动的情况下进入下一个腔室。前两个腔室可以由在提取和扩增反应之间去除抑制剂的材料隔开。c部分示出了反应/分配腔室的选项:(a)单分配腔室可仅释放提取的样品或提取/扩增提取/扩增 /detectr反应,(b)双分配腔室可释放提取/多重扩增产物,并且(c) 四分配腔室可允许多重扩增反应和单个detectr反应或四个单扩增反应。图8示出了使用样品处理装置的样品工作流程。样品收集装置附接至样品处理装置的插入部(a)。将插入物放入装置腔室中并按压,直到第一止动件(顶部上的下部凸舌与底部上的上部凸舌相遇)(b)。该步骤使样品与核酸提取试剂接触。在适当的时间后,将插入物转动 90
°
(c),然后压下(d)至下一组凹槽。这些动作将样品转移到扩增腔室中。样品收集装置不再与样品或扩增产物接触。在适当温育后,将插入物旋转90
°
(e),然后压下(f)至下一组凹槽。这些动作将样品释放到 detectr(绿色反应)中。再次将插入物转动90
°
(g)并压下(h)以分配反应。
[0506]
阻力通道装置。在一些实施方案中,本公开内容的装置可以是阻力通道、样品计量通道、用于流体流动的阀或其任何组合。图126a、图126b、图127a、图127b、图128a、图128b、图128c、图128d、图129a、图129b、图129c、图129d示出了用于detectr反应的所述微流体盒的示例。在一些实施方案中,盒可以包括扩增腔室、与扩增腔室流体连接的阀、与阀流体连接的检测反应腔室,以及与检测腔室流体连接的检测试剂储器,如图130a所示。在一些实施方案中,装置还可以包括鲁尔滑动适配器,如图131c所示。鲁尔滑动适配器可用于适配用于将样品或试剂输送至装置中的鲁尔锁注射器。微流体装置的一个或多个元件(例如,腔室、通道、阀或泵)可以与微流体装置的一个或多个其他元件流体连接。第一元件可以与第二元件流体连接,使得流体可以在第一元件和第二元件之间流动。第一元件可以通过第三元件与第二元件流体连接,使得流体可以通过第三元件从第一元件流至第二元件。例如,检测试剂腔室可以通过阻力通道与检测腔室流体连接,如图130a所示。
[0507]
装置的腔室(例如,扩增腔室、检测腔室或检测试剂储器)可以通过一个或多个通道与一个或多个另外的腔室流体连接。在一些实施方案中,通道可以是被配置成调节第一腔室和第二腔室之间的流体流动的阻力通道。阻力通道可以在第一腔室和第二腔室之间形成非线性路径。它可以包括限制或混乱流动的特征,例如弯曲、转弯、翼状、 v字形、人字形或其他微结构。与相当长度和宽度的线性通道相比,阻力通道可以减少回流。与具有相当长度和宽度的线性通道相比,阻力通道可以通过需要增加压力来使流体通过通道而起作用。在一些实施方案中,与由相当长度和宽度的线性通道连接的两个腔室之间的交叉污染相比,阻力通道可导致由阻力通道连接的两个腔室之间的交叉污染减少。阻力通道可以具有角路径,例如如图128a、图128b、图 129c和图129d所示。角路径可以包括在通过通道的流体的流动方向上的一个或多个角。在一些实施方案中,角路径可以包括直角。在一些实施方案中,角路径可以包括约90
°
的角。在一些实施方案中,角路径可以包括约45
°
至约135
°
的至少
一个角。在一些实施方案中,角路径可以包括约80
°
至约100
°
的至少一个角。在一些实施方案中,角路径可以包括约85
°
至约95
°
的至少一个角。阻力通道可以具有迂回或蜿蜒路径,例如如图128c、图128d、图129a和图129b所示。迂回或蜿蜒路径可以包括在通过通道的流体的流动方向上的一个或多个弯曲。在一些实施方案中,迂回或蜿蜒路径可以包括约90
°
的弯曲。在一些实施方案中,迂回或蜿蜒路径可以包括约45
°
至约135
°
的至少一个弯曲。在一些实施方案中,迂回或蜿蜒路径可以包括约80
°
至约100
°
的至少一个弯曲。在一些实施方案中,迂回或蜿蜒路径可以包括约85
°
至约95
°
的至少一个弯曲。在一些实施方案中,阻力通道可以基本上包含在平面内(例如,阻力通道可以是二维的有角的、迂回的或蛇形的)。二维阻力通道可以基本上定位在本公开内容的微流体装置的单层内。在一些实施方案中,阻力通道可以是三维阻力通道 (例如,阻力通道在微流体装置的x、y和z维度上可以是有角的、迂回的或蛇形的)。在一些实施方案中,阻力通道的样品输入可以与阻力通道、与阻力通道连接的腔室或两者在相同的平面中(例如,在 z方向上的相同水平)。在一些实施方案中,阻力通道的样品输入可以在与阻力通道、与阻力通道连接的腔室或两者不同的平面中(例如,在z方向上的不同水平面上)。图133示出了阻力通道的实例。在一些实施方案中,阻力通道的宽度可以为约300μm。在一些实施方案中,阻力通道的宽度可以为10μm至约100μm、约50μm至约100μm、约100μm至约200μm、约100μm至约300μm、约100μm至约400 μm、约100μm至约500μm、约200μm至约300μm、约200μm至约400μm、约200μm至约500μm、约200μm至约600μm、约200 μm至约700μm、约200μm至约800μm、约200μm至约900μm、或约200μm至约1000μm。
[0508]
在一些实施方案中,通道可以是样品计量通道。样品计量通道可以形成第一腔室和第二腔室之间的路径并且具有通道体积,该通道体积被配置成保持设定体积的流体以计量从第一腔室转移至第二腔室的流体体积。样品计量路径可以形成第一腔室和第二腔室之间的路径并且具有被配置成允许以期望的速率从第一通道流至第二通道的通道体积。计量还可受到施加至用作液体试剂储存储器的辅助腔室的正压或负压的影响。这也可以通过将空气储存在用于低成本应用的泡罩包装中来实现。样品计量通道的实例如图133所示。在一些实施方案中,样品计量通道的样品输入可以与样品计量通道、与样品计量通道连接的腔室或两者在同一平面中(例如,在z方向上的同一水平面)。在一些实施方案中,样品计量通道的样品输入可以在与样品计量通道、与样品计量通道连接的腔室或两者不同的平面中(例如,在z方向上的不同水平面上)。样品计量通道的长度、宽度、体积或它们的组合可以被设计成使期望体积的流体穿过第一腔室至第二腔室。样品计量通道的长度、宽度、体积或它们的组合可以被设计成以期望的速率使流体穿过第一腔室至第二腔室。在一些实施方案中,样品计量通道的宽度可以为约300μm。在一些实施方案中,样品计量通道的宽度可以为10μm至约100μm、50μm至约100μm、100μm至约200μm、 100μm至约300μm、100μm至约400μm、100μm至约500μm、200 μm至约300μm、200μm至约400μm、200μm至约500μm、200μm 至约600μm、200μm至约700μm、200μm至约800μm、200μm至约900μm、或约200μm至约1000μm。在一些实施方案中,第一腔室可以通过包括阻力通道和样品计量通道的通道与第二腔室连接。
[0509]
图133示出了阻力通道的示意性示例。阀座可以具有约142μm 的折算高度并且阀具有约2μl的死体积。阀可以定位在与样品计量通道不同的平面上,以最小化阀座高度和死体积并改善密封。 detectr样品计量入口可以位于与样品计量通道不同的水平面上使得样品以不同的高度进入通道,以防止扩增的样品进入或回流。与高度为142μm、占用空间为约
0.142mm
×
0.75mm
×
46mm的通道相比,样品计量通道可以具有约784μm的增加高度,以容纳5μl的计量样品,占用空间为约0.784mm
×
0.75mm
×
8.25mm。detectr样品检测孔入口可以位于与混合孔不同的水平面上,使得detectr样品在不同水平面进入检测孔,以减少横截面积并减少回流。
[0510]
微流体装置可以包括一个或多个试剂端口,其被配置成将试剂接收至装置中(例如,至装置的腔室中)。试剂端口可以包括腔室壁中的开口。试剂端口可以包括通道壁或通道端中的开口。被配置成接收样品的试剂端口可以是样品入口端口。可以通过试剂端口将试剂 (例如,缓冲液、溶液或样品)引入微流体装置。试剂可以由用户(例如,人用户)手动引入,或者试剂可以由机器(例如,通过检测歧管) 自动引入。
[0511]
在本公开内容的盒中可以采用多种腔室形状。腔室可以呈圆形,例如图128a和图128c中所示的扩增腔室、检测腔室和检测试剂储器。腔室可以呈细长形,例如图128b、图128d、图129a、图129b、图129c和图129d中所示的扩增腔室和检测试剂储器。
[0512]
阀可以被配置成防止、调节或允许流体从第一腔室流向一个或多个另外的腔室。在一些实施方案中,阀可以从第一位置旋转至第二位置以防止、允许或改变流体流动路径。在一些实施方案中,阀可以从第一位置滑动至第二位置以防止、允许或改变流体流动路径。在一些实施方案中,阀可以基于施加至阀的压力打开或关闭。在一些实施方案中,阀可以是弹性阀。阀可以是主动的(机械的、非机械的或外部驱动的)或被动的(机械的或非机械的)。阀可以是推拉/电磁致动阀。可以电子控制阀。例如,可以使用螺线管来控制阀。在一些实施方案中,可以手动控制阀。其他控制机制可以是:磁、电、压电、热、双稳态、电化学、相变、流变、气动、止回阀或毛细作用。在一些实施方案中,阀可以是一次性的。例如,可以从微流体装置中移除阀并用新阀替换以防止在重复使用微流体装置时受到污染。在一些实施方案中,阀可以被阀盖或弹性塞覆盖。
[0513]
盒可以被配置成与第一泵连接以将流体从扩增腔室泵送至检测腔室,并且与第二泵连接以将流体从检测试剂储器泵送至检测腔室。本领域已知的多种泵具有将流体从第一腔室移动至第二腔室的作用并且可以与本公开内容的盒一起使用。在一些实施方案中,盒可以与蠕动泵、气动泵、液压泵或注射泵一起使用。
[0514]
图127a和图127b中示出了微流体盒的实例。如图127a所示,盒可以包含扩增腔室和样品入口孔,能够储存约45μl的水性反应混合物,用户可向其中添加约5μl的样品。扩增腔室可以密封。泵进气口将盒与外部小容量低功率泵接通用于溶液控制。盒板载阀可以被配置成在加热步骤期间和升压期间容纳扩增混合物。盒可以包含扩增混合物分流器以分流进入的扩增反应混合物,并允许泵将约5μl直接分配至检测腔室。双检测腔室可以具有疏水性ptfe通口以允许溶液进入,具有用于成像和检测的透明顶部,并且可以在反应期间加热至37℃持续10分钟。在一些实施方案中,检测腔室的尺寸可以使得扩增的样品混合物在与来自检测试剂储存腔室的检测试剂组合时填充检测腔室。detectr反应混合物储存孔,也称为检测试剂储存腔室,可以在盒板上储存约100μl的水性detectr混合物。泵进气口将盒与外部小容量低功率泵接通,用于溶液控制。如图127b所示,盒可以包含盒供气阀,并且入口位于水性试剂上方以防止溢出。被动试剂加注挡块形成曲折路径并具有静水压头,可在加注后被动防止水溶液流入盒。板载弹性阀可防止加热至65℃的反应混合物在升压下向前流动,并由低成本、占用空间小的线性致动器驱动。
[0515]
在一些实施方案中,装置可以包括用激光压印图案化的多层层压盒,以及具有集成电子、光学和机械的硬件,如图130b所示。多层装置可以通过二维层压制造,如图131b(左)所示。在一些实施方案中,装置可以是注塑成型的。注塑成型装置可以经层压以密封该装置,如图131b(右)所示。注塑成型可用于本公开内容的微流体装置的大批量生产。
[0516]
检测歧管。检测歧管可用于在本公开内容的装置中执行和检测本公开内容的detectr测定。检测歧管在本文中还可以称为盒歧管或加热歧管。检测歧管可以被配置成促进或检测在本公开内容的微流体装置中进行的detectr反应。在一些实施方案中,检测歧管可以包括一个或多个加热区以加热微流体装置的一个或多个区域。在一些实施方案中,检测歧管可以包括第一加热区以加热在其中进行扩增反应的微流体装置的第一区域。例如,第一加热器可以将微流体装置的第一区域加热至约60℃。在一些实施方案中,检测歧管可以包括第二加热区以加热在其中进行检测反应的微流体装置的第二区域。例如,第二加热器可以将微流体装置的第二区域加热至约37℃。在一些实施方案中,检测歧管可以包括第三加热区以加热在其中进行裂解反应的微流体装置的第三区域。例如,第三加热器可以将微流体装置的第三区域加热至约95℃。图131a中示出了检测歧管的实例,该检测歧管包括与微流体盒一起使用的两个绝缘加热区。在一些实施方案中,检测歧管可以包括被配置成加热本公开内容的微流体装置的裂解区域的加热区。图132a和图132b中示出了包括裂解加热区、扩增加热区和检测加热区的检测歧管的实例。检测歧管可以被配置成与包括裂解腔室、扩增腔室和检测腔室的微流体装置相容。
[0517]
在一些实施方案中,检测歧管可以包括照明源,该照明源被配置成照亮微流体装置的检测腔室。照明源可以被配置成发射窄光谱照明(例如,led),或者照明可以被配置成发射广谱照明(例如,弧光灯)。检测歧管还可以包括一个或多个过滤器或光栅以过滤期望的照明波长。在一些实施方案中,照明源可以被配置成通过微流体装置的顶面照亮检测腔室(例如,包括detectr反应的腔室)。在一些实施方案中,照明源可以被配置成通过微流体装置的侧表面照明检测腔室。在一些实施方案中,照明源可以被配置成通过微流体装置的底面照亮检测腔室。在一些实施方案中,检测歧管可以包括用于检测由detectr反应产生的信号的传感器。该信号可以是荧光信号。例如,检测歧管可以包括相机(例如,电荷耦合器件(ccd)、互补金属氧化物半导体(cmos))或光电二极管。图136a和图136b中示出了检测歧管的示意性示例。图137a中示出了在检测歧管中照明的检测实例。
[0518]
检测歧管可以包括被配置成控制温度、泵、阀、照明源或传感器中的一个或多个的电子器件。在一些实施方案中,可以使用程序自主控制电子器件。例如,可以自主控制电子器件以实现本公开内容的工作流程(例如,图134中提供的工作流程)。图135中提供了电子布局的示意性示例。电子器件可以使用功率控制、温度反馈或pid回路中的一种或多种来控制一个或多个加热器。泵、阀(例如,电磁控制阀)或led(例如,蓝色led)中的一个或多个可以由功率转换器(例如,3v、12v或9v功率转换器)或电源继电器板中的一个或多个控制。逻辑板可用于控制检测歧管的一个或多个元件。检测歧管可以包括一个或多个指示灯以指示一个或多个元件(例如,led、加热器、泵或阀)的状态。本节中描述的装置可以与本文公开的任何其他特征相结合(例如,气动阀、通过使用滑动阀操作的组件或本文公开的装置的任何其他一般特征)。
[0519]
装置的一般特征。在一些实施方案中,本公开内容的装置可容纳2个或更多个扩增
腔室。在一些实施方案中,本公开内容的装置可容纳10个或更多个检测腔室。在一些实施方案中,本公开内容的装置包括单个腔室,其中样品裂解、靶核酸扩增、逆转录和检测均在单个腔室中进行。在一些情况下,不同的缓冲液存在于不同的腔室中。在一些实施方案中,本公开内容的装置的所有腔室具有相同的缓冲液。在一些实施方案中,样品腔室包含裂解缓冲液,并且扩增腔室和检测腔室中的所有材料都是冻干的或玻璃化的。在一些实施方案中,样品腔室包括本文公开的用于裂解样品的任何缓冲液。扩增腔室可以包括本文公开的、与靶核酸的扩增和/或逆转录相容的任何缓冲液。检测腔室可包括本文公开的、或者其他方式能够允许进行detectr反应的任何detectr或crispr缓冲液(例如,mbuffer)。在这种情况下,一旦发生了样品裂解,体积就以足以再水化其它腔室中的材料的量从样品腔室移动到其它腔室。在一些实施方案中,该装置还包括在一端处的移液泵,用于抽吸、混合和分配流体。在一些实施方案中,自动化仪器用于控制抽吸、混合和分配流体。在一些实施案中,不需要其他仪器来使装置中的流体从一个腔室移动到另一个腔室或进行样品混合。本公开内容的装置可以由任何合适的热塑性材料制成,例如coc、聚合物cop、聚四氟乙烯或另一种热塑性材料。可替代地,该装置可以由玻璃制成。在一些实施案中,检测腔室可以包括珠粒,诸如纳米颗粒(例如,金纳米颗粒)。在一些实施方案中,报道分子被固定在珠粒上。在一些实施方案中,在从珠粒上切割后,释放的报道分子流入次级检测腔室,在次级腔室,产生的信号通过本文公开的任何一种仪器来检测。在一些实施案中,检测腔室是浅的,但是具有针对光学检测而优化的大表面积。本公开内容的装置还可以耦合至温度调节器。例如,该装置可以在平面加热器的顶部或邻近平面加热器,该平面加热器可以将装置加热至高达高温。或者,将导热的金属棒插入装置内部并压在软的聚合物上。热量通过穿过聚合物消散进入样品,而传递到样品。这允许样品在金属棒和样品之间直接接触的情况下加热。在一些实施案中,除用于裂解样品的缓冲液或代替用于裂解样品的缓冲液之外,样品腔室可包括用于样品裂解的超声发生器。携带样品的拭子可直接插入样品腔室。通常,可以使用口腔拭子,其可以携带血液、尿液或唾液样品。过滤器可包括在本文公开的装置中的任何腔室中,以在将样品运送到方法的下一步骤之前过滤样品。本文公开的任何装置都可以耦合到另外的样品制备模块,以在detectr反应的各个步骤之前进一步处理样品。在一些实施方案中,报道分子可以在检测腔室中的溶液中。在其他实施方案中,报道分子可以直接固定在检测腔室的表面上。该表面可以是腔室的顶部或底部。在其他实施方案中,报道分子可以固定在珠粒的表面上。在珠粒的情况下,在切割后,在珠粒保持被卡住的情况下,可检测信号可被洗涤到随后的腔室中,因此允许可检测信号与珠粒的分离。或者,报道分子从珠粒表面的切割足以产生足够强的待测可检测信号。通过隔离或固定上述报道分子,可以提高本公开内容的装置中进行detectr反应的报道分子的稳定性。任何上述装置均可与比色信号、荧光信号、电流信号、电位信号或其他电化学信号相容。在一些实施方案中,比色信号、荧光信号、电流信号、电位信号或其他电化学信号可以使用连接到检测腔室的测量装置(例如,荧光测量装置、分光光度计或示波器)来检测。
[0520]
在一些实施方案中,信号本身可以例如通过使用酶(诸如辣根过氧化物酶(hrp))来扩增。在一些实施方案中,以4:1比例结合的生物素和抗生物素蛋白反应可用于将多种酶或次级信号分子(例如,次级信号分子的4种酶,每种在生物素上)固定到单个蛋白质(例如,抗生物素蛋白)。在一些实施方案中,电化学信号可以由电化学分子(例如,生物素、二茂铁、
异羟基洋地黄毒甙元或转化酶)产生。在一些实施方案中,上述装置可以与附加的浓缩步骤耦合。例如,二氧化硅膜可用于从柱上捕获核酸,并将cas反应混合物直接施用在所述过滤器的顶部。在一些实施方案中,本文公开的任何一种装置的样品腔室可容纳20ul至1000ul的体积。在一些实施方案中,样品腔室容纳20至500、40至400、30至300、20至200或10至100ul的体积。在优选的实施方案中,样品腔室容纳200ul的体积。扩增腔室和检测腔室可以容纳比样品腔室小的体积。例如,扩增腔室和检测腔室可容纳1至50、10至40、20至30、10至40、5至35、40至50、或 1至30ul的体积。优选地,扩增腔室和检测腔室可容纳约200ul的体积。在一些实施方案中,核酸外切酶存在于扩增腔室中或可以被添加至扩增腔室。核酸外切酶可以清除不是靶标的单链核酸。在一些实施方案中,靶核酸的引物可以被硫代磷酸化,以防止在核酸外切酶的存在下靶核酸的降解。在一些实施方案中,本文公开的任何装置可以具有用于平衡样品的ph的ph平衡孔。在一些实施方案中,在上述的每个装置中,报道分子以总核酸(靶核酸 非靶核酸)的至少四倍过量存在。优选地,报道分子以总核酸的至少10倍过量存在。在一些实施方案中,报道分子以总核酸的至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少15倍、至少20 倍、至少50倍、至少100倍、1.5到100倍、4到80倍、4到10倍、 5到20倍或4至15倍过量存在。在一些实施方案中,本文公开的任何装置都可以进行detectr反应,其检测极限为至少0.1am、至少 0.1nm、至少1nm、或0.1am至1nm。在一些实施方案中,本文公开的装置可以以至少75%、至少80%、至少85%、至少90%、至少 92%、至少95%、至少97%、至少99%或100%的阳性预测值进行 detectr反应。在一些实施方案中,本文公开的装置可以以至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%或100%的阳性预测值进行detectr反应。在一些实施方案中,上述装置中的空间多路复用通过使装置中的至少一个、一个以上或每个检测腔室包括独特指导核酸来进行。
[0521]
工作流程。可以使用许多不同的工作流程在微流体装置中执行 detectr反应。在一些实施方案中,用于测量口腔拭子样品的工作流程可以包括擦拭面颊,将拭子加入裂解液中,温育拭子以裂解样品,将裂解的样品与用于扩增靶核酸的试剂组合,将扩增的样品与 detctr试剂组合,并温育样品以检测靶核酸。在一些实施方案中,裂解、扩增和检测中的一种或多种可以在微流体装置中进行(例如,图126a-b、图127a-b、图128a-d、图129a-d、图130a、图133、图150、图151或图157-图167中所示的微流体装置)。在一些实施方案中,工作流程可以包括使用检测歧管测量指示是否存在靶核酸的可检测信号(例如,图136a-b、图137b、图137c、图138a-b、图 156、图168或图172中所示的检测歧管)。
[0522]
图134中提供了用于检测靶核酸的工作流程的示例。盒可以装载样品和反应溶液。扩增腔室可以加热至60℃,并且样品可以在扩增腔室中温育30分钟。可以将扩增的样品泵送至detectr反应腔室,并且可以将detectr试剂泵送至detectr反应腔室。detectr 反应腔室可以加热至37℃,并且样品可以温育30分钟。可以实时测量detectr反应腔室中的荧光以产生定量结果。
[0523]
用于检测靶核酸(例如,病毒靶核酸)的工作流程的示例可以包括擦拭受试者的面颊。可以将拭子加入约200μl的低ph溶液中。在一些实施方案中,拭子可以置换溶液使得总体积为约220μl。拭子可以在低ph溶液中温育约一分钟。在一些实施方案中,存在于拭子上的细胞或病毒衣壳可以在低ph溶液中裂解。部分样品(5μl)可以在扩增腔室中与约45μl的
扩增溶液混合。腔室内的总体积可以为约50μl。样品可以在扩增腔室中在约50℃至约65℃的温度下温育长达约30分钟以扩增样品中的靶核酸。在一些实施方案中,每个扩增样品约5μl的两个等分样品可以被引导至两个检测腔室,在其中它们与每个约95μl的detectr反应混合物组合。扩增的样品可以在两个检测腔室的每一个中与detectr反应混合物在约37℃下温育长达约10分钟,以检测是否存在靶核酸。
[0524]
在一些实施方案中,用于在微流体装置中执行的detectr反应的工作流程可以由用户实施。用户可以从受试者采集样品(例如,口腔拭子或鼻拭子),将样品置于裂解缓冲液中,将裂解的样品添加至本公开内容的微流体盒中,并将盒插入本公开内容的检测歧管中。在一些实施方案中,用户可以将未裂解的样品添加至微流体盒中。在一些实施方案中,detectr反应的工作流程可以在本公开内容的微流体盒中实施。微流体盒可以在一个或多个腔室中包含一种或多种试剂以促进样品中靶核酸的裂解、扩增或检测中的一种或多种。在一些实施方案中,检测歧管可以促进在微流体装置中进行的detectr反应的工作流程。检测歧管可以为扩增反应、检测反应或两者提供加热控制、溶液移动控制(例如,泵控制或阀控制)、照明或检测中的一种或多种。
[0525]
在一些实施方案中,detectr的工作流程在微流体盒中进行并由用户和检测歧管促进,可以包括以下步骤:1)用户将样品装载至包含一种或多种试剂的盒中,2)用户将盒插入检测歧管并按下开始按钮,3)歧管使螺线管通电以关闭扩增腔室和检测腔室之间的阀, 4)歧管指示灯led亮起,5)歧管打开第一加热器以将第一加热区加热至60℃,并打开第二加热器将第二加热区加热至37℃,5)在第一加热区将样品在扩增腔室中温育30分钟以扩增样品,6)歧管关闭第一加热器,7)歧管使电磁阀断电以打开阀,8)歧管打开第一泵15 秒以将扩增的样品泵送至检测腔室,9)歧管关闭第一泵,10)歧管打开第二泵15秒以将检测试剂从检测试剂储存腔室泵送至检测腔室, 11)歧管关闭第二泵,12)在第二加热区的检测腔室中将扩增的样品和检测试剂温育30分钟以进行检测反应,13)歧管指示灯led关闭, 14)歧管打开照明源并测量检测反应产生的可检测信号。
[0526]
可以在微流体装置(例如图159中所示的微流体装置)中进行并由检测歧管(例如图168所示的检测歧管)促进的工作流程的示例可以包括以下步骤:1)在阀v1-v18关闭、加热器1关闭和加热器2 关闭的情况下,将含有样品的拭子加入腔室c2;2)折断拭子的末端并关闭装置的盖子;3)通过打开阀v1将拭子悬浮于裂解液中,以促进裂解液从腔室c1流至腔室c2;4)通过打开阀v2计量从腔室c2 至腔室c7-c10中的每一个的约20μl裂解物,并通过打开阀v3-v6 与来自腔室c3-c6的内容物混合;5)关闭所有阀门并打开加热器1,将腔室c7-c10中的样品在60℃下孵育扩增;6)关闭加热器1,计量约10μl的扩增子从腔室c7-c10(每个腔室2
×
10μl)至腔室c19-c26 中的每一个中,并通过打开阀v7-v18与来自腔室c11-c18中的每一个的内容物组合;7)关闭所有阀并打开加热器2,将样品在腔室 c19-c26中在37℃下温育以进行crispr检测反应;8)在步骤7的温育过程中,通过在470nm处照射和在520nm处检测来检测腔室 c19-c26中的样品。
[0527]
在一些实施方案中,在微流体装置中进行的工作流程可以包括将样品分成两个或更多个腔室。装置可以被配置成将样品分成多个部分。装置可以被配置成将分成部分的样品的两个部分转移至单独的流体通道或腔室中。装置可以被配置成将样品的多个部分转移至多个不同的流体通道或腔室中。装置可以被配置成对分成部分的样品的各个部分进行反
应。装置可以被配置成将样品分成2个部分。装置可以被配置成将样品分成3个部分。装置可以被配置成将样品分成4个部分。装置可以被配置成将样品分成5个部分。装置可以被配置成将样品分成6个部分。装置可以被配置成将样品分成7个部分。装置可以被配置成将样品分成8个部分。装置可以被配置成将样品分成9个部分。装置可以被配置成将样品分成10个部分。装置可以被配置成将样品分成12个部分。装置可以被配置成将样品分成15个部分。装置可以被配置成将样品分成至少20个部分。装置可以被配置成将样品分成至少50个部分。装置可以被配置成将样品分成100个部分。装置可以被配置成将样品分成500个部分。
[0528]
装置可以被配置成对样品的第一部分进行第一反应并且对分成部分的样品的第二部分进行第二反应。装置可以被配置成对分成部分的样品的每个部分进行不同的反应。装置可以被配置成对样品或样品的一部分进行顺序反应。装置可以被配置成在第一腔室中对样品或样品的一部分进行第一反应和在第二腔室中对其进行第二反应。
[0529]
装置可以被配置成将样品与试剂混合。在一些情况下,装置通过在多个隔室之间使样品和试剂来回流动来混合样品和试剂。在一些情况下,装置通过将样品和试剂级联至单个隔室中(例如,通过将样品和试剂从上方流入隔室)来混合样品和试剂。在一些情况下,通过装置进行的混合方法可以最大限度地减少气泡的形成。在一些情况下,由装置进行的混合方法可以最大限度地减少样品损失或损坏(例如,蛋白质沉淀)。
[0530]
装置可以被配置成对样品的多个部分进行多个反应。在一些情况下,装置包括多个腔室,其各自均包含试剂。在一些情况下,包含试剂的多个腔室中的两个腔室包含不同的试剂。在一些情况下,样品的第一部分和第二部分可以经历不同的反应。在一些情况下,样品的第一部分和第二部分可以在不同的报道分子存在下经历相同的反应。在一些情况下,样品的第一部分和第二部分可以经历相同的检测方法。在一些情况下,样品的第一部分和第二部分可以经历不同的检测方法。在一些情况下,可以单独检测样品的多个部分(例如,通过单独激发和检测来自样品每个部分的荧光的二极管阵列)。在一些情况下,可以同时检测样品的多个部分。例如,装置可以将单个样品分成4个部分,对每个部分进行不同的扩增反应,将每个扩增反应的产物分成两部分,对每一部分进行不同的detectr反应,分别测量每个 detectr反应的进展。
[0531]
装置可以被配置成分出少量样品用于大量不同的反应或反应顺序。在一些情况下,装置可以分出小于1ml的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于800μl的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于600 μl的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于400μl的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于200μl的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于100μl的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于50μl的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于1mg 的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于800μg的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于600μg的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于400μg的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于200μg的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于100μg的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于50μg
的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于20μg的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于10μg的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于1μg的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于800ng的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于600ng的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于400ng的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于200ng的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于100ng 的样品用于多个不同的反应或反应顺序。在一些情况下,装置可以分出小于50ng的样品用于多个不同的反应或反应顺序。在一些情况下,样品可以包含核酸。在一些情况下,样品可以包含细胞。在一些情况下,样品可以包含蛋白质。在一些情况下,多个不同的反应或反应顺序可以包括2个或更多个不同的反应或反应顺序。在一些情况下,多个不同的反应或反应顺序可以包括3个或更多个不同的反应或反应序列。在一些情况下,多个不同的反应或反应顺序可以包括4个或更多个不同的反应或反应顺序。在一些情况下,多个不同的反应或反应顺序可以包括5个或更多个不同的反应或反应顺序。在一些情况下,多个不同的反应或反应顺序可以包括10个或更多个不同的反应或反应顺序。在一些情况下,多个不同的反应或反应顺序可以包括20个或更多个不同的反应或反应顺序。在一些情况下,多个不同的反应或反应顺序可以包括50个或更多个不同的反应或反应顺序。在一些情况下,多个不同的反应或反应顺序可以包括100个或更多个不同的反应或反应顺序。在一些情况下,多个不同的反应或反应顺序可以包括500 个或更多个不同的反应或反应顺序。在一些情况下,多个不同的反应或反应顺序可以包括1000个或更多个不同的反应或反应顺序。在一些情况下,第一反应或反应顺序和第二反应或反应顺序检测两个不同的核酸序列。在一些情况下,来自多个不同反应或反应顺序中的每个反应或反应顺序检测不同的核酸序列。例如,装置可以被配置成进行 40个不同的反应顺序,这些反应旨在从包含200ng dna(例如,来自口腔拭子的200ng dna)的单个样品中检测40个不同的核酸序列。在这种情况下,40个不同的核酸序列中的每一个均可用于确定样品中特定病毒的存在。
[0532]
在一些情况下,装置被配置成使步骤自动化。在一些情况下,装置自动进行反应步骤(例如,通过将样品与试剂混合并加热至一定温度持续一段定义的时间)。在一些情况下,装置在样品输入后自动进行每个步骤。在一些情况下,装置可以自动对单个输入样品进行多个反应。在一些情况下,装置可以自动化、检测和提供对单个输入样品的多个反应的结果。在一些情况下,装置可以在小于2小时内自动化、检测和提供对单个样品的多个反应的结果。例如,装置可以自动对包含400ng dna的样品进行100次单独的扩增和detectr反应,然后在小于2小时内检测并提供反应结果。在一些情况下,装置可以在小于1小时内自动化、检测和提供对单个样品的多个反应的结果。在一些情况下,装置可以在小于40分钟内自动化、检测和提供对单个样品的多个反应的结果。在一些情况下,装置可以在小于20分钟的时间内自动化、检测和提供对单个样品的多个反应的结果。在一些情况下,装置可以在小于10分钟内自动化、检测和提供对单个样品的多个反应的结果。在一些情况下,装置可以在小于5分钟的时间内自动化、检测和提供对单个样品的多个反应的结果。在一些情况下,装置可以在小于2分钟的时间内自动化、检测和提供对单个样品的多个反应的结果。
[0533]
用于检测病毒感染的微流体装置和检测歧管。本公开内容的微流体装置(例如,图
126a-b、图127a-b、图128a-d、图129a-d、图130a、图133、图151、图154或图157-图167中所示的微流体装置)可用于检测生物样品中是否存在流感病毒(例如,甲型流感病毒或乙型流感病毒)。检测歧管(例如,图136a-b、图137b、图137c、图138a-b、图156、图168或图172中所示的检测歧管)可以促进流感病毒的检测。可以例如经由鼻拭子或口腔拭子从受试者采集生物样品,并将其引入微流体装置的扩增腔室中。腔室可以包含裂解缓冲液、扩增试剂或两者。在一些实施方案中,生物样品可以在引入扩增腔室之前与裂解缓冲液接触。在一些实施方案中,可以将扩增试剂从扩增试剂储存腔室引入扩增腔室。通过经由检测歧管致动泵、阀或两者,可以控制扩增试剂的引入。扩增试剂可以包括用于扩增存在于流感病毒基因组中的靶核酸的引物。如果样品中存在靶核酸,则可以扩增靶核酸(例如,通过tma、hda、chda、sda、lamp、expar、 rca、lcr、smart、spia、mda、nasba、hip、near或imda)。第一腔室可以经由检测歧管加热。通过经由检测歧管致动泵、阀或两者,可以将扩增的样品引入检测腔室。扩增的样品可以通过样品计量通道。通过经由检测歧管致动泵、阀或两者,可以将检测试剂从检测试剂储存腔室引入检测通道。检测试剂可以通过样品计量通道、阻力通道或两者。检测试剂可以包括可编程核酸酶、针对靶核酸的指导核酸和经标记的检测核酸。通过经由检测歧管加热检测通道,可以在检测通道中进行检测反应。可以使用检测歧管检测在检测通道中是否存在与流感病毒相关的靶核酸。是否存在流感病毒可以通过测量由可编程核酸酶在与靶核酸结合时对检测核酸的切割产生的可检测信号来确定。
[0534]
本公开内容的微流体装置(例如,图126a-b、图127a-b、图 128a-d、图129a-d、图130a、图133、图151、图154或图157-图 167中所示的微流体装置)可用于检测生物样品中是否存在冠状病毒 (例如,sars-cov-2病毒、sars-cov病毒、mers-cov病毒、其组合、或任何冠状病毒株与一种或多种其他病毒或细菌的组合)。检测歧管(例如,图136a-b、图137b、图137c、图138a-b、图156、图168或图172中所示的检测歧管)可以促进冠状病毒的检测。可以例如经由鼻拭子或口腔拭子从受试者采集生物样品,并将其引入微流体装置的扩增腔室中。腔室可以包含裂解缓冲液、扩增试剂或两者。在一些实施方案中,生物样品可以在引入扩增腔室之前与裂解缓冲液接触。在一些实施方案中,可以将扩增试剂从扩增试剂储存腔室引入扩增腔室。通过经由检测歧管致动泵、阀或两者,可以控制扩增试剂的引入。扩增试剂可以包括用于扩增存在于冠状病毒基因组中的靶核酸的引物。如果样品中存在靶核酸,则可以扩增靶核酸(例如,通过 tma、hda、chda、sda、lamp、expar、rca、lcr、smart、 spia、mda、nasba、hip、near或imda)。第一腔室可以由检测歧管加热。通过经由检测歧管致动泵、阀或两者,可以将扩增的样品引入检测腔室。扩增的样品可以通过样品计量通道。通过经由检测歧管致动泵、阀或两者,可以将检测试剂从检测试剂储存腔室引入检测通道。检测试剂可以通过样品计量通道、阻力通道或两者。检测试剂可以包括可编程核酸酶、针对靶核酸的指导核酸和经标记的检测核酸。通过经由检测歧管加热检测通道,可以在检测通道中进行检测反应。可以使用检测歧管检测在检测通道中是否存在与冠状病毒相关的靶核酸。是否存在冠状病毒可以通过测量由可编程核酸酶在与靶核酸结合时对检测核酸的切割产生的可检测信号来确定。
[0535]
本公开内容的微流体装置(例如,图126a-b、图127a-b、图 128a-d、图129a-d、图130a、图133、图151、图154或图157-图 167中所示的微流体装置)可用于检测生物样品中是否存在呼吸道合胞病毒。检测歧管(例如,图136a-b、图137b、图137c、图138a-b、图156、图
168或图172中所示的检测歧管)可以促进呼吸道合胞病毒的检测。可以例如经由鼻拭子或口腔拭子从受试者采集生物样品,并将其引入微流体装置的扩增腔室中。腔室可以包含裂解缓冲液、扩增试剂或两者。在一些实施方案中,生物样品可以在引入扩增腔室之前与裂解缓冲液接触。在一些实施方案中,可以将扩增试剂从扩增试剂储存腔室引入扩增腔室。可以通过经由检测歧管致动泵、阀或两者来控制扩增试剂的引入。扩增试剂可以包括用于扩增存在于呼吸道合胞病毒基因组中的靶核酸的引物。如果样品中存在靶核酸,则可以扩增靶核酸(例如,通过tma、hda、chda、sda、lamp、expar、 rca、lcr、smart、spia、mda、nasba、hip、near或imda)。第一腔室可以由检测歧管加热。可以通过经由检测歧管致动泵、阀或两者来将扩增的样品引入检测腔室。扩增的样品可以通过样品计量通道。通过经由检测歧管致动泵、阀或两者,可以将检测试剂从检测试剂储存腔室引入检测通道。检测试剂可以通过样品计量通道、阻力通道或两者。检测试剂可以包括可编程核酸酶、针对靶核酸的指导核酸和经标记的检测核酸。通过经由检测歧管加热检测通道,可以在检测通道中进行检测反应。可以使用检测歧管检测在检测通道中是否存在与呼吸道合胞病毒相关的靶核酸。是否存在呼吸道合胞病毒可以通过测量由可编程核酸酶在与靶核酸结合时对检测核酸的切割产生的可检测信号来确定。试剂盒
[0536]
本文公开了用于检测靶核酸的试剂盒流体装置和系统。在一些实施方案中,试剂盒包括试剂和支持介质。试剂可提供在试剂腔室或支持介质上。或者,可由使用试剂盒的个体将试剂放入试剂腔室或支持介质中。任选地,该试剂盒还包括缓冲液和滴管。试剂腔室应为测试孔或容器。试剂腔室的开口可以足够大到容纳支持介质。缓冲液可设置在滴管瓶中,以便于分配。滴管可以是一次性的,可以转移固定的体积。滴管可用于将样品放入试剂腔室或支持介质上。
[0537]
在一些实施方案中,用于检测靶核酸的试剂盒包括支持介质;靶向靶核酸区段的指导核酸;当与指导核酸和靶核酸区段复合时能够被激活的可编程核酸酶;以及包含检测部分的单链检测核酸,其中所述检测核酸能够被激活的核酸酶切割,从而产生第一可检测信号。
[0538]
在一些实施方案中,用于检测靶核酸的试剂盒包括pcr板;靶向靶核酸区段的指导核酸;当与指导核酸和靶核酸区段复合时能够被激活的可编程核酸酶;以及包含检测部分的单链检测核酸,其中所述检测核酸能够被激活的核酸酶切割,从而产生第一可检测信号。pcr 板的孔可由靶向靶核酸区段的指导核酸、当与指导核酸和靶序列复合时能够被激活的可编程核酸酶以及至少一个包含检测部分的单链检测核酸群体预先等分。因此,用户可以将感兴趣的生物样品添加到预等分的pcr板的孔中,并使用荧光读取器或可见光读取器测量可检测信号。
[0539]
在一些情况下,此类试剂盒可包括包装、载体或容器,其被分隔以接收一个或多个容器,例如小瓶、试管等,每个容器包括将在本文所述方法中使用的一个单独元件。合适的容器包括,例如,测试孔、瓶子、小瓶和试管。在一个实施方案中,容器由多种材料形成,所述材料例如玻璃、塑料或聚合物。
[0540]
本文描述的试剂盒或系统包含包装材料。包装材料的实例包括但不限于适合预期使用模式的小袋、泡罩包装、瓶、管、袋、容器、瓶和任何包装材料。
[0541]
试剂盒通常包括列出内容物和/或使用说明的标签,以及带有使用说明的包装说明书。通常还包括一组说明书。在一个实施方案中,标签在容器上或与容器相关联。在一些情况下,当构成标签的字母、数字或其他字符被附着、模制或蚀刻到容器本身时,标签就在容器上;当标签出现在同样容纳容器的大容器或载体内时,标签就与容器相关联,例如作为包装说明书。在一个实施方案中,标签用于指示所述内容物将用于特定治疗应用。标签还指示内容物的使用指导,例如在本文所描述的方法中。
[0542]
在包装成型产品并打包或装箱以保持无菌屏障后,可通过热灭菌、气体灭菌、γ射线辐照或电子束灭菌对产品进行最终灭菌。或者,产品可以通过无菌处理制备和包装。稳定性
[0543]
本文公开了用于上述方法的试剂和可编程核酸酶系统的稳定组合物。本文所述的试剂和可编程核酸酶系统可以在各种储存条件下稳定,所述储存条件包括冷藏条件、环境条件和加速条件。本文公开了稳定剂。可以针对试剂和可编程核酸酶系统本身测量稳定性,或者可以针对存在于支持介质上的试剂和可编程核酸酶系统测量稳定性。
[0544]
在一些情况下,本文所用的稳定是指试剂在给定存储期结束后具有约5%w/w或更少的总杂质。稳定性通过hplc或任何其他已知的测试方法来评估。稳定剂可以在给定存储期结束后具有约10%w/w、约5%w/w、约4%w/w、约3%w/w、约2%w/w、约1%w/w或0.5%w/w的总杂质。稳定剂可以在给定存储期结束后具有0.5%w/w至10% w/w、1%w/w至8%w/w、2%w/w至7%w/w或3%w/w至5%w/w 的总杂质。
[0545]
在一些情况下,本文所用的稳定是指试剂在给定存储期结束后具有约5%w/w或更少的总杂质。稳定性通过hplc或任何其他已知的测试方法来评估。稳定剂可以在给定存储期结束后具有约10%w/w、约5%w/w、约4%w/w、约3%w/w、约2%w/w、约1%w/w或0.5% w/w的总杂质。
[0546]
在一些实施方案中,稳定的组合物在给定储存期结束时和在给定储存条件下检测活性的损失为零。给定储存条件可以包括等于或小于10%、20%、30%、40%、50%、60%、70%、80%、90%或100%相对湿度的湿度。受控的储存环境可以包括0%至50%相对湿度、0%至 40%相对湿度、0%至30%相对湿度、0%至20%相对湿度、或0%至 10%相对湿度的湿度。受控的储存环境可以包括
–
100℃、
–
80℃、
–
20 ℃、4℃、约25℃(室温)或40℃的温度。受控的储存环境可以包括
–
80℃至25℃、或
–
100℃至40℃的温度。受控的储存环境可以保护系统或试剂盒免受光照或机械损坏。受控的储存环境可以是无菌的或洁净的或保持光导管无菌。受控的储存环境可以是洁净的或无菌的。
[0547]
在一些情况下,试剂可以储存在毛细管中。毛细管可以是玻璃毛细管。在一些情况下,毛细管提供了受控的储存环境。毛细管还可以储存在受控的储存环境中。毛细管可以储存含有试剂的溶液。毛细管可以储存干燥形式的试剂。毛细管可以装载含有试剂的溶液,然后干燥以产生含有干燥或粉末形式的试剂的毛细管。可以通过用溶液 (例如缓冲液)填充毛细管来水合或溶解干燥的或粉末状的试剂。毛细管内的试剂在室温下储存时可以是稳定的。毛细管内的试剂在(例如37℃)下储存时可以是稳定的。毛细管内的试剂在低于室温(例如 4 37℃)下储存时可以是稳定的。毛细管内的试剂在储存1、2、3、4、5、6、7、8、9、10、11或12个月时可以是稳定的。储存在毛细管内的试剂在储存超过一年时可以是稳定的。储存在毛细管内的试剂可以保留大于25%、30%、35%、40%、45%、50%、55%、60%、65%、 70%、
75%、80%、85%、90%、95%或100%的活性。
[0548]
毛细管可以含有以干燥形式的或在溶液中的酶。毛细管可以含有以干燥形式的或在溶液中的可编程核酸酶。毛细管可以含有以干燥形式的或在溶液中的核酸。毛细管可以含有以干燥形式的或在溶液中的核糖核蛋白。毛细管可以含有以干燥形式的或在溶液中的染料。毛细管可以含有以干燥形式的或在溶液中的缓冲液(例如,裂解缓冲液)。毛细管可以含有以干燥形式的或在溶液中的扩增试剂。
[0549]
可以通过使溶液流过毛细管来从毛细管中去除试剂。可以通过向毛细管的开口端施加压力(例如,液压或气动压力)从毛细管中去除试剂。可以通过破坏毛细管从毛细管中除去试剂。毛细管可以定位,使其内容物由于重力而洗脱。毛细管可以在两端打开。毛细管可以在一端或两端密封。
[0550]
毛细管的内部体积可以小于1μl。毛细管的内部体积可以为1μl。毛细管的内部体积可以为2μl。毛细管的内部体积可以为3μl。毛细管的内部体积可以为4μl。毛细管的内部体积可以为5μl。毛细管的内部体积可以为5至10μl。毛细管的内部体积可以为10至20μl。毛细管的内部体积可以为20至30μl。毛细管的内部体积可以为30至 40μl。毛细管的内部体积可以为40至50μl。毛细管的内部体积可以为50至60μl。毛细管的内部体积可以为60至70μl。毛细管的内部体积可以为70至80μl。毛细管的内部体积可以为80至90μl。毛细管的内部体积可以为90至100μl。毛细管的内部体积可以大于100μl。
[0551]
试剂盒或系统可以在使用前被包装以便长时间存储。试剂盒或系统可被包装以避免试剂盒或系统的降解。包装可包括干燥剂或其他药剂,以控制包装内的湿度。包装可保护试剂盒或系统免受机械损坏或热损坏。包装可保护试剂盒或系统免受试剂和可编程核酸酶系统的污染。试剂盒或系统可在类似于储存条件的条件下运输,这种条件会导致试剂稳定性高或试剂活性损失小。包装可配置为提供和保持试剂盒或系统的无菌性。试剂盒或系统可以与标准制造和运输操作相容。靶标扩增和检测
[0552]
许多靶标扩增和检测方法与本文公开的方法、组合物、试剂、酶和试剂盒一致。如本文所述,可以使用dna激活的可编程rna核酸酶(例如,cas13)、dna激活的可编程dna核酸酶(例如,cas12) 或rna激活的可编程rna核酸酶(例如,cas13)和本文公开的其他试剂(例如,rna组分)检测靶核酸。如本文所述,可以使用 detectr检测靶核酸。靶核酸可以是rna、逆转录的rna、dna、 dna扩增子、扩增的dna、合成核酸或在生物或环境样品中发现的核酸。在一些情况下,靶核酸在检测之前或同时被扩增。在一些情况下,靶核酸在扩增之前被逆转录。可以通过靶核酸序列的环介导的等温扩增(lamp)来扩增靶核酸。在一些情况下,使用lamp结合逆转录(rt-lamp)来扩增核酸。lamp扩增可以独立进行,或者lamp 扩增可以结合detectr以检测靶核酸。rt-lamp扩增可以独立进行,或者rt-lamp扩增可以结合detectr以检测靶核酸。detectr 反应可以使用与本文公开的方法一致的任何方法进行。扩增和检测反应混合物
[0553]
在一些实施方案中,lamp扩增反应包括多种引物、dntp和 dna聚合酶。lamp可用于在等温条件下以高特异性扩增dna。dna 可以是单链dna或双链dna。在一些情况下,包含rna的靶核酸可以在lamp扩增之前使用逆转录酶逆转录成dna。逆转录反应可以包括引物、dntp和逆转录酶。在一些情况下,逆转录反应和lamp 扩增反应可以在同一反应中进行。组合的
rt-lamp反应可以包括 lamp引物、逆转录引物、dntp、逆转录酶和dna聚合酶。在一些情况下,lamp引物可以包含逆转录引物。
[0554]
检测靶核酸序列的detectr反应可以包括指导核酸,该指导核酸包括与靶核酸的区段反向互补的区段和可编程核酸酶。如本文其他地方所述,可编程核酸酶在被激活时表现出对报道分子的序列非依赖性切割(例如,包含在核酸被可编程核酸酶切割时变得可检测的部分的核酸)。可编程核酸酶在指导核酸与靶核酸杂交时被激活。组合的lamp detectr反应可以包括多种引物、dntp、dna聚合酶、指导核酸、可编程核酸酶和底物核酸。组合的rt-lamp detectr 反应可以包括lamp引物、逆转录引物、dntp、逆转录酶、dna聚合酶、指导核酸、可编程核酸酶和底物核酸。在一些情况下,lamp 引物可以包含逆转录引物。lamp和detector可以在相同的样品体积中进行。lamp和detectr可以在不同的样品体积或相同的样品体积中同时进行。rt-lamp和detectr可以在相同的样品体积中进行。rt-lamp和detectr可以在不同的样品体积或相同的样品体积中同时进行。lamp扩增的引物设计
[0555]
lamp反应可以包括多种引物。设计多种引物以扩增靶核酸序列,其在图61中相对于双链核酸的各个区域显示。引物可以退火至这些不同区域或具有对应于这些不同区域的序列。如图61所示,靶核酸是f1c区的5’,f1c区是f2c区的5’,并且f2c区是f3c区的5’。另外,b1区是b2区的3’,并且b2区是b3区的3’。f3c、f2c、f1c、 b1、b2和b3区显示在图61的下链上。f3区是与f3c区反向互补的序列。f2区是与f2c区反向互补的序列。f1区是与f1c区反向互补的序列。b1c区是与b1区反向互补的序列。b2c区是与b2区反向互补的序列。b3c区是与b3区反向互补的序列。靶核酸可以是f1c区的5’和b1区的3’,如图61的顶部配置所示。靶核酸可以是b1c区的5’和f1区的3’,如图61的底部配置所示。在一些实施方案中,靶核酸可以是f2c区的5’和f1c区的3’。在一些实施方案中,靶核酸可以是b2c区的5’和b1c区的3’。在一些实施方案中,靶核酸序列可以是b1区的5’和b2区的3’。在一些实施方案中,靶核酸序列可以是f1区的5’和f2区的3’。
[0556]
图61还显示了各种引物的结构和方向性。正向外部引物具有 f3区序列。因此,正向外部引物退火至f3c区。反向外部引物具有 b3区序列。因此,反向外部引物退火至b3c区。正向内部引物具有 f2区序列5’的f1c区序列。因此,正向内部引物的f2区退火至f2c 区,并且扩增的序列通过正向内部引物和f1区中的f1c区序列的杂交形成保持在一起的环。反向内部引物具有b2区序列5’的b1c区序列。因此,反向内部引物的b2区退火至b2c区,并且扩增的序列通过反向内部引物的b1c区和靶标链的b1区的序列杂交形成保持在一起的环。
[0557]
此外,如图61所示,多个引物可以另外包括环正向引物(lf) 和/或环反向引物(lb)。lf位于f1c区的3’和f2c区的5’。lb位于b2c区的5’和b1c区的3’。f1、f1c、f2、f2c、f3、f3c、b1、 b1c、b2、b2c、b3和/或b3c区以相对于靶核酸、pam和指导rna (grna)的多种排列示出,如图61-图63或图71-图72中任一图所示。靶核酸可以在包含b1、b2、b3、lf、f1c、f2c、f3c和lbc区的核酸链内。靶核酸可以在包含f1、f2、f3、lb、b1c、b2c、b3c 和lfc区的核酸链内。
[0558]
可设计一组lamp引物用于与detectr反应组合使用。核酸可以包含指导rna与其杂交的区域(例如,靶核酸)。全部或部分指导rna序列可以与全部或部分靶序列反向互补。靶核酸序列可以与靶核酸序列的前间区序列邻近基序(pam)3’相邻。pam可以促进可编程核酸酶与靶核酸的相互作用。靶核酸序列可以与靶核酸序列的前间区序列侧翼位点(pfs)3’相
邻。pfs可以促进可编程核酸酶与靶核酸的相互作用。指导rna、pam或pfs、或靶核酸序列中的一种或多种可以相对于f1、flc、f2、f2c、f3、f3c、lf、lfc、lb、 lbc、b1、b1c、b2、b2c、b3和/或b3c区中的一个或多个特异性定位。
[0559]
在一些情况下,指导rna与位于flc区和b1区之间的靶核酸序列反向互补,如图62a所示。在一些情况下,指导rna与位于b1c 区和f1区之间的靶核酸序列反向互补。
[0560]
在一些情况下,指导rna与位于f1c区和b1区之间的靶核酸序列部分反向互补,如图62b所示。在一些情况下,指导rna与位于b1c区和f1区之间的靶核酸序列部分反向互补。例如,靶核酸包含位于f1c区和b1区之间或位于b1c区和f1区之间的序列,其与至少60%的指导核酸反向互补。在另一个示例中,靶核酸包含位于 flc区和bl区之间的序列,其与靶核酸的至少10%、至少11%、至少 12%、至少13%、至少14%、至少15%、至少16%、至少17%、至少 18%、至少19%、至少20%、至少21%、至少22%、至少23%、至少 24%、至少25%、至少26%、至少27%、至少28%、至少29%、至少 30%、至少31%、至少32%、至少33%、至少34%、至少35%、至少 36%、至少37%、至少38%、至少39%、至少40%、至少41%、至少 42%、至少43%、至少44%、至少45%、至少46%、至少47%、至少 48%、至少49%、至少50%、至少51%、至少52%、至少53%、至少 54%、至少55%、至少56%、至少57%、至少58%、至少59%、至少 60%、至少61%、至少62%、至少63%、至少64%、至少65%、至少 66%、至少67%、至少68%、至少69%、至少70%、至少71%、至少 72%、至少73%、至少74%、至少75%、至少76%、至少77%、至少78%、至少79%、至少80%、至少81%、至少82%、至少83%、至少 84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少 90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少 96%、至少97%、至少98%、至少99%、至少100%、5%至100%、 5%至10%、10%至15%、15%至20%、20%至25%、25%至30%、30%至35%、35%至40%、40%至45%、45%至50%、50%至55%、55%至60%、60%至65%、65%至70%、70%至75%、75%至80%、80%至85%、85%至90%、90%至95%、或95%至100%反向互补。在这种排列中,指导rna不与图61所示的正向内部引物或反向内部引物反向互补。
[0561]
在一些情况下,指导rna与正向内部引物、反向内部引物或其组合的不超过50%、不超过40%、不超过35%、不超过30%、不超过25%、不超过20%、不超过15%、不超过10%或不超过5%反向互补。位于f1c区和b1区之间的序列或位于b1c区和f1区之间的序列与指导核酸序列至少50%、至少70%、至少75%、至少80%、至少 85%、至少90%、至少92%、至少95%、至少99%或100%反向互补。在一些情况下,指导核酸具有与正向内部引物、反向内部引物、正向外部引物、反向外部引物或其任何组合的不超过50%、不超过40%、不超过35%、不超过30%、不超过25%、不超过20%、不超过15%、不超过10%或不超过5%反向互补的序列。在一些情况下,指导核酸序列具有与f3c区、f2c区、f1c区、b1c区、b2c区、b3c区或其任何组合的序列的不超过50%、不超过40%、不超过35%、不超过30%、不超过25%、不超过20%、不超过15%、不超过10%或不超过5%反向互补的序列。
[0562]
在一些情况下,对应于指导rna序列的区域不与任何引物重叠或杂交,并且可以进一步不与图61-图63和图71-图72中所示的任何区域重叠或杂交。
[0563]
在一些情况下,所有或部分指导核酸与环区中的靶核酸序列反向互补。例如,与grna杂交的靶核酸序列的全部或部分可以位于 b1c和b2区之间,如图62c所示。在另一个实
例中,与grna杂交的靶核酸的全部或部分序列可以位于f2c和f1c区之间,如图62d所示。在一些情况下,与grna杂交的靶核酸的全部或部分序列可以位于f1和f2区之间。在一些情况下,与grna杂交的靶核酸的全部或部分序列可以位于b2c和b1c区之间。
[0564]
在一些情况下,可以使用可商购获得的引物设计软件设计 lamp引物集。lamp引物集可设计用于与dtecr反应、逆转录反应或两者组合使用。在一些情况下,可以使用分布式账本技术(dlt)、人工智能(ai)、扩展现实(xr)和量子计算(通常称为“darq”) 设计lamp引物集。在一些情况下,可以使用未整合的扩增信号报道基因(quasr)的猝灭来设计lamp引物集(ball等人,anal chem. 2016apr 5;88(7):3562-8.doi:10.1021/acs.analchem.5b04054.epub 2016mar 24.)。这些设计一组lamp引物的方法仅作为示例提供;设计一组lamp引物的其他方法对于本领域技术人员而言是显而易见的并且可以用于本文所述的任何组合物、试剂盒和方法中。用于组合的rt-lamp detectr反应或lamp-detectr以检测对应于呼吸道合胞病毒(rsv)、甲型流感病毒(iav)、乙型流感病毒(iav) 或herc2 snp的核酸序列的存在的示例性lamp引物集在表6中提供。表6-示例性lamp引物
[0565]
一组lamp引物可设计用于与detectr反应组合以检测靶核酸中的单核苷酸多态性(snp)。在一些实施方案中,包含snp的靶核酸序列可以与全部或部分指导核酸反向互补。例如,snp可以位于与指导rna序列反向互补的靶核酸序列内,如图2c所示。在一些情况下,包含snp的靶核酸序列的序列不与引物或f1、f1c、f2、f2c、 f3、f3c、b1、b1c、b2、b2c、b3、b3c、lb、lbc、lf或lfc区中的一个或多个重叠或反向互补,如图71所示。指导核酸可以与flc 和b1区之间的靶核酸序列反向互补,如图72a所示。指导核酸可以与blc和f1区之间的靶核酸序列反向互补。指导核酸可以与flc区和 b1区之间的靶核酸序列部分反向互补,例如如图72b所示。指导核酸可以与blc区和f1区之间的靶核酸序列部分反向互补。例如,具有snp的靶核酸序列的序列可以与指导核酸的至少10%、至少11%、至少12%、至少13%、至少14%、至少15%、至少16%、至少17%、至少18%、至少19%、至少20%、至少21%、至少22%、至少23%、至少24%、至少25%、至少26%、至少27%、至少28%、至少29%、至少30%、至少31%、至少32%、至少33%、至少34%、至少35%、至少36%、至少37%、至少38%、至少39%、至少40%、至少41%、至少42%、至少43%、至少44%、至少45%、至少46%、至少47%、至少48%、至少49%、至少50%、至少51%、至少52%、至少53%、至少54%、至少55%、至少56%、至少57%、至少58%、至少59%、至少60%、至少61%、至少62%、至少63%、至少64%、至少65%、至少66%、至少67%、至少68%、至少69%、至少70%、至少71%、至少72%、至少73%、至少74%、至少75%、至少76%、至少77%、至少78%、至少79%、至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少100%、5%至100%、 5%至10%、10%至15%、15%至20%、20%至25%、25%至30%、30%至35%、35%至40%、40%至45%、45%至50%、50%至55%、55%至60%、60%至65%、65%至70%、70%至75%、75%至80%、80%至85%、85%至90%、90%至95%、或95%至100%反向互补。在一些情况下,指导核酸不与多个引物或f1、f1c、f2、f2c、f3、f3c、 b1、b1c、b2、b2c、b3、b3c、lb、lbc、lf或lfc区中的任何一个重叠和/或反向互补。用于组合的rt-lamp detectr或 lamp-detectr反应以检测对应于呼吸道合胞病毒(rsv)、甲型流感病毒(iav)、乙型流感病毒(iav)或herc2 snp的核酸序列的存在的示例性detectr grna集在表7
中提供。表7-示例性detectr指导rna示例性detectr指导rna单核苷酸多态性等位基因的扩增和检测
[0566]
detectr反应可用于检测样品中特定单核苷酸多态性(snp) 等位基因的存在。如本文别处所述,在存在包含特定snp等位基因的靶核酸的情况下,detectr反应可产生可检测信号。在不存在靶核酸或存在不包含特定snp等位基因或包含不同snp等位基因的核酸序列的情况下,detectr反应可能不产生信号。在一些情况下,detectr反应可以包含与包含特定snp等位基因的靶核酸序列的一部分反向互补的指导rna。包含特定snp等位基因的指导rna和靶核酸可以结合并激活可编程核酸酶,从而产生如本文别处所述的可检测信号。指导rna和不包含特定snp等位基因的核酸序列可能不结合或激活可编程核酸酶,并且可能不产生可检测信号。在一些情况下,可以使用例如lamp扩增反应来扩增可能包含或可能不包含特定 snp等位基因的靶核酸序列。在一些情况下,lamp扩增反应可以与逆转录反应、detectr反应或两者组合。例如,lamp反应可以是 rt-lamp反应、lamp detectr反应或rt-lamp detectr反应。
[0567]
如本文别处所述,在存在包含特定snp等位基因的靶核酸序列的情况下,detectr反应可以特异性地产生可检测信号。例如,在存在snp位置处包含g核酸的靶核酸的情况下,detectr反应可以产生可检测信号,但在存在snp位置处包含c、t或a核酸的核酸的情况下不产生可检测信号。在存在snp位置处包含t核酸的靶核酸的情况下,detectr反应可以产生可检测信号,但在存在snp位置处包含g、c或a核酸的核酸的情况下不产生可检测信号。在存在 snp位置处包含c核酸的靶核酸的情况下,detectr反应可以产生可检测信号,但在存在snp位置处包含g、t或a核酸的核酸的情况下不产生可检测信号。在存在snp位置处包含a核酸的靶核酸的情况下,detectr反应可以产生可检测信号,但在存在snp位置处包含g、t或c核酸的核酸的情况下不产生可检测信号。除了 detectr反应之外,具有snp的靶核酸可以在样品中同时、顺序、同时一起,或在样品中顺序一起与lamp或rt-lamp一起进行。例如,反应可以包括lamp和detectr反应,或rt-lamp和 detectr反应。与不存在lamp反应的情况下的detectr反应相比,进行detectr反应组合lamp反应可能导致可检测信号增加。
[0568]
在一些情况下,在存在包含特定snp等位基因的靶核酸的情况下,detectr反应中产生的可检测信号可以高于在存在不包含特定 snp等位基因的核酸的情况。在一些情况下,在存在包含特定snp 等位基因的情况下,detectr反应可以产生的可检测信号比在存在不包含特定snp等位基因的核酸的情况下高至少1倍、至少2倍、至少3倍、至少4倍、至少5倍、至少10倍、至少20倍、至少30 倍、至少40倍、至少50倍、至少100倍、至少200倍、至少300倍、至少400倍、至少500倍、至少1000倍、至少2000倍、至少3000 倍、至少4000倍、至少5000倍、至少6000倍、至少7000倍、至少 8000倍、至少9000倍、至少10000倍、至少50000倍、至少100000 倍、至少500000倍、或至少1000000倍。在一些情况下,在存在包含特定snp等位基因的情况下,detectr反应可以产生的可检测信号比在存在不包含特定snp等位基因的核酸的情况下高1倍至2倍、 2倍至3倍、3倍至4倍、4倍至5倍、5倍至10倍、10倍至20倍、 20倍至30倍、30倍至40倍、40倍至50倍、50倍至100倍、100 倍至500倍、500倍至1000倍、1000倍至10,000倍、10,000倍至100,000 倍、或100,000倍至1,000,000倍。
[0569]
detectr反应可用于检测与核酸样品中的疾病或病况相关的 snp等位基因的存在。detectr反应可用于检测与核酸样品中发生疾病或病况的可能性增加相关的snp等位基因的存在。detectr反应可用于检测与核酸样品中的表型相关的snp等位基因的存在。例如,detectr反应可用于检测与疾病(例如苯丙酮尿症(pku)、囊性纤维化、镰状细胞性贫血、白化病、亨廷顿病、1型强直性营养不良、高胆固醇血症、神经纤维瘤病、多囊肾病、血友病、肌营养不良症、低磷性佝偻病、rett综合征或生精衰竭)相关的snp等位基因。 detectr反应可用于检测与癌症(例如膀胱癌、脑癌、乳腺癌、宫颈癌、结肠癌、结肠直肠癌、胆囊癌、胃癌、白血病、肝癌、肺癌、口腔癌、食道癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌、睾丸癌、甲状腺癌、神经母细胞瘤或淋巴瘤)风险增加相关的snp等位基因。 detectr反应可用于检测与疾病(例如阿尔茨海默病、帕金森病、淀粉样变性、异色病、乳糜泻、黄斑变性或高胆固醇血症)风险增加相关的snp等位基因。detectr反应可用于检测与表型(例如眼睛颜色、头发颜色、身高、肤色、人种、酒精潮红反应、咖啡因消耗、深度睡眠、遗传体重、乳糖不耐症、肌肉成分、饱和脂肪和体重、或睡眠运动)相关的snp等位基因。定义
[0570]
除非另有定义,否则本文所使用的所有技术术语具有本发明所属领域中的普通技
术人员通常理解的相同含义。如本说明书和所附权利要求书中所使用的,除非上下文明确规定,否则单数形式“一个(a)”、“一个(an)”和“所述(the)”包括复数指代。除非另有说明,否则本文中任何提及的“或”旨在包括“和/或”。
[0571]
如本文所用,术语“包括”及其语法等同项规定了所述特征、整数、步骤、操作、元件和/或组分的存在,但不排除存在或添加一个或多个其他特征、整数、步骤、操作、元件、组分和/或其集合。如本文所使用的,术语“和/或”包括一个或多个相关联的所列项目的任何和所有组合。
[0572]
除非上下文有明确说明或明显说明,否则如本文所用,提及数字或数字范围的术语“约”应理解为表示所述一个或多个数字的 /-10%,或对于所列范围值低于所列下限的10%和高于所列上限的10%。
[0573]
如本文所用,术语“个体”、“受试者”和“患者”可互换使用,包括动物界的任何成员,包括人类。
[0574]
如本文所用,术语“抗体”是指但不限于单克隆抗体、合成抗体、多克隆抗体、多特异性抗体(包括双特异性抗体)、人类抗体、人源化抗体、嵌合抗体、单链(scfv)(包括双特异性scfv)、单链抗体、 fab片段、f(ab’)片段、f(ab’)2片段、二硫键连接fvs(sdfv)或其表位结合片段。在一些情况下,抗体是免疫球蛋白分子或免疫球蛋白分子的免疫活性部分。在一些情况下,抗体来源于动物,包括鸟类和哺乳动物。或者,抗体是人或人源化单克隆抗体。
[0575]
图1从左至右示出了工作流程的步骤1至4的示意图。步骤1 中是椭圆形中的“样品准备”。步骤2是椭圆形中的“核酸扩增”。在步骤3是矩形中的“可编程核酸酶反应温育”。在步骤4是矩形中的“检测 (读出)”。
[0576]
图2在右侧描绘了类似注射器的过滤装置。左侧是三个样品,从上到下分别是面颊/面部拭子、尿液标本收集器和指纹。
[0577]
图3在顶部示出了题为“装置2.1-仅必要元件/无扩增”的示意图。图中描绘了一个样品通过p1进入,p1与下方垂直连接至v1。v1与 v2相邻,v2与上方垂直连接至p2,通过p2引入预混合的可编程核酸酶混合物。在v1的右边是一个弯曲的区域,标记为s1。在s1的右边是一个温育和检测腔室,标记为c1。c1右侧为v3,与上方垂直连接至p3,p3为收集出口。示意图中间显示的是题为“装置2.2-伴随扩增的单腔室反应”的流体装置的图。图中描绘了样品通过p1进入, p1与下方垂直连接至v1。v1与v2相邻,v2在上方垂直连接至p2,通过p2引入扩增混合物。v2与v2相邻,v2与上方垂直连接至p3,通过p3引入预混合的可编程核酸酶混合物。在v3的右边是一个弯曲的区域,标记为s1。在s1的右边是一个温育和检测腔室,标记为c1。 c1右侧为v4,与上方垂直连接至p4,p4为收集出口。底部示出了另一个流体装置,标题为“装置2.3-伴随扩增的双腔室反应”。图中描绘了样品通过p1进入,p1与下方垂直连接至v1。v1与v2相邻, v2在上方垂直连接至p2,通过p2引入扩增混合物。v2右侧是一个弯曲区域,标记为s1。s1的右侧是一个标有c1的温育箱。c1的右边是v3,与上方垂直连接至p3,通过p3引入预混的可编程核酸酶混合物。在v3的右侧是另一个标记为s2的蛇形区域。s2右侧是一个标记为c2的温育和检测腔室。c2右侧为v4,与上方垂直连接至 p4,p4为收集出口。
[0578]
图4示出顶部是“(a)荧光读出”,并描绘了具有薄膜平面加热器的矩形芯片基底表面,所示为矩形区域中的彩色。芯片上方是荧光激发/检测装置的图。下方示出的为“(b)电化学读出”。电化学读出示出两个示意图。顶部示意图为“使用链霉亲和素信号扩增的固相
检测”。左边是矩形表面描述顶部腔室表面,所述腔室表面包被有生物素标记的ssdna,用星星表示。正下方是具有链霉亲和素的电极表面,它以六角形表示。功能化腔室右侧显示的是x轴上的电压与y轴上电流的关系图,图中的标题为“低”。右边是一个箭头,显示了可编程核酸酶的引入,该酶被描绘为一把剪刀,其示出将生物素从顶部表面上切割出来。生物素被描绘成附接在链霉亲和素上。右边进一步示出了 x轴上的电压与y轴上电流的关系图,图中的标题为“高”。下面是第二个示意图,标题为“使用固定的电活性寡核苷酸的固相检测”。示意图左侧显示的是具有ssna/fc ntp的矩形电极表面。表面被电活性部分功能化,表示为具有呈圆形二茂铁的树状结构。右边是x轴上的电压与y轴上电流的关系图,图中的标题为“高”。再右边是一个箭头,示出了可编程核酸酶的引入,该酶被描绘成一把剪刀,并且示出了切割fc圆。再右边是x轴上的电压与y轴上电流的关系图,图中的标题为“低”。
[0579]
图5示出了在p1处引入的样品,p1在下方垂直连接至v1。v1 与v2相邻,v2在上方垂直连接等温扩增混合物。v2的右侧是一个标有s1的蛇形通道。再往右边是一个标记为c1的温育腔室。c1的右边是v3,与上方垂直连接至p3,通过p3引入预复合的可编程核酸酶混合物。v3右侧是另一个标记为s2的蛇形通道,并且再右侧是标记为c2的另一个温育腔室。c2右边是v4,在上方垂直连接至p4,通过p4引入蔗糖或比色试剂。在v4的右边是另一个标记为s3的蛇形通道,再右边是标记为c3的检测腔室。在c3的右边是v5,它在上方垂直连接至p5。下面是c2温育腔室的分解图。图示出了顶部腔室,表示为具有如下标签的矩形,标签上写着“包被有与转化酶缀合的ssna的顶部腔室表面”。转化酶显示在标有“inv”的矩形框中。在顶部腔室的下方是示出了具有薄膜平面加热器的底部腔室表面的结构。再往右方是一个箭头,显示了可编程核酸酶的引入,该酶描绘为一把剪刀,并且被显示为切割转化酶。再下面是标记为c3的检测腔室的分解图。此分解图在顶部示出了一个示意图,标记为“(a)使用dns 或其他化合物的光学读出”。顶部是“(a)使用dns或其他化合物的光学读出”,描绘了具有薄膜平面加热器的矩形芯片基板表面,显示为矩形区域中的彩色区域。芯片上方是相机或光学传感器。底部是“(b) 电化学读出(电化学分析仪或血糖仪),从左至右显示具有固定的葡萄糖氧化酶的电极表面,其被描绘为带有椭圆形标记“gox”的矩形。在功能化电极表面的上方是一个流程图,从左至右示出了蔗糖,朝右的箭头,上方有“inv”,右边是果糖 葡萄糖。在功能化电极表面的右侧是x轴上的电压与y轴上的电流的关系图,其下方是指示“低”的电子读取器。再右边是葡萄糖与gox功能化的电极的相互作用,电极表面在h2)2 f-葡萄糖酸-δ-内酯中溶解。右边是x轴上的电压与y 轴上的电流的关系图,下面是指示“高”的电子读取器。下面是示出了转化酶标记的寡核苷酸的关键图,该寡核苷酸表示为一条线和标记有“inv”的矩形。可编程核酸酶描绘为一把剪刀。示出了dns的分子结构。葡萄糖氧化酶是标记有gox的椭圆。
[0580]
图9描绘了原始荧光随时间的线图。x轴示出了时间,以分钟为单位,从0.0至20.0,增量为2.5。y轴显示原始荧光,从0到3,500,000,增量为500,000。这些线描绘了对应于低ph、rt池、低ph 加热、 genmark池、脱氧胆酸盐、脱氧胆酸盐 加热、chaps、chaps 加热、脱氧胆酸盐 尿素、脱氧胆酸盐 尿素 加热、nucleospin金标准、 triton x-100、10e4和ntc的靶标。crna是iav。图中的最高线对应于rt池、低ph和genmark池。其余的线从左上到右下依次对应 nucleospin金标准、脱氧胆酸盐和chaps 尿素(大致相等)、低 ph 加热、chaps 加热、chaps 尿素 加热、triton x-100、脱氧胆酸盐 尿素、10e4和脱氧胆酸 尿素 加热。ntc是约
1,500,000左右的平线。
[0581]
图10示出了原始荧光随时间的线图。x轴示出了时间,以分钟为单位,从0.0至20.0,增量为2.5。y轴示出了原始荧光,从1,000,000 到3,000,000,增量为1,000,000。这些线描绘了对应于低ph 0min、低ph 3min、低ph 5min、低ph 10min、低ph 15min、低ph无etoh、低ph 加热50、低ph 加热100、未处理、rt池、10e5、10e4、10e3 和ntc的靶标。crrna是iav。两条最高的线对应于低ph 0min和 rt池。其余线从左上到右下对应于低ph 5min、低ph无etoh、低 ph 15min、低ph 10min、10e5、低ph 加热100、低ph 加热50、未处理、10e4、10e3和ntc。
[0582]
图15描绘了流程图和两个线图。流程图显示了四个方框。顶部的方框写着“dna/rna”,其余三个框从上到下写着“rpa/rt-rpa”,“体外转录”和“cas13a检测”。这两幅图都显示了随时间变化的原始荧光。x轴显示从0到40(增量为10)的分钟数。y轴显示从0到60,000 (增量为20,000)的原始荧光(au)。两幅图都显示了分别对应于在500am下的中靶和脱靶(实线),以及在0am下的中靶和脱靶(虚线)的两组两条线。左图描绘了pprv。在左图中,对应于500am下的中靶的线随时间上升。其余的线看起来大致平坦。右图显示 pprv-noivt。这四条线大致都是平的。
[0583]
图17描绘了流程图和四个线图。流程图显示了四个方框。顶部的方框上写着“dna/rna”,其余三个方框从上到下为“rpa/rt-rpa”、“体外转录”和“cas13a检测”。这四幅图都显示了随时间变化的原始荧光。所有四幅图的x轴示出了从0到20分钟,以10为增量。所有四幅图的y轴示出了原始荧光(au),从0到25,000,增量为5,000。所有四幅图显示了与中靶和脱靶crrna对应的两行。左上角的绘图显示 rt和 umt。中靶线随着时间的推移而上升,而脱靶线看起来大致平坦。左下角的图显示 rt和-umt。中靶线随着时间的推移而上升,而脱靶线看起来大致平坦。右上角的图显示-rt和 umt。这两条线看起来大致平坦。右下角的图显示-rt和-umt。两条线都看起来大致平坦,但中靶线高于脱靶线。
[0584]
图20b示出描述时间结果的柱状图(越低越好)。图中显示了六组,每组四个条形。如x轴所示,六组条形对应于从左至右74、72、 70、68、66和64的温度(c)。每组的四个条形,从左至右依次为 hela-总-rna、小鼠-肝脏-rna、hela-dna和ntc。y轴显示时间(分钟)结果,从0到40分钟,以5为增量。在所有六个温度下,与小鼠-肝脏-rna和ntc相对应的条形的结果时间是40或更多。在所有 6个温度下,hela-总-rna最高,hela-dna最低。
[0585]
图20c从左至右描绘了对应于crrna=脱靶、crrna=中靶#1 和crrna=中靶#2的三个线图。对于所有三个图,x轴显示从0到75 的分钟数,以25为增量;y轴显示从0到1,500,000的原始荧光(au),以500,000为增量。每个图描绘了三条与靶标相对应的线,这些线代表hela rna、hela dna、小鼠肝脏rna和ntc。在左图和右图上,所有四条线都大致平坦。在中间图中,与hela-dna和hela-rna相对应的线随着时间的推移而上升,其中hela-dna最高。小鼠-肝脏
ꢀ‑
rna和ntc最低。
[0586]
图21描绘了流程图和六个线图。流程图显示了三个方框,从上到下分别标记为“dna/rna”、“lamp/rt-lamp”和“cas12a检测”。六个图显示了随时间推移的荧光。在所有六个图中,x轴显示0到75 分钟,以25为增量;y轴显示原始荧光(au),从0到60,000,增量为20,000。所有六个图显示了对应于不同的crrna的三条线。这三条线显示中靶#2、中靶#2和脱靶。左上图显示引物=iav1,靶标=iav。对应于中靶#2的线随时间而上升,是最高的。对应
于脱靶的线随时间略有上升。对应于中靶#1的线大致是平的。中上图显示引物=iav2,靶标=iav。对应于中靶#2的线随时间而上升,是最高的。对应于中靶#1的线随时间而上升,但没有中靶#2上的高。对应于脱靶的线随时间略有上升,且最低。右上图显示引物=iav3,靶标=iav。对应于中靶#1的线随着时间的推移而上升,是最高的。对应于脱靶的线随时间略有上升,但没有中靶#1上的高。对应于中靶#2的线在图上示出,并且看起来大致平坦。左下图显示引物=iav1,靶标=ntc。对应于中靶#2的线随时间而上升,是最高的。对应于脱靶的线随时间略有上升,但没有中靶#2上的高。对应于中靶#1的线看起来大致平坦。中下图显示引物=iav2,靶标=ntc。对应于脱靶的线随时间略有上升。对应于中靶#1和中靶#2的线看起来大致平坦。右下角的图显示引物=iav3,靶标=ntc。对应于脱靶的线随时间略有上升。对应于中靶 #1和中靶#2的线在图中显示较低,并且看起来大致平坦。
[0587]
图22描绘了流程图和三个线图。流程图显示了从上到下标记的三个方框,“dna/rna”、“lamp/rt-lamp”和“cas12a检测”。三个线图显示了荧光随时间的变化。在所有三个图中,x轴显示0到75分钟,以25为增量;y轴显示0到60,000的原始荧光(au),以20,000 为增量。所有三个图都显示了对应于不同crrna的三条线。三条线 ibv#1、ibv#2和ibv#3。左图显示靶标=iav。所有三条线看起来都大致平坦。中间的图显示靶标=ibv。与ibv#3相对应的线随着时间的推移而上升,并且是最高的。与ibv#2相对应的线随时间而上升,但速度不如ibv#3快。与ibv#1相对应的线看起来大致平坦。右图显示靶标=ntc。所有三条线看起来都大致平坦。
[0588]
图24b示出了六条线图。在所有六个图中,x轴显示0到75分钟,以25为增量;y轴显示0到60,000的原始荧光(au),以20,000 为增量。所有六个图都显示了分别对应于10000和0的浓度的两条线。左上图显示靶标=iav,crrna=iav。对应于10000的线随着时间的推移而上升,并且是最高的。对应于0的线看起来大致平坦。中上图显示靶标=ibv,crrna=iav。两条线都不可见。右上图显示靶标=iav 和ibv,crrna=iav。对应于10000的线随着时间的推移而上升,并且是最高的。对应于0的线看起来大致平坦。左下方的图显示靶标=iav,crrna=ibv。两条线都不可见。中下图显示靶标=ibv, crrna=ibv。对应于10000的线随着时间的推移而上升,并且是最高的。对应于0的线看起来大致平坦。右下图显示靶标=iav和ibv, crrna=ibv。对应于10000的线随着时间的推移而上升,并且是最高的。对应于0的线看起来大致平坦。
[0589]
图25描绘了流程图和四个线图。流程图有五个方框。上面的框写着“病毒rna”,中间的框写着“多重rn-lamp”,其余的框从左至右写着“cas12甲型流感检测”、“cas12乙型流感检测”和“cas12a内部扩增检测”。四个图描绘了荧光随时间的变化。所有四个图的x轴显示从0到80的分钟数,以20为增量;y轴显示从0到50,000的原始荧光(au),以10,000为增量。每个图显示三条线对应不同的crrna,即iav、ibv和猛犸象iac。最左边的图描绘了iav。与iav相对应的直线随着时间的推移而上升。左边的第二个图显示了ibv。与ibv 相对应的线随时间而上升。右边的第二个图描绘了iav和ibv。与 ibv相对应的线随着时间的推移而上升,并且是最高的。与iav相对应的线随着时间的推移而上升,但没有ibv高。最右边的图描绘了 iav、ibv和猛犸象iac。与ibv相对应的线随着时间的推移而上升,并且是最高的。与猛犸象iac相对应的线随着时间的推移而上升,但并不像ibv那样高。与iav相对应的线看起来大致平坦。
[0590]
图49c示出了六个线图,描绘了荧光随着时间的变化。在所有六个图中,x轴以25为增量显示0到75分钟;y轴显示0.0至1.0的归一化的荧光,增量为0.2。每个图描绘两组四条线。第一组四条线显示rna-fq报道分子(实线)的浓度(nm)为2.5、0.25、0.025 和0。第二组四条线显示dna-fq报道分子(虚线)的浓度(nm) 为2.5、0.25、0.025和0。左上图显示靶标=rna,蛋白质=cas13m26 (lbucas13a具有seq id no:131的序列)。与2.5rna-fq、0.25 rna-fq和0.0025rna-fq相对应的线随着时间上升。对应于2.5 rna-fq的线最高,其次为对应于0.25rna-fq的线,对应于0.025 rna-fq的线在三者中最低。其余的线与基线不可区分。中上图显示靶标=ssdna,蛋白质=cas13m26。与2.5rna-fq和0.25rna-fq 相对应的线随着时间上升。对应于2.5rna-fq的线最高,其次是对应于0.25rna-fq的线。其余的线与基线不可区分。右上图显示靶标=dsdna,蛋白质=cas13m26。所有的线都不能与基线区分。左下角显示靶标=rna,蛋白质=cas12m08(cas12家族中的变体,具有seqid no:37的序列)。所有的线都不能与基线区分。中下图显示靶标=ssdna,蛋白质=cas12m08。与2.5dna-fq、0.25dna-fq和0.0025 dna-fq相对应的线随时间的推移而升高。对应于2.5dna-fq的线最高,其次为对应于0.25dna-fq的线,对应于0.025dna-fq的线在三者中最低。其余的线与基线之间的区别最小。右下图显示靶标=dsdna,蛋白质=cas12m08。与2.5dna-fq、0.25dna-fq和0.0025 dna-fq相对应的线随时间的推移而升高。对应于2.5dna-fq的线最高,其次为对应于0.25dna-fq的线,对应于0.025dna-fq的线在三者中最低。其余的线与基线之间的区别很小。
[0591]
图50示出了描绘荧光随时间变化的两个线图。对于这两个图, x轴以50为增量显示从0到50的分钟数,y轴以500,000为增量显示从0到2,000,000的原始荧光(au)。两个图都描绘了代表报道分子 rep01
–
fam-u5、rep08
–
a5、rep09
–
c5、rep10
–
g5、rep11
–
t5、 rep12
–
ta6、rep13
–
ta13、rep14
–
ta10、rep15
–
t6、rep16
–
t7、 rep19
–
t10、rep20
–
t11、rep21
–
t12和rep30
–
beacon的线。左图显示的是0nm,没有任何一条线与基线有实质性区别。右图显示2.5 nm。与rep01
–
fam相对应的线随时间上升。其余的线与基线基本上没有区别。
[0592]
图54a显示了描绘不同crrna和引物的荧光的柱状图。y轴显示从0到160,000的归一化的荧光,增量为20,000。x轴显示crrna。这个图描绘了两组三个条形。左边的组示出了中靶crrna,右边的组示出了脱靶crrna。每组中的三个条形从左至右对应于引物lf lb、 lf和lb。
[0593]
虽然本发明的各种实施方案已在本文中示出和描述,但对于本领域技术人员来说,这些实施方案仅作为示例的方式提供是显而易见的。在不脱离本发明的情况下,本领域技术人员能够想到许多变更、改变和替换。应当理解,在实施本发明时,可以采用本文所描述的本发明实施方案的各种替代方案。以下权利要求旨在限定本发明的范围,并由此涵盖这些权利要求及其等效物范围内的方法和结构。编号的实施方案
[0594]
以下实施方案记载了本文公开的特征的组合的非限制性排列。特征的组合的其他排列也在构想之内。特别地,这些编号的实施方案中的每一项均被构想为依赖于或与每个先前或后续的编号的实施方案相关,而与其列出的顺序无关。1.一种用于检测靶核酸的微流体盒,其包括:a)与阀流体连接的扩增腔室;b)与所述阀流体连接的检测腔室,其中所述阀与样品计量通道连接;c)经由阻力通道与所述检测腔室流体连接的检测试剂腔室,所述
检测试剂腔室包含可编程核酸酶、指导核酸和经标记的检测核酸,其中所述经标记的检测核酸能够在所述指导核酸与靶核酸的区段结合后被切割。2.实施方案1的微流体盒,其中所述样品计量通道控制在通道或腔室中分配的液体体积。 3.实施方案2的微流体盒,其中所述样品计量通道与所述检测腔室流体连接。4.实施方案1-3中任一项的阻力通道,其中所述阻力通道具有蛇形路径、角形路径或迂回路径。5.实施方案1-4中任一项的微流体盒,其中所述阀是旋转阀、气动阀、液压阀、弹性阀。6.实施方案 1-5中任一项的微流体盒,其中所述阻力通道与所述阀流体连接。7. 实施方案1-6中任一项的微流体盒,其中所述阀包括壳体,所述壳体包括“基底”或“包覆成型件”。8.实施方案1-7中任一项的微流体盒,其中所述阀由螺线管致动。9.实施方案1-8中任一项的微流体盒,其中所述阀由手动、磁力、电力、热、双稳态电路、压电材料、电化学、相变、流变、气动、止回阀、毛细管作用或它们的任何组合控制。10. 实施方案5-9中任一项的微流体盒,其中所述旋转阀流体连接至少3 个、至少4个或至少5个腔室。11.实施方案1-10中任一项的微流体盒,还包括与所述扩增腔室流体连接的扩增试剂腔室。12.实施方案 11的微流体盒,还包括与所述扩增试剂腔室流体连接的样品腔室。13. 实施方案12的微流体盒,还包括与所述样品腔室连接的样品入口。 14.实施方案13的微流体盒,其中所述样品入口是可密封的。15.实施方案14的微流体盒,其中所述样品入口在所述样品周围形成密封。 16.实施方案12-15中任一项的微流体盒,其中所述样品腔室包含裂解缓冲液。17.实施方案12-16中任一项的微流体盒,还包括与所述样品腔室流体连接的裂解缓冲液储存腔室。18.实施方案17的微流体盒,其中所述裂解缓冲液储存腔室包含裂解缓冲液。19.实施方案16-18中任一项的微流体盒,其中所述裂解缓冲液是双重裂解/扩增缓冲液。20. 实施方案17-19中任一项的微流体盒,其中所述裂解缓冲液储存腔室通过第二阀与所述样品腔室流体连接。21.实施方案12-20中任一项的微流体盒,其中所述样品腔室通过所述扩增试剂腔室与所述扩增腔室流体连接。22.实施方案12-20中任一项的微流体盒,其中所述样品腔室通过所述扩增腔室与所述扩增试剂腔室流体连接。23.实施方案 11-22中任一项的微流体盒,其中所述微流体盒被配置成在所述扩增试剂腔室和扩增腔室之间双向引导流体。24.实施方案1-23中任一项的微流体盒,其中所述检测试剂腔室与所述扩增腔室流体连接。25. 实施方案1-24中任一项的微流体盒,其中所述扩增腔室通过所述检测试剂腔室与所述检测腔室流体连接。26.实施方案1-25中任一项的微流体盒,还包括位于所述检测腔室上方的试剂端口,所述试剂端口被配置成将流体从所述检测试剂腔室输送至所述检测腔室。27.实施方案1-26中任一项的微流体盒,其中所述扩增腔室通过所述检测腔室与所述检测试剂腔室流体连接。28.实施方案1-27中任一项的微流体盒,其中所述阻力通道被配置成减少回流至所述检测腔室和所述检测试剂腔室。29.实施方案2-27中任一项的微流体盒,其中所述样品计量通道被配置成将预定体积的流体从所述检测试剂腔室引导至所述检测腔室。30.实施方案1-29中任一项的微流体盒,其中所述扩增腔室和检测腔室是热隔绝的。31.实施方案1-30中任一项的微流体盒,其中所述检测试剂腔室与所述检测腔室流体连接。32.实施方案1-31 中任一项的微流体盒,其中所述检测试剂腔室经由第二阻力通道与所述检测腔室流体连接。33.实施方案1-32中任一项的微流体盒,其中所述阻力通道或所述第二阻力通道是蛇形阻力通道。34.实施方案1-33 中任一项的微流体盒,其中所述阻力通道或所述第二阻力通道包括至少两个发夹。35.实施方案1-34中任一项的微流体盒,其中所述阻力通道或所述第二阻力通道包括至少一个、至少2个、至少3个或至少 4个直角。36.
实施方案1-35中任一项的微流体盒,其中所述扩增腔室包括可密封的样品入口。37.实施方案36的微流体盒,其中所述样品入口被配置成在拭子周围形成密封。38.实施方案1-37中任一项的微流体盒,其中微流体盒被配置成与第一泵连接以将流体从所述扩增腔室泵送至所述检测腔室。39.实施方案1-38中任一项的微流体盒,其中微流体盒被配置成与第二泵连接以将流体从所述检测试剂腔室泵送至所述检测腔室。40.实施方案38-39中任一项的微流体盒,其中第一泵或第二泵是气动泵、蠕动泵、液压泵或注射泵。41.实施方案 1-40中任一项的微流体盒,其中所述扩增腔室与被配置成接收气动压力的端口流体连接。42.实施方案41的微流体盒,其中所述扩增腔室通过通道与所述端口流体连接。43.实施方案11-42中任一项的微流体盒,其中所述扩增试剂腔室与被配置成接收气动压力的第二端口连接。 44.实施方案43的微流体盒,其中所述扩增试剂腔室通过第二通道与所述第二端口流体连接。45.实施方案11-44中任一项的微流体盒,其中所述微流体盒被配置成与第三泵连接以将流体从所述扩增试剂腔室泵送至所述扩增腔室。46.实施方案45的微流体盒,其中所述第三泵是气动泵、蠕动泵、液压泵或注射泵。47.实施方案1-46中任一项的微流体盒,其中所述检测试剂腔室与被配置成接收气动压力的端口连接。48.实施方案1-47中任一项的微流体盒,其中所述检测试剂腔室通过第三通道与第三端口流体连接。49.实施方案1-48中任一项的微流体盒,其中所述微流体盒被配置成与第四泵连接以将流体从所述检测试剂腔室泵送至所述检测腔室。50.实施方案49的微流体盒,其中所述第四泵是气动泵、蠕动泵、液压泵或注射泵。51.实施方案1-50 中任一项的微流体盒,还包括被配置成与气体歧管耦合的多个端口,其中所述多个端口被配置成接收气动压力。52.实施方案1-51中任一项的微流体盒,其中所述微流体盒的任一腔室与权利要求50的所述多个端口连接。53.实施方案1-52中任一项的微流体盒,其中所述阀是在施加电流电信号后打开。54.实施方案1-53中任一项的微流体盒,其中所述检测试剂腔室呈圆形。55.实施方案1-53中任一项的微流体盒,其中所述检测试剂腔室呈细长形。56.实施方案1-53中任一项的微流体盒,其中所述检测试剂腔室呈六边形。57.实施方案2-56中任一项的微流体盒,其中所述阻力通道的区域被模制成在垂直于所述净流动方向的方向上引导流动。58.实施方案2-56中任一项的微流体盒,其中所述阻力通道的区域被模制成在垂直于由所述阻力通道的两端限定的轴线的方向上引导流动。59.实施方案2-58中任一项的微流体盒,其中所述阻力通道的区域被模制成沿所述微流体盒的z轴线引导流动。60.实施方案1-59中任一项的微流体盒,其中所述阀经由扩增混合物分流器与两个检测腔室流体连接。61.实施方案1-60中任一项的微流体盒,其中所述阀通过扩增混合物分流器与3、4、5、6、7、8、 9或10个检测腔室流体连接。62.实施方案例1-61中任一项的微流体盒,还包括与所述检测试剂腔室和所述检测腔室流体连接的第二阀。 63.实施方案1-62中任一项的微流体盒,其中所述检测腔室具有疏水性ptfe通口。64.实施方案1-63中任一项的微流体盒,其中所述检测腔室包括光学透明表面。65.实施方案1-64中任一项的微流体盒,其中所述扩增腔室被配置成容纳10μl至500μl的流体。66.实施方案11-65中任一项的微流体盒,其中所述扩增试剂腔室被配置成容纳 10μl至500μl的流体。67.实施方案1-66中任一项的微流体盒,其中所述微流体盒被配置成接纳2μl至100μl的包含核酸的样品。68. 实施方案1-67中任一项的微流体盒,其中所述扩增试剂腔室包含5 至200μl扩增缓冲液。69.实施方案1-68中任一项的微流体盒,其中所述扩增腔室包含45μl扩增缓冲液。70.实施方案1-69中任一项的微流体盒,其中所述检测试剂腔室储存5至200μl的含有所述可编程核
酸酶、所述指导核酸和所述经标记的检测核酸的流体。71.实施方案 1-70中任一项的微流体盒,包括2、3、4、5、6、7或8个检测腔室。 72.实施方案71的微流体盒,其中所述2、3、4、5、6、7或8个检测腔室与单个样品腔室流体连接。73.实施方案1-72中任一项的微流体盒,其中所述检测腔室容纳多达100μl、200μl、300μl或400μl 的流体。74.实施方案1-73中任一项的微流体盒,其中所述微流体盒包括5-7层。75.实施方案1-74中任一项的微流体盒,其中所述盒包括如图130b所示的层。76.实施方案1-75中任一项的微流体盒,还包括被配置成适配滑动鲁尔尖端的样品入口。77.实施方案76的微流体盒,其中所述滑动鲁尔尖端适合于安装容纳样品的注射器。78.实施方案76-77中任一项的微流体盒,其中所述样品入口能够被气密密封。79.实施方案1-78中任一项的微流体盒,还包括滑动阀。80.实施方案 79的微流体盒,其中所述滑动阀将所述扩增试剂腔室与所述扩增腔室连接。81.实施方案79或80中任一项的微流体盒,其中所述滑动阀将所述扩增腔室与所述检测试剂腔室连接。82.实施方案79-81中任一项的微流体盒,其中所述滑动阀将所述扩增试剂腔室与所述检测腔室连接。83.一种歧管,其被配置成接纳实施方案1-82中任一项的所述微流体盒。84.实施方案83的歧管,包括被配置成将流体泵入所述检测腔室的泵、被配置成照亮所述检测腔室的照明源、被配置成检测由所述经标记的检测核酸产生的可检测信号的检测器、和被配置成加热所述扩增腔室的加热器。85.实施方案84的歧管,还包括被配置成加热所述检测腔室的第二加热器。86.实施方案84-85中任一项的歧管,其中所述照明源是广谱光源。87.实施方案84-86中任一项的歧管,其中所述照明源光产生带宽小于5nm的照明。88.实施方案84-87中任一项的歧管,其中所述照明源是发光二极管。89.实施方案88的歧管,其中所述发光二极管产生白光、蓝光或绿光。90.实施方案84-89中任一项的歧管,其中所述可检测信号是光。91.实施方案84-90中任一项的歧管,其中所述检测器是照相机或光电二极管。92.实施方案84-91 中任一项的歧管,其中所述检测器的检测带宽小于100nm、小于75nm、小于50nm、小于40nm、小于30nm、小于20nm、小于10nm或小于5nm。93.实施方案84-92中任一项的歧管,还包括被配置成位于所述检测腔室和所述检测器之间的滤光器。94.实施方案1-93中任一项的微流体盒,其中所述扩增腔室包含扩增试剂。95.实施方案11-94 中任一项的微流体盒,其中所述扩增试剂腔室包含扩增试剂。96.实施方案94-95中任一项的微流体盒,其中所述扩增试剂包含引物、聚合酶、dntp、扩增缓冲液。97.实施方案1-96中任一项的微流体盒,其中所述扩增腔室包含裂解缓冲液。98.实施方案11-97中任一项的微流体盒,其中所述扩增试剂腔室包含裂解缓冲液。99.实施方案94-98中任一项的微流体盒,其中所述扩增试剂包含逆转录酶。100.实施方案 94-99中任一项的微流体盒,其中所述扩增试剂包含热循环扩增试剂。 101.实施方案94-99中任一项的微流体盒,其中所述扩增试剂包含等温扩增试剂。102.实施方案94-101中任一项的微流体盒,其中所述扩增试剂包含用于以下项的试剂:转录介导的扩增(tma)、解旋酶依赖性扩增(hda)、环状解旋酶依赖性扩增(chda)、链置换扩增 (sda)、环介导的扩增(lamp)、指数扩增反应(expar)、滚环扩增(rca)、连接酶链反应(lcr)、简单方法扩增rna靶标 (smart)、单引物等温扩增(spia)、多置换扩增(mda)、基于核酸序列的扩增(nasba)、铰链引发的引物依赖性核酸扩增(hip)、切口酶扩增反应(near)或改进的多置换扩增(imda)。103.实施方案94-102中任一项的微流体盒,其中所述扩增试剂包含用于环介导的扩增(lamp)的试剂。104.实施方案16-103中任一项的微流体盒,其中所述裂解缓冲液和所述扩增缓冲液是单一缓冲液。105.实施方案16-104中任一项的微流体盒,其中所述裂解缓冲液
储存腔室包含裂解缓冲液。106.实施方案16-105中任一项的微流体盒,其中所述裂解缓冲液的ph值为ph 4至ph 5。107.实施方案1-106中任一项的微流体盒,其中所述微流体盒还包含逆转录试剂。108.实施方案107 的微流体盒,其中所述逆转录试剂包含逆转录酶、引物和dntp。109. 实施方案1-108中任一项的微流体盒,其中所述可编程核酸酶包含 ruvc催化结构域。110.实施方案1-109中任一项的微流体盒,其中所述可编程核酸酶是v型crispr/cas效应蛋白。111.实施方案110的微流体盒,其中所述v型crispr/cas效应蛋白是cas12蛋白。112. 实施方案111的微流体盒,其中所述cas12蛋白包含cas12a多肽、 cas12b多肽、cas12c多肽、cas12d多肽、cas12e多肽、c2c4多肽、 c2c8多肽、c2c5多肽、c2c10多肽和c2c9多肽。113.实施方案110-112 中任一项的微流体盒,其中所述cas12蛋白与seq id no:27-seq idno:37中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%或至少99%序列同一性。114.实施方案110-113 中任一项的微流体盒,其中所述cas12蛋白选自seq id no:27-seqid no:37。115.实施方案110的微流体盒,其中所述v型crispr/cas 效应蛋白是cas14蛋白。116.实施方案115的微流体盒,其中所述 cas14蛋白包含cas14a多肽、cas14b多肽、cas14c多肽、cas14d多肽、cas14e多肽、cas14f多肽、cas14g多肽、cas14h多肽、cas14i 多肽、cas14j多肽或cas14k多肽。117.实施方案115-116中任一项的微流体盒,其中所述cas14蛋白与seq id no:38-seq id no:129 中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%或至少99%序列同一性。118.实施方案115-117中任一项的微流体盒,其中所述cas14蛋白选自seq id no:38-seq id no:129。 119.实施方案110的微流体盒,其中所述v型crispr/cas效应蛋白是casф蛋白。120.实施方案119的微流体盒,其中所述casф蛋白与 seq id no:274-seq id no:321中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%或至少99%序列同一性。 121.实施方案119-120中任一项的微流体盒,其中所述casф蛋白选自 seq id no:274-seq id no:321。122.实施方案1-121中任一项的微流体盒,所述微流体盒还提供用于体外转录扩增的冠状病毒靶核酸的一个或多个腔室。123.实施方案122的微流体盒,其中所述体外转录包括使所述扩增的冠状病毒靶核酸与用于体外转录的试剂接触。124. 实施方案123的微流体盒,其中所述用于体外转录的试剂包含rna 聚合酶、ntp和引物。125.实施方案1-124中任一项的微流体盒,其中所述可编程核酸酶包含hep切割结构域。126.实施方案1-125中任一项的微流体盒,其中所述可编程核酸酶是vi型crispr/cas效应蛋白。127.实施方案126的微流体盒,其中所述vi型crispr/cas效应蛋白是cas13蛋白。128.实施方案127的微流体盒,其中所述cas13 蛋白包含cas13a多肽、cas13b多肽、cas13c多肽、cas13c多肽、cas13d 多肽或cas13e多肽。129.实施方案例127-128中任一项的微流体盒,其中所述cas13蛋白与seq id no:130-seq id no:137中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%或至少99%序列同一性。130.实施方案127-129中任一项的微流体盒,其中所述cas13蛋白选自seq id no:130-seq id no:137。131.实施方案1-130中任一项的微流体盒,其中所述靶核酸来自病毒。132.实施方案131的微流体盒,其中所述病毒包含呼吸道病毒。133.实施方案132的微流体盒,其中所述呼吸道病毒是上呼吸道病毒。134.实施方案131的微流体盒,其中所述病毒包含流感病毒。135.实施方案 131-133中任一项的微流体盒,其中所述病毒包含冠状病毒。136.实施方案135的微流体盒,其中所述冠状病毒靶核酸来自sars-cov-2。 137.实施方案135-136中任一项的微流体盒,其中所述冠状病毒靶核酸来自
n-基因、e-基因或其组合。138.实施方案135-137中任一项的微流体盒,其中所述冠状病毒靶核酸具有seq id no:333-seq id no: 338中任一项的序列。139.实施方案135中任一项的微流体盒,其中所述指导核酸是指导rna。140.实施方案135-139中任一项的微流体盒,其中所述指导核酸与seq id no:323-seq id no:328中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少 97%、或至少99%序列同一性。141.实施方案135-140中任一项的微流体盒,其中所述指导核酸选自seq id no:323-seq id no:328中的任一项。142.实施方案1-141中任一项的微流体盒,其中所述微流体盒包含对照核酸。143.实施方案142的微流体盒,其中所述对照核酸在所述检测腔室中。144.实施方案142-143中任一项的微流体盒,其中所述对照核酸是rnasep。145.实施方案142-144中任一项的微流体盒,其中所述对照核酸具有seq id no:379的序列。146.实施方案 142-144中任一项的微流体盒,其中所述指导核酸与seq id no: 330-seq id no:332中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%或至少99%序列同一性。147.实施方案142-146中任一项的微流体盒,其中所述指导核酸选自seq id no: 330-seq id no:332中的任一项。148.实施方案134-147中任一项的微流体盒,其中所述流感病毒包含甲型流感病毒、乙型流感病毒或其组合。149.实施方案1-148的微流体盒,其中所述指导核酸靶向多个靶序列。150.实施方案1-149的微流体盒,其中所述微流体盒包含针对病毒平铺的多个指导序列。151.实施方案150的微流体盒,其中所述多个靶序列包含来自甲型流感病毒、乙型流感病毒和第三病原体的序列。152.实施方案1-151中任一项的微流体盒,其中所述经标记的检测核酸包含单链报道分子,所述单链报道分子包含检测部分。153. 实施方案152的微流体盒,其中所述检测部分是荧光团、fret对、荧光团/猝灭剂对或电化学报道分子。154.实施方案153的微流体盒,其中所述电化学报道分子包含图149中所示的种类。155.实施方案 1-154中任一项的微流体盒,其中经标记的检测子在所述检测核酸切割后产生可检测信号。156.实施方案155的微流体盒,其中所述可检测信号是比色信号、荧光信号、电流信号或电位信号。157.一种检测靶核酸的方法,所述方法包括:a)提供受试者的样品;b)将样品添加至实施方案1-156中任一项的所述微流体盒中;c)将实施方案 84-156中任一项的所述可检测信号与存在或不存在所述靶核酸相关联;和d)任选地定量所述可检测信号,从而定量所述样品中存在的所述靶核酸的量。158.实施方案1-156中任一项的微流体盒在检测靶核酸的方法中的用途。159.实施方案1-156中任一项的系统在检测靶向核酸的方法中的用途。160.可编程核酸酶在检测根据实施方案 30-63、66、150、153中任一项的靶核酸的方法中的用途。161.根据实施方案66-87中任一项的组合物在检测靶核酸的方法中的用途。162. dna激活的可编程rna核酸酶在测定根据实施方案88、90-106或151中任一项的样品中病毒的靶脱氧核糖核酸的方法中的用途。163. dna激活的可编程rna核酸酶在测定根据实施方案88、90-106或 152中任一项的样品中病毒的靶核糖核酸的方法中的用途。164.可编程核酸酶在检测根据实施方案108-120、123-148或156中任一项的样品中的靶核酸的方法中的用途。165.一种包含干燥试剂的玻璃毛细管,包含:a)可编程核酸酶b)指导核酸c)经标记的检测核酸。其中经标记的检测核酸能够在指导核酸与靶核酸的区段结合后被切割。166. 实施方案165的玻璃毛细管,其中所述干燥试剂可以储存超过1年。 167.实施方案165的玻璃毛细管,其中所述干燥试剂可以储存至多7 个月、至多8个月、至多9个月、至多10个月、或至多11个月。168. 实施方案165-167中任一项的玻璃毛细管,其中所述干燥试剂可以在室温下稳定储存。169.实施
方案165-168中任一项的玻璃毛细管,其中所述干燥试剂可以在4℃下稳定储存。170.实施方案165-169中任一项的玻璃毛细管,其中可以通过所述毛细管洗脱包含所述靶核酸的样品。171.实施方案98的玻璃毛细管,其中所述样品再水合所述干燥试剂。172.实施方案165-170中任一项的玻璃毛细管,其中所述玻璃毛细管适用于实施方案1-156中任一项的微流体盒或实施方案83-93 中任一项的歧管,用于读出从切割的标记检测核酸发射的可检测信号,其中所述可检测信号是光学信号。173.一种检测靶核酸的方法,所述方法包括:a)提供受试者的样品;b)将样品添加至实施方案165-172 中任一项的玻璃毛细管中;c)将实施方案84-173中任一项的可检测信号与存在或不存在靶核酸的相关联;d)任选地定量所述可检测信号,从而定量所述样品中存在的靶核酸的量。174.一种旋转柱,包括 a)上腔室,所述上腔室包含可编程核酸酶、指导核酸、经标记的检测核酸,其中所述经标记的检测核酸能够在指导核酸与靶核酸的区段结合后被切割,并且其中所述上腔室具有密封的第一侧和包括过滤器的第二侧;b)下腔室,所述下腔室包含用于扩增的试剂和具有靶核酸的样品,其中所述下腔室经由所述上腔室的第二侧附接至所述上腔室。175.实施方案174的旋转柱,其中在离心时,可编程核酸酶、指导核酸和经标记的检测核酸经由过滤器流过底部腔室。176.实施方案 174-175中任一项的旋转柱,其中所述下腔室可以被成像以获得来自切割的标记检测核酸的可检测信号。177.实施方案174-176中任一项的旋转柱,其中所述旋转柱能够被气密密封。178.实施方案174-177 中任一项的旋转柱,其中所述上腔室与所述下腔室热隔绝。179.一种测定样品中冠状病毒靶核酸区段的方法,所述方法包括:a)使样品与以下项接触:i)检测核酸;和ii)组合物,所述组合物包含可编程核酸酶和与靶核酸的区段杂交的非天然存在的指导核酸,其中当非天然存在的指导核酸与冠状病毒靶核酸区段杂交时,所述可编程核酸酶检测核酸酶;和b)测定信号的变化,其中信号的变化由检测核酸的切割产生。180.实施方案179的方法,其中所述冠状病毒靶核酸来自 sars-cov-2。181.实施方案179的方法,其中所述冠状病毒靶核酸来自e基因、n基因或其组合。182.实施方案179的方法,其中所述冠状病毒靶核酸具有seq id no:333-seq id no:338中任一项的序列。 183.实施方案179-182中任一项的方法,其中所述指导核酸是指导 rna。184.实施方案179-183中任一项的方法,其中所述指导核酸与 seq id no:323-seq id no:332中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、或至少99%序列同一性。185.实施方案179-184中任一项的方法,其中所述指导核酸选自 seq id no:323-seq id no:332中的任一项。186.实施方案179-185 中任一项的方法,所述方法进一步包括扩增冠状病毒靶核酸。187.实施方案186的方法,其中所述扩增冠状病毒靶核酸包括使样品与试剂接触以进行扩增。188.实施方案187的方法,其中使样品与试剂接触以进行扩增发生在使样品与检测核酸与检测核酸和组合物接触之前。 189.实施方案187的方法,其中使样品与试剂接触以进行扩增与使样品与检测核酸与检测核酸和组合物接触同时发生。190.实施方案 186-189中任一项的方法,其中所述扩增包括热循环扩增。191.实施方案186-189中任一项的方法,其中所述扩增包括等温扩增。192.实施方案186-191中任一项的方法,其中所述扩增包括转录介导的扩增 (tma)、解旋酶依赖性扩增(hda)、环状解旋酶依赖性扩增(chda)、链置换扩增(sda)、环介导的扩增(lamp)、指数扩增反应(expar)、滚环扩增(rca)、连接酶链反应(lcr)、简单方法扩增rna靶标(smart)、单引物等温扩增(spia)、多置换扩增(mda)、基于核酸序列的扩增(nasba)、铰链引发的引物依赖性核酸扩增 (hip)、切口酶扩增反应(near)或改进的
多置换扩增(imda)。 193.实施方案186-192中任一项的方法,其中所述扩增包括环介导的扩增(lamp)。194.实施方案187-193中任一项的方法,其中用于扩增的试剂包括扩增引物、聚合酶和dntp。195.实施方案187-194 中任一项的方法,其中用于扩增的试剂包括fip引物、bip引物、lf 引物和lb引物。196.实施方案194-195中任一项的方法,其中扩增引物选自seq id no:348-seq id no:353或seq id no:356-seqid no:359。197.实施方案179-196中任一项的方法,其中所述方法进一步包括逆转录冠状病毒靶核酸。198.实施方案197的方法,其中所述逆转录包括使所述样品与用于逆转录的试剂接触。199.实施方案 198的方法,其中用于逆转录的试剂包括逆转录酶、寡核苷酸引物和 dntp。200.实施方案198-199中任一项的方法,其中使样品与用于逆转录的试剂接触发生在使样品与检测核酸与检测核酸和组合物接触之前,在使样品与用于扩增的试剂接触之前,或在这两者之前。201. 实施方案198-200中任一项的方法,其中使样品与用于逆转录的试剂接触与使样品与检测核酸与检测核酸和组合物接触同时发生,与使样品与用于扩增的试剂接触同时发生,或与两者同时发生。202.实施方案179-201中任一项的方法,所述方法进一步包括通过使对照核酸与第二检测核酸和包含可编程核酸酶和与对照核酸的区段杂交的非天然存在的指导核酸的组合物接触来测定对照序列,其中在非天然存在的指导核酸与对照核酸的区段杂交时,可编程核酸酶检测核酸酶。203. 实施方案202的方法,其中对照核酸是rnase p。204.实施方案202-203 中任一项的方法,其中对照核酸具有seq id no:339的序列。205. 实施方案179-204中任一项的方法,其中所述指导核酸与seq id no: 330-seq id no:332具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、或至少99%序列同一性。206.实施方案179-205 中任一项的方法,其中所述指导核酸是seq id no:330-seq id no: 332。207.实施方案179-206中任一项的方法,其中所述方法在横向流动条上进行。208.实施方案207的方法,其中所述横向流动条包括样品垫区域、控制线和测试线。209.实施方案208的方法,进一步包括将所述样品添加至所述样品垫区域。210.实施方案208-209中任一项的方法,其中在对照线处检测是否存在未切割的报道分子并且在测试线处检测是否存在切割的报道分子。211.实施方案179-210中任一项的方法,其中所述方法在实施方案1-81中任一项的微流体盒中进行。 212.实施方案179-211中任一项的方法,进一步包括裂解所述样品。 213.实施方案212的方法,其中裂解样品包括使样品与裂解缓冲液接触。214.实施方案213的方法,其中所述裂解缓冲液包含缓冲剂(ph 值为ph 4至ph 5)和还原剂。215.实施方案214的方法,其中所述还原剂是n-乙酰半胱氨酸、二硫苏糖醇或三(2-羧乙基)膦。216.实施方案214-215中任一项的方法,其中所述缓冲剂是tris、磷酸盐或 hepes。217.实施方案213-216中任一项的方法,其中所述裂解缓冲液还包含螯合剂。218.实施方案217的方法,其中螯合剂是edta或 egta。219.实施方案213-218中任一项的方法,其中裂解缓冲液还包含镁盐。220.实施方案219的方法,其中镁盐是硫酸镁、氯化镁或乙酸镁。221.实施方案179-220中任一项的方法,其中可编程核酸酶包含ruvc催化结构域。222.实施方案179-221中任一项的方法,其中可编程核酸酶是v型crispr/cas效应蛋白。223.实施方案222的方法,其中v型crispr/cas效应蛋白是cas12蛋白。224.实施方案223 的方法,其中cas12蛋白包含cas12a多肽、cas12b多肽、cas12c多肽、cas12d多肽、cas12e多肽、c2c4多肽、c2c8多肽、c2c5多肽、 c2c10多肽和c2c9多肽。225.实施方案223-224中任一项的方法,其中cas12蛋白与seq id no:27-seq id no:37中任一项具有至少 80%、至少85%、至少90%、至少92%、至少95%、
至少97%、或至少99%序列同一性。226.实施方案223-225中任一项的方法,其中 cas12蛋白选自seq id no:27-seq id no:37。227.实施方案222 的方法,其中v型cripsr/cas效应蛋白是cas14蛋白。228.实施方案227的方法,其中cas14蛋白包括cas14a多肽、cas14b多肽、cas14c 多肽、cas14d多肽、cas14e多肽、cas14f多肽、cas14g多肽、cas14h 多肽、cas14i多肽、cas14j多肽、或cas14k多肽。229.实施方案227-228 中任一项的方法,其中cas14蛋白与seq id no:38-seq id no:129 中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、或至少至少99%序列同一性。230.实施方案227-229中任一项的方法,其中cas14蛋白选自seq id no:38-seq id no:129。 231.实施方案222的方法,其中v型cripsr/cas效应蛋白是casф蛋白。232.实施方案231的方法,其中casф蛋白与seq id no: 274-seq id no:321中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、或至少99%序列同一性。233.实施方案231-232中任一项的方法,其中casф蛋白选自seq id no: 274-seq id no:321。234.实施方案179-233中任一项的方法,所述方法进一步包括体外转录扩增的冠状病毒靶核酸。235.实施方案234 的方法,其中体外转录包括使扩增的冠状病毒靶核酸与用于体外转录的试剂接触。236.实施方案235的方法,其中用于体外转录的试剂包括rna聚合酶、引物和ntp。237.实施方案179-236中任一项的方法,其中可编程核酸酶包含hepn切割结构域。238.实施方案179-237 中任一项的方法,其中可编程核酸酶是vi型crispr/cas效应蛋白。 239.实施方案238的方法,其中vi型crispr/cas效应蛋白是cas13 蛋白。240.实施方案239的方法,其中cas13蛋白包括cas13a多肽、 cas13b多肽、cas13c多肽、cas13c多肽、cas13d多肽、或cas13e 多肽。241.实施方案239-240中任一项的方法,其中cas13蛋白与seqid no:130-seq id no:147中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、或至少99%序列同一性。 242.实施方案239-241中任一项的方法,其中cas13蛋白选自seq idno:130-seq id no:147。243.实施方案179-242中任一项的方法,进一步包括多路复用检测多于一种冠状病毒靶核酸。244.实施方案 179-243中任一项的方法,进一步包括多路复用检测多于一种冠状病毒靶核酸和对照核酸。245.实施方案243-244中任一项的方法,其中多路复用检测在试管、孔板、横向流动条或微流体盒中进行。246.实施方案179-245中任一项的方法,其中样品裂解、逆转录、扩增、体外转录、检测或其任何组合在单一体积中进行。247.实施方案179-246 中任一项的方法,其中样品裂解、逆转录、扩增、体外转录、检测或其任何组合在单独的体积中进行。248.一种组合物,包含与seq id no: 323-seq id no:332中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、或至少99%序列同一性的非天然存在的指导核酸。249.实施方案248的组合物,其中指导核酸选自seqid no:323-seq id no:332中的任一项。250.实施方案248-249任一项的组合物,组合物还包含实施方案179-247中任一项的检测核酸。 251.实施方案248-250中任一项的组合物,所述组合物还包含实施例 179-247中任一项的可编程核酸酶。252.实施方案248-251中任一项的组合物,所述组合物还包含实施方案187-247中任一项的用于扩增的试剂。253.实施方案248-252中任一项的组合物,所述组合物还包含实施方案200-247中任一项的用于逆转录的试剂。254.实施方案 248-253中任一项的组合物,所述组合物还包含实施方案135-254中任一项的用于体外转录的试剂。255.实施方案248-254中任一项的组合物,所述组合物还包含实施方案213-247中任一项的裂解缓冲液。 256.实施方案248-255中任一项的组合物,所述组合物还包含实施方案244-247中任一
项的对照核酸。257.实施方案248-256中任一项的组合物,所述组合物还包含实施方案202-247中任一项的指导核酸。 258.实施方案248-257中任一项的组合物,其中所述组合物存在于实施方案245-247中任一项的横向流动条中。259.实施方案248-258中任一项的组合物,其中所述组合物存在于实施方案1-156中任一项的微流体盒中。260.可编程核酸酶在测定根据实施方案179-247中任一项的样品中冠状病毒靶核酸的区段的方法中的用途。261.根据实施方案248-268中任一项的组合物在检测靶核酸的方法中的用途。
[0595]
以下实施方案记载了本文公开的特征的组合的非限制性排列。特征的组合的其他排列也在构想之内。特别地,这些编号的实施方案中的每一项均被构想为依赖于或与每个先前或后续的编号的实施方案相关,而与其列出的顺序无关。1.一种用于检测靶核酸的系统,所述系统包含:靶向靶序列的指导核酸;在与指导核酸和靶序列复合时能够被激活的可编程核酸酶;和报道分子,其中所述报道分子能够被激活的核酸酶切割,从而产生可检测信号。2.实施方案1的系统,其中所述报道分子包含单链报道分子,所述单链报道分子包含检测部分。 3.实施方案1的系统,其中所述病毒包含流感病毒或冠状病毒。4.实施方案3的系统,其中所述流感病毒包含甲型流感病毒、乙型流感病毒或其组合。5.实施方案1的系统,其中所述病毒包含呼吸道病毒。 6.实施方案5的系统,其中所述呼吸道病毒是上呼吸道病毒。7.实施方案1的系统,其中所述指导核酸靶向多个靶序列。8.实施方案1的系统,其中所述系统包含多个针对病毒平铺的指导序列。9.实施方案 7的系统,其中所述多个靶序列包含来自甲型流感病毒、乙型流感病毒和第三病原体的序列。10.实施方案2的系统,其中单链报道分子在 5’末端包含检测部分。11.实施方案2的系统,其中所述单链报道分子包含生物素-dt/fam部分或生物素-dt/rox部分。12.实施方案2的系统,其中单链报道分子在3’末端包含能够与基底缀合的化学功能柄。 13.实施方案12的系统,其中基底是磁珠。14.实施方案12的系统,其中基底是反应腔室的表面。15.实施方案14的系统,其中反应腔室的下游是测试线。16.实施方案15的系统,其中测试线包含链霉亲和素。17.实施方案15的系统,其中测试线的下游是流动对照线。18. 实施方案17的系统,其中流动对照线包含抗igg抗体。19.实施方案 18的系统,其中抗igg抗体包含抗兔igg抗体。20.实施方案11的系统,其中激活的核酸酶能够切割单链报道分子并释放生物素-dt/fam 部分或生物素-dt/rox部分。21.实施方案20的系统,其中生物素
ꢀ‑
dt/fam部分能够结合在测试线的链霉亲和素。22.实施方案1的系统,其中报道分子是电活性报道分子。23.实施方案22的系统,其中电活性报道分子包含生物素和亚甲蓝。24.实施方案1的系统,其中报道分子是酶-核酸。25.实施方案24的系统,其中酶-核酸是转化酶。 26.实施方案24的系统,其中酶-核酸的酶是空间位阻酶。27.实施方案24的系统,其中在酶-核酸的核酸切割时,酶具有功能性。28.实施方案1的系统,其中可检测信号是比色信号、荧光信号、电流信号或电位信号。29.一种检测样品中靶核酸的方法,包括:使样品与靶向靶序列的指导核酸;在与指导核酸和靶序列复合时能够被激活的可编程核酸酶;和报道分子接触,其中所述报道分子能够被激活的核酸酶切割,从而产生可检测信号。30.实施方案29的方法,其中所述靶核酸来自外源病原体。31.实施方案30的方法,其中所述外源病原体包含病毒。32.实施方案31的方法,其中所述病毒包含流感病毒或冠状病毒。33.实施方案32的方法,其中所述流感病毒包含甲型流感病毒、乙型流感病毒或其组合。34.实施方案31的方法,其中所述病毒包含呼吸道病毒。35.实施方案34的方法,其中所述呼吸道病毒是上呼吸道病毒。36.实施方案31的方法,其中可检测信号表明样品中存在病毒。
37.实施方案31的方法,其中所述方法进一步包括诊断从其采集样品的受试者带有病毒。38.实施方案37的方法,其中所述受试者是人。39.实施方案29的方法,其中所述样品是口腔拭子、鼻拭子或尿液。40.实施方案29的方法,其中所述报道分子包含单链报道分子,所述单链报道分子包含检测部分。41.实施方案29的方法,其中所述指导核酸靶向多个靶序列。42.实施方案31的系统,其中所述方法包括针对病毒平铺的多个指导序列。43.实施方案42的方法,其中多个靶序列包含来自甲型流感病毒、乙型流感病毒和第三种病原体的序列。 44.实施方案40的方法,其中单链报道分子在5’末端包含检测部分。 45.实施方案40的方法,其中单链报道分子包含生物素-dt/fam部分或生物素-dt/rox部分。46.实施方案40的方法,其中单链报道分子在3’末端包含能够与基底缀合的化学功能柄。47.实施方案46的方法,其中基底是磁珠。48.实施方案46的方法,其中基底是反应腔室的表面。49.实施方案48的方法,其中反应腔室的下游是测试线。50.实施方案49的方法,其中测试线包含链霉抗生物素蛋白。51.实施方案49 的方法,其中测试线的下游是流动对照线。52.实施方案51的方法,其中流动对照线包含抗igg抗体。53.实施方案52的方法,其中抗igg 抗体包含抗兔igg抗体。54.实施方案45的方法,其中激活的核酸酶能够切割单链报道分子并释放生物素-dt/fam部分或生物素
ꢀ‑
dt/rox部分。55.实施方案54的方法,其中生物素-dt/fam部分能够结合在测试线的链霉亲和素。56.实施方案29的方法,其中报道分子是电活性报道分子。57.实施方案56的方法,其中电活性报道分子包含生物素和亚甲蓝。58.实施方案29的方法,其中报道分子是酶
‑ꢀ
核酸。59.实施方案58的方法,其中酶-核酸是转化酶。60.实施方案 58的方法,其中酶-核酸的酶是空间位阻酶。61.实施方案58的方法,其中在酶-核酸的核酸切割时,酶具有功能性。62.实施方案29的方法,其中可检测信号是比色信号、荧光信号、电流信号或电位信号。63. 实施方案5的系统,其中所述呼吸道病毒是下呼吸道病毒。64.实施方案34的方法,其中所述呼吸道病毒是下呼吸道病毒。65.一种组合物,其包含:a)dna激活的可编程rna核酸酶;b)包含与靶脱氧核糖核酸的区段反向互补的区段的指导核酸,其中dna激活的可编程 rna核酸酶与指导核酸结合以形成复合体。66.实施方案65的组合物,所述组合物还包含rna报道分子。67.实施方案65和66中任一项的组合物,所述组合物还包含来自病毒的靶脱氧核糖核酸。68.实施方案 65-67中任一项的组合物,其中所述靶脱氧核糖核酸是核酸的扩增子。 69.实施方案68的组合物,其中所述核酸是脱氧核糖核酸或核糖核酸。 70.实施方案65-69中任一项的组合物,其中dna激活的可编程rna 核酸酶是vi型crispr/cas酶。71.实施方案65-70中任一项的组合物,其中dna激活的可编程rna核酸酶是cas13。72.实施方案65-71 中任一项的组合物,其中dna激活的可编程rna核酸酶是cas13a。 73.实施方案72的组合物,其中cas13a是lbucas13a或lwacas13a。 74.实施方案65-73中任一项的组合物,其中所述组合物的ph值为ph 6.8至ph 8.2。75.实施方案65-74中任一项的组合物,其中靶脱氧核糖核酸在3’末端缺失鸟嘌呤。76.实施方案65-75中任一项的组合物,其中靶脱氧核糖核酸是单链脱氧核糖核酸。77.实施方案65-76中任一项的组合物,所述组合物还包含支持介质。78.实施方案65-77中任一项的组合物,所述组合物还包含横向流动测定装置。79.实施方案65-78 中任一项的组合物,所述组合物还包含被配置用于荧光检测的装置。 80.实施方案65-79中任一项的组合物,所述组合物还包含第二指导核酸和dna激活的可编程dna核酸酶,其中所述第二指导核酸包含与包含指导核酸的第二靶脱氧核糖核酸的区段反向互补的区段。81.实施方案80的组合物,所述组合物还包含dna报道分子。82.实施方案 80和81中任一项的组
合物,其中dna激活的可编程dna核酸酶是 v型crispr/cas酶。83.实施方案81-82中任一项的组合物,其中dna 激活的可编程dna核酸酶是cas12。84.实施方案83的组合物,其中所述cas12是cas12a、cas12b、cas12c、cas12d或cas12e。85.实施方案80-82中任一项的组合物,其中dna激活的可编程dna核酸酶是cas14。86.实施方案85的组合物,其中所述cas14是cas14a、cas14b、 cas14c、cas14d、cas14e、cas14f、cas14g或cas14h。87.实施方案 82的组合物,其中v型cripsr/cas效应蛋白是casф蛋白。88.实施方案87的组合物,其中所述casф蛋白与seq id no:274-seq id no: 321中任一项具有至少80%、至少85%、至少90%、至少92%、至少 95%、至少97%、或至少99%序列同一性。89.实施方案87-88中任一项的组合物,其中所述casф蛋白选自seq id no:274-seq id no: 321。90.一种测定样品中病毒的靶脱氧核糖核酸的方法,所述方法包括:使所述样品与包含指导核酸和dna激活的可编程rna核酸酶的复合体接触,其中所述指导核酸包含与所述靶脱氧核糖核酸的区段反向互补的区段,和测定通过切割多个rna报道分子中的至少一些 rna报道分子产生的信号。91.测定来自样品中病毒的靶核糖核酸的方法,所述方法包括:扩增样品中的核酸以产生靶脱氧核糖核酸;使所述靶脱氧核糖核酸与包含指导核酸和dna激活的可编程rna核酸酶的复合体接触,其中所述指导核酸包含与所述靶脱氧核糖核酸的区段反向互补的区段,和测定通过切割多个rna报道基因中的至少一些rna报道基因产生的信号。92.实施方案90或91中任一项的方法,其中dna激活的可编程rna核酸酶是vi型crispr核酸酶。93. 实施方案90-92中任一项的方法,其中dna激活的可编程rna核酸酶是cas13。94.实施方案93的方法,其中所述cas13是cas13a。95. 实施方案94的方法,其中所述cas13a是lbucas13a或lwacas13a。 96.实施方案90-95中任一项的方法,其中多个报道分子中的至少一些 rna报道分子的切割在ph 6.8至ph 8.2下发生。96.实施方案90-96 中任一项的方法,其中靶脱氧核糖核酸在3’末端缺失鸟嘌呤。98.实施方案90-97中任一项的方法,其中靶脱氧核糖核酸是单链脱氧核糖核酸。99.实施方案90-98中任一项的方法,其中靶脱氧核糖核酸是核糖核酸的扩增子。100.实施方案90-99中任一项的方法,其中靶脱氧核糖核酸或核糖核酸来自生物体。101.实施方案100的方法,其中所述生物体是病毒、细菌、植物或动物。102.实施方案90-101中任一项的方法,其中所述靶脱氧核糖核酸通过核酸扩增方法产生。103.实施方案102的方法,其中所述核酸扩增方法是等温扩增。104.实施方案 102的方法,其中所述核酸扩增方法是热扩增。105.实施方案102的方法,其中所述核酸扩增方法是重组酶聚合酶扩增(rpa)、转录介导的扩增(tma)、链置换扩增(sda)、解旋酶依赖性扩增(hda)、环介导的扩增(lamp)、滚环扩增(rca)、单引物等温扩增(spia)、连接酶链反应(lcr)、简单方法扩增rna靶标(smart)、或改进的多置换扩增(imda)、或基于核酸序列的扩增(nasba)。106. 实施方案90-105中任一项的方法,其中所述信号是荧光、发光、比色、电化学、酶促、量热、光学、电流或电位信号。107.实施方案90-106 中任一项的方法,所述方法进一步包括使样品与第二指导核酸和dna 激活的可编程dna核酸酶接触,其中所述第二指导核酸包含与包含指导核酸的第二靶脱氧核糖核酸的区段反向互补的区段。108.实施方案39的方法,所述方法进一步包括测定通过切割多个dna报道分子中的至少一些dna报道分子产生的信号。109.实施方案107和108 中任一项的方法,其中dna激活的可编程dna核酸酶是v型crispr 核酸酶。110.实施方案107-109中任一项的方法,其中dna激活的可编程dna核酸酶是cas12。111.实施方案110的方法,其中所述cas12 是cas12a、cas12b、cas12c、cas12d或cas12e。112.实施方案107-109 的方法,其
中dna激活的可编程dna核酸酶是cas14。113.实施方案112所述的方法,其中所述cas14是cas14a、cas14b、cas14c、 cas14d、cas14e、cas14f、cas14g或cas14h。114.实施方案107-109 的方法,其中dna激活的可编程dna核酸酶是casф蛋白。115.实施方案114所述的方法,其中所述casф蛋白与seq id no:274-seqid no:321中任一项具有至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、或至少99%序列同一性。116.实施方案114-115 中任一项的方法,其中所述casф蛋白选自seq id no:274-seq idno:321。117.实施方案90-116中任一项的方法,其中所述指导核酸包含crrna。118.实施方案90-117中任一项的方法,其中所述指导核酸包含crrna和tracrrna。119.实施方案90-118中任一项的方法,其中在切割至少一些rna报道分子之前存在信号。120.实施方案 90-119中任一项的方法,其中在切割至少一些rna报道分子之前不存在信号。121.实施方案90-120中任一项的方法,其中所述样品包含血液、血清、血浆、唾液、尿液、粘膜样品、腹膜样品、脑脊液、胃分泌物、鼻分泌物、痰、咽溢泌物、尿道或阴道分泌物、溢泌物、积液或组织。122.实施方案90-121中任一项的方法,其中所述方法在支持介质上进行。123.实施方案90-122中任一项的方法,其中所述方法在横向流动测定装置上进行。124.实施方案90-123中任一项的方法,其中所述方法在被配置用于荧光检测的装置上进行。125.一种设计用于扩增靶核酸的多个引物的方法,所述方法包括:提供靶核酸,其中指导核酸与靶核酸杂交并且其中至少60%的靶核酸序列在f1c区和 b1区之间或在f1和b1c区之间;设计多个引物,其包含:i)包含 f2区序列5’的f1c区序列的正向内部引物;ii)包含b2区序列5’的 b1c区序列的反向内部引物;iii)包含f3区序列的正向外部引物;和 iv)包含b3区序列的反向外部引物。126.一种检测样品中靶核酸的方法,所述方法包括:使样品与以下项接触:多个引物,其包含:i) 包含与对应于f2区的序列5’的f1c区对应的序列的正向内部引物; ii)包含与对应于b2区的序列5’的b1c区对应的序列的反向内部引物;iii)包含对应于f3区的序列的正向外部引物;和iv)包含对应于b3区的序列的反向外部引物;指导核酸,其中所述指导核酸与所述靶核酸杂交,并且其中至少60%的靶核酸序列在f1c区和b1区之间或在f1区和b1c区之间;报道分子;以及当与指导核酸复合时切割报道分子的可编程核酸酶;和测量由所述报道分子的切割产生的可检测信号,其中所述测量提供样品中靶核酸的检测。127.实施方案 125-126中任一项的方法,其中在f1c区和b1区之间的序列或在b1c 区和f1区之间的序列与指导核酸序列至少50%反向互补。128.实施方案125-127中任一项的方法,其中指导核酸序列与不超过50%的正向内部引物、反向内部引物或其组合反向互补。129.实施方案125-128 中任一项的方法,其中指导核酸不与正向内部引物和反向内部引物杂交。130.实施方案125-129中任一项的方法,其中前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是靶核酸的3’。131.实施方案125-130中任一项的方法,其中前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是b1区的3’和f1c区的5’,或前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是f1区的3’和b1c区的5’。132.权利要求125-131中任一项的方法,其中靶核酸的3’末端在f3c区的5’末端的5’,或靶核酸的3’末端在b3c区的5’末端的5’。133.实施方案125-132中任一项的方法,其中靶核酸的3’末端在f2c区的5’末端的5’,或靶核酸的3’末端在b2c区的5’末端的5’。134.实施方案125-133中任一项的方法,其中靶核酸在f1c区和b1区之间并且靶核酸的3’末端在f2c区的3’末端的5’,或其中靶核酸在b1c区和f1区之间并且靶核酸的3’末端在b2c区的3’末端的 5’。135.实施方案125-134中任一项的方法,其中所述指导核酸具有与不超过50%的正向内
部引物、反向内部引物、正向外部引物、反向外部引物或其任何组合反向互补的序列。136.实施方案125-135中任一项的方法,其中所述指导核酸序列不与正向内部引物、反向内部引物、正向外部引物、反向外部引物或其任何组合杂交。137.实施方案 125-136中任一项的方法,其中所述指导核酸序列具有与不超过50%的f3c区、f2c区、f1c区、b1c区、b2c区、b3c区或其任何组合的序列反向互补的序列。138.实施方案125-137中任一项的方法,所述指导核酸序列不与f3c区、f2c区、f1c区、b1c区、b2c区、b3c区或其任何组合的序列杂交。139.一种设计用于扩增靶核酸的多个引物的方法,所述方法包括:提供包含与指导核酸杂交的在b2区和b1 区之间或在f2区和f1区之间的序列的靶核酸;和设计多个引物,其包含:i)包含f2区序列5’的f1c区序列的正向内部引物;ii)包含 b2区序列5’的b1c区序列的反向内部引物;iii)包含f3区序列的正向外部引物;和iv)包含b3区序列的反向外部引物。140.一种设计用于扩增靶核酸的多个引物的方法,所述方法包括:提供包含与指导核酸杂交的在f1c区和f2c区之间或在b1c区和b2c区之间的序列的靶核酸;和设计多个引物,其包含:i)包含f2区序列5’的f1c区序列的正向内部引物;ii)包含b2区序列5’的b1c区序列的反向内部引物;iii)包含f3区序列的正向外部引物;和iv)包含b3区序列的反向外部引物。141.一种检测样品中的靶核酸的方法,所述方法包括:使所述样品与以下项接触:多个引物,其包含:i)包含与对应于f2 区的序列5’的f1c区对应的序列的正向内部引物;ii)包含与对应于 b2区的序列5’的b1c区对应的序列的反向内部引物;iii)包含对应于f3区的序列的正向外部引物;和iv)包含对应于b3区的序列的反向外部引物;指导核酸,其中所述靶核酸包含与所述指导核酸杂交的在b2区和b1区之间或在f2区和f1区之间的序列;报道分子;以及当与指导核酸复合时切割报道分子的可编程核酸酶;和测量由所述报道分子的切割产生的可检测信号,其中所述测量提供样品中靶核酸的检测。142.一种检测样品中靶核酸的方法,所述方法包括:使样品与以下项接触:多个引物,其包含:i)包含与对应于f2区的序列5’的f1c区对应的序列的正向内部引物;ii)包含与对应于b2区的序列 5’的b1c区对应的序列的反向内部引物;iii)包含对应于f3区的序列的正向外部引物;和iv)包含对应于b3区的序列的反向外部引物;指导核酸,其中所述靶核酸包含与所述指导核酸杂交的在f1c区和 f2c区之间或在b1c区和b2c区之间的序列;报道分子;以及当与指导核酸复合时切割报道分子的可编程核酸酶;和测量由所述报道基因的切割产生的可检测信号,其中所述测量提供样品中靶核酸的检测。 143.实施方案139或实施方案141中任一项的方法,其中前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)是b2区的3’和b1 区的5’,或前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs) 是f2区的3’和f1区的5’。144.实施方案140或实施方案142中任一项的方法,其中前间区序列邻近基序(pam)或前间区序列侧翼位点 (pfs)是b1c区的3’和b2c区的5’,或前间区序列邻近基序(pam) 或前间区序列侧翼位点(pfs)是f1c区的3’和f2c区的5’。145.实施方案139-144中任一项的方法,其中前间区序列邻近基序(pam) 或前间区序列侧翼位点(pfs)是靶核酸的3’。146.实施方案145的方法,其中pam和pfs在f1c区5’末端的5’、b1c区5’末端的5’、 f3区3’末端的3’、b3区3’末端的3’、f2区3’末端的3’、b2区3’末端的3’或其任何组合。147.实施方案146的方法,其中pam和pfs 不与f2区、b3区、f1c区、f2区、b1c区、b2区或其任何组合重叠。 148.实施方案145-147中任一项的方法,其中pam和pfs不与正向内部引物、反向内部引物、正向外部引物、反向外部引物或其任何组合杂交。149.实施方案125-148中任一项的方法,其中多个引物还包含环正向引物。150.实施方案125-149
中任一项的方法,其中多个引物还包含环反向引物。151.实施方案149-150中任一项的方法,其中环正向引物在f1c区和f2c区之间。152.实施方案150-151中任一项的方法,其中环反向引物在b1c区和b2c区之间。153.实施方案 125-152中任一项的方法,其中靶核酸包含单核苷酸多态性(snp)。在一些方面,单核苷酸多态性(snp)包含herc2 snp。154.实施方案153的方法,其中所述单核苷酸多态性(snp)包含herc2 snp。 155.实施方案153的方法,其中单核苷酸多态性(snp)与癌症风险增加或风险降低相关。156.实施方案126-138或141-155中任一项的方法,其中靶核酸包含单核苷酸多态性(snp),并且其中在与包含单核苷酸多态性(snp)的靶核酸100%互补的指导核酸存在下的可检测信号比在与包含单核苷酸多态性(snp)的靶核酸小于100%互补的指导核酸存在下的可检测信号更高。157.实施方案125-156中任一项的方法,其中多个引物和指导核酸一起存在于包含靶核酸的样品中。158.实施方案126-138或141-157中任一项的方法,其中使样品与多个引物接触导致扩增靶核酸。159.实施方案158的方法,其中样品与指导核酸的扩增和接触同时发生。160.实施方案158的方法,其中样品与指导核酸的扩增和接触在不同时间发生。161.实施方案 126-138或141-160中任一项的方法,其中所述方法进一步包括提供聚合酶、datp、dttp、dgtp、dctp或其任何组合。162.实施方案 125-161中任一项的方法,其中所述靶核酸来自病毒。163.实施方案 162的方法,其中所述病毒包含流感病毒、呼吸道合胞病毒、冠状病毒或其组合。164.实施方案163的方法,其中所述流感病毒包含甲型流感病毒、乙型流感病毒或其组合。165.实施方案162-164中任一项的方法,其中所述病毒包含呼吸道病毒。166.实施方案165的方法,其中所述呼吸道病毒是上呼吸道病毒。167.实施方案1-28中任一项的系统,其中所述系统还包含正向内部引物、反向内部引物、正向外部引物、反向外部引物、环正向引物、环反向引物或其任何组合。168. 实施方案29-64中任一项的方法,所述方法进一步包括使样品与正向内部引物、反向内部引物、正向外部引物、反向外部引物、环正向引物、环反向引物或其任何组合接触。169.实施方案87的方法,所述方法进一步包括用正向内部引物、反向内部引物、正向外部引物、反向外部引物、环正向引物、环反向引物或其任何组合扩增靶脱氧核糖核酸。170.实施方案88-125中任一项的方法,其中所述扩增包括使样品与正向内部引物、反向内引物、正向外部引物、反向外部引物、环正向引物、环反向引物或其任何组合接触。171.实施方案3、32或163 中任一项的系统或方法,其中所述冠状病毒是sars cov-2。172.实施方案105的方法,其中所述核酸扩增方法是环介导的扩增(lamp)。实施例
[0596]
以下实施例是说明性的,并且不限于本文所述的装置、系统、流体装置、试剂盒和方法的范围。实施例1流感测试
[0597]
可以测试来自个体的生物样品以确定个体是否患有流感。可以测试生物样品以检测是否存在指示甲型流感病毒或乙型流感病毒的靶核酸。
[0598]
个体获得尿液的生物样品并将生物样品施加到试剂盒中提供的试剂腔室中的本文所述的试剂。所述试剂包含靶向存在于病毒中并且是病毒特异性的核酸的指导核酸、可编程核酸酶和具有检测部分的单链检测核酸。生物样品中具有流感病毒,并且来自病毒的靶核酸与指导核酸结合并激活可编程核酸酶以切割靶核酸和单链检测核酸。
[0599]
在样品和试剂接触预定时间之后,个体可以将反应的样品和试剂施加到支持介质上的样品垫区域。支持介质包括装在保护性壳体中的横向流动测定测试条,该保护性壳体具有用于样品垫区域以施加反应样品和试剂的开口以及用于读取测试结果的检测区域的开口。壳体还具有基准标记、参考色标和识别试剂盒进行的测试的条形码。随着反应的样品和试剂沿横向流动测定测试条移动到检测区域,来自切割的单链检测核酸的检测部分与支持介质上的捕获分子和检测区域中的检测分子结合以在支持介质上产生可检测信号。可检测信号可以在支持介质的检测区域中成行。一旦测试完成,通过检测区域开口可见一条阳性对照标记线和另一条阳性测试线。
[0600]
在将反应的样品和试剂施加到支持介质后的预定时间量之后,个体可以使用移动装置获取测试结果。个体可以打开移动应用程序以在带有摄像头的移动装置上读取测试结果,并使用移动装置的相机和移动应用程序的gui来拍摄支持介质的图像,包括壳体上的检测区域、条形码、参考色标和基准标记。移动应用程序基于图像中的条形码识别测试,基于条形码对测试的识别在同一图像中使用壳体上的基准标记和参考色标分析图像中的检测区域,并确定是否存在病毒。移动应用程序可以将测试结果呈现给个体。移动应用程序可以将测试结果存储在移动应用程序中。移动应用程序可以与远程设备通信并传输测试结果的数据。其他个体(包括医疗保健专业人员)可以从远程设备远程查看测试结果。实施例2流感测试-试纸法
[0601]
可以测试来自个体的生物样品以确定个体是否患有流感。可以测试生物样品以检测是否存在指示甲型流感或乙型流感的靶核酸。
[0602]
个体获得尿液的生物样品并将生物样品施加到试剂盒中提供的试剂腔室中的本文所述的试剂。该试剂包含靶向存在于病毒中并且是病毒特异性的核酸的指导核酸、可编程核酸酶和单链检测核酸。
[0603]
在样品和试剂接触预定时间之后,个体可以将支持介质的一端放入试剂腔室中,以将反应的样品和试剂施加到支持介质上的样品垫区域。支持介质包括横向流动测定测试条。随着反应的样品和试剂沿试纸条移动到检测区域时,阳性对照标记线在检测区域中变得可见。在将反应的样品和试剂施加到支持介质上后的预定时间之后,可以将支持介质放入具有用于读取测试结果的检测区域的开口、基准标记、参考色标和识别试剂盒进行的测试的条形码的保护壳体中。
[0604]
个体可以使用移动装置获取测试结果。个体可以打开移动应用程序以在带有摄像头的移动装置上读取测试结果,并使用移动装置的相机和移动应用程序的gui来拍摄支持介质的图像,包括壳体上的检测区域、条形码、参考色标和基准标记。移动应用程序基于图像中的条形码识别测试,基于条形码对测试的识别在同一图像中使用壳体上的基准标记和参考色标分析图像中的检测区域,并确定是否存在病毒。移动应用程序可以将测试结果呈现给个体。实施例3流感测试-在支持介质上原位切割
[0605]
可以测试来自个体的生物样品以确定个体是否患有流感。可以测试生物样品以检测是否存在指示甲型流感病毒或乙型流感病毒的靶核酸。
[0606]
个体获得尿液的生物样品并将生物样品施加到试剂盒中提供的支持介质上的样品垫区域上的本文所述的试剂。该试剂包含靶向存在于病毒中并且对病毒特异性的核酸的指导核酸、可编程核酸酶和单链检测核酸。支持介质包括装在保护性壳体中的横向流动测定测试条,该保护性壳体具有用于读取测试结果的检测区域的开口、基准标记、参考色标和识别试剂盒进行的测试的条形码。
[0607]
在样品和试剂在支持介质上接触预定时间之后,反应的样品和试剂沿支持介质移动到支持介质上的检测区域。个体可以任选地放入少量缓冲液,以助于使反应的样品和试剂移动到检测区域。随着反应的样品和试剂沿试纸条移动到检测区域时,阳性对照标记线在检测区域中变得可见。
[0608]
个体可以使用移动装置获取测试结果。个体可以使用移动装置获取测试结果。移动应用程序基于图像中的条形码识别测试,分析图像中的检测区域,并确定是否存在病毒。移动应用程序可以将测试结果呈现给个体。实施例4多种流感病毒的测试-多路复用横向流动测定
[0609]
可以测试来自个体的生物样品以确定个体是否带有一种或多于一种流感病毒株(例如甲型流感病毒、乙型流感病毒。可以测试生物样品以检测是否存在一种或多种靶核酸,其中单个靶核酸指示病毒。
[0610]
个体获得尿液的生物样品并将生物样品施加到试剂盒中提供的多个试剂腔室中以测试一组流感病毒株。每个试剂腔室包含对检测一种流感病毒株具有特异性的试剂。每个试剂腔室中的试剂包括靶向存在于病毒中的核酸的指导核酸;可编程核酸酶;和单链检测核酸。
[0611]
在样品和试剂接触预定时间之后,个体可以将反应过的样品和试剂从试剂腔室中的一个腔室施加到支持介质上匹配的样品垫区域。每个试剂腔室在支持介质上均有匹配的样品垫区域。支持介质包括装在保护性壳体中的多个横向流动测定测试条,该保护性壳体具有用于匹配样品垫区域的开口以应用来自匹配试剂腔室的反应样品和试剂,以及具有用于读取测试结果的检测区域。壳体还具有基准标记、参考色标和识别试剂盒进行的测试的条形码。随着反应的样品和试剂沿横向流动测定测试条移动到检测区域,每个横向流动测试条的阳性对照标记通过检测区域开口变得可见。
[0612]
在将反应的样品和试剂施加到支持介质后的预定时间量之后,个体可以使用移动装置获取测试结果。个体可以使用移动装置获取测试结果。个体可以使用移动装置获取测试结果。移动应用程序基于图像中的条形码识别测试,分析图像中的检测区域,并确定是否存在病毒(甲型流感、乙型流感或甲型和乙型流感)。移动应用程序可以将测试结果呈现给个体。实施例5多种流感病毒株的测试-多路复用横向流动测定
[0613]
可以测试来自个体的生物样品以确定个体是否带有一种或多于一种流感毒株(例如甲型流感、乙型流感。可以测试生物样品以检测是否存在一种或多种靶核酸,其中单个靶核酸指示病毒。
[0614]
个体获得尿液的生物样品并将生物样品施加到试剂盒中提供的试剂腔室以测试
一组流感病毒株。试剂腔室包含多组试剂以检测多种流感病毒株。用于检测一种流感病毒株的一组试剂包括靶向存在于病毒中并且是病毒特异性的核酸的指导核酸;可编程核酸酶;和单链检测核酸。
[0615]
在样品和试剂接触预定时间之后,个体可以将反应的样品和试剂施加到支持介质上的样品垫区域。支持介质包括可以检测测试条上的多个检测分子的多路复用横向流动测定测试条。横向流动测定条装在保护性壳体中,该壳体具有用于样品垫区域的开口以施加反应的样品和试剂,以及具有用于读取测试结果的检测区域。壳体还具有基准标记、参考色标和识别试剂盒进行的测试的条形码。随着反应的样品和试剂沿横向流动测定测试条移动到检测区域,每个横向流动测试条的阳性对照标记通过检测区域开口变得可见。
[0616]
在将反应的样品和试剂施加到支持介质后的预定时间量之后,个体可以使用移动装置获取测试结果。个体可以使用移动装置获取测试结果。个体可以使用移动装置获取测试结果。移动应用程序基于图像中的条形码识别测试,分析图像中的检测区域,并确定是否存在病毒。移动应用程序可以将测试结果呈现给个体。实施例6使用流体装置检测来自呼吸道病毒的核酸
[0617]
本实施例说明了使用流体装置检测来自呼吸道病毒(例如流感病毒)的核酸。使用流体装置进行用于检测样品中呼吸道病毒(例如流感病毒)的靶核酸的crispr-cas反应。
[0618]
图1示出了说明crispr-cas反应的工作流程的示意图。工作流程中的步骤1是样品制备,工作流程中的步骤2是从呼吸道病毒(例如流感病毒)扩增靶核酸。工作流程中的步骤3是cas反应温育。工作流程中的步骤4是检测(读出)。如果将检测和读出结合到cas反应中,则步骤1和2是任选的,步骤3和4可以同时进行。图2显示了所使用的用于样品制备的流体装置。样品制备流体装置处理不同类型的生物样品。生物样品是手指刺血、尿液或粪便拭子、鼻拭子、面颊拭子或其他收集物拭子。样品在图2的流体装置中制备,然后引入到流体装置中。
[0619]
流体装置是图3的三个流体装置之一或图5的流体装置。图3 的三个流体装置可以在荧光或电化学读出情况下进行cas反应。分解视图概括了用于检测反应的荧光和电化学过程,如图4所示。图4显示了所使用的读出过程的示意图,包括(a)荧光读出和(b)电化学读出。图5显示了用于在比色或电化学/血糖仪读出情况下的偶联的转化酶 /cas反应的流体装置。该图示出了用于使与转化酶偶联的cas反应小型化的流体装置。在底部的分解视图中描述了表面修饰和读出过程,包括(a)使用dns或其他化合物的光学读出,以及(b)电化学读出(电化学分析仪或血糖仪)。
[0620]
将来自呼吸道病毒(例如,流感病毒)的包含目标靶核酸的样品引入图2的流体装置中。过滤样品并将其引入图3或图5的流体装置中,其中感兴趣的核酸任选地被扩增,并与预复合的cas混合物一起温育。cas-grna复合体与扩增的样品中与其匹配的核酸靶结合,并被激活为非特异性核酸酶,所述非特异性核酸酶切割基于核酸的报道分子以产生信号读出。使用如图4所示的荧光读数、电化学读数或电化学发光读数或如图5所示的光学读数或电化学读数检测来自呼吸道病毒(例如流感病毒)的目标靶核酸。实施例7使用crispr/cas系统经由detectr反应电化学检测来自呼吸道病毒的靶核酸
[0621]
本实施例描述了使用crispr/cas系统在detectr反应中对来自呼吸道病毒(例如流感病毒)的靶核酸的电化学检测。在该测定中,使用在阳性detectr反应(其中存在靶核酸的反应)存在下被酶切割的生物素化的crispr-cas报道分子采用生物素-链霉亲和素信号增强方法。
[0622]
测试电化学检测作为(1)使用固定在电极表面上的二茂铁标记的寡核苷酸和(2)将detectr与转化酶催化反应结合(二者也在本文中公开)的替代方案。后一者反应产生的葡萄糖可以用血糖仪直接或间接检测。电化学检测和使用二茂铁标记的寡核苷酸的检测均是电位法,而转化酶催化反应是电流法。
[0623]
使用dnase酶切割报道分子,与报道分子完整时相比,切割导致氧化峰处的电流增加。使用台式金标准电化学分析仪(ustat, metrohm,usa)收集结果。报道基因的序列是 /5biosg/tttttttttttttttttttt/3mebln/(seq id no:373)。获得循环伏安图,其中电活性报道分子的切割导致电流增加。实施例8用于使用crispr-cas系统经由detectr反应检测来自呼吸道病毒的靶核酸的基于荧光的装置
[0624]
本实施例描述了用于使用crispr-cas系统在detectr反应中检测来自呼吸道病毒(例如流感病毒)的靶核酸的基于荧光的装置。两种方法用于开发用于检测来自呼吸道病毒(例如流感病毒)的靶核酸的detectr反应的小型化装置。首先,将玻璃毛细管(drummondscientific,美国)用作detectr反应的单个毛细管驱动容器。使用试剂的快速干燥制剂和液体制剂。第二,使用没有机械致动的市售塑料(topas)微流体芯片(microfluidic chip shop,德国),以进行混合或试剂输送。
[0625]
使用(1)便携式的基于光电二极管的荧光传感器(eselog, quiagen lake constance,德国)和(2)市售透照器(e-gel, thermofisher,美国)收集结果。该系统检测能力的主要进步包括基于芯片的检测反应。来自一锅逆转录-重组酶聚合酶扩增-体外转录 (rt-rpa-ivt)-detectr反应的荧光实时测量在芯片上进行实施例9用于呼吸道病毒靶核酸的高灵敏度和广谱检测的指导物合并
[0626]
本实施例描述了用于高灵敏度和广谱检测来自呼吸道病毒(例如流感病毒)的靶核酸的指导物合并。虽然传统检测需要每个靶序列 /生物体一种grna,但本文公开的指导物合并方法,包括使用具有一种或多种crispr效应蛋白的多种grna,适用于提高灵敏度(在跨单个靶序列/生物体的指导物平铺的情况下)和广谱检测(在单个反应中检测多个靶序列/生物体的情况下)。因此,与传统的诊断方法相比,指导物合并是提高检测灵敏度性能以及作为快速且低成本的初始分类步骤的有用方法(例如,血源性病原体、大流行性流感、泛细菌检测等的“警报”)。
[0627]
为了进行detectr测定,首先将指导rna(crrna)与cas 蛋白复合。复合反应在37℃下进行30分钟。然后添加报道分子和另外缓冲液以完成复合体主混合物。最后,将复合体添加到样品中,以检测指导物特异性靶向的序列。通过合并设计用于靶向同一靶的不同序列或不同序列区段的多个指导rna,可以在单个反应中拓宽检测谱并提高检测效率。为了实现这一目标,将指导rna高浓度地分别与cas蛋白复合。合并多个指导物-蛋白复合体反应。合
并后,添加报道分子和另外缓冲液以完成合并的复合体,以用于detectr测定。a.用于检测流感毒株的指导物合并。
[0628]
用于检测流感毒株的指导物合并方法涉及使用不同流感毒株 (例如,来自iav和/或ibv的毒株)的指导rna。多种指导rna (例如15-20种)被设计靶向1种流感病毒株。
[0629]
detectr测定中使用的可编程核酸酶是lbcas12a(seq idno:27)。报道分子是8-mer ssdna,带有fam标记的5’末端和iowablack fq标记的3’末端。
[0630]
指导rna(crrna)单独与高浓度的lbcas12a蛋白复合。每个crrna在1x mbuffer 2(20mm tris hcl(ph8)、100mm nacl、 5mm mgcl2、1mm dtt、5%甘油、50ug/ml肝素)中与lbcas12a 混合。crrna和蛋白的浓度比标准单指导物复合反应中的高至少4倍。将混合物在37℃下温育30分钟,以形成指导物-蛋白复合体。下面的表8列出了复合反应的配制。该体积用于一个detectr反应,并且可以相应地按比例放大。表8表8
[0631]
指导物合并。温育完成时,通过组合等体积的单指导物-蛋白复合反应生成指导物池。生成了不同n-plex(n=不同指导物的数量)级别的几个池。
[0632]
每20μl detectr测定中使用5ul的复合反应。指导物和蛋白质测定中的有效浓度是复合反应中的有效浓度的四分之一。
[0633]
复合体主混合物。通过添加等体积的mix2(包含ssdna报道分子和另外缓冲液,配制列于表9)完成了指导物池的复合体主混合物。表9
[0634]
此外,将mix2添加到单独的指导物-蛋白复合反应中,以生成单个指导物复合体主混合物。在复合体主混合物中,指导物和蛋白的浓度被稀释了一半。
[0635]
detectr测定。将靶标稀释至200pm和20pm。在每个 detectr测定中,在384孔板的
detectr测定中的温度和crispr-cas蛋白温度耐受性优化。本公开内容的crispr诊断利用v型(例如,cas12) 和vi型(例如,cas13)crispr-cas蛋白的独特生化特性来实现核酸的特异性检测。这些蛋白通过crispr rna(crrna)(也称为指导rna(grna))定向结合来自呼吸道病毒(例如流感病毒)的靶核酸。一旦与互补的靶序列结合,cas蛋白开始无差别地切割周围的单链dna或单链rna。当与猝灭的荧光报道分子或其他切割报道分子偶联时,cas蛋白仅在存在靶核酸的情况下才会产生荧光或其他信号。crispr-cas蛋白分离自各种自然环境,因此对升高的温度具有不同的耐受性并且具有最佳温度范围。这些不同的温度耐受性用于在不同阶段激活或抑制蛋白,以实现其他分子过程,例如来自呼吸道病毒(例如流感病毒)的核酸的靶向扩增。
[0640]
在靶核酸来自呼吸道病毒(例如流感病毒)并使用cas12变体 (seq id no:37)可编程核酸酶的detectr检测中,v型蛋白cas12 变体在25℃至45℃范围具有功能,在35℃下具有最大活性。对于v 型蛋白lbcas12a(seq id no:27),在35℃至50℃范围具有功能,在40℃左右具有峰值活性。对于vi型蛋白lbucas13a(seq id no: 131),在25℃至40℃范围具有功能,在30℃至35℃下具有最大活性。v型蛋白,例如cas12变体和lbcas12a,在高温下稳定且具有功能性。在靶核酸来自呼吸道病毒(例如流感病毒)的detectr测定中,cas12变体在37℃的温度下表现出活性。该温度变化可用于等温扩增方法,其中扩增在较高的温度下发生,但是在降低反应温度后, cas蛋白可以被激活而不会损害其功能。
[0641]
在靶核酸来自呼吸道病毒(例如流感病毒)的detectr测定中,cas12变体在升高的温度下暴露30分钟后保持稳定,然后将反应温度降至37℃。cas12变体在0.5x nebuffer4(new england biolabs) 0.05%tween和1x mbuffer3中具有活性。实施例11样品制备方案和装置工作流程
[0642]
本实施例描述了样品制备方案和装置工作流程。通常在护理点或临床实验室进行收集和处理用于诊断分析的材料。当前有最少的方法可用于家庭样品收集和核酸提取以进行诊断分析。本文公开的装置提供了一种用于具有或不具有核酸扩增以及具有或不具有detectr 反应的核酸提取的非处方溶液。这些模块中的任何一个或所有模块生成的产物都将被应用到读出设备,以进行数据收集和后续分析。
[0643]
粗样品制备方案包括将样品从样品收集装置(例如拭子)洗脱到缓冲液中,所述缓冲液将诱导样品解离成释放其基因组核酸的大分子组分。这些组分包括以下任何一项或全部:ph值变化,离液盐和去污剂(tween 20,triton x-100,脱氧胆酸盐,月桂硫酸钠或chaps。该方案以逐步的工作流程发生,该工作流程将馈入手持式装置。在该装置中,至少有一个腔室,其中装有用于样品制备方案的试剂组分。
[0644]
图7显示了本公开内容的样品制备装置的各个部分。该图的a 部分显示了单个腔室样品提取装置:(a)插入物固定样品收集装置,并调节样品提取和将样品分配到另一个反应或检测装置之间的步骤, (b)单个腔室包含提取缓冲液。该图的b部分显示了可以在分配室中填充可在分配核酸时进一步纯化核酸的材料,这是一种选择:(a)插入物固定样品收集装置并调节样品提取和核酸扩增的“阶段”。每组凹槽 (红色、蓝色和绿色)与前一组凹槽偏移90
°
,(b)反应模块包含由基底隔开的多个腔室,这些腔室允许进行独立的反应。(例如,i.核酸分离室,ii.核酸扩增腔室和iii.detectr反应腔室或分配腔室)。 detectr反应腔室或
分配腔室)。每个腔室都有凹槽(黑色),其防止插入物在非故意90
°
转动的情况下进入下一个腔室。前两个腔室可以由在提取和扩增反应之间去除抑制剂的材料隔开。c部分显示了反应/分配腔室的选项:(a)单个分配腔室可以仅释放提取的样品或提取/扩增或提取/扩增/检测反应,(b)双重分配腔室可以释放提取/ 多路复用扩增产物,和(c)四重分配腔室将实现多路复用扩增和单个detectr或四个单个扩增反应。
[0645]
图8显示了使用样品处理装置的样品工作流程。样品收集装置安装在样品处理装置的插入部分(a)。将插入物放入装置腔室并压紧,直到第一止动件(绿色凸舌与黑色凸舌相遇)(b)。该步骤允许样品与核酸提取试剂接触。在适当的时间后,将插入物旋转90
°
(c),然后将其按下(d)至下一组凹槽。这些动作将样品转移到扩增腔室中。样品收集装置不再与样品或扩增产物接触。经过适当的温育后,将插入物旋转90
°
(e)并按下(f)到下一组凹槽。这些动作将样品释放到 detectr(绿色反应)中。再次将插入物旋转90
°
(g)并按下(h)以分配反应。
[0646]
粗样品制备方案的实施例总结在表11中。表11
[0647]
图9显示了用于从剩余临床样品中提取甲型流感rna的提取缓冲液。将重复的剩余临床样品暴露于上面表11中列出的试剂。提取过程使用nucleospin病毒试剂盒完成。进行qpcr分析以评估提取的rna基因组的质量和数量。低ph条件产生的rna量等于使用“金标准”试剂盒(rt-池)提取的样品。
[0648]
图10显示低ph条件允许快速提取甲型流感基因组rna。减少在低ph条件下的暴露时间不会影响病毒解离的效率,随后使用 nucleospin virus试剂盒完成提取。提取的产物的量类似于“金标准”提取(rt-池)。实施例12crispr-cas诊断中的等温扩增
[0649]
该实施例描述了本公开内容的crispr-cas诊断中的等温扩增方法,包括那些涉及detectr测定的诊断。crispr诊断剂利用v 型(例如,cas12)和vi型(例如,cas13)crispr-cas蛋白的独特生化特性来实现核酸的特异性检测。这些蛋白通过crispr rna (crrna)(也称为指导rna(grna))导向其靶核酸。一旦与互补靶序列结合,cas蛋白就开始对周围的单链dna或单链rna进行不加区分的切割。当与猝灭的荧光报道分子或其他切割报道分子偶联
时,仅在靶核酸存在下cas蛋白才能产生荧光或其他信号。这些蛋白单独能够在靶核酸的pm或fm范围内进行检测。当与在该实施例中提出并在本文其他地方公开的核酸扩增偶联时,crispr诊断的灵敏度增加到了am或zm范围。pcr是一种常用的核酸扩增方法,当温度在两个或三个不同的温度之间循环时,会生成双链dna(dsdna)。在单一温度下起作用的核酸扩增方法称为等温扩增。这些方法包括 lamp、rpa、siba、sda和nasba。这些方法可以与逆转录(rt) 结合,逆转录通过首先通过逆转录将rna转换为cdna,从而使这些方法能够扩增rna靶。
[0650]
使用靶核酸的等温扩增方法运行使用v型(例如cas12)和 casvi(例如cas13)蛋白的基于crispr的诊断,以实现敏感的诊断测定。
[0651]
rpa.重组酶聚合酶扩增(rpa)通过在反应(rt-rpa)中加入逆转录酶来扩增dna序列或rna序列。rpa和rt-rpa可用于生成适用于v型(例如cas12)cas蛋白检测的扩增子。
[0652]
图11显示了rt-rpa在通过cas12a检测甲型流感、乙型流感和人类呼吸道合胞病毒(rsv)病毒rna中的应用。通过在rpa引物之一上包含t7启动子,在rpa反应后进行使用rna聚合酶将rna 转化为dna的体外转录(ivt)反应,以生成可被vi型(例如cas13) 蛋白检测的靶rna。在图11中,使用cas12a从甲型流感(iav),乙型流感(ibv)和人呼吸道合胞病毒(rsv)rna的4000个拷贝中进行了rt-rpa扩增子的检测。rt-rpa反应在40℃下进行30分钟。对照包括无rt酶,无靶标对照和引物对照。rt-rpa反应后,将rt-rpa扩增子转移至cas12a detectr测定。
[0653]
图12显示了rt-rpa结合ivt反应的应用,这使得能够使用 cas13a检测病毒rna。在图12中,使用cas13a从2fm的ppr病毒 rna中检测rt-rpa扩增子。rt-rpa反应在40℃下进行30分钟。评估了几种逆转录酶与rpa反应的相容性。对照包括无rt酶、无靶标和无引物。在进行rt-rpa反应后,将rt-rpa扩增子转移至ivt 反应中,以在37℃的条件下10分钟生成rna。稀释ivt反应的产物,并在37℃下添加至cas13a反应中。使用中靶和脱靶crrna来证明 cas13a反应的特异性。
[0654]
使用rpa和cas13a通过将ivt反应与rt-rpa或rpa反应组合以同时与rpa反应生成rna来进行“两锅法”detectr测定。图 13显示了使用rt-rpa-ivt“两锅法”反应,从rna病毒中通过cas13a 检测到的rna的产生。在两锅法反应中,第一反应是rt-rpa-ivt,第二反应是cas13a检测测定。在存在rna转录缓冲液(来自twist dx
ꢀ“
缓冲液1”的rpa再水合缓冲液)或rpa再水合缓冲液(20mm咪唑,ph 7.5;50mm kcl;5mm mgcl2;bsa 10μg/ml;0.01%igepalca-630;5%甘油“缓冲液2”)的情况下,将ivt的组分(t7 rna聚合酶,ntp)添加到rt-rpa反应中。作为对照,添加了没有rna 聚合酶的rt-rpa。在这些反应中,将2fm的ppr病毒rna用作靶 rna。反应在37℃下进行15分钟,使用中靶和脱靶crrna以显示特异性。
[0655]
将ivt和cas13a检测测定反应与rt-rpa或rpa反应组合,以“一锅法”测定同时生成和检测rna。图14显示了各种缓冲液对一锅法cas13a测定的性能的影响。将rt-rpa的组分与ivt(t7 rna 聚合酶,ntp)和cas13a检测(cas13a酶,crrna,荧光切割报道分子)的两种组分组合在一个反应中。反应在三种缓冲液中进行(缓冲液1:rpa再水合缓冲液,缓冲液2:cas13a缓冲液和缓冲液3: cas12a缓冲液(20mm tris-hcl,ph 8.0;100mm nacl;5mm mgcl2; 1mm dtt;5%甘油;50μg/ml肝素))。没有rna聚合酶的反应用作对照。另外,通过比较中靶crrna的反应与脱靶crrna的反应来显示特异性。使反应在40℃下进行10分钟。
[0656]
图15显示了使用一锅法cas13a测定从感染山羊的ppr病毒中特异性检测病毒rna。将500am的病毒rna加入反应中,并将该反应在40℃下温育。作为对照,使用没有t7 rna聚合酶的相同反应 (“pprv-noivt”;右图)来显示rna的特异性产生,供cas13a检测。使用中靶和脱靶crrna来证明测定特异性。
[0657]
图16显示了使用一锅法cas13a测定(在40℃下运行)对乙型流感的特异性检测。将40fm病毒rna添加到反应中。作为对照,使用没有逆转录酶的相同反应(标记为
“‑
rt”)来显示rna的特异性产生,供cas13a检测。使用中靶和脱靶crrna来证明测定特异性。
[0658]
图17显示了在40℃、存在和不存在称为通用运输介质(utmcopan)的通用病毒运输介质的情况下,一锅法cas13a测定对检测乙型流感病毒rna的耐受性。将40fm病毒rna添加到反应中。作为对照,使用没有逆转录酶的相同反应(-rt)来显示rna的特异性产生,供cas13a检测。使用中靶和脱靶crrna来证明测定特异性。
[0659]
图18示出了在不同温度下检测甲型流感(a)、乙型流感(b) 和人rsv(c)rna的一锅法cas13a。将100,000个病毒基因组添加到反应中,并与包含0个拷贝的反应进行比较。反应在30℃、32.5、 35℃、37.5℃或40℃下进行。该测定被确定为在35℃至37.5℃下最稳定。
[0660]
lamp.环介导的等温扩增(lamp)也用于与逆转录酶 (rt-lamp)组合扩增dna序列或rna序列。lamp反应使用四个、五个或六个引物的组合从rna扩增靶dna或cdna。在lamp 反应过程中,形成扩增子的串联体。如果rt-lamp或lamp扩增子包含支持cas蛋白识别的序列特征(例如pam或pfs),则它们可用作crispr诊断中的靶核酸。
[0661]
图19显示了lamp反应的最优化,该lamp反应用于检测内部扩增对照,该内部扩增对照使用源自普通猛犸象(长毛猛犸象)线粒体的dna序列。另外,图19显示了使用多种crrna的cas12a对 lamp扩增子的特异性检测。图19a显示了包括提供dna/rna、 lamp/rt-lamp和cas12a检测的工作流程的示意图。图19b显示了对于使用源自普通猛犸象的dna序列进行内部扩增对照的lamp反应的结果的时间,如通过荧光定量。得到结果的时间由达到反应最大荧光的一半的时间确定。对照包括脱靶的hela基因组dna和无靶对照。图19c显示了在37℃下对来自68℃温度反应的lamp扩增子的 cas12a特异性检测。检验了两个靶crrna。通过未从hela基因组dna 扩增子检测到或无模板对照(ntc)扩增子来显示特异性。
[0662]
图20示出了对作为rnase p组分的人pop7基因(actccgcagcccgttcaggaccccggcgcgggcagggcgccc acgagctggctggctgcttgcacccacatccttctttctctggg acctggggtcgcggttacttgggctggccggcgaacccttgagt ggcctggcggggagcgggcctcgcgcgcctggagggccctgtg gaacgaagagaggcacacagcatggcagaaaaccgagagccc cgcggtgctgtggaggctgaactggatccagtggaatacaccc ttaggaaaaggcttcccagccgcctgccccggagacccaatga catttatgtcaacatgaagacggactttaaggcccagctggccc gctgccagaagctgctggacggaggggcccggggtcagaacgc gtgctctgagatctacattcacggcttgggcctggccatcaacc gcgccatcaacatcgcgctgcagctgcaggcgggcagcttcgg gtccttgcaggtggctgccaatacctccaccgtggagcttgttg atgagctggagccagagaccgacacacgggagccactgactcg gatccgcaacaactcagccatccacatccgagtcttcagggtca cacccaagtaattgaaaagacactcctccacttatcccctccgt gatatggctcttcgcatgctgagtactggacctcggaccagagc catgtaagaaaaggcctgttccctggaagcccaaaggactctg cattgagggtgggggtaattgtctcttggtgggcccagttagtg ggccttcctgagtgtgtgtatgcggtctgtaactattgccatat aaataaaaaatcctgttgcactagt,seq id no:339)的lamp 和cas12特异性检
测的优化。该序列存在于人dna和rna中,并且用作样品提取效率的对照(样品对照)。图20a显示了包括提供 dna/rna、lamp/rt-lamp和cas12a检测的工作流程的示意图。图20b显示了在不同温度下对于rna酶p pop7的lamp/rt-lamp 反应的结果的时间,如通过荧光定量。得到结果的时间由达到反应最大荧光的一半的时间确定。对照包括脱靶小鼠肝rna和无靶对照。通过rt-lamp和lamp反应分别检测hela-总-rna和hela基因组 rna。图20c显示了三个曲线图,表明了在37℃下对来自68℃温度反应的lamp/rt-lamp扩增子的cas12a特异性检测。检验了两个中靶crrna,检验了一个脱靶crrna。通过未检测到小鼠总rna扩增子或无模板对照(ntc)扩增子来显示特异性。
[0663]
cas12还用于检测rt-lamp产物。图21显示了针对甲型流感病毒的三种不同rt-lamp扩增子的特异性检测。来自该实验的数据表明,cas12a相容位点周围的rt-lamp引物的设计对于实验的特异性很重要。优化了引物和crrna,并组合用于通过rt-lamp特异性检测甲型流感(iav)。简而言之,针对iav特异性的rt-lamp,检验了三种不同的引物集。rt-lamp反应在iav rna存在下进行,或作为无模板(ntc)的对照进行。对于每个扩增子,在37℃的cas12a 检测测定中使用两个中靶crrna和一个脱靶crrna。
[0664]
图22显示了用于特异性检测乙型流感(rtv-lamp)扩增子的最佳crrna的鉴定。rt-lamp反应在甲型流感(iav)rna、ibv rna 或无模板对照(ntc)的存在下于60℃进行30分钟。对于所得的扩增子,使用三个中靶crrna来确定哪种试剂对于cas12a在37℃下检测乙型流感最为特异性和有效。
[0665]
将rt-lamp或lamp反应的引物组合在一起以进行多重扩增。由于在rt-lamp和lamp期间形成了串联体,因此难以通过常规方式在多重rt-lamp或lamp反应中区分扩增子,如图23所示。甲型流感(iav)和乙型流感病毒(ibv)的多重rt-lamp在60℃下进行30分钟。将rt-lamp反应与iav、ibv或iav和ibv的10,000 个病毒基因组拷贝一起温育。使用包含0个病毒基因组拷贝的无靶对照(ntc)。温育30分钟后,将0.5μl的rt-lamp产物在1%琼脂糖凝胶上电泳。图23显示了1%琼脂糖凝胶的结果,其中带显示了 rt-lamp反应的产物。从凝胶中可以看出,很难区分iav、ibv和 iav ibv样品。v型(例如cas12)酶的应用鉴定了在多重rt-lamp 或lamp反应中扩增了哪些扩增子。图24显示了来自针对甲型流感和乙型流感的多重rt-lamp反应的扩增子之间的cas12a区分。图 24a显示了包括提供病毒rna、多重rt-lamp和cas12a甲型流感检测或cas12a乙型流感检测的工作流程的示意图。图24b显示了在 60℃下30分钟的多重rt-lamp扩增后,cas12a对rt-lamp扩增子的检测。多重扩增包含甲型流感(iav)和乙型流感(ibv)的引物集。反应包含10000个病毒基因组拷贝或0个拷贝作为对照。使用针对仅iav、仅ibv以及iav和ibv组合的靶标。图24c显示了iav 和ibv的10,000个病毒基因组拷贝的rt-lamp扩增子的在37℃的 cas12a检测的30分钟时的减去背景的荧光。iav和ibv特异性crrna 可以区分存在哪些病毒样品。同样,图25显示了在60℃下30分钟的多重rt-lamp扩增后,针对甲型流感、乙型流感和普通猛犸象(长毛猛犸象)线粒体内部扩增对照序列的三次多重rt-lamp反应之间的cas12a区分。多重扩增包含甲型流感(iav)、乙型流感(ibv) 和猛犸象内部扩增对照(猛犸象iac)的引物集。反应包含100,000 个病毒基因组拷贝或500am的iac。使用针对仅iav、仅ibv、多重iav ibv和多重iav ibv 猛犸象iac的靶标。在37℃下用iav、 ibv和猛犸象iac特异的crrna进行cas12a检测测定,以区分来自多重反应的扩增子。
[0666]
通过在lamp或rt-lamp反应的正向内部引物(fip)或反向向内部引物(bip)中包含t7启动子序列,可以将所得的扩增子添加到体外转录反应中以生成rna,如图26示意图所示。该rna可以用于vi型(例如cas13)检测测定中。图26a显示了说明在lamp 和rt-lamp中使用的引物的身份的示意图。在一些lamp和 rt-lamp设计中,引物lf和lb是任选的,但通常会提高反应效率。图26b显示了说明在多种lamp引物中t7启动子的位置和取向的示意图。
[0667]
图27显示t7启动子可以包含在甲型流感的f3或b3引物(外部引物)或fip或bip引物上。但是,只有位于fip或bip引物中的 t7启动子才能够产生足够的rna实现cas13a检测测定。图27a显示了工作流程的示意图,包括提供dna/rna、lamp/rt-lamp、体外转录和cas13a检测。图27b显示了使用不同的引物集对甲型流感的rt-lamp反应的得到结果的时间,如通过荧光定量。每个引物集在不同位置包含t7启动子序列。得到结果的时间由达到反应最大荧光的一半的时间确定。没有靶标被用作特异性对照。结果表明,b3 t7和bip t7有义引物集最适合rt-lamp反应。反应在68℃下进行30分钟。图27c显示了使用不同引物集在37℃进行10分钟的针对甲型流感rt-lamp反应产物采用t7 rna聚合酶的体外转录 (ivt)。然后使用在37℃的cas13a检测测定来检测ivt反应的rna 产物。三种不同的中靶crrna与脱靶crrna一起使用以证明特异性。 bip t7有义和反义引物集与中靶crrna#2一起最适合rna的产生。因此,brt t7有义引物集与crrna#2结合使用最适合在rt-lamp 反应然后进行ivt反应后检测rna。
[0668]
siba.基于链入侵的扩增(siba)是可以使用的另一种等温方法。图28显示了cas12对甲型流感的rt-siba扩增子的检测。在cas12 的siba和rt-siba反应中,指导rna与入侵寡核苷酸不互补,并且扩增子包含pam。rt-siba反应在41℃下进行60分钟,起始rna 浓度为500am。rt-siba反应的对照包括无靶对照和无引物对照。 rt-siba反应完成后,将2μl扩增子添加到20μl cas12a检测反应中。中靶和脱靶crrna用于显示cas12的特异性检测。实施例13用于检测来自呼吸道病毒的靶核酸的基于crispr detectr的诊断测定的测定条件优化
[0669]
本实施例描述了用于检测来自呼吸道病毒(例如流感病毒)的靶核酸的本文公开的基于crispr-cas detectr的诊断测定的测定条件的优化。detectr反应的组分,例如蛋白浓度、crrna和缓冲液组分会影响反应的速度和效率。缓冲液的优化允许开发具有增加的灵敏度和特异性的测定。cas13m26(lbucas13a(seq id no:131))在trna量减少的缓冲液中的detectr反应中表现最佳,并且未改变反应的稳定性。减少反应中trna的量或完全消除,可以提高cas13a检测测定的效率,而不显著改变在没有激活剂的情况下反应的稳定性。其中cas13a在用于检测来自呼吸道病毒(例如流感病毒)的核酸的detectr测定中表现出活性的缓冲液缺乏或含有少量尿素和sds。此外,在含有 nacl或kcl的缓冲液(含30mm盐或以下)中或在含有nacl或kcl 的缓冲液(含0-10mm dtt)中,cas13a在用于检测来自呼吸道病毒(例如流感病毒)的核酸的detectr测定中表现出活性。通过荧光测量,cas13a还表现出对于许多报道分子的活性,包括“u5”报道分子(/5-6fam/rururururu/3iabkfq/)、“uu”报道分子 (/56-fam/tarurugc/3iabkfq/),以及具有与“u5”报道分子相同核苷酸序列但具有不同荧光团和猝灭剂的报道分子“tye665u5”(/5
‑ꢀ
tye665/rururururu/3iabkrq/)。cas13a detectr检测的最
佳缓冲液组分和ph值包括ph值为约7.5的缓冲液以及咪唑、磷酸盐、tricine 和spg。
[0670]
cas13a在nebuffer2(nebuffer 2.1;1x缓冲液组分、50mm nacl、 10mm tris-hcl、10mm mgcl2、100μg/ml bsa,ph 7.9@25℃)和 cutsmart(1x缓冲液组分、50mm乙酸钾、20mm tris-乙酸盐、10mm 乙酸镁、100μg/ml bsa,ph 7.9@25℃))中的性能得到改善。cas13a 在mbuffer1中表现最佳。1x mbuffer1包括20mm咪唑ph 7.5、50mmkcl、5mm mgcl2、10μg/μl bsa、0.01%igepal ca-630和5%甘油。此外,在包含5%甘油、bsa和np-40的缓冲液中,cas13a的性能得到改善,从而改善cas13a detectr测定。np-40(igecal-ca 630) 提高cas13a检测测定的效率,并且少量的bsa也提高测定的性能。 0.05%至0.0625%的np-40浓度最佳,并且2.5至0.625μg/ml bsa的浓度是理想的。
[0671]
缓冲液缺乏抑制cas13a detectr测定性能的化合物,包括:硫酸铍、氯化锰、氯化锌、柠檬酸三钠、氯化铜、氯化钇、1-6-二氨基己烷、1-8-二氨基辛烷、氟化铵、乙醇胺、水杨酸锂、硫酸镁、氰酸钾和氟化钠。
[0672]
lbcas12a(seq id no:27)在使用ph 8.0的缓冲液和以下缓冲液类型检测来自呼吸道病毒(例如流感病毒)的靶核酸的detectr 测定中表现出最佳活性:ampd、bis-tris丙烷、dipso、hepes、 mops、taps、tris和tricine缓冲液。lbcas12a在低kcl浓度(0-40 mm或小于20mm盐和更少kcl)的detectr测定中表现出活性。
[0673]
cas12变体(seq id no:37)在ph 7.5和在包括dipso、hepes、 mops、taps、咪唑和tricine的缓冲液中表现最佳。与含有mgcl和 kcl的缓冲液相比,cas12变体在盐浓度约为4mm(范围为2-10nm) 时表现最佳,并且在含有mgoac和koac(乙酸盐缓冲液)的缓冲液中表现出更高活性。此外,cas12变体受肝素抑制并且优选低盐。
[0674]
缓冲液缺乏抑制cas12变体dtecr测定性能的特定化合物,包括:苯甲脒盐酸盐、硫酸铍、氯化锰、溴化钾、碘钠、氯化锌、磷酸氢二铵、柠檬酸三锂、柠檬酸三钠、氯化镉、氯化铜、氯化钇、1-6 二氨基己烷、1-8-二氨基辛烷、氟化铵和硫酸铵。提高检测性能的化合物包括:聚乙烯醇ii型、dtt、dmso、聚乙烯吡咯烷酮k15、聚乙二醇(peg)600和聚丙二醇400。
[0675]
对于cas12变体而言沿crrna的3’末端(远离pam)的snp 分化更强。lbcas12a(seq id no:27)在沿靶序列的所有位置均显示出强突变灵敏度,并且在pam近端(与crrna靶序列的5’末端互补)表现出灵敏度,并且对该区域的突变更灵敏且突变灵敏度具有靶位点依赖性。实施例14用于使用crispr-cas系统在detectr反应中目测检测来自呼吸道病毒的靶核酸的横向流动测试条
[0676]
本实施例描述了用于使用crispr-cas系统在detectr反应中目测检测来自呼吸道病毒(例如流感病毒)的靶核酸的横向流动测试条。detectr反应的可视化读出已开发为具有低成本形式并适合于大批量生产。此处描述的是定制的横向流动条。将胶体金纳米颗粒与抗体缀合,并且金纳米颗粒用作测定中的可视化读出。测试了两个市售的横向流动条,包括:(1)millenia hybridetect 1,twistdx(英国,现为abbott的一部分)和(2)pcrd,abingdon health(英国)。
[0677]
与市售的横向流动测试条不同,本文公开的定制的横向流动测试条设计包括新型的crispr-cas报道分子,其由以下制成:(1)6-荧光素(fam)部分;(2)生物素部分;以及(3)
基于dna的寡核苷酸接头,该接头不可逆地与反应上游的detectr反应腔室缀合。
[0678]
用于读出cas12变体和lbcas12a的横向流动条。测试了横向流动条以读出cas12变体(seq id no:37)和lbcas12a(seq id no: 27)。复合反应包括每次反应终浓度为40nm的crrna、每次反应 40nm最终蛋白质和每次反应500nm报道分子。复合反应在37℃下温育30min,加入报道分子底物,并将15ul的复合反应等分至pcr 管中。加入5ul稀释的ppr病毒pcr产物,将靶标(例如,含有来自呼吸道病毒的靶核酸的样品)和复合体在37℃下温育20min。加入 100ul milenia genline试纸测定缓冲液(tween或triton)并将试纸条插入含靶标和复合体的溶液中。对测试条拍照并使用imagej对顶部条带进行定量。
[0679]
mnt-横向流动,au np缀合。将抗fam和抗rox多克隆抗体与金纳米颗粒缀合,以用于下游的定制横向流动条中。材料包括 corning spin-x uf 500μl浓缩器和盒装缀合试剂盒中的金。通过用无核酸酶的水以1:1稀释ph 7.2(1x)的pbs来制备0.5x缓冲液。使用100μl的mnt抗体和100μl的fitc抗体。旋转浓缩器用于对于两种抗体将天然缓冲液从0.1m tris甘油(ph 7)与10%甘油交换为0.5x pbs。用100μl 0.5x pbs洗涤,每次洗涤将浓缩器以18,000rcg (xg)旋转1.5分钟。抗体用100μl 0.5x pbs洗脱。金的缀合按照制造商的说明进行。将试管标记为mnt1-10和fitc1-10,并添加7μl 的每种抗体。将反应物在室温下在摇床培养箱中培养30分钟。通过向每个试管中加入50μl的bsa封闭缓冲液来终止反应,并将试管保存在4℃。
[0680]
用于lbucas13a的读出的横向流动条。针对lbucas13a的读出,测试横向流动条。twistdx横向流动条用于检验fam-u5-生物素 (rep71报道分子)。在室温下以各种靶标标浓度进行测定。复合反应包括终浓度为40nm的crrna/反应,40nm的终蛋白/反应和500 nm报道分子/反应。复合反应在37℃下温育30分钟。将靶标的稀释液添加到反应中,包括10nm、1nm、0.1nm、0.01nm以及无靶。将30μl的复合反应物添加至靶标,并在室温下温育15分钟。将反应物置于冰上,将10μl反应物直接吸移至横向流动样品区域。添加50 μl milenia genline试纸测定缓冲液,并拍照。
[0681]
使用试剂盒将3’氨基报道分子与nhs珠粒缀合。nhs flexibind 磁珠试剂盒用于缀合3’氨基修饰的横向流动报道分子,该报道分子可用于横向流动装置(milenia hybrid)的预期用途,在所述装置处首先检测到配体,而对照线用作流动对照。使用的报道分子的序列是 /56-fam/*/ibiodt/*aattaattaattaattaatt/3ammo/。
[0682]
如下进行珠粒缀合。将rep75重悬至100μm的洗涤/偶联缓冲液(pbs,ph 7.4)中。从idt递送32.5nmol,并使用5.4nmol(54 μl)的rep75。20%nhs flexibind磁珠通过涡旋20秒重悬。将100μl 的珠浆液移液至1.5ml微量离心管中。将磁珠沉淀在磁力架上,直到溶液变澄清为止。去除并丢弃存储缓冲液。立即添加100μl冰冷的平衡缓冲液(1mm hcl)。将反应从磁体中移出并涡旋20秒,然后放回磁体上以使珠粒沉淀。去除并弃去上清液,添加54μl的100 μm rep75的pbs溶液。将珠粒在室温下温育并间隔混合:静置2分钟,以1200rpm的转速混合15秒,持续2小时。将试管放置在磁力架上,以使珠粒迁移到磁体上。去除未结合的配体并保存用于分析。
[0683]
在读板器上,在20μl nfw中相比于在20μl nfw中的0.5μl 缀合后上清液中测量了0.5μl原始报道分子,直到不再可见绿色。添加500μl的quench缓冲液,涡旋30秒,并用磁力架沉淀。丢弃上清液,并将样品洗涤5次。将珠粒重悬于500μl的quench缓冲液中,并在室温
下温育1小时。珠用磁力架沉淀,并且去除并弃去缓冲液。将珠粒重悬于100μl洗涤/偶联缓冲液(pbs,ph 7.4)中,并将珠粒在暗管中置于冰上。
[0684]
使用以下对未切割/未缀合的报道分子进行横向流动检验:2x ng-40-b009裸金溶胶珠-40nm-15od-9ml,fitc抗体(invitrogentb265150),抗igg(invitrogen a16098),链霉抗生物素(neb n7021s), ph 8.8和三个批次——批次1:au(5μl)-》抗-igg(μl)-》strep(0.5 μl)、批次2:au(5μl)-》strep(1μl)-》抗-igg(1μl)和批次3:au (2.5μl)-》strep(1μl)-》抗-igg(1μl)。
[0685]
通过首次复合反应,用cas12变体(seq id no:37)检验珠粒。如下运行反应:最终浓度为40nm crrna/反应,40nm蛋白/反应和 100、250、500或1000nm报道分子/反应。将复合体在37℃下温育 30分钟。将40μm的珠粒储备液稀释至1:10至4μm。将报告珠粒添加到5μl pprv稀释的pcr产物或nfw中,将15μl的复合反应物添加至靶。将反应在37℃下在thermomixer中以2000rpm振荡温育30分钟。用磁力架将珠粒沉淀2分钟。将10μl反应转移到新试管中,添加50μl试纸测定缓冲液,并将60μl稀释的反应液置于磁体上,然后再将溶液添加至横向流动条。反应在milenia流动条上进行。
[0686]
图29显示了具有典型的报道分子的milenia市售条的布局。此示意图显示了分析物独立的通用试纸,其样品施加区域在右侧,紧接着是左侧的芯吸区域,再左侧是包含生物素配体的区域,再左侧是带有抗兔抗体斑点的区域。样品和分析物特异性溶液与带有生物素或 fitc的分析物检测物一起温育。样品在条上运行。阳性结果显示两个条带——最左边的条带来自对照条带并且是由于抗fitc抗体包被的金纳米颗粒与抗兔抗体的结合所致。正确的条带来自测试条带本身并且是由于生物素配体与带有生物素的分析物检测物的结合,其中检测物使分析物复合,并且其中分析物进一步与另一个带有fitc的检测物复合,然后再与抗fitc抗体包被的金颗粒结合。如果结果是阴性的,则在对照线上只能看到一个条带。
[0687]
图30显示了带有扩增子的milenia hybriddetect 1条的布局。该示意图在顶部图的右端显示了使用fam和生物素引物的顶部pcr 扩增子。在阳性结果的情况下,该条显示两个条带——该pcr扩增子与固定在测试线上的部分结合,而fam分子(显示为起点)与抗 fam抗体包被的颗粒结合。测试线的左侧是流动对照线,其中包含与抗fam抗体包被的纳米颗粒结合的抗兔抗体。在阴性结果的情况下,该条显示一个条带,即仅结合抗fam抗体包被的纳米颗粒,所述纳米颗粒与固定在测试条上的抗兔抗体结合。
[0688]
图31显示了带有标准cas报道分子的milenia hybriddetect 1 条的布局。阳性结果显示在顶部,其中cas蛋白切割了标准报道分子,并且仅看到一个条带——由于抗fam抗体包被的纳米颗粒与点样在条上的抗兔抗体结合。阴性结果显示在底部,其中完整的报道分子与固定在条上的部分结合,所有抗fam抗体包被的纳米颗粒均在对照线处与完整的cas报道分子上的fam分子结合。用靶核酸和用仅水对照运行样品的结果表明,即使使用仅水对照,在测试线上也会出现假阳性条带。
[0689]
图32显示了修饰的cas报道分子,其包含与fam分子(示为绿色起点)结合的生物素-dt(示为粉红色六边形)的dna接头。将整个修饰的cas报道分子与磁珠或在条上游的反应腔室表面结合。这在示意图中显示为将修饰的cas报道分子固定在detectr腔室/珠粒的底物上。在被cas(显示为黄色pac-man)切割的过程中,生物素 fam分子从dna接头中释放出来。与其他测定形式不同,这种特定的测定形式包含对反应腔室的整个cas切割反应。在这
种测定形式中,测试线是实际测试线,而对照线是真实的对照线。图33显示了具有经修饰的cas报道分子的milenia hybriddetect条的布局。顶部显示了阳性结果,在cas反应腔室中,cas蛋白切割了经修饰的cas报道分子的dna接头片段。释放生物素-dt/fam分子,并沿测试条向下流动,与包被在测试线上的链霉亲和素结合。抗fam抗体包被的金纳米颗粒在测试线处与生物素dt/fam报道分子结合。另外,抗fam 抗体包被的金纳米颗粒与在流动对照线处包被的抗兔抗体结合。在底部,显示了阴性结果,其中仅抗fam抗体包被的金纳米颗粒与在流动对照线处包被的抗兔抗体结合。
[0690]
图34显示了单个靶标测定形式(左)和多重测定形式(右)的实施例。顶部是显示使用前测定示意图的图,仅抗fam抗体包被的金纳米颗粒(左)或抗fam抗体包被的金纳米颗粒和抗rox抗体包被的金纳米颗粒(右)在对照和测试线上游。用链霉亲和素点样对照线,用仅靶标a(左侧)或靶标a和靶标b(右侧)点样测试线。带有阳性结果的测定显示在中间的示意图中,带有阴性结果的测定显示在最低的示意图中。
[0691]
图35示出了使用前的测定(上),具有阳性结果的测定(左中),具有阴性结果的测定(右中)和检验失败(下)的另一种变型。在此测定中,流动对照位于条的最左端,然后是包被有抗igg兔抗体的测试线,然后是包被有链霉亲和素的对照线,然后是包被有抗fam或抗生物素抗体的金纳米颗粒。cas报道分子在反应腔室中的条的上游。如果切割,则将cas报道分子切割(阳性结果),fam分子与抗fam 包被的金纳米颗粒结合,随后在测试线结合,而抗生物素抗体包被的纳米颗粒在对照线结合到dna/rna接头/生物素构建体。如果未切割cas报道分子(阴性结果),则完整的报道分子在对照线与链霉亲和素结合,在对照线处随后它们被抗fam包被的金纳米颗粒结合。
[0692]
金纳米颗粒与抗生物素抗体缀合。使用100μl抗生物素抗体的等分样品,并将抗体悬浮在无核酸酶的水中。将溶液中的7μl稀释抗体添加到试管中,并将反应物在室温摇床培养箱中温育30分钟。添加50μl bsa封闭缓冲液终止每个试管中的反应,并将试管保存在4℃。实施例15寡核苷酸与肽/酶的缀合,用于使用可编程核酸酶系统进行靶核酸的安培检测的转化酶偶联测定中的下游用途
[0693]
该实施例描述了寡核苷酸与肽/酶的缀合方法,用于转化酶偶联测定中的下游用途,用于在使用crispr-cas系统的detectr反应中安培检测来自呼吸道病毒(例如流感病毒)的靶核酸。本文公开的方法被开发为detectr反应的荧光和横向流动免疫色谱读出的替代方法,并且包括使用3’硫醇修饰将转化酶与detectr报道分子有效缀合。用于进行detectr反应的安培检测的转化酶偶联测定中使用的crispr-cas报道分子包括(1)5
’‑
生物素部分和(2)3
’‑
转化酶。寡核苷酸的序列是/5biosg/tttttttttttttttttttt/3thiomc3-d/ (seq id no:373),并且在3’末端缀合了转化酶。用于缀合的试剂包括来自贝克酵母的转化酶(酿酒酵母)、链霉亲和素磁珠、盐酸三 (2-羧乙基)膦(tcep)、n-琥珀酰亚胺基4-(马来酰亚胺基甲基)环己烷甲酸酯,smcc(smcc)、1m磷酸钠缓冲液ph 7.2、2-(n吗啉代) 乙烷磺酸(mes)、氯化钠5m无菌和生物素标记的寡核苷酸。
[0694]
缓冲液和溶液的制备。制备的缓冲液包括(1)0.1m磷酸盐缓冲液,无nacl,ph 7.2,(2)0.1m磷酸盐缓冲液,0.1m nacl,ph 7.2, (3)0.05m mes缓冲液,ph 5.5和(4)0.05m mes
缓冲液,含0.1m nacl, ph 5.5。由固体制备tcep溶液、smcc溶液和转化酶溶液。还准备了dns试剂。
[0695]
dna寡核苷酸的硫醇活化。将硫醇-生物素标记的寡核苷酸(15 μl,在水中1mm)与tcep(3μl,在水中0.5m)在1.5ml微量离心管中混合。添加12μl等同缓冲液,使反应体积达到30μl。准备了以下十二个反应物:mb406,具有低ph,无盐缓冲液;mb406,具有低ph和盐缓冲液;mb406,具有pbs,无盐;mb406,具有pbs 和盐缓冲液;mb407,具有低ph,无盐缓冲液;mb407,具有低ph 和盐缓冲液;mb407,具有pbs,无盐;mb407,具有pbs和盐缓冲液;mb408,具有低ph,无盐缓冲液;mb408,具有低ph和盐缓冲液;mb408,具有pbs,无盐;以及mb408,具有pbs和盐。在每个缓冲液中,dna寡核苷酸的体积为15μl,tcep的体积为3μl,缓冲液的体积为12μl。将反应在37℃的摇床培养箱中温育3-5小时。通过在液氮中速冻终止反应。将微量离心管储存在-20℃下直至反应的下一步。在与活化的转化酶/或其他活化的蛋白/肽缀合之前,将硫醇活化的寡核苷酸试管从冰箱中取出3小时。首先将试管在37℃下温育3小时,然后用于缀合反应。
[0696]
转化酶的smcc活化。制备了转化酶实验室储备瓶的新鲜溶液。在干净的1.5ml微量离心管中称量10mg固体,添加860μl缓冲液 a(0.1m nacl,0.1m磷酸钠缓冲液,ph 7.2)制成20mg/ml的溶液。将1mg smcc添加到1.5ml微量离心管中,并通过添加转化酶溶液 (400μl,20mg/ml,在0.1m nacl、0.1m磷酸钠缓冲液中,ph 7.2) 启动反应。将反应在摇床培养箱中在37℃下培养24小时。
[0697]
清除smcc活化的转化酶。23小时15分钟后,将反应从摇床培养箱(37℃)中移出。将smcc活化的转化酶洗涤8次,然后重悬于400μl缓冲液中。通过bca方法定量蛋白。
[0698]
硫醇dna寡核苷酸的重新活化。从-20℃去除寡核苷酸,并在 37℃的摇床培养箱中培养。启动反应并在摇床培养箱(37℃)中培养 48小时。从培养箱中移出反应,并且每个反应包含(1)35μl的转化酶溶液和(2)30μl的硫醇-dna寡核苷酸溶液。
[0699]
与链霉亲和素珠粒结合。在1.5ml微量离心管中,将12.5μl 的链霉亲和素珠粒与50μl事先与转化酶缀合的生物素化的dna寡核苷酸混合。将反应在室温下温育5分钟,在磁架上用50μl等分样品的缓冲液a将珠粒洗涤5次,以从溶液中去除任何未结合的dna 寡核苷酸,并检查所有洗涤液中的洗脱液的转化酶活性(并因此链霉亲和素和生物素分子之间的结合效率低下)。在最后一次洗涤期间,将珠粒重悬于50μl缓冲液a中,并将珠粒储存在4℃下。
[0700]
使用dns/蔗糖进行温育。制备了包含5μl 20%蔗糖、30μl dns试剂、25μl具有转化酶部分的生物素化dna的反应。在高温 (95℃)下温育后观察到颜色变化。
[0701]
dna-转化酶缀合。使用异双功能接头磺基-smcc进行缀合。向millipore水中的30μl 1mm硫醇-dna中添加2μl ph 5.5的1m磷酸钠缓冲液和在millipore水中的2μl 30mm tcep并混合。将该混合物在室温下保持1小时,然后使用不含tween-20的缓冲液a(0.1m nacl,0.1m磷酸钠缓冲液,ph 7.3,0.05%tween-20)通过amicon-10k 纯化8次。为了进行转化酶缀合,将不含tween-20的缓冲液a中的 400μl 20mg/ml转化酶与1mg磺基smcc混合。涡旋5分钟后,将溶液在室温下在振荡器上放置1小时。然后将混合物离心并去除不溶的过量磺基-smcc。然后使用不含tween-20的缓冲液a,通过 amicon-100k将澄清溶液纯化8次。将磺基-smcc活化的转化酶的纯化溶液与上述硫醇-dna溶液混合。将所得溶液在室温下保持48 小
时。为了去除未反应的硫醇-dna,通过amicon-100k使用不含tween-20的缓冲液a将溶液纯化8次。还使用同双功能接头pditc 进行缀合。向在millipore水中的60μl 1mm胺dna中添加30μl缓冲液b(0.1m硼酸钠缓冲液,ph 9.2)并混合。将该溶液与溶解在1 ml dmf中的20mg pditc进一步混合。将所得溶液置于振荡器上,并在黑暗中于室温下保持2小时。之后,将溶液与6ml的millipore 水和6ml的1-丁醇混合。离心15分钟后,弃去上层有机相。然后将水相用4ml的1-丁醇提取3次,并使用不具有tween-20的缓冲液a 通过amicon-10k纯化8次以产生pditc活化的胺-dna溶液。根据使dna产物脱盐后获得的malti-tof质谱,pditc活化比大于90%。然后,将10mg的转化酶添加到不含tween-20的缓冲液a中的活化 dna溶液中,以达到约5mg/ml的最终浓度。将所得溶液在室温下保持48小时。为了去除未反应的pditc活化的胺-dna,通过 amicon-100k使用不含tween-20的缓冲液a将溶液纯化8次。缀合的结果表明:(1)tween对于转化酶活性不是必需的;(2)5分钟后1 mg/ml的转化酶反应可能完成;(3)2%的蔗糖输入在约15分钟后的室温下产生红色;以及(4)对于《0.2%蔗糖,dns无效。实施例16用于检测来自呼吸道病毒的靶核酸的crispr诊断的横向流动切割报道分子
[0702]
本实施例描述了用于检测来自呼吸道病毒(例如流感病毒)的靶核酸的crispr诊断的横向流动切割报道分子。本文公开的cas报道分子的一种设计涉及将cas报道分子栓系至横向流动测试条上游的反应腔室。
[0703]
图36示出了拴系的横向流动cas报道分子的一种设计。左侧是 dna或rna接头,在3’末端连接了用于化学缀合的功能性柄(胺,硫醇等),在5’末端生物素(显示为菱形)进一步与fam报道分子连接。整个cas报道分子都缀合到磁珠上,并固定在反应腔室的表面上。crispr-cas切割反应后,dna/rna接头被切割,生物素/fam 报道分子部分被释放。
[0704]
图37显示了使用磁珠采用拴系的切割报道分子进行crispr诊断的工作流程。首先,将crispr-cas蛋白rnp与靶核酸一起温育,并将磁珠与报道分子缀合。用磁体捕获磁珠,去除上清液,然后将样品放在具有chase缓冲液的横向流动条上。
[0705]
拴系的切割报道分子也可以用于从crispr诊断程序中多次读出。在两个独立的detectr反应中,在存在或不存在靶dna(约 0.5nm)的情况下,将与磁珠缀合的fam-生物素和dig-生物素报道分子与cas12变体(seq id no:37)在37℃下温育30分钟。温育期后,将磁珠沉淀,并将上清液转移至pcrd横向流动条(abingdonhealth)。
[0706]
图38显示了在到达反应腔室之前被链霉亲和素-生物素过滤的酶-报道分子系统的示意图。报道分子的结构显示在左侧,并且包括连接生物素和酶的dna/rna接头。在存在靶标的情况下(靠上显示), cas蛋白在cas反应腔室中切割接头,导致生物素与捕获腔室内部或纸条上的链霉亲和素结合,并在含有酶底物的检测腔室中表现出酶促活性。在没有靶标的情况下(靠下显示),cas蛋白不会在cas反应腔室中切割接头,从而导致捕获室中完整的报道分子结合,并且在含有酶底物的检测腔室中没有酶(因此没有酶促活性)。实施例17用于流感crispr诊断的横向流动测定
[0707]
本实施例描述了用于流感crispr诊断的横向流动测定。dna 或rna接头在5’末端与生物素-dt/fam缀合,并在3’末端与 detectr腔室/珠粒的基底缀合,如图32所示。这些cas报道分子位于横向流动测试条上游的反应腔室内。加入cas酶和含有来自流感病毒的靶
核酸的样品,以及用于扩增的试剂。扩增的靶核酸激活cas 蛋白对dna或rna接头的反式切割。cas蛋白是cas12、cas12a、 cas12b、cas12c、cas12d、cas13、cas13a或cas14。生物素-dt/fam 报道分子部分被释放并流向下游至其结合链霉亲和素的测试线,如图 33所示。生物素-dt/fam报道分子与抗fam抗体包被的金纳米颗粒结合,金纳米颗粒还与包被在流动对照线上的抗兔抗体结合,从而显示阳性测试结果。在样品中没有来自流感病毒的靶核酸的情况下,cas 报道分子仍然固定在反应腔室中的基底上,并且抗fam抗体包被的金纳米颗粒仅与包被在流动对照线上的抗兔抗体结合,因此显示阴性测试结果。实施例18多路复用流感crispr诊断
[0708]
本实施例描述了用于流感crispr诊断的横向流动测定。dna 或rna接头在5’末端与生物素-dt/fam缀合,并且第二dna或rna 接头在5’末端与生物素-dt/rox缀合。两个报道分子均在3’末端与 detectr腔室/珠粒的基底缀合,如图61所示。这些cas报道分子位于横向流动测试条上游的反应腔室内,并且加入cas酶和含有来自流感病毒的靶核酸的样品,以及用于扩增的试剂。扩增的靶核酸激活 cas蛋白对dna或rna接头的反式切割。cas蛋白是cas12、cas12a、 cas12b、cas12c、cas12d、cas13、cas13a或cas14。生物素-dt/fam 和/或生物素-dt/rox报道分子部分被释放并流向下游至其结合链霉抗生物素蛋白的测试线,如图33所示。报道分子部分与抗fam抗体和/或抗rox抗体包被的金纳米颗粒结合,金纳米颗粒还与包被在流动对照线上的抗兔抗体结合,从而显示阳性测试结果。在样品中没有来自流感病毒的靶核酸的情况下,cas报道分子仍然固定在反应腔室中的基底上,并且抗fam抗体包被的金纳米颗粒仅与包被在流动对照线上的抗兔抗体结合,因此显示阴性测试结果。实施例19使用crispr诊断法诊断受试者中的流感
[0709]
本实施例描述了利用本公开内容的crispr cas诊断法来诊断受试者中的流感。样品取自受试者,例如口腔拭子或鼻拭子。受试者患有未确诊的疾病。将样品添加到本公开内容的crispr-cas诊断法,例如实施例17的crispr-cas诊断法。指导物针对流感病毒设计。流感病毒是甲型流感病毒或乙型流感病毒。样品中对应于流感的靶核酸与指导序列结合,从而激活cas蛋白对cas报道分子的反式附带切割。 cas蛋白是cas12、cas12a、cas12b、cas12c、cas12d、cas13、cas13a 或cas14。因此,crispr诊断法显示阳性结果,并且受试者被诊断患有流感。实施例20流感crispr-cas伴随诊断法
[0710]
本实施例描述了本公开内容的流感crispr-cas伴随诊断。样品取自受试者,例如口腔拭子或鼻拭子。受试者患有流感并且已被开具处方并服用流感治疗剂。将样品添加到本公开内容的crispr-cas 诊断法,例如实施例17的crispr-cas诊断法。指导物针对流感病毒设计。流感病毒是甲型流感病毒或乙型流感病毒。样品中对应于流感的靶核酸与指导序列结合,从而激活cas蛋白对cas报道分子的反式附带切割。cas蛋白是cas12、cas12a、cas12b、cas12c、cas12d、 cas13、cas13a或cas14。因此,crispr诊断显示的结果表明流感治疗剂尚未完全消除受试者体内的流感病毒。实施例21
作为检测核酸的转化酶-核酸
[0711]
本实施例显示了转化酶-核酸(作为检测核酸的)用于在可编程核酸酶系统中检测来自呼吸道病毒(例如流感病毒)的靶核酸。
[0712]
图39显示了用于检测靶核酸的转化酶-核酸。将固定在磁珠上的转化酶-核酸添加到包含cas蛋白、指导rna和靶核酸的样品反应中。靶标识别激活cas蛋白以切割转化酶-核酸的核酸,从而从固定的磁珠中释放出转化酶。将该溶液转移到含有蔗糖和dns试剂的“反应混合物”中,当转化酶将蔗糖转化为葡萄糖时,颜色从黄色变为红色,或者可以将该溶液转移到手持式血糖仪进行数字读出。实施例22detectr反应的测定布局和工作流程
[0713]
本实施例描述了用于检测来自呼吸道病毒(例如流感病毒)的靶核酸的detectr反应的测定布局和工作流程。相对于可编程的基于核酸酶的检测测定,提供了包括用于扩增和逆转录的单独腔室的测定。可编程核酸酶是cas12、cas13或cas14。样品是由拭子收集的生物流体,并插入拭子收集储器中。泵驱动测定中的流体将样品从一个腔室移到另一个腔室。可检测信号是比色的、基于荧光的、电化学的和/或使用酶(例如转化酶)产生的。
[0714]
图40示出了detectr测定法的一种布局。在这种布局中,拭子收集盖密封了拭子储存腔室。拭子储存腔室的顺时针方向是容纳扩增反应混合物的腔室。容纳扩增反应混合物的腔室顺时针方向是容纳 detectr反应混合物的腔室。容纳detectr反应混合物的腔室的顺时针方向是检测区域。检测区域的顺时针是ph平衡孔。显示了药盒孔盖,并且其密封了包含各种试剂混合物的所有孔。盒本身在示意图的底部显示为方形层。右侧是仪器管道泵的示意图,该泵驱动每个腔室/孔中的流体并与整个盒连接。盒下方是与仪器接口的旋转阀。图 41示出了图40的detectr测定中各种反应的一个工作流程。首先,如左上图所示,可将拭子插入200ul拭子腔室中并混合。在左中图中,将阀顺时针旋转至“拭子腔室位置”,并取1ul样品。在左下图中,将阀顺时针旋转至“扩增反应混合物”位置,并分配和混合1ul样品。在右上图中,从“扩增反应混合物”中抽吸2ul的样品。在顶部中间图中,将阀顺时针旋转至“detectr”位置,分配并混合样品,并抽吸20ul 样品。最后,在右下图中,将阀顺时针旋转至检测区域位置,并分配 20ul样品。当旋转阀处于关闭位置时,将样品装入拭子裂解腔室并使用盖密封。然后温育样品,并通过仪器与裂解缓冲液混合。样品裂解后,旋转阀旋转以与样品孔对齐,并吸出2至4μl样品。然后,旋转阀旋转以与扩增腔室对齐,在此处将样品与扩增混合物混合。然后将样品吸出,旋转阀旋转到detectr腔室。在detectr腔室中,样品与detectr混合物混合。移液泵的致动将反应混合物混合。然后可以从扩增腔室到第二detectr腔室重复该过程。
[0715]
图42显示了对图41中所示的工作流程的修改,也与本公开内容的方法和系统一致。左侧是图41右上方显示的图。右边是修改后的图,其中存在在拭子裂解腔室逆时针方向的第一扩增腔室和在拭子裂解腔室顺时针方向的第二扩增腔室。另外,在扩增腔室#2的顺时针上有两组,或分别标记为“双重detectr腔室#2”和“双重detectr 腔室#1”的“双重”detectr腔室。图43显示了针对图42中所示的修改布局的工作流程的分解。具体地,从容纳200μl样品的拭子裂解腔室中,可将20μl样品移至扩增腔室#1,并将20μl样品移至扩增腔室 #2。在#1扩增腔室中扩增后,可以将20ul样品移至双重detectr 腔室#1a,可将20μl样品移
至双重detectr腔室#1b。另外,在#2 扩增腔室中扩增后,可以将20μl移至双重detectr腔室#2a,将20 μl样品移至双重detectr腔室#2b。
[0716]
图44显示了对图42和图43中所示的盒的修改。图45示出了图44的盒的俯视图。与图40-41的布局和工作流程相比,该布局和工作流程具有重复。图46显示了detectr测定的布局。顶部显示的是气动泵,它与盒连接。中间显示的是盒的俯视图,显示了带有储器的顶层。底部显示的是包含样品的滑动阀和指向左侧裂解腔室,接着是右侧的扩增腔室,再右侧则是detect腔室的箭头。图57示出了滑动阀装置的示意图。图58显示了滑动阀装置的布局和工作流程。在初始关闭位置(i.),将样品加载样品孔中并裂解。然后由仪器启动滑动阀,并使用移液泵将样品加载到每个通道中,所述移液泵将适当的体积分配到通道(ii.)中。通过启动滑动阀将样品输送至扩增腔室,并用移液泵混合(iii.)。将来自扩增腔室的样品吸到每个通道(iv.) 中,然后通过启动滑动阀和移液泵将其分配并混合到每个detectr 腔室(v.)中。实施例23detectr测定相比于基于pcr的检测
[0717]
本实施例描述了本文公开的detectr测定与金标准:检测靶核酸的基于pcr的方法的比较。样品可用作detectr测定的粗制样品(仅裂解)或基于pcr的检测方法的纯化样品(裂解、结合、洗涤和洗脱)。在粗制样品上进行了使用可编程核酸酶(例如,cas 蛋白)的detectr测定。可编程核酸酶被样品中的靶核酸活化,并通过反向互补指导rna与之结合。激活的可编程核酸酶不加区分地切割报道分子,产生荧光可检测信号。基于标准pcr的方法也用于检测样品中的靶核酸。
[0718]
图47示出了本文公开的detectr测定与金标准检测靶核酸的基于pcr的方法的比较。显示的流程图显示了从粗品(左)到纯品 (右)的样品制备评估梯度。将粗制样品转化为纯样品的样品制备步骤包括裂解、结合、洗涤和洗脱。本文公开的detectr测定可仅需要裂解的样品制备步骤,产生粗制样品。另一方面,基于pcr的方法可能需要裂解、结合、洗涤和洗脱,从而产生非常纯的样品。本文公开的detectr测定法可以与基于金标准pcr的检测方法一样识别来自呼吸道病毒(例如流感病毒)的靶核酸。实施例24dna的cas13a检测
[0719]
本实施例描述了靶dna的cas13a检测。cas13a用于检测来自甲型流感rna的靶rt-lamp dna扩增子。图48a示出了示意图。 rt-lamp反应在55℃下进行30分钟,起始rna浓度为10,000个病毒基因组拷贝或0个病毒基因组拷贝作为对照。两个不同的引物集显示了相同的结果(图48b和图48c)。rt-lamp反应完成后,将1μl 扩增子加入20μl cas13a检测反应中。中靶和脱靶crrna用于显示 cas13a在37℃下对rt-lamp dna扩增子的特异性检测。
[0720]
图48a示出了包括提供dna/rna、lamp/rt-lamp和cas13a 检测的工作流程的示意图。图48b示出了用第一引物集对靶 rt-lamp dna扩增子的cas13a特异性检测,如通过y轴上的减去背景的荧光所测量。中靶crrna结果显示为较暗的柱和脱靶crrna 对照结果以较亮的柱显示。10,000个病毒基因组拷贝的起始rna浓度显示在左侧两个柱中,0个病毒基因组拷贝(阴性对照)显示在右侧两个柱中。图48c示出了用第二引物集对靶rt-lamp dna扩增子的cas13a特异性检测,如通过y轴上的减去背景的荧光所测量。中靶crrna结果显示为较
暗的柱和脱靶crrna对照结果以较亮的柱显示。10,000个病毒基因组拷贝的起始rna浓度显示在左侧两个柱中,0个病毒基因组拷贝(阴性对照)显示在右侧两个柱中。
[0721]
cas13a识别靶ssdna和靶rna。图49a示出了使用2.5nm rna、单链dna(ssdna)或双链(dsdna)作为靶核酸的cas13 检测测定,其中检测通过荧光对每个测试的靶核酸进行测量。反应在 37℃下使用rna-fq(rna荧光猝灭报道基因)和dna-fq报道分子底物进行20分钟。结果表明,cas13启动rna-fq对靶rna和靶 ssdna的反式切割活性。将数据归一化为每个报道分子底物的最大荧光信号。图49b示出了使用2.5nm rna、ssdna和dsdna作为靶核酸的cas12检测测定,其中检测通过荧光对每个测试的靶核酸进行测量。使用rna-fq和dna-fq报道分子底物在37℃下反应20分钟。结果支持先前确定的cas12对靶ssdna或靶dsdna的偏好以及对 dna-fq的特异性。将数据归一化为每个报道分子底物的最大荧光信号。图49c显示了cas13和cas12在不同浓度下对靶rna、靶ssdna 和靶dsdna的性能,其中检测通过荧光对每个测试的靶核酸进行测量。使用rna-fq和dna-fq报道分子底物在37℃下进行反应90分钟。将数据归一化为每个报道分子底物的最大荧光信号。结果表明 cas13对靶ssdna具有皮摩尔灵敏度。
[0722]
当靶向靶ssdna时,发现cas13a反式切割活性对rna报道分子具有特异性。图50示出了lbucas13a(seq id no:131)检测测定,使用2.5nm靶ssdna和170nm各种报道分子底物,其中检测通过荧光测量每种测试的报道分子底物。测试单个rna-fq报道分子底物 (rep01-fam-u5)并测试13个dna-fq报道分子底物。下表12显示了每个测试的报道分子的序列。表12-报道分子序列报道分子序列
[0723]
结果表明,cas13反式切割对rna报道分子具有特异性,即使在被靶ssdna激活时也是如此。
[0724]
多个cas13家族成员检测到靶ssdna。图51a示出了使用10nm 或0nm的靶rna对lbucas13a(seq id no:131)和lwacas13a(seq id no:137)的cas13检测测定的结果,其中检测通过报道分子随时间切割产生的荧光测量。用相应的grna评估编码不同序列的三个靶 rna。结果显示对两个cas13家族成员的所有三种靶核酸的检测相似。图51b示出了使用10nm或0nm的靶ssdna对lbucas13a和 lwacas13a的cas13检测测定的结果,其中检测通过报道分子随时间切割产生的荧光测量。评估与靶rna具有相同序列的三个靶dna及其相应的grna。
结果显示cas13家族在靶ssdna识别中的偏好, lbucas13a对某些靶核酸的检测速度更快,而lwacas13a对其他靶标的检测速度更快
[0725]
靶ssdna的cas13检测在多个ph值下是稳健的。图52示出了在具有6.8至8.2范围内的各种ph值的缓冲液中使用1nm靶rna (左)或靶ssdna(右)的lbucas13a检测测定。使用rna-fq报道分子底物在37℃下进行反应20分钟。结果表明,在ph值较高(7.9 至8.2)的缓冲液中,cas13 rna检测增强,而cas13 ssdna检测在 ph条件下(6.8至8.2)一致。
[0726]
发现cas13对靶ssdna的偏好与对靶rna的偏好不同。图53a 示出了沿靶序列以1个核苷酸间隔平铺的指导rna(grna)。图53b 示出了使用0.1nm rna或2nm靶ssdna以及以1个核苷酸间隔平铺的grna和脱靶grna的lbucas13a(seq id no:131)检测测定。指导rna按其沿靶核酸序列的位置排列。图53c示出了来自图53b 的数据,按靶ssdna的性能排序。结果表明,grna对靶ssdna的性能与相同grna对rna的性能不相关。图53d示出了grna对于靶rna的3’末端上的每个核苷酸的性能。结果表明,无论该位置的靶核苷酸身份如何,grna对靶rna上均有高性能。图53e示出了 grna对于靶ssdna的3’末端上的每个核苷酸的性能。结果表明,靶标中这个位置的g表现比其他grna差。
[0727]
cas13a检测到通过核酸扩增方法(pcr、lamp)产生的靶dna。图54a显示了使用来自各种lamp等温核酸扩增反应的1μl靶dna 扩增子的lbucas13a(seq id no:131)检测分析。测试的lamp条件包括具有环正向(lf)和环反向(lb)的6-引物、仅具有lf的不对称lamp和仅具有lb的不对称lamp。所有测试的lamp反应均生成与lbucas13a相容的靶dna。图54b示出了使用不同量的pcr 反应作为靶dna的lbucas13a(seq id no:131)检测分析。结果表明,pcr产生足够的靶ssdna以实现cas13检测。实施例25detectr反应的布局和工作流程
[0728]
本实施例描述了detectr反应的测定布局和工作流程。相对于可编程的基于核酸酶的检测测定,提供了包括用于扩增和逆转录的单独腔室的测定。可编程核酸酶是cas12、cas13或cas14。样品是由拭子收集的生物流体,并插入拭子收集储器中。泵驱动测定中的流体将样品从一个腔室移到另一个腔室。可检测信号是比色的、基于荧光的、电化学的和/或使用酶(例如转化酶)产生的。
[0729]
图55a显示了气动阀装置的示意图。移液泵抽吸并分配样品。空气歧管与气动泵相连,以打开和关闭常闭阀。气动装置将流体从一个位置移动到下一位置,并隔离系统的未使用部分。与其他装置相比,气动设计减少了通道串扰。图55b显示了用于气动阀装置中的盒的示意图。常闭阀(一个这样的阀用箭头表示)在通道顶部包括弹性密封件,以在不使用腔室时将每个腔室与系统的其余部分隔离。气动泵根据需要使用空气来打开和关闭阀,以将流体移动到盒内的必要腔室中。盒可以并入多种不同的样品介质。盒可容纳200μl的裂解缓冲液体积,并执行温育步骤,例如10分钟的温育。盒可容纳从多达四个扩增腔室吸出两个2μl样品。可以将这两个样品分配到相应的检测腔室中,在扩增腔室或检测腔室之间交叉污染有限。盒可容纳1-2μl 裂解的样品从样品输入腔室到扩增腔室的转移。盒可包括多达四个扩增腔室,每个扩增腔室有两个检测腔室,总共多达八个检测腔室。每个detectr腔室可以例如通过光谱仪成像。如图55所示和图56所示,盒可以具有两个扩增腔室和每个扩增腔室两个检测腔室。
[0730]
图56显示了用于气动阀detectr装置的阀电路布局。如(i.) 所示,将生物流体样品置于样品孔中,同时关闭所有阀。样品在样品孔中裂解。如(ii.)所示,通过打开第一振动阀,并使用移液泵将样品吸出,将裂解的样品从样品腔室移至第二腔室。然后,如(iii.)所示,通过关闭第一振动阀并打开第二振动阀,将样品移至第一扩增腔室,在第一扩增腔室将样品与扩增混合物混合。如(iv)所示,样品与扩增混合物混合后,通过关闭第二振动阀并打开第三振动阀,将样品移至随后的腔室。如(v)所示,通过关闭快速第三阀并打开快速第四阀将样品移至检测腔室。检测腔室包含可编程核酸酶。如果样品中存在靶核酸,则可能产生可检测信号。可检测信号可以在检测腔室中成像。如 (vi)所示,通过打开和关闭不同系列的振动阀,可以使样品移动通过不同系列的腔室。所需腔室系列中的单个阀的致动可防止通道之间的交叉污染。
[0731]
图59显示了本公开内容的气动阀装置的盒的顶层的示意图,突出了合适的尺寸。示意图显示了一个2英寸乘1.5英寸的盒。图60 显示了本公开内容的气动阀装置的盒的适于电化学尺寸的改进的顶层的示意图。在此示意图中,在检测腔室(在最右边有4个室)中显示了三条线。这三条线代表接线(或“金属引线”),其在一次性盒中共模制、3d打印或手动装配以形成三电极系统。电极称为工作电极、对电极和参考电极。电极也可以丝网印刷在盒上。所使用的金属可以是碳、金、铂或银。实施例26用于组合的lamp和detectr反应的引物设计
[0732]
本实施例描述了用于扩增和检测如本文提供的靶核酸的组合的 lamp和detectr反应的引物设计。针对多种靶核酸测试和评价了用于设计用于lamp和detectr组合反应的引物的策略。从这些实验中,确定了一组设计指导物以促进dna核酸靶标的lamp和 detectr组合反应或rna核酸靶标的rt-lamp和detectr反应。
[0733]
图61示出了设计用于靶核酸序列的环介导的等温扩增(lamp) 的引物的方案。lamp产生包含靶核酸序列的多联体扩增子,其在扩增过程中由核酸环形成。为了产生环,lamp可以使用四至六种引物,包括正向外部引物、反向外部引物、正向内部引物、反向内部引物、任选的环正向引物和任选的环反向引物。
[0734]
图62示出了对应于lamp引物或与lamp引物退火的核酸序列、指导rna序列、前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)、以及通过lamp和detectr进行扩增和检测的靶核酸序列的各个区域的示例性配置的示意图。
[0735]
图62a示出了指导rna(grna)相对于对应于lamp引物或与lamp引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,指导rna与位于f1c区和b1区之间的靶核酸序列反向互补。
[0736]
图62b示出了指导rna序列相对于对应于lamp引物或与 lamp引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,指导rna与位于f1c区和b1区之间的靶核酸序列部分反向互补。例如,靶核酸包含与指导核酸的至少60%反向互补的在f1c 区和b1区之间的序列。在这种排列中,指导rna不与图61所示的正向内部引物或反向内引物反向互补。
[0737]
图62c示出了指导rna相对于对应于lamp引物或与lamp 引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,指导rna与位于b1区和b2区之间的环区域内
的靶核酸序列杂交。引物序列不包含pam或pfs也不与pam或pfs反向互补。
[0738]
图62d示出了指导rna相对于对应于lamp引物或与lamp 引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,指导rna与位于f2c区和f1c区域之间的环区域内的靶核酸序列杂交。引物序列不包含pam或pfs也不与pam或pfs反向互补。
[0739]
测试了用于组合lamp和detectr反应的引物集和指导rna 用于检测样品中靶核酸的存在的灵敏度和特异性。使用针对特定 lamp引物集设计的三种指导rna中的每一种,测量每个lamp引物集的detectr信号,测量为原始荧光。对于每种lamp引物和指导rna对,在含有10000个靶核酸序列拷贝的样品和含有零拷贝靶核酸序列(阴性对照)的样品中测量detectr信号。
[0740]
图63分别示出了对应于lamp引物或与lamp引物退火的核酸序列、指导rna序列、前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)、以及用于组合的lamp和detectr进行扩增和检测的靶核酸序列的各个区域的示例性配置的示意图。在右侧,示意图还显示了使用lamp扩增和指导rna序列检测靶核酸序列存在的相应荧光数据,其中荧光信号是detectr反应的输出并指示存在靶核酸。对应于lamp引物或与lamp引物退火的区域、指导rna 序列、前间区序列邻近基序(pam)或前间区序列侧翼位点(pfs)、以及靶核酸序列的序列和排列示于图64a-图64c。在每种引物配置中测试了三种示例性指导rna(grna1(seq id no:271)、grna2 (seq id no:272)和grna3(seq id no:273))。将来自检测反应的针对三种指导rna中的每一种测量的指示检测到靶核酸的荧光信号针对两个样品进行比较,所述两个样品一个含有靶核酸序列(每个反应1000个基因组拷贝)和一个不包含靶核酸序列的阴性对照(每个反应0个基因组拷贝)。grna和引物的序列如下表13所示。表13-示例性lamp引物和detectr grna集
[0741]
图63a示出了对应于lamp引物或与lamp引物退火的核酸序列(seq id no:211、seq id no:212、seq id no:215、seq idno:216和seq id no:259
–
seq id no:262)的各个区域的排列和三种指导rna(grna1(seq id no:271)、grna2(seq id no: 272)和grna3(seq id no:273))相对于lamp引物(左侧)的位置的示意图。grna1与b2c区部分重叠,因此与b2区部分反向互补。grna2与b1区重叠,因此与b1c区反向互补。grna3与b3区部分重叠并且与b2区部分重叠,因此与b3c区部分反向互补并且与 b2c区部分反向互补。互补区域(b1c、b2c、b3c、f1c、f2c和f3c) 未示出,但对应于图61中所示的区域。右侧是在存在10,000个靶核酸基因组拷贝(扩增前)或0个靶核酸基因组拷贝的情况下detectr 反应的荧光图。与grna1和
grna3的detectr反应表现出低荧光强度,表明靶核酸的检测率很低或未检测到(右)。由于grna2与 bip的b1c区杂交和指导rna的自我激活,grna2产生不依赖于靶核酸存在的荧光信号。和cas切割活性。由于引物二聚体的形成, grna2与bip的杂交可以进一步导致非靶序列的扩增。
[0742]
图63b示出了对应于lamp引物或与lamp引物退火的核酸序列(seq id no:212、seq id no:220、seq id no:221、seq idno:224、seq id no:225、seq id no:263
–
seq id no:265)的各个区域的排列和三种指导rna(grna1(seq id no:271)、grna2 (seq id no:272)和grna3(seq id no:273))相对于lamp 引物(左侧)的位置的示意图。grna1与b1c区重叠,因此与b1区反向互补。grna2与lf区重叠,因此与lfc区反向互补。grna 3 与b2区部分重叠并与lbc区部分重叠,因此与b2c区部分反向互补并与lb区部分反向互补。右侧是在存在10,000个靶核酸基因组拷贝或0个靶核酸基因组拷贝的情况下detectr反应的荧光图。所有三种指导rna在detectr反应中均检测到靶核酸的存在,靶核酸存在时的高荧光信号证明了这一点(右)。由于与bip形成引物二聚体, grna1在不存在靶核酸的情况下也产生非特异性荧光信号。grna2 和grna3未产生大量的非特异性荧光信号。
[0743]
图63c示出了对应于lamp引物或与lamp引物退火的核酸序列(seq id no:194、seq id no:198、seq id no:265
–
seq id no:270)的各个区域的排列和三种指导rna(grna1(seq id no: 271)、grna2(seq id no:272)和grna3(seq id no:273)) 相对于lamp引物(左侧)的位置的示意图。grna1与b1c区重叠,因此与b1区反向互补。grna2与lf区部分重叠并与f2c区部分重叠,因此与lfc区部分反向互补并与f2区部分反向互补。grna3与 b2重叠,因此与b2c区反向互补。右侧是在存在10,000个靶核酸基因组拷贝或0个靶核酸基因组拷贝的情况下detectr反应的荧光图。 grna2和grna3在detectr反应中特异性地检测到靶核酸的存在,如存在靶核酸时的高荧光信号和不存在靶核酸时的低荧光信号所证明(右)。grna1在detectr反应中检测到靶核酸的存在,但由于与bip形成引物二聚体,在不存在靶核酸的情况下也非特异性地产生荧光信号,如在靶核酸存在时的高荧光信号和在靶核酸不存在时的中等荧光信号所证明的。实施例27使用组合的lamp和detectr反应检测靶核酸
[0744]
本实施例描述了使用组合的lamp和detectr反应检测靶核酸。测试了用于rt-lamp测定的十个lamp引物集(#1-#10)对含有靶核酸序列的样品的灵敏度和特异性。使用syto 9检测或 detectr进行rt-lamp扩增后的检测。每个引物集中lamp引物的序列在表14中提供。表14-用于rt-lamp扩增和检测的lamp引物
[0745]
图65示出了使用dna结合染料检测的逆转录lamp (rt-lamp)反应的结果时间。随时间观察到通过syto 9荧光增加而测量的lamp扩增,并且将结果时间确定为达到最大syto 9荧光强度的一半的时间。在rna病毒的靶序列存在(1000个基因组拷贝) 或不存在(0个基
因组拷贝)的情况下,比较10个lamp引物集的结果时间。引物集,即#1(seq id no:148
–
seq id no:153)、 #7(seq id no:173
–
seq id no:178)、#8(seq id no:174、 seq id no:176和seq id no:179
–
seq id no:182)和#10(seqid no:187
–
seq id no:192),显示了包含靶序列的样品和缺乏靶序列的阴性对照之间的明显区别。结果时间减少表明样品对靶核酸序列呈阳性。
[0746]
图66示出了在与来自rt-lamp反应的产物温育五分钟后使用 cas 12变体(seq id no:37)的detectr反应的荧光信号。lamp 引物集#1-6设计用于与指导rna#2(seq id no:250)一起使用, lamp引物集#7-10设计用于与指导rna#1(seq id no:249)一起使用。每个引物集中的引物序列在表14中提供。在存在(1000个基因组拷贝)或不存在(0个基因组拷贝)靶序列的情况下,使用具有对应于seq id no:249的序列的指导rna(指导rna#1,上柱状图) 或具有对应于seq id no:250的序列的指导rna(指导rna#2,下柱状图)比较每个lamp引物集的detectr信号。数据显示,当使用detectr区分特异性和非特异性lamp扩增时,具有靶序列的反应与无靶对照反应之间的明显区别。表15中提供了detectr反应中使用的grna序列。表15-使用detectr情况下针对rt-lamp扩增的detectr grna实施例28使用rt-lamp和syto9检测甲型和乙型流感病毒
[0747]
本实施例描述了使用lamp和syto9检测甲型和乙型流感病毒。使用不同lamp引物集对含有0、100、1000、10,000或100,000 个拷贝的甲型流感病毒(iav)或者0、100、1000、10,000或100,000 个拷贝的乙型流感病毒(ibv)靶核酸序列的样品进行rt-lamp扩增。比较lamp引物集(1、2、4、5、6、7、8、9、10、11或阴性对照)特异性扩增靶核酸序列的能力。使用syto9测量扩增作为结果时间。结果时间减少表明样品对靶核酸序列呈阳性。
[0748]
每个反应rt-lamp反应均在每10μl反应1x neb isoamp缓冲液、4.5mm mgso4、6.4u/μl bst 2.0(neb)、0.75μl warmstartrtx逆转录酶、1μl 10x引物混合物和0.2μl syto9的存在下在无核酸酶水中进行。
[0749]
图67示出了在用lamp引物集1、2、4、5、6、7、8、9、10、 11或阴性对照进行rt-lamp扩增后,使用syto 9(dna结合染料) 检测来自甲型流感病毒(iav)的序列。每个引物集进行十次反应,反应一式两份进行。各个图描绘了lamp扩增反应期间随时间的荧光强度。syto 9的荧光随时间测量,作为反应中存在的靶序列量的函数。行中的图显示存在从上到下0、100、1000、10,000或100,000个拷贝的靶核酸的情况下的扩增。列中的图从左至右显示使用引物集1、 2、ibv、4、5、6、7、8、9、10和11进行的扩增。引物集1(seq id no:193
–
seq id no:198)显示了平坦的阴性对照曲线,表明适用于lamp扩增反应。引物集2(seq id no:199
–
seq id no:204) 非常适合用于使用lamp扩增靶核酸。引物集8(seq id no:220
–ꢀ
seq id no:225)
和引物集10(seq id no:221、seq id no:223
–ꢀ
seq id no:225、和seq id no:229
–
seq id no:230)在使用lamp 扩增靶核酸方面也很有效。引物集8产生的阴性对照扩增信号低于引物集10。
[0750]
图69示出了在用不同引物集进行lamp扩增后iav靶序列的扩增时间,如从图67中所示的syto 9荧光迹线所确定的。结果时间被确定为达到syto 9荧光强度的一半最大值的时间。使用syto9 在增加浓度的靶序列(每个反应0、100、1000、10,000或100,000个靶序列的基因组拷贝)存在下检测扩增。该测定能够区分阴性对照反应(无靶序列)和包含所有引物集靶序列的100,000个基因组拷贝的反应。每个引物集中lamp引物的序列在表16中提供。表16-使用rt-lamp扩增和检测iav和ibv病毒的引物
[0751]
图68示出了在rt-lamp扩增后乙型流感病毒(ibv)靶序列的扩增时间。在增加浓度的靶核酸序列(每个反应0、100、1000、10,000 或100,000个靶序列的基因组拷贝)存在下,使用syto9检测扩增。使用表16中提供的引物集#8(seq id no:220
–
seq id no:225) 进行rt-lamp扩增。实施例29使用lamp和detectr检测甲型流感病毒
[0752]
本实施例描述了使用lamp和detectr检测甲型流感病毒。使用不同lamp引物集对含有甲型流感病毒(iav)靶核酸序列或缺乏iav靶核酸序列的样品进行rt-lamp扩增。比较lamp引物集特异性扩增靶核酸序列的能力。随后使用detectr测量样品中是否存在靶核酸。随时间观察到通过激活可编程核酸酶后荧光信号的增加进行测量的detectr信号。荧光的增加表明存在靶核酸序列。
[0753]
每个rt-lamp反应均在每20μl反应1x neb isoamp缓冲液、 4.5mm mgso4、1.4mm dntp(neb)、6.4u/μl bst 2.0(neb)、 1.5μl warmstart rtx和2μl 10x引物混合物的存在下在无核酸酶水中进行。每个detectr反应在1x处理缓冲液、250nm crrna和200 nm sr-wt lbcas12a(seq id no:27)可编程核酸酶的存在下在无核酸酶水中进行。
[0754]
图70示出了在用lamp引物集1、2、4、5、6、7、8、9、10 或阴性对照进行rt-lamp扩增后使用detectr检测来自甲型流感病毒(iav)的靶核酸序列。使用表16中提供的引物集进行rt-lamp 扩增。每个引物集进行十次反应。detectr使用不同的grna进行。表17中提供了detectr反应中使用的grna序列。detectr信号作为反应中存在的靶序列量的函数被测量。各个图描绘了lamp扩增后detectr反应期间荧光强度随时间的变化。每个图上的单独迹线显示在用对应于seq id no:251的指导rna(r283 grna,蓝色)、对应于seq id no:252的指导rna(r781 grna,红色)、对应于 seq id no:253的指导rna(r782 grna,绿色)或对应于seq idno:254的指导rna(ibv grna,紫色)进行detectr后的扩增。行中的图显示了lamp扩增后的detectr,从上到下,存在0、100、 1000、10,000或100,000个拷贝的靶核酸。列中的图显示lamp扩增后的detectr,从左至右,引物集1、2、4、5、6、7、8、9、10、 11或ibv。使用引物集1导致rt-lamp对靶核酸进行稳健扩增。还发现引物集2非常适合用于通过rt-lamp扩增靶核酸序列和通过 detectr检测靶核酸序列的组合方法。当使用对应于用r782分析的seq id no:253的指导rna检测时,引物集8(seq id no:220
–ꢀ
seq id no:225)和引物集10(seq id no:221、seq id no:223
–ꢀ
seq id no:225和seq id no:229
–
seq id no:230)非常适合用于组合的rt-lamp和detectr反应,如靶核酸的稳健扩增和检测并且在不存在靶核酸的情况下没有非特异性扩增或检测所示。在靶标的 rt-lamp扩增后,还通过detectr检测来自ibv的靶标核酸序列。表17-iav或ibv的detectr情况下针对rt-lamp扩增的 detectr grna
实施例30使用lamp和detectr检测snp
[0755]
本实施例描述了使用lamp和detectr检测snp。针对多个靶snp测试和评价设计用于组合的lamp和detectr反应以检测 snp的引物的策略。从这些实验中,确定一组设计指导物,以促进用于dna核酸靶标的组合的lamp和detectr反应或用于rna核酸靶标的rt-lamp和detectr反应。
[0756]
图71示出了设计用于靶核酸序列的lamp扩增和靶核酸序列中单核苷酸多态性(snp)检测的引物的方案。在示例性排列中,靶核酸的snp位于flc区和b1区之间。
[0757]
图72示出了用于靶核酸的lamp扩增和使用detectr检测靶核酸的方法的lamp引物、指导rna序列、前间区序列邻近基序 (pam)或前间区序列侧翼位点(pfs)、以及具有snp的靶核酸的示例性排列的示意图。
[0758]
图72a示出了指导rna相对于对应于lamp引物或与lamp 引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,靶核酸的pam或pfs位于f1c区和b1区之间。整个指导rna 序列可以在f1c区和b1c区之间。snp显示为位于与指导rna杂交的靶核酸序列内。
[0759]
图72b示出了指导rna序列相对于对应于lamp引物或与 lamp引物退火的核酸序列的各个区域的示例性排列的示意图。在这种安排下,靶核酸的pam或pfs位于flc区和b1区之间,并且靶核酸包含f1c区和b1区之间的序列,该序列与指导核酸的至少60%反向互补。在本实施例中,指导rna不与正向内部引物或反向内部引物反向互补。snp显示为位于与指导rna杂交的靶核酸序列内。
[0760]
图72c示出了指导rna序列相对于对应于lamp引物或与 lamp引物退火的核酸序列的各个区域的示例性排列的示意图。在这种排列中,靶核酸的pam或pfs位于f1c区和b1区之间,并且整个指导rna序列位于f1c区和b1区之间。snp显示为位于与指导 rna杂交的靶核酸序列内。
[0761]
图73示出了包含两个pam位点和herc2 snp的核酸的示例性序列。snp位于相对于第一pam位点的第9位或相对于第二pam 位点的第14位。
[0762]
图74示出了detectr反应的结果,所述反应在lamp扩增后检测相对于第一pam位点的第9位或相对于第二pam位点的第14位处的herc2 snp。snp位置由三角形表示。在包含
herc2中的g snp等位基因或a snp等位基因的靶序列存在的情况下,随时间测量指示检测到靶序列的荧光信号。使用表18中提供的引物扩增包含snp的靶核酸。表18-用于扩增和检测herc2 snp的lamp引物snp的lamp引物
[0763]
使用指导rna(仅crrna)检测靶序列,以检测具有第一pam 位点的a等位基因(snp第9位,“a snp”)、具有第一pam位点的g等位基因(snp第9位,“g snp”)、具有第二pam位点的a 等位基因(snp第14位,“a snp”)或具有第二pam位点的g等位基因(snp第14位,“g snp”)。使用针对每种条件设计的四种指导 rna。用于检测相对于两个pam位点的两个snp等位基因的指导 rna列于表19。对应于seq id no:255的指导rna被设计用于检测第9位的a等位基因,对应于seq id no:256的指导rna被设计用于检测第9位的g等位基因,对应于seq id no:257的指导rna 被设计用于检测第14位的a等位基因,以及对应于seq id no:258 的指导rna被设计用于检测第14位的g等位基因。在第9位g snp 指导rna(seq id no:256,左上)存在下检测到g等位基因的高荧光信号,以及在第9位a snp指导rna(seq id no:255,右下) 存在下检测到a等位基因的高荧光信号。在第9位a snp指导rna (seq id no:255,右上)存在下检测到g等位基因的最小荧光信号,以及在第9位g snp指导rna(seq id no:256,左下)存在下检测到a等位基因的最小荧光信号。这表明第9位g snp和第9位a snp指导rna分别显示对g等位基因和a等位基因的特异性。第 14位a snp指导rna(seq id no:257)和第14位g snp指导rna (seq id no:258)检测到两个等位基因,如在检测具有第14位a snp或g snp指导rna的snp所示,与存在的靶序列无关。
[0764]
图75显示了靶核酸序列的lamp扩增后来自detectr反应的荧光的热图。detectr反
应使用a等位基因(seq id no:255) 或g等位基因(seq id no:256)特异性的指导rna(仅crrna) 区分两个herc2 snp等位基因。阳性检测由detectr反应中的高荧光值指示。对应于seq id no:255的指导rna对a等位基因具有特异性,如(i)a snp阳性对照、hela样品和样品2中的高荧光信号和(ii)g snp阳性对照、阴性对照和样品1中的低荧光信号所示。对应于seq id no:256的指导rna对g等位基因具有特异性,如(i) g snp阳性对照、hela样品和样品1中的高荧光信号和(ii)a snp 阳性对照、阴性对照和样品2中的低荧光信号所示。样品1对于g等位基因是纯合的,并且样品2对于a等位基因是纯合的。表19-用于扩增和检测herc2 snp的detectr指导rna
[0765]
图76示出了通过lamp对靶核酸的组合lamp扩增和通过 detectr对靶核酸的检测。通过用红色led照亮样品,用detectr 目测进行检测。每个反应均包含靶核酸序列,该序列包含蓝眼表型 (“蓝眼”)或棕眼表型(“棕眼”)的snp等位基因。样品“棕色*”和“蓝色*”分别是a等位基因阳性对照和g等位基因阳性对照。棕眼表型 (seq id no:255,“br”)或蓝眼表型(seq id no:256,“bl”)的第 9位指导rna用于每个lamp detectr反应。蓝眼等位基因或棕眼等位基因的存在通过肉眼目测检测,如含有靶核酸序列和相应指导 rna的每个管中荧光增加所示。棕眼等位基因的指导rna(seq idno:255)对a等位基因具有特异性,如在含有棕眼指导rna和棕眼靶核酸或a snp阳性对照的试管中具有高荧光信号(较亮的试管),以及在含有棕眼指导rna和蓝眼靶核酸或g snp阳性对照的试管中具有低荧光信号(较暗的试管)所示。蓝眼等位基因(seq id no:256) 的指导rna对g等位基因具有特异性,如在含有蓝眼指导rna和蓝眼靶核酸或g snp阳性对照的试管中具有高荧光信号(较亮的试管),以及在含有蓝眼指导rna和棕眼靶核酸或a snp阳性对照的试管中具有低荧光信号(较暗的试管)所示。实施例31用于检测冠状病毒的rt-lamp detectr反应
[0766]
本实施例描述了用于检测冠状病毒的rt-lamp detectr反应。使用gisaid提供的所有可用基因组设计sars-cov-2靶序列。简而言之,使用clustal omega比对病毒基因组。接下来,针对 sars-cov、两个蝙蝠sars样cov基因组和常见的人冠状病毒基因组过滤sars-cov-2基因组上的lbcas12a靶位点。最后将相容的靶位点与cdc和who的当前方案中使用的靶位点进行比较。使用 primerexplorer v5(https://primerexplorer.jp/e/)针对n-基因
和e-基因区域设计sars-cov-2的lamp引物。图114a示出了三种冠状病毒株的被n-基因grna靶向的靶位点的序列比对。n基因grna#1与 cdc-n2扩增子相容,n基因grna#2与who n-sarbeco扩增子相容。图114b示出了三种冠状病毒株的被e-基因grna靶向的靶位点的序列比对。测试的两个e基因grna(e基因grna#1和e基因 grna#2)与who e-sarbeco扩增子相容。rnase p pop7引物最初由curtis等人(2018)发表并且设计了相容的grna以与这些引物集一起使用。
[0767]
靶rna从目标病毒基因的合成基因片段产生。首先,使用含有t7启动子的正向引物对合成基因片段进行pcr步骤。接下来,将 pcr产物用作模板,在37℃下进行2小时的体外转录(ivt)反应。然后在37℃下用turbo dnase(thermo)处理ivt反应30分钟,然后在75℃下加热变性步骤15分钟。使用rna clean andconcentrator 5柱(zymo research)纯化rna。通过nanodrop和qubit 对rna进行定量,并在无核酸酶水中稀释至工作浓度。
[0768]
进行detectr测定,其中使用rt-lamp预扩增病毒或对照 rna靶标并使用lbcas12a进行反式切割测定。rt-lamp使用6.5mm 浓度的mgso4和10μl的最终体积制备。添加的lamp引物的最终浓度为f3和b3为0.2μm,fip和bip为1.6μm,lf和lb为0.8μm。使用2μl输入rna在62℃下对n-基因、e-基因和rnase p独立进行反应20分钟。
[0769]
对于lbcas12a(seq id no:27)反式切割,在37℃下将50nmlbcas12a(可从neb获得)与62.5nm grna在1x nebuffer 2.1中预温育30分钟。在形成rna-蛋白质复合体后,将横向流动切割报道分子(/56-fam/ttattatt/3bio/,idt)加入反应中,最终浓度为500 nm。rna-蛋白质复合体立即使用或在使用前在4℃下储存至多24小时。
[0770]
完成预扩增步骤后,将2μl扩增子与18μl lbcas12a-grna 复合体和80μl 1x nebuffer 2.1组合。允许100μl lbcas12a反式切割测定在37℃下进行10分钟。
[0771]
然后将横向流动条(milenia hybridetect 1,twistdx)加入反应管中,并在约2-3分钟后可视化结果。靠近样品施加垫的单条带表示阴性结果,而靠近条顶部的单条带或双条带表示阳性结果。
[0772]
使用上述rt-lamp方法进行患者优化的detectr测定,并进行以下修改:dna结合染料syto9(thermo fisher scientific)包含在反应中以监测扩增反应,并将温育时间延长至30分钟以从较低滴度样品中捕获数据。
[0773]
如上所述进行了基于荧光的患者优化的lbcas12a反式切割测定,并进行了修改;40nm lbcas12a与40nm grna预温育,然后将 100nm的与在syto9染料(/5alex594n/ttattatt/3iabrqsp/) 存在下的检测相容的荧光报道分子添加到复合体。2μl扩增子与18 μl lbcas12a-grna复合体在黑色384孔测定板中组合,并使用tecan 读板器监测荧光。实施例32筛选用于扩增sars-cov-2靶位点的引物集
[0774]
本实施例描述了用于扩增sars-cov-2靶位点的引物集筛选。使用不同的lamp引物集(集1至集11)扩增对应于病毒n-基因的冠状病毒rna基因组区域。使用每个引物集扩增含有1.5pm、5fm 或0fm sars-cov-2rna的样品。使用热启动逆转录酶(“warmstartrtx”)对每个样品中的sars-cov-2rna进行逆转录,并使用bst 2.0 dna聚合酶进行lamp扩增。该测定在60℃下进行60分钟。图77 示意性地示出了使用rt-lamp和cas12 detectr反应制备和检测样品的步骤。图97示出了使用逆转录和环介导的等温扩增(rt-lamp) 以及cas12检测对
lamp引物集扩增的靶序列。对应于seq id no:327(“r1767
–ꢀ
n-sarbeco”)的grna足以检测使用大多数针对sars-cov-2的n-基因的lamp引物集扩增的靶序列。图98示出了一系列显示detectr 反应的线图,从左至右分别是2019-ncov-e-集13、2019-ncov-e-集14、2019-ncov-e-集15、2019-ncov-e-集16、2019-ncov-e-集17、 2019-ncov-e-集18、2019-ncov-e-集19、2019-ncov-e-集20、 2019-ncov-e-集21、2019-ncov-e-集22、2019-ncov-e-集23和 2019-ncov-e-集24。在图表的第一行,右起第二、第三和第四个图表显示r1767最快表现出最高信号。在中间一行的图表中,左起前8个图表显示r1764和r1765最快表现出最高信号。在图表的底行,左起第六个图表显示r1764和r1765最快表现出最高信号。所有图表上的x轴以分钟为单位显示时间,范围从0至75,以25为增量,所有图表上的y轴以任意单位(au)显示原始荧光,范围从0至60000,以20000为增量。
[0779]
使用detectr测定检测含有5fm或0fm sars-cov-2rna 的样品。使用lbcas12a和针对sars-cov-2的n-基因的grna r1763 或针对sars-cov的n-基因的grna r1766检测样品。本实施例中使用的grna序列在表20中提供。图81示出了使用引物集1 (“2019-ncov-集1”)扩增并使用lbcas12a(seq id no:27)和针对 sars-cov-2的n-基因的grna(“r1763-cdc-n2-sars-cov-2”,seqid no:323)或针对sars-cov n-基因的grna (“r1766-cdc-n2-sars”,seq id no:326)检测的sars-cov-2n
‑ꢀ
基因的detectr测定结果。
[0780]
图87a示意性地示出了在该测定中用于检测sars-cov-2的 n-2基因的cdc-n2靶位点的序列。靶位点序列在表21中提供。表20-用于检测冠状病毒的示例性grna序列用于检测冠状病毒的示例性grna序列实施例34
sars-cov-2的检测限
[0781]
本实施例描述了sars-cov-2的检测限。使用detectr反应检测含有减少拷贝数的sars-cov-2靶核酸的样品。图82示出了在使用针对sars-cov-2的n-基因的引物集(“2019-ncov-n-集1”)扩增的detectr反应中确定sars-cov-2检测限的detectr反应的结果。检测了含有15,000、4,000、1,000、500、200、100、50、20 或0个拷贝的sars-cov-2n-基因靶核酸的样品。n-基因rna的凝胶如下所示。使用针对sars-cov-2的n-基因的grna(seq id no: 323)检测样品。
[0782]
图116示出了sars-cov-2的detectr分析可在约30min内识别下至10个病毒基因组(20min扩增,10min detectr)。一式两份lamp反应扩增20min,然后进行lbcas12a detectr分析。
[0783]
图117示出了图116中提供的lbcas12a detectr分析在5分钟时的原始荧光。sars-cov-2n-基因的检测限被确定为每次反应10 个病毒基因组(n=6)。实施例35用于检测sars-cov-2的多路复用sars-cov-2引物集
[0784]
本实施例描述了用于检测sars-cov-2的多路复用 sars-cov-2引物集。使用针对一种或多种sars-cov-2或rnase p 的引物集组合扩增含有靶核酸的样品。针对sars-cov-2的引物集由带有数字的“集”表示。图84示出了多路复用detectr反应的结果时间。样品含有sars-cov-2的体外转录的n-基因(“n-基因ivt”)、 sars-cov-2的体外转录的e-基因(“e-基因ivt”)、hela总rna、或无靶标(“ntc”)。使用针对sars-cov-2n-基因(“集1”)、 sars-cov-2e-基因(“集14”)或rnase(“rnasep”)的一个或多个引物集扩增样品。图85示出了使用针对sars-cov-2n-基因(“集1”)、 sars-cov-2e-基因(“集14”)或rnase p(“rnasep”)的不同引物集组合进行多路复用detectr反应的时间。检测含有sars-cov-2 体外转录的n-基因(左图,“n-基因ivt”)或sars-cov-2体外转录的e-基因(右图,“e-基因ivt”)的样品。图86示出了使用来自图 84和图85的表现最佳的引物集组合的多路复用detectr反应的结果时间。图84下图示出了不同引物集的detectr反应的一系列线图,从左至右分别为0.5x集1、0.5x集14、0.5x rnasep、0.25x集 1、0.25x集14、0.25x rnasep、0.5x集1/rnasep、0.5x集1/集 14/rnasep、0.5集14/rnasep、0.25x集1/rnasep、0.25x集1/集 14/rnasep、0.25x集14/rnasep。x轴以分钟为单位显示时间,范围从0至60,增量为10。y轴范围从0e 00至3e 07,增量为1e 07。图表上的每条线均显示靶标,包括n-基因ivt、e-基因ivt、hela 总rna和非靶标对照(ntc)。在每个图表中,ntc线基本上是最低线,并且在某些图表中主要是平坦的。在最左边的图中,n-基因ivt 线最快表现出最高信号。在最左边的第二张图中,e-基因ivt线最快表现出最高信号。在最左边的第三张图中,hela总rna系最快表现出最高信号,而n-基因ivt和e-基因ivt系在40-50分钟后才表现出信号。在最左边的第四个图中,n-基因ivt系最快表现出最高信号,随后是hela总rna系在40-50分钟左右出现信号。在最左边的第五个图中,e-基因ivt线最快表现出最高信号。在最左边的第六个图中, hela总rna线最快表现出最高信号。在最左边的第七张图中,n
‑ꢀ
基因ivt和hela总rna系最快表现出最高信号。在最左边的八个图中,n-基因ivt、e-基因ivt和hela总rna系最快表现出最高信号。在最左边的第九个图中,e-基因ivt和hela总rna系最快表现出最高信号。在最左边的第十个图中,n-基因ivt和hela总 rna系最快表现出最高信号。在最左边的第11个图中,n-基因ivt、 e-基因ivt和
hela总rna系最快表现出最高信号。在最右边的图中,e-基因ivt和hela总rna系最快表现出最高信号。
[0785]
图101示出了评价lamp引物集在sars-cov-2靶标多重扩增中的效用的detectr测定结果。使用针对sars-cov-2n-基因(“集 1”)或sars-cov-2e-基因(“集14”)或rnase p(“rnasep”)的一个或多个引物集扩增样品。使用针对sars-cov-2的n-基因(seq idno:323,“n-基因”)、sars-cov-2的e-基因(seq id no:325,“e
‑ꢀ
基因”),或rnase p(seq id no:330)检测样品。实施例36detectr测定区分三种冠状病毒的灵敏度
[0786]
本实施例描述了detectr测定区分三种冠状病毒的灵敏度。样品含有250pm的rna,对应于sars-cov-2的n-基因、sars-cov 的n-基因或蝙蝠-sl-cov45的n-基因。如实施例2中所述,在检测时扩增样品。使用针对sars-cov-2的n-基因(“r1763”)的grna、针对sars-cov的n-基因(“r1766”)的grna或针对sarbeco冠状病毒(“r1767”)的n-基因。在本实施例中使用的grna的序列在表20 中提供。图87b示意性地示出了sars-cov-2n-基因(“n-sarbeco”) 靶位点的区域的序列。表21中提供了靶位点序列。图88示出了确定针对sars-cov-2的n-基因(“r1763”,seq id no:323)、sars-cov 的n-基因(“r1766,”seq id no:326)或sarbeco冠状病毒的n
‑ꢀ
基因(“r1767”seq id no:327)的grna对含有sars-cov-2的n
‑ꢀ
基因(“n-2019-ncov”)、sars-cov的n-基因(“n-sars-cov”) 或蝙蝠-sl-cov45的n-基因(“n-蝙蝠-sl-cov45”)的样品的灵敏度的detectr测定的结果。sars-cov-2、sars-cov和蝙蝠-sl-cov45 是sarbeco冠状病毒的毒株。使用lbcas12a(seq id no:27)检测样品。图88示出了detectr反应的线图。图从左至右示出了不同的靶标,包括n-2019-ncov、n-sars-cov和n-蝙蝠-sl-cov45。x轴以分钟为单位显示时间,范围从0至75,增量为25。y轴以任意单位 (au)显示原始荧光,范围从0至1000000,增量为250000。每个图中的三条线包括r1763、r1766和r1767。在最左边的图中,r1766 线显得平坦,而r1763和r1767线最快表现出最高信号。在中间图表中,r1763线显得平坦,而r1766和r1767线最快表现出最高信号。在最右边的图中,r1763线显得平坦,而r1766和r1767线最快表现出最高信号。
[0787]
图99示出了评价多种grna在区分三种不同冠状病毒株 sars-cov-2(“covid-2019”)、sars-cov或蝙蝠-sl-cov45中的效用的detectr测定的结果。对包含sars-cov-2(“n-2019-ncov”)、 sars-cov(“n-sars-cov”)或蝙蝠-sl-cov45(“n-蝙蝠-sl-cov45”) 的样品进行测试。使用针对sars-cov-2的n-基因的grna(seq id no:323,“covid-2019grna”)、针对sars-cov的n-基因的grna (seq id no:326,“sars-cov grna”)或针对多种冠状病毒种类的n-基因的grna(seq id no:327,“multi-cov grna”)检测样品。表21-示例性冠状病毒n-基因和e-基因基因片段
实施例37四种冠状病毒e-基因检测的灵敏度
[0788]
本实施例描述了检测三种冠状病毒的e-基因的灵敏度。样品含有250pm的对应于sars-cov-2的e-基因、sars-cov的e-基因、蝙蝠-sl-cov45的e-基因、或蝙蝠-sl-cov21的e-基因的rna。如实施例2中所述,在检测时扩增样品。使用针对e-基因(r1764)的第一grna或针对e-基因(r1765)的第二grna中的每一个检测样品。本实施例中使用的grna序列在表20中提供。图89示意性地示出了sars-cov-2e-基因(“e-sarbeco”)靶位点的区域的序列。靶位点序列在表21中提供。图90示出了确定针对冠状病毒n-基因的两种grna对含有sars-cov-2的e-基因(“e-2019-ncov”)、sars-cov 的e-基因(“e-sars-cov”)、蝙蝠-sl-cov45的e-基因(“e-蝙蝠
ꢀ‑
sl-cov45”)或蝙蝠-sl-cov21的e-基因(“e-蝙蝠-sl-cov21”)的样品的灵敏度的detectr测定的结果。使用lbcas12a(seq id no: 27)和对应于seq id no:324(“r1764
–
e-基因1”)的grna或对应于seq id no:325(“r1765
–
e-基因2”)的grna检测样品。随时间测量荧光强度。
[0789]
图100示出了评价多种grna在区分三种不同冠状病毒株 sars-cov-2(“covid-2019”)、sars-cov或蝙蝠-sl-cov45中的效用的detectr测定的结果。对包含sars-cov-2(“n-2019-ncov”)、 sars-cov(“n-sars-cov”)或蝙蝠-sl-cov45(“n-蝙蝠-sl-cov45”) 的样品进行测试。使用针对对应于seq id no:324(“e-基因grna#1”) 或seq id no:325(“e-基因grna#2”)的多种冠状病毒的e-基因的 grna检测样品。用具有针对e-基因的grna检测样品实现对相关冠状病毒株的广谱靶向。实施例38使用cas12变体使用横向流动detectr反应检测冠状病毒
[0790]
本实施例描述了使用横向流动detectr反应检测冠状病毒。图106示出了与pcrd横向流动装置相容的检测核酸的设计。提供了示例性相容检测核酸rep072、rep076和rep100(左)。这些检测核酸可用于pcrd横向流动装置(右)以检测是否存在靶核酸。右上示意图示出了当与不含靶核酸的样品接触时产生的示例性条带配置。右下示意图示出了当与包含靶核酸的样品接触时产生的示例性条带配置。表22中提供了与pcrd横向流动装置相容的示例性报道分子。横向流动切割报道分子rep100使得能够通过应用信号线检测横向流动条上的样品。rep072报道分子仅在报道分子被可编程核酸酶切割后在 igg线上发出信号。与附接至磁珠上的rep076报道分子类似,rep100 报道分子在被切割时在pcrd条上的fam-生物素线上产生信号。然而,与rep076不同的是,rep100报道分子在dig-生物素线上被捕获,从而无需磁珠。
[0791]
使用等温扩增来扩增包含来自冠状病毒的rna靶序列的样品。使用逆转录lamp(rt-lamp)扩增测定将含有0fm(
“‑”
)或5fm (“ ”)体外转录冠状病毒n-基因的样品扩增60分钟。使用cas12变体(seq id no:37)进行detectr反应0min、2.5min、5min或 10min。图91示出了使用cas12变体(seq id no:37)检测是否存在sars-cov-2n-基因靶rna的横向流动detectr反应的结果。显示了横向流动测试条。测试了含有(“ ”)或不含(
“‑”
)体外转录的 sars-cov-2n-基因rna(“n-基因ivt”)的样品。顶部的一组水平线(表示为“测试”)表示detectr反应的结果。detectr反应对含有体外转录的冠状病毒靶序列的样品灵敏。表22-用于检测冠状病毒的示例性报道分子序列
报道分子序列rep072/56-fam/ttattatt/3bio/(seq id no:9)rep076/56-fam/*/ibiodt/*aattaattaattaattaatt/3thiomc3-d/(seq id no:372)rep100/56-fam/*/ibiodt/*aattaattaattaattaatt/3dig_n/(seq id no:372)
实施例39使用横向流动detectr反应检测sars-cov-2
[0792]
本实施例描述了使用横向流动detectr反应检测 sars-cov-2。图92示意性地示出了使用可编程核酸酶检测靶核酸。简而言之,具有反式附带切割活性的cas蛋白在与指导核酸和与指导核酸的区域反向互补的靶序列结合后被激活。激活的可编程核酸酶切割报道核酸,从而产生可检测信号。图93示意性地示出了样品中是否存在靶核酸的检测。样品中的选择核酸使用等温扩增进行扩增。扩增的样品与可编程核酸酶、指导核酸和报道核酸接触,如图92所示。如果样品含有靶核酸,则产生可检测信号。在体外转录和等温预扩增靶核酸后,使用detectr反应检测是否存在对应于sars-cov-2的靶核酸。使用cas12可编程核酸酶检测样品。样品包含sars-cov-2 病毒rna或对应于rnase p的序列(阴性对照)。使用图92和图 93中描述的detectr反应,使用针对sars-cov-2的grna检测样品。图94示出了检测样品中是否存在sars-cov-2(“2019-ncov”) rna的detectr横向流动反应的结果。rnase p的检测用作样品质量对照。样品在体外转录和扩增(左)并使用cas12可编程核酸酶进行检测(右)。使用cas12可编程核酸酶和针对sars-cov-2的grna 对含有(“ ”)或缺乏(
“‑”
)体外转录的sars-cov-2rna(“2019-ncov ivt”)的样品进行测定,持续0分钟或5分钟。该反应对含有 sars-cov-2的样品灵敏。实施例40使用detectr反应测试sars-cov-2的临床样品
[0793]
本实施例描述了使用detectr反应测试sars-cov-2的临床样品。使用rt-pcr扩增临床样品并使用lbcas12a检测。使用针对 sars-cov-2的n-基因或e-基因或rnase p(阴性对照)的grna (“crrna”)检测样品。图95示出了使用lbcas12a可编程核酸酶(seqid no:27)确定患者样品中是否存在sars-cov-2的detectr反应的结果。图95的右侧是一组柱状图。柱状图上图显示rt-pcr扩增子测试-15分钟,crrna在x轴上变化,从左至右显示n基因、e基因和rnase p的crrna。y轴以任意单位(au)显示原始荧光,范围从0至60000,增量为20000。在每个crrna组内是不同的测试靶标,从左至右分别是样品1、样品1ntc、样品2、样品2ntc和detectrntc。柱状图下图显示rt-pcr扩增子测试-15分钟,靶标在x轴上变化,从左至右显示样品1、样品1ntc、样品2、样品2ntc和 detectr ntc的靶标。y轴以任意单位(au)显示原始荧光,范围从0至60000,增量为20000。在每个靶标组中测试不同的crrna,从左至右分别是n基因、e基因和rnase p。
[0794]
使用横向流动detectr反应对sars-cov-2阳性或阴性患者的临床样品进行测定。使用rt-pcr对样品进行扩增和逆转录,并使用cas12可编程核酸酶进行检测。还测定了阴性对照样品(“ntc”)。 detectr反应进行5分钟。图96示出了检测患者样品中是否存在 sars-cov-2的横向流动detectr反应的结果。使用针对 sars-cov-2的grna或针对rnase p的grna检测样品。针对e
‑ꢀ
基因区域的引物用于使用rt-pcr扩增靶区域。实施例41
用于改进rt-lamp扩增和检测的缓冲液筛选
[0795]
本实施例描述了用于改进rt-lamp扩增和检测的缓冲液筛选。在不同缓冲条件下使用rt-lamp扩增含有hela总rna(“总rna”)、 sars-cov-2n-基因rna和hela总rna(“n-基因 总rna”)或不含靶标(“ntc”)的样品。
[0796]
图102示出了评价rt-lamp扩增反应对常见样品缓冲液的灵敏度的detectr测定的结果。在通用转运培养基(utm,上图)或 dna/rna shield缓冲液(下图)中以不同的缓冲液稀释度(从左至右:1
×
、0.5
×
、0.25
×
、0.125
×
或无缓冲液)测量反应。实施例42detectr测定中sars-cov-2的检测限
[0797]
本实施例描述了detectr测定中sars-cov-2的检测限。使用不同拷贝数的sars-cov-2病毒基因组进行detectr反应。图103 示出了确定sars-cov-2(致covid-19感染的病毒)的detectr 测定检测限(lod)的detectr测定结果。使用针对sars-cov-2 的n-基因的grna(seq id no:323,“r1763
–
n-基因”)或针对rnasep的grna(seq id no:330,“r779-rnase p”)检测样品。每个条件重复7次。detectr检测能够重复性和特异性地检测sars-cov-2 rna的存在,每个反应低至约625至约150个拷贝。实施例43使用detectr进行多路复用rt-lamp扩增的靶标特异性
[0798]
本实施例描述了使用detectr反应进行多路复用rt-lamp 扩增的靶标特异性。图104示出了评价针对sars-cov-2n-基因 (“r1763-n-基因”)的grna在使用lbcas12a可编程核酸酶(seq idno:27)的2路复用rt-lamp反应中的靶标特异性的detectr测定结果。使用2路复用rt-lamp扩增来扩增来自sars-cov-2 (“2019-ncov n-基因ivt”)、sars-cov(“sars-cov n-基因ivt”) 或蝙蝠-sl-cov45(“蝙蝠-sl-cov45 n-基因ivt”)的体外转录的冠状病毒n-基因序列,或来自带有不同冠状病毒株(cov-hku1、 cov-299e、cov-oc43或cov-nl63)的患者的临床剩余样品。hela 总rna用作rnase p的阳性对照。测试无靶标对照(“ntc”)作为阴性对照。2路复用rt-lamp扩增使用两个引物集对样品进行扩增,一个引物集针对sars-cov-2n-基因和一个引物集针对rnasep。使用针对rnase p(seq id no:330,“r779
–
rnase p”)或sars-cov-2 的n-基因(seq id no:323,“r1763
–
n-基因”)的grna检测扩增样品。两种grna均能够检测在2路复用rt-lamp扩增测定中扩增的样品。
[0799]
图105示出了评价针对sars-cov-2的n-基因(“r1763-n-基因”)或sars-cov-2的e-基因(“r1765-e-基因”)的grna在使用 lbcas12a可编程核酸酶(seq id no:27)的3路复用rt-lamp反应中的靶标特异性的detectr测定结果。使用3路复用rt-lamp 扩增来扩增来自sars-cov-2(“2019-ncov n-基因ivt”)、sars-cov (“sars-cov n-基因ivt”)或蝙蝠-sl-cov45(“蝙蝠-sl-cov45 n
‑ꢀ
基因ivt”)的体外转录的冠状病毒n-基因,来自sars-cov-2 (“2019-ncov e-基因ivt”)或sars-cov(“sars-cov e-基因ivt”) 的体外转录的冠状病毒e-基因序列,或来自带有不同毒株 (cov-hku1、cov-299e、cov-oc43或cov-nl63)的患者的临床剩余样品。hela总rna用作rnase p的阳性对照。测试无靶标对照 (“ntc”)作为阴性对照。3路复用rt-lamp扩增使用三个引物集扩增样品,一个引物集针对sars-cov-2n-基因,一个引物集针对 sars-cov-2e-基因,以及一个引物集针对rnasep。使用针对rnasep(seq id no:330,“r779
–
rnase p”)、sars-cov-2的n-基因(seqid no:323,“r1763
–
n-基因”)或
sars-cov-2的e-基因(seq id no:325,“r1765
–
e-基因”)的grna检测扩增样品。所有三种grna 均能够检测在3路复用rt-lamp扩增测定中扩增的样品。实施例44n-基因和e-基因grna的冠状病毒株特异性
[0800]
本实施例描述了n-基因和e-基因grna的冠状病毒株特异性。指导rna还被设计用于特异性检测sars-cov-2的n-基因。指导 rna还被设计用于检测三种sars样冠状病毒株(sars-cov、蝙蝠 sars样冠状病毒(蝙蝠-sl-covzc45)和sars-cov-2)中的e-基因。将合成的体外转录的(ivt)sars-cov-2rna基因靶标加标至无核酸酶的水中。通过使用lbcas12a(seq id no:27)的基于 crispr-cas12的检测测定来检测样品。detectr测定包括在62℃下进行20分钟的rt-lamp反应和在37℃下进行10分钟的cas12检测反应。用于靶标生成、qpcr和lamp扩增的引物在表23中提供。图107a示出了基因组图谱,其表明冠状病毒基因组内的e(包膜) 基因和n(核蛋白)基因区的位置。引物和探针相对于e和n基因区的相应区域或退火区域显示在各自基因区下方。rt-lamp引物由黑色矩形表示,fip引物(灰色)的f1c半和b1c半的结合位置由带虚线边框的条纹矩形表示。在世界卫生组织(who)和疾病控制中心 (cdc)使用的测试中扩增的区域分别表示为“who e扩增子”和“cdc n2扩增子”。
[0801]
指导rna能够区分sars-cov-2,使用n基因grna与相关冠状病毒株不发生交叉反应,而发生e-基因grna的预期交叉反应。图107b示出了使用lbcas12a可编程核酸酶(seq id no:27)评价针对多种冠状病毒株(sars-cov-2、sars-cov或蝙蝠-sl-covzc45) 的n-基因或e-基因的grna的特异性或广泛检测效用的detectr 测定结果。测定中使用的n-基因grna(左,“n-基因”)对sars-cov-2 具有特异性,而e-基因grna能够检测3种sars样冠状病毒(右,“e-基因”)。靶向sars-cov和蝙蝠冠状病毒的单独n基因grna 未检测到sars-cov-2(中,“n-基因相关物种变体”)。指导rna 被设计特异性靶向sars-cov-2或广谱检测相关的冠状病毒株。含有 sars-cov-2n-基因(“n-基因:sars-cov-2”)、sars-cov n-基因(“n-基因:sars-cov”)、蝙蝠-sl-covzc45 n-基因(“n-基因:蝙蝠-sl-covzc45”)、sars-cov-2e-基因(“e-基因:sars-cov-2”)、 sars-cov e-基因(“e-基因:sars-cov”)或蝙蝠-sl-covzc45 e
‑ꢀ
基因(“e-基因:蝙蝠-sl-covzc45”)的样品使用被设计用于特异性检测sars-cov n-基因(seq id no:323,“n-基因”)的grna、被设计用于检测冠状病毒变体的n-基因(seq id no:326,“n-基因(相关物种变体)”)的grna、或被设计用于广谱检测冠状病毒e-基因 (seq id no:324,“e-基因”)的grna进行检测。表23-靶标生成和扩增引物
实施例45使用横向流动detectr测定对冠状病毒的特异性和广谱检测
[0802]
本实施例描述了使用横向流动detectr测定对冠状病毒的特异性和广谱检测。在适当的生物安全实验室要求范围内,可以使用最少的设备进行横向流动detectr测定。图107c示出了冠状病毒 detectr测定中使用的示例性实验室设备。除了适当的生物安全防护
设备外,所使用的设备还包括样品收集装置、微量离心管、设置为 37℃和62℃的加热块、移液器和吸头以及横向流动条。
[0803]
detectr测定可以在30至40分钟内运行,并在横向流动条上可视化。常规rna提取或样品基质可用作detectr的输入(lamp 预扩增和基于cas12的n-基因、e-基因和rnase p检测),其可通过荧光读取器或横向流动条进行可视化。如果同时检测到e和n基因,则认为sars-cov-2detectr检测呈阳性,或如果检测到e或n基因,则假定阳性。这种解释与当前fda紧急使用授权(eua)指南和最近批准的eua的即时诊断一致。图107d示出了用于检测受试者中冠状病毒的detectr测定的示例性工作流程。常规rna提取或样品基质可用作detectr的输入(用于ne基因、en基因和rnase p的lamp预扩增和基于cas12的检测),可通过荧光读取器或横向流动条进行可视化。可以直接从原始样品基质中检测样品,也可以提取病毒rna然后进行检测。使用等温扩增方法(例如rt-lamp)扩增编码sars-cov-2e-基因和sars-cov n-基因的病毒rna和编码人rnase p的rna。使用与针对sars-cov-2n-基因和e-基因序列的grna复合的cas12可编程核酸酶检测扩增的样品。cas12可编程核酸酶在与靶核酸形成复合体后切割ssdna报道核酸。然后使用横向流动读出来检测样品。样品采集可以在约0min至约10min内进行,扩增和检测可以在约20min至约30min内进行,并且样品读出可以在约2min内进行。
[0804]
图107e示出了横向流测试条(左),表明sars-cov-2n-基因的阳性测试结果(左,上)和sars-cov-2n-基因的阴性测试结果 (左,下)。样品中的sars-cov-2阳性鉴定需要同时检测e-基因和 n-基因以确认阳性检测。如图107d所示和所述进行横向测定。表(右) 示出了测试是否存在rnase p(阳性对照)、sars-cov-2n-基因和冠状病毒e-基因的基于横向流动条的冠状病毒诊断测定的可能测试指标和相关结果。检测到两个sars-cov-2病毒基因靶标和内部加标的人rnase p对照表明结果呈阳性。实施例46直接从原始样品基质扩增和检测患者样品
[0805]
本实施例描述了直接从原始样品基质扩增和检测患者样品。评估了rt-lamp测定直接从原始样品基质扩增sars-cov-2核酸的能力。使用rt-lamp detectr反应测定由无症状供体的鼻拭子组成的样品,这些样品置于通用运输介质(utm)或磷酸盐缓冲盐水(pbs) 中并加标sars-cov-2ivt靶rna。由于鼻拭子在通用运输介质 (utm)中比在磷酸盐缓冲盐水(pbs)中采集更频繁,因此评估了从由utm缓冲液组成的鼻拭子样品基质中运行测定的效果。在utm 或pbs中采集来自无症状供体的鼻拭子。
[0806]
图110a示出了在不同缓冲条件下rt-lamp的扩增时间。结果时间计算为荧光值是实验最大值的三分之一时的时间。扩增失败的反应报告为20分钟的值,并标记为“无扩增”。确定靶标对照质粒在水、 10%磷酸盐缓冲盐水(pbs)或10%通用转运培养基(utm)中的不同起始浓度的结果时间。结果时间越短表示扩增越快。结果表明10% pbs对测定的抑制小于10%utm的。图110b示出了用于确定 sars-cov-2的n-基因、sars-cov-2的e-基因和rnase p在5%utm、 5%pbs或水中的扩增效率的rt-lamp测定的结果。对含有0.5fm 体外转录的n-基因、0.5fm体外转录的e-基因和0.8ng/μl hela总 rna(“n e 总rna”)或无靶标对照(“ntc”)的样品进行测试。对5%样品缓冲液终体积中n-基因、e-基因和rnase p的rt-lamp 扩增效率的评价表明,在5%样品缓冲液浓度下,rt-lamp对所有靶基因均有效。最终靶标浓
度为0.5fm n-基因ivt、0.5fm e-基因ivt 和0.08ng/μl hela总rna。图110c示出了直接从在pbs中的鼻拭子扩增rna。结果时间作为pbs浓度的函数进行测量。鼻拭子(“鼻拭子”)加标hela总rna(左,“总rna:0.08ng/ul”)或水(右,“总rna:0ng/ul”)。将不含鼻拭子(“无拭子”)的样品作为对照品进行比较。使用rt-lamp,当反应浓度≥10%utm(体积)或≥20%pbs (体积)时,检测性能下降。检测限估计值在≥10%utm中降至500 拷贝/μl,并且在≥20%pbs中降至1,00拷贝/μl。rt-lamp能够直接从pbs中的鼻拭子扩增rna,在每个rt-lamp预扩增反应的pbs 终体积为5%或10%时性能最佳。鼻拭子在pbs中制备,并加标hela 总rna或水,并在针对rnase p的rt-lamp反应中以不同浓度运行。实施例47sars-cov-2的detectr测定的检测限
[0807]
本实施例描述了sars-cov-2的detectr测定的检测限。使用加标至ivt sars-cov-2靶rna(在pbs中)中的供体鼻拭子样品基质,将用于检测sars-cov-2的detectr测定的分析检测限 (lod)相对于美国fda紧急使用授权(eua)批准的cdc测定(对 3个靶标中的2个n2和n3运行测试)进行比较。将体外转录的病毒 rna的五个10倍系列稀释液以101-105拷贝/ml的浓度加标至样品基质中,detectr测定的每个稀释度重复6次,cdc测定的每个稀释度重复3次。图111a示出了通过lbcas12a(seq id no:27)检测sars-cov-2n-基因(n=6)产生的原始荧光曲线。曲线显示在少于20分钟内饱和。图111b示出了使用lbcas12a检测的sars-cov-2 n-基因的detectr测定的检测限,如从图111a中所示的原始荧光迹线所确定。随着sars-cov-2n-基因浓度(每ml拷贝数)的降低,测量荧光强度。图111c示出了从图111a中所示的原始荧光迹线确定的detectr测定检测限的结果时间。结果时间越短表示扩增和检测越快。sars-cov-2detectr的lod估计值为约10拷贝/μl,其与cdc n2和n3测定的lod相当。sars-cov-2的detectr测定在30分钟内鉴定出多达10个病毒基因组。将一式两份lamp反应扩增20分钟,然后进行lbcas12a detectr分析。进一步的分析揭示了sars-cov-2n-基因的检测限是每个反应10个病毒基因组(n=6,图111b)。评价这些反应的结果时间突出显示在5分钟内检测到10 个sars-cov-2病毒基因组(n=6,图111c)。
[0808]
将用于检测sars-cov-2的rt-lamp detectr反应的分析检测限与美国fda紧急使用授权批准的cdc测定使用的qrt-pcr 检测测定进行比较。使用7次稀释的对照ivt病毒核蛋白rna(“cdcvtc ncov转录本”)构建定量标准曲线,每个稀释度重复3次,并使用cdc方案检测(图108d,左)。然后使用相同对照核蛋白rna 的10个两倍连续稀释液进行detectr测定,每个稀释液重复6次 (图108d,中间)。加州公共卫生部测试的cdc测定的估计稀释限度为1拷贝/μl反应,与fda包装插页中的分析性能一致,相比于 detectr测定为10拷贝/μl反应。图108d示出了使用lbcas12a(中) 或cdc方案(左)进行的detectr测定的结果以确定sars-cov-2 的检测限。信号显示为每次反应的病毒基因组拷贝数的函数。显示0 拷贝/μl和10拷贝/μl(右)的测定的代表性横向流动结果。
[0809]
使用横向流动装置测量检测sars-cov-2的检测限(lod)。图108a示出了在存在靶核酸(上图)的情况下,cas12可编程核酸酶对用fam和生物素标记的检测核酸的切割。横向流动测试条(下图)的示意图示出了指示测试样品中靶核酸存在(“阳性”)或不存在 (“阴性”)的标记。完整的fam生物素化报道分子流向对照捕获线。识别匹配的靶标后,cas-grna复合体切割报道分子,然后流向靶标捕获线。
实施例48sars-cov-2的detectr测定中的温育时间影响
[0810]
本实施例描述了sars-cov-2的detectr测定中的温育时间影响。使用rt-lamp扩增样品并使用lbcas12a(seq id no:27) 检测。测试cas12反应温育时间对信号的影响。
[0811]
图108b示出了使用lbcas12a的detectr测定的结果,以确定反应时间对含有0fm sars-cov-2rna或5fm sars-cov-2rna 的样品的影响。lbcas12a检测测定对10分钟内饱和的sars-cov-2 n-基因的rt-lamp扩增子的荧光信号。rt-lamp扩增子从2μl的 5fm或0fm sars-cov-2n-基因ivt rna中通过在62℃下扩增20 分钟产生。cas12检测反应的可视化使用fam-生物素报道分子和设计用于捕获标记核酸的横向流动条实现,如图108a所示。未切割的报道分子在第一条检测线(对照线)处被捕获,而不加选择的cas12 切割活性在第二条检测线(测试线)处产生信号。为了比较使用荧光或横向流动时cas12产生的信号,使用n基因引物使用5fm或0fmivt模板进行rt-lamp,并使用荧光读板器和通过在0、2.5、5和 10分钟时的横向流动来监测相同扩增子上cas12读出的性能。cas12 荧光信号可在《1分钟内检测到,而横向流动的目视信号可在5分钟内实现。图112a示出了使用lbcas12a确定反应时间对含有0fmsars-cov-2rna或5fm sars-cov-2rna的样品的影响的 detectr测定的结果。lbcas12a(seq id no:27)的荧光信号检测在sars-cov-2n-基因在10分钟内饱和的rt-lamp扩增子上测定。 rt-lamp扩增子由2μl 5fm或0fm sars-cov-2n-基因ivt rna 通过在62℃下扩增20分钟产生。
[0812]
图108c示出了对应于图108b中通过detectr测定的样品的横向流动测试条测定样品。对于含有0fm sars-cov-2rna(
“‑”
) 或5fm sars-cov-2rna(“ ”)的样品,以反应时间的函数显示对应于对照(c)或测试(t)的条带。相同rt-lamp扩增子上的lbcas12a 在5分钟内通过横向流动测定产生可见信号。图112b示出了对应于图112a中通过detectr测定的样品的横向流动测试条测定样品。以反应时间的函数显示含有0fm sars-cov-2rna(
“‑”
)或5fmsars-cov-2rna(“ ”)的样品的对应于对照(c)或测试(t)的条带。如图112a所示,相同rt-lamp扩增子上的lbcas12a(seq idno:27)在5分钟内通过横向流动测定产生可见信号。实施例49使用detectr测定检测患者样品中的sars-cov-2
[0813]
本实施例描述了使用detectr测定检测患者样品中的 sars-cov-2。从6名确诊感染sars-cov-2患者的鼻拭子样品、15 名其他流感或冠状病毒感染患者的鼻拭子样品和5名健康供体的鼻拭子样品中提取的rna进行测试。将流感(n=4)和其他人冠状病毒感染(常见人季节性冠状病毒感染(oc34、hku1、229e和nl63,n=7)) 患者的rna提取物与体外转录的sars-cov-2靶标rna加标的utm 中的鼻拭子基质和从2名sars-cov-2感染患者的鼻拭子中提取的 rna进行比较。使用带有荧光和横向流动条读出的sars-cov-2 detectr测定检测样品。图109示出了比较使用本公开内容的 rt-lamp的sars-cov-2detectr检测与使用定量逆转录聚合酶链反应(qrt-pcr)检测方法的sars-cov-2测定的表格。detectr rt-lamp测定中的n-基因靶标与qrt-pcr测定中检测到的n-基因 n2扩增子重叠。图108e示出了患者样品detectr数据。来自6名 covid-19感染患者(n=11,5次重复)和12名感染流感或4种季节性冠状病毒(hcov-229e、hcov-hku1、hcov-nl63、hcov-oc43) 中的一种的患者(n=12)的临床样品使用sars-cov-2detectr(阴影框)进行测定。使用imagej定量来自横向流动条的信号
强度,并归一化为n基因、e基因或rnase p集内的最高值,阳性阈值高于背景五个标准偏差。sars-cov-2测试的最终确定基于图107e中的解释矩阵。flua表示甲型流感,flub表示乙型流感。hcov表示人冠状病毒。图108f示出了在covid-19患者(sars-cov-2阳性,“患者1”)、缺乏靶核酸的无靶标对照样品(“ntc”)和含有靶核酸(“pc”) 的阳性对照样品中检测sars-cov-2的横向流动测试条。使用对应于 seq id no:325的grna检测e-基因。使用对应于seq id no:323 的grna检测n-基因。对所有三个样品均进行sars-cov-2n-基因、 sars-cov-2e-基因和rnase p的检测。基于cas12的检测结果与 cdc n1/n2 qrt-pcr检测结果有100%的一致性,证明使用基于 detectr cas12的检测方法诊断sars-cov-2感染患者的可行性。
[0814]
sars-cov-2在11名患者拭子中的9份中检测到,并且未与其他呼吸道病毒发生交叉反应。确认来自covid-19患者的两个阴性拭子低于既定检测限。图118示出了10个covid-19感染患者样品和 12个其他病毒性呼吸道感染患者样品的横向流动detectr结果。使用两种不同的基因n2和e以及相同样品输入对照rnase p,对来自6 名患者(covid19-1至covid19-5)的10个样品以及一个鼻咽拭子 (a)和一个口咽拭子(b)进行sars-cov-2测试。根据图119中提供的指导分析结果。图119示出了用于解释sars-cov-2detectr 横向流动结果的说明。图120a-c示出了对11个covid-19感染患者样品和12个其他病毒性呼吸道感染患者样品进行的荧光detectr 动力学曲线。使用两种不同的基因n2和e以及样品输入对照rnase p 对来自6名患者(covid19-1至covid19-6)的10个鼻咽/口咽拭子样品进行了sars-cov-2测试。
[0815]
图120a示出了使用标准扩增和检测条件测试的样品,12个 covid-19阳性患者样品中有10个产生表明存在sars-cov-2e基因的稳健荧光曲线(20分钟扩增,10分钟内发出信号)。其他12个病毒性呼吸道临床样品均未检测到e基因信号。
[0816]
图120b示出了对12个covid-19阳性患者样本中的10个使用为了产生强荧光曲线(30分钟扩增,10分钟内发出信号)的延长扩增时间测试存在sars-cov-2n基因的样品。在其他12个病毒性呼吸道临床样品中未检测到n基因信号。
[0817]
图120c示出了对应于样品输入对照rnase p的图。
[0818]
鉴于图120和图121中所示的横向流动和基于荧光的读出之间 100%一致,基于荧光的读出被用于对来自急性呼吸道感染患者的另外60个鼻咽拭子样品进行sars-cov2盲测,其中使用我们的 detectr测定。通过qrt-pcr测试,在60个样品中,30个样品对 covid-19感染呈阳性,并且30个对covid-19感染呈阴性,但通过呼吸道病毒面组(rvp)多路复用pcr测试对另一种病毒性呼吸道感染呈阳性或所有检测呈阴性。对于83个总呼吸道拭子样品中的冠状病毒检测,sars-cov-2detectr相对于cdc qrt-pcr测定的阳性预测一致性(ppa)和阴性预测一致性(npa)分别为95%和100%。
[0819]
图121示出了临床样品的sars-cov-2detectr测定结果的热图,并显示了测试解释。通过imagej gel analyzer工具对24个临床样品(12个covid-19阳性)的sars-cov-2detectr定量横向流动sars-cov-2detectr测定结果(上图)显示98.6%(71/72条) 与荧光形式的测定结果(下图)一致。两种测定均以30分钟扩增运行,cas12反应信号在10分钟时获取。橙色( )表示表示假定阳性(下图,第4列)。
[0820]
图122示出了临床样品的sars-cov-2detectr测定结果的热图,并显示了测试解释。上图显示了对另外30个covid-19阳性临床样品(27个阳性,1个假定阳性,2个阴性)进行
荧光sars-cov-2 detectr测定的结果。橙色( )表示假定阳性(上图,第9列)。下图显示了对另外30个covid-19阴性临床样品(0个阳性,30个阴性)进行荧光sars-cov-2detectr测定的结果。
[0821]
相对于cdc qrt-pcr方案,sars-cov-2detectr测定对检测鼻拭子样品中的冠状病毒具有90%灵敏度和100%特异性,分别对应于100%和91.7%的阳性和阴性预测值。图108g示出了 sars-cov-2detectr测定的性能特征。fm表示飞摩尔;ntc表示无模板对照;ppv表示阳性预测值;npv表示阴性预测值。使用 sars-cov-2detectr测定的荧光版本评价了83个临床样品(41 个covid-19阳性,42个阴性)。由于测定质量对照失败,省略了一个样品(covid19-3)。阳性和阴性检测基于图107e中描述的标准。fm 表示飞摩尔;ntc表示无模板对照;ppa表示阳性预测一致性;npa 表示阴性预测一致性。
[0822]
对来自sars-cov-2、sars-cov、蝙蝠-sl-cov zc45和来自常见人冠状病毒的临床样品的ivt rna产物进行sars-cov-2 detectr测定(rt-lamp cas12a)评价。图113示出了用于确定 grna对不同人冠状病毒株的交叉反应性的detectr测定的结果。对含有sars-cov-2n-基因、sars-cov n-基因、蝙蝠-sl-covzc45n-基因、sars-cov-2e-基因、sars-cov e-基因、或蝙蝠
ꢀ‑
sl-covzc45 e-基因的体外转录的rna的样品,或对cov-hku1、 cov-299e、cov-oc43或cov-nl63呈阳性的临床样品进行测试。 hela总rna被测试作为rnase p的阳性对照,而缺乏靶核酸(“ntc”) 的样品被测试作为阴性对照。使用对应于seq id no:323的grna 检测n-基因。使用对应于seq id no:325的grna检测e-基因。使用对应于seq id no:330的grna检测rnase p。sars-cov-2 detectr测定仅在体外转录的sars-cov-2加标样品和 sars-cov-2感染患者的鼻拭子样品中呈阳性,表明detectr测定对sars-cov-2具有特异性。n-基因仅在sars-cov-2中检测到,而 e-基因仅在sars-cov-2和蝙蝠-sl-covzc45中检测到。未检测到 sars-cov e-基因,因为rt-lamp引物集不能扩增sars-cov e-基因,即使e-基因grna能够检测sars-cov e-基因靶位点。在常见人冠状病毒中检测到rnase p,因为这些样品是从临床样品中提取的 rna。在荧光酶标仪上lbcas12a(seq id no:27)检测测定信号的 15分钟时显示结果。图113示出了x轴上的靶标,从左至右依次是 sars-cov-2_n-基因、sars-cov n-基因、蝙蝠-sl-covzc45 n-基因、 sars-2e-基因、sars-cov e-基因、蝙蝠-sl-covzc45 e-基因、 cov-hkui、cov-299e、cov-oc43、cov-nl63、hela总rna和ntc。每个靶标组内有三个柱,从左至右显示不同的grna,包括n-基因、 e-基因和rnasep。y轴以任意单位(au)显示原始荧光,范围从0 至3000,增量为1000。
[0823]
图115a-图115b示出了关于covid-19感染患者样品的 detectr动力学曲线。使用两种不同的基因n2和e以及样品输入对照rnase p对来自5名患者(covid19-1至covid19-10)的10 个鼻拭子样品进行sars-cov-2检测。图115a示出了使用标准扩增和检测条件,10名患者中有9名产生了表明存在sars-cov-2e-基因的稳健荧光曲线(20分钟扩增,10分钟内发出信号)。图115b示出了sars-cov-2n-基因需要延长扩增时间才能使10名患者中有8名产生强荧光曲线(30分钟扩增,10分钟内发出信号)。图115c示出了作为样品输入对照,rnase p对于22个总测试样品中的17个呈阳性(20分钟扩增,10分钟内发出信号)。实施例50使用经修饰的lamp引物和grna改进rnase p pop7对照基因的检测
[0824]
本实施例描述了使用经修饰的lamp引物和grna改进rnasep pop7对照基因的检
测。使用rt-lamp和detectr反应对含有 rnase p pop7 rna的样品进行分析,以评估针对rnase p pop7的引物集和grna的扩增和检测效率。含有0.16ng/μl总rna或0ng/μl 总rna的样品通过rt-lamp用不同的引物集在60℃下扩增60分钟。图123示出了使用不同引物集对rnase p pop7进行rt-lamp扩增的时间。确定用引物集1-10扩增的样品的结果时间。引物集1对应于seq id no:360-seq id no:365,并且引物集9对应于seq id no: 366-seq id no:371。对于含有0.16ng/μl总rna的样品,引物集9 显示出比引物集1和引物集2-8和10更短的结果时间。此外,与引物集1和引物集2、3、7、8和10相比,引物集9对不含总rna(0 ng/μl总rna)的样品的非特异性扩增更少。
[0825]
对由rt-lamp产生的扩增子进行detectr反应。使用对应于r779(seq id no:330)、r780(seq id no:332)或r1965(seqid no:331)的grna检测样品。图124示出了对使用rt-lamp用引物集1或引物集9扩增并用r779、r780或r1965 grna检测的 rnase p pop7进行的detectr反应随时间的原始荧光。detectr 反应在37℃下进行90分钟。r779在无背景(虚线)的情况下检测到由引物集1产生的扩增子。r1965和r780在集9生成的扩增子上也见干净的检测。结果表明,r1965的检测速度比r779或r780快。图 124显示了detectr反应的两条线图。左图显示集1(原始),右图显示集9。每个图中均有三种crrna,包括r779、r780和r1965。实线表示0.16ng/ul的总rna,虚线表示0ng/ul。x轴以分钟为单位显示时间,范围从0至30,增量为10。y轴以0至60000的任意单位 (au)显示原始荧光,增量为20000。在左图中,r1965以最快的速度显示最高信号,其次是r779,r1965的总rna为0ng/ul。在右图中,r1965显示最高信号最快,其次是r780。
[0826]
然后,使用rt-lamp和引物集1(seq id no:360
–
seq id no: 365)或引物集9(seq id no:366
–
seq id no:371)测试检测限,并用r779 grna(seq id no:330)或r1965 grna(seq id no:331) 检测。图125a示出了在含有10倍稀释的总rna的样品中的rnase p pop7检测的结果时间,这些样品使用rt-lamp和引物集1或引物集9扩增。扩增在60℃下进行30分钟。图125b示出了图125a中所示的rnase p pop7扩增子的detectr反应,并使用grna 779(seqid no:330)或grna 1965(seq id no:331)检测。使用grna 779 检测使用引物集1扩增的样品,使用grna 1965检测使用引物集9 扩增的样品。detectr反应在37℃下进行90分钟。与引物集1相比,引物集9显示出检测限时间改善,如在低rna浓度下结果时间更快。此外,与使用引物集1扩增并使用grna 779检测的样品相比,使用grna 1965检测时,引物集9在detectr反应中显示出更高的速度和灵敏度。图125a示出了标题为rt-lamp rnase p pop7-lamp的柱状图。x轴表示浓度,从左至右分别为2ng/ul、0.2 ng/ul、0.02ng/ul、0.002ng/ul、0.0002ng/ul、0.00002ng/ul、0.000002 ng/ul和0ng/ul。y轴以分钟为单位显示时间,范围从0至30,增量为10。在x轴上的各组内,有两个柱表示使用的引物集,从左至右分别是集1(原始)和集9。图125b显示了标题为rnase p pop7引物集比较-detectr的线图。每个图上的x轴以分钟为单位显示时间,范围从0至30,增量为10。每个图上的y轴以任意单位(au)显示原始荧光,范围从0至50000,增量为10000。从左至右的图显示2ng/ul、 0.2ng/ul、0.02ng/ul、0.002ng/ul和0ng/ul的降低浓度。每个图中有两条线,它们是不同的crrna,包括r779和r1965。在最左边的图中,虽然两个crrna最终达到相同的原始荧光值,但r1965线更快地达到最大荧光。在左起第二个图中,虽然两个crrna最终达到相同的原始荧光值,但r1965线更快地达到最大荧光。在左起第三个图中,虽然两个crrna最终达到相同的原始
荧光值,但r1965线更快地达到最大荧光。在左起第四个图中,r1965线最快达到最高最大荧光。实施例51用于冠状病毒裂解和扩增的病毒裂解缓冲液
[0827]
本实施例描述了用于冠状病毒裂解和扩增的病毒裂解缓冲液。鼻拭子或唾液样品采集自疑似冠状病毒感染个体。将鼻拭子和唾液样品悬浮于病毒裂解缓冲液中,该缓冲液被配制用于裂解病毒衣壳并释放病毒基因组。病毒裂解缓冲液与病毒基因组的rt-lamp扩增和靶核酸的detectr检测相容,为冠状病毒detectr反应提供了一步样品制备解决方案。实施例52在微流体盒上使用detectr测定检测snp
[0828]
本实施例描述了在微流体盒上使用detectr测定检测snp。该测定在图126b中所示的微流体盒上进行。打开配置为加热盒的盒歧管。将来自蓝眼个体的5μl样品与45μl含有用于样品lamp扩增的组分的lamp主混合溶液混合。样品在加入盒之前进行预混合。将预混合的样品装载至扩增腔室的盒中,并用透明胶带密封该腔室。将95μl蓝眼rnp(g snp)装载至detectr腔室中。将装载的芯片转移到预热的歧管上并用透明胶带密封。
[0829]
歧管的第一加热器设置为60℃,第二加热器设置为37℃。将样品在60℃下温育30分钟。30分钟后,启动歧管中的第一泵以将lamp 缓冲液和样品一起泵送通过盒。启动歧管中的第二泵以将95μl detector溶液推入检测腔室。将样品在37℃下温育30分钟。使用黑盒荧光检测器观察荧光。
[0830]
使用加热块在微量离心管中进行对照测定。在第一试管中,将来自蓝眼个体的5μl样品与45μl lamp主混合溶液混合。在第二试管中,将来自棕色眼个体的5μl样品与45μl lamp主混合溶液混合。样品在小型干浴中在60℃下温育30分钟。将每个扩增样品5μl 转移至95μl的1x rnp溶液中,用于检测a和g snp。将反应转移至37℃加热块。实施例53微流体盒中snp的扩增和检测
[0831]
本实施例描述了微流体盒中snp的扩增和检测。这些测定在图 128b所示的微流体盒中进行。制备以下溶液:lamp主混合物(1x isoamp缓冲液(neb)、4.5mm mgso4、1.4mm dntp、1:5bst 2.0 (neb)、1x引物主混合物和1:10靶dna)和crispr复合体(1x mbuffer3、40nm crrna和40nm cas12变体(seq id no:37);在37℃温育后加入1μm报道分子底物)。
[0832]
通过在rnase zap中浸泡20分钟来清洁盒的pmma层,并通过在无核酸酶的水中洗涤两次来洗涤清洁溶液的残余物。使用氮气流干燥盒。组装盒的层。crispr反应工作流程的上半部分用高溶胶环氧树脂封闭并干燥20分钟直至澄清。将80μl lamp主混合物与10 μl引物混合物和10μl纯dna提取物在微量离心管中预混合。通过上下移液混合溶液。使用移液器将70μl该溶液装载至试剂盒的扩增腔室。使用一小块矩形pcr粘合剂(biorad,msb-1001)密封腔室。
[0833]
将盒放入加热歧管中,并将铝块加热至60℃芯片上温度。将样品在60℃下温育30分钟以使用lamp扩增样品。将100μl含有蓝眼grna的crispr试剂加入detectr下腔室中。顶部和底部腔室用小矩形pcr粘合剂密封。通过启动盒中的阀,将crispr试剂与5 μl扩增样品混合。歧管上覆盖3d打印的aps护罩以阻挡光线。将铝块加热至37℃芯片上温度。将crispr
反应在37℃下温育30分钟。肉眼观察产生的荧光。
[0834]
使用图128c中所示的盒,如上所述重复测定,除了上半部没有用环氧树脂密封。在这两种测定中,对应于阳性结果的荧光是肉眼可观察到的。从盒顶部对歧管中的盒进行照明导致检测腔室照明不均匀。实施例54修改后的微流体盒中snp的扩增和检测
[0835]
本实施例描述了修改后的微流体盒中snp的扩增和检测。该测定在图129a中所示的微流体盒上进行。如实施例53中所述制备 lamp主混合物和crispr复合体溶液。通过在rnase zap中浸泡 20分钟来清洁盒的pmma层,并通过在无核酸酶水中洗涤两次来洗涤清洁溶液的残余物。使用氮气流干燥盒。组装盒的层。
[0836]
将40μl lamp主混合物与5μl引物混合物和5μl纯dna提取物在微量离心管中预混合。通过上下移液混合溶液。使用移液器将 50μl该溶液装载至试剂盒的扩增腔室。使用一小块矩形pcr粘合剂 (biorad,msb-1001)密封腔室。将95μl含有cas12变体(seq id no: 37)和针对棕眼snp的grna的crispr试剂溶液加入detectr 下腔室中,并将95μl阴性试剂溶液(5x mbuffer3)加入上检测腔室。使用一小块矩形pcr粘合剂(biorad,msb-1001)密封腔室。
[0837]
在加热歧管上组装盒,并且铝块在扩增腔室中被加热至60℃芯片上温度。在开始测定前2分钟开始加热。扩增在60℃下进行30分钟。启动盒的阀以将crispr试剂与5μl的扩增样品混合。检测腔室的歧管加热器在没有预热的情况下被加热至37℃。detectr反应在37℃下进行30分钟,并且肉眼观察产生的荧光。通过使用来自minipcr试剂盒的led或来自thorlabs的led照明对腔室进行成像。
[0838]
在具有以下改进的相同设计的新盒上重复测定:crispr试剂未预装载至装置中,因为加热器先前运行后仍有温度,并且扩增和检测步骤运行15分钟而不是30分钟。
[0839]
在图129b所示的微流体盒上进行第三次测定。扩增腔室装载 50μl无核酸酶水,并用一小块pcr粘合剂密封该室。将50μl的1μm atto-488染料和45μl的无核酸酶水装载至crispr下腔室,并将 95μl的无核酸酶水装载至crispr上腔室。两个腔室均用一小块pcr 粘合剂密封。如图137b所示,将盒组装在加热歧管上。样品在扩增腔室中温育10秒。第一泵运行3秒以将5μl的流体从扩增腔室驱出并进入crispr腔室(也称为检测腔室)。第二泵运行5秒以驱动检测试剂进入crisper腔室。样品在crispr腔室中温育10秒,然后用led照明。使用以下参数重复测定:在扩增腔室中温育30分钟,泵1运行1秒,泵2运行20秒,然后在crispr室中温育15分钟,然后用led照明。较长泵送时间提高了腔室之间的流体转移。实施例55微流体装置用于detectr反应的用途
[0840]
本实施例描述了微流体装置用于detectr反应的用途。图 126a、图126b、图127a、图127b、图128a、图128b、图128c、图128d、图129a、图129b、图129c或图129d中的任一个中所示的微流体盒装载有扩增试剂和detectr试剂。将50μl扩增试剂加入扩增腔室,并将95μl detectr试剂加入detectr腔室。盒的孔密封。图136a、图136b、图137b、图137c或图138a-b中的任一个所示的盒被装载至加热歧管中。盒以特定取向插入。拧紧螺钉以将盒固定到位。开口用切割成一定尺寸的透明qpcr胶带密封,形成气密密封。将热电偶插入扩增腔室以记录
温度。图130a中所示的螺线管通电以关闭阀。指示led灯亮。打开设置为60℃和37℃的两个加热器。样品在扩增腔室中在60℃下温育30分钟。螺线管断电以打开阀。泵1启动15秒以使流体从扩增腔室流至detectr反应腔室。 15秒后,泵2启动15秒以使流体从detectr试剂容器移至 detectr反应腔室。样品在detectr反应腔室中在37℃下温育30 分钟。指示灯熄灭。打开led并通过图像、视觉评估或光电二极管检测来测量荧光。
[0841]
在30分钟60℃lamp温育结束时,打开电磁阀,并且蠕动泵 #1以100%pwm接合10秒。lamp缓冲液通过阀泵送至通向 detectr反应腔室的蛇形通道和通向detectr试剂容器的直通道的交叉点。通向detectr反应腔室的蛇形通道比通向detectr试剂容器的通道具有更大的横截面积。这是为了减少蛇形通道中的流体阻力,并将所有缓冲液引向detectr反应腔室。然而,在整个研究过程中(测试23 个芯片),缓冲液几乎每次均双路分流,其中约一半的缓冲液体积流路出错。在下一个流体步骤中,关闭电磁阀,并将 detectr试剂泵入detectr反应腔室,沿途收集lamp产物。这提供了一些混合,因为两个缓冲液同时通过蛇形通道,但这个过程也产生气泡,这些气泡可被带到检测腔室。
[0842]
为防止气泡在detectr期间干扰荧光测量,将比反应腔室可以容纳的更大体积的缓冲液装载至容器中,并使用比必要时间更长的泵送时间。这可确保腔室完全充满试剂并且所有气泡均已爆破。 detectr反应腔室的体积为70μl,每个反应腔室中分别输送25μl lamp和95μl detectr试剂。第二流体步骤(detectr试剂至 detectr反应腔室)需要约20-30秒来输送所有缓冲液,但此步骤运行45秒。这导致detectr反应腔室完全充满,多余的试剂留在蛇形通道中。除气泡外,如果detectr反应腔室未完全充满,在37℃温育期间,反应腔室顶部形成冷凝水,这也干扰从上方进行的荧光测量。实施例56用于detectr反应的微流体装置的热测试
[0843]
本实施例描述了用于检测反应的微流体装置的热测试。加热歧管的热性能通过测量温度的时间和加热至设定点的准确度来测试,热电偶浸没在缓冲液中。在标准测定温度设定点(60℃lamp/37℃ detectr)下,lamp缓冲液在8.5分钟内加热至60℃,但detectr 缓冲液在约21分钟时达到34℃的最高温度。这有点违反直觉,因为达到较低温度需要更长的时间(并且detectr缓冲液未达到设定点温度)。为了达到特定温度,加热器控制器改变它在开启状态下花费的时间。这种状态切换由脉冲宽度调制(pwm)值定量,即它在开启状态中花费的给定时间单位的百分比。加热器控制器还对加热器的温度进行采样,以反馈当前温度与设定点温度之间的差异。这两个值之间的差异越大,得到的pwm值就越高。随着加热器温度接近设定点,pwm值下降以减缓变化率并避免超过设定点温度。室温加热器与lamp设定点之间的差异为约35℃,而detectr加热器与其设定点之间的差异为约12℃。lamp温育器以20%左右的最大pwm值加热,而detectr温育器以12%左右的最大pwm值加热。我们当前的设置在设计时更加强调准确度,并且不超过设定点温度,而不是快速加热缓冲液至测定温度。
[0844]
特定的pwm值可用于更快地加热至我们的设定温度。然而,这是手动过程,可能导致超出目标温度并损坏歧管原型和熔化微流体芯片。将lamp加热器pwm值设置为100%时,lamp缓冲液(由热电偶测量)在90秒内加热至60℃,但加热器温度达到100℃。将 detectr加热器pwm设置为100%,detectr缓冲液在60秒内加热至37℃,加热器达到80℃。当detectr缓冲液达到37℃时关闭加热器导致最高缓冲液温度为约60℃。在60℃lamp温育30分钟期间,
芯片detectr侧的温度升高,使其高于室温。它不时变化,但通常在detectr侧开始时在25-29℃之间。
[0845]
图139a、图139b、图140a和图140b示出了加热至60℃的扩增腔室(图139a和图140a)或加热至37℃的detectr腔室(图 139b和图140b)的热测试总结。图140a示出了标题为bobv2 lamp 温度vs时间(61℃设定点)的关系图。x轴以秒为单位显示从0至 1800的时间,增量为200。y轴以℃显示温度,范围从20至65,增量为5。该图包括代表加热器和缓冲液的两条线。虽然加热器和缓冲液线最终均达到相同的温度,但加热器线更快达到最高温度。图140b 示出了标题为bobv2 lamp温度vs时间(40℃设定点)的图表。x 轴以秒为单位显示从0至1800的时间,增量为200。y轴显示以℃为单位的温度,范围从25至43,增量为2。该图包括代表加热器和缓冲液的两条线。加热器线更快达到更高温度。实施例57使用微流体盒检测herc2 snp
[0846]
本实施例描述了使用微流体盒检测herc2 snp。制备在无核酸酶水中含有2μm f3引物、2μm b3引物、16μm fip引物、16μm bip 引物、8μm lf引物和8μm lb引物的引物混合物。制备包含1x mbuffer3、40nm crrna和50nm cas12变体(seq id no:37)的复合反应。在37℃下温育30分钟后加入40nm报道分子底物。制备含有1x isoamp缓冲液、4.5mm mgso4、dntp和1x引物混合物的 lamp混合物。将detectr试剂装载至微流体盒,并用pcr胶带密封孔。lamp混合物与引物混合并装载至盒。chip shop罐的窄端用封口膜覆盖并插入lamp反应腔室上方的鲁尔接头。chip shop罐装载有200μl的20mm naoh。将盒插入加热歧管并拧紧螺钉。将口腔拭子加入罐中,轻轻搅拌,并温育2分钟。使用drummond微量移液器通过封口膜将10μl裂解样品输送至lamp反应腔室中。移除罐并用切割成尺寸的qpcr胶带密封腔室。
[0847]
图141a示出了在读板器上以100的增益运行的detectr结果,使用来自微流体盒的lamp产品作为输入。使用单个非模板对照 (ntc)重复运行样品。将19μl detectr主混合物(与装置上使用的混合物相同)移液至384孔板的孔中,并加入1μl lamp扩增子。一个样品不慎加入了10μl的扩增子;该样品由“10μl靶标”表示。由于供体对于a-snp是纯合的,因此预期指导r570比r571更快产生信号。在两个样品之间观察到轻微差异。图141a示出了线图,其中x轴显示以分钟为单位的时间,范围从0至30,增量为10,y 轴以任意单位(au)显示原始荧光,范围从0至60000,增量为20000。底部两条平坦的线是r570 ntc和r571 ntc。快速实现高信号的线从左至右依次为r570 10ul、r 570 1ul和r571 1ul。
[0848]
图141b示出了使用来自微流体芯片的样品在读板器上运行的三种lamp产物。lamp反应按照芯片运行的顺序编号(lamp_1 首先运行,等等)。供体对于snp a是纯合的,因此crrna 570首先出现。atto 488用作荧光标准品。这些测量在读板器上进行,增益为60。三个lamp反应的结果聚集在一起,这表明微流体盒和加热歧管上的扩增具有良好的运行间重复性。每个lamp反应使用每种 crrna重复运行三次,生成图中可见的误差范围。图141b示出了线图,其中x轴以分钟为单位显示时间,范围从0至30,增量为10,y 轴以任意单位(au)显示原始荧光,范围从0至8000,增量为2000。图底部附近的平线是10nm atto488 none和ntc。6000au附近的平虚线是100nm atto488无。快速达到高信号的线从左至右大致包括lamp_1r570和lamp_3r570、lamp_2r570、lamp_3r571、 lamp_1r571和lamp_2r571。
[0849]
进行另一测定。如上所述制备溶液,并且样品在图129a中所示的微流体盒上运行,
其中在扩增腔室顶部添加鲁尔连接器。如上所述制备口腔拭子样品。装载盒,并使用以下设置运行测定:30分钟扩增,10秒泵1,40秒泵2,30分钟detectr。在读板器上测量样品。图142a是测定后微流体盒的图像。与左侧孔的绿色外观相比,右侧孔的蓝色外观可能是由于右侧孔中的气泡扩散输入的蓝光。图142b 示出了lamp扩增30分钟后在读板器上测量的detectr反应结果。一个反应腔室中的气泡干扰了来自ese记录的信号,所以定量测量不应被信任。然而,10分钟和20分钟的时间点具有相似的信号。此外,当led在detectr 30分钟后打开时,两个孔在视觉上看起来均很亮。读板器上的detectr结果显示,30分钟后,两个snp的信号均很高。图142b示出了从左至右标题为r570、r571和无的线图。每张图上的x轴以秒为单位显示时间,范围从0至80,增量为20,每张图上的y轴以任意单位(au)显示原始荧光,范围从0至60000,增量为20000。在最左边的图中,ntc线底部平坦,而提取的dna 线快速达到高荧光信号。在中图中,ntc线底部平坦,而提取的dna 线快速达到高荧光信号。在右图中,10nm atto线在底部平坦,10nmatto线在靠近中间平坦,100nm atto线在顶部平坦。实施例58使用微流体盒检测冠状病毒
[0850]
本实施例描述了使用微流体盒检测冠状病毒。制备含有1x mbuffer3、40nm crrna和50nm cas12变体(seq id no:37)的复合反应。在37℃下温育30分钟后加入40nm报道分子底物。将95 μl detectr试剂装载至每个detectr试剂孔并用qpcr胶带密封。将一管n基因lamp主混合物(537μl)与32μl的100mm mgso4混合,并将40μl的混合物装载至盒。将10μl的twist sars-cov-2 标准品以不同的拷贝数/μl或作为阴性对照的1
×
te加入lamp反应腔室。将盒插入歧管并拧紧。lamp反应腔室用qpcr胶带密封。设定温度(62℃lamp,40℃detectr(考虑热偏移))并启动自动化工作流程。3d打印的光学盖被放置在盒上,以最大限度地减少光学噪音。detectr测量在0min、2min、5min、10min、20min和 30min进行。改变lamp反应中rna的拷贝数以估计装置中的检测下限。
[0851]
图143a、图143b、图143c和图143d示出了冠状病毒 detectr反应的结果。具有输入至lamp的10个拷贝的两个反应腔室产生快速增加的detectr信号。所有ntc均为阴性。将10个拷贝输入至lamp时,detectr信号在反应过程中逐渐增加,如下图143c中的光电二极管测量所示。图143d中的阴性对照表明无污染。
[0852]
重复测定。图144a、图144b、图144c和图144d示出了重复冠状病毒detectr反应的结果。实施例59微流体盒中乙型流感detectr测定的周转时间
[0853]
本实施例描述了微流体盒中乙型流感病毒detectr测定的周转时间。制备在无核酸酶水中含有2μm f3引物、2μm b3引物、16 μm fip引物、16μm bip引物、8μm lf引物和8μm lb引物的引物混合物。制备含有1x mbuffer3、40nm crrna和50nm cas12变体 (seq id no:37)的复合反应。在37℃下温育30分钟后加入40nm 报道分子底物。将95μl detectr试剂装入每个detectr试剂孔并用qpcr胶带密封。将40μl的lamp混合物加入盒中。将2μl 的1pm ibv靶标加入198μl病毒裂解缓冲液中,并装载至chip shop 罐。使用drummond微量移液器通过封口膜将10μl裂解样品输送至 lamp反应腔室中。移除罐并密封腔室。
[0854]
图145a、图145b、图146a、图146b和图146c示出了微流体盒中乙型流感病毒
detectr反应的光电二极管测量结果。10分钟的扩增时间导致背景信号增加(这也可以通过肉眼观察到)。5分钟的扩增时间未导致信号明显增加。图145a示出了标题为聚合的 detectr信号的线图:歧管上的ibv lamprey时间点测试。x轴以分钟为单位显示时间,范围从0至25,增量为5。y轴显示范围从0 至0.5的原始荧光,增量为0.1。靠近中间的3条线是15min lamp、 5min lamp和ntc,3条线的最上线是15min lamp。图中最上线是 10min lamp。图145b示出了标题为detectr信号的线图:15minibv lamp。x轴以分钟为单位显示时间,范围从0至30,增量为10。 y轴显示范围从0至0.5的原始荧光,增量为0.1。靠近中间的两条线是通道1和通道2,通道1的线更高。实施例60使用储存在玻璃毛细管中的试剂的detectr测定
[0855]
本实施例描述了玻璃毛细管在detectr反应中的用途。玻璃毛细管可以通过被动毛细作用实现流体流动,从而消除对动力驱动流动的需要(例如,使用机械泵)。玻璃毛细管还能够长期、稳定地储存试剂。
[0856]
detectr反应所需的试剂以干燥形式在毛细管内部提供。使毛细管水合可溶解试剂,并允许它们从毛细管洗脱到收集器隔室或容器中。crispr-cas复合体可以以这种方式储存和回收而不失去活性。
[0857]
detectr试剂混合物通过在5x mbuffer2(20mm tris hcl (ph8),100mm nacl,5mm mgcl2,1mm dtt,5%甘油,50ug/ml 肝素)中预复合seq id no:374的指导核酸与5μm的具有seq idno:37的可编程核酸酶进行制备。容量为20μl的23.5mm毛细管装载有0.5μl试剂混合物液滴,然后在室温下干燥过夜。212天后,用含有0μm或0.170μm带有荧光报道基因的ssdna底物,以及0μm、 0.1μm或1μm靶核酸的5x mbuffer2的20μl等分样品对毛细血管进行再水化。指导核酸、ssdna底物和靶核酸的序列在下表24中提供。在室温再水化2分钟后,将每个毛细管的内容物排出至384孔板上的单独孔中。将孔在37℃下温育90分钟,在此期间监测每个孔的荧光读数。表24
[0858]
detectr实验的结果如图147中所示。对于0.17μm报道核酸以及0.1μm和1.0μm靶核酸的反应,检测到荧光增加。结果表明,预复合的指导核酸-可编程核酸酶复合体在风干和长期储存后仍保持催化活性。再水化是迅速的,使毛细管内干燥或冻干成为理想的储存方法。实施例61用于顺序扩增和crispr反应的离心柱
[0859]
本实施例描述了设计用于混合用于核酸扩增反应和crispr反应的试剂的装置。扩增反应和crispr反应通常需要单独的缓冲液和条件。因此,对单个样品进行顺序扩增和crispr反应可能需要将样品暴露于周围环境。本实施例描述了多隔室离心柱,其可以使样品移动通过包含不同试剂的单独隔室,同时保持密封以减少污染。
[0860]
离心柱可以具有图148小图a中所示的结构。该离心柱具有可装载crispr试剂的顶部隔室101和可装载等温扩增试剂的底部隔室 102。单个盖103能够将两个隔室与外部环境
密封。顶部隔室通过例如膜或过滤器的弱渗透材料104与底部隔室隔离。顶部隔室内的向下的力或压力可用于使试剂移动通过弱渗透材料并进入底部隔室。这可以通过碱将离心柱离心、将盖压缩或选择性地加热顶部隔室来实现。顶部隔室可以从底部隔室移除。例如,顶部隔室可以是安装在底部隔室内的管。
[0861]
离心柱可用于图148所示的方法中。如小图a所示,顶部隔室装载crispr试剂,并且底部隔室可以装载扩增试剂和样品。通过关闭离心柱顶部的盖,两个隔室均与外部环境隔离。然后可以对样品进行扩增反应,如小图b所示。在此阶段,离心柱可以在适合扩增反应的温度(例如,37至65℃)下温育。接下来,如小图c所示,通过离心将crispr试剂从顶部隔室通过弱渗透材料吸入底部隔室。在小图d中,然后可以在适合crispr反应的第二温度下温育离心柱。任选地,可以通过透明的离心柱材料从样品中检测信号(小图e,例如,如果crispr反应产生荧光信号)。实施例62用于detectr反应的电化学可检测报道分子
[0862]
本实施例描述了用于detectr反应的电化学可检测报道分子。报道分子是含有经修饰的胸腺嘧啶核碱基的ssdna,这些碱基与通过磷酸二酯键缀合至5’末端的二茂铁部分和荧光部分(例如,荧光素) 缀合。报道分子可以在3’末端被生物素化。两个ssdna报道分子的序列是5
’‑
yxxttattxx-3’和5
’‑
yxxttattattxxz-3’,其中x 是二茂铁标记的胸苷(图149小图a),y是6-羧基荧光素(图149 小图b),以及z是3’生物素部分(图149小图c)。
[0863]
在detectr反应中,报道分子可以经历从可编程核酸酶(例如,具有seq id no:37序列的cas12变体)的反式附带切割。报道分子切割动员电化学可检测的含二茂铁的ssdna亚基。二茂铁具有相对较高的氧化电位,因此可以在低氧化电位生物分子的背景下进行电位检测。电化学信号的幅度随报道分子的切割而增加。相反,来自报道分子的荧光信号强度不受反式附带切割程度的影响。因此,荧光读数可用于通过定量存在的报道分子的总浓度来校准电化学测量,并且电化学和荧光测量的组合可用于确定已被切割的报道分子的分数。生物素用作报道分子或报道分子片段的捕获部分(例如,含链霉亲和素)。
[0864]
使用5
’‑
yxxttattxx-3’报道寡核苷酸、靶向herc2的可编程核酸酶和herc2靶核酸进行测定。使用dropsensμstat ecl仪器和dropsens丝网印刷碳电极进行检测。在开始后的多个时间点采集detectr反应的等分样品。
[0865]
图176示出了用方波伏安法测量的detectr反应的结果。该反应使用50fm靶核酸和2.4μm报道核酸。如图176所示,在 detectr反应开始后33分钟采集的样品的氧化(小图a)和还原(小图b)曲线的信号强度大于detectr反应开始后立即采集的样品。误差条表示同一溶液的两次测量的标准偏差,每次测量使用三个迹线。
[0866]
图177示出了用循环伏安法测量的detectr反应的结果。反应使用24μm报道核酸和500pm靶核酸。如图177所示,信号在 detectr反应的0分钟和26分钟时间点之间增加。图177中所示的每条迹线是相同溶液的三次扫描的平均值。误差线代表标准偏差。实施例63用于自动化顺序扩增和crispr反应的装置
[0867]
本实施例描述了能够对样品进行多重扩增和crispr反应的装置。该装置能够分割样品以对单个输入样品的不同等分样品进行多个不同的扩增和crispr反应序列。该装置装
有微流体芯片,该芯片包含多个隔室,用于储存试剂和反应样品。该装置被配置成检测由 crispr反应产生的信号(例如,光信号),从而促进来自单个样品输入的多个测量。该装置的可能应用是进行单独的一系列扩增和 crispr反应,以测定单个生物样品中的大量病毒。
[0868]
微流体芯片的示意图如图150中所示。在插入装置后,生物样品将被运送至第一隔室(v1),根据样品的类型以及待进行的测定的数量和类型,样品可以与各种溶液(例如裂解缓冲液)组合。在一些测定中,v1将在装载前预装载稀释缓冲液。该装置可以(例如,经由泵)将受控量的样品(例如,5μl)从第一隔室移动至第二隔室(v2),其中它可以与来自p1的扩增试剂混合。该装置控制v2的温度以促进扩增反应。该装置将部分扩增产物从v2运送至v3或v4,其中样品与用于crispr反应的试剂混合。来自v3和v4的样品可以被运送至废物隔室(分别为v5和v6)。
[0869]
图151中提供了该装置的描述。该装置被配置成将微流体芯片 101保持在样品入口端口102下方。入口端口包含可以将样品推入微流体芯片104中的第一隔室的突出物103(例如,气动针)。微流体芯片可以被移除和更换,并且保持在调节微流体芯片中的隔室内的温度的温度控制元件105上。该装置包含被配置为测量来自多个微流体芯片隔室的吸光度和荧光的二极管阵列106。该装置使用电池107作为电源。实施例64使用双扩增病毒裂解缓冲液系统的流感detectr反应
[0870]
本实施例描述了用于检测流感病毒核酸的测定。该测定组合了环境温度rt-lamp扩增和指导核酸驱动的可编程核酸酶检测。 lamp方案通常需要严格的操作温度,这对于在执行多种类型反应的装置中实施是不可行的。例如,一些扩增反应所需的高温可能破坏 crispr反应的试剂。本实施例公开了可在一定温度范围(包括环境温度,其更适合在装置内实现)内操作的用于lamp扩增的激活剂。本实施例还提供了包含lamp激活剂的病毒裂解缓冲液,在输入样品 (例如含有与流感相关的核酸的拭子)时实现同时裂解和扩增。
[0871]
测试了多种潜在的lamp激活剂的lamp激活能力和病毒裂解缓冲液相容性。lamp激活能力通过在没有单一lamp激活剂的情况下进行双重lamp-detectr测定来评估。在这些测定中,lamp使用缓冲剂、激活剂、dntp和引物中的四分之三进行。用seq id no: 37和下表25中提供的指导核酸(靶向herc2)对口腔拭子样品进行 detectr反应。在90分钟内通过荧光监测detectr反应。使用 lamp扩增过程中存在的所有四种试剂进行单独的对照测定。如图 152所示,lamp反应因四种试剂中任何一种的缺失而受到抑制。不同的提取条件显示在两列中。左列显示粗裂解,右列显示标准商业提取方法。表25
[0872]
图153示出了靶向流感核酸的双重lamp-detectr测定的结果。第一列和第三列的小图显示了缺少激活剂的lamp反应的阴性结果。使用靶向对应于seq id no:378的靶序列 (agcagaagcagaggatttgtttagtcactggcaaacaggaaa aaaaaatggcggacaacaacatgaccacaacacaaattgaggt gggtccgggagcaaccaatgccaccataaactttgaagcagga attctggagtgctatgaaaggctttcatggcaaagggcccttga ctaccctggtcaagaccgcctaaacagactaaagagaaaatta gagtcaagaataaagactcacaacaaaagtgagcctgaaagta aaaggatgtctcttgaagagagaaaagcaattggagtaaaaat gatgaaagtactcctatttatgaatccgtctgctggaattgaag ggtttgagccatact)的对应于seq id no:377的grna (uaauuucuacuaaguguagauagcugcucgaauuggcuuu g r1463)检测样品。第二列和第四列的小图显示了在存在激活剂的情况下在缓冲液(第二列的小图)和病毒裂解缓冲液(第四列的小图) 中进行的lamp反应的结果。实施例65用于平行扩增和crispr反应的多腔室注塑成型盒
[0873]
本实施例描述了能够对一个输入样品进行多次扩增和 detectr反应的完全集成的装置。该装置包含用于插入样品的入口、包含用于扩增和检测反应的试剂的注塑成型盒、用于为多个反应分配样品的流体系统、用于detectr反应的检测组件以及用于处理反应的硬件。将样品插入入口将样品密封在装置内,防止样品和周围环境受到污染。
[0874]
图154小图(a)示出了注塑成型盒。注塑成型盒包含用于插入样品的入口端口101。入口的底部窄,允许拭子在插入时卡入并密封到位。入口端口的顶部附接至盖102,其被配置成气密地密封入口端口。注塑成型盒包含样品和试剂可以流过的流体通道103(例如,微流体通道),包括分配具有限定体积的样品部分的计量通道103a。通道通过可容纳泵(例如,蠕动泵、液压泵、连接至气动泵歧管的端口等)以及引导和计量流体流动的可切换阀104的位置相互连接。一些通道包含或终止于用于反应的隔室105。盒包含与端口107耦合的试剂储存隔室106阵列,用于将试剂输送通过流体通道和反应隔室。注塑成型盒由两个器件108和109构成,它们连接至储存在盒内的气密密封试剂。注塑成型盒腔室还包括激光粘合的密封层。
[0875]
图154小图(b)示出了能够容纳注塑成型盒的装置。该装置包含顶部110和底部111平台,其被设计为将注塑成型盒牢固地固定到位。该装置包含控制注塑成型盒内的液压系统的泵阵列和可切换阀112,以及调节注塑成型盒内的温度的加热元件113。容纳在该装置内的荧光计114能够测量来自注塑成型盒中的检测腔室的荧光。计算装置115控制装置内的
荧光计、电机和加热元件。
[0876]
图155示出了利用使用户输入最小化的装置的测定方法。该方法包括需要用户输入的芯片外制备步骤和由装置控制的芯片上自动化过程。注塑成型盒包含多个试剂隔室。在用于测定之前,隔室需要填充裂解缓冲液、扩增试剂和detectr试剂,包括基于荧光的报道分子、可编程核酸酶和指导核酸。注塑成型盒具有多个隔室,能够储存多组不同的扩增和detectr试剂(例如,具有不同靶序列的扩增和检测试剂)。在装载之前,可编程核酸酶和指导核酸需要在37℃下温育30分钟。一旦已装载试剂,就可以将注塑成型盒密封,然后将其装载至装置中。注塑成型盒可以重新装载,或者可以预先装载试剂。在这种情况下,该装置可以在执行detectr反应之前混合和预热指导核酸和可编程核酸酶。
[0877]
注塑成型盒包含用于样品插入的入口端口。一旦注塑成型盒已准备好试剂并密封,就可以在拭子上采集样品并将其插入入口端口。入口端口被配置成使得拭子可以在入口端口内的断裂点处被折断以将样品固定在注塑成型盒内。一旦样品被固定在注塑成型盒中,入口端口就可以用密封盖密封。
[0878]
密封的注塑成型盒(装载试剂和样品)可以插入装置中,使样品制备和分析自动化。该装置首先将样品与200μl裂解缓冲液一起温育2分钟。该装置将20μl等分样品计量加入80μl或180μl lamp 主混合物中,用于在60℃下等温扩增10-60分钟。将所得扩增子的 10μl等分样品计量加入含有detectr试剂的90μl或190μl溶液中,并在37℃下温育,同时在470nm和520nm处进行实时激发和检测。该设备收集这些数据(例如,作为无线电信号)并将其传输到计算设备进行分析。该装置可以针对单个样品上的不同核酸序列执行和检测大量顺序和平行的扩增和检测反应。
[0879]
图156示出了该装置的光学组件。图156小图(a)示出了二极管116的阵列,其可以产生470nm的光并检测520nm或594nm的光以分别激发和检测报道分子。图156小图(b)示出了琥珀色和蓝色led照亮的二极管阵列。图156小图(c)示出了由二极管阵列照明的注塑成型盒。
[0880]
图157示出了注塑成型盒的可能设计。注塑成型盒包含用于采集样品然后将样品与高达400μl的缓冲液混合的样品腔室117。样品腔室包含泵,并通过旋转阀与一系列流体通道118(例如,微流体通道)连接,这些通道将样品分成多个扩增腔室119。样品腔室出口处的旋转阀内的计量阀每次旋转将20μl等分样品从样品腔室分配到流体通道中。扩增腔室耦合到扩增试剂腔室(其包含用于扩增反应的试剂)120通过阻力通道118b,其各自配置有泵和阀,用于控制储存的试剂流入扩增腔室。每个扩增腔室的后端连接至阀,该阀计量通过第二系列流体通道121进入一系列检测腔室122的流量。检测腔室耦合至检测试剂腔室(其储存用于检测反应的试剂)123通过阻力通道 118b,其各自配置有泵和阀,用于控制储存的试剂流入检测腔室。该注塑成型盒包含一个样品腔室、5个扩增腔室和10个检测腔室。实施例66用于对单个样品进行多重扩增和detectr反应的注塑成型盒设计
[0881]
本实施例提供了能够分隔样品以进行单独的扩增和检测反应的注塑成型盒的设计。注塑成型盒被设计用于从拭子(例如口腔拭子) 中采集样品。不同扩增和detectr反应的组合实现待测定样品的多个序列。例如,8detectr反应可用于查询8个单独的病毒或7个病毒和内部对照。注塑成型盒被设计用于安装自动样品和试剂移动、加热和检测的装置。
中的注塑成型盒的不同之处在于它的样品入口端口,该样品入口端口缺少用于固定拭子的易破密封和突出物。
[0888]
图164小图a示出了注塑成型盒设计的底视图。这种设计具有宽且平坦的试剂腔室(例如,扩增试剂腔室),通过将流体泵入和泵出试剂腔室来实现快速加热和快速流体混合,而不是顺序地将不同的溶液流入单个室。矮盒高度允许加热器环绕反应腔室。连接相同类型的腔室以在用于混合时提供相等的流体阻力的通道155的长度。从盒的底部可以看到滑动阀156的底部、扩增试剂腔室157和检测腔室158。小图b显示了注塑成型芯片的俯视图。顶部159和底部160塑料壳体器件在注塑成型芯片周围形成气密密封。塑料壳体器件上的互锁夹子 161便于组装成单个单元。一系列o形环顶部端口162允许注塑成型盒连接至可以控制整个注塑成型盒的流动的气动泵歧管。样品入口端口163包含由易破密封件164塞住的顶部室。实施例67能够对单个样品进行平行扩增和crispr反应的注塑成型盒
[0889]
本实施例描述了被设计用于对单个样品进行多次扩增和 crispr反应的注塑成型盒。该试剂盒有4个扩增腔室和8个检测腔室。单个样品将首先在样品腔室中稀释,然后在四个扩增腔室之间分配。来自每个扩增腔室的扩增产物将被分隔到两个单独的检测腔室。每个扩增腔室都是透明的,以允许对crispr(例如,detectr)反应进行光学(例如,荧光)监测。每个扩增和检测腔室均连接至独特的试剂储存腔室(例如,扩增试剂腔室)。一些腔室可以装载相同的试剂,或者每个腔室可以装载不同的试剂(例如,针对不同序列的扩增试剂和detectr试剂)。因此,注塑成型盒能够对单个输入样品执行多达8个独特的扩增序列和crispr反应。
[0890]
注塑成型盒被配置成插入能够控制盒内的样品分配、试剂装载、加热和检测的装置中。盒包含多个阀以及气动输送歧管,它们共同实现装置控制该装置内的腔室和流体通道中的流量、压力和温度。该装置还可以配备能够测量检测腔室组件的光学检测器(例如,荧光计)。
[0891]
图165示出了包含样品腔室101和扩增腔室102的注塑成型盒的一部分的设计。小图a和b提供了自上而下的视图,而小图c至e 从底部显示注塑成型盒。如小图a所示,包含待分析样品的拭子103 可插入样品入口104。样品入口端口具有密封盖105,其将注塑成型盒的内容物与周围环境密封。一旦样品被插入样品腔室,旋转阀106 可以将裂解缓冲液从裂解缓冲液储存腔室107输送至样品腔室。小图 a显示连接裂解缓冲液储存和样品腔室的旋转阀。样品裂解完成后,旋转阀可以将20μl等分样品转移到计量通道108中,其可以旋转以将样品输送至通向四个扩增试剂腔室110的微流体通道109中。小图 b显示了旋转阀用于将计量通道与样品腔室连接的位置。
[0892]
如小图c中描绘的自下而上视图所示,扩增试剂腔室的内容物可以流入扩增腔室101。通过在两个腔室之间来回移动内容物进行混合。混合完成后,将样品完全转移到扩增腔室中并温育一段受控的时间。如小图d所示,注塑成型盒可以位于控制装置内的加热元件上,从而实现在扩增期间进行温度控制。
[0893]
流入和流出扩增腔室的流动方向由滑动阀111调节。小图c描绘了处于将每个扩增试剂腔室连接至扩增腔室的第一位置的滑动阀。一旦扩增反应完成,该面板可以滑动至第
二和第三位置(其中之一在小图e中描绘),这实现样品从扩增腔室移动到计量通道112中。然后滑块能够采用第四位置,其中计量通道与通向检测试剂腔室的通道 113重叠。因此,样品在扩增后被分成8个独立的部分。
[0894]
图166小图a提供了包含检测试剂腔室和检测腔室的注塑成型盒的部分的设计。在扩增之后,样品从扩增腔室流入检测试剂腔室114。然后样品从检测试剂腔室流出并向下级联进入检测腔室115。注塑成型盒连接至塑料盖片,该塑料盖片安装在盒顶部并密封其腔室。小图 b显示了具有塑料盖件116的注塑成型盒。如小图b的侧视图所示,检测腔室具有平坦透明的表面,能够激发和检测荧光。检测腔室位于控制装置中能够升高检测腔室温度的第二加热器上方。检测腔室之间的黑色凸台最大限度地减少腔室之间的光污染,从而提高光学实验 (例如发光检测、荧光等)的准确度和灵敏度。
[0895]
图167小图a和b提供了注塑成型盒的全视图。扩增腔室102、裂解缓冲液储存腔室107、扩增试剂腔室110和检测试剂腔室114是敞开的,并且可以装载溶液和试剂。一旦将所需的试剂装载至装置,可以将塑料盖件附接至注塑成型盒,从而密封装置内的腔室和流体通道。小图c显示了附接有塑料盖件116的注塑成型盒的工作物理模型的图片。塑料盖件包含可以连接至气动歧管的顶部o形环入口端口 118的阵列,该气动歧管能够引导流过腔室和注塑成型盒内的流体通道。盒的总尺寸为92mm
×
80mm
×
52.5mm(包括样品入口的高度) 和92mm
×
80mm
×
19.5mm(不包括样品入口)。固定环在注塑成型盒和入口之间形成密封,否则它们是不同的和可分离的。实施例68用于激发和检测注塑成型盒荧光检测的二极管阵列
[0896]
本实施例涵盖了用于在多腔室盒中的荧光读出detectr反应的检测方案。该盒被设计用于对经过扩增的样品的不同部分进行单独的detectr反应。图168示出了容纳在装置102中的注塑成型盒101,该装置102包含能够检测来自每个腔室的光的二极管阵列和定位成照亮腔室的白光发光二极管103。注塑成型盒具有8个检测腔室104。最左边的四个(橙色)检测腔室包含染料atto 594,最右边的四个检测腔室包含染料atto 488。包含594染料的检测腔室的正面(指向装置开口外侧)涂有橙色凝胶滤光器。包含488染料的检测腔室的正面涂有黄色滤光器。白光从侧面照亮检测腔室,激发检测腔室内的荧光染料。检测腔室面向白光的侧面可以涂有滤光器或颜色吸收凝胶。该装置包含检测从检测腔室发出的光的二极管,从而允许该装置使用荧光报道分子监测detectr反应。
[0897]
图169的小图a和b显示了用于控制白光、检测器二极管和用于监测在检测器二极管上采集的数据的图形用户界面。图形用户界面允许用户设置温度关闭点(例如,配置检测二极管以在其温度超过 50℃时关闭)、通过二极管的偏置电压或电流以及在每个检波二极管上的采样率(例如,100hz)。该图形可以显示来自每个检测二极管的荧光读数数据。
[0898]
图170示出了二极管阵列的校准测试的结果。每组8个数据点对应于8个检测二极管在一次测试中采集的数据。数据集a在装置中没有注塑成型盒的情况下采集。数据集b-h用装置中的空注塑成型盒采集。数据集b在空盒上采集。数据集c和d用含有缓冲液但不含染料的盒采集。数据集e、f和g用含有1nm、10nm和100nm染料的试剂盒,使用二极管1-4在含有atto 488的孔和含有atto 594 的孔5-8上采集。数据集h用100nm atto 488在孔1-3中、1μm atto 488在孔4中、100nm atto 594在孔5-7中和1μm atto 594 在孔8中采集。图170示出了
8个部分的柱状图,分别指定为a、b、 c、d、e、f、g和h。1部分led亮,无芯片,b部分led,空芯片,c部分led亮,芯片具有100ul 1x te,d部分led亮,芯片具有90ul 1x te,e部分为90ul 1nm染料,f部分为90ul 10nm染料, g部分为90ul 100nm染料,h部分为100nm和1um。每个部分内有7个柱,从左至右分别是diode 1、diode 2、diode 3、diode 4、diode 5、diode 6、diode 7和diode 8。y轴以任意单位(a.u.) 显示荧光,范围从2.4至3.0,增量为0.1。实施例69使用二极管阵列进行测量的herc2 detectr测定
[0899]
本实施例描述了使用实施例68的二极管阵列在实施例67的注塑成型盒上进行的detectr测定。detectr测定试剂直接装载至检测腔室。该测定利用具有seq id no:37的可编程核酸酶、具有seqid no:256的靶向herc2 g snp等位基因的指导核酸,以及在切割时增加荧光响应的报道核酸。四个孔含有5μm报道分子、150nm可编程核酸酶、600nm指导核酸和500pm靶核酸。两个孔含有5μm 报道分子、150nm可编程核酸、600nm指导核酸,而没有靶标。两个孔仅包含缓冲液。报道分子包含atto 488或atto 594。
[0900]
图171示出了来自8个检测腔室的荧光轨迹,由8个二极管检测器阵列测量。包含报道分子、可编程核酸酶、指导核酸和靶核酸的检测腔室提供随时间线性增加的荧光响应。含有detectr试剂但缺乏靶核酸的检测腔室和仅含有缓冲液的检测腔室未显示荧光增加。因此,具有活性反式附带报道分子切割的检测腔室可通过荧光区分。图171示出了线图,其中x轴以分钟为单位显示detectr时间点,范围从0至35,增量为5,y轴以任意单位(a.u.)显示的净荧光,范围为-0.02至0.12,增量为0.02。线性增加的四条线从左/最高至右/最低分别是g-snp
–
488nm、g-snp
–
594nm、g-snp
–
488nm和g-snp
ꢀ–
488nm。先前列表中的最后两个几乎重叠。靠近底部的较高平坦线对应于detectr mm
–
488nm。在底部的较低平坦线对应于 detectr mm
–
594nm和1x te
–
594nm。
[0901]
图172示出了在detectr试剂添加30分钟后检测腔室的图像。检测腔室1、4、5和8包含靶核酸,并且明显可见比其余检测腔室更亮。实施例70在病毒裂解缓冲液中扩增靶核酸
[0902]
本实施例描述了在病毒裂解缓冲液中扩增靶核酸。测试了各种缓冲液组合物、还原剂和温育温度对靶核酸扩增的影响。使用lamp 扩增对不同缓冲液中的样品进行扩增,并测量产生的荧光。荧光更高表明扩增更多。
[0903]
图173示出了在不同裂解条件下使用lamp扩增seracare靶核酸的结果。样品在各种缓冲液中扩增。样品在室温(左图)或95℃(右图)下温育5分钟。每次反应样品不含靶标(“ntc”),含有2.5、 25或250个拷贝。在25μl反应中使用5μl样品进行测定,重复三次。
[0904]
图174示出了在不同裂解条件下使用lamp扩增seracare标准靶核酸的结果。样品在各种缓冲液中扩增。每次反应不含靶标 (“ntc”),含有1.5、2.5、15、25、150或250个拷贝。在15μl 反应中使用3μl样品或在25μl反应中使用5μl样品进行测定,重复三次。
[0905]
该实验的结果表明某些缓冲液更有利于lamp扩增。实施例71在病毒裂解缓冲液中扩增来自covid-19患者样品的靶核酸
[0906]
本实施例描述了在病毒裂解缓冲液中扩增来自covid-19患者样品的靶核酸。从
covid-19阳性患者采集的样品在具有不同组分的病毒裂解缓冲液中裂解和扩增。如实施例22中所述,使用lamp扩增对应于sars-cov-2n-基因和rnasep的靶核酸。测试了各种病毒裂解缓冲液制剂。
[0907]
图175示出了在存在六种不同病毒裂解缓冲液(“vlb”、“vlb-d”、“vlb-t”、“缓冲液”、“缓冲液-a”和“缓冲液-b”)的情况下sars-cov-2n基因(“n”)和rnase p样品输入对照核酸(“rp”) 的扩增。缓冲液-a含有具有还原剂a的缓冲液,缓冲液-b含有具有还原剂b的缓冲液。阴影方块表示扩增速率,阴影更深表示扩增更快。在95℃(“95c”)或室温(“rt”)下对高、中或低滴度covid-19阳性患者样品(分别为“16.9”、“30.5”和“33.6”)进行扩增。样品重复测量两次。
[0908]
虽然已经示出和在本文所述了本公开内容的优选实施方案,对本领域技术人员将是显而易见的是,仅通过举例的方式来提供这样的实施方案。在不脱离本公开内容的情况下,本领域技术人员现在将清楚许多变型、改变和替代。应当理解,在实践本公开内容时可以采用本文所述的本公开实施方案的各种替代方案。所附权利要求旨在限定本公开内容的范围,并且由此覆盖这些权利要求及其等同物的范围内的方法和结构。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。