乙型肝炎病毒(hbv)疫苗和抗pd-1或抗pd-l1抗体的组合
1.对电子提交的序列表的引用本技术含有序列表,其通过efs-web作为ascii格式的序列表以电子方式提交,文件名称为“065814_15wo1_ sequence_listing”,创建日期为2020年6月15日,且大小为46 kb。通过efs-web提交的序列表是说明书的一部分,并通过引用整体并入本文。
2.相关申请的交叉引用本技术要求2019年6月18日提交的美国临时申请号62/862,791的优先权,其公开内容通过引用整体并入本文。
背景技术:
3.乙型肝炎病毒(hbv)是一种编码四种开放读码框和七种蛋白的小型3.2-kb嗜肝dna病毒。大约2.4亿人具有慢性乙型肝炎感染(慢性hbv),其特征在于病毒和亚病毒颗粒在血液中持续超过6个月(cohen等人. j. viral hepat. (2011) 18(6), 377-83)。通过病毒肽和循环抗原对hbv-特异性的t-细胞受体的慢性刺激,持续性hbv感染导致循环的和肝内的hbv-特异性的cd4 和cd8 t-细胞中的t-细胞衰竭。结果,t细胞多功能性降低(即,il-2、肿瘤坏死因子(tnf)-α、ifn-γ水平降低和增殖缺乏)。
4.自二十世纪80年代以来,针对hbv感染的安全且有效的预防性疫苗已经面世,并且是乙型肝炎预防的主要支柱(world health organization, hepatitis b: fact sheet no. 204 [因特网] 2015年3月)。世界卫生组织推荐对所有婴儿进行疫苗接种,并且在乙型肝炎低度或中度流行的国家,对所有儿童和青少年(《18岁)以及某些风险群体种类的人进行疫苗接种。由于疫苗接种,全球感染率已经大幅下降。但是,预防性疫苗不能治愈已确定的hbv感染。
[0005]
慢性hbv目前用ifn-α和核苷或核苷酸类似物治疗,但由于被称为共价闭合环状dna (cccdna)(其作为病毒rna的模板起重要作用)的细胞内病毒复制中间体和因而新病毒粒子在被感染的肝细胞中持续存在,因此没有最终治愈。有人认为,诱导的病毒特异性的t-细胞和b-细胞应答可以有效地消除携带cccdna的肝细胞。靶向hbv聚合酶的当前疗法会抑制病毒血症,但对驻留在细胞核中的cccdna和循环抗原的相关产生具有有限的影响。最严格的治愈形式可能是从生物体消除hbv cccdna,这既没有作为天然存在的结果观察到,也没有作为任何治疗干预的结果观察到。但是,hbv表面抗原(hbsag)的丧失是在临床上可靠的治愈等同指标,因为只有在严重免疫抑制的情况下才会出现疾病复发,其则可以通过预防性治疗来预防。因此,至少从临床观点看,hbsag的消失与针对hbv的最严格的免疫重建形式有关。
[0006]
例如,在具有有限疗程的持续停药(off-treatment)应答方面,与核苷或核苷酸疗法相比,用聚乙二醇化的干扰素(pegifn)-α的免疫调节已被证明是更好的。除了直接的抗病毒作用外,据报道ifn-α在细胞培养物和人源化的小鼠中对cccdna发挥表观遗传抑制作用,这导致病毒粒子生产力和转录物的减少(belloni等人. j. clin. invest. (2012) 122(2), 529-537)。但是,这种疗法仍然伴有副作用并且总体应答是相当低的,部分原因是
ifn-α对hbv-特异性的t-细胞仅具有差的调节影响。具体地,治愈率低(《10%)且毒性高。同样,直接起作用的hbv抗病毒剂,即hbv聚合酶抑制剂恩替卡韦和替诺福韦,作为单一疗法可有效诱导病毒抑制,具有对耐药突变体出现的高遗传屏障和肝疾病进展的连续预防。但是,很少使用此类hbv聚合酶抑制剂实现慢性乙型肝炎的治愈(由hbsag消失或血清转化定义)。因此,这些抗病毒剂在理论上需要无限期地施用以预防肝病复发,类似于人免疫缺陷病毒(hiv)的抗逆转录病毒疗法。
[0007]
治疗性疫苗接种具有从慢性感染的患者消除hbv的潜力(michel等人. j. hepatol. (2011) 54(6), 1286-1296)。已经探索了许多策略,但迄今为止尚未证明治疗性疫苗接种是成功的。
技术实现要素:
[0008]
因此,在治疗乙型肝炎病毒(hbv)、特别是慢性hbv方面存在未得到满足的医疗需求,即关于具有更高治愈率的有限良好耐受的治疗。本发明通过提供用于诱导针对乙型肝炎病毒(hbv)感染的免疫应答的治疗组合或组合物和方法来满足这种需要。本发明的免疫原性组合物/组合和方法可以用于给受试者(诸如具有慢性hbv感染的受试者)提供治疗性免疫。
[0009]
在一般方面,本技术涉及用于在有此需要的受试者中治疗hbv感染的治疗组合或组合物,其包含一种或多种hbv抗原或一种或多种编码hbv抗原的多核苷酸和抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0010]
在一个实施方案中,所述治疗组合包含:i)以下至少一种:a) 截短的hbv核心抗原,其由与seq id no: 2具有至少95%(诸如至少95%、96%、97%、98%、99%或100%)同一性的氨基酸序列组成,b) 第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列;c) hbv聚合酶抗原,其氨基酸序列与seq id no: 7具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性,和d) 第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列;和ii)抗pd-1或抗pd-l1抗体或其抗原结合片段,例如本文所述那些。
[0011]
在一个实施方案中,所述截短的hbv核心抗原由seq id no: 2或seq id no: 4的氨基酸序列组成,且所述hbv聚合酶抗原包含seq id no: 7的氨基酸序列。
[0012]
在一个实施方案中,所述治疗组合包含hbv聚合酶抗原和截短的hbv核心抗原中的至少一种。在某些实施方案中,所述治疗组合包含hbv聚合酶抗原和截短的hbv核心抗原。
[0013]
在一个实施方案中,所述治疗组合包含以下至少一种:第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列;和第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列。在某些实施方案中,所述第一种非天然存在的核酸分子进一步包含编码信号序列的多核苷酸序列,所述信号序列可操作地
连接至截短的hbv核心抗原的n-端,且所述第二种非天然存在的核酸分子进一步包含编码信号序列的多核苷酸序列,所述信号序列可操作地连接至hbv聚合酶抗原的n-端,优选地,所述信号序列独立地包含seq id no: 9或seq id no: 15的氨基酸序列,更优选地,所述信号序列分别由seq id no: 8或seq id no: 14的多核苷酸序列编码。
[0014]
在某些实施方案中,所述第一种多核苷酸序列包含与seq id no: 1或seq id no: 3具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的多核苷酸序列。
[0015]
在某些实施方案中,所述第二种多核苷酸序列包含与seq id no: 5或seq id no: 6具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的多核苷酸序列。
[0016]
在一个实施方案中,治疗组合包含:a) 第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述截短的hbv核心抗原由与seq id no: 2具有至少95%(诸如至少95%、96%、97%、98%、99%或100%)同一性的氨基酸序列组成;b) 第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列,所述hbv聚合酶抗原的氨基酸序列与seq id no: 7具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性;和c) 抗pd-1或抗pd-l1抗体或其抗原结合片段,优选选自:i)17d8, 2d3, 4h1, 5c4, 4a11, 7d3, 5f4, h409a11, hpd-1.08a, hpd-1.09a, 109a-h, k09a-l-11, k09a-l-16, k09a-l-17, 409a-h, h1m7789n, h1m7799n, h1m7800n, h2m7780n, h2m7788n, h2m7790n, h2m7791n, h2m7794n, h2m7795n, h2m7796n, h2m7798n, h4h9019p, h4xh9034p2, h4xh9035p2, h4xh9037p2, h4xh9045p2, h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab, 及其变体;ii)结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体;和iii)纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0017]
优选地,治疗组合包含a)第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述截短的hbv核心抗原由seq id no: 2或seq id no: 4
的氨基酸序列组成;b)第二种非天然存在的核酸分子,其包含编码具有seq id no: 7的氨基酸序列的hbv聚合酶抗原的第二种多核苷酸序列,和c)抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0018]
优选地,治疗组合包含:第一种非天然存在的核酸分子,其包含与seq id no: 1或seq id no: 3具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的多核苷酸序列;和第二种非天然存在的核酸分子,其包含与seq id no: 5或seq id no: 6具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的多核苷酸序列。
[0019]
更优选地,治疗组合包含:a)第一种非天然存在的核酸分子,其包含seq id no: 1或seq id no: 3的第一种多核苷酸序列;b)第二种非天然存在的核酸分子,其包含seq id no: 5或6的第二种多核苷酸序列;和c)抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0020]
在一个实施方案中,第一种和第二种非天然存在的核酸分子中的每一种是dna分子, 优选地所述dna分子存在于质粒或病毒载体上。
[0021]
在另一个实施方案中,第一种和第二种非天然存在的核酸分子中的每一种是rna分子,优选mrna或自复制的rna分子。
[0022]
在某些实施方案中,第一种和第二种非天然存在的核酸分子中的每一种用脂质纳米颗粒(lnp)独立地配制。
[0023]
在另一个一般方面,本技术涉及一种试剂盒,其包含本技术的治疗组合。
[0024]
本技术也涉及用于诱导针对乙型肝炎病毒(hbv)的免疫应答的本技术的治疗组合或试剂盒;和本技术的治疗组合、组合物或试剂盒在药物制备中的用途,所述药物用于诱导针对乙型肝炎病毒(hbv)的免疫应答。所述用途可以进一步包含与另一种免疫原性剂或治疗剂、优选另一种hbv抗原或另一种hbv疗法的组合。优选地,所述受试者具有慢性hbv感染。
[0025]
本技术进一步涉及用于在有此需要的受试者中治疗hbv诱导的疾病的本技术的治疗组合或试剂盒;和本技术的治疗组合或试剂盒在药物制备中的用途,所述药物用于在有此需要的受试者中治疗hbv诱导的疾病。所述用途可以进一步包含与另一种治疗剂、优选另一种抗-hbv抗原的组合。优选地,所述受试者具有慢性hbv感染,且所述hbv诱导的疾病选自晚期纤维化、肝硬化和肝细胞癌(hcc)。
[0026]
本技术也涉及诱导针对hbv的免疫应答的方法或治疗hbv感染或hbv诱导的疾病的方法,所述方法包括给有此需要的受试者施用根据本发明的实施方案的治疗组合。
[0027]
从以下公开内容,包括发明详述及其优选实施方案和所附权利要求书,会明白本发明的其它方面、特征和优点。
附图说明
[0028]
当结合附带的附图阅读时,将更好地理解前述概述、以及本技术的优选实施方案的以下详细描述。但是,应当理解,本技术不限于附图所示的精确实施方案。
[0029]
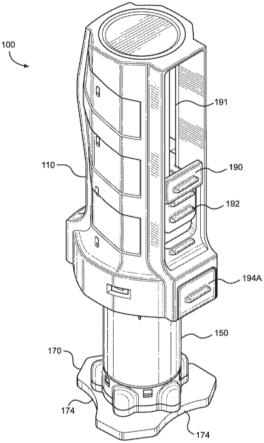
图1a和图1b显示了根据本技术的实施方案的dna质粒的示意图;图1a显示了根据本技术的一个实施方案编码hbv核心抗原的dna质粒;图1b显示了根据本技术的一个实施方案编码hbv聚合酶(pol)抗原的dna质粒;在cmv启动子的控制下表达hbv核心和pol抗原,其中n-端半胱氨酸蛋白酶抑制剂s信号肽在从细胞分泌后从表达的抗原切割;质粒的转录调
节元件包括位于cmv启动子和编码hbv抗原的多核苷酸序列之间的增强子序列以及位于编码hbv抗原的多核苷酸序列下游的bgh多腺苷酸化序列;第二个表达盒以相反取向被包括在质粒中,包括在ampr (bla)启动子控制下的卡那霉素抗性基因;复制起点(puc)也以相反取向被包括;图2a和图2b显示了根据本技术的实施方案的腺病毒载体中的表达盒的示意图;图2a显示了截短的hbv核心抗原的表达盒,其含有cmv启动子、内含子(从人apoai基因衍生出的片段-genbank登录号x01038碱基对295
ꢀ‑
523,携带apoai第二内含子)、人免疫球蛋白分泌信号,随后是截短的hbv核心抗原的编码序列和sv40多腺苷酸化信号;图2b显示了可操作地连接至hbv聚合酶抗原的截短的hbv核心抗原的融合蛋白的表达盒,其除了hbv抗原以外在其它方面与截短的hbv核心抗原的表达盒相同;图3显示了如在实施例3中所述,用表达hbv核心抗原或hbv pol抗原的不同dna质粒免疫的balb/c小鼠的elispot应答;用灰度等级指示用于刺激从不同的接种疫苗的动物组分离的脾细胞的肽池;在y-轴上指示应答性t-细胞的数目,表示为斑点形成细胞(sfc)/106个脾细胞;图4a和图4b显示了通过elispot测量的小鼠的免疫应答,所述小鼠被施用了根据本技术的实施方案的dna质粒(在d0和d21)以及根据本技术的实施方案的抗pd-1或同种型抗体;图4a显示在第一次接种后1周开始接受3次抗pd-1(黑色)或同种型(灰色)注射(即,d7、d14、d21)的小鼠的结果;图4b显示在第一次接种的同时,然后每7天(即,d0、d7、d14、d21)用抗pd-1(黑色)或同种型(灰色)处理的小鼠的结果;和图5a、图5b、图5c、图5d、图5e和图5f显示了由分离自小鼠的脾细胞的ics测量的免疫应答,所述小鼠被施用了根据本技术的实施方案的dna质粒(在d0和d21)以及根据本技术的实施方案的抗pd-1或同种型抗体,结果表示为平均值 /-sem;用核心(图5a和图5d)、pol1(图5b和图5e)或pol2(图5c和图5f)刺激脾细胞6小时,然后测量针对ifn-γ、il-2或tnf-α的应答;图5a、图5b和图5c显示从在第一次接种后1周开始接受3次抗pd-1(黑色)或同种型(灰色)注射(即,d7、d14、d21)的小鼠分离的脾细胞的结果;图5d、图5e和图5f显示在第一次接种的同时,然后每7天(即,d0、d7、d14、d21)用抗pd-1(黑色)或同种型(灰色)处理的小鼠的结果。
[0030]
图6显示cd8t细胞在从小鼠分离的肝内淋巴细胞(ihl)中的增殖能力,所述小鼠被施用了根据本技术的实施方案的dna质粒(在d28和d49)以及根据本技术的实施方案的抗pd-1或同种型抗体,结果表示为平均值 /-sem。
[0031]
图7显示了分离自小鼠的脾细胞中cd8t细胞的增殖能力,所述小鼠被施用了根据本技术的实施方案的dna质粒(在d28和d49)以及根据本技术的实施方案的抗pd-1或同种型抗体,结果表示为平均值 /-sem。
具体实施方式
[0032]
在背景和整个说明书中引用或描述了各种出版物、文章和专利;这些参考文献中的每一篇通过引用整体并入本文。已经包括在本说明书中的文件、法案、材料、装置、文章等的讨论是用于提供本发明的上下文的目的。这样的讨论并非承认任何或所有这些内容形成关于公开或要求保护的任何发明的现有技术的一部分。
[0033]
除非另外定义,否则在本文中使用的所有技术和科学术语具有本发明所属领域的普通技术人员通常理解的相同含义。否则,本文使用的某些术语具有如在说明书中所述的含义。本文引用的所有专利、公开的专利申请和出版物都通过引用并入,如同在本文中充分阐述。
[0034]
必须指出,如在本文中和在所附权利要求书中所使用的,单数形式“一种”、“一个”和“该”包括复数形式,除非上下文另外清楚地指明。
[0035]
除非另有说明,否则在一系列元件之前的术语“至少”应理解为表示该系列中的每个元件。本领域技术人员会认识到或仅仅使用例行实验就能够确定许多与本文所述的本发明的具体实施方案等效的方案。这样的等效方案意图被本发明涵盖。
[0036]
在本说明书和下面的权利要求书中,除非上下文另外要求,否则词语“包含”和变体诸如“包括”和“含有”应理解为暗示包括所陈述的整数或步骤或者整数或步骤的组,但是不排除任何其它整数或步骤或者整数或步骤的组。当在本文中使用时,术语“包含”可以用术语“含有”或“包括”替代,或者有时当在本文中使用时可以用术语“具有”替代。
[0037]
当在本文中使用时,“由
……
组成”排除在权利要求要素中未指定的任何要素、步骤或成分。当在本文中使用时,“基本上由
……
组成”不排除对权利要求的基本和新颖特征没有实质性影响的材料或步骤。无论何时在本文中使用时在本技术的一个方面或实施方案的上下文中,“包含”、“含有”、“包括”和“具有”的前述术语中的任一个可以用术语“由
……
组成”或“基本上由
……
组成”替换以改变本公开内容的范围。
[0038]
如本文中使用的,多个列举的要素之间的连接术语“和/或”被理解为涵盖单独的和组合的选项。例如,当两个要素由“和/或”连接时,第一种选项表示在没有第二个要素的情况下第一个要素的适用性。第二种选项表示在没有第一个要素的情况下第二个要素的适用性。第三种选项表示第一个要素和第二个要素一起的适用性。这些选项中的任何一个都被理解为落入其含义内,且因此满足本文中使用的术语“和/或”的要求。超过一个选项的同时适用性也被理解为落入该含义内,且因此满足术语“和/或”的要求。
[0039]
除非另有说明,任何数值,诸如本文所述的浓度或浓度范围,在所有情况下应理解为由术语“约”修饰。因此,数值通常包括所列举值的
±
10%。例如,1 mg/ml的浓度包括0.9 mg/ml至1.1 mg/ml。同样,1 mg/ml至10 mg/ml的浓度范围包括0.9 mg/ml至11 mg/ml。如本文中使用的,数值范围的使用明确包括所有可能的子范围、在该范围内的所有单个数值,包括在这样的范围内的整数和值的分数,除非上下文另外清楚地指出。
[0040]
短语“序列同一性百分比(%)”或“%同一性”或“与
……
的%同一性”在参考氨基酸序列使用时描述了与构成氨基酸序列的总长度的氨基酸残基的数目相比两个或更多个比对的氨基酸序列中相同的氨基酸的匹配(“命中”)数目。换句话说,使用比对,对于两个或更多个序列,当对序列进行对比和比对以获得最大对应时,如使用本领域已知的序列对比算法所测量的,或者当手工比对和目视检查时,可以确定相同的氨基酸残基的百分比(例如在氨基酸序列的全长上,90%、91%、92%、93%、94%、95%、97%、98%、99%或100%同一性)。被对比以确定序列同一性的序列因此可能因氨基酸的置换、添加或缺失而不同。用于比对蛋白序列的合适程序是技术人员已知的。例如,用程序诸如clustalw、clustal omega、fasta或blast,例如使用ncbi blast算法(altschul sf, 等人(1997), nucleic acids res. 25:3389-3402),可以确定蛋白序列的序列同一性百分比。
[0041]
如本文中使用的,在向受试者施用两种或更多种疗法或组分的上下文中,术语和短语“联合”、“与
……
联合”、“共同递送”和“与
……
一起施用”表示同时施用或随后施用两种或更多种疗法或组分,诸如两种载体,例如,dna质粒、肽、或治疗组合和佐剂。“同时施用”可以是至少在同一天内施用两种或更多种疗法或组分。当两种组分“与
……
一起施用”或“与
……
联合施用”时,它们可以在短时间段内诸如24、20、16、12、8或4小时或在1小时内在分开的组合物中依次施用,或者它们可以同时在单一组合物中施用。“依次施用”可以是在同一天或在不同天施用两种或更多种疗法或组分。术语“与
……
联合”的使用不限制对受试者施用疗法或组分的顺序。例如,可以在施用第二种疗法或组分(例如,编码hbv抗原的第二种dna质粒)和/或第三种疗法或组分(例如,抗pd-1或抗pd-l1抗体或其抗原结合片段)之前(例如,之前5分钟至1小时)、伴随地或同时地或之后(例如,之后5分钟至1小时)施用第一种疗法或组分(例如编码hbv抗原的第一种dna质粒)。在某些实施方案中,在相同组合物中施用第一种疗法或组分(例如编码hbv抗原的第一种dna质粒)、第二种疗法或组分(例如,编码hbv抗原的第二种dna质粒)和第三种疗法或组分(例如,抗pd-1或抗pd-l1抗体或其抗原结合片段)。在其它实施方案中,在分开的组合物(诸如两种或三种分开的组合物)中施用第一种疗法或组分(例如编码hbv抗原的第一种dna质粒)、第二种疗法或组分(例如,编码hbv抗原的第二种dna质粒)和第三种疗法或组分(例如,抗pd-1或抗pd-l1抗体或其抗原结合片段)。
[0042]
本文中使用的“非天然存在的”核酸或多肽表示在自然界中不存在的核酸或多肽。可以在实验室和/或制造环境中合成、处理、制造和/或以其它方式操作“非天然存在的”核酸或多肽。在某些情况下,非天然存在的核酸或多肽可以包含天然存在的核酸或多肽,其被处理、加工或操作以表现出在处理之前在天然存在的核酸或多肽中不存在的性能。本文中使用的“非天然存在的”核酸或多肽可以是从发现它的天然来源分离或分开的核酸或多肽,并且它缺乏与它在天然来源中相关联的序列的共价键。可以重组地制备或通过其它方法(诸如化学合成)制备“非天然存在的”核酸或多肽。
[0043]
本文中使用的“受试者”是指任何动物,优选哺乳动物,最优选人类,其将被或已经被根据本技术的一个实施方案的方法治疗。本文中使用的术语“哺乳动物”涵盖任何哺乳动物。哺乳动物的例子包括,但不限于,牛、马、羊、猪、猫、狗、小鼠、大鼠、兔、豚鼠、非人灵长类动物(nhp)诸如猴或猿、人类等,更优选人。
[0044]
本文中使用的术语“可操作地连接”表示连接或并置,其中如此描述的组件处于允许它们以其预期方式起作用的关系中。例如,可操作地连接至感兴趣的核酸序列的调节序列能够指导感兴趣的核酸序列的转录,或者可操作地连接至感兴趣的氨基酸序列的信号序列能够跨膜分泌或转移感兴趣的氨基酸序列。
[0045]
为了帮助本技术的读者,说明书已被分成多个段落或部分,或涉及本技术的不同实施方案。这些分离不应被视为将段落或部分或实施方案的内容与另一个段落或部分或实施方案的内容断开。相反,本领域技术人员会理解,该描述具有广泛的应用并且涵盖了可以考虑的各个部分、段落和句子的所有组合。任何实施方案的讨论意图仅仅是示例性的,并且无意提示本公开内容(包括权利要求)的范围限于这些实施例。例如,虽然本文描述的本技术的hbv载体(例如,质粒dna或病毒载体)的实施方案可以包含特定组分,包括、但不限于,以特定顺序排列的某些启动子序列、增强子或调节序列、信号肽、hbv抗原的编码序列、多腺
苷酸化信号序列等,本领域普通技术人员会明白,本文公开的概念同样可以适用于以其它顺序排列的可用于本技术的hbv载体中的其它组分。本技术涵盖以具有可用于本技术的hbv载体中的任何序列的任何组合使用任何适用组分,无论是否明确描述了特定组合。本发明总体上涉及一种治疗组合,其包含一种或多种hbv抗原和至少一种抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0046]
乙型肝炎病毒(hbv)本文中使用的“乙型肝炎病毒”或“hbv”表示嗜肝病毒科的病毒。hbv是一种小的(例如3.2 kb)嗜肝dna病毒,其编码四种开放读码框和七种蛋白。由hbv编码的七种蛋白包括小(s)、中(m)和大(l)表面抗原(hbsag)或包膜(env)蛋白、前核心蛋白(pre-core)、核心蛋白、病毒聚合酶(pol)和hbx蛋白。hbv表达三种表面抗原或包膜蛋白l、m和s,其中s是最小的,l是最大的。m和l蛋白中的额外结构域分别命名为pre-s2和pre-s1。核心蛋白是病毒核衣壳的亚基。病毒dna (逆转录酶、rna酶h和引物)的合成需要pol,该合成发生在定位于受感染的肝细胞的细胞质的核衣壳中。precore是具有n端信号肽的核心蛋白,并且在从受感染细胞分泌之前在其n端和c端发生蛋白水解性加工,成为所谓的乙型肝炎e-抗原(hbeag)。共价闭合环状dna (cccdna)的有效转录需要hbx蛋白。hbx不是病毒的结构蛋白。除了共享mrna的核心和聚合酶外,hbv的所有病毒蛋白都具有其自己的mrna。除前核心蛋白外,hbv病毒蛋白都没有进行翻译后蛋白水解加工。
[0047]
hbv病毒粒子含有病毒包膜、核衣壳和部分双链dna基因组的单个拷贝。核衣壳包含120个核心蛋白的二聚体,并被衣壳膜覆盖,所述衣壳膜嵌入了s、m和l病毒包膜或表面抗原蛋白。在进入细胞后,病毒没有被包裹,且含有衣壳的松弛环状dna (rcdna)与共价结合的病毒聚合酶一起迁移到细胞核。在该过程中,核心蛋白的磷酸化诱导结构变化,从而暴露核定位信号,实现衣壳与所谓的输入蛋白相互作用。这些输入蛋白介导核心蛋白与核孔复合物(衣壳在其上分解)的结合且聚合酶/rcdna复合物被释放到细胞核中。在细胞核内,rcdna变成去蛋白化(聚合酶的除去)并通过宿主dna修复机制转化为共价闭合环状dna (cccdna)基因组,重叠的转录物从其编码hbeag、hbsag、核心蛋白、病毒聚合酶和hbx蛋白。核心蛋白、病毒聚合酶和前基因组rna (pgrna)在细胞质中缔合并自组装成含有未成熟的pgrna的衣壳颗粒,所述颗粒进一步转化为成熟的rcdna-衣壳并作为常见中间体起作用,所述常见中间体要么作为感染性病毒颗粒被包裹和分泌,要么被运回细胞核以补充和维持稳定的cccdna池。
[0048]
迄今为止,基于在包膜蛋白上存在的抗原性表位,将hbv分为四种血清型(adr、adw、ayr、ayw),并基于病毒基因组的序列分为八种基因型(a、b、c、d、e、f、g和h)。hbv基因型分布在不同的地理区域。例如,在亚洲最流行的基因型是基因型b和c。基因型d在非洲、中东和印度占主导地位,而基因型a在北欧、撒哈拉大沙漠以南非洲和西非普遍存在。
[0049]
hbv抗原本文中使用的术语“hbv抗原”、“hbv的抗原性多肽”、“hbv抗原性多肽”、“hbv抗原性蛋白”、“hbv免疫原性多肽”和“hbv免疫原”都表示能够在受试者中诱导针对hbv的免疫应答(例如,体液和/或细胞介导的应答)的多肽。hbv抗原可以是hbv的多肽、其片段或表位、或多种hbv多肽、其部分或衍生物的组合。hbv抗原能够在宿主中产生保护性免疫应答,例如,诱导针对病毒性疾病或感染的免疫应答,和/或在受试者中产生针对病毒性疾病或感染的
免疫(即,接种疫苗),其保护受试者免受病毒性疾病或感染。例如,hbv抗原可以包含来自任何hbv蛋白的多肽或其免疫原性片段,诸如hbeag、前核心蛋白、hbsag (s、m或l蛋白)、核心蛋白、病毒聚合酶或从任何hbv基因型(例如,基因型a、b、c、d、e、f、g和/或h或它们的组合)衍生出的hbx蛋白。
[0050]
(1) hbv核心抗原如本文中使用的,术语“hbv核心抗原”、“hbc”和“核心抗原”中的每一个表示能够在受试者中诱导针对hbv核心蛋白的免疫应答(例如,体液和/或细胞的介导的应答)的hbv抗原。术语“核心”、“核心多肽”和“核心蛋白”中的每一个表示hbv病毒核心蛋白。全长核心抗原通常为183个氨基酸的长度,并且包括组装结构域(氨基酸1至149)和核酸结合结构域(氨基酸150至183)。前基因组rna衣壳化需要34-残基核酸结合结构域。该结构域还作为入核转运信号起作用。它包含17个精氨酸残基并且是高碱性的,这与其功能一致。hbv核心蛋白在溶液中是二聚体,所述二聚体自组装成二十面体衣壳。核心蛋白的每个二聚体具有四个α-螺旋束,后者在任一侧侧接α-螺旋结构域。缺乏核酸结合结构域的截短的hbv核心蛋白也能够形成衣壳。
[0051]
在本技术的一个实施方案中,hbv抗原是截短的hbv核心抗原。本文中使用的“截短的hbv核心抗原”表示不含有hbv核心蛋白的整个长度但能够在受试者中诱导针对hbv核心蛋白的免疫应答的hbv抗原。例如,可以修饰hbv核心抗原以缺失核心抗原的高度带正电荷的(富含精氨酸的)c-端核酸结合结构域的一个或多个氨基酸,所述c-端核酸结合结构域通常含有十七个精氨酸(r)残基。本技术的截短的hbv核心抗原优选地是不包含hbv核心入核转运信号的c-端截短的hbv核心蛋白和/或已从其缺失c-端hbv核心入核转运信号的截短的hbv核心蛋白。在一个实施方案中,截短的hbv核心抗原包含c-端核酸结合结构域中的缺失,诸如c-端核酸结合结构域的1-34个氨基酸残基的缺失,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33或34个氨基酸残基,优选全部34个氨基酸残基的缺失。在一个优选的实施方案中,截短的hbv核心抗原包含c-端核酸结合结构域中的缺失,优选全部34个氨基酸残基的缺失。
[0052]
本技术的hbv核心抗原可以是源自多个hbv基因型(例如,基因型a、b、c、d、e、f、g和h)的共有序列。本文中使用的“共有序列”是指基于同源蛋白的氨基酸序列的比对的人工氨基酸序列,例如,如通过同源蛋白的氨基酸序列的比对(例如,使用clustal omega)所确定的。它可以是在序列比对中的每个位置发现的最常见氨基酸残基的计算顺序,这基于来自至少100个天然hbv分离株的hbv抗原(例如,核心、pol等)的序列。共有序列可以是非天然存在的并且不同于天然病毒序列。通过使用多序列比对工具比对来自不同来源的多个hbv抗原序列,并在可变比对位置选择最常见的氨基酸,可以设计共有序列。优选地,hbv抗原的共有序列源自hbv基因型b、c和d。术语“共有抗原”用于表示具有共有序列的抗原。
[0053]
根据本技术的示例性的截短的hbv核心抗原缺乏核酸结合功能,并且能够在哺乳动物中诱导针对至少两种hbv基因型的免疫应答。优选地,截短的hbv核心抗原能够在哺乳动物中诱导针对至少hbv基因型b、c和d的t细胞应答。更优选地,截短的hbv核心抗原能够在人类受试者中诱导针对至少hbv基因型a、b、c和d的cd8 t细胞应答。
[0054]
优选地,本技术的hbv核心抗原是共有抗原,优选从hbv基因型b、c和d衍生出的共有抗原,更优选从hbv基因型b、c和d衍生出的截短的共有抗原。根据本技术的示例性的截短
的hbv核心共有抗原由与seq id no: 2或seq id no: 4具有至少90%同一性(诸如与seq id no: 2或seq id no: 4具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性)的氨基酸序列组成。seq id no: 2和seq id no: 4是从hbv基因型b、c和d衍生出的核心共有抗原。seq id no: 2和seq id no: 4各自含有天然核心抗原的高度带正电荷的(富含精氨酸的)核酸结合结构域的34-氨基酸c-端缺失。
[0055]
在本技术的一个实施方案中,hbv核心抗原是由seq id no: 2的氨基酸序列组成的截短的hbv抗原。在另一个实施方案中,hbv核心抗原是由seq id no: 4的氨基酸序列组成的截短的hbv抗原。在另一个实施方案中,hbv核心抗原进一步含有信号序列,其可操作地连接至成熟的hbv核心抗原序列(诸如seq id no: 2或seq id no: 4的氨基酸序列)的n-端。优选地,信号序列具有seq id no: 9或seq id no: 15的氨基酸序列。
[0056]
(2) hbv聚合酶抗原本文中使用的术语“hbv聚合酶抗原”、“hbv pol抗原”或“hbv pol抗原”表示能够在受试者中诱导针对hbv聚合酶的免疫应答(例如,体液和/或细胞的介导的应答)的hbv抗原。术语“聚合酶”、“聚合酶多肽”、“pol”和“pol”中的每一个表示hbv病毒dna聚合酶。hbv病毒dna聚合酶具有四个结构域,从n末端到c末端包括:末端蛋白(tp)结构域,其作为负链dna合成的引物;对聚合酶功能非必需的间隔区;用于转录的逆转录酶(rt)结构域;和rna酶h结构域。
[0057]
在本技术的一个实施方案中,hbv抗原包含hbv pol抗原,或其任何免疫原性片段或组合。hbv pol抗原可以含有进一步修饰以提高抗原的免疫原性,诸如通过将突变引入聚合酶和/或rna酶结构域的活性部位以降低或基本上消除某些酶活性。
[0058]
优选地,本技术的hbv pol抗原不具有逆转录酶活性和rna酶h活性,并且能够在哺乳动物中诱导针对至少两种hbv基因型的免疫应答。优选地,hbv pol抗原能够在哺乳动物中诱导针对至少hbv基因型b、c和d的t细胞应答。更优选地,hbv pol抗原能够在人类受试者中诱导针对至少hbv基因型a、b、c和d的cd8 t细胞应答。
[0059]
因而,在某些实施方案中,hbv pol抗原是灭活的pol抗原。在一个实施方案中,灭活的hbv pol抗原在聚合酶结构域的活性部位中包含一个或多个氨基酸突变。在另一个实施方案中,灭活的hbv pol抗原在rna酶h结构域的活性部位中包含一个或多个氨基酸突变。在一个优选的实施方案中,灭活的hbv pol抗原在聚合酶结构域和rna酶h结构域的活性部位中包含一个或多个氨基酸突变。例如,核苷酸/金属离子结合所需要的hbv pol抗原的聚合酶结构域中的“yxdd”基序可以被突变,例如,通过用天冬酰胺残基(n)替换一个或多个天冬氨酸残基(d),消除或降低金属配位功能,从而降低或基本上消除逆转录酶功能。可替换地,或除了“yxdd”基序的突变之外,mg2 配位所需的hbv pol抗原的rna酶h结构域中的“dedd”基序可以被突变,例如,通过用天冬酰胺残基(n)替换一个或多个天冬氨酸残基(d)和/或用谷氨酰胺(q)替换谷氨酸残基(e),从而降低或基本上消除rna酶h功能。在一个特定实施方案中,如下修饰hbv pol抗原:(1)将聚合酶结构域的“yxdd”基序中的天冬氨酸残基(d)突变为天冬酰胺残基(n);和(2)将rna酶h结构域的“dedd”基序中的第一个天冬氨酸残基(d)突变为天冬酰胺残基(n)并将第一个谷氨酸残基(e)突变为谷氨酰胺残基(n),从而降低或基本上消除pol抗原的逆转录酶和rna酶h功能。
[0060]
在本技术的一个优选的实施方案中,hbv pol抗原是共有抗原,优选从hbv基因型b、c和d衍生出的共有抗原,更优选从hbv基因型b、c和d衍生出的灭活的共有抗原。根据本技术的示例性的hbv pol共有抗原包含与seq id no: 7具有至少90%同一性的氨基酸序列,诸如与seq id no: 7具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选与seq id no: 7具有至少98%同一性,诸如与seq id no: 7具有至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性。seq id no: 7是从hbv基因型b、c和d衍生出的pol共有抗原,其包含位于聚合酶和rna酶h结构域的活性部位中的四个突变。具体地,四个突变包括在聚合酶结构域的“yxdd”基序中的天冬氨酸残基(d)向天冬酰胺残基(n)的突变;在rna酶h结构域的“dedd”基序中,第一个天冬氨酸残基(d)向天冬酰胺残基(n)的突变以及谷氨酸残基(e)向谷氨酰胺残基(q)的突变。
[0061]
在本技术的一个特定实施方案中,hbv pol抗原包含seq id no: 7的氨基酸序列。在本技术的其它实施方案中,hbv pol抗原由seq id no: 7的氨基酸序列组成。在另一个实施方案中,hbv pol抗原进一步含有信号序列,其可操作地连接至成熟的hbv pol抗原序列(诸如seq id no: 7的氨基酸序列)的n-端。优选地,所述信号序列具有seq id no: 9或seq id no: 15的氨基酸序列。
[0062]
(3) hbv核心抗原和hbv聚合酶抗原的融合体本文中使用的术语“融合蛋白”或“融合体”表示具有至少两个多肽结构域的单个多肽链,所述多肽结构域通常不存在于单个天然多肽中。
[0063]
在本技术的一个实施方案中,hbv抗原包含融合蛋白,所述融合蛋白包含可操作地连接至hbv pol抗原的截短的hbv核心抗原或者可操作地连接至截短的hbv核心抗原的hbv pol抗原,优选地经由接头。
[0064]
例如,在包含第一多肽和第二异源多肽的融合蛋白中,接头主要用作第一和第二多肽之间的间隔物。在一个实施方案中,接头由通过肽键连接在一起的氨基酸组成,优选由通过肽键连接的1至20个氨基酸组成,其中氨基酸选自20种天然存在的氨基酸。在一个实施方案中,1-20个氨基酸选自甘氨酸、丙氨酸、脯氨酸、天冬酰胺、谷氨酰胺和赖氨酸。优选地,接头由大部分在空间上不受阻碍的氨基酸组成,诸如甘氨酸和丙氨酸。示例性的接头是聚甘氨酸,特别是(gly)5、(gly)8;聚(gly-ala)和聚丙氨酸。如在下面实施例中所示的一种示例性的合适接头是(alagly)n,其中n是2-5的整数。
[0065]
优选地,本技术的融合蛋白能够在哺乳动物中诱导针对至少两种hbv基因型的hbv核心和hbv pol的免疫应答。优选地,融合蛋白能够在哺乳动物中诱导针对至少hbv基因型b、c和d的t细胞应答。更优选地,融合蛋白能够在人类受试者中诱导针对至少hbv基因型a、b、c和d的cd8 t细胞应答。
[0066]
在本技术的一个实施方案中,融合蛋白包含:其氨基酸序列与seq id no: 2或seq id no: 4具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的截短的hbv核心抗原,接头,和其氨基酸序列与seq id no: 7具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的hbv pol抗
id no: 1或seq id no: 3具有98%、99%或100%同一性,所述多核苷酸序列可操作地连接至与seq id no: 11具有至少90%同一性的接头编码序列,诸如与seq id no: 11具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 11具有98%、99%或100%同一性,所述接头编码序列进一步可操作地连接至与seq id no: 5或seq id no: 6具有至少90%同一性的多核苷酸序列,诸如与seq id no: 5或seq id no: 6具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 5或seq id no: 6具有98%、99%或100%同一性。在本技术的特定实施方案中,编码hbv抗原融合蛋白的非天然存在的核酸分子包含seq id no: 1或seq id no: 3,其可操作地连接至seq id no: 11,后者进一步可操作地连接至seq id no: 5或seq id no: 6。
[0079]
在另一个实施方案中,编码hbv融合体的非天然存在的核酸分子进一步包含信号序列的编码序列,所述信号序列可操作地连接至hbv融合体序列(诸如seq id no: 16的氨基酸序列)的n-端。优选地,所述信号序列具有seq id no: 9或seq id no: 15的氨基酸序列。更优选地,信号序列的编码序列包含seq id no: 8或seq id no: 14的多核苷酸序列。在一个实施方案中,编码的具有信号序列的融合蛋白包含seq id no: 17的氨基酸序列。
[0080]
本技术也涉及一种载体,其包含第一种和/或第二种非天然存在的核酸分子。本文中使用的“载体”是用于将遗传物质携带到另一个细胞中的核酸分子,在那里它可以被复制和/或表达。可以使用考虑到本公开内容本领域技术人员已知的任何载体。载体的例子包括、但不限于质粒、病毒载体(细菌噬菌体、动物病毒和植物病毒)、粘粒和人工染色体(例如,yac)。优选地,载体是dna质粒。载体可以是dna载体或rna载体。考虑到本公开内容,本领域普通技术人员可以通过标准重组技术构建本技术的载体。
[0081]
本技术的载体可以是表达载体。本文中使用的术语“表达载体”表示包含核酸的任何类型的遗传构建体,所述核酸编码能够被转录的rna。表达载体包括、但不限于用于重组蛋白表达的载体,诸如dna质粒或病毒载体,以及用于将核酸递送到受试者中以在受试者的组织中表达的载体,诸如dna质粒或病毒载体。本领域技术人员将理解,表达载体的设计可以取决于诸如待转化的宿主细胞的选择、期望的蛋白表达水平等因素。
[0082]
本技术的载体可以含有多种调节序列。本文中使用的术语“调节序列”表示允许、有助于或调节核酸分子的功能调节(包括核酸或其衍生物之一(即mrna)的复制、重复、转录、剪接、翻译、稳定性和/或运输进宿主细胞或生物体中)的任何序列。在本公开内容的上下文中,该术语涵盖启动子、增强子和其它表达控制元件(例如,多腺苷酸化信号和影响mrna稳定性的元件)。
[0083]
在本技术的某些实施方案中,载体是非病毒载体。非病毒载体的例子包括、但不限于dna质粒、细菌人工染色体、酵母人工染色体、细菌噬菌体等。非病毒载体的例子包括、但不限于rna复制子、mrna复制子、修饰的mrna复制子或自扩增mrna、闭合线性脱氧核糖核酸,例如线性共价闭合dna,诸如线性共价闭合双链dna分子。优选地,非病毒载体是dna质粒。与“dna质粒载体”、“质粒dna”或“质粒dna载体”互换使用的“dna质粒”表示能够在合适的宿主细胞中自复制的双链且通常为环状的dna序列。用于表达编码的多核苷酸的dna质粒通常包含复制起点、多克隆位点和选择标志物,例如可以是抗生素抗性基因。可以使用的合适的
dna质粒的例子包括、但不限于用于众所周知的表达系统(包括原核和真核系统)的商购可得的表达载体,诸如pse420 (invitrogen, san diego, calif.),其可以用于在大肠杆菌中生产和/或表达蛋白;pyes2 (invitrogen, thermo fisher scientific),其可以用于在酵母的酿酒酵母菌株中生产和/或表达;maxbac
®
完整杆状病毒表达系统(thermo fisher scientific),其可以用于在昆虫细胞中生产和/或表达;pcdnatm或pcdna3tm (life technologies, thermo fisher scientific),其可以用于在哺乳动物细胞中的高水平组成型蛋白表达;和pvax或pvax-1 (life technologies, thermo fisher scientific),其可以用于在大多数哺乳动物细胞中高水平瞬时表达感兴趣的蛋白。通过使用常规技术和容易得到的起始原料,可以修饰任何商购可得的dna质粒的主链以优化在宿主细胞中的蛋白表达,诸如反转某些元件(例如,复制起点和/或抗生素抗性盒)的方向,替换质粒的内源启动子(例如,在抗生素抗性盒中的启动子),和/或替换编码所转录的蛋白的多核苷酸序列(例如,抗生素抗性基因的编码序列) (参见例如,sambrook等人, molecular cloning a laboratory manual, 第二版. cold spring harbor press (1989))。
[0084]
优选地,dna质粒是适合于在哺乳动物宿主细胞中表达蛋白的表达载体。适用于在哺乳动物宿主细胞中表达蛋白的表达载体包括、但不限于pcdnatm、pcdna3tm、pvax、pvax-1、advax、ntc8454等。优选地,表达载体是基于pvax-1,其可被进一步修饰以优化在哺乳动物细胞中的蛋白表达。pvax-1是dna疫苗中的常用质粒,且含有强大的人类立即早期巨细胞病毒(cmv-ie)启动子,然后是牛生长激素(bgh)衍生的多腺苷酸化序列(pa)。pvax-1进一步含有puc复制起点和由允许细菌质粒繁殖的小原核启动子驱动的卡那霉素抗性基因。
[0085]
本技术的载体还可以是病毒载体。一般而言,病毒载体是遗传工程改造的病毒,其携带已被赋予非传染性的经修饰的病毒dna或rna,但仍含有病毒启动子和转基因,从而允许通过病毒启动子翻译转基因。因为病毒载体通常缺乏传染性序列,因此它们需要辅助病毒或包装线才能大规模转染。可以使用的病毒载体的例子包括、但不限于腺病毒载体、腺伴随病毒载体、痘病毒载体、肠道病毒载体、委内瑞拉马脑炎病毒载体、西门利克森林病毒载体、烟草花叶病毒载体、慢病毒载体等。可以使用的病毒载体的例子包括、但不限于沙粒病毒病毒载体、复制缺陷型沙粒病毒病毒载体或有复制能力的沙粒病毒病毒载体、双节段或三节段沙粒病毒、传染性的沙粒病毒病毒载体、包含沙粒病毒基因组区段的核酸(其中该基因组区段的一个开放读码框被删除或在功能上灭活,并被编码如本文所述的hbv抗原的核酸替代)、沙粒病毒诸如淋巴细胞性脉络丛脑膜炎病毒(lcmv)(例如,克隆13株或mp株)、以及沙粒病毒诸如胡宁病毒(例如,candid #1株)。载体还可以是非病毒载体。
[0086]
优选地,病毒载体是腺病毒载体,例如,重组腺病毒载体。重组腺病毒载体可以例如衍生自人腺病毒(hadv或adhu)或猿猴腺病毒诸如黑猩猩或大猩猩腺病毒(chad、adch或sadv)或恒河猴腺病毒(rhad)。优选地,腺病毒载体是重组人腺病毒载体,例如重组人腺病毒血清型26,或重组人腺病毒血清型5、4、35、7、48等中的任一种。在其它实施方案中,腺病毒载体是rhad载体,例如rhad51、rhad52或rhad53。
[0087]
载体也可以是线性共价闭合双链dna载体。本文中使用的“线性共价闭合双链dna载体”表示在结构上不同于质粒dna的闭合线性脱氧核糖核酸(dna)。它具有质粒dna的许多优点以及类似于rna策略的最小盒大小。例如,它可以是通常包含编码的抗原序列、启动子、多腺苷酸化序列和端粒末端的载体盒。可以通过酶促过程合成无质粒构建体,无需细菌序
列。合适的线性共价闭合dna载体的例子包括、但不限于商购可得的表达载体诸如
‘
doggybone
™
闭合线性dna’(dbdna
™
) (touchlight genetics ltd.;伦敦, 英国)。参见,例如,scott等人, hum vaccin immunother. 2015年8月;11(8): 1972-1982,其整个内容通过引用并入本文。在us2012/0282283、us2013/0216562和us2018/0037943中描述了线性共价闭合双链dna载体、组合物和用于产生和使用此类载体以递送dna分子(诸如本发明的活性分子)的一些实例,其各自的相关内容特此通过引用整体并入。
[0088]
考虑到本公开内容,使用本领域已知的方法可以制备用于本技术的重组载体。例如,考虑到遗传密码的简并性,可以设计几种编码相同多肽的核酸序列。编码本技术的hbv抗原的多核苷酸可以任选地进行密码子优化以确保在宿主细胞(例如,细菌或哺乳动物细胞)中的适当表达。密码子优化是本领域广泛应用的技术,且考虑到本公开内容,获得经过密码子优化的多核苷酸的方法将是本领域技术人员众所周知的。
[0089]
本技术的载体,例如,dna质粒、病毒载体(特别是腺病毒载体)、rna载体(诸如自复制的rna复制子)或线性共价闭合双链dna载体,可以包含任何调节元件以建立载体的常规功能,包括、但不限于由载体的多核苷酸序列编码的hbv抗原的复制和表达。调节元件包括、但不限于启动子、增强子、多腺苷酸化信号、翻译终止密码子、核糖体结合元件、转录终止子、选择标志物、复制起点等。载体可以包含一个或多个表达盒。“表达盒”是指导细胞机器制造rna和蛋白的载体的一部分。表达盒通常包含三个组件:启动子序列、开放读码框和任选地包含多腺苷酸化信号的3
’‑
非翻译区(utr)。开放读码框(orf)是一种读码框,它含有从起始密码子到终止密码子的感兴趣的蛋白(例如,hbv抗原)的编码序列。表达盒的调节元件可以可操作地连接至编码感兴趣的hbv抗原的多核苷酸序列。本文中使用的术语“可操作地连接”应放在最广泛的合理上下文中,并表示具有功能关系的多核苷酸元件的连接。当多核苷酸被置于与另一种多核苷酸的功能关系中时,所述多核苷酸是“可操作地连接的”。例如,如果启动子影响编码序列的转录,则所述启动子可操作地连接至编码序列。适用于本文所述的表达盒的任何组件可以以任何组合和以任何顺序使用以制备本技术的载体。
[0090]
载体可以包含启动子序列,优选在表达盒内,以控制感兴趣的hbv抗原的表达。术语“启动子”以其常规含义使用,且表示启动可操作地连接的核苷酸序列的转录的核苷酸序列。启动子位于同一条链上,靠近它所转录的核苷酸序列。启动子可以是组成型、诱导型或抑制型。启动子可以是天然存在的或合成的。启动子可以来源于包括病毒、细菌、真菌、植物、昆虫和动物的来源。启动子可以是同源启动子(即,源自与载体相同的遗传来源)或异源启动子(即,源自不同的载体或遗传来源)。例如,如果要使用的载体是dna质粒,则启动子可以是质粒内源性的(同源的)或源自其它来源(异源的)。优选地,启动子在表达盒内位于编码hbv抗原的多核苷酸的上游。
[0091]
可以使用的启动子的例子包括、但不限于来自猿猴病毒40 (sv40)的启动子、小鼠乳腺肿瘤病毒(mmtv)启动子、人免疫缺陷病毒(hiv)启动子诸如牛免疫缺陷病毒(biv)长末端重复序列(ltr)启动子、莫洛尼病毒启动子、禽造白细胞组织增生病毒(alv)启动子、巨细胞病毒(cmv)启动子诸如cmv立即早期启动子(cmv-ie)、爱泼斯坦-巴尔病毒(ebv)启动子或劳斯肉瘤病毒(rsv)启动子。启动子也可以是来自人基因的启动子,诸如人肌动蛋白、人肌球蛋白、人血红蛋白、人肌肉肌酸或人金属硫蛋白。启动子也可以是组织特异性启动子,诸如天然的或合成的肌肉或皮肤特异性启动子。
[0092]
优选地,启动子是强真核启动子,优选巨细胞病毒立即早期(cmv-ie)启动子。示例性的cmv-ie启动子的核苷酸序列显示在seq id no: 18或seq id no: 19中。
[0093]
载体可以包含额外的多核苷酸序列,其稳定化表达的转录物、增强rna转录物的核输出和/或改善转录-翻译偶联。这样的序列的例子包括多腺苷酸化信号和增强子序列。多腺苷酸化信号在载体表达盒内通常位于感兴趣的蛋白(例如,hbv抗原)的编码序列的下游。增强子序列是调节性dna序列,当被转录因子结合时,其增强相关基因的转录。增强子序列优选地在载体表达盒内位于编码hbv抗原的多核苷酸序列的上游,但位于启动子序列的下游。
[0094]
可以使用考虑到本公开内容本领域技术人员已知的任何多腺苷酸化信号。例如,多腺苷酸化信号可以是sv40多腺苷酸化信号、ltr多腺苷酸化信号、牛生长激素(bgh)多腺苷酸化信号、人生长激素(hgh)多腺苷酸化信号或人β-珠蛋白多腺苷酸化信号。优选地,多腺苷酸化信号是牛生长激素(bgh)多腺苷酸化信号或sv40多腺苷酸化信号。示例性的bgh多腺苷酸化信号的核苷酸序列显示在seq id no: 20中。示例性的sv40多腺苷酸化信号的核苷酸序列显示在seq id no: 13中。
[0095]
可以使用考虑到本公开内容本领域技术人员已知的任何增强子序列。例如,增强子序列可以是人肌动蛋白、人肌球蛋白、人血红蛋白、人肌肉肌酸或病毒增强子,诸如来自cmv、ha、rsv或ebv的增强子。具体增强子的例子包括、但不限于土拨鼠hbv转录后调节元件(wpre)、源自人载脂蛋白a1前体(apoai)的内含子/外显子序列、人t-细胞白血病病毒1型(htlv-1)长末端重复序列(ltr)的非翻译r-u5结构域、剪接增强子、合成的兔β-珠蛋白内含子或它们的任意组合。优选地,增强子序列是htlv-1 ltr的非翻译r-u5结构域、兔β-珠蛋白内含子和剪接增强子的三个连续元件的复合序列,其在本文中被称作“三重增强子序列”。示例性的三重增强子序列的核苷酸序列显示在seq id no: 10中。另一种示例性的增强子序列是在seq id no: 12中所示的apoai基因片段。
[0096]
载体可以包含编码信号肽序列的多核苷酸序列。优选地,编码信号肽序列的多核苷酸序列位于编码hbv抗原的多核苷酸序列的上游。信号肽通常指导蛋白的定位,促进蛋白从产生蛋白的细胞中的分泌,和/或改善抗原表达和向抗原呈递细胞的交叉呈递。当从载体表达时,信号肽可以存在于hbv抗原的n端,但被信号肽酶切掉,例如在从细胞分泌后。其中信号肽已被切割的表达的蛋白经常被称为“成熟的蛋白”。可以使用考虑到本公开内容本领域已知的任何信号肽。例如,信号肽可以是半胱氨酸蛋白酶抑制剂s信号肽;免疫球蛋白(ig)分泌信号,诸如ig重链γ信号肽spigg或ig重链ε信号肽spige。
[0097]
优选地,信号肽序列是半胱氨酸蛋白酶抑制剂s信号肽。半胱氨酸蛋白酶抑制剂s信号肽的示例性核酸和氨基酸序列分别显示在seq id no: 8和9中。免疫球蛋白分泌信号的示例性核酸和氨基酸序列分别显示在seq id no: 14和15中。
[0098]
载体,诸如dna质粒,还可以包括细菌复制起点和抗生素抗性表达盒,其用于在细菌细胞(例如大肠杆菌)中选择和维持质粒。细菌复制起点和抗生素抗性盒可以以与编码hbv抗原的表达盒相同的取向或以相反(反向)取向位于载体中。复制起点(ori)是启动复制处的序列,从而使质粒能够在细胞内繁殖和存活。适用于本技术的ori的例子包括、但不限于cole1、pmb1、puc、psc101、r6k和15a,优选puc。puc ori的示例性核苷酸序列显示在seq id no: 21中。
[0099]
用于在细菌细胞中选择和维持的表达盒通常包括可操作地连接至抗生素抗性基因的启动子序列。优选地,可操作地连接至抗生素抗性基因的启动子序列不同于可操作地连接至编码感兴趣的蛋白(例如hbv抗原)的多核苷酸序列的启动子序列。抗生素抗性基因可以是密码子优化的,并且抗生素抗性基因的序列组成通常根据细菌(例如,大肠杆菌)密码子选择进行调整。可以使用考虑到本公开内容本领域技术人员已知的任何抗生素抗性基因,包括、但不限于卡那霉素抗性基因(kanr)、氨苄西林抗性基因(ampr)和四环素抗性基因(tetr)、以及赋予对氯霉素、博来霉素、大观霉素、羧苄西林等的抗性的基因。
[0100]
优选地,在载体的抗生素表达盒中的抗生素抗性基因是卡那霉素抗性基因(kanr)。kanr基因的序列显示在seq id no: 22中。优选地,kanr基因是密码子优化的。密码子优化的kanr基因的示例性核酸序列显示在seq id no: 23中。kanr可以与其天然启动子可操作地连接,或者kanr基因可以与异源启动子连接。在一个特定实施方案中,kanr基因可操作地连接至氨苄西林抗性基因(ampr)启动子,后者称作bla启动子。bla启动子的示例性核苷酸序列显示在seq id no: 24中。
[0101]
在本技术的一个特定实施方案中,载体是包含表达盒的dna质粒,所述表达盒包括编码至少一种hbv抗原的多核苷酸,所述hbv抗原选自:hbv pol抗原,其包含与seq id no: 7具有至少90%(诸如90%、91%、92%、93%、94%、95%、96%、97%,优选地至少98%,诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列;和截短的hbv核心抗原,其由与seq id no: 2或seq id no: 4具有至少95%(诸如95%、96%、97%,优选地至少98%,诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列组成;可操作地连接至编码hbv抗原的多核苷酸的上游序列,其从5’端至3’端包含启动子序列,优选seq id no: 18的cmv启动子序列,增强子序列,优选seq id no: 10的三重增强子序列,和编码信号肽序列的多核苷酸序列,优选具有seq id no: 9的氨基酸序列的半胱氨酸蛋白酶抑制剂s信号肽;和可操作地连接至编码hbv抗原的多核苷酸的下游序列,其包含多腺苷酸化信号,优选seq id no: 20的bgh多腺苷酸化信号。这样的载体进一步包含抗生素抗性表达盒,其包括编码抗生素抗性基因(优选kanr基因)的多核苷酸,更优选与seq id no: 23具有至少90%同一性的密码子优化的kanr基因,诸如与seq id no: 23具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 23具有100%同一性,其可操作地连接至seq id no: 24的ampr (bla)启动子,在编码抗生素抗性基因的多核苷酸的上游并与其可操作地连接;和复制起点,优选seq id no: 21的puc ori。优选地,抗生素抗性盒和复制起点以相对于hbv抗原表达盒相反的取向存在于质粒中。
[0102]
在本技术的另一个特定实施方案中,载体是病毒载体,优选腺病毒载体,更优选ad26或ad35载体,其包含表达盒,所述表达盒包括编码至少一种hbv抗原的多核苷酸,所述hbv抗原选自:hbv pol抗原,其包含与seq id no: 7具有至少90%(诸如90%、91%、92%、93%、94%、95%、96、97%、优选地至少98%,诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列;和截短的hbv核心抗原,其由与seq id no: 2或seq id no: 4具有至少95%(诸如95%、96%、97%,优选地至少98%,诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或
100%)同一性的氨基酸序列组成;可操作地连接至编码hbv抗原的多核苷酸的上游序列,其从5’端至3’端包含启动子序列,优选seq id no: 19的cmv启动子序列,增强子序列,优选seq id no: 12的apoai基因片段序列,和编码信号肽序列(优选具有seq id no: 15的氨基酸序列的免疫球蛋白分泌信号)的多核苷酸序列;和可操作地连接至编码hbv抗原的多核苷酸的下游序列,其包含多腺苷酸化信号,优选seq id no: 13的sv40多腺苷酸化信号。
[0103]
在本技术的一个实施方案中,载体,诸如质粒dna载体或病毒载体(优选腺病毒载体,更优选ad26或ad35载体),编码具有seq id no: 7的氨基酸序列的hbv pol抗原。优选地,载体包含hbv pol抗原的编码序列,其与seq id no: 5或6的多核苷酸序列具有至少90%同一性,诸如与seq id no: 5或6具有90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 5或6具有100%同一性。
[0104]
在本技术的一个实施方案中,载体,诸如质粒dna载体或病毒载体(优选腺病毒载体,更优选ad26或ad35载体),编码由seq id no: 2或seq id no: 4的氨基酸序列组成的截短的hbv核心抗原。优选地,载体包含截短的hbv核心抗原的编码序列,其与seq id no: 1或seq id no: 3的多核苷酸序列具有至少90%同一性,诸如与seq id no: 1或seq id no: 3具有90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 1或seq id no: 3具有100%同一性。
[0105]
在本技术的另一个实施方案中,载体,诸如质粒dna载体或病毒载体(优选腺病毒载体,更优选ad26或ad35载体),编码融合蛋白,所述融合蛋白包含具有seq id no: 7的氨基酸序列的hbv pol抗原和由seq id no: 1或seq id no: 3的氨基酸序列组成的截短的hbv核心抗原。优选地,载体包含融合体的编码序列,其含有与seq id no: 1或seq id no: 3具有至少90%同一性的截短的hbv核心抗原的编码序列,诸如与seq id no: 1或seq id no: 3具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 1或seq id no: 3具有98%、99%或100%同一性,更优选地seq id no: 1或seq id no: 3,所述编码序列可操作地连接至与seq id no: 5或seq id no: 6具有至少90%同一性的hbv pol抗原的编码序列,诸如与seq id no: 5或seq id no: 6具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 5或seq id no: 6具有98%、99%或100%同一性,更优选地seq id no: 5或seq id no: 6。优选地,截短的hbv核心抗原的编码序列经由与seq id no: 11具有至少90%同一性的接头的编码序列可操作地连接至hbv pol抗原的编码序列,诸如与seq id no: 11具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 11具有98%、99%或100%同一性。在本技术的特定实施方案中,载体包含融合体的编码序列,其具有可操作地连接至seq id no: 11的seq id no: 1或seq id no: 3,所述seq id no: 11进一步可操作地连接至seq id no: 5或seq id no: 6。
[0106]
考虑到本公开内容,通过本领域已知的任意方法可以制备本技术的编码hbv抗原
85:5879, 1988; bird等人, science 242:423, 1988)、具有改变的恒定区的抗体(例如,u.s. pat. no. 5,624,821)、结构域抗体和包含所需特异性的抗原结合位点的免疫球蛋白分子的任何其他修饰构型。
[0115]
如本文中使用的,“特异性地结合”抗原的抗体表示以1
×
10
−
7 m或更低的kd结合抗原的抗体。优选地,“特异性地结合”抗原的抗体以1
×
10
−
8 m或更低的kd结合抗原,更优选5
×
10
−
9 m或更低、1
×
10
−
9 m或更低、5
×
10
−
10 m或更低或1
×
10
−
10 m或更低。术语“kd”表示解离常数,它从kd与ka的比率(即,kd/ka)获得,并表示为摩尔浓度(m)。考虑到本公开内容,可以使用本领域中的方法确定抗体的kd值。例如,通过使用表面等离子体共振,诸如通过使用生物传感器系统,例如,biacore
®
系统,或通过使用生物层干扰量度技术,诸如octet red96系统,可以确定抗体的kd。抗体的kd值越小,抗体与靶抗原结合的亲和力越高。
[0116]
抗pd-1和抗pd-l1抗体本技术还涉及抗pd-1或抗pd-l1抗体的治疗应用。如上所述,“抗体”是广义的,包括免疫球蛋白分子,包括多克隆抗体;单克隆抗体,包括鼠、人、人源化和嵌合单克隆抗体;抗原结合片段、双特异性或多特异性抗体、二聚体抗体、四聚体抗体、多聚体抗体、fv、fab、f(ab')2、双功能杂合体、单链抗体、具有改变的恒定区的抗体、结构域抗体和包含所需特异性的抗原结合位点的免疫球蛋白分子的任何其他修饰构型。
[0117]“全长抗体”包括通过二硫键相互连接的两条重(h)链和两条轻(l)链及其多聚体(例如igm)。每条重链包括重链可变区(vh)和重链恒定区(包括结构域ch1、铰链ch2和ch3)。每条轻链包括轻链可变区(vl)和轻链恒定区(cl)。vh和vl区可以进一步细分为高变区,称为互补决定区(cdr),其被框架区(fr)隔开。每个vh和vl包括三个cdr和四个fr片段,从氨基端到羧基端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。
[0118]“互补决定区(cdr)”是抗体中的“抗原结合位点”。可以使用各种术语定义cdr:(i)互补决定区(cdr),三个在vh中(hcdr1、hcdr2、hcdr3)和三个在vl中(lcdr1、lcdr2、lcdr3),是基于序列可变性(wu and kabat, (1970) j exp med 132:211-50; kabat等人, sequences of proteins of immunological interest, 5th ed. public health service, national institutes of health, bethesda, md., 1991)。(ii)“高变区”、“hvr”或“hv”,三个在vh中(h1、h2、h3)和三个在vl中(l1、l2、l3),是指由chothia和lesk定义的结构高变的抗体可变结构域的区域(chothia and lesk, (1987) mol biol 196:901-17)。international immunogenetics (imgt)数据库(http://www_imgt_org)提供了抗原结合位点的标准化编号和定义。cdr、hv和imgt描述之间的对应关系描述在lefranc等人, (2003) dev comparat immunol 27:55-77。本文使用的术语“cdr”、“hcdr1”、“hcdr2”、“hcdr3”、“lcdr1”、“lcdr2”和“lcdr3”除非说明书中另有明确说明,包括上文kabat、chothia或imgt描述的任何方法定义的cdr。
[0119]
取决于重链恒定结构域氨基酸序列,免疫球蛋白可分为五个主要类别:iga、igd、ige、igg和igm。iga和igg进一步细分为同种型iga1、iga2、igg1、igg2、igg3和igg4。基于其恒定结构域的氨基酸序列,任何脊椎动物物种的抗体轻链都可以归为两种明显不同的类型之一,即κ(κ)和λ(λ)。
[0120]
如本文所用,“抗体片段”或“抗原结合片段”是指保留亲本全长抗体的抗原结合特性的免疫球蛋白分子的部分。示例性抗原结合片段是重链互补决定区(hcdr)1、2和3、轻链
互补决定区(lcdr)1、2和3、重链可变区(vh)、轻链可变区(vl)、fab、f(ab')2、fd和fv片段以及由一个vh或vl结构域组成的结构域抗体(dab)。vh和vl结构域可以通过合成接头连接在一起以形成各种类型的单链抗体设计,其中vh/vl结构域可以分子内配对,或者在vh和vl结构域由单独的单链抗体构建体表达的情况下分子间配对,以形成单价抗原结合位点,例如单链fv(scfv)或双抗体;例如在国际专利公布no. wo1998/44001, wo1988/01649, wo1994/13804和wo1992/01047中描述。
[0121]
如本文所用,“单克隆抗体”是指在每条重链和每条轻链中具有单一氨基酸组成的抗体群体,除了可能的众所周知的改变,例如从抗体重链去除c-末端赖氨酸。单克隆抗体通常结合一个抗原表位,除了多特异性单克隆抗体结合两个或更多个不同的抗原或表位。双特异性单克隆抗体结合两个不同的抗原表位。单克隆抗体可以在抗体群内具有异质糖基化。单克隆抗体可以是单特异性的或多特异性的,或者是单价的、二价的或多价的。多特异性抗体,例如双特异性抗体或三特异性抗体包括在术语单克隆抗体中。
[0122]
如本文所用,“人源化抗体”是指其中至少一个cdr来源于非人类物种并且可变区框架来源于人类免疫球蛋白序列的抗体。人源化抗体可以包括在框架区中有意引入的突变,以致框架可能不是表达的人免疫球蛋白或种系基因序列的精确拷贝。
[0123]
如本文所用,“人抗体”是指具有重链和轻链可变区的抗体,其中框架和所有6个cdr均源自人源序列。如果抗体包含恒定区或恒定区的一部分,则恒定区也来源于人源序列。如果抗体的可变区获自使用人种系免疫球蛋白或重排免疫球蛋白基因的系统,则人抗体包含“衍生自”人源序列的重链或轻链可变区。此类示例性系统是展示在噬菌体上的人免疫球蛋白基因文库,以及如本文所述携带人免疫球蛋白基因座的转基因非人动物例如小鼠或大鼠。当与人种系免疫球蛋白或重排的免疫球蛋白基因相比时,“人抗体”可能包含氨基酸差异,这是由于例如天然发生的体细胞突变或有意将取代引入框架或抗原结合位点,或两者。通常,“人抗体”与人种系免疫球蛋白或重排免疫球蛋白基因编码的氨基酸序列具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性。在一些情况下,“人抗体”可以包含源自人框架序列分析的共有框架序列,例如描述于knappik等人, (2000) j mol biol 296:57-86,或并入展示在噬菌体上的人免疫球蛋白基因文库中的合成hcdr3,例如描述于shi等人, (2010) j mol biol 397:385-96和国际专利公布no. wo2009/085462。
[0124]
源自人免疫球蛋白序列的人抗体可以使用诸如结合合成cdr和/或合成框架的噬菌体展示的系统产生,或者可以进行体外诱变以改进抗体特性,导致体内人抗体种系库不表达的抗体。
[0125]
如本文所用,“表位”是指抗体特异性结合的抗原部分。表位通常由具有化学活性(例如极性、非极性或疏水性)的表面集群部分组成,例如氨基酸或多糖侧链,可以具有特定的三维结构特征,以及特定的电荷特征。表位可由形成构象空间单位的连续和/或不连续氨基酸组成。对于不连续的表位,来自抗原线性序列不同部分的氨基酸通过蛋白质分子的折叠在3维空间中非常接近。抗体“表位”取决于用于鉴定表位的方法。
[0126]
如本文所用,“多特异性”是指特异性结合至少两种不同抗原或抗原内的两种不同表位,例如三个、四个或五个不同抗原或表位的抗体。
[0127]
如本文所用,“双特异性”是指特异性结合两种不同抗原或同一抗原内的两种不同
表位的抗体。
[0128]
如本文所用,“pd-1”是指程序性死亡-1蛋白,一种t细胞共抑制剂,也称为cd279或pdcd1。全长pd-1的代表性氨基酸序列在genbank中作为登录号np005009.2提供。术语“pd-1”包括蛋白质变体和重组pd-1或其片段。本技术中的“pd-1”是指人类成熟的pd-1,除非另有明确说明。
[0129]
pd-1是一种288个氨基酸的蛋白质受体,在活化的t细胞和b细胞、自然杀伤细胞和单核细胞上表达。pd-1是t细胞共抑制受体的cd28/ctla-4(细胞毒性t淋巴细胞抗原)/icos(诱导型共刺激物)家族的成员(chen等人 2013, nat. rev. immunol. 13 : 227-242)。该蛋白具有igv样的细胞外n端结构域、跨膜结构域和包含基于免疫受体酪氨酸抑制(itim)基序和基于免疫受体酪氨酸开关(itsm)基序的胞内结构域(chattopadhyay等人 2009, immunol. rev.)。pd-1的主要功能是减弱免疫应答(riley 2009, immunol. rev. 229: 114-125)。pd-1有两个配体,pd-配体1(pd-l1)和pd-l2。pd-l1(cd274,b7h 1)在淋巴和非淋巴组织,例如cd4和cd8 t细胞、巨噬细胞谱系细胞、外周组织以及肿瘤细胞、病毒感染细胞和自身免疫组织细胞上广泛表达。pd-l2(cd273,b7-dc)具有比pd-l1更受限制的表达,在活化的树突细胞和巨噬细胞上表达(dong等人 1999, nature med.)。pd-1与其配体结合导致减少的t细胞增殖和细胞因子分泌,破坏体液和细胞免疫应答。
[0130]
如本文所用,“pd-l1”是指程序性死亡配体1,也称为cd274和b7h1。全长pd-l1的氨基酸序列提供于genbank,登录号是np_054862.1。术语“pd-l1”还包括蛋白质变体和重组pd-l1或其片段。除非指定为来自非人类物种,否则术语“pd-l1”是指人类pd-l1。
[0131]
pd-l1是290个氨基酸的蛋白质,具有细胞外igv样和igc样结构域(全长pd-l1的氨基酸19-239)、跨膜结构域和约30个氨基酸的细胞内结构域。pd-l1在许多细胞上组成型表达,例如抗原呈递细胞(例如树突细胞、巨噬细胞和b细胞)以及造血和非造血细胞(例如血管内皮细胞、胰岛和免疫特权部位)。pd-l1也在多种肿瘤和病毒感染的细胞上表达,是免疫抑制环境的组分(ribas 2012, nejm 366: 2517-2519)。pd-l1与两种t细胞共抑制剂pd-1和b7-1之一结合。
[0132]
t细胞共刺激和共抑制分子(统称为共信号传导分子)在调节t细胞活化、亚群分化、效应子功能和存活中起关键作用(chen等人2013, nature rev. immunol. 13 : 227-242)。在t细胞受体识别抗原呈递细胞上的同源肽-mhc复合物后,共信号传导受体与t细胞受体在免疫突触处共定位,它们与tcr信号传导协同作用以促进或抑制t细胞激活和功能(flies等人 2011, yale j. biol. med. 84: 409-421)。最终的免疫应答受共刺激和共抑制信号(“免疫检查点”)之间的平衡调节(pardoll 2012, nature 12: 252-264)。虽然不希望受理论束缚,但目前认为pd-1在介导外周t细胞耐受性和避免自身免疫中作为一个这样的“免疫检查点”起作用。pd-1与pd-l1或pd-l2结合并抑制t细胞活化。慢性病毒感染和肿瘤利用pd-1抑制t细胞活化的能力来逃避免疫应答。在慢性病毒感染中,pd-1在病毒特异性t细胞上高度表达,这些t细胞变得“疲惫”,失去效应子功能和增殖能力(freeman 2008, pnas 105: 10275-1 0276)。pd-1:pd-l1系统还在诱导的t调节(treg)细胞发育和维持treg功能中发挥重要作用(francisco等人2010, immunol. rev. 236:219-242)。
[0133]
如本文所用,“拮抗剂”是指当与细胞蛋白质结合时抑制由蛋白质的天然配体诱导的至少一种反应或活性的分子。当所述至少一种反应或活性被抑制超过不存在拮抗剂(例
如,阴性对照)时抑制的所述至少一种反应或活性至少约30%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%时,或当与不存在拮抗剂时的抑制相比时所述抑制具有统计学意义时,分子是拮抗剂。拮抗剂可以是抗体、可溶性配体、小分子、dna或rna如sirna。示例性拮抗剂是特异性结合pd-1或pd-l1的拮抗抗体。由pd-1与其受体pd-l1或pd-l2结合诱导的典型反应或活性可以是减少的抗原特异性cd4 或cd8 细胞增殖或减少的由t细胞的干扰素-γ(ifn-γ)产生,导致免疫应答的抑制。因此,特异性结合pd-1的拮抗性pd-1抗体或特异性结合pd-l1的抗pd-l1抗体通过抑制抑制性途径诱导免疫应答。
[0134]
在一些实施方案中,抗pd-1抗体或其抗原结合片段具有以下特性中的一种、两种、三种、四种或五种:a)以剂量依赖性方式增强抗原特异性cd4
或cd8
t细胞的活化,其中使用如us20170121409的实施例1中所述的巨细胞病毒抗原回忆测定法(cmv测定法)测量该活化,其通过引用整体并入本文;b)以小于约100nm的平衡解离常数(kd)结合人pd-1,其中kd使用proteon xpr36系统在 25
°
c下测量;c)以小于约1nm的kd结合人pd-1,其中kd使用proteon xpr36系统在 25
°
c下测量;d)以小于约100nm的kd结合食蟹猴pd-1,其中kd使用proteon xpr36系统在 25
°
c下测量,或e)以小于约1nm的kd结合食蟹猴pd-1,其中kd使用proteon xpr36系统在 25
°
c下测量。
[0135]
在一些实施方案中,抗pd-l1抗体或其抗原结合片段具有以下特性中的一种、两种、三种、四种或五种:a)以剂量依赖性方式增强抗原特异性cd4
或cd8
t细胞的活化,其中使用如us20170121409的实施例1中所述的巨细胞病毒抗原回忆测定法(cmv测定法)测量该活化,其通过引用整体并入本文;b)以小于约100nm的平衡解离常数(kd)结合人pd-l1,其中kd使用proteon xpr36系统在 25
°
c下测量;c)以小于约1nm的kd结合人pd-l1,其中kd使用proteon xpr36系统在 25
°
c下测量;d)以小于约100nm的kd结合食蟹猴pd-l1,其中kd使用proteon xpr36系统在 25
°
c下测量,或e)以小于约1nm的kd结合食蟹猴pd-l1,其中kd使用proteon xpr36系统在 25
°
c下测量。
[0136]
抗体对人或食蟹猴pd-1或pd-l1的亲和力可以使用任何合适的方法通过实验确定。这样的方法可以利用本领域技术人员已知的proteon xpr36、biacore 3000或kinexa仪器、elisa或竞争性结合测定。如果在不同条件(例如,渗透压、ph)下测量,特定抗体/pd-1或抗体/pd-l1相互作用的测量亲和力可能不同。因此,亲和力和其他结合参数(例如,kd、k
on
、k
off
)的测量通常使用标准化条件和标准化缓冲液进行。本领域技术人员将理解,对于通常检测限内的测量,例如使用biacore 3000或proteon进行亲和力测量的内部误差(测量为标准偏差,sd)通常可以在5-33%内。因此,kd上下文中的术语“约”反映了测定中的通常的标准偏差。例如,1
×
10
−9m的kd的通常的sd最高达 0.33
×
10
−9m。
h2m7780n, h2m7788n, h2m7790n, h2m7791n, h2m7794n, h2m7795n, h2m7796n, h2m7798n, h4h9019p, h4xh9034p2, h4xh9035p2, h4xh9037p2, h4xh9045p2, h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab或其变体;(b)结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体;或(c)纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0143]
如本文所用,关于抗体的术语“其等同物”是指例如与参考抗体具有基本相同的cdr,结合基本相同的表位并具有基本相同的生物学活性的抗体。
[0144]
本文所述的抗pd-1或抗pd-l1抗体或其抗原结合片段的变体在本技术的范围内。例如,变体可以在vh和/或vl中包含1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个或15个氨基酸取代,只要与亲本抗体相比,同源抗体保留或具有改进的功能特性。在一些实施方案中,序列同一性可以是与本技术的vh或vl氨基酸序列相比约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。任选地,变体与亲本抗体相比的任何变化都不在变体的cdr内。
[0145]
还提供了特异性结合pd-1或pd-l1的拮抗性抗体或其抗原结合片段,包括包含hcdr1、hcdr2和hcdr3序列的vh和包含lcdr1、lcdr2和lcdr3序列的vl,其中一个或多个cdr序列包含基于本文所述的抗体的特定氨基酸序列或其保守修饰,并且其中抗体保留本技术的特异性结合pd-1或pd-l1的亲本拮抗性抗体的所需功能特性。
[0146]“保守修饰”是指不显著影响或改变包含氨基酸序列的抗体的结合特性的氨基酸修饰。保守修饰包括氨基酸取代、添加和缺失。保守取代是其中氨基酸被具有相似侧链的氨基酸残基替代的那些。
[0147]
具有相似侧链的氨基酸残基家族已明确定义,包括具有酸性侧链(例如天冬氨酸、谷氨酸)、碱性侧链(例如赖氨酸、精氨酸、组氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸)、不带电荷的极性侧链(例如,甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸、色氨酸)、芳族侧链(例如,苯丙氨酸、色氨酸、组氨酸、酪氨酸)、脂族侧链(例如,甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸)、酰胺(例如,天冬酰胺、谷氨酰胺)、β-支链侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和含硫侧链(半胱氨酸、蛋氨酸)的氨基酸。此外,多肽中的任何天然残基也可以用丙氨酸取代,如先前对丙氨酸扫描诱变所描述的(maclennan等人, acta physiol. scand. suppl. 643:55-67, 1998; sasaki等人, adv. biophys. 35:1-24, 1998)。本技术的抗体的氨基
pol抗原的编码序列可以存在于相同的分离的或非天然存在的核酸分子(dna或rna)中,或存在于两种不同的分离的或非天然存在的核酸分子(dna或rna)中。
[0154]
在本技术的一个实施方案中,组合物包含载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码截短的hbv核心抗原的多核苷酸,所述截短的hbv核心抗原由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成。
[0155]
在本技术的一个实施方案中,组合物包含载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码hbv pol抗原的多核苷酸,所述hbv pol抗原包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列。
[0156]
在本技术的一个实施方案中,组合物包含载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码截短的hbv核心抗原的多核苷酸,所述截短的hbv核心抗原由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成;和载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码hbv pol抗原的多核苷酸,所述hbv pol抗原包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列。包含截短的hbv核心抗原的编码序列的载体和包含hbv pol抗原的编码序列的载体可以是同一载体或两种不同的载体。
[0157]
在本技术的一个实施方案中,组合物包含载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码融合蛋白的多核苷酸,所述融合蛋白包含可操作地连接至hbv pol抗原的截短的hbv核心抗原,所述截短的hbv核心抗原由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成,所述hbv pol抗原包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列,或反之亦然。优选地,所述融合蛋白进一步包含接头,所述接头将截短的hbv核心抗原可操作地连接至hbv pol抗原,或反之亦然。优选地,所述接头具有(alagly)n的氨基酸序列,其中n是2-5的整数。
[0158]
在本技术的一个实施方案中,组合物包含分离的或非天然存在的截短的hbv核心抗原,其由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成。
[0159]
在本技术的一个实施方案中,组合物包含分离的或非天然存在的hbv pol抗原,其包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列。
[0160]
在本技术的一个实施方案中,组合物包含分离的或非天然存在的截短的hbv核心抗原,其由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成;和分离的或非天然存在的hbv pol抗原,其包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列。
[0161]
在本技术的一个实施方案中,组合物包含分离的或非天然存在的融合蛋白,其包含可操作地连接至hbv pol抗原的截短的hbv核心抗原,所述截短的hbv核心抗原由与seq id no: 2或seq id no: 14具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成,所述hbv pol抗原包含与seq id no: 7具有至少90%同一
性、优选地与seq id no: 7具有100%同一性的氨基酸序列,或反之亦然。优选地,所述融合蛋白进一步包含接头,所述接头将截短的hbv核心抗原可操作地连接至hbv pol抗原,或反之亦然。优选地,所述接头具有(alagly)n的氨基酸序列,其中n是2-5的整数。
[0162]
在本技术的一个实施方案中,组合物包含抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0163]
在优选实施方案中,可用于本发明的抗pd-1或抗pd-l1抗体或其片段是纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559或阿特珠单抗(tecentriq, genentech)或其等同物。
[0164]
本技术也涉及包含多核苷酸的治疗组合或试剂盒,所述多核苷酸表达根据本技术的实施方案的截短的hbv核心抗原和hbv pol抗原和/或根据本技术的实施方案的抗pd-1或抗pd-l1抗体或其抗原结合片段。本文描述的本技术的编码hbv核心和pol抗原的任何多核苷酸和/或载体可以用在本技术的治疗组合或试剂盒中,且本文描述的本技术的任何抗pd-1或抗pd-l1抗体或其抗原结合片段可以用在本技术的治疗组合或试剂盒中。
[0165]
根据本技术的实施方案,用于在有此需要的受试者中治疗hbv感染的治疗组合或试剂盒包含:i)以下至少一种:a)截短的hbv核心抗原,其由与seq id no: 2具有至少95%同一性的氨基酸序列组成,和b)第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,c) hbv聚合酶抗原,其具有与seq id no: 7具有至少90%同一性的氨基酸序列,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性,和d)第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列;和ii)抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0166]
在本技术的一个特定实施方案中,治疗组合或试剂盒包含:i)第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述截短的hbv核心抗原由与seq id no: 2具有至少95%同一性的氨基酸序列组成;ii)第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列,所述hbv聚合酶抗原具有与seq id no: 7具有至少90%同一性的氨基酸序列,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性;和iii)抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0167]
根据本技术的实施方案,疫苗组合或试剂盒中的多核苷酸可以连接或分开,使得从这样的多核苷酸表达的hbv抗原融合在一起或产生为分开的蛋白,无论是由相同的还是不同的多核苷酸表达。在一个实施方案中,第一种和第二种多核苷酸存在于分开的载体(例如,dna质粒或病毒载体)中,在相同或分开的组合物中联合使用,使得表达的蛋白也是分开的蛋白,但联合使用。在另一个实施方案中,由第一种和第二种多核苷酸编码的hbv抗原可
id no: 19的cmv启动子序列,增强子序列,优选seq id no: 12的apoai基因片段序列,和编码信号肽序列(优选具有seq id no: 15的氨基酸序列的免疫球蛋白分泌信号)的多核苷酸序列;和可操作地连接至编码hbv抗原的多核苷酸的下游序列,其包含多腺苷酸化信号,优选seq id no: 13的sv40多腺苷酸化信号。
[0173]
当本技术的治疗组合包含第一载体(诸如dna质粒或病毒载体)和第二载体(诸如dna质粒或病毒载体)时,第一和第二载体各自的量没有特别限制。例如,第一种dna质粒和第二种dna质粒可以以10:1至1:10(按重量计)的比例存在,诸如10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9或1:10(按重量计)。优选地,第一种和第二种dna质粒以1:1(按重量计)的比例存在。本技术的治疗组合可以进一步包含第三载体,其编码可用于治疗hbv感染的第三活性剂。
[0174]
本技术的组合物和治疗组合可以包含额外的多核苷酸或载体,其编码额外的hbv抗原和/或额外的hbv抗原或其免疫原性片段,诸如hbsag、hbv l蛋白或hbv包膜蛋白,或编码它们的多核苷酸序列,或根据本技术的实施方案的抗pd-1或抗pd-l1抗体或其抗原结合片段。但是,在特定实施方案中,本技术的组合物和治疗组合不包含某些抗原。
[0175]
在一个特定实施方案中,本技术的组合物或治疗组合或试剂盒不包含hbsag或编码hbsag的多核苷酸序列。
[0176]
在另一个特定实施方案中,本技术的组合物或治疗组合或试剂盒不包含hbv l蛋白或编码hbv l蛋白的多核苷酸序列。
[0177]
在本技术的另一个特定实施方案中,本技术的组合物或治疗组合不包含hbv包膜蛋白或编码hbv包膜蛋白的多核苷酸序列。
[0178]
本技术的组合物和治疗组合还可以包含药学上可接受的载体。药学上可接受的载体是无毒的,且不应干扰活性成分的效力。药学上可接受的载体可以包括一种或多种赋形剂诸如粘合剂、崩解剂、膨胀剂、助悬剂、乳化剂、润湿剂、润滑剂、调味剂、甜味剂、防腐剂、染料、增溶剂和包衣剂。药学上可接受的载体可以包括媒介物,诸如脂质纳米颗粒(lnp)。载体或其它材料的精确性质可取决于施用途径,例如,肌肉内、真皮内、皮下、口服、静脉内、皮肤、粘膜内(例如,肠道)、鼻内或腹膜内途径。对于液体可注射制剂,例如悬浮液和溶液,合适的载体和添加剂包括水、二醇、油、醇、防腐剂、着色剂等。对于固体口服制剂,例如粉剂、胶囊剂、囊片、囊形片和片剂,合适的载体和添加剂包括淀粉、糖、稀释剂、造粒剂、润滑剂、粘合剂、崩解剂等。对于鼻腔喷雾剂/吸入剂混合物,水溶液/悬浮液可以包含水、二醇、油、软化剂、稳定剂、润湿剂、防腐剂、芳族化合物、矫味剂等作为合适的载体和添加剂。
[0179]
可以以适合施用给受试者以促进施用和提高效力的任何方式配制本技术的组合物和治疗组合,包括、但不限于口服(肠内)施用和胃肠外注射。胃肠外注射包括静脉内注射或输注、皮下注射、真皮内注射和肌肉内注射。本技术的组合物也可以配制用于其它施用途径,包括透粘膜、眼部、直肠、长效植入、舌下施用、在舌下、从口腔粘膜绕过门静脉循环、吸入或鼻内。
[0180]
在本技术的一个优选的实施方案中,将本技术的组合物和治疗组合配制用于胃肠外注射,优选皮下、真皮内注射或肌肉内注射,更优选肌肉内注射。
[0181]
根据本技术的实施方案,用于施用的组合物和治疗组合通常包含在药学上可接受的载体中的缓冲溶液,所述载体是例如水性载体诸如缓冲盐水等,例如磷酸盐缓冲盐水
(pbs)。组合物和治疗组合还可以含有接近生理条件所需的药学上可接受的物质,例如ph调节剂和缓冲剂。例如,包含质粒dna的本技术的组合物或治疗组合可以含有磷酸盐缓冲盐水(pbs)作为药学上可接受的载体。质粒dna可以以例如0.5 mg/ml至5 mg/ml的浓度存在,诸如0.5 mg/ml、1mg/ml、2 mg/ml、3 mg/ml、4 mg/ml或5 mg/ml,优选1 mg/ml。
[0182]
根据本领域众所周知的方法,可以将本技术的组合物和治疗组合配制成疫苗(也被称作“免疫原性组合物”)。这样的组合物可以包括佐剂以增强免疫应答。考虑到本公开内容,可以通过本领域技术人员众所周知的技术来确定制剂中每种组分的最佳比例。
[0183]
在本技术的一个特定实施方案中,组合物或治疗组合是dna疫苗。dna疫苗通常包含细菌质粒,所述细菌质粒含有在强真核启动子控制下的编码感兴趣抗原的多核苷酸。一旦质粒被递送到宿主的细胞质中,编码的抗原就被内源性地产生和加工。得到的抗原通常诱导体液和细胞介导的免疫应答。dna疫苗是有利的,至少因为它们提供了改善的安全性,是温度稳定的,可以容易地适应表达抗原变体,并且易于生产。本技术的任何dna质粒均可用于制备这样的dna疫苗。
[0184]
在本技术的其它特定实施方案中,组合物或治疗组合是rna疫苗。rna疫苗通常包含至少一种单链rna分子,其编码感兴趣的抗原,例如根据本技术的融合蛋白或hbv抗原。一旦rna被递送到宿主的细胞质中,编码的抗原就会内源性地产生和加工,从而诱导体液和细胞介导的免疫应答,这类似于dna疫苗。可以对rna序列进行密码子优化以提高翻译效率。考虑到本公开内容,可以通过本领域已知的任意方法修饰rna分子以增强稳定性和/或翻译,例如通过添加聚腺苷酸尾巴,例如至少30个腺苷残基;和/或用修饰的核糖核苷酸(例如,7-甲基鸟苷帽)给5-末端加帽,其可以在rna合成过程中掺入或在rna转录后进行酶工程改造。rna疫苗也可以是从甲病毒属表达载体开发的自复制的rna疫苗。自复制rna疫苗包含复制酶rna分子,该分子衍生自属于甲病毒科的病毒,其亚基因组启动子控制融合蛋白或hbv抗原rna的复制,随后是位于复制酶下游的人工聚腺苷酸尾巴。
[0185]
在某些实施方案中,其它佐剂可以被包含在本技术的组合物或治疗组合中,或与本技术的组合物或治疗组合共同施用。另一种佐剂的使用是任选的,并且当组合物用于疫苗接种目的时可以进一步增强免疫应答。适合于根据本技术共同施用或包含在组合物中的其它佐剂应优选地是这样的:其为在人类中潜在安全的、较好耐受的和有效的。佐剂可以是小分子或抗体,包括、但不限于,免疫检查点抑制剂(例如,抗-pd-1、抗-tim-3等)、toll-样受体激动剂(例如,tlr7激动剂和/或tlr8激动剂)、rig-1激动剂、il-15超激动剂(altor bioscience)、突变体irf3和irf7遗传佐剂、sting激动剂(aduro)、flt3l遗传佐剂和il-7-hyfc。例如,佐剂可以例如选自下述抗-hbv剂:hbv dna聚合酶抑制剂;免疫调节剂;toll-样受体7调节剂;toll-样受体8调节剂;toll-样受体3调节剂;干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;toll样受体9调节剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;靶向病毒mrna的反义寡核苷酸,更特别是抗-hbv反义寡核苷酸;短干扰rna (sirna),更特别是抗-hbv sirna;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒的表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,诸如il12;衣壳组装调节剂, 核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸可诱导基因1的刺激物;nod2的刺激物;重组胸腺素α-1;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;
免疫检查点抑制剂,诸如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂、ctla-4抑制剂;在免疫细胞(更具体地t细胞)上表达的共刺激性受体诸如cd27和cd28的激动剂;btk抑制剂;用于治疗hbv的其它药物;ido抑制剂;精氨酸酶抑制剂;和kdm5抑制剂。
[0186]
在某些实施方案中,第一种和第二种非天然存在的核酸分子中的每一种独立地用脂质纳米颗粒(lnp)配制。
[0187]
本技术也提供了制备本技术的组合物和治疗组合的方法。生产组合物或治疗组合的方法包括将本技术的编码hbv抗原、载体和/或多肽的分离的多核苷酸与一种或多种药学上可接受的载体混合。本领域普通技术人员熟悉用于制备这样的组合物的常规技术。
[0188]
诱导免疫应答或治疗hbv感染的方法本技术也提供了在有此需要的受试者中诱导针对乙型肝炎病毒(hbv)的免疫应答的方法,所述方法包括给所述受试者施用免疫原性上有效量的本技术的组合物或免疫原性组合物。本文描述的本技术的组合物和治疗组合中的任一种可以用在本技术的方法中。
[0189]
本文中使用的术语“感染”表示病原体侵入宿主。当病原体能够侵入宿主并在宿主内复制或繁殖时,它被认为是“传染性的”。传染因子的例子包括病毒,例如hbv和某些种类的腺病毒、朊病毒、细菌、真菌、原生动物等。“hbv感染”特别表示hbv侵入宿主生物体,诸如宿主生物体的细胞和组织。
[0190]
在参考本文所述的方法使用时,短语“诱导免疫应答”涵盖在有此需要的受试者中引起针对感染(例如,hbv感染)的期望免疫应答或效果。“诱导免疫应答”也涵盖提供治疗性免疫以治疗致病体,例如,hbv。本文中使用的术语“治疗性免疫”或“治疗性免疫应答”是指,接种疫苗的受试者能够控制疫苗接种所针对的致病体的感染,例如通过接种hbv疫苗赋予的针对hbv感染的免疫。在一个实施方案中,“诱导免疫应答”是指在有此需要的受试者中产生免疫,例如,以提供针对疾病诸如hbv感染的治疗效果。在某些实施方案中,“诱导免疫应答”表示引起或改善针对hbv感染的细胞免疫,例如,t细胞应答。在某些实施方案中,“诱导免疫应答”表示引起或改善针对hbv感染的体液免疫应答。在某些实施方案中,“诱导免疫应答”表示引起或改善针对hbv感染的细胞和体液免疫应答。
[0191]
本文中使用的术语“保护性免疫”或“保护性免疫应答”是指,接种疫苗的受试者能够控制疫苗接种所针对的致病体的感染。通常,已经产生“保护性免疫应答”的受试者仅出现轻度至中度临床症状或根本不出现症状。通常,具有针对某种病原体的“保护性免疫应答”或“保护性免疫”的受试者不会因所述病原体的感染而死亡。
[0192]
通常,本技术的组合物和治疗组合的施用将具有治疗目的,以在hbv感染后或出现hbv感染的特征性症状后产生针对hbv的免疫应答,例如用于治疗性疫苗接种。
[0193]
本文中使用的“免疫原性上有效量”或“免疫学上有效量”是指,足以在有此需要的受试者中诱导期望的免疫效果或免疫应答的组合物、多核苷酸、载体或抗原的量。免疫原性上有效量可以是足以在有此需要的受试者中诱导免疫应答的量。免疫原性上有效量可以是足以在有此需要的受试者中产生免疫的量,例如提供针对疾病诸如hbv感染的治疗效果。免疫原性上有效量可以根据多种因素而变化,诸如受试者的身体状况、年龄、重量、健康等;特定应用,例如提供保护性免疫或治疗性免疫;以及免疫期望针对的特定疾病,例如病毒感染。考虑到本公开内容,免疫原性上有效量可以由本领域普通技术人员容易地确定。
[0194]
在本技术的特定实施方案中,免疫原性上有效量表示足以实现以下效果中的一
种、两种、三种、四种或更多种的组合物或治疗组合的量:(i)降低或改善hbv感染或与之相关的症状的严重程度;(ii)减少hbv感染或与之相关的症状的持续时间;(iii)防止hbv感染或与之相关的症状的进展;(iv)造成hbv感染或与之相关的症状的消退;(v)预防hbv感染或与之相关的症状的发展或发作;(vi)防止hbv感染或与之相关的症状的复发;(vii)减少具有hbv感染的受试者的住院治疗;(viii)减少具有hbv感染的受试者的住院治疗长度;(ix)提高具有hbv感染的受试者的存活率;(x)消除受试者中的hbv感染;(xi)抑制或减少受试者中的hbv复制;和/或(xii)增强或改善另一种疗法的预防或治疗效果。
[0195]
免疫原性上有效量也可以是这样的量,其足以降低与临床血清转化进化一致的hbsag水平;实现受试者的免疫系统对与被感染的肝细胞的减少相关的持续hbsag清除;诱导hbv-抗原特异性的活化的t-细胞群体;和/或在12个月内实现hbsag持续消失。目标指数的例子包括低于500个hbsag国际单位(iu)拷贝的阈值的较低hbsag和/或较高cd8计数。
[0196]
作为一般指导,当参考dna质粒使用时,免疫原性上有效量可以在约0.1 mg/ml至10 mg/ml总dna质粒的范围内,诸如0.1 mg/ml、0.25 mg/ml、0.5 mg/ml. 0.75 mg/ml 1 mg/ml、1.5 mg/ml、2 mg/ml、3 mg/ml、4 mg/ml、5 mg/ml、6 mg/ml、7 mg/ml、8 mg/ml、9 mg/ml或10 mg/ml。优选地,dna质粒的免疫原性上有效量小于8 mg/ml,更优选地小于6 mg/ml,甚至更优选地3-4 mg/ml。免疫原性上有效量可以来自一种载体或质粒,或来自多种载体或质粒。作为进一步的一般指导,当参考肽使用时,免疫原性上有效量可以在每次施用约10
µ
g至1 mg的范围内,诸如每次施用10、20、50、100、200、300、400、500、600、700、800、9000或1000
µ
g。免疫原性上有效量可以在单一组合物中或在多个组合物中施用,诸如1、2、3、4、5、6、7、8、9或10个组合物(例如,片剂、胶囊剂或注射剂,或适用于真皮内递送的任何组合物,例如,适用于使用真皮内递送贴剂的真皮内递送),其中多个胶囊剂或注射剂的施用共同为受试者提供免疫原性上有效量。例如,当使用两种dna质粒时,免疫原性上有效量可以是3-4 mg/ml,其中每种质粒为1.5-2 mg/ml。在所谓的初免-强化方案中,也可能给受试者施用免疫原性上有效量,并随后给同一受试者施用免疫原性上有效量的另一个剂量。初免-强化方案的这种一般概念是疫苗领域的技术人员众所周知的。如果需要,可以任选地将进一步强化施用添加到该方案中。
[0197]
通过混合两种质粒并将混合物递送至单个解剖学部位,可以将包含两种dna质粒(例如,编码hbv核心抗原的第一种dna质粒和编码hbv pol抗原的第二种dna质粒)的治疗组合施用给受试者。可替换地,可以进行两次分开的免疫接种,每次递送单一表达质粒。在这样的实施方案中,无论两种质粒在单次免疫接种中还是作为两次分开免疫接种的混合物施用,第一种dna质粒和第二种dna质粒都可以以10:1至1:10(按重量计)的比例施用,诸如10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9或1:10(按重量计)。优选地,第一种和第二种dna质粒以1:1(按重量计)的比例施用。
[0198]
作为一般指导,当参考抗pd-1或抗pd-l1抗体或其抗原结合片段使用时,免疫原性上有效量可以在约0.005 mg/kg至约100 mg/kg的范围内,例如约0.05 mg/kg至约30 mg/kg或约5 mg/kg至约25 mg/kg,或约4 mg/kg,约8 mg/kg,约16mg/kg或约24 mg/kg,或例如约1, 2, 3, 4, 5, 6, 7, 8, 9或10 mg/kg,但可以甚至更高,例如约15、16、17、18、19、20、21、22、23、24、25、30、40、50、60、70、80、90或100 mg/kg。也可以施用固定的单位剂量,例如50、100、200、500或1000 mg,或者剂量可以基于患者的表面积,例如,500、400、300、250、200
或100 mg/m2。通常可以施用1至8个(例如,1、2、3、4、5、6、7或8个)剂量来治疗患者,但可以施用9、10、11、12、13、14、15、16、17、18、19、20个或更多个剂量。
[0199]
可以在一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间以后重复本技术的抗体或其抗原结合片段的施用。重复的疗程也是可能的,慢性施用也是如此。重复的施用可以是在相同剂量或在不同剂量。例如,本技术的抗体或其抗原结合片段可以8mg/kg或16mg/kg每周间隔施用8周,然后以8mg/kg或16mg/kg每两周施用再持续16周,然后通过静脉输注以8mg/kg或16mg/kg每4周施用。例如,本技术的抗体或其抗原结合片段可以以约0.1-100mg/kg的量的每日剂量提供,例如0.5, 0.9, 1.0, 1.1, 1.5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90或100 mg/kg每天,在治疗开始后第1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39或40天中的至少一天,或者第1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19或20周中的至少一周提供,或其组合,使用每24、12、8、6、4或2小时的单次或分次剂量,或其任何组合。
[0200]
优选地,要根据本技术的方法治疗的受试者是hbv感染的受试者,特别是具有慢性hbv感染的受试者。急性hbv感染的特征是先天免疫系统的有效激活,并辅以随后的广泛适应性应答(例如,hbv-特异性的t-细胞、中和抗体),这通常导致复制的成功抑制或受感染的肝细胞的除去。相反,由于高病毒和抗原载量,这样的应答会受损或减弱,例如,大量产生hbv包膜蛋白,并且可以相对感染性病毒以1,000倍过量以亚病毒颗粒形式释放。
[0201]
以特征在于病毒载量、肝酶水平(坏死性炎症活动)、hbeag或hbsag载量或针对这些抗原的抗体的存在的阶段来描述慢性hbv感染。cccdna水平保持相对稳定在每个细胞大约10到50个拷贝,即使病毒血症可以有很大差异。cccdna物质的持续存在导致慢性化。更具体地,慢性hbv感染的阶段包括:(i)以高病毒载量和正常或轻微升高的肝酶为特征的免疫耐受阶段;(ii)免疫激活hbeag阳性阶段,其中观察到病毒复制水平降低或下降和肝酶显著升高;(iii)非活动性hbsag携带期,这是一种低复制状态,具有低病毒载量和血清中正常的肝酶水平,可能在hbeag血清转化之后;和(iv) hbeag阴性阶段,其中病毒复制周期性地发生(重新激活),伴随肝酶水平的波动,前核心和/或基础核心启动子中的突变是常见的,因此受感染的细胞不会产生hbeag。
[0202]
本文中使用的“慢性hbv感染”表示受试者具有可检测的hbv存在超过6个月。具有慢性hbv感染的受试者可以处于慢性hbv感染的任何阶段。慢性hbv感染按照其在本领域中的普通含义来理解。慢性hbv感染可以例如特征在于,在急性hbv感染后hbsag持续存在6个月或更长。例如,本文所提及的慢性hbv感染遵循疾病控制和预防中心(cdc)公布的定义,根据该定义,慢性hbv感染可以通过实验室标准表征,例如:(i)针对乙型肝炎核心抗原的igm抗体(igm抗-hbc)为阴性,且乙型肝炎表面抗原(hbsag)、乙型肝炎e抗原(hbeag)、或关于乙型肝炎病毒dna的核酸检验为阳性,或(ii) hbsag或关于hbv dna的核酸检验为阳性,或hbeag为阳性2次间隔至少6个月。
[0203]
优选地,免疫原性上有效量表示足以治疗慢性hbv感染的本技术的组合物或治疗组合的量。
[0204]
在某些实施方案中,具有慢性hbv感染的受试者正在接受核苷类似物(nuc)治疗,并且是nuc抑制的。本文中使用的“nuc抑制的”表示受试者具有不可检测的hbv病毒水平和稳定的丙氨酸氨基转移酶(alt)水平至少六个月。核苷/核苷酸类似物治疗的例子包括hbv聚合酶抑制剂,诸如恩替卡韦和替诺福韦。优选地,具有慢性hbv感染的受试者不具有晚期肝纤维化或肝硬化。这样的受试者通常具有小于3的关于纤维化的metavir评分和小于9 kpa的纤维扫描结果。metavir评分是一种评分系统,其常用于在乙型肝炎患者的肝活组织检查中通过组织病理学评价来评估炎症和纤维化的程度。评分系统分配两个标准化数字:一个反映炎症程度,一个反映纤维化程度。
[0205]
据信,慢性hbv的消除或减少可能允许严重肝病的早期疾病拦截,包括病毒诱导的肝硬化和肝细胞癌。因此,本技术的方法也可以用作治疗hbv诱导的疾病的疗法。hbv诱导的疾病的例子包括、但不限于肝硬化、癌症(例如,肝细胞癌)和纤维化,特别是特征在于关于纤维化的metavir评分为3或更高的晚期纤维化。在这样的实施方案中,免疫原性上有效量是足以在12个月内实现hbsag的持续消失并显著减少临床疾病(例如,肝硬化、肝细胞癌等)的量。
[0206]
根据本技术的实施方案的方法进一步包括与本技术的组合物联合地给有此需要的受试者施用另一种免疫原性药剂(诸如另一种hbv抗原或其它抗原)或另一种抗-hbv药剂(诸如核苷类似物或其它抗-hbv药剂)。例如,另一种抗-hbv药剂或免疫原性药剂可以是小分子或抗体,包括、但不限于,免疫检查点抑制剂(例如,抗-pd-1、抗-tim-3等),toll-样受体激动剂(例如,tlr7激动剂和/或tlr8激动剂), rig-1激动剂, il-15超激动剂(altor bioscience), 突变体irf3和irf7遗传佐剂, sting激动剂(aduro), flt3l遗传佐剂, il12遗传佐剂, il-7-hyfc;结合hbv包膜的car-t (s-car细胞);衣壳组装调节剂;cccdna抑制剂, hbv聚合酶抑制剂(例如,恩替卡韦和替诺福韦)。一种或其它抗-hbv活性剂可以是,例如,小分子、抗体或其抗原结合片段、多肽、蛋白或核酸。一种或其它抗-hbv药剂可以例如选自:hbv dna聚合酶抑制剂;免疫调节剂;toll-样受体7调节剂;toll-样受体8调节剂;toll-样受体3调节剂;干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;toll样受体9调节剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;靶向病毒mrna的反义寡核苷酸,更特别是抗-hbv反义寡核苷酸;短干扰rna (sirna),更特别是抗-hbv sirna;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒的表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,诸如il12;衣壳组装调节剂, 核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸可诱导基因1的刺激物;nod2的刺激物;重组胸腺素α-1;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,诸如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂和ctla-4抑制剂;在免疫细胞(更具体地t细胞)上表达的共刺激性受体诸如cd27、cd28的激动剂;btk抑制剂;用于治疗hbv的其它药物;ido抑制剂;精氨酸酶抑制剂;和kdm5抑制剂。
[0207]
递送的方法考虑到本公开内容,通过本领域已知的任意方法,包括、但不限于,胃肠外施用(例如,肌肉内、皮下、静脉内或真皮内注射)、口服施用、透皮施用和鼻施用,可以将本技术的组合物和治疗组合施用给受试者。优选地,胃肠外地(例如,通过肌肉内注射或真皮内注射)或
透皮地施用组合物和治疗组合。
[0208]
在其中组合物或治疗组合包含一种或多种dna质粒的本技术的某些实施方案中,施用可以是通过皮肤注射,例如肌肉内或真皮内注射,优选肌肉内注射。肌肉内注射可以与电穿孔组合,即施加电场以促进dna质粒向细胞的递送。本文中使用的术语“电穿孔”表示使用跨膜电场脉冲在生物膜中诱导微观通路(孔)。在体内电穿孔过程中,对细胞施加适当大小和持续时间的电场,诱导增强的细胞膜渗透性的瞬时状态,从而实现不能自行穿过细胞膜的分子的细胞摄取。通过电穿孔产生这样的孔有利于生物分子(诸如质粒、寡核苷酸、sirna、药物等)从细胞膜的一侧向另一侧的通过。用于递送dna疫苗的体内电穿孔已经被证实显著增加宿主细胞的质粒摄取,同时还会导致在注射部位处的轻度至中度炎症。因此,与常规注射相比,真皮内或肌肉内电穿孔显著改善了转染效率和免疫应答(例如,分别高达1,000倍和100倍)。
[0209]
在一个典型的实施方案中,将电穿孔与肌肉内注射相组合。但是,也可能将电穿孔与其它形式的胃肠外施用(例如,真皮内注射、皮下注射等)相组合。
[0210]
可以使用电穿孔装置完成通过电穿孔对本技术的组合物、治疗组合或疫苗的施用,所述电穿孔装置可以被构造成向哺乳动物的所需组织递送有效造成可逆孔在细胞膜中形成的能量脉冲。电穿孔装置可以包括电穿孔部件和电极组件或手柄组件。电穿孔组件可以包括电穿孔装置的以下组件中的一种或多种:控制器、电流波形发生器、阻抗测试仪、波形记录器、输入元件、状态报告元件、通信端口、存储器组件、电源和电源开关。可以使用体内电穿孔装置完成电穿孔。电穿孔装置的例子和可以促进本技术的组合物和治疗组合(特别是包含dna质粒的那些)的递送的电穿孔方法包括cellectra
®
(inovio pharmaceuticals, blue bell, pa)、elgen电穿孔仪(inovio pharmaceuticals, inc.)、tri-gridtm递送系统(ichor medical systems, inc., san diego, ca 92121)和在美国专利号7,664,545、美国专利号8,209,006、美国专利号9,452,285、美国专利号5,273,525、美国专利号6,110,161、美国专利号6,261,281、美国专利号6,958,060,和美国专利号6,939,862、美国专利号7,328,064、美国专利号6,041,252、美国专利号5,873,849、美国专利号6,278,895、美国专利号6,319,901、美国专利号6,912,417、美国专利号8,187,249、美国专利号9,364,664、美国专利号9,802,035、美国专利号6,117,660,和国际专利申请公开wo2017172838中描述的那些,它们都通过引用整体并入本文。体内电穿孔装置的其它例子描述在标题为“method and apparatus for the delivery of hepatitis b virus (hbv) vaccines”的国际专利申请中,其以代理人案卷号688097-405wo与本技术在同一天提交,其内容特此通过引用整体并入。用于递送本技术的组合物和治疗组合的应用还考虑使用脉冲电场,例如如在例如美国专利号6,697,669中所描述,其通过引用整体并入本文。
[0211]
在其中组合物或治疗组合包含一种或多种dna质粒的本技术的其它实施方案中,施用方法是透皮施用。透皮施用可以与表皮皮肤磨损相组合以促进dna质粒向细胞的递送。例如,皮肤病学贴剂可用于表皮皮肤磨损。在除去皮肤病学贴剂后,组合物或治疗组合可以沉积在磨损的皮肤上。
[0212]
递送方法不限于上述实施方案,并且可以使用用于细胞内递送的任何方式。本技术的方法考虑的其它细胞内递送方法包括、但不限于脂质体包封、脂质纳米颗粒(lnp)等。
[0213]
在本技术的某些实施方案中,施用方法是脂质组合物,例如脂质纳米颗粒(lnp)。
可用于递送治疗产品(例如本发明的一种或多种核酸分子)的脂质组合物,优选脂质纳米颗粒包括但不限于脂质体或脂质囊泡,其中水体积由两亲脂质双层包封,或其中脂质包覆包含治疗产品的内部;或脂质聚集体或胶束,其中脂质包封的治疗产品包含在相对无序的脂质混合物中。
[0214]
在特定实施方案中,lnp包含阳离子脂质以包封和/或增强核酸分子例如本发明的dna或rna分子递送到靶细胞中。阳离子脂质可以是在选定的ph例如生理ph下携带净正电荷的任何脂质种类。脂质纳米颗粒可以通过包括使用一种或多种阳离子脂质、非阳离子脂质和聚乙二醇(peg)修饰的脂质的不同比例的多组分脂质混合物来制备。文献中已经描述了几种阳离子脂质,其中许多是可商购的。例如,用于本发明的组合物和方法的合适的阳离子脂质包括1,2-二油酰基-3-三甲基铵-丙烷(dotap)。
[0215]
lnp制剂可以包括阴离子脂质。阴离子脂质可以是在选定的ph例如生理ph下携带净负电荷的任何脂质种类。阴离子脂质与阳离子脂质结合时,用于降低lnp的整体表面电荷,并引入lnp双层结构的ph依赖性破坏,促进核苷酸释放。文献中已经描述了几种阴离子脂质,其中许多是可商购的。例如,用于本发明的组合物和方法的合适的阴离子脂质包括1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)。
[0216]
可以使用本领域熟知的方法并参考本公开制备lnp。例如,可以使用乙醇注射或稀释、薄膜水合、冻融、法压壶(french press)或膜挤出、渗滤、超声、去污剂透析、醚注入和反相蒸发制备lnp。
[0217]
脂质、脂质组合物和产生用于递送活性核酸分子(例如本发明的那些)的脂质载体的方法的一些实例描述于:us2017/0190661, us2006/0008910, us2015/0064242, us2005/0064595, wo/2019/036030, us2019/0022247, wo/2019/036028, wo/2019/036008, wo/2019/036000, us2016/0376224, us2017/0119904, wo/2018/200943, wo/2018/191657, us2014/0255472和us2013/0195968,其各自相关内容通过引用整体并入本文。
[0218]
本技术的抗pd-1或抗pd-l1抗体或其抗原结合片段可以通过任何合适的途径施用给受试者,例如通过静脉内(i.v.)输注或快速推注胃肠外地,肌肉内地或皮下地或腹膜内地。可以在例如15、30、60、90、120、180或240分钟或1、2、3、4、5、6、7、8、9、10、11或12小时中进行静脉内输注。
[0219]
佐剂在本技术的某些实施方案中,诱导针对hbv的免疫应答的方法进一步包括施用佐剂。术语“佐剂”和“免疫刺激剂”在本文中可互换地使用,并被定义为一种或多种造成免疫系统刺激的物质。在该背景下,佐剂用于增强对本技术的hbv抗原和抗原性hbv多肽的免疫应答。
[0220]
根据本技术的实施方案,佐剂可存在于本技术的治疗组合或组合物中,或在分开的组合物中施用。佐剂可以是例如小分子或抗体。适用于本技术的佐剂的例子包括、但不限于:免疫检查点抑制剂(例如,抗-pd-1、抗-tim-3等),toll-样受体激动剂(例如,tlr7和/或tlr8激动剂),rig-1激动剂,il-15超激动剂(altor bioscience),突变体irf3和irf7遗传佐剂,sting激动剂(aduro),flt3l遗传佐剂,il12遗传佐剂,和il-7-hyfc。佐剂的例子可以例如选自下述抗-hbv药剂:hbv dna聚合酶抑制剂;免疫调节剂;toll-样受体7调节剂;
toll-样受体8调节剂;toll-样受体3调节剂;干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;toll样受体9调节剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;靶向病毒mrna的反义寡核苷酸,更特别是抗-hbv反义寡核苷酸;短干扰rna (sirna),更特别是抗-hbv sirna;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒的表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,诸如il12;衣壳组装调节剂,核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸可诱导基因1的刺激物;nod2的刺激物;重组胸腺素α-1;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,诸如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂和ctla-4抑制剂;在免疫细胞(更具体地t细胞)上表达的共刺激性受体,诸如cd27、cd28的激动剂;btk抑制剂;用于治疗hbv的其它药物;ido抑制剂;精氨酸酶抑制剂;和kdm5抑制剂。
[0221]
本技术的组合物和治疗组合还可以与至少一种其它抗-hbv药剂联合施用。适用于本技术的抗-hbv药剂的例子包括、但不限于结合hbv包膜的小分子、抗体和/或car-t疗法(s-car细胞)、衣壳组装调节剂、tlr激动剂(例如,tlr7和/或tlr8激动剂)、cccdna抑制剂、hbv聚合酶抑制剂(例如,恩替卡韦和替诺福韦)和/或免疫检查点抑制剂等。
[0222]
至少一种抗-hbv药剂可以例如选自:hbv dna聚合酶抑制剂;免疫调节剂;toll-样受体7调节剂;toll-样受体8调节剂;toll-样受体3调节剂;干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;toll样受体9调节剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;靶向病毒mrna的反义寡核苷酸,更特别是抗-hbv反义寡核苷酸;短干扰rna (sirna),更特别是抗-hbv sirna;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒的表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,诸如il12;衣壳组装调节剂, 核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸可诱导基因1的刺激物;nod2的刺激物;重组胸腺素α-1;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,诸如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂和ctla-4抑制剂;在免疫细胞(更具体地t细胞)上表达的共刺激性受体诸如cd27、cd28的激动剂;btk抑制剂;用于治疗hbv的其它药物;ido抑制剂;精氨酸酶抑制剂;和kdm5抑制剂。这样的抗-hbv药剂可以与本技术的组合物和治疗组合同时或依次施用。
[0223]
初免/强化免疫接种的方法本技术的实施方案也涵盖在所谓的初免-强化方案中给受试者施用免疫原性上有效量的组合物或治疗组合,并随后给同一受试者施用免疫原性上有效量的组合物或治疗组合的另一剂量。因此,在一个实施方案中,本技术的组合物或治疗组合是用于初始引发免疫应答的初免疫苗。在另一个实施方案中,本技术的组合物或治疗组合是用于强化免疫应答的强化疫苗。本技术的初免和强化疫苗可以用在本文描述的本技术的方法中。初免-强化方案的这种一般概念是疫苗领域的技术人员众所周知的。本文描述的本技术的组合物和治疗组合中的任一种可以用作初免和/或强化疫苗以初始引发和/或强化针对hbv的免疫应答。
[0224]
在本技术的某些实施方案中,可以施用本技术的组合物或治疗组合以进行初免免疫接种。可以重新施用组合物或治疗组合以进行强化免疫接种。如果需要,可以任选地将组合物或疫苗组合的进一步强化施用添加到方案中。佐剂可以存在于用于强化免疫接种的本
申请的组合物中,存在于要与本技术的组合物或治疗组合一起施用以进行强化免疫接种的分开的组合物中,或作为强化免疫接种单独施用。在其中在方案中包括佐剂的那些实施方案中,佐剂优选地用于强化免疫接种。
[0225]
初免-强化方案的示例性和非限制性例子包括给受试者施用单剂量的免疫原性上有效量的本技术的组合物或治疗组合以初始引发免疫应答;并且随后施用免疫原性上有效量的本技术的组合物或治疗组合的另一个剂量以强化免疫应答,其中在最初施用初免免疫接种后约2至6周,优选4周,首次施用强化免疫接种。任选地,在最初施用初免免疫接种后约10-14周,优选12周,施用组合物或治疗组合或其它佐剂的进一步强化免疫接种。
[0226]
试剂盒本文还提供了试剂盒,其包含本技术的治疗组合。试剂盒可以包含在一种或多种分开的组合物中的第一种多核苷酸、第二种多核苷酸和抗pd-1或抗pd-l1抗体或其抗原结合片段,或者试剂盒可以包含在单一组合物中的第一种多核苷酸、第二种多核苷酸和抗pd-1或抗pd-l1抗体或其抗原结合片段。试剂盒可以进一步包含一种或多种佐剂或免疫刺激剂和/或其它抗-hbv药剂。
[0227]
使用本领域中标准的多种测定可以在体外或在体内评价在动物或人生物体中施用后诱导或刺激抗-hbv免疫应答的能力。关于可用于评价免疫应答的发生和激活的技术的一般描述,参见例如coligan等人(1992和1994, current protocols in immunology; j wiley & sons inc编辑, national institute of health)。细胞免疫的测量可以如下进行:通过测量活化的效应细胞分泌的细胞因子谱,所述细胞因子包括源自cd4 和cd8 t-细胞的那些(例如通过elispot定量产生il-10或ifnγ的细胞),通过确定免疫效应细胞的激活状态(例如通过经典的[3h]胸苷摄取的t细胞增殖测定或基于流式细胞计量术的测定),通过测定致敏受试者中的抗原特异性的t淋巴细胞(例如在细胞毒性测定中的肽特异性裂解等)。
[0228]
通过抗体结合和/或结合竞争可以确定刺激细胞和/或体液应答的能力(参见例如harlow, 1989, antibodies, cold spring harbor press)。例如,通过酶联免疫吸附测定(elisa),可以测量响应于提供免疫原的组合物的施用而产生的抗体的滴度。也可以通过中和抗体测定来测量免疫应答,其中病毒的中和被定义为通过病毒与特异性抗体的反应/抑制/中和而丧失侵染性。通过抗体依赖性的细胞吞噬作用(adcp)测定可以进一步测量免疫应答。
[0229]
实施方案本发明也提供了下述非限制性的实施方案。
[0230]
实施方案1是用于在有此需要的受试者中治疗乙型肝炎病毒(hbv)感染的治疗组合,其包含:i)以下至少一种:a) 截短的hbv核心抗原,其由与seq id no: 2具有至少95%(诸如至少95%、96%、97%、98%、99%或100%)同一性的氨基酸序列组成,b) 第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列c) hbv聚合酶抗原,其氨基酸序列与seq id no: 7具有至少90%(诸如至少90%、
91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性,和d) 第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列;和ii)抗pd-1或抗pd-l1抗体或其抗原结合片段,优选选自:a)17d8, 2d3, 4h1, 5c4, 4a11, 7d3, 5f4, h409a11, hpd-1.08a, hpd-1.09a, 109a-h, k09a-l-11, k09a-l-16, k09a-l-17, 409a-h, h1m7789n, h1m7799n, h1m7800n, h2m7780n, h2m7788n, h2m7790n, h2m7791n, h2m7794n, h2m7795n, h2m7796n, h2m7798n, h4h9019p, h4xh9034p2, h4xh9035p2, h4xh9037p2, h4xh9045p2, h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab, 及其变体;b)结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体;和c)纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0231]
实施方案2是实施方案1的治疗组合,其包含hbv聚合酶抗原和截短的hbv核心抗原中的至少一种。
[0232]
实施方案3是实施方案2的治疗组合,其包含hbv聚合酶抗原和截短的hbv核心抗原。
[0233]
实施方案4是实施方案1的治疗组合,其包含第一种非天然存在的核酸分子和第二种非天然存在的核酸分子中的至少一种,所述第一种非天然存在的核酸分子包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述第二种非天然存在的核酸分子包含编码hbv聚合酶抗原的第二种多核苷酸序列。
[0234]
实施方案5是用于在有此需要的受试者中治疗乙型肝炎病毒(hbv)感染的治疗组合,其包含i) 第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述截短的hbv核心抗原由与seq id no: 2具有至少95%同一性的氨基酸序列组成;和ii) 第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列,所述hbv聚合酶抗原具有与seq id no: 7具有至少90%同一性的氨基酸序列,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性;和
iii) 抗pd-1或抗pd-l1抗体或其抗原结合片段,优选选自:a)17d8, 2d3, 4h1, 5c4, 4a11, 7d3, 5f4, h409a11, hpd-1.08a, hpd-1.09a, 109a-h, k09a-l-11, k09a-l-16, k09a-l-17, 409a-h, h1m7789n, h1m7799n, h1m7800n, h2m7780n, h2m7788n, h2m7790n, h2m7791n, h2m7794n, h2m7795n, h2m7796n, h2m7798n, h4h9019p, h4xh9034p2, h4xh9035p2, h4xh9037p2, h4xh9045p2, h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab, 及其变体;b)结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体;和c)纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0235]
实施方案6是实施方案4或5的治疗组合,其中所述第一种非天然存在的核酸分子进一步包含编码信号序列的多核苷酸序列,所述信号序列可操作地连接至截短的hbv核心抗原的n-端。
[0236]
实施方案6a是实施方案4-6中的任一个的治疗组合,其中所述第二种非天然存在的核酸分子进一步包含编码信号序列的多核苷酸序列,所述信号序列可操作地连接至hbv聚合酶抗原的n-端。
[0237]
实施方案6b是实施方案6或6a的治疗组合,其中所述信号序列独立地包含seq id no: 9或seq id no: 15的氨基酸序列。
[0238]
实施方案6c是实施方案6或6a的治疗组合,其中所述信号序列独立地由seq id no: 8或seq id no: 14的多核苷酸序列编码。
[0239]
实施方案7是实施方案1-6c中的任一个的治疗组合,其中所述hbv聚合酶抗原包含与seq id no: 7具有至少98%(诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列。
[0240]
实施方案7a是实施方案7的治疗组合,其中所述hbv聚合酶抗原包含seq id no: 7的氨基酸序列。
[0241]
实施方案7b是实施方案1-7a中的任一个的治疗组合,其中所述截短的hbv核心抗原由与seq id no: 2具有至少98%(诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列组成。
[0242]
实施方案7c是实施方案7b的治疗组合,其中所述截短的hbv抗原由seq id no: 2或seq id no: 4的氨基酸序列组成。
h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab或其变体。
[0260]
实施方案15a是实施方案1-14中的任一个的治疗组合,其中抗pd-1或抗pd-ll抗体或其片段是结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体。
[0261]
实施方案15b是实施方案1-14中的任一个的治疗组合,其中抗pd-1或抗pd-ll抗体或其片段是纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0262]
实施方案16是试剂盒,其包含实施方案1-15b中的任一个的治疗组合,和关于使用所述治疗组合在有此需要的受试者中治疗乙型肝炎病毒(hbv)感染的说明书。
[0263]
实施方案17是在有此需要的受试者中治疗乙型肝炎病毒(hbv)感染的方法,所述方法包括给所述受试者施用实施方案1-15b中的任一个的治疗组合。
[0264]
实施方案17a是实施方案17的方法,其中所述治疗在有此需要的受试者中诱导针对乙型肝炎病毒的免疫应答,优选地所述受试者具有慢性hbv感染。
[0265]
实施方案17b是实施方案17或17a的方法,其中所述受试者具有慢性hbv感染。
[0266]
实施方案17c是实施方案17-17b中的任一个的方法,其中所述受试者需要治疗选自晚期纤维化、肝硬化和肝细胞癌(hcc)的hbv诱导的疾病。
[0267]
实施方案18是实施方案17-17c中的任一个的方法,其中通过经皮肤注射,例如,肌肉内或真皮内注射,优选肌肉内注射,施用所述治疗组合。
[0268]
实施方案19是实施方案18的方法,其中所述治疗组合包含第一种和第二种非天然存在的核酸分子中的至少一种。
[0269]
实施方案19a是实施方案19的方法,其中所述治疗组合包含第一种和第二种非天然存在的核酸分子。
[0270]
实施方案20是实施方案19或19a的方法,其中通过与电穿孔联合的肌肉内注射将所述非天然存在的核酸分子施用给所述受试者。
[0271]
实施方案21是实施方案19或19a的方法,其中通过脂质组合物,优选地通过脂质纳米颗粒,将所述非天然存在的核酸分子施用给所述受试者。
实施例
[0272]
本领域技术人员将理解,可以对上述实施方案做出变化,而不脱离其广泛发明概念。因此,应当理解,本发明不限于公开的特定实施方案,而是意图涵盖在由本说明书定义
的本发明的精神和范围内的修改。
[0273]
实施例1. hbv核心质粒和hbv pol质粒pdk-pol和pdk-core载体的示意图分别显示在图1a和1b中。使用标准的分子生物学技术将含有cmv启动子(seq id no: 18)、剪接增强子(三重复合序列) (seq id no: 10)、半胱氨酸蛋白酶抑制剂s前体信号肽spcs (np_0018901.1) (seq id no: 9)和pol (seq id no: 5)或核心(seq id no: 2)基因的hbv核心或pol抗原优化的表达盒引入pdk质粒主链中。使用核心和pol特异性抗体通过蛋白质印迹分析关于核心和pol抗原表达在体外试验该质粒,并证实关于细胞的和分泌的核心和pol抗原提供一致的表达谱(数据未显示)。
[0274]
实施例2. 表达截短的hbv核心抗原与hbv pol抗原的融合体的腺病毒载体的产生已经将腺病毒载体的创建设计为从单个开放读码框表达的融合蛋白。也可以设想用于表达两种蛋白的额外构型,例如使用两个分开的表达盒,或使用2a-样序列来隔开两个序列。
[0275]
腺病毒载体的表达盒的设计表达盒(如图2a和图2b所示)包含cmv启动子(seq id no: 19)、内含子(seq id no:12)(源自人apoai基因的片段
‑ꢀ
genbank登录号x01038碱基对295
ꢀ‑
523,携带apoai第二内含子),然后是优化的编码序列-单独的核心或核心和聚合酶融合蛋白,所述融合蛋白前面是人免疫球蛋白分泌信号编码序列(seq id no: 14)且后面是sv40多腺苷酸化信号(seq id no: 13)。
[0276]
包含分泌信号,因为过去的经验表明,某些携带分泌型转基因的腺病毒载体的可制造性有所提高,而不影响引起的t-细胞应答(小鼠实验)。
[0277]
核心蛋白(vv)的最后两个残基和聚合酶蛋白(mp)的前两个残基如果融合的话会产生存在于人多巴胺受体蛋白(d3同种型)上的连接序列(vvmp),以及侧翼同源性。
[0278]
agag接头在核心和聚合酶序列之间的插入会消除这种同源性,并且在人蛋白质组的blast中不再返回命中。
[0279]
实施例3. dna疫苗在小鼠中的体内免疫原性研究在小鼠中试验了含有编码hbv核心抗原或hbv聚合酶抗原的dna质粒的免疫治疗性dna疫苗。该研究的目的是为了检测疫苗在通过电穿孔肌肉内递送进balb/c小鼠中以后诱导的t-细胞应答。最初的免疫原性研究集中在确定由引入的hbv抗原引起的细胞免疫应答。
[0280]
具体而言,试验的质粒包括pdk-pol质粒和pdk-core质粒,分别如图1a和1b所示,以及如上文实施例1中所述。pdk-pol质粒编码具有seq id no: 7的氨基酸序列的聚合酶抗原,且pdk-core质粒编码具有seq id no: 2的氨基酸序列的核心抗原。首先,试验了由每种质粒单独诱导的t-细胞应答。使用商购可得的trigrid
tm
肌肉内递送系统(tds-im)通过电穿孔将dna质粒(pdna)疫苗肌肉内地递送给balb/c小鼠,该系统适合于小鼠模型的胫骨前肌(cranialis tibialis)中应用。关于通过电穿孔将dna肌肉内递送给小鼠的方法和装置的更多描述,参见于2017年12月19日提交的国际专利申请公开wo2017172838和美国专利申请号62/607,430,其标题为“method and apparatus for the delivery of hepatitis b virus (hbv) vaccines”,它们的公开内容特此通过引用整体并入。具体地,将具有电极阵列(电极之间间隔2.5 mm且直径为0.030英寸)的tds-im v1.0装置的tds-im阵列经皮插入所选肌肉中,导电长度为3.2 mm且有效穿透深度为3.2 mm,并且电极的菱形构型的长轴与
肌肉纤维平行地定向。在电极插入后,开始注射以在肌肉中分布dna (例如,0.020 ml)。在完成肌肉内注射后,局部施加250 v/cm电场(施加的电压为59.4
ꢀ‑
65.6 v,施加的电流限制小于4 a,0.16 a/秒),总持续时间为约400 ms,10%占空比(即,在约400 ms持续时间中主动施加电压共约40 ms),共6个脉冲。一旦完成电穿孔程序,移除trigridtm阵列并使动物恢复。如在表1中总结的那样进行给balb/c小鼠的高剂量(20
µ
g)施用。给六只小鼠施用编码hbv核心抗原的质粒dna(pdk-core;组1),给六只小鼠施用编码hbv pol抗原的质粒dna (pdk-pol;组2),且两只小鼠接受空载体作为阴性对照。动物接受间隔两周的两次dna免疫接种,并在最后一次免疫接种后一周收集脾细胞。
[0281]
表1:初步研究的小鼠免疫接种实验设计.通过ifn-γ 酶联免疫斑点(elispot)分析和量化抗原特异性应答。在该测定中,将免疫动物的分离脾细胞与覆盖核心蛋白、pol蛋白或小肽前导序列和连接序列的肽池(2
µ
g/ml的每种肽)一起温育过夜。这些池由15聚体肽组成,所述肽重叠与core和pol疫苗 载体的genotypes bcd共有序列相匹配的11个残基。大的94 kd hbv pol蛋白在中间被分成两个肽池。用同源肽池刺激抗原特异性t细胞,并使用elispot测定评估ifn-γ阳性t细胞。将单个抗原特异性t细胞释放的ifn-γ通过适当的抗体和随后的显色检测可视化为微量培养板上的有色斑点,称为斑点形成细胞(sfc)。
[0282]
在用dna疫苗质粒pdk-core (组 1)免疫的小鼠中实现了针对hbv核心的大量t细胞应答,达到每106个细胞1,000个sfc(图3)。对pol 1肽池的pol t-细胞应答是强烈的(每106个细胞约1,000个sfc)。弱的pol-2-指导的抗-pol细胞应答可能是由于小鼠中有限的mhc多样性,这种现象被称为t细胞免疫优势,定义为对来自一种抗原的不同表位的不平等识别。进行的一项验证性研究确认了在本研究中获得的结果(数据未显示)。
[0283]
上述结果证实,用编码hbv抗原的dna质粒疫苗的疫苗接种在小鼠中诱导针对施用的hbv抗原的细胞免疫应答。用非人灵长类动物也获得了类似的结果(数据未显示)。
[0284]
实施例4.抗pd-1对hbv疫苗诱导的免疫应答的影响为了评估阻断pd-1是否影响健康小鼠的hbv疫苗诱导的细胞介导免疫(cmi),成年c57bl/6小鼠在d0和d21通过dna电穿孔接种疫苗,并在d28收集其脾脏。该疫苗是pdf-core和pdf-pol vax的混合物(与pdk-core和pdk-pol的序列相同,但不同的主链编码不同的抗生素抗性),在双腿中施用10
µ
g/每种/部位。抗pd-1 mab(cd279;invivomab)或同种型mab(invivomab)在第一次接种时以及之后每周一次直到d21(即d0, d7, d14和d21)通过腹膜内注射(10mg/kg)施用。第二组小鼠在d7、d14和d21用抗pd-1 mab或同种型mab处理。对照小鼠用同种型抗体处理。
[0285]
在第28天,即最后一次接种疫苗后一周,处死小鼠,分离其脾细胞,通过elispot和细胞内细胞因子染色(ics)测量免疫应答。简而言之,以无菌方式从处死的免疫小鼠中取出每个脾脏,并置于含有2ml r10培养基的5ml卡口聚丙烯管中。然后通过金属网格刮擦脾脏,在6cm培养皿中破坏脾脏。用另外的2ml r10培养基洗涤网格,并将样品收集在管中。将碎屑倾析几分钟,将上相迅速转移到新管中并在室温下以1200rpm离心10分钟。通过将4.5ml裂解缓冲液(ack lysing buffer)添加到悬浮的细胞沉淀中,轻轻混合并放置10分钟来进行红细胞(rbc)渗透裂解。加入0.5ml 10x pbs以中和裂解缓冲液。在室温下以1200rpm旋转10分钟后,将细胞用r10洗涤,重新离心并重新悬浮在1ml r10培养基中。为了评估细胞的活力,将脾细胞在guava viacount试剂中以1:10稀释,并使用accuri c6 facs分选仪进行计数。细胞活力通常为96-99%。将所提供的肽池以每种0.33mg/ml重新悬浮在dmso中,组成如下:核心: 35种肽, pol1: 103种肽, 以及pol2: 105种肽。
[0286]
elispot测定是根据标准实践使用四个板进行的,其中对于每个样品,将400,000或200,000个脾细胞一式两份接种,并用dmso、核心或cona刺激。
[0287]
使用的肽池的最终浓度为1μg/ml。该测定揭示了低背景(dmso刺激)和伴刀豆球蛋白a(cona)的活化。用以下公式计算斑点形成细胞(sfc):[(2,5*平均400k) (5*平均200k)]/2。质量检查和数据精化显示所有动物都没有免疫应答,包括在第0天接种pcore的那些。
[0288]
结果示于图4并表明针对核心和pol抗原的强烈免疫应答,与先前疫苗接种研究中获得的数据一致。没有测量到显著的背景(dmso),而对pol2肽池测量到强烈的应答。针对pol1肽池测量到较低的应答。有趣的是,与同种型抗体相比,接受3次抗pd-1注射的组对pol抗原显示明显更高的应答(对于pol1和pol2分别为p=0.04和p=0.015)。此外,与接受四次抗体处理的小鼠相比,接受三次抗pd-1注射组的对pol的应答也更高(对于pol1和pol2分别为p=0.02和p=0.004)。总之,这些数据表明,3x抗pd-1施用可以增加接种疫苗的健康小鼠的hbv特异性免疫应答。
[0289]
为了进一步表征免疫应答,通过多色ics分析脾细胞的ifnγ、tnfα和il2的分泌。该测定是根据标准ics实践进行的。
[0290]
结果示于图5。
[0291]
ics分析与elispot的发现一致:核心特异性应答主要是cd4 /ifnγ /tnfα /il2 ,而pol1特异性应答是cd4 和cd8 / ifnγ /tnfα /il2 。相反,pol2特异性cmi是cd8 / ifnγ /tnfα 。与其他组相比,ics检测的pol特异性cmi在用抗pd-1处理3次的小鼠中更高。
[0292]
总之,这些数据表明hbv核心/pol疫苗具有免疫原性,并且3次抗pd-1的施用可产生最佳免疫效果。
[0293]
实施例5. 抗pd-1对aav/hbv感染小鼠中iibv疫苗诱导的免疫应答的影响。
[0294]
为了进一步评估阻断pd-1是否影响aav/hbv感染小鼠中hbv疫苗诱导的细胞介导免疫(cmi),成年c57bl/6小鼠感染aav/hbv28天。之后,一组14只动物在d28和d49通过dna电穿孔(每种质粒2.5μg)接种,一组在d28和d49通过dna电穿孔接种,并在第56天用抗pd-1抗体(10mg/kg)处理。第三组动物在接种后用同种型抗体处理。在第63天,处死小鼠。分离脾细胞以及肝内淋巴细胞(ihl),并测量cd8 t细胞的增殖能力。如图6所示,与未用抗pd-1处理的那些小鼠和用同种型抗体处理的那些小鼠相比,用抗pd-1处理的小鼠的ihl具有显著更
高的cd8增殖性t细胞。相反,脾细胞没有表现出更高的增殖能力(图7),这反映了以下事实:增殖性cd8 t细胞迁移到感染发生的部位,在此例中是肝。
[0295]
动物:c57bl/6小鼠以moi 10
11
通过尾静脉感染raav8-1.3hbv (fiveplus medical institute, china)。当感染后28天达到hbv慢性化时进行疫苗接种。
[0296]
质粒dna:dna疫苗是编码hbv核心(pdf-core)和聚合酶(pol)蛋白(pdf-pol)的两种单独dna质粒的组合,分别如图1a和图1b所示。用trigrid系统i.m.电穿孔2.5μg每种质粒。
[0297]
抗体:抗pd-1抗体(rmp1-14,bioxcell),同种型对照抗体(bioxcell)。研究中使用了10μg/ml的抗体,i.p.施用。
[0298]
研究设计:成年c57bl/6小鼠感染aav/hbv28天。之后,一组14只动物在d28和d49通过dna电穿孔(每种质粒2.5μg)接种,一组在d28和d49通过dna电穿孔接种,并在第56天用抗pd-1抗体(10mg/kg)处理。第三组动物在接种后用同种型抗体处理。
[0299]
脾细胞和ihl的分离:从小鼠中分离脾;使用gentlemacs dissociater (miltenyi biotec)进行组织破坏,细胞计数并用于指定的测定。通过用pbs灌注肝获得肝内淋巴细胞,使用gentlemacs dissociater,然后是33.75% (v/v) percoll
®ꢀ
/ pbs2�s梯度进行组织破坏。以700xg(12分钟,室温,最大加速度和制动为1)离心,将肝细胞与淋巴细胞分离。这些样品被仔细吸出并用于指定的测定。
[0300]
免疫表型分析:脾细胞和ihl每孔接种100.000个细胞。接下来,它们用活力染料染色。然后将细胞固定并透化以进行细胞内染色。用以下标志物对细胞进行染色:抗cd3、抗cd8、抗cd4和ki67,其是增殖性t细胞的标志物。1小时后,洗涤细胞两次,重悬于100μl染色缓冲液中,并在facs fortessa上进行读数。
[0301]
应当理解,本文描述的实施例和实施方案仅用于例证目的,并且可以在不脱离其广泛发明概念的情况下对上述实施方案做出改变。因此,应当理解,本发明不限于所公开的特定实施方案,而是意图涵盖在由所附权利要求限定的本发明的精神和范围内的修改。
1.对电子提交的序列表的引用本技术含有序列表,其通过efs-web作为ascii格式的序列表以电子方式提交,文件名称为“065814_15wo1_ sequence_listing”,创建日期为2020年6月15日,且大小为46 kb。通过efs-web提交的序列表是说明书的一部分,并通过引用整体并入本文。
2.相关申请的交叉引用本技术要求2019年6月18日提交的美国临时申请号62/862,791的优先权,其公开内容通过引用整体并入本文。
背景技术:
3.乙型肝炎病毒(hbv)是一种编码四种开放读码框和七种蛋白的小型3.2-kb嗜肝dna病毒。大约2.4亿人具有慢性乙型肝炎感染(慢性hbv),其特征在于病毒和亚病毒颗粒在血液中持续超过6个月(cohen等人. j. viral hepat. (2011) 18(6), 377-83)。通过病毒肽和循环抗原对hbv-特异性的t-细胞受体的慢性刺激,持续性hbv感染导致循环的和肝内的hbv-特异性的cd4 和cd8 t-细胞中的t-细胞衰竭。结果,t细胞多功能性降低(即,il-2、肿瘤坏死因子(tnf)-α、ifn-γ水平降低和增殖缺乏)。
4.自二十世纪80年代以来,针对hbv感染的安全且有效的预防性疫苗已经面世,并且是乙型肝炎预防的主要支柱(world health organization, hepatitis b: fact sheet no. 204 [因特网] 2015年3月)。世界卫生组织推荐对所有婴儿进行疫苗接种,并且在乙型肝炎低度或中度流行的国家,对所有儿童和青少年(《18岁)以及某些风险群体种类的人进行疫苗接种。由于疫苗接种,全球感染率已经大幅下降。但是,预防性疫苗不能治愈已确定的hbv感染。
[0005]
慢性hbv目前用ifn-α和核苷或核苷酸类似物治疗,但由于被称为共价闭合环状dna (cccdna)(其作为病毒rna的模板起重要作用)的细胞内病毒复制中间体和因而新病毒粒子在被感染的肝细胞中持续存在,因此没有最终治愈。有人认为,诱导的病毒特异性的t-细胞和b-细胞应答可以有效地消除携带cccdna的肝细胞。靶向hbv聚合酶的当前疗法会抑制病毒血症,但对驻留在细胞核中的cccdna和循环抗原的相关产生具有有限的影响。最严格的治愈形式可能是从生物体消除hbv cccdna,这既没有作为天然存在的结果观察到,也没有作为任何治疗干预的结果观察到。但是,hbv表面抗原(hbsag)的丧失是在临床上可靠的治愈等同指标,因为只有在严重免疫抑制的情况下才会出现疾病复发,其则可以通过预防性治疗来预防。因此,至少从临床观点看,hbsag的消失与针对hbv的最严格的免疫重建形式有关。
[0006]
例如,在具有有限疗程的持续停药(off-treatment)应答方面,与核苷或核苷酸疗法相比,用聚乙二醇化的干扰素(pegifn)-α的免疫调节已被证明是更好的。除了直接的抗病毒作用外,据报道ifn-α在细胞培养物和人源化的小鼠中对cccdna发挥表观遗传抑制作用,这导致病毒粒子生产力和转录物的减少(belloni等人. j. clin. invest. (2012) 122(2), 529-537)。但是,这种疗法仍然伴有副作用并且总体应答是相当低的,部分原因是
ifn-α对hbv-特异性的t-细胞仅具有差的调节影响。具体地,治愈率低(《10%)且毒性高。同样,直接起作用的hbv抗病毒剂,即hbv聚合酶抑制剂恩替卡韦和替诺福韦,作为单一疗法可有效诱导病毒抑制,具有对耐药突变体出现的高遗传屏障和肝疾病进展的连续预防。但是,很少使用此类hbv聚合酶抑制剂实现慢性乙型肝炎的治愈(由hbsag消失或血清转化定义)。因此,这些抗病毒剂在理论上需要无限期地施用以预防肝病复发,类似于人免疫缺陷病毒(hiv)的抗逆转录病毒疗法。
[0007]
治疗性疫苗接种具有从慢性感染的患者消除hbv的潜力(michel等人. j. hepatol. (2011) 54(6), 1286-1296)。已经探索了许多策略,但迄今为止尚未证明治疗性疫苗接种是成功的。
技术实现要素:
[0008]
因此,在治疗乙型肝炎病毒(hbv)、特别是慢性hbv方面存在未得到满足的医疗需求,即关于具有更高治愈率的有限良好耐受的治疗。本发明通过提供用于诱导针对乙型肝炎病毒(hbv)感染的免疫应答的治疗组合或组合物和方法来满足这种需要。本发明的免疫原性组合物/组合和方法可以用于给受试者(诸如具有慢性hbv感染的受试者)提供治疗性免疫。
[0009]
在一般方面,本技术涉及用于在有此需要的受试者中治疗hbv感染的治疗组合或组合物,其包含一种或多种hbv抗原或一种或多种编码hbv抗原的多核苷酸和抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0010]
在一个实施方案中,所述治疗组合包含:i)以下至少一种:a) 截短的hbv核心抗原,其由与seq id no: 2具有至少95%(诸如至少95%、96%、97%、98%、99%或100%)同一性的氨基酸序列组成,b) 第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列;c) hbv聚合酶抗原,其氨基酸序列与seq id no: 7具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性,和d) 第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列;和ii)抗pd-1或抗pd-l1抗体或其抗原结合片段,例如本文所述那些。
[0011]
在一个实施方案中,所述截短的hbv核心抗原由seq id no: 2或seq id no: 4的氨基酸序列组成,且所述hbv聚合酶抗原包含seq id no: 7的氨基酸序列。
[0012]
在一个实施方案中,所述治疗组合包含hbv聚合酶抗原和截短的hbv核心抗原中的至少一种。在某些实施方案中,所述治疗组合包含hbv聚合酶抗原和截短的hbv核心抗原。
[0013]
在一个实施方案中,所述治疗组合包含以下至少一种:第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列;和第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列。在某些实施方案中,所述第一种非天然存在的核酸分子进一步包含编码信号序列的多核苷酸序列,所述信号序列可操作地
连接至截短的hbv核心抗原的n-端,且所述第二种非天然存在的核酸分子进一步包含编码信号序列的多核苷酸序列,所述信号序列可操作地连接至hbv聚合酶抗原的n-端,优选地,所述信号序列独立地包含seq id no: 9或seq id no: 15的氨基酸序列,更优选地,所述信号序列分别由seq id no: 8或seq id no: 14的多核苷酸序列编码。
[0014]
在某些实施方案中,所述第一种多核苷酸序列包含与seq id no: 1或seq id no: 3具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的多核苷酸序列。
[0015]
在某些实施方案中,所述第二种多核苷酸序列包含与seq id no: 5或seq id no: 6具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的多核苷酸序列。
[0016]
在一个实施方案中,治疗组合包含:a) 第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述截短的hbv核心抗原由与seq id no: 2具有至少95%(诸如至少95%、96%、97%、98%、99%或100%)同一性的氨基酸序列组成;b) 第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列,所述hbv聚合酶抗原的氨基酸序列与seq id no: 7具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性;和c) 抗pd-1或抗pd-l1抗体或其抗原结合片段,优选选自:i)17d8, 2d3, 4h1, 5c4, 4a11, 7d3, 5f4, h409a11, hpd-1.08a, hpd-1.09a, 109a-h, k09a-l-11, k09a-l-16, k09a-l-17, 409a-h, h1m7789n, h1m7799n, h1m7800n, h2m7780n, h2m7788n, h2m7790n, h2m7791n, h2m7794n, h2m7795n, h2m7796n, h2m7798n, h4h9019p, h4xh9034p2, h4xh9035p2, h4xh9037p2, h4xh9045p2, h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab, 及其变体;ii)结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体;和iii)纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0017]
优选地,治疗组合包含a)第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述截短的hbv核心抗原由seq id no: 2或seq id no: 4
的氨基酸序列组成;b)第二种非天然存在的核酸分子,其包含编码具有seq id no: 7的氨基酸序列的hbv聚合酶抗原的第二种多核苷酸序列,和c)抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0018]
优选地,治疗组合包含:第一种非天然存在的核酸分子,其包含与seq id no: 1或seq id no: 3具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的多核苷酸序列;和第二种非天然存在的核酸分子,其包含与seq id no: 5或seq id no: 6具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)序列同一性的多核苷酸序列。
[0019]
更优选地,治疗组合包含:a)第一种非天然存在的核酸分子,其包含seq id no: 1或seq id no: 3的第一种多核苷酸序列;b)第二种非天然存在的核酸分子,其包含seq id no: 5或6的第二种多核苷酸序列;和c)抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0020]
在一个实施方案中,第一种和第二种非天然存在的核酸分子中的每一种是dna分子, 优选地所述dna分子存在于质粒或病毒载体上。
[0021]
在另一个实施方案中,第一种和第二种非天然存在的核酸分子中的每一种是rna分子,优选mrna或自复制的rna分子。
[0022]
在某些实施方案中,第一种和第二种非天然存在的核酸分子中的每一种用脂质纳米颗粒(lnp)独立地配制。
[0023]
在另一个一般方面,本技术涉及一种试剂盒,其包含本技术的治疗组合。
[0024]
本技术也涉及用于诱导针对乙型肝炎病毒(hbv)的免疫应答的本技术的治疗组合或试剂盒;和本技术的治疗组合、组合物或试剂盒在药物制备中的用途,所述药物用于诱导针对乙型肝炎病毒(hbv)的免疫应答。所述用途可以进一步包含与另一种免疫原性剂或治疗剂、优选另一种hbv抗原或另一种hbv疗法的组合。优选地,所述受试者具有慢性hbv感染。
[0025]
本技术进一步涉及用于在有此需要的受试者中治疗hbv诱导的疾病的本技术的治疗组合或试剂盒;和本技术的治疗组合或试剂盒在药物制备中的用途,所述药物用于在有此需要的受试者中治疗hbv诱导的疾病。所述用途可以进一步包含与另一种治疗剂、优选另一种抗-hbv抗原的组合。优选地,所述受试者具有慢性hbv感染,且所述hbv诱导的疾病选自晚期纤维化、肝硬化和肝细胞癌(hcc)。
[0026]
本技术也涉及诱导针对hbv的免疫应答的方法或治疗hbv感染或hbv诱导的疾病的方法,所述方法包括给有此需要的受试者施用根据本发明的实施方案的治疗组合。
[0027]
从以下公开内容,包括发明详述及其优选实施方案和所附权利要求书,会明白本发明的其它方面、特征和优点。
附图说明
[0028]
当结合附带的附图阅读时,将更好地理解前述概述、以及本技术的优选实施方案的以下详细描述。但是,应当理解,本技术不限于附图所示的精确实施方案。
[0029]
图1a和图1b显示了根据本技术的实施方案的dna质粒的示意图;图1a显示了根据本技术的一个实施方案编码hbv核心抗原的dna质粒;图1b显示了根据本技术的一个实施方案编码hbv聚合酶(pol)抗原的dna质粒;在cmv启动子的控制下表达hbv核心和pol抗原,其中n-端半胱氨酸蛋白酶抑制剂s信号肽在从细胞分泌后从表达的抗原切割;质粒的转录调
节元件包括位于cmv启动子和编码hbv抗原的多核苷酸序列之间的增强子序列以及位于编码hbv抗原的多核苷酸序列下游的bgh多腺苷酸化序列;第二个表达盒以相反取向被包括在质粒中,包括在ampr (bla)启动子控制下的卡那霉素抗性基因;复制起点(puc)也以相反取向被包括;图2a和图2b显示了根据本技术的实施方案的腺病毒载体中的表达盒的示意图;图2a显示了截短的hbv核心抗原的表达盒,其含有cmv启动子、内含子(从人apoai基因衍生出的片段-genbank登录号x01038碱基对295
ꢀ‑
523,携带apoai第二内含子)、人免疫球蛋白分泌信号,随后是截短的hbv核心抗原的编码序列和sv40多腺苷酸化信号;图2b显示了可操作地连接至hbv聚合酶抗原的截短的hbv核心抗原的融合蛋白的表达盒,其除了hbv抗原以外在其它方面与截短的hbv核心抗原的表达盒相同;图3显示了如在实施例3中所述,用表达hbv核心抗原或hbv pol抗原的不同dna质粒免疫的balb/c小鼠的elispot应答;用灰度等级指示用于刺激从不同的接种疫苗的动物组分离的脾细胞的肽池;在y-轴上指示应答性t-细胞的数目,表示为斑点形成细胞(sfc)/106个脾细胞;图4a和图4b显示了通过elispot测量的小鼠的免疫应答,所述小鼠被施用了根据本技术的实施方案的dna质粒(在d0和d21)以及根据本技术的实施方案的抗pd-1或同种型抗体;图4a显示在第一次接种后1周开始接受3次抗pd-1(黑色)或同种型(灰色)注射(即,d7、d14、d21)的小鼠的结果;图4b显示在第一次接种的同时,然后每7天(即,d0、d7、d14、d21)用抗pd-1(黑色)或同种型(灰色)处理的小鼠的结果;和图5a、图5b、图5c、图5d、图5e和图5f显示了由分离自小鼠的脾细胞的ics测量的免疫应答,所述小鼠被施用了根据本技术的实施方案的dna质粒(在d0和d21)以及根据本技术的实施方案的抗pd-1或同种型抗体,结果表示为平均值 /-sem;用核心(图5a和图5d)、pol1(图5b和图5e)或pol2(图5c和图5f)刺激脾细胞6小时,然后测量针对ifn-γ、il-2或tnf-α的应答;图5a、图5b和图5c显示从在第一次接种后1周开始接受3次抗pd-1(黑色)或同种型(灰色)注射(即,d7、d14、d21)的小鼠分离的脾细胞的结果;图5d、图5e和图5f显示在第一次接种的同时,然后每7天(即,d0、d7、d14、d21)用抗pd-1(黑色)或同种型(灰色)处理的小鼠的结果。
[0030]
图6显示cd8t细胞在从小鼠分离的肝内淋巴细胞(ihl)中的增殖能力,所述小鼠被施用了根据本技术的实施方案的dna质粒(在d28和d49)以及根据本技术的实施方案的抗pd-1或同种型抗体,结果表示为平均值 /-sem。
[0031]
图7显示了分离自小鼠的脾细胞中cd8t细胞的增殖能力,所述小鼠被施用了根据本技术的实施方案的dna质粒(在d28和d49)以及根据本技术的实施方案的抗pd-1或同种型抗体,结果表示为平均值 /-sem。
具体实施方式
[0032]
在背景和整个说明书中引用或描述了各种出版物、文章和专利;这些参考文献中的每一篇通过引用整体并入本文。已经包括在本说明书中的文件、法案、材料、装置、文章等的讨论是用于提供本发明的上下文的目的。这样的讨论并非承认任何或所有这些内容形成关于公开或要求保护的任何发明的现有技术的一部分。
[0033]
除非另外定义,否则在本文中使用的所有技术和科学术语具有本发明所属领域的普通技术人员通常理解的相同含义。否则,本文使用的某些术语具有如在说明书中所述的含义。本文引用的所有专利、公开的专利申请和出版物都通过引用并入,如同在本文中充分阐述。
[0034]
必须指出,如在本文中和在所附权利要求书中所使用的,单数形式“一种”、“一个”和“该”包括复数形式,除非上下文另外清楚地指明。
[0035]
除非另有说明,否则在一系列元件之前的术语“至少”应理解为表示该系列中的每个元件。本领域技术人员会认识到或仅仅使用例行实验就能够确定许多与本文所述的本发明的具体实施方案等效的方案。这样的等效方案意图被本发明涵盖。
[0036]
在本说明书和下面的权利要求书中,除非上下文另外要求,否则词语“包含”和变体诸如“包括”和“含有”应理解为暗示包括所陈述的整数或步骤或者整数或步骤的组,但是不排除任何其它整数或步骤或者整数或步骤的组。当在本文中使用时,术语“包含”可以用术语“含有”或“包括”替代,或者有时当在本文中使用时可以用术语“具有”替代。
[0037]
当在本文中使用时,“由
……
组成”排除在权利要求要素中未指定的任何要素、步骤或成分。当在本文中使用时,“基本上由
……
组成”不排除对权利要求的基本和新颖特征没有实质性影响的材料或步骤。无论何时在本文中使用时在本技术的一个方面或实施方案的上下文中,“包含”、“含有”、“包括”和“具有”的前述术语中的任一个可以用术语“由
……
组成”或“基本上由
……
组成”替换以改变本公开内容的范围。
[0038]
如本文中使用的,多个列举的要素之间的连接术语“和/或”被理解为涵盖单独的和组合的选项。例如,当两个要素由“和/或”连接时,第一种选项表示在没有第二个要素的情况下第一个要素的适用性。第二种选项表示在没有第一个要素的情况下第二个要素的适用性。第三种选项表示第一个要素和第二个要素一起的适用性。这些选项中的任何一个都被理解为落入其含义内,且因此满足本文中使用的术语“和/或”的要求。超过一个选项的同时适用性也被理解为落入该含义内,且因此满足术语“和/或”的要求。
[0039]
除非另有说明,任何数值,诸如本文所述的浓度或浓度范围,在所有情况下应理解为由术语“约”修饰。因此,数值通常包括所列举值的
±
10%。例如,1 mg/ml的浓度包括0.9 mg/ml至1.1 mg/ml。同样,1 mg/ml至10 mg/ml的浓度范围包括0.9 mg/ml至11 mg/ml。如本文中使用的,数值范围的使用明确包括所有可能的子范围、在该范围内的所有单个数值,包括在这样的范围内的整数和值的分数,除非上下文另外清楚地指出。
[0040]
短语“序列同一性百分比(%)”或“%同一性”或“与
……
的%同一性”在参考氨基酸序列使用时描述了与构成氨基酸序列的总长度的氨基酸残基的数目相比两个或更多个比对的氨基酸序列中相同的氨基酸的匹配(“命中”)数目。换句话说,使用比对,对于两个或更多个序列,当对序列进行对比和比对以获得最大对应时,如使用本领域已知的序列对比算法所测量的,或者当手工比对和目视检查时,可以确定相同的氨基酸残基的百分比(例如在氨基酸序列的全长上,90%、91%、92%、93%、94%、95%、97%、98%、99%或100%同一性)。被对比以确定序列同一性的序列因此可能因氨基酸的置换、添加或缺失而不同。用于比对蛋白序列的合适程序是技术人员已知的。例如,用程序诸如clustalw、clustal omega、fasta或blast,例如使用ncbi blast算法(altschul sf, 等人(1997), nucleic acids res. 25:3389-3402),可以确定蛋白序列的序列同一性百分比。
[0041]
如本文中使用的,在向受试者施用两种或更多种疗法或组分的上下文中,术语和短语“联合”、“与
……
联合”、“共同递送”和“与
……
一起施用”表示同时施用或随后施用两种或更多种疗法或组分,诸如两种载体,例如,dna质粒、肽、或治疗组合和佐剂。“同时施用”可以是至少在同一天内施用两种或更多种疗法或组分。当两种组分“与
……
一起施用”或“与
……
联合施用”时,它们可以在短时间段内诸如24、20、16、12、8或4小时或在1小时内在分开的组合物中依次施用,或者它们可以同时在单一组合物中施用。“依次施用”可以是在同一天或在不同天施用两种或更多种疗法或组分。术语“与
……
联合”的使用不限制对受试者施用疗法或组分的顺序。例如,可以在施用第二种疗法或组分(例如,编码hbv抗原的第二种dna质粒)和/或第三种疗法或组分(例如,抗pd-1或抗pd-l1抗体或其抗原结合片段)之前(例如,之前5分钟至1小时)、伴随地或同时地或之后(例如,之后5分钟至1小时)施用第一种疗法或组分(例如编码hbv抗原的第一种dna质粒)。在某些实施方案中,在相同组合物中施用第一种疗法或组分(例如编码hbv抗原的第一种dna质粒)、第二种疗法或组分(例如,编码hbv抗原的第二种dna质粒)和第三种疗法或组分(例如,抗pd-1或抗pd-l1抗体或其抗原结合片段)。在其它实施方案中,在分开的组合物(诸如两种或三种分开的组合物)中施用第一种疗法或组分(例如编码hbv抗原的第一种dna质粒)、第二种疗法或组分(例如,编码hbv抗原的第二种dna质粒)和第三种疗法或组分(例如,抗pd-1或抗pd-l1抗体或其抗原结合片段)。
[0042]
本文中使用的“非天然存在的”核酸或多肽表示在自然界中不存在的核酸或多肽。可以在实验室和/或制造环境中合成、处理、制造和/或以其它方式操作“非天然存在的”核酸或多肽。在某些情况下,非天然存在的核酸或多肽可以包含天然存在的核酸或多肽,其被处理、加工或操作以表现出在处理之前在天然存在的核酸或多肽中不存在的性能。本文中使用的“非天然存在的”核酸或多肽可以是从发现它的天然来源分离或分开的核酸或多肽,并且它缺乏与它在天然来源中相关联的序列的共价键。可以重组地制备或通过其它方法(诸如化学合成)制备“非天然存在的”核酸或多肽。
[0043]
本文中使用的“受试者”是指任何动物,优选哺乳动物,最优选人类,其将被或已经被根据本技术的一个实施方案的方法治疗。本文中使用的术语“哺乳动物”涵盖任何哺乳动物。哺乳动物的例子包括,但不限于,牛、马、羊、猪、猫、狗、小鼠、大鼠、兔、豚鼠、非人灵长类动物(nhp)诸如猴或猿、人类等,更优选人。
[0044]
本文中使用的术语“可操作地连接”表示连接或并置,其中如此描述的组件处于允许它们以其预期方式起作用的关系中。例如,可操作地连接至感兴趣的核酸序列的调节序列能够指导感兴趣的核酸序列的转录,或者可操作地连接至感兴趣的氨基酸序列的信号序列能够跨膜分泌或转移感兴趣的氨基酸序列。
[0045]
为了帮助本技术的读者,说明书已被分成多个段落或部分,或涉及本技术的不同实施方案。这些分离不应被视为将段落或部分或实施方案的内容与另一个段落或部分或实施方案的内容断开。相反,本领域技术人员会理解,该描述具有广泛的应用并且涵盖了可以考虑的各个部分、段落和句子的所有组合。任何实施方案的讨论意图仅仅是示例性的,并且无意提示本公开内容(包括权利要求)的范围限于这些实施例。例如,虽然本文描述的本技术的hbv载体(例如,质粒dna或病毒载体)的实施方案可以包含特定组分,包括、但不限于,以特定顺序排列的某些启动子序列、增强子或调节序列、信号肽、hbv抗原的编码序列、多腺
苷酸化信号序列等,本领域普通技术人员会明白,本文公开的概念同样可以适用于以其它顺序排列的可用于本技术的hbv载体中的其它组分。本技术涵盖以具有可用于本技术的hbv载体中的任何序列的任何组合使用任何适用组分,无论是否明确描述了特定组合。本发明总体上涉及一种治疗组合,其包含一种或多种hbv抗原和至少一种抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0046]
乙型肝炎病毒(hbv)本文中使用的“乙型肝炎病毒”或“hbv”表示嗜肝病毒科的病毒。hbv是一种小的(例如3.2 kb)嗜肝dna病毒,其编码四种开放读码框和七种蛋白。由hbv编码的七种蛋白包括小(s)、中(m)和大(l)表面抗原(hbsag)或包膜(env)蛋白、前核心蛋白(pre-core)、核心蛋白、病毒聚合酶(pol)和hbx蛋白。hbv表达三种表面抗原或包膜蛋白l、m和s,其中s是最小的,l是最大的。m和l蛋白中的额外结构域分别命名为pre-s2和pre-s1。核心蛋白是病毒核衣壳的亚基。病毒dna (逆转录酶、rna酶h和引物)的合成需要pol,该合成发生在定位于受感染的肝细胞的细胞质的核衣壳中。precore是具有n端信号肽的核心蛋白,并且在从受感染细胞分泌之前在其n端和c端发生蛋白水解性加工,成为所谓的乙型肝炎e-抗原(hbeag)。共价闭合环状dna (cccdna)的有效转录需要hbx蛋白。hbx不是病毒的结构蛋白。除了共享mrna的核心和聚合酶外,hbv的所有病毒蛋白都具有其自己的mrna。除前核心蛋白外,hbv病毒蛋白都没有进行翻译后蛋白水解加工。
[0047]
hbv病毒粒子含有病毒包膜、核衣壳和部分双链dna基因组的单个拷贝。核衣壳包含120个核心蛋白的二聚体,并被衣壳膜覆盖,所述衣壳膜嵌入了s、m和l病毒包膜或表面抗原蛋白。在进入细胞后,病毒没有被包裹,且含有衣壳的松弛环状dna (rcdna)与共价结合的病毒聚合酶一起迁移到细胞核。在该过程中,核心蛋白的磷酸化诱导结构变化,从而暴露核定位信号,实现衣壳与所谓的输入蛋白相互作用。这些输入蛋白介导核心蛋白与核孔复合物(衣壳在其上分解)的结合且聚合酶/rcdna复合物被释放到细胞核中。在细胞核内,rcdna变成去蛋白化(聚合酶的除去)并通过宿主dna修复机制转化为共价闭合环状dna (cccdna)基因组,重叠的转录物从其编码hbeag、hbsag、核心蛋白、病毒聚合酶和hbx蛋白。核心蛋白、病毒聚合酶和前基因组rna (pgrna)在细胞质中缔合并自组装成含有未成熟的pgrna的衣壳颗粒,所述颗粒进一步转化为成熟的rcdna-衣壳并作为常见中间体起作用,所述常见中间体要么作为感染性病毒颗粒被包裹和分泌,要么被运回细胞核以补充和维持稳定的cccdna池。
[0048]
迄今为止,基于在包膜蛋白上存在的抗原性表位,将hbv分为四种血清型(adr、adw、ayr、ayw),并基于病毒基因组的序列分为八种基因型(a、b、c、d、e、f、g和h)。hbv基因型分布在不同的地理区域。例如,在亚洲最流行的基因型是基因型b和c。基因型d在非洲、中东和印度占主导地位,而基因型a在北欧、撒哈拉大沙漠以南非洲和西非普遍存在。
[0049]
hbv抗原本文中使用的术语“hbv抗原”、“hbv的抗原性多肽”、“hbv抗原性多肽”、“hbv抗原性蛋白”、“hbv免疫原性多肽”和“hbv免疫原”都表示能够在受试者中诱导针对hbv的免疫应答(例如,体液和/或细胞介导的应答)的多肽。hbv抗原可以是hbv的多肽、其片段或表位、或多种hbv多肽、其部分或衍生物的组合。hbv抗原能够在宿主中产生保护性免疫应答,例如,诱导针对病毒性疾病或感染的免疫应答,和/或在受试者中产生针对病毒性疾病或感染的
免疫(即,接种疫苗),其保护受试者免受病毒性疾病或感染。例如,hbv抗原可以包含来自任何hbv蛋白的多肽或其免疫原性片段,诸如hbeag、前核心蛋白、hbsag (s、m或l蛋白)、核心蛋白、病毒聚合酶或从任何hbv基因型(例如,基因型a、b、c、d、e、f、g和/或h或它们的组合)衍生出的hbx蛋白。
[0050]
(1) hbv核心抗原如本文中使用的,术语“hbv核心抗原”、“hbc”和“核心抗原”中的每一个表示能够在受试者中诱导针对hbv核心蛋白的免疫应答(例如,体液和/或细胞的介导的应答)的hbv抗原。术语“核心”、“核心多肽”和“核心蛋白”中的每一个表示hbv病毒核心蛋白。全长核心抗原通常为183个氨基酸的长度,并且包括组装结构域(氨基酸1至149)和核酸结合结构域(氨基酸150至183)。前基因组rna衣壳化需要34-残基核酸结合结构域。该结构域还作为入核转运信号起作用。它包含17个精氨酸残基并且是高碱性的,这与其功能一致。hbv核心蛋白在溶液中是二聚体,所述二聚体自组装成二十面体衣壳。核心蛋白的每个二聚体具有四个α-螺旋束,后者在任一侧侧接α-螺旋结构域。缺乏核酸结合结构域的截短的hbv核心蛋白也能够形成衣壳。
[0051]
在本技术的一个实施方案中,hbv抗原是截短的hbv核心抗原。本文中使用的“截短的hbv核心抗原”表示不含有hbv核心蛋白的整个长度但能够在受试者中诱导针对hbv核心蛋白的免疫应答的hbv抗原。例如,可以修饰hbv核心抗原以缺失核心抗原的高度带正电荷的(富含精氨酸的)c-端核酸结合结构域的一个或多个氨基酸,所述c-端核酸结合结构域通常含有十七个精氨酸(r)残基。本技术的截短的hbv核心抗原优选地是不包含hbv核心入核转运信号的c-端截短的hbv核心蛋白和/或已从其缺失c-端hbv核心入核转运信号的截短的hbv核心蛋白。在一个实施方案中,截短的hbv核心抗原包含c-端核酸结合结构域中的缺失,诸如c-端核酸结合结构域的1-34个氨基酸残基的缺失,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33或34个氨基酸残基,优选全部34个氨基酸残基的缺失。在一个优选的实施方案中,截短的hbv核心抗原包含c-端核酸结合结构域中的缺失,优选全部34个氨基酸残基的缺失。
[0052]
本技术的hbv核心抗原可以是源自多个hbv基因型(例如,基因型a、b、c、d、e、f、g和h)的共有序列。本文中使用的“共有序列”是指基于同源蛋白的氨基酸序列的比对的人工氨基酸序列,例如,如通过同源蛋白的氨基酸序列的比对(例如,使用clustal omega)所确定的。它可以是在序列比对中的每个位置发现的最常见氨基酸残基的计算顺序,这基于来自至少100个天然hbv分离株的hbv抗原(例如,核心、pol等)的序列。共有序列可以是非天然存在的并且不同于天然病毒序列。通过使用多序列比对工具比对来自不同来源的多个hbv抗原序列,并在可变比对位置选择最常见的氨基酸,可以设计共有序列。优选地,hbv抗原的共有序列源自hbv基因型b、c和d。术语“共有抗原”用于表示具有共有序列的抗原。
[0053]
根据本技术的示例性的截短的hbv核心抗原缺乏核酸结合功能,并且能够在哺乳动物中诱导针对至少两种hbv基因型的免疫应答。优选地,截短的hbv核心抗原能够在哺乳动物中诱导针对至少hbv基因型b、c和d的t细胞应答。更优选地,截短的hbv核心抗原能够在人类受试者中诱导针对至少hbv基因型a、b、c和d的cd8 t细胞应答。
[0054]
优选地,本技术的hbv核心抗原是共有抗原,优选从hbv基因型b、c和d衍生出的共有抗原,更优选从hbv基因型b、c和d衍生出的截短的共有抗原。根据本技术的示例性的截短
的hbv核心共有抗原由与seq id no: 2或seq id no: 4具有至少90%同一性(诸如与seq id no: 2或seq id no: 4具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性)的氨基酸序列组成。seq id no: 2和seq id no: 4是从hbv基因型b、c和d衍生出的核心共有抗原。seq id no: 2和seq id no: 4各自含有天然核心抗原的高度带正电荷的(富含精氨酸的)核酸结合结构域的34-氨基酸c-端缺失。
[0055]
在本技术的一个实施方案中,hbv核心抗原是由seq id no: 2的氨基酸序列组成的截短的hbv抗原。在另一个实施方案中,hbv核心抗原是由seq id no: 4的氨基酸序列组成的截短的hbv抗原。在另一个实施方案中,hbv核心抗原进一步含有信号序列,其可操作地连接至成熟的hbv核心抗原序列(诸如seq id no: 2或seq id no: 4的氨基酸序列)的n-端。优选地,信号序列具有seq id no: 9或seq id no: 15的氨基酸序列。
[0056]
(2) hbv聚合酶抗原本文中使用的术语“hbv聚合酶抗原”、“hbv pol抗原”或“hbv pol抗原”表示能够在受试者中诱导针对hbv聚合酶的免疫应答(例如,体液和/或细胞的介导的应答)的hbv抗原。术语“聚合酶”、“聚合酶多肽”、“pol”和“pol”中的每一个表示hbv病毒dna聚合酶。hbv病毒dna聚合酶具有四个结构域,从n末端到c末端包括:末端蛋白(tp)结构域,其作为负链dna合成的引物;对聚合酶功能非必需的间隔区;用于转录的逆转录酶(rt)结构域;和rna酶h结构域。
[0057]
在本技术的一个实施方案中,hbv抗原包含hbv pol抗原,或其任何免疫原性片段或组合。hbv pol抗原可以含有进一步修饰以提高抗原的免疫原性,诸如通过将突变引入聚合酶和/或rna酶结构域的活性部位以降低或基本上消除某些酶活性。
[0058]
优选地,本技术的hbv pol抗原不具有逆转录酶活性和rna酶h活性,并且能够在哺乳动物中诱导针对至少两种hbv基因型的免疫应答。优选地,hbv pol抗原能够在哺乳动物中诱导针对至少hbv基因型b、c和d的t细胞应答。更优选地,hbv pol抗原能够在人类受试者中诱导针对至少hbv基因型a、b、c和d的cd8 t细胞应答。
[0059]
因而,在某些实施方案中,hbv pol抗原是灭活的pol抗原。在一个实施方案中,灭活的hbv pol抗原在聚合酶结构域的活性部位中包含一个或多个氨基酸突变。在另一个实施方案中,灭活的hbv pol抗原在rna酶h结构域的活性部位中包含一个或多个氨基酸突变。在一个优选的实施方案中,灭活的hbv pol抗原在聚合酶结构域和rna酶h结构域的活性部位中包含一个或多个氨基酸突变。例如,核苷酸/金属离子结合所需要的hbv pol抗原的聚合酶结构域中的“yxdd”基序可以被突变,例如,通过用天冬酰胺残基(n)替换一个或多个天冬氨酸残基(d),消除或降低金属配位功能,从而降低或基本上消除逆转录酶功能。可替换地,或除了“yxdd”基序的突变之外,mg2 配位所需的hbv pol抗原的rna酶h结构域中的“dedd”基序可以被突变,例如,通过用天冬酰胺残基(n)替换一个或多个天冬氨酸残基(d)和/或用谷氨酰胺(q)替换谷氨酸残基(e),从而降低或基本上消除rna酶h功能。在一个特定实施方案中,如下修饰hbv pol抗原:(1)将聚合酶结构域的“yxdd”基序中的天冬氨酸残基(d)突变为天冬酰胺残基(n);和(2)将rna酶h结构域的“dedd”基序中的第一个天冬氨酸残基(d)突变为天冬酰胺残基(n)并将第一个谷氨酸残基(e)突变为谷氨酰胺残基(n),从而降低或基本上消除pol抗原的逆转录酶和rna酶h功能。
[0060]
在本技术的一个优选的实施方案中,hbv pol抗原是共有抗原,优选从hbv基因型b、c和d衍生出的共有抗原,更优选从hbv基因型b、c和d衍生出的灭活的共有抗原。根据本技术的示例性的hbv pol共有抗原包含与seq id no: 7具有至少90%同一性的氨基酸序列,诸如与seq id no: 7具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选与seq id no: 7具有至少98%同一性,诸如与seq id no: 7具有至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性。seq id no: 7是从hbv基因型b、c和d衍生出的pol共有抗原,其包含位于聚合酶和rna酶h结构域的活性部位中的四个突变。具体地,四个突变包括在聚合酶结构域的“yxdd”基序中的天冬氨酸残基(d)向天冬酰胺残基(n)的突变;在rna酶h结构域的“dedd”基序中,第一个天冬氨酸残基(d)向天冬酰胺残基(n)的突变以及谷氨酸残基(e)向谷氨酰胺残基(q)的突变。
[0061]
在本技术的一个特定实施方案中,hbv pol抗原包含seq id no: 7的氨基酸序列。在本技术的其它实施方案中,hbv pol抗原由seq id no: 7的氨基酸序列组成。在另一个实施方案中,hbv pol抗原进一步含有信号序列,其可操作地连接至成熟的hbv pol抗原序列(诸如seq id no: 7的氨基酸序列)的n-端。优选地,所述信号序列具有seq id no: 9或seq id no: 15的氨基酸序列。
[0062]
(3) hbv核心抗原和hbv聚合酶抗原的融合体本文中使用的术语“融合蛋白”或“融合体”表示具有至少两个多肽结构域的单个多肽链,所述多肽结构域通常不存在于单个天然多肽中。
[0063]
在本技术的一个实施方案中,hbv抗原包含融合蛋白,所述融合蛋白包含可操作地连接至hbv pol抗原的截短的hbv核心抗原或者可操作地连接至截短的hbv核心抗原的hbv pol抗原,优选地经由接头。
[0064]
例如,在包含第一多肽和第二异源多肽的融合蛋白中,接头主要用作第一和第二多肽之间的间隔物。在一个实施方案中,接头由通过肽键连接在一起的氨基酸组成,优选由通过肽键连接的1至20个氨基酸组成,其中氨基酸选自20种天然存在的氨基酸。在一个实施方案中,1-20个氨基酸选自甘氨酸、丙氨酸、脯氨酸、天冬酰胺、谷氨酰胺和赖氨酸。优选地,接头由大部分在空间上不受阻碍的氨基酸组成,诸如甘氨酸和丙氨酸。示例性的接头是聚甘氨酸,特别是(gly)5、(gly)8;聚(gly-ala)和聚丙氨酸。如在下面实施例中所示的一种示例性的合适接头是(alagly)n,其中n是2-5的整数。
[0065]
优选地,本技术的融合蛋白能够在哺乳动物中诱导针对至少两种hbv基因型的hbv核心和hbv pol的免疫应答。优选地,融合蛋白能够在哺乳动物中诱导针对至少hbv基因型b、c和d的t细胞应答。更优选地,融合蛋白能够在人类受试者中诱导针对至少hbv基因型a、b、c和d的cd8 t细胞应答。
[0066]
在本技术的一个实施方案中,融合蛋白包含:其氨基酸序列与seq id no: 2或seq id no: 4具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的截短的hbv核心抗原,接头,和其氨基酸序列与seq id no: 7具有至少90%(诸如至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的hbv pol抗
id no: 1或seq id no: 3具有98%、99%或100%同一性,所述多核苷酸序列可操作地连接至与seq id no: 11具有至少90%同一性的接头编码序列,诸如与seq id no: 11具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 11具有98%、99%或100%同一性,所述接头编码序列进一步可操作地连接至与seq id no: 5或seq id no: 6具有至少90%同一性的多核苷酸序列,诸如与seq id no: 5或seq id no: 6具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 5或seq id no: 6具有98%、99%或100%同一性。在本技术的特定实施方案中,编码hbv抗原融合蛋白的非天然存在的核酸分子包含seq id no: 1或seq id no: 3,其可操作地连接至seq id no: 11,后者进一步可操作地连接至seq id no: 5或seq id no: 6。
[0079]
在另一个实施方案中,编码hbv融合体的非天然存在的核酸分子进一步包含信号序列的编码序列,所述信号序列可操作地连接至hbv融合体序列(诸如seq id no: 16的氨基酸序列)的n-端。优选地,所述信号序列具有seq id no: 9或seq id no: 15的氨基酸序列。更优选地,信号序列的编码序列包含seq id no: 8或seq id no: 14的多核苷酸序列。在一个实施方案中,编码的具有信号序列的融合蛋白包含seq id no: 17的氨基酸序列。
[0080]
本技术也涉及一种载体,其包含第一种和/或第二种非天然存在的核酸分子。本文中使用的“载体”是用于将遗传物质携带到另一个细胞中的核酸分子,在那里它可以被复制和/或表达。可以使用考虑到本公开内容本领域技术人员已知的任何载体。载体的例子包括、但不限于质粒、病毒载体(细菌噬菌体、动物病毒和植物病毒)、粘粒和人工染色体(例如,yac)。优选地,载体是dna质粒。载体可以是dna载体或rna载体。考虑到本公开内容,本领域普通技术人员可以通过标准重组技术构建本技术的载体。
[0081]
本技术的载体可以是表达载体。本文中使用的术语“表达载体”表示包含核酸的任何类型的遗传构建体,所述核酸编码能够被转录的rna。表达载体包括、但不限于用于重组蛋白表达的载体,诸如dna质粒或病毒载体,以及用于将核酸递送到受试者中以在受试者的组织中表达的载体,诸如dna质粒或病毒载体。本领域技术人员将理解,表达载体的设计可以取决于诸如待转化的宿主细胞的选择、期望的蛋白表达水平等因素。
[0082]
本技术的载体可以含有多种调节序列。本文中使用的术语“调节序列”表示允许、有助于或调节核酸分子的功能调节(包括核酸或其衍生物之一(即mrna)的复制、重复、转录、剪接、翻译、稳定性和/或运输进宿主细胞或生物体中)的任何序列。在本公开内容的上下文中,该术语涵盖启动子、增强子和其它表达控制元件(例如,多腺苷酸化信号和影响mrna稳定性的元件)。
[0083]
在本技术的某些实施方案中,载体是非病毒载体。非病毒载体的例子包括、但不限于dna质粒、细菌人工染色体、酵母人工染色体、细菌噬菌体等。非病毒载体的例子包括、但不限于rna复制子、mrna复制子、修饰的mrna复制子或自扩增mrna、闭合线性脱氧核糖核酸,例如线性共价闭合dna,诸如线性共价闭合双链dna分子。优选地,非病毒载体是dna质粒。与“dna质粒载体”、“质粒dna”或“质粒dna载体”互换使用的“dna质粒”表示能够在合适的宿主细胞中自复制的双链且通常为环状的dna序列。用于表达编码的多核苷酸的dna质粒通常包含复制起点、多克隆位点和选择标志物,例如可以是抗生素抗性基因。可以使用的合适的
dna质粒的例子包括、但不限于用于众所周知的表达系统(包括原核和真核系统)的商购可得的表达载体,诸如pse420 (invitrogen, san diego, calif.),其可以用于在大肠杆菌中生产和/或表达蛋白;pyes2 (invitrogen, thermo fisher scientific),其可以用于在酵母的酿酒酵母菌株中生产和/或表达;maxbac
®
完整杆状病毒表达系统(thermo fisher scientific),其可以用于在昆虫细胞中生产和/或表达;pcdnatm或pcdna3tm (life technologies, thermo fisher scientific),其可以用于在哺乳动物细胞中的高水平组成型蛋白表达;和pvax或pvax-1 (life technologies, thermo fisher scientific),其可以用于在大多数哺乳动物细胞中高水平瞬时表达感兴趣的蛋白。通过使用常规技术和容易得到的起始原料,可以修饰任何商购可得的dna质粒的主链以优化在宿主细胞中的蛋白表达,诸如反转某些元件(例如,复制起点和/或抗生素抗性盒)的方向,替换质粒的内源启动子(例如,在抗生素抗性盒中的启动子),和/或替换编码所转录的蛋白的多核苷酸序列(例如,抗生素抗性基因的编码序列) (参见例如,sambrook等人, molecular cloning a laboratory manual, 第二版. cold spring harbor press (1989))。
[0084]
优选地,dna质粒是适合于在哺乳动物宿主细胞中表达蛋白的表达载体。适用于在哺乳动物宿主细胞中表达蛋白的表达载体包括、但不限于pcdnatm、pcdna3tm、pvax、pvax-1、advax、ntc8454等。优选地,表达载体是基于pvax-1,其可被进一步修饰以优化在哺乳动物细胞中的蛋白表达。pvax-1是dna疫苗中的常用质粒,且含有强大的人类立即早期巨细胞病毒(cmv-ie)启动子,然后是牛生长激素(bgh)衍生的多腺苷酸化序列(pa)。pvax-1进一步含有puc复制起点和由允许细菌质粒繁殖的小原核启动子驱动的卡那霉素抗性基因。
[0085]
本技术的载体还可以是病毒载体。一般而言,病毒载体是遗传工程改造的病毒,其携带已被赋予非传染性的经修饰的病毒dna或rna,但仍含有病毒启动子和转基因,从而允许通过病毒启动子翻译转基因。因为病毒载体通常缺乏传染性序列,因此它们需要辅助病毒或包装线才能大规模转染。可以使用的病毒载体的例子包括、但不限于腺病毒载体、腺伴随病毒载体、痘病毒载体、肠道病毒载体、委内瑞拉马脑炎病毒载体、西门利克森林病毒载体、烟草花叶病毒载体、慢病毒载体等。可以使用的病毒载体的例子包括、但不限于沙粒病毒病毒载体、复制缺陷型沙粒病毒病毒载体或有复制能力的沙粒病毒病毒载体、双节段或三节段沙粒病毒、传染性的沙粒病毒病毒载体、包含沙粒病毒基因组区段的核酸(其中该基因组区段的一个开放读码框被删除或在功能上灭活,并被编码如本文所述的hbv抗原的核酸替代)、沙粒病毒诸如淋巴细胞性脉络丛脑膜炎病毒(lcmv)(例如,克隆13株或mp株)、以及沙粒病毒诸如胡宁病毒(例如,candid #1株)。载体还可以是非病毒载体。
[0086]
优选地,病毒载体是腺病毒载体,例如,重组腺病毒载体。重组腺病毒载体可以例如衍生自人腺病毒(hadv或adhu)或猿猴腺病毒诸如黑猩猩或大猩猩腺病毒(chad、adch或sadv)或恒河猴腺病毒(rhad)。优选地,腺病毒载体是重组人腺病毒载体,例如重组人腺病毒血清型26,或重组人腺病毒血清型5、4、35、7、48等中的任一种。在其它实施方案中,腺病毒载体是rhad载体,例如rhad51、rhad52或rhad53。
[0087]
载体也可以是线性共价闭合双链dna载体。本文中使用的“线性共价闭合双链dna载体”表示在结构上不同于质粒dna的闭合线性脱氧核糖核酸(dna)。它具有质粒dna的许多优点以及类似于rna策略的最小盒大小。例如,它可以是通常包含编码的抗原序列、启动子、多腺苷酸化序列和端粒末端的载体盒。可以通过酶促过程合成无质粒构建体,无需细菌序
列。合适的线性共价闭合dna载体的例子包括、但不限于商购可得的表达载体诸如
‘
doggybone
™
闭合线性dna’(dbdna
™
) (touchlight genetics ltd.;伦敦, 英国)。参见,例如,scott等人, hum vaccin immunother. 2015年8月;11(8): 1972-1982,其整个内容通过引用并入本文。在us2012/0282283、us2013/0216562和us2018/0037943中描述了线性共价闭合双链dna载体、组合物和用于产生和使用此类载体以递送dna分子(诸如本发明的活性分子)的一些实例,其各自的相关内容特此通过引用整体并入。
[0088]
考虑到本公开内容,使用本领域已知的方法可以制备用于本技术的重组载体。例如,考虑到遗传密码的简并性,可以设计几种编码相同多肽的核酸序列。编码本技术的hbv抗原的多核苷酸可以任选地进行密码子优化以确保在宿主细胞(例如,细菌或哺乳动物细胞)中的适当表达。密码子优化是本领域广泛应用的技术,且考虑到本公开内容,获得经过密码子优化的多核苷酸的方法将是本领域技术人员众所周知的。
[0089]
本技术的载体,例如,dna质粒、病毒载体(特别是腺病毒载体)、rna载体(诸如自复制的rna复制子)或线性共价闭合双链dna载体,可以包含任何调节元件以建立载体的常规功能,包括、但不限于由载体的多核苷酸序列编码的hbv抗原的复制和表达。调节元件包括、但不限于启动子、增强子、多腺苷酸化信号、翻译终止密码子、核糖体结合元件、转录终止子、选择标志物、复制起点等。载体可以包含一个或多个表达盒。“表达盒”是指导细胞机器制造rna和蛋白的载体的一部分。表达盒通常包含三个组件:启动子序列、开放读码框和任选地包含多腺苷酸化信号的3
’‑
非翻译区(utr)。开放读码框(orf)是一种读码框,它含有从起始密码子到终止密码子的感兴趣的蛋白(例如,hbv抗原)的编码序列。表达盒的调节元件可以可操作地连接至编码感兴趣的hbv抗原的多核苷酸序列。本文中使用的术语“可操作地连接”应放在最广泛的合理上下文中,并表示具有功能关系的多核苷酸元件的连接。当多核苷酸被置于与另一种多核苷酸的功能关系中时,所述多核苷酸是“可操作地连接的”。例如,如果启动子影响编码序列的转录,则所述启动子可操作地连接至编码序列。适用于本文所述的表达盒的任何组件可以以任何组合和以任何顺序使用以制备本技术的载体。
[0090]
载体可以包含启动子序列,优选在表达盒内,以控制感兴趣的hbv抗原的表达。术语“启动子”以其常规含义使用,且表示启动可操作地连接的核苷酸序列的转录的核苷酸序列。启动子位于同一条链上,靠近它所转录的核苷酸序列。启动子可以是组成型、诱导型或抑制型。启动子可以是天然存在的或合成的。启动子可以来源于包括病毒、细菌、真菌、植物、昆虫和动物的来源。启动子可以是同源启动子(即,源自与载体相同的遗传来源)或异源启动子(即,源自不同的载体或遗传来源)。例如,如果要使用的载体是dna质粒,则启动子可以是质粒内源性的(同源的)或源自其它来源(异源的)。优选地,启动子在表达盒内位于编码hbv抗原的多核苷酸的上游。
[0091]
可以使用的启动子的例子包括、但不限于来自猿猴病毒40 (sv40)的启动子、小鼠乳腺肿瘤病毒(mmtv)启动子、人免疫缺陷病毒(hiv)启动子诸如牛免疫缺陷病毒(biv)长末端重复序列(ltr)启动子、莫洛尼病毒启动子、禽造白细胞组织增生病毒(alv)启动子、巨细胞病毒(cmv)启动子诸如cmv立即早期启动子(cmv-ie)、爱泼斯坦-巴尔病毒(ebv)启动子或劳斯肉瘤病毒(rsv)启动子。启动子也可以是来自人基因的启动子,诸如人肌动蛋白、人肌球蛋白、人血红蛋白、人肌肉肌酸或人金属硫蛋白。启动子也可以是组织特异性启动子,诸如天然的或合成的肌肉或皮肤特异性启动子。
[0092]
优选地,启动子是强真核启动子,优选巨细胞病毒立即早期(cmv-ie)启动子。示例性的cmv-ie启动子的核苷酸序列显示在seq id no: 18或seq id no: 19中。
[0093]
载体可以包含额外的多核苷酸序列,其稳定化表达的转录物、增强rna转录物的核输出和/或改善转录-翻译偶联。这样的序列的例子包括多腺苷酸化信号和增强子序列。多腺苷酸化信号在载体表达盒内通常位于感兴趣的蛋白(例如,hbv抗原)的编码序列的下游。增强子序列是调节性dna序列,当被转录因子结合时,其增强相关基因的转录。增强子序列优选地在载体表达盒内位于编码hbv抗原的多核苷酸序列的上游,但位于启动子序列的下游。
[0094]
可以使用考虑到本公开内容本领域技术人员已知的任何多腺苷酸化信号。例如,多腺苷酸化信号可以是sv40多腺苷酸化信号、ltr多腺苷酸化信号、牛生长激素(bgh)多腺苷酸化信号、人生长激素(hgh)多腺苷酸化信号或人β-珠蛋白多腺苷酸化信号。优选地,多腺苷酸化信号是牛生长激素(bgh)多腺苷酸化信号或sv40多腺苷酸化信号。示例性的bgh多腺苷酸化信号的核苷酸序列显示在seq id no: 20中。示例性的sv40多腺苷酸化信号的核苷酸序列显示在seq id no: 13中。
[0095]
可以使用考虑到本公开内容本领域技术人员已知的任何增强子序列。例如,增强子序列可以是人肌动蛋白、人肌球蛋白、人血红蛋白、人肌肉肌酸或病毒增强子,诸如来自cmv、ha、rsv或ebv的增强子。具体增强子的例子包括、但不限于土拨鼠hbv转录后调节元件(wpre)、源自人载脂蛋白a1前体(apoai)的内含子/外显子序列、人t-细胞白血病病毒1型(htlv-1)长末端重复序列(ltr)的非翻译r-u5结构域、剪接增强子、合成的兔β-珠蛋白内含子或它们的任意组合。优选地,增强子序列是htlv-1 ltr的非翻译r-u5结构域、兔β-珠蛋白内含子和剪接增强子的三个连续元件的复合序列,其在本文中被称作“三重增强子序列”。示例性的三重增强子序列的核苷酸序列显示在seq id no: 10中。另一种示例性的增强子序列是在seq id no: 12中所示的apoai基因片段。
[0096]
载体可以包含编码信号肽序列的多核苷酸序列。优选地,编码信号肽序列的多核苷酸序列位于编码hbv抗原的多核苷酸序列的上游。信号肽通常指导蛋白的定位,促进蛋白从产生蛋白的细胞中的分泌,和/或改善抗原表达和向抗原呈递细胞的交叉呈递。当从载体表达时,信号肽可以存在于hbv抗原的n端,但被信号肽酶切掉,例如在从细胞分泌后。其中信号肽已被切割的表达的蛋白经常被称为“成熟的蛋白”。可以使用考虑到本公开内容本领域已知的任何信号肽。例如,信号肽可以是半胱氨酸蛋白酶抑制剂s信号肽;免疫球蛋白(ig)分泌信号,诸如ig重链γ信号肽spigg或ig重链ε信号肽spige。
[0097]
优选地,信号肽序列是半胱氨酸蛋白酶抑制剂s信号肽。半胱氨酸蛋白酶抑制剂s信号肽的示例性核酸和氨基酸序列分别显示在seq id no: 8和9中。免疫球蛋白分泌信号的示例性核酸和氨基酸序列分别显示在seq id no: 14和15中。
[0098]
载体,诸如dna质粒,还可以包括细菌复制起点和抗生素抗性表达盒,其用于在细菌细胞(例如大肠杆菌)中选择和维持质粒。细菌复制起点和抗生素抗性盒可以以与编码hbv抗原的表达盒相同的取向或以相反(反向)取向位于载体中。复制起点(ori)是启动复制处的序列,从而使质粒能够在细胞内繁殖和存活。适用于本技术的ori的例子包括、但不限于cole1、pmb1、puc、psc101、r6k和15a,优选puc。puc ori的示例性核苷酸序列显示在seq id no: 21中。
[0099]
用于在细菌细胞中选择和维持的表达盒通常包括可操作地连接至抗生素抗性基因的启动子序列。优选地,可操作地连接至抗生素抗性基因的启动子序列不同于可操作地连接至编码感兴趣的蛋白(例如hbv抗原)的多核苷酸序列的启动子序列。抗生素抗性基因可以是密码子优化的,并且抗生素抗性基因的序列组成通常根据细菌(例如,大肠杆菌)密码子选择进行调整。可以使用考虑到本公开内容本领域技术人员已知的任何抗生素抗性基因,包括、但不限于卡那霉素抗性基因(kanr)、氨苄西林抗性基因(ampr)和四环素抗性基因(tetr)、以及赋予对氯霉素、博来霉素、大观霉素、羧苄西林等的抗性的基因。
[0100]
优选地,在载体的抗生素表达盒中的抗生素抗性基因是卡那霉素抗性基因(kanr)。kanr基因的序列显示在seq id no: 22中。优选地,kanr基因是密码子优化的。密码子优化的kanr基因的示例性核酸序列显示在seq id no: 23中。kanr可以与其天然启动子可操作地连接,或者kanr基因可以与异源启动子连接。在一个特定实施方案中,kanr基因可操作地连接至氨苄西林抗性基因(ampr)启动子,后者称作bla启动子。bla启动子的示例性核苷酸序列显示在seq id no: 24中。
[0101]
在本技术的一个特定实施方案中,载体是包含表达盒的dna质粒,所述表达盒包括编码至少一种hbv抗原的多核苷酸,所述hbv抗原选自:hbv pol抗原,其包含与seq id no: 7具有至少90%(诸如90%、91%、92%、93%、94%、95%、96%、97%,优选地至少98%,诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列;和截短的hbv核心抗原,其由与seq id no: 2或seq id no: 4具有至少95%(诸如95%、96%、97%,优选地至少98%,诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列组成;可操作地连接至编码hbv抗原的多核苷酸的上游序列,其从5’端至3’端包含启动子序列,优选seq id no: 18的cmv启动子序列,增强子序列,优选seq id no: 10的三重增强子序列,和编码信号肽序列的多核苷酸序列,优选具有seq id no: 9的氨基酸序列的半胱氨酸蛋白酶抑制剂s信号肽;和可操作地连接至编码hbv抗原的多核苷酸的下游序列,其包含多腺苷酸化信号,优选seq id no: 20的bgh多腺苷酸化信号。这样的载体进一步包含抗生素抗性表达盒,其包括编码抗生素抗性基因(优选kanr基因)的多核苷酸,更优选与seq id no: 23具有至少90%同一性的密码子优化的kanr基因,诸如与seq id no: 23具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 23具有100%同一性,其可操作地连接至seq id no: 24的ampr (bla)启动子,在编码抗生素抗性基因的多核苷酸的上游并与其可操作地连接;和复制起点,优选seq id no: 21的puc ori。优选地,抗生素抗性盒和复制起点以相对于hbv抗原表达盒相反的取向存在于质粒中。
[0102]
在本技术的另一个特定实施方案中,载体是病毒载体,优选腺病毒载体,更优选ad26或ad35载体,其包含表达盒,所述表达盒包括编码至少一种hbv抗原的多核苷酸,所述hbv抗原选自:hbv pol抗原,其包含与seq id no: 7具有至少90%(诸如90%、91%、92%、93%、94%、95%、96、97%、优选地至少98%,诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列;和截短的hbv核心抗原,其由与seq id no: 2或seq id no: 4具有至少95%(诸如95%、96%、97%,优选地至少98%,诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或
100%)同一性的氨基酸序列组成;可操作地连接至编码hbv抗原的多核苷酸的上游序列,其从5’端至3’端包含启动子序列,优选seq id no: 19的cmv启动子序列,增强子序列,优选seq id no: 12的apoai基因片段序列,和编码信号肽序列(优选具有seq id no: 15的氨基酸序列的免疫球蛋白分泌信号)的多核苷酸序列;和可操作地连接至编码hbv抗原的多核苷酸的下游序列,其包含多腺苷酸化信号,优选seq id no: 13的sv40多腺苷酸化信号。
[0103]
在本技术的一个实施方案中,载体,诸如质粒dna载体或病毒载体(优选腺病毒载体,更优选ad26或ad35载体),编码具有seq id no: 7的氨基酸序列的hbv pol抗原。优选地,载体包含hbv pol抗原的编码序列,其与seq id no: 5或6的多核苷酸序列具有至少90%同一性,诸如与seq id no: 5或6具有90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 5或6具有100%同一性。
[0104]
在本技术的一个实施方案中,载体,诸如质粒dna载体或病毒载体(优选腺病毒载体,更优选ad26或ad35载体),编码由seq id no: 2或seq id no: 4的氨基酸序列组成的截短的hbv核心抗原。优选地,载体包含截短的hbv核心抗原的编码序列,其与seq id no: 1或seq id no: 3的多核苷酸序列具有至少90%同一性,诸如与seq id no: 1或seq id no: 3具有90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 1或seq id no: 3具有100%同一性。
[0105]
在本技术的另一个实施方案中,载体,诸如质粒dna载体或病毒载体(优选腺病毒载体,更优选ad26或ad35载体),编码融合蛋白,所述融合蛋白包含具有seq id no: 7的氨基酸序列的hbv pol抗原和由seq id no: 1或seq id no: 3的氨基酸序列组成的截短的hbv核心抗原。优选地,载体包含融合体的编码序列,其含有与seq id no: 1或seq id no: 3具有至少90%同一性的截短的hbv核心抗原的编码序列,诸如与seq id no: 1或seq id no: 3具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 1或seq id no: 3具有98%、99%或100%同一性,更优选地seq id no: 1或seq id no: 3,所述编码序列可操作地连接至与seq id no: 5或seq id no: 6具有至少90%同一性的hbv pol抗原的编码序列,诸如与seq id no: 5或seq id no: 6具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 5或seq id no: 6具有98%、99%或100%同一性,更优选地seq id no: 5或seq id no: 6。优选地,截短的hbv核心抗原的编码序列经由与seq id no: 11具有至少90%同一性的接头的编码序列可操作地连接至hbv pol抗原的编码序列,诸如与seq id no: 11具有至少90%、91%、92%、93%、94%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%同一性,优选地与seq id no: 11具有98%、99%或100%同一性。在本技术的特定实施方案中,载体包含融合体的编码序列,其具有可操作地连接至seq id no: 11的seq id no: 1或seq id no: 3,所述seq id no: 11进一步可操作地连接至seq id no: 5或seq id no: 6。
[0106]
考虑到本公开内容,通过本领域已知的任意方法可以制备本技术的编码hbv抗原
85:5879, 1988; bird等人, science 242:423, 1988)、具有改变的恒定区的抗体(例如,u.s. pat. no. 5,624,821)、结构域抗体和包含所需特异性的抗原结合位点的免疫球蛋白分子的任何其他修饰构型。
[0115]
如本文中使用的,“特异性地结合”抗原的抗体表示以1
×
10
−
7 m或更低的kd结合抗原的抗体。优选地,“特异性地结合”抗原的抗体以1
×
10
−
8 m或更低的kd结合抗原,更优选5
×
10
−
9 m或更低、1
×
10
−
9 m或更低、5
×
10
−
10 m或更低或1
×
10
−
10 m或更低。术语“kd”表示解离常数,它从kd与ka的比率(即,kd/ka)获得,并表示为摩尔浓度(m)。考虑到本公开内容,可以使用本领域中的方法确定抗体的kd值。例如,通过使用表面等离子体共振,诸如通过使用生物传感器系统,例如,biacore
®
系统,或通过使用生物层干扰量度技术,诸如octet red96系统,可以确定抗体的kd。抗体的kd值越小,抗体与靶抗原结合的亲和力越高。
[0116]
抗pd-1和抗pd-l1抗体本技术还涉及抗pd-1或抗pd-l1抗体的治疗应用。如上所述,“抗体”是广义的,包括免疫球蛋白分子,包括多克隆抗体;单克隆抗体,包括鼠、人、人源化和嵌合单克隆抗体;抗原结合片段、双特异性或多特异性抗体、二聚体抗体、四聚体抗体、多聚体抗体、fv、fab、f(ab')2、双功能杂合体、单链抗体、具有改变的恒定区的抗体、结构域抗体和包含所需特异性的抗原结合位点的免疫球蛋白分子的任何其他修饰构型。
[0117]“全长抗体”包括通过二硫键相互连接的两条重(h)链和两条轻(l)链及其多聚体(例如igm)。每条重链包括重链可变区(vh)和重链恒定区(包括结构域ch1、铰链ch2和ch3)。每条轻链包括轻链可变区(vl)和轻链恒定区(cl)。vh和vl区可以进一步细分为高变区,称为互补决定区(cdr),其被框架区(fr)隔开。每个vh和vl包括三个cdr和四个fr片段,从氨基端到羧基端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。
[0118]“互补决定区(cdr)”是抗体中的“抗原结合位点”。可以使用各种术语定义cdr:(i)互补决定区(cdr),三个在vh中(hcdr1、hcdr2、hcdr3)和三个在vl中(lcdr1、lcdr2、lcdr3),是基于序列可变性(wu and kabat, (1970) j exp med 132:211-50; kabat等人, sequences of proteins of immunological interest, 5th ed. public health service, national institutes of health, bethesda, md., 1991)。(ii)“高变区”、“hvr”或“hv”,三个在vh中(h1、h2、h3)和三个在vl中(l1、l2、l3),是指由chothia和lesk定义的结构高变的抗体可变结构域的区域(chothia and lesk, (1987) mol biol 196:901-17)。international immunogenetics (imgt)数据库(http://www_imgt_org)提供了抗原结合位点的标准化编号和定义。cdr、hv和imgt描述之间的对应关系描述在lefranc等人, (2003) dev comparat immunol 27:55-77。本文使用的术语“cdr”、“hcdr1”、“hcdr2”、“hcdr3”、“lcdr1”、“lcdr2”和“lcdr3”除非说明书中另有明确说明,包括上文kabat、chothia或imgt描述的任何方法定义的cdr。
[0119]
取决于重链恒定结构域氨基酸序列,免疫球蛋白可分为五个主要类别:iga、igd、ige、igg和igm。iga和igg进一步细分为同种型iga1、iga2、igg1、igg2、igg3和igg4。基于其恒定结构域的氨基酸序列,任何脊椎动物物种的抗体轻链都可以归为两种明显不同的类型之一,即κ(κ)和λ(λ)。
[0120]
如本文所用,“抗体片段”或“抗原结合片段”是指保留亲本全长抗体的抗原结合特性的免疫球蛋白分子的部分。示例性抗原结合片段是重链互补决定区(hcdr)1、2和3、轻链
互补决定区(lcdr)1、2和3、重链可变区(vh)、轻链可变区(vl)、fab、f(ab')2、fd和fv片段以及由一个vh或vl结构域组成的结构域抗体(dab)。vh和vl结构域可以通过合成接头连接在一起以形成各种类型的单链抗体设计,其中vh/vl结构域可以分子内配对,或者在vh和vl结构域由单独的单链抗体构建体表达的情况下分子间配对,以形成单价抗原结合位点,例如单链fv(scfv)或双抗体;例如在国际专利公布no. wo1998/44001, wo1988/01649, wo1994/13804和wo1992/01047中描述。
[0121]
如本文所用,“单克隆抗体”是指在每条重链和每条轻链中具有单一氨基酸组成的抗体群体,除了可能的众所周知的改变,例如从抗体重链去除c-末端赖氨酸。单克隆抗体通常结合一个抗原表位,除了多特异性单克隆抗体结合两个或更多个不同的抗原或表位。双特异性单克隆抗体结合两个不同的抗原表位。单克隆抗体可以在抗体群内具有异质糖基化。单克隆抗体可以是单特异性的或多特异性的,或者是单价的、二价的或多价的。多特异性抗体,例如双特异性抗体或三特异性抗体包括在术语单克隆抗体中。
[0122]
如本文所用,“人源化抗体”是指其中至少一个cdr来源于非人类物种并且可变区框架来源于人类免疫球蛋白序列的抗体。人源化抗体可以包括在框架区中有意引入的突变,以致框架可能不是表达的人免疫球蛋白或种系基因序列的精确拷贝。
[0123]
如本文所用,“人抗体”是指具有重链和轻链可变区的抗体,其中框架和所有6个cdr均源自人源序列。如果抗体包含恒定区或恒定区的一部分,则恒定区也来源于人源序列。如果抗体的可变区获自使用人种系免疫球蛋白或重排免疫球蛋白基因的系统,则人抗体包含“衍生自”人源序列的重链或轻链可变区。此类示例性系统是展示在噬菌体上的人免疫球蛋白基因文库,以及如本文所述携带人免疫球蛋白基因座的转基因非人动物例如小鼠或大鼠。当与人种系免疫球蛋白或重排的免疫球蛋白基因相比时,“人抗体”可能包含氨基酸差异,这是由于例如天然发生的体细胞突变或有意将取代引入框架或抗原结合位点,或两者。通常,“人抗体”与人种系免疫球蛋白或重排免疫球蛋白基因编码的氨基酸序列具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性。在一些情况下,“人抗体”可以包含源自人框架序列分析的共有框架序列,例如描述于knappik等人, (2000) j mol biol 296:57-86,或并入展示在噬菌体上的人免疫球蛋白基因文库中的合成hcdr3,例如描述于shi等人, (2010) j mol biol 397:385-96和国际专利公布no. wo2009/085462。
[0124]
源自人免疫球蛋白序列的人抗体可以使用诸如结合合成cdr和/或合成框架的噬菌体展示的系统产生,或者可以进行体外诱变以改进抗体特性,导致体内人抗体种系库不表达的抗体。
[0125]
如本文所用,“表位”是指抗体特异性结合的抗原部分。表位通常由具有化学活性(例如极性、非极性或疏水性)的表面集群部分组成,例如氨基酸或多糖侧链,可以具有特定的三维结构特征,以及特定的电荷特征。表位可由形成构象空间单位的连续和/或不连续氨基酸组成。对于不连续的表位,来自抗原线性序列不同部分的氨基酸通过蛋白质分子的折叠在3维空间中非常接近。抗体“表位”取决于用于鉴定表位的方法。
[0126]
如本文所用,“多特异性”是指特异性结合至少两种不同抗原或抗原内的两种不同表位,例如三个、四个或五个不同抗原或表位的抗体。
[0127]
如本文所用,“双特异性”是指特异性结合两种不同抗原或同一抗原内的两种不同
表位的抗体。
[0128]
如本文所用,“pd-1”是指程序性死亡-1蛋白,一种t细胞共抑制剂,也称为cd279或pdcd1。全长pd-1的代表性氨基酸序列在genbank中作为登录号np005009.2提供。术语“pd-1”包括蛋白质变体和重组pd-1或其片段。本技术中的“pd-1”是指人类成熟的pd-1,除非另有明确说明。
[0129]
pd-1是一种288个氨基酸的蛋白质受体,在活化的t细胞和b细胞、自然杀伤细胞和单核细胞上表达。pd-1是t细胞共抑制受体的cd28/ctla-4(细胞毒性t淋巴细胞抗原)/icos(诱导型共刺激物)家族的成员(chen等人 2013, nat. rev. immunol. 13 : 227-242)。该蛋白具有igv样的细胞外n端结构域、跨膜结构域和包含基于免疫受体酪氨酸抑制(itim)基序和基于免疫受体酪氨酸开关(itsm)基序的胞内结构域(chattopadhyay等人 2009, immunol. rev.)。pd-1的主要功能是减弱免疫应答(riley 2009, immunol. rev. 229: 114-125)。pd-1有两个配体,pd-配体1(pd-l1)和pd-l2。pd-l1(cd274,b7h 1)在淋巴和非淋巴组织,例如cd4和cd8 t细胞、巨噬细胞谱系细胞、外周组织以及肿瘤细胞、病毒感染细胞和自身免疫组织细胞上广泛表达。pd-l2(cd273,b7-dc)具有比pd-l1更受限制的表达,在活化的树突细胞和巨噬细胞上表达(dong等人 1999, nature med.)。pd-1与其配体结合导致减少的t细胞增殖和细胞因子分泌,破坏体液和细胞免疫应答。
[0130]
如本文所用,“pd-l1”是指程序性死亡配体1,也称为cd274和b7h1。全长pd-l1的氨基酸序列提供于genbank,登录号是np_054862.1。术语“pd-l1”还包括蛋白质变体和重组pd-l1或其片段。除非指定为来自非人类物种,否则术语“pd-l1”是指人类pd-l1。
[0131]
pd-l1是290个氨基酸的蛋白质,具有细胞外igv样和igc样结构域(全长pd-l1的氨基酸19-239)、跨膜结构域和约30个氨基酸的细胞内结构域。pd-l1在许多细胞上组成型表达,例如抗原呈递细胞(例如树突细胞、巨噬细胞和b细胞)以及造血和非造血细胞(例如血管内皮细胞、胰岛和免疫特权部位)。pd-l1也在多种肿瘤和病毒感染的细胞上表达,是免疫抑制环境的组分(ribas 2012, nejm 366: 2517-2519)。pd-l1与两种t细胞共抑制剂pd-1和b7-1之一结合。
[0132]
t细胞共刺激和共抑制分子(统称为共信号传导分子)在调节t细胞活化、亚群分化、效应子功能和存活中起关键作用(chen等人2013, nature rev. immunol. 13 : 227-242)。在t细胞受体识别抗原呈递细胞上的同源肽-mhc复合物后,共信号传导受体与t细胞受体在免疫突触处共定位,它们与tcr信号传导协同作用以促进或抑制t细胞激活和功能(flies等人 2011, yale j. biol. med. 84: 409-421)。最终的免疫应答受共刺激和共抑制信号(“免疫检查点”)之间的平衡调节(pardoll 2012, nature 12: 252-264)。虽然不希望受理论束缚,但目前认为pd-1在介导外周t细胞耐受性和避免自身免疫中作为一个这样的“免疫检查点”起作用。pd-1与pd-l1或pd-l2结合并抑制t细胞活化。慢性病毒感染和肿瘤利用pd-1抑制t细胞活化的能力来逃避免疫应答。在慢性病毒感染中,pd-1在病毒特异性t细胞上高度表达,这些t细胞变得“疲惫”,失去效应子功能和增殖能力(freeman 2008, pnas 105: 10275-1 0276)。pd-1:pd-l1系统还在诱导的t调节(treg)细胞发育和维持treg功能中发挥重要作用(francisco等人2010, immunol. rev. 236:219-242)。
[0133]
如本文所用,“拮抗剂”是指当与细胞蛋白质结合时抑制由蛋白质的天然配体诱导的至少一种反应或活性的分子。当所述至少一种反应或活性被抑制超过不存在拮抗剂(例
如,阴性对照)时抑制的所述至少一种反应或活性至少约30%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%时,或当与不存在拮抗剂时的抑制相比时所述抑制具有统计学意义时,分子是拮抗剂。拮抗剂可以是抗体、可溶性配体、小分子、dna或rna如sirna。示例性拮抗剂是特异性结合pd-1或pd-l1的拮抗抗体。由pd-1与其受体pd-l1或pd-l2结合诱导的典型反应或活性可以是减少的抗原特异性cd4 或cd8 细胞增殖或减少的由t细胞的干扰素-γ(ifn-γ)产生,导致免疫应答的抑制。因此,特异性结合pd-1的拮抗性pd-1抗体或特异性结合pd-l1的抗pd-l1抗体通过抑制抑制性途径诱导免疫应答。
[0134]
在一些实施方案中,抗pd-1抗体或其抗原结合片段具有以下特性中的一种、两种、三种、四种或五种:a)以剂量依赖性方式增强抗原特异性cd4
或cd8
t细胞的活化,其中使用如us20170121409的实施例1中所述的巨细胞病毒抗原回忆测定法(cmv测定法)测量该活化,其通过引用整体并入本文;b)以小于约100nm的平衡解离常数(kd)结合人pd-1,其中kd使用proteon xpr36系统在 25
°
c下测量;c)以小于约1nm的kd结合人pd-1,其中kd使用proteon xpr36系统在 25
°
c下测量;d)以小于约100nm的kd结合食蟹猴pd-1,其中kd使用proteon xpr36系统在 25
°
c下测量,或e)以小于约1nm的kd结合食蟹猴pd-1,其中kd使用proteon xpr36系统在 25
°
c下测量。
[0135]
在一些实施方案中,抗pd-l1抗体或其抗原结合片段具有以下特性中的一种、两种、三种、四种或五种:a)以剂量依赖性方式增强抗原特异性cd4
或cd8
t细胞的活化,其中使用如us20170121409的实施例1中所述的巨细胞病毒抗原回忆测定法(cmv测定法)测量该活化,其通过引用整体并入本文;b)以小于约100nm的平衡解离常数(kd)结合人pd-l1,其中kd使用proteon xpr36系统在 25
°
c下测量;c)以小于约1nm的kd结合人pd-l1,其中kd使用proteon xpr36系统在 25
°
c下测量;d)以小于约100nm的kd结合食蟹猴pd-l1,其中kd使用proteon xpr36系统在 25
°
c下测量,或e)以小于约1nm的kd结合食蟹猴pd-l1,其中kd使用proteon xpr36系统在 25
°
c下测量。
[0136]
抗体对人或食蟹猴pd-1或pd-l1的亲和力可以使用任何合适的方法通过实验确定。这样的方法可以利用本领域技术人员已知的proteon xpr36、biacore 3000或kinexa仪器、elisa或竞争性结合测定。如果在不同条件(例如,渗透压、ph)下测量,特定抗体/pd-1或抗体/pd-l1相互作用的测量亲和力可能不同。因此,亲和力和其他结合参数(例如,kd、k
on
、k
off
)的测量通常使用标准化条件和标准化缓冲液进行。本领域技术人员将理解,对于通常检测限内的测量,例如使用biacore 3000或proteon进行亲和力测量的内部误差(测量为标准偏差,sd)通常可以在5-33%内。因此,kd上下文中的术语“约”反映了测定中的通常的标准偏差。例如,1
×
10
−9m的kd的通常的sd最高达 0.33
×
10
−9m。
h2m7780n, h2m7788n, h2m7790n, h2m7791n, h2m7794n, h2m7795n, h2m7796n, h2m7798n, h4h9019p, h4xh9034p2, h4xh9035p2, h4xh9037p2, h4xh9045p2, h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab或其变体;(b)结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体;或(c)纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0143]
如本文所用,关于抗体的术语“其等同物”是指例如与参考抗体具有基本相同的cdr,结合基本相同的表位并具有基本相同的生物学活性的抗体。
[0144]
本文所述的抗pd-1或抗pd-l1抗体或其抗原结合片段的变体在本技术的范围内。例如,变体可以在vh和/或vl中包含1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个或15个氨基酸取代,只要与亲本抗体相比,同源抗体保留或具有改进的功能特性。在一些实施方案中,序列同一性可以是与本技术的vh或vl氨基酸序列相比约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。任选地,变体与亲本抗体相比的任何变化都不在变体的cdr内。
[0145]
还提供了特异性结合pd-1或pd-l1的拮抗性抗体或其抗原结合片段,包括包含hcdr1、hcdr2和hcdr3序列的vh和包含lcdr1、lcdr2和lcdr3序列的vl,其中一个或多个cdr序列包含基于本文所述的抗体的特定氨基酸序列或其保守修饰,并且其中抗体保留本技术的特异性结合pd-1或pd-l1的亲本拮抗性抗体的所需功能特性。
[0146]“保守修饰”是指不显著影响或改变包含氨基酸序列的抗体的结合特性的氨基酸修饰。保守修饰包括氨基酸取代、添加和缺失。保守取代是其中氨基酸被具有相似侧链的氨基酸残基替代的那些。
[0147]
具有相似侧链的氨基酸残基家族已明确定义,包括具有酸性侧链(例如天冬氨酸、谷氨酸)、碱性侧链(例如赖氨酸、精氨酸、组氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸)、不带电荷的极性侧链(例如,甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸、色氨酸)、芳族侧链(例如,苯丙氨酸、色氨酸、组氨酸、酪氨酸)、脂族侧链(例如,甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸)、酰胺(例如,天冬酰胺、谷氨酰胺)、β-支链侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和含硫侧链(半胱氨酸、蛋氨酸)的氨基酸。此外,多肽中的任何天然残基也可以用丙氨酸取代,如先前对丙氨酸扫描诱变所描述的(maclennan等人, acta physiol. scand. suppl. 643:55-67, 1998; sasaki等人, adv. biophys. 35:1-24, 1998)。本技术的抗体的氨基
pol抗原的编码序列可以存在于相同的分离的或非天然存在的核酸分子(dna或rna)中,或存在于两种不同的分离的或非天然存在的核酸分子(dna或rna)中。
[0154]
在本技术的一个实施方案中,组合物包含载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码截短的hbv核心抗原的多核苷酸,所述截短的hbv核心抗原由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成。
[0155]
在本技术的一个实施方案中,组合物包含载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码hbv pol抗原的多核苷酸,所述hbv pol抗原包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列。
[0156]
在本技术的一个实施方案中,组合物包含载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码截短的hbv核心抗原的多核苷酸,所述截短的hbv核心抗原由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成;和载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码hbv pol抗原的多核苷酸,所述hbv pol抗原包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列。包含截短的hbv核心抗原的编码序列的载体和包含hbv pol抗原的编码序列的载体可以是同一载体或两种不同的载体。
[0157]
在本技术的一个实施方案中,组合物包含载体,优选dna质粒或病毒载体(诸如腺病毒载体),其包含编码融合蛋白的多核苷酸,所述融合蛋白包含可操作地连接至hbv pol抗原的截短的hbv核心抗原,所述截短的hbv核心抗原由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成,所述hbv pol抗原包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列,或反之亦然。优选地,所述融合蛋白进一步包含接头,所述接头将截短的hbv核心抗原可操作地连接至hbv pol抗原,或反之亦然。优选地,所述接头具有(alagly)n的氨基酸序列,其中n是2-5的整数。
[0158]
在本技术的一个实施方案中,组合物包含分离的或非天然存在的截短的hbv核心抗原,其由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成。
[0159]
在本技术的一个实施方案中,组合物包含分离的或非天然存在的hbv pol抗原,其包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列。
[0160]
在本技术的一个实施方案中,组合物包含分离的或非天然存在的截短的hbv核心抗原,其由与seq id no: 2或seq id no: 4具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成;和分离的或非天然存在的hbv pol抗原,其包含与seq id no: 7具有至少90%同一性、优选地与seq id no: 7具有100%同一性的氨基酸序列。
[0161]
在本技术的一个实施方案中,组合物包含分离的或非天然存在的融合蛋白,其包含可操作地连接至hbv pol抗原的截短的hbv核心抗原,所述截短的hbv核心抗原由与seq id no: 2或seq id no: 14具有至少90%同一性、优选地与seq id no: 2或seq id no: 4具有100%同一性的氨基酸序列组成,所述hbv pol抗原包含与seq id no: 7具有至少90%同一
性、优选地与seq id no: 7具有100%同一性的氨基酸序列,或反之亦然。优选地,所述融合蛋白进一步包含接头,所述接头将截短的hbv核心抗原可操作地连接至hbv pol抗原,或反之亦然。优选地,所述接头具有(alagly)n的氨基酸序列,其中n是2-5的整数。
[0162]
在本技术的一个实施方案中,组合物包含抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0163]
在优选实施方案中,可用于本发明的抗pd-1或抗pd-l1抗体或其片段是纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559或阿特珠单抗(tecentriq, genentech)或其等同物。
[0164]
本技术也涉及包含多核苷酸的治疗组合或试剂盒,所述多核苷酸表达根据本技术的实施方案的截短的hbv核心抗原和hbv pol抗原和/或根据本技术的实施方案的抗pd-1或抗pd-l1抗体或其抗原结合片段。本文描述的本技术的编码hbv核心和pol抗原的任何多核苷酸和/或载体可以用在本技术的治疗组合或试剂盒中,且本文描述的本技术的任何抗pd-1或抗pd-l1抗体或其抗原结合片段可以用在本技术的治疗组合或试剂盒中。
[0165]
根据本技术的实施方案,用于在有此需要的受试者中治疗hbv感染的治疗组合或试剂盒包含:i)以下至少一种:a)截短的hbv核心抗原,其由与seq id no: 2具有至少95%同一性的氨基酸序列组成,和b)第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,c) hbv聚合酶抗原,其具有与seq id no: 7具有至少90%同一性的氨基酸序列,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性,和d)第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列;和ii)抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0166]
在本技术的一个特定实施方案中,治疗组合或试剂盒包含:i)第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述截短的hbv核心抗原由与seq id no: 2具有至少95%同一性的氨基酸序列组成;ii)第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列,所述hbv聚合酶抗原具有与seq id no: 7具有至少90%同一性的氨基酸序列,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性;和iii)抗pd-1或抗pd-l1抗体或其抗原结合片段。
[0167]
根据本技术的实施方案,疫苗组合或试剂盒中的多核苷酸可以连接或分开,使得从这样的多核苷酸表达的hbv抗原融合在一起或产生为分开的蛋白,无论是由相同的还是不同的多核苷酸表达。在一个实施方案中,第一种和第二种多核苷酸存在于分开的载体(例如,dna质粒或病毒载体)中,在相同或分开的组合物中联合使用,使得表达的蛋白也是分开的蛋白,但联合使用。在另一个实施方案中,由第一种和第二种多核苷酸编码的hbv抗原可
id no: 19的cmv启动子序列,增强子序列,优选seq id no: 12的apoai基因片段序列,和编码信号肽序列(优选具有seq id no: 15的氨基酸序列的免疫球蛋白分泌信号)的多核苷酸序列;和可操作地连接至编码hbv抗原的多核苷酸的下游序列,其包含多腺苷酸化信号,优选seq id no: 13的sv40多腺苷酸化信号。
[0173]
当本技术的治疗组合包含第一载体(诸如dna质粒或病毒载体)和第二载体(诸如dna质粒或病毒载体)时,第一和第二载体各自的量没有特别限制。例如,第一种dna质粒和第二种dna质粒可以以10:1至1:10(按重量计)的比例存在,诸如10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9或1:10(按重量计)。优选地,第一种和第二种dna质粒以1:1(按重量计)的比例存在。本技术的治疗组合可以进一步包含第三载体,其编码可用于治疗hbv感染的第三活性剂。
[0174]
本技术的组合物和治疗组合可以包含额外的多核苷酸或载体,其编码额外的hbv抗原和/或额外的hbv抗原或其免疫原性片段,诸如hbsag、hbv l蛋白或hbv包膜蛋白,或编码它们的多核苷酸序列,或根据本技术的实施方案的抗pd-1或抗pd-l1抗体或其抗原结合片段。但是,在特定实施方案中,本技术的组合物和治疗组合不包含某些抗原。
[0175]
在一个特定实施方案中,本技术的组合物或治疗组合或试剂盒不包含hbsag或编码hbsag的多核苷酸序列。
[0176]
在另一个特定实施方案中,本技术的组合物或治疗组合或试剂盒不包含hbv l蛋白或编码hbv l蛋白的多核苷酸序列。
[0177]
在本技术的另一个特定实施方案中,本技术的组合物或治疗组合不包含hbv包膜蛋白或编码hbv包膜蛋白的多核苷酸序列。
[0178]
本技术的组合物和治疗组合还可以包含药学上可接受的载体。药学上可接受的载体是无毒的,且不应干扰活性成分的效力。药学上可接受的载体可以包括一种或多种赋形剂诸如粘合剂、崩解剂、膨胀剂、助悬剂、乳化剂、润湿剂、润滑剂、调味剂、甜味剂、防腐剂、染料、增溶剂和包衣剂。药学上可接受的载体可以包括媒介物,诸如脂质纳米颗粒(lnp)。载体或其它材料的精确性质可取决于施用途径,例如,肌肉内、真皮内、皮下、口服、静脉内、皮肤、粘膜内(例如,肠道)、鼻内或腹膜内途径。对于液体可注射制剂,例如悬浮液和溶液,合适的载体和添加剂包括水、二醇、油、醇、防腐剂、着色剂等。对于固体口服制剂,例如粉剂、胶囊剂、囊片、囊形片和片剂,合适的载体和添加剂包括淀粉、糖、稀释剂、造粒剂、润滑剂、粘合剂、崩解剂等。对于鼻腔喷雾剂/吸入剂混合物,水溶液/悬浮液可以包含水、二醇、油、软化剂、稳定剂、润湿剂、防腐剂、芳族化合物、矫味剂等作为合适的载体和添加剂。
[0179]
可以以适合施用给受试者以促进施用和提高效力的任何方式配制本技术的组合物和治疗组合,包括、但不限于口服(肠内)施用和胃肠外注射。胃肠外注射包括静脉内注射或输注、皮下注射、真皮内注射和肌肉内注射。本技术的组合物也可以配制用于其它施用途径,包括透粘膜、眼部、直肠、长效植入、舌下施用、在舌下、从口腔粘膜绕过门静脉循环、吸入或鼻内。
[0180]
在本技术的一个优选的实施方案中,将本技术的组合物和治疗组合配制用于胃肠外注射,优选皮下、真皮内注射或肌肉内注射,更优选肌肉内注射。
[0181]
根据本技术的实施方案,用于施用的组合物和治疗组合通常包含在药学上可接受的载体中的缓冲溶液,所述载体是例如水性载体诸如缓冲盐水等,例如磷酸盐缓冲盐水
(pbs)。组合物和治疗组合还可以含有接近生理条件所需的药学上可接受的物质,例如ph调节剂和缓冲剂。例如,包含质粒dna的本技术的组合物或治疗组合可以含有磷酸盐缓冲盐水(pbs)作为药学上可接受的载体。质粒dna可以以例如0.5 mg/ml至5 mg/ml的浓度存在,诸如0.5 mg/ml、1mg/ml、2 mg/ml、3 mg/ml、4 mg/ml或5 mg/ml,优选1 mg/ml。
[0182]
根据本领域众所周知的方法,可以将本技术的组合物和治疗组合配制成疫苗(也被称作“免疫原性组合物”)。这样的组合物可以包括佐剂以增强免疫应答。考虑到本公开内容,可以通过本领域技术人员众所周知的技术来确定制剂中每种组分的最佳比例。
[0183]
在本技术的一个特定实施方案中,组合物或治疗组合是dna疫苗。dna疫苗通常包含细菌质粒,所述细菌质粒含有在强真核启动子控制下的编码感兴趣抗原的多核苷酸。一旦质粒被递送到宿主的细胞质中,编码的抗原就被内源性地产生和加工。得到的抗原通常诱导体液和细胞介导的免疫应答。dna疫苗是有利的,至少因为它们提供了改善的安全性,是温度稳定的,可以容易地适应表达抗原变体,并且易于生产。本技术的任何dna质粒均可用于制备这样的dna疫苗。
[0184]
在本技术的其它特定实施方案中,组合物或治疗组合是rna疫苗。rna疫苗通常包含至少一种单链rna分子,其编码感兴趣的抗原,例如根据本技术的融合蛋白或hbv抗原。一旦rna被递送到宿主的细胞质中,编码的抗原就会内源性地产生和加工,从而诱导体液和细胞介导的免疫应答,这类似于dna疫苗。可以对rna序列进行密码子优化以提高翻译效率。考虑到本公开内容,可以通过本领域已知的任意方法修饰rna分子以增强稳定性和/或翻译,例如通过添加聚腺苷酸尾巴,例如至少30个腺苷残基;和/或用修饰的核糖核苷酸(例如,7-甲基鸟苷帽)给5-末端加帽,其可以在rna合成过程中掺入或在rna转录后进行酶工程改造。rna疫苗也可以是从甲病毒属表达载体开发的自复制的rna疫苗。自复制rna疫苗包含复制酶rna分子,该分子衍生自属于甲病毒科的病毒,其亚基因组启动子控制融合蛋白或hbv抗原rna的复制,随后是位于复制酶下游的人工聚腺苷酸尾巴。
[0185]
在某些实施方案中,其它佐剂可以被包含在本技术的组合物或治疗组合中,或与本技术的组合物或治疗组合共同施用。另一种佐剂的使用是任选的,并且当组合物用于疫苗接种目的时可以进一步增强免疫应答。适合于根据本技术共同施用或包含在组合物中的其它佐剂应优选地是这样的:其为在人类中潜在安全的、较好耐受的和有效的。佐剂可以是小分子或抗体,包括、但不限于,免疫检查点抑制剂(例如,抗-pd-1、抗-tim-3等)、toll-样受体激动剂(例如,tlr7激动剂和/或tlr8激动剂)、rig-1激动剂、il-15超激动剂(altor bioscience)、突变体irf3和irf7遗传佐剂、sting激动剂(aduro)、flt3l遗传佐剂和il-7-hyfc。例如,佐剂可以例如选自下述抗-hbv剂:hbv dna聚合酶抑制剂;免疫调节剂;toll-样受体7调节剂;toll-样受体8调节剂;toll-样受体3调节剂;干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;toll样受体9调节剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;靶向病毒mrna的反义寡核苷酸,更特别是抗-hbv反义寡核苷酸;短干扰rna (sirna),更特别是抗-hbv sirna;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒的表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,诸如il12;衣壳组装调节剂, 核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸可诱导基因1的刺激物;nod2的刺激物;重组胸腺素α-1;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;
免疫检查点抑制剂,诸如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂、ctla-4抑制剂;在免疫细胞(更具体地t细胞)上表达的共刺激性受体诸如cd27和cd28的激动剂;btk抑制剂;用于治疗hbv的其它药物;ido抑制剂;精氨酸酶抑制剂;和kdm5抑制剂。
[0186]
在某些实施方案中,第一种和第二种非天然存在的核酸分子中的每一种独立地用脂质纳米颗粒(lnp)配制。
[0187]
本技术也提供了制备本技术的组合物和治疗组合的方法。生产组合物或治疗组合的方法包括将本技术的编码hbv抗原、载体和/或多肽的分离的多核苷酸与一种或多种药学上可接受的载体混合。本领域普通技术人员熟悉用于制备这样的组合物的常规技术。
[0188]
诱导免疫应答或治疗hbv感染的方法本技术也提供了在有此需要的受试者中诱导针对乙型肝炎病毒(hbv)的免疫应答的方法,所述方法包括给所述受试者施用免疫原性上有效量的本技术的组合物或免疫原性组合物。本文描述的本技术的组合物和治疗组合中的任一种可以用在本技术的方法中。
[0189]
本文中使用的术语“感染”表示病原体侵入宿主。当病原体能够侵入宿主并在宿主内复制或繁殖时,它被认为是“传染性的”。传染因子的例子包括病毒,例如hbv和某些种类的腺病毒、朊病毒、细菌、真菌、原生动物等。“hbv感染”特别表示hbv侵入宿主生物体,诸如宿主生物体的细胞和组织。
[0190]
在参考本文所述的方法使用时,短语“诱导免疫应答”涵盖在有此需要的受试者中引起针对感染(例如,hbv感染)的期望免疫应答或效果。“诱导免疫应答”也涵盖提供治疗性免疫以治疗致病体,例如,hbv。本文中使用的术语“治疗性免疫”或“治疗性免疫应答”是指,接种疫苗的受试者能够控制疫苗接种所针对的致病体的感染,例如通过接种hbv疫苗赋予的针对hbv感染的免疫。在一个实施方案中,“诱导免疫应答”是指在有此需要的受试者中产生免疫,例如,以提供针对疾病诸如hbv感染的治疗效果。在某些实施方案中,“诱导免疫应答”表示引起或改善针对hbv感染的细胞免疫,例如,t细胞应答。在某些实施方案中,“诱导免疫应答”表示引起或改善针对hbv感染的体液免疫应答。在某些实施方案中,“诱导免疫应答”表示引起或改善针对hbv感染的细胞和体液免疫应答。
[0191]
本文中使用的术语“保护性免疫”或“保护性免疫应答”是指,接种疫苗的受试者能够控制疫苗接种所针对的致病体的感染。通常,已经产生“保护性免疫应答”的受试者仅出现轻度至中度临床症状或根本不出现症状。通常,具有针对某种病原体的“保护性免疫应答”或“保护性免疫”的受试者不会因所述病原体的感染而死亡。
[0192]
通常,本技术的组合物和治疗组合的施用将具有治疗目的,以在hbv感染后或出现hbv感染的特征性症状后产生针对hbv的免疫应答,例如用于治疗性疫苗接种。
[0193]
本文中使用的“免疫原性上有效量”或“免疫学上有效量”是指,足以在有此需要的受试者中诱导期望的免疫效果或免疫应答的组合物、多核苷酸、载体或抗原的量。免疫原性上有效量可以是足以在有此需要的受试者中诱导免疫应答的量。免疫原性上有效量可以是足以在有此需要的受试者中产生免疫的量,例如提供针对疾病诸如hbv感染的治疗效果。免疫原性上有效量可以根据多种因素而变化,诸如受试者的身体状况、年龄、重量、健康等;特定应用,例如提供保护性免疫或治疗性免疫;以及免疫期望针对的特定疾病,例如病毒感染。考虑到本公开内容,免疫原性上有效量可以由本领域普通技术人员容易地确定。
[0194]
在本技术的特定实施方案中,免疫原性上有效量表示足以实现以下效果中的一
种、两种、三种、四种或更多种的组合物或治疗组合的量:(i)降低或改善hbv感染或与之相关的症状的严重程度;(ii)减少hbv感染或与之相关的症状的持续时间;(iii)防止hbv感染或与之相关的症状的进展;(iv)造成hbv感染或与之相关的症状的消退;(v)预防hbv感染或与之相关的症状的发展或发作;(vi)防止hbv感染或与之相关的症状的复发;(vii)减少具有hbv感染的受试者的住院治疗;(viii)减少具有hbv感染的受试者的住院治疗长度;(ix)提高具有hbv感染的受试者的存活率;(x)消除受试者中的hbv感染;(xi)抑制或减少受试者中的hbv复制;和/或(xii)增强或改善另一种疗法的预防或治疗效果。
[0195]
免疫原性上有效量也可以是这样的量,其足以降低与临床血清转化进化一致的hbsag水平;实现受试者的免疫系统对与被感染的肝细胞的减少相关的持续hbsag清除;诱导hbv-抗原特异性的活化的t-细胞群体;和/或在12个月内实现hbsag持续消失。目标指数的例子包括低于500个hbsag国际单位(iu)拷贝的阈值的较低hbsag和/或较高cd8计数。
[0196]
作为一般指导,当参考dna质粒使用时,免疫原性上有效量可以在约0.1 mg/ml至10 mg/ml总dna质粒的范围内,诸如0.1 mg/ml、0.25 mg/ml、0.5 mg/ml. 0.75 mg/ml 1 mg/ml、1.5 mg/ml、2 mg/ml、3 mg/ml、4 mg/ml、5 mg/ml、6 mg/ml、7 mg/ml、8 mg/ml、9 mg/ml或10 mg/ml。优选地,dna质粒的免疫原性上有效量小于8 mg/ml,更优选地小于6 mg/ml,甚至更优选地3-4 mg/ml。免疫原性上有效量可以来自一种载体或质粒,或来自多种载体或质粒。作为进一步的一般指导,当参考肽使用时,免疫原性上有效量可以在每次施用约10
µ
g至1 mg的范围内,诸如每次施用10、20、50、100、200、300、400、500、600、700、800、9000或1000
µ
g。免疫原性上有效量可以在单一组合物中或在多个组合物中施用,诸如1、2、3、4、5、6、7、8、9或10个组合物(例如,片剂、胶囊剂或注射剂,或适用于真皮内递送的任何组合物,例如,适用于使用真皮内递送贴剂的真皮内递送),其中多个胶囊剂或注射剂的施用共同为受试者提供免疫原性上有效量。例如,当使用两种dna质粒时,免疫原性上有效量可以是3-4 mg/ml,其中每种质粒为1.5-2 mg/ml。在所谓的初免-强化方案中,也可能给受试者施用免疫原性上有效量,并随后给同一受试者施用免疫原性上有效量的另一个剂量。初免-强化方案的这种一般概念是疫苗领域的技术人员众所周知的。如果需要,可以任选地将进一步强化施用添加到该方案中。
[0197]
通过混合两种质粒并将混合物递送至单个解剖学部位,可以将包含两种dna质粒(例如,编码hbv核心抗原的第一种dna质粒和编码hbv pol抗原的第二种dna质粒)的治疗组合施用给受试者。可替换地,可以进行两次分开的免疫接种,每次递送单一表达质粒。在这样的实施方案中,无论两种质粒在单次免疫接种中还是作为两次分开免疫接种的混合物施用,第一种dna质粒和第二种dna质粒都可以以10:1至1:10(按重量计)的比例施用,诸如10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9或1:10(按重量计)。优选地,第一种和第二种dna质粒以1:1(按重量计)的比例施用。
[0198]
作为一般指导,当参考抗pd-1或抗pd-l1抗体或其抗原结合片段使用时,免疫原性上有效量可以在约0.005 mg/kg至约100 mg/kg的范围内,例如约0.05 mg/kg至约30 mg/kg或约5 mg/kg至约25 mg/kg,或约4 mg/kg,约8 mg/kg,约16mg/kg或约24 mg/kg,或例如约1, 2, 3, 4, 5, 6, 7, 8, 9或10 mg/kg,但可以甚至更高,例如约15、16、17、18、19、20、21、22、23、24、25、30、40、50、60、70、80、90或100 mg/kg。也可以施用固定的单位剂量,例如50、100、200、500或1000 mg,或者剂量可以基于患者的表面积,例如,500、400、300、250、200
或100 mg/m2。通常可以施用1至8个(例如,1、2、3、4、5、6、7或8个)剂量来治疗患者,但可以施用9、10、11、12、13、14、15、16、17、18、19、20个或更多个剂量。
[0199]
可以在一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间以后重复本技术的抗体或其抗原结合片段的施用。重复的疗程也是可能的,慢性施用也是如此。重复的施用可以是在相同剂量或在不同剂量。例如,本技术的抗体或其抗原结合片段可以8mg/kg或16mg/kg每周间隔施用8周,然后以8mg/kg或16mg/kg每两周施用再持续16周,然后通过静脉输注以8mg/kg或16mg/kg每4周施用。例如,本技术的抗体或其抗原结合片段可以以约0.1-100mg/kg的量的每日剂量提供,例如0.5, 0.9, 1.0, 1.1, 1.5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90或100 mg/kg每天,在治疗开始后第1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39或40天中的至少一天,或者第1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19或20周中的至少一周提供,或其组合,使用每24、12、8、6、4或2小时的单次或分次剂量,或其任何组合。
[0200]
优选地,要根据本技术的方法治疗的受试者是hbv感染的受试者,特别是具有慢性hbv感染的受试者。急性hbv感染的特征是先天免疫系统的有效激活,并辅以随后的广泛适应性应答(例如,hbv-特异性的t-细胞、中和抗体),这通常导致复制的成功抑制或受感染的肝细胞的除去。相反,由于高病毒和抗原载量,这样的应答会受损或减弱,例如,大量产生hbv包膜蛋白,并且可以相对感染性病毒以1,000倍过量以亚病毒颗粒形式释放。
[0201]
以特征在于病毒载量、肝酶水平(坏死性炎症活动)、hbeag或hbsag载量或针对这些抗原的抗体的存在的阶段来描述慢性hbv感染。cccdna水平保持相对稳定在每个细胞大约10到50个拷贝,即使病毒血症可以有很大差异。cccdna物质的持续存在导致慢性化。更具体地,慢性hbv感染的阶段包括:(i)以高病毒载量和正常或轻微升高的肝酶为特征的免疫耐受阶段;(ii)免疫激活hbeag阳性阶段,其中观察到病毒复制水平降低或下降和肝酶显著升高;(iii)非活动性hbsag携带期,这是一种低复制状态,具有低病毒载量和血清中正常的肝酶水平,可能在hbeag血清转化之后;和(iv) hbeag阴性阶段,其中病毒复制周期性地发生(重新激活),伴随肝酶水平的波动,前核心和/或基础核心启动子中的突变是常见的,因此受感染的细胞不会产生hbeag。
[0202]
本文中使用的“慢性hbv感染”表示受试者具有可检测的hbv存在超过6个月。具有慢性hbv感染的受试者可以处于慢性hbv感染的任何阶段。慢性hbv感染按照其在本领域中的普通含义来理解。慢性hbv感染可以例如特征在于,在急性hbv感染后hbsag持续存在6个月或更长。例如,本文所提及的慢性hbv感染遵循疾病控制和预防中心(cdc)公布的定义,根据该定义,慢性hbv感染可以通过实验室标准表征,例如:(i)针对乙型肝炎核心抗原的igm抗体(igm抗-hbc)为阴性,且乙型肝炎表面抗原(hbsag)、乙型肝炎e抗原(hbeag)、或关于乙型肝炎病毒dna的核酸检验为阳性,或(ii) hbsag或关于hbv dna的核酸检验为阳性,或hbeag为阳性2次间隔至少6个月。
[0203]
优选地,免疫原性上有效量表示足以治疗慢性hbv感染的本技术的组合物或治疗组合的量。
[0204]
在某些实施方案中,具有慢性hbv感染的受试者正在接受核苷类似物(nuc)治疗,并且是nuc抑制的。本文中使用的“nuc抑制的”表示受试者具有不可检测的hbv病毒水平和稳定的丙氨酸氨基转移酶(alt)水平至少六个月。核苷/核苷酸类似物治疗的例子包括hbv聚合酶抑制剂,诸如恩替卡韦和替诺福韦。优选地,具有慢性hbv感染的受试者不具有晚期肝纤维化或肝硬化。这样的受试者通常具有小于3的关于纤维化的metavir评分和小于9 kpa的纤维扫描结果。metavir评分是一种评分系统,其常用于在乙型肝炎患者的肝活组织检查中通过组织病理学评价来评估炎症和纤维化的程度。评分系统分配两个标准化数字:一个反映炎症程度,一个反映纤维化程度。
[0205]
据信,慢性hbv的消除或减少可能允许严重肝病的早期疾病拦截,包括病毒诱导的肝硬化和肝细胞癌。因此,本技术的方法也可以用作治疗hbv诱导的疾病的疗法。hbv诱导的疾病的例子包括、但不限于肝硬化、癌症(例如,肝细胞癌)和纤维化,特别是特征在于关于纤维化的metavir评分为3或更高的晚期纤维化。在这样的实施方案中,免疫原性上有效量是足以在12个月内实现hbsag的持续消失并显著减少临床疾病(例如,肝硬化、肝细胞癌等)的量。
[0206]
根据本技术的实施方案的方法进一步包括与本技术的组合物联合地给有此需要的受试者施用另一种免疫原性药剂(诸如另一种hbv抗原或其它抗原)或另一种抗-hbv药剂(诸如核苷类似物或其它抗-hbv药剂)。例如,另一种抗-hbv药剂或免疫原性药剂可以是小分子或抗体,包括、但不限于,免疫检查点抑制剂(例如,抗-pd-1、抗-tim-3等),toll-样受体激动剂(例如,tlr7激动剂和/或tlr8激动剂), rig-1激动剂, il-15超激动剂(altor bioscience), 突变体irf3和irf7遗传佐剂, sting激动剂(aduro), flt3l遗传佐剂, il12遗传佐剂, il-7-hyfc;结合hbv包膜的car-t (s-car细胞);衣壳组装调节剂;cccdna抑制剂, hbv聚合酶抑制剂(例如,恩替卡韦和替诺福韦)。一种或其它抗-hbv活性剂可以是,例如,小分子、抗体或其抗原结合片段、多肽、蛋白或核酸。一种或其它抗-hbv药剂可以例如选自:hbv dna聚合酶抑制剂;免疫调节剂;toll-样受体7调节剂;toll-样受体8调节剂;toll-样受体3调节剂;干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;toll样受体9调节剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;靶向病毒mrna的反义寡核苷酸,更特别是抗-hbv反义寡核苷酸;短干扰rna (sirna),更特别是抗-hbv sirna;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒的表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,诸如il12;衣壳组装调节剂, 核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸可诱导基因1的刺激物;nod2的刺激物;重组胸腺素α-1;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,诸如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂和ctla-4抑制剂;在免疫细胞(更具体地t细胞)上表达的共刺激性受体诸如cd27、cd28的激动剂;btk抑制剂;用于治疗hbv的其它药物;ido抑制剂;精氨酸酶抑制剂;和kdm5抑制剂。
[0207]
递送的方法考虑到本公开内容,通过本领域已知的任意方法,包括、但不限于,胃肠外施用(例如,肌肉内、皮下、静脉内或真皮内注射)、口服施用、透皮施用和鼻施用,可以将本技术的组合物和治疗组合施用给受试者。优选地,胃肠外地(例如,通过肌肉内注射或真皮内注射)或
透皮地施用组合物和治疗组合。
[0208]
在其中组合物或治疗组合包含一种或多种dna质粒的本技术的某些实施方案中,施用可以是通过皮肤注射,例如肌肉内或真皮内注射,优选肌肉内注射。肌肉内注射可以与电穿孔组合,即施加电场以促进dna质粒向细胞的递送。本文中使用的术语“电穿孔”表示使用跨膜电场脉冲在生物膜中诱导微观通路(孔)。在体内电穿孔过程中,对细胞施加适当大小和持续时间的电场,诱导增强的细胞膜渗透性的瞬时状态,从而实现不能自行穿过细胞膜的分子的细胞摄取。通过电穿孔产生这样的孔有利于生物分子(诸如质粒、寡核苷酸、sirna、药物等)从细胞膜的一侧向另一侧的通过。用于递送dna疫苗的体内电穿孔已经被证实显著增加宿主细胞的质粒摄取,同时还会导致在注射部位处的轻度至中度炎症。因此,与常规注射相比,真皮内或肌肉内电穿孔显著改善了转染效率和免疫应答(例如,分别高达1,000倍和100倍)。
[0209]
在一个典型的实施方案中,将电穿孔与肌肉内注射相组合。但是,也可能将电穿孔与其它形式的胃肠外施用(例如,真皮内注射、皮下注射等)相组合。
[0210]
可以使用电穿孔装置完成通过电穿孔对本技术的组合物、治疗组合或疫苗的施用,所述电穿孔装置可以被构造成向哺乳动物的所需组织递送有效造成可逆孔在细胞膜中形成的能量脉冲。电穿孔装置可以包括电穿孔部件和电极组件或手柄组件。电穿孔组件可以包括电穿孔装置的以下组件中的一种或多种:控制器、电流波形发生器、阻抗测试仪、波形记录器、输入元件、状态报告元件、通信端口、存储器组件、电源和电源开关。可以使用体内电穿孔装置完成电穿孔。电穿孔装置的例子和可以促进本技术的组合物和治疗组合(特别是包含dna质粒的那些)的递送的电穿孔方法包括cellectra
®
(inovio pharmaceuticals, blue bell, pa)、elgen电穿孔仪(inovio pharmaceuticals, inc.)、tri-gridtm递送系统(ichor medical systems, inc., san diego, ca 92121)和在美国专利号7,664,545、美国专利号8,209,006、美国专利号9,452,285、美国专利号5,273,525、美国专利号6,110,161、美国专利号6,261,281、美国专利号6,958,060,和美国专利号6,939,862、美国专利号7,328,064、美国专利号6,041,252、美国专利号5,873,849、美国专利号6,278,895、美国专利号6,319,901、美国专利号6,912,417、美国专利号8,187,249、美国专利号9,364,664、美国专利号9,802,035、美国专利号6,117,660,和国际专利申请公开wo2017172838中描述的那些,它们都通过引用整体并入本文。体内电穿孔装置的其它例子描述在标题为“method and apparatus for the delivery of hepatitis b virus (hbv) vaccines”的国际专利申请中,其以代理人案卷号688097-405wo与本技术在同一天提交,其内容特此通过引用整体并入。用于递送本技术的组合物和治疗组合的应用还考虑使用脉冲电场,例如如在例如美国专利号6,697,669中所描述,其通过引用整体并入本文。
[0211]
在其中组合物或治疗组合包含一种或多种dna质粒的本技术的其它实施方案中,施用方法是透皮施用。透皮施用可以与表皮皮肤磨损相组合以促进dna质粒向细胞的递送。例如,皮肤病学贴剂可用于表皮皮肤磨损。在除去皮肤病学贴剂后,组合物或治疗组合可以沉积在磨损的皮肤上。
[0212]
递送方法不限于上述实施方案,并且可以使用用于细胞内递送的任何方式。本技术的方法考虑的其它细胞内递送方法包括、但不限于脂质体包封、脂质纳米颗粒(lnp)等。
[0213]
在本技术的某些实施方案中,施用方法是脂质组合物,例如脂质纳米颗粒(lnp)。
可用于递送治疗产品(例如本发明的一种或多种核酸分子)的脂质组合物,优选脂质纳米颗粒包括但不限于脂质体或脂质囊泡,其中水体积由两亲脂质双层包封,或其中脂质包覆包含治疗产品的内部;或脂质聚集体或胶束,其中脂质包封的治疗产品包含在相对无序的脂质混合物中。
[0214]
在特定实施方案中,lnp包含阳离子脂质以包封和/或增强核酸分子例如本发明的dna或rna分子递送到靶细胞中。阳离子脂质可以是在选定的ph例如生理ph下携带净正电荷的任何脂质种类。脂质纳米颗粒可以通过包括使用一种或多种阳离子脂质、非阳离子脂质和聚乙二醇(peg)修饰的脂质的不同比例的多组分脂质混合物来制备。文献中已经描述了几种阳离子脂质,其中许多是可商购的。例如,用于本发明的组合物和方法的合适的阳离子脂质包括1,2-二油酰基-3-三甲基铵-丙烷(dotap)。
[0215]
lnp制剂可以包括阴离子脂质。阴离子脂质可以是在选定的ph例如生理ph下携带净负电荷的任何脂质种类。阴离子脂质与阳离子脂质结合时,用于降低lnp的整体表面电荷,并引入lnp双层结构的ph依赖性破坏,促进核苷酸释放。文献中已经描述了几种阴离子脂质,其中许多是可商购的。例如,用于本发明的组合物和方法的合适的阴离子脂质包括1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)。
[0216]
可以使用本领域熟知的方法并参考本公开制备lnp。例如,可以使用乙醇注射或稀释、薄膜水合、冻融、法压壶(french press)或膜挤出、渗滤、超声、去污剂透析、醚注入和反相蒸发制备lnp。
[0217]
脂质、脂质组合物和产生用于递送活性核酸分子(例如本发明的那些)的脂质载体的方法的一些实例描述于:us2017/0190661, us2006/0008910, us2015/0064242, us2005/0064595, wo/2019/036030, us2019/0022247, wo/2019/036028, wo/2019/036008, wo/2019/036000, us2016/0376224, us2017/0119904, wo/2018/200943, wo/2018/191657, us2014/0255472和us2013/0195968,其各自相关内容通过引用整体并入本文。
[0218]
本技术的抗pd-1或抗pd-l1抗体或其抗原结合片段可以通过任何合适的途径施用给受试者,例如通过静脉内(i.v.)输注或快速推注胃肠外地,肌肉内地或皮下地或腹膜内地。可以在例如15、30、60、90、120、180或240分钟或1、2、3、4、5、6、7、8、9、10、11或12小时中进行静脉内输注。
[0219]
佐剂在本技术的某些实施方案中,诱导针对hbv的免疫应答的方法进一步包括施用佐剂。术语“佐剂”和“免疫刺激剂”在本文中可互换地使用,并被定义为一种或多种造成免疫系统刺激的物质。在该背景下,佐剂用于增强对本技术的hbv抗原和抗原性hbv多肽的免疫应答。
[0220]
根据本技术的实施方案,佐剂可存在于本技术的治疗组合或组合物中,或在分开的组合物中施用。佐剂可以是例如小分子或抗体。适用于本技术的佐剂的例子包括、但不限于:免疫检查点抑制剂(例如,抗-pd-1、抗-tim-3等),toll-样受体激动剂(例如,tlr7和/或tlr8激动剂),rig-1激动剂,il-15超激动剂(altor bioscience),突变体irf3和irf7遗传佐剂,sting激动剂(aduro),flt3l遗传佐剂,il12遗传佐剂,和il-7-hyfc。佐剂的例子可以例如选自下述抗-hbv药剂:hbv dna聚合酶抑制剂;免疫调节剂;toll-样受体7调节剂;
toll-样受体8调节剂;toll-样受体3调节剂;干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;toll样受体9调节剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;靶向病毒mrna的反义寡核苷酸,更特别是抗-hbv反义寡核苷酸;短干扰rna (sirna),更特别是抗-hbv sirna;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒的表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,诸如il12;衣壳组装调节剂,核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸可诱导基因1的刺激物;nod2的刺激物;重组胸腺素α-1;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,诸如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂和ctla-4抑制剂;在免疫细胞(更具体地t细胞)上表达的共刺激性受体,诸如cd27、cd28的激动剂;btk抑制剂;用于治疗hbv的其它药物;ido抑制剂;精氨酸酶抑制剂;和kdm5抑制剂。
[0221]
本技术的组合物和治疗组合还可以与至少一种其它抗-hbv药剂联合施用。适用于本技术的抗-hbv药剂的例子包括、但不限于结合hbv包膜的小分子、抗体和/或car-t疗法(s-car细胞)、衣壳组装调节剂、tlr激动剂(例如,tlr7和/或tlr8激动剂)、cccdna抑制剂、hbv聚合酶抑制剂(例如,恩替卡韦和替诺福韦)和/或免疫检查点抑制剂等。
[0222]
至少一种抗-hbv药剂可以例如选自:hbv dna聚合酶抑制剂;免疫调节剂;toll-样受体7调节剂;toll-样受体8调节剂;toll-样受体3调节剂;干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;toll样受体9调节剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;靶向病毒mrna的反义寡核苷酸,更特别是抗-hbv反义寡核苷酸;短干扰rna (sirna),更特别是抗-hbv sirna;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒的表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,诸如il12;衣壳组装调节剂, 核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸可诱导基因1的刺激物;nod2的刺激物;重组胸腺素α-1;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,诸如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂和ctla-4抑制剂;在免疫细胞(更具体地t细胞)上表达的共刺激性受体诸如cd27、cd28的激动剂;btk抑制剂;用于治疗hbv的其它药物;ido抑制剂;精氨酸酶抑制剂;和kdm5抑制剂。这样的抗-hbv药剂可以与本技术的组合物和治疗组合同时或依次施用。
[0223]
初免/强化免疫接种的方法本技术的实施方案也涵盖在所谓的初免-强化方案中给受试者施用免疫原性上有效量的组合物或治疗组合,并随后给同一受试者施用免疫原性上有效量的组合物或治疗组合的另一剂量。因此,在一个实施方案中,本技术的组合物或治疗组合是用于初始引发免疫应答的初免疫苗。在另一个实施方案中,本技术的组合物或治疗组合是用于强化免疫应答的强化疫苗。本技术的初免和强化疫苗可以用在本文描述的本技术的方法中。初免-强化方案的这种一般概念是疫苗领域的技术人员众所周知的。本文描述的本技术的组合物和治疗组合中的任一种可以用作初免和/或强化疫苗以初始引发和/或强化针对hbv的免疫应答。
[0224]
在本技术的某些实施方案中,可以施用本技术的组合物或治疗组合以进行初免免疫接种。可以重新施用组合物或治疗组合以进行强化免疫接种。如果需要,可以任选地将组合物或疫苗组合的进一步强化施用添加到方案中。佐剂可以存在于用于强化免疫接种的本
申请的组合物中,存在于要与本技术的组合物或治疗组合一起施用以进行强化免疫接种的分开的组合物中,或作为强化免疫接种单独施用。在其中在方案中包括佐剂的那些实施方案中,佐剂优选地用于强化免疫接种。
[0225]
初免-强化方案的示例性和非限制性例子包括给受试者施用单剂量的免疫原性上有效量的本技术的组合物或治疗组合以初始引发免疫应答;并且随后施用免疫原性上有效量的本技术的组合物或治疗组合的另一个剂量以强化免疫应答,其中在最初施用初免免疫接种后约2至6周,优选4周,首次施用强化免疫接种。任选地,在最初施用初免免疫接种后约10-14周,优选12周,施用组合物或治疗组合或其它佐剂的进一步强化免疫接种。
[0226]
试剂盒本文还提供了试剂盒,其包含本技术的治疗组合。试剂盒可以包含在一种或多种分开的组合物中的第一种多核苷酸、第二种多核苷酸和抗pd-1或抗pd-l1抗体或其抗原结合片段,或者试剂盒可以包含在单一组合物中的第一种多核苷酸、第二种多核苷酸和抗pd-1或抗pd-l1抗体或其抗原结合片段。试剂盒可以进一步包含一种或多种佐剂或免疫刺激剂和/或其它抗-hbv药剂。
[0227]
使用本领域中标准的多种测定可以在体外或在体内评价在动物或人生物体中施用后诱导或刺激抗-hbv免疫应答的能力。关于可用于评价免疫应答的发生和激活的技术的一般描述,参见例如coligan等人(1992和1994, current protocols in immunology; j wiley & sons inc编辑, national institute of health)。细胞免疫的测量可以如下进行:通过测量活化的效应细胞分泌的细胞因子谱,所述细胞因子包括源自cd4 和cd8 t-细胞的那些(例如通过elispot定量产生il-10或ifnγ的细胞),通过确定免疫效应细胞的激活状态(例如通过经典的[3h]胸苷摄取的t细胞增殖测定或基于流式细胞计量术的测定),通过测定致敏受试者中的抗原特异性的t淋巴细胞(例如在细胞毒性测定中的肽特异性裂解等)。
[0228]
通过抗体结合和/或结合竞争可以确定刺激细胞和/或体液应答的能力(参见例如harlow, 1989, antibodies, cold spring harbor press)。例如,通过酶联免疫吸附测定(elisa),可以测量响应于提供免疫原的组合物的施用而产生的抗体的滴度。也可以通过中和抗体测定来测量免疫应答,其中病毒的中和被定义为通过病毒与特异性抗体的反应/抑制/中和而丧失侵染性。通过抗体依赖性的细胞吞噬作用(adcp)测定可以进一步测量免疫应答。
[0229]
实施方案本发明也提供了下述非限制性的实施方案。
[0230]
实施方案1是用于在有此需要的受试者中治疗乙型肝炎病毒(hbv)感染的治疗组合,其包含:i)以下至少一种:a) 截短的hbv核心抗原,其由与seq id no: 2具有至少95%(诸如至少95%、96%、97%、98%、99%或100%)同一性的氨基酸序列组成,b) 第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列c) hbv聚合酶抗原,其氨基酸序列与seq id no: 7具有至少90%(诸如至少90%、
91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性,和d) 第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列;和ii)抗pd-1或抗pd-l1抗体或其抗原结合片段,优选选自:a)17d8, 2d3, 4h1, 5c4, 4a11, 7d3, 5f4, h409a11, hpd-1.08a, hpd-1.09a, 109a-h, k09a-l-11, k09a-l-16, k09a-l-17, 409a-h, h1m7789n, h1m7799n, h1m7800n, h2m7780n, h2m7788n, h2m7790n, h2m7791n, h2m7794n, h2m7795n, h2m7796n, h2m7798n, h4h9019p, h4xh9034p2, h4xh9035p2, h4xh9037p2, h4xh9045p2, h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab, 及其变体;b)结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体;和c)纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0231]
实施方案2是实施方案1的治疗组合,其包含hbv聚合酶抗原和截短的hbv核心抗原中的至少一种。
[0232]
实施方案3是实施方案2的治疗组合,其包含hbv聚合酶抗原和截短的hbv核心抗原。
[0233]
实施方案4是实施方案1的治疗组合,其包含第一种非天然存在的核酸分子和第二种非天然存在的核酸分子中的至少一种,所述第一种非天然存在的核酸分子包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述第二种非天然存在的核酸分子包含编码hbv聚合酶抗原的第二种多核苷酸序列。
[0234]
实施方案5是用于在有此需要的受试者中治疗乙型肝炎病毒(hbv)感染的治疗组合,其包含i) 第一种非天然存在的核酸分子,其包含编码截短的hbv核心抗原的第一种多核苷酸序列,所述截短的hbv核心抗原由与seq id no: 2具有至少95%同一性的氨基酸序列组成;和ii) 第二种非天然存在的核酸分子,其包含编码hbv聚合酶抗原的第二种多核苷酸序列,所述hbv聚合酶抗原具有与seq id no: 7具有至少90%同一性的氨基酸序列,其中所述hbv聚合酶抗原不具有逆转录酶活性和rna酶h活性;和
iii) 抗pd-1或抗pd-l1抗体或其抗原结合片段,优选选自:a)17d8, 2d3, 4h1, 5c4, 4a11, 7d3, 5f4, h409a11, hpd-1.08a, hpd-1.09a, 109a-h, k09a-l-11, k09a-l-16, k09a-l-17, 409a-h, h1m7789n, h1m7799n, h1m7800n, h2m7780n, h2m7788n, h2m7790n, h2m7791n, h2m7794n, h2m7795n, h2m7796n, h2m7798n, h4h9019p, h4xh9034p2, h4xh9035p2, h4xh9037p2, h4xh9045p2, h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab, 及其变体;b)结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体;和c)纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0235]
实施方案6是实施方案4或5的治疗组合,其中所述第一种非天然存在的核酸分子进一步包含编码信号序列的多核苷酸序列,所述信号序列可操作地连接至截短的hbv核心抗原的n-端。
[0236]
实施方案6a是实施方案4-6中的任一个的治疗组合,其中所述第二种非天然存在的核酸分子进一步包含编码信号序列的多核苷酸序列,所述信号序列可操作地连接至hbv聚合酶抗原的n-端。
[0237]
实施方案6b是实施方案6或6a的治疗组合,其中所述信号序列独立地包含seq id no: 9或seq id no: 15的氨基酸序列。
[0238]
实施方案6c是实施方案6或6a的治疗组合,其中所述信号序列独立地由seq id no: 8或seq id no: 14的多核苷酸序列编码。
[0239]
实施方案7是实施方案1-6c中的任一个的治疗组合,其中所述hbv聚合酶抗原包含与seq id no: 7具有至少98%(诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列。
[0240]
实施方案7a是实施方案7的治疗组合,其中所述hbv聚合酶抗原包含seq id no: 7的氨基酸序列。
[0241]
实施方案7b是实施方案1-7a中的任一个的治疗组合,其中所述截短的hbv核心抗原由与seq id no: 2具有至少98%(诸如至少98%、98.5%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%或100%)同一性的氨基酸序列组成。
[0242]
实施方案7c是实施方案7b的治疗组合,其中所述截短的hbv抗原由seq id no: 2或seq id no: 4的氨基酸序列组成。
h4xh9048p2, h4h9057p2, h4h9068p2, h4xh9119p2, h4xh9120p2, h4xh9128p2, h4xh9135p2, h4xh9145p2, h4xh8992p, h4xh8999p, h4xh9008p, h4h7798n, h4h7795n2, h4h9008p, h4h9048p2, pd1-0103, pd1-0098, pd1-0050, pd1-0069, pd1-0073, pd1-0078, pd1-0102, pd1-0103_01, pd1-0103_02, pd1-0103_03, pd1-0103_04, pd1-0103-0312, pd1-0103-0313, pd1-0103-0314, pd1-0103-0315, 1.7.3 hab, 1.49.9 hab, 1.103.11 hab, 1.103.11-v2 hab, 1.139.15 hab, 1.153.7 hab或其变体。
[0260]
实施方案15a是实施方案1-14中的任一个的治疗组合,其中抗pd-1或抗pd-ll抗体或其片段是结合于具有sehsi, dpfel, klng, qtswk, lhfep, ndngsy, ttlyvt或laafpedrsqpgqdcr的序列的表位的抗体。
[0261]
实施方案15b是实施方案1-14中的任一个的治疗组合,其中抗pd-1或抗pd-ll抗体或其片段是纳武单抗(mdx-1 106, opdivo; bristol-myers squibb)、派姆单抗 (mk-3475, keytruda, lambrolizumab, bms-936558; merck)、tsr-042 (tesaro, inc.)、regn2810 (regeneron pharmaceuticals)、eh12.2h7 (biolegend, 目录号329902)、阿维单抗(bavencio; emd serono, pfizer)、德瓦鲁单抗
(imfinzi, astrazeneca)、西米普利单抗(regn-2810, libtayo; regeneron)、bms-936559、阿特珠单抗(tecentriq, genentech)或其等同物。
[0262]
实施方案16是试剂盒,其包含实施方案1-15b中的任一个的治疗组合,和关于使用所述治疗组合在有此需要的受试者中治疗乙型肝炎病毒(hbv)感染的说明书。
[0263]
实施方案17是在有此需要的受试者中治疗乙型肝炎病毒(hbv)感染的方法,所述方法包括给所述受试者施用实施方案1-15b中的任一个的治疗组合。
[0264]
实施方案17a是实施方案17的方法,其中所述治疗在有此需要的受试者中诱导针对乙型肝炎病毒的免疫应答,优选地所述受试者具有慢性hbv感染。
[0265]
实施方案17b是实施方案17或17a的方法,其中所述受试者具有慢性hbv感染。
[0266]
实施方案17c是实施方案17-17b中的任一个的方法,其中所述受试者需要治疗选自晚期纤维化、肝硬化和肝细胞癌(hcc)的hbv诱导的疾病。
[0267]
实施方案18是实施方案17-17c中的任一个的方法,其中通过经皮肤注射,例如,肌肉内或真皮内注射,优选肌肉内注射,施用所述治疗组合。
[0268]
实施方案19是实施方案18的方法,其中所述治疗组合包含第一种和第二种非天然存在的核酸分子中的至少一种。
[0269]
实施方案19a是实施方案19的方法,其中所述治疗组合包含第一种和第二种非天然存在的核酸分子。
[0270]
实施方案20是实施方案19或19a的方法,其中通过与电穿孔联合的肌肉内注射将所述非天然存在的核酸分子施用给所述受试者。
[0271]
实施方案21是实施方案19或19a的方法,其中通过脂质组合物,优选地通过脂质纳米颗粒,将所述非天然存在的核酸分子施用给所述受试者。
实施例
[0272]
本领域技术人员将理解,可以对上述实施方案做出变化,而不脱离其广泛发明概念。因此,应当理解,本发明不限于公开的特定实施方案,而是意图涵盖在由本说明书定义
的本发明的精神和范围内的修改。
[0273]
实施例1. hbv核心质粒和hbv pol质粒pdk-pol和pdk-core载体的示意图分别显示在图1a和1b中。使用标准的分子生物学技术将含有cmv启动子(seq id no: 18)、剪接增强子(三重复合序列) (seq id no: 10)、半胱氨酸蛋白酶抑制剂s前体信号肽spcs (np_0018901.1) (seq id no: 9)和pol (seq id no: 5)或核心(seq id no: 2)基因的hbv核心或pol抗原优化的表达盒引入pdk质粒主链中。使用核心和pol特异性抗体通过蛋白质印迹分析关于核心和pol抗原表达在体外试验该质粒,并证实关于细胞的和分泌的核心和pol抗原提供一致的表达谱(数据未显示)。
[0274]
实施例2. 表达截短的hbv核心抗原与hbv pol抗原的融合体的腺病毒载体的产生已经将腺病毒载体的创建设计为从单个开放读码框表达的融合蛋白。也可以设想用于表达两种蛋白的额外构型,例如使用两个分开的表达盒,或使用2a-样序列来隔开两个序列。
[0275]
腺病毒载体的表达盒的设计表达盒(如图2a和图2b所示)包含cmv启动子(seq id no: 19)、内含子(seq id no:12)(源自人apoai基因的片段
‑ꢀ
genbank登录号x01038碱基对295
ꢀ‑
523,携带apoai第二内含子),然后是优化的编码序列-单独的核心或核心和聚合酶融合蛋白,所述融合蛋白前面是人免疫球蛋白分泌信号编码序列(seq id no: 14)且后面是sv40多腺苷酸化信号(seq id no: 13)。
[0276]
包含分泌信号,因为过去的经验表明,某些携带分泌型转基因的腺病毒载体的可制造性有所提高,而不影响引起的t-细胞应答(小鼠实验)。
[0277]
核心蛋白(vv)的最后两个残基和聚合酶蛋白(mp)的前两个残基如果融合的话会产生存在于人多巴胺受体蛋白(d3同种型)上的连接序列(vvmp),以及侧翼同源性。
[0278]
agag接头在核心和聚合酶序列之间的插入会消除这种同源性,并且在人蛋白质组的blast中不再返回命中。
[0279]
实施例3. dna疫苗在小鼠中的体内免疫原性研究在小鼠中试验了含有编码hbv核心抗原或hbv聚合酶抗原的dna质粒的免疫治疗性dna疫苗。该研究的目的是为了检测疫苗在通过电穿孔肌肉内递送进balb/c小鼠中以后诱导的t-细胞应答。最初的免疫原性研究集中在确定由引入的hbv抗原引起的细胞免疫应答。
[0280]
具体而言,试验的质粒包括pdk-pol质粒和pdk-core质粒,分别如图1a和1b所示,以及如上文实施例1中所述。pdk-pol质粒编码具有seq id no: 7的氨基酸序列的聚合酶抗原,且pdk-core质粒编码具有seq id no: 2的氨基酸序列的核心抗原。首先,试验了由每种质粒单独诱导的t-细胞应答。使用商购可得的trigrid
tm
肌肉内递送系统(tds-im)通过电穿孔将dna质粒(pdna)疫苗肌肉内地递送给balb/c小鼠,该系统适合于小鼠模型的胫骨前肌(cranialis tibialis)中应用。关于通过电穿孔将dna肌肉内递送给小鼠的方法和装置的更多描述,参见于2017年12月19日提交的国际专利申请公开wo2017172838和美国专利申请号62/607,430,其标题为“method and apparatus for the delivery of hepatitis b virus (hbv) vaccines”,它们的公开内容特此通过引用整体并入。具体地,将具有电极阵列(电极之间间隔2.5 mm且直径为0.030英寸)的tds-im v1.0装置的tds-im阵列经皮插入所选肌肉中,导电长度为3.2 mm且有效穿透深度为3.2 mm,并且电极的菱形构型的长轴与
肌肉纤维平行地定向。在电极插入后,开始注射以在肌肉中分布dna (例如,0.020 ml)。在完成肌肉内注射后,局部施加250 v/cm电场(施加的电压为59.4
ꢀ‑
65.6 v,施加的电流限制小于4 a,0.16 a/秒),总持续时间为约400 ms,10%占空比(即,在约400 ms持续时间中主动施加电压共约40 ms),共6个脉冲。一旦完成电穿孔程序,移除trigridtm阵列并使动物恢复。如在表1中总结的那样进行给balb/c小鼠的高剂量(20
µ
g)施用。给六只小鼠施用编码hbv核心抗原的质粒dna(pdk-core;组1),给六只小鼠施用编码hbv pol抗原的质粒dna (pdk-pol;组2),且两只小鼠接受空载体作为阴性对照。动物接受间隔两周的两次dna免疫接种,并在最后一次免疫接种后一周收集脾细胞。
[0281]
表1:初步研究的小鼠免疫接种实验设计.通过ifn-γ 酶联免疫斑点(elispot)分析和量化抗原特异性应答。在该测定中,将免疫动物的分离脾细胞与覆盖核心蛋白、pol蛋白或小肽前导序列和连接序列的肽池(2
µ
g/ml的每种肽)一起温育过夜。这些池由15聚体肽组成,所述肽重叠与core和pol疫苗 载体的genotypes bcd共有序列相匹配的11个残基。大的94 kd hbv pol蛋白在中间被分成两个肽池。用同源肽池刺激抗原特异性t细胞,并使用elispot测定评估ifn-γ阳性t细胞。将单个抗原特异性t细胞释放的ifn-γ通过适当的抗体和随后的显色检测可视化为微量培养板上的有色斑点,称为斑点形成细胞(sfc)。
[0282]
在用dna疫苗质粒pdk-core (组 1)免疫的小鼠中实现了针对hbv核心的大量t细胞应答,达到每106个细胞1,000个sfc(图3)。对pol 1肽池的pol t-细胞应答是强烈的(每106个细胞约1,000个sfc)。弱的pol-2-指导的抗-pol细胞应答可能是由于小鼠中有限的mhc多样性,这种现象被称为t细胞免疫优势,定义为对来自一种抗原的不同表位的不平等识别。进行的一项验证性研究确认了在本研究中获得的结果(数据未显示)。
[0283]
上述结果证实,用编码hbv抗原的dna质粒疫苗的疫苗接种在小鼠中诱导针对施用的hbv抗原的细胞免疫应答。用非人灵长类动物也获得了类似的结果(数据未显示)。
[0284]
实施例4.抗pd-1对hbv疫苗诱导的免疫应答的影响为了评估阻断pd-1是否影响健康小鼠的hbv疫苗诱导的细胞介导免疫(cmi),成年c57bl/6小鼠在d0和d21通过dna电穿孔接种疫苗,并在d28收集其脾脏。该疫苗是pdf-core和pdf-pol vax的混合物(与pdk-core和pdk-pol的序列相同,但不同的主链编码不同的抗生素抗性),在双腿中施用10
µ
g/每种/部位。抗pd-1 mab(cd279;invivomab)或同种型mab(invivomab)在第一次接种时以及之后每周一次直到d21(即d0, d7, d14和d21)通过腹膜内注射(10mg/kg)施用。第二组小鼠在d7、d14和d21用抗pd-1 mab或同种型mab处理。对照小鼠用同种型抗体处理。
[0285]
在第28天,即最后一次接种疫苗后一周,处死小鼠,分离其脾细胞,通过elispot和细胞内细胞因子染色(ics)测量免疫应答。简而言之,以无菌方式从处死的免疫小鼠中取出每个脾脏,并置于含有2ml r10培养基的5ml卡口聚丙烯管中。然后通过金属网格刮擦脾脏,在6cm培养皿中破坏脾脏。用另外的2ml r10培养基洗涤网格,并将样品收集在管中。将碎屑倾析几分钟,将上相迅速转移到新管中并在室温下以1200rpm离心10分钟。通过将4.5ml裂解缓冲液(ack lysing buffer)添加到悬浮的细胞沉淀中,轻轻混合并放置10分钟来进行红细胞(rbc)渗透裂解。加入0.5ml 10x pbs以中和裂解缓冲液。在室温下以1200rpm旋转10分钟后,将细胞用r10洗涤,重新离心并重新悬浮在1ml r10培养基中。为了评估细胞的活力,将脾细胞在guava viacount试剂中以1:10稀释,并使用accuri c6 facs分选仪进行计数。细胞活力通常为96-99%。将所提供的肽池以每种0.33mg/ml重新悬浮在dmso中,组成如下:核心: 35种肽, pol1: 103种肽, 以及pol2: 105种肽。
[0286]
elispot测定是根据标准实践使用四个板进行的,其中对于每个样品,将400,000或200,000个脾细胞一式两份接种,并用dmso、核心或cona刺激。
[0287]
使用的肽池的最终浓度为1μg/ml。该测定揭示了低背景(dmso刺激)和伴刀豆球蛋白a(cona)的活化。用以下公式计算斑点形成细胞(sfc):[(2,5*平均400k) (5*平均200k)]/2。质量检查和数据精化显示所有动物都没有免疫应答,包括在第0天接种pcore的那些。
[0288]
结果示于图4并表明针对核心和pol抗原的强烈免疫应答,与先前疫苗接种研究中获得的数据一致。没有测量到显著的背景(dmso),而对pol2肽池测量到强烈的应答。针对pol1肽池测量到较低的应答。有趣的是,与同种型抗体相比,接受3次抗pd-1注射的组对pol抗原显示明显更高的应答(对于pol1和pol2分别为p=0.04和p=0.015)。此外,与接受四次抗体处理的小鼠相比,接受三次抗pd-1注射组的对pol的应答也更高(对于pol1和pol2分别为p=0.02和p=0.004)。总之,这些数据表明,3x抗pd-1施用可以增加接种疫苗的健康小鼠的hbv特异性免疫应答。
[0289]
为了进一步表征免疫应答,通过多色ics分析脾细胞的ifnγ、tnfα和il2的分泌。该测定是根据标准ics实践进行的。
[0290]
结果示于图5。
[0291]
ics分析与elispot的发现一致:核心特异性应答主要是cd4 /ifnγ /tnfα /il2 ,而pol1特异性应答是cd4 和cd8 / ifnγ /tnfα /il2 。相反,pol2特异性cmi是cd8 / ifnγ /tnfα 。与其他组相比,ics检测的pol特异性cmi在用抗pd-1处理3次的小鼠中更高。
[0292]
总之,这些数据表明hbv核心/pol疫苗具有免疫原性,并且3次抗pd-1的施用可产生最佳免疫效果。
[0293]
实施例5. 抗pd-1对aav/hbv感染小鼠中iibv疫苗诱导的免疫应答的影响。
[0294]
为了进一步评估阻断pd-1是否影响aav/hbv感染小鼠中hbv疫苗诱导的细胞介导免疫(cmi),成年c57bl/6小鼠感染aav/hbv28天。之后,一组14只动物在d28和d49通过dna电穿孔(每种质粒2.5μg)接种,一组在d28和d49通过dna电穿孔接种,并在第56天用抗pd-1抗体(10mg/kg)处理。第三组动物在接种后用同种型抗体处理。在第63天,处死小鼠。分离脾细胞以及肝内淋巴细胞(ihl),并测量cd8 t细胞的增殖能力。如图6所示,与未用抗pd-1处理的那些小鼠和用同种型抗体处理的那些小鼠相比,用抗pd-1处理的小鼠的ihl具有显著更
高的cd8增殖性t细胞。相反,脾细胞没有表现出更高的增殖能力(图7),这反映了以下事实:增殖性cd8 t细胞迁移到感染发生的部位,在此例中是肝。
[0295]
动物:c57bl/6小鼠以moi 10
11
通过尾静脉感染raav8-1.3hbv (fiveplus medical institute, china)。当感染后28天达到hbv慢性化时进行疫苗接种。
[0296]
质粒dna:dna疫苗是编码hbv核心(pdf-core)和聚合酶(pol)蛋白(pdf-pol)的两种单独dna质粒的组合,分别如图1a和图1b所示。用trigrid系统i.m.电穿孔2.5μg每种质粒。
[0297]
抗体:抗pd-1抗体(rmp1-14,bioxcell),同种型对照抗体(bioxcell)。研究中使用了10μg/ml的抗体,i.p.施用。
[0298]
研究设计:成年c57bl/6小鼠感染aav/hbv28天。之后,一组14只动物在d28和d49通过dna电穿孔(每种质粒2.5μg)接种,一组在d28和d49通过dna电穿孔接种,并在第56天用抗pd-1抗体(10mg/kg)处理。第三组动物在接种后用同种型抗体处理。
[0299]
脾细胞和ihl的分离:从小鼠中分离脾;使用gentlemacs dissociater (miltenyi biotec)进行组织破坏,细胞计数并用于指定的测定。通过用pbs灌注肝获得肝内淋巴细胞,使用gentlemacs dissociater,然后是33.75% (v/v) percoll
®ꢀ
/ pbs2�s梯度进行组织破坏。以700xg(12分钟,室温,最大加速度和制动为1)离心,将肝细胞与淋巴细胞分离。这些样品被仔细吸出并用于指定的测定。
[0300]
免疫表型分析:脾细胞和ihl每孔接种100.000个细胞。接下来,它们用活力染料染色。然后将细胞固定并透化以进行细胞内染色。用以下标志物对细胞进行染色:抗cd3、抗cd8、抗cd4和ki67,其是增殖性t细胞的标志物。1小时后,洗涤细胞两次,重悬于100μl染色缓冲液中,并在facs fortessa上进行读数。
[0301]
应当理解,本文描述的实施例和实施方案仅用于例证目的,并且可以在不脱离其广泛发明概念的情况下对上述实施方案做出改变。因此,应当理解,本发明不限于所公开的特定实施方案,而是意图涵盖在由所附权利要求限定的本发明的精神和范围内的修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。