1.本发明涉及尿样中类固醇测定方法、以及该方法中使用的用于测定尿样中类固醇的试剂盒和中和液。
背景技术:
2.血样、尿样中包含的类固醇的测定已被用于各种疾病的诊断、鉴别,例如醛固酮的测定在以原发性醛固酮症为首的高血压疾病、肾疾病、浮肿性疾病等的诊断、鉴别中是有用的。
3.作为测定样品中包含的类固醇的方法,已知通过类固醇与针对该类固醇的抗体(抗类固醇抗体)的抗原抗体反应进行免疫学测定的方法,例如,作为使用抗醛固酮抗体的醛固酮测定试剂,有diasorin公司销售的“liaison”(非专利文献1)、富士瑞必欧株式会社销售的“spac(注册商标)-s醛固酮试剂盒”(非专利文献2)。
4.在从体内排出的尿中,类固醇通常与葡糖醛酸、硫酸结合而形成缀合物。因此,如果将尿样直接供于基于抗原抗体反应的免疫学测定,则形成缀合物的其它分子会抑制抗原抗体反应,实际的类固醇量与检测到的类固醇量之间产生偏离,得不到准确的测定结果。因此,需要用于使类固醇从上述缀合物去结合的预处理,作为上述预处理,在上述的以往的醛甾酮测定试剂的情况下均需要以下处理:在尿样中添加0.2n的盐酸,反应16~24小时后添加血清、缓冲液进行中和。现有技术文献
5.非专利文献非专利文献1:diasorin公司、“liaison”附加文件、2014年修订;非专利文献2:富士瑞必欧株式会社、“spac(注册商标)-s醛固酮试剂盒”附加文件、2018年修订
技术实现要素:
发明所要解决的技术问题
6.以往,尿样中的类固醇的测定通常在从患者采集样品的施设(医院等)之外的机构(检测公司等)进行,得到测定结果为止通常需要数天。但是,近年由于免疫学测定装置的自动化,已经能够在采集样品的施设进行各种生体物质的同机构测定,对于尿样中的类固醇的测定,这种需要也在提高。在尿样中的类固醇的全自动化过程中,需要能够在测定装置上贯穿进行样品的预处理(特别是类固醇的去结合)至测定完成的操作,在尿样的预处理需要长时间(16~24小时)的以往方法中,该预处理在装置外进行。因此,需要一种包括预处理的能够全自动的、且能够在更短时间内进行尿样的预处理的类固醇测定方法。
7.本发明是鉴于上述现有技术具有的问题而完成的,其目的在于,提供能够在比以往短的时间内进行尿样的预处理的、尿样中类固醇测定方法、以及其中使用的用于测定尿
样中类固醇的试剂盒和中和液。用于解决问题的技术方案
8.本发明人们为了解决上述课题而反复进行深入研究,结果发现:通过使用以酸当量比以往大且设为特定范围内的方式对尿样进行酸处理后,对其进行中和而得到的预处理后的试样,令人吃惊的是,通过比以往显著短时间的酸处理,能够达到与以往的测定方法同等的、充分的预处理的效果(特别是类固醇的去结合等),从而完成本发明。
9.即,本发明提供以下方案。[1]一种尿样中类固醇测定方法,其为测定尿样中的类固醇的方法,其包括:酸处理工序,在尿样中以酸当量达到0.6~4n的方式混合酸溶液并使其反应,制成酸处理液;中和处理工序,将上述酸处理液和中和液混合并使其反应,制成中和处理液;以及测定工序,将上述中和处理液和能够与类固醇特异性结合的抗体混合并测定类固醇。[2]根据[1]记载的尿样中类固醇测定方法,其中,上述酸处理液的20~40℃下的ph为1.0~6.0。[3]根据[1]或[2]记载的尿样中类固醇测定方法,其中,上述酸处理工序中的反应时间为1~60分钟。[4]根据[1]~[3]中任一项记载的尿样中类固醇测定方法,其中,上述酸溶液的酸当量为1~6n。[5]根据[1]~[4]中任一项记载的尿样中类固醇测定方法,其中,上述中和处理液的25℃下的ph为4.0~10.0。[6]根据[1]~[5]中任一项记载的尿样中类固醇测定方法,其中,上述中和液含有选自good’s缓冲剂、tris缓冲剂、碳酸钠、碳酸氢钠、硼酸钠和碱性物质中的至少1种。[7]根据[1]~[6]中任一项记载的尿样中类固醇测定方法,其中,上述中和液的20℃下的pka为6~8。[8]一种用于测定尿样中类固醇的试剂盒,其为用于[1]~[7]中任一项记载的尿样中类固醇测定方法的试剂盒,其包含选自以下组成中的至少1种:酸当量为1~6n的酸溶液;含有选自good’s缓冲剂、tris缓冲剂、碳酸钠、碳酸氢钠、硼酸钠和碱性物质中的至少1种的中和液;以及能够与类固醇特异性结合的抗体。
[9]一种用于测定尿样中类固醇的中和液,其为用于[1]~[7]中任一项记载的尿样中类固醇测定方法的中和液,其含有选自good’s缓冲剂、tris缓冲剂、碳酸钠、碳酸氢钠、硼酸钠和碱性物质中的至少1种。发明的效果
[0010]
根据本发明,可提供能够以比以往短的时间进行尿样的预处理的尿样中类固醇测定方法、以及其中使用的用于测定尿样中类固醇的试剂盒和中和液。另外,由此也能够贯穿从尿样的预处理至测定实现自动化。
附图说明
[0011]
图1为表示实施例2-1中的酸处理时间与测定值平均相对于参考例2-1的比例的关系的图。图2为表示实施例2-2中的酸处理时间与测定值平均相对于参考例2-2的比例的关系的图。图3为表示实施例4中的酸处理时间与测定值平均相对于参考例4的比例的关系的图。
具体实施方式
[0012]
<尿样中类固醇测定方法>本发明提供一种尿样中类固醇测定方法,其包括:酸处理工序,在尿样中以酸当量达到0.6~4n的方式混合酸溶液并使其反应,制成酸处理液;中和处理工序,将上述酸处理液和中和液混合并使其反应,制成中和处理液;以及测定工序,将上述中和处理液和能够与类固醇特异性结合的抗体混合并测定类固醇。
[0013]
本发明中,作为“尿样”,没有特别限制,可举出任意时刻的尿、累积24小时的尿等。另外,作为尿样的来源,也没有特别限制,例如可举出:人、及人以外的哺乳类、禽类(黑猩猩、猴子等灵长类;牛、猪、马、鸡、猫、狗等家畜、宠物)。作为本发明涉及的尿样,只要能够满足以下酸当量,则也可以利用稀释液适当稀释,作为上述稀释液,例如可举出选自缓冲液、生理盐水、纯化水、血清和血浆中的至少一种。
[0014]
本发明中,“类固醇”是指具有类固醇骨架(环戊烷多氢菲骨架)的化合物的总称。作为上述类固醇,可举出类固醇激素以及保持类固醇骨架的其衍生物(例:蛋白质同化类固醇、抗雄性激素剂以及抗卵泡激素剂等合成类固醇)。作为上述类固醇激素,例如可举出睾丸激素(例:睾酮)、卵泡激素(例:雌二醇)、黄体激素(例:黄体酮)、类皮质激素(例:糖皮质激素(皮质醇等)、盐皮质激素(醛固酮等))。作为适用本发明的类固醇,没有特别限制,例如,优选选自醛固酮、黄体酮、睾酮、皮质醇和雌二醇中的至少1种。
[0015]
醛固酮是一种由肾上腺皮质的球状带分泌的类固醇激素(盐皮质激素),主要促进肾脏的肾小管中的钠离子重吸收和与此相伴的水分吸收、以及与钠离子进行交换的钾离子和氢离子的排出。
[0016]
黄体酮是一种由卵巢的黄体合成的类固醇激素(黄体激素),主要具有改变子宫内膜分泌期、维持妊娠、升高体温、抑制排卵、使乳腺发育等作用。
[0017]
睾酮是一种由睾丸的间质细胞分泌的类固醇激素(雄性激素),主要具有促进男性青春期的第二性征发育作用、增肌作用、造血作用。
[0018]
皮质醇是一种由肾上腺皮质分泌的类固醇激素(糖皮质激素),主要具有调节糖
·
脂质
·
蛋白质代谢、核酸代谢的作用。
[0019]
雌二醇是一种在卵巢的颗粒细胞、外卵泡膜细胞、胎盘、肾上腺皮质、睾丸间质细胞中形成的类固醇激素(卵泡激素),主要具有促进乳腺细胞增殖、控制卵巢排卵、控制脂质代谢、胰岛素作用、凝血作用、中枢神经(意识)女性化、皮肤薄化、抑制由ldl减少和vldl/hdl增加引起的动脉硬化等作用。
[0020]
〔酸处理工序〕在本发明的尿样中类固醇测定方法中,首先,在尿样中以酸当量达到0.6~4n的方式混合酸溶液并使其反应,制成酸处理液(酸处理工序)。
[0021]
在尿样中,通常类固醇与其它分子结合而形成缀合物,因此在上述酸处理工序中,主要是使该缀合的类固醇去结合而形成游离的类固醇。作为与类固醇形成缀合物的其它分子,例如可举出葡糖醛酸;硫酸;n-乙酰葡糖胺(n-acetyl-glucosamide)、葡萄糖等糖;甘氨酸。应予说明,本发明中“缀合”是指与上述其它分子结合,“去结合”是指类固醇不再与上述其它分子结合,而是游离的状态。
[0022]
本发明中,酸处理工序中需要在上述尿样中混合酸溶液,并且使混合后的溶液(优选反应后,即,经过酸处理时间后的溶液(本说明书中,称为“酸处理液”))中的酸当量为0.6~4n。通过将酸处理工序中的酸浓度设为如此之高,从而能够大幅缩短去结合需要的时间。作为上述酸当量,只要在该范围内即可,可根据酸处理时间、酸处理温度和以下中和液的种类等适当调整,从存在能够在更优选的酸处理时间和酸处理温度下高效进行各操作的趋势的观点出发,更优选为1.3~3n,特别优选为1.3~2n。如果上述酸当量低于上述下限,则有酸处理耗费时间的趋势,另一方面,如果超过上述上限,则酸处理的时间变得过短,存在无法确保下一操作的准备时间,或者,中和变困难而使测定值下降的趋势。应予说明,本发明中,溶液中的“酸当量”可通过氢氧化钠水溶液的中和滴定来测定。
[0023]
另外,作为上述尿样和酸溶液混合后的溶液(优选为酸处理液),从与上述相同的观点出发,20~40℃(优选为25℃)下的ph优选为1.0~6.0,更优选为1.0~4.9。
[0024]
作为混合于上述尿样中的酸溶液,可举出显示酸性的水溶液。作为本发明涉及的酸溶液,可举出盐酸、硫酸、对甲苯磺酸,可以是其中的1种,也可以是2种以上的混合物。另外,作为本发明涉及的酸溶液,在不抑制本发明的效果的范围内,也可以进一步含有甲醇等。
[0025]
在本发明涉及的酸溶液中,酸浓度只要是能够使在上述尿样中混合酸溶液后的溶液中的酸当量为上述范围内的浓度,则没有特别限制。例如,如果希望在混合于尿样中时稀释为n倍,则可以预先制备成包含n倍浓度的酸的酸溶液。从操作的安全性和操作效率的观点出发,作为本发明涉及的酸溶液中的酸浓度,优选酸当量为1~6n,更优选为2~4n,进一步优选为2~3n。
[0026]
在本发明涉及的酸处理工序中,作为上述尿样与酸溶液的混合比,只要使混合后
的溶液中的酸当量为上述范围内就没有特别限制,从操作效率的观点出发,例如相对于尿样100μl,优选酸溶液为10~1000μl的混合比。
[0027]
根据本发明的尿样中类固醇测定方法,能够充分缩短酸处理工序中的反应时间(酸处理时间),具体可为1~60分钟。反应时间可在该范围内根据酸溶液中的酸当量、酸处理温度和以下中和液的种类等适当调整,从存在在更优选的酸浓度和酸处理温度下高效进行各操作的趋势的观点出发,优选为1~10分钟,更优选为1~7分钟,进一步优选为5~7分钟,进一步更优选为5~6分钟。如果上述酸处理时间低于上述下限,则类固醇的去结合变得不充分,存在测定值下降的趋势,另一方面,如果超过上述上限,则存在因为过度的酸水解反应使类固醇本身分解或变,从而测定值下降的趋势。
[0028]
在本发明涉及的酸处理工序中,作为反应温度(酸处理温度),没有特别限制,例如可举出5~95℃的范围,可根据酸溶液中的酸当量、酸处理时间和以下中和液的种类等适当调整,从存在能够在更优选的酸浓度和酸处理时间下高效进行各操作的趋势的观点出发,优选为20~40℃。如果上述酸处理温度低于上述下限,则存在类固醇的去结合变得不充分,测定值下降的趋势,另一方面,如果超过上述上限,则存在因为过度的酸水解反应使类固醇本身分解或变质,从而测定值下降的趋势。
[0029]
作为上述酸处理条件的示例,例如可举出:上述酸处理液中的酸当量为0.6~4n、酸处理时间为1~60分钟、酸处理温度为5~95℃的条件;上述酸处理液中的酸当量为1.3~3n、酸处理时间为1~10分钟(更优选为1~7分钟)、酸处理温度为20~40℃的条件;上述酸处理液中的酸当量为1.3~2n、酸处理时间为1~10分钟(更优选为1~7分钟)、酸处理温度为20~40℃的条件;上述酸处理液的酸当量为1.3~2n、酸处理时间为5~6分钟、酸处理温度为20~40℃的条件。
[0030]
〔中和处理工序〕在本发明的尿样中类固醇测定方法中,接着,将上述酸处理工序中将尿样和酸溶液混合并使其反应得到的溶液(酸处理液)与中和液混合并使其反应,制成中和处理液(中和处理工序)。在上述中和处理工序中,主要是为了抑制以下测定工序中使用的抗体等的变性而将上述酸处理工序中加添加的酸中和。
[0031]
在中和处理工序中,作为酸处理液与中和液混合后的溶液(优选反应后,即,经过中和处理时间后的溶液(本说明书中称为“中和处理液”)),25℃下的ph优选为4.0~10.0,更优选为5.0~8.0。如果ph在上述范围外,则存在下述测定工序中使用的抗体等发生变性,测定值下降的趋势。
[0032]
作为本发明涉及的中和液,例如可举出:以缓冲液(buffer)为基础,只要不阻碍其缓冲能力,则根据需要适当含有添加物的水溶液。作为上述缓冲液,优选选自由good’s缓冲液(hepes缓冲液、mops缓冲液等)、tris缓冲液(tris-hcl缓冲液、te缓冲液、tae缓冲液、tbe缓冲液、tris缓冲生理盐水等)、碳酸-碳酸氢盐缓冲液、及硼酸钠缓冲液组成的组中的至少1种。
[0033]
另外,作为本发明涉及的中和液,例如可举出在碱性物质的水溶液中根据需要适当含有添加物的液体。作为上述碱性物质,例如可举出碱金属的氢氧化物(naoh、koh、ca(oh)2等)、氨、胺。
[0034]
此外,作为本发明涉及的中和液,只要不含类固醇,则例如也可以为以血清为基
础,根据需要适当含有添加物的液体。作为上述血清,没有特别限制,例如可举出来自动物的血清(源自人、牛、马、羊、山羊、猪、美洲驼、狗、鸡、驴、猫、兔、豚鼠、仓鼠、大鼠、小鼠等动物的血清)、脱脂血清(ddc mass spect gold(株式会社veritas制造)等)。
[0035]
作为本发明涉及的中和液,只要具有能够中和上述酸处理液中的酸的中和能力就没有特别限制,其中,优选为选自以各种缓冲液为基础的水溶液、碱性物质的水溶液、以及脱脂血清中的至少1种,从能够降低来自原料的批次差异的观点、以及存在能够在更优选的酸浓度和酸处理时间下高效进行各操作的趋势的观点出发,更优选为以各种缓冲液为基础的水溶液和/或碱性物质的水溶液,从能够抑制盐的生成等观点出发,进一步优选以上述缓冲液为基础的水溶液。
[0036]
作为上述以各种缓冲液为基础的水溶液和碱性物质的水溶液,更具体可举出含有选自good’s缓冲剂、tris缓冲剂、碳酸钠、碳酸氢钠、硼酸钠和碱性物质中的至少1种的水溶液。
[0037]
作为上述good’s缓冲剂,例如可举出mes、bis-tris、ada、pipes、aces、mopso、bes、mops、tes、hepes、tapso、popso、hepso、epps、tricine、bicine、taps、ches、caps。另外,作为上述tris缓冲剂,例如可举出tris、tris-hcl、tris-maleate。
[0038]
另外,作为本发明涉及的中和液,更具体而言,20℃下的pka(解离常数)也优选为6~8。如果pka在上述范围内,则充分中和上述酸处理液而提高其ph,能够抑制以下测定工序中使用的抗体等的变性,因此能够使酸处理工序中的酸当量增大,进一步缩短酸处理时间。
[0039]
作为本发明涉及的中和液,在不抑制本发明效果的范围内,此外,作为上述添加物,可以还含有氯化钠等盐浓度调整用分子、叠氮化钠等保存剂(防腐剂)、牛血清白蛋白(bsa)等蛋白质成分、封闭剂、蛋白质稳定化剂、增敏剂、糖类、亲水性聚合物(例如,聚乙二醇、聚乙烯醇)等中的单独1种或2种以上的组合。
[0040]
另外,作为本发明涉及的中和液,从预期类固醇稳定化的观点出发,也优选进一步含有环糊精。本发明中“环糊精”表示多个葡萄糖键合成环状结构的环状低聚糖的总称,例如可举出α-环糊精、β-环糊精、羟丙基-β-环糊精和γ-环糊精,可以为其中的单独1种,也可以为2种以上的组合。
[0041]
在本发明涉及的中和处理工序中,作为上述酸处理液与中和液的混合比,只要能够进行中和(优选只要能够使中和处理液的ph为上述范围内)就没有特别限制,从操作效率的观点出发,例如可举出:相对于酸处理液100μl,中和液为10~1000μl的混合比。
[0042]
在本发明涉及的中和处理工序中,作为中和处理的时间(中和处理时间),没有特别限制,通常为1~10分钟。另外,在本发明涉及的中和处理工序中,作为温度(中和处理温度)也没有特别限制,例如可举出5~95℃的范围,从与上述酸处理工序为相同温度时简便的观点出发,优选为20~40℃。
[0043]
〔测定工序〕在本发明的尿样中类固醇测定方法中,接着,将上述中和处理工序后的中和处理液以及能够与类固醇特异性结合的抗体混合而测定类固醇(测定工序)。
[0044]
在尿样中的类固醇形成缀合物的状态下添加抗体并进行抗原抗体反应的情况下,抗原抗体反应被抑制,实际的类固醇量与检测到的类固醇量之间产生偏离,测定值下降,但是在本发明的尿样中类固醇测定方法中,通过基于上述酸处理工序和中和处理工序的预处
理充分使类固醇去结合,因此能够抑制上述偏离的产生。
[0045]
在本发明中,“测定”包括:以信号形式获得试样(中和处理液)中无类固醇的有无及其含量的检测,除此以外,还包括等类固醇量的定量或半定量。在本发明中,类固醇的测定优选通过检测由标记物质产生的信号,并根据需要对其进行定量来进行。上述“信号”包括显色(发色)、反射光、发光、荧光、放射性同位素产生的放射线等,除肉眼可确认的信号以外,还包括可通过与信号种类相应的测定方法
·
装置来确认的信号。
[0046]
在本发明涉及的测定工序中,使用能够与类固醇特异性结合的抗体,进行基于抗原抗体反应的免疫学测定。作为上述测定方法,例如可举出使用酶作为标记(标记物质)的cleia法(化学发光酶免疫测定法)、eia法(酶免疫测定法);使用放射性同位素作为标记的ria法(放射免疫测定法);使用化学发光性化合物作为标记的clia法(化学发光免疫测定法);胶乳凝集法;免疫色谱等免疫学方法,但是不限于此。另外,作为上述免疫学手法,可以为非竞争性测定方法,也可以为竞争性测定方法。
[0047]
在本发明中,作为“能够与类固醇特异性结合的抗体(以下有时称为“抗类固醇抗体”)”,只要能够与类固醇结合就没有特别限制,可以为多克隆抗体,也可以为单克隆抗体(嵌合抗体、人源化抗体、人抗体等)。另外,可以为igg、igm、iga、igd、ige、igy等任意的同种型。在本发明中,“抗体”除包括完整的抗体以外,还包括抗体片段(例如,fab、fab’、f(ab’)2、fv、单链抗体、双特异抗体(diabody)等)、结合有抗体的可变区的低分子化抗体。作为本发明涉及的抗类固醇抗体,优选为单克隆抗体。作为单克隆抗体,例如可使用通过杂交瘤法、重组dna法等公知的方法制作的单克隆抗体。
[0048]
作为本发明涉及的抗类固醇抗体,可使用结合有标记物质的抗体。作为上述标记物质,只要是能够与抗体结合并进行检测就没有特别限制,例如可举出碱性磷酸酶(alp)、辣根过氧化物酶(hrp)、β-半乳糖苷酶(β-gal)等酶;荧光素异硫氰酸酯(fitc)、罗丹明异硫氰酸酯(ritc)等荧光色素;
125
i等放射性同位素;别藻蓝蛋白(apc)、藻红蛋白(r-pe)等荧光蛋白;亲和素;生物素;胶乳;金粒子,但是不限于此。
[0049]
在使用酶作为上述标记物质的情况下,例如通过使用显色底物、荧光底物、化学发光底物等作为底物,可根据上述底物进行各种信号的检测。
[0050]
在本发明中,作为测定类固醇的方法,除使用结合有上述标记物质的抗类固醇抗体直接检测试样(中和处理液)中的类固醇的方法以外,还可利用以下方法,上述抗类固醇抗体不结合上述标记物质,利用结合有上述标记物质的二次抗体等间接进行检测。此处“二次抗体”是指:针对抗类固醇抗体显示出反应性的抗体。例如,在以小鼠抗体形式制备上述抗类固醇抗体的情况下,可使用抗小鼠igg抗体作为该二次抗体。作为上述二次抗体,针对源自兔、山羊、小鼠等各种物种的抗体,市售有分别能够用于这些的标记二次抗体,可根据上述抗类固醇抗体的来源物种选择使用合适的二次抗体。另外,也可使用结合有上述标记物质的蛋白g、蛋白a等来代替上述二次抗体。
[0051]
上述抗类固醇抗体与上述标记物质、或者上述二次抗体与上述标记物质的结合可适当采用以往公知的方法,另外,上述结合也可利用生物素-亲和素系统。在该方法中,例如将抗类固醇抗体生物素化,使其与亲和素化的标记物质作用,利用生物素与亲和素的相互作用而使用标记物质与抗类固醇抗体结合。
[0052]
作为上述免疫学手法的检测原理,优选夹心法和竞争法。上述夹心法中,利用固定
(固相化)于固相的捕捉用抗体(例如,抗类固醇抗体)捕捉检测对象物质(例如,抗原(类固醇)),使其被结合有标记物质的检测用抗体(例如,结合有标记物质的抗类固醇抗体、结合有标记物质的二次抗体等)识别,根据上述标记物质的种类进行检测。作为上述固相,例如可使用磁性粒子、胶乳粒子等微小粒子、塑料板等板、或者硝基纤维素等纤维状物质。
[0053]
上述捕捉用抗体可以直接或间接固定于上述固相。例如,将与上述捕捉用抗体结合的物质固定于上述固相,通过使上述捕捉用抗体与该物质结合,可将上述捕捉用抗体间接固定于上述固相。作为与上述捕捉用抗体结合的物质,例如可举出上述二次抗体、蛋白g、蛋白a等,但是不限于此。在上述固相上的固定可适当采用以往公知的方法,另外,在上述捕捉用抗体被生物素化的情况下,可以利用亲和素化的固相。
[0054]
上述夹心法中,例如优选:将上述中和处理液和固相化的上述捕捉用抗体混合,进行第一抗原抗体反应(第一反应),形成中和处理液中的类固醇和上述捕捉用抗体的复合体(免疫复合体),将该免疫复合体根据需进行分离清洗后,对其添加结合有上述标记物质的检测用抗体而进行第二体原抗体反应(第二反应),根据上述标记物质进行各种检测。
[0055]
作为上述检测用抗体,不仅可使用仅与类固醇结合的抗体,也可使用与类固醇和抗体的复合体特异性结合的抗体。
[0056]
作为上述夹心法,优选例如clia法的一个方式即夹心clia法、cleia法的一个方式即夹心cleia法、ria法的一个方式即irma法(免疫放射定量法)。
[0057]
另一方面,作为上述竞争法,例如,在第一方式中,使试样中的检测对象物质(类固醇)和固相化的竞争物质(与检测对象物质相同的类固醇或与其发生交叉反应的物质)竞争与结合有标记物质的检测用抗体(例如,结合有标记物质的抗类固醇抗体)的结合。例如,优选将上述中和处理液、上述结合有标记物质的检测用抗体、以及固相化的上述竞争物质混合而进行抗原抗体反应。
[0058]
另外,例如,在上述竞争法的第二方式中,关于与固相化的捕捉用抗体的结合,使试样中的检测对象物质和结合有标记物质的上述竞争物质竞争。例如,优选将上述中和处理液和上述结合有标记物质的竞争物质混合,对其添加固相化的上述捕捉用抗体而进行抗原抗体反应。
[0059]
上述竞争法中的竞争物质、捕捉用抗体与固相的固定,可适当采用以往公知的方法,作为上述固定,与上述夹心法中的捕捉用抗体与固相的固定相同,可以为直接固定,也可以为间接固定。
[0060]
在本发明涉及的测定工序中,上述中和处理液可直接供于测定,但是在上述中和液中添加环糊精等情况下,例如可以将包含表面活性剂的处理液添加至测定工序前的中和处理液、和/或、抗原抗体反应系。作为上述包含表面活性剂的处理液,例如可举出国际公开第2019/098314号记载的处理液。作为上述包含表面活性剂的处理液,例如可以在抗原抗体反应系使用的其它溶液(例如,上述竞争法的第一方式中的结合有标记物质的检测用抗体、上述竞争法的第二方式中的结合有标记物质的竞争物质等)中预先添加该处理液而使用,也可以在这些溶液中预先添加上述表面活性剂而兼做该处理液。
[0061]
根据本发明涉及的测定工序得到的测定值的类固醇量的定量,通常通过与基于包含各浓度的类固醇的标准溶液的测定值进行比较来进行。此时,例如,通过调查待测试样(中和处理液)中得到的测定值位于基于利用标准溶液的测定值而制作的标准曲线上的哪
个位置,可求出尿样中的类固醇量。
[0062]
本发明的尿样中类固醇测定方法可测定成为类固醇激素分泌量异常相关疾病的诊断(罹患、罹患风险的评价)基础的类固醇浓度,因此能够用于上述诊断。此处“类固醇激素分泌量异常相关疾病”是包含类固醇激素的分泌量异常引起的疾病、以及、作为疾病发病的结果的类固醇激素分泌量异常的疾病、这两者的含义。
[0063]
例如已知:在原发性醛固酮症、肾血管性高血压、恶性高血压、产肾素肿瘤、巴特综合征、浮肿性疾病(肝硬化
·
心力衰竭)等的情况下,血液中的醛固酮浓度会显示高值,在艾迪森氏病、21-羟化酶缺乏症、选择性低醛固酮症等的情况下,会显示低值。另外已知:先天性肾上腺增生、库欣综合征、肾上腺肿瘤等的情况下,血液中的黄体酮浓度会显示高值,在卵巢功能不全、黄体功能不全等的情况下,会显示低值。此外已知:在肝疾病、产雌激素肿瘤、先天性肾上腺皮质增生、多胎妊娠、卵巢过度刺激综合征等的情况下,血液中的雌二醇浓度会显示高值,在卵巢功能不全、早发卵巢功能不全、低促性腺素性功能减退症(低
ゴナドトロピン
症)、chiari-frommel综合征等的情况下,会显示低值。
[0064]
<用于测定尿样中类固醇的试剂盒和中和液>本发明还提供可在上述的本发明的尿样中类固醇测定方法中使用的用于测定尿样中类固醇的试剂盒和中和液。
[0065]
本发明的用于测定尿样中类固醇的试剂盒包含:选自以下组成中的至少1种:酸当量为1~6n的酸溶液;含有选自good’s缓冲剂、tris缓冲剂、碳酸钠、碳酸氢钠、硼酸钠和碱性物质中的至少1种的中和液;以及能够与类固醇特异性结合的抗体。另外,本发明的用于测定尿样中类固醇的中和液含有选自good’s缓冲剂、tris缓冲剂、碳酸钠、碳酸氢钠、硼酸钠和碱性物质中的至少1种。
[0066]
作为上述酸溶液、中和液以及能够与类固醇特异性结合的抗体(抗类固醇抗体),包括其优选的方式在内,如上述所示。
[0067]
作为本发明的试剂盒,此外例如可组合标准类固醇试剂、包含表面活性剂的处理液、对照试剂、清洗液、稀释液、稀释用盒等。另外,例如在利用酶标记作为上述标记物质的情况下,可包含标记检测需要的底物、反应停止液等。
[0068]
此外,在检测原理为上述夹心法的情况下,例如,可包含固相化的类固醇捕捉用抗体、或者固定有与类固醇捕捉用抗体结合的物质的固相、结合有标记物质的检测用抗体等。另一方面,在检测原理为上述竞争法的情况下,例如,除此以外,还可包含固相化的竞争物质、或者固定有与竞争物质结合的物质的固相等。
[0069]
另外,在未标记一次抗体(与抗原直接结合的抗体)、二次抗体的情况下,例如,试剂盒可包含标记有可与这些抗体结合的物质。另外,在抗类固醇抗体被生物素化的情况下,例如,试剂盒可包含亲和素化的标记物质。本发明的试剂盒还可包含该试剂盒的使用说明书。
[0070]
本发明的试剂盒和中和液,不仅可用作研究用途,例如,还可作为体外诊断用药品,用于定量成为上述类固醇激素的分泌量异常相关疾病的诊断基础的类固醇浓度。实施例
[0071]
以下,基于实施例、参考例、以及比较例更具体说明本发明,本发明不受以下实施例限定。应予说明,以下“%”的表述在没有特别记载的情况下,表示重量/体积(w/v)百分比(g/100ml)。
[0072]
<尿样的预处理的时间缩短>(参考例1-1)〔预处理〕作为尿样,使用志愿者a的任意时刻的尿样(样品a)、志愿者b的任意时刻的尿样(样品b)、志愿者c的任意时刻的尿样(样品c)。以体积比(尿样:盐酸)1:2将各尿样和0.2n的盐酸混合,在30℃下温育18小时而进行酸处理。接着,在酸处理后的溶液(酸处理液、0.13n盐酸)中,以体积比(酸处理液:中和液)达到1:9的方式混合mops浓度为50mm的中和液(50mm mops、150mm nacl、1%hpβcd(2-羟丙基-β-环糊精)、0.025%lipidure802(日油株式会社制造)、ph7.5、pka(20℃下的pka,以下相同)=7.2),制成测定试样(中和处理液)。
[0073]
〔类固醇测定〕测定通过2步法来实施,上述2步法对各测定试样使用抗醛固酮抗体结合粒子(通过以往方法制备的抗醛固酮抗体结合磁性粒子(抗体结合粒子))和碱性磷酸酶标记抗醛固酮免疫复合体抗体(通过以往方法制备的碱性磷酸酶标记抗醛固酮抗体(酶标记抗体))。详细而言,通过以下(a)~(g)工序进行。(a)在抗体结合粒子约50μl中添加约30μl的测定试样并搅拌,在37℃下反应8分钟(第一反应)。(b)使用磁性分离器收集磁性粒子,进行清洗。(c)添加酶标记抗体约50μl并进行搅拌,在37℃下反应8分钟(第二反应)。(d)使用磁性分离器收集磁性粒子,进行清洗。(e)添加amppd(底物,3-(2
’‑
螺金刚烷)-4-甲氧基-4-(3
”‑
磷酰氧基)苯基-1,2-二氧杂环乙烷二钠盐)约200μl并进行搅拌,在37℃下反应4分钟(酶反应)。(f)测定伴随上述底物分解而放出的、在波长463nm附近具有发光最峰的光的发光量(计数)。发光量的测定结果为4次重复测定(n=4)的平均值(计数平均)。(g)使用标准醛固酮试剂(富士瑞必欧株式会社制造)代替测定试样,实施(a)~(f)的工序,制作标准曲线。使用制作的标准曲线,由(f)测得的计数计算测定试样中的醛固酮量,作为测定值(pg/ml)。结果为由4次重复测定(n=4)的各计数值算出的各测定值的平均(测定值平均)。
[0074]
(参考例1-2)将中和液替换为mops浓度为1m的中和液(1m mops、150mm nacl、1%hpβcd、0.025%lipidure802(日油株式会社制造)、ph7.5、pka=7.2),制备测定试样。使用得到的测定试样,除此以外,与参考例1-1相同,进行类固醇测定。
[0075]
(比较例1)将使各尿样(样品a~c)和0.2n的盐酸混合后的温育条件替换为37℃下6.5分钟,且将中和液替换为mops浓度为1m的中和液(1mmops、150mm nacl、1%hpβcd、0.025%lipidure802(日油株式会社制造)、ph7.5、pka=7.2),制备测定试样。使用得到的测定试样,除此以外,与参考例1-1相同,进行类固醇测定。
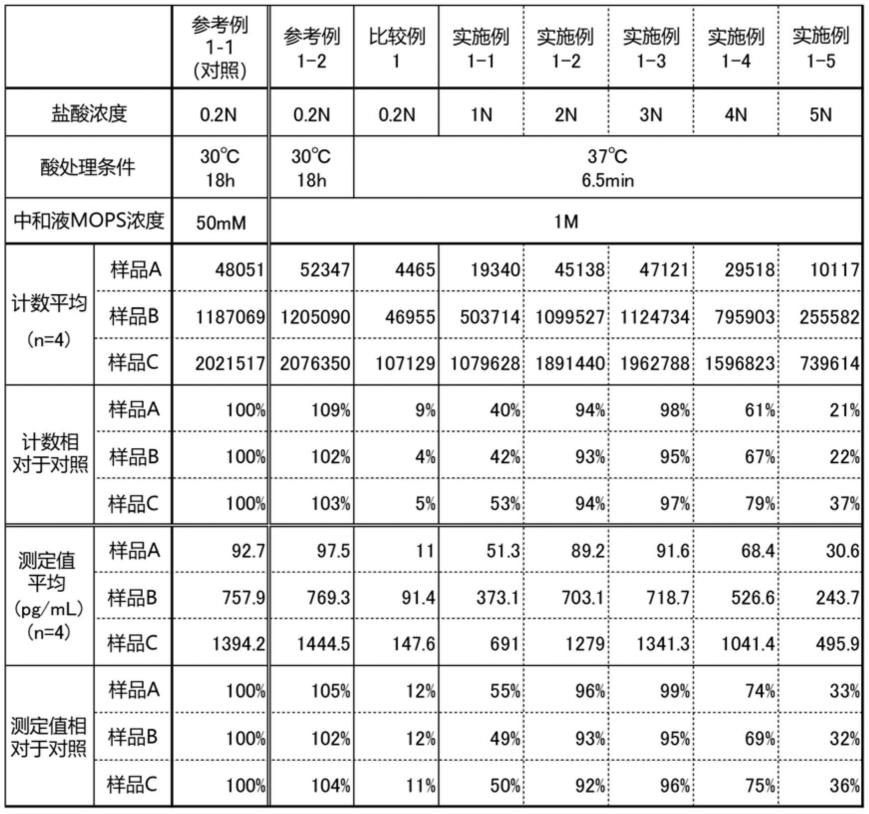
5),即使将酸处理的时间缩短到6.5分钟,也可得到了与以往的长时间条件下进行酸处理的情况(例如,参考例1-1~1-2)相同的测定结果,可确认类固醇的去结合已经充分进行。另一方面,与以往相同,在使用0.2n的盐酸的情况下,即,在酸处理液中的酸当量为0.13n左右的情况下(例如,比较例1),如果将酸处理的时间缩短至6.5分钟,则即使是相同的样品,计数值平均和测定值平均的值也会显著下降,表明类固醇的去结合未充分进行。
[0080]
<尿样的预处理中的酸处理时间、中和液的比较1>〔缓冲液中和液〕(参考例2-1)作为尿样,使用志愿者d的任意时刻的尿样(样品d)。将尿样和0.2n的盐酸以体积比(尿样:盐酸)达到1:2的方式混合,在30℃下温育18小时而进行酸处理。接着,在酸处理后的溶液(酸处理液、0.13n盐酸)中,以体积比(酸处理液:中和液)达到1:9的方式混合作为中和液的mops浓度为2m的缓冲液(2m mops、150mm nacl、1%hpβcd、0.025%lipidure802(日油株式会社制造)、ph7.3、pka=7.2),制成测定试样(中和处理液)。使用得到的测定试样,除此以外,与参考例1-1相同,进行类固醇测定。
[0081]
(实施例2-1)将尿样(样品d)和3n、4n、5n或6n的盐酸,分别以体积比(尿样:盐酸)达到1:2的方式混合,在37℃下温育1、2、3、4、5或6分钟而进行酸处理。接着,在酸处理后的溶液(酸处理液、2n、2.67n、3.33n或4n盐酸)中,以体积比(酸处理液:中和液)达到1:9的方式混合作为中和液的mops浓度为2m的缓冲液(2m mops、150mm nacl、1%hpβcd、0.025%lipidure802(日油株式会社制造)、ph7.3、pka=7.2),制成测定试样(中和处理液)。使用得到的测定试样,除此以外,与参考例1-1相同,进行类固醇测定。
[0082]
图1表示酸处理时间与将参考例2-1的测定值平均设为100%(对照)时的、实施例2-1的各测定值平均的比例(相对于0.2n hcl、18h、30℃酸处理测定值(%))的关系。
[0083]
〔脱脂血清中和液〕(参考例2-2)将尿样(样品d)和0.2n的盐酸以体积比(尿样:盐酸)达到1:2的方式混合,在30℃下温育18小时而进行酸处理。接着,在酸处理后的溶液(酸处理液、0.13n盐酸)中,以体积比(酸处理液:中和液)达到1:9的方式混合作为中和液的脱脂血清(“ddc mass spect gold”、类固醇系激素以及无胆固醇
·
tg的血清、株式会社veritas制造),制成测定试样(中和处理液)。使用得到的测定试样,除此以外,与参考例1-1相同,进行类固醇测定。
[0084]
(实施例2-2)将尿样(样品d)和3n的盐酸以体积比(尿样:盐酸)达到1:2的方式混合,在37℃下温育1、2、3、4、5或6分钟而进行酸处理。接着,在酸处理后的溶液(酸处理液、2n盐酸)中,以体积比(酸处理液:中和液)达到1:9的方式混合作为中和液的脱脂血清(“ddc mass spect gold”、类固醇系激素以及无胆固醇
·
tg的血清、株式会社veritas制造),制成测定试样(中和处理液)。使用得到的测定试样,除此以外,与参考例1-1相同,进行类固醇测定。
[0085]
图2表示酸处理时间与以参考例2-2的测定值平均为100%(对照)时的、实施例2-2的测定值平均的比例(相对于0.2n hcl、18h、30℃酸处理测定值(%))的关系。
[0086]
如图1所示,可确认到:存在酸处理中的酸当量越大,酸处理的时间越短的趋势。此
外,如图2所示,可确认到:即使使用脱脂血清作为中和液(例如,实施例2-2),通过短时间的酸处理,也可得到与以往的长时间条件下进行酸处理的情况(例如,参考例2-2)水平接近的测定结果。但是,使用基于脱脂血清的中和液的情况下,存在如果酸处理中的酸当量进一步增大则测定值平均的值下降的趋势。推测其原因在于,脱脂血清的中和能力低于缓冲液,因此不能充分中和酸浓度高的酸处理液,抗原抗体反应受到阻碍。根据上述结果可确认到:使用基于缓冲液的中和液作为中和液的情况(例如,实施例2-1),与使用基于脱脂血清的中和液的情况(例如,实施例2-2)相比,可进一步提高酸处理中的酸浓度,因此能够进一步缩短酸处理时间。
[0087]
<尿样的预处理中的中和液的比较2>(参考例3)〔缓冲液中和液〕作为尿样,使用志愿者e的任意时刻的尿样(样品e)。将尿样和0.2n的盐酸以体积比(尿样:盐酸)达到1:2的方式混合,在30℃下温育18小时而进行酸处理。接着,在酸处理后的溶液(酸处理液、0.13n盐酸)中,以体积比(酸处理液:中和液)达到1:9的方式混合作为中和液的mops浓度为2m的缓冲液(2m mops、150mm nacl、1%hpβcd、0.025%lipidure802(日油株式会社制造)、ph7.3、pka=7.2),制成测定试样(中和处理液)。使用得到的测定试样,除此以外,与参考例1-1相同,进行类固醇测定。
[0088]
〔脱脂血清中和液〕另外,将中和液替换为脱脂血清(“ddc mass spect gold”、类固醇系激素以及无胆固醇
·
tg的血清、株式会社veritas制造),除此以外,与上述相同,制备测定试样,进行类固醇测定。
[0089]
(比较例3、实施例3)〔缓冲液中和液〕将尿样(样品e)和0.2n(比较例3)、1n(实施例3-1)、2n(实施例3-2)或3n(实施例3-3)的盐酸分别以体积比(尿样:盐酸)达到1:2的方式混合,在37℃下温育6.5分钟而进行酸处理。接着,在酸处理后的溶液(酸处理液、0.13n盐酸(比较例3)、0.67n盐酸(实施例3-1)、1.33n盐酸(实施例3-2)或2n盐酸(实施例3-3))中,以体积比(酸处理液:中和液)达到1:9的方式混合作为中和液的mops浓度为2m的缓冲液(2m mops、150mm nacl、1%hpβcd、0.025%lipidure802(日油株式会社制造)、ph7.3、pka=7.2),制成测定试样(中和处理液)。使用得到的测定试样,除此以外,与参考例1-1相同,进行类固醇测定。
[0090]
〔脱脂血清中和液〕另外,将中和液替换为脱脂血清(“ddc mass spect gold”、类固醇系激素以及无胆固醇
·
tg的血清、株式会社veritas制造),除此以外,与上述相同,制备各测定试样,分别进行类固醇测定。
[0091]
在以下表2中,分别示出参考例3、比较例3、实施例3-1~3-3中的测定值平均、以及以使用参考例3的各中和液时的测定值平均为100%(对照)时的、使用比较例3和实施例3-1~3-3的各中和液时的测定值平均的比例(测定值相对于对照(%))。
[0092]
[表2]
[0093]
如表2所示,可确认到:通过使酸处理液中的酸当量为0.6n以(例如,实施例3-1~3-3),即使将酸处理的时间缩短至6.5分钟,也可得到与以往的长时间条件下进行酸处理的情况(例如,参考例3)相同的测定结果,可确认到:至少至2n左右为止,使用缓冲液作为中和液的情况与使用脱脂血清作为中和液的情况显示同样的行为。但是,在使用脱脂血清作为中和液的情况下,如果进一步增加酸处理中的酸当量,则与使用缓冲液作为中和液的情况相比,存在测定值平均的值下降的趋势。
[0094]
<尿样的预处理中的中和液的比较3>(参考例4)〔缓冲液中和液〕作为尿样,使用志愿者f的任意时刻的尿样(样品f)。将尿样和0.2n的盐酸以体积比(尿样:盐酸)达到1:2的方式混合,在30℃下温育18小时而进行酸处理。接着,在酸处理后的溶液(酸处理液、0.13n盐酸)中,以体积比(酸处理液:中和液)达到1:9的方式混合作为中和液的mops浓度为2m的缓冲液(2m mops、150mm nacl、1%hpβcd、0.025%lipidure802(日油株式会社制造)、ph7.3、pka=7.2),制成测定试样(中和处理液)。使用得到的测定试样,除此以外,与参考例1-1相同,进行类固醇测定。
[0095]
〔脱脂血清中和液〕另外,将中和液替换为脱脂血清(“ddc mass spect gold”、类固醇系激素以及无胆固醇
·
tg的血清、株式会社veritas制造),除此以外,与上述相同,制备测定试样并进行类固醇测定。
[0096]
(实施例4)〔缓冲液中和液〕将尿样(样品f)和1n的盐酸以体积比(尿样:盐酸)达到1:2的方式混合,在37℃下温育10分钟、30分钟、1小时、2小时或3小时而进行酸处理。接着,在酸处理后的溶液(酸处理液、0.67n盐酸)中,以体积比(酸处理液:中和液)达到1:9的方式混合作为中和液的mops浓度为2m的缓冲液(2m mops、150mm nacl、1%hpβcd、0.025%lipidure802(日油株式会社制造)、ph7.3、pka=7.2),制成测定试样(中和处理液)。使用得到的测定试样,除此以外,与参
考例1-1相同,进行类固醇测定。
[0097]
〔脱脂血清中和液〕另外,将中和液替换为脱脂血清(“ddc mass spect gold”、类固醇系激素以及无胆固醇
·
tg的血清、株式会社veritas制造),除此以外,与上述相同,制备各测定试样并分别进行类固醇测定。
[0098]
图3表示酸处理时间与以参考例4的测定值平均为100%(对照)时的、实施例4中的测定值平均的比例(相对于0.2n hcl、18h、30℃酸处理测定值(%))的关系。
[0099]
如图3所示,可确认到:至少酸处理液中的酸当量为0.67n的情况、使用缓冲液作为中和液的基础的情况与使用脱脂血清作为中和液的基础的情况,显示相同的行为,均能够充分缩短酸处理的时间。产业上的可利用性
[0100]
如以上说明所示,根据本发明,可提供能够以比以往短的时间进行尿样的预处理的尿样中类固醇测定方法、以及、其中使用的用于测定尿样中类固醇的试剂盒和中和液。另外,由此也能够贯穿从尿样的预处理至测定完成实现自动化。类固醇活性与各种疾病有关,因此本发明不仅可利用于研究方面,也非常有助于疾病的诊断。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。