1.本发明涉及生物医学工程与人工智能领域,尤其涉及基于细胞穿孔的人工智能重构长周期胞内电信号方法及系统。
背景技术:
2.生物电信号检测的主要研究对象是心脏和大脑,检测范围涵盖了细胞层面、组织器官、和活体层面。心脏是人最重要器官之一,是循环系统的动力,具有兴奋性、自律性、传导性及收缩性等生理特性。其中兴奋性、自律性及传导性,都是以生物电为基础而表现的兴奋功能总称为心脏电生理特性。心肌细胞作为心脏的重要组成部分,也具有电兴奋特性,且这一特性是心电产生原理和发生各种心律失常的理论基础,因此,通过记录心肌细胞的电生理特性,可以研究各种心律失常等疾病机理,对研究心脏疾病机制及治疗方法都有较高价值的指导意义。另一方面,细胞电信号记录也是心脏病学中药物研发筛选的重要手段:通过分析药物对细胞动作电位峰谱的变化影响,可以了解药物分子对细胞离子通道开闭的调控机制,从而掌握药物治疗效应和毒性效应等有价值信息。对于细胞电信号记录具有如下要求:1)在细胞内部记录高质量信号、高分辨的峰谱细节;2)高通量并行记录多个细胞;3)长时间、稳定地记录细胞内动作电位。
3.根据细胞电信号记录的这些要求,对于电学传感器的设计需考虑如下因素:1)信号质量(包括信号幅值与信噪比),与细胞-器件的耦合效率相关。相比于细胞外电信号,跨细胞膜的细胞内信号具有更高的信号质量。细胞内电信号具有更高幅值、信噪比,信号峰谱能反映更多细节动作电位。但是细胞内信号记录的实现极具挑战性,极度依赖于能穿透细胞膜安全介入细胞内部环境的技术。对于微观细胞的介入,为了避免对细胞活性和功能的损坏,要求使用的介入电极具有高精度(直径<200nm)。2)通过微纳电极阵列传感技术,实现高通量并行记录,有利于同步记录细胞网络中大量细胞的电信号,理解细胞网络间电信号传递机制。而通过微纳电极实现单细胞精度电信号记录,有利于从微观细胞层面精确理解生命信息传递过程。3)非平面的在体组织细胞电信号记录,对于常规刚性硅基衬底的传感器往往难以满足;而新型的柔性微纳器件为满足此要求提供了重要机会。
4.传统的细胞外电信号记录方法,通常采用平面型多电极阵列(如微电极、场效应管阵列)等非侵入性传感检测技术,以实现高通量与长时间的生物电信号记录。平面型微电极阵列能够同时间记录多个(64、128、256通路等)细胞的胞外电信号。由于细胞外无创的特点,胞外记录能够长时间进行。但细胞外电信号质量与细胞-电极耦合状态、相对位置有着紧密的关系。这些条件的一致性通常难以精确控制,容易影响信号质量和通道间信号的一致性。微电极阵列由于平面结构与微加工尺寸的限制,无法用于胞内电信号的记录。微电极阵列是使用mems微加工技术,在玻璃或硅衬底上制作与细胞尺寸相匹配、导电性良好、抗腐蚀的电极和引线,仅暴露出与细胞接触的电极,剩下的金属部分使用绝缘材料进行钝化,实现多通道同步检测细胞外电生理信号的细胞电生理传感器。微电极阵列包含三个部分:衬底、金属电极与引线阵列、钝化层。制作好的芯片中,金属电极检测位点暴露于细胞生存环
境中,可以与细胞直接接触。当心肌细胞生长在金属电极检测位点上时,其动作电位会导致电极表面电势发生变化,这样便可检测到心肌细胞外部电信号。与金属电极相连接的引线用于将检测到的信号传到电路中,电路对信号进行滤波与放大,引线被绝缘材料包围,避免与外界接触。引线的末端是焊盘,使用导电银胶把微电极阵列焊盘与pcb焊盘连接起来,再用聚二甲基硅氧烷固化剂进行包裹,避免和细胞生长环境接触。它是一种长期无损检测细胞电生理信号的工具,利用高通量的微电极,把从心肌细胞上记录到的电信号传输出来。它具有生物相容性好、制作简单、可用显微镜观察等优点,目前在细胞传感器研究领域有着大量的应用。基于微电极阵列的细胞芯片,可以研究心肌细胞的生长和电信号传递过程,进行细胞电生理检测和分析,也为药物评估和仿生研究提供重要技术手段。为了适应药物筛选的高通量需求,微电极阵列被发展起来,微电极阵列具有通量高、成本低和非侵入式的优点。根据电极的几何结构不同,又可以将其分为平面微电极阵列与3d微电极阵列。平面微电极阵列的电极是平面结构而3d微电极阵列的电极是3d结构,所以后者与细胞的间隙要小于前者,后者电极耦合细胞部分的周长要更长,后者记录到的胞外信号幅度与信噪比要比前者高。但微电极阵列记录胞外电信号也暴露出了一定缺点:胞外电信号是胞内动作电位经过电极耦合后输出的信号,形状发生了改变,很难真实反应出胞内动作电位的特点,且信号幅度与信噪比较低。
5.另一方面,现有细胞内电信号记录的常规方法是膜片钳技术。其中电流钳技术能记录标准的动作电位信号,电压钳技术能记录离子通道响应,成为理解电兴奋型细胞行为的基础。这种技术通常是使用一根内含金属丝的尖头玻璃管作为记录电极,贴附到细胞表面,并采用负压使得细胞膜破裂,从而记录细胞质中动作电位。然而,由于手动膜片钳的通量较低、操作过程复杂耗时、对细胞造成较大的伤害,导致无法长时记录细胞的电生理信号(<2小时)。而自动膜片钳技术可以逐个对多个细胞进行单细胞内信号记录,但仍无法在细胞网络开展信号同步记录。目前,膜片钳技术被称为研究心肌细胞电生理特性的“金标准”。它利用一个微电极吸附细胞膜,形成巨大的阻抗,使两者封接,让电极尖端开口处相接的小面积细胞膜与其在电学上分离,然后对此膜片上的离子通道的离子电流进行记录,进而获得细胞电生理特性。膜片钳包括微电极与放大电路两部分,而微电极又包括玻璃微吸管、电极内液和测试电极。根据检测模式的需要,可以将微电极另一端与电压钳模式放大电路或电流钳模式放大电路相连接。电压钳模式放大电路使用命令电压钳制细胞膜电位,使其与命令电压一致,然后在此条件下检测膜片上的离子通道的电流。电流钳模式放大电路使用命令电压产生电流,通过电极将其注入到细胞,然后检测该电流引起的跨膜电位变化情况。在进行电生理信号记录过程中,人们多采用细胞贴附、内面向外、外面向外三种模式。细胞贴附模式中,微电极与细胞膜接触时,对微电极施加负压,使得微电极尖端的膜片进入微电极内,该模式不会破坏细胞膜,极大地保证了细胞活性。在以上模式的基础上,将微电极从膜片上快速提起,此时吸附的膜片仍然会在微电极内,但是与细胞分离的膜片会形成囊泡,在空气中存在一定时间后会破裂,然后就形成了内面向外模式。在细胞吸附模式的基础上,对微电极施加负压或通过微电极施加电脉冲以打破微电极中的膜片,然后慢慢提起微电极,膜片在拉力的作用下与细胞分离并断裂,之后膜片又重新生长好,形成新的膜片,这就是外面向外吸附模式。虽然膜片钳可以准确地记录心肌细胞电生理信号,但是它每次只能记录一个细胞,且对实验人员技术要求较高,实验过程耗费时间长。此外,膜片钳在记录细
胞电生理特性时,由于膜片钳会侵入到细胞内,所以记录时间只能维持几个小时,之后细胞便会死亡。
6.近年来,通过微电极阵列给细胞施加电脉冲的技术,在高通量记录心肌细胞胞内电信号领域获得了较大的进展。在微电极阵列的电极上施加幅值大约2v的电脉冲,就可以在细胞膜上打出许多小孔,然后电极便可以接触到细胞内部环境。从而微电极阵列可以记录到心肌细胞胞内电信号。此外,微电极阵列有高通量记录的优势,再结合电穿孔技术,可以同时对多个心肌细胞的胞内电信号进行记录。但是,通过微电极阵列对细胞膜进行电穿孔后,细胞膜上的小孔通常只能存在若干分钟。也就是说,细胞膜上的小孔会在若干分钟之后愈合,所以也只能对胞内电信号进行若干分钟的记录,而不能实现更长时间的记录。
技术实现要素:
7.本发明的目的是提供一种基于细胞穿孔的人工智能重构长周期胞内电信号方法及系统,从而实现长期准确获取细胞胞内电信号。
8.有鉴于此,本发明第一方面提供了一种基于细胞穿孔的人工智能重构长周期胞内电信号方法,该方法利用一训练好的人工神经网络将采集的细胞胞外电信号作为输入推导重构获得对应的细胞胞内电信号;所述人工神经网络通过采集的若干细胞胞内外电信号作为训练样本,将胞外电信号作为输入,对应胞内信号作为学习目标进行训练。
9.本发明方法利用微电极阵列电穿孔细胞的方法,从大量不同状态的电兴奋型细胞读取其细胞外动作电位和细胞内动作电位。通过将大量(》5000样本)细胞外动作电位(胞外电信号)和细胞内动作电位(胞内电信号)进行关联,利用人工神经网络(如:多层感知机人工智能模型),建立利用细胞外动作电位推导细胞内动作电位的模型。通过此方式,可以进一步利用微电极对细胞测试组进行细胞外电信号记录,利用所构建的模型对所采集的细胞外动作电位信号进行信号重构,推导出其相对应的细胞内动作电位。解决了采用微电极阵列细胞穿孔技术对电兴奋型细胞(例如心肌细胞)的细胞内动作电位信号记录难以长时间重复记录的难题。常规多通路微电极阵列,能够高效采集细胞的胞外电信号,但无法记录到细胞内的动作电位。膜片钳技术能记录单个或少数个细胞的细胞内动作电位,但是由于膜片钳操作复杂,难于高通量读取细胞网络中多个细胞的胞内动作电位。利用微电极阵列结合电穿孔的形式,能将细胞膜有效击破,在短时间(通常小于5分钟)读取多个细胞的细胞内电信号。但是由于细胞膜具有愈合性,此方法难于长时间重复读取细胞内电信号。而且由于电穿孔对细胞具有损伤性,多次电穿孔容易导致细胞失活或影响细胞的健康状况。
10.本发明方法具有3大优势:1)由于利用人工智能辅助细胞电穿孔的方法,在长时间读取细胞外动作电位与推导细胞内动作电位的过程中对细胞是无创式操作,能有效保障细胞的安全性。2)本发明能够高通量,长时间,重复地从细胞网络中读取细胞的胞外动作电位并精准地推导出其所对应的细胞内动作电位。3)本发明所采集到的细胞内动作电位信号,能精准反映细胞离子通道的开启或关闭效应,具有优良的准确性。
11.进一步地,还包括采用单次电穿孔对此细胞的细胞内电信号进行采集作为检测人工神经网络准确性的样本,具体为:采集单次或多次细胞的胞内电信号,计算采集的胞内电信号与所述人工神经网络推导重构获得的细胞胞内电信号的相关性,根据相关性判断人工神经网络是否需要重新训练。
12.进一步地,还包括对采集的细胞胞内外电信号筛选步骤:筛选保留其中形状理想的信号。
13.进一步地,还包括对细胞胞内外电信号数据进行归一化的步骤。
14.本发明第二方面提供了一种基于细胞穿孔的人工智能重构长周期胞内电信号系统,包括:
15.信号采集装置,用于采集细胞的胞外电信号和/或胞内电信号。
16.人工智能重构胞内电信号装置,包括训练好的人工神经网络,用于将采集的细胞胞外电信号作为输入推导重构获得对应的细胞胞内电信号。
17.进一步地,所述信号采集装置包括:
18.微电极阵列传感器单元,用于检测细胞的胞外和/或胞内的电信号。
19.胞内外电信号调理电路单元,用于对检测到的细胞胞内外电信号进行放大与滤波。
20.脉冲电穿孔电路单元,用于把数据采集单元输出的脉冲信号传送到微电极阵列传感器单元的工作电极上。
21.数据采集单元,用于产生电穿孔所需的脉冲信号和采集胞内外电信号调理电路单元输出的信号。
22.进一步地,还包括信号处理装置,用于对采集的细胞的胞外电信号和/或胞内电信号进行预处理。
23.进一步地,所述信号处理装置包括:
24.信号提取单元,用于从采集的细胞的胞外电信号和/或胞内电信号中筛选出形状理想的信号,并提取出理想信号的数据;
25.信号归一化单元,用于对提取的理想信号的数据进行归一化。
26.进一步地,还包括数据处理装置,用于对推导重构获得对应的细胞胞内电信号进行筛选,剔除信号趋势异常的对应的细胞胞内电信号。
27.进一步地,所述人工智能重构胞内电信号装置还包括:
28.训练单元,用于将信号采集装置获得的细胞胞外信号作为输入,细胞胞内信号作为学习目标,对人工神经网络进行训练获得训练好的人工神经网络。
29.本发明提供了基于细胞穿孔的人工智能重构长周期胞内电信号技术,该技术包括一种方法与装置,其中方法包括:采集用于训练的细胞内外电信号;从采集到的细胞内外电信号中人工筛选出形状理想的信号,并提取出理想信号的数据;对提取出的理想信号的数据进行归一化;将归一化后的胞内电信号数据作为细胞内电信号重构的人工神经网络的监督信息,并对人工神经网络进行训练;使用自动化细胞穿孔仪器采集用于重构细胞内电信号的细胞外电信号;从采集到的细胞外电信号中人工筛选出形状理想的信号,并提取出理想信号的数据;对提取出的理想信号的数据进行归一化;把归一化后的胞外电信号数据作为训练后的人工神经网络的输入,重构出细胞内电信号。相比于使用自动化细胞穿孔仪器记录细胞内电信号的方法,本发明所提出的方法可以通过细胞外电信号重构细胞内电信号,避免电穿孔仪器对细胞穿孔时造成的伤害以及电穿孔失败的问题,而且重构效率高,重构出的细胞内电信号良好,解决了使用自动化细胞穿孔仪器的方式对细胞进行研究的办法存在的鲁棒性低、记录良好细胞内电信号效率低的问题,可以为细胞研究提供更加可靠的
研究信息。
附图说明
30.为了更清楚地展示本技术实施例中的方法与装置,下面对实施例中所需要使用的附图进行简要说明,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
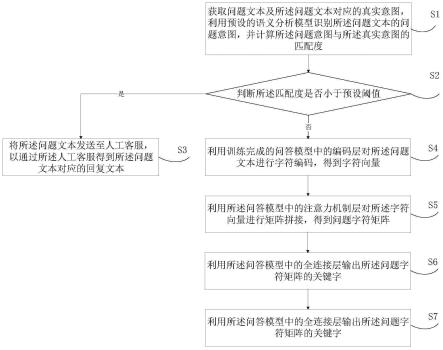
31.图1是本技术第一实施例中基于细胞穿孔的人工智能重构长周期胞内电信号方法流程图;
32.图2是本技术第二实施例中基于细胞穿孔的人工智能重构长周期胞内电信号方法筛选药物的实施方法流程图;
33.图3是本技术第三实施例中基于细胞穿孔的人工智能重构长周期胞内电信号系统结构示意图;
34.图4是理想信号的数据的提取流程图;
35.图5是重构出的胞内信号与实际的胞内信号对比图;
36.图6是第二实施例最终绘出的图;
37.图7是自动化细胞穿孔仪器的结构示意图。
具体实施方式
38.为了使本技术领域的人员更好地理解本技术方案,下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
39.本发明提供了一种基于细胞穿孔的人工智能重构长周期胞内电信号的方法及装置,由于本发明通过建立人工神经网络模型来获得细胞内电信号,可以避免自动化细胞穿孔仪器在对细胞穿孔时有可能导致细胞死亡或者无法打破细胞膜表面等缺陷,从而为细胞研究人员提供更可靠的研究信息,运用人工神经网络重构细胞内电信号的方法具有鲁棒性强、重构效果好等优势。
40.本发明第一方面提供了基于细胞穿孔的人工智能重构长周期胞内电信号的方法,请参阅图1,图1为本发明第一实施例中基于细胞穿孔的人工智能重构长周期胞内电信号方法从训练至实施的流程图,包括:
41.步骤s1,采集用于训练的细胞胞内外电信号。
42.可以理解的是,由于本发明是基于人工神经网络模型对细胞内电信号进行重构,因此,首先需要对模型进行训练,而训练信息则通过使用如自动化细胞穿孔仪器等信号采集装置采集获取。
43.步骤s2,为了提高准确性,从采集到的细胞胞内外电信号中人工筛选出形状理想的信号,并提取出理想信号的数据。
44.需要说明的是,使用自动化细胞穿孔仪器采集到的细胞胞内外电信号有的形状比较理想,有的则很差。而对人工神经网络模型进行训练时,需要良好的训练信息,也就是形
状理想的信号,所述形状理想的信号是指杂峰少,信噪比高的信号,因此,需要进行筛选出形状理想的信号,并将理想信号的数据提取出来,图4为所述理想信号的数据提取流程图。其中,筛选标准可以根据需求确定,杂峰越少,信噪比越高,形状越理想。
45.步骤s3,对提取出的理想信号的数据进行归一化。
46.可以理解的是,对用于训练人工神经网络的数据进行归一化便于数据处理。
47.步骤s4,将归一化后的胞内电信号数据作为细胞内电信号重构的人工神经网络的监督信息,并对人工神经网络进行训练。
48.需要说明的是,人工神经网络可以为任意一种现有的人工神经网络,如多层感知机人工智能模型等。在对模型进行训练时,需要把细胞内电信号数据作为监督信息,也就是学习目标,而把预测的细胞内电信号数据作为输出,细胞外电信号数据作为输入信息,通过最小化预测的细胞内电信号数据与学习目标的损失对人工神经网络进行训练获得具有根据细胞外电信号推导细胞内电信号功能的人工神经网络。
49.步骤s5,获取用于重构细胞内电信号的胞外电信号作为训练好的人工神经网络的输入,推导重构获得对应的细胞胞内电信号。
50.可以理解的是,在人工神经网络训练好之后,即可利用训练好的人工神经网络对获取的胞外电信号推导重构获得对应的细胞胞内电信号。其中,获取用于重构细胞内电信号的胞外电信号信息如步骤s1-s3所示,可以通过自动化细胞穿孔仪器进行采集,再从采集到的细胞外电信号中人工筛选出形状理想的信号,并提取出理想信号的数据。最后对提取出的理想信号的数据进行归一化。
51.图5所示为重构出的胞内信号与实际的胞内信号对比图,结果表明:本实施例所提供的基于细胞穿孔的人工智能重构长周期胞内电信号技术,通过对细胞内电信号进行重构,可以得到优质的细胞内电信号,为细胞研究提供可靠的研究信息,增加了细胞实验的可靠性和信服力,解决了使用自动化细胞穿孔仪器的方式对细胞进行研究的办法存在的鲁棒性低、记录良好细胞内电信号效率低的问题。
52.作为一优选实施方案,还可以采集单次或多次细胞的胞内电信号,计算采集的胞内电信号与所述人工神经网络推导重构获得的细胞胞内电信号的相关性,根据相关性判断人工神经网络是否需要重新训练,特别适用于应用场景与训练场景差异较大的情形。
53.进一步的,在上述第一实施例的基础下,本技术第二实施例提供了一种基于所述细胞穿孔的人工智能重构长周期胞内电信号方法筛选药物的实施方法,请参阅图2,具体包括:
54.步骤201,采集在不同药物培养条件中培养的细胞的用于重构细胞内电信号的胞外电信号。
55.可以理解的是,此处的细胞被放在不同药物培养条件中培养,可以检测出不同药物培养条件中细胞电生理信号的差异,进而研究药物的相关作用。不同药物培养条件可以为不同药物的培养液和/或同一药物不同药物浓度的培养液,以下以同一药物不同药物浓度的培养液为例进行详细说明。
56.步骤202,从采集到的细胞外电信号中人工筛选出形状理想的信号,并提取出理想信号的数据。
57.需要说明的是,为了提高准确性,该处对提取出的数据还有一定要求:每个加药浓
度数据需要选定三个通道,每个通道中提取20个形状比较理想的信号,并且应该从加药浓度数据中选定相同的通道。
58.步骤203,对提取出的理想信号的数据进行归一化。
59.该步骤与上述第一实施例的步骤s3一致,此处不再赘述。
60.步骤204,把归一化后的胞外电信号数据作为训练后的人工神经网络的输入,重构出细胞内电信号。
61.该步骤与上述第一实施例的步骤s4一致,此处不再赘述。
62.步骤205,剔除掉重构效果不好的胞内电信号。
63.可以理解的是,人工神经网络重构出的细胞内电信号中,有的重构效果好,有的重构效果差,而重构效果差的胞内电信号在后续处理过程中不具有意义,所以要把重构效果差的胞内电信号数据剔除掉,具体地,剔除信号趋势异常的细胞胞内电信号。
64.步骤206,分别计算不同加药浓度数据中三个通道预测出的胞内信号的apd50(在50%复极化时的动作电位持续时间)平均值,并绘制出图表。
65.可以理解的是,每个加药浓度数据中选定了三个相同的通道,每个通道中提取了20个形状比较理想的信号,这三个通道预测出的胞内电信号数据有各自的apd50平均值。然后以加药浓度为横坐标,每个通道的平均apd50值为纵坐标,绘制出图表,即可评估药物对细胞电生理的相关作用,筛选药物。
66.图6所示为胺碘酮药物不同浓度的筛选的结果图,结果表明:随着药物浓度的上升,三个通道预测出的胞内信号的apd50平均值整体上呈上升趋势,当药物浓度过高,反而导致了apd50下降,说明胺碘酮药物在一定浓度范围内可以延长心肌细胞apd50数值。
67.与上述基于细胞穿孔的人工智能重构长周期胞内电信号方法实施例相对应,本具体实施方式还提供了基于细胞穿孔的人工智能重构长周期胞内电信号系统,请参阅图3,图3为本技术第三实施例中基于细胞穿孔的人工智能重构长周期胞内电信号系统结构示意图,包括:
68.信号采集装置301,用于采集细胞的胞外电信号和/或胞内电信号。
69.示例性地,具体包括:
70.微电极阵列传感器单元3011,用于检测心肌细胞胞外与胞内的电生理信号。
71.所述微电极阵列传感器单元3011可以使用光刻等工艺制备微电极阵列,其工艺流程,选用总尺寸为25mm
×
25mm,厚度为0.5mm的玻璃基底。基底至少用去离子水清洗3次后,旋涂一层rzj-390pg-50正性光刻胶,并在100℃热板上软烘2分钟,使用光刻机曝光后,使用rzx3038显影剂显影35s去除多余的光刻胶。接着,先后使用磁控溅射工艺在基底上制作10nm厚的ti和100nm厚的au,并用丙酮剥离多余的金属和光刻胶,形成引线和电极。关于绝缘层的制作,首先以3000转/分钟的速度旋涂一层2μm厚的su-8 2002,并在95℃下软烘1分钟,经曝光后su-8在95℃下后烘1分钟,然后在丙二醇甲醚乙酸酯(pgmea)中显影1分钟,接着用异丙醇漂洗1分钟,最后用氮气枪干燥并在热板上硬烘1小时,这样便完成了微电极阵列的制备。
72.制备完成后的微电极阵列需要进行封装,其封装的主要流程为:首先使用双面胶把微电极阵列芯片固定在定制的pcb上,接着用导电银胶将芯片电极的连接垫与pcb的焊盘连接起来,然后使用聚二甲基硅氧烷(pdms)把细胞培养腔粘在微电极阵列芯片的中心,最
后在pcb的焊盘上焊接排针。此外,为了更好地进行细胞信号检测与电穿孔,用钛丝制作参考电极,最终制成的微电极阵列传感器单元。微电极阵列传感器单元传感调控系统通道数大于1,可实现高通量检测。微电极阵列传感器通过直插排针与电信号调理电路相连,此外系统也可以使用其它微电极阵列传感器,比如平面电极,纳米针电极等。
73.胞内外电信号调理电路单元3012,用于对检测到的细胞胞内外电生理信号进行放大与滤波。
74.心肌细胞胞外电信号峰峰值范围是60μv~1.4mv,胞内电信号峰峰值范围是100μv~10mv,所以心肌细胞电信号属于微弱信号。由于微弱信号容易被外界噪声淹没,所以传感调控系统应该放大有用的微弱信号,抑制其它噪声,以提高信噪比。示例性地,信号调理电路由一级放大电路、高通滤波电路、低通滤波电路、二级放大器组成。由于细胞-溶液-电极之间的耦合会形成数百kω的内阻,所以为了减小输入到放大电路中的信号的衰减,采用高输入阻抗低噪声密度的运放opa2140aid构成同相比例运算电路作为一级放大器。
75.opa2140aid运放的温度漂移值仅为1μv/℃,所以传感调控系统适合在温度变化较大的细胞培养环境中使用。微电极阵列电极与一级放大器中opa2140aid的同相输入端通过电阻r10相连,微电极阵列传感器的参考电极与电路的电位参考点相连。根据同相比例运算放大电路输出电压与输入电压之间的关系式,可知一级放大器的电压放大倍数是10。同相输入端平衡电阻r10的阻值应与r2和r3并联等效电阻的阻值相同,用以保证运放两个输入端的对称性,进而减少运放输入偏置电流引起的偏置电压。在r2两端并联一个反馈电容c2形成补偿电路进行相位超前补偿,这样可以防止放大电路产生自激振荡,同时也可以抑制高频杂波。此外,在运放电源的引脚处放一个小容量电容,用于抑制高频噪声。
76.脉冲电穿孔电路单元3013,用于把数据采集单元输出的脉冲信号传送到微电极阵列传感器单元的工作电极上。
77.为了检测心肌细胞胞内电信号,本系统集成了脉冲电穿孔电路实现高通量胞内电信号检测,相比自穿孔和光穿孔,电穿孔具有效率高、可控的优点。为了提高内电信号的检测通量,需要并行穿孔多路工作电极上的细胞,心肌细胞贴附在工作电极上生长,为了检测胞内电信号,有三种施加脉冲的方式:单通道穿孔需要手动连接电极和信号发生器,效率低,且在手动更换电极接线时会引入干扰;选用短接多路电极施加脉冲的穿孔方式,对于有细胞贴附的工作电极,脉冲电流流经工作电极作用于细胞,最终流向参考电极形成回路,这种有细胞贴附的支路比没有细胞贴附的工作电极支路的阻抗大得多,根据并联电路的分流原理,电阻大的支路电流较小,因此驱动能力较弱的脉冲大部分电流没有穿过细胞,严重影响了细胞的穿孔效率:选用分离多路电极施加脉冲的电穿孔方式,各路径上均放置同相放大器提高脉冲的驱动能力,即使某些工作电极没有细胞贴附分电流大,也不会减弱其它路径上脉冲的穿孔电流,所以分离多路脉冲的电穿孔显著提高了细胞的穿孔效率,系统检测通量得到提升。
78.数据采集单元3014,用于产生电穿孔所需的脉冲信号和采集胞内外电信号调理电路单元输出的信号。
79.人工智能重构胞内电信号装置303,包括训练好的人工神经网络,用于将采集的细胞胞外电信号作为输入推导重构获得对应的细胞胞内电信号。
80.作为一优选方案,人工智能重构胞内电信号装置303具体包括:
81.训练单元3031,用于将所述胞内电信号数据作为细胞内电信号重构的人工神经网络的监督信息,并对人工神经网络进行训练;
82.细胞内电信号重构单元3032,即训练好的人工神经网络,用于将细胞外电信号数据作为输入,重构出细胞内电信号。
83.作为一优选方案,所述基于细胞穿孔的人工智能重构长周期胞内电信号系统还包括信号处理装置302,用于对采集的细胞的胞外电信号和/或胞内电信号进行预处理,具体包括:
84.信号提取单元3021,用于从所述细胞内外电信号中人工筛选出形状理想的信号,并提取出理想信号的数据;
85.信号降采样单元3022,用于根据需要对所述提取出的理想信号的数据进行降采样;
86.信号归一化单元3023,用于把所述理想信号的数据进行归一化,若理想信号的数据进行了降采样,则应对降采样后的数据进行归一化。
87.作为另一优选方案,所述基于细胞穿孔的人工智能重构长周期胞内电信号系统还包括数据处理装置304,具体包括:
88.无效数据剔除单元3041,用于将重构出的效果不好的细胞内电信号剔除,即剔除信号趋势异常的对应的细胞胞内电信号;
89.进一步地,对于应用于药物筛选的基于细胞穿孔的人工智能重构长周期胞内电信号系统,其数据处理装置还可以包括计算apd50单元3042,用于计算重构出的细胞内电信号的apd50数值。
90.作为另一优选方案,所述信号采集装置如图7所示,还包括:
91.金属屏蔽盒单元3015,用于消除整个装置的工频噪声和电磁辐射噪声,增强整个装置的抗干扰能力。
92.上位机单元3016,用于记录、显示数据采集单元采集到的信号,并且可以控制数据采集单元脉冲信号的产生和调节脉冲的参数。
93.电源模块单元3017,用于给胞内外电信号调理电路单元、脉冲电穿孔电路单元提供5.0v的电压。
94.基于上述实施例,本技术还提供基于细胞穿孔的人工智能重构长周期胞内电信号技术的应用例。
95.1.首先将脉冲电穿孔电路单元安装到胞内外电信号调理电路单元底下,连接各单元模块之间的连线,将心肌细胞及不同浓度药物的培养液加入细胞培养腔中,将微电极阵列传感器单元插入到插槽中,用金属屏蔽盒单元盖将微电极阵列传感器单元罩住,打开上位机,选出电穿孔的最优条件,再以电穿孔的最优条件进行电穿孔,进行心肌细胞胞内电信号采集,并把采集到的细胞电信号保存。
96.2.人工筛选出形状良好的细胞内外电信号,接着用提取算法提取出理想信号的数据并保存。
97.3.读取上述保存的数据,根据需要利用信号降采样单元对读取出的数据进行降采样,之后利用信号归一化单元对数据进行归一化,用归一化后的数据去训练人工智能神经网络模型,将细胞外信号数据作为模型的输入,将细胞内信号的数据作为模型的学习目标。
98.4.再次使用组装好的信号采集装置采集用于重构细胞内电信号的细胞外电信号并保存。此处的细胞是放在加有同一种药物的培养液中进行培养,但培养液中的加药浓度是不一样的。
99.5.人工筛选出形状良好的细胞外电信号,接着用提取算法提取出理想信号的数据并保存。此外,该处对提取出的数据还有一定要求:不同加药浓度的数据需要选定三个通道,并且应该从不同加药浓度数据中选定相同的通道,然后从每个通道中选取20个形状良好的细胞外电信号。
100.6.读取数据,根据需要对读取出的数据进行降采样,之后对数据进行归一化,接着把归一化后的数据输入到训练后的模型中,然后模型会输出重构好的细胞内电信号数据。
101.7.把重构好的细胞内电信号数据绘制成图片,人工剔除掉重建效果不好的胞内电信号数据。
102.8.分别计算不同加药浓度数据中三个通道预测出的胞内信号的adp50平均值,并绘制出图表。
103.本技术应用例将基于细胞穿孔的人工智能技术应用在重构细胞内电信号上,为广大进行细胞实验的人员以较高的效率提供了良好的细胞内电信号,为细胞的进一步研究提供了可靠的基础。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。