基于抗cd47和抗cd20的血癌治疗
1.相关申请的交叉引用
2.本技术要求以下美国临时申请的权益:2019年10月31日提交的美国临时申请号62/928,988;以及2020年5月28日提交的美国临时申请号63/031,418;这些临时申请中的每一者据此全文以引用方式并入以用于所有目的。
3.序列表
4.本技术包含序列表,该序列表以ascii格式以电子方式提交并且据此全文以引用方式并入。所述ascii副本创建于2020年10月22日,名称为fsi-007_p2f_sl.txt,并且大小为158,904字节。
背景技术:
5.cd47已被确认为介导癌细胞逃避先天性免疫系统的吞噬作用的关键分子。cd47看起来是癌细胞(包括癌症干细胞)克服其促吞噬的“吃我”信号的固有表达的重要手段。从正常细胞向癌细胞的进展可以涉及触发程序性细胞死亡(pcd)和程序性细胞清除(pcr)的基因和/或基因表达的变化。癌症进展中的许多步骤破坏了pcd的多种机制,并且抗吞噬信号cd47的表达可以代表重要的检查点。
6.cd47表达在来自大量不同的人类肿瘤类型的许多癌细胞的表面上增加,这些肿瘤类型包括以下原发性恶性肿瘤:头颈恶性肿瘤、黑素瘤、乳腺恶性肿瘤、肺部恶性肿瘤、卵巢恶性肿瘤、胰腺恶性肿瘤、结肠恶性肿瘤、膀胱恶性肿瘤、前列腺恶性肿瘤、平滑肌肉瘤、胶质母细胞瘤、髓母细胞瘤、少突胶质细胞瘤、神经胶质瘤、淋巴瘤、白血病和多发性骨髓瘤。在鼠异种移植研究中,已经证实cd47阻断抗体通过能够吞噬和消除来自各种血液恶性肿瘤和几种实体肿瘤的癌细胞来抑制人类癌症生长和转移。
7.cd47充当sirpα的配体,后者在包括巨噬细胞和树突状细胞在内的吞噬细胞上表达。sirpα在被cd47结合激活时启动信号转导级联,从而导致对吞噬作用的抑制。以这种方式,cd47通过将显性抑制信号递送到吞噬细胞而起到抗吞噬信号的作用。
8.用于在患有癌症的人类中有效递送阻断cd47的抗体的方法具有临床意义,并且在本文中提供。
技术实现要素:
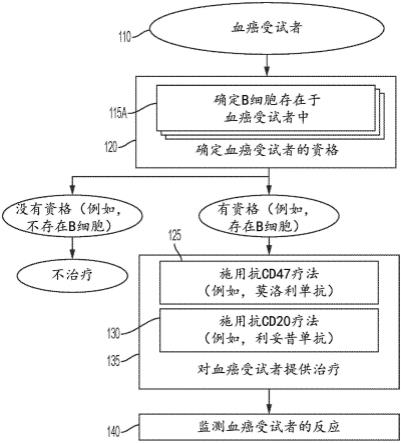
9.本文公开了一种使用包括抗cd47剂和抗cd20剂(例如,抗cd20抗体)的治疗来治疗受试者的血癌的方法。在各种实施方案中,通过验证b细胞存在于受试者中来确定受试者有资格接受该治疗。被确定为有资格接受该治疗的患者可能比被确定为没有资格接受该治疗的患者更有利地对该治疗作出反应。在各种实施方案中,受试者患有b细胞血液恶性肿瘤,例如cd20 癌症。
10.本文公开了一种治疗受试者的血癌的方法,包括:(a)施用抑制cd47与sirpα之间的结合的抗cd47剂;以及(b)将抗cd20抗体施用于所述受试者,其中在进行步骤(a)和(b)之前确定或已经确定b细胞存在于所述受试者中。本文另外公开了一种治疗受试者的血癌的
方法,包括:确定或已经确定b细胞存在于所述受试者中;以及向所述受试者施用或已经向所述受试者施用(i)抑制cd47与sirpα之间的结合的抗cd47剂,和(ii)抗cd20抗体。在各种实施方案中,受试者患有b细胞血液恶性肿瘤,例如cd20 癌症。
11.在各种实施方案中,确定b细胞存在于所述受试者中包括进行或已经进行至少一种选自以下的测定:流式细胞术、b细胞耐药组套、elisa、免疫组织化学显微镜检查、rna表达谱分析、rna测序、基于rna阵列的检测、rt-pcr、北方墨点法、免疫球蛋白测序、西方墨点法、酶联免疫斑点、或免疫荧光显微镜检查。
12.在各种实施方案中,该方法还包括:在将抗cd47剂和抗cd20抗体施用于受试者之前,如果确定b细胞存在于受试者中,则确定该受试者是治疗的候选者。在各种实施方案中,确定b细胞存在于受试者中包括确定或已经确定受试者具有cd19 b细胞。
13.在各种实施方案中,确定或已经确定受试者具有cd19 b细胞包括确定或已经确定受试者具有高于阈值量的cd19 b细胞。在各种实施方案中,cd19 b细胞的阈值量是用于确定存在cd19 b细胞的测定的检测限。在各种实施方案中,cd19 b细胞的阈值量是总淋巴细胞群中至少5%的cd19 b细胞。在各种实施方案中,cd19 b细胞的阈值量是每微升至少1个cd19 b细胞。在各种实施方案中,cd19 b细胞的阈值量是每微升至少40个cd19 b细胞。
14.在各种实施方案中,确定b细胞存在于受试者中包括确定或已经确定受试者具有cd20 b细胞。在各种实施方案中,确定或已经确定受试者具有cd20 b细胞包括确定或已经确定受试者具有高于阈值量的cd20 b细胞。在各种实施方案中,cd20 b细胞的阈值量是用于确定存在cd20 b细胞的测定的检测限。在各种实施方案中,cd20 b细胞的阈值量是总淋巴细胞群中至少5%的cd20 b细胞。在各种实施方案中,cd20 b细胞的阈值量是每微升至少1个cd20 b细胞。在各种实施方案中,cd20 b细胞的阈值量是每微升至少40个cd20 b细胞。
15.在各种实施方案中,确定b细胞存在于受试者中包括确定或已经确定受试者具有cd19 b细胞和cd20 b细胞两者。在各种实施方案中,确定或已经确定受试者具有cd19 b细胞和cd20 b细胞两者包括确定或已经确定受试者具有高于阈值量的cd19 b细胞和cd20 b细胞。在各种实施方案中,cd19 b细胞的阈值量是以下中的任一者:用于确定存在cd19 b细胞的测定的检测限、总淋巴细胞群中至少5%的cd19 b细胞、每微升至少1个cd19 b细胞、或者每微升至少40个cd19 b细胞。在各种实施方案中,cd20 b细胞的阈值量是以下中的任一者:用于确定存在cd20 b细胞的测定的检测限、总淋巴细胞群中至少5%的cd20 b细胞、每微升至少1个cd20 b细胞、或者每微升至少40个cd20 b细胞。
16.在各种实施方案中,确定b细胞存在于受试者中包括确定或已经确定受试者先前在超过阈值时间量以前接受抗cd20疗法。在各种实施方案中,阈值时间量是至少4周。在各种实施方案中,阈值时间量是至少5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周或28周。
17.在各种实施方案中,确定b细胞存在于受试者中包括确定或已经确定抗cd20疗法不存在于受试者中。在各种实施方案中,确定或已经确定抗cd20疗法不存在于受试者中包括确定或已经确定受试者具有低于抗cd20疗法的阈值浓度的浓度。在各种实施方案中,抗cd20疗法的阈值浓度是用于检测存在抗cd20疗法的检测测定的定量限。在各种实施方案中,用于检测存在抗cd20疗法的检测测定是以下中的一者:免疫测定法、elispot、荧光斑点、基于流式细胞术的测定、西方墨点法、lc质谱法、或表面等离子体共振。
18.在各种实施方案中,先前接受的抗cd20疗法包括利妥昔单抗。在各种实施方案中,使用从受试者获得的样品确定或已经确定b细胞存在于受试者中。在各种实施方案中,从受试者获得的样品是外周血液样品。
19.在各种实施方案中,抗cd47剂包括抑制cd47与sirpα之间的结合的分离抗体。在各种实施方案中,抗cd47剂包括sirpα试剂,例如sirpα-fc融合蛋白。在各种实施方案中,sirpα试剂包括sirpα的结合cd47的一部分。在各种实施方案中,sirpα试剂是高亲和力sirpα试剂。在各种实施方案中,抗cd47剂包括抗cd47抗体或抗sirpα抗体。在各种实施方案中,抗cd47剂包括莫洛利单抗(hu5f9-g4)。在各种实施方案中,抗cd47剂包括hu1h9-g1、hu1h9-g4、hu3c2-g1、hu3c2-g4、9b11-g1、9b11-g4、7e11-g1和7e11-g4中的至少一者。在各种实施方案中,抗sirpα剂是抗sirpα抗体,包括fsi-189(gs-0189)、es-004、bi765063、adu1805、al008和cc-9525中的至少一者。
20.在各种实施方案中,血癌是弥漫性大b细胞淋巴瘤(dlbcl)。在各种实施方案中,受试者患有复发性或难治性dlbcl。在各种实施方案中,受试者先前已经用至少两条在先治疗线治疗过。在各种实施方案中,血癌是滤泡性淋巴瘤(fl)。在各种实施方案中,血癌是以下中的一者:非霍奇金氏淋巴瘤、边缘区淋巴瘤、套细胞淋巴瘤、慢性淋巴细胞性白血病/小淋巴细胞性白血病、华氏巨球蛋白血症/淋巴浆细胞性淋巴瘤、原发性纵隔b细胞淋巴瘤、伯基特氏淋巴瘤、未分类b细胞淋巴瘤、b细胞急性淋巴母细胞性白血病、或移植后淋巴细胞增生性疾病(ptld)。
21.在各种实施方案中,抗cd47剂以每kg体重至少10mg至30mg、20mg至30mg、10mg、15mg、20mg、30mg、46mg、60mg或100mg的剂量施用。在各种实施方案中,抗cd47剂静脉内施用。在各种实施方案中,抗cd20抗体静脉内施用。在各种实施方案中,该方法靶向cd47或sirpα。
22.在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂是抗cd47抗体,并且其中该抗cd47抗体在第一周期中施用于受试者,该第一周期包括:在第1天,每kg体重至少1mg抗体或者在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)的抗体的初免剂量;以及从第8天开始持续4周,每kg体重至少30mg的周剂量。在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂进一步在第二周期中施用于受试者,该第二周期包括:持续4周,每kg体重至少30mg的周剂量。在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂进一步在第三周期中施用于受试者,该第三周期包括:每kg体重至少30mg的隔周剂量。在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂进一步在后续周期中施用于受试者,该后续周期包括:每kg体重至少30mg的隔周剂量。在各种实施方案中,该后续周期作为一个或多个附加周期被无限制地重复,或者被重复直到临床益处减弱或丧失或者不再观察到临床益处为止。在一些实施方案中,抗cd47剂静脉内施用。在各种实施方案中,受试者患有b细胞血液恶性肿瘤,例如cd20 癌症,例如惰性或侵袭性淋巴瘤,例如弥漫性大b细胞淋巴瘤(dlbcl)(包括复发性或难治性)、滤泡性淋巴瘤(fl)(包括复发性、难治性或无症状性)、非霍奇金氏淋巴瘤(nhl)(包括复发性或难治性)、边缘区淋巴瘤(例如淋巴结外边缘区淋巴瘤)、套细胞淋巴瘤(mcl)(包括复发性或难治性)、慢性淋巴细胞性白血病(cll)/小淋巴细胞性白血病(包括复发性或难治性)、华氏巨球蛋白血症/淋巴浆细胞性淋巴瘤、原发性纵隔b细胞淋巴瘤、伯基特氏淋巴瘤、双重打击淋巴瘤(例如,具有myc和bcl2或bcl6重
排中的一者或两者的高级b细胞淋巴瘤)、myc重排淋巴瘤、未分类b细胞淋巴瘤、b细胞急性淋巴母细胞性白血病(all)(例如,费城染色体阴性急性淋巴母细胞性白血病)、或移植后淋巴细胞增生性疾病(ptld)。在一些实施方案中,受试者患有弥漫性大b细胞淋巴瘤(dlbcl),例如从头dlbcl或转化性dlbcl,或者活化b细胞(abc)、生发中心b细胞(gcb)或非生发中心b细胞(非gcb)dlbcl。在一些实施方案中,受试者患有nhl,例如以下中的一者或两者:(i)低级或高风险nhl,或者(ii)滤泡性(例如,大体积、非大体积或晚期滤泡性)或非滤泡性nhl。在一些实施方案中,受试者患有复发性或难治性形式的b细胞血液恶性肿瘤。在各种实施方案中,该方法靶向cd47或sirpα。
23.在各种实施方案中,第一周期还包括每m2体表面积375mg抗cd20抗体的周剂量。在各种实施方案中,第二周期还包括每m2体表面积375mg抗cd20抗体的月剂量。在各种实施方案中,第三周期还包括每m2体表面积375mg抗cd20抗体的月剂量。在各种实施方案中,后续周期还包括每m2体表面积375mg抗cd20抗体的隔月剂量。在各种实施方案中,抗cd20抗体以100mg/m2、125mg/m2、150mg/m2、175mg/m2、200mg/m2、225mg/m2、250mg/m2、275mg/m2、300mg/m2、325mg/m2、350mg/m2、375mg/m2、400mg/m2、425mg/m2、450mg/m2、475mg/m2或500mg/m2中任一者的剂量施用于受试者。在各种实施方案中,该方法靶向cd47或sirpα。
24.在各种实施方案中,在将抗cd47剂和抗cd20抗体均施用于受试者的那些天,抗cd47剂在抗cd20抗体之前施用于受试者。在各种实施方案中,在将抗cd47剂和抗cd20抗体均施用于受试者的那些天,抗cd20抗体在抗cd47剂之前施用于受试者。在各种实施方案中,该方法靶向cd47或sirpα。
25.在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂是抗cd47抗体,并且其中该抗cd47抗体在第一周期中施用于受试者,该第一周期包括:在第1天,至少80mg或者在80mg至800mg范围内(例如80mg至400mg,例如80mg至200mg,例如80mg、100mg、160mg、200mg、240mg、320mg、400mg)的初免剂量;以及从第8天开始持续4周,至少2400mg的周剂量。在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂进一步在第二周期中施用于受试者,该第二周期包括:持续4周,至少2400mg的周剂量。在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂进一步在第三周期中施用于受试者,该第三周期包括:至少2400mg的隔周剂量。在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂进一步在后续周期中施用于受试者,该后续周期包括:至少2400mg的隔周剂量。在各种实施方案中,该后续周期作为一个或多个附加周期被无限制地重复,或者被重复直到临床益处减弱或丧失或者不再观察到临床益处为止。在一些实施方案中,抗cd47剂静脉内施用。在各种实施方案中,受试者患有b细胞血液恶性肿瘤,例如cd20 癌症,例如惰性或侵袭性淋巴瘤,例如弥漫性大b细胞淋巴瘤(dlbcl)(包括复发性或难治性)、滤泡性淋巴瘤(fl)(包括复发性、难治性或无症状性)、非霍奇金氏淋巴瘤(nhl)(包括复发性或难治性,或无症状性)、边缘区淋巴瘤(例如淋巴结外边缘区淋巴瘤)、套细胞淋巴瘤(mcl)(包括复发性或难治性)、慢性淋巴细胞性白血病(cll)/小淋巴细胞性白血病(包括复发性或难治性)、华氏巨球蛋白血症/淋巴浆细胞性淋巴瘤、原发性纵隔b细胞淋巴瘤、伯基特氏淋巴瘤、双重打击淋巴瘤(例如,具有myc和bcl2或bcl6重排中的一者或两者的高级b细胞淋巴瘤)、myc重排淋巴瘤、未分类b细胞淋巴瘤、b细胞急性淋巴母细胞性白血病(all)(例如,费城染色体阴性急性淋巴母细胞性白血病)、或移植后淋巴细胞增生性疾病(ptld)。在一些实施方案中,受试者患有弥漫性大b细
胞淋巴瘤(dlbcl),例如原发性或转化性dlbcl,或者活化b细胞(abc)、生发中心b细胞(gcb)或非生发中心b细胞(非gcb)dlbcl。在一些实施方案中,受试者患有nhl,例如以下中的一者或两者:(i)低级或高风险nhl,或者(ii)滤泡性(例如,大体积、非大体积或晚期滤泡性)或非滤泡性nhl。在一些实施方案中,受试者患有复发性或难治性形式的b细胞血液恶性肿瘤。在各种实施方案中,该方法靶向cd47或sirpα。
26.在各种实施方案中,第一周期还包括每m2体表面积375mg抗cd20抗体的周剂量。在各种实施方案中,第二周期还包括每m2体表面积375mg抗cd20抗体的月剂量。在各种实施方案中,第三周期还包括每m2体表面积375mg抗cd20抗体的月剂量。在各种实施方案中,后续周期还包括每m2体表面积375mg抗cd20抗体的隔月剂量。在各种实施方案中,抗cd20抗体以100mg/m2、125mg/m2、150mg/m2、175mg/m2、200mg/m2、225mg/m2、250mg/m2、275mg/m2、300mg/m2、325mg/m2、350mg/m2、375mg/m2、400mg/m2、425mg/m2、450mg/m2、475mg/m2或500mg/m2中任一者的剂量施用于受试者。在各种实施方案中,该方法靶向cd47或sirpα。
27.在各种实施方案中,在将抗cd47剂和抗cd20抗体均施用于受试者的那些天,抗cd47剂在抗cd20抗体之前施用于受试者。在各种实施方案中,在将抗cd47剂和抗cd20抗体均施用于受试者的那些天,抗cd20抗体在抗cd47剂之前施用于受试者。
28.在各种实施方案中,该方法还包括将化学疗法施用于受试者。在各种实施方案中,该化学疗法是吉西他滨、奥沙利铂,或吉西他滨和奥沙利铂的组合(gemox)。
29.在各种实施方案中,抗cd20抗体包括利妥昔单抗。在各种实施方案中,抗cd20抗体包含一个、两个、三个、四个、五个或六个具有序列seq id:131-136的互补决定区(cdr)。在各种实施方案中,抗cd20抗体包含可变重链序列seq id no:137。在各种实施方案中,抗cd20抗体包含可变轻链序列seq id no:142。在各种实施方案中,抗cd20抗体包含fc区,该fc区包含c
h2
序列seq id no:140和c
h3
序列seq id no:141。在各种实施方案中,抗cd20抗体包含fab或scfv,其中该fab或scfv包含可变重链序列seq id no:137和可变轻链序列seq id no:142。在各种实施方案中,抗cd20抗体包含fab或scfv,其中该fab或scfv具有序列seq id:131-136。
30.本文另外公开了一种治疗受试者的血癌的方法,该方法包括:确定或已经确定b细胞存在于受试者中,其中该确定包括确定或已经确定该受试者在淋巴细胞总量中具有至少5%的cd19 b细胞;向该受试者施用莫洛利单抗;并且施用利妥昔单抗,其中该受试者是先前已经用至少两条在先治疗线治疗过的人类受试者,其中该血癌(例如b细胞血液恶性肿瘤,例如cd20 癌症)是复发性或难治性dlbcl,其中施用莫洛利单抗包括:(1)在第1天,施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)的抗体的莫洛利单抗初免剂量,(2)以每kg体重30mg施用莫洛利单抗周剂量,持续8周,以及(3)此后以每kg体重30mg施用莫洛利单抗隔周剂量,并且其中施用利妥昔单抗包括:(1)以每m2体表面积375mg施用利妥昔单抗周剂量,持续4周,随后(2)以每m2体表面积375mg每月施用利妥昔单抗。在各种实施方案中,该方法靶向cd47或sirpα。
31.本文另外公开了一种方法,包括:基于患有血癌的受试者是否在超过阈值时间量以前最后一次接受抗cd20疗法来确定b细胞是否存在于该受试者中,其中该受试者在超过阈值时间量以前最后一次接受抗cd20疗法指示b细胞存在于该受试者中,其中b细胞存在于该受试者中指示该受试者可能对以下疗法作出反应,该疗法包括:1)抗cd47剂,其抑制cd47
与sirpα之间的结合,和2)利妥昔单抗,其中b细胞不存在于该受试者中指示该受试者不大可能对以下疗法作出反应,该疗法包括:1)抗cd47剂,其抑制cd47与sirpα之间的结合,和2)利妥昔单抗。
32.本文另外公开了一种方法,包括:从患有血癌的受试者获得样品;通过对从该受试者获得的样品进行测定来确定b细胞是否存在于该受试者中,其中b细胞存在于该受试者中指示该受试者可能对以下疗法作出反应,该疗法包括:1)抗cd47剂,其抑制cd47与sirpα之间的结合,和2)利妥昔单抗,其中b细胞不存在于该受试者中指示该受试者不大可能对以下疗法作出反应,该疗法包括:1)抗cd47剂,其抑制cd47与sirpα之间的结合,和2)利妥昔单抗。在各种实施方案中,从受试者获得的样品是外周血液样品。
33.本文另外公开了一种方法,包括:获得或已经获得包含指示b细胞存在于患有血癌的受试者中的信息的数据集,其中指示b细胞存在于患有血癌的受试者中的信息包括以下中的一者:所述受试者中的b细胞的量;所述受试者的总淋巴细胞中b细胞的百分比;所述受试者最后一次接受抗cd20疗法的天数;抗cd20疗法存在或不存在于所述受试者中;使用所述数据集确定b细胞存在于患有所述血癌的所述受试者中;以及向患有所述血癌的所述受试者施用治疗。在各种实施方案中,获得或已经获得所述数据集包括进行或已经进行至少一种选自以下的测定:流式细胞术、b细胞耐药组套、elisa、免疫组织化学显微镜检查、rna表达谱分析、rna测序、基于rna阵列的检测、rt-pcr、北方墨点法、免疫球蛋白测序、西方墨点法、elispot、或免疫荧光显微镜检查。在各种实施方案中,该数据集中的信息包括以下中的任一者:从受试者获得的样品中的b细胞的量,或者从受试者获得的样品中的b细胞的百分比,并且其中确定b细胞存在于受试者中包括将该信息与b细胞的阈值量进行比较。
34.在各种实施方案中,b细胞的阈值量是总淋巴细胞群中至少5%的b细胞。在各种实施方案中,b细胞的阈值量至少是用于确定存在b细胞的测定的检测限。在各种实施方案中,b细胞的阈值量是每微升至少1个b细胞。在各种实施方案中,b细胞的阈值量是每微升至少40个b细胞。在各种实施方案中,b细胞是cd19 b细胞或cd20 b细胞中的一种。在各种实施方案中,b细胞是cd19 b细胞和cd20 b细胞两者。
35.在各种实施方案中,该数据集中的信息包括受试者先前接受抗cd20疗法的时间量,并且其中确定b细胞存在于受试者中包括确定受试者先前接受抗cd20疗法的时间量是否高于阈值时间量。在各种实施方案中,阈值时间量是至少4周。在各种实施方案中,阈值时间量是至少5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周或28周。
36.在各种实施方案中,该数据集中的信息包括抗cd20疗法存在或不存在于受试者中,并且其中确定b细胞存在于受试者中包括确定抗cd20疗法不存在于受试者中。在各种实施方案中,确定抗cd20疗法不存在于受试者中包括确定或已经确定受试者具有低于抗cd20疗法的阈值浓度的浓度。在各种实施方案中,抗cd20疗法的阈值浓度是用于检测存在抗cd20疗法的检测测定的定量限。在各种实施方案中,用于检测存在抗cd20疗法的检测测定是以下中的一者:免疫测定法、酶联免疫斑点、荧光斑点、基于流式细胞术的测定、西方墨点法、lc质谱法、或表面等离子体共振。在各种实施方案中,先前接受的抗cd20疗法包括利妥昔单抗。
37.在各种实施方案中,血癌是弥漫性大b细胞淋巴瘤(dlbcl)。在各种实施方案中,血
癌是复发性或难治性dlbcl。在各种实施方案中,受试者先前已经用至少两条在先治疗线治疗过。在各种实施方案中,血癌(例如b细胞血液恶性肿瘤,例如cd20 癌症)是滤泡性淋巴瘤(fl)。在各种实施方案中,血癌是以下中的一者:非霍奇金氏淋巴瘤、边缘区淋巴瘤、套细胞淋巴瘤、慢性淋巴细胞性白血病/小淋巴细胞性白血病、华氏巨球蛋白血症/淋巴浆细胞性淋巴瘤、原发性纵隔b细胞淋巴瘤、伯基特氏淋巴瘤、未分类b细胞淋巴瘤、b细胞急性淋巴母细胞性白血病、或移植后淋巴细胞增生性疾病(ptld)。
38.在各种实施方案中,施用该治疗包括向受试者施用抑制cd47与sirpα,之间的结合的抗cd47剂,以及施用抗cd20抗体。在各种实施方案中,抗cd47剂包括抑制cd47与sirpα之间的结合的分离抗体。在各种实施方案中,抗cd47剂包括sirpα试剂。在各种实施方案中,sirpα试剂包括sirpα的结合cd47的一部分。在各种实施方案中,sirpα试剂是高亲和力sirpα试剂。在各种实施方案中,抗cd47剂包括抑制cd47与sirpα。之间的结合的分离抗体。在各种实施方案中,抗cd47剂包括抗cd47抗体或抗sirpα抗体。在各种实施方案中,抗cd47剂包括莫洛利单抗(hu5f9-g4)。在各种实施方案中,抗cd47剂包括hu1h9-g1、hu1h9-g4、hu3c2-g1、hu3c2-g4、9b11-g1、9b11-g4、7e11-g1和7e11-g4中的至少一者。在各种实施方案中,抗sirpα剂是抗sirpα抗体,包括fsi-189(gs-0189)、es-004、bi765063、adu1805和cc-9525中的至少一者。
39.在各种实施方案中,受试者先前用抗cd20疗法治疗,并且其中向受试者施用抑制cd47与sirpα之间的结合的抗cd47剂以及施用抗cd20抗体在受试者先前用抗cd20疗法治疗之后各自进行不少于28天。在各种实施方案中,抗cd47剂以每kg体重至少10mg至30mg、20mg至30mg、10mg、15mg、20mg、30mg、45mg、60mg或100mg的剂量施用。在各种实施方案中,抗cd47剂静脉内施用。在各种实施方案中,抗cd20抗体静脉内施用。在各种实施方案中,该方法靶向cd47或sirpα。
40.在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂是抗cd47抗体,并且其中该抗cd47抗体在第一周期中施用于受试者,该第一周期包括:在第1天,每kg体重至少1mg或者在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)的初免剂量;以及从第8天开始持续4周,每kg体重至少30mg的周剂量。在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂进一步在第二周期中施用于受试者,该第二周期包括:持续4周,每kg体重至少30mg的周剂量。在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂进一步在第三周期中施用于受试者,该第三周期包括:每kg体重至少30mg的隔周剂量。在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂进一步在后续周期中施用于受试者,该后续周期包括:每kg体重至少30mg的隔周剂量。在各种实施方案中,该后续周期作为一个或多个附加周期被无限制地重复,或者被重复直到临床益处减弱或丧失或者不再观察到临床益处为止。在一些实施方案中,抗cd47剂静脉内施用。在各种实施方案中,受试者患有b细胞血液恶性肿瘤,例如cd20 癌症,例如惰性或侵袭性淋巴瘤,例如弥漫性大b细胞淋巴瘤(dlbcl)(包括复发性或难治性)、滤泡性淋巴瘤(fl)(包括复发性、难治性或无症状性)、非霍奇金氏淋巴瘤(nhl)(包括复发性或难治性)、边缘区淋巴瘤(例如淋巴结外边缘区淋巴瘤)、套细胞淋巴瘤(mcl)(包括复发性或难治性)、慢性淋巴细胞性白血病(cll)/小淋巴细胞性白血病(包括复发性或难治性)、华氏巨球蛋白血症/淋巴浆细胞性淋巴瘤、原发性纵隔b细胞淋巴瘤、伯基特氏淋巴瘤、双重打击淋巴瘤(例如,具有myc和bcl2或bcl6重排中的一
者或两者的高级b细胞淋巴瘤)、myc重排淋巴瘤、未分类b细胞淋巴瘤、b细胞急性淋巴母细胞性白血病(all)(例如,费城染色体阴性急性淋巴母细胞性白血病)、或移植后淋巴细胞增生性疾病(ptld)。在一些实施方案中,受试者患有低弥漫性大b细胞淋巴瘤(dlbcl),例如原发性或转化性dlbcl,或者活化b细胞(abc)、生发中心b细胞(gcb)或非生发中心b细胞(非gcb)dlbcl。在一些实施方案中,受试者患有nhl,例如以下中的一者或两者:(i)低级或高风险nhl,或者(ii)滤泡性(例如,大体积、非大体积或晚期滤泡性)或非滤泡性nhl。在一些实施方案中,受试者患有复发性或难治性形式的b细胞血液恶性肿瘤。在各种实施方案中,该方法靶向cd47或sirpα。
41.在各种实施方案中,第一周期还包括每m2体表面积375mg抗cd20抗体的周剂量。在各种实施方案中,第二周期还包括每m2体表面积375mg抗cd20抗体的月剂量。在各种实施方案中,第三周期还包括每m2体表面积375mg抗cd20抗体的月剂量。在各种实施方案中,后续周期还包括每m2体表面积375mg抗cd20抗体的隔月剂量。在各种实施方案中,抗cd20抗体以100mg/m2、125mg/m2、150mg/m2、175mg/m2、200mg/m2、225mg/m2、250mg/m2、275mg/m2、300mg/m2、325mg/m2、350mg/m2、375mg/m2、400mg/m2、425mg/m2、450mg/m2、475mg/m2或500mg/m2中任一者的剂量施用于受试者。在各种实施方案中,在将抗cd47剂和抗cd20抗体均施用于受试者的那些天,抗cd47剂在抗cd20抗体之前施用于受试者。在各种实施方案中,在将抗cd47剂和抗cd20抗体均施用于受试者的那些天,抗cd20抗体在抗cd47剂之前施用于受试者。在各种实施方案中,该方法还包括将化学疗法施用于受试者。在各种实施方案中,该方法靶向cd47或sirpα。
42.在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂是抗sirpα抗体。在各种实施方案中,抗sirpα抗体以每两周至少10mg、至少30mg或至少100mg中任一者的剂量施用于受试者,持续9个月。在各种实施方案中,抗sirpα抗体以每两周至少100mg、至少200mg、至少400mg或至少800mg中任一者的剂量施用于受试者,持续9个月。在各种实施方案中,抗sirpα抗体与每m2体表面积375mg抗cd20抗体组合施用。在一些实施方案中,抗sirpα抗体静脉内施用。在一些实施方案中,抗cd20抗体静脉内施用。在各种实施方案中,受试者患有b细胞血液恶性肿瘤,例如cd20 癌症,例如惰性或侵袭性淋巴瘤,例如弥漫性大b细胞淋巴瘤(dlbcl)(包括复发性或难治性)、滤泡性淋巴瘤(fl)(包括复发性、难治性或无症状性)、非霍奇金氏淋巴瘤(nhl)(包括复发性或难治性)、边缘区淋巴瘤(例如淋巴结外边缘区淋巴瘤)、套细胞淋巴瘤(mcl)(包括复发性或难治性)、慢性淋巴细胞性白血病(cll)/小淋巴细胞性白血病(包括复发性或难治性)、华氏巨球蛋白血症/淋巴浆细胞性淋巴瘤、原发性纵隔b细胞淋巴瘤、伯基特氏淋巴瘤、双重打击淋巴瘤(例如,具有myc和bcl2或bcl6重排中的一者或两者的高级b细胞淋巴瘤)、myc重排淋巴瘤、未分类b细胞淋巴瘤、b细胞急性淋巴母细胞性白血病(all)(例如,费城染色体阴性急性淋巴母细胞性白血病)、或移植后淋巴细胞增生性疾病(ptld)。在一些实施方案中,受试者患有低弥漫性大b细胞淋巴瘤(dlbcl),例如原发性或转化性dlbcl,或者活化b细胞(abc)、生发中心b细胞(gcb)或非生发中心b细胞(非gcb)dlbcl。在一些实施方案中,受试者患有nhl,例如以下中的一者或两者:(i)低级或高风险nhl,或者(ii)滤泡性(例如,大体积、非大体积或晚期滤泡性)或非滤泡性nhl。在一些实施方案中,受试者患有复发性或难治性形式的b细胞血液恶性肿瘤。在各种实施方案中,该方法靶向cd47或sirpα。
43.在各种实施方案中,抑制cd47与sirpα之间的结合的抗cd47剂是抗sirpα抗体。在各种实施方案中,抗sirpα抗体在第一周期中施用于受试者,该第一周期包括:在第1天,至少3mg或至少10mg的初免剂量;以及从第15天开始持续9个月,至少100mg或至少200mg的隔周剂量。在各种实施方案中,从第15天开始持续9个月,抗sirpα抗体与每m2体表面积375mg抗cd20抗体组合施用。在一些实施方案中,抗sirpα抗体静脉内施用。在一些实施方案中,抗cd20抗体静脉内施用。在各种实施方案中,受试者患有b细胞血液恶性肿瘤,例如cd20 癌症,例如惰性或侵袭性淋巴瘤,例如弥漫性大b细胞淋巴瘤(dlbcl)(包括复发性或难治性)、滤泡性淋巴瘤(fl)(包括复发性、难治性或无症状性)、非霍奇金氏淋巴瘤(nhl)(包括复发性或难治性)、边缘区淋巴瘤(例如淋巴结外边缘区淋巴瘤)、套细胞淋巴瘤(mcl)(包括复发性或难治性)、慢性淋巴细胞性白血病(cll)/小淋巴细胞性白血病(包括复发性或难治性)、华氏巨球蛋白血症/淋巴浆细胞性淋巴瘤、原发性纵隔b细胞淋巴瘤、伯基特氏淋巴瘤、双重打击淋巴瘤(例如,具有myc和bcl2或bcl6重排中的一者或两者的高级b细胞淋巴瘤)、myc重排淋巴瘤、未分类b细胞淋巴瘤、b细胞急性淋巴母细胞性白血病(all)(例如,费城染色体阴性急性淋巴母细胞性白血病)、或移植后淋巴细胞增生性疾病(ptld)。在一些实施方案中,受试者患有低弥漫性大b细胞淋巴瘤(dlbcl),例如原发性或转化性dlbcl,或者活化b细胞(abc)、生发中心b细胞(gcb)或非生发中心b细胞(非gcb)dlbcl。在一些实施方案中,受试者患有nhl,例如以下中的一者或两者:(i)低级或高风险nhl,或者(ii)滤泡性(例如,大体积、非大体积或晚期滤泡性)或非滤泡性nhl。在一些实施方案中,受试者患有复发性或难治性形式的b细胞血液恶性肿瘤。在各种实施方案中,该方法靶向cd47或sirpα。
44.在各种实施方案中,该化学疗法是吉西他滨、奥沙利铂,或吉西他滨和奥沙利铂的组合(gemox)。
45.在各种实施方案中,抗cd20抗体包括利妥昔单抗。在各种实施方案中,抗cd20抗体包含一个、两个、三个、四个、五个或六个具有序列seq id:131-136的互补决定区(cdr)。在各种实施方案中,抗cd20抗体包含可变重链序列seq id no:137。在各种实施方案中,抗cd20抗体包含可变轻链序列seq id no:142。在各种实施方案中,抗cd20抗体包含fc区,该fc区包含c
h2
序列seq id no:140和c
h3
序列seq id no:141。在各种实施方案中,抗cd20抗体包含fab或scfv,其中该fab或scfv包含可变重链序列seq id no:137和可变轻链序列seq id no:142。在各种实施方案中,抗cd20抗体包含fab或scfv,其中该fab或scfv具有序列seq id:131-136。
附图说明
46.参照以下描述和附图,本发明的这些和其他特征、方面和优点将变得更好理解,其中:
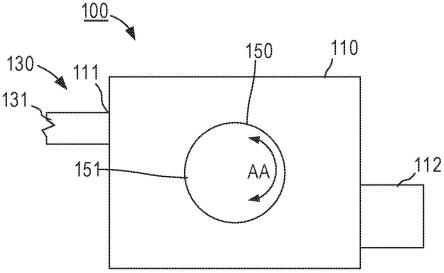
47.图1是根据一个实施方案的用于确定血癌受试者接受抗cd47治疗的资格的示例流程图。
48.图2示出了以下研究设计方案:hu5f9-g4与利妥昔单抗组合在复发性/难治性b细胞非霍奇金氏淋巴瘤患者中的1b/2期试验。利用莫洛利单抗初免剂量(1mg/kg)来缓解靶向性贫血,在标准3 3设计中与利妥昔单抗组合使用的维持剂量从10mg/kg递增至30mg/kg。
49.图3示出了使用cd19 b细胞的百分比和利妥昔单抗作为存在cd20 b细胞的代表。
50.图4示出了在1b/2期试验中影响患者反应率的确定变量。
51.图5是描绘cd19 b细胞阴性患者的最佳总体反应率的柱形图。
52.图6是描绘基于患者外周血中cd19 b细胞的百分比的患者最佳总体反应率的图。
53.图7是描绘基于患者外周血中cd19 b细胞的绝对计数的患者最佳总体反应率的图。
54.图8示出了在应用cd19 b细胞存在的资格标准之前和之后,参与1b/2期试验的患者的反应率。
55.图9示出了基于cd20 b细胞存在或不存在于患有弥漫性大b细胞淋巴瘤或滤泡性淋巴瘤的患者中描绘所述患者的最佳总体反应率的饼形图。
56.图10示出了参与1b/2期试验的缩减患者集合的反应率,其中估计该缩减集合中的每个患者都存在cd20 b细胞。
57.图11a和图11b描绘了描述cd20 h分数的结果,该分数可以用作存在或不存在cd20 b细胞的直接量度。
58.图12a和图12b描绘了使用免疫组织化学确认的具有cd20 cd19 或cd20-cd19 分布的两名患者的结果。
59.图13示出了基于患者最后一次接受抗cd20治疗的天数的患者最佳总体反应率。
60.图14a和图14b示出了涉及抗cd20治疗(例如利妥昔单抗)的治疗后cd20表达的减少。
61.图15a和图15b示出了个体dlbcl患者在筛选时和治疗后cd20表达的变化。
62.图16示出了患者最后一次接受抗cd20治疗的时间与患者中存在的cd19 b细胞的绝对计数之间的相关性。
63.图17示出了患者最后一次接受抗cd20治疗的时间与患者中存在的cd19 b细胞的百分比之间的相关性。
64.图18示出了患者中的利妥昔单抗浓度(例如,作为利妥昔单抗药代动力学的量度)与患者中存在的cd19 b细胞的百分比之间的相关性。
65.图19示出了患者中存在或不存在利妥昔单抗与患者中存在的cd19 b细胞的百分比之间的相关性。
66.图20示出了患者中的利妥昔单抗浓度与患者中存在或不存在cd19 b细胞之间的相关性。
67.图21a示出了从hu5f9-g4给药(q1w)转变为隔周hu5f9-g4给药(q2w)之后,随时间推移cd45 外周血细胞中hu5f9-g4的cd47受体占有率。
68.图21b示出了从每周hu5f9-g4给药(q1w)转变为隔周hu5f9-g4给药(q2w)之后,随时间推移cd45 骨髓细胞中hu5f9-g4的cd47受体占有率。
具体实施方式
69.本文公开了通过以下方式治疗患有血癌的受试者的方法:基于确定b细胞存在于受试者中来确定受试者有资格接受该治疗,并且进一步用抗cd47剂(例如,莫洛利单抗)单独地或者与一种或多种附加药剂诸如抗cd20剂(例如,利妥昔单抗)组合治疗受试者。
70.在描述本发明的方法和组合物之前,应当理解,本发明不限于所描述的具体方法
或组合物,因为它们当然可以变化。还应当理解,本文使用的术语仅用于描述具体实施方案的目的,而并非旨在进行限制,因为本发明的范围将仅由所附权利要求限制。
71.在提供数值范围的情况下,应当理解,除非上下文另外明确指出,否则在该范围的上限与下限之间的每个居间值(到下限单位的十分之一)也被具体公开。指定范围内的任何指定值或居间值与该指定范围内的任何其他指定或居间值之间的每个较小范围均涵盖在本发明之内。这些较小范围的上限和下限可以独立地包括在该范围内或排除在该范围外,并且其中任一个限值均包括在该较小范围内、两个限值均不包括在或均包括在该较小范围内的每个范围也涵盖在本发明之内,受限于该指定范围内的任何明确排除的限值。在指定范围包括所述限值中的一者或两者的情况下,排除那些包括的限值中的任一者或两者的范围也包括在本发明中。
72.除非另有定义,否则本文所使用的所有技术和科学术语均具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管在本发明的实践或测试中可以使用与本文所述的那些类似或等同的任何方法和材料,但是现在描述一些潜在的和优选的方法和材料。本文提及的所有出版物均通过引用并入本文,以公开和描述与所引用的出版物相关的方法和/或材料。应当理解,在存在矛盾的情况下,本公开取代并入的出版物的任何公开内容。
73.本领域技术人员在阅读本公开时将显而易见的,本文描述和展示的各个实施方案中的每一者具有分立的组分和特征,这些组分和特征可以容易地与其他若干实施方案中的任一者的特征分离或组合,而不脱离本发明的范围或实质。任何列举的方法均能够以列举的事件的顺序或者以逻辑上可能的任何其他顺序来执行。
74.必须注意的是,如本文和所附权利要求中所使用的,单数形式“一个”、“一种”和“该”包括多个指代物,除非上下文另有明确规定。因此,例如,提及“一个细胞”包括多个此类细胞,并且提及“该肽”包括提及一种或多种肽及其等同物,例如多肽,这是本领域技术人员已知的,等等。
75.提供本文所讨论的出版物仅仅是为了它们在本技术的申请日之前的公开内容。本文中的任何内容都不应理解为承认本发明由于在先发明而无权先于这种出版物。另外,所提供的出版日期可能与实际出版日期不同,实际出版日期可能需要独立确认。
76.定义
77.术语“抗cd47剂”或“提供cd47阻断的药剂”是指减少cd47(例如,靶细胞上的)与cd47配体诸如sirpα(例如,吞噬细胞上的)的结合的任何药剂。合适的抗cd47试剂的非限制性示例包括sirpα试剂,包括但不限于:高亲和力sirpα多肽、抗sirpα抗体、可溶性cd47多肽,以及抗cd47抗体或抗体片段。在一些实施方案中,合适的抗cd47剂(例如,抗cd47抗体、sirpα试剂等)特异性地结合cd47,以减少cd47与sirpα的结合。在一些实施方案中,主题抗cd47抗体特异性地结合cd47并且减弱一个细胞(例如,受感染细胞)上的cd47与另一个细胞(例如,吞噬细胞)上的sirpα之间的相互作用。在一些实施方案中,合适的抗cd47抗体在结合时不活化cd47。一些抗cd47抗体不减少cd47与sirpα的结合,这样的抗体可以被称为“非阻断性抗cd47抗体”。作为“抗cd47剂”的合适的抗cd47抗体可以被称为“cd47阻断抗体”。合适抗体的非限制性示例包括克隆b6h12、5f9、8b6和c3(例如,如2012年1月19日公开的国际专利公布wo2011143624中所述,该专利公布以引用方式明确地并入本文)。合适的抗cd47抗
体包括此类抗体的完全人源性、人源化或嵌合型式。人源化抗体(例如,hu5f9-g4)由于其抗原性低而特别适用于人的体内应用。类似地,犬源化、猫源化等抗体分别特别适用于狗、猫和其他物种中的应用。感兴趣的抗体包括人源化抗体,或犬源化、猫源化、马源化、牛源化、猪源化等抗体,以及它们的变体。
78.在一些实施方案中,抗cd47剂在结合时不活化cd47。
79.当cd47被活化时,可能发生类似于细胞凋亡(即,程序性细胞死亡)的过程(manna和frazier,cancer research,64,1026-1036,2004年2月1日)。因此,在一些实施方案中,抗cd47剂不直接诱导表达cd47的细胞的细胞死亡。
80.一些病原体(例如痘病毒、粘液瘤病毒、deerpox病毒、猪痘病毒、山羊痘病毒、绵羊痘病毒等)表达cd47类似物(即cd47模拟物)(例如m128l蛋白),其作为毒力因子发挥作用以使得能够感染(cameron等人,virology.2005年6月20日;337(1):55-67),并且一些病原体诱导宿主细胞中内源性cd47的表达。因此,用表达cd47类似物的病原体感染的细胞可以单独地表达或者与内源性cd47组合表达病原体提供的cd47类似物。这种机制在增加或不增加内源性cd47的水平的情况下,允许病原体增加受感染细胞中的cd47表达(经由表达cd47类似物)。在一些实施方案中,抗cd47剂(例如,抗cd47抗体、sirpα试剂、sirpα抗体、可溶性cd47多肽等)可以减少cd47类似物(即cd47模拟物)与sirpα的结合。在一些情况下,合适的抗cd47剂(例如,sirpα试剂、抗cd47抗体等)可以结合cd47类似物(即cd47模拟物),以减少该cd47类似物与sirpα的结合。在一些情况下,合适的抗cd47剂(例如,抗sirpα抗体、可溶性cd47多肽等)可以结合到sirpα。结合sirpα的合适的抗cd47剂不活化sirpα(例如,在表达sirpα的吞噬细胞中)。当病原体是提供cd47类似物的病原体时,可以在本文所提供的任何方法中使用抗cd47剂。换句话讲,如本文所用的术语“cd47”涵盖cd47以及cd47类似物(即,cd47模拟物)。
81.sirpα试剂包含sirpα的足以以可识别的亲和力结合cd47的部分(该部分通常位于信号序列与跨膜结构域之间),或其保留结合活性的片段。合适的sirpα试剂减弱(例如,阻断、阻止等)天然蛋白sirpα与cd47之间的相互作用。sirpα试剂通常将包含至少sirpα的d1结构域。在一些实施方案中,sirpα试剂是融合蛋白,例如与第二多肽框内融合的融合蛋白。在一些实施方案中,第二多肽能够增加该融合蛋白的大小,例如,使得该融合蛋白将不会从循环中迅速清除。在一些实施方案中,第二多肽是免疫球蛋白fc区的部分或全部。fc区通过提供“吃我”信号来辅助吞噬作用,这增强了对由高亲和力sirpα试剂提供的“别吃我”信号的阻断。在其他实施方案中,第二多肽是基本上类似于fc的任何合适的多肽,例如,提供增加的大小、多聚化结构域和/或与ig分子的附加结合或相互作用。
82.在一些实施方案中,主题抗cd47剂是“高亲和力sirpα试剂”,其包括sirpα衍生的多肽及其类似物。高亲和力sirpα试剂描述于国际申请pct/us13/21937和wo2013109752a1中,这两份国际申请中的每一者据此以引用方式明确地并入本文。高亲和力sirpα试剂是天然sirpα蛋白的变体。在一些实施方案中,高亲和力sirpα试剂是可溶的,其中该多肽缺少sirpα跨膜结构域并且包含相对于野生型sirpα序列的至少一个氨基酸改变,并且其中该氨基酸改变例如通过将解离速率降低到至多1/10、至多1/20、至多1/50、至多1/100、至多1/500或更少来增加sirpα多肽与cd47结合的亲和力。
83.高亲和力sirpα试剂包含sirpα的足以以可识别的亲和力(例如高亲和力)结合
cd47的部分(该部分通常位于信号序列与跨膜结构域之间),或其保留结合活性的片段。高亲和力sirpα试剂通常将至少包含sirpα的d1结构域,其具有经修饰的氨基酸残基以增加亲和力。在一些实施方案中,本发明的sirpα变体是融合蛋白,例如,与第二多肽框内融合的融合蛋白。在一些实施方案中,第二多肽能够增加该融合蛋白的大小,例如,使得该融合蛋白将不会从循环中迅速清除。在一些实施方案中,第二多肽是免疫球蛋白fc区的部分或全部。提供增加的亲和力的氨基酸变化位于d1结构域中,因此高亲和力sirpα试剂包含人sirpα的d1结构域,其相对于d1结构域中的野生型序列具有至少一个氨基酸变化。此类高亲和力sirpα试剂任选地包含:附加的氨基酸序列,例如抗体fc序列;野生型人sirpα蛋白的除d1结构域以外的部分(包括但不限于天然蛋白质的残基150至374或其片段)通常是与d1结构域邻接的片段;等等。高亲和力sirpα试剂可以是单体或多聚体,即二聚体、三聚体、四聚体等。
84.在一些实施方案中,主题抗cd47剂是以下抗体:其特异性地结合sirpα(即,抗sirpα抗体)并且减弱一个细胞(例如,受感染细胞)上的cd47与另一个细胞(例如,吞噬细胞)上的sirpα之间的相互作用。合适的抗sirpα抗体可以结合sirpα,而不活化或刺激通过sirpα的信号传导,因为sirpα的活化将抑制吞噬作用。相反,合适的抗sirpα抗体有利于患病细胞相对于正常细胞被优先吞噬。相对于其他细胞(未受感染细胞)表达较高水平的cd47的那些细胞(例如,受感染细胞)将被优先吞噬。因此,合适的抗sirpα抗体特异性地结合sirpα(而不活化/刺激足够的信号传导应答以抑制吞噬作用)并且阻断sirpα与cd47之间的相互作用。合适的抗sirpα抗体包括此类抗体的完全人、人源化或嵌合型式。人源化抗体由于其抗原性低而特别适用于人的体内应用。类似地,犬源化、猫源化等抗体分别特别适用于狗、猫和其他物种中的应用。感兴趣的抗体包括人源化抗体,或犬源化、猫源化、马源化、牛源化、猪源化等抗体,以及它们的变体。
85.如本文所用,“抗体”包括提到能与特定抗原(例如cd47)发生免疫反应的基于免疫球蛋白的分子,并且包括多克隆抗体和单克隆抗体两者。该术语还包括基因工程化形式,诸如嵌合抗体(例如人源化鼠抗体)和异源缀合物抗体。术语“抗体”还包括抗体的抗原结合形式,包括具有抗原结合能力的片段(例如,fab'、f(ab')2、fab、fv和rigg)。该术语还指重组单链fv片段(scfv)。术语“抗体”还包括二价或双特异性分子、双体抗体、三体抗体和四体抗体。术语“抗体”的附加说明见下文。
86.如本文所用,“抗cd47抗体”是指减少cd47(例如,靶细胞上的)与cd47配体诸如sirpα(例如,吞噬细胞上的)的结合的任何抗体。非限制性示例在下文中更详细地描述,并且包括但不限于hu5f9-g4。在一些实施方案中,主题抗cd47剂是以下抗体:其特异性地结合cd47(即,抗cd47抗体)并且减弱一个细胞(例如,受感染细胞)上的cd47与另一个细胞(例如,吞噬细胞)上的sirpα之间的相互作用。在一些实施方案中,合适的抗cd47抗体在结合时不活化cd47。合适抗体的非限制性示例包括克隆b6h12、5f9、8b6和c3(例如,如国际专利公布wo2011/143624中所述,该专利公布以引用方式明确地并入本文)。合适的抗cd47抗体包括抗体的完全人源性、人源化或嵌合型式。人源化抗体(例如,hu5f9-g4)由于其抗原性低而特别适用于人的体内应用。类似地,犬源化、猫源化等抗体分别特别适用于狗、猫和其他物种中的应用。感兴趣的抗体包括人源化抗体,或犬源化、猫源化、马源化、牛源化、猪源化等抗体,以及它们的变体。
87.如本文所用,“hu5f9-g4”、“5f9”和“莫洛利单抗”可互换使用,并且是指可以如下
所述施用于受试者、个体或患者以治疗血癌的抗cd47抗体的示例。
88.用于本发明目的的“患者”既包括人,也包括其他动物,特别是哺乳动物,包括宠物和实验动物,例如小鼠、大鼠、兔子等。因此,所述方法既适用于人类疗法,也适用于兽医应用。在一个实施方案中,患者是哺乳动物,优选地是灵长类动物。在其他实施方案中,患者是人。
89.术语“受试者”、“个体”和“患者”在本文中可互换使用,以指代正在评估治疗和/或正在治疗的哺乳动物。在一个实施方案中,哺乳动物是人。术语“受试者”、“个体”和“患者”涵盖但不限于患有癌症的个体。受试者可以是人,但也包括其他哺乳动物,特别是可用作人类疾病的实验室模型的那些哺乳动物,例如小鼠、大鼠等。
90.关于患者的术语“样品”涵盖血液和生物性来源的其他液体样品、固体组织样品(诸如活检标本或组织培养物)或者由其衍生的细胞及其后代。该定义还包括在获取后已经以任何方式操作的样品,所述方式诸如:用试剂处理;洗涤;或富集某些细胞群,诸如癌细胞。该定义还包括已经富集了特定类型的分子(例如,核酸、多肽等)的样品。术语“生物样品”涵盖临床样品,并且还包括通过手术切除获得的组织、通过活检获得的组织、培养中的细胞、细胞上层清液、细胞裂解物、组织样品、器官、骨髓、血液、血浆、血清等。“生物样品”包括从患者的癌细胞获得的样品,例如,包含从患者的癌细胞获得的多核苷酸和/或多肽的样品(例如,包含多核苷酸和/或多肽的细胞裂解物或其他细胞提取物);以及包含来自患者的癌细胞的样品。包含来自患者的癌细胞的生物样品还可以包含非癌性细胞。
91.术语“诊断”在本文中用于指代鉴定分子或病理状态、疾病或病症,诸如鉴定乳腺癌、前列腺癌或其他类型癌症的分子亚型。
92.术语“预后”在本文中用于指代预测肿瘤性疾病(诸如淋巴瘤)的可归因于癌症的死亡或进展(包括复发、转移性扩散和耐药性)的可能性。术语“预测”在本文中用于指基于观察、经验或科学推理来预言或估算的行为。在一个示例中,医师可以预测在手术移除原发性肿瘤和/或化疗一定时间段后患者将存活而无癌症复发的可能性。
93.如本文所用,术语“治疗”是指为了获得效果而施用药剂或执行某个规程。就实现疾病和/或疾病症状的部分或完全治愈而言,该效果可以是治疗性的。如本文所用,“治疗”可以包括治疗哺乳动物,特别是人类的肿瘤,并且包括但不限于:抑制该疾病,即阻止其发展;以及缓解该疾病,即引起该疾病消退。
94.治疗可以指癌症的治疗或改善中的任何成功标记,包括任何客观或主观参数,诸如减轻、缓解、减弱症状或使患者更耐受疾病病症;减缓退化或衰退的速率;或使退化终点的衰弱程度较轻。症状的治疗或改善可以基于客观或主观参数;包括医师检查的结果。术语“治疗效果”是指在受试者中减少、消除或预防疾病、疾病的症状或疾病的副作用。
95.在某些实施方案中,“与
…
组合”、“联合疗法”和“组合产品”是指同时向患者施用本文所述的药剂。当组合施用时,每种组分可以同时施用或在不同的时间点以任何顺序相继施用。因此,每种组分可以分开但在时间上足够接近地施用,以便提供期望的治疗效果。
96.在本文所公开的方法中“伴随施用”活性剂意味着在这些活性剂将同时具有治疗效果的时间施用这些活性剂。这种伴随施用可以涉及同时(即,在同一时间)、在先或随后施用所述活性剂。
97.如本文所用,术语“相关”或“与
…
相关”和类似术语是指两个事件的实例之间的统
计关联性,其中事件包括数字、数据集等。例如,当事件涉及数字时,正相关(在本文中也称为“直接相关”)意味着随着一者增加,另一者也增加。负相关(在本文中也称为“逆相关”)意味着随着一者增加,另一者减少。
[0098]“剂量单位”或“剂量”是指适合作为用于待治疗的特定个体的单元剂量的物理上离散的单位。每个单位可以含有与药用载剂联合的预定量的活性化合物,所述预定量经计算以产生期望的治疗效果。剂量单位形式的规格可以由以下项决定:(a)活性化合物的独特特征和要实现的特定治疗效果,和(b)配混这类活性化合物的领域中固有的限制。
[0099]“治疗有效量”意指当施用于受试者以治疗疾病时,足以实现对该疾病的治疗的量。
[0100]
抗体
[0101]
本文所述的方法包括施用一种或多种抗体,即施用抗cd47抗体,并且在一些实施方案中,施用附加抗体。抗体的选择可以基于多种标准,包括选择性、亲和力、细胞毒性等。当涉及蛋白质或肽时,短语“特异性地(或选择性地)结合”抗体或“特异性地(或选择性地)与
…
发生免疫反应”是指在蛋白质和其他生物制剂的异质群体中决定蛋白质存在的结合反应。因此,在指定的免疫测定条件下,特定的抗体与特定的蛋白质序列的结合是背景的至少两倍,并且更典型地是背景的10倍至100倍。一般来讲,本发明的抗体在效应细胞(诸如自然杀伤细胞或巨噬细胞)存在下结合靶细胞表面上的抗原。效应细胞上的fc受体识别结合的抗体。
[0102]
与特定抗原发生免疫反应的抗体可以通过重组方法(诸如在噬菌体或类似载体中选择重组抗体文库)或者通过用该抗原或用编码该抗原的dna对动物进行免疫来产生。制备多克隆抗体的方法是技术人员已知的。替代性地,所述抗体可以是单克隆抗体。单克隆抗体可以使用杂交瘤方法来制备。在杂交瘤方法中,适当的宿主动物通常用免疫剂免疫以诱发淋巴细胞,这些淋巴细胞产生或能够产生将与该免疫剂特异性结合的抗体。替代性地,可以在体外对所述淋巴细胞进行免疫。然后使用合适的融合剂(诸如聚乙二醇)将所述淋巴细胞与无限增殖化细胞系融合,以形成杂交瘤细胞。
[0103]
可以使用本领域已知的各种技术(包括噬菌体展示文库)来产生人类抗体。类似地,可以通过将人免疫球蛋白基因座引入转基因动物(例如其中内源性免疫球蛋白基因已经部分或完全失活的小鼠)中来制备人类抗体。在攻击后,观察到人类抗体产生,其在所有方面都与在人类中看到的非常相似,包括基因重排、装配和抗体组库。
[0104]
抗体还作为通过用各种肽酶消化产生的许多充分表征的片段存在。因此,胃蛋白酶在铰链区中的二硫键下方消化抗体以产生fab的二聚体f(ab)'2,fab本身是通过二硫键与v
h-c
h1
接合的轻链。f(ab)'2可以在温和条件下还原以使铰链区中的二硫键断裂,从而将f(ab)'2二聚体转化成fab’单体。该fab’单体实质上是具有铰链区的一部分的fab。虽然根据完整抗体的消化定义了各种抗体片段,但是本领域技术人员将会知道,此类片段可以通过化学方式或通过使用重组dna方法从头合成。因此,如本文所用的术语“抗体”还包括通过修饰完整抗体产生的抗体片段,或者使用重组dna方法(例如单链fv)从头合成的抗体片段,或者使用噬菌体展示文库鉴定的抗体片段。
[0105]“人源化抗体”是含有来源于非人免疫球蛋白的最小序列的免疫球蛋白分子。人源化抗体包括人免疫球蛋白(受体抗体),其中来自该受体的互补决定区(cdr)的残基被来自
非人物种(供体抗体)诸如小鼠、大鼠或兔子的cdr的具有所需特异性、亲和力和能力的残基替代。在一些情况下,人免疫球蛋白的fv框架残基被对应的非人残基替代。人源化抗体还可以包含既不存在于受体抗体中也不存在于输入的cdr或框架序列中的残基。一般来讲,人源化抗体将包含至少一个、通常两个可变结构域的基本上全部,其中全部或基本上全部的cdr区对应于非人免疫球蛋白的cdr区,并且全部或基本上全部的框架(fr)区是人免疫球蛋白共有序列的框架区。人源化抗体最佳地还将包含免疫球蛋白恒定区(fc)(通常是人免疫球蛋白的恒定区)的至少一部分。
[0106]
可以测试感兴趣抗体诱导adcc(抗体依赖性细胞毒性)、adcp(抗体依赖性细胞吞噬作用)或补体依赖性细胞毒性(cdc)的能力。抗体相关的adcc活性可以通过检测标记或乳酸脱氢酶从裂解细胞的释放或者检测降低的靶细胞活力(例如,膜联蛋白测定)来监测和定量。细胞凋亡测定可以通过末端脱氧核苷酸转移酶介导的地高辛-11-dutp切口末端标记(tunel)测定(lazebnik等人,nature:371,346(1994))来进行。细胞毒性也可以通过本领域中已知的检测试剂盒(诸如来自roche applied science(indianapolis,ind.)的细胞毒性检测试剂盒)直接检测。
[0107]
在一些实施方案中,定向抗体的fc区或fc结构域包含促进抗结合分子的血清半衰期延长的氨基酸修饰。已经描述了增加抗体的半衰期的突变。在一个实施方案中,cd3靶向重链和hiv抗原靶向重链中的一者或两者的fc区或fc结构域包含位置252(eu编号)处的甲硫氨酸至酪氨酸置换、位置254(eu编号)处的丝氨酸至苏氨酸置换以及位置256(eu编号)处的苏氨酸至谷氨酸置换。参见例如美国专利号7,658,921。这种类型的突变体(命名为“yte突变体”)相对于相同抗体的野生型型式表现出四倍增加的半衰期(dall’acqua等人,j biol chem,281:23514-24(2006);robbie等人,antimicrob agents chemotherap.,57(12):6147-6153(2013))。在某些实施方案中,cd3靶向重链和hiv抗原靶向重链中的一者或两者的fc区或fc结构域包含igg恒定结构域,该igg恒定结构域包含位置251-257、285-290、308-314、385-389和428-436(eu编号)处的氨基酸残基的一个、两个、三个或更多个氨基酸置换。另选地,m428l和n434s(“ls”)置换可以增加多特异性抗原结合分子的药代动力学半衰期。在其他实施方案中,cd3靶向重链和hiv抗原靶向重链中的一者或两者的fc区或fc结构域包含m428l和n434s置换(eu编号)。在其他实施方案中,cd3靶向重链和hiv抗原靶向重链中的一者或两者的fc区或fc结构域包含t250q和m428l(eu编号)突变。在其他实施方案中,cd3靶向重链和hiv抗原靶向重链中的一者或两者的fc区或fc结构域包含h433k和n434f(eu编号)突变。
[0108]
在一些实施方案中,该抗体的fc区或fc结构域包含增加效应子活性(例如,具有改善的fcγiiia结合和增加的抗体依赖性细胞毒性(adcc))的翻译后修饰和/或氨基酸修饰。在一些实施方案中,该抗体的fc区或fc结构域在fc区中包含de修饰(即,按eu编号的s239d和i332e)。在一些实施方案中,该抗体的fc区或fc结构域在fc区中包含del修饰(即,按eu编号的s239d、i332e和a330l)。在一些实施方案中,该抗体的fc区或fc结构域在fc区中包含dea修饰(即,按eu编号的s239d、i332e和g236a)。在一些实施方案中,该抗体的fc区或fc结构域在fc区中包含deal修饰(即,按eu编号的s239d、i332e、g236a和a330l)。参见例如美国专利号7,317,091、7,662,925、8,039,592、8,093,357、8,093,359、8,383,109、8,388,955、8,735,545、8,858,937、8,937,158、9,040,041、9,353,187、10,184,000和10,584,176。增加
效应子活性(例如,具有改善的fcγiiia结合和增加的抗体依赖性细胞毒性(adcc))的附加氨基酸修饰包括但不限于(eu编号)第一fc结构域上的f243l/r292p/y300l/v305i/p396l;s298a/e333a/k334a;或l234y/l235q/g236w/s239m/h268d/d270e/s298a以及第二fc结构域上的d270e/k326d/a330m/k334e。增加c1q结合和补体依赖性细胞毒性(cdc)的氨基酸突变包括但不限于(eu编号)s267e/h268f/s324t或k326w/e333s。增强效应子活性的fc区突变综述于例如wang等人,protein cell(2018)9(1):63
–
73;和saunders,front immunol.(2019)10:1296中。
[0109]
在其他实施方案中,该抗体或其抗原结合片段具有经修饰的糖基化,其例如可以在翻译后引入或通过基因工程引入。在一些实施方案中,该抗体或其抗原结合片段例如在该抗体或其抗原结合片段中存在的糖基化位点处被无岩藻糖基化。大多数批准的单克隆抗体具有igg1同种型,其中两个n连接的双分枝复合物型低聚糖结合到fc区。fc区通过其与fcγr家族的白细胞受体的相互作用来发挥adcc的效应子功能。非岩藻糖基化单克隆抗体是工程化以使得抗体的fc区中的寡糖不具有任何岩藻糖单位的单克隆抗体。
[0110]
抗cd47剂
[0111]
本文所述的方法包括施用治疗剂,诸如抗cd47剂。在一些实施方案中,抗cd47剂是抗cd47抗体。
[0112]
cd47是广泛表达的具有单个ig样结构域和五个跨膜区的跨膜糖蛋白,其作为sirpα的细胞配体通过sirpα的nh2末端v样结构域介导的结合起作用。sirpα主要在骨髓细胞上表达,该骨髓细胞包括巨噬细胞、粒细胞、骨髓树突状细胞(dc)、肥大细胞及其前体,包括造血干细胞。sirpα上介导cd47结合的结构决定簇由以下文献论述:lee等人,(2007)j.immunol.179:7741-7750;hatherley等人,(2008)mol cell.31(2):266-77;hatherley等人,(2007)j.b.c.282:14567-75;并且sirpα顺式二聚反应在cd47结合中的作用由lee等人,(2010)j.b.c.285:37953-63论述。与cd47抑制正常细胞吞噬功能的作用一致,有证据表明造血干细胞(hsc)和祖细胞在它们的迁移阶段即将开始之前和期间被瞬时上调,并且这些细胞上的cd47水平决定了它们在体内被吞噬的概率。
[0113]
在一些实施方案中,抗cd47抗体包含人igg fc区,例如igg1、igg2a、igg2b、igg3、igg4恒定区。在一个实施方案中,igg fc区是igg4恒定区。igg4铰链可以由氨基酸置换s241p稳定(参见angal等人,(1993)mol.immunol.30(1):105-108,该文献以引用方式明确地并入本文)。
[0114]
在一些实施方案中,抗cd47抗体与hu5f9-g4竞争结合cd47。在一些实施方案中,抗cd47与hu5f9-g4结合相同的cd47表位。
[0115]
在一些实施方案中,抗体以小于或等于约1
×
10^-9m、1
×
10^-9m至6
×
10^-9m、1
×
10^-9m至5
×
10^-9m、1
×
10^-9m至4
×
10^-9m、1
×
10^-9m至3
×
10^-9m、2
×
10^-9m、3
×
10^-9m、4
×
10^-9m、5
×
10^-9m、6
×
10^-9m、7
×
10^-9m、8
×
10^-9m、9
×
10^-9m或10
×
10^-9m的kd结合人cd47,如通过biacore测定所测量的。
[0116]
在一些实施方案中,抗cd47抗体以每kg体重10mg至30mg、20mg至30mg、10mg、20mg或30mg抗体的剂量施用。
[0117]
在一些实施方案中,抗cd47抗体导致大于或等于90%的受体饱和度,任选地90%至100%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的受体饱和度,
任选地其中受体饱和度使用流式细胞术或等效测定进行测量。
[0118]
抗cd47抗体可以与药学上可接受的赋形剂一起配制在药物组合物中。
[0119]
抗cd47抗体可以静脉内施用。
[0120]
抗cd47剂可以包括sirpα剂,其包含sirpα或其一部分。例如,抗cd47剂可以包括基于sirpα的fc融合体。参见例如,kipp weiskopf等人,science 341,88(2013),其以引用方式并入本文。
[0121]
抗cd47剂可以包括wo2014094122中所公开的sirpα剂,该专利全文以引用方式并入本文,以用于所有目的。例如,sirpα剂可以包括如wo2014094122中所公开的序列seq id no:3、25或26;这些序列中的每一者以引用方式并入本文。
[0122]
抗cd47剂可以包括wo2017177333中所公开的sirpα剂,该专利全文以引用方式并入本文,以用于所有目的。例如,sirpα剂可以包括如wo2017177333中所公开的序列seq id no:3或8;这些序列中的每一者以引用方式并入本文。
[0123]
抗cd47剂可以包括wo2016023040中所公开的sirpα剂,该专利全文以引用方式并入本文,以用于所有目的。例如,sirpα剂可以包括如wo2016023040中所公开的序列seq id no:78-85、98-104、107-113、116-122、135-137或152-159;这些序列中的每一者以引用方式并入本文。
[0124]
抗cd47剂可以包括wo2017027422中所公开的sirpα剂,该专利全文以引用方式并入本文,以用于所有目的。例如,sirpα剂可以包括如wo2017027422中所公开的序列seq id no:3-34;这些序列中的每一者以引用方式并入本文。
[0125]
附加的抗cd47剂包括但不限于抗cd47 mab(vx-1004)、抗人cd47 mab(cnto-7108)、cc-90002、cc-90002-st-001、人源化抗cd47抗体(hu5f9-g4;莫洛利单抗)、ni-1701、ni-1801、rct-1938、alx-148、tti-621、rrx-001、dsp-107、vt-1021、tti-621、tti-622、imm-02、来佐利单抗和sgn-cd47m。
[0126]
在一些实施方案中,抗cd47剂包括双特异性抗体。在一些实施方案中,抗cd47剂包括双特异性抗cd47抗体。靶向cd47的双特异性抗体的示例包括但不限于:ibi-322(cd47/pd-l1)、imm-0306(cd47/cd20)、tj-l1c4(cd47/pd-l1)、hx-009(cd47/pd-1)、pmc-122(cd47/pd-l1)、pt-217(cd47/dll3)、imm-26011(cd47/flt3)、imm-0207(cd47/vegf)、imm-2902(cd47/her2)、bh29xx(cd47/pd-l1)、imm-0306(cd47/cd20)、imm-2502(cd47/pd-l1)、hmbd-004b(cd47/bcma)、hmbd-004a(cd47/cd33)。附加的单特异性和双特异性抗cd47抗体包括但不限于:ibi-188、tjc-4、shr-1603、hlx-24、lq-001、imc-002、zl-1201、imm-01、b6h12、gensci-059、tay-018、pt-240、1f8-gmcsf、sy-102和kd-015。
[0127]
cd47抗体
[0128]
在一些实施方案中,本文所述的方法包括施用抗cd47抗体hu5f9-g4。在一些实施方案中,本文所述的方法包括施用具有以下序列(轻链、重链、可变轻链结构域、可变重链结构域和/或cdr)的抗cd47抗体:所述序列与hu5f9-g4的序列具有至少97%、至少98%、至少99%或100%的同一性。表1包含:hu5f9-g4抗体重链和轻链的序列(分别为seq id no:50和51);根据kabat cdr定义的vh cdr和vl cdr(seq id no:52-57和146);根据imgt cdr定义的vh cdr和vl cdr(seq id no:147-152);根据chothia cdr定义的vh cdr和vl cdr(seq id no:153-158);根据honegger cdr定义的vh cdr和vl cdr(seq id no:159-164);以及可
变重链序列和轻链序列(seq id no:144和145)。另外的合适的抗cd47抗体包括克隆b6h12、5f9、8b6、c3和huc3(例如,如国际专利公布wo2011143624中所述,该专利公布以引用方式明确地并入本文)。5f9可变重链结构域以seq id no:58提供,并且5f9可变轻链结构域以seq id no:59提供。hub6h12可变重链结构域以seq id no:60提供,并且hub6h12可变轻链结构域以seq id no:61提供。8b6可变重链结构域以seq id no:62提供,并且hub6h12可变轻链结构域以seq id no:63提供。c3可变重链结构域以seq id no:64提供,并且c3可变轻链结构域以seq id no:65提供。huc3可变重链结构域以seq id no:66和67提供,并且huc3可变轻链结构域以seq id no:68和69提供。抗cd47抗体可以包含:重链序列seq id no:50和轻链序列seq id no:51。抗cd47抗体可以包含:vh序列seq id no:58和vl序列seq id no:59。抗cd47抗体可以包含:vh序列seq id no:60和vl序列seq id no:61。抗cd47抗体可以包含:vh序列seq id no:62和vl序列seq id no:63。抗cd47抗体可以包含:vh序列seq id no:64和vl序列seq id no:65。抗cd47抗体可以包含:vh序列seq id no:66或67和vl序列seq id no:68或69。
[0129]
抗cd47抗体重链可变区作为seq id no:5-30并且抗cd47抗体轻链可变区作为seq id no:31-47公开于2014年5月22日公布的美国专利公布us 20140140989和2013年8月15日公布的国际专利公布wo2013119714中,这两份专利公布均全文以引用方式并入本文。合适的抗cd47可变重链结构域以seq id no:70-95提供,并且抗cd47可变轻链结构域以seq id no:96-112提供。抗cd47抗体可以包含vh序列seq id no:70-95。抗cd47抗体可以包含vl序列seq id no:96-112。抗cd47抗体可以包含vh序列seq id no:70-95和vl序列seq id no:96-112。
[0130]
抗cd47抗体可以包含vh序列seq id no:113-115。抗cd47抗体可以包含vl序列seq id no:116-118。抗cd47抗体可以包含vh序列seq id no:113-115和vl序列seq id no:116-118。
[0131]
表1.
[0132]
[0133][0134]
附加的cd47抗体描述于以下专利中:wo199727873、wo199940940、wo2002092784、wo2005044857、wo2009046541、wo2010070047、wo2011143624、wo2012170250、wo2013109752、wo2013119714、wo2014087248、wo2015191861、wo2016022971、wo2016023040、wo2016024021、wo2016081423、wo2016109415、wo2016141328、wo2016188449、wo2017027422、wo2017049251、wo2017053423、wo2017121771、wo2017194634、wo2017196793、wo2017215585、wo2018075857、wo2018075960、wo2018089508、wo2018095428、wo2018137705、wo2018233575、wo2019027903、wo2019034895、wo2019042119、wo2019042285、wo2019042470、wo2019086573、wo2019108733、wo2019138367、wo2019144895、wo2019157843、wo2019179366、wo2019184912、wo2019185717、wo2019201236、wo2019238012、wo2019241732、wo2020019135、wo2020036977、wo2020043188和wo2020009725,这些专利中的每一者全文以引用方式并入本文。
[0135]
抗sirpα剂
[0136]
本文所述的方法包括施用抗sirpα剂。
[0137]
在一些实施方案中,抗sirpα剂是sirpα抑制剂。此类抑制剂包括但不限于al-008、rrx-001和ctx-5861。
[0138]
在一些实施方案中,抗sirpα剂是抗sirpα抗体。此类抗体包括但不限于fsi-189、es-004、bi765063、adu1805和cc-95251。
[0139]
在一些实施方案中,抗sirpα剂是特异性地结合sirpα的抗sirpα抗体。在一些方面,sirpα是人sirpα。
[0140]
在一些实施方案中,本文所提供的抗sirpα抗体特异性地结合sirpα的细胞外结构域。sirpα可以在任何合适的靶细胞的表面上表达。在一些实施方案中,靶细胞是专职性抗原递呈细胞。在一些实施方案中,靶细胞是巨噬细胞。抗体对于人sirpα同种型可以是泛特异性的。抗体对于人sirpα同种型可以具有特异性。
[0141]
在某些实施方案中,抗体是1h9。在某些实施方案中,抗体是3c2。
[0142]
在一些实施方案中,本文所提供的抗体抑制sirpα与sirpα的一种或多种配体的结合。
[0143]
在某些方面,抗体不与sirpγ结合。在某些方面,抗体基本上不与sirpγ结合。
[0144]
在一些实施方案中,本文所提供的抗体片段与1h9和/或3c2竞争结合sirpα。在一些实施方案中,本文所提供的抗体的片段与这种抗体结合sirpα的相同表位。
[0145]
在一些方面,本文所公开的抗体对于人sirpα同种型是泛特异性的。本文所公开的抗体(诸如1h9)可以结合多种人类sirpα同种型,包括v1、v2和v1/v5中的一者或多者。示例性v1序列以seq id no:48示出。示例性v2序列以seq id no:49示出。还可参见polymorphism in sirpa modulates engraftment of human hematopoietic stem cells.nature immunology,8;1313,2007。本文所公开的抗体可以结合人sirpα同种型v1和v2中的每一者。本文所公开的抗体可以结合人sirpα同种型v1(包括纯合的)。本文所公开的抗体可以结合人sirpα同种型v2(包括纯合的)。本文所公开的抗体可以结合人sirpα同种型v1/v5(杂合的)。本文所公开的抗体(诸如1h9)可以结合多种人sirpα同种型,包括v1、v2和v1/v5中的每一者。此类抗体可以包括1h9和3c2,包括此类抗体的人源化和/或fc工程化型式。1h9可以结合人sirpα同种型v1和v2中的每一者。1h9可以结合人sirpα同种型v1(包括纯合的)。1h9可以结合人sirpα同种型v2(包括纯合的)。1h9可以结合人sirpα同种型v1/v5(杂合的)。1h9可以结合多种人sirpα同种型,包括v1、v2和v1/v5中的每一者。与人sirpα变体的结合可以使用本领域中已知的测定(包括pcr和/或流式细胞术)来测量。例如,可以对给定样品进行基因分型以确定sirp状态,并且可以使用流式细胞术确定与sirp的结合。
[0146]
在某些方面,抗体与选自1h9和3c2的抗体竞争结合人sirpα。在某些方面,抗体结合与1h9或3c2所结合的人sirpα表位相同的人sirpα表位。在某些方面,抗体结合与1h9或3c2所结合的人sirpα表位重叠的人sirpα表位。在某些方面,抗体结合与1h9或3c2所结合的人sirpα表位不同的人sirpα表位。
[0147]
在某些方面,抗体不与kwar抗体竞争结合人sirpα。
[0148]
在某些方面,抗体与kwar抗体部分地竞争结合人sirpα。
[0149]
在某些方面,抗体抑制人cd47与人sirpα的结合。
[0150]
在某些方面,抗体抑制人sp-a与人sirpα的结合。
[0151]
在某些方面,抗体抑制人sp-d与人sirpα的结合。
[0152]
在某些方面,抗体与恒河猴sirpα结合。
[0153]
在某些方面,抗体与食蟹猴sirpα结合。
[0154]
在一些实施方案中,sirpα抗体是与本文所提供的说明性抗体(例如,1h9和/或3c2)竞争的抗体。在一些方面,与本文所提供的说明性抗体竞争的抗体与本文所提供的说明性抗体结合相同的表位。
[0155]
在一些实施方案中,主题抗cd47剂是高亲和力sirpα试剂,其包括sirpα衍生的多
肽及其类似物。
[0156]
附加的抗sirpα剂、抑制剂和抗体描述于以下专利中:wo200140307、wo2002092784、wo2007133811、wo2009046541、wo2010083253、wo2011076781、wo2013056352、wo2015138600、wo2016179399、wo2016205042、wo2017178653、wo2018026600、wo2018057669、wo2018107058、wo2018190719、wo2018210793、wo2019023347、wo2019042470、wo2019175218、wo2019183266、wo2020013170和wo2020068752,这些专利中的每一者全文以引用方式并入本文。
[0157]
sirpα抗体
[0158]
在一些实施方案中,抗体以小于或等于约1、1-6、1-5、1-4、1-3、2、3、4、5、6、7、8、9或10
×
10-9
m的kd结合人sirpα,如通过biacore测定所测量的。
[0159]
抗体可以包含:cdr-h1,其具有以seq id no:1示出的序列;cdr-h2,其具有以seq id no:2示出的序列;cdr-h3,其具有以seq id no:3示出的序列;cdr-l1,其具有以seq id no:4示出的序列;cdr-l2,其具有以seq id no:5示出的序列;和cdr-l3,其具有以seq id no:6示出的序列。
[0160]
抗体可以包含:vh序列seq id no:7和vl序列seq id no:8。
[0161]
抗体可以包含:重链seq id no:17和轻链seq id no:18。
[0162]
抗体可以包含:cdr-h1,其具有以seq id no:9示出的序列;cdr-h2,其具有以seq id no:10示出的序列;cdr-h3,其具有以seq id no:11示出的序列;cdr-l1,其具有以seq id no:12示出的序列;cdr-l2,其具有以seq id no:13示出的序列;和cdr-l3,其具有以seq id no:14示出的序列。
[0163]
抗体可以包含:vh序列seq id no:15和vl序列seq id no:16。
[0164]
抗体可以包含:重链seq id no:19和轻链seq id no:20。
[0165]
抗体可以包含:cdr-h1,其具有以seq id no:21示出的序列;cdr-h2,其具有以seq id no:22示出的序列;cdr-h3,其具有以seq id no:23示出的序列;cdr-l1,其具有以seq id no:24示出的序列;cdr-l2,其具有以seq id no:25示出的序列;和cdr-l3,其具有以seq id no:26示出的序列。
[0166]
抗体可以包含:vh序列seq id no:27和vl序列seq id no:28。
[0167]
抗体可以包含:cdr-h1,其具有以seq id no:29示出的序列;cdr-h2,其具有以seq id no:30示出的序列;cdr-h3,其具有以seq id no:31示出的序列;cdr-l1,其具有以seq id no:32示出的序列;cdr-l2,其具有以seq id no:33示出的序列;和cdr-l3,其具有以seq id no:34示出的序列。
[0168]
抗体可以包含:vh序列seq id no:35和vl序列seq id no:36。
[0169]
在某些方面,抗体可以包含1h9的一个或多个cdr。在某些方面,抗体可以包含1h9的所有cdr。在某些方面,抗体可以包含1h9的一个或多个可变序列。在某些方面,抗体可以包含1h9的每个可变序列。在某些方面,抗体可以包含1h9的重链。在某些方面,抗体可以包含1h9的轻链。在某些方面,抗体可以包含1h9的重链和轻链。在某些方面,抗体是1h9。
[0170]
在某些方面,抗体可以包含3c2的一个或多个cdr。在某些方面,抗体可以包含3c2的所有cdr。在某些方面,抗体可以包含3c2的一个或多个可变序列。在某些方面,抗体可以包含3c2的每个可变序列。在某些方面,抗体可以包含3c2的重链。在某些方面,抗体可以包
含3c2的轻链。在某些方面,抗体可以包含3c2的重链和轻链。在某些方面,抗体是3c2。
[0171]
在某些方面,抗体可以包含9b11的一个或多个cdr。在某些方面,抗体可以包含9b11的所有cdr。在某些方面,抗体可以包含9b11的一个或多个可变序列。在某些方面,抗体可以包含9b11的每个可变序列。在某些方面,抗体可以包含9b11的重链。在某些方面,抗体可以包含9b11的轻链。在某些方面,抗体可以包含9b11的重链和轻链。在某些方面,抗体是9b11。
[0172]
在某些方面,抗体可以包含7e11的一个或多个cdr。在某些方面,抗体可以包含7e11的所有cdr。在某些方面,抗体可以包含7e11的一个或多个可变序列。在某些方面,抗体可以包含7e11的每个可变序列。在某些方面,抗体可以包含7e11的重链。在某些方面,抗体可以包含7e11的轻链。在某些方面,抗体可以包含7e11的重链和轻链。在某些方面,抗体是7e11。
[0173]
抗sirpα抗体重链可变结构域还作为seq id no:119-125提供。抗sirpα抗体轻链可变结构域还作为seq id no:126-128提供。抗sirpα抗体重链可变区作为seq id no:24、25、26、27、28、29和30并且抗sirpα抗体轻链可变区作为seq id no:31、32和33公开于2019年5月5日公布的美国专利公布us 20190127477中,该专利公布全文以引用方式并入本文。
[0174]
抗sirpα抗体重链可变区作为seq id no:7、10、14、16、18、30、75、78、80、82、84、86和88并且抗sirpα抗体轻链可变区作为seq id no:8、20、22、24、26、28、32、76、90、92、94、96、98、100和104公开于2018年11月1日公布的美国专利公布us 20180312587中,该专利公布全文以引用方式并入本文。
[0175]
抗sirpα抗体重链可变区作为seq id no:26、81、83并且抗sirpα抗体轻链可变区作为seq id no:25、39-41公开于2019年9月26日公布的国际专利公布wo2019183266a1中,该专利公布全文以引用方式并入本文。
[0176]
在一些实施方案中,本文所提供的抗体包含与以seq id no:1-36提供的说明性序列具有至少约50%、60%、70%、80%、90%、95%或99%同一性的序列。在一些实施方案中,本文所提供的抗体包含以seq id no:1-36提供的序列,该序列具有最多1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个或25个氨基酸置换。在一些方面,氨基酸置换是保守氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中被称为“变体”。在一些实施方案中,此类变体是从本文所提供的序列衍生的,例如通过亲和力成熟、定点诱变、随机诱变,或者本领域中已知或本文所述的任何其他方法。在一些实施方案中,此类变体不是从本文所提供的序列衍生的,并且可以例如根据本文所提供的用于获得抗体的方法从头分离。
[0177]
抗cd20抗体
[0178]
本文所述的方法包括施用抗cd20抗体。在一些实施方案中,抗cd20抗体与如本文所述的抗cd47抗体或抗sirpα剂协同施用。可以共同施用的抗cd20剂或抗体的示例包括但不限于:ign-002、pf-05280586;利妥昔单抗(rituxan/biogen idec)、奥法木单抗(arzerra/genmab)、奥滨尤妥珠单抗(gazyva/roche glycart biotech)、阿仑单抗、维妥珠单抗、immu-106(immunomedics)、奥美珠单抗(ocrevus/biogen idec;genentech)、奥卡妥珠单抗、ly2469298(applied molecular evolution)和乌布妥昔单抗、lfb-r603(lfb biotech.;revo biologics)、ign-002、pf-05280586。
[0179]
抗cd20抗体可以与利妥昔单抗竞争结合cd20。
[0180]
抗cd20抗体可以与利妥昔单抗结合相同的cd20表位。利妥昔单抗结合cd20上的氨基酸170-173和182-185。参见binder等人,the epitope recognized by rituximab.blood(2006)108(6):1975-1978。
[0181]
抗cd20抗体可以包括利妥昔单抗,或者由利妥昔单抗组成。
[0182]
抗cd20抗体可以与以下项竞争结合cd20:奥滨尤妥珠单抗、奥法木单抗、奥美珠单抗、维妥珠单抗、奥卡妥珠单抗、替伊莫单抗、托西莫单抗、碘131托西莫单抗、利妥昔单抗生物仿制药(blitzima、ritemvia、tuxella),或乌布妥昔单抗。
[0183]
抗cd20抗体可以与以下项结合相同的cd20表位:奥滨尤妥珠单抗、奥法木单抗、奥美珠单抗、维妥珠单抗、奥卡妥珠单抗、替伊莫单抗、托西莫单抗、碘131托西莫单抗、利妥昔单抗生物仿制药(blitzima、ritemvia、tuxella),或乌布妥昔单抗。
[0184]
抗cd20抗体可以包括以下项或由以下项组成:奥滨尤妥珠单抗、奥法木单抗、奥美珠单抗、维妥珠单抗、奥卡妥珠单抗、替伊莫单抗、托西莫单抗、碘131托西莫单抗、利妥昔单抗生物仿制药(blitzima、ritemvia、tuxella),或乌布妥昔单抗。
[0185]
抗cd20抗体可以包含fc,诸如活性fc或野生型fc。抗cd20抗体可以包含能够引起adcc、adcp和cdc中的至少一者的fc。抗cd20抗体包含以下fc:该fc包含一种或多种导致adcc、adcp和/或cdc活性相对于野生型fc增加的修饰。示例性fc突变在下表2中示出。
[0186]
表2
[0187][0188][0189]
抗cd20抗体相对于以下项可以具有对cd20更高的结合亲和力:利妥昔单抗、奥滨尤妥珠单抗、奥法木单抗、奥美珠单抗、替伊莫单抗、托西莫单抗、碘131托西莫单抗、利妥昔
单抗生物仿制药(blitzima、ritemvia、tuxella),或乌布妥昔单抗。
[0190]
抗cd20抗体可以以375mg/m2抗体的剂量施用于受试者。抗cd20抗体可以每周一次、每两周一次、每月一次、每四周一次、每八周一次或每两月一次,任选地在每个相关时间点以375mg/m2抗体的剂量施用。
[0191]
抗cd47抗体和抗cd20抗体可以同时或相继施用,任选地其中抗cd20抗体在抗cd47抗体之前施用。在一些实施方案中,抗cd20抗体在施用抗cd47抗体之后施用。
[0192]
抗cd20抗体可以与药学上可接受的赋形剂一起配制在药物组合物中。抗cd20抗体和抗cd47抗体可以一起配制。
[0193]
抗cd20抗体可以静脉内施用。
[0194]
在一些实施方案中,抗cd20抗体具有以下序列(轻链、重链、可变轻链结构域、可变重链结构域和/或cdr):所述序列与利妥昔单抗的序列(在下表3中示出)具有至少97%、至少98%、至少99%或100%的同一性。表3包含利妥昔单抗抗体重链和轻链的序列(分别为seq id no:129和130)以及vh cdr和vl cdr的序列(seq id no:131-136)。表3进一步示出了利妥昔单抗的可变重链、恒定重链(例如,c
h1
、c
h2
、c
h3
)、铰链、可变轻链和恒定轻链。抗cd20抗体可以包含:重链序列seq id no:129和轻链序列seq id no:130。抗cd20抗体可以包含:vh序列seq id no:137和vl序列seq id no:142。抗cd20抗体可以包含以下中的一者或多者:c
h1
序列seq id no:138、铰链序列seq id no:139(其中该铰链序列将c
h1
序列和c
h2
序列连接)、c
h2
序列seq id no:140,以及c
h3
序列seq id no:141。抗cd20抗体可以包含恒定轻链seq id no:143。抗cd20抗体可以包含一个或多个以seq id no:131-136示出序列的cdr。抗cd20抗体可以包含以seq id no:131-136示出序列的cdr。抗cd20抗体可以包含一个或多个以seq id no:137示出序列的cdr。抗cd20抗体可以包含一个或多个以seq id no:142示出序列的cdr。抗cd20抗体可以包含以seq id no:137示出v区序列的cdr。抗cd20抗体可以包含以seq id no:142示出v区序列的cdr。
[0195]
在各种实施方案中,抗cd20抗体可以包含fc区,该fc区包含c
h2
序列seq id no:140和c
h3
序列seq id no:141。在各种实施方案中,抗cd20抗体可以包含抗原结合片段(fab)。在各种实施方案中,抗cd20fab可以包含可变重链序列seq id no:137、c
h1
序列seq id no:138、可变轻链序列seq id no:142和恒定轻链序列seq id no:143。在各种实施方案中,抗cd20抗体可以包含单链可变片段(scfv)。在各种实施方案中,该scfv可以包含可变重链序列seq id no:137和可变轻链序列seq id no:142。在各种实施方案中,抗cd20抗体可以包含f(ab)'2片段。在各种实施方案中,抗cd20 f(ab)'2片段可以包含可变重链序列seq id no:137、c
h1
序列seq id no:138、可变轻链序列seq id no:142、恒定轻链序列seq id no:143和铰链序列seq id no:139。
[0196]
表3包含利妥昔单抗抗体重链和轻链的序列。
[0197]
[0198][0199]
用于联合疗法的附加药剂
[0200]
在各种实施方案中,适用于治疗血液恶性肿瘤的附加药剂(诸如小分子、抗体、过继性细胞疗法和嵌合抗原受体t细胞(car-t)、检查点抑制剂和疫苗)可以与如本文所述的抗cd47剂组合施用。用于血液恶性肿瘤的附加免疫治疗剂描述于dong s等人,j life sci(westlake village).2019年6月;1(1):46
–
52;和cuesta-mateos c等人,
front.immunol.8:1936.doi:10.3389/fimmu.2017.01936中,这些文献中的每一者据此全文以引用方式并入本文。
[0201]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种附加治疗剂组合,所述附加治疗剂例如抑制性免疫检查点阻断剂或抑制剂、刺激性免疫检查点刺激剂、激动剂或活化剂、化学治疗剂、抗癌剂、放射性治疗剂、抗肿瘤剂、抗增殖剂、抗血管生成剂、抗炎剂、免疫治疗剂、治疗性抗原结合分子(任何形式的单特异性和多特异性抗体及其片段,例如包括但不限于bikes、trikes、scfv、fab、fab衍生物)、双特异性抗体、非免疫球蛋白抗体模拟物(例如,包括但不限于adnectin、亲和体分子、affilin、affimer、affitin、alphabody、anticalin、肽适配体、犰狳重复蛋白(arm)、atrimer、avimer、设计的锚蛋白重复蛋白fynomer、knottin、kunitz结构域肽、monobody和nanoclamp)、抗体-药物缀合物(adc)、抗体-肽偶联物)、溶瘤病毒、基因修饰剂或编辑剂、包含嵌合抗原受体(car)的细胞(例如,包括t细胞免疫治疗剂、nk细胞免疫治疗剂或巨噬细胞免疫治疗剂)、包含工程化t细胞受体的细胞(tcr-t),或它们的任何组合。
[0202]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种附加治疗剂组合,所述附加治疗剂包括但不限于靶标(例如多肽或多核苷酸)的抑制剂、激动剂、拮抗剂、配体、调节剂、刺激剂、阻断剂、活化剂或阻抑剂,包括但不限于:爱柏森鼠白血病病毒癌基因同源物1基因(abl,诸如abl1)、乙酰辅酶a羧化酶(诸如acc1/2)、活化的cdc激酶(ack,诸如ack1)、腺苷脱氨酶、腺苷受体(诸如a2br、a2ar、a3ar)、腺苷酸环化酶、adp核糖基环化酶-1、促肾上腺皮质激素受体(acth)、气单胞菌溶素、akt1基因、alk-5蛋白激酶、碱性磷酸酶、α1肾上腺受体、α2肾上腺受体、α-酮戊二酸脱氢酶(kgdh)、氨基肽酶n、amp活化的蛋白激酶、间变性淋巴瘤激酶(alk,诸如alk1)、雄激素受体、血管生成素(诸如配体-1、配体-2)、血管紧张素原(agt)基因、鼠胸腺瘤病毒癌基因同源物1(akt)蛋白激酶(诸如akt1、akt2、akt3)、载脂蛋白a-i(apoa1)基因、凋亡诱导因子、凋亡蛋白(诸如1、2)、凋亡信号调节激酶(ask,诸如ask1)、精氨酸酶(i)、精氨酸脱亚氨酶、芳香酶、类固醇同源物1(aste1)基因、共济失调毛细血管扩张和rad3相关(atr)丝氨酸/苏氨酸蛋白激酶、aurora蛋白激酶(诸如1、2)、axl酪氨酸激酶受体、4-1bb配体(cd137l)、含杆状病毒iap重复5(birc5)基因、basigin、b细胞淋巴瘤2(bcl2)基因、bcl2结合组分3、bcl2蛋白、bcl2l11基因、bcr(裂点簇区)蛋白和基因、β肾上腺受体、β-连环蛋白、b-淋巴细胞抗原cd19、b-淋巴细胞抗原cd20、b-淋巴细胞粘附分子、b-淋巴细胞刺激剂配体、骨形态发生蛋白-10配体、骨形态发生蛋白-9配体调节剂、brachyury蛋白、bradykinin受体、b-raf原癌基因(braf)、brc-abl酪氨酸激酶、含溴结构域和外部结构域(bet)溴结构域的蛋白(诸如brd2、brd3、brd4)、布鲁顿酪氨酸激酶(btk)、钙调蛋白、钙调蛋白依赖性蛋白激酶(camk,诸如camkii)、癌症/睾丸抗原2、癌症/睾丸抗原ny-eso-1、癌症/睾丸抗原1b(ctag1)基因、大麻素受体(诸如cb1、cb2)、碳酸酐酶、酪蛋白激酶(ck,诸如cki、ckii)、胱天蛋白酶(诸如胱天蛋白酶-3、胱天蛋白酶-7、胱天蛋白酶-9)、胱天蛋白酶8凋亡相关的半胱氨酸肽酶casp8-fadd样调节子、胱天蛋白酶募集结构域蛋白-15、组织蛋白酶g、ccr5基因、cdk活化激酶(cak)、检查点激酶(诸如chk1、chk2)、趋化因子(c-c基序)受体(诸如ccr2、ccr4、ccr5、ccr8)、趋化因子(c-x-c基序)受体
(诸如cxcr1、cxcr2、cxcr3和cxcr4)、趋化因子cc21配体、缩胆囊素cck2受体、绒膜促性腺激素、c-kit(酪氨酸-蛋白激酶kit或cd117)、cish(含细胞因子诱导型sh2的蛋白)、封闭蛋白(诸如6、18)、分化簇(cd)(诸如cd4、cd27、cd29、cd30、cd33、cd37、cd40、cd40配体受体、cd40配体、cd40lg基因、cd44、cd45、cd47、cd49b、cd51、cd52、cd55、cd58、cd66e(ceacam6)、cd70基因、cd74、cd79、cd79b、cd79b基因、cd80、cd95、cd99、cd117、cd122、cdw123、cd134、cdw137、cd158a、cd158b1、cd158b2、cd223、cd276抗原);凝聚素(clu)基因、凝聚素、c-met(肝细胞生长因子受体(hgfr))、补体c3、结缔组织生长因子、cop9信号复合体亚单位5、csf-1(集落刺激因子1受体)、csf2基因、ctla-4(细胞毒性t淋巴细胞蛋白4)受体、c型凝集素结构域蛋白9a(clec9a)、细胞周期素d1、细胞周期素g1、细胞周期素依赖性激酶(cdk,诸如cdk1、cdk12、cdk1b、cdk2-9)、环氧合酶(诸如cox1、cox2)、cyp2b1基因、豪猪半胱氨酸棕榈酰转移酶、细胞色素p450 11b2、细胞色素p450 17、细胞色素p450 17a1、细胞色素p450 2d6、细胞色素p4503a4、细胞色素p450还原酶、细胞因子信号传导-1、细胞因子信号传导-3、细胞质异柠檬酸脱氢酶、胞嘧啶脱氨酶、胞嘧啶dna甲基转移酶、细胞毒性t淋巴细胞蛋白-4、ddr2基因、dead-box解旋酶6(ddx6)、死亡受体5(dr5,trailr2)、死亡受体4(dr4,trailr1)、δ样蛋白配体(诸如3、4)、脱氧核糖核酸酶、去泛素化酶(dub)、dickkopf-1配体、二氢叶酸还原酶(dhfr)、二氢嘧啶脱氢酶、二肽基肽酶iv、盘状结构域受体(ddr,诸如ddr1)、二酰基甘油激酶ζ(dgkz)、dna结合蛋白(诸如hu-β)、dna依赖性蛋白激酶、dna旋转酶、dna甲基转移酶、dna聚合酶(诸如α)、dna引发酶、dutp焦磷酸酶、l-多巴色素互变异构酶、e3泛素-蛋白连接酶(诸如rnf128、cbl-b)、棘皮动物微管样蛋白4、egfr酪氨酸激酶受体、弹性蛋白酶、延伸因子1α2、延伸因子2、内皮糖蛋白、核酸内切酶、内质网氨肽酶(erap,诸如erap1、erap2)、内质蛋白、内皮唾液酸蛋白、内皮抑素、内皮素(诸如et-a、et-b)、zeste基因增强子同源物2(ezh2)、肝配蛋白(eph)酪氨酸激酶(诸如epha3、ephb4)、肝配蛋白b2配体、表皮生长因子、表皮生长因子受体(egfr)、表皮生长因子受体(egfr)基因、上皮有丝分裂原(epigen)、上皮细胞粘附分子(epcam)、erb-b2(v-erb-b2禽成红细胞白血病病毒癌基因同源物2)酪氨酸激酶受体、erb-b3酪氨酸激酶受体、erb-b4酪氨酸激酶受体、e选择素、雌二醇17β脱氢酶、雌激素受体(诸如α、β)、雌激素相关受体、真核翻译起始因子5a(eif5a)基因、输出蛋白1、细胞外信号相关激酶(诸如1、2)、细胞外信号调节激酶(erk)、低氧诱导因子脯氨酰羟化酶(hif-ph或egln)、因子(诸如xa、viia)、法尼酯x受体(fxr)、fas配体、脂肪酸合酶(fasn)、铁蛋白、fgf-2配体、fgf-5配体、成纤维细胞生长因子(fgf,诸如fgf1、fgf2、fgf4)、纤粘蛋白、粘着斑激酶(fak,诸如fak2)、叶酸水解酶前列腺特异性膜抗原1(folh1)、叶酸受体(诸如α)、叶酸、叶酸转运蛋白1、fyn酪氨酸激酶、成对碱性氨基酸切割酶(furin)、β-葡萄糖醛酸酶、半乳糖基转移酶、半乳凝素-3、神经节苷脂gd2、糖皮质激素、糖皮质激素诱导的tnfr相关蛋白gitr受体、谷氨酸羧肽酶ii、谷氨酰胺酶、谷胱甘肽s-转移酶p、糖原合酶激酶(gsk,诸如3-β)、磷脂酰肌醇聚糖3(gpc3)促性腺激素释放激素(gnrh)、粒细胞巨噬细胞集落刺激因子(gm-csf)受体、粒细胞集落刺激因子(gcsf)配体、生长因子受体结合蛋白2(grb2)、grp78(78kda葡萄糖调节蛋白)钙结合蛋白、分子伴侣groel2基因、血红素加氧酶1(ho1)、血红素加氧酶2(ho2)、热休克蛋白(诸如27、70、90α、β)、热休克蛋白基因、热稳定肠毒素受体、刺猬蛋白、肝素酶、肝细胞生长因子、herv-h ltr相关蛋白2、己糖激酶、组胺h2受体、组蛋白甲基转移酶(dot1l)、组蛋白脱乙酰酶(hdac,诸如1、2、3、6、10、11)、组蛋白h1、
组蛋白h3、hla i类抗原(a-2α)、hla ii类抗原、hla i类抗原αg(hla-g)、非经典hla、同源异型盒蛋白nanog、hspb1基因、人白细胞抗原(hla)、人乳头瘤病毒(诸如e6、e7)蛋白、透明质酸、透明质酸酶、低氧诱导因子-1α(hif1α)、母系印迹表达转录物(h19)基因、丝裂原活化蛋白激酶1(map4k1)、酪氨酸蛋白激酶hck、i-κ-b激酶(ikk,诸如ikkbe)、il-1α、il-1β、il-12、il-12基因、il-15、il-17、il-2基因、il-2受体α亚基、il-2、il-3受体、il-4、il-6、il-7、il-8、免疫球蛋白(诸如g、g1、g2、k、m)、免疫球蛋白fc受体、免疫球蛋白γfc受体(诸如i、iii、iiia)、吲哚胺2,3-双加氧酶(ido,诸如ido1和ido2)、吲哚胺吡咯2,3-双加氧酶1抑制剂、胰岛素受体、胰岛素样生长因子(诸如1、2)、整联蛋白α-4/β-1、整联蛋白α-4/β-7、整联蛋白α-5/β-1、整联蛋白α-v/β-3、整联蛋白α-v/β-5、整联蛋白α-v/β-6、细胞间粘附分子1(icam-1)、干扰素(诸如α、α2、β、γ)、黑色素瘤缺乏干扰素诱导型蛋白2(aim2)、干扰素i型受体、白介素1配体、白介素13受体α2、白介素2配体、白介素-1受体相关激酶4(irak4)、白介素-2、白介素-29配体、白介素35(il-35)、异柠檬酸脱氢酶(诸如idh1、idh2)、janus激酶(jak,诸如jak1、jak2)、jun n末端激酶、激肽释放酶相关肽酶3(klk3)基因、杀伤细胞ig样受体、激酶插入结构域受体(kdr)、驱动蛋白样蛋白kif11、kirsten大鼠肉瘤病毒癌基因同源物(kras)基因、kisspeptin(kiss-1)受体、kit基因、v-kit hardy-zuckerman 4猫肉瘤病毒癌基因同源物(kit)酪氨酸激酶、乳铁蛋白、羊毛甾醇-14脱甲基酶、ldl受体相关蛋白-1、白细胞免疫球蛋白样受体亚家族b成员1(ilt2)、白细胞免疫球蛋白样受体亚家族b成员2(ilt4)、白三烯a4水解酶、单核细胞增多性李斯特菌素(listeriolysin)、l-选择素、促黄体激素受体、裂解酶、淋巴细胞活化基因3蛋白(lag-3)、淋巴细胞抗原75、淋巴细胞功能抗原-3受体、淋巴细胞特异性蛋白酪氨酸激酶(lck)、淋巴细胞趋化因子、lyn(lck/yes新型)酪氨酸激酶、赖氨酸脱甲基酶(诸如kdm1、kdm2、kdm4、kdm5、kdm6、a/b/c/d)、溶血磷脂酸-1受体、溶酶体相关膜蛋白家族(lamp)基因、赖氨酰氧化酶同源物2、赖氨酰氧化酶蛋白(lox)、5-脂氧合酶(5-lox)、造血祖细胞激酶1(hpk1)、肝细胞生长因子受体(met)基因、巨噬细胞集落刺激因子(mcsf)配体、巨噬细胞移动抑制因子、magec1基因、magec2基因、主穹窿蛋白、mapk活化蛋白激酶(诸如mk2)、mas相关g蛋白偶联受体、基质金属蛋白酶(mmp,诸如mmp2、mmp9)、mcl-1分化蛋白、mdm2 p53-结合蛋白、mdm4蛋白、melan-a(mart-1)黑素瘤抗原、黑素细胞蛋白pmel 17、促黑素细胞激素配体、黑色瘤抗原家族a3(magea3)基因、黑色瘤相关抗原(诸如1、2、3、6)、膜铜胺氧化酶、间皮素、met酪氨酸激酶、代谢型谷氨酸受体1、金属还原酶steap1(前列腺六跨膜表皮抗原1)、转移抑素、甲硫氨酸氨肽酶-2、甲基转移酶、线粒体3酮脂酰coa硫解酶、丝裂原活化蛋白激酶(mapk)、丝裂原活化蛋白激酶(mek,诸如mek1、mek2)、mtor(雷帕霉素机能靶点)(丝氨酸/苏氨酸激酶)、mtor复合物(诸如1、2)、粘蛋白(诸如1、5a、16)、mut t同源物(mth,诸如mth1)、myc原癌基因蛋白、骨髓细胞白血病1(mcl1)基因、富含肉豆蔻酰化丙氨酸的蛋白激酶c底物(marcks)蛋白、nad adp核糖基转移酶、钠尿肽受体c、神经细胞粘附分子1、神经激肽1(nk1)受体、神经激肽受体、神经纤毛蛋白2、nfκb活化蛋白、nima相关激酶9(nek9)、一氧化氮合酶、nk细胞受体、nk3受体、nkg2 a b活化nk受体、nlrp3(nacht lrr pyd结构域蛋白3)调节剂、去甲肾上腺素转运蛋白、notch(诸如notch-2受体、notch-3受体、notch-4受体)、核类红细胞2-相关因子2、核因子(nf)κb、核仁素、核磷蛋白、核磷蛋白-间变性淋巴瘤激酶(npm-alk)、2-氧代戊二酸脱氢酶、2,5-寡腺苷酸合成酶、o-甲基鸟嘌呤dna甲基转移酶、阿片受体(诸如δ)、鸟氨酸脱羧酶、乳清酸盐磷酸核糖基转移酶、
孤儿核激素受体nr4a1、骨钙蛋白、破骨细胞分化因子、骨桥蛋白、ox-40(肿瘤坏死因子受体超家族成员4tnfrsf4,或cd134)受体、p3蛋白、p38激酶、p38 map激酶、p53肿瘤抑制蛋白、甲状旁腺激素配体、过氧化物酶体增殖剂活化受体(ppar,诸如α、δ、γ)、p-糖蛋白(诸如1)、磷酸酶和张力蛋白同源物(pten)、磷脂酰肌醇3-激酶(pi3k)、磷酸肌醇-3激酶(pi3k,诸如α、δ、γ)、磷酸化酶激酶(pk)、pkn3基因、胎盘生长因子、血小板衍生生长因子(pdgf,诸如α、β)、血小板衍生生长因子(pdgf,诸如α、β)、多效耐药性转运蛋白、丛状蛋白b1、plk1基因、polo样激酶(plk)、polo样激酶1、聚(adp-核糖)聚合酶(parp,诸如parp1、parp2和parp3、parp7,以及单parp)、黑素瘤中优先表达的抗原(prame)基因、异戊二烯基结合蛋白(prpb)、可能的转录因子pml、黄体酮受体、程序性细胞死亡1(pd-1)、程序性细胞死亡配体1抑制剂(pd-l1)、鞘脂激活蛋白原(psap)基因、前列腺素类受体(ep4)、前列腺素e2合酶、前列腺特异性抗原、前列腺酸性磷酸酶、蛋白酶体、蛋白e7、蛋白质法尼基转移酶、蛋白激酶(pk,诸如a、b、c)、蛋白酪氨酸激酶、蛋白酪氨酸磷酸酶β、原癌基因丝氨酸/苏氨酸-蛋白激酶(pim,诸如pim-1、pim-2、pim-3)、p-选择蛋白、嘌呤核苷磷酸化酶、嘌呤能受体p2x配体门控离子通道7(p2x7)、丙酮酸脱氢酶(pdh)、丙酮酸脱氢酶激酶、丙酮酸盐激酶(pyk)、5-α-还原酶、raf蛋白激酶(诸如1、b)、raf1基因、ras基因、ras gtp酶、ret基因、ret酪氨酸激酶受体、成视网膜细胞瘤相关蛋白、视黄酸受体(诸如γ)、维甲酸x受体、rheb(在脑中富集的ras同源物)gtp酶、rho(ras同源物)相关蛋白激酶2、核糖核酸酶、核糖核苷酸还原酶(诸如m2亚基)、核糖体蛋白s6激酶、rna聚合酶(诸如i、ii)、ron(recepteur d'origine nantais)酪氨酸激酶、ros1(ros原癌基因1,受体酪氨酸激酶)基因、ros1酪氨酸激酶、runt相关转录因子3、γ-分泌酶、s100钙结合蛋白a9、肌内质网钙atp酶、第二线粒体来源的胱天蛋白酶活化剂(smac)蛋白、分泌型卷曲相关蛋白-2、分泌型磷脂酶a2、脑信号蛋白-4d、丝氨酸蛋白酶、丝氨酸/苏氨酸激酶(stk)、丝氨酸/苏氨酸蛋白激酶(tbk,诸如tbk1)、信号转导和转录(stat,诸如stat-1、stat-3、stat-5)、信号传导淋巴细胞活化分子(slam)家族成员7、前列腺六次跨膜上皮抗原(steap)基因、sl细胞因子配体、平滑化(smo)受体、碘化钠协同转运蛋白、磷酸钠协同转运蛋白2b、生长抑素受体(诸如1、2、3、4、5)、刺猬蛋白、无七基因之子(sos)、特异性蛋白1(sp1)转录因子、鞘磷脂合酶、鞘氨醇激酶(诸如1、2)、1-磷酸-鞘氨醇受体-1、脾酪氨酸激酶(syk)、src基因、src酪氨酸激酶、稳定素-1(stab1)、stat3基因、类固醇硫酸酯酶、干扰素基因刺激剂(sting)受体、干扰素基因蛋白刺激剂、基质细胞衍生因子1配体、sumo(小泛素样修饰剂)、超氧化物歧化酶、细胞因子信号传导调节剂抑制剂(socs)、存活蛋白、突触蛋白3、多配体聚糖-1、突触核蛋白α、t细胞表面糖蛋白cd28、tank结合激酶(tbk)、tata盒结合蛋白相关因子rna聚合酶i亚基b(taf1b)基因、t细胞cd3糖蛋白ζ链、t细胞分化抗原cd6、含t细胞免疫球蛋白和粘蛋白结构域-3(tim-3)、t细胞表面糖蛋白cd8、tec蛋白酪氨酸激酶、tek酪氨酸激酶受体、端粒酶、端粒酶逆转录酶(tert)基因、腱生蛋白、三引物修复核酸外切酶1(trex1)、三引物修复核酸外切酶2(trex2)、血小板生成素受体、胸苷激酶、胸苷磷酸化酶、胸苷酸合酶、胸腺素(诸如α1)、甲状腺激素受体、促甲状腺激素受体、组织因子、tnf相关细胞凋亡诱导配体、tnfr1相关死亡结构域蛋白、tnf相关细胞凋亡诱导配体(trail)受体、tnfsf11基因、tnfsf9基因、toll样受体(tlr,诸如1-13)、拓扑异构酶(诸如i、ii、iii)、转录因子、转移酶、转铁蛋白(tf)、转化生长因子α(tgfα)、转化生长因子β(tgfb)及其同种型、tgfβ2配体、转化生长因子tgf-β受体激酶、转谷氨酰胺酶、易位相关蛋白、跨膜
糖蛋白nmb、trop-2钙信号转导子、滋养层糖蛋白(tpbg)基因、滋养层糖蛋白、原肌球蛋白受体激酶(trk)受体(诸如trka、trkb、trkc)、色氨酸2,3-双加氧酶(tdo)、色氨酸5-羟化酶、微管蛋白、肿瘤坏死因子(tnf,诸如α、β)、肿瘤坏死因子13c受体、肿瘤进展基因座2(tpl2)、肿瘤蛋白53(tp53)基因、肿瘤抑制基因候选物2(tusc2)基因、肿瘤特异性新抗原、酪氨酸酶、酪氨酸羟化酶、酪氨酸激酶(tk)、酪氨酸激酶受体、具有免疫球蛋白样和egf样结构域的酪氨酸激酶(tie)受体、酪氨酸蛋白激酶abl1抑制剂、泛素、泛素羧基水解酶同工酶l5、泛素硫酯酶-14、泛素偶联酶e2i(ube2i、ubc9)、泛素特异性加工蛋白酶7(usp7)、脲酶、尿激酶纤溶酶原激活剂、子宫珠蛋白、辣椒素vr1、血管细胞粘附蛋白1、血管内皮生长因子受体(vegfr)、t细胞活化的v结构域ig抑制因子(vista)、vegf-1受体、vegf-2受体、vegf-3受体、vegf-a、vegf-b、波形蛋白、维生素d3受体、原癌基因酪氨酸蛋白激酶、mer(mer酪氨酸激酶受体调节剂)、yap(yes相关蛋白调节剂)、wee-1蛋白激酶、沃纳综合症recq样解旋酶(wrn)、威耳姆氏肿瘤抗原1、威耳姆氏肿瘤蛋白、含有ww结构域的转录调节蛋白1(taz)、凋亡蛋白的x联抑制剂、锌指蛋白转录因子,或者它们的任何组合。
[0203]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种附加治疗剂组合,所述附加治疗剂可以根据其作用机理分类为例如以下组:抗代谢物/抗癌剂,诸如嘧啶类似物氟尿苷、卡培他滨、阿糖胞苷、cpx-351(脂质体阿糖胞苷、柔红霉素)和tas-118;α1肾上腺素受体/α2肾上腺素受体拮抗剂,诸如盐酸酚苄明(可注射,嗜铬细胞瘤);雄激素受体拮抗剂,诸如尼鲁米特;抗钙粘蛋白抗体,诸如hkt-288;抗含富亮氨酸重复蛋白15(lrrc15)抗体,诸如abbv-085、argx-110;血管紧张素受体阻断剂、一氧化氮供体;反义寡核苷酸,诸如aeg35156、ionis-kras-2.5rx、ezn-3042、rx-0201、ionis-ar-2.5rx、bp-100(普瑞希伯森(prexigebersen))、ionis-stat3-2.5rx;抗血管生成素(ang)-2抗体,诸如medi3617和ly3127804;抗ang-1/ang-2抗体,诸如amg-780;抗csf1r抗体,诸如艾马妥珠单抗(emactuzumab)、ly3022855、amg-820、fpa-008(卡比利珠单抗(cabiralizumab));抗内皮糖蛋白抗体,诸如trc105(卡罗妥昔单抗(carotuximab));抗erbb抗体,诸如cdx-3379、hlx-02、瑟瑞妥单抗(seribantumab);抗her2抗体,诸如(曲妥珠单抗)、曲妥珠单抗生物仿制药、马吉妥昔单抗、medi4276、bat-8001、帕妥珠单抗(perjeta)、rg6264、zw25(靶向细胞外结构域2和4的双特异性her2导向抗体;cancer discov.2019年1月;9(1):8;pmid:30504239);抗hla-dr抗体,诸如immu-114;抗il-3抗体,诸如jnj-56022473;抗tnf受体超家族成员18(tnfrsf18、gitr;ncbi基因id:8784)抗体,诸如mk-4166、medi1873、fpa-154、incagn-1876、trx-518、bms-986156、mk-1248、gwn-323;以及例如国际专利公布号wo2017/096179、wo 2017/096276、wo 2017/096189和wo 2018/089628中所述的那些;抗epha3抗体,诸如kb-004;抗cd37抗体,诸如奥乐妥珠单抗(otlertuzumab)(tru-016);抗fgfr-3抗体,诸如ly3076226、b-701;抗fgfr-2抗体,诸如gal-f2;抗c5抗体,诸如alxn-1210;抗epcam抗体,诸如vb4-845;抗cea抗体,诸如rg-7813;抗癌胚抗原相关细胞粘附分子6(ceacam6、cd66c)抗体,诸如bay-1834942、neo-201(ceacam 5/6);抗gd2抗体,诸如apn-301;抗白介素-17(il-17)抗体,诸如cjm-112;抗白介素-1β抗体,诸如康纳单抗(acz885)、vpm087;抗碳酸酐酶9(ca9、caix)抗体,诸如tx-250;抗粘蛋白1(muc1)抗体,诸如伽妥珠单抗(gatipotuzumab)、mab-ar-20.5;抗kma抗体,诸如mdx-1097;抗cd55抗体,诸如pat-sc1;抗c-met抗体,诸如abbv-399;抗psma抗体,诸如atl-101;抗cd100抗体,诸如vx-15;抗epha3
抗体,诸如菲巴妥珠单抗(fibatuzumab);抗april抗体,诸如bion-1301;抗成纤维细胞活化蛋白(fap)/il-2r抗体,诸如rg7461;抗成纤维细胞活化蛋白(fap)/trail-r2抗体,诸如rg7386;抗岩藻糖基-gm1抗体,诸如bms-986012;抗il-8(白介素-8)抗体,诸如humax-inflam;抗肌抑素抑制剂,诸如兰度戈珠单抗(landogrozumab);抗δ样蛋白配体3(ddl3)抗体,诸如罗伐匹妥单抗替西林(rovalpituzumab tesirine);抗dll4(δ样配体4)抗体,诸如地珠单抗(demcizumab);抗簇蛋白抗体,诸如ab-16b5;抗肝配蛋白a4(efna4)抗体,诸如pf-06647263;抗间皮素抗体,诸如bms-986148、抗msln-mmae;抗磷酸钠共转运蛋白2b(nap2b)抗体,诸如利法妥珠单抗(lifastuzumab);抗tgfb抗体,诸如sar439459;抗转化生长因子-β(tgf-β)抗体,诸如abbv-151、ly3022859、nis793、xoma 089;嘌呤类似物、叶酸拮抗剂(诸如普拉曲沙)、克拉屈滨、喷司他丁、氟达拉滨和相关的抑制剂;抗增殖剂/抗有丝分裂剂,包括天然产物,诸如长春花生物碱(长春花碱、长春新碱);以及微管破坏剂,诸如紫杉烷(紫杉醇、多西他赛)、长春碱、诺考达唑、埃博霉素、长春瑞滨和表鬼臼毒素(依托泊苷、替尼泊苷);dna损伤剂,诸如放线菌素、安吖啶、白消安、卡铂、苯丁酸氮芥、顺铂、环磷酰胺更生霉素、柔红霉素、多柔比星、debdox、表柔比星、异环磷酰胺、美法仑、氮芥(merchlorethamine)、丝裂霉素c、米托蒽醌、亚硝基脲、丙卡巴嗪、他克唑、泰素帝、替尼泊苷、依托泊苷和三乙烯硫代磷酰胺;dna-次甲基化剂,诸如瓜地他滨(guadecitabine)(sgi-110)、astx727;抗生素,诸如更生霉素、柔红霉素、多柔比星、伊达比星、蒽环霉素、米托蒽醌、博来霉素、普卡霉素(光神霉素);酶,诸如l-天冬酰胺酶,其全身性代谢l-天冬酰胺并且剥夺不具有合成其自身天冬酰胺的能力的细胞;靶向bcl-2的dnai寡核苷酸,诸如pnt2258;活化或再活化潜伏性人类免疫缺陷病毒(hiv)的药剂,诸如帕比司他和罗米地辛;天冬酰胺酶刺激剂,诸如克瑞他酶(crisantaspase)和graspa(ery-001、ery-asp)、卡拉斯巴加斯聚乙二醇(calaspargase pegol)、培门冬酶;pan-trk、ros1和alk抑制剂,诸如恩曲替尼、tpx-0005;间变性淋巴瘤激酶(alk)抑制剂,诸如艾乐替尼、色瑞替尼、alecensa(rg7853)、(布格替尼);抗增殖/抗有丝分裂烷基化剂,诸如氮芥环磷酰胺和类似物(例如美法仑、苯丁酸氮芥、六甲嘧胺、噻替哌)、烷基亚硝基脲(例如卡莫司汀)和类似物、链脲菌素和三氮烯(例如达卡巴嗪);抗增殖/抗有丝分裂抗代谢物,诸如叶酸类似物(甲氨蝶呤);铂配位络合物(例如顺铂、奥沙利铂和卡铂)、丙卡巴嗪、羟基脲、米托坦和氨格鲁米特;激素、激素类似物(例如雌激素、它莫西芬、戈舍瑞林、比卡鲁胺和尼鲁胺)和芳香酶抑制剂(例如来曲唑和阿那曲唑);抗血小板剂;抗凝剂,诸如肝素、合成肝素盐和凝血酶的其他抑制剂;纤维蛋白溶解剂,诸如组织纤溶酶原活化剂、链激酶、尿激酶、阿司匹林、双嘧达莫、噻氯匹啶和氯吡格雷;抗迁移剂;抗分泌剂(例如布雷菲德菌素(breveldin));免疫抑制剂,诸如他克莫司、西罗莫司、硫唑嘌呤和霉酚酸酯;生长因子抑制剂和血管内皮生长因子抑制剂;成纤维细胞生长因子抑制剂,诸如fpa14;amp活化蛋白激酶刺激剂,诸如盐酸二甲双胍;adp核糖基环化酶-1抑制剂,诸如达雷木单抗胱天蛋白酶募集结构域蛋白-15刺激剂,诸如米伐木肽(脂质体);ccr5趋化因子拮抗剂,诸如mk-7690(维克韦罗(vicriviroc));cdc7蛋白激酶抑制剂,诸如tak-931;胆固醇侧链切割酶抑制剂,诸如odm-209;二氢嘧啶脱氢酶/乳清酸磷酸核糖基转移酶抑制剂,诸如cefesone(替加氟 吉美嘧啶 氧嗪酸钾);dna聚合酶/核糖核苷酸还原酶
抑制剂,诸如氯法拉滨;dna干扰寡核苷酸,诸如pnt2258、azd-9150;雌激素受体调节剂,诸如巴多昔芬;雌激素受体激动剂/孕酮受体拮抗剂,诸如tri-cyclen lo(炔诺酮 乙炔雌二醇);hla i类抗原a-2α调节剂,诸如fh-mcva2tcr;hla i类抗原a-2α/mart-1黑素瘤抗原调节剂,诸如mart-1f5 tcr工程化pbmc;人粒细胞集落刺激因子,诸如pf-06881894;gnrh受体激动剂,诸如醋酸亮丙瑞林、醋酸亮丙瑞林缓释贮库(atrigel)、双羟萘酸曲普瑞林、醋酸戈舍瑞林;gnrh受体拮抗剂,诸如噁拉戈利(elagolix)、瑞格列克(relugolix)、地加瑞克(degarelix);内质蛋白调节剂,诸如安罗替尼;h k atp酶抑制剂,诸如奥美拉唑、埃索美拉唑;icam-1/cd55调节剂,诸如cavatak(v-937);il-15/il-12调节剂,诸如sar441000;白介素23a抑制剂,诸如古塞库单抗(guselkumab);赖氨酸特异性组蛋白脱甲基酶1抑制剂,诸如cc-90011;il-12mrna,诸如medi1191;rig-i调节剂,诸如rgt-100;nod2调节剂,诸如sb-9200和ir-103;孕酮受体激动剂,诸如左炔诺孕酮;cereblon蛋白调节剂,诸如cc-92480、cc-90009;cereblon蛋白调节剂/dna结合蛋白ikaros抑制剂/锌指结合蛋白aiolos抑制剂,诸如伊贝多胺(iberdomide);retinoid x受体调节剂,诸如阿利维a酸、蓓萨罗丁(口服制剂);rip-1激酶抑制剂,诸如gsk-3145095;选择性雌激素受体降解剂,诸如azd9833;sumo抑制剂,诸如tak-981;血小板生成素受体激动剂,诸如艾曲波帕;甲状腺激素受体激动剂,诸如左甲状腺素钠;tnf激动剂,诸如他索纳明;酪氨酸磷酸酶底物1抑制剂,诸如cc-95251;her2抑制剂,诸如来那替尼、妥卡替尼(tucatinib)(ont-380);egfr/erbb2/ephb4抑制剂,诸如特伐替尼(tesevatinib);egfr/her2抑制剂,诸如tak-788;egfr家族酪氨酸激酶受体抑制剂,诸如dzd-9008;egfr/erbb-2抑制剂,诸如瓦里替尼;突变型选择性egfr抑制剂,诸如pf-06747775、egf816(纳扎替尼)、asp8273、acea-0010、bi-1482694;epha2抑制剂,诸如mm-310;多梳蛋白(eed)抑制剂,诸如mak683;dhfr抑制剂/叶酸转运蛋白1调节剂/叶酸受体拮抗剂,诸如普拉曲沙;dhfr/gar转甲酰酶/胸苷酸合酶/转移酶抑制剂,诸如培美曲塞二钠;p38 map激酶抑制剂,诸如雷利美替尼(ralimetinib);prmt抑制剂,诸如ms203、pf-06939999、gsk3368715、gsk3326595;鞘氨醇激酶2(sk2)抑制剂,诸如奥帕尼布(opaganib);核类红细胞2相关因子2刺激剂,诸如奥马索龙(rta-408);原肌球蛋白受体激酶(trk)抑制剂,诸如loxo-195、ono-7579;粘蛋白1抑制剂,诸如go-203-2c;marcks蛋白抑制剂,诸如bio-11006;叶酸拮抗剂,诸如阿夫替索林(arfolitixorin);半乳凝素-3抑制剂,诸如gr-md-02;磷酸化p68抑制剂,诸如rx-5902;cd95/tnf调节剂,诸如ofranergene obadenovec;泛pim激酶抑制剂,诸如incb-053914;il-12基因刺激剂,诸如egen-001、tavokinogene telseplasmid;热休克蛋白hsp90抑制剂,诸如tas-116、pen-866;vegf/hgf拮抗剂,诸如mp-0250;vegf配体抑制剂,如贝伐珠单抗生物仿制药;vegf受体拮抗剂/vegf配体抑制剂,诸如雷莫卢单抗;vegf-1/vegf-2/vegf-3受体拮抗剂,诸如呋喹替尼;vegf-1/vegf-2受体调节剂,诸如hla-a2402/hla-a0201限制性表位肽疫苗;胎盘生长因子配体抑制剂/vegf-a配体抑制剂,诸如阿柏西普;syk酪氨酸激酶/jak酪氨酸激酶抑制剂,诸如asn-002;trk酪氨酸激酶受体抑制剂,诸如硫酸拉罗替尼;jak3/jak1/tbk1激酶抑制剂,诸如cs-12912;il-24拮抗剂,诸如ad-il24;nlrp3(nacht lrr pyd结构域蛋白3)调节剂,诸如bms-986299;rig-i激动剂,诸如rgt-100;气单胞菌溶素刺激剂,诸如topsalysin;p-糖蛋白1抑制剂,诸如hm-30181a;csf-1拮抗剂,诸如arry-382、blz-945;ccr8抑制剂,诸如jtx-1811、i-309、sb-649701、hg-1013、rap-310;抗间皮素抗体,诸如sel-403;胸苷激酶刺激剂,诸如
aglatimagene besadenovec;polo样激酶1抑制剂,诸如pcm-075、恩万塞替尼(onvansertib);nae抑制剂,诸如pevonedistat(mln-4924)、tas-4464;多向途径调节剂,诸如avadomide(cc-122);淀粉样蛋白结合蛋白-1抑制剂/泛素连接酶调节剂,诸如培迪司他(pevonedistat);foxm1抑制剂,诸如硫链丝菌肽;uba1抑制剂,诸如tak-243;src酪氨酸激酶抑制剂,诸如val-201;vdac/hk抑制剂,诸如vda-1102;elf4a抑制剂,诸如罗西替布(rohinitib)、eft226;tp53基因刺激剂,诸如ad-p53;视黄酸受体激动剂,诸如维甲酸;视黄酸受体α(rarα)抑制剂,诸如sy-1425;sirt3抑制剂,诸如yc8-02;基质细胞衍生因子1配体抑制剂,诸如olaptesed pegol(nox-a12);il-4受体调节剂,诸如mdna-55;精氨酸酶-i刺激剂,诸如pegzilarginase;拓扑异构酶i抑制剂,诸如盐酸伊立替康、onivyde;拓扑异构酶i抑制剂/低氧诱导因子-1α抑制剂,诸如peg-sn38(firtecan pegol);低氧诱导因子-1α抑制剂,诸如pt-2977、pt-2385;cd122(il-2受体)激动剂,诸如proleukin(阿地白介素、il-2);聚乙二醇化il-2(例如nktr-214);il-2的经修饰变体(例如thor-707);tlr7/tlr8激动剂,诸如nktr-262;tlr7激动剂,诸如ds-0509、gs-9620、lhc-165、tmx-101(咪喹莫特);p53肿瘤抑制蛋白刺激剂,诸如kevetrin;mdm4/mdm2 p53结合蛋白抑制剂,诸如alrn-6924;纺锤体驱动蛋白(ksp)抑制剂,诸如非那西布(filanesib)(arry-520);cd80-fc融合蛋白抑制剂,诸如fpt-155;menin和混合谱系白血病(mll)抑制剂,诸如ko-539;肝脏x受体激动剂,诸如rgx-104;il-10激动剂,诸如聚乙二醇化il-10(pegilodecakin)(am-0010);vegfr/pdgfr抑制剂,诸如伏罗尼布(vorolanib);irak4抑制剂,诸如ca-4948;抗tlr-2抗体,诸如opn-305;钙调蛋白调节剂,诸如cbp-501;
[0204]
糖皮质激素受体拮抗剂,诸如瑞拉可兰(relacorilant)(cort-125134);胱天蛋白酶的第二线粒体衍生活化剂(smac)蛋白抑制剂,诸如bi-891065;乳铁蛋白调节剂,诸如ltx-315;kit原癌基因受体酪氨酸激酶(kit)抑制剂,诸如plx-9486;血小板衍生生长因子受体α(pdgfra)/kit原癌基因受体酪氨酸激酶(kit)突变体特异性拮抗剂/抑制剂,诸如blu-285、dcc-2618;输出蛋白1抑制剂,诸如eltanexor;chst15基因抑制剂,诸如stnm-01;生长抑素受体拮抗剂,诸如ops-201;cebpa基因刺激剂,诸如mtl-501;dkk3基因调节剂,诸如mtg-201;趋化因子(cxcr1/cxcr2)抑制剂,诸如sx-682;p70s6k抑制剂,诸如msc2363318a;甲硫氨酸氨肽酶2(metap2)抑制剂,诸如m8891、apl-1202;精氨酸n-甲基转移酶5抑制剂,诸如gsk-3326595;cd71调节剂,诸如cx-2029(abbv-2029);atm(共济失调毛细血管扩张)抑制剂,诸如azd0156、azd1390;chk1抑制剂,诸如gdc-0575、ly2606368(普瑞沙替尼(prexasertib))、sra737、rg7741(chk1/2);cxcr4拮抗剂,诸如bl-8040、ly2510924、布利沙福(burixafor)(tg-0054)、x4p-002、x4p-001-io、普乐沙福;exh2抑制剂,诸如gsk2816126;kdm1抑制剂,诸如ory-1001、img-7289、incb-59872、gsk-2879552;cxcr2拮抗剂,诸如azd-5069;dna依赖性蛋白激酶抑制剂,诸如msc2490484a(尼迪西替布(nedisertib))、vx-984、asidna(dt-01);蛋白激酶c(pkc)抑制剂,诸如lxs-196、sotrastaurin;选择性雌激素受体下调因子(serd),诸如氟维司群rg6046、rg6047、rg6171、艾拉司群(rad-1901)、sar439859和azd9496;选择性雌激素受体共价拮抗剂(serca),诸如h3b-6545;选择性雄激素受体调节剂(sarm),诸如gtx-024、达罗他胺;转化生长因子-β(tgf-β)激酶拮抗剂,诸如加洛尼替布、ly3200882;wo 2019/103203中描述的tgf-β抑制剂;tgfβ受体1抑制剂,诸如pf-06952229;双特异性抗体,诸如abt-165
(dll4/vegf)、mm-141(igf-1/erbb3)、mm-111(erb2/erb3)、jnj-64052781(cd19/cd3)、prs-343(cd-137/her2)、afm26(bcma/cd16a)、jnj-61186372(egfr/cmet)、amg-211(cea/cd3)、rg7802(cea/cd3)、ery-974(cd3/gpc3)vancizumab(血管生成素/vegf)、pf-06671008(钙粘蛋白/cd3)、afm-13(cd16/cd30)、apvo436(cd123/cd3)、氟替珠单抗(cd123/cd3)、regn-1979(cd20/cd3)、mcla-117(cd3/clec12a)、mcla-128(her2/her3)、jnj-0819、jnj-7564(cd3/血红素)、amg-757(dll3-cd3)、mgd-013(pd-1/lag-3)、fs-118(lag-3/pd-l1)、mgd-019(pd-1/ctla-4)、kn-046(pd-1/ctla-4)、medi-5752(ctla-4/pd-1)、ro-7121661(pd-1/tim-3)、xmab-20717(pd-1/ctla-4)、ak-104(ctla-4/pd-1)、amg-420(bcma/cd3)、bi-836880(vefg/ang2)、jnj-63709178(cd123/cd3)、mgd-007(cd3/gpa33)、mgd-009(cd3/b7h3)、agen1223、imcgp100(cd3/gp100)、agen-1423、ator-1015(ctla-4/ox40)、ly-3415244(tim-3/pdl1)、inhibrx-105(4-1bb/pdl1)、法立昔单抗(faricimab)(vegf-a/ang-2)、fap-4-ibbl(4-1bb/fap)、xmab-13676(cd3/cd20)、tak-252(pd-1/ox40l)、tg-1801(cd19/cd47)、xmab-18087(sstr2/cd3)、卡妥索单抗(cd3/epcam)、sar-156597(il4/il13)、emb-01(egfr/cmet)、regn-4018(muc16/cd3)、regn-1979(cd20/cd3)、rg-7828(cd20/cd3)、cc-93269(cd3/bcma)、regn-5458(cd3/bcma)、纳维西单抗(navicixizumab)(dll4/vegf)、grb-1302(cd3/erbb2)、vanucizumab(vegf-a/ang-2)、grb-1342(cd38/cd3)、gem-333(cd3/cd33)、imm-0306(cd47/cd20)、rg6076、medi5752(pd-1/ctla-4)、ly3164530(met/egfr);α-酮戊二酸脱氢酶(kgdh)抑制剂,诸如cpi-613;xpo1抑制剂,诸如selinexor(kpt-330);异柠檬酸脱氢酶2(idh2)抑制剂,诸如伊那尼布(ag-221);idh1抑制剂,诸如ag-120和ag-881(idh1和idh2)、idh-305、bay-1436032;idh1基因抑制剂,诸如艾伏尼布;白介素-3受体(il-3r)调节剂,诸如sl-401;精氨酸脱亚氨酶刺激剂,诸如pegargiminase(adi-peg-20);封闭蛋白-18抑制剂,诸如克劳迪昔单抗(claudiximab);β-连环蛋白抑制剂,诸如cwp-291;趋化因子受体2(ccr)抑制剂,诸如pf-04136309、ccx-872、bms-813160(ccr2/ccr5);胸苷酸合酶抑制剂,诸如onx-0801;alk/ros1抑制剂,诸如洛拉替尼;端锚聚合酶抑制剂,诸如g007-lk;在骨髓细胞上表达的触发受体1(trem1;ncbi基因id:54210),诸如py159;在骨髓细胞上表达的触发受体2(trem2;ncbi基因id:54209),诸如py314;mdm2 p53结合蛋白抑制剂,诸如cmg-097、hdm-201;c-pim抑制剂,诸如pim447;鞘氨醇激酶-2(sk2)抑制剂,诸如(abc294640);dna聚合酶抑制剂,诸如沙帕他滨;细胞周期/微管抑制剂,诸如甲磺酸艾瑞布林;c-met抑制剂,诸如amg-337、赛沃替尼、替万替尼(arq-197)、卡马替尼和特泊替尼、abt-700、ag213、amg-208、jnj-38877618(omo-1)、美瑞替尼、hqp-8361;c-met/vegfr抑制剂,诸如bms-817378、tas-115;c-met/ron抑制剂,诸如bms-777607;bcr/abl抑制剂,诸如瑞巴司替尼、阿西替尼、帕纳替尼mnk1/mnk2抑制剂,诸如eft-508;细胞色素p45011b2/细胞色素p450 17/akt蛋白激酶抑制剂,诸如lae-201;细胞色素p450 3a4刺激剂,诸如米托坦;赖氨酸特异性脱甲基酶-1(lsd1)抑制剂,诸如cc-90011;csf1r/kit和flt3抑制剂,诸如培西达替尼(plx3397);flt3酪氨酸激酶/kit酪氨酸激酶抑制剂和pdgf受体拮抗剂,诸如奎扎替尼二盐酸盐;激酶抑制剂,诸如凡德他尼;e选择蛋白拮抗剂,诸如gmi-1271;分化诱导剂,诸如维甲酸;表皮生长因子受体(egfr)抑制剂,诸如奥希替尼(azd-9291)、西妥昔单抗;拓扑异构酶抑制剂,诸如阿霉素、多柔比星、柔红霉素、更生霉素、
daunoxome、caelyx、恩尼泊苷(eniposide)、表柔比星、依托泊苷、伊达比星、伊立替康、米托蒽醌、匹杉琼、索布佐生、拓扑替康、伊立替康、mm-398(脂质体伊立替康)、沃沙罗辛和gpx-150、阿多柔比星、ar-67、马维替尼(mavelertinib)、ast-2818、艾维替尼(avitinib)(acea-0010)、伊洛福芬(mgi-114);皮质类固醇,诸如可的松、地塞米松、氢化可的松、甲泼尼龙、泼尼松、泼尼松龙;生长因子信号转导激酶抑制剂;核苷类似物,诸如dfp-10917;axl抑制剂,诸如bgb-324(贝森替尼(bemcentinib))、slc-0211;axl/flt3抑制剂,诸如吉瑞替尼;溴区结构域和末端外基序(bet)蛋白的抑制剂,包括abbv-744、brd2(ncbi基因id:6046)、brd3(ncbi基因id:8019)、brd4(ncbi基因id:23476)和溴区结构域睾丸特异性蛋白(brdt;ncbi基因id:676),诸如incb-054329、incb057643、ten-010、azd-5153、abt-767、bms-986158、cc-90010、gsk525762(莫尼西布(molibresib))、nhwd-870、odm-207、gsk-2820151、gsk-1210151a、zbc246、zbc260、zen3694、ft-1101、rg-6146、cc-90010、cc-95775、米维西布(mivebresib)、bi-894999、plx-2853、plx-51107、cpi-0610、gs-5829;parp抑制剂,诸如奥拉帕尼(mk7339)、卢卡帕尼、维利帕尼、他拉唑帕尼、abt-767、bgb-290、氟唑帕利(shr-3162)、尼拉帕尼(jnj-64091742)、盐酸苯达莫司汀;parp/端锚聚合酶抑制剂,诸如2x-121(e-7499);imp-4297、sc-10914、idx-1197、hwh-340、ck-102、西米帕尼(simmiparib);蛋白酶体抑制剂,诸如伊沙佐米(ixazomib)卡非佐米(carfilzomib)马里佐米(marizomib)、硼替佐米;谷氨酰胺抑制剂,诸如cb-839(特拉格司他(telaglenastat))、双-2-(5-苯乙酰氨基-1,3,4-噻二唑-2-基)乙基硫醚(bptes);线粒体复合物i抑制剂,诸如二甲双胍、苯乙双胍;疫苗,诸如肽疫苗tg-01(ras)、gale-301、gale-302、nelipepimut-s、survaxm、dsp-7888、tpiv-200、pvx-410、vxl-100、dpx-e7、isa-101、6mhp、ose-2101、galinpepimut-s、svn53-67/m57-klh、imu-131、肽亚单位疫苗(急性淋巴母细胞性白血病,图宾根大学儿童医院(university children’s hospital tuebingen));细菌载体疫苗,诸如crs-207/gvax、axalimogene filolisbac(adxs11-001);腺病毒载体疫苗,诸如nadofaragene firadenovec;自体gp96疫苗;树突状细胞疫苗,诸如cvactm、tapuldencel-t、eltrapuldencel-t、sl-701、bsk01tm、rocapuldencel-t(ags-003)、dcvac、cvactm、stapuldencel-t、eltrapuldencel-t、sl-701、bsk01tm、adxs31-142、自体树突状细胞疫苗(转移性恶性黑素瘤,真皮内/静脉内,universitatsklinikum erlangen);溶瘤疫苗,诸如talimogene laherparepvec、pexastimogene devacirepvec、gl-onc1、mg1-ma3、细小病毒h-1、prostatak、enadenotucirev、mg1ma3、asn-002(tg-1042);治疗性疫苗,诸如cvac-301、cmp-001、creavax-bc、pf-06753512、vbi-1901、tg-4010、proscavax
tm
;肿瘤细胞疫苗,诸如(ind-14205)、oncoquest-l疫苗;活减毒的重组1型血清型脊髓灰质炎病毒疫苗,诸如pvs-ripo;adagloxad simolenin;medi-0457;dpv-001肿瘤来源的富含自噬体的癌症疫苗;rna疫苗,诸如cv-9209、lv-305;dna疫苗,诸如medi-0457、mvi-816、ino-5401;表达p53的经修饰的牛痘病毒ankara疫苗,诸如mva-p53;dpx-survivac;briavax
tm
;gi-6301;gi-6207;gi-4000;io-103;新抗原肽疫苗,诸如agen-2017、gen-010、neovax、rg-6180、gen-009、pgv-001(tlr-3激动剂)、granite-001、neo-pv-01;靶向热休克蛋白的肽疫苗,诸如phosphosynvax
tm
;vitespen(hsppc-96-c)、含aldoxorubicin的nant结肠直肠癌疫苗、自体肿瘤细胞疫苗 全身性cpg-b ifn-α(癌症)、io-120 io-103
(pd-l1/pd-l2疫苗)、hb-201、hb-202、hb-301、基于*的疫苗;tlr-3激动剂/干扰素诱导剂,诸如poly-iclc(nsc-301463);stat-3抑制剂,诸如那巴布卡星(bbi-608);atp酶p97抑制剂,诸如cb-5083;平滑(smo)受体抑制剂,诸如(索尼吉布(sonidegib),以前称为lde-225)、leq506、维斯莫吉布(vismodegib)(gdc-0449)、bms-833923、格拉吉布(glasdegib)(pf-04449913)、ly2940680和依曲康唑;干扰素α配体调节剂,诸如干扰素α-2b、干扰素α-2a生物仿制药(biogenomics)、ropeg干扰素α-2b(aop-2014、p-1101、peg ifnα-2b)、multiferon(alfanative,viragen)、干扰素α1b、roferon-a(canferon,ro-25-3036)、干扰素α-2a后续生物制剂(biosidus)(inmutag,inter 2a)、干扰素α-2b后续生物制剂(biosidus-bioferon,citopheron,ganapar,beijing kawin technology
–
kaferon)、alfaferone、聚乙二醇化干扰素α-1b、聚乙二醇化干扰素α-2b后续生物制剂(amega)、重组人干扰素α-1b、重组人干扰素α-2a、重组人干扰素α-2b、维妥珠单抗-ifnα2b偶联物、dynavax(sd-101)和干扰素α-n1(humoferon,sm-10500,sumiferon);干扰素γ配体调节剂,诸如干扰素γ(oh-6000、oγ100);端粒酶调节剂,诸如特莫肽(tertomotide)(gv-1001,hr-2802,riavax)和伊美司他(grn-163,jnj-63935937);dna甲基转移酶抑制剂,诸如替莫唑胺(ccrg-81045)、地西他滨、瓜地他滨(s-110,sgi-110)、krx-0402、rx-3117、rrx-001和氮杂胞苷(cc-486);dna旋转酶抑制剂,诸如匹杉琼和索布佐生;dna旋转酶抑制剂/拓扑异构酶ii抑制剂,诸如氨柔比星;bcl-2家族蛋白抑制剂,诸如abt-263、维奈托克(abt-199)、abt-737、rg7601和at-101;bcl-2/bcl-xl抑制剂,诸如纳维托克;notch抑制剂,诸如ly3039478(克雷尼加司他(crenigacestat))、塔曲单抗(tarextumab)(抗notch2/3)、bms-906024;透明质酸酶刺激剂,诸如pegph-20;erbb2酪氨酸激酶受体抑制剂/透明质酸酶刺激剂,诸如herceptin hylecta;wnt途径抑制剂,诸如sm-04755、pri-724、wnt-974;γ-分泌酶抑制剂,诸如pf-03084014、mk-0752、ro-4929097;grb-2(生长因子受体结合蛋白-2)抑制剂,诸如bp1001;trail途径诱导化合物,诸如onc201、abbv-621;trail调节剂,诸如scb-313;粘着斑激酶抑制剂,诸如vs-4718、地法替尼、gsk2256098;刺猬蛋白抑制剂,诸如萨瑞德吉布(saridegib)、索尼吉布(lde225)、格拉吉布;aurora激酶抑制剂,诸如阿立塞替(mln-8237)和azd-2811、amg-900、巴拉塞替、enmd-2076;hspb1调节剂(热休克蛋白27,hsp27),诸如溴夫定、阿帕托森(apatorsen);atr抑制剂,诸如bay-937、azd6738、azd6783、vx-803、vx-970(柏唑色替)和vx-970;hsp90抑制剂,诸如auy922、奥奈司匹布(onalespib)(at13387)、snx-2112、snx5422;鼠双微体(mdm2)癌基因抑制剂,诸如ds-3032b、rg7775、amg-232、hdm201和伊达萨努林(idasanutlin)(rg7388);cd137激动剂,诸如乌拉单抗(urelumab)、乌托鲁单抗(utomilumab)(pf-05082566)、agen2373、adg-106、bt-7480、ql1806;sting激动剂,诸如adu-s100(miw-815)、sb-11285、mk-1454、sr-8291、advca0848、gsk-532、syn-sting、msa-1、sr-8291、gsk3745417;fgfr抑制剂,诸如fgf-401、incb-054828、bay-1163877、azd4547、jnj-42756493、ly2874455、debio-1347;脂肪酸合酶(fasn)抑制剂,诸如tvb-2640;cd44结合剂,诸如a6;蛋白磷酸酶2a(pp2a)抑制剂,诸如lb-100;cyp17抑制剂,诸如seviteronel(vt-464)、asn-001、odm-204、cfg920、乙酸阿比特龙;rxr激动剂,诸如irx4204;刺猬蛋白/平滑(hh/smo)拮抗剂,诸如塔拉吉布(taladegib)、帕替吉布(patidegib)、维莫德吉(vismodegib);补体c3调节剂,诸如imprime pgg;il-15激动剂,诸如alt-803、nktr-255、白
介素-15/fc融合蛋白、am-0015、niz-985和hetil-15;ezh2(zeste基因增强子同源物2)抑制剂,诸如他泽司他(tazemetostat)、cpi-1205、gsk-2816126、pf-06821497;溶瘤病毒,诸如pelareorep、cg-0070、mv-nis疗法、hsv-1716、ds-1647、vcn-01、oncos-102、tbi-1401、tasadenoturev(dnx-2401)、vocimagene amiretrorepvec、rp-1、cva21、celyvir、load-703、obp-301、dot1l(组蛋白甲基转移酶)抑制剂,诸如匹诺司他(epz-5676);毒素,诸如霍乱毒素、蓖麻毒素、假单胞菌外毒素、百日咳博德特氏杆菌(bordetella pertussis)腺苷酸环化酶毒素、白喉毒素和胱天蛋白酶活化剂;dna质粒,诸如bc-819;plk 1、2和3的plk抑制剂,诸如伏拉塞替(volasertib)(plk1);wee1抑制剂,诸如azd-1775(阿达色替(adavosertib));rho激酶(rock)抑制剂,诸如at13148、kd025;凋亡抑制蛋白(iap)抑制剂,诸如astx660、debio-1143、比瑞那帕、apg-1387、lcl-161;rna聚合酶抑制剂,诸如鲁比卡丁(pm-1183)、cx-5461;微管蛋白抑制剂,诸如pm-184、bal-101553(利沙万布林(lisavanbulin))和oxi-4503、氟莱哌素(fluorapacin)(ac-0001)、普那布林(plinabulin)、长春氟宁;toll样受体4(tlr-4)激动剂,诸如g100、gsk1795091和pepa-10;延长因子1α2抑制剂,诸如普利替普辛(plitidepsin);延伸因子2抑制剂/白介素-2配体/nad adp核糖基转移酶刺激剂,诸如地尼白介素-毒素连接物(denileukin diftitox);cd95抑制剂,诸如apg-101、apo-010、阿苏赛普(asunercept);wt1抑制剂,诸如dsp-7888;剪接因子3b亚基1(sf3b1)抑制剂,诸如h3b-8800;类视色素z受体γ(rorγ)激动剂,诸如lyc-55716;和微生物组调节剂,诸如ser-401、edp-1503、mrx-0518。
[0205]
在一些实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种附加治疗剂共同施用,所述附加治疗剂包括以下物质的抑制剂或拮抗剂:骨髓细胞白血病序列1(mcl1)细胞凋亡调节因子(ncbi基因id:4170);丝裂原活化蛋白激酶1(map4k1)(也称为造血祖细胞激酶1(hpk1),ncbi基因id:11184);二酰基甘油激酶α(dgka、dagk、dagk1或dgk-α;ncbi基因id:1606);5'-胞外核苷酸酶(nt5e或cd73;ncbi基因id:4907);胞外核苷酸三磷酸盐二磷酸水解酶1(entpd1或cd39;ncbi基因id:593);转化生长因子β1(tgfb1或tgfβ;ncbi基因id:7040);血红素加氧酶1(hmox1、ho-1或ho1;ncbi基因id:3162);血红素加氧酶2(hmox2、ho-2或ho2;ncbi基因id:3163);血管内皮生长因子a(vegfa或vegf;ncbi基因id:7422);erb-b2受体酪氨酸激酶2(erbb2、her2、her2/neu或cd340;ncbi基因id:2064)、表皮生长因子受体(egfr、erbb、erbb1或her1;ncbi基因id:1956);alk受体酪氨酸激酶(alk、cd246;ncbi基因id:238);聚(adp-核糖)聚合酶1(parp1;ncbi基因id:142);聚(adp-核糖)聚合酶2(parp2;ncbi基因id:10038);tcdd诱导型聚(adp-核糖)聚合酶(tiparp、parp7;ncbi基因id:25976);细胞周期素依赖性激酶4(cdk4;ncbi基因id:1019);细胞周期素依赖性激酶6(cdk6;ncbi基因id:1021);tnf受体超家族成员14(tnfrsf14、hvem、cd270;ncbi基因id:8764);具有ig和itim结构域的t细胞免疫受体(tigit;ncbi基因id:201633);x连锁的细胞凋亡抑制剂(xiap、birc4、iap-3;ncbi基因id:331);含杆状病毒iap重复序列的2(birc2、ciap1;ncbi基因id:329);含杆状病毒iap重复序列的3(birc3、ciap2;ncbi基因id:330);含杆状病毒iap重复序列的5(birc5、生存素;ncbi基因id:332);c-c基序趋化因子受体2(ccr2、cd192;ncbi基因id:729230);c-c基序趋化因子受体5(ccr5、cd195;ncbi基因id:1234);c-c基序趋化因子受体8(ccr8、cdw198;ncbi基因id:1237);c-x-c基序趋化因子受体2(cxcr2、cd182;ncbi基因id:3579);c-x-c基序趋化因子受体3(cxcr3、cd182、cd183;ncbi
基因id:2833);c-x-c基序趋化因子受体4((cxcr4、cd184;ncbi基因id:7852);精氨酸酶(arg1(ncbi基因id:383)、arg2(ncbi基因id:384))、碳酸酐酶(ca1(ncbi基因id:759)、ca2(ncbi基因id:760)、ca3(ncbi基因id:761)、ca4(ncbi基因id:762)、ca5a(ncbi基因id:763)、ca5b(ncbi基因id:11238)、ca6(ncbi基因id:765)、ca7(ncbi基因id:766)、ca8(ncbi基因id:767)、ca9(ncbi基因id:768)、ca10(ncbi基因id:56934)、ca11(ncbi基因id:770)、ca12(ncbi基因id:771)、ca13(ncbi基因id:377677)、ca14(ncbi基因id:23632))、前列腺素-内过氧化物合酶1(ptgs1、cox-1;ncbi基因id:5742)、前列腺素-内过氧化物合酶2(ptgs2、cox-2;ncbi基因id:5743)、分泌型磷脂酶a2、前列腺素e合酶(ptges、pges;基因id:9536)、花生四烯酸5-脂氧合酶(alox5、5-lox;ncbi基因id:240)和/或可溶性环氧化物水解酶2(ephx2、seh;ncbi基因id:2053);分泌型磷脂酶a2(例如,pla2g1b(ncbi基因id:5319);pla2g7(ncbi基因id:7941)、pla2g3(ncbi基因id:50487)、pla2g2a(ncbi基因id:5320);pla2g4a(ncbi基因id:5321);pla2g12a(ncbi基因id:81579);pla2g12b(ncbi基因id:84647);pla2g10(ncbi基因id:8399);pla2g5(ncbi基因id:5322);pla2g2d(ncbi基因id:26279);pla2g15(ncbi基因id:23659));吲哚胺2,3-双加氧酶1(ido1;ncbi基因id:3620);吲哚胺2,3-双加氧酶2(ido2;ncbi基因id:169355);低氧诱导因子1亚基α(hif1a;ncbi基因id:3091);血管生成素1(angpt1;ncbi基因id:284);内皮tek酪氨酸激酶(tie-2、tek、cd202b;ncbi基因id:7010);janus激酶1(jak1;ncbi基因id:3716);连环蛋白β1(ctnnb1;ncbi基因id:1499);组蛋白脱乙酰酶9(hdac9;ncbi基因id:9734),和/或5'-3’外切核糖核酸酶1(xrn1;ncbi基因id:54464)。
[0206]
在各种实施方案中,适用于治疗血液恶性肿瘤的附加药剂(诸如小分子、抗体、过继性细胞疗法和嵌合抗原受体t细胞(car-t)、检查点抑制剂和疫苗)可以与如本文所述的抗cd47剂和抗cd20剂组合施用。
[0207]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与fms相关受体酪氨酸激酶3(flt3);flk2;stk1;cd135;flk-2;ncbi基因id:2322)的激动剂组合。flt3激动剂的示例包括但不限于cdx-301和gs-3583。
[0208]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗cd19剂或抗体组合。可以共同施用的抗cd19剂或抗体的示例包括但不限于:mor00208、xmab5574(xencor)、afm-11、英比利珠单抗(inebilizumab)、medi 551(cellective therapeutics);mdx-1342(medarexand)和博纳吐单抗(amgen)。
[0209]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗cd22剂或抗体组合。可以共同施用的抗cd22剂或抗体的示例包括但不限于:依帕珠单抗、amg-412、immu-103(immunomedics)。
[0210]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗cd30剂或抗体组合。可以共同施用的抗cd30剂或抗体的示例包括但不限于:维布妥昔单抗(seattle genetics)。
[0211]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗cd33剂或抗体组合。可以共同施用的抗cd33剂或抗体的示例包括但不限于:cik-car.cd33;cd33cart、amg-330(cd33/cd3)、amg-673(cd33/cd3)、gem-333(cd3/cd33)和imgn-779。
[0212]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗cd37剂或抗体组
pharmaceuticals)。
[0237]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗cd44剂或抗体组合。可以共同施用的抗cd44剂或抗体的示例包括但不限于:rg7356、ro5429083(chugai biopharmaceuticals;roche)。
[0238]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗vla-4(cd49d)剂或抗体组合。可以共同施用的抗vla-4剂或抗体的示例包括但不限于:那他珠单抗、bg-0002-e(tysabri/elan corporation)。
[0239]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗icam-1(cd54)剂或抗体组合。可以共同施用的抗icam-1剂或抗体的示例包括但不限于:bi-505(bioinvent international)。
[0240]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗vegf-a剂或抗体组合。可以共同施用的抗vegf-a剂或抗体的示例包括但不限于:贝伐珠单抗(avastin/genentech;哈肯萨克大学医学中心(hackensack university medical center))。
[0241]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗内皮唾液酸蛋白(cd248,tem1)剂或抗体组合。可以共同施用的抗内皮唾液酸蛋白剂或抗体的示例包括但不限于:翁特珠单抗(ontecizumab)、morab-004(路德维格癌症研究所;morphotek)。
[0242]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗cd79剂或抗体组合。可以共同施用的抗cd79剂或抗体的示例包括但不限于:泊洛妥珠单抗、dcds4501a、rg7596(genentech)。
[0243]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗异柠檬酸脱氢酶(idh)剂或抗体组合。可以共同施用的抗idh剂或抗体的示例包括但不限于:idh1抑制剂依维替尼(tibsovo;agios)和idh2抑制剂恩西地平(idhifa;celgene/agios)。
[0244]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与靶向肿瘤相关钙信号转导子2(tacstd2)(ncbi基因id:4070;egp-1、egp1、ga733-1、ga7331、gp50、m1s1、trop2)的抗体(诸如赛妥珠单抗)组合。
[0245]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗主要组织相容性复合体i、g类(hla-g;ncbi基因id:3135)抗体(诸如ttx-080)组合。
[0246]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗白细胞免疫球蛋白样受体b2(lilrb2,又名cd85d,ilt4;ncbi基因id:10288)抗体(诸如jtx-8064或mk-4830)组合。
[0247]
tnf受体超家族(tnfrsf)成员激动剂或激活剂
[0248]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种tnf受体超家族(tnfrsf)成员的激动剂组合,所述激动剂例如以下中的一者或多者的激动剂:tnfrsf1a(ncbi基因id:7132)、tnfrsf1b(ncbi基因id:7133)、tnfrsf4(ox40、cd134;ncbi基因id:7293)、tnfrsf5(cd40;ncbi基因id:958)、tnfrsf6(fas,ncbi基因id:355)、tnfrsf7(cd27,ncbi基因id:939)、tnfrsf8(cd30,ncbi基因id:943)、tnfrsf9(4-1bb、cd137,ncbi基因id:3604)、tnfrsf10a(cd261、dr4、trailr1,ncbi基因id:8797)、tnfrsf10b(cd262、dr5、trailr2,ncbi基因id:8795)、tnfrsf10c(cd263、trailr3,ncbi基因id:8794)、tnfrsf10d(cd264、trailr4,ncbi基因id:8793)、tnfrsf11a(cd265、rank,ncbi基因id:8792)、
tnfrsf11b(ncbi基因id:4982)、tnfrsf12a(cd266,ncbi基因id:51330)、tnfrsf13b(cd267,ncbi基因id:23495)、tnfrsf13c(cd268,ncbi基因id:115650)、tnfrsf16(ngfr、cd271,ncbi基因id:4804)、tnfrsf17(bcma、cd269,ncbi基因id:608)、tnfrsf18(gitr、cd357,ncbi基因id:8784)、tnfrsf19(ncbi基因id:55504)、tnfrsf21(cd358、dr6,ncbi基因id:27242)和tnfrsf25(dr3,ncbi基因id:8718)。
[0249]
可以共同施用的抗tnfrsf4(ox40)抗体的示例包括但不限于medi6469、medi6383、medi0562(他沃立珠单抗)、moxr0916、pf-04518600、rg-7888、gsk-3174998、incagn1949、bms-986178、gbr-8383、abbv-368,以及wo2016179517、wo2017096179、wo2017096182、wo2017096281和wo2018089628中所述的那些,这些专利中的每一者据此全文以引用方式并入本文。
[0250]
可以共同施用的抗tnf受体超家族成员10b(tnfrsf10b、dr5、trailr2)抗体的示例包括但不限于:诸如ds-8273、ctb-006、inbrx-109和gen-1029。
[0251]
可以共同施用的抗tnfrsf5(cd40)抗体的示例包括但不限于:塞鲁单抗(ro7009789)、米他利单抗(mitazalimab)(又名vanalimab)、adc-1013、jnj-64457107、rg7876、sea-cd40、apx-005m和abbv-428、abbv-927和jnj-64457107。
[0252]
可以共同施用的抗tnfrsf7(cd27)的示例包括但不限于伐立鲁单抗(cdx-1127)。
[0253]
可以共同施用的抗tnfrsf9(4-1bb、cd137)抗体的示例包括但不限于:乌瑞鲁单抗、乌托鲁单抗(pf-05082566)、agen2373、adg-106、bt-7480和ql1806。
[0254]
可以共同施用的抗tnfrsf17(bcma)的示例包括但不限于gsk-2857916。
[0255]
可以共同施用的抗tnfrsf18(gitr)抗体的示例包括但不限于:medi1873、fpa-154、incagn-1876、trx-518、bms-986156、mk-1248、gwn-323,以及wo2017096179、wo2017096276、wo2017096189和wo2018089628中所述的那些。在一些实施方案中,共同施用共同靶向tnfrsf4(ox40)和tnfrsf18(gitr)的抗体或其片段。此类抗体描述于例如wo2017096179和wo2018089628中,这些专利中的每一者据此全文以引用方式并入本文。
[0256]
可以共同施用的抗trailr1抗体、抗trailr2抗体、抗trailr3抗体、抗trailr4抗体的示例包括但不限于abbv-621。
[0257]
可以共同施用的靶向tnfrsf家族成员的双特异性抗体的示例包括但不限于:prs-343(cd-137/her2)、afm26(bcma/cd16a)、afm-13(cd16/cd30)、regn-1979(cd20/cd3)、amg-420(bcma/cd3)、inhibrx-105(4-1bb/pdl1)、fap-4-ibbl(4-1bb/fap)、xmab-13676(cd3/cd20)、rg-7828(cd20/cd3)、cc-93269(cd3/bcma)、regn-5458(cd3/bcma)、imm-0306(cd47/cd20)和amg-424(cd38.cd3)。
[0258]
可以共同施用的含pvr相关免疫球蛋白结构域(pvrig、cd112r)的抑制剂的示例包括但不限于:com-701。
[0259]
可以共同施用的具有ig和itim结构域的t细胞免疫受体(tigit;ncbi基因id:201633)的抑制剂的示例包括但不限于:bms-986207、rg-6058、agen-1307、com-902、艾替吉单抗(etigilimab)、替瑞利尤单抗(又名mtig-7192a;rg-6058;ro 7092284)、agen1777、ibi-939、ab154、mg1131和eos884448(eos-448)。
[0260]
可以共同施用的甲型肝炎病毒细胞受体2(havcr2、timd3、tim-3)的抑制剂的示例包括但不限于:tsr-022、ly-3321367、mbg-453、incagn-2390、ro-7121661(pd-1/tim-3)、
ly-3415244(tim-3/pdl1)和rg7769(pd-1/tim-3)。
[0261]
可以共同施用的淋巴细胞活化3(lag-3、cd223)的抑制剂的示例包括但不限于:瑞拉特利单抗(relatlimab)(ono-4482)、lag-525、mk-4280、regn-3767、incagn2385、tsr-033、mgd-013(pd-1/lag-3)和fs-118(lag-3/pd-l1)。
[0262]
抗杀伤细胞免疫球蛋白样受体、三个ig结构域和长胞质尾1(kir3dl1;kir;ncbi基因id:3811)单克隆抗体的示例,诸如利瑞鲁单抗(lirilumab)(iph-2102)和iph-4102。
[0263]
可以共同施用的抗nkg2a抗体的示例包括但不限于:莫那利珠单抗。
[0264]
可以共同施用的抗v-set免疫调节受体(vsir、b7h5、vista)抗体的示例包括但不限于:hmbd-002和ca-170(pd-l1/vista)。
[0265]
可以共同施用的抗cd70抗体的示例包括但不限于:amg-172。
[0266]
可以共同施用的抗icos抗体的示例包括但不限于:jtx-2011、gsk3359609。
[0267]
可以共同施用的icos激动剂的示例包括但不限于:icos-l.comp(gariepy,j.等人,第106届美国免疫学家协会年会(aai)(2019年5月9日至13日,san diego),摘要71.5)。
[0268]
免疫检查点抑制剂
[0269]
在一些实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种免疫检查点抑制剂组合。在一些实施方案中,一种或多种免疫检查点抑制剂为pd-l1(cd274)、pd-1(pdcd1)或ctla4的蛋白质类(例如,抗体或其片段,或者抗体模拟物)抑制剂。在一些实施方案中,一种或多种免疫检查点抑制剂包括pd-l1(cd274)、pd-1(pdcd1)或ctla4的有机小分子抑制剂。
[0270]
可以共同施用的ctla4抑制剂的示例包括但不限于:伊匹单抗、曲美木单抗、bms-986218、agen1181、agen1884、bms-986249、mk-1308、regn-4659、adu-1604、cs-1002、bcd-145、apl-509、js-007、ba-3071、onc-392、agen-2041、jhl-1155、kn-044、cg-0161、ator-1144、pbi-5d3h5、bpi-002、hbm-4003,以及多特异性抑制剂fpt-155(ctla4/pd-l1/cd28)、pf-06936308(pd-1/ctla4)、mgd-019(pd-1/ctla4)、kn-046(pd-1/ctla4)、medi-5752(ctla4/pd-1)、xmab-20717(pd-1/ctla4)和ak-104(ctla4/pd-1)。
[0271]
可以共同施用的pd-l1(cd274)或pd-1(pdcd1)的抑制剂/抗体的示例包括但不限于:派姆单抗、纳武单抗、西米普利单抗、匹地利珠单抗、amg-404、amp-224、medi0680(amp-514)、斯巴达珠单抗、阿特珠单抗、阿维鲁单抗、度伐利尤单抗、bms-936559、ck-301、pf-06801591、bgb-a317(替雷利珠单抗)、gen-1046(pd-l1/4-1bb)、gls-010(wbp-3055)、ak-103(hx-008)、ak-105、cs-1003、hlx-10、mga-012、bi-754091、agen-2034、js-001(特瑞普利单抗)、jnj-63723283、杰诺单抗(cbt-501)、lzm-009、bcd-100、ly-3300054、shr-1201、shr-1210(卡瑞利珠单抗)、sym-021、abbv-181、pd1-pik、bat-1306(msb0010718c)、cx-072、cbt-502、tsr-042(多塔利单抗)、msb-2311、jtx-4014、bgb-a333、shr-1316、cs-1001(wbp-3155、kn-035、ibi-308(信迪利单抗)、hlx-20、kl-a167、sti-a1014、sti-a1015(imc-001)、bcd-135、faz-053、tqb-2450、mdx1105-01、gs-4224、gs-4416、incb086550、max10181,以及多特异性抑制剂fpt-155(ctla4/pd-l1/cd28)、pf-06936308(pd-1/ctla4)、mgd-013(pd-1/lag-3)、ro-7247669(pd-1/lag-3)、fs-118(lag-3/pd-l1)、mgd-019(pd-1/ctla4)、kn-046(pd-1/ctla4)、medi-5752(ctla4/pd-1)、ro-7121661(pd-1/tim-3)、xmab-20717(pd-1/ctla4)、ak-104(ctla4/pd-1)、m7824(pd-l1/tgfβ-ec结构域)、ca-170(pd-l1/vista)、cdx-527
9688、vtx-1463、vtx-763、3m-051、3m-052,以及us20140045849(janssen)、us20140073642(janssen)、wo2014/056953(janssen)、wo2014/076221(janssen)、wo2014/128189(janssen)、us20140350031(janssen)、wo2014/023813(janssen)、us20080234251(array biopharma)、us20080306050(array biopharma)、us20100029585(ventirx pharma)、us20110092485(ventirx pharma)、us20110118235(ventirx pharma)、us20120082658(ventirx pharma)、us20120219615(ventirx pharma)、us20140066432(ventirx pharma)、us20140088085(ventirx pharma)、us20140275167(novira therapeutics)和us20130251673(novira therapeutics)中所公开的化合物。可以共同施用的示例tlr9激动剂包括但不限于ast-008、cmp-001、imo-2055、imo-2125、利尼莫特(litenimod)、mgn-1601、bb-001、bb-006、imo-3100、imo-8400、ir-103、imo-9200、阿格托莫特(agatolimod)、dims-9054、dv-1079、dv-1179、azd-1419、来非莫特(leftolimod)(mgn-1703)、cyt-003、cyt-003-qbg10和pul-042。tlr3激动剂的示例包括雷他莫德、聚iclc、apoxxim、iph-33、mct-465、mct-475和nd-1.1。
[0275]
tlr8抑制剂的示例包括但不限于e-6887、imo-8400、imo-9200和vtx-763。
[0276]
tlr8激动剂的示例包括但不限于mct-465、莫托莫德、gs-9688和vtx-1463。
[0277]
tlr9抑制剂的示例包括但不限于ast-008、imo-2055、imo-2125、来菲特莫德(lefitolimod)、利泰莫德、mgn-1601和pul-042。
[0278]
tlr7/tlr8激动剂的示例,诸如nktr-262、imo-4200、medi-9197(替拉莫德)、瑞喹莫德;
[0279]
tlr激动剂的示例包括但不限于:来菲特莫德、替索托莫德(tilsotolimod)、雷他莫德、dsp-0509、al-034、g-100、可比托莫德(cobitolimod)、ast-008、莫托莫德、gsk-1795091、gsk-2245035、vtx-1463、gs-9688、lhc-165、bdb-001、rg-7854、替拉莫德。
[0280]
在一些实施方案中,该治疗剂是干扰素基因(sting)的刺激剂。在一些实施方案中,sting受体激动剂或活化剂选自由以下项组成的组:adu-s100(miw-815)、sb-11285、mk-1454、sr-8291、advca0848、gsk-532、syn-sting、msa-1、sr-8291、5,6-二甲基呫吨酮-4-醋酸(dmxaa)、环状gamp(cgamp)和环状二amp。
[0281]
tcr信号传导调节剂
[0282]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与t细胞受体(tcr)信号传导调节剂的一种或多种激动剂或拮抗剂组合。t细胞通过tcr活化对于胸腺细胞发育和效应t细胞功能是必需的。tcr活化促进信号传导级联反应,其通过调节细胞因子产生、细胞存活、增殖和分化最终决定细胞的命运。tcr信号传导调节剂的示例包括但不限于:cd2(分化簇2、lfa-2、t11、lfa-3受体)、cd3(分化簇3)、cd4(分化簇4)、cd8(分化簇8)、cd28(分化簇28)、cd45(ptprc、b220、gp180)、lat(用于活化t细胞的接头,lat1)、lck、lfa-1(itgb2、cd18、lad、lcamb)、src、zap-70、slp-76、dgkα、cbl-b、cish、hpk1。可以共同施用的分化簇3(cd3)的激动剂的示例包括但不限于mgd015。
[0283]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抑制性免疫检查点蛋白或受体的一种或多种阻断剂或抑制剂以及/或者与一种或多种刺激性免疫检查点蛋白或受体的一种或多种刺激剂、活化剂或激动剂组合。抑制性免疫检查点的阻断或抑制可以
正向调节t细胞或nk细胞活化并防止肿瘤微环境内癌细胞的免疫逃逸。刺激性免疫检查点的活化或刺激可以增强免疫检查点抑制剂在癌症治疗中的效果。在各种实施方案中,免疫检查点蛋白或受体调节t细胞应答(例如,在xu等人,j exp clin cancer res.(2018)37:110中综述)。在各种实施方案中,免疫检查点蛋白或受体调节nk细胞应答(例如,在davis等人,semin immunol.(2017)31:64
–
75以及chiossone等人,nat rev immunol.(2018)18(11):671-688)。
[0284]
免疫检查点蛋白或受体的示例包括但不限于cd27、cd70;cd40、cd40lg;cd47、cd48(slamf2)、含跨膜和免疫球蛋白结构域的2(tmigd2、cd28h)、cd84(ly9b、slamf5)、cd96、cd160、ms4a1(cd20)、cd244(slamf4);cd276(b7h3);含v-set结构域的t细胞活化抑制剂1(vtcn1、b7h4);v-set免疫调节受体(vsir、b7h5、vista);免疫球蛋白超家族成员11(igsf11、vsig3);自然杀伤细胞细胞毒性受体3配体1(ncr3lg1、b7h6);herv-h ltr相关2(hhla2、b7h7);诱导型t细胞共刺激因子(icos、cd278);诱导型t细胞共刺激因子配体(icoslg、b7h2);tnf受体超家族成员4(tnfrsf4、ox40);tnf超家族成员4(tnfsf4、ox40l);tnfrsf8(cd30)、tnfsf8(cd30l);tnfrsf10a(cd261、dr4、trailr1)、tnfrsf9(cd137)、tnfsf9(cd137l);tnfrsf10b(cd262、dr5、trailr2)、tnfrsf10(trail);tnfrsf14(hvem、cd270)、tnfsf14(hveml);cd272(b和t淋巴细胞相关(btla));tnfrsf17(bcma、cd269)、tnfsf13b(baff);tnfrsf18(gitr)、tnfsf18(gitrl);mhc i类多肽相关序列a(mica);mhc i类多肽相关序列b(micb);cd274(pdl1、pd-l1);程序性细胞死亡1(pdcd1、pd-1、pd-1);细胞毒性t淋巴细胞相关蛋白4(ctla4、cd152);cd80(b7-1)、cd28;nectin细胞粘附分子2(nectin2、cd112);cd226(dnam-1);脊髓灰质炎病毒受体(pvr)细胞粘附分子(pvr、cd155);具有ig和itim结构域的t细胞免疫受体(tigit);含t细胞免疫球蛋白和粘蛋白结构域4(timd4;tim4);甲型肝炎病毒细胞受体2(havcr2、timd3、tim-3);半乳凝素9(lgals9);淋巴细胞活化3(lag-3、cd223);信号转导淋巴细胞活化分子家族成员1(slamf1、slam、cd150);淋巴细胞抗原9(ly9、cd229、slamf3);slam家族成员6(slamf6、cd352);slam家族成员7(slamf7、cd319);ul16结合蛋白1(ulbp1);ul16结合蛋白2(ulbp2);ul16结合蛋白3(ulbp3);视黄酸早期转录物1e(raet1e;ulbp4);视黄酸早期转录物1g(raet1g;ulbp5);视黄酸早期转录物1l(raet1l;ulbp6);淋巴细胞活化3(cd223);杀伤细胞免疫球蛋白样受体(kir);杀伤细胞凝集素样受体c1(klrc1、nkg2a、cd159a);杀伤细胞凝集素样受体k1(klrk1、nkg2d、cd314);杀伤细胞凝集素样受体c2(klrc2、cd159c、nkg2c);杀伤细胞凝集素样受体c3(klrc3、nkg2e);杀伤细胞凝集素样受体c4(klrc4、nkg2f);杀伤细胞免疫球蛋白样受体、两个ig结构域和长胞质尾1(kir2dl1);杀伤细胞免疫球蛋白样受体、两个ig结构域和长胞质尾2(kir2dl2);杀伤细胞免疫球蛋白样受体、两个ig结构域和长胞质尾3(kir2dl3);杀伤细胞免疫球蛋白样受体、三个ig结构域和长胞质尾1(kir3dl1);杀伤细胞凝集素样受体d1(klrd1)。
[0285]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种t细胞抑制性免疫检查点蛋白或受体的一种或多种阻断剂或抑制剂组合。说明性t细胞抑制性免疫检查点蛋白或受体包括但不限于cd274(pdl1、pd-l1);程序性细胞死亡1配体2(pdcd1lg2、pd-l2、cd273);程序性细胞死亡1(pdcd1、pd1、pd-1);细胞毒性t淋巴细胞相关蛋白4(ctla4、cd152);cd276(b7h3);含v-set结构域的t细胞活化抑制剂1(vtcn1、b7h4);v-set免
疫调节受体(vsir、b7h5、vista);免疫球蛋白超家族成员11(igsf11、vsig3);tnfrsf14(hvem、cd270)、tnfsf14(hveml);cd272(b和t淋巴细胞相关(btla));含pvr相关免疫球蛋白结构域(pvrig、cd112r);具有ig和itim结构域的t细胞免疫受体(tigit);淋巴细胞活化3(lag-3、cd223);甲型肝炎病毒细胞受体2(havcr2、timd3、tim-3);半乳凝素9(lgals9);杀伤细胞免疫球蛋白样受体(kir);杀伤细胞免疫球蛋白样受体、两个ig结构域和长胞质尾1(kir2dl1);杀伤细胞免疫球蛋白样受体、两个ig结构域和长胞质尾2(kir2dl2);杀伤细胞免疫球蛋白样受体、两个ig结构域和长胞质尾3(kir2dl3);以及杀伤细胞免疫球蛋白样受体、三个ig结构域和长胞质尾1(kir3dl1)。在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种t细胞刺激性免疫检查点蛋白或受体的一种或多种激动剂或活化剂组合。例示性t细胞刺激性免疫检查点蛋白或受体包括但不限于cd27、cd70;cd40、cd40lg;诱导型t细胞共刺激因子(icos、cd278);诱导型t细胞共刺激因子配体(icoslg、b7h2);tnf受体超家族成员4(tnfrsf4、ox40);tnf超家族成员4(tnfsf4、ox40l);tnfrsf9(cd137)、tnfsf9(cd137l);tnfrsf18(gitr)、tnfsf18(gitrl);cd80(b7-1)、cd28;nectin细胞粘附分子2(nectin2、cd112);cd226(dnam-1);cd244(2b4、slamf4)、脊髓灰质炎病毒受体(pvr)细胞粘附分子(pvr、cd155)。参见例如xu等人,j exp clin cancer res.(2018)37:110。
[0286]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种nk细胞抑制性免疫检查点蛋白或受体的一种或多种阻断剂或抑制剂组合。例示性nk细胞抑制性免疫检查点蛋白或受体包括但不限于杀伤细胞免疫球蛋白样受体、三个ig结构域和长胞质尾区1(kir、cd158e1);杀伤细胞免疫球蛋白样受体、两个ig结构域和长胞质尾1(kir2dl1);杀伤细胞免疫球蛋白样受体、两个ig结构域和长胞质尾2(kir2dl2);杀伤细胞免疫球蛋白样受体、两个ig结构域和长胞质尾3(kir2dl3);杀伤细胞免疫球蛋白样受体、三个ig结构域和长胞质尾1(kir3dl1);杀伤细胞凝集素样受体c1(klrc1、nkg2a、cd159a);和杀伤细胞凝集素样受体d1(klrd1、cd94)。
[0287]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种nk细胞刺激性免疫检查点蛋白或受体的一种或多种激动剂或活化剂组合。例示性nk细胞刺激性免疫检查点蛋白或受体包括但不限于cd16、cd226(dnam-1);cd244(2b4、slamf4);杀伤细胞凝集素样受体k1(klrk1、nkg2d、cd314);slam家族成员7(slamf7)。参见例如davis等人,semin immunol.(2017)31:64
–
75;fang等人,semin immunol.(2017)31:37-54;以及chiossone等人,nat rev immunol.(2018)18(11):671-688。
[0288]
腺苷生成和信号传导
[0289]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与a1r、a2ar、a2br、a3r、cd73、cd39、cd26的激动剂或拮抗剂组合;所述激动剂或拮抗剂例如腺苷a3受体(a3r)激动剂,诸如纳莫德森(namodenoson)(cf102);a2ar/a2br拮抗剂,诸如ab928;抗cd73抗体,诸如medi-9447(奥来鲁单抗)、cpx-006、iph-53、bms-986179、nzv-930、cpi-006;cd73抑制剂,诸如ab-680、psb-12379、psb-12441、psb-12425、cb-708,以及国际专利公布号wo19173692中所述的那些;cd39/cd73抑制剂,诸如pbf-1662;抗cd39抗体,诸如ttx-030;腺苷a2a受体拮抗剂,诸如cpi-444、azd-4635、preladenant、pbf-509;和腺苷脱氨酶抑制剂,诸如喷司他丁、克拉屈滨。
[0290]
双特异性t细胞衔接物
[0291]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与双特异性t细胞衔接物(例如,不具有fc)或抗cd3双特异性抗体(例如,具有fc)组合。可以共同施用的说明性抗cd3双特异性抗体或bite包括:amg-160(psma/cd3)、amg-212(psma/cd3)、amg-330(cd33/cd3)、amg-420(bcma/cd3)、amg-427(flt3/cd3)、amg-562(cd19/cd3)、amg-596(egfrviii/cd3)、amg-701(bcma/cd3)、amg-757(dll3/cd3)、jnj-64052781(cd19/cd3)、amg-211(cea/cd3)、(cd19/cd3)、rg7802(cea/cd3)、ery-974(cd3/gpc3)、hugd2-bsab(cd3/gd2)、pf-06671008(钙粘蛋白/cd3)、apvo436(cd123/cd3)、ery974、氟替珠单抗(cd123/cd3)、gem333(cd3/cd33)、gemoab(cd3/psca)、regn-1979(cd20/cd3)、regn-5678(psma/cd28)、mcla-117(cd3/clec12a)、jnj-0819、jnj-7564(cd3/血红素)、jnj-63709178(cd123/cd3)、mgd-007(cd3/gpa33)、mgd-009(cd3/b7h3)、imcgp100(cd3/gp100)、xmab-14045(cd123/cd3)、xmab-13676(cd3/cd20)、xmab-18087(sstr2/cd3)、卡妥索单抗(cd3/epcam)、regn-4018(muc16/cd3)、rg6026、rg6076、rg6194、rg-7828(cd20/cd3)、cc-93269(cd3/bcma)、regn-5458(cd3/bcma)、grb-1302(cd3/erbb2)、grb-1342(cd38/cd3)、pf-06863135(bcma/cd3)、sar440234(cd3/cdw123)。视情况而定,抗cd3结合双特异性分子可具有或可不具有fc。可以共同施用的例示性双特异性t细胞衔接物靶向cd3和如本文所述的肿瘤相关抗原,包括例如cd19(例如,博纳吐单抗);cd33(例如,amg330);cea(例如,medi-565);受体酪氨酸激酶样孤儿受体1(ror1)(gohil等人,oncoimmunology.2017年5月17日;6(7):e1326437);pd-l1(horn等人,oncotarget.2017年8月3日;8(35):57964-57980);以及egfrviii(yang等人,cancer lett.2017年9月10日;403:224-230)。
[0292]
双特异性和三特异性自然杀伤(nk)细胞衔接物
[0293]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与双特异性nk细胞衔接物(bike)或三特异性nk细胞衔接物(trike)(例如,不具有fc)或者抗以下项的双特异性抗体(例如,具有fc)组合:nk细胞活化受体,例如cd16a、c型凝集素受体(cd94/nkg2c、nkg2d、nkg2e/h和nkg2f)、天然细胞毒性受体(nkp30、nkp44和nkp46)、杀伤细胞c型凝集素样受体(nkp65、nkp80)、fc受体fcγr(其介导抗体依赖性细胞毒性)、slam家族受体(例如,2b4、slam6和slam7)、杀伤细胞免疫球蛋白样受体(kir)(kir-2ds和kir-3ds)、dnam-1和cd137(41bb)。可以共同施用的例示性抗cd16双特异性抗体、bike或trike包括afm26(bcma/cd16a)和afm-13(cd16/cd30)。视情况而定,抗cd16结合双特异性分子可具有或可不具有fc。可以共同施用的例示性双特异性nk细胞衔接物靶向cd16和如本文所述的一种或多种肿瘤相关抗原,包括例如cd19、cd20、cd22、cd30、cd33、cd123、egfr、epcam、神经节苷脂gd2、her2/neu、hla ii类和folr1。bike和trike例如在以下文献中描述:felices等人,methods mol biol.(2016)1441:333
–
346;fang等人,semin immunol.(2017)31:37-54。
[0294]
造血祖细胞激酶1(hpk1)抑制剂
[0295]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与丝裂原活化蛋白激酶激酶激酶激酶1(map4k1,hpk1;ncbi基因id:11184)的抑制剂组合。造血祖细胞激酶1(hpk1)抑制剂的示例包括但不限于wo-2018183956、wo-2018183964、wo-2018167147、wo-2018183964、wo-2016205942、wo-2018049214、wo-2018049200、wo-2018049191、wo-2018102366、wo-2018049152、wo2020092528、wo2020092621和wo-2016090300中所述的那
h-ras;c-k-ras;h-rasidx;c-ki-ras;c-bas/has;c-ha-ras1;ncbi基因id:3265)。ras抑制剂可以在多核苷酸(例如,转录抑制剂)或多肽(例如,gtp酶抑制剂)水平上抑制ras。在一些实施方案中,抑制剂靶向ras途径中的一种或多种蛋白质,例如抑制egfr、ras、raf(a-raf、b-raf、c-raf)、mek(mek1、mek2)、erk、pi3k、akt和mtor中的一种或多种。
[0314]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与kras的抑制剂组合。kras抑制剂的示例包括amg-510、coti-219、mrtx-1257、ars-3248、ars-853、wdb-178、bi-3406、bi-1701963、ars-1620(g12c)、sml-8-73-1(g12c)、化合物3144(g12d)、kobe0065/2602(ras gtp)、rt11、mrtx-849(g12c)和k-ras(g12d)-选择性抑制肽,包括krpep-2(ac-rrcplyisydpvcrr-nh2)(seq id no:167)和krpep-2d(ac-rrrrcplyisydpvcrrrr-nh2)(seq id no:168)。
[0315]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与kras mrna的抑制剂组合。例示性kras mrna抑制剂包括抗kras u1适配物、azd-4785、sig12d-loder
tm
和sig12d外泌体。
[0316]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与mek的抑制剂组合。可以共同施用的说明性mek抑制剂包括比美替尼、考比替尼、pd-0325901、匹马替布、rg-7304、司美替尼、曲美替尼和司美替尼。
[0317]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与akt的抑制剂组合。可以共同施用的说明性akt抑制剂包括rg7440、mk-2206、伊帕曲替尼、阿富塞替尼、azd5363、arq-092、卡帕塞替尼、曲西立滨、abtl-0812(pi3k/akt/mtor)。
[0318]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与raf的抑制剂组合。可以共同施用的说明性raf抑制剂包括bgb-283(raf/egfr)、hm-95573、lxh-254、ly-3009120、rg7304、tak-580、达拉非尼、维莫非尼、康奈非尼(lgx818)、plx8394、raf-265(raf/vegfr)、asn-003(raf/pi3k)。
[0319]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与erk的抑制剂组合。可以共同施用的说明性erk抑制剂包括ltt-462、ly-3214996、mk-8353、拉伏替尼(ravoxertinib)、gdc-0994和优立替尼。
[0320]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与pi3k的抑制剂组合。可以共同施用的说明性pi3k抑制剂包括艾德利西布阿博利西布、布帕利西布、吡替西布(pictilisib)、依格尼西布(ipi-549)。可以共同施用的说明性pi3k/mtor抑制剂包括达托利西布(dactolisib)、奥米帕西布(omipalisib)、沃塔西布(voxtalisib)、吉达利塞(gedatolisib)、gsk2141795、rg6114。
[0321]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与mtor的抑制剂组合。可以共同施用的说明性mtor抑制剂包括:沙帕色替、维斯图替尼(vistusertib)(azd2014)、me-344、西罗莫司(口服纳米无定形制剂,癌症)、tyme-88(mtor/细胞色素p450 3a4)。
[0322]
在某些实施方案中,具有cdkn2a突变的ras驱动的癌症(例如,nsclc)可以通过共同施用mek抑制剂司美替尼和cdk4/6抑制剂帕博西利来抑制。参见例如zhou等人,cancer lett.2017年11月1日;408:130-137。而且,k-ras和突变体n-ras可以通过不可逆的erbb1/2/4抑制剂来那替尼来降低。参见例如booth等人,cancer biol ther.2018年2月1日;19(2):132-137。
[0323]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与ras的抑制剂组合。ras抑制剂的示例包括neo-100、瑞格替尼;
[0324]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与egfr的拮抗剂组合,所述拮抗剂诸如amg-595、耐昔妥珠单抗、abbv-221、depatuxizumab mafodotin(abt-414)、托木妥昔单抗、abt-806、维克替比、莫妥昔单抗、rm-1929。
[0325]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与蛋白酪氨酸磷酸酶非受体型11(ptpn11;bptp3、cfc、jmml、metcds、ns1、ptp-1d、ptp2c、sh-ptp2、sh-ptp3、shp2;ncbi基因id:5781)的抑制剂组合。shp2抑制剂的示例包括tno155(shp-099)、rmc-4550、jab-3068、rmc-4630、sar442720,以及wo2018172984和wo2017211303中所述的那些。
[0326]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与丝裂原活化蛋白激酶7(map2k7、jnkk2、mapkk7、mek、mek 7、mkk7、prkmk7、sapkk-4、sapkk4;ncbi基因id:5609)的抑制剂组合。mek抑制剂的示例包括:安卓奎诺尔、比美替尼(binimetinib)、ck-127、考比替尼(cobimetinib)(gdc-0973,xl-518)、mt-144、司美替尼(selumetinib)(azd6244)、索拉非尼(sorafenib)、曲美替尼(trametinib)(gsk1120212)、阿瑟替布(uprosertib) 曲美替尼、pd-0325901、匹马替布(pimasertib)、ltt462、as703988、cc-90003、瑞法替尼(refametinib)、tak-733、ci-1040、rg7421。
[0327]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与以下项的抑制剂组合:磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基,例如磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基α(pik3ca、clapo、clove、cws5、mcap、mcm、mcmtc、pi3k、pi3k-α、p110-α;ncbi基因id:5290);磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基β(pik3cb、p110beta、pi3k、pi3kbeta、pik3c1;ncbi基因id:5291);磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基γ(pik3cg、pi3cg、pi3k、pi3kγ、pik3、p110γ、p120-pi3k;基因id:5494);以及/或者磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基δ(pik3cd、apds、imd14、p110delta、pi3k、p110d,ncbi基因id:5293)。在一些实施方案中,pi3k抑制剂是泛pi3k抑制剂。pi3k抑制剂的示例包括但不限于:acp-319、aeza-129、amg-319、as252424、azd8186、bay 1082439、bez235、比米利西布(bimiralisib)(pqr309)、布帕利西布(buparlisib)(bkm120)、byl719(阿尔贝利西布)、羧胺三唑乳清酸盐(cto)、ch5132799、clr-457、clr-1401、帕潘西伯(bay 80-6946)、ds-7423、达克利司(dactolisib)、杜韦利西布(duvelisib)(ipi-145)、非美诺司他(fimepinostat)(cudc-907)、吉达利塞(pf-05212384)、gdc-0032、gdc-0084(rg7666)、gdc-0077、哌替西布(pictilisib)(gdc-0941)、gdc-0980、gsk2636771、gsk2269577、gsk2141795、艾达拉西布(idelalisib)incb040093、incb50465、ipi-443、ipi-549、kar4141、ly294002、ly3023414、(来那替尼)、奈米拉西布(nemiralisib)(gsk2269557)、奥米帕利西布(omipalisib)(gsk2126458,gsk458)、oxy111a、帕努西布(panulisib)(p7170,ak151761)、pa799、哌立福辛(krx-0401)、匹拉利塞(pilaralisib)(sar245408;xl147)、甲磺酸普喹替尼(puquitinib mesylate)(xc-302)、sar260301、塞来利西布(seletalisib)(ucb-5857)、塞拉贝西布(serabelisib)(ink-1117、mln-1117、tak-117)、sf1126、索诺西布(sonolisib)(px-866)、rg6114、rg7604、瑞格色替钠(on-01910钠)、rp5090、特那西布(tenalisib)(rp6530)、rv-1729、srx3177、塔塞西布(taselisib)、
tg100115、茵巴利西布(umbralisib)(tgr-1202)、tgx221、沃塔西布(sar245409)、vs-5584、wx-037、x-339、x-414、xl499、xl756、渥曼青霉素、zstk474,以及wo2005/113556(icos)、wo 2013/052699(gilead calistoga)、wo2013/116562(gilead calistoga)、wo 2014/100765(gilead calistoga)、wo 2014/100767(gilead calistoga)和wo 2014/201409(gilead sciences)中所述的化合物。
[0328]
脾酪氨酸激酶(syk)抑制剂
[0329]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与脾相关酪氨酸激酶(syk,p72-syk,gene id:6850)的抑制剂组合。syk抑制剂的示例包括但不限于6-(1h-吲唑-6-基)-n-(4-吗啉代苯基)咪唑并[1,2-a]吡嗪-8-胺、bay-61-3606、赛度替尼(cerdulatinib)(prt-062607)、依托司替尼(entospletinib)、福他替尼(fostamatinib)(r788)、hmpl-523、nvp-qab 205aa、r112、r343、他马替尼(tamatinib)(r406),以及us 8450321(gilead connecticut)中所述的那些和u.s.2015/0175616中所述的那些。
[0330]
酪氨酸激酶抑制剂(tki)
[0331]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与酪氨酸激酶抑制剂(tki)组合。tki可靶向表皮生长因子受体(egfr)以及成纤维细胞生长因子(fgf)、血小板衍生生长因子(pdgf)和血管内皮生长因子(vegf)的受体。tki的示例包括但不限于:阿西替尼、阿法替尼、arq-087(德拉赞替尼)、asp5878、azd3759、azd4547、博舒替尼、布加替尼、卡博替尼、西地尼布、克伦奥尼布、达克替尼、达沙替尼、多韦替尼、e-6201、厄达替尼、厄洛替尼、吉非替尼、吉瑞替尼(asp-2215)、fp-1039、hm61713、埃克替尼、伊马替尼、kx2-391(src)、拉帕替尼、来他替尼、乐伐替尼、米哚妥林、尼达尼布、odm-203、奥莫替尼、奥希替尼(azd-9291)、帕唑帕尼、帕纳替尼、波齐替尼、奎扎替尼、拉多替尼、罗西替尼、索凡替尼(hmpl-012)、舒尼替尼、l-苹果酸法米替尼(mac-4)、替沃尼布、th-4000、替沃尼布和medi-575(抗pdgfr抗体)、tak-659、卡博替尼。
[0332]
化学治疗剂(护理标准)
[0333]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与化学治疗剂或抗肿瘤剂组合。
[0334]
如本文所用,术语“化学治疗剂”或“化学疗剂”(或在用化学治疗剂治疗的情况下的“化学疗法”)意在涵盖可用于治疗癌症的任何非蛋白质性(例如非肽性)化合物。化学治疗剂的示例包括但不限于:烷基化剂,诸如噻替哌和环磷酰胺烷基磺酸盐,诸如白消安、英丙舒凡和哌泊舒凡;氮杂环丙烷,诸如苯佐替哌、卡波醌、美妥替哌和乌瑞替哌;乙撑亚胺和甲基蜜胺,包括六甲蜜胺、三乙撑蜜胺、三乙撑磷酰胺、三乙撑硫代磷酰胺和三羟甲蜜胺(trimemylolomelamine);内脂,例如布拉酸和布拉它辛酮;喜树碱,包括合成类似物拓扑替康;苔藓虫素、愈伤组织抑制素(callystatin);cc-1065,包括其阿多来新、卡折来新和比折来新合成类似物;念珠藻素,尤其是念珠藻素1和念珠藻素8;尾海兔素;倍癌霉素,包括合成类似物kw-2189和cbi-tmi;艾榴塞洛素(eleutherobin);5-氮杂胞苷;水鬼蕉碱(pancratistatin);匍枝珊瑚醇(sarcodictyin);海绵抑制素(spongistatin);氮芥,诸如苯丁酸氮芥、萘氮芥、环磷酰胺、葡磷酰胺、艾伏磷酰胺、苯达莫司汀、雌莫司汀、异环磷酰胺、二氯甲基二乙胺、盐酸氧化二氯甲基二乙胺、美法仑、新恩比兴、苯芥胆甾醇、泼尼莫司汀、曲洛磷胺和尿嘧啶氮芥;亚硝基脲,诸如卡莫司汀、氯脲霉素、福莫司汀、洛莫司
汀、尼莫司汀和雷莫司汀;抗生素,诸如烯二炔抗生素(例如,卡奇霉素,尤其是卡奇霉素γii和卡奇霉素phii1)、达尼霉素(包括达尼霉素a)、双膦酸盐(诸如氯膦酸盐)、埃斯帕米霉素、新抑癌素发色团和相关的发色蛋白烯二炔抗生素发色团、阿克拉霉素、放线菌素、蒽霉素(authramycin)、重氮丝氨酸、博来霉素、放线菌素、卡柔比星(carabicin)、卡尼米辛(carrninomycin)、嗜癌菌素(carzinophilin)、色霉素(chromomycin)、更生霉素、柔红霉素、地托比星、6-重氮-5-氧代-l-正亮氨酸、多柔比星(包括吗啉代-多柔比星、氰基吗啉代-多柔比星、2-吡咯并-多柔比星和脱氧多柔比星)、表柔比星、依索比星、伊达比星、麻西罗霉素、丝裂霉素(诸如丝裂霉素c)、霉酚酸、诺加霉素、橄榄霉素、培洛霉素、泊非霉素、嘌呤霉素、奎那霉素、罗多比星、链霉黑素、链脲菌素、杀结核菌素、乌苯美司、净司他丁和佐柔比星;抗代谢物,诸如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,诸如去甲蝶呤、甲氨蝶呤、蝶罗呤和三甲曲沙;嘌呤类似物,诸如克拉屈滨、喷司他汀、氟达拉滨、6-巯基嘌呤、硫咪嘌呤和硫鸟嘌呤;嘧啶类似物,诸如安西他滨、阿扎胞苷、6-氮尿苷、卡莫氟、阿糖胞苷、双脱氧尿苷、去氧氟尿苷、依诺他滨和氟尿苷;雄激素,诸如卡普睾酮、丙酸屈他雄酮、环硫雄醇、美雄烷和睾内酯;抗肾上腺类,诸如氨鲁米特、米托坦和曲洛司坦;叶酸补充剂,诸如亚叶酸;放射治疗剂,诸如radium-223、177-lu-psma-617;单端孢霉烯,尤其是t-2毒素、疣孢菌素(verracurin)a、杆孢菌素(roridin)a和蛇形菌素(anguidine);紫杉烷类,诸如紫杉醇白蛋白结合型紫杉醇(abraxane)、多西他赛卡巴他赛、bind-014、替司他赛;铂类似物,诸如顺铂和卡铂、nc-6004纳米铂;醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶;安吖啶;赫布西尔(hestrabucil);比生群;依达曲沙;地磷酰胺;秋水仙胺;地吖醌;依氟鸟氨酸(elformthine);依利醋铵;埃博霉素;依托格鲁;硝酸镓;羟基脲;香菇多糖;甲酰四氢叶酸;氯尼达明;美登木生物碱,诸如美登素和安丝菌素;米托胍腙;米托蒽醌;莫哌达醇;二胺硝吖啶;蛋氨氮芥;吡柔比星;洛索蒽醌;氟嘧啶;亚叶酸;鬼臼酸;2-乙基酰肼;丙卡巴肼;多糖-k(psk);雷佐生;根霉素;西佐喃;锗螺胺;细交链孢菌酮酸;曲贝替定、三亚胺醌;2,2',2
”‑
三氯三甲胺;氨基甲酸酯;长春地辛;达卡巴嗪;甘露莫司汀;二溴甘露醇;二溴卫矛醇;哌泊溴烷;加西托星(gacytosine);阿拉伯糖苷(“ara-c”);环磷酰胺;噻替派;苯丁酸氮芥;吉西他滨6-硫鸟嘌呤;巯嘌呤;甲氨蝶呤;长春碱;铂;依托泊苷(vp-16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞滨诺消灵;替尼泊苷;依达曲沙;道诺霉素;氨喋呤;昔洛达(xeoloda);伊班膦酸盐;cpt-11;拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dfmo);类视色素,诸如视黄酸;卡培他滨;nuc-1031;folfox(亚叶酸、5-氟尿嘧啶、奥沙利铂);folfiri(亚叶酸、5-氟尿嘧啶、伊立替康);folfoxiri(亚叶酸、5-氟尿嘧啶、奥沙利铂、伊立替康)、folfirinox(亚叶酸、5-氟尿嘧啶、伊立替康、奥沙利铂)以及上述任何物质的药学上可接受的盐、酸或衍生物。此类试剂可以缀合到抗体或本文所述的任何靶向剂上,以形成抗体-药物缀合物(adc)或靶向药物缀合物。
[0335]“化学治疗剂”的定义中还包括抗激素剂,诸如抗雌激素和选择性雌激素受体调节剂(serm)、芳香酶抑制剂、抗雄激素以及任何上述物质的药学上可接受的盐、酸或衍生物,其用于调节或抑制激素对肿瘤的作用。抗雌激素和serm的示例包括例如他莫昔芬(包括nolvadextm)、雷洛昔芬、屈洛昔芬、4-羟基他莫昔芬、曲沃昔芬、雷洛昔芬盐酸盐、
ly117018、奥那司酮和托瑞米芬芳香酶的抑制剂调节肾上腺中雌激素的产生。示例包括4(5)-咪唑、氨鲁米特、醋酸甲地孕酮依西美坦、福美司坦、法倔唑、伏氯唑来曲唑和阿那曲唑抗雄激素的示例包括阿帕鲁胺、阿比特龙、恩杂鲁胺、氟他胺、加来特龙、尼鲁米特、比卡鲁胺、亮丙瑞林、戈舍瑞林、odm-201、apc-100、odm-204。孕酮受体拮抗剂的示例包括奥那司酮。
[0336]
抗血管生成剂
[0337]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗血管生成剂组合。可以共施用的抗血管生成剂包括但不限于视黄酸及其衍生物、2-甲氧基雌二醇、瑞戈非尼、尼古帕尼、苏拉明、角鲨胺、金属蛋白酶-1的组织抑制剂、金属蛋白酶-2的组织抑制剂、纤溶酶原激活物抑制剂-1、纤溶酶原激活物抑制剂-2、软骨来源的抑制剂、紫杉醇(纳布-紫杉醇)、血小板因子4、硫酸鱼精蛋白(鲱精蛋白)、硫酸化甲壳素衍生物(由雪蟹壳制备)、硫酸化多糖肽聚糖复合物(sp-pg)、星形孢菌素、基质代谢调节剂(包括脯氨酸类似物,诸如l-氮杂环丁烷-2-羧酸(laca)、顺式羟基脯氨酸、d,i-3,4-脱氢脯氨酸、硫代脯氨酸)、α,α'-联吡啶、β-氨基丙腈延胡索酸盐、4-丙基-5-(4-吡啶基)-2(3h)-噁唑酮、甲氨蝶呤、米托蒽醌、肝素、干扰素、2巨球蛋白-血清、鸡金属蛋白酶-3的抑制剂(chimp-3)、糜蛋白酶抑素、β-环糊精十四硫酸盐、依泊霉素、夫马菌素、硫代苹果酸金钠、右旋青霉胺、β-1-抗胶原酶-血清、α-2-抗纤溶酶、比生群、氯苯扎利二钠、n-2-羧基苯基-4-氯蒽酮酸二钠或“cca”、沙利度胺、血管抑制性类固醇、羧基氨基咪唑、金属蛋白酶抑制剂(诸如bb-94)、s100a9的抑制剂(诸如他喹莫德)。其他抗血管新生剂包括抗体、优选针对这些血管生成生长因子的单克隆抗体:β-fgf、α-fgf、fgf-5、vegf同种型、vegf-c、hgf/sf和ang-1/ang-2。
[0338]
抗纤维化剂
[0339]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗纤维化剂组合。可以共同施用的抗纤维化剂包括但不限于诸如β-氨基丙腈(bapn)的化合物,以及us 4965288中公开的涉及赖氨酰氧化酶抑制剂及其在治疗与胶原异常沉积相关的疾病和病症中的用途和us 4997854中公开的涉及抑制lox以治疗各种病理纤维化状态的化合物的化合物,这些专利以引用方式并入本文。另外的示例性抑制剂在涉及诸如2-异丁基-3-氟-、氯-或溴-烯丙胺的化合物的us 4943593、涉及2-(1-萘氧基甲基)-3-氟烯丙胺的us 5021456、us 5059714、us 5120764、us 5182297、us 5252608以及us 2004-0248871中描述,这些专利以引用方式并入本文。
[0340]
示例性抗纤维化剂还包括与赖氨酰氧化酶的活性位点的羰基基团反应的伯胺,并且更具体地,与羰基结合后产生通过共振稳定的产物的那些,诸如以下伯胺:乙二胺、肼、苯肼以及它们的衍生物;氨基脲和脲衍生物;氨基腈,诸如bapn或2-硝基乙胺;不饱和或饱和的卤代胺,诸如2-溴-乙胺、2-氯乙胺、2-三氟乙胺、3-溴丙胺和对卤代苄胺;以及硒高半胱氨酸内酯。
[0341]
其他抗纤维化剂是渗入或不渗入细胞的铜螯合剂。示例性化合物包括间接抑制剂,其阻断源自赖氨酰氧化酶对赖氨酰和羟基赖氨酰残基氧化脱氨基的醛衍生物。示例包
括硫醇胺(特别是d-青霉胺)及其类似物,诸如2-氨基-5-巯基-5-甲基己酸、d-2-氨基-3-甲基-3-((2-乙酰氨基乙基)二硫代)丁酸、p-2-氨基-3-甲基-3-((2-氨基乙基)二硫代)丁酸、4-((p-1-二甲基-2-氨基-2-羧基乙基)二硫代)丁烷硫酸钠、2-乙酰氨基乙基-2-乙酰氨基乙硫醇硫酸盐和4-巯基丁烷亚磺酸钠三水合物。
[0342]
抗炎剂
[0343]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与抗炎剂组合。示例抗炎剂包括但不限于以下项中的一种或多种的抑制剂:精氨酸酶(arg1(ncbi基因id:383)、arg2(ncbi基因id:384))、碳酸酐酶(ca1(ncbi基因id:759)、ca2(ncbi基因id:760)、ca3(ncbi基因id:761)、ca4(ncbi基因id:762)、ca5a(ncbi基因id:763)、ca5b(ncbi基因id:11238)、ca6(ncbi基因id:765)、ca7(ncbi基因id:766)、ca8(ncbi基因id:767)、ca9(ncbi基因id:768)、ca10(ncbi基因id:56934)、ca11(ncbi基因id:770)、ca12(ncbi基因id:771)、ca13(ncbi基因id:377677)、ca14(ncbi基因id:23632))、前列腺素-内过氧化物合酶1(ptgs1、cox-1;ncbi基因id:5742)、前列腺素-内过氧化物合酶2(ptgs2、cox-2;ncbi基因id:5743)、分泌型磷脂酶a2、前列腺素e合酶(ptges、pges;基因id:9536)、花生四烯酸5-脂氧合酶(alox5、5-lox;ncbi基因id:240)、可溶性环氧化物水解酶2(ephx2、seh;ncbi基因id:2053)和/或丝裂原活化蛋白激酶激酶激酶8(map3k8、tpl2;ncbi基因id:1326)。在一些实施方案中,抑制剂是双抑制剂,例如cox-2/cox-1、cox-2/seh、cox-2/ca、cox-2/5-lox的双抑制剂。
[0344]
可以共同施用的前列腺素-内过氧化物合酶1(ptgs1、cox-1;ncbi基因id:5742)的抑制剂的示例包括但不限于莫苯唑酸、gly-230和trk-700。
[0345]
可以共同施用的前列腺素-内过氧化物合酶2(ptgs2、cox-2;ncbi基因id:5743)的抑制剂的示例包括但不限于:双氯芬酸、美洛昔康、帕瑞昔布、依托昔布、ap-101、塞来昔布、axs-06、双氯芬酸钾、drgt-46、aat-076、美索舒利、罗美昔布、美洛昔康、伐地昔布、扎托洛芬、尼美舒利、阿尼扎芬、阿利考昔、西米考昔、地拉考昔、氟鲁咪唑、非罗昔布、马伐昔布、ns-398、帕米格雷、帕瑞昔布、罗贝昔布、罗非昔布、吴茱萸次碱、替莫昔布和扎托洛芬。可以共同施用的双cox1/cox2抑制剂的示例包括但不限于hp-5000、氯诺昔康、酮咯酸氨丁三醇、溴芬酸钠、atb-346、hp-5000。可以共同施用的双cox-2/碳酸酐酶(ca)抑制剂的示例包括但不限于波马昔布和艾瑞昔布。
[0346]
可以共同施用的分泌型磷脂酶a2、前列腺素e合酶(ptges、pges;基因id:9536)的抑制剂的示例包括但不限于ly3023703、grc27864,以及wo2015158204、wo2013024898、wo2006063466、wo2007059610、wo2007124589、wo2010100249、wo2010034796、wo2010034797、wo2012022793、wo2012076673、wo2012076672、wo2010034798、wo2010034799、wo2012022792、wo2009103778、wo2011048004、wo2012087771、wo2012161965、wo2013118071、wo2013072825、wo2014167444、wo2009138376、wo2011023812、wo2012110860、wo2013153535、wo2009130242、wo2009146696、wo2013186692、wo2015059618、wo2016069376、wo2016069374、wo2009117985、wo2009064250、wo2009064251、wo2009082347、wo2009117987和wo2008071173中所述的化合物。还发现二甲双胍可抑制cox2/pge2/stat3轴,并且可以共同施用二甲双胍。参见例如tong等人,cancer lett.(2017)389:23-32;以及liu等人,oncotarget.(2016)7(19):
28235-46。
[0347]
可以共同施用的碳酸酐酶(例如,ca1(ncbi基因id:759)、ca2(ncbi基因id:760)、ca3(ncbi基因id:761)、ca4(ncbi基因id:762)、ca5a(ncbi基因id:763)、ca5b(ncbi基因id:11238)、ca6(ncbi基因id:765)、ca7(ncbi基因id:766)、ca8(ncbi基因id:767)、ca9(ncbi基因id:768)、ca10(ncbi基因id:56934)、ca11(ncbi基因id:770)、ca12(ncbi基因id:771)、ca13(ncbi基因id:377677)、ca14(ncbi基因id:23632)中的一种或多种)的抑制剂的示例包括但不限于乙酰唑胺、甲醋唑胺、多佐胺、唑尼沙胺、布林佐胺和二氯苯磺胺。可以共同施用的双cox-2/ca1/ca2抑制剂包括cg100649。
[0348]
可以共同施用的花生四烯酸5-脂氧合酶(alox5、5-lox;ncbi基因id:240)的抑制剂的示例包括但不限于甲氯芬那酸钠、齐留通(zileuton)。
[0349]
可以共同施用的可溶性环氧化物水解酶2(ephx2、seh;ncbi基因id:2053)的抑制剂的示例包括但不限于wo2015148954中所述的化合物。可以共同施用的cox-2/seh的双抑制剂包括wo2012082647中所述的化合物。可以共同施用的seh和脂肪酸酰胺水解酶(faah;ncbi基因id:2166)的双抑制剂包括wo2017160861中所述的化合物。
[0350]
可以共同施用的丝裂原活化蛋白激酶激酶激酶8(map3k8、肿瘤进展基因座-2、tpl2;ncbi基因id:1326)的抑制剂的示例包括但不限于gs-4875、gs-5290、bhm-078,以及例如以下文献中所述的那些:wo2006124944、wo2006124692、wo2014064215、wo2018005435;teli等人,j enzyme inhib med chem.(2012)27(4):558-70;gangwall等人,curr top med chem.(2013)13(9):1015-35;wu等人,bioorg med chem lett.(2009)19(13):3485-8;kaila等人,bioorg med chem.(2007)15(19):6425-42;以及hu等人,bioorg med chem lett.(2011)21(16):4758-61。
[0351]
肿瘤氧合剂
[0352]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与促进或增加肿瘤氧合或再氧合、或者防止或减少肿瘤缺氧的药剂组合。可以共同施用的例示性药剂包括例如低氧诱导因子1α(hif-1α)抑制剂,诸如pt-2977、pt-2385;vegf抑制剂,诸如贝伐单抗(bevasizumab)、imc-3c5、gnr-011、替尼比鲁单抗、lyn-00101、abt-165;以及/或者氧载体蛋白(例如,血红素一氧化氮和/或氧结合蛋白(hnox)),诸如wo2007/137767、wo 2007/139791、wo 2014/107171和wo 2016/149562中所述的omx-302和hnox蛋白。
[0353]
免疫治疗剂
[0354]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与免疫治疗剂组合。可以共同施用的示例性免疫治疗剂包括但不限于阿巴伏单抗(abagovomab)、abp-980、阿德木单抗(adecatumumab)、阿夫土珠(afutuzumab)、阿仑单抗(alemtuzumab)、阿妥莫单抗(altumomab)、阿麦妥单抗(amatuximab)、安那莫单抗(anatumomab)、阿西莫单抗(arcitumomab)、巴威单抗(bavituximab)、贝妥莫单抗(bectumomab)、贝伐珠单抗(bevacizumab)生物仿制药、比瓦妥珠单抗(bivatuzumab)、博纳吐单抗(blinatumomab)、本妥昔单抗(brentuximab)、坎妥珠单抗(cantuzumab)、卡妥索单抗(catumaxomab)、cc49、西妥昔单抗(cetuximab)、西他土珠单抗(citatuzumab)、西妥木单抗(cixutumumab)、克利妥珠单抗(clivatuzumab)、可那木单抗(conatumumab)、达西珠单抗(dacetuzumab)、达洛珠单抗(dalotuzumab)、达雷木单抗(daratumumab)、地莫单抗(detumomab)、迪妥昔单抗
(dinutuximab)、曲齐妥单抗(drozitumab)、度利戈妥单抗(duligotumab)、杜西格单抗(dusigitumab)、埃克莫昔单抗(ecromeximab)、依米妥单抗(emibetuzumab)、恩司昔单抗(ensituximab)、厄妥索单抗(ertumaxomab)、埃达珠单抗(etaracizumab)、法妥珠单抗(farletuzumab)、芬妥木单抗(figitumumab)、弗兰妥他单抗(flanvotumab)、氟妥昔单抗(futuximab)、吉妥单抗(gemtuzumab)、吉妥昔单抗(girentuximab)、格伦巴单抗(glembatumumab)、替伊莫单抗(ibritumomab)、伊戈单抗(igovomab)、伊马曲单抗(imgatuzumab)、英达妥昔单抗(indatuximab)、奥英妥珠单抗(inotuzumab)、英妥木单抗(intetumumab)、伊匹单抗(ipilimumab)(mdx-010、bms-734016和mdx-101)、伊妥木单抗(iratumumab)、拉贝珠单抗(labetuzumab)、来沙木单抗(lexatumumab)、林妥珠单抗(lintuzumab)、洛尔妥珠单抗(lorvotuzumab)、卢卡木单抗(lucatumumab)、马妥珠单抗(matuzumab)、米拉妥珠单抗(milatuzumab)、明瑞莫单抗(minretumomab)、米妥莫单抗(mitumomab)、莫西妥单抗(moxetumomab)、莫西妥单抗pasudotox、那普妥莫单抗(naptumomab)、那呐妥单抗(narnatumab)、耐昔妥珠单抗(necitumumab)、尼妥珠单抗(nimotuzumab)、诺非妥莫单抗(nofetumomab)、obi-833、奥滨尤妥珠单抗(obinutuzumab)、奥卡妥珠单抗(ocaratuzumab)、奥法木单抗(ofatumumab)、奥拉单抗(olaratumab)、奥纳妥珠单抗(onartuzumab)、莫妥组单抗(oportuzumab)、奥戈伏单抗(oregovomab)、帕尼单抗(panitumumab)、帕萨妥珠单抗(parsatuzumab)、假单康(pasudotox)、帕曲妥单抗(patritumab)、培妥莫单抗(pemtumomab)、帕妥珠单抗(pertuzumab)、平妥莫单抗(pintumomab)、普林木单抗(pritumumab)、雷克图玛单抗(racotumomab)、雷曲妥单抗(radretumab)、雷莫卢单抗(ramucirumab)利妥木单抗(rilotumumab)、利妥昔单抗(rituximab)、罗妥木单抗(robatumumab)、萨马利珠单抗(samalizumab)、沙妥莫单抗(satumomab)、西罗珠单抗(sibrotuzumab)、司妥昔单抗(siltuximab)、索洛他单抗(solitomab)、辛妥珠单抗(simtuzumab)、替组单抗(tacatuzumab)、塔普妥单抗(taplitumomab)、特那妥单抗(tenatumomab)、替妥木单抗(teprotumumab)、替加妥珠单抗(tigatuzumab)、托西莫单抗(tositumomab)、曲妥珠单抗(trastuzumab)、曲妥珠单抗生物仿制药、土考妥珠单抗(tucotuzumab)、乌布妥昔单抗(ubilituximab)、维妥珠单抗(veltuzumab)、沃瑟妥珠单抗(vorsetuzumab)、伏妥莫单抗(votumumab)、扎芦木单抗(zalutumumab)和3f8。利妥昔单抗可用于治疗惰性b细胞癌症,包括边缘区淋巴瘤、wm、cll和小淋巴细胞淋巴瘤。利妥昔单抗和化学治疗剂的组合是特别有效的。
[0355]
可进一步对例示的治疗抗体进行标记,或将其与放射性同位素颗粒(诸如铟-111、钇-90(90y-克利妥珠单抗)或碘-131)组合。
[0356]
在一些实施方案中,免疫治疗剂是抗体-药物缀合物(adc)。可以共同施用的例示性adc包括但不限于药物缀合的抗体、其片段或靶向上文和本文(例如,表b中)列出的蛋白质或抗原的抗体模拟物。可以共同施用的示例adc包括但不限于:吉妥单抗、本妥昔单抗、曲妥珠单抗、奥英妥珠单抗、格伦巴单抗、阿奈妥单抗、米韦妥昔单抗(mirvetuximab)、德帕妥昔组单抗(depatuxizumab)、罗伐匹妥单抗、伐达妥昔单抗、拉贝珠单抗、赛妥珠单抗、利法妥珠单抗、英度妥单抗、泊妥珠单抗、匹那妥珠单抗、考妥昔单抗、英达妥昔单抗、米拉妥珠单抗、罗伐匹妥单抗、abbv-011、abbv-2029、abbv-321、abbv-647、mln0264(抗gcc,鸟苷酸环
化酶c)、t-dm1(恩美曲妥珠单抗(trastuzumab emtansine),kadcycla);syd985(抗her2、倍癌霉素)、米拉妥珠单抗多柔比星(milatuzumab-doxorubicin)(hcd74-dox)、dcdt2980s、贝兰他单抗莫福汀(belantamab mafodotin)(gsk2857916)、泊洛妥珠单抗维多汀(polatuzumab vedotin)(rg-7596)、sgn-cd70a、sgn-cd19a、奥英妥珠单抗奥唑米星(inotuzumab ozogamicin)(cmc-544)、洛尔妥珠单抗美坦新(lorvotuzumab mertansine)、sar3419、爱莎妥珠单抗戈维替康(isactuzumab govitecan)、恩富妥单抗维多汀(enfortumab vedotin)(asg-22me)、asg-15me、ds-8201(曲妥珠单抗德鲁替康(trastuzumab deruxtecan))、225ac-林妥珠单抗、u3-1402、177lu-替曲塞坦特拉克斯坦-特图玛(177lu-tetraxetan-tetuloma)、替索妥单抗维多汀(tisotumab vedotin)、阿奈妥单抗瑞维坦新(anetumab ravtansine)、cx-2009、sar-566658、w-0101、abbv-085、吉妥单抗奥唑米星(gemtuzumab ozogamicin)、abt-414、格伦巴单抗维多汀(glembatumumab vedotin)(cdx-011)、拉贝珠单抗戈维替康(labetuzumab govitecan)(immu-130)、赛妥珠单抗戈维替康(sacituzumab govitecan)(immu-132)、利法妥珠单抗维多汀(lifastuzumab vedotin)(rg-7599)、米拉妥珠单抗多柔比星(immu-110)、英达妥昔单抗瑞维坦新(indatuximab ravtansine)(bt-062)、匹那妥珠单抗维多汀(pinatuzumab vedotin)(rg-7593)、sgn-liv1a、sgn-cd33a、sar566658、mln2704、sar408701、罗伐匹妥单抗替西林(rovalpituzumab tesirine)、abbv-399、ags-16c3f、asg-22me、ags67e、amg 172、amg 595、ags-15e、bay1129980、bay1187982、bay94-934(阿奈妥单抗瑞维坦新(anetumab ravtansine))、gsk2857916、humax-tf-adc(替索妥单抗维多汀(tisotumab vedotin))、imgn289、imgn529;imgn853(米韦妥昔单抗索维坦新(mirvetuximab soravtansine))、lop628、pca062、mdx-1203、medi-547、pf-06263507、pf-06647020、pf-06647263、pf-06664178、pf-06688992、pf-06804103、rg7450、rg7458、rg7598、sar566658、sgn-cd33a、ds-1602和ds-7300、ds-6157、ds-6000、tak-164、medi2228、medi7247、amg575。可以共同施用的adc例如在lambert等人,adv ther(2017)34:1015
–
1035以及de goeij,current opinion in immunology(2016)40:14
–
23中描述。
[0357]
可以与药物缀合的抗体、其片段或抗体模拟物缀合的例示性治疗剂(例如,抗癌剂或抗肿瘤剂)包括但不限于一甲基瑞奥西汀e(mmae)、一甲基瑞奥西汀f(mmaf)、卡奇霉素、安丝菌素、美登素或其类似物(例如,美坦新(mertansine)/恩坦新(emtansine)(dm1)、瑞维坦新(ravtansine)/索维坦新(soravtansine)(dm4))、蒽环类(例如,多柔比星、柔红霉素、表柔比星、伊达比星)、吡咯并苯二氮杂卓(pbd)dna交联剂sc-dr002(d6.5)、倍癌霉素、微管抑制剂(mti)(例如,紫杉烷、长春花生物碱、埃博霉素)、吡咯并苯并二氮杂卓(pbd)或其二聚体、倍癌霉素(a、b1、b2、c1、c2、d、sa、cc-1065)以及本文所述的其他抗癌剂或抗肿瘤剂。
[0358]
癌症基因疗法和细胞疗法
[0359]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与癌症基因疗法和细胞疗法组合。癌症基因疗法和细胞疗法包括将正常基因插入癌细胞中以替换突变或改变的基因;沉默突变基因的遗传修饰;直接杀死癌细胞的遗传方法;包括免疫细胞的输注,所述免疫细胞被设计成替换大部分患者自身的免疫系统以增强对癌细胞的免疫应答,或激活患者自身的免疫系统(t细胞或自然杀伤细胞)以杀死癌细胞,或找到并杀死癌细胞;改变细胞活性以进一步改变针对癌症的内源性免疫应答的遗传方法。
[0360]
细胞疗法
[0361]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与一种或多种细胞疗法组合。说明性的细胞疗法包括但不限于共同施用一种或多种免疫细胞群。在一些实施方案中,免疫细胞是自然杀伤(nk)细胞、nk-t细胞、t细胞、γδt细胞、b细胞、细胞因子诱导的杀伤(cik)细胞、巨噬细胞(mac)、肿瘤浸润淋巴细胞(til)、粒细胞、先天淋巴样细胞、巨核细胞、单核细胞、巨噬细胞、血小板、胸腺细胞、骨髓细胞和/或树突状细胞(dc)。在一些实施方案中,细胞疗法需要t细胞疗法,例如共同施用α/βtcr t细胞、γ/δtcr t细胞、调节t(treg)细胞和/或truc
tm
t细胞的群体。在一些实施方案中,细胞疗法需要nk细胞疗法,例如共同施用nk-92细胞。视情况而定,细胞疗法可能需要共同施用对受试者而言是自体的、同基因的或同种异体的细胞。
[0362]
在一些实施方案中,细胞疗法需要共施用经工程改造以表达嵌合抗原受体(car)或t细胞受体(tcr)tcr的免疫细胞。在特定实施方案中,免疫细胞群经工程改造以表达car,其中car包含肿瘤抗原结合结构域。在其他实施方案中,免疫细胞群经工程改造以表达经工程改造以靶向在肿瘤细胞表面上呈递的肿瘤衍生肽的t细胞受体(tcr)。在一个实施方案中,经工程改造以表达嵌合抗原受体(car)或t细胞受体(tcr)tcr的免疫细胞是t细胞。在另一个实施方案中,经工程改造以表达嵌合抗原受体(car)或t细胞受体(tcr)tcr的免疫细胞是nk细胞。
[0363]
就car的结构而言,在一些实施方案中,car包含抗原结合结构域、跨膜结构域和胞内信号结构域。在一些实施方案中,胞内结构域包含初级信号结构域、共刺激结构域或初级信号结构域和共刺激结构域两者。在一些实施方案中,初级信号结构域包含选自由以下项组成的组的一种或多种蛋白质的功能信号结构域:cd3ζ、cd3γ、cd3δ、cd3ε、常见fcrγ(fcerig)、fcr β(fcεrlb)、cd79a、cd79b、fcγriia、dap10和dap12 4-1bb/cd137、激活nk细胞受体、免疫球蛋白、b7-h3、baffr、blame(slamf8)、btla、cd100(sema4d)、cd103、cd160(by55)、cd18、cd19、cd19a、cd2、cd247、cd27、cd276(b7-h3)、cd28、cd29、cd3δ、cd3ε、cd3γ、cd30、cd4、cd40、cd49a、cd49d、cd49f、cd69、cd7、cd84、cd8α、cd8β、cd96(tactile)、cd11a、cd11b、cd11c、cd11d、cds、ceacam1、crt am、细胞因子受体、dap-10、dnam1(cd226)、fcγ受体、gads、gitr、hvem(lightr)、ia4、icam-1、icam-1、igα(cd79a)、il-2rβ、il-2rγ、il-7rα、诱导型t细胞共刺激因子(icos)、整联蛋白、itga4、itga4、itga6、itgad、itgae、itgal、itgam、itgax、itgb2、itgb7、itgb1、kirds2、lat、lfa-1、lfa-1、与cd83结合的配体、light、light、ltbr、ly9(cd229)、ly108、淋巴细胞功能相关抗原-1(lfa-1;cd1-1a/cd18)、mhc 1类分子、nkg2c、nkg2d、nkp30、nkp44、nkp46、nkp80(klrf1)、ox-40、pag/cbp、程序性死亡-1(pd-1)、psgl1、selplg(cd162)、信号淋巴细胞活化分子(slam蛋白)、slam(slamf1;cd150;ipo-3)、slamf4(cd244;2b4)、slamf6(ntb-a、slamf7、slp-76、tnf受体蛋白、tnfr2、tnfsf14、toll配体受体、trance/rankl、vla1或vla-6,或它们的片段、截短形式或组合。
[0364]
在一些实施方案中,共刺激结构域包含选自由以下项组成的组的一种或多种蛋白质的功能结构域:cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、cd2、cd7、light、nkg2c、淋巴细胞功能相关抗原-1(lfa-1)、myd88、b7-h3、与cd83特异性结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrfi)、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、itgae、
cd103、itgal、cd1a(ncbi基因id:909)、cd1b(ncbi基因id:910)、cd1c(ncbi基因id:911)、cd1d(ncbi基因id:912)、cd1e(ncbi基因id:913)、itgam、itgax、itgb1、cd29、itgb2(cd18、lfa-1)、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46和nkg2d。
[0365]
在一些实施方案中,跨膜结构域包含来源于选自由以下项组成的组的蛋白质的跨膜结构域:t-细胞受体的α、β或ζ链、cd28、cd3ε、cd3δ、cd3γ、cd45、cd4、cd5、cd7、cd8α、cd8β、cd9、cd11a、cd11b、cd11c、cd11d、cd16、cd18、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、kirds2、ox40、cd2、cd27、icos(cd278)、4-1bb(cd137)、gitr、cd40、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd19、cd19a、il2rβ、il2rγ、il7rα、itga1、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd1a、cd1b、cd1c、cd1d、cd1e、itgae、cd103、itgal、itgam、itgax、itgb1、itgb2、itgb7、cd29、itgb2(lfa-1、cd18)、itgb7、tnfr2、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、pag/cbp、nkp44、nkp30、nkp46、nkg2d和nkg2c激活nk细胞受体、免疫球蛋白、btla、cd247、cd276(b7-h3)、cd30、cd84、cds、细胞因子受体、fcγ受体、gads、icam-1、igα(cd79a)、整联蛋白、lat、与cd83结合的配体、light、mhc 1类分子、pag/cbp、tnfsf14、toll配体受体、trance/rankl,或它们的片段、截短形式或组合。
[0366]
在一些实施方案中,car包含铰链结构域。铰链结构域可来源于选自由以下项组成的组的蛋白质:cd2、cd3δ、cd3ε、cd3γ、cd4、cd7、cd8.α、cd8.β、cd11a(itgal)、cd11b(itgam)、cd11c(itgax)、cd11d(itgad)、cd18(itgb2)、cd19(b4)、cd27(tnfrsf7)、cd28、cd28t、cd29(itgb1)、cd30(tnfrsf8)、cd40(tnfrsf5)、cd48(slamf2)、cd49a(itga1)、cd49d(itga4)、cd49f(itga6)、cd66a(ceacam1)、cd66b(ceacam8)、cd66c(ceacam6)、cd66d(ceacam3)、cd66e(ceacam5)、cd69(clec2)、cd79a(b细胞抗原受体复合物相关α链)、cd79b(b细胞抗原受体复合物相关β链)、cd84(slamf5)、cd96(tactile)、cd100(sema4d)、cd103(itgae)、cd134(ox40)、cd137(4-1bb)、cd150(slamf1)、cd158a(kir2dl1)、cd158b1(kir2dl2)、cd158b2(kir2dl3)、cd158c(kir3dp1)、cd158d(kirdl4)、cd158f1(kir2dl5a)、cd158f2(kir2dl5b)、cd158k(kir3dl2)、cd160(by55)、cd162(selplg)、cd226(dnam1)、cd229(slamf3)、cd244(slamf4)、cd247(cd3-zeta)、cd258(light)、cd268(baffr)、cd270(tnfsf14)、cd272(btla)、cd276(b7-h3)、cd279(pd-1)、cd314(nkg2d)、cd319(slamf7)、cd335(nk-p46)、cd336(nk-p44)、cd337(nk-p30)、cd352(slamf6)、cd353(slamf8)、cd355(crtam)、cd357(tnfrsf18)、诱导型t细胞共刺激因子(icos)、lfa-1(cd11a/cd18)、nkg2c、dap-10、icam-1、nkp80(klrf1)、il-2rβ、il-2rγ、il-7rα、lfa-1、slamf9、lat、gads(grpl)、slp-76(lcp2)、pag1/cbp、cd83配体、fcγ受体、mhc 1类分子、mhc 2类分子、tnf受体蛋白、免疫球蛋白、细胞因子受体、整联蛋白、激活nk细胞受体或toll配体受体、igg1、igg2、igg3、igg4、iga、igd、ige、igm,或它们片段或组合。
[0367]
在一些实施方案中,tcr或car抗原结合结构域或本文所述的免疫治疗剂(例如,单特异性或多特异性抗体或其抗原结合片段或抗体模拟物)结合肿瘤相关抗原(taa)。在一些
实施方案中,肿瘤相关的抗原选自由以下项组成的组:cd19;cd123;cd22;cd30;cd171;cs-1(也称为cd2子集1、cracc、slamf7、cd319和19a24);c型凝集素样分子-1(cll-1或clecli);cd33;表皮生长因子受体变体iii(egfrvlll);神经节苷脂g2(gd2);神经节苷脂gd3(αneusac(2-8)αneusac(2-3)βdgaip(1-4)bdgicp(1-1)cer);神经节苷脂gm3(αneusac(2-3)βdgalp(1-4)βdglcp(1-1)cer);gm-csf受体;tnf受体超家族成员17(tnfrsf17、bcma);b-淋巴细胞细胞粘附分子;tn抗原((tn ag)或(gainacu-ser/thr));前列腺特异性膜抗原(psma);受体酪氨酸激酶样孤儿受体1(rori);肿瘤相关糖蛋白72(tag72);cd38;cd44v6;癌胚抗原(cea);上皮细胞粘附分子(epcam);b7h3(cd276);kit(cd117);白介素-13受体亚基α-2(il-13ra2或cd213a2);间皮素;白介素11受体α(il-11ra);前列腺干细胞抗原(psca);蛋白酶丝氨酸21(testisin或prss21);血管内皮生长因子受体2(vegfr2);hla i类抗原a-2α;hla抗原;lewis(y)抗原;cd24;血小板衍生生长因子受体β(pdgfr-β);阶段特异性胚胎抗原-4(ssea-4);cd20;δ样3(dll3);叶酸受体α;叶酸受体β、gdnfα4受体、受体酪氨酸蛋白激酶、erbb2(her2/neu);细胞表面相关粘蛋白1(muc1);april受体;adp核糖基环化酶-1;ephb4酪氨酸激酶受体、dcamkl1丝氨酸苏氨酸激酶、天冬氨酸β-羟化酶、表皮生长因子受体(egfr);神经细胞粘附分子(ncam);前列腺酶;前列腺酸磷酸酶(pap);突变的延伸因子2(elf2m);肝配蛋白b2;成纤维细胞活化蛋白α(fap);胰岛素样生长因子1受体(igf-i受体)、碳酸酐酶ix(caix);蛋白酶体(prosome、macropain)亚基β型9(lmp2);糖蛋白100(gp100);由裂点簇区(bcr)和abelson鼠白血病病毒癌基因同源物1(abl)(bcr-abl)组成的癌基因融合蛋白;酪氨酸酶;肝配蛋白a型受体2(epha2);肝配蛋白a型受体3(epha3)、岩藻糖基gm1;唾液酸化lewis粘附分子(sle);转谷氨酰胺酶5(tgs5);高分子量黑素瘤相关抗原(hmwmaa);邻乙酰基-gd2神经节苷脂(oacgd2);叶酸受体β;肿瘤内皮标志物1(tem1/cd248);肿瘤内皮标志物7相关(tem7r);前列腺六跨膜上皮抗原i(steap1);封闭蛋白6(cldn6);甲状腺刺激激素受体(tshr);g蛋白偶联受体c类5组成员d(gprcsd);il-15受体(il-15);染色体x开放阅读框61(cxorf61);cd97;cd179a;间变性淋巴瘤激酶(alk);聚唾液酸;胎盘特异性1(plac1);globoh糖神经酰胺的六糖部分(globoh);乳腺分化抗原(ny-br-1);尿母细胞蛋白(uroplakin)2(upk2);甲型肝炎病毒细胞受体1(havcr1);肾上腺受体β3(adrb3);泛连接蛋白3(panx3);g蛋白偶联受体20(gpr20);淋巴细胞抗原6复合物,基因座k 9(ly6k);嗅觉受体51e2(ors ie2);tcrγ交替阅读框蛋白(tarp);wilms肿瘤蛋白(wt1);癌症/睾丸抗原1(ny-eso-1);癌症/睾丸抗原2(lage-la);黑素瘤相关抗原1(mage-a1);黑素瘤相关抗原3(mage-a3);黑素瘤相关抗原4(mage-a4);t细胞受体β2链c;位于染色体12p上的ets易位变体基因6(etv6-aml);精子蛋白17(spa17);x抗原家族成员1a(xage1);促血管生成素结合细胞表面受体2(tie2);黑素瘤癌睾丸抗原-1(madct-1);黑素瘤癌睾丸抗原-2(mad-ct-2);fos相关抗原1;肿瘤蛋白p53(p53);p53突变体;prostein;生存素;端粒酶;前列腺癌肿瘤抗原-1(pcta-1或半乳凝素8)、被t细胞1识别的黑素瘤抗原(melana或marti);大鼠肉瘤(ras)突变体;人端粒酶逆转录酶(htert);肉瘤易位断点;黑素瘤细胞凋亡抑制剂(ml-iap);erg(跨膜蛋白酶、丝氨酸2(tmprss2)ets融合基因);n-乙酰基葡糖胺转移酶v(na17);配对盒蛋白pax-3(pax3);雄激素受体;细胞周期素a1;细胞周期素b1;v-myc禽骨髓细胞瘤病毒癌基因成神经细胞瘤衍生的同源物(mycn);ras同源物家族成员c(rhoc);酪氨酸酶相关蛋白2(trp-2);细胞色素p450 1b1(cyp ibi);ccctc结合因子(锌指蛋白)样
g12d mtcr pbl、抗cd123 car t细胞疗法、抗突变新抗原tcr t细胞疗法、肿瘤裂解物/muc1/生存素加载peptivator的树突状细胞疫苗、自体树突状细胞疫苗(转移性恶性黑素瘤,真皮内/静脉内)、抗ley-scfv-cd28-ζcar t细胞、prgn-3005、ic9-gd2-car-il-15t细胞、hsc-100、atl-dc-101、midrix4-lung、midrixneo、fcr-001、plx干细胞疗法、mdr-101、geniusvac-mel4、ilixadencel、同种异体间充质干细胞疗法、romyelocel l、cynk-001、protrans、ect-100、msctrail、dilanubicel、ft-516、astvac-2、e-cel uvec、ck-0801、同种异体α/βcd3 t细胞和cd19 b细胞耗尽的干细胞(血液病,tbx-1400、hlcn-061、脐带衍生的hu-phec细胞(血液恶性肿瘤/再生障碍性贫血)、ap-011、apceth-201、apceth-301、senti-101、干细胞疗法(胰腺癌)、icovir15-cbite、cd33hsc/cd33 car-t、plx-免疫、subcuvax、基于crispr同种异体γ-δt细胞的基因疗法(癌症)、基于离体crispr同种异体健康供体nk细胞的基因疗法(癌症)、基于离体同种异体诱导的多能干细胞衍生的nk细胞的基因疗法(实体瘤)和抗cd20 car t细胞疗法(非霍奇金氏淋巴瘤)。
[0370]
靶向肿瘤的附加药剂
[0371]
用于靶向肿瘤的附加药剂包括但不限于:α-甲胎蛋白调节剂,诸如et-1402和afp-tcr;炭疽毒素受体1调节剂,诸如抗tem8 car t细胞疗法;tnf受体超家族成员17(tnfrsf17、bcma),诸如bb-2121(ide-cel)、bb-21217、jcarh125、ucart-bcma、et-140、mcm-998、lcar-b38m、cart-bcma、sea-bcma、bb212、et-140、p-bcma-101、auto-2(april-car)、jnj-68284528;抗cll-1抗体(参见例如pct/us2017/025573);抗pd-l1-car靶向活化自然杀伤细胞疗法,诸如kd-045;抗pd-l1 t-hank,诸如pd-l1 t-hank;抗cd45抗体,诸如131i-bc8(lomab-b);抗her3抗体,诸如ljm716、gsk2849330;april受体调节剂,诸如抗bcma car t细胞疗法、descartes-011;adp核糖基环化酶-1/april受体调节剂,诸如双重抗bcma/抗cd38 car t细胞疗法;cart-ddbcma;b7同源物6,诸如car-nkp30和car-b7h6;b淋巴细胞抗原cd19,诸如tbi-1501、ctl-119hucart-19t细胞、liso-cel、jcar-015us7446190、jcar-014、jcar-017(wo2016196388、wo2016033570、wo2015157386)、axicabtagene ciloleucel(kte-c19、)、kte-x19、us7741465、us6319494、ucart-19、ebv-ctl、t tisagenlecleucel-t(ctl019)、wo2012079000、wo2017049166、表达cd19car-cd28-cd3ζ-egfrt的t细胞、装甲cd19/4-1bbl的car t细胞疗法、c-car-011、cik-car.cd19、cd19car-28-ζt细胞、pcar-019、matchcart、dscar-01、im19 car-t、tc-110;抗cd19 car t细胞疗法(b细胞急性成淋巴细胞性白血病,universiti kebangsaan malaysia);抗cd19 car t细胞疗法(急性成淋巴细胞性白血病/非霍奇金淋巴瘤,university hospital heidelberg)、抗cd19 car t细胞疗法(il-6表达沉默,癌症,shanghai unicar-therapy bio-medicine technology)、mb-cart2019.1(cd19/cd20)、gc-197(cd19/cd7)、clic-1901、et-019003、抗cd19-star-t细胞、ava-001、bcma-cd19 ccar(cd19/april)、icg-134、icg-132(cd19/cd20)、cta-101、wztl-002、双重抗cd19/抗cd20 car t细胞(慢性淋巴细胞性白血病/b细胞淋巴瘤)、hy-001、et-019002、ytb-323、gc-012(cd19/april)、gc-022(cd19/cd22)、表达cd19car-cd28-cd3ζ-egfrt的tn/mem;ucar-011、ictcar-014、gc-007f、ptg-01、cc-97540;同种异体抗cd19cart细胞,诸如gc-007g;april受体调节剂;slam家族成员7调节剂bcma-cs1 ccar;自体树突状细胞肿瘤抗原(adcta),诸如adcta-ssi-g;b-淋巴细胞抗原cd20,诸如actr707 attck-20、pbcar-20a;表达cd20 car的同种异体t细胞,诸如lb-1905;b-淋巴细
胞抗原cd19/b-淋巴细胞抗原22,诸如tc-310;b-淋巴细胞抗原22细胞粘附,诸如ucart-22、jcar-018wo2016090190;ny-eso-1调节剂,诸如gsk-3377794、tbi-1301、gsk3537142;碳酸酐酶,诸如dc-ad-gmcaix;半胱天冬酶9自杀基因,诸如caspacide dli、bpx-501;ccr5,诸如sb-728;ccr5基因抑制剂/tat基因/trim5基因刺激因子,诸如慢病毒载体ccr5 shrna/trim5α/tar诱饵转导的自体cd34阳性造血祖细胞;cdw123,诸如mb-102、im-23、jez-567、ucart-123;cd4,诸如icg-122;cd5调节剂,诸如cd5.28z cart细胞;抗cd22,诸如抗cd22 cart;抗cd30,诸如tt-11;双重抗cd33/抗cll1,诸如lb-1910;cd40配体,诸如bpx-201、medi5083;cd56,诸如同种异体cd56阳性cd3阴性自然杀伤细胞(骨髓恶性肿瘤);cd19/cd7调节剂,诸如gc-197;t细胞抗原cd7调节剂,诸如抗cd7 car t细胞疗法(cd7阳性血液恶性肿瘤);cd123调节剂,诸如unicar02-t-cd123;抗cd276,诸如抗cd276 cart;ceacam蛋白5调节剂,诸如mg7-cart;封闭蛋白6,诸如csg-002;封闭蛋白18.2,诸如lb-1904;氯毒素,诸如cltx-cart;靶向ebv,诸如cmd-003;muc16egfr,诸如自体4h11-28z/fil-12/efgrt t细胞;内切核酸酶,诸如pgn-514、pgn-201;epstein-barr病毒特异性t淋巴细胞,诸如tt-10;epstein-barr核抗原1/潜伏膜蛋白1/分泌蛋白barf1调节剂,诸如tt-10x;erbb2,诸如cst-102、cidecar;神经节苷脂(gd2),诸如4scar-gd2;γδt细胞,诸如ics-200;叶酸水解酶1(folh1、谷氨酸羧肽酶ii、psma;ncbi基因id:2346),诸如cik-car.psma、cart-psma-tgfβrdn、p-psma-101;磷脂酰肌醇蛋白聚糖-3(gpc3),诸如tt-16、glycar;血红蛋白,诸如pgn-236;肝细胞生长因子受体,诸如抗cmet rna car t;hla i类抗原a-2α调节剂,诸如fh-mcva2tcr;hla i类抗原a-2α/黑素瘤相关抗原4调节剂,诸如adp-a2m4cd8;hla抗原调节剂,诸如fit-001、neotcr-p1;人乳头瘤病毒e7蛋白,诸如kite-439(参见例如pct/us2015/033129);icam-1调节剂,诸如aic-100;免疫球蛋白γfc受体iii,诸如actr087;il-12,诸如dc-rts-il-12;il-12激动剂/粘蛋白16,诸如jcar-020;il-13α2,诸如mb-101;il-15受体激动剂,诸如prgn-3006、alt-803;白介素-15/fc融合蛋白(例如xmab24306);重组白介素-15(例如am0015、niz-985);聚乙二醇化il-15(例如nktr-255);il-2,诸如cst-101;干扰素α配体,诸如自体肿瘤细胞疫苗 系统性cpg-b ifn-α(癌症);k-ras gtp酶,诸如抗kras g12v mtcr细胞疗法;神经细胞粘附分子l1 l1cam(cd171),诸如jcar-023;潜伏膜蛋白1/潜伏膜蛋白2,诸如ad5f35-lmpd1-2转导的自体树突状细胞;mart-1黑素瘤抗原调节剂,诸如mart-1f5 tcr工程改造的pbmc;黑素瘤相关抗原10,诸如mage-a10c796t mage-a10 tcr;黑素瘤相关抗原3/黑素瘤相关抗原6(mage a3/a6),诸如kite-718(参见例如pct/us2013/059608);间皮素,诸如csg-meso、tc-210;粘蛋白1调节剂,诸如ictcar-052、tn muc-1car-t、ictcar-053;抗mica/micb,诸如cyad-02;nkg2d,诸如nkr-2;ntrkr1酪氨酸激酶受体,诸如jcar-024;pramet细胞受体,诸如bpx-701;前列腺干细胞抗原调节剂,诸如mb-105;环岛同源物1调节剂,诸如atcg-427;肽聚糖识别蛋白调节剂,诸如tag-7基因修饰的自体肿瘤细胞疫苗;psma,诸如psma-car t细胞疗法(慢病毒载体、去势抵抗性前列腺癌);slam家族成员7调节剂,诸如ic9-luc90-cd828z;tgfβ受体调节剂,诸如dnr.npc t细胞;t-淋巴细胞,诸如tt-12;t-淋巴细胞刺激剂,诸如atl-001;tsh受体调节剂,诸如ictcar-051;肿瘤浸润性淋巴细胞,诸如ln-144、ln-145;和/或wilms肿瘤蛋白,诸如jtcr-016、wt1-ctl、asp-7517。
[0372]
mcl1细胞凋亡调节剂、bcl2家族成员(mcl1)抑制剂
[0373]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与mcl1细胞凋亡调节
因子(bcl2家族成员)(mcl1、tm;eat;mcl1l;mcl1s;mcl-1;bcl2l3;mcl1-es;bcl2-l-3;mcl1/eat;ncbi基因id:4170)的抑制剂组合。mcl1抑制剂的示例包括amg-176、amg-397、s-64315和azd-5991、483-lm、a-1210477、umi-77、jky-5-037,以及wo2018183418、wo2016033486、wo2019222112和wo2017147410中所述的那些。
[0374]
含细胞因子诱导型sh2的蛋白(cish)抑制剂
[0375]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与含细胞因子诱导型sh2的蛋白(cish;cis;g18;socs;cis-1;bacts2;ncbi基因id:1154)的抑制剂组合。cish抑制剂的示例包括wo2017100861、wo2018075664和wo2019213610中所述的那些。
[0376]
基因编辑物
[0377]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与基因编辑物组合。可以共同施用的例示性基因编辑系统包括但不限于crispr/cas9系统、锌指核酸酶系统、talen系统、归巢内切核酸酶系统(例如arcus)和归巢大范围核酸酶系统。
[0378]
具有未指定靶标的其他药物
[0379]
在各种实施方案中,将如本文所述的抗cd47剂或抗sirpα剂与以下物质组合:人免疫球蛋白(10%液体制剂)、cuvitru(人免疫球蛋白(20%溶液))、左亚叶酸二钠、imsa-101、bms-986288、imuno bgc moreau rj、r-oky-034f、gp-2250、ar-23、左亚叶酸钙、卟吩姆钠、rg6160、abbv-155、cc-99282、以聚苯丙生20为载体的卡莫司汀植入膜剂(polifeprosan 20with carmustine)、veregen、钆塞酸二钠、钆布醇、钆特酸葡甲胺、钆特醇、司他比锝[99mtc](99mtc-sestamibi)、泊马度胺、pacibanil和/或戊柔比星。
[0380]
例示的联合疗法
[0381]
淋巴瘤或白血病联合疗法
[0382]
一些化学治疗剂适用于治疗淋巴瘤或白血病。这些药剂包括阿地白介素、阿伏昔地、阿米福汀三水合物、氨基喜树碱、抗瘤酮a10、抗瘤酮as2-1、抗胸腺细胞球蛋白、三氧化二砷、bcl-2家族蛋白抑制剂abt-263、β-阿理新(alethine)、bms-345541硼替佐米(ps-341)、苔藓虫素1、布舒凡(bulsulfan)、坎帕斯(campath)-1h、卡铂、卡非佐米卡莫司汀、醋酸卡泊芬净、cc-5103、苯丁酸氮芥、chop(环磷酰胺、多柔比星、长春新碱和泼尼松)、顺铂、克拉屈滨、氯法拉滨、姜黄素、cvp(环磷酰胺、长春新碱和泼尼松)、环磷酰胺、环孢霉素、阿糖胞苷、地尼白介素(denileukin diftitox)、地塞米松、多西他赛、尾海兔素10、多柔比星、盐酸多柔比星、dt-pace(地塞米松、沙利度胺、顺铂、多柔比星、环磷酰胺和依托泊苷)、恩扎妥林、阿法依泊汀、依托泊苷、依维莫司(rad001)、fcm(氟达拉滨、环磷酰胺和米托蒽醌)、fcr(氟达拉滨、环磷酰胺和利妥昔单抗)、芬维a胺、非格司亭、夫拉平度(flavopiridol)、氟达拉滨、fr(氟达拉滨和利妥昔单抗)、格尔德霉素(17aag)、hypercvad(高分次环磷酰胺、长春新碱、多柔比星、地塞米松、甲氨蝶呤和阿糖胞苷)、ice(异磷酰胺、卡铂和依托泊苷)、异环磷酰胺、盐酸伊立替康、干扰素α-2b、伊沙匹隆、来那度胺(cc-5013)、泊马度胺淋巴因子活化的杀伤细胞、mcp(米托蒽醌、苯丁酸氮芥和泼尼松龙)、美法仑、美司钠、甲氨蝶呤、盐酸米托蒽醌、莫特沙芬钆、麦考酚酸莫酯、奈拉滨、奥巴克拉(obatoclax)(gx15-070)、奥利默森(oblimersen)、醋酸奥曲肽、ω-3脂肪酸、omr-igg-am(wnig、omrix)、奥沙利铂、紫
杉醇、帕博西尼(pd0332991)、培非格司亭、peg化脂质体盐酸多柔比星、派瑞弗辛(perifosin)、泼尼松龙、泼尼松、重组flt3配体、重组人血小板生成素、重组干扰素α、重组白介素-11、重组白介素-12、利妥昔单抗、r-chop(利妥昔单抗和chop)、r-cvp(利妥昔单抗和cvp)、r-fcm(利妥昔单抗和fcm)、r-ice(利妥昔单抗和ice)和r mcp(利妥昔单抗和mcp)、r-罗斯科维汀(r-roscovitine)(塞利西利布(seliciclib)、cyc202)、沙格司亭、柠檬酸西地那非、辛伐他汀、西罗莫司、苯乙烯基砜、他克莫司、坦螺旋霉素、替西罗莫司(ccl-779)、沙利度胺、治疗性同种异体淋巴细胞、噻替哌、替吡法尼、长春新碱、硫酸长春新碱、二酒石酸长春瑞滨、saha(辛二酸胺异羟肟酸或辛二酰、苯胺和异羟肟酸)、维莫非尼维奈托克(abt-199)。
[0383]
一种改良方法是放射免疫疗法,其中单克隆抗体与放射性同位素颗粒(诸如铟-111、钇-90和碘-131)组合。联合疗法的示例包括但不限于碘-131托西莫单抗钇-90替伊莫单抗和与chop。
[0384]
可将上述疗法用干细胞移植或治疗补充或者与干细胞移植或治疗组合。治疗程序包括外周血干细胞移植、自体造血干细胞移植、自体骨髓移植、抗体疗法、生物疗法、酶抑制剂疗法、全身辐照、干细胞输注、具有干细胞支持的骨髓消融、体外处理的外周血干细胞移植、脐带血移植、免疫酶技术、低let钴-60γ射线疗法、博来霉素、常规外科手术、放射疗法和非清髓性异基因造血干细胞移植。
[0385]
非霍奇金淋巴瘤联合疗法
[0386]
非霍奇金淋巴瘤(nhl)(尤其是b细胞来源的那些)的治疗包括使用单克隆抗体、标准化学疗法方法(例如chop(环磷酰胺、多柔比星、长春新碱和泼尼松)、cvp(环磷酰胺、长春新碱和泼尼松)、fcm(氟达拉滨、环磷酰胺和米托蒽醌)、mcp(米托蒽醌、苯丁酸氮芥、泼尼松龙),所有任选地包括利妥昔单抗(r)等)、放射免疫疗法以及它们的组合,尤其是抗体疗法与化学疗法的整合。
[0387]
用于治疗nhl/b细胞癌症的未缀合单克隆抗体的示例包括利妥昔单抗、阿仑单抗、人或人源化抗cd20抗体、鲁米昔单抗(lumiliximab)、抗tnf相关细胞凋亡诱导配体(抗trail)、贝伐珠单抗(bevacizumab)、加利昔单抗(galiximab)、依帕珠单抗(epratuzumab)、sgn-40和抗cd74。
[0388]
用于治疗nhl/b细胞癌症的实验抗体药剂的示例包括奥法木单抗(ofatumumab)、ha20、pro131921、阿仑单抗、加利昔单抗、sgn-40、chir-12.12、依帕珠单抗、鲁米昔单抗、阿泊珠单抗(apolizumab)、米拉妥珠单抗(milatuzumab)和贝伐珠单抗。
[0389]
nhl/b细胞癌症的化学疗法的标准方案的示例包括chop、fcm、cvp、mcp、r-chop(利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松)、r-fcm、r-cvp和r mcp。
[0390]
nhl/b细胞癌症的放射免疫疗法的示例包括钇-90替伊莫单抗和碘-131托西莫单抗
[0391]
套细胞淋巴瘤联合疗法
[0392]
套细胞淋巴瘤(mcl)的治疗性治疗包括组合化学疗法,诸如chop、hypercvad和fcm。这些方案也可以用单克隆抗体利妥昔单抗补充以形成联合疗法r-chop、hypercvad-r和r-fcm。上述疗法中的任一种可与干细胞移植或ice组合以治疗mcl。
[0393]
治疗mcl的替代方法是免疫疗法。一种免疫疗法使用单克隆抗体如利妥昔单抗。另一种使用癌症疫苗,诸如gtop-99,这些癌症疫苗基于个体患者肿瘤的基因构成。
[0394]
治疗mcl的改良方法是放射免疫疗法,其中将单克隆抗体与放射性同位素颗粒(诸如碘-131托西莫单抗和钇-90替伊莫单抗组合。在另一个示例中,用于与chop顺序治疗。
[0395]
治疗mcl的其他方法包括自体干细胞移植联合高剂量化学疗法、施用蛋白酶体抑制剂诸如硼替佐米(或ps-341)或施用抗血管生成剂诸如沙利度胺,尤其是与利妥昔单抗组合。
[0396]
另一种治疗方法是与其他化学治疗剂组合施用导致bcl-2蛋白降解并增加癌细胞对化学疗法(诸如奥利默森)的敏感性的药物。
[0397]
另一种治疗方法包括施用可以导致对细胞生长的抑制甚至细胞死亡的mtor抑制剂。非限制性示例为西罗莫司、替西罗莫司(cci-779)、cc-115、cc-223、sf-1126、pqr-309(比拉利西布(bimiralisib))、沃塔西布(voxtalisib)、gsk-2126458以及与或其他化学治疗剂组合的替西罗莫司。
[0398]
已经公开了其他最近的mcl疗法。此类示例包括夫拉平度、帕博西尼(pd0332991)、r-罗斯科维汀(塞利西利布、cyc202)、苯乙烯基砜、奥巴克拉(gx15-070)、trail、抗trail死亡受体dr4和dr5抗体、替西罗莫司(ccl-779)、依维莫司(rad001)、bms-345541、姜黄素、saha、沙利度胺、来那度胺(cc-5013)和格尔德霉素(17aag)。
[0399]
华氏巨球蛋白血症联合疗法
[0400]
用于治疗华氏巨球蛋白血症(wm)的治疗剂包括阿地白介素、阿仑单抗、阿伏昔地、阿米福汀三水合物、氨基喜树碱、抗瘤酮a10、抗瘤酮as2-1、抗胸腺细胞球蛋白、三氧化二砷、自体人肿瘤来源的hsppc-96、bcl-2家族蛋白抑制剂abt-263、β-阿理新、硼替佐米苔藓虫素1、布舒凡、坎帕斯-1h、卡铂、卡莫司汀、醋酸卡泊芬净、cc-5103、顺铂、氯法拉滨、环磷酰胺、环孢霉素、阿糖胞苷、地尼白介素、地塞米松、多西他塞、尾海兔素10、盐酸多柔比星、dt-pace、恩扎妥林、阿法依泊汀、依帕珠单抗(hll2-抗-cd22人源化抗体)、依托泊苷、依维莫司、芬维a胺、非格司亭、氟达拉滨、依鲁替尼、异磷酰胺、铟-111单克隆抗体mn-14、碘-131托西莫单抗、盐酸伊立替康、伊沙匹隆、淋巴因子活化的杀伤细胞、美法仑、美司钠、甲氨蝶呤、盐酸米托蒽醌、单克隆抗体cd19(诸如tisagenlecleucel-t、cart-19、ctl-019)、单克隆抗体cd20、莫特沙芬钆、麦考酚酸莫酯、奈拉滨、奥利默森、醋酸奥曲肽、ω-3脂肪酸、奥沙利铂、紫杉醇、培非格司亭、peg化脂质体盐酸多柔比星、喷司他丁、派瑞弗辛、泼尼松、重组flt3配体、重组人血小板生成素、重组干扰素α、重组白介素-11、重组白介素-12、利妥昔单抗、沙格司亭、柠檬酸西地那非辛伐他汀、西罗莫司、他克莫司、坦螺旋霉素、沙利度胺、治疗性同种异体淋巴细胞、噻替哌、替吡法尼、托西莫单抗、优库路单抗(ulocuplumab)、维妥珠单抗(veltuzumab)、硫酸长春新碱、二酒石酸长春瑞滨、伏立诺他、wt1 126-134肽疫苗、wt-1类似肽疫苗、钇-90替伊莫单抗、钇-90人源化依帕珠单抗以及它们的任何组合。
[0401]
用于治疗wm的治疗程序的示例包括外周血干细胞移植、自体造血干细胞移植、自体骨髓移植、抗体疗法、生物疗法、酶抑制剂疗法、全身辐照、干细胞输注、干细胞支持下进行骨髓消融、经体外处理的外周血干细胞移植、脐带血移植、免疫酶技术、低let钴-60γ射线疗法、博来霉素、常规外科手术、放射疗法和非骨髓消融性同种异体造血干细胞移植。
[0402]
弥漫性大b细胞淋巴瘤联合疗法
[0403]
用于治疗弥漫性大b细胞淋巴瘤(dlbcl)的治疗剂包括环磷酰胺、多柔比星、长春新碱、泼尼松、抗cd20单克隆抗体、依托泊苷、博来霉素、针对wm列出的许多药剂,以及它们的任何组合,诸如ice和rice。
[0404]
慢性淋巴细胞白血病联合疗法
[0405]
用于治疗慢性淋巴细胞性白血病(cll)的治疗剂的示例包括苯丁酸氮芥、环磷酰胺、氟达拉滨、喷司他丁、克拉屈滨、多柔比星、长春新碱、泼尼松、泼尼松龙、阿仑单抗、针对wm列出的许多药剂以及组合化学疗法和化学免疫疗法,包括以下常见组合方案:cvp、r-cvp、ice、r-ice、fcr和fr。
[0406]
骨髓纤维化联合疗法
[0407]
骨髓纤维化抑制剂包括但不限于刺猬蛋白(hedgehog)抑制剂、组蛋白脱乙酰酶(hdac)抑制剂和酪氨酸激酶抑制剂。刺猬蛋白抑制剂的非限制性示例为萨瑞德吉(saridegib)和维斯莫吉布(vismodegib)。hdac抑制剂的示例包括但不限于普西司他(pracinostat)和帕比司他(panobinostat)。酪氨酸激酶抑制剂的非限制性示例为来他替尼、博舒替尼、伊马替尼、雷多替尼和卡博替尼。
[0408]
过度增生性障碍联合疗法
[0409]
吉西他滨、纳布-紫杉醇和吉西他滨/纳布-紫杉醇可与jak抑制剂和/或pi3kδ抑制剂一起使用以治疗过度增生性障碍。
[0410]
癌症
[0411]
术语“癌症”、“赘生物”和“肿瘤”在本文中可互换使用,是指以下细胞:其表现出自主的、不受调节的生长,使得它们表现出特征在于对细胞增殖明显失去控制的异常生长表型。本技术中的用于检测、分析或治疗的感兴趣细胞包括癌前(例如良性)细胞、恶性细胞、转移前细胞、转移细胞和非转移细胞。几乎每种组织的癌症都是已知的。短语“癌症负荷”是指受试者中的癌细胞量或癌体积。减少癌症负荷相应地是指减少受试者中的癌细胞数目或癌体积。如本文所用,术语“癌细胞”是指作为癌细胞或者来源于癌细胞(例如,癌细胞的克隆)的任何细胞。本领域技术人员已知许多类型的癌症,包括实体肿瘤诸如上皮癌、肉瘤、胶质母细胞瘤、黑素瘤、淋巴瘤、骨髓瘤等,以及循环癌症诸如白血病。
[0412]
癌症的“病理学”包括损害患者健康的所有现象。这包括但不限于:异常或不可控制的细胞生长、转移、干扰相邻细胞的正常功能、以异常水平释放细胞因子或其他分泌产物、抑制或加重炎症或免疫应答、瘤形成、癌前病变、恶性肿瘤、侵袭周围或远处的组织或器官(诸如淋巴结等)。
[0413]
如本文所用,术语“癌症复发”和“肿瘤复发”及其语法变型是指在诊断癌症后赘生性细胞或癌性细胞的进一步生长。具体地讲,当在癌性组织中发生进一步的癌性细胞生长时,可能出现复发。类似地,当肿瘤细胞扩散到局部或远处的组织和器官中时,出现“肿瘤扩散”;因此,肿瘤扩散涵盖肿瘤转移。当肿瘤生长局部扩展,通过压制、破坏或阻止正常器官
功能而损害所涉及组织的功能时,出现“肿瘤侵袭”。
[0414]
如本文所用,术语“转移”是指癌性肿瘤在不直接与原始癌性肿瘤的器官相连的器官或身体部分中的生长。转移应理解为包括微转移,所述微转移是在不直接与原始癌性肿瘤的器官相连的器官或身体部分中存在不可检测量的癌性细胞。转移还可以被定义为过程的几个步骤,诸如癌细胞从原始肿瘤部位离开,以及癌细胞向身体其他部分迁移和/或侵袭。
[0415]
在一些实施方案中,患者具有低突变负荷。在一些实施方案中,患者具有高突变负荷。如本领域中已知的,癌症类型可以在平均或具体的突变程度上变化,其中较高水平的突变与新抗原的表达增加相关联。参见例如,vogelstein等人,(2013),出处同上。低突变负荷可以是每个肿瘤的平均数目或单个肿瘤的具体数目为每个肿瘤具有最多约10个、最多约20个、最多约30个、最多约40个、最多约50个非同义突变的癌症类型。高突变负荷可以是每个肿瘤具有大于约50个、大于约75个、大于约100个、大于约125个、大于约150个非同义突变的癌症类型。
[0416]
cd20 癌症
[0417]
本文提供了治疗患有cd20 癌症的个体或者减小受试者中的这种癌症的大小的方法,包括:将治疗有效量的抗cd47抗体施用于该受试者;以及任选地将治疗有效量的至少一种附加药剂(诸如抗cd20剂)施用于该受试者。
[0418]
在一些实施方案中,cd20 癌症是b细胞癌症。在一些实施方案中,受试者患有b细胞血液恶性肿瘤。在一些实施方案中,cd20 癌症是惰性或侵袭性淋巴瘤。在一些实施方案中,受试者患有复发性或难治性形式的b细胞癌症。b细胞癌症可以包括非霍奇金氏淋巴瘤(nhl)。在一些实施方案中,nhl是低级nhl或高风险nhl。在一些实施方案中,nhl是滤泡性(例如,大体积、非大体积或晚期滤泡性)或非滤泡性nhl。
[0419]
nhl可以包括惰性淋巴瘤。惰性淋巴瘤可以包括滤泡性淋巴瘤(fl)。惰性淋巴瘤可以包括边缘区淋巴瘤。
[0420]
nhl可以包括弥漫性大b细胞淋巴瘤(dlbcl)。nhl还可以包括dlbcl亚型,诸如从头dlbcl或转化性dlbcl。dlbcl可以来自不同来源的细胞,包括活化b细胞、生发中心b细胞和双重打击淋巴瘤。
[0421]
cd20 癌症可以包括弥漫性大b细胞淋巴瘤(dlbcl)(包括复发性或难治性)、滤泡性淋巴瘤(fl)(包括复发性、难治性或无症状性)、非霍奇金氏淋巴瘤(nhl)(包括复发性或难治性)、边缘区淋巴瘤(例如淋巴结外边缘区淋巴瘤)、套细胞淋巴瘤(mcl)(包括复发性或难治性)、慢性淋巴细胞性白血病(cll)/小淋巴细胞性白血病(包括复发性或难治性)、华氏巨球蛋白血症/淋巴浆细胞性淋巴瘤、原发性纵隔b细胞淋巴瘤、伯基特氏淋巴瘤、双重打击淋巴瘤(例如,具有myc和bcl2或bcl6重排中的一者或两者的高级b细胞淋巴瘤)、myc重排淋巴瘤、未分类b细胞淋巴瘤、b细胞急性淋巴母细胞性白血病(all)(例如,费城染色体阴性急性淋巴母细胞性白血病)、或移植后淋巴细胞增生性疾病(ptld)。给定的cd20 癌症亚型(诸如本文所公开的那些)可以基于组织病理学、流式细胞术、分子分类、一种或多种等效测定或者它们的组合进行分类。
[0422]
cd20 癌症可以包括双重打击淋巴瘤(例如,具有myc和bcl2和/或bcl6重排的高级c细胞淋巴瘤)。cd20 癌症可以包括myc重排淋巴瘤。
[0423]
测定
[0424]
在一些方面,存在或不存在b细胞(例如,cd19 b细胞或cd20 b细胞)可以通过测定来确定。存在或不存在b细胞可以使用检测cd19/cd20特异性蛋白(例如,cd19和cd20)的测定来检测。此外,抗体(例如抗体治疗,诸如抗cd47抗体(例如,莫洛利单抗)和抗cd20抗体(例如,利妥昔单抗))的血清水平也可以通过测定来定量。
[0425]
示例测定可以包括免疫组织化学、流式细胞术、大量细胞计数法(cytof),或者通过rna分析或rna测序、微阵列分析或其他基因表达谱方法的基因表达。可以用于测量存在/不存在b细胞的测定的附加示例包括:dna测定(包括全基因组或外显子组测序)、微阵列、聚合酶链反应(pcr)、rt-pcr、南方墨点法、北方墨点法、抗体结合测定、酶联免疫吸附测定(elisa)、蛋白质测定、西方墨点法、散射比浊法、透射比浊法、色谱法、质谱法、免疫测定法,包括例如但不限于:ria、免疫荧光、免疫化学发光、免疫电化学发光或竞争性免疫测定法,以及免疫沉淀法。测定的另外的示例可以包括b细胞耐药组套、免疫球蛋白测序,或酶联免疫斑点(elispot)测定。来自测定的信息可以是定量的,并且被发送到本发明的计算机系统。该信息还可以是定性的,诸如观察模式或荧光,其可以由用户或者自动地由读取器或计算机系统转换成定量量度。在一个实施方案中,受试者还可以向计算机系统提供除测定信息以外的信息,诸如种族、身高、体重、年龄、性别、眼睛颜色、头发颜色、家族病史,以及任何其他可能对用户有用的信息(诸如临床因素)。
[0426]
蛋白质检测测定是用于检测来自样品的给定蛋白质(例如,抗cd47抗体或抗cd20抗体)的表达水平的测定。蛋白质检测测定在本领域中是公知的,并且可以包括免疫测定法、蛋白质结合测定、基于抗体的测定、基于抗原结合蛋白的测定、基于蛋白质的测定、酶联免疫吸附测定(elisa)、流式细胞术、蛋白质测定、墨点法、西方墨点法、散射比浊法、透射比浊法、色谱法、质谱法、酶活性和免疫测定法,其中免疫测定法选自ria、免疫荧光、免疫化学发光、免疫电化学发光、免疫电泳、竞争性免疫测定法和免疫沉淀法。可以用于测量抗体的血清水平的示例性实例测定包括:elisa、免疫测定法、elispot、荧光斑点、流式细胞术、西方墨点法、光谱法(例如,液相色谱法-质谱法)、或表面等离子体共振。
[0427]
使用与由改变的核酸编码的多肽特异性结合的如上所述抗体或与由未改变的核酸编码的多肽特异性结合的抗体,或者与由核酸编码的特定剪接变体特异性结合的抗体,基于蛋白质的分析可以用于鉴定测试样品中存在特定剪接变体或者由多态性或改变的核酸编码的多肽,或者测试样品中不存在特定剪接变体或者由非多态性或未改变的核酸编码的多肽。存在由多态性或改变的核酸编码的多肽,或者不存在由非多态性或未改变的核酸编码的多肽,是对冠状动脉疾病易感性的诊断标准。
[0428]
在一个方面,将测试样品中由核酸编码的多肽的水平或量与对照样品中由该核酸编码的多肽的水平或量进行比较。测试样品中的多肽的水平或量高于或低于对照样品中的该多肽的水平或量,使得差异在统计学上有显著意义,指示由核酸编码的多肽的表达发生改变,并且具有诊断性。替代性地,将测试样品中由核酸编码的多肽的组成与对照样品中由该核酸编码的多肽的组成(例如,存在不同的剪接变体)进行比较。与对照样品中多肽的组成相比,测试样品中多肽的组成的差异具有诊断性。在另一方面,可以在测试样品和对照样品中既评估多肽的水平或量,又评估多肽的组成。与对照样品相比,测试样品中的多肽的量或水平的差异;与对照样品相比,测试样品中的多肽的组成的差异;或者量或水平的差异以
及组成的差异两者,指示受试者是应当用增加的抗cd47抗体还是减少的抗cd47抗体进行治疗。
[0429]
此外,本领域技术人员还将理解,上述方法通常也可以用于检测不包括多态性的标志物。
[0430]
在一些方面,从其取得样品用于测定的受试者具有活化b细胞(abc)dlbcl。在一些方面,从其取得样品用于测定的受试者具有非生发中心b细胞(gcb)dlbcl。在一些方面,受试者相对于(正常)对照具有增加的cd47表达,并且将抗cd47抗体施用于该受试者,任选地该受试者具有abc或非生发中心b细胞(gcb)dlbcl。abc或gcb状态的确定可以通过例如基因表达谱来进行。
[0431]
可以进一步进行测定以确定待提供给受试者的治疗剂(例如,抗cd47抗体或抗cd20抗体)的有效剂量。这种测定的一个示例是受体占有率(ro)测定,其测量结合剂(例如抗cd47抗体(ab))的占有水平。测量cd47 ro水平的目的是确定cd47结合剂的剂量、cd47受体饱和度与药理作用之间的关系。随时间推移的受体占有率百分比可以提供关于产生期望的药理作用所需的药物量或暴露持续时间的有用信息。该测定可以用于通过测量替代细胞上的cd47 ro,例如cd45阴性(-)红细胞(rbc)和cd45阳性( )白细胞(wbc)或其他细胞群(例如通过组织活检获得的骨髓或组织细胞)上的cd47 ro,来确定体内的总ro。ro测定还可以用于确定靶细胞(例如rbc、白血病细胞或实体肿瘤细胞)上的cd47ro,其用于cd47结合和/或阻断疗法。
[0432]
感兴趣的是使用该测定来确定与期望的药理作用相关联的cd47受体占有率的阈值。该阈值可以通过离体(体外)进行的测定或者通过在体内给药/治疗期间分析样品来确定。
[0433]
在该测定的一个实施方案中,通过使用各种浓度的荧光染料偶联抗体制作关于感兴趣细胞的cd47结合标准曲线。通过以下方式来测量受体占有率:以不同的浓度将靶细胞与未标记抗体一起温育,然后基于标准曲线,在体外吞噬作用中测定靶细胞,或者将靶细胞与饱和浓度的标记抗体一起温育,并且通过流式细胞术对结合进行分析。如下计算受体占有率:
[0434]
%ro=100
–
((mfi
测试
–
mfi
未染色
)/(mfi
饱和std
–
mfi
未染色
))
×
100
[0435]
在其他实施方案中,以下述方式来进行测定:向患者输注限定剂量的抗体,通常在输注抗体之前和之后从患者获得组织样品,例如血液样品。将组织样品与饱和浓度的标记抗体一起温育,并且通过流式细胞术进行分析。该分析可以例如对红细胞、白细胞、癌细胞等进行设门。
[0436]
已经发现,在rbc上实现至少约80%cd47饱和度的初免剂量足以诱导对贫血的补偿并且在后续的剂量中降低贫血的程度。在人类中,已经发现初免剂量如上所述,即约0.5mg/kg至约5mg/kg,例如1mg/kg。在一些实施方案中,用候选cd47结合剂进行受体占有率测定,以确定在rbc上提供至少约50%饱和度、至少约60%饱和度、至少约70%饱和度、至少约80%饱和度、至少约90%饱和度、至少约95%饱和度、至少约99%饱和度或更高饱和度的初免剂量水平。
[0437]
在一些实施方案中,进行受体占有率测定,以确定候选抗cd47剂(例如,结合cd47、sirpα多肽等的抗体)的适当初免剂量。
[0438]
使用方法
[0439]
提供了用治疗剂量的抗cd47剂治疗受试者的方法。例如,该方法可以包括治疗患有cd20 癌症的人类受试者或减小人类受试者的cd20 癌症的大小,包括:(a)将抗cd47抗体以大于或等于每kg体重10mg抗体的剂量施用于受试者;和(b)将抗cd20抗体施用于该受试者。在各种实施方案中,在将抗cd47抗体和抗cd20抗体施用于受试者之前,所述方法还包括确定或已经确定b细胞存在于该受试者中,这可以意味着该受试者有资格接受所述抗体治疗。
[0440]
所述方法可以包括将初免剂施用于受试者的步骤,之后是将治疗有效剂量的抗cd47剂施用于受试者的步骤。在一些实施方案中,施用治疗有效剂量的步骤在开始施用初免剂之后至少约3天(例如至少约4天、至少约5天、至少约6天、至少约7天、至少约8天、至少约9天或至少约10天)之后进行。该时间段例如足以使个体的网织红细胞产量增加。
[0441]
施用治疗有效剂量的抗cd47剂能够以许多不同的方式实现。在一些情况下,在施用初免剂之后施用两个或更多个治疗有效剂量。治疗有效剂量的适当施用可能需要施用单次剂量,或者可能需要每天一次、半周一次、每周一次、每两周一次、每月一次、每年一次等施用多个剂量。在一些情况下,治疗有效剂量作为两个或更多个浓度递增剂量(即,逐渐增大的剂量)施用,其中(i)所有的剂量都是治疗剂量,或者其中(ii)最初给予一个亚治疗剂量(或者两个或更多个亚治疗剂量)并且通过所述递增实现治疗剂量。作为说明递增浓度(即,逐渐增大的剂量)的一个非限制性示例,治疗有效剂量可以从亚治疗剂量(例如少于10mg/kg的剂量,例如5mg/kg、4mg/kg、3mg/kg、2mg/kg、1mg/kg的剂量)开始每周施用,并且每个后续剂量可以增加特定的增量(例如,增加5mg/kg、10mg/kg、15mg/kg),或者增加可变的增量,直到达到治疗剂量(例如,15mg/kg、30mg/kg、45mg/kg、60mg/kg)为止,此时可以停止施用,或者可以继续施用一个或多个附加治疗剂量(例如,连续的治疗剂量、递增的治疗剂量,例如15mg/kg、30mg/kg、45mg/kg、60mg/kg的剂量)。作为说明递增浓度(即,逐渐增大的剂量)的另一个非限制性示例,治疗有效剂量可以从一个或多个相对较低的治疗剂量(例如10mg/kg、15mg/kg、30mg/kg的剂量)开始每周施用,并且每个后续剂量可以增加特定的增量(例如,增加10mg/kg或15mg/kg),或者增加可变的增量,直到达到相对较高的治疗剂量(例如,30mg/kg、45mg/kg、60mg/kg、100mg/kg等)为止,此时可以停止施用,或者可以继续施用(例如,一个或多个连续的治疗剂量或递增剂量,例如30mg/kg、45mg/kg、60mg/kg、100mg/kg等剂量)。在一些实施方案中,施用治疗有效剂量可以是连续输注,并且该剂量可以随时间推移而改变(例如,递增)。
[0442]
剂量和频率可以根据抗cd47剂在患者中的半衰期而变化。本领域的技术人员应当理解,此类指导方针将针对以下过程中的活性剂的分子量进行调整:例如抗体片段的使用中、抗体偶联物的使用中、sirpα试剂的使用中、可溶性cd47肽的使用中等。对于局部施用(例如鼻内、吸入等),或者对于全身施用(例如肌内(i.m.)、腹膜内(i.p.)、静脉内(i.v.)、皮下(s.c.)等),剂量也可以变化。
[0443]
cd47结合剂的初始剂量,包括但不限于初免剂量,可以在输注后立即导致血凝集一段时间。不受理论的约束,据信多价cd47结合剂的初始剂量可以引起与该结合剂结合的rbc的交联。在本发明的某些实施方案中,将cd47结合剂以初始剂量,并且任选地以后续剂量,在一定时间段内并且/或者以一定的浓度输注给患者,所述时间段和/或浓度降低其中
存在高局部浓度的rbc和该结合剂的血液微环境的可能性。
[0444]
在一些实施方案中,cd47结合剂的初始剂量在至少约2小时、至少约2.5小时、至少约3小时、至少约3.5小时、至少约4小时、至少约4.5小时、至少约5小时、至少约6小时或更长时间的时期内输注。在一些实施方案中,初始剂量在约2.5小时至约6小时;例如约3小时至约4小时的时间段内输注。在一些此类实施方案中,输注物中药剂的剂量为约0.05mg/ml至约0.5mg/ml;例如约0.1mg/ml至约0.25mg/ml。
[0445]
在其他实施方案中,cd47结合剂的初始剂量(例如初免剂量)通过连续融合(例如作为渗透泵、递送贴剂等)施用,其中该剂量在至少约6小时、至少约12小时、至少约24小时、至少约2天、至少约3天的时期内施用。许多此类系统在本领域中是已知的。例如,duros技术提供了由活塞隔开的双隔室系统。隔室之一包括渗透动力系统,该渗透动力系统特别地配制有过量的固体nacl,使得其在整个递送期中保持存在并且导致恒定的渗透梯度。该隔室还包括在一端的半透膜,水通过该半透膜被吸入渗透动力系统中,并且在组织水与渗透动力系统之间建立大且恒定的渗透梯度。另一个隔室包括药物溶液和孔,药物由于渗透梯度从该孔释放。这有助于在植入人体时提供部位特异性和全身性的药物递送。优选的植入部位是在上臂内侧皮下放置。
[0446]
在施用初免剂并且允许经过有效地使网织红细胞产量增加的一段时间之后,施用治疗剂量的抗cd47剂。治疗剂量能够以多种不同的方式施用。在一些实施方案中,在施用初免剂之后施用两个或更多个治疗有效剂量,例如以每周给药时间表。在一些实施方案中,治疗有效剂量的抗cd47剂作为两个或更多个浓度递增剂量施用,在其他情况下剂量是相等的。初免剂量后血凝集减少。
[0447]
附加药剂可以增强抗cd47剂的功效。抗cd47抗体可以与附加药剂组合施用或在附加药剂之前施用。
[0448]
将本文所述的抗cd47抗体与附加药剂的组合给予具有对这些疗法有反应的肿瘤亚型的患者。如本文所述,这些肿瘤可以通过较高的突变频率来定义,较高的突变频率导致更多的肿瘤抗原,因此更具免疫原性。在一些实施方案中,用联合疗法治疗的患者对用免疫活化剂或检查点抑制剂治疗有反应;然而,这仅代表特定的潜在反应性肿瘤亚型内的大约25%患者的子集。在一些实施方案中,个体可以对铂疗法敏感或具有抗性。
[0449]
在一些实施方案中,主题方法包括将初免剂施用于受试者的步骤,之后是将治疗有效剂量的抗cd47抗体和附加药剂施用于受试者的步骤。在一些实施方案中,施用治疗有效剂量的步骤在开始施用初免剂之后至少约3天(例如至少约4天、至少约5天、至少约6天、至少约7天、至少约8天、至少约9天或至少约10天)之后进行。该时间段例如足以使个体的网织红细胞产量增加。
[0450]
施用治疗有效剂量的抗cd47抗体和/或附加药剂能够以许多不同的方式实现。在一些情况下,在施用初免剂之后施用两个或更多个治疗有效剂量。治疗有效剂量的适当施用可能需要施用单次剂量,或者可能需要每天一次、半周一次、每周一次、每两周一次、每月一次、每年一次等施用多个剂量。在一些情况下,治疗有效剂量作为两个或更多个浓度递增剂量(即,逐渐增大的剂量)施用,其中(i)所有的剂量都是治疗剂量,或者其中(ii)最初给予一个亚治疗剂量(或者两个或更多个亚治疗剂量)并且通过所述递增实现治疗剂量。作为说明递增浓度(即,逐渐增大的剂量)的一个非限制性示例,治疗有效剂量可以从亚治疗剂
量(例如5mg/kg的剂量)开始每周施用,并且每个后续剂量可以增加特定的增量(例如,增加5mg/kg),或者增加可变的增量,直到达到治疗剂量(例如,30mg/kg)为止,此时可以停止施用,或者可以继续施用(例如,连续的治疗剂量,例如30mg/kg的剂量)。作为说明递增浓度(即,逐渐增大的剂量)的另一个非限制性示例,治疗有效剂量可以从治疗剂量(例如10mg/kg的剂量)开始每周施用,并且每个后续剂量可以增加特定的增量(例如,增加10mg/kg),或者增加可变的增量,直到达到治疗剂量(例如,30mg/kg、100mg/kg等)为止,此时可以停止施用,或者可以继续施用(例如,连续的治疗剂量,例如30mg/kg、100mg/kg等剂量)。在一些实施方案中,施用治疗有效剂量可以是连续输注,并且该剂量可以随时间推移而改变(例如,递增)。
[0451]
剂量和频率可以根据抗cd47抗体和/或附加药剂在患者中的半衰期而变化。本领域的技术人员应当理解,此类指导方针将针对以下过程中的活性剂的分子量进行调整:例如抗体片段的使用中、抗体偶联物的使用中、sirpα试剂的使用中、可溶性cd47肽的使用中等。对于局部施用(例如鼻内、吸入等),或者对于全身施用(例如i.m.、i.p.、i.v.、s.c.等),剂量也可以变化。
[0452]
在本发明的某些实施方案中,将cd47抗体以初始剂量,并且任选地以后续剂量,在一定时间段内并且/或者以一定的浓度输注给患者,所述时间段和/或浓度降低其中存在高局部浓度的rbc和该结合剂的血液微环境的可能性。
[0453]
在本发明的一些实施方案中,抗cd47抗体的初始剂量在至少约2小时、至少约2.5小时、至少约3小时、至少约3.5小时、至少约4小时、至少约4.5小时、至少约5小时、至少约6小时或更长时间的时期内输注。在一些实施方案中,初始剂量在约2.5小时至约6小时;例如约3小时至约4小时的时间段内输注。在一些此类实施方案中,输注物中药剂的剂量为约0.05mg/ml至约0.5mg/ml;例如约0.1mg/ml至约0.25mg/ml。
[0454]
另外的联合疗法
[0455]
在一些实施方案中,本文所提供的抗体与至少一种附加治疗剂一起施用。任何合适的附加治疗剂可以与本文所提供的抗体一起施用。
[0456]
在一些实施方案中,附加治疗剂包括免疫刺激剂。在一些实施方案中,免疫刺激剂是阻断免疫细胞的抑制性受体或其配体的信号传导的药剂。在一些方面,抑制性受体或配体是pd-1或pd-l1。在一些方面,该药剂选自抗pd-1抗体(例如派姆单抗或纳武单抗)、抗pd-l1抗体(例如阿特珠单抗),以及它们的组合。在一些方面,该药剂是派姆单抗。在一些方面,该药剂是纳武单抗。在一些方面,该药剂是阿特珠单抗。
[0457]
表4包含阿特珠单抗的重链序列和轻链序列。
[0458][0459]
在一些实施方案中,附加治疗剂是抑制pd-1与pd-l1之间的相互作用的药剂。在一些方面,抑制pd-1与pd-l1之间的相互作用的附加治疗剂选自抗体、肽模拟物和小分子。在一些方面,抑制pd-1与pd-l1之间的相互作用的附加治疗剂选自派姆单抗、纳武单抗、阿特珠单抗、阿维鲁单抗、度伐利尤单抗、替雷利珠单抗、西米普利单抗、bms-936559、磺胺间甲氧嘧啶1、磺胺甲二唑2,以及它们的组合。在一些实施方案中,抑制pd-1与pd-l1之间的相互作用的附加治疗剂是本领域已知的具有这种活性的任何治疗剂,例如,如weinmann等人,chem med chem,2016,14:1576(doi:10.1002/cmdc.201500566)中所述的,该文献全文以引用方式并入本文。在一些实施方案中,抑制pd-1与pd-l1之间的相互作用的药剂与本文所提供的抗体配制在相同的药物组合物中。在一些实施方案中,抑制pd-1与pd-l1之间的相互作用的药剂与本文所提供的抗体配制在不同的药物组合物中。在一些实施方案中,抑制pd-1与pd-l1之间的相互作用的药剂在施用本文所提供的抗体之前施用。在一些实施方案中,抑制pd-1与pd-l1之间的相互作用的药剂在施用本文所提供的抗体之后施用。在一些实施方案中,抑制pd-1与pd-l1之间的相互作用的药剂与本文所提供的抗体同时施用,但是该药剂和该抗体在分开的药物组合物中施用。
[0460]
在一些实施方案中,附加治疗剂包括bcl-2/bcl-xl抑制剂。bcl-2/bcl-xl抑制剂可以包括维奈托克、纳维托克和/或azd0466,或其他。在一些实施方案中,bcl-2/bcl-xl抑制剂与本文所提供的抗体配制在相同的药物组合物中。在一些实施方案中,bcl-2/bcl-xl抑制剂与本文所提供的抗体配制在不同的药物组合物中。在一些实施方案中,bcl-2/bcl-xl抑制剂在施用本文所提供的抗体之前施用。在一些实施方案中,bcl-2/bcl-xl抑制剂在
施用本文所提供的抗体之后施用。在一些实施方案中,bcl-2/bcl-xl抑制剂与本文所提供的抗体同时施用,但是该bcl-2/bcl-xl抑制剂和该抗体在分开的药物组合物中施用。
[0461]
在一些实施方案中,附加治疗剂包括一种或多种化学治疗剂。示例的化学治疗剂包括抗代谢物抗肿瘤剂(例如,氟尿嘧啶、克拉屈滨、甲氨蝶呤、巯嘌呤、培美曲塞、吉西他滨、卡培他滨、羟基脲、氟达拉滨、普拉曲沙、奈拉滨、氯法拉滨、地西他滨、阿糖胞苷和氟尿苷)、烷基化剂(例如,苯达莫司汀、苯丁酸氮芥、环磷酰胺、异环磷酰胺、卡莫司汀、洛莫司汀、白消安、达卡巴嗪、替莫唑胺、六甲蜜胺和噻替派),以及铂抗肿瘤药物(例如,顺铂、卡铂和奥沙利铂)。
[0462]
受试者状态、资格和治疗
[0463]
被施用抗cd47剂和抗cd20剂的患有癌症的受试者可以具有某种状态。该状态可以用于确定受试者接受施用所述治疗剂的资格。在一些实施方案中,被确定为有资格的受试者与被确定为没有资格的不同受试者相比,更可能受益于施用两种药剂。
[0464]
参考图1,该图是根据一个实施方案的用于确定血癌受试者110接受治疗的资格的示例流程。评价血癌受试者110的状态,以便确定120该血癌受试者接受治疗的资格。
[0465]
受试者状态的一般示例可以包括:受试者是存在b细胞还是不存在b细胞、受试者目前患有的癌症的类型、受试者已经历的先前疗法的数量、受试者是否是某些疗法后复发的或某些疗法难治的、受试者是否可以接受car-t治疗,以及自从受试者最后一次接受治疗(例如,抗cd20治疗)以来的时间量。
[0466]
作为一个具体示例,血癌受试者的状态可以是该受试者在至少1条、2条、3条、4条、5条、6条、7条、8条、9条、10条或大于10条在先癌症治疗线后复发,或者该受试者是至少1条、2条、3条、4条、5条、6条、7条、8条、9条、10条或大于10条在先癌症治疗线难治的。受试者状态的附加示例包括受试者可以是利妥昔单抗难治的。受试者可以对利妥昔单抗具有抗性。利妥昔单抗难治状态可以是在任何先前的含有利妥昔单抗的方案期间不能作出反应或出现进展,或者在最后一个利妥昔单抗剂量的6个月内出现进展。利妥昔单抗难治状态可以是在最后一个先前的含有利妥昔单抗的方案期间不能作出反应或出现进展,或者在最后一个利妥昔单抗剂量的6个月内出现进展。
[0467]
在一些方面,受试者状态包括受试者患有滤泡性淋巴瘤(fl)并且/或者已接受至少两种先前的全身性疗法。在一些方面,受试者患有滤泡性淋巴瘤(fl)并且在含有利妥昔单抗的方案之后复发,或者是含有利妥昔单抗的方案难治的。
[0468]
在一些方面,受试者状态包括受试者患有复发性或难治性大b细胞淋巴瘤并且/或者已接受两条或更多条全身性治疗线。在一些方面,受试者患有一线疗法难治的从头或转化性大b细胞淋巴瘤,或者是二线挽救方案或自体造血细胞移植后复发的,或二线挽救方案或自体造血细胞移植难治的。在一些方面,受试者患有大b细胞淋巴瘤,并且在两条或更多条全身性治疗线(包括含有利妥昔单抗的方案)之后复发,或者是两条或更多条全身性治疗线(包括含有利妥昔单抗的方案)难治的。
[0469]
在一些方面,受试者状态是b细胞存在或不存在于受试者中。在一些实施方案中,受试者的状态是存在cd19 b细胞。在一些实施方案中,受试者的状态是存在cd20 b细胞。在一些实施方案中,受试者的状态是存在cd19 b细胞和cd20 b细胞两者。
[0470]
返回图1,使用血癌受试者的状态来确定120该血癌受试者的资格。图1描绘了一个
实施方案,其中确定120该血癌受试者的资格包括确定115a b细胞存在于该血癌受试者中。在一个实施方案中,如果确定受试者存在b细胞,则该受试者有资格接受该治疗。相比之下,如果确定受试者不存在b细胞,则该受试者没有资格接受该治疗。在一些实施方案中,确定120该血癌受试者的资格可以另外包括确定受试者状态的其他部分(例如,受试者的癌症类型、先前疗法的数量、受试者是否是某些疗法后复发的或某些疗法难治的)是否满足建立的资格标准(例如,用于入选临床试验的标准)。作一个示例,除了满足存在b细胞的资格标准之外,有资格的患者已接受了至少2条在先治疗线、患有dlbcl,并且在超过4周以前最后一次接受抗cd20治疗。
[0471]
在一个实施方案中,存在或不存在b细胞可以通过从受试者获得样品并且如上文所述对所获得的样品执行测定来确定。此类测定可以直接测量从受试者获得的样品中b细胞的数量。b细胞的量可以表示为受试者中b细胞的总量、淋巴细胞总量中b细胞的百分比,或者每微升样品中b细胞的量。在一些实施方案中,存在或不存在b细胞可以通过进行组织活检(例如,癌组织活检)以及进行存在或不存在b细胞的定性分析来确定。作为一个示例,可以进行b细胞(例如,cd19或cd20 b细胞)的免疫组织化学(ihc)染色。ihc染色的组织切片可以被定性分析(例如,由病理学家)并且可以被分配分数(下文称为h分数),该分数指示存在或不存在b细胞。
[0472]
然后可以使用b细胞的量来确定b细胞存在或不存在于受试者中。在一个实施方案中,将b细胞的量与阈值进行比较。如果b细胞的量高于阈值,则确定b细胞存在于受试者中。如果b细胞的量低于阈值,则确定b细胞不存在于受试者中。作为一个示例,如果b细胞的量表示为淋巴细胞总量中b细胞的百分比,则阈值可以是5%。淋巴细胞的总量可以通过标志物(诸如cd45)测量。作为另一个示例,如果b细胞的量表示为每微升样品中b细胞的量,则阈值可以是每微升1个b细胞。在一些情形下,阈值可以是每微升40个b细胞。在一些实施方案中,基于用来确定存在b细胞的测定的检测限或定量限来设定阈值。因此,在这些实施方案中,如果该测定能够可靠地检测到b细胞(例如,高于检测限或高于定量限),则认为b细胞存在于受试者中。
[0473]
在一些实施方案中,不直接测量b细胞存在或不存在。相反,测量b细胞存在或不存在的替代物。这种替代物测量值为确定115a b细胞存在或不存在于血癌受试者110中提供信息。b细胞存在或不存在的替代物的示例包括受试者最后一次接受抗cd20疗法的时间量、受试者最后一次接受的抗cd20疗法的浓度,以及当前在受试者中的抗cd20疗法的浓度。
[0474]
为了使用替代标志物确定b细胞是存在还是不存在于受试者中,将该替代物的测量值与阈值进行比较。根据特定的替代物测量值以及该替代物测量值是高于还是低于阈值,确定b细胞存在或不存在于受试者中。
[0475]
例如,替代物测量值是受试者最后一次接受抗cd20疗法的时间量,因此,如果受试者在超过阈值时间量以前最后一次接受抗cd20疗法,则b细胞存在于该受试者中。如果受试者在小于阈值时间量以前最后一次接受抗cd20疗法,则b细胞不存在于该受试者中。如果受试者先前未接受过抗cd20疗法,则b细胞存在于受试者中,或者进行不同的测量来确定b细胞是否存在。在各种实施方案中,阈值时间量为至少2周、至少3周、至少4周、至少5周、至少6周、至少7周、至少8周、至少9周、至少10周、至少11周、至少12周、至少13周、至少14周、至少15周、至少16周、至少17周、至少18周、至少19周、至少20周、至少21周、至少22周、至少23周、
至少24周、至少25周、至少26周、至少27周,或至少28周。在各种实施方案中,阈值时间量是2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周或28周。在一些实施方案中,阈值时间量介于2周与28周之间、介于4周与24周之间、介于6周与22周之间、介于8周与20周之间、介于9周与19周之间、介于10周与18周之间、介于11周与17周之间、介于12周与18周之间、介于13周与17周之间,或者介于14周与16周之间。
[0476]
作为另一个示例,替代物测量值是当前在受试者中的抗cd20疗法的浓度,因此,如果受试者具有高于阈值的抗cd20疗法浓度,则b细胞不存在于该受试者中。如果受试者具有低于阈值的抗cd20疗法浓度,则b细胞存在于该受试者中。在各种实施方案中,受试者中的抗cd20疗法浓度的阈值量基于用来确定抗cd20疗法浓度的测定的检测限或定量限。因此,在这些实施方案中,如果该测定能够可靠地检测到抗cd20疗法(例如,抗cd20疗法的浓度高于检测限或高于定量限),则认为抗cd20疗法存在于受试者中。
[0477]
返回图1,对有资格的受试者(例如,被确定为存在b细胞的受试者)进行治疗。在各种实施方案中,向血癌受试者提供135治疗包括施用125抗cd47疗法(例如,莫洛利单抗)。在一些实施方案中,向血癌受试者110提供135治疗包括施用130抗cd20疗法(例如,利妥昔单抗)。在一些实施方案中,向血癌受试者110提供135治疗包括既施用125抗cd47疗法,也施用130抗cd20疗法。此类治疗剂可以根据特定的给药周期进一步施用,如下文进一步详细论述的。治疗后,监测140受试者的反应,如果需要,受试者可以经历附加的疗法周期。
[0478]
在各种实施方案中,没有资格的受试者(例如,被确定为不存在b细胞的受试者)不经历治疗。在一些实施方案中,没有资格的受试者经历不涉及施用抗cd47和/或抗cd20抗体的替代性治疗。
[0479]
用于存在b细胞的免疫组织化学分析
[0480]
在各种实施方案中,通过免疫组织化学分析确定b细胞存在或不存在于受试者中。可以从患者获得组织活检物(例如,癌症活检物),并且针对b细胞标志物(诸如cd19或cd20)进行免疫染色。可以对免疫染色的组织切片进行b细胞标志物成像,以确定b细胞存在或不存在于受试者的组织中。
[0481]
在各种实施方案中,分析免疫染色的组织切片以计算代表b细胞存在或不存在的分数(也称为h分数)。在各种实施方案中,对免疫染色的组织切片进行评分由病理学家执行。
[0482]
在各种实施方案中,可以基于组织中b细胞染色的强度对h分数进行评分。例如,组织中的细胞在染色强度较高的情况下可以被分配较高的值,与之相比,该组织中的具有较低染色强度的不同细胞被分配较低的值。在各种实施方案中,计算具有每个值的细胞的百分比,然后用该值对细胞百分比进行加权,以便针对该值生成细胞百分比的分数。可以组合跨不同值的分数以生成受试者的h分数。
[0483]
作为一个示例,可以为细胞分配值0、1、2或3,其中0表示不存在b细胞染色,且3表示最大b细胞染色强度。计算每个染色强度水平下的细胞百分比,并且使用下式分配h分数:[1
×
(%评分为1的细胞) 2
×
(%评分为2的细胞 3
×
(%评分为3的细胞)]。这里,h分数可以在0至300范围内。
[0484]
h分数可以用于确定受试者是存在b细胞还是不存在b细胞。在一个实施方案中,将
受试者的h分数与阈值h分数进行比较。如果受试者的h分数高于阈值h分数,则认为该受试者存在b细胞。如果受试者的h分数低于阈值h分数,则认为该受试者不存在b细胞。在各种实施方案中,阈值h分数是最大可能h分数值的10%、20%、30%、40%、50%、60%、70%、80%或90%。例如,如果h评分可以在0至300范围内,其中300是最大可能h评分值,则阈值h评分可以是30、60、90、120、150、180、210、240或270。
[0485]
给药
[0486]
本文所述的方法包括施用治疗有效剂量的组合物,即治疗有效剂量的抗cd47抗体(例如,莫洛利单抗),和任选地附加药剂,诸如抗cd20抗体(例如,利妥昔单抗)。在各种实施方案中,所述方法靶向cd47或sirpα。中的一者或两者。
[0487]
如上所述,组合物以足以基本上消融靶细胞的量施用于患者。足以实现这一点的量被定义为“治疗有效剂量”,其可以提供整体存活率的改善。根据患者需要和耐受的剂量和频率,可以单次施用或多次施用所述组合物。用于治疗的具体剂量将取决于哺乳动物的身体状况和医疗病史,以及其他因素,诸如年龄、体重、性别、施用途径、效率等。
[0488]
用于治疗癌症的本发明的组合药剂的有效剂量取决于许多不同因素而变化,这些因素包括施用的方式、目标部位、患者的生理状态、患者是人还是动物、施用的其他药物,以及治疗是预防性的还是治疗性的。通常,患者是人类,但是也可以治疗非人哺乳动物,例如伴侣动物(诸如狗、猫、马等)、实验室哺乳动物(诸如兔子、小鼠、大鼠等),等等。可以滴定治疗剂量,以优化安全性和功效。
[0489]
抗cd47抗体的治疗有效剂量可以取决于所使用的具体药剂,但是通常为约20mg/kg体重或更多(例如,约20mg/kg或更多、约25mg/kg或更多、约30mg/kg或更多、约35mg/kg或更多、约40mg/kg或更多、约45mg/kg或更多、约50mg/kg或更多、或者约55mg/kg或更多、或者约60mg/kg或更多、或者约65mg/kg或更多、或者约70mg/kg或更多)、或者约20mg/kg至约70mg/kg(例如,约20mg/kg至约67.5mg/kg、或者约20mg/kg至约60mg/kg)。
[0490]
在一些实施方案中,抗cd47抗体的治疗有效剂量为20mg/kg、30mg/kg、45mg/kg、60mg/kg或67.5mg/kg。在一些实施方案中,抗cd47抗体的治疗有效剂量为20mg/kg至60mg/kg。在一些实施方案中,抗cd47抗体的治疗有效剂量为20mg/kg至67.5mg/kg。
[0491]
抗cd47抗体的剂量可以是固定剂量。例如,可以给予固定剂量,而不考虑特定受试者的体重。替代性地,可以基于落入特定体重范围(例如小于或等于100kg的第一范围;或者大于100kg的第二范围)内的特定受试者的体重来给予固定剂量。固定剂量可以是例如1000mg至5000mg、2000mg至4000mg、2000mg至3500mg、2400mg至3500mg、1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900mg、2000mg、2100mg、2200mg、2300mg、2400mg、2500mg、2600mg、2700mg、2800mg、2900mg、3000mg、3100mg、3200mg、3300mg、3400mg、3500mg、3600mg、3700mg、3800mg、3900mg、4000mg、4100mg、4200mg、4300mg、4400mg、4500mg、4600mg、4700mg、4800mg、4900mg、5000mg,或者这些剂量的中间mg数。
[0492]
抗cd20抗体的治疗有效剂量可以取决于所使用的特定药剂,但是可以为每m2体表面积约100mg抗体或更多(例如,约100mg/m2或更多、约125mg/m2或更多、约150mg/m2或更多、约175mg/m2或更多、约200mg/m2或更多、约225mg/m2或更多、约250mg/m2或更多、约275mg/m2或更多、约300mg/m2或更多、约325mg/m2或更多、约350mg/m2或更多、约375mg/m2或更多、约400mg/m2或更多、约425mg/m2或更多、约450mg/m2或更多、约475mg/m2或更多、或者约500mg/
m2或更多),或者约300mg/m2至约450mg/m2(例如,约325mg/m2至约425mg/m2,或者约350mg/m2至约400mg/m2)。在一些实施方案中,抗cd20抗体的治疗有效剂量为100mg/m2、125mg/m2、150mg/m2、175mg/m2、200mg/m2、225mg/m2、250mg/m2、275mg/m2、300mg/m2、325mg/m2、350mg/m2、375mg/m2、400mg/m2、425mg/m2、450mg/m2、475mg/m2或500mg/m2。在一些实施方案中,抗cd20抗体的治疗有效剂量优选地为375mg/m2。
[0493]
抗cd20抗体的剂量可以是固定剂量。例如,可以给予固定剂量,而不考虑特定受试者的体重。替代性地,可以基于特定受试者的性别给予固定剂量,例如,针对男性(平均体表面积为1.9m2)给予第一范围,并且针对女性(平均体表面积为1.6m2)给予第二范围。固定剂量可以是例如500mg至2000mg、600mg至1900mg、700mg至1800mg、800mg至1700mg、900mg至1600mg、1000mg至1700mg、1100mg至1600mg、1200mg至1500mg、1300mg至1400mg、500mg、600mg、700mg、800mg、900mg、1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900mg、2000mg,或者这些剂量的中间mg数。
[0494]
达到和/或维持所施用组合物的特定血清水平所需的剂量与剂量之间的时间量成正比,并且与所施用的剂量的数量成反比。因此,随着给药频率增加,所需的剂量减少。本领域的普通技术人员将容易理解和实践对给药策略的优化。示例性的治疗方案需要每两周一次或每月一次或每3至6个月一次施用。本发明的治疗实体通常多次施用。单次剂量之间的间隔可以是每周、每月或每年。间隔也可以是不规则的,如通过测量患者中的治疗实体的血液水平所指示的。替代性地,本发明的治疗实体可以作为缓释制剂施用,在这种情况下,以较低的频率施用。剂量和频率根据多肽在患者中的半衰期而变化。
[0495]“维持剂量”是旨在作为治疗有效剂量的剂量。例如,在确定治疗有效剂量的实验中,可以对不同受试者施用多个不同的维持剂量。因此,一些维持剂量可以是治疗有效剂量,而其他维持剂量可以是亚治疗剂量。
[0496]
在预防性应用中,可以在较长的时间段内以相对不频繁的间隔施用相对低的剂量。一些患者在余生中继续接受治疗。在其他治疗应用中,有时使用相对短间隔的相对高剂量,直到疾病的进展减少或终止,并且优选地直到患者显示疾病症状的部分或完全改善。此后,可以对患者施用预防性方案。
[0497]
在还有其他实施方案中,本发明的方法包括治疗、减少或预防癌症的肿瘤生长、肿瘤转移或肿瘤侵袭,所述癌症包括上皮癌、血液癌症、黑素瘤、肉瘤、神经胶质瘤等。对于预防性应用,将药物组合物或药物以足以消除或降低疾病的风险、减轻疾病的严重性或延迟疾病发作的量施用于易感疾病或者说是有疾病风险的患者,所述疾病包括疾病的生物化学症状、组织学症状和/或行为症状、其并发症,以及在疾病发展期间呈现的中间病理学表型。
[0498]
本文所述的组合药剂的毒性可以通过标准药学规程在细胞培养物或实验动物中测定,例如,通过测定ld
50
(50%群体致死剂量)或ld
100
(100%群体致死剂量)。毒性与治疗效果之间的剂量比是治疗指数。从这些细胞培养物测定和动物研究获得的数据可以用于制定对人类使用无毒性的剂量范围。本文所述蛋白质的剂量优选地在包括只有很小毒性或没有毒性的有效剂量的循环浓度范围内。剂量可以在该范围内变化,这取决于所采用的剂型和所利用的施用途径。确切的制剂、施用途径和剂量可以由个体医师根据患者的病症来选择。
[0499]
初免剂和初免剂量
[0500]
在本文所述方法的一些实施方案中,先施用初免剂,之后再将治疗有效剂量的抗
cd47抗体施用于个体。合适的初免剂包括红细胞生成刺激剂(esa)和/或初免剂量的抗cd47抗体。在施用初免剂并且允许经过有效地使网织红细胞产量增加的一段时间之后,施用治疗剂量的抗cd47抗体。可以根据共同未决的专利申请ussn 14/769,069中描述的方法进行施用,该专利申请以引用方式明确地并入本文。
[0501]
在一些实施方案中,将施用本发明的药剂组合与有效剂量的增加患者血细胞比容的药剂(例如促红细胞生成素刺激剂(esa))组合。此类药剂是本领域中已知的并且在本领域中使用,包括例如,(阿法达贝泊汀)、nf(阿法依泊汀)、(培奈萨肽)、等等。
[0502]
术语“初免剂量”或如本文所用,是指抗cd47剂的以下剂量:其对受试者进行初免以便施用治疗有效剂量的抗cd47剂,使得该治疗有效剂量不会导致rbc严重损失(血细胞比容降低或血红蛋白减少)。抗cd47剂的具体的适当初免剂量可以根据所使用药剂的性质和许多受试者特异性因素(例如,年龄、体重等)而变化。抗cd47剂的合适的初免剂量的示例包括约0.5mg/kg至约5mg/kg、约0.5mg/kg至约4mg/kg、约0.5mg/kg至约3mg/kg、约1mg/kg至约5mg/kg、约1mg/kg至约4mg/kg、约1mg/kg至约3mg/kg、约1mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg。在一些实施方案中,初免剂量优选地为1mg/kg。
[0503]
在本文所述方法的一些实施方案中,抗cd47抗体作为以下初免剂量施用于受试者:约0.5mg至约10mg,例如约0.5mg/kg至约5mg/kg范围内的抗体,任选地4mg/kg、3mg/kg、2mg/kg或1mg/kg的抗体。在一些实施方案中,抗cd47抗体作为以下剂量施用于受试者:约20mg/kg至约67.5mg/kg范围内的抗体,任选地15mg/kg至60mg/kg范围内的抗体,任选地30mg/kg至60mg/kg范围内的抗体,任选地15mg/kg的抗体、20mg/kg的抗体、30mg/kg的抗体、45mg/kg的抗体、60mg/kg的抗体或67.5mg/kg的抗体。
[0504]
抗cd47抗体的初免剂量可以是固定初免剂量。例如,可以给予固定初免剂量,而不考虑特定受试者的体重。替代性地,可以基于落入特定体重范围(例如小于或等于100kg的第一范围;或者大于100kg的第二范围)内的特定受试者的体重来给予固定初免剂量。固定初免剂量可以是例如10mg至200mg、50mg至100mg、80mg至800mg、80mg至400mg、80mg至200mg、70mg至90mg、75mg至85mg、10mg、20mg、30mg、40mg、50mg、60mg、70mg、80mg、90mg、100mg、110mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mg、240mg、300mg、320mg、400mg、500mg、600mg、700mg或800mg,或者这些剂量的中间mg数。
[0505]
在本发明的一些实施方案中,先施用初免剂,之后再将治疗有效剂量的抗cd47剂施用于个体。合适的初免剂包括红细胞生成刺激剂(esa)和/或初免剂量的抗cd47剂。在施用初免剂并且允许经过有效地使网织红细胞产量增加的一段时间之后,施用治疗剂量的抗cd47剂。治疗剂量能够以多种不同的方式施用。在一些实施方案中,在施用初免剂之后施用两个或更多个治疗有效剂量。在一些实施方案中,治疗有效剂量的抗cd47剂作为两个或更多个浓度递增剂量施用,在其他情况下剂量是相等的。
[0506]
在本发明的一些实施方案中,提供了有效初免剂量的hu-5f9g4,其中对人类的有效初免剂量为约1mg/kg,例如从至少约0.5mg/kg至最高不超过约5mg/kg;从至少约0.75mg/kg至最高不超过约1.25mg/kg;从至少约0.95mg/kg至最高不超过约1.05mg/kg;并且可以为约1mg/kg。
[0507]
在本发明的一些实施方案中,cd47结合剂的初始剂量在至少约2小时、至少约2.5小时、至少约3小时、至少约3.5小时、至少约4小时、至少约4.5小时、至少约5小时、至少约6小时或更长时间的时期内输注。在一些实施方案中,初始剂量在约2.5小时至约6小时;例如约3小时至约4小时的时间段内输注。在一些此类实施方案中,输注物中药剂的剂量为约0.05mg/ml至约0.5mg/ml;例如约0.1mg/ml至约0.25mg/ml。
[0508]
在一些实施方案中,如本领域中已知的,初免剂量可以通过皮下途径、注射、贴剂、渗透泵等递送。
[0509]
在施用初免剂并且允许经过有效地使网织红细胞产量增加的一段时间之后,施用治疗剂量的抗cd47剂。治疗剂量能够以多种不同的方式施用。在一些实施方案中,在施用初免剂之后施用两个或更多个治疗有效剂量,例如以每周给药时间表。在一些实施方案中,治疗有效剂量的抗cd47剂作为两个或更多个浓度递增剂量施用,在其他情况下剂量是相等的。
[0510]
在其他实施方案中,cd47结合剂的初始剂量(例如初免剂量)通过连续融合(例如作为渗透泵、递送贴剂等)施用,其中该剂量在至少约6小时、至少约12小时、至少约24小时、至少约2天、至少约3天的时期内施用。许多此类系统在本领域中是已知的。例如,duros技术提供了由活塞隔开的双隔室系统。隔室之一包括渗透动力系统,该渗透动力系统特别地配制有过量的固体nacl,使得其在整个递送期中保持存在并且导致恒定的渗透梯度。该隔室还包括在一端的半透膜,水通过该半透膜被吸入渗透动力系统中,并且在组织水与渗透动力系统之间建立大且恒定的渗透梯度。另一个隔室包括药物溶液和孔,药物由于渗透梯度从该孔释放。这有助于在植入人体时提供部位特异性和全身性的药物递送。优选的植入部位是在上臂内侧皮下放置。
[0511]
在施用初免剂并且允许经过有效地使网织红细胞产量增加的一段时间之后,施用治疗剂量的抗cd47抗体。治疗剂量能够以多种不同的方式施用。在一些实施方案中,在施用初免剂之后施用两个或更多个治疗有效剂量,例如以每周给药时间表。在一些实施方案中,治疗有效剂量的抗cd47抗体作为两个或更多个浓度递增剂量施用,在其他情况下剂量是相等的。初免剂量后血凝集减少。
[0512]
给药周期
[0513]
一种治疗患有cd20 癌症的人类受试者或减小人类受试者的cd20 癌症的大小的方法可以包括至少一个以下周期:(a)将抗cd47抗体以大于或等于每kg体重10mg抗体的剂量施用于受试者;和(b)将抗cd20抗体施用于该受试者。在各种实施方案中,所述方法靶向cd47或sirpα.中的一者或两者。
[0514]
抗cd47抗体可以在给定周期中作为以下剂量施用于受试者:每kg体重约20mg抗体至约67.5mg抗体范围内,任选地每kg体重20mg抗体至30mg抗体,任选地每kg体重20mg抗体、每kg体重30mg抗体、每kg体重45mg抗体、每kg体重60mg抗体,或每kg体重67.5mg抗体。
[0515]
在一些实施方案中,每个单剂量之间的间隔是一周。在一些实施方案中,每个单剂量之间的间隔是两周。在一些实施方案中,每个单剂量之间的间隔是三周。在一些实施方案中,每个单剂量之间的间隔是四周。在一些实施方案中,每个单剂量的抗cd47抗体之间的间隔是一周。在一些实施方案中,每个单剂量的抗cd47抗体之间的间隔是两周。在一些实施方案中,每个单剂量的抗cd47抗体之间的间隔是三周。在一些实施方案中,每个单剂量的抗
cd47抗体之间的间隔是四周。在一些实施方案中,每个单剂量的hu5f9(例如hu5f9-g4)之间的间隔是一周。在一些实施方案中,每个单剂量的hu5f9(例如hu5f9-g4)之间的间隔是两周。在一些实施方案中,每个单剂量的hu5f9(例如hu5f9-g4)之间的间隔是三周。在一些实施方案中,每个单剂量的hu5f9(例如hu5f9-g4)之间的间隔是四周。在一些实施方案中,每个单剂量的抗cd20抗体之间的间隔是一周。在一些实施方案中,每个单剂量的抗cd20抗体之间的间隔是两周。在一些实施方案中,每个单剂量的抗cd20抗体之间的间隔是三周。在一些实施方案中,每个单剂量的抗cd20抗体之间的间隔是四周。在一些实施方案中,每个单剂量的抗cd20抗体之间的间隔是八周。在一些实施方案中,每个单剂量的利妥昔单抗之间的间隔是一周。在一些实施方案中,每个单剂量的利妥昔单抗之间的间隔是两周。在一些实施方案中,每个单剂量的利妥昔单抗之间的间隔是三周。在一些实施方案中,每个单剂量的利妥昔单抗之间的间隔是四周。在一些实施方案中,每个单剂量的利妥昔单抗之间的间隔是八周。
[0516]
在各种实施方案中,施用抗cd47抗体和/或施用抗cd20抗体可以在一个或多个周期中发生,例如,第一周期可以具有第一给药方案,并且一个或多个后续周期可以具有与第一周期不同(或相同)的给药方案。在各种实施方案中,第一周期和第二周期的给药间隔相同(例如,抗cd47剂每周施用一次),并且第三周期和另外的附加周期的给药间隔不同于第一周期和第二周期(例如,抗cd47剂每两周施用一次)。第三周期和附加周期的给药间隔可以相同。例如,抗cd47抗体可以根据需要(例如,如医师所确定)在以下周期中施用:第一周期,其包括每周一次施用一剂抗体;第二周期,其包括每周一次施用一剂抗体;第三周期,其包括每两周一次施用一剂抗体;第四周期,其包括每两周一次施用一剂抗体;和附加周期,其包括每两周一次施用一剂抗体。第一周期、第二周期、第三周期和附加周期的持续时间可以是4周。
[0517]
在一些实施方案中,可以将抗cd47抗体施用于受试者持续至少三个不同的周期,每个周期为四周,这些周期为:第一周期,其包括(1)每周一次施用一剂抗cd47抗体;第二周期,其包括(2)每周一次施用一剂抗cd47抗体;和第三周期,其包括(3)每两周一次施用一剂抗cd47抗体。
[0518]
在各种实施方案中,可以将抗cd20抗体施用于受试者持续至少三个不同的周期,每个周期为四周,第一周期包括:(1)每周一次施用一剂抗cd20抗体;第二周期包括:(2)每4周一次施用一剂抗cd20抗体;并且第三周期包括:(3)每4周一次施用一剂抗cd20抗体。在各种实施方案中,可以将抗cd20抗体进一步施用于受试者持续附加周期。在各种实施方案中,抗cd20抗体可以每4周施用一次,或者在附加周期期间每8周施用一次。
[0519]
在各种实施方案中,将抗cd47抗体的初免剂量在给定周期中施用于受试者,之后将抗cd47抗体以大于或等于每kg体重10mg抗体的剂量施用于受试者。初免剂量可以是每kg体重1mg抗体。可以将初免剂量施用于受试者持续约3小时。
[0520]
在特定实施方案中,根据以下周期将抗cd47抗体和抗cd20抗体施用于受试者:
[0521]
周期1(4周)
[0522]-在第1天,1mg/kg抗cd47的初免剂量
[0523]-从第8天开始,30mg/kg抗cd47的周剂量
[0524]-从第8天开始,375mg/m2利妥昔单抗的周剂量或抗cd20抗体的等效剂量
[0525]
周期2(4周)
[0526]-30mg/kg抗cd47的周剂量
[0527]-375mg/m2利妥昔单抗的周剂量或抗cd20抗体的等效剂量
[0528]
周期3至5
[0529]-隔周30mg/kg抗cd47
[0530]-375mg/m2利妥昔单抗的周剂量或抗cd20抗体的等效剂量
[0531]
周期6 (继续直到临床益处丧失)
[0532]-隔周30mg/kg抗cd47剂量
[0533]-375mg/m2利妥昔单抗的隔月剂量或抗cd20抗体的等效剂量
[0534]
在各种实施方案中,第一周期包括提供抗cd47抗体的初免剂量,之后是抗cd47抗体的周剂量(例如,每周一次)。抗cd47抗体的周剂量可以通过第二周期施用。在第二周期之后,抗cd47抗体可以在第三周期期间通过隔周剂量施用。在各种实施方案中,抗cd47抗体可以通过第四周期和第五周期继续施用。在各种实施方案中,在后续周期中施用抗cd47抗体,直到实现治疗反应为止。在各种实施方案中,抗cd20抗体也可以在第一周期、第二周期、第三周期、第四周期、第五周期和后续周期中的每个周期期间施用。在各种实施方案中,抗cd20抗体通过第一周期的周剂量,第二周期、第三周期、第四周期和第五周期的月剂量,以及后续周期中的隔月剂量施用。
[0535]
作为一个示例,抗cd47抗体可以在第一周期中施用于受试者,该第一周期包括:在第1天,每kg体重1mg抗体的初免剂量;之后是每kg体重30mg抗体,每周一次的剂量(例如,第8天、第15天,以此类推)。第一周期的持续时间可以是4周。抗cd20抗体可以在第一周期中以375mg/m2抗体的剂量每周一次施用于受试者。在各种实施方案中,该方法靶向cd47或sirpα。
[0536]
抗cd47抗体可以在第二周期中施用,该第二周期包括:每kg体重30mg抗体,每周一次的剂量。第二周期的持续时间可以是4周。抗cd20抗体可以在第二周期中以375mg/m2抗体的剂量每四周一次(例如每月)施用。在各种实施方案中,该方法靶向cd47或sirpα。
[0537]
在各种实施方案中,抗cd47抗体和抗cd20抗体可以各自在同一天施用于患者(例如,第8天、第15天等的周剂量)。在一些实施方案中,在将这两种疗法施用于患者的这些天,抗cd20抗体在施用抗cd47抗体之前施用。在其他实施方案中,在将这两种疗法施用于患者的这些天,抗cd47抗体可以在施用抗cd20抗体之前施用。
[0538]
抗cd47抗体可以在第三周期中施用,该第三周期包括:每kg体重30mg抗体,每两周一次的剂量。第三周期的持续时间可以是4周。抗cd20抗体可以在第三周期中以375mg/m2抗体的剂量每四周一次(例如每月)施用。在各种实施方案中,该方法靶向cd47或sirpα。
[0539]
在各种实施方案中,第三周期可以通过一个或多个附加周期来重复。在一个实施方案中,第三周期被重复两次(例如,通过第四周期和第五周期)。
[0540]
在各种实施方案中,抗cd47抗体可以在第六周期中施用,该第六周期包括:每kg体重30mg抗体,每两周一次的剂量。在各种实施方案中,第六周期还包括以375mg/m2抗体的剂量隔月一次施用抗cd20抗体。第六周期可以是设定的周数,或者在一些实施方案中,可以取决于患者是否对治疗有反应。例如,一旦患者对治疗有反应,就可以在患者表现出临床益处之后的数周终止第六周期。作为另一个示例,如果在第六周期中将治疗提供给患者之后,患
者未能对治疗产生临床反应,则可以终止第六周期。作为另一个示例,如果在第六周期中将治疗提供给患者之后,治疗的临床益处丧失,则可以终止第六周期。在各种实施方案中,该方法靶向cd47或sirpα。
[0541]
可以使用附加周期。例如,可以使用至少一个附加周期,任选地1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个或多于20个附加周期。至少一个附加周期的给药方案可以与第二周期的相同,任选地其中该给药方案的抗cd20抗体部分在完成总共6个周期之后中止。任选地,给定周期的抗cd20部分可以在完成总共6个周期之后继续,例如,通过每月一次或隔月一次进行给药方案。至少一个附加周期的持续时间可以是4周。
[0542]
本文还公开了一种治疗人类受试者的癌症或减小其大小的方法,包括将抗cd47抗体(例如hu5f9-g4)和抗cd20抗体(例如利妥昔单抗)施用于该受试者持续至少两个不同的周期,每个周期为四周,第一周期包括:(1)在时间0(例如t0或第1天),施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)抗体的抗cd47抗体初免剂量,(2)从t0之后一周开始,每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,并且在第11天(第2周)额外(任选地)施用每kg至少30mg(例如30mg至50mg、30mg、35mg、40mg、45mg、50mg)的剂量,以及(3)每周一次施用375mg/m2抗cd20抗体的剂量;并且第二周期包括:(1)每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。随后可以通过第三周期、第四周期和第五周期施用抗cd47抗体和抗cd20抗体。在各种实施方案中,第三周期、第四周期和第五周期各自包括:(1)隔周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。抗cd47抗体和抗cd20抗体的附加周期(例如,第六周期、第七周期、第八周期、第九周期、第十周期等)可以被无限制地提供,或者被提供例如直到临床益处减弱或丧失或者不再观察到临床益处为止。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。一般来讲,抗cd47抗体和抗cd20抗体将如上所述继续施用于受试者,直到受试者丧失临床益处(例如经由cr体现)或死亡。抗cd47抗体可以是hu5f9-g4。抗cd20抗体可以是利妥昔单抗。癌症可以是以下中的至少一者:cd20 癌症、b细胞癌症、非霍奇金氏淋巴瘤(nhl)、惰性淋巴瘤、滤泡性淋巴瘤(fl)、边缘区淋巴瘤,或弥漫性大b细胞淋巴瘤(dlbcl)。在各种实施方案中,该方法靶向cd47或sirpα。
[0543]
本文还公开了一种治疗人类受试者的cd20 癌症或减小其大小的方法,包括将抗cd47抗体(其为hu5f9-g4)和抗cd20抗体(其为利妥昔单抗)施用于该受试者持续至少两个不同的周期,每个周期为四周,第一周期包括:(1)在时间0(例如t0或第1天),施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)抗体的抗cd47抗体初免剂量,(2)从t0之后一周开始,每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,并且在第11天(第2周)额外(任选地)施用每kg至少30mg(例如30mg至50mg、30mg、35mg、40mg、45mg、50mg)的剂量,以及(3)每周一次施用375mg/m2抗cd20抗体的剂量;并且第二周期包括:(1)每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用
375mg/m2抗cd20抗体的剂量。随后可以通过第三周期、第四周期和第五周期施用抗cd47抗体和抗cd20抗体。在各种实施方案中,第三周期、第四周期和第五周期各自包括:(1)隔周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。抗cd47抗体和抗cd20抗体的附加周期(例如,第六周期、第七周期、第八周期、第九周期、第十周期等)可以被无限制地提供,或者被提供例如直到临床益处减弱或丧失或者不再观察到临床益处为止。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。一般来讲,抗cd47抗体和抗cd20抗体将如上所述继续施用于受试者,直到受试者丧失临床益处(例如经由cr体现)或死亡。cd20 癌症可以是以下中的至少一者:b细胞癌症、非霍奇金氏淋巴瘤(nhl)、惰性淋巴瘤、滤泡性淋巴瘤(fl)、边缘区淋巴瘤,或弥漫性大b细胞淋巴瘤(dlbcl)。在各种实施方案中,该方法靶向cd47或sirpα。
[0544]
本文还公开了一种治疗患有cd20 癌症的人类受试者的方法,包括将抗cd47抗体(例如hu5f9-g4)和抗cd20抗体(例如利妥昔单抗)施用于该受试者持续至少两个不同的周期,每个周期为四周,第一周期包括:(1)在时间0(例如t0或第1天),施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)抗体的抗cd47抗体初免剂量,(2)从t0之后一周开始,每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,并且在第11天(第2周)额外(任选地)施用每kg至少30mg(例如30mg至50mg、30mg、35mg、40mg、45mg、50mg)的剂量,以及(3)每周一次施用375mg/m2抗cd20抗体的剂量;并且第二周期包括:(1)每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。随后可以通过第三周期、第四周期和第五周期施用抗cd47抗体和抗cd20抗体。在各种实施方案中,第三周期、第四周期和第五周期各自包括:(1)隔周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。抗cd47抗体和抗cd20抗体的附加周期(例如,第六周期、第七周期、第八周期、第九周期、第十周期等)可以被无限制地提供,或者被提供例如直到临床益处减弱或丧失或者不再观察到临床益处为止。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。一般来讲,抗cd47抗体和抗cd20抗体将如上所述继续施用于受试者,直到受试者丧失临床益处(例如经由cr体现)或死亡。抗cd47抗体可以是hu5f9-g4。抗cd20抗体可以是利妥昔单抗。在各种实施方案中,该方法靶向cd47或sirpα。
[0545]
本文还公开了一种治疗患有淋巴瘤的人类受试者的方法,包括将抗cd47抗体(例如hu5f9-g4)和抗cd20抗体(例如利妥昔单抗)施用于该受试者持续至少两个不同的周期,每个周期为四周,第一周期包括:(1)在时间0(例如t0或第1天),施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)抗体的抗cd47抗体初免剂量,(2)从t0之后一周开始,每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,并且在第11天(第2周)额外(任选地)施用每kg至少30mg(例如30mg至50mg、30mg、35mg、40mg、45mg、50mg)的剂量,以及(3)每周一次施用375mg/m2抗
cd20抗体的剂量;并且第二周期包括:(1)每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。随后可以通过第三周期、第四周期和第五周期施用抗cd47抗体和抗cd20抗体。在各种实施方案中,第三周期、第四周期和第五周期各自包括:(1)隔周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。抗cd47抗体和抗cd20抗体的附加周期(例如,第六周期、第七周期、第八周期、第九周期、第十周期等)可以被无限制地提供,或者被提供例如直到临床益处减弱或丧失或者不再观察到临床益处为止。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。一般来讲,抗cd47抗体和抗cd20抗体将如上所述继续施用于受试者,直到受试者丧失临床益处(例如经由cr体现)或死亡。抗cd47抗体可以是hu5f9-g4。抗cd20抗体可以是利妥昔单抗。在各种实施方案中,该方法靶向cd47或sirpα。
[0546]
本文还公开了一种治疗患有nhl的人类受试者的方法,包括将抗cd47抗体(例如hu5f9-g4)和抗cd20抗体(例如利妥昔单抗)施用于该受试者持续至少两个不同的周期,每个周期为四周,第一周期包括:(1)在时间0(例如t0或第1天),施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)抗体的抗cd47抗体初免剂量,(2)从t0之后一周开始,每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,并且在第11天(第2周)额外(任选地)施用每kg至少30mg(例如30mg至50mg、30mg、35mg、40mg、45mg、50mg)的剂量,以及(3)每周一次施用375mg/m2抗cd20抗体的剂量;并且第二周期包括:(1)每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。随后可以通过第三周期、第四周期和第五周期施用抗cd47抗体和抗cd20抗体。在各种实施方案中,第三周期、第四周期和第五周期各自包括:(1)隔周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。抗cd47抗体和抗cd20抗体的附加周期(例如,第六周期、第七周期、第八周期、第九周期、第十周期等)可以被无限制地提供,或者被提供例如直到临床益处减弱或丧失或者不再观察到临床益处为止。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。一般来讲,抗cd47抗体和抗cd20抗体将如上所述继续施用于受试者,直到受试者丧失临床益处(例如经由cr体现)或死亡。抗cd47抗体可以是hu5f9-g4。抗cd20抗体可以是利妥昔单抗。在各种实施方案中,该方法靶向cd47或sirpα。
[0547]
本文还公开了一种治疗患有弥漫性大b细胞淋巴瘤(dlbcl)的人类受试者的方法,包括将抗cd47抗体(例如hu5f9-g4)和抗cd20抗体(例如利妥昔单抗)施用于该受试者持续至少两个不同的周期,每个周期为四周,第一周期包括:(1)在时间0(例如t0或第1天),施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)抗体的抗cd47抗体初免剂量,(2)从t0之后一周开始,每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,并且在第11天(第2周)额外(任选地)施用
每kg至少30mg(例如30mg至50mg、30mg、35mg、40mg、45mg、50mg)的剂量,以及(3)每周一次施用375mg/m2抗cd20抗体的剂量;并且第二周期包括:(1)每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。随后可以通过第三周期、第四周期和第五周期施用抗cd47抗体和抗cd20抗体。在各种实施方案中,第三周期、第四周期和第五周期各自包括:(1)隔周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。抗cd47抗体和抗cd20抗体的附加周期(例如,第六周期、第七周期、第八周期、第九周期、第十周期等)可以被无限制地提供,或者被提供例如直到临床益处减弱或丧失或者不再观察到临床益处为止。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。一般来讲,抗cd47抗体和抗cd20抗体将如上所述继续施用于受试者,直到受试者丧失临床益处(例如经由cr体现)或死亡。抗cd47抗体可以是hu5f9-g4。抗cd20抗体可以是利妥昔单抗。在各种实施方案中,该方法靶向cd47或sirpα。
[0548]
本文还公开了一种治疗患有惰性淋巴瘤的人类受试者的方法,包括将抗cd47抗体(例如hu5f9-g4)和抗cd20抗体(例如利妥昔单抗)施用于该受试者持续至少两个不同的周期,每个周期为四周,第一周期包括:(1)在时间0(例如t0或第1天),施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)抗体的抗cd47抗体初免剂量,(2)从t0之后一周开始,每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,并且在第11天(第2周)额外(任选地)施用每kg至少30mg(例如30mg至50mg、30mg、35mg、40mg、45mg、50mg)的剂量,以及(3)每周一次施用375mg/m2抗cd20抗体的剂量;并且第二周期包括:(1)每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。随后可以通过第三周期、第四周期和第五周期施用抗cd47抗体和抗cd20抗体。在各种实施方案中,第三周期、第四周期和第五周期各自包括:(1)隔周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。抗cd47抗体和抗cd20抗体的附加周期(例如,第六周期、第七周期、第八周期、第九周期、第十周期等)可以被无限制地提供,或者被提供例如直到临床益处减弱或丧失或者不再观察到临床益处为止。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。一般来讲,抗cd47抗体和抗cd20抗体将如上所述继续施用于受试者,直到受试者丧失临床益处(例如经由cr体现)或死亡。抗cd47抗体可以是hu5f9-g4。抗cd20抗体可以是利妥昔单抗。在各种实施方案中,该方法靶向cd47或sirpα。
[0549]
本文还公开了一种治疗患有滤泡性淋巴瘤(fl)的人类受试者的方法,包括将抗cd47抗体(例如hu5f9-g4)和抗cd20抗体(例如利妥昔单抗)施用于该受试者持续至少两个不同的周期,每个周期为四周,第一周期包括:(1)在时间0(例如t0或第1天),施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)抗体的抗cd47抗体初免剂量,(2)从t0之后一周开始,每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、
35mg、40mg、45mg、50mg)抗cd47抗体的剂量,并且在第11天(第2周)额外(任选地)施用每kg至少30mg(例如30mg至50mg、30mg、35mg、40mg、45mg、50mg)的剂量,以及(3)每周一次施用375mg/m2抗cd20抗体的剂量;并且第二周期包括:(1)每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。随后可以通过第三周期、第四周期和第五周期施用抗cd47抗体和抗cd20抗体。在各种实施方案中,第三周期、第四周期和第五周期各自包括:(1)隔周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。抗cd47抗体和抗cd20抗体的附加周期(例如,第六周期、第七周期、第八周期、第九周期、第十周期等)可以被无限制地提供,或者被提供例如直到临床益处减弱或丧失或者不再观察到临床益处为止。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。一般来讲,抗cd47抗体和抗cd20抗体将如上所述继续施用于受试者,直到受试者丧失临床益处(例如经由cr体现)或死亡。抗cd47抗体可以是hu5f9-g4。抗cd20抗体可以是利妥昔单抗。在各种实施方案中,该方法靶向cd47或sirpα。
[0550]
本文还公开了一种治疗患有边缘区淋巴瘤的人类受试者的方法,包括将抗cd47抗体(例如hu5f9-g4)和抗cd20抗体(例如利妥昔单抗)施用于该受试者持续至少两个不同的周期,每个周期为四周,第一周期包括:(1)在时间0(例如t0或第1天),施用每kg体重在1mg至10mg范围内(例如1mg至5mg,例如1mg、2mg、3mg、4mg、5mg)抗体的抗cd47抗体初免剂量,(2)从t0之后一周开始,每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,并且在第11天(第2周)额外(任选地)施用每kg至少30mg(例如30mg至50mg、30mg、35mg、40mg、45mg、50mg)的剂量,以及(3)每周一次施用375mg/m2抗cd20抗体的剂量;并且第二周期包括:(1)每周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。随后可以通过第三周期、第四周期和第五周期施用抗cd47抗体和抗cd20抗体。在各种实施方案中,第三周期、第四周期和第五周期各自包括:(1)隔周一次施用每kg体重至少30mg(例如,30mg至50mg、30mg、35mg、40mg、45mg、50mg)抗cd47抗体的剂量,以及(2)每月一次施用375mg/m2抗cd20抗体的剂量。抗cd47抗体和抗cd20抗体的附加周期(例如,第六周期、第七周期、第八周期、第九周期、第十周期等)可以被无限制地提供,或者被提供例如直到临床益处减弱或丧失或者不再观察到临床益处为止。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。当到达并开始周期6时及以后,抗cd20抗体可以改为每八周一次以375mg/m2的剂量施用于受试者。一般来讲,抗cd47抗体和抗cd20抗体将如上所述继续施用于受试者,直到受试者丧失临床益处(例如经由cr体现)或死亡。抗cd47抗体可以是hu5f9-g4。抗cd20抗体可以是利妥昔单抗。在各种实施方案中,该方法靶向cd47或sirpα。
[0551]
施用
[0552]
在本文所述的方法中,将组合物(例如抗cd47抗体和任选地附加药剂)施用于受试者。所述组合物可以通过肠胃外、局部、静脉内、腹内、肿瘤内、口服、皮下、动脉内、颅内、腹膜内、鼻内或肌内方式施用。典型的施用途径是静脉内或肿瘤内,但其他途径可以同样有
效。
[0553]
在一些实施方案中,抗cd47抗体和/或附加药剂腹膜内施用。在一些实施方案中,抗cd47抗体和/或附加药剂静脉内施用。在一些实施方案中,抗cd47抗体和/或附加药剂肿瘤内施用。在一个实施方案中,施用抗cd47抗体的初免剂量,并且该初免剂量皮下递送。在一些实施方案中,抗cd47抗体和附加药剂同时施用。在一些实施方案中,抗cd47抗体和附加药剂相继施用。
[0554]
在一段时间内施用活性剂,以对宿主中癌细胞的耗竭产生累加效应或协同效应。施用方法包括但不限于全身施用、肿瘤内施用等。通常,抗cd47抗体在大约以下时期内施用:约45天、约30天、约21天、约14天、约10天、约8天、约7天、约6天、约5天、约4天、约3天、约2天、约1天,或者与附加药剂基本上同一天。在一些实施方案中,抗cd47抗体在附加药剂之前施用。在一些实施方案中,抗cd47抗体在附加药剂之后施用。如果施用日程安排使得两种药剂的血清水平同时处于治疗水平,则可以认为这两种药剂是组合的。为了耗竭癌细胞群,必要时可以重复施用。
[0555]
本文所公开的一种或多种抗体可以由医疗专业人员(任选地,医师)施用。
[0556]
本文所公开的一种或多种抗体可以由受试者施用。
[0557]
临床终点
[0558]
本文所述的方法导致与基线相比出现至少一个改善的终点。
[0559]
本文所公开的方法可以导致受试者的客观反应(or)。客观反应是部分反应或完全缓解,如cheson、lugano或类似的nhl反应标准所定义的。
[0560]
本文所公开的方法可以导致受试者的疾病控制。疾病控制是病情稳定加上客观反应。
[0561]
本文所公开的方法可以导致受试者的部分反应(pr)。pr是根据成像标准(ct或pet/ct)肿瘤缩小至少50%,而肿瘤病变没有完全消失。根据pet/ct标准,pr如上所述,或者通过与基线和任何大小的残余肿块相比降低的代谢摄取来定义(lugano标准,cheson等人,jco 2014)。
[0562]
本文所公开的方法可以导致受试者的完全反应(cr)。cheson等人,jco 2014。
[0563]
本文所公开的方法可以导致受试者的病情稳定(sd)。cheson等人,jco 2014。
[0564]
本文所公开的方法可以相对于基线减小受试者癌症的大小,其中基线在施用抗cd47抗体之前确定。
[0565]
本文所公开的方法可以导致受试者的利妥昔单抗难治性的逆转。
[0566]
药物组合物
[0567]
本文所述的方法包括施用包含抗cd47抗体和/或附加药剂的药物组合物。在一些实施方案中,该药物组合物包含抗cd47和附加药剂两者。在一些实施方案中,该药物组合物包含抗cd47和附加药剂中的一者。因此,抗cd47和附加药剂的相继施用可以通过分开地施用第一药物组合物,随后施用第二药物组合物来实现。
[0568]
通常,将所述组合物制备为注射剂,作为液体溶液剂或混悬剂;也可以制备适于在注射前溶解于或悬浮于液体媒介物中的固体形式。如上文所论述的,该制备物也可以被乳化或包封在脂质体或微粒(诸如聚丙交酯、聚乙交酯或共聚物)中,以增强佐剂效果。langer,science 249:1527,1990和hanes,advanced drug delivery reviews 28:97-119,
1997。本发明的药剂能够以贮库注射剂或植入物制剂的形式施用,所述贮库注射剂或植入物制剂能够以允许活性成分缓释或脉冲式释放的方式配制。所述药物组合物通常被配制成无菌、基本上等渗的,并且完全符合美国食品药品监督管理局的所有良好生产规范(gmp)规定。
[0569]
根据施用方法,所述药物组合物能够以多种单位剂型施用。例如,适于口服施用的单位剂型包括但不限于粉剂、片剂、丸剂、胶囊剂和锭剂。应认识到,当口服施用本发明的组合物时,应当保护其免受消化。这通常通过将分子与组合物复合以使它们对酸性水解和酶水解具有抗性,或者通过将分子包装在具有适当抗性的载剂(诸如脂质体或保护屏障)中来实现。保护药剂免受消化的方式在本领域中是众所周知的。
[0570]
用于施用的组合物将通常包含溶解在药学上可接受的载剂(优选地为含水载剂)中的抗体或其他消融剂。可以使用多种含水载体,例如缓冲盐水等。这些溶液是无菌的并且通常不含不期望的物质。这些组合物可以通过常规的、众所周知的灭菌技术来灭菌。所述组合物可以含有接近生理条件所需的药学上可接受的辅助物质,诸如ph调节剂和缓冲剂、毒性调节剂等,例如乙酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等。活性剂在这些制剂中的浓度可以有很大差异,并且将主要基于流体体积、粘度、体重等根据所选的具体施用模式和患者的需求进行选择(例如,remington's pharmaceutical science(第15版,1980)以及goodman和gillman,the pharmacological basis of therapeutics(hardman等人编辑,1996))。
[0571]“药学上可接受的赋形剂”意指可用于制备药物组合物的赋形剂,其通常是安全、无毒和期望的,并且包括兽医用途以及人类药物用途可接受的赋形剂。此类赋形剂可以是固体、液体、半固体,或者在气溶胶组合物的情况下,可以是气态的。
[0572]“药学上可接受的盐和酯”意指药学上可接受的并且具有期望的药理特性的盐和酯。此类盐包括在化合物中存在的酸性质子能够与无机碱或有机碱反应的情况下可以形成的盐。合适的无机盐包括与碱金属(例如钠和钾、镁、钙和铝)形成的那些。合适的有机盐包括与有机碱形成的那些,所述有机碱诸如胺碱,例如乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、n-甲基葡糖胺等。此类盐还包括与无机酸(例如,盐酸和氢溴酸)和有机酸(例如,乙酸、柠檬酸、马来酸,以及烷烃磺酸和芳烃磺酸,诸如甲磺酸和苯磺酸)形成的酸加成盐。药学上可接受的酯包括由化合物中存在的羧基基团、磺酰氧基基团和膦酰氧基基团形成的酯,例如c
1-6
烷基酯。当存在两个酸性基团时,药学上可接受的盐或酯可以是单酸单盐或单酸单酯,或者二盐或二酯;并且类似地,当存在多于两个酸性基团时,此类基团中的一些或全部可以成盐或酯化。本发明中命名的化合物能够以未成盐或未酯化的形式存在,或者以成盐和/或酯化的形式存在,并且此类化合物的命名旨在既包括原始(未成盐和未酯化的)化合物,也包括其药学上可接受的盐和酯。另外,本发明中命名的某些化合物能够以多于一种立体异构形式存在,并且此类化合物的命名旨在包括所有单一立体异构体,以及此类立体异构体的所有混合物(无论是外消旋的还是其他的)。
[0573]
术语“药学上可接受的”、“生理上可耐受的”及其语法变型在指代组合物、载剂、稀释剂和试剂时可互换使用,并且表示所述材料能够施用于人或在人上施用,而不会产生不期望的生理效应至将阻止施用该组合物的程度。
[0574]
试剂盒
[0575]
本文还描述了试剂盒,其包括活性剂(例如抗cd47抗体)和任选地附加药剂,和它们的制剂,以及使用说明。附加药剂可以是抗cd20剂,诸如利妥昔单抗。试剂盒通常包括指示试剂盒内容物的预期用途的标签。术语“标签”包括在试剂盒上或与试剂盒一起提供的,或者以其他方式伴随试剂盒的任何书面材料或记录材料。
[0576]
还提供了在本文所公开的各种方法中使用的试剂盒。本发明的试剂盒包括引物剂和抗cd47剂。在一些实施方案中,试剂盒包括两种或更多种引物剂。在一些实施方案中,试剂盒包括两种或更多种抗cd47剂。在一些实施方案中,初免剂以剂型(例如,初免剂型)提供。在一些实施方案中,初免剂以两种或更多种不同的剂型(例如,两种或更多种不同的初免剂型)提供。在一些实施方案中,抗cd47剂以剂型(例如,治疗有效剂型)提供。在一些实施方案中,抗cd47剂以两种或更多种不同的剂型(例如,两种或更多种不同的治疗有效剂型)提供。在试剂盒的上下文中,初免剂和/或抗cd47剂能够在任何方便的包装材料(例如,条形包装、剂量包装等)中以液体或固体形式提供。
[0577]
除了上述组分之外,主题试剂盒还可以包括(在某些实施方案中)用于实施主题方法的说明。这些说明能够以多种形式存在于主题试剂盒中,其中的一种或多种可以存在于该试剂盒中。这些说明可以存在的一种形式是作为以下印刷信息:在合适的介质或基底(例如其上印刷该信息的一张或多张纸)上的印刷信息、在试剂盒的包装材料中的印刷信息、在包装说明书中的印刷信息,等等。这些指令的另一种形式是其上已记录该信息的计算机可读介质,例如磁盘、光盘(cd)、闪存驱动器等。这些说明可以存在的又一种形式是可以经由互联网使用以访问在远程站点处的信息的网站地址。
[0578]
序列
[0579]
在一些实施方案中,本文所述的方法包括施用具有本文所述序列(例如,本文所述的重链序列、轻链序列和/或cdr序列)的抗体。所施用抗体的序列可以是例如与本文所述序列至少95%、96%、97%、98%、99%或100%相同的。
[0580]
在两个或更多个核酸或多肽序列的上下文中,术语“同一性”百分比是指两个或更多个序列或子序列在比较和比对最大对应性时,如使用下述序列比较算法之一(例如,blastp和blastn或技术人员可用的其他算法)或通过目视检查所测量的,具有指定百分比的相同核苷酸或氨基酸残基。根据应用,“同一性”百分比可以存在于被比较序列的某个区域上(例如功能结构域上),或替代性地,存在于待比较的两个序列的全长上。
[0581]
对于序列比较,通常一个序列作为参考序列,测试序列与其进行比较。当使用序列比较算法时,将测试序列和参考序列输入计算机中,如有必要,指定子序列坐标,并且指定序列算法程序参数。然后序列比较算法基于指定的程序参数计算测试序列相对于参考序列的序列同一性百分比。
[0582]
用于比较的序列最佳比对可以例如通过以下方法来进行:smith和waterman,adv.appl.math.2:482(1981)的局部同源性算法;needleman和wunsch,j.mol.biol.48:443(1970)的同源性比对算法;pearson和lipman,proc.nat'l.acad.sci.usa 85:2444(1988)的相似性搜索方法;这些算法的计算机化实施(wisconsin遗传学软件包(genetics computer group,575science dr.,madison,wis.)中的gap、bestfit、fasta和tfasta);或目视检查(大体参见ausubel等人,见下文)。
[0583]
适于测定序列同一性百分比和序列相似性百分比的算法的一个示例是blast算
法,其在altschul等人,j.mol.biol.215:403-410(1990)中有所描述。用于进行blast分析的软件可通过美国国家生物技术信息中心(《www.ncbi.nlm.nih.gov/》)公开获得。
[0584]
实施例
[0585]
以下是用于实施本发明的具体实施方案的实施例。这些实施例仅仅是为了说明的目的而提供的,并且不旨在以任何方式限制本发明的范围。尽管已努力确保所用数值(例如,量、温度等)的准确性,但是当然应当允许一些实验误差和偏差。
[0586]
除非另外指明,否则本发明的实施将采用本领域技术范围内的蛋白质化学、生物化学、重组dna技术和药理学的常规方法。此类技术在文献中有完整的解释。参见例如,t.e.creighton,proteins:structures and molecular properties(w.h.freeman and company,1993);a.l.lehninger,biochemistry(worth publishers,inc.,current addition);sambrook等人,molecular cloning:a laboratory manual(第2版,1989);methods in enzymology(s.colowick和n.kaplan编辑,academic press,inc.);remington's pharmaceutical sciences,第18版(easton,pennsylvania:mack publishing company,1990);carey和sundberg advanced organic chemistry第3版(plenum press)卷a和卷b(1992)。
[0587]
实施例1:hu5f9-g4与利妥昔单抗组合治疗复发性/难治性b细胞非霍奇金氏淋巴瘤人类患者
[0588]
简介
[0589]
非霍奇金氏淋巴瘤(nhl)是美国和欧洲最常见的癌症之一,每年分别诊断出超过70,000和93,000个新病例。弥漫性大b细胞淋巴瘤(dlbcl)是nhl的侵袭性亚型,其复发率高且长期存活率差。此外,患有惰性淋巴瘤并且在施用利妥昔单抗后复发或是利妥昔单抗难治的患者几乎没有治疗选择。需要新型和有效的疗法来解决这些高度未满足的医疗需求。hu5f9-g4是靶向抗吞噬细胞表面蛋白cd47的单克隆抗体。非临床研究已证明,通过该抗体阻断cd47信号传导通过促进巨噬细胞的吞噬作用来消除人类肿瘤细胞(包括nhl)。另外的非临床研究证明,抗cd47抗体可以与fc受体活化抗癌抗体(包括利妥昔单抗)协同作用。在nhl的非临床模型中,采用hu5f9-g4和抗cd20单克隆抗体利妥昔单抗的联合疗法证明了与单独的任一种药剂相比存在协同抗癌反应。
[0590]
该1b/2期试验确定了在患有复发性/难治性b细胞nhl的患者中hu5f9-g4与利妥昔单抗组合的安全性和耐受性以及给药策略。hu5f9-g4和利妥昔单抗均静脉内施用。最初,该试验利用了降低的起始剂量hu5f9-g4与全剂量利妥昔单抗的组合。后续的剂量队列递增hu5f9-g4的剂量。此外,用该抗体组合研究了初步的抗癌活性。图2示出了以下研究设计方案:hu5f9-g4与利妥昔单抗组合在复发性/难治性b细胞非霍奇金氏淋巴瘤患者中的1b/2期试验。
[0591]
患者资格
[0592]
纳入标准如下:
[0593]
1.≥18岁的成人
[0594]
2.仅1b期:通过免疫组织化学(ihc)或流式细胞术确定患有表达cd20的b细胞nhl,其在至少2条在先治疗线后复发或是至少2条在先治疗线难治的
[0595]
3.dlbcl 2期队列:通过ihc或流式细胞术确定患有经组织学证实的表达cd20的从
头dlbcl或转化性dlbcl,是一线疗法难治的;或者是二线挽救方案或自体造血细胞移植后复发的,或二线挽救方案或自体造血细胞移植难治的
[0596]
4.惰性淋巴瘤2期队列:通过ihc或流式细胞术确定患有经组织学证实的表达cd20的边缘区或滤泡性淋巴瘤(级别1-3a),其在至少2条在先治疗线后复发或是至少2条在先治疗线难治的
[0597]
5.东部肿瘤协作组(ecog)分数0-2
[0598]
6.根据淋巴瘤lugano分类可测量或可评估反应的疾病
[0599]
7.实验室测量结果,血细胞计数:
[0600]
ο血红蛋白≥9.5g/dl
[0601]
ο绝对中性粒细胞计数(anc)≥1.0
×
109个/ml
[0602]
ο血小板≥50
×
109个/ml
[0603]
8.实验室测量结果,肝功能:
[0604]
ο天冬氨酸转氨酶(ast)/丙氨酸转氨酶(alt)《5
×
正常值上限(uln)
[0605]
ο胆红素≤1.5
×
或3.0
×
uln,并且如果患者具有吉尔伯特综合征或遗传等同改变的记录病史,则主要是未结合型胆红素
[0606]
9.实验室测量结果,肾功能:
[0607]
ο血清肌酸酐≤1.5
×
uln,或计算的肾小球滤过率(gfr)》40ml/min/1.73m2
[0608]
10.对于育龄妇女,入选前30天内和首次施用hu5f9-g4前72小时内尿液或血清妊娠试验呈阴性。
[0609]
11.育龄女性应当愿意在研究期间使用1种高效避孕方法,并且在最后一剂利妥昔单抗后持续使用12个月,或者在最后一剂hu5f9-g4后持续使用4个月,以后到者为准
[0610]
12.如果配偶是育龄女性,则男性应当愿意在研究期间使用1种有效避孕方法,并且在最后一剂利妥昔单抗后持续使用12个月,或者在最后一剂hu5f9-g4后持续使用4个月,以后到者为准
[0611]
13.受试者已提供知情同意书
[0612]
14.应当愿意并能够遵守研究方案中概述的临床访视和规程
[0613]
15.仅2期:愿意同意1次强制性治疗前肿瘤活检和1次治疗中肿瘤活检,除非研究者确定不可行(原因包括但不限于:对于活检缺少可触及的肿瘤组织,以及患者安全性问题)
[0614]
排除标准如下:
[0615]
1.活动性脑转移患者。(停用皮质类固醇疗法至少3周的具有稳定治疗的中枢神经系统[cns]病变的患者被认为不是活动性的。)
[0616]
2.在hu5f9-g4给药前2周内或至少4个半衰期内(直到最长4周),以较长者为准,进行了先前抗癌疗法(包括化学疗法、激素疗法或施用研究药剂)。在所有情况下,在用hu5f9-g4第一次治疗的当天之前,所需的最大洗脱期将不超过4周。低剂量类固醇(每天口服泼尼松或等效物≤20mg)、局部非cns放射疗法、先前存在的用lhrh激动剂治疗前列腺癌的先前激素疗法,以及用双膦酸盐和rankl抑制剂治疗不是排除标准。
[0617]
3.已知活动性或慢性乙型肝炎或丙型肝炎感染,或者人免疫缺陷病毒(hiv)。
[0618]
4.红细胞(rbc)输血依赖性,被定义为在筛选前的4周期间需要超过2个单位的rbc
输血。在筛选期间和入选前允许rbc输血以满足血红蛋白纳入标准。
[0619]
5.过去3个月中有溶血性贫血或伊文氏综合征病史。
[0620]
6.直接抗球蛋白测试(dat)呈阳性。
[0621]
7.先前用cd47或信号调节蛋白α(sirpα)靶向剂治疗。
[0622]
8.第二恶性肿瘤,治疗的基底细胞或局部鳞状皮肤癌、局部前列腺癌或其他恶性肿瘤除外,针对其患者没有正在接受如排除标准2所定义的主动抗癌疗法。
[0623]
9.对以下链接列出的活性物质、鼠蛋白或者利妥昔单抗的任何其他赋形剂存在超敏反应:(利妥昔单抗)处方信息http://www.gene.com/download/pdf/rituxan_prescribing.pdf;(利妥昔单抗)处方信息http://www.ema.europa.eu/docs/en_gb/document_library/epar_-_product_information/human/000165/wc500025821.pdf。每个链接均截至2017年4月27日。
[0624]
10.重大的医学疾病或病症,研究者和申办者评估其将显著增大参与该研究的风险收益比。这包括但不限于过去6个月内的急性心肌梗塞、不稳定型心绞痛、不受控制的糖尿病、显著的活动性感染、严重免疫受损状态,以及纽约心脏协会(nyha)ii-iv类充血性心力衰竭。
[0625]
11.精神疾病史或药物滥用史可能妨碍遵守方案要求或提供知情同意书的能力。
[0626]
12.怀孕或主动母乳喂养。
[0627]
研究目标
[0628]
主要目标
[0629]
(1)研究hu5f9-g4与利妥昔单抗组合的安全性和耐受性,以及定义该组合的2期剂量。
[0630]
(2)在2期中,评价hu5f9-g4与利妥昔单抗组合在患有惰性淋巴瘤和dlbcl的患者中的功效,如通过总体反应率(orr)测量的。
[0631]
次要目标
[0632]
(1)在1b期和2期中,评价hu5f9-g4与利妥昔单抗组合的药代动力学(pk)分布。
[0633]
(2)在1b期和2期中,评价hu5f9-g4与利妥昔单抗组合的免疫原性。
[0634]
(3)在2期中,评价hu5f9-g4与利妥昔单抗组合在惰性淋巴瘤和dlbcl中的功效,如通过反应持续时间、最佳总体反应率、无进展存活率和总体存活率测量的。
[0635]
(4)根据淋巴瘤lyric标准来评价反应率。
[0636]
探索性目标
[0637]
(1)评估hu5f9-g4与利妥昔单抗组合的免疫细胞功效和肿瘤穿透的
[0638]
生物标志物。
[0639]
(2)评估nhl的分子亚型中的功效。
[0640]
终点
[0641]
主要终点
[0642]
(1)剂量限制性毒性(dlt)(仅1b期)和不良事件(ae),根据nci ctcae,版本4.03。
[0643]
(2)2期:根据淋巴瘤lugano分类的客观反应。
[0644]
次要终点
[0645]
(1)1b期和2期:hu5f9-g4与利妥昔单抗组合的浓度对时间测量结果和pk参数,包括最大血浆浓度(c
max
)、达到最大浓度的时间(t
max
)、终末半衰期(t
1/2
)、曲线下面积(auc)、清除率(cl),以及终末期期间的分布体积(vz)。
[0646]
(2)1b期和2期:针对hu5f9-g4和利妥昔单抗的抗药物抗体。
[0647]
(3)2期:反应持续时间(dor)、最佳总体反应率(bor)、无进展存活率(pfs)和总体存活率(os)。
[0648]
(4)根据淋巴瘤lyric标准的客观反应。
[0649]
探索
[0650]
(1)适用时,cd47受体在外周rbc和白细胞(wbc)以及淋巴瘤细胞上的占有率。
[0651]
(2)hu5f9-g4生物活性的药效动力学标志物,潜在地包括但不限于循环细胞因子谱、对循环t细胞的t细胞受体测序、循环白细胞的大量细胞计数法(cytof)/流式细胞术,以及t细胞活化研究。
[0652]
(3)在经历肿瘤活检的患者中,肿瘤细胞的hu5f9-g4饱和以及肿瘤微环境中的变化,包括但不限于巨噬细胞和t细胞肿瘤浸润。
[0653]
(4)在经历肿瘤活检的患者中,抗癌反应与nhl分子亚型(包括但不限于dlbcl的起源细胞)以及bcl2、bcl6和myc突变/表达状态的关联。
[0654]
干预和递送模式
[0655]
hu5f9-g4是针对cd47的人源化单克隆抗体,而利妥昔单抗是针对cd20的嵌合单克隆抗体。这两种药物均静脉内施用。hu5f9-g4在所有1b期周期的第1天、第8天、第15天和第22天施用,而利妥昔单抗在第1周期的第8天、第15天和第22天,之后在第2周期至第6周期的第1天施用。
[0656]
干预和评价的持续时间
[0657]
1b/2期:对于该研究的1b期部分,患者用hu5f9-g4和利妥昔单抗以标准的3 3剂量递增设计进行治疗。用于确定最大耐受剂量(mtd)的dlt安全性评价在前4周内进行。每2个周期(8周)进行一次反应评估,直至疾病进展。利妥昔单抗共施用6个周期,而hu5f9-g4治疗对于没有疾病进展的患者来说超过6个周期。
[0658]
患者数量
[0659]
1b期:总计9至18名患者
[0660]
每个剂量水平:
[0661]
水平1:3至6名
[0662]
水平2:3至6名
[0663]
水平3:3至6名
[0664]
2期:48名患者(24名惰性淋巴瘤患者;24名dlbcl患者)
[0665]
研究总计:57至66名患者(假设进展至2期的2阶段)
[0666]
h分数
[0667]
h分数被计算为b细胞存在或不存在于患者中的量度。从患者获得组织活检物(例如,癌症活检物),并且针对b细胞标志物(诸如cd19或cd20)进行免疫染色。对免疫染色的组织切片进行b细胞标志物成像,以确定h分数。用于确定h分数的示例性方法在下文参考存在或不存在cd20 b细胞进行描述。
[0668]
h分数可以如下进行评分:1)在0至3 标度上的分数为2 或 3,其中0表示不存在b细胞染色,且3 表示最大b细胞染色;2)或者使用h分数、半定量分数,由此在固定视野中确定每个细胞的cd20膜染色强度(0、1 、2 或3 )。计算每个染色强度水平下的细胞百分比,并且使用下式分配h分数:[1
×
(%评分为1 的细胞) 2
×
(%评分为2 的细胞 3
×
(%评分为3 的细胞)]。h分数可以在0至300范围内。可以使用用于导出h分数的类似方法。高h分数截止值将用于确定存在b细胞。低cd20表达可以用分数0或1 来评分;由此利用低h分数截止值来确定受试者中缺乏b细胞。
[0669]
影响反应率的变量的回顾性分析
[0670]
分析不同的变量,以确定在1b期试验中入选的dlbcl患者与在2期试验中入选的dlbcl患者之间的不同反应率。变量包括:基线处的cd19细胞计数、基线处cd19细胞计数相对于总淋巴细胞的百分比、基线处的总淋巴细胞计数、自最后一次抗cd20疗法以来的月数、基线处患者中的利妥昔单抗浓度、基线处的肿瘤负荷、血红蛋白计数、中性粒细胞计数、血小板计数、东部肿瘤协作组(ecog)状态、基线处的乳酸脱氢酶(ldh)量,以及基线处的白蛋白量。
[0671]
此外,尽管没有收集临床cd20 b细胞数据,但是关于cd19 b细胞和利妥昔单抗浓度的患者数据被用作存在或不存在cd20 b细胞的代表,使得存在/不存在cd20 b细胞将用作分析的附加变量。
[0672]
图3示出了使用cd19 b细胞的百分比和利妥昔单抗作为存在cd20 b细胞的代表。具体地讲,具有高利妥昔单抗浓度(例如,高于103ng/ml)和有限的cd19 b细胞(例如,低于0.01%的cd19 b细胞)的患者(在图3中标记为310)被分类为不具有cd20 b细胞。具有低利妥昔单抗浓度(例如,低于10ng/ml)和大量cd19 b细胞(例如,高于1%的cd19 b细胞)的患者(在图3中标记为320)被分类为具有cd20 b细胞。具有中等利妥昔单抗浓度(介于1ng/ml与500ng/ml之间)与一些cd19 b细胞(高于0.01%的cd19 b细胞)的患者(在图3中标记为330)被分类为具有cd20 b细胞。具有高利妥昔单抗浓度(例如,高于500ng/ml)与一些cd19 b细胞(高于0.01%的cd19 b细胞)的患者(在图3中标记为340)被分类为具有cd20 b细胞。
[0673]
对于每个变量,使用逻辑回归方法进行单变量分析,该方法对在1b期试验和2期试验中入选的dlbcl患者的变量与客观反应率(包括完全反应和部分反应两者)之间的关系进行建模。
[0674]
具有细化的患者资格标准的计划研究
[0675]
修订的资格标准将在新注册dlbcl患者队列中实施。将使用新修订的资格标准进行估计20名患者的期中分析,以验证是否入选后续的80名患者。终点将基于客观反应率(完全反应或部分反应)和反应持续时间。
[0676]
期中分析中的dlbcl患者将已接受大于或等于2条在先治疗线。下表5记录了用于选择将被纳入20名患者期中分析的患者和用于其后续治疗的附加的修订方案标准。
[0677]
表5:修订的方案标准
[0678][0679]
实施例2:人类结果
[0680]
患者反应率
[0681]
一般来讲,与入选2期试验的患者相比,入选1b期试验的dlbcl患者更有利地对莫洛利单抗和利妥昔单抗的组合治疗作出反应。表6示出了截至2019年5月15日,在1b期和2期这两项研究中用莫洛利单抗和利妥昔单抗组合治疗的患者中观察到的抗肿瘤活性的汇总。
[0682]
表6
[0683]
最佳总体反应率总dlbcl n=591b期n=21(%)2期n=38(%)客观反应率(orr)21(36%)10(48%)11(29%)完全反应(cr)9(15%)7(33%)2(5%)部分反应(pr)12(20%)3(14%)9(24%)病情稳定(sd)7(12%)4(19%)3(8%)疾病进展(pd)31(53%)7(33%)24(63%)
[0684]
具体地讲,如表6所示,在入选1b期试验的dlbcl患者中,21名患者中有10名(48%)表现出客观反应率(7名是完全反应,3名是部分反应)。比较而言,在入选2期试验的dlbcl患者中,38名患者中只有11名(29%)表现出客观反应率(2名是完全反应,9名是部分反应)。
[0685]
此外,在入选1b期试验的dlbcl患者中,4名患者(19%)表现出病情稳定,并且7名患者(33%)表现出疾病进展。入选2期试验的3名患者(8%)表现出病情稳定,但在入选2期试验的患者中有显著较高百分比的患者表现出疾病进展(38名患者中的24名,63%)。
[0686]
此外,在1b期试验中,dlbcl患者的中位随访期为13.8个月。相比之下,在2期试验中,dlbcl患者的中位随访期显著缩短,为3.7个月。
[0687]
影响反应率的变量的回顾性分析
[0688]
考虑到入选1b期和2期试验的患者的反应率存在显著差异,对不同变量进行单变量分析,以确定导致反应率差异的可能原因。
[0689]
图4示出了在1b/2期试验中影响患者反应率的确定变量。特别地,发现以下变量与患者对莫洛利单抗和利妥昔单抗联合疗法的反应在统计学上显著相关:基线处的cd19细胞计数、基线处cd19细胞计数相对于淋巴细胞的百分比、自最后一次抗cd20疗法以来的月数,以及受试者中的利妥昔单抗浓度。
[0690]
特别地,基线处的cd19细胞计数、基线处cd19细胞计数相对于淋巴细胞的百分比以及自最后一次抗cd20疗法以来的月数这些变量中的每一者表现出与患者客观反应率的
直接相关性。基线处受试者中的利妥昔单抗浓度与患者客观反应率呈负相关。
[0691]
cd19 b细胞的存在
[0692]
进一步研究了cd19 b细胞存在的变量,以确定其与表现出客观反应率的患者的关联。图5是描绘cd19 b细胞阴性患者的最佳总体反应率的柱形图。在cd19 b细胞数据可用的患者中,6名患者表现出cr、7名患者表现出pr、4名患者表现出sd,并且23名患者表现出pd。表现出cr的6名患者中没有患者为cd19 b细胞阴性,表现出pr的7名患者中没有患者为cd19 b细胞阴性,表现出sd的4名患者中有2名为cd19 b细胞阴性,并且表现出pd的23名患者中有12名为cd19 b细胞阴性。这些结果表明,为b细胞阴性的患者不成比例地表现出sd或pd。
[0693]
图6是描绘基于患者外周血中cd19 b细胞的百分比的患者最佳总体反应率的图。具体地讲,图6描绘了入选1b期或2期试验的个体患者的外周血中cd19 b细胞相对于总淋巴细胞的百分比,以及这些个体患者中的每个患者的最佳总体反应率。一般来讲,外周血中cd19 b细胞相对于总淋巴细胞的百分比较高的患者相比于cd19 b细胞百分比较低的患者更有利地作出反应(例如,cr或pr)。
[0694]
具体地讲,表现出cr的患者具有总淋巴细胞中平均约7.5%的cd19 b细胞。表现出pr的患者具有总淋巴细胞中平均约5.5%的cd19 b细胞。表现出sd或pd的患者具有总淋巴细胞中平均约2%的cd19 b细胞。cr患者和pr患者各自的平均%cd19 b细胞群与pd患者的平均%cd19 b细胞群相比具有统计学显著性。特别地,表现出pd的患者大群体(在图6中标记为610)没有cd19 b细胞。值得注意的是,四名患者表现出cr或pr,在图6中标记为615,这可能是由于先前治疗(利妥昔单抗)导致的长期b细胞耗竭所致。
[0695]
图7是描绘基于患者外周血中cd19 b细胞的绝对计数的患者最佳总体反应率的图。具体地讲,图7描绘了入选1b期或2期试验的个体患者的cd19 b细胞绝对计数(每微升的细胞数),以及这些个体患者中的每个患者的最佳总体反应率。与从图6所示结果得出的结论类似,具有较高cd19 b细胞绝对计数的患者相比于具有较低cd19 b细胞绝对计数的患者更有利地作出反应(例如,cr或pr)。
[0696]
具体地讲,表现出cr的患者每微升具有平均约75个cd19 b细胞。表现出pr的患者每微升具有平均约42个cd19 b细胞。表现出sd的患者每微升具有平均约5%的cd19 b细胞。表现出pd的患者每微升具有平均约39%的cd19 b细胞。值得注意的是,表现出pd的患者具有宽范围的cd19 b细胞绝对计数(范围从每微升0个细胞至最多每微升约600个细胞)。cr患者中cd19 b细胞的绝对计数与pd患者中cd19 b细胞的绝对计数相比具有统计学显著性。
[0697]
图8示出了在应用cd19 b细胞存在的资格标准之前和之后,参与1b/2期试验的患者的反应率。标题为“未选择的数据”的列是指入选1b期试验和2期试验的患者群体(n=42),不考虑cd19 b细胞的存在。标题为“cd19 b细胞阳性患者”的列表示其中存在cd19 b细胞的患者群体的子集(n=28)。b细胞的存在被定义为检测到高于检测限的b细胞。因此,如果将资格标准追溯性地应用于入选1b/2期试验的患者,则42名患者中的14名将被排除。在这些被排除的患者中,全都表现出sd或pd。具体地讲,追溯性地应用存在cd19 b细胞的这种资格标准将表现出orr的患者的百分比从33%增加至最高50%。此外,追溯性地应用存在cd19 b细胞的这种资格标准将表现出cr和pr的患者的百分比分别从14%增加至21%和从19%增加至29%。这表明,要求患者存在cd19 b细胞的资格标准可能有望用于识别可能有利地对莫洛利单抗和利妥昔单抗联合疗法作出反应的患者。
[0698]
cd20 b细胞的存在
[0699]
图9示出了基于cd20 b细胞存在或不存在于患有弥漫性大b细胞淋巴瘤或滤泡性淋巴瘤的患者中描绘所述患者的最佳总体反应率的饼形图。对于这两种疾病,缺乏cd20 b细胞(在图9中表示为cd20-)的患者表现出sd或pd。相反,存在cd20 b细胞的患者表现出更多样化的反应率。
[0700]
具体地讲,在存在cd20 b细胞的17名dlbcl患者中,超过25%的那些患者表现出cr或pr。此外,在存在cd20 b细胞的21名滤泡性淋巴瘤患者中,超过50%的那些患者表现出cr或pr。这表明,存在cd20 b细胞的资格标准可以识别更可能对莫洛利单抗和利妥昔单抗组合治疗作出反应的患者。
[0701]
图10示出了在应用cd20 b细胞存在的资格标准之前和之后,参与1b/2期试验的患者的客观反应率。标题为“未选择的数据”的列是指入选1b期试验和2期试验的患者群体(n=42),不考虑cd20 b细胞的存在。标题为“cd20 b细胞阳性患者”的列表示其中估计存在(例如,如上所述,通过cd19 b细胞的代表数据和利妥昔单抗浓度来估计)cd20 b细胞的患者群体的子集(n=16)。如果将存在cd20 b细胞的资格标准追溯性地应用于入选1b/2期试验的患者,则42名患者中的26名将被排除。
[0702]
追溯性地应用存在cd20 b细胞的这种资格标准将表现出orr的患者的百分比从33%增加至最高62.5%。此外,追溯性地应用存在cd20 b细胞的这种资格标准将表现出cr和pr的患者的百分比分别从14%增加至25%和从19%增加至37.5%。这表明,要求患者存在cd20 b细胞的资格标准可能有望用于识别可能有利地对莫洛利单抗和利妥昔单抗联合疗法作出反应的患者。
[0703]
图11a和图11b描绘了描述cd20 h评分的结果,该评分用作存在或不存在cd20 b细胞的直接量度。具体地讲,图11a描绘了dlbcl患者在其筛选时(例如,在入选试验和接受治疗之前筛选资格)的cd20 h分数。图11b描绘了在筛选时所有nhl患者的cd20 h分数。使用cd20 b细胞小于或等于总cd45 细胞的0.2%的截止值来定义cd20阴性病例。在图11a和图11b两者中,具有高cd20 h分数的患者存在cd20 b细胞,而具有低cd20 h分数的患者不存在cd20 b细胞。更具体地讲,在图11a中,具有cd20 b细胞的dlbcl患者的平均cd20 h分数为约200,这明显不同于缺乏cd20 b细胞的dlbcl患者的对应h分数。在图11b中,具有cd20 b细胞的所有nhl患者的平均cd20 h分数为约180,这明显不同于缺乏cd20 b细胞的nhl患者的对应h分数。这表明如果实施了存在cd20 b细胞的资格标准,则cd20 h分数可以用于直接预测存在或不存在cd20 b细胞。
[0704]
cd19 b细胞和cd20 b细胞两者的存在
[0705]
图12a和图12b描绘了使用免疫组织化学(ihc)确认的具有cd20 cd19 或cd20-cd19 分布的两名患者的结果。如上所述,通过肿瘤活检物的ihc染色和通过计算h分数确定存在cd20 b细胞和cd19 b细胞。
[0706]
图12a描绘了对莫洛利单抗和利妥昔单抗的联合疗法表现出部分反应的dlbcl患者中的cd20 b细胞和cd19 b细胞两者的阳性ihc染色。相比之下,图12b描绘了另一个dlbcl患者中的cd20 b细胞的阴性ihc染色和cd19 b细胞的阳性ihc染色。在此,该dlbcl患者对莫洛利单抗和利妥昔单抗的联合疗法作出反应而表现出疾病进展。总而言之,图12a和图12b表明,具有cd20-/cd19 分布的患者与具有不同分布的其他患者相比,对莫洛利单抗 利妥
昔单抗联合疗法的反应可能较差。
[0707]
最后一次抗cd20治疗的时间
[0708]
最后一次抗cd20治疗的时间可以用作患者对联合疗法的反应的直接预测因子并且/或者可以用作存在或不存在cd19 b细胞或cd20 b细胞的替代物测量值。
[0709]
图13在y轴上示出了自最后一次抗cd20治疗以来的天数(对数标度),并且在x轴上示出了患者反应(例如,cr、pr、sd、pd)。一般来讲,自最后一次抗cd20治疗以来的天数越高,患者将表现出cr或pr而不是sd或pd的可能性就越大。具体地讲,如图13所示,患者自最后一次抗cd20治疗以来表现出cr或pr的平均天数为约750天至800天。相比之下,患者自最后一次抗cd20治疗以来表现出sd的平均天数为约200天,而患者自最后一次抗cd20治疗以来表现出pd的平均天数为约120天。这表明最后一次抗cd20治疗的时间可以是患者对莫洛利单抗和利妥昔单抗联合疗法的反应的直接预测因子。
[0710]
图14a和图14b示出了涉及抗cd20治疗(例如利妥昔单抗)的治疗后cd20表达的减少。具体地讲,图14a描绘了在筛选时和治疗后2个月时从dlbcl患者(患者24-014)获得的组织切片的cd20免疫组织化学染色。与筛选时组织中的cd20免疫组织化学染色相比,治疗后组织中的cd20染色的强度降低,这可能是抗cd20治疗的结果。此外,图14b描绘了筛选时(例如“治疗前”)和治疗后(例如,“治疗后”)的cd20 表达的定量百分比。在此,筛选时cd20 超过细胞的50%,而治疗后cd20 少于细胞的40%。这种差异具有统计学显著性。
[0711]
图15a和图15b示出了个体dlbcl患者在筛选时和治疗后cd20表达的变化。图15a示出大多数dlbcl患者在治疗后经历表达cd20的细胞的百分比降低。图15b类似地示出,大多数dlbcl患者经历cd20 h分数降低,该分数是衡量存在cd20 b细胞的量度。
[0712]
总而言之,图14a/14b和图15a/15b证明cd20表达由于包括抗cd20在内的治疗而降低,因此,考虑到cd20 b细胞随时间推移的补充,自最后一次抗cd20治疗以来的较大天数将可能导致改善的结果,如图13所示。
[0713]
图16示出了患者最后一次接受抗cd20治疗的时间与患者中存在的cd19 b细胞的绝对计数之间的相关性。一般来讲,从最后一次抗cd20治疗起的月数与cd19 b细胞的绝对数量(每微升的细胞数)之间存在直接相关性。图17示出了患者最后一次接受抗cd20治疗的时间与患者中存在的cd19 b细胞的百分比之间的相关性。在此,从最后一次抗cd20治疗开始的月数与cd19 b细胞相对于总淋巴细胞的百分比之间存在直接相关性。值得注意的是,在图16和图17两者中,有在介于1个月至10个月之间不恢复cd19 b细胞的患者亚群。这些患者在其cd19 b细胞被补充之前可能需要超过10个月的时间。下表7提供了关于在确定存在或不存在cd19 b细胞的患者中从最后一次抗cd20治疗起的月数的统计数据。检测限的截止值用于区分cd19 b细胞是存在还是不存在。
[0714]
表7
[0715]
[0716]
总而言之,这些结果表明,最后一次抗cd20治疗的时间可以作为资格标准实施,以排除不太可能对莫洛利单抗和利妥昔单抗的组合治疗作出反应的患者。作为一个示例,资格标准可以是患者在至少4周以前最后一次接受抗cd20治疗。
[0717]
受试者中的利妥昔单抗浓度
[0718]
基线处受试者中的抗cd20疗法(例如,利妥昔单抗)的浓度可以用作存在或不存在b细胞(诸如cd19 b细胞)的替代物测量值。图17至图19中的每一者均描述了支持使用受试者中的利妥昔单抗浓度作为存在cd19 b细胞的替代物测量值的结果。
[0719]
图18示出了患者中的利妥昔单抗浓度(例如,作为利妥昔单抗药代动力学的量度)与患者中存在的cd19 b细胞的百分比之间的相关性。显著比例的患者(在图18中标记为1810)具有低血清水平的利妥昔单抗(约1ng/ml)和较高百分比的cd19 b细胞(介于100%与101%之间的b细胞)。第二患者群体(在图18中标记为1820)具有较高血清水平的利妥昔单抗(介于102ng/ml与105ng/ml之间),与稍低水平的cd19 b细胞(介于10-2%
与100%之间的b细胞)。此外,第三患者群体(在图18中标记为1830)具有较高水平的利妥昔单抗(介于102ng/ml与105ng/ml之间)和低百分的cd19 b细胞(约10-3%
的b细胞)。因此,在第一群体1810,第二群体1820和第三群体1830中,利妥昔单抗浓度的降低导致患者中cd19 b细胞百分比的显著增加。
[0720]
图19示出了患者中存在或不存在利妥昔单抗与患者中存在的cd19 b细胞的百分比之间的相关性。具体地讲,基于每个患者的血清利妥昔单抗水平,将患者分类为“阴性”类别和“阳性”类别。检测限的截止值用于区分cd19 b细胞是存在还是不存在。被分类为“阴性”类别的患者具有约4%的平均cd19 b细胞百分比,而被分类为“阳性”类别的患者具有0.01%的平均cd19 b细胞百分比。n/a类别是指没有可用cd19测量值的患者。
[0721]
图20示出了患者中的利妥昔单抗浓度与患者中存在或不存在cd19 b细胞之间的相关性。患者被分类为“不存在”类别和“存在”类别。检测限的截止值用于区分cd19 b细胞是存在还是不存在。被分类为“不存在”类别的患者具有约104pg/μl的平均利妥昔单抗浓度,而被分类为“存在”类别的患者具有约102pg/μl的平均利妥昔单抗浓度。
[0722]
下表8记录了为利妥昔单抗阳性或阴性类别之一以及为cd19 b细胞不存在或cd19 b细胞存在类别之一的患者分类。
[0723]
表8
[0724][0725]
总而言之,这些结果表明,患者中的利妥昔单抗浓度可以作为资格标准实施,以排除不太可能对莫洛利单抗和利妥昔单抗的组合治疗作出反应的患者。例如,资格标准可以是在基线处或筛选时患者中的利妥昔单抗浓度小于1ng/ml、10ng/ml或100ng/ml。
[0726]
尽管已经参考优选实施方案和各种替代实施方案具体示出和描述了本发明,但是相关领域的技术人员将理解,在不脱离本发明的实质和范围的情况下,可以在形式和细节上在其中作出各种改变。
[0727]
在本说明书正文中引用的所有参考文献、授权专利和专利申请据此全文以引用方
式并入本文,以用于所有目的。
[0728]
实施例3:在q1w对q2w hu5f9-g4给药方案中的抗体受体占有率图21a示出了从hu5f9-g4给药(q1w)转变为隔周hu5f9-g4给药(q2w)之后,随时间推移cd45 外周血细胞中hu5f9-g4的cd47受体占有率。受体占有率表示为稳态qw水平的分数。图21b示出了从每周hu5f9-g4给药(q1w)转变为隔周hu5f9-g4给药(q2w)之后,随时间推移cd45 骨髓细胞中hu5f9-g4的cd47受体占有率。受体占有率表示为稳态qw水平的分数。
[0729]
在每周一次给药(q1w)方案和每两周一次给药(q2w)方案中评估抗体受体占有率(ro)。用hu5f9-g4向患者给药,方式为:每周一次,持续所有周期(自始至终q1w);或者每周一次,持续周期1和周期2,然后在周期3和以后的周期中每两周一次(q2w)。在外周血和骨髓中评估cd47抗体受体占有率(ro),并且针对q1w给药与q2w给药进行比较。用hu5f9-g4反应性荧光抗igg4抗体将原代患者血液或骨髓细胞染色,之后经由流式细胞术定量。占有率水平被计算为最大信号的百分比,其通过在抗igg4抗体染色之前添加饱和量的未标记hu5f9-g4的匹配患者样品来定义。将q2w给药的数据相对于q1w ro水平归一化。
[0730]
患者在周期1和周期2期间(q1w给药,未示出)快速达到最大占有率。在外周血(图21a)或骨髓(图21b)两者中,在周期3和以后的周期中的q2w给药改变之后,都观察到了类似的cd47抗体ro。对于这两张图,点表示从周期3和以后的周期起随时间推移而获取的患者样品中的抗体占有率水平相对于患者q1w ro水平进行归一化后的结果,而中线表示线性回归最佳拟合,顶线和底线则表示95%置信区间。因此,hu5f9-g4q2w(即,每两周一次施用剂量)给药导致与q1w(即,每周一次施用剂量)给药相似的cd47受体占有率。
[0731]
尽管已经参考优选实施方案和各种替代实施方案具体示出和描述了本发明,但是相关领域的技术人员将理解,在不脱离本发明的实质和范围的情况下,可以在形式和细节上在其中作出各种改变。
[0732]
表9
–
序列
[0733]
[0734]
[0735]
[0736]
[0737]
[0738]
[0739]
[0740]
[0741]
[0742]
[0743]
[0744]
[0745]
[0746]
[0747]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。