1.本发明属于生物技术和医药领域,特别涉及一种连接基-药物偶联物、其制备方法及应用。
背景技术:
2.配体偶联药物是近几年抗肿瘤药物研究的热门领域,包含了抗体偶联药物(adc) 和小分子配体偶联药物(smdc),其中adc尤其引人关注。目前国外已有9个adc药物获批上市销售。2000年5月17日fda批准辉瑞公司的gemtuzumab ozogamicin(商品名mylotarg)上市,用于治疗首次复发、60岁以上、cd33 、不适合细胞毒化疗的急性髓性白血病(aml)患者,虽然该药在2010年遭撤市,但又于2017年重新上市,同年辉瑞的inotuzumab ozogamicin(商品名besponsa)也被fda批准上市,用于治疗成人复发难治b细胞all。2011年8月19日,fda批准seattle genetics公司开发的 brentuximab vedotin(商品名adcetris)上市,用于治疗cd30阳性的霍杰金淋巴瘤(hl) 和罕见疾病系统性间变性大细胞淋巴瘤(salcl)。2013年2月22日,genentech公司开发的ado-trastuzumab emtansine(t-dm1,商品名kadcyla)获fda批准上市销售,主要用于治疗her2阳性晚期(转移性)乳腺癌。特别在2019年,polatuzumab vedotin(商品名polivy)、enfortumab vedotin(商品名padcev)和fam-trastuzumabderuxtecan(商品名 enhertu)相继获批上市。另外,国内外还有超过100多种adc药物处在临床以及临床前开发阶段。
3.连接基-药物(linker-drug)是adc的核心部分,adc的活性分子的可选范围较广,各种高活性的化合物、临床阶段或已上市的细胞毒药物均能用于adc设计。但是针对特定类型的drug分子设计合适的linker仍然存在较大挑战。目前临床阶段和已上市的adc 大部分使用的是西雅图的adcetris的linker-drug技术。该技术仅能用于氨基类药物,羟基类药物的linker较少,immu-132使用的是羟基类linker,但是该linker很不稳定。ds
‑ꢀ
8201使用的是一种稳定的linker,但该linker不常见,且实践中发现酶切释放速率较慢。理想的linker应该包含以下特点:(1)血液循环中稳定(2)酶切后迅速释放完整药物分子(3)适用范围广,能与常见的羟基、巯基和氨基药物拼接(4)能被常见的溶酶体酶 (如组织蛋白酶)活化释放药物。从现有技术来看,能同时满足上述四点的linker非常罕见,本发明提供了一种满足上述三点要求的linker分子,实践中发现该linker能与常见的羟基和巯基连接形成稳定的连接基-药物偶联物,可以很好地应用于adc和smdc的设计中。
技术实现要素:
4.本发明针对现有技术中缺乏理想的连接基-药物偶联物的现状,提供了一种连接基-药物偶联物,该类连接基-药物偶联物在小鼠和人血浆中均能稳定存在,几乎不释放药物,在组织蛋白酶b的作用下迅速释放完整药物分子,达到100%释放效率。
5.本发明还提供了基于该类连接基-药物偶联物的adc和smdc分子,可以实现细胞毒性药物在adc和smdc领域的广泛应用。本发明提供的adc和smdc分子具有很好的生物学活
性、稳定性和均一性,能抑制哺乳动物肿瘤生长,且具有很好的安全性,可用于治疗多种癌症。
6.本发明通过以下技术方案解决上述技术问题。
7.本发明提供了一种连接基-药物偶联物,其结构通式为:l
4-l
2-l
1-d,其中,
8.d为细胞毒性药物;
9.l1的结构如式i、ii或iii所示,其a端与所述的细胞毒性药物相连,e端和与所述的l2相连,
[0010][0011]
r1为c1~c6烷基或氢;
[0012]
r2为氢、c1~c6烷基、c3~c
10
环烷基、c6~c
14
芳基或5~14元杂芳基;所述的5~14元杂芳基中的杂原子选自n、o和s中的一种或多种,杂原子个数为1、2、3或4;
[0013]
r3为-n(r
3-1r3-2
)取代的c1~c6烷基、r
3-3-s(o)
2-取代的c1~c6烷基、c1~c6烷基、c3~c
10
环烷基、c6~c
14
芳基或5~14元杂芳基;所述的5~14元杂芳基中的杂原子选自n、o和s中的一种或多种,杂原子个数为1、2、3或4;
[0014]
所述的r
3-1
、r
3-2
和r
3-3
独立地为c1~c6烷基;
[0015]
r4为氢、c1~c6烷基、c3~c
10
环烷基、羧酸取代的c1~c6烷基;
[0016]
当r3为且r4为氢时,r2不为氢;
[0017]
通式iii中m为1-3的整数;通式ii中n为0或1-3的整数;
[0018]
l独立地选自20种天然氨基酸;p为1-3的整数;(l)
p
为1-3个氨基酸残基的片段,氨基端和羰基端均通过酰胺键连接,如在式i、ii和iii中,n端与左侧羰基相连,c端与右侧氨基相连;
[0019]
l2为c
2-c
12
直链烷基、或c3~c6环烷基、或含有1-12个乙二醇单元的(聚)乙二醇链、或其任意两种的组合;l2的一端与所述的l1的e端相连,另一端与所述的l4的d端相连;
[0020]
l4为其中d端与所述的l2的一端相连。
[0021]
在本发明一优选实施方案中,上述的连接基-药物偶联物里,某些基团具有如下定义,未提及的基团的定义如上任一方案所述(本段内容以下简称为“在本发明一优选的连接基
ꢀ‑
药物偶联物的实施方案中”):
[0022]
所述细胞毒性药物可为adc领域常规的细胞毒性药物,本发明特别地优选为含有
羟基或巯基的药物,所述的含有羟基或巯基的药物优选自如下结构所示的药物,进一步优选dxd(拓扑异构酶i抑制剂喜树碱衍生物(dx-8951衍生物dxd));
[0023][0024]
在dm-x中,y为0-6整数,x为羟基或者巯基。
[0025]
在本发明一优选的连接基-药物偶联物的实施方案中,所述的细胞毒性药物结构中的羟基或巯基可任选其一地与l1的a端连接,且优选地以醚键的形式与l1连接。以l1为式i时和dxd连接为例,所述的-l
1-d为:
[0026][0027]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0028]
所述的r1为c1~c6烷基(例如甲基、乙基、丙基、丁基、戊基、己基)可为c1~c4烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,又例如甲基。
[0029]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0030]
所述的r2为氢或c1~c6烷基;
[0031]
所述的c1~c6烷基(例如甲基、乙基、丙基、丁基、戊基、己基)可为c1~c4烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,又例如甲基;
[0032]
例如,所述的r2为氢或甲基。
[0033]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0034]
所述的r3为r
3-1r3-2
n-取代的c1~c6烷基或r
3-3-s(o)
2-取代的c1~c6烷基。
[0035]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0036]
所述的r3为r
3-1r3-2
n-取代的c1~c6烷基;
[0037]
所述的c1~c6烷基(例如甲基、乙基、丙基、丁基、戊基、己基)可为c1~c4烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,又例如乙基;
[0038]
所述的r
3-1
和r
3-2
可各自独立地为c1~c4烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,又例如甲基;
[0039]
例如,所述的r3为
[0040]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0041]
所述的r3为r
3-3-s(o)
2-取代的c1~c6烷基;
[0042]
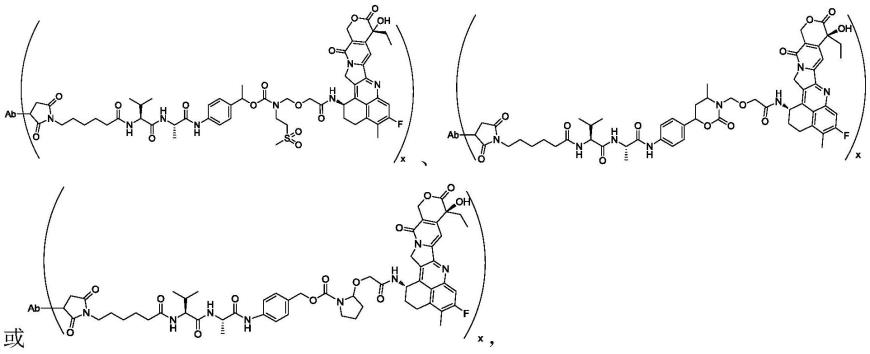
所述的c1~c6烷基(例如甲基、乙基、丙基、丁基、戊基、己基)可为c1~c4烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,又例如乙基;
[0043]
所述的r
3-3
可为c1~c4烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,又例如甲基;
[0044]
例如,所述的r3为
[0045]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0046]
所述的r4为氢或c1~c6烷基;
[0047]
所述的c1~c6烷基(例如甲基、乙基、丙基、丁基、戊基、己基)可为c1~c4烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,又例如甲基;
[0048]
例如,所述的r4为氢或甲基。
[0049]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0050]
所述的l独立地为苯丙氨酸残基、丙氨酸残基、甘氨酸残基、谷氨酸残基、天冬氨酸残基、半胱氨酸残基、谷氨酸残基、组氨酸残基、异亮氨酸残基、亮氨酸残基、赖氨酸残基、甲硫氨酸残基、脯氨酸残基、丝氨酸残基、苏氨酸残基、色氨酸残基、酪氨酸残基或缬氨酸残基;
[0051]
例如,缬氨酸残基、甘氨酸残基或苯丙氨酸残基,又例如缬氨酸残基。
[0052]
在本发明一优选的连接基-药物偶联物的实施方案中,n为1。
[0053]
在本发明一优选的连接基-药物偶联物的实施方案中,m为1或2。
[0054]
在本发明一优选的连接基-药物偶联物的实施方案中,p为1。
[0055]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0056]
所述的(l)
p
为其中氨基端和式i、ii或iii中的羰基端相连,羰基端和式i、 ii或iii中的氨基端相连。
[0057]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0058]
所述的l1结构如式i所示时,所述的l1为
[0059][0060][0061]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0062]
所述的l1结构如式ii所示时,所述的l1为
[0063][0064]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0065]
所述的l1结构如式iii所示时,所述的l1为为
[0066]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0067]
所述的l2为c
2-c
12
直链烷基或含有1-12个乙二醇单元的(聚)乙二醇链或其两种的组合。
[0068]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0069]
所述的l2为c
2-c
12
直链烷基;
[0070]
所述的c
2-c
12
直链烷基可为c
3-c7直链烷基,例如正丙基、正丁基、正戊基、正己基或正庚基,又例如正戊基。
[0071]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0072]
所述的l2为c
2-c
12
直链烷基与含有1-12个乙二醇单元的(聚)乙二醇链的组合;
[0073]
例如-c
2-c
12
直链烷基-o-(ch2ch2o)q-c
2-c
12
直链烷基-,所述的c
2-c
12
直链烷基优选为c
2-c4直链烷基,例如乙基、正丙基、正丁基,又例如乙基,所述的-(ch2ch2o)q
‑ꢀ
中q为1-7,例如1或7,又例如7;
[0074]
所述的c
2-c
12
直链烷基与含有1-12个乙二醇单元的(聚)乙二醇链的组合又例如再例如
[0075]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0076]
所述的l1结构如式i所示时,所述的l2为正戊基或
[0077]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0078]
所述的l1结构如式ii所示时,所述的l2为正戊基或
[0079]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0080]
所述的l1结构如式iii所示时,所述的l2为正戊基、为正戊基、例如
[0081]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0082]
所述的l4为
[0083]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0084]
所述的细胞毒性药物为dxd;l1的结构如式i、ii或iii所示,所述的(l)
p
为所述的l2为正戊基或所述的l4为
[0085]
当所述的l1为式i时,所述的r1和r2各自独立地为c
1-c6烷基;所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r3为r
3-1r3-2
n-取代的c1~c6烷基或r
3-3
s(o)
2-取代的c1~c6烷基,所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为乙基;所述的r
3-1
、r
3-2
和r
3-3
各自独立地优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r3最优选为所述的r4为氢或c1~c6烷基,所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r4优选为氢或甲基;
[0086]
当所述的l1为式ii时,所述的r1为c
1-c6烷基;所述的r2和r4各自独立地为c1‑ꢀ
c6烷基或氢;所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的n为1;
[0087]
当所述的l1为式iii时,所述的r1为c
1-c6烷基,所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所
述的r2为氢;所述的m为1或2。
[0088]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0089]
所述的细胞毒性药物为dm-x,其中,y为1,x为羟基或者巯基;l1的结构如式i、 ii或iii所示,所述的(l)
p
为所述的l4为
[0090]
当所述的l1为式i时,所述的r1为c
1-c6烷基;所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r2为氢;所述的r3为r
3-3
s(o)
2-取代的c1~c6烷基,所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为乙基;所述的r
3-3
优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r3最优选为所述的 r4为氢;所述的l2为正戊基;
[0091]
当所述的l1为式ii时,所述的r1和r2各自独立地为c
1-c6烷基;所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r4为氢;所述的n为1;所述的l2为
[0092]
当所述的l1为式iii时,所述的r1为c
1-c6烷基,所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r2为氢;所述的m为1;所述的l2为为
[0093]
在本发明一优选的连接基-药物偶联物的实施方案中,
[0094]
所述的细胞毒性药物为tubulysin a;
[0095]
l1的结构如式i、ii或iii所示,所述的r1为c
1-c6烷基,所述的c1~c6烷基优选为 c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r2为氢或c1~c6烷基,所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r2优选为氢或甲基;所述的r3为r
3-3
s(o)
2-取代的c1~c6烷基,所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为乙基;所述的r
3-3
优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r3最优选为所述的r4为氢或c1~c6烷基,所述的c1~c6烷基优选为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,最优选为甲基;所述的r4优选为氢或甲基;所述的m为1或2;所述的n为1;所述的(l)
p
为
[0096]
所述的l2为正戊基或所述的l4为
[0097]
在本发明一优选的连接基-药物偶联物的实施方案中,所述的连接基-药物偶联物优选为如下所示的任一化合物:
[0098]
[0099]
[0100][0101]
本发明还提供了一种由以上任一实施方案所述的连接基-药物偶联物与抗体偶联得到的抗体偶联药物,其结构通式为:ab-(l
3-l
2-l
1-d)
x
,
[0102]
其中,
[0103]
ab为抗体;
[0104]
x为2~8;
[0105]
l3为例如其中b端和抗体相连,d端与 l2相连;
[0106]
d、l1和l2定义如前任一实施方案所述。
[0107]
在本发明一优选实施方案中,上述的抗体偶联药物里,某些基团具有如下定义,未提及的基团的定义如上任一方案所述(本段内容以下简称为“在本发明一优选的抗体偶联药物的实施方案中”):
[0108]
所述的抗体可为抗肿瘤的adc领域常规的igg1类型抗体,例如herceptin(赫赛汀(注射用曲妥珠单抗))。
[0109]
在本发明一优选的抗体偶联药物的实施方案中,
[0110]
所述的l3的b端和所述的抗体上巯基以硫醚键的形式相连;
[0111]
例如与所述的抗体中的半胱氨酸残基的连接形式为
[0112]
在本发明一优选的抗体偶联药物的实施方案中,
[0113]
所述的m优选为4~8,进一步优选为7~8(例如7.8、7.9、8.0)。
[0114]
在本发明一优选的抗体偶联药物的实施方案中,所述的m优选为4~8,进一步优选为 7或8。
[0115]
在本发明一优选的抗体偶联药物的实施方案中,所述的d优选为dxd。
[0116]
在本发明一优选的抗体偶联药物的实施方案中,所述的l2优选为正戊基。
[0117]
在本发明一优选的抗体偶联药物的实施方案中,所述的抗体偶联药物优选为如下所示的任一化合物:
[0118][0119]
其中,ab为igg1类型抗体,x为2-8,优选为4-8,进一步优选为7-8,例如7.0、7.8、 7.9或8.0。
[0120]
在本发明一优选的抗体偶联药物的实施方案中,所述的抗体偶联药物优选为如下所示的任一化合物:
[0121][0122]
其中,ab为herceptin;x优选为7~8,例如7.8、7.9或8.0。
[0123]
在本发明一优选的抗体偶联药物的实施方案中,所述的抗体偶联药物优选为如下所示的任一化合物:
[0124][0125]
其中,ab为herceptin。
[0126]
本发明还提供了一种上述抗体偶联药物的制备方法,其包括将上述所述的连接基-药物偶联物和上述所述的抗体偶联的步骤。
[0127]
本发明中,所述的偶联的条件和操作可为本领域该偶联常规的条件和操作。
[0128]
本发明还提供了一种由以上任一实施方案所述的连接基-药物偶联物与小分子配体偶联得到的小分子配体偶联药物,其结构通式为:sm-l
3-l
2-l
1-d,
[0129]
其中,
[0130]
sm为小分子配体;
[0131]
d、l1和l2定义如前任一实施方案所述;
[0132]
l3为例如其d端和l2相连,b端通过醚键或硫醚键和小分子配体相连。
[0133]
在本发明一优选实施方案中,上述的小分子配体偶联药物里,某些基团具有如下定义,未提及的基团的定义如上任一方案所述(本段内容以下简称为“在本发明一优选的小分子配体偶联药物的实施方案中”):所述的小分子配体为含有巯基的叶酸衍生物,含有巯基的小分子多肽,含有巯基的多糖衍生物。
[0134]
在本发明一优选的小分子配体偶联药物的实施方案中,所述的d为dxd。
[0135]
在本发明一优选的小分子配体偶联药物的实施方案中,所述的l1为其中的r1、r2、r3、r4和(l)
p
如前任一实施方案所述。
[0136]
在本发明一优选的小分子配体偶联药物的实施方案中,所述的l2为正戊基。
[0137]
在本发明一优选的小分子配体偶联药物的实施方案中,所述的小分子配体为含有巯基的叶酸衍生物,优选为具有如下结构的化合物:
[0138][0139]
在本发明一优选的小分子配体偶联药物的实施方案中,所述的小分子配体偶联药物具有如下结构:
[0140][0141]
在本发明一优选的小分子配体偶联药物的实施方案中,所述的小分子配体偶联药物具有如下结构:
[0142][0143]
本发明还提供了一种上述小分子配体偶联药物的制备方法,其包括将上述所述的连接基-药物偶联物和上述所述的小分子配体偶联的步骤。
[0144]
本发明中,所述的偶联的条件和操作可为本领域该偶联常规的条件和操作。
[0145]
本发明还提供了一种药物组合物,其包括上述的抗体药物偶联物或小分子配体偶联药物和药用辅料、或、上述的抗体药物偶联物或小分子配体偶联药物药学上可接受的盐和药用辅料。
[0146]
所述的药物组合物中,所述的上述的抗体药物偶联物或上述小分子配体偶联药物的用量可为治疗有效量。
[0147]
本发明还提供了一种上述的抗体偶联药物、或上述的小分子配体偶联药物或上述的药物组合物在制备用于预防或治疗癌症的药物中的用途。所述的癌症为优选为胃癌,乳腺癌,非小细胞肺癌,尿路上皮癌、结肠癌或胰腺癌。
[0148]
本发明还提供了一种预防和/或治疗癌症的方法,其包括将受试者施用治疗有效量的上述的抗体偶联药物、或上述的小分子配体偶联药物或上述的药物组合物。所述的癌症优选为胃癌,乳腺癌,非小细胞肺癌,尿路上皮癌、结肠癌或胰腺癌。
[0149]
除非另有说明,在本发明说明书和权利要求书中出现的以下术语具有下述含义:
[0150]
如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换言之,所述术语也包括“基本上由
…
构成”、或“由
…
构成”。术语“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。
[0151]
在本说明书中,可由本领域技术人员选择基团及其取代基以提供稳定的结构部分和化合物。当通过从左向右书写的常规化学式描述取代基时,该取代基也同样包括从右向左书写结构式时所得到的在化学上等同的取代基。
~c4烷基”。
[0166]
在本说明书的各部分,本发明公开化合物的取代基按照基团种类或范围公开。特别指出,本发明包括这些基团种类和范围的各个成员的每一个独立的次级组合。术语“c
x-cy烷基"是指含有x至y个碳原子的直链或支链饱和烃。例如,术语“c1~c6烷基”或“c
1-6
烷基”特别指独立公开的甲基、乙基、c3烷基、c4烷基、c5烷基和c6烷基;“c
1-4
烷基”特指独立公开的甲基、乙基、c3烷基(即丙基,包括正丙基和异丙基)、c4烷基(即丁基,包括正丁基、异丁基、仲丁基和叔丁基)。
[0167]
本发明中,术语“c1~c6烷基”单独或组合地表示含有1至6个、特别是1至4个碳原子的饱和的直链或支链烷基基团,例如甲基、乙基、丙基、丁基、戊基、己基;在某一方案中,优选地“c1~c6烷基”为“c1~c4烷基”,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基;又例如表示甲基或乙基。
[0168]
在本发明的各部分,描述了连接取代基。当该结构清楚地需要连接基团时,针对该基团所列举的马库什变量应理解为连接基团。例如,如果该结构需要连接基团并且针对该变量的马库什基团定义列举了“烷基”,则应该理解,该“烷基”代表连接的亚烷基基团。
[0169]
在一些具体的结构中,当烷基基团清楚地表示为连接基团时,则该烷基基团代表连接的亚烷基基团,例如,基团“卤代-c1~c6烷基”中的c
1-c6烷基应当理解为c1~c6亚烷基。
[0170]
在本技术中,作为基团或是其它基团的一部分,除非另有规定,术语“环烷基”意指仅由碳原子和氢原子组成的饱和的单环、多环或者桥接碳环取代基,且其可经由任何适宜的碳原子通过单键与分子的其余部分连接;当为多环时,可为并环连接或螺环连接(即,碳原子上的两个偕氢被亚烷基取代)的桥环体系或螺环体系。环烷基取代基可以经任何适宜的碳原子连接在中心分子上。在一些实施例中,具有3-10个碳原子的环可以表示为 c
3-c
10
环烷基。在一些实施例中,c3~c6的环烷基包括环丙基(c3)、环丁基(c4)、环戊基(c5)及环己基(c6)。在一些实施例中,c3~c
10
的环烷基的实例包括上述c3~c6环烷基基团连同环庚基(c7)、环辛基(c8)、环壬基(c9)及环癸基(c
10
)。
[0171]
在本技术中,作为基团或是其它基团的一部分,术语“芳基”是指具有6-14个环原子以及提供在芳香族环系统中的零个杂原子单环的或多环的(例如,二环的或三环的)4n 2 芳香族环系统(例如,在循环阵列中具有6,10,或14个共享的p电子)的基团(“c6‑ꢀc14
芳基”)。上述芳基单元的实例包括苯基、萘基、菲基、或者蒽基。
[0172]
在本技术中,作为基团或是其它基团的一部分,术语“杂芳基”是指具有碳原子以及提供在该芳香族环系统中的1-3个杂原子(其中每个杂原子独立地选自氮、氧以及硫)的4
‑ꢀ
16元单环的或二环的4n 2芳香族环系统(例如,在循环阵列中具有6或10个共享的p 电子)的基团(“4-16元杂芳基”)。在包含一个或多个氮原子的杂芳基基团中,连接点可以是碳或氮原子,只要化合价允许。
[0173]
在一些实施例中,所述的杂芳基为杂原子选自n、o和s中的一种或多种,杂原子数为1~3个的4-6元杂芳基,较佳地为5-6元杂芳基。
[0174]
示例性5-元杂芳基基团包括但不限于:吡咯基、呋喃基、噻吩基、咪唑基、吡唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、三氮唑基、噁二唑基、噻二唑基、呋咱基、噁三唑基或四唑基。示例性6-元杂芳基基团包括但不限于:吡啶基、吡嗪基、哒嗪基、嘧啶基、三嗪基或四嗪基。
[0175]
本领域技术人员可以理解,根据本领域中使用的惯例,本技术描述基团的结构式中所使用的是指,相应的基团通过该位点与化合物中的其它片段、基团进行连接。
[0176]
本发明中,x表示细胞毒性药物分子与ab的摩尔比(又称dar,即药物抗体偶联比率),优选地理解为是:单克隆抗体分子与细胞毒性药物偶联后得到的抗体偶联药物中的药物分子与单克隆抗体分子的摩尔比的平均值,一般可以采用疏水层析(hydrophobic
‑ꢀ
interaction chromatography,hic),聚丙烯酰胺-sds凝胶电泳(sds-page,electrophoresis),液相质谱(liquid chromatograph-mass spectrometer,lc-ms)等方式测定得到。比如,l
‑ꢀ
d是和抗体上的缀合点具反应性的基团,l是连接子,d是在连接l的抗体上进一步缀合的细胞毒剂,x表示的是每个抗体最终缀合d的数目,或者是单个抗体缀合d的数量。x可为整数或小数,在一些实施方式中,x实际上为介于2至8、4至8或6至8的平均值,或x为2、 3、4、5、6、7或8中的某个整数;在一些实施方式中,x为2、4、6、或8的平均值;在其它实施方式中,x为2、3、4、5、6、7或8的平均值。
[0177]
本发明的抗体在此取其最广义的解释,其可透过位于该免疫球蛋白分子的可变区的至少一个抗原辨认区特异性地与目标结合,诸如碳水化合物、多核苷酸、脂肪、多肽等。具体包括完整的单克隆抗体,多克隆抗体,双特异抗体以及抗体片段,只要他们具有所需的生物活性。本发明的抗体可利用该领域广为周知的技术制备,例如杂交瘤方法、重组dna技术、噬菌体展示技术、合成技术或该等技术的组合、或该领域己知的其它技术。
[0178]
本发明的抗体的变体是指氨基酸序列突变体,以及天然多肽的共价衍生物,条件是保留了与天然多肽相当的生物活性。氨基酸序列突变体与天然氨基酸序列的差异一般在于天然氨基酸序列中的一个活多个氨基酸被取代或在多肽序列中缺失和/或插入一个或多个氨基酸。缺失突变体包括天然多肽的片段和n端和/或c端截短突变体。通常氨基酸序列突变体与天然序列相比至少具有70%(例如70%、75%、80%、85%、90%、95%、 98%或99%)的同源性。
[0179]
单克隆抗体或单抗指的是该抗体来自一群基本均一抗体,即构成该集群的各抗体完全相同,除了可能存在的少量天然突变或在抗体表达制备过程中产生的异构体。单克隆抗体具有针对单一抗原的高度特异性。而多克隆抗体则包含了针对不同决定簇的不同抗体,每个单克隆抗体只针对抗原的一个决定簇。本发明中,单克隆抗体还特别包含嵌合抗体及其片段,即抗体的重链和/或轻链的一部分来自于某种、某类或某亚类,其余部分则与另一种、类或亚类。
[0180]
连接子是指抗体与药物间的直接或间接连接。将连接子连接至mab可经由许多方式完成,诸如经由表面赖氨酸、还原偶合至经氧化的碳水化合物、及经由还原链间二硫键所释放的半胱氨酸残基。多种adc连接系统是该领域所知,包括以腙、双硫及肽为基底的连接。
[0181]
所述的药用辅料可为药物生产领域中广泛采用的辅料。辅料主要用于提供一个安全、稳定和功能性的药物组合物,还可以提供方法,使受试者接受给药后活性成分以所期望速率溶出,或促进受试者接受组合物给药后活性成分得到有效吸收。所述的药用辅料可以是惰性填充剂,或者提供某种功能,例如稳定该组合物的整体ph值或防止组合物活性成分的降解。所述的药用辅料可包括下列辅料中的一种或多种:缓冲剂、螯合剂、防腐剂、助溶剂、稳定剂、赋形剂和表面活性剂着色剂、矫味剂和甜味剂。
[0182]
术语“药学上可接受的盐”是指本发明化合物与相对无毒的、药学上可接受的酸或碱制备得到的盐。当本发明的化合物中含有相对酸性的功能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的药学上可接受的碱与这类化合物的中性形式接触的方式获得碱加成盐。药学上可接受的碱加成盐包括但不限于:锂盐、钠盐、钾盐、钙盐、铝盐、镁盐、锌盐、铋盐、铵盐、二乙醇胺盐。当本发明的化合物中含有相对碱性的官能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的药学上可接受的酸与这类化合物的中性形式接触的方式获得酸加成盐。所述的药学上可接受的酸包括无机酸,所述无机酸包括但不限于:盐酸、氢溴酸、氢碘酸、硝酸、碳酸、磷酸、亚磷酸、硫酸等。所述的药学上可接受的酸包括有机酸,所述有机酸包括但不限于:乙酸、丙酸、草酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、反丁烯二酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、水杨酸、酒石酸、甲磺酸、异烟酸、酸式柠檬酸、油酸、单宁酸、泛酸、酒石酸氢、抗坏血酸、龙胆酸、富马酸、葡糖酸、糖酸、甲酸、乙磺酸、双羟萘酸(即4,4
’‑
亚甲基-双(3-羟基-2-萘甲酸))、氨基酸(例如谷氨酸、精氨酸)等。当本发明的化合物中含有相对酸性和相对碱性的官能团时,可以被转换成碱加成盐或酸加成盐。具体可参见berge et al.,"pharmaceutical salts",journal of pharmaceutical science 66:1
‑ꢀ
19(1977)、或、handbook of pharmaceutical salts:properties,selection,and use(p.heinrichstahl and camille g.wermuth,ed.,wiley-vch,2002)。
[0183]
术语“治疗”或它的同等表达当用于例如癌症时,指用来减少或消除患者体内癌细胞数目或减轻癌症的症状的程序或过程。癌症或另外的增生性障碍的“治疗”不一定指癌症细胞或其它障碍会实际上被消除,细胞或障碍的数目会实际上被减少或者癌症或其它障碍的症状会实际上被减轻。通常,即使只具有低的成功可能性也会进行治疗癌症的方法,但是考虑到患者的病史和估计的生存预期,其仍然被认为诱导总体有益的作用过程。
[0184]
术语“预防”是指获得或发生疾病或障碍的风险降低。
[0185]
另外,需要说明的是,除非以其他方式明确指出,在本发明中所采用的描述方式
“…
独立地为”应做广义理解,是指所描述的各个个体之间是相互独立的,可以独立地为相同或不同的具体基团。更详细地,描述方式
“…
独立地为”既可以是指在不同基团中,相同符号之间所表达的具体选项之间互相不影响;也可以表示在相同的基团中,相同符号之间所表达的具体选项之间互相不影响。
[0186]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0187]
如无特殊说明,本发明中的室温是指20-30℃。本发明所用试剂和原料均市售可得。
[0188]
本发明的积极进步效果在于:
[0189]
1.本发明的连接基-药物偶联可以和不同的抗体偶联制备出具有很好靶向性的抗体偶联药物,或者和不同的小分子配体偶联制备出对小分子配体的受体具有很好亲和性的小分子配体偶联药物。
[0190]
2.本发明的抗体偶联药物和小分子配体偶联药物具有很好的体外细胞活性和体内抗肿瘤活性。
[0191]
3.本发明的抗体偶联药物具有很好血浆稳定性和安全性。
具体实施方式
[0192]
表1.缩写词说明
[0193][0194]
。
[0195]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0196]
实施例1:通式i所示化合物通用合成路线
[0197][0198]
步骤1
[0199]
i-1和i-2为市售原料,二者投料比为1:1-1:2,在dmf作溶剂的条件下,以eedq 为缩合剂(2当量),反应6-8小时,通过柱层析获得纯品i-3。
[0200]
步骤2
[0201]
i-3与npc(2当量)在三乙胺(2当量)存在的条件下于dmf中反应5-6小时,通过柱层析获得纯品i-4。
[0202]
步骤3
[0203]
i-4与不同的伯胺片段(1-2当量,市售可得)于dmf中反应1-2小时,通过柱层析纯化得纯品i-5。
[0204]
步骤4
[0205]
i-5与不同的醛(3-5当量,市售可得)以及三甲基氯硅烷(3-5当量)在无水二氯甲烷中反应10-12小时可得到活性中间体i-6,进一步在碱(通常为潘必啶)存在的情况下与不同的药物分子的巯基或羟基反应可拼接反应1-3小时得到中间体i-7,经柱层析纯化得纯品。
[0206]
步骤5
[0207]
i-7与三甲基膦试剂在四氢呋喃/醋酸缓冲液(ph 5.0)混合体系中反应1-3小时,后经柱层析纯化可得含有伯氨基的中间体i-8。
[0208]
步骤6
[0209]
i-8与不同的含有羧基的马来酰胺片段(市售或定制)获得不同的linker-drug(i-ld 系列)终产物可通过制备色谱进行精制。
[0210]
按照以上步骤1-步骤6所述的通用方法,采用如表2所列的起始原料,制备得到以下结构所示的化合物:
[0211]
[0212]
[0213][0214]
表2.i-ld01至i-ld10的ms数据及制备时所用的原料
[0215][0216]
本发明中各马来酰胺片段结构如下:
[0217]
片段1:片段2:
[0218]
片段3:
[0219]
实施例2:通式ii所示化合物通用合成路线
[0220][0221]
步骤1
[0222]
ii-1为市售原料或定制获得,ii-1与i-2二者投料比为1:2-1:4,在dmf作溶剂的条件下,以eedq为缩合剂(4当量),反应6-8小时,通过柱层析获得纯品ii-2。
[0223]
步骤2
[0224]
参考实施例1中步骤4可获得中间体ii-3,进一步与含巯基或羟基的药物分子拼接得到ii-4。
[0225]
步骤3
[0226]
参考实施例1中的步骤5可获得中间体ii-5。
[0227]
步骤4
[0228]
参考实施例1中的步骤6可获得不同的连接基-药物(ii-ld系列)。终产物可通过制备色谱进行精制。
[0229]
按照以上步骤1-步骤4所述的通用方法,采用如表3所列的起始原料,制备得到以下结构所示的化合物:
[0230]
[0231]
[0232][0233]
表3.ii-ld01至ii-ld08的ms数据及制备时所用的原料
[0234]
[0235][0236]
实施例3:通式iii所示化合物通用合成路线
[0237][0238]
步骤1
[0239]
i-4与不同的氨基醇(市售)反应得到中间体iii-2,柱层析纯化。
[0240]
步骤2
[0241]
iii-2经过pcc氧化得到iii-3,柱层析纯化。
[0242]
步骤3
[0243]
参考实施例1中的步骤4获得活性氯中间体iii-4,进一步与含有羟基或巯基的药物分子拼接得到中间体iii-5,柱层析纯化。
[0244]
步骤4
[0245]
参考实施例1中的步骤5,iii-5经三甲基膦还原后柱层析纯化得到中间体iii-6。
[0246]
步骤5
[0247]
iii-6与不同的羧酸片段缩合后柱层析纯化获得终产物(iii-ld系列)。
[0248]
按照以上步骤1-步骤5所述的通用方法,采用如表4所列的起始原料,制备得到以下结构所示的化合物:
[0249]
[0250]
。
[0251]
表4.iii-ld01至ii-ld07的ms数据及制备时所用的原料
[0252][0253]
实施例4:ph稳定性实验
[0254]
配制不同ph的缓冲液(ph 1.0 ph 5.0 ph 7.4),将按实施例1-3方法制备得到的连接基-药物偶联物用dmso溶解用缓冲液稀释100倍,最终底物浓度为100um。25℃下恒温放置24小时,hplc检测,以相应的药物分子作为外标,计算药物分子在缓冲液中的释放比例(相对于等量外标),所得结果(如表5)表明本发明的连接基-药物偶联物在ph5.0和7.4条件下具有很好的稳定性。
[0255]
表5.连接子-药物偶联物的ph稳定性实验
[0256][0257]
。
[0258]
实施例5小鼠血浆稳定性实验
[0259]
将所选定的化合物用dmso溶解后,以小鼠血浆稀释100倍,最终底物浓度为100 um,37℃下恒温放置24小时,然后各取200ul样品,并以400ul甲醇处理,离心沉淀后hplc检测药物释放量,以相应的药物作为外标计算,所得结果(如表6)表明本发明的连接基-药物
偶联物在小鼠血浆中具有很好的稳定性。
[0260]
表6.小鼠血浆稳定性实验结果
[0261][0262]
。
[0263]
实施例6人血浆稳定性实验
[0264]
将所选定的化合物用dmso溶解后,以人血浆稀释100倍,最终底物浓度为100um, 37℃下恒温放置24小时,然后各取200ul样品,并以400ul甲醇处理,离心沉淀后 hplc检测药物释放量,以相应的药物作为外标计算,所得结果(见表7)表明本发明的连接基-药物偶
联物在人血浆中具有很好的稳定性。
[0265]
表7.人血浆稳定性实验结果
[0266][0267]
。
[0268]
实施例7酶切释放实验
[0269]
将所选化合物用dmso溶解后,以配好的含有组织蛋白酶b的溶液(酶浓度:0.1 mg/ml,25mm醋酸缓冲液,ph 5.0)稀释100倍,最终底物浓度为100um,37℃下恒温放置5小时,然
后各取200ul样品,并以400ul冰乙腈处理,离心沉淀后hplc检测药物释放量,以相应的药物作为外标计算,所得结果(见表8)表明本发明的连接基
‑ꢀ
药物偶联物在组织蛋白酶b作用下,能被有效地酶切释放出细胞毒性药物分子。
[0270]
表8.酶切释放实验结果
[0271][0272]
。
[0273]
实施例8抗体偶联药物制备
[0274]
将市售的抗体herceptin配成20mg/ml溶液(ph 7.4磷酸缓冲液),加入8当量tcep, 25℃反应1小时,充分打开抗体链间二硫键,然后通过凝胶柱g25换液到弱酸性缓冲液中(ph 5.0柠檬酸缓冲液)。将相对于抗体摩尔量12当量的上述连接基-药物偶联物溶于适量dmso后加入到换液后的抗体溶液中,反应30分钟,得到adc原液,经过g25 凝胶柱去除未偶联小分子得到adc样品。通过lc-ms法测定dar值,sec法测定单体纯度,所得结果见表9。
[0275]
表9.抗体偶联药物的dar值和纯度测试结果
[0276]
adc编号连接基-药物偶联物darsec纯度adc01i-ld017.999.1%adc02ii-ld017.899.5%adc03iii-ld018.099.4%
[0277]
实施例9小分子配体偶联药物制备
[0278]
将市售的叶酸衍生物(结构如下所示)与选定的连接基-药物(i-ld01)以等当量混合于ph 6.0的柠檬酸缓冲液中,反应1小时,混合液通过反相制备色谱纯化,收集主要组分冻干得到固体粉末,代号smdc01,经质谱表征,分子量为1699.81(m h)。
[0279][0280]
实施例10adc01,adc02,adc03细胞毒活性评价
[0281]
选择高表达her2受体的nci-n87细胞作为本次实验体外活性检测用细胞株,观察不同的抗体偶联药物对细胞杀伤的量效情况。选择每种细胞的种板密度:2
×
103cells/孔, 16~24小时后进行细胞毒活性测定;其次测试制备得到的抗体偶联药物加样后终浓度设定5000nm为起始浓度,5000~0.006nm设计系列10个浓度(4-10倍比稀释),观察144 小时的杀伤(或抑制)变化,luminescent cell viability assay化学发光染色,读取荧光数据后计算ic
50
,所得结果(如表10所示)表明本发明提供的adc在体外对细胞具有很好的杀伤活性。
[0282]
表10.adc的细胞毒活性评价
[0283]
样品编号ic
50
(nm)
adc010.451adc020.501adc030.489dxd(参比)4.6
[0284]
实施例11 smdc01细胞毒活性评价
[0285]
选择高表达叶酸受体的kb细胞作为本次实验体外活性检测用细胞株,观察不同的小分子配体偶联药物对细胞杀伤的量效情况。选择每种细胞的种板密度:3
×
103cells/孔, 16~24小时后进行细胞毒活性测定;其次测试制备得到的抗体偶联药物加样后终浓度设定5000nm为起始浓度,5000~0.006nm设计系列10个浓度(4-10倍比稀释),观察96小时的杀伤(或抑制)变化,luminescent cell viability assay化学发光染色,读取荧光数据后计算ic
50
,所得结果(如表11所示)表明。
[0286]
表11.smda01的细胞毒活性评价
[0287]
样品编号ic
50
(nm)smdc014.5dxd8.8
[0288]
实施例12 adc01体内药效评价
[0289]
6-8周大的雌性balb/c nude小鼠颈背部皮下注射溶于100ul pbs溶液的5
×
106人源胰腺癌细胞(capan-1)。待肿瘤平均体积约160mm3时,根据肿瘤大小随机分组,将所述裸鼠36只随机分成6组,每组6只动物,分组尾静脉注射给药:01为空白对照组,02 为adc-01(5mg/kg),给药1次。每周两次测量实验动物体重和肿瘤体积并观察实验过程中动物生存状态。实验结果(如表12所示)显示adc01具有较好的体内抗肿瘤活性,同时所有实验小鼠无死亡情况,无体重减轻情况,表明adc01具有很好的安全性。
[0290]
表12.adc01体内药效评价结果
[0291]
。
[0292]
虽然以上描述了本发明的具体实施方式,但是本领域的技术人员应当理解,这些仅是举例说明,在不背离本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改。因此,本发明的保护范围由所附权利要求书限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。