且卵磷脂/kolliphor hs15重量百分比为1-3:1-3(%,w/w)。
9.作为本发明的进一步优化方案,所述卵磷脂/kolliphor hs15重量百分比为1:1(%, w/w)。
10.作为本发明的进一步优化方案,所述载藤黄酸卵磷脂/kolliphor hs15混合胶束的 包封率为98.32%,粒径为87.22
±
0.68nm,载药量为4.68%,形貌为均匀的纳米球形, 且水中溶解度是游离藤黄酸的200倍,相对生物利用度是游离藤黄酸的2.42倍。
11.作为本发明的进一步优化方案,所述纳米二元混合胶束采用薄膜水合法或有机溶 剂蒸发法制备。
12.本发明还提供了如上述任一所述的新型载藤黄酸纳米二元混合胶束在制备抗肿瘤 药物中的应用。
13.作为本发明的进一步优化方案,所述药物为口服制剂。
14.本发明还提供了一种抗肿瘤的药物,所述药物为含载藤黄酸纳米二元混合胶束的 口服制剂。
15.作为本发明的进一步优化方案,所述载藤黄酸纳米二元混合胶束为载藤黄酸卵磷 脂/hs15混合胶束,所述卵磷脂/kolliphor hs15重量百分比为1:1(%,w/w)。
16.本技术研究了由kolliphorhs15(增溶剂)和卵磷脂组成的纳米二元混合胶束,以 增加ga的口服吸收。卵磷脂作为一种常见的两亲性天然赋形剂,具有增溶能力和安全 性。hs15是一种安全的聚合物,具有较大百分比的聚乙二醇嵌段,不仅增加了载药量和 结构稳定性,还抑制了p-gp介导的药物外流(vyu等人,1996年;husseini等人,2009 年;chen等人,2013年)。因此,本技术利用kolliphor hs15和卵磷脂开发了一种新 型混合聚合物胶束系统,以增加水溶性,促进肠道吸收,提高ga的生物利用度。并针 对优化后的ga-m的物理化学特性,如粒径、zeta电位、形态,考察了其稳定性和体外 释放行为,此外,还评估了caco-2细胞的转运和ga-m的药代动力学特征以及通过胃肠 道病理学试验研究了ga-m的安全性。
17.综上所述,本发明的有益效果为:
18.本发明利用卵磷脂/kolliphor hs15混合胶束作为ga的潜在载体制得的载藤黄酸 卵磷脂/hs15混合胶束,其具有良好的物理稳定性、外排抑制和缓释性能,并且可增加 藤黄酸的水溶性,减缓药物释放,促进肠道吸收,提高藤黄酸的生物利用度,扩大了藤 黄酸在临床抗肿瘤的应用前景。
附图说明
19.图1为ga-m(卵磷脂/hs15=1:1)的粒径、电位和形貌;
20.图2为4℃条件下ga-m(卵磷脂/hs15=1:1)的粒径、电位分析以及在模拟胃液(sgf) 和模拟肠液(sif)中ga-m(卵磷脂/hs15=1:1)的粒径分析;
21.图3为ga-m(卵磷脂/hs15=1:1)在模拟胃液(ph 1.2)和模拟肠液(ph 6.8)中 的ga释放行为;
22.图4为ga-m(卵磷脂/hs15=1:1)和ga-m(壳聚糖/hs15=1:1)的p
app(a-b)
和p
app(b-a)
分析;
23.图5为ga-m(卵磷脂/hs15=1:1)和ga-m(壳聚糖/hs15=1:1)的药动学行为分析。
具体实施方式
24.下面结合附图对本技术作进一步详细描述,有必要在此指出的是,以下具体实施 方式只用于对本技术进行进一步的说明,不能理解为对本技术保护范围的限制,该领域 的技术人员可以根据上述申请内容对本技术做出一些非本质的改进和调整。
25.一、材料
26.1、细胞与试剂
27.caco-2细胞系来自美国类型培养收集(美国弗吉尼亚州马纳萨斯);
28.kolliphor hs15(批号#j70618409t0)由巴斯夫有限公司(中国上海)友好供应, 卵磷脂(批号#al16001)由先进技术有限公司(中国上海)提供;ga(纯度》99%,批号 #jz16032805)购自景竹科技有限公司(中国南京);其他所有相关培养基及试剂无特 别说明均为市购,试剂均为分析级。
29.2、动物
30.雄性sd大鼠(220
±
20g)由上海实验动物中心提供。在进行相关实验之前,所有 大鼠均在温度为25
±
0.5℃,湿度为45
±
5%,光/暗周期为12小时的设定环境中喂养7 天。
31.二、方法
32.1、验证胶束配方对ga-m的平均粒径、zeta电位、dl%和ee%各项物理参数的影响
33.(1)ga-m的制备:采用薄膜水合法制备载藤黄酸卵磷脂/hs15混合胶束,具体如 下,准备5个500ml茄形瓶,先称取1mg藤黄酸分别加入5个500ml茄形瓶中,再依 次按照卵磷脂:hs15的重量比为3:1、2:1、1:1、1:2以及1:3加入总重为20mg的卵 磷脂/hs15,再分别加入100ml无水乙醇,超声5min,溶解完全后,转移至旋转蒸发仪 中,45℃条件下,0.1mpa减压回收乙醇,在茄形瓶内壁获得一层均匀的透明薄膜,随后, 向瓶中加入10ml蒸馏水,超声水合30min,以获得透明的蓝色乳光系统,最后,用0.45 μm微孔膜过滤去除未包载的药物,即得到5组藤黄酸卵磷脂/hs15混合胶束。
34.同法制备5组藤黄酸壳聚糖/hs15混合胶束。
35.(2)高效液相色谱分析:使用配备hypersil odsc
18
柱(250mm
×
4.6mm,5μm)的 安捷伦1260hplc系统测量ga浓度。柱温为25℃,进样量20μl,流动相为甲醇-0.1% 乙酸(92:8,v/v),流速为1.0ml/min,在360nm处测定色谱峰面积。
36.(3)粒度和zeta电位分析:使用malvern zetasizer nanozs仪器(英国malverninstruments)通过动态光散射法测量各组ga-m的平均粒径和zeta电位。在测量之前, 通过微孔过滤器(孔径0.45μm)过滤样品溶液。
37.(4)形貌分析:使用tem(日本jeoljem-2100f)进行形态学观察。将少量ga-m 样品置于碳涂层铜格栅上,在室温下风干,磷钨酸负染,然后通过tem进行检查。
38.(5)包封率(ee)和载药量(dl)的测量:采用超滤离心法测定药物纳米载体的 ee。具体步骤为,首先,称取1.0ml ga-m在甲醇中适当稀释,并用超声波处理10min, 破坏胶束结构以完全释放胶囊药物,微孔滤膜过滤并测定总ga(w
tot
)的量;其次,1.0 ml ga-m用超滤管(ultra-4.0,mwco1000,密理博)以12000
×
g的速度离心2次,每 次10min,然后测量过滤液中的游离ga(w
fre
);最后,结合ga-m处方中使用的赋形剂 重量(w
exc
),根据以下方程式计算ee%和dl%:
[0039][0040]
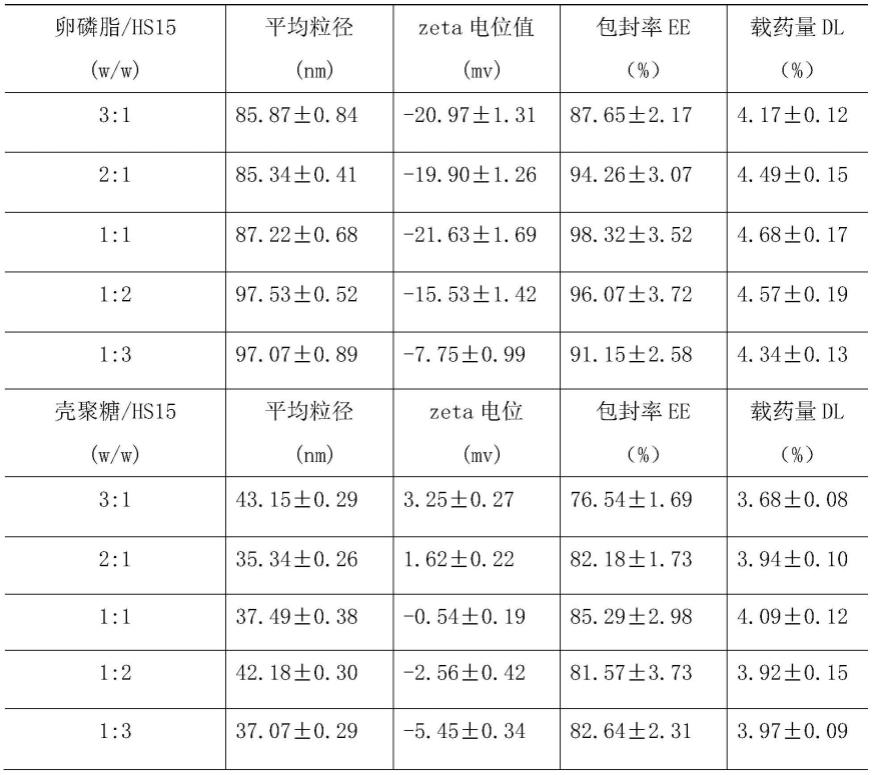
(6)结果如表1所示。
[0041]
表1.胶束配方对ga-m的平均粒径、zeta电位、dl%和ee%各项物理参数的影响
[0042][0043]
结果分析:ga-m的平均粒径、zeta电位、dl%和ee%各项物理参数受胶束配方的影 响。当卵磷脂/hs15的比例从3:1降低到1:1(%,w/w)时,薄膜水合过程更容易进行, 尽管粒径和zeta电位值没有明显变化,但ee%和dl%分别从87.65
±
2.17%、4.17
±
0.12% 显著增加到98.32
±
3.52%、4.68
±
0.17%。随着卵磷脂/hs15比值从1:1下降到1:3(%, w/w),平均粒径从87.22
±
0.68nm轻微增加到97.07
±
0.89nm,zeta电位值从-21.63
ꢀ±
1.69mv明显下降到-7.75
±
0.99mv,但ee%和dl%始终保持在同一水平,zeta电位 值的绝对值越大越稳定,综上所述,卵磷脂/hs15比例为1:1(%,w/w)的ga-m被认为 是后续研究的最佳配方;
[0044]
再者,观察图1a,优化获得的ga-m的平均直径为87.22
±
0.68nm,pdi为0.212
±ꢀ
0.01,表明粒径分布的形状范围,这可能是由于添加hs15引起的临界胶束浓度(cmc) 变化所致;zeta电位小于-20mv,说明粒子之间存在较大的静电斥力,聚集的倾向较小。 此外,通过tem确定了ga-m粒子是规则的球形结构,如图1c所示;
[0045]
最后,在该二元胶束体系中,ga-m的负载量ee%为98.32
±
3.52μg/ml,其溶解度 提高了近200倍。
[0046]
2、ga-m稳定性试验
[0047]
从储存和稀释两方面考察了优化ga-m的稳定性。
[0048]
(1)储存稳定性:将ga-m储存在4℃下,然后在第1、3、5、10、20和30天取出 样品,立即测量平均粒径和zeta电位。
[0049]
(2)稀释稳定性:分别用模拟胃液(sgf,ph1.2)及模拟肠液(sif,ph6.8)100 倍稀释ga-m后,在37℃温和搅拌条件下培养24小时,在0、2、4、6、8、12和24小 时取样和过滤,并立即测定颗粒大小和zeta电位。
[0050]
结果分析:首先,在4℃时,ga-m系统在30天的观察期内没有出现浑浊和沉淀。 由图2可知,在观察期内,颗粒大小和zeta电位的显著变化,表明卵磷脂/hs15(1:1) 混合胶束具有良好的物理稳定性。此外,zeta电位低于-20mv,表明低聚集倾向的ga-m 主要是由纳米粒子之间的斥力引起的;
[0051]
其实,在24小时内,当在37℃下用100倍体积的模拟胃液(sgf)或模拟肠液(sif) 稀释1ml ga-m时,观察到颗粒小于5.0nm的尺寸变化,表明ga-m在胃肠道中具有良 好的物理稳定性,这可能是由于hs15的聚乙二醇基团形成的水合层的空间位阻所致。
[0052]
3、体外药物释放试验
[0053]
采用透析袋法比较了ga和ga-m的体外释药行为。具体的,将1ml ga-m和等量的 游离ga悬浮液分别放置在单独的透析袋(mwco=3500da)中,并在含有0.5%(w/v)吐 温80的100mlpbs缓冲液(ph1.2,ph 7.4)中在37℃和100rpm搅拌速度下培养。按 照所需的时间间隔,取出1ml释放介质,立即补充等量的新鲜释放介质。
[0054]
在测量ga在介质中的释放量后,用多种数学模型拟合释放曲线,以分析释放行为。
[0055]
表2.ga在混合胶束中的释放动力学
[0056][0057]
结果分析,如图3所示,在ph值为1.2(sgf)和6.8(sif)的培养基中,ga-m 缓慢地将药物释放到透析袋外部,24h累积释放率约为12%,相比之下,ga悬浮液的释 放率更高,为44.86
±
2.84%,54.16
±
3.07%,具有剧烈的突释行为,48h时,ga-m在 sgf和sif中的累积释放率分别为52.31%和58.17%,而游离ga的释放率分别为87.73% 和95.18%。
[0058]
综上所述,首先,游离ga和ga-m在sif中的累积释放量均高于sgf中的累积释放 量,这与酸性药物在碱性体系中更好的溶解有关。其次,ga-m表现出显著的缓释行为, 表明ga在烃链疏水核中负载良好,并且混合胶束的亲水壳具有良好的阻隔性能。
[0059]
此外,还对混合胶束中ga的释放动力学进行了拟合,以分析48小时内的释放行为, 如表2所示,曲线拟合显示释放行为符合一级动力学(r2=0.9910),这表明混合胶束的 ga释放不仅通过介质扩散,还通过结构溶蚀进行调节。
[0060]
4、caco-2细胞培养模型中的转运试验
[0061]
通过caco-2细胞单层转运研究测定p
app(a-b)
和p
app(b-a)
,探索卵磷脂/hs15促进ga 肠道吸收的作用。试验过程如下,
量。如图5和表4所示,绘制了血浆药物浓度-时间曲线,并使用das2.0软件计算ga 的药代动力学参数。
[0073]
表4.给药后ga在血浆中的药代动力学参数(mean
±
sd,n=6)
[0074][0075][0076]
结果分析,游离ga和ga-m(卵磷脂/hs15=1:1)达到最大血浆浓度(t
max
)的时间 为2小时,但ga-m的c
max
(374.3
±
23.92μg/l)显著高于游离ga 222.07
±
13.22μg/l。 ga-m(3805.08
±
350.37μg/l)的auc(0-24小时)
·
h)比1652.93
±
199.25μg/l 高2.11倍。同时,ga-m的半衰期(t
1/2
)和mrt
(0-24h)
分别是游离ga的1.91倍和1.20 倍。此外,ga-m(卵磷脂/hs15=1:1)比ga-m(壳聚糖/hs15=1:1)具有更大的峰浓度、 半衰期和药时曲线下面积,说
明ga-m(卵磷脂/hs15=1:1)显示出比游离ga、ga-m(壳 聚糖/hs15=1:1)有更高的药物生物利用度,这可能是由于三个原因:首先,p-gp外排 抑制剂hs15在抑制药物肠道分泌中起关键作用,促进ga转移到血液中。其次,磷脂作 为细胞的重要组成,在具有更好生物相容性,体现出更强的协同作用;最后,胶束壳上 的peg嵌段避免了网状内皮系统诱导药物摄取,并在循环中提供了长时间的滞留效应。
[0077]
结论:本技术选用卵磷脂/hs15(1:1)作为纳米胶束载体制备了混合胶束体系ga-m, 用于ga的递送。ga-m的包封率为98.32%,粒径为87.22
±
0.68nm,载药量为4.68%, 为均匀的纳米球形。此外,ga-m还表现出良好的物理稳定性、外排抑制和缓释性能。最 后,药代动力学特征表明,ga-m的相对生物利用度是游离ga的2.42倍。这种开发的胶 束系统提高了溶解性,抑制了p-gp介导的ga分泌。因此,这种hs15/卵磷脂胶束体系 有望成为ga的潜在载体,减缓药物释放,提高ga的生物利用度。
[0078]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不 能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员 来说,在不脱离本发明构思的前提下,还可以做出若干改进,这些都属于本发明的保护 范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。