药物组合物、其制备方法和用途
1.本技术是申请号为201811112830.8、申请日为2018年9月25日、发明名称为“一种提高低浓度阿托品眼用制剂稳定性的方法”的中国发明专利申请的分案申请。
技术领域
2.本发明属于药物制剂领域,具体涉及一种提高低浓度阿托品眼用制剂稳定性的方法,以及制备所述眼用制剂的方法和由此制得的阿托品眼用制剂及其用途。
背景技术:
3.阿托品眼用制剂应用于临床多年,主要用于散瞳、睫状肌麻痹,以及弱视治疗中的压抑疗法。此外,阿托品作为目前唯一经循证医学证实的有效减缓近视进展的药物,其用于控制近视的进展也有很多年的历史。
4.目前国内外用于控制青少年近视进展的药物不多,且副作用大。在我国过去用阿托品治疗近视眼多为高浓度短期治疗,作用为解除调节痉挛,停药后疗效不易巩固。目前国内上市销售的阿托品眼用制剂的规格1%,由于阿托品的浓度较大,存在瞳孔散大、视物模糊等副作用,会对患者的生活学习造成一定程度的影响,无法作为临床常规长期用药控制近视的进展。
5.使用低浓度阿托品眼用制剂预防和治疗青少年近视已取得阶段性进展。如新加坡眼科研究所新加坡国家眼科中心已开展多年的低浓度阿托品治疗近视的研究,结果证明低浓度阿托品治疗组与其他高浓度阿托品治疗组相比近视患儿的剩余人数最少,且使瞳孔扩张效应减少了很多,从而大大降低了高浓度阿托品造成的瞳孔扩大,近物视物不清、畏光、结膜炎和皮炎等副作用。因此,低浓度阿托品眼用制剂更适宜青少年长期点眼以控制近视进展,且停药后反弹效应明显降低。
6.然而,阿托品作为毒蕈碱受体拮抗剂,在制成低浓度制剂时(例如0.001%~0.05%),其稳定性显著低于高浓度制剂(例如0.1%~1%),这使得获得高稳定性的低浓度阿托品制剂将面临更高的挑战。
7.通常产品的组方调整是提高制剂稳定性的最有效方法。调整组方缓冲体系,或降低制剂ph值可以显著提高阿托品眼用制剂的稳定性。本发明人发现,对于低浓度阿托品眼用制剂需要更低的ph值以达到制剂稳定的要求,但制剂的刺激性大幅度提高,这不仅影响患者使用的顺应性,同时会因刺激引发泪液的分泌从而影响阿托品的生物利用度。专利us9421199b2中采用氘化水提高低浓度阿托品滴眼液的稳定性,然而同位素的引入,对产品的安全性必然产生影响,且对产品的生产及质量控制方面的要求更高,限制了产品的开发和推广。综上,本领域仍需一种具有高稳定性的低浓度阿托品制剂。
技术实现要素:
8.硫酸阿托品原料药要求严格,各国药典中对其质量标准均进行了严格的限定,尤其是有关物质的含量,如下表中所示:
[0009][0010]
本发明人意外的发现,通过对市售符合上述标准的阿托品原料药总杂质和/或单杂含量作进一步控制,可明显提高低浓度阿托品眼用制剂货架期稳定性。
[0011]
因此,在一个方面,本技术提供一种提高硫酸阿托品制剂稳定性的方法,其特征在于,控制所述硫酸阿托品原料药总杂质含量≤0.25%(例如,≤0.2%,≤0.15%,≤0.1%,≤0.05%或者未检出)和/或单杂含量≤0.05%(例如,≤0.01%或者未检出)。
[0012]
所述硫酸阿托品原料药可通过hplc进行杂质含量分析。在一些实施方案中,所述hplc分析条件为:检测波长210nm;色谱柱采用十八烷基硅烷键合硅胶为填充剂(3μm,250mm
×
4.6mm),以[3.5g/l的磷酸二氢钾溶液(用磷酸调节ph至3.3)606ml和乙腈320ml的混合溶液](含1.7g十二烷基硫酸钠)为流动相a,乙腈为流动相b,照下表梯度洗脱:
[0013][0014]
供试品溶液浓度为1mg/ml。
[0015]
在一些优选的实施方案中,所述制剂为眼用液体制剂(例如滴眼剂)。在一些优选的实施方案中,所述制剂中硫酸阿托品的浓度为0.001~0.1%(优选0.005-0.05%)。
[0016]
在另一个方面,本技术提供一种硫酸阿托品的精制方法,其包括以下步骤:
[0017]
将硫酸阿托品原料药分别用浆洗溶剂a、浆洗溶剂b和浆洗溶剂c浆洗;其中,
[0018]
所述浆洗溶剂a为低极性溶剂;
[0019]
所述浆洗溶剂b为丙酮-水混合溶剂(水的体积占2-10%,例如5%);
[0020]
所述浆洗溶剂c为低极性溶剂。
[0021]
在一些优选的实施方案中,所述浆洗溶剂a为丙酮、乙醇-丙酮混合溶剂、乙醚、乙醇-乙醚混合溶剂、甲基叔丁基醚、异丙醚、石油醚(例如石油醚(60-90)、石油醚(90-120))或其任意组合。在一些优选的实施方案中,浆洗溶剂a的用量为每克硫酸阿托品加3-30毫升(例如5、10、15或20毫升)浆洗溶剂a。在一些优选的实施方案中,采用浆洗溶剂a浆洗的温度为0-50℃(例如室温、40℃)。在一些优选的实施方案中,采用浆洗溶剂a浆洗的时间为0.5-6h(例如3h)。
[0022]
在一些优选的实施方案中,浆洗溶剂b的用量为每克硫酸阿托品加5-20毫升(例如10或15毫升)浆洗溶剂b。在一些优选的实施方案中,采用浆洗溶剂b浆洗的温度为0-50℃(例如室温、40℃)。在一些优选的实施方案中,采用浆洗溶剂b浆洗的时间为0.5-6h(例如
4h)。
[0023]
在一些优选的实施方案中,所述浆洗溶剂c为乙醇-丙酮混合溶剂、乙醇-乙醚混合溶剂、丙酮或其任意组合。在一些优选的实施方案中,浆洗溶剂c的用量为每克硫酸阿托品加3-30毫升(例如5或10毫升)浆洗溶剂c。在一些优选的实施方案中,采用浆洗溶剂c浆洗的温度为0-室温(例如10℃)。在一些优选的实施方案中,采用浆洗溶剂c浆洗的时间为0.5-6h(例如1.5h)。
[0024]
在一些优选的实施方案中,在浆洗前还包括将所述硫酸阿托品原料药粉碎的步骤。在一些优选的实施方案中,所述方法进一步包括将粉碎后的硫酸阿托品原料药过30-100目筛的步骤。
[0025]
在一些优选的实施方案中,在浆洗后还包括过滤和/或干燥的步骤。在一些优选的实施方案中,所述过滤选自抽滤、压滤和甩滤。在一些优选的实施方案中,所述干燥为减压干燥。
[0026]
在另一个方面,本技术提供一种硫酸阿托品,其通过上述的方法制备得到;或者其总杂质含量≤0.25%(例如,≤0.2%,≤0.15%,≤0.1%,≤0.05%或者未检出)和/或单杂含量≤0.05%(例如,≤0.01%或者未检出)。
[0027]
在另一个方面,本技术提供一种药物组合物,其含有上述的硫酸阿托品,以及药学上可接受的辅料。
[0028]
在一些优选的实施方案中,所述药物组合物为眼用液体制剂,例如滴眼剂。在一些优选的实施方案中,所述药物组合物中硫酸阿托品的浓度为0.001~0.1%(优选0.005-0.05%)。
[0029]
在一些优选的实施方案中,所述药物组合物重量组成为:
[0030][0031]
任选地,其还含有0.001~0.05%的抑菌剂;
[0032]
任选地,其还含有0.1~2%的渗透压调节剂。
[0033]
在一些优选的实施方案中,所述增稠剂选自纤维素衍生物、交联聚乙烯醇吡咯烷酮、玻璃酸钠、聚乙烯吡咯烷酮、聚乙烯醇、聚乙二醇及其任意组合在一些优选的实施方案中,所述纤维素衍生物选自羟丙基甲基纤维素、甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素和羧甲基纤维素钠及其任意组合。在一些优选的实施方案中,所述增稠剂为羟丙基甲基纤维素。在一些优选的实施方案中,所述增稠剂在所述药物组合物中的重量含量为0.5~10%,例如0.5~8%、0.5~5%、0.5~3%或1~3%。
[0034]
在一些优选的实施方案中,所述络合剂选自依地酸、依地酸二钠和依地酸钙钠,优选为依地酸二钠。在一些优选的实施方案中,所述络合剂在所述药物组合物中的重量含量为0.005~0.05%,例如0.005~0.03%、0.005~0.02%、0.005~0.01%或0.008~0.01%。
[0035]
在一些优选的实施方案中,所述抑菌剂选自苯扎氯铵、苯扎溴铵、西曲溴铵、苯氧
乙醇、苯乙醇、对羟基苯甲酸酯类抑菌剂及其任意组合。在一些优选的实施方案中,所述抑菌剂为苯扎氯铵、对羟基苯甲酸乙酯的一种或其任意组合。在一些优选的实施方案中,所述抑菌剂为苯扎氯铵。在一些优选的实施方案中,所述抑菌剂在所述药物组合物中的重量含量为0.005~0.03%,例如0.005~0.02%、0.006~0.02%、0.006~0.012%或0.008~0.01%。
[0036]
在一些优选的实施方案中,所述ph调节剂选自碳酸缓冲体系、磷酸缓冲体系、柠檬酸缓冲体系、醋酸缓冲体系、巴比妥酸缓冲体系、三羟甲基氨基甲烷缓冲体系、硼酸、硼砂、氢氧化钠、盐酸和枸橼酸及其盐中的一种或多种。在一些优选的实施方案中,所述ph调节剂为硼酸和磷酸缓冲体系(例如磷酸二氢钠-磷酸氢二钠缓冲体系、磷酸二氢钾-磷酸氢二钾缓冲体系)。在一些优选的实施方案中,所述ph调节剂的在所述药物组合物中的含量为使得所述药物组合物ph为4.0~6.0,例如4.5~5.5。
[0037]
在一些优选的实施方案中,所述渗透压调节剂选自氯化钠、甘油、丙二醇、甘露醇及其任意组合。在一些优选的实施方案中,所述渗透压调节剂为丙二醇。在一些优选的实施方案中,所述渗透压调节剂在所述药物组合物中的重量含量为0.1~1%、0.1~0.5%或0.1~0.3%。
[0038]
在一些优选的实施方案中,所述药物组合物选自配方1-4:
[0039]
配方1:
[0040][0041]
配方2:
[0042]
[0043]
配方3:
[0044][0045]
配方4:
[0046][0047]
在另一个方面,本技术提供制备上述药物组合物的方法,其包括以下步骤:
[0048]
将所述增稠剂加60-90℃(例如70-90℃、80-90℃)水分散溶胀,补加20-30℃(例如20-25℃)水溶解,得a液;
[0049]
分别将所述ph调节剂、络合剂、抑菌剂以及任选的渗透压调节剂加60-80℃(例如65-80℃、65-75℃)水溶解,降至30℃以下(例如室温)加入所述硫酸阿托品,溶解得b液;
[0050]
将a液和b液混合,加余量水得所述药物组合物;
[0051]
任选地,还包括将所得药物组合物过滤的步骤,优选用0.22μm滤膜过滤。
[0052]
在另一个方面,本技术还提供所述的药物组合物在制备预防和/或治疗视力缺陷(例如近视,尤其是儿童或青少年近视)的药物中的用途。
[0053]
特别地,本发明可通过如下实现:
[0054]
1.一种提高硫酸阿托品制剂稳定性的方法,其特征在于,控制所述硫酸阿托品原料药总杂质含量≤0.25%(例如,≤0.2%,≤0.15%,≤0.1%,≤0.05%或者未检出)和/或单杂含量≤0.05%(例如,≤0.01%或者未检出);优选地,所述制剂为眼用液体制剂(例如滴眼剂);进一步优选地,所述制剂中硫酸阿托品的浓度为0.001~0.1%(优选0.005-0.05%)。
[0055]
2.一种硫酸阿托品的精制方法,其包括以下步骤:
[0056]
将硫酸阿托品原料药分别用浆洗溶剂a、浆洗溶剂b和浆洗溶剂c浆洗;其中,
[0057]
所述浆洗溶剂a为低极性溶剂,例如丙酮、乙醇-丙酮混合溶剂、乙醚、乙醇-乙醚混合溶剂、甲基叔丁基醚、异丙醚、石油醚(例如石油醚(60-90)、石油醚(90-120))或其任意组合;优选地,浆洗溶剂a的用量为每克硫酸阿托品加3-30毫升(例如5、10、15或20毫升)浆洗
溶剂a;优选地,浆洗温度为0-50℃(例如室温、40℃);优选地,浆洗时间为0.5-6h(例如3h);
[0058]
所述浆洗溶剂b为丙酮-水混合溶剂(水的体积占2-10%,例如5%);优选地,浆洗溶剂b的用量为每克硫酸阿托品加5-20毫升(例如10或15毫升)浆洗溶剂b;优选地,浆洗温度为0-50℃(例如室温、40℃);优选地,浆洗时间为0.5-6h(例如4h);
[0059]
所述浆洗溶剂c为低极性溶剂,例如乙醇-丙酮混合溶剂、乙醇-乙醚混合溶剂、丙酮或其任意组合;优选地,浆洗溶剂c的用量为每克硫酸阿托品加3-30毫升(例如5或10毫升)浆洗溶剂c;优选地,浆洗温度为0-室温(例如10℃);优选地,浆洗时间为0.5-6h(例如1.5h)。
[0060]
3.条目2的方法,在浆洗前还包括将所述硫酸阿托品原料药粉碎的步骤;优选地,所述方法进一步包括将粉碎后的硫酸阿托品原料药过30-100目筛的步骤;
[0061]
优选地,在浆洗后还包括过滤和/或干燥的步骤;优选地,所述过滤选自抽滤、压滤和甩滤;优选地,所述干燥为减压干燥。
[0062]
4.硫酸阿托品,其通过条目2或3的方法制备得到;或者其总杂质含量≤0.25%(例如,≤0.2%,≤0.15%,≤0.1%,≤0.05%或者未检出)和/或单杂含量≤0.05%(例如,≤0.01%或者未检出)。
[0063]
5.药物组合物,其含有条目4所述的硫酸阿托品,以及药学上可接受的辅料;优选地,其为眼用液体制剂,例如滴眼剂;进一步优选地,所述药物组合物中硫酸阿托品的浓度为0.001~0.1%(优选0.005-0.05%)。
[0064]
6.条目5的药物组合物,其重量组成为:
[0065][0066]
任选地,其还含有0.001~0.05%的抑菌剂;
[0067]
任选地,其还含有0.1~2%的渗透压调节剂。
[0068]
7.条目6的药物组合物,其中所述增稠剂选自纤维素衍生物、交联聚乙烯醇吡咯烷酮、玻璃酸钠、聚乙烯吡咯烷酮、聚乙烯醇、聚乙二醇及其任意组合;优选地,所述纤维素衍生物选自羟丙基甲基纤维素、甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素和羧甲基纤维素钠及其任意组合,优选为羟丙基甲基纤维素;优选地,所述增稠剂在所述药物组合物中的重量含量为0.5~10%,例如0.5~8%、0.5~5%、0.5~3%或1~3%;
[0069]
优选地,所述络合剂选自依地酸、依地酸二钠和依地酸钙钠,优选为依地酸二钠;优选地,所述络合剂在所述药物组合物中的重量含量为0.005~0.05%,例如0.005~0.03%、0.005~0.02%、0.005~0.01%或0.008~0.01%;
[0070]
优选地,所述抑菌剂选自苯扎氯铵、苯扎溴铵、西曲溴铵、苯氧乙醇、苯乙醇、对羟基苯甲酸酯类抑菌剂及其任意组合,优选为苯扎氯铵、对羟基苯甲酸乙酯的一种或其任意组合,更优选为苯扎氯铵;优选地,所述抑菌剂在所述药物组合物中的重量含量为0.005~0.03%,例如0.005~0.02%、0.006~0.02%、0.006~0.012%或0.008~0.01%;
[0071]
优选地,所述ph调节剂选自碳酸缓冲体系、磷酸缓冲体系、柠檬酸缓冲体系、醋酸缓冲体系、巴比妥酸缓冲体系、三羟甲基氨基甲烷缓冲体系、硼酸、硼砂、氢氧化钠、盐酸和枸橼酸及其盐中的一种或多种,优选为硼酸和磷酸缓冲体系(例如磷酸二氢钠-磷酸氢二钠缓冲体系、磷酸二氢钾-磷酸氢二钾缓冲体系);优选地,所述ph调节剂的在所述药物组合物中的含量为使得所述药物组合物ph为4.0~6.0,例如4.5~5.5;
[0072]
优选地,所述渗透压调节剂选自氯化钠、甘油、丙二醇、甘露醇及其任意组合;优选为丙二醇;优选地,所述渗透压调节剂在所述药物组合物中的重量含量为0.1~1%、0.1~0.5%或0.1~0.3%。
[0073]
8.条目6的组合物,其选自配方1-4:
[0074]
配方1:
[0075][0076]
配方2:
[0077][0078]
配方3:
[0079][0080]
配方4:
[0081][0082]
9.制备条目6-8任一项所述药物组合物的方法,其包括以下步骤:将所述增稠剂加60-90℃(例如70-90℃、80-90℃)水分散溶胀,补加20-30℃(例如20-25℃)水溶解,得a液;
[0083]
分别将所述ph调节剂、络合剂、抑菌剂以及任选的渗透压调节剂加60-80℃(例如65-80℃、65-75℃)水溶解,降至30℃以下(例如室温)加入所述硫酸阿托品,溶解得b液;
[0084]
将a液和b液混合,加余量水得所述药物组合物;
[0085]
任选地,还包括将所得药物组合物过滤的步骤,优选用0.22μm滤膜过滤。
[0086]
10.条目6-8任一项所述的药物组合物在制备预防和/或治疗视力缺陷(例如近视,尤其是儿童或青少年近视)的药物中的用途。
附图说明
[0087]
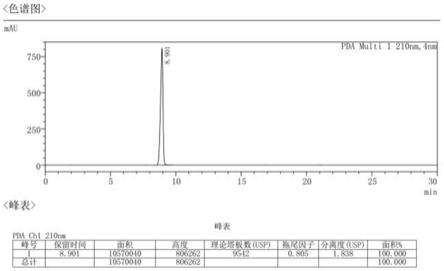
图1显示了市售硫酸阿托品原料药b160903的hplc分析图谱;
[0088]
图2显示了市售硫酸阿托品原料药b160903精制后得到的160903-p01的hplc分析图谱。
具体实施方式
[0089]
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品,实施例中未注明检测方法者,可采用本领域常用方法进行检测,或参考《中华人民共和国药典》(2015年版)中所规定的检测方法。
[0090]
硫酸阿托品原料药中各杂质代号及结构如下所示:
[0091][0092][0093]
实施例1硫酸阿托品原料药的精制
[0094]
将纯度在99%以上的市售硫酸阿托品原料药a或b置于60目筛网的粉碎机中,缓慢粉碎过筛,收集筛网下的原料备用。取50g粉碎后的原料药置于3000ml三口烧瓶中,加入20倍量的无水丙酮,40℃下搅拌浆洗3h,抽滤,得到湿品1。取该湿品1,置于3000ml三口烧瓶中,加入15倍量的5%丙酮水溶液,40℃下搅拌浆洗4h,抽滤,得到湿品2。取该湿品2置于1000ml三口烧瓶中,加入10倍量的丙酮,5℃下搅拌浆洗1.5h,抽滤,减压干燥6h,得到硫酸阿托品41g,收率:82%。hplc进行杂质分析,结果如图1-2和表1-2所示。
[0095]
hplc分析方法如下所述:
[0096]
取上述样品,加流动相a溶解并稀释制成每1ml中含1mg的溶液,作为供试品溶液;取供试品溶液适量,加流动相a溶解并稀释制成每1ml中含硫酸阿托品1μg的溶液,作为对照溶液;另取硫酸阿托品和杂质b适量,加流动相溶解并稀释制成每1ml中含杂质b约为1μg/ml、含硫酸阿托品约为1mg/ml的混合溶液作为系统适用性试验溶液。照高效液相色谱法(中国药典2015年版通则0512)试验。用十八烷基硅烷键合硅胶为填充剂(3μm,250mm
×
4.6mm);以[3.5g/l的磷酸二氢钾溶液(用磷酸调节ph至3.3)606ml和乙腈320ml的混合溶液](含1.7g十二烷基硫酸钠)为流动相a,乙腈为流动相b,照下表梯度洗脱,检测波长为210nm。精密量取系统适用性试验溶液10μl注入液相色谱仪,硫酸阿托品与杂质b色谱峰的分离度应不小于2.0。精密量取对照溶液与供试品溶液各10μl注入液相色谱仪。
[0097][0098]
供试品溶液色谱图中如有杂质峰,扣除相对保留时间0.25之前的杂质峰,杂质a、杂质b、杂质c、杂质j和杂质k的峰面积(相对保留时间及校正因子见下表)不得大于对照溶液主峰面积(0.1%),其它单个杂质峰面积不得大于对照溶液主峰面积(0.1%),各杂质峰面积的和不得大于对照溶液主峰面积的5倍(0.5%)。供试品溶液色谱图中小于对照溶液主峰面积0.5倍的色谱峰忽略不计。
[0099][0100][0101]
表1市售硫酸阿托品原料a精制前后纯度对比
[0102][0103]
表2市售硫酸阿托品原料b精制前后纯度对比
[0104][0105]
实施例2~实施例6
[0106]
按表3中相应处方配比,采用下述制备方法制备阿托品眼用制剂。
[0107]
制备方法:
[0108]
(1)取10g 80~90℃的注射用水,加入处方量的羟丙基甲基纤维素或玻璃酸钠充分分散溶胀,补30℃以下注射用水至20g,搅拌溶解至透明溶液,备用;
[0109]
(2)取50g的65~75℃注射用水,依次溶解处方量的一水磷酸二氢钠、磷酸氢二钠、依地酸二钠和苯扎氯铵,放至30℃以下,加入处方量的按实施例1中方法精制后的硫酸阿托品,搅拌溶解;
[0110]
(3)将(1)所得的羟丙基甲基纤维素溶液与(2)所得的溶液混合均匀;
[0111]
(4)向(3)所得的混合溶液中,补水至全量100g,搅拌均匀,0.22μm滤膜过滤除菌,灌装。
[0112]
表3处方配比
[0113]
组份实施例2实施例3实施例4实施例5实施例6硫酸阿托品0.005g0.010g0.050g0.010g0.020g羟丙甲纤维素1.000g1.000g1.000g1.000g1.000g玻璃酸钠
‑‑‑
2.0g2.0g一水磷酸二氢钠0.250g0.250g0.250g0.250g0.250g磷酸氢二钠0.0025g0.0025g0.0025g0.0025g0.0025g依地酸二钠0.010g0.010g0.010g0.010g0.010g苯扎氯铵0.010g0.010g0.010g0.010g0.010g注射用水余量余量余量余量余量
[0114]
实施例7~实施例9
[0115]
按表4中相应处方配比,采用下述制备方法制备阿托品眼用制剂。
[0116]
制备方法:
[0117]
(1)取10g 80~90℃的注射用水,加入处方量的羟丙基甲基纤维素充分分散溶胀,补30℃以下注射用水至20g,搅拌溶解至透明溶液,备用;
[0118]
(2)取50g的65~75℃注射用水,依次溶解处方量的硼酸、依地酸二钠和苯扎氯铵,放至30℃以下,加入处方量的按实施例1中方法精制后的硫酸阿托品,搅拌溶解;
[0119]
(3)将(1)所得的羟丙基甲基纤维素溶液与(2)所得的溶液混合均匀;
[0120]
(4)向(3)所得的混合溶液中,补水至全量100g,搅拌均匀,0.22μm滤膜过滤除菌,灌装。
[0121]
表4处方配比
[0122]
组份实施例7实施例8实施例9硫酸阿托品0.005g0.010g0.050g羟丙甲纤维素1.000g1.000g1.000g丙二醇0.300g-0.300g硼酸1.800g1.800g1.800g依地酸二钠0.010g0.010g0.010g苯扎氯铵0.010g-0.010g注射用水余量余量余量
[0123]
比较例1~比较例5
[0124]
按表3中相应处方配比,采用下述制备方法制备阿托品眼用制剂。
[0125]
制备方法:
[0126]
(1)取10g 80~90℃的注射用水,加入处方量的羟丙基甲基纤维素或玻璃酸钠充分分散溶胀,补30℃以下注射用水至20g,搅拌溶解至透明溶液,备用;
[0127]
(2)取50g的65~75℃注射用水,依次溶解处方量的一水磷酸二氢钠、磷酸氢二钠、依地酸二钠和苯扎氯铵,放至30℃以下,加入处方量的硫酸阿托品原料药b160903,搅拌溶解;
[0128]
(3)将(1)所得的羟丙基甲基纤维素溶液与(2)所得的溶液混合均匀;
[0129]
(4)补水至全量100g,搅拌均匀,0.22μm滤膜过滤除菌,灌装。
[0130]
比较例6~比较例8
[0131]
按表4中相应处方配比,采用下述制备方法制备阿托品眼用制剂。
[0132]
制备方法:
[0133]
(1)取10g 80~90℃的注射用水,加入处方量的羟丙基甲基纤维素充分分散溶胀,补30℃以下注射用水至20g,搅拌溶解至透明溶液,备用;
[0134]
(2)取50g的65~75℃注射用水,依次溶解处方量的硼酸、依地酸二钠和苯扎氯铵,放至30℃以下,加入处方量的硫酸阿托品原料药b160903,搅拌溶解;
[0135]
(3)将(1)所得的羟丙基甲基纤维素溶液与(2)所得的溶液混合均匀;
[0136]
(4)向(3)所得的混合溶液中,补水至全量100g,搅拌均匀,0.22μm滤膜过滤除菌,灌装。
[0137]
实验例1:精制硫酸阿托品原料药加速稳定实验
[0138]
取实施例1精制得到的硫酸阿托品原料药(批号:160903-p01)进行包装(内层药用低密度聚乙烯袋塑封,外层铝桶),于40℃
±
2℃,相对湿度75%
±
5%的条件下放置,分别于0个月、1个月、2个月、3个月、6个月观察产品变化,结果见表5。
[0139][0140]
实验例1:低浓度阿托品眼用制剂稳定性比较试验
[0141]
取实施例2~9和比较例1~8所得阿托品眼用制剂,于温度40℃
±
2℃,相对湿度
25%
±
5%的条件下放置,分别于0个月、1个月、2个月、3个月、6个月对活性成分的含量及主要降解产物杂质c含量进行检测。结果见表6。
[0142]
活性成分含量测定方法如下:取所述眼用制剂约0.5g,精密称定,加乙醋酐40ml溶解后,加结晶紫指示液1~2滴,用高氯酸滴定液(0.1mol/l)滴定至溶液显纯蓝色,并将滴定结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/l)相当于67.68mg的(c
17h23
no3)2·
h2so4。
[0143]
杂质c含量测定方法参照实施例1中的hplc方法。
[0144]
表6低浓度阿托品眼用制剂的稳定性数据
[0145][0146][0147]
从表5数据中可以看出,采用本技术的硫酸阿托品制得的低浓度眼用制剂与常规工艺制备的产品比较,活性成分的降解速率显著减慢,主要降解产物杂质c的含量显著降低,低浓度硫酸阿托品眼用制剂的稳定性显著提高,提高产品的质量,有效延长产品的有效期。
[0148]
尽管本发明的具体实施方式已经得到详细的描述,根据已经公开的所有教导,本领域技术人员可以对本发明技术方案的细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
