检测标本中ckap4试剂的应用及膀胱癌检测试剂盒
技术领域
1.本发明属于肿瘤分子生物学技术领域,涉及一种检测标本中ckap4试剂的应用及膀胱癌检测试剂盒。
背景技术:
2.膀胱癌是一种发病于膀胱上皮的恶性泌尿系统疾病,据2020年的数据显示,全球范围内膀胱癌的发病率和死亡率都排在前10,每年有57.3万新发病例和21.3万死亡病例。其中,大约75%的为非肌层浸润性膀胱癌,25%为肌层浸润性膀胱癌。然而,无论是否发生肌层浸润,膀胱癌的一个重要特征是其高复发性,并且膀胱癌的转移会引起疾病的快速进展,并在短时间内致使患者死亡。因此,建立快速、简便、廉价、可满足高频率检测要求的方法,是应对膀胱癌复发和改善治疗效果的一项关键技术。
3.在现有的检测方法中,膀胱镜组织活检是临床诊断的金标准,这项技术是将膀胱镜经尿道插入膀胱,直接观察膀胱和尿道内病变情况,并切取疑似病灶组织用于病理诊断的侵入式有创检查方法,准确率高。然而,这种侵入式的检查方法不仅需要医生具有丰富的操作经验,并且并发症多,容易遗漏平坦型尿路上皮原位癌,患者的接受程度较低,难以满足大规模推广的需求。基于超声、ct、mri等技术的影像学检查是一类在临床上广泛使用的检测手段。对于膀胱癌,尤其是早期的非浸润性膀胱癌或术后复发的微小病灶,该类影像学检测手段常因仪器分辨率的限制而导致错诊、漏诊现象,具有较大的局限性。另外,目前临床使用的基于尿液的无创检测技术如尿液脱落细胞学、核基质蛋白22(nmp22)及染色体荧光原位杂交(fish),其灵敏度和特异性等性能指标难以满足临床诊断的需要,尤其对低级别膀胱癌检测灵敏度较差,更无法实现膀胱癌的早期筛查。
4.外泌体是由细胞分泌的尺寸在30-100nm的微小囊泡,携带了众多细胞内部的生物信息,能够准确反映其来源细胞的分子生物学特征。由于肾小球滤过的尺寸限制,血液中的外泌体通常无法直接进入泌尿系统,因此尿液中的外泌体均来源于泌尿系统细胞,能够有效地排除其他全身性细胞分泌的外泌体的干扰。研究表明,相比于正常细胞,癌细胞由于其增殖旺盛,具有更强的外泌体分泌能力,能够将更大量包含有细胞生物信息的外泌体分泌到细胞外环境。在分离纯化方面,由于外泌体本身的尺寸效应,分子量小的无机盐、生物小分子、杂质蛋白和分子量较大的脱落细胞等干扰性杂质会被极大地排除在外,因此膀胱癌作为一种发病于泌尿系统的疾病,通过患者尿液外泌体生物特征实现膀胱癌的无创检测是一种极具前途的新型分子检测手段。
5.目前,在外泌体生物标志物的研究方面,tacstd2、aat、filamin-a和h2b1k被发现在肿瘤衍生的外泌体样本中含量较高,但是通过特异性抗体印迹技术检测,发现信号较差,仍无法达到各组患者与对照样本之间的统计学差异,加上检测灵敏度的不足,使其难以转化为临床应用成果。因此,发现可用于膀胱癌临床检测的尿液外泌体生物标志物具有显著的应用优势与市场需求。
技术实现要素:
6.本发明公开了一种具有膀胱癌特异性的蛋白质分子ckap4,该分子不仅高表达于膀胱癌细胞系及其外泌体中,而且在膀胱癌患者尿液的外泌体中也特异性高表达。本发明还发现ckap4经由外泌体调控细胞表面力学性质,从而促进细胞的迁移和在小鼠体内的转移,强调了ckap4在膀胱癌外泌体中的重要作用。
7.本发明的首要目的是提供一种检测标本中ckap4试剂的应用,用于制备膀胱癌诊断制剂,所述的标本包括:组织、细胞、细胞外泌体、血液、尿液和尿液外泌体中的至少一种。
8.进一步地,ckap4在膀胱癌患者标本中表达量要高于健康人、泌尿系统炎症,或者其他癌症患者。
9.进一步地,所述的检测标本中ckap4试剂包括检测标本中ckap4蛋白含量的试剂。
10.进一步地,所述的检测标本中ckap4试剂还包括提取标本中ckap4蛋白的试剂。
11.进一步地,所述的标本包括:尿液和尿液外泌体中的至少一种,尤其是尿液外泌体。
12.本发明的第二个目的是提供一种膀胱癌检测试剂盒,包括检测标本中ckap4蛋白含量的试剂。
13.进一步地,所述的试剂盒,还包括提取标本中ckap4蛋白的试剂。
14.所述的标本包括:组织、细胞、细胞外泌体、血液、尿液和尿液外泌体中的至少一种。
15.进一步地,所述的标本包括:尿液和尿液外泌体中的至少一种,尤其是尿液外泌体。
16.本发明还提供ckap4在通过外泌体的转运调控细胞表面力学性质,维持细胞表面由中心到边缘的高硬度梯度研究中的应用。这种特性能够显著促进膀胱癌的转移。
17.在临床上,本发明通过收集不同等级的膀胱癌患者治疗前后的晨尿样本,采用超高速离心法提取外泌体,经werstern blot验证外泌体中ckap4的表达情况,确定了ckap4在膀胱癌患者尿液外泌体中的特异性高表达,经手术切除肿瘤后的样本中表达量显著降低,而在泌尿系统炎症患者和健康人供体的尿液外泌体中ckap4表达量很低。在本发明涉及的32例样本中,基于外泌体ckap4检测的敏感性、特异性、准确度分别为93.8%(16例膀胱癌阳性患者中检出15例)、100%(16例非膀胱癌患者阴性样本中均未检测出ckap4表达)、96.8%(所有32例样本中31例符合检测预期)(如图7),其优良的选择性与灵敏度适用于临床上的检测标准。
18.所述的检测膀胱癌的外泌体蛋白质分子还包括如下应用:
19.(1)基于膀胱癌患者尿液中外泌体ckap4的临床检测手段,如检测试纸、试剂盒、器件、仪器等。
20.(2)在制备膀胱癌治疗载体试剂中的应用。
21.(3)在研究膀胱癌细胞与正常细胞的差异性中的应用。
22.(4)在研究膀胱肿瘤活体成像中的应用。
23.与现有技术相比,本发明的优点在于:
24.1、基于膀胱癌患者尿液中外泌体ckap4的检测敏感性、特异性、准确度分别为93.8%、100%、96.8%,远远大于现有基于游离蛋白和脱落细胞的检测手段;
25.2、本发明收集到的外泌体可以来自于不同发病位点的膀胱癌细胞,能够反映患者发病部位的整体状况,避免膀胱镜等检测方法中可能发生的漏检状况;
26.3、本发明的检测手段能够很好地避免来自临床样本中较大的脱落细胞、沉淀、代谢产物的影响,同时可以避免无法去除的游离杂蛋白的影响;
27.4、本发明基于外泌体蛋白ckap4的检测手段,能够被用于初次发病检测、随检等方面的应用。
28.上述优点使得所述外泌体ckap4作为膀胱癌特异性识别分子探针,用于诊断和靶向治疗膀胱癌方面具有重要的潜力。
附图说明
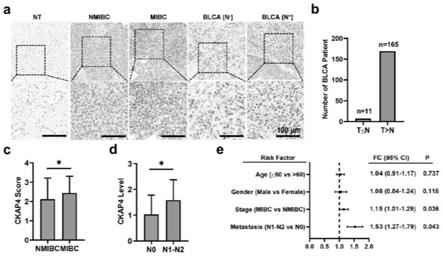
29.图1:ckap4在膀胱癌组织中的表达情况;
30.a)相比于正常组织,ckap4在膀胱癌患者中高表达;其中,blca(n-)代表膀胱癌无淋巴结转移;blca(n )代表膀胱癌出现淋巴结转移;nmibc代表非浸润性膀胱癌;mibc代表浸润性膀胱癌;
31.b)在176例样本中,ckap4在膀胱癌患者中的阳性样本(ckap4表达评分高于正常组织ckap4评分的样本,)为165例,阳性率93.75%;
32.c)ckap4的高表达与膀胱癌进展有关,nmibc:非浸润性膀胱癌;mibc:浸润性膀胱癌,*p《0.05;如图所示,随着膀胱癌浸润性的提高,ckap4表达量随之增加;
33.d)ckap4的表达与膀胱癌的转移相关,n0:未转移;n1-n2:出现膀胱癌转移,*p《0.05;如图所示,随着膀胱癌淋巴结转移程度的加深,ckap4表达量随之增加;
34.e)森林图评估与膀胱癌进展相关的风险因素,如图所示,相比于年龄、性别,膀胱癌的浸润和转移是更为显著的风险因素。
35.图2:ckap4在膀胱癌细胞和其分泌的外泌体中的高表达;
36.a)ckap4在膀胱癌5637细胞和正常细胞系sv-huc-1中的表达情况的蛋白印迹,其中gapdh为内参;
37.b)图2a)中蛋白印迹的定量分析;通过利用抗原抗体特异性识别并结合的原理,将蛋白转印至pvdf膜后用anti-ckap4的特异性抗体识别并结合ckap4,然后利用化学发光的方法即可检测到ckap4并可对其进行定量分析。由图可知,相比于正常细胞sv-huc-1,ckap4在膀胱癌的细胞系5637中高表达;
38.c)从细胞培养上清液中分离的5637细胞和sv-huc-2细胞中的外泌体的透射电镜,标尺100nm;
39.d)对5637和sv-huc-1外泌体的粒径分析;
40.e)ckap4在5637和sv-huc-1外泌体中表达的蛋白印迹;
41.f)图2e)中蛋白印迹的定量分析;由图可知,ckap4在膀胱癌细胞系5637细胞分泌的外泌体中高表达,而在正常细胞sv-huc-1的外泌体中表达量较低。
42.g-h)用ckap4适体修饰的aunps标记外泌体表面的ckap4表达情况;
43.g)标尺100nm;及其定量分析h),****p《0.0001。
44.图3:ckap4为5637和sv-huc-1外泌体的差异性表达蛋白;
45.a)5637和sv-huc-1外泌体的蛋白质质谱分析;结果显示,相比于正常细胞来源的
sv-huc-1外泌体蛋白,ckap4为膀胱癌外泌体中高表达的蛋白,同时其表达差异性最大,是膀胱癌细胞特异性高表达的蛋白;
46.b)ckap4的蛋白质质谱数据;图中数据表明了ckap4特征性的肽段信息。
47.图4:细胞内ckap4及外泌体中ckap4促进细胞表面力学性质变化;
48.其中,oe表示overexpression,即过表达ckap4,shnc表示敲低实验的对照组;shckap4表示敲低ckap4;
49.a)原子力探针测定细胞表面硬度的示意图;
50.b)细胞表面软硬程度的力曲线特性;
51.c)膀胱癌5637细胞敲低或过表达ckap4后细胞形貌(上)以及表面软硬程度(下)变化;
52.d)沿箭头所指方向的细胞表面软硬程度曲线;
53.e)图4d)中的统计数据,其中每组包含有大于15个细胞;统计采用student's t test,**p《0.01,****p《0.0001;由图c-e可知,膀胱癌细胞的ckap4维持了细胞表面由中心到边缘的高硬度梯度,当ckap4敲低时,梯度减小,过表达时该梯度加大;
54.f)外泌体ckap4增强受体细胞表面硬度梯度;
55.g-h)沿箭头所示方向上5637细胞(g)和sv-huc-1细胞(h)表面硬度的变化曲线;
56.i-j)5637细胞(i)和sv-huc-1细胞(j)的细胞力学特性的统计学差异,每组包含了至少15个细胞,采用student's t test,*p《0.05,****p《0.0001,ns,无显著差异;由图f-j可知,在膀胱癌外泌体ckap4的作用下,5637细胞和sv-huc-1细胞表面的硬度梯度都升高,而单独的外泌体本身不显著改变细胞表面力学特性。
57.图5:外泌体ckap4提升膀胱癌细胞运动能力,并增强细胞迁移;
58.no exo:未加入外泌体;shnc exo:加入敲低实验中对照组细胞提取的外泌体;shckap4 exo:加入敲低ckap4细胞中提取的外泌体;
59.5637shnc:在5637细胞中敲低实验的对照组;5637shckap4:5637细胞中敲低ckap4的表达;
60.a)细胞内ckap4及外泌体ckap4促进细胞运动能力的提升,每个圆圈代表10min,标尺20μm;低表达ckap4的sv-huc-1细胞的运动能力较高表达ckap4的5637细胞弱;敲低5637细胞内ckap4后细胞运动能力减弱;然后分别在对照组和实验组中加入含有ckap4、不含ckap4的外泌体,发现加入含有ckap4的外泌体后实验组的细胞运动能力增强;
61.b)细胞轨迹追踪;对细胞的运动轨迹进行分析,低表达ckap4的sv-huc-1细胞的运动范围较高表达ckap4的5637细胞小;敲低5637细胞内ckap4后细胞运动范围减小;然后分别在对照组和实验组中加入含有ckap4、不含ckap4的外泌体,发现加入含有ckap4的外泌体后实验组的细胞运动范围增加;
62.c)细胞内ckap4及外泌体ckap4促进细胞运动能力的提升的统计数据,每组统计50个以上细胞,采用student's t test,**p《0.01,****p《0.0001,ns,无显著差异;对图4a)各个细胞及条件下运动能力即运动距离进行统计分析,发现对照组中加入含有ckap4外泌体的运动距离与不加或加了不含ckap4外泌体存在显著差异,而在实验组中这种差异更加明显,在低表达ckap4的sv-huc-1中也出现了同样的结果;
63.d)划痕实验;在对照组中,不加入或加入不含ckap4的外泌体,其伤口愈合能力即
细胞迁移能力较加入含有ckap4外泌体的一组能力差;而在实验组中敲低ckap4后细胞的迁移能力减弱,加入含有ckap4的外泌体后迁移能力有所恢复;
64.e)图5d)中的统计学分析,采用student's t test,**p《0.01,****p《0.0001,ns,无显著差异;在对照组中,不加入外泌体与加入含有ckap4外泌体的细胞的迁移能力具有显著性差异;在实验组中,不加入外泌体与加入含有ckap4外泌体的细胞的迁移能力也具有显著性差异;
65.f)transwell实验检测ckap4作用下细胞转移能力;在对照组中,不加入或加入不含ckap4的外泌体,其细胞转移能力较加入含有ckap4外泌体的一组能力差;而在实验组中敲低ckap4后细胞转移移能力减弱,加入含有ckap4的外泌体后细胞转移能力有所恢复;
66.g)图5f)中的统计学分析,采用student's t test,***p《0.001,ns,无显著差异。在对照组中或实验组中,加入含有ckap4的外泌体后细胞转移能力与不加入外泌体的组别存在显著性差异。
67.图6:外泌体ckap4对膀胱癌细胞在小鼠体内的转移中的作用;
68.a)膀胱癌细胞在小鼠体内的转移模型示意图;
69.b)细胞及外泌体作用的各组信息示意图;
70.c)膀胱癌细胞在小鼠肝脏的转移,各组信息如图6b);由图可知,ckap4的高表达促进膀胱癌细胞在肝脏定植,转移病灶部位表现处明显的he染色、ki67染色、ckap4染色加深;ckap4在外泌体的作用下进一步加剧肝脏处的转移;而不含有ckap4的外泌体未对膀胱癌细胞的肝转移产生明显变化。
71.d-f)膀胱癌细胞在肝脏转移部位的统计分析;
72.d)肿瘤结节数;
73.e)ki-67指数;
74.f)ckap4表达情况,采用student's t test,*p《0.05,**p《0.01,***p《0.001,****p《0.0001;图d-f)中数据显示,膀胱癌细胞ckap4的高表达促进其肝转移;在外泌体ckap4的作用下,膀胱癌细胞的转移能力加强;不表达ckap4的外泌体对膀胱癌细胞的肝转移无明显促进作用。
75.图7:ckap4在膀胱癌患者尿液外泌体中的表达情况;
76.a)健康人(hd)、膀胱癌(高级别hblca;低级别lblca)、膀胱癌术后(as)、前列腺癌(prad)、肾癌(kirc)、膀胱良性肿物(bbl)患者尿液外泌体样本的ckap4表达的代表性蛋白印迹;
77.b)所有已检测尿液外泌体样本中的ckap4相对含量的热图分析,其中前列腺癌、肾癌等非膀胱部位肿瘤统称为非膀胱癌症(nblca);
78.c)所有已检测尿液外泌体样本中的ckap4相对含量的统计学分析,*p《0.05,**p《0.01。
具体实施方式
79.以下结合具体实施例旨在进一步说明本发明,而非限制本发明。
80.一、材料与仪器
81.1、材料
82.1.1细胞系
83.5637(人膀胱癌细胞)、sv-huc-1(人膀胱上皮永生化细胞)。
84.1.2培养基、血清
85.dpbs、无血清1640、无血清dmem、ps、胰蛋白酶、zeta血清(thermofisher scientific)。
86.1.3抗体
87.兔抗ckap4多克隆抗体(生工生物工程(上海)有限公司,d261564);cd81抗体(d-4)sc-166028、cd63(e-12):sc-365604、alix(1a12):sc-53540(santa cruz biotechnology);鼠二抗、兔二抗(merck)。
88.1.4临床样本
89.临床样本均来自于湘雅第二附属医院泌尿科,健康人样本来源于志愿者捐赠,均符合生物伦理。
90.1.5其他试剂
91.ecl化学发光液(advansta);1.5m tris-hcl ph 8.8、1.0m tris-hcl ph6.8以及10%sds(上海威奥生物科技有限公司)。
92.2、仪器
93.低温超高速离心机及配套超速离心管(beckman);一次性针头式滤器0.22um33mm(millipore);离心浓缩仪(labconco);程控五段金属浴(天根);垂直电泳仪、电泳槽及其他电泳配件、伯乐chemidoc xrs 化学发光凝胶成像系统(biorad)。
94.实施例1:免疫组化
95.含有正常、恶性和转移的组织微阵列购自avilabio(中国西安,dc-bla11021)。将载玻片浸泡在柠檬酸钠抗原回收溶液(ph 6.0)中。在用3%h2o2阻断内源性过氧化物酶和血清封闭后,将切片与ckap4的一级抗体在4℃下孵育过夜,并在室温下用hrp二级抗体标记50分钟。最后,切片在新制备的dab显色试剂中显影,直到细胞核在显微镜下呈棕黄色,然后用苏木精染色溶液对细胞核进行复染。
96.组织微阵列中ckap4的表达水平由两位独立的有经验的病理学家以盲法进行审查和评分,并取平均百分比值。ckap4表达根据细胞质和核染色的比例和强度评分如下:0-10%评分为0;11-50%为1分;50-75%为2分;超过75%为3分。苏木精染色的细胞核呈蓝色。dab试剂培养的阳性细胞有棕黄色的细胞核。结果见图1。
97.实施例2:利用梯度离心法收集细胞样本中的外泌体。
98.实验具体步骤如下:
99.(1)复苏5637(人膀胱癌细胞)、sv-huc-1(人膀胱上皮永生化细胞)。待细胞增殖至对数生长期,传代到超大皿。超大皿中的细胞长到60%,收集培养基上清后并传代。重复收集细胞培养基上清至体积到300~500ml。
100.(2)将培养基上清转移至50ml离心管,4000rpm,30min,4℃;收集并将转移上清至新的50ml离心管。
101.(3)一次性针头式滤器0.22um 33mm过滤并收集上清。
102.(4)上清分装于beckman超速离心管(55654),低温超高速离心机(beckman_l-100xp)程序设计为转速110000g,1h,4℃。
103.(5)弃上清,用预冷的dpbs重悬沉淀,低温超高速离心机程序设计为110000g,1h,4℃。
104.(6)弃上清,利用残余的液体重悬外泌体,并用预冷的200~400ul dpbs彻底收集外泌体。
105.(7)将收集到的外泌体用离心浓缩仪冷冻浓缩为干粉状后,加入100ul ddh2o重新溶解。
106.(8)利用western blot检测外泌体中ckap4的含量,并且以cd81作为内参。制样:取适量的外泌体加入2ul 5
×
protein loading buffer后100℃金属浴10min,变性结束后立即置于冰上。待温度降至室温将样品稍稍离心。
107.上样:将制好的样品加入sds-page凝胶,电泳程序为70v 35min,120v 90min。转膜程序为300ma 90min。
108.(9)利用5%脱脂牛奶在室温封闭,封闭结束后将相应蛋白条带ckap4(63kda)、cd81(22-26kda)减下并用相应抗体4℃孵育过夜。
109.(10)回收抗体,tbst洗三次,每次10min。室温孵育鼠抗、兔抗,1h。回收抗体,tbst洗三次,每次10min。
110.(11)ecl化学发光液覆盖膜表面,利用bio-rad伯乐chemidoc xrs 化学发光凝胶成像系统检测相应条带。
111.相关溶液的配制:
112.(1)5
×
电泳缓冲:288g,gly;60.6g,tris;20g,sds,最后加去离子水定容至4l。使用:100ml 5
×
电泳缓冲液 400ml去离子水
113.(2)转膜液:14.4g,甘氨酸;3.03g,tris;200m,甲醇,最后加去离子水定容至1l。
114.(3)10
×
tbs:48.46g,tris;160.21g,nacl;先加去离子水至1600~1800ml,用浓盐酸调ph 7.6
±
0.1,最后加去离子水定容至2000ml。
115.(4)tbst:50ml 10
×
tbs 450ml去离子水 500ul tween-20。
116.sds-page胶制备:
117.10%分离胶和5%浓缩胶。10%sds-page蛋白分离胶(5ml):在50ml离心管中,按顺序加入2.0ml ddh2o,1.7ml30%acr-bis(29:1),1.25ml 1.5m tris-hcl(ph8.8),0.05ml10%sds,0.05ml10%aps,0.002ml temed,充分混匀加入胶板中并用无水乙醇去除气泡。室温放置,待胶凝固后加入5%sds-page蛋白浓缩胶,按顺序吸取3.4ml ddh2o,0.85ml 30%acr-bis(29:1),0.625ml 1.0m tris-hcl(ph6.8),0.05ml10%sds,0.05ml10%aps,0.005ml temed,混匀加入胶板中并插上梳子,待凝固即可使用。
118.胶体金aunps表征外泌体ckap4
119.利用透射电镜(tem)观察5637和sv-huc-1细胞的外泌体。首先将能够特异性识别的核酸适体spl3c连接在尺寸在5nm的胶体金颗粒aunps上,然后将spl3c-aunps与外泌体在室温下孵育30分钟。之后,将10μl上述外泌体样品滴在铜网上吸附20分钟,用2%磷钨酸染色10分钟,然后用100μl纯水洗涤2-3次,以去除多余的染料和未结合的aunps。最后,在室温下干燥,并进行tem成像(hitachi h-7000nar)。
120.结果见图2。
121.实施例3:外泌体的蛋白质质谱
122.分别将从5637和sv-huc-1细胞中收集到的外泌体进行蛋白质质谱测定,对比两组外泌体样品中的蛋白质丰度评分以及蛋白质倍数变化,选取其中同时具有较高评分和差异性较大的蛋白,即显著差异性蛋白。如图3所示,ckap4为膀胱癌外泌体中特征性表达的蛋白。
123.该蛋白氨基酸序列为:
124.mpsakqrgskgghgaaspsekgahpsggaddvakkpppapqqpppppaphpqqhpqqhpqnqahgkgghrgggggggkssssssasaaaaaaaasssascsrrlgralnflfylalvaaaafsgwcvhhvleevqqvrrshqdfsrqreelgqglqgveqkvqslqatfgtfesilrssqhkqdltekavkqgesevsrisevlqklqneilkdlsdgihvvkdarerdftslentveerlteltksindniaiftevqkrsqkeindmkakvasleesegnkqdlkalkeavkeiqtsaksrewdmealrstlqtmesdiytevrelvslkqeqqafkeaadterlalqaltekllrseesvsrlpeeirrleeelrqlksdshgpkedggfrhseafealqqksqgldsrlqhvedgvlsmqvasarqteslesllsksqeheqrlaalqgrleglgsseadqdglastvrslgetqlvlygdveelkrsvgelpstveslqkvqeqvhtllsqdqaqaarlppqdfldrlssldnlkasvsqveadlkmlrtavdslvaysvkietnennlesakgllddlrndldrlfvkvekihekv
125.实施例4:细胞表面力学性质的测定
126.用dnp-10探针(0.06n/m)在jpk nanowizard 4原子力光谱仪上测定细胞表面力学图谱,并用olympus共焦显微镜在明场下观察细胞。在测量细胞的杨氏模量之前,首先通过热噪声信号校准悬臂梁的弹簧常数,在充满超纯水的细胞培养皿上收集力曲线矫正探针参数。之后,将接种在35mm细胞培养皿中的细胞用1ml pbs洗涤3次,最终将细胞置于不含fbs的rpmi-1640细胞培养基中。设定测定参数:下压力为2.0nn,z长度为2000nm,z扫描速度为60μm/s,扫描区域为60
×
60μm,像素为256。为了拟合实验数据,选择herz模型,用jpkspm数据处理软件拟合力曲线。
[0127][0128]
式中,f是力曲线产生的力,e是杨氏模量,ν是泊松比(通常为0.2-0.5),r是尖端半径,δ是压痕深度。结果见图4。
[0129]
实施例5:细胞迁移能力测定
[0130]
1)单细胞运动追踪
[0131]
将细胞接种在35mm的玻璃底培养皿中。待细胞贴壁后,用pbs洗涤细胞,然后在室温下以4μg/ml的浓度用hoechst染色10分钟。用pbs洗涤细胞3次,并保存在完全培养基中使用。在60
×
物镜下观察细胞相对位置的变化,每10分钟记录一次细胞位置,总时长为1小时。图像用imagej软件进行分析,每个实验统计大于50个细胞。(对于外泌体作用实验,细胞接种前首先将含有外泌体的培养基和细胞孵育过夜,使外泌体进入细胞中。)结果见图5。
[0132]
2)划痕实验
[0133]
将5637nc和5637shckap4细胞接种在96孔板中过夜使细胞贴壁,细胞附着后将原来培养基替换成不含fbs的rpmi-1640培养基中培养24h。在细胞密度达到80-90%后用划痕仪(biotek)在单层细胞中均匀划下大小一致的痕迹并洗涤三次以去除悬浮的细胞和细胞碎片。之后用倒置显微镜监测0、4、8和12h划痕愈合情况。imagej软件测量并记录划痕面积。(对于外泌体作用实验,细胞接种前首先将外泌体和细胞孵育过夜,使外泌体进入细胞中。)结果见图5。
[0134]
3)transwell实验
[0135]2×
104细胞悬浮于200μl完全细胞培养基中并接种于24孔板的上室(8μm pore size,corning),过夜至贴壁。次日,用不含fbs的新鲜细胞培养基替换上室的培养基,下室加入含20%胎牛血清的培养基500μl用于诱导细胞迁移。37℃孵育3天。随后,细胞用pbs洗涤3次,然后分别用4%多聚甲醛和1%结晶紫在室温固定10min。用ddh2o洗涤,用棉棒擦拭非迁移细胞,biotek cytation1cell imaging multi-mode reader成像系统获取图像,imagej统计迁移细胞数量。(对于外泌体作用实验,细胞接种前首先将外泌体和细胞孵育过夜,使外泌体进入细胞中。)结果见图5。
[0136]
实施例6:膀胱癌细胞在小鼠体内的肝转移
[0137]
在膀胱癌细胞的肿瘤模型中,雌性胸腺缺陷型balb/c(balb/c-裸鼠)小鼠购自湖南sja实验动物有限公司,使用6周龄的雌性balb/c小鼠进行研究。对于无外泌体组,小鼠静脉注射200μl的5
×
10
6 5637shnc和shckap4的5637细胞,对于外泌体处理组,shnc和shckap4的5637细胞和带有ckap4或不带有ckap4的外泌体共同孵育12小时,然后收集细胞,制成200μl的5
×
106细胞悬液并注射到小鼠体内,之后,每2周静脉注射5637个shnc或shckap4外泌体,直到第8周。将肝脏固定在4%多聚甲醛中,并包埋在石蜡中,使用苏木精-伊红(h&e)、ki-67和ckap4染色对膀胱癌细胞的肝转移情况进行分析。结果见图6。
[0138]
实施例7:利用梯度离心法收集尿液样本中的外泌体。
[0139]
实验具体步骤如下:
[0140]
(1)收集健康人(hd)、膀胱癌(高级别hblca;低级别lblca)、术后(as)、前列腺癌(prad)、肾癌(kirc)、非尿路癌症(nblca)、膀胱良性肿物(bbl)患者的晨尿,体积在100-200ml,将尿液转移至50ml离心管,4000rpm,30min,4℃;收集并转移上清至新的50ml离心管,20000rpm,40min,4℃,收集并将转移上清至新的50ml离心管。
[0141]
(2)一次性针头式滤器0.22um 33mm过滤并收集上清。
[0142]
(3)上清分装于beckman超速离心管(55654),低温超高速离心机(beckman_l-100xp)程序设计为109000g,1h,4℃。
[0143]
(4)弃上清,用预冷的dpbs重悬沉淀,低温超高速离心机程序设计为110000g,1h,4℃。
[0144]
(5)弃上清,利用残余的液体重悬外泌体,并用预冷的200~400ul dpbs彻底收集外泌体。
[0145]
(6)将收集到的外泌体用离心浓缩仪冷冻浓缩为干粉状后,加入100ul ddh2o重新溶解。
[0146]
(7)利用western blot检测外泌体中ckap4的含量,并且以cd81作为内参。制样:取适量的外泌体加入4ul protein loading buffer后100℃金属浴10min,变性结束后立即置于冰上。待温度降至室温将样品稍稍离心。
[0147]
上样:将制好的样品加入sds-page凝胶,电泳程序为70v 35min,120v 90min。转膜程序为300ma 90min。
[0148]
(8)利用5%脱脂牛奶在室温封闭,封闭结束后将相应蛋白条带ckap4(63kda)、cd81(22-26kda)减下并用相应抗体4℃孵育过夜。
[0149]
(9)回收抗体,tbst洗三次,每次10min。室温孵育鼠抗、兔抗,1h。回收抗体,tbst洗
三次,每次10min。
[0150]
(10)ecl化学发光液覆盖膜表面,利用bio-rad伯乐chemidoc xrs 化学发光凝胶成像系统检测相应条带。
[0151]
结果见图7。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。