1.本说明书涉及用于样品制备(例如,从较大分子中分离小分子)的组合物、装置、设备、方法、试剂盒和系统。在一些实施例中,本文所述的组合物、设备、装置、系统、方法和试剂盒可以用于从样品中的如但不限于生物分子等较大分子中分离、提取、纯化、减少或去除小分子。
背景技术:
2.用于分离生物分子的样品制备技术旨在从其它样品组分并且从样品处理组分中提取生物分子,以实现对生物分子的下游分析和处理。例如,在如蛋白质或核酸等生物分子的样品制备期间,通常需要用染料、亲和标签、放射性标记物、质量标签等来标记生物分子。在其它情况下,需要对生物分子进行化学改性,如还原、氧化、交联、甲基化等。在这些处理期间,某种量的标记试剂或化学试剂以未经反应的标记物/化学品的形式或以经部分反应的中间体或衍生物的形式保留在样品中。这些未经反应的小分子可能会在下游分析或生物分子的使用期间引起一些问题。例如,未与蛋白质或核酸缀合的游离未经反应的荧光染料会在蛋白质或核酸的荧光成像期间引起背景问题。
3.另一实例是制备通常用于检测对应抗原的加标签抗体(如生物素化抗体)。基于链霉亲和素的载体与生物素化抗体一起用于抗原的检测。如果生物素化抗体的样品中存在游离未经反应的生物素,则所述游离未经反应的生物素将与链霉亲和素载体相互作用并损害生物素化抗体的结合能力。
4.用于解决从如生物分子等较大分子中去除如标记物和化学试剂等小分子的一些方法包含透析与离子交换色谱、尺寸排阻色谱的组合或脱盐树脂与离子交换树脂的组合。然而,这些方法中的每个方法都有几个缺点。
5.例如,透析通常用于从蛋白质中去除未经反应的染料、生物素和还原剂。然而,透析进行两次到三次缓冲液更换,并且花费十二小时到十四小时来去除小分子。
6.尺寸排阻色谱是用于去除小分子的另一种方法。此程序需要复杂且昂贵的色谱仪器(如通用电气公司(ge)的akta系统)。在这些复杂的色谱系统中,含有小分子的样品穿过特定的柱,所述柱是针对特定目的和样品类型定制和设置的。通常,根据样品尺寸设置定制化的1ml、5ml、10ml或更大的柱。首先由柱排阻如抗体缀合物等较大生物分子,之后排阻穿过孔的较小分子。因此,小分子需要更多时间从柱中洗脱出。用于执行尺寸排阻色谱的时间可以从三十分钟到几小时不等,这取决于柱尺寸、设置时间等。因此,尺寸排阻色谱方法既昂贵又耗时。
7.又其它程序使用脱盐树脂,在这种情况下使用各种树脂来进行缓冲液交换和脱盐。然而,脱盐树脂去除如染料、标记物和缀合物等小分子的能力非常有限(还如本说明书的后面部分所示)。
8.已使用了离子交换树脂与脱盐树脂或透析的组合来分离小分子,其中树脂上的离子交换剂与小分子相互作用。然而,除了上面列出的基于透析和脱盐树脂的方法的缺点之
外,离子交换树脂的蛋白质回收很差,因为蛋白质必须从离子交换剂中洗脱出。用于蛋白质洗脱的离子交换方法需要多个步骤,所述多个步骤当与对透析或脱盐树脂的额外需求组合时使处理既耗时又乏味。
9.因此,需要用于从与如游离染料、标记物、还原剂、交联剂等小分子中分离较大生物分子或较大分子的更好方法、组合物、系统和设备,这将在如但不限于荧光成像、生物缀合、免疫沉淀等方法中实现对生物分子的更清洁的下游处理。
技术实现要素:
10.在一些实施例中,本说明书涉及用于样品制备,如但不限于从样品中的较大分子(如但不限于生物分子)中分离小分子,的组合物、设备、装置、方法、试剂盒和系统。在一些实施例中,本文所述的组合物、设备、装置、系统、方法和试剂盒可以用于分离、提取、纯化、消除、减少小分子的量或从样品中的较大分子中去除小分子。在一些实施例中,本文所述的组合物、设备、装置、系统、方法和试剂盒使小分子的量从样品中的生物分子或较大分子中显著减少。在一些实施例中,本文所述的组合物、设备、装置、系统、方法和试剂盒使小分子的量从样品中的生物分子或较大分子中快速增加。术语生物分子或较大分子在本说明书中可互换使用。术语较大仅与要去除的小分子相关,并不将生物分子指定或限制为任何特定尺寸或尺寸范围。
11.可以通过本公开的组合物、设备、装置、系统、方法和试剂盒分离、提取、减少或去除的一种或多种小分子的一些实例包含但不限于染料、染料的衍生物、生物素、生物素衍生物、交联剂、还原剂、氧化剂、甲基化剂、蛋白质防腐剂、标记物、纳米颗粒、放射性配体、质量标签、未经反应的分子以及其组合、中间体和衍生物。
12.适于使用的染料是本领域的技术人员已知的并且包含但不限于芘、香豆素、花青、苯并呋喃、喹啉、喹唑啉酮、吲哚、苯并唑、硼聚吖吲得辛(borapolyazaindacene)以及包含荧光素、罗丹明和螺环蒽的氧杂蒽以及richard p.haugland,“荧光探针和研究化学品的分子探针手册(molecular probes handbook of fluorescent probes and research chemicals)”(第11版,2010年1月)中描述的其它染料,所述文献通过引用以其整体并入。
13.在一些实施例中,可以通过本公开的组合物、设备、装置、系统、方法和试剂盒分离的小分子的分子量范围为《2000da。
14.可以通过本公开的组合物、设备、装置、系统、方法和试剂盒从小分子中分离的示例性较大分子包含但不限于蛋白质、糖蛋白、抗体、肽、核酸(dna、基因组dna、pdna、rna)、多糖、碳水化合物、脂质、毒素、纳米颗粒和以上列出的分子中的每种分子的衍生物。分子的衍生物包含但不限于:加标签的蛋白质或加标签的核酸;标记有多种标记物的所标记分子,如但不限于染料、荧光染料、放射性标记物、亲和标记物、质量标记物、金属等;所缀合分子,包含所缀合抗体;与纳米颗粒缀合的分子,例如金纳米颗粒;与如生物素标记的毒素等毒素缀合的分子在非限制性实例中通过霍乱毒素标记的化合物等例示;化学衍生物,如但不限于还原蛋白质、氧化蛋白质、甲基化核酸、具有巯基改性蛋白的蛋白质等生物分子。在一些实施例中,在样品中可以包含较大分子和生物分子。
15.本公开的一个实施例涉及用于从样品中分离或提取一种或多种小分子的组合物。在一些实施例中,组合物包括(至少一种)尺寸排阻载体和能与一种或多种小分子缔合,由
此从样品的其余部分中分离小分子的至少一种部分。
16.在一些实施例中,使样品与本公开的组合物接触使一种或多种小分子的量从样品中显著减少。
17.样品中存在的较大分子被本公开的组合物尺寸排阻。一种或多种小分子通过至少一种部分与组合物保持缔合。
18.在一些实施例中,使样品与本公开的组合物接触包括但不限于以下中的一个或多个:将样品施加到所述组合物上,使所述样品穿过组合物,通过重力或通过使用旋转或离心力允许样品流动穿过组合物,产生正压差或负压差以使样品移动穿过组合物。
19.在一些实施例中,在本公开的组合物中,至少一种部分与尺寸排阻载体缔合。在一些实施例中,在本公开的组合物中,至少一种部分被固定到尺寸排阻载体上。在一些实施例中,在本公开的组合物中,至少一种部分与尺寸排阻载体连接。
20.在一些实施例中,所述至少一种部分通过电荷相互作用、亲水相互作用、疏水相互作用、亲和相互作用、氢键合、范德华力(van der waals force)或共价键合与一种或多种小分子缔合。
21.在一些实施例中,本公开的组合物可以包括至少两种部分、或至少三种部分或至少四种部分、或至少五种部分等。
22.在一些实施例中,本公开的组合物中使用的尺寸排阻载体从样品中排阻等于2kda或大于2kda的分子。在一些实施例中,本公开的组合物中使用的尺寸排阻载体从样品中排阻等于或大于3kda的分子。
23.在一些实施例中,本公开的组合物可以包括多于一种尺寸排阻载体。例如,组合物可以包括至少第二尺寸排阻载体和至少第二部分。在一些实施例中,本公开的组合物可以进一步包括第三尺寸排阻载体、第四尺寸排阻载体、第五尺寸排阻载体等。
24.每种排阻载体可以与相同或不同的部分缔合。例如,在一些实施例中,第一尺寸排阻载体可以与如第一部分、第二部分、第三部分、第四部分、第五部分等一种或多种部分缔合。在其它示例实施例中,第一尺寸排阻载体可以缔合第一部分,第二尺寸排阻载体可以缔合第二部分,第三尺寸排阻载体可以缔合第三部分,第四尺寸排阻载体可以缔合第四部分,并且第五尺寸排阻载体可以缔合第五部分。还设想了其它组合。
25.在一些实施例中,本公开的组合物可以包括不同比率的尺寸排阻载体和部分的多种组合。例如,组合物可以包括一定比率的第一尺寸排阻载体和至少第一部分以及一种或多种额外部分或一种或多种额外尺寸排阻载体和部分。在另一实例中,组合物可以包括一定比率的第一尺寸排阻载体和第一部分以及至少第二尺寸排阻载体和至少第二部分。
26.本公开的组合物还可以包括排阻载体与部分的共混物,例如,第一尺寸排阻载体与第一部分以及第二尺寸排阻载体与第二部分的共混物等,或者甚至第一尺寸排阻载体与第一部分、第二部分(和第三部分等)的共混物。设想了包括一种或多种尺寸排阻载体与一种或多种部分的各种组合的组合物。
27.在一些实施例中,本公开的组合物的一种或多种部分可以包括多糖、右旋糖酐、聚乙二醇聚合物、含胺聚合物、聚氨基酸、抗生素、螯合基、磁性颗粒、顺磁性颗粒、官能团、离子交换剂和其组合。
28.在一些实施例中,本公开的组合物的含胺聚合物为聚(乙二醇)二胺、聚乙二胺、线
性的聚乙亚胺或支化的聚乙亚胺。在一些实施例中,线性的聚乙亚胺为二乙二胺。
29.在本公开的组合物的一些实施例中,至少一种部分为右旋糖酐。可以使用多种右旋糖酐。在一些实施例中,本公开的组合物中使用的右旋糖酐的分子量在约6kda-2800kda的范围内。在一些实施例中,本公开的组合物中使用的右旋糖酐的分子量在约1500kda-2800kda的范围内。
30.在一些实施例中,本公开的组合物中使用的部分为离子交换剂。所述离子交换剂为阴离子交换剂或阳离子交换剂。离子交换剂的非限制性实例包含带负电的羟基和带正电的戊胺基、二胺、亚胺基。
31.在一些实施例中,本公开的组合物中使用的部分为如聚赖氨酸、聚组氨酸和/或聚谷氨酸等聚氨基酸。
32.在一些非限制性示例性实施例中,本公开的组合物可以包括:第一尺寸排阻载体与第一部分缔合,所述第一部分例如包括含胺聚合物(例如聚乙二醇二胺);并且第二尺寸排阻载体与第二部分缔合,所述第二部分例如包括右旋糖酐。
33.在一些其它非限制性示例性实施例中,本公开的组合物可以包括:第一尺寸排阻载体与第一部分缔合,所述第一部分包括例如聚(乙二醇)二胺、聚乙二胺、线性的聚乙亚胺或支化的聚乙亚胺;并且第二尺寸排阻载体与第二部分缔合,所述第二部分例如包括右旋糖酐。
34.在一些其它非限制性示例性实施例中,本公开的组合物可以包括:与第一部分缔合的至少第一尺寸排阻载体,所述第一部分包括聚(乙二醇)二胺;并且所述第一尺寸排阻载体或第二尺寸排阻载体与第二部分缔合,所述第二部分包含右旋糖酐。
35.在一些其它非限制性示例性实施例中,本公开的组合物可以包括:第一尺寸排阻载体与第一部分缔合,所述第一部分包括n,n二乙基乙二胺;并且第二尺寸排阻载体与第二部分缔合,所述第二部分例如包括右旋糖酐。
36.在一些非限制性示例性实施例中,本公开的组合物可以包括:第一尺寸排阻载体与第一部分缔合,所述第一部分例如包括含胺聚合物;并且第二尺寸排阻载体与第二部分缔合,所述第二部分例如包括聚乙二醇聚合物。
37.如本文所述的组合物包含在本公开的装置、设备、系统和试剂盒中,并且用于本公开的一种或多种方法中,所述方法在下文章节中另外详细地描述。
38.在一些实施例中,本公开提供了一种用于从样品中分离、去除或提取一种或多种小分子的设备和/或装置,所述设备和/或装置包括:a)容器,所述容器包括:至少一种尺寸排阻载体和能与所述一种或多种小分子缔合的至少一种部分;以及b)定位在所述容器下方的接受器。
39.在一些实施例中,本公开提供了一种用于从样品中分离、去除或提取一种或多种小分子的系统,所述系统包括:a)容器,所述容器包括:尺寸排阻载体和能与所述一种或多种小分子缔合的至少一种部分;以及b)定位在所述容器下方的接受器。本公开的系统被配置成具有施加到容器中的样品的力,如但不限于真空、重力、负压或正压。在一些实施例中,本公开的系统包括向接受器和容器的组合施加如但不限于真空、重力、负压或正压的力的器具。
40.在本公开的装置、设备或系统的一些实施例中,所述接受器与柱连接。在一些实施
例中,所述接受器可从所述柱上拆卸。接受器的内容物可以由用户去除。所述装置的接受器收集具有显著减少的小分子的样品。本公开的设备、装置或系统可操作为在单个步骤中从样品中分离、减少或去除一种或多种小分子。本公开的装置、设备或系统可操作为具有施加到容器中的样品的力,如但不限于真空、重力、负压或正压。
41.在本公开的装置、设备或系统的一些实施例中,被可操作地配置成经受重力流、离心力、正压、负压、真空和其组合。
42.在本公开的装置、设备或系统的一些实施例中,所述容器为柱状容器、管、多孔管、多孔板或多孔过滤板。示例性容器包含但不限于旋转柱、多孔板、多孔过滤板、微孔板、微孔过滤板。
43.在实施例中,本公开的系统、设备和装置包括容器,所述容器包括如上文和下文的部分中所述的本公开的一种或多种组合物。
44.在一些实施例中,本公开描述了一种用于从一种或多种小分子中分离生物分子的试剂盒,所述试剂盒包括:装置,所述装置包括:a)容器,所述容器包括:尺寸排阻树脂和能与所述至少一种小分子缔合并捕获所述小分子的至少一种部分;以及b)定位在所述容器下方的接受器,其中所述装置被可操作地配置成经受重力流、离心力、正压、负压、真空和其组合。
45.本公开的试剂盒可以包括本文所述的一种或多种组合物、一个或多个装置、设备和/或系统。在一些实施例中,本公开的试剂盒包括能与一种或多种小分子缔合的至少两种或更多种部分。
46.在本公开的试剂盒的一些实施例中,所述装置为旋转柱、多孔过滤板或多孔板。试剂盒可以进一步包括包装在一个或多个单独容器中或包含在第一容器中的一种或多种缓冲液。
47.在一些实施例中,本公开描述了一种用于从一种或多种小分子中分离生物分子的方法,所述方法包括:a)将样品施加到容器,所述容器包括尺寸排阻载体和能与至少一种小分子结合的至少一种部分;以及b)使所述容器经受重力流、离心力、正压、负压、真空或其组合,其中通过所述尺寸排阻载体排阻所述样品中的所述生物分子并且以流过液的形式收集所述生物分子,并且其中所述至少一种小分子与所述至少一种部分缔合并由此从所述样品中分离。
48.在本公开的方法的一些实施例中,在一个步骤中执行从所述样品的其余部分中分离至少一种小分子。在本公开的方法的一些实施例中,将流过液收集在定位在所述容器下方的接受器中。
49.本公开的方法、组合物、试剂盒、装置、设备和系统有利地提供了小分子的优异分离并且另外减少了与从样品中的较大生物分子中分离小分子相关的时间和费用。如本文所述分离的较大生物分子适合于更好地进行下游处理。尽管上文已经公开了具体优点,但是应当理解,各个实施例可以包含先前公开的优点中的所有优点、一些优点或不包含所述优点。鉴于本公开的教导,其它技术优势对于本领域的技术人员而言可能变得显而易见。
50.本教导的这些和其它特征将从以下各节的详细描述中变得更加明显。
附图说明
51.参考下面的一个或多个附图可以更好地理解本公开的一个或多个实施例。本领域技术人员将理解,以下描述的附图仅用于说明目的。附图不旨在以任何方式限制本教导的范围。
52.图1a描绘了根据本公开的一个实施例的与部分缔合以形成示例性组合物的尺寸排阻载体的示意图;
53.图1b描绘了根据本公开的一个实施例的与一种或多种小分子缔合的本公开的组合物的示意图;
54.图2a描绘了根据本公开的一个实施例的本公开的非限制性示例性组合物的示意图;
55.图2b描绘了根据本公开的一个实施例的本公开的非限制性示例性组合物的示意图;
56.图2c描绘了根据本公开的一个实施例的本公开的非限制性示例性组合物的示意图;
57.图2d描绘了根据本公开的一个实施例的本公开的非限制性示例性组合物的示意图;
58.图2e描绘了根据本公开的一个实施例的本公开的非限制性示例性组合物的示意图;
59.图2f描绘了根据本公开的一个实施例的本公开的非限制性示例性组合物的示意图;
60.图3描绘了根据本公开的一个实施例的示例性设备/装置的三维(3-d)视图;
61.图4a和4b描绘了根据本公开的一个实施例的示例性设备/装置的三维(3-d)视图;
62.图5描绘了使用根据本公开的一个实施例的组合物、装置、试剂盒和方法去除示例性小分子,即游离染料;
63.图6描绘了使用根据本公开的一个实施例的组合物、装置、试剂盒和方法去除示例性小分子,即游离染料;
64.图7描绘了使用根据本公开的一个实施例的组合物、装置、试剂盒和方法去除示例性小分子,即还原剂;
65.图8描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子,即游离染料;
66.图9描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子,即游离染料;
67.图10描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子,即游离染料;
68.图11描绘了根据本公开的一个实施例使用经共混的组合物、装置、试剂盒和方法去除示例性小分子,即游离染料;
69.图12描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子,即两种示例性游离染料;
70.图13描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方
法去除示例性小分子还原剂并进行对应蛋白质回收;
71.图14描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子,即游离生物素并进行对应蛋白质回收;
72.图15描绘了根据本公开的一个实施例的图13的使用经共混的组合物、装置、试剂盒和方法去除示例性小分子,即游离染料alexa fluor
tm
555并进行对应蛋白质回收的定量数据;
73.图16描绘了根据本公开的一个实施例的图12的使用经共混的组合物、装置、试剂盒和方法去除示例性小分子,即游离染料荧光素并进行蛋白质回收的定量数据;
74.图17描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子,即bs3——双(磺基琥珀酰亚胺基)硫酸氢盐并进行蛋白质回收;
75.图18描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子,即smcc(4-(n马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯)并进行蛋白质回收;
76.图19描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子,即dtt(二硫苏糖醇)并进行蛋白质回收;
77.图20a和图20b描绘了使用根据本公开的一个实施例的组合物、装置、试剂盒和/或方法去除示例性小分子,即游离染料alexa fluor
tm
647并进行蛋白质回收与通过出售的用于类似用途的其它现有产品去除小分子并进行蛋白质回收的比较;
78.图21描绘了使用根据本公开的一个实施例的组合物、装置、试剂盒和/或方法去除示例性小分子,即生物素并进行蛋白质回收与通过出售的用于类似用途的其它现有产品去除小分子并进行蛋白质回收的比较;
79.图22描绘了使用根据本公开的一个实施例的组合物、装置、试剂盒和方法去除示例性小分子,即还原剂tcep与通过出售的用于类似用途的其它现有产品去除还原剂的比较;
80.图23描绘了使用根据本公开的一个实施例的组合物、旋转柱装置、试剂盒和方法去除示例性小分子,即游离染料alexa fluor
tm
647染料并进行蛋白质回与使用现有透析方法去除游离alexa fluor
tm
647染料的比较;
81.图24描绘了使用根据本公开的一个实施例的组合物、装置、试剂盒和方法去除示例性小分子,即生物素并进行蛋白质回收与用于去除生物素的现有透析方法的比较;
82.图25描绘了使用根据本公开的一个实施例的组合物、旋转板装置、试剂盒和方法去除示例性小分子,即游离染料alexa fluor
tm
647并进行蛋白质回收;
83.图26描绘了使用根据本公开的一个实施例的组合物、旋转柱装置、试剂盒和方法去除示例性小分子,即游离染料荧光素染料并进行蛋白质回收;
84.图27a和图27b描绘了用多克隆抗体-alexa fluor
tm
647缀合物染色的示例性细胞的免疫荧光图像,并且示出了通过使用包括本公开的组合物的旋转柱进行清洁去除过量的游离染料alexa fluor
tm
647(图27b)与未进行清洁(通过不使用本公开的旋转柱)的相同细胞的免疫荧光图像(图27a)的比较;
85.图28a、图28b和图28c描绘了用使用alexa fluor
tm
647标记的多克隆抗体染色的示例性细胞的免疫荧光图像,并且示出了通过使用包括本公开的组合物的旋转柱进行清洁去
除过量的游离染料alexa fluor
tm
647(图28c)与不进行清洁(通过不使用本公开的旋转柱)的相同细胞的免疫荧光图像(图28a)的比较;以及另外的与通过使用具有现有产品ge pd10的旋转柱进行清洁的相同细胞的免疫荧光图像(图28b)的比较;
86.图29a和图29b描绘了用利用alexa fluor
tm
488标记的单克隆抗体染色的示例性细胞的免疫荧光图像,并且示出了通过具有本公开的组合物的旋转柱去除过量的游离染料alexa fluor
tm
488(图29b)与不进行清洁(通过不使用本公开的旋转柱)的相同细胞的免疫荧光图像(图29a)的比较;
87.图30a和图30b描绘了根据一个实施例的本公开(roomba)与离子交换树脂(dowex)的蛋白质回收和染料去除组合物、装置和方法的比较;并且
88.图31a和图31b描绘了根据一个实施例的本公开(roomba)与离子交换树脂(dowex)的蛋白质回收和染料去除组合物、装置和方法的比较。
具体实施方式
89.应当理解,前面的一般性描述和下面的详细描述仅是示范性和说明性的,并不旨在限制当前教导的范围。在本技术中,除非另外特别说明,否则单数的使用包含复数。例如,除非上下文另有规定,否则说明书中使用的单数形式“一个(a)”,“一种(an)”和“所述(the)”也包括复数方面。类似地,除非上下文另有规定,否则在说明书中使用的任何单数术语也意味着复数,反之亦然。
90.此外,“包括”、“含有”和“包含”的使用或这些词根的修正,例如但不限于“包括(comprises)”、“含有(contained)”和“包含(including)”,并不旨在是限制性的。除非另有说明,否则使用“或”是指“和/或”。术语“和/或”是指之前和之后的术语可以一起使用或分开使用。为了说明,但不是作为限制,“x和/或y”可以意指“x”或“y”或“x和y”。
91.每当在本文中提供值的范围,该范围意在包括起始值和终止值以及其间的任何值或值范围,除非另外具体说明。例如,“0.2到0.5”是指0.2、0.3、0.4、0.5;其间的范围,如0.2-0.3、0.3-0.4、0.2-0.4;其间的增量,如0.25、0.35、0.225、0.335、0.49;其间的增量范围,如0.26-0.39;等等。
92.本文所用的术语“或其组合”是指该术语之前所列项目的所有排列和组合。例如,“a、b、c或其组合”旨在包含以下中的至少一个:a、b、c、ab、ac、bc或abc,并且如果在特定上下文中顺序是重要的,则还包含ba、ca、cb、acb、cba、bca、bac或cab。继续此实例,明确地包含的是含有一个或多个项或术语的重复的组合,如bb、aaa、aab、bbc、aaabcccc、cbbaaa、cababb等。本领域技术人员将理解,通常不限制任何组合中的项目或术语的数量,除非另外从上下文显而易见。
93.术语“分离(separation)”、“提取(extraction)”、“提取(extracted)”、“去除(removal)”、“减少(reducing)”或“减少量(reducing the quantity of)”或“纯化(purification)”均指从混合物(如细胞组分等几种组分的混合物或样品中的小分子和/或生物分子和/或较大分子所包含的材料)中去除或分离物质(例如,如标记物或化学试剂等小分子,或如dna、rna、蛋白质等较大分子或生物分子)的动作或过程。所提取的物质或已经从中提取物质的样品具有其所存在的显著减少数量的组分,并且与提取之前相比可以是基本上减少的、基本上去除的、基本上纯的或纯的(无任何污染物)或是浓缩的或基本上浓缩
的。
94.术语“小分子”总体上是指小于大分子(如但不限于生物分子)的用于对较大分子进行处理、衍生化、缀合、交联、标记、加标签或化学或生物改性以供进一步分析的分子。包含蛋白质、糖蛋白、抗体、核酸(dna、基因组dna、pdna、rna)、多糖、碳水化合物、脂质的较大分子和/或生物分子以及如毒素、纳米颗粒等一些其它较大分子通常是在额外分析或使用之前通过各种处理进行衍生化的。衍生化包含用如染料、亲和标签、放射性标记物、质量标签、金属等标记物对分子进行标记。衍生化还包含通过还原、氧化、甲基化、生物改性或生化改性生物分子等对分子进行化学改性。生物分子的衍生物包含但不限于:加标签的蛋白质或核酸;用各种标记物标记的所标记生物分子,如但不限于染料、荧光染料、放射性标记物、亲和标记物、质量标签、金属等;所缀合生物分子,包含所缀合抗体;与纳米颗粒缀合的生物分子;金属,如与纳米颗粒缀合的金;染料或标记物,如与毒素缀合的生物素;化学衍生物,如但不限于还原蛋白质、氧化蛋白质、甲基化核酸、具有巯基改性蛋白的蛋白质等生物分子。
95.衍生方法通常会在样品中留下“小分子”副产物,如但不限于未经反应的游离标记物、经部分反应的标记物、包含游离染料的未经反应的游离标记物的衍生物、染料的衍生物、游离放射性配体、放射性配体的中间体、游离质量标签、游离金属、生物素、生物素衍生物、交联剂和其衍生物、过量还原剂或其衍生物、未经反应的纳米颗粒、其它未经反应的、经部分反应的或中间分子以及其组合、中间体和衍生物。由于这些未经反应的小分子会在下游分析或使用较大分子期间引起几种问题,因此需要在样品制备期间从较大分子和其衍生物中分离、提取、去除或减少“小分子”的量。在一些实施例中,可被本公开的组合物、装置、设备、系统、试剂盒和方法分离、提取或去除的小分子通常《2kda。
96.术语“载体”是指惰性有孔固体。术语“尺寸排阻载体”描述了具有一定孔隙度的惰性有孔固体,所述孔隙度决定了可以被包含或被排阻进入孔的分子的尺寸。在一些实施例中,尺寸排阻载体的孔径等于2kda。在一些实施例中,本公开的尺寸排阻载体的孔的分子尺寸截止值为2kda,并且因此被排阻的分子是2kda或大于2kda的那些。在一些实施例中,尺寸排阻载体的孔径》2kda。在一些实施例中,本公开的尺寸排阻载体的孔的分子尺寸截止值为约》2kda,并且因此被排阻的分子是高于2kda的那些。在一个实施例中,尺寸排阻柱的孔径对于从孔分子中排阻的分子尺寸截止尺寸为约2kda到约150kda、约5kda到约150kda,包含介于两者之间的范围,如但不限于2kda、3kda、5kda、7kda、10kda、15kda、20kda、30kda、40kda、50kda、60kda、70kda、80kda、90kda、100kda、110kda、120kda、130kda、140kda和150kda。在一些实施例中,可以排阻的蛋白质的尺寸没有上限,并且还设想通过本公开的组合物、装置、系统、试剂盒和方法从小分子杂质或污染物中分离兆道尔顿尺寸的分子。
97.本文使用的章节标题仅用于组织目的,并且不应解释为以任何方式限制所描述的主题。本技术中引用的所有文献和类似材料,包括但不限于专利、专利申请、文章、书籍、论文和互联网网页,无论这些文献和类似材料的形式如何,均出于任何目的明确地通过引用整体并入本文。在所并入的文献和类似材料中的一个或多个以与本技术中的术语的定义相矛盾的方式定义或使用该术语的情况下,以本技术为准。虽然结合各个实施例对本发明教导进行了描述,但是本发明教导不旨在受限于此类实施例。相反,本教导涵盖各种替代、修改和等同物,如本领域技术人员根据本教导将理解的。
98.组合物:
99.本公开的一个实施例描述了用于从较大生物分子中分离、提取、去除和/或减少一种或多种小分子的量的组合物。本发明组合物包括尺寸排阻载体和可以与一个或多个小分子缔合,由此从样品中存在的其它组分(如较大生物分子)中分离小分子的至少一种部分。
100.尺寸排阻载体通常包括由凝胶或具有孔的凝胶状材料制成的球形珠。一些示例性尺寸排阻载体是由右旋糖酐聚合物、琼脂糖、聚丙烯酰胺、纤维素材料和其衍生物制成的。尺寸排阻载体的孔径范围决定了可以被包含或被排阻进入尺寸排阻载体的分子的尺寸。
101.在将样品溶液施加在尺寸排阻载体上时,所述样品溶液沿载体向下行进,并且较小样品组分进入到孔中。大于孔径的样品组分不能进入到孔中。因此,较大样品组分被排阻并比截留在孔中的较小组分更快从尺寸排阻柱中洗脱出。
102.本发明组合物包括至少一种尺寸排阻载体和可以与一个或多个小分子缔合的至少一种部分的组合。因此,本发明组合物通过尺寸排阻、尺寸包含的组合以及通过小分子到至少一种部分上的缔合的分离来提供从样品的较大生物分子中分离小分子。发明人已经发现,本发明组合物提供了小分子与较大生物分子的意想不到地快速的、经济且高效的分离。
103.在一些实施例中,本公开的组合物包括与至少一种尺寸排阻载体缔合的至少一种部分。在一些实施例中,本公开的组合物包括被固定到至少一种尺寸排阻载体上的至少一种部分。
104.图1a描绘了根据本公开的一个实施例的与部分20缔合以形成示例性组合物30的示例性尺寸排阻载体10的示意图。图1b描绘了根据本公开的一个实施例的与一种或多种小分子40缔合以形成复合物50的本公开的组合物30的示意图。
105.图2a描绘了根据本公开的一个实施例的包括与部分20'缔合的示例性尺寸排阻载体10'的本公开的另一非限制性示例性组合物30'的示意图。图2b描绘了根据本公开的一个实施例的包括与部分20”缔合的示例性尺寸排阻载体10'的本公开的又另一非限制性示例性组合物30”。这些附图是用于说明一些可能组合物的非限制性示例性组合物。根据本文的描述和附图,本领域的技术人员将认识到本公开设想了组合物的若干其它组合。
106.在一些实施例中,固定是通过形成共价键进行的,如但不限于形成键,如酰胺键、烷基化、胺化、酰胺化、共价胺形成键或共价胺在尺寸排阻载体与部分之间形成键。在一些实施例中,尺寸排阻载体包括右旋糖酐聚合物、琼脂糖、聚丙烯酰胺、纤维素材料和其衍生物。在一些实施例中,尺寸排阻载体包括羟乙基纤维素。在一示例性固定中,根据本公开,羟乙基纤维素可被高碘酸盐氧化以产生醛基。这些所产生的醛基可以与示例性部分(如但不限于戊胺(其可以用作间隔分子)或聚(乙二醇)二胺)上的末端胺反应以形成席夫碱中间体(schiff base intermediate)。不稳定的席夫碱相互作用通过使用如氰基硼氢化钠等化学品进行还原以形成仲胺键而在化学上稳定化。
107.在一些实施例中,尺寸排阻载体的孔径等于2kda或》2kda。在这些示例性组合物中,从孔中排阻的分子是2kda的那些或2kda以上的那些。2kda或高于2kda的生物分子从这些组合物中洗脱出。在一些示例性实施例中,尺寸排阻载体的孔径为约》2kda到约50kda、》2kda到约75kda、》2kda到约100kda、》2kda到约150kda、》2kda到约200kda。在一些实施例中,尺寸排阻载体的孔径为约7000da到约50,000da。在一些实施例中,可以排阻的蛋白质的尺寸没有上限,并且还设想通过本公开的组合物、装置、系统、试剂盒和方法从小分子杂质或
污染物中分离兆道尔顿尺寸分子和较大。
108.在一些实施例中,本公开的组合物(当与样品接触时)使一种或多种小分子的量从样品中显著减少。在一些实施例中,使样品与本公开的组合物接触包括但不限于以下中的一个或多个:将样品施加到所述组合物上,使所述样品穿过组合物,通过重力或通过使用旋转或离心力允许样品流动穿过组合物,产生压差以使样品移动穿过组合物。
109.在一些实施例中,所述至少一种部分通过电荷相互作用、亲水相互作用、疏水相互作用、亲和相互作用、氢键合、范德华力或共价键合与一种或多种小分子缔合。
110.在一些实施例中,本公开的组合物可以包括至少两种部分、或至少三种部分或至少四种部分、或至少五种部分等。图2c描绘了根据本公开的一个实施例的包括与至少两种部分20'和20”缔合的示例性尺寸排阻载体10'的本公开的非限制性示例性组合物30”'的示意图。这些附图是用于说明不同数量的部分的一些可能组合的非限制性示例性组合物。鉴于本文的描述和附图,本领域的技术人员认识到本公开设想了组合物的若干其它组合,并且图示不限制本文教导的范围。
111.在一些实施例中,尺寸排阻树脂从样品中排阻等于2kda的分子。在一些实施例中,尺寸排阻树脂从样品中排阻》2kda的分子。在一些实施例中,尺寸排阻树脂从样品中排阻》3kda的分子。在一些实施例中,尺寸排阻树脂从样品中排阻》5kda的分子。
112.在一些实施例中,本公开的组合物可以进一步包括至少第二尺寸排阻载体。在一些实施例中,本公开的组合物可以进一步包括第三尺寸排阻载体、第四尺寸排阻载体、第五尺寸排阻载体等。在一些实施例中,本公开的组合物可以进一步包括和至少第二部分、至少第三部分、第四部分、第五部分等。一种尺寸排阻载体可以包括一种或多种不同类型的部分。可替代地,不同的尺寸排阻载体可以包括同一部分或不同类型的部分。
113.在一些实施例中,本公开的组合物包括不同比率的一种或多种尺寸排阻载体与如本文所述的一种或多种部分的各个组合。例如,本公开的组合物包括不同比率的第一尺寸排阻载体与至少第一部分以及第二尺寸排阻载体与至少第二部分。本公开的另一示例性组合物包括不同比率的第一尺寸排阻载体与至少第一部分以及第一尺寸排阻载体与至少第二部分。本公开的又另一示例性组合物包括不同比率的第一尺寸排阻载体与至少第一部分以及第一尺寸排阻载体与至少第一部分和第二部分(以及第三部分等)。设想了可以通过将样品施加到单个组合物上来促进从样品中存在的一种或多种生物分子中分离或去除或一种或多种小分子的组合物。
114.图2d描绘了包括比率为n:n的组合物30'与30”的共混物的非限制性示例性组合物的示意图(其中每个n可以独立地为1-9的数字,例如1:1、2:1、3:4、1:5等的比率)。图2e描绘了包括比率为n:n的组合物30”'和30'的共混物的另一种非限制性示例性组合物的示意图(其中每个n可以独立地为1-9的数字)。图2f描绘了包括比率为n:n的组合物30”与30”'的共混物的又另一种非限制性示例性组合物的示意图(其中每个n可以独立地为1-9的数字)。这些附图是用于说明一些可能组合物的非限制性示例性组合物。鉴于本文的描述和附图,本领域的技术人员将认识到本公开设想了组合物的几种其它共混物和组合物的组合。
115.在一些实施例中,本公开的组合物的一种或多种部分可以包括多糖、聚乙二醇聚合物、含胺聚合物、聚氨基酸、抗生素、螯合基、磁性颗粒、顺磁性颗粒、官能团、离子交换剂和其组合。
116.可以用于本公开的组合物的示例性含胺聚合物包含但不限于聚(乙二醇)二胺、聚乙二胺、线性的聚乙亚胺或支化的聚乙亚胺。线性的示例性聚乙亚胺为二乙二胺。
117.在本公开的一些示例性组合物中,一种或多种多糖部分可以为一种或多种右旋糖酐。可以使用多种右旋糖酐。在一些实施例中,本公开的组合物中使用的右旋糖酐的分子量在约6kda-2800kda的范围内。在一些实施例中,本公开的组合物中使用的右旋糖酐的分子量在约1500kda-2800kda的范围内。
118.在一些实施例中,本公开的组合物中使用的部分为离子交换剂,如阳离子交换剂或阴离子交换剂。阴离子交换剂部分可以与带负电荷的小分子结合,并且留下带正电的样品组分。阳离子交换剂可以与带正电荷的小分子结合并留下带负电的样品组分。离子交换剂的非限制性实例包含带负电的羟基、带正电的戊胺基、二胺和亚胺基。
119.在本公开的一些示例性组合物中,一种或多种聚氨基酸部分可以为聚赖氨酸、聚组氨酸、聚谷氨酰胺、聚天冬酰胺等。在一些实施例中,聚氨基酸部分可以将内毒素从其它较大生物分子中去除或分离。
120.在一些实施例中,尺寸排阻载体或部分可以包含反应性官能团。尺寸排阻载体上的官能团可以用于与一种或多种部分相互作用并缔合以形成组合物。部分上的官能团可以用于与要从较大生物分子中分离或提取的一种或多种小分子相互作用并缔合。官能团可以包括但不限于羟基、羧基、氨基、硫醇、醛、卤素、硝基、氰基、胺基、脲、碳酸酯、氨基甲酸酯、异氰酸酯、砜、磺酸酯、磺酰胺、亚砜等用于与部分或小分子缔合或相互作用的基团。
121.在另一实施例中,官能团包含由表示反应性官能部分的r
x
或表示通过共价键l与尺寸排阻载体或部分连接的反应性官能部分r
x
的(-l-r
x
)表示的至少一种反应性基团。所述反应性基团充当与部分或小分子缔合、连接和/或相互作用的位点,其中反应性基团与固体载体上的适当反应性基团或官能团、部分或小分子化学反应。在示例性实施例中,反应性基团或官能团可以为丙烯酰胺、羧酸的活化酯、酰基卤基、酰基叠氮、酰基腈、醛、烷基卤、酸酐、苯胺、芳基卤、叠氮、氮丙啶、硼酸酯、硫代硼酸基(thioboronate group)、羧酸、重氮烷、卤代乙酰胺、卤代三嗪、肼、酰肼、亚氨基酯、异氰酸酯、异硫氰酸酯、马来酰亚胺、亚磷酰胺、磺酰基卤、硫醇基、硫化物基、二硫化物基、环氧基、环硫基、硫酯基、醇基、活化醇基、磷酸基、磷酸酯基和可光活化的基团。
122.在另一示例性实施例中,反应性基团或官能团可以包括亲电体和/或亲核体,并且在一些实施例中可以在其之间产生共价键。示例性亲电体和亲核体官能团可以包含活化酯,通常具有式
–
coω,其中ω为合适的离去基团(例如,琥珀酰亚胺基氧基(
–
oc4h4o2)、磺基琥珀酰亚胺基氧基(
–
oc4h3o
2-so3h)、-1-苯并三唑基氧基(-oc6h n3);或被如硝基、氟基、氯基、氰基或三氟甲基或其组合等拉电子取代基取代一次或多次的用于形成活化芳基酯的芳基氧基(aryloxy group)或芳基氧基(aryloxy);或被碳二亚胺活化以形成酸酐或经混合的酸酐-ocora或-ocnranhrb的羧酸,其中ra和rb(其可以相同或不同)为c
1-c6烷基、crc6全氟烷基或c
1-c6烷氧基;或环己基、3-二甲基氨基丙基、酰基卤基、酰基腈、醛、烷基卤、酸酐、芳基卤、氮丙啶、重氮烷、卤代乙酰胺、卤代三嗪、异氰酸酯、异硫氰酸酯、马来酰亚胺、亚磷酰胺、磺酰基卤、硫醇基、二硫化物基、环氧基和环硫基、硫酯基、活化醇基、磷酸基、磷酸酯基和可光活化的基团。酰基叠氮还可以被重新布置为异氰酸酯。
123.在一些实施例中,除了反应性官能部分之外,反应性基团进一步包括接头l。接头
可以用于共价连接反应性官能团。当存在时,接头是单个共价键或一系列稳定键。反应性官能部分可以通过一系列稳定键与固体载体、部分或与小分子直接连接(其中接头是单键)或连接。当接头是一系列稳定的共价键时,接头通常掺入有选自由c、n、o、s、si、b和p组成的组的几种非氢原子。另外,共价键可以掺入有如美国专利第5,714,327号中所述的铂原子。当接头不是单个共价键时,接头可以是稳定的化学键的任何组合,所述稳定的化学键任选地包含单、双、三或芳香族碳-碳键,以及碳-氮键、氮-氮键、碳-氧键、硫-硫键、碳-硫键、磷-氧键、磷-氮键和氮-铂键。在一示例性实施例中,接头掺入有少于15个非氢原子并且是由醚、硫醚、硫脲、胺、酯、羧酰胺、磺酰胺、酰肼键以及芳香族或杂芳香族键的组合构成的。通常,接头是单个共价键或单个碳-碳键与羧酰胺、磺酰胺或硫醚键的组合。接头中可以存在以下部分:醚、硫醚、羧酰胺、硫脲、磺酰胺、脲、尿烷、肼、烷基、芳基、杂芳基、烷氧基、环烷基和胺部分。l的实例包含经取代的或未经取代的聚亚甲基、亚芳基、烷基亚芳基、亚芳基烷基或芳硫基。
124.接头的任何组合都可以用于连接官能团或反应性基团。当反应性基团为马来酰亚胺或卤代乙酰胺时,所产生的化合物可具体用于与含硫醇物质缀合。在反应性基团为酰肼的情况下,所产生的化合物可具体用于与高碘酸盐氧化的碳水化合物和糖蛋白缀合。在反应性基团为甲硅烷基卤的情况下,所产生的化合物可具体用于与二氧化硅表面缀合,具体地用于将二氧化硅表面掺入到随后用于远程离子检测或定量的光纤探针中的情况。
125.在本公开的组合物的一些非限制性示例性实施例中,第一尺寸排阻载体与第一部分缔合,所述第一部分例如包括含胺聚合物,并且第二尺寸排阻载体与第二部分缔合,所述第二部分例如包括右旋糖酐。
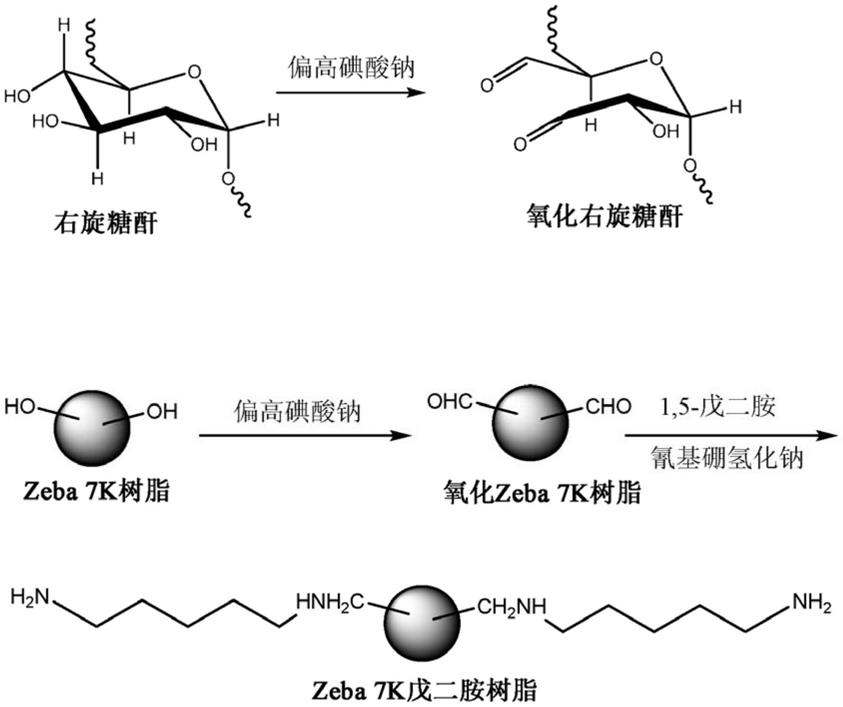
126.在本公开的组合物的一些其它非限制性示例性实施例中,第一尺寸排阻载体与第一部分缔合,所述第一部分包括例如聚(乙二醇)二胺、聚乙二胺、线性的聚乙亚胺或支化的聚乙亚胺,并且第二尺寸排阻载体与第二部分缔合,所述第二部分例如包括右旋糖酐。
127.在本公开的组合物的一些其它非限制性示例性实施例中,第一尺寸排阻载体与第一部分缔合,所述第一部分包括二乙二胺,并且第二尺寸排阻载体与第二部分缔合,所述第二部分例如包括右旋糖酐。
128.在本公开的组合物的一些非限制性示例性实施例中,第一尺寸排阻载体与第一部分缔合,所述第一部分例如包括含胺聚合物,并且第二尺寸排阻载体与第二部分缔合,所述第二部分例如包括聚乙二醇聚合物。
129.设备和装置:
130.在一些实施例中,本公开提供了一种用于从样品中去除一种或多种小分子的设备和/或装置和/或系统,所述设备和/或装置和/或系统包括:a)容器,所述容器包括:至少一种尺寸排阻载体和能与所述一种或多种小分子缔合的至少一种部分;以及b)定位在所述容器下方的接受器。在本公开的装置、设备或系统的一些实施例中,所述接受器与柱连接。在一些实施例中,所述接受器可从所述柱上拆卸。接受器的内容物可以由用户去除。在一些实施例中,所述装置的接受器收集具有显著减少的小分子的样品。在一些实施例中,所述装置的接受器收集不具有小分子的样品。
131.在本公开的装置、设备或系统的一些实施例中,被可操作地配置成经受重力流、离心力、正压、负压、真空和其组合。允许施加以上提到的压力或力的结构包含但不限于可以
抽吸以产生正压的注射器、用于产生负压的真空熔块、适于可商购获得的离心机或旋转装置的管或容器。
132.本公开的设备、装置或系统可操作为通过向装置单次施加样品并使本公开的装置、设备或系统经受施加到容器中的样品的一种或多种力,如但不限于真空、重力、负压或正压来从样品中分离、减少一种或多种小分子的量或去除一种或多种小分子。
133.在本公开的装置、设备或系统的一些实施例中,所述容器为柱状容器、管、多孔管、多孔板或多孔过滤板。示例性容器包含但不限于测试管、旋转柱、多孔板、多孔过滤板、微孔板或微孔过滤板。
134.图3描绘了根据本公开的一种或多种小分子实施例的包括容器60(例如柱状管、测试管或旋转柱)的示例性设备/装置或系统100的非限制性三维(3-d)视图,容器60具有位于容器的底端处的过滤器、网孔或有孔表面区域(未描绘)。容器60还可以包括一个或多个熔块(未描绘)。容器60在示例性组合物30(至少一种尺寸排阻载体和能与一种或多种小分子缔合的至少一种部分)内部包括或含有可以用于将容器60固定在顶端处的任选盖60'。接受器70定位在容器60下方,其适于或被配置成通过其底端收纳来自容器的洗脱液或流过液。接受器70可以从容器60拆卸,因此用户可以收集流过液或洗脱液。在一些实施例中,接受器60具有用于移除的拧开式凸片构型。在其它实施例中,接受器70可以通过凹槽或螺纹附接到容器60,所述凹槽或螺纹可以通过如旋转、拧开或通过可以拉开的互补配件的附接等手动或机械方式附接和移除。
135.图4a和图4b描绘了根据本公开的一个实施例的包括多孔容器80、用于所述容器的任选盖80'的示例性设备/装置或系统100'的非限制性三维(3-d)视图,所述多孔容器在每个孔的内部安置有示例组合物30(至少一种尺寸排阻载体和可以与一种或多种小分子缔合的至少一种部分)。80'可以为箔、透明包装、撕开式密封件和/或任何类型的可移除/可拆卸盖。
136.多孔容器80可以为多孔板、多孔板过滤器、微孔板或微量滴定板,并且包括具有多个孔的平板,其中每个孔用作小测试管或容器。对于高通量用途,多孔板存在多种形式并且通常可以具有6个、12个、24个、48个、96个、384个、1536个、3456个、9600个或更多个被布置为矩形矩阵或阵列的孔。
137.多孔容器80可以具有定位在容器下方的适于或被配置成收纳来自容器的洗脱液或流过液的接受器70。多孔过滤板、容器80可以具有流过液或洗脱液可以通过其流动到接受器70(未示出)中的网孔、过滤器或其它类型的有孔底表面。
138.在一些实施例中,接受器70如为用于收集洗脱液或流过液的多孔托盘(参见例如图4a)。接受器70是可拆卸的,并且可以由使用者从接受器收集洗脱液(参见图4a和4b)。在一些实施例中,接受器70是洗涤板或收集板。
139.应当理解,图3、图4a和图4b仅描绘了示例装置,并且尽管本说明书使用这些实施例进行描述,但是本领域的技术人员可以通过修改本文的描述而容易地进行设备的其它实施例。
140.可以通过本公开的装置、设备或系统去除或提取的一种或多种小分子可以是或者可以包括染料、染料的衍生物、生物素、生物素衍生物、交联剂、还原剂、标记物、纳米颗粒、放射性配体、质量标签、未经反应的分子以及其组合、中间体和衍生物。
141.可以通过本公开的装置/设备或系统去除的小分子的分子量范围为《2000da。这包含约100-200da、200-300da、300-400da、400-500da、500-600da、600-700da、700-800da、800-900da、900-1000da、1000-1100da、1100-1200da、1200-1300da、1300-1400da、1400-1500da、1500-1600da、1600-1700da、1700-1800da、1800-1900da、1900-《2000da的分子量范围。在一些实施例中,可以通过本公开的装置/设备或系统去除的小分子的分子量范围小于或等于50da、100da、150da、200da、250da、300da、350da、400da、450da、500da、550da、600da、650da、700da、750da、800da、850da、900da、950da、1000da、1050da、1100da、1150da、1200da、1250da、1300da、1350da、1400da、1450da、1500da、1550da、1600da、1650da、1700da、1750da、1800da、1850da、1900da、1950da、1975da到约《2000da。
142.在实施例中,本公开的系统、设备和装置包括容器,所述容器包括如上文和下文的部分中所示的本公开的一种或多种组合物。
143.本公开的系统、设备和装置的一个或多个优点包含以下中的一个或多个:经济、简单且易于使用、提供了更快的结果时间、适于单次使用一次性单元、可用于多孔容器形式的高通量样品制备、适于经受自动化和机器人样品制备系统。使用本文提供的设备、装置和系统从样品中减少小分子的量提供了可以用于下游应用的快速且质量优质的生物分子和其衍生物。
144.系统
145.在一些实施例中,本公开提供了一种用于从样品中去除一种或多种小分子的系统,所述系统包括:a)容器,所述容器包括:尺寸排阻载体和能与所述一种或多种小分子缔合的至少一种部分;以及b)定位在所述容器下方的接受器。在一些实施例中,系统进一步包括用于使容器和接受器经受重力流、离心力、正压、负压、真空和其组合的器具。
146.在一些实施例中,本公开的系统可以包括以上描绘的可以形成为容纳到离心管或任何其它相当的旋转仪器中的装置100或100”。在一些实施例中,本公开的系统可以包括以上描绘的可以形成为经受负压(如真空)或正压(如注射器、移液器)的装置100或100”。
147.本公开的系统(未描绘)可以是完全自动化的或者可以是手动操作的系统。在一些实施例中,系统可以部分手动操作并且部分通过自动化操作。
148.系统还可以包括计算机系统,所述计算机系统包括cpu、硬件元件和/或软件元件,可以物理地驻留在内部或外部并且可以可操作地链接到硬件/软件元件。计算机系统可操作为控制装置100或100”的各种组件,如用于检索洗脱液并分析洗脱液的控制机器人。
149.本公开的系统还可以任选地包括可操作为对洗脱的生物分子进行进一步处理,如但不限于对如用于荧光检测或免疫测定的所缀合抗体或加标签的蛋白质等洗脱的衍生化蛋白质进行处理的一个或多个装置。在一些实施例中,系统可以包括成像仪或蛋白质或核酸检测器或测序仪。
150.计算机系统可操作为控制本公开的系统的一个或多个组件。在一些实施例中,如上所述,计算机系统和/或其组件可以物理地驻留在装置100或100”内或者可以驻留在外部。计算机系统可以包括可操作为控制和指导样品处理(通过装置100或100”和系统的其它组件)和/或通过对样品进行处理获取的数据的数据处理和/或数据的下游数据处理的任何自动化步骤的中央处理单元、硬件和软件元件。因此,本文使用的计算机系统可以包括数据分析和控制系统、如读写cd rom驱动器或dvd驱动器等数据转移系统、至少一个usb端口和/
或至少一个以太网端口。在一些实施例中,计算机系统可以包含可以实现对装置100、100”和/或系统的其它组件,包含系统的多个组件的控制、对处理和分析的控制和/或对显示和/或输出结果的控制的预加载的软件和/或专用集成电路(asic)。
151.系统还可以包括额外装置或组件,如但不限于:电源、如可操作为观看样品处理和/或监测从样品中提取生物分子的检测器等显示单元;分光光度计;用于测量核酸提取的装置;对所提取的生物分子进行进一步处理以供进一步分析的装置;打印机等。本公开的系统可以被配置成安装在实验室工作台顶部上。
152.方法
153.在一些实施例中,本公开描述了一种用于从一种或多种小分子中分离生物分子的方法,所述方法包括:a)将样品施加到容器,所述容器包括尺寸排阻载体和能与至少一种小分子结合的至少一种部分;以及b)使所述容器经受重力流、离心力、正压、负压、真空或其组合,其中通过所述尺寸排阻载体排阻所述样品中的所述生物分子并且以流过液的形式收集所述生物分子,并且其中所述至少一种小分子与所述至少一种部分缔合并由此从所述样品中分离。
154.在本公开的方法的一些实施例中,在一个步骤中执行从所述样品的其余部分中分离至少一种小分子。在本公开的方法的一些实施例中,将流过液收集在定位在所述容器下方的接受器中。在一些实施例中,小分子可以构成样品的杂质或污染物。
155.可以通过本公开的方法测试的多种样品可以是可以具有必须从中分离或去除小分子的生物分子或其衍生物的任何类型的生物样品或临床样品。一些示例性非限制性样品包含具有蛋白质染料缀合物的样品、生物素化蛋白质样品、如dtt或tcep交联蛋白等具有还原剂的蛋白质以及具有交联剂的蛋白质样品。适于使用的染料是本领域的技术人员已知的并且包含但不限于芘、香豆素、花青、苯并呋喃、喹啉、喹唑啉酮、吲哚、苯并唑、硼聚吖吲得辛以及包含荧光素、罗丹明和螺环蒽的氧杂蒽以及richard p.haugland,“荧光探针和研究化学品的分子探针手册”(第11版,2010年1月)中描述的其它染料,所述文献通过引用以其整体并入。
156.本公开的方法可以有利地减少对样品进行处理以减少来自样品的小分子的量所需的时间。
157.试剂盒
158.本公开还描述了用于实施本文讨论的方法的试剂盒和/或含有组合物的试剂盒和/或含有本文讨论的设备/装置的试剂盒。
159.在一些实施例中,本公开描述了一种用于从一种或多种小分子中分离生物分子的试剂盒,所述试剂盒包括:装置,所述装置包括:a)容器,所述容器包括:至少一种尺寸排阻树脂和能与所述至少一种小分子缔合并捕获所述小分子的至少一种部分;以及b)定位在所述容器下方的接受器,其中所述装置被可操作地配置成经受重力流、离心力、正压、负压、真空和其组合。
160.在一些实施例中,本公开的试剂盒包括能与一种或多种小分子缔合的至少两种或更多种部分。
161.在本公开的试剂盒的一些实施例中,所述装置为旋转柱、多孔过滤板或多孔板。试剂盒可以进一步包括包装在一个或多个单独容器中或包含在第一容器中的一种或多种缓
冲液。
162.本公开的试剂盒还可以包括一种或多种试剂,如一种或多种洗涤缓冲液、洗脱缓冲液、过滤膜和/或额外的旋转柱或多孔板。
163.试剂盒的试剂和组分可以包含在一个或多个合适的容器器件中。容器器件总体上可以包括组分可以被放置到其中并且优选地被适当地等分的至少一个小瓶、测试管、烧瓶、瓶子、注射器或其它容器器件。在试剂盒中存在多于一种组分的情况下,如果合适的话,可以将所述组分包装在一起,或者试剂盒通常将含有额外组分可以被单独放置的第二容器、第三容器或其它额外容器。然而,在一些实施例中,组分的某些组合可以包装在一起,包含在一个容器器具中。试剂盒还可以包含用于将任何试剂容器牵制在严格限制内以供商业销售的器具。此类容器可以包含将期望的小瓶保留在其中的注射或吹气模制的塑料容器。
164.在一些实施例中,本公开的试剂盒的装置可以预先填充有用于试剂中一种或多种试剂以对样品进行处理并且可以适当地等分到适当的室中。试剂盒或其容器可以具有用于保持内部隔室和其中的任何内容物无菌和防溢出的密封件。
165.试剂盒的一些组分是以一种和/或多种液体溶液的形式提供的。液体溶液可以是非水性溶液、水性溶液,并且可以是无菌溶液。试剂盒的组分也可以以干燥粉末的形式提供。当试剂和/或组分以干燥粉末的形式提供时,可以通过添加合适的溶剂来重组粉末。设想了也可以在另一个容器器具中提供合适的溶剂。试剂盒还可以包括用于容纳无菌、药学上可接受的缓冲液和/或其它稀释剂的容器器具。
166.本公开的试剂盒还可以包含用于采用试剂盒组分的说明书,并且还可以具有用于使用试剂盒中未包含的任何其它试剂的说明书。说明书可以包含可以实施的变体。
167.实例
168.可以根据以下实例来进一步理解本发明教导的各方面,这些实例不应该被解释为以任何方式限制本教导的范围。
169.实例1:组合物的制备和测试
170.制备了包括至少一种尺寸排阻载体和可以与一种或多种小分子缔合的至少一种部分的用于从样品中分离或提取一种或多种小分子的组合物,并对所述组合物进行测试。
171.在一些实施例中,用包括可以通过电荷相互作用、疏水相互作用或任何其它相互作用与小分子缔合以与这些小分子缔合并由此从样品中去除这些小分子,同时允许排阻并收集样品中的较大生物分子的官能团的部分对示例性尺寸排阻载体进行改性。
172.在本实例和以下实例中,制备了用于包含染料(在约700da-1100 da的分子量范围内)、生物素和其衍生物(在约300da-1000 da的分子量范围分子量范围内)、还原剂(在约150da-300 da的分子量范围内)和交联剂(在约300-600da的分子量范围内)的四种类型的示例性小分子的去除的组合物并针对其去除小分子的能力对所述组合物进行了测试。虽然这些示例性小分子和列出的分子量范围用于实验展示,但本领域的技术人员将认识到本实施例不限于这些小分子或分子量范围,并且本文的教导使本领域的技术人员能够制造和使用用于各种小分子类型和分子量范围的去除的组合物和装置。
173.以下部分以各种方式固定在尺寸排阻载体树脂上:1.分子量在6kda到2800kda的范围内的右旋糖酐;2.聚乙亚胺(pei)(线性和支化);以及3.二乙二胺(dea)。
174.实例1a:化学物质1的制备和测试
175.化学物质1:用支化聚乙亚胺部分固定尺寸排阻载体:如下所述对包括具有7k和40k尺寸排阻范围的羟乙基纤维素树脂,例如,来自赛默飞世尔科技公司(thermo scientific)的zeba 40k旋转脱盐柱和zeba 7k旋转脱盐柱的尺寸排阻载体的两个实例进行了改性。对定位在这些尺寸排阻载体柱上的邻二醇(vicinal diol)进行高碘酸盐氧化以产生醛基。使用席夫碱化学物质使具有伯胺的聚乙亚胺和二乙二胺与所产生的醛反应。在pbs中制备聚乙亚胺和二乙二胺,将ph调节到8.0-8.5的范围,并且使聚乙亚胺和二乙二胺与氧化的zeba柱反应。这些组合物之后被称为zeba 7k-pei(聚乙亚胺)和zeba40 k-pei(聚乙亚胺)。
176.还对不具有任何尺寸排阻性质的琼脂糖树脂(来自通用电气公司的sepharose快速流动4(ff4)树脂)执行了相同的化学改性。对定位在琼脂糖树脂上的邻二醇进行高碘酸盐氧化以产生醛基。使用席夫碱化学物质使具有伯胺的聚乙亚胺和二乙二胺与所产生的醛反应。在pbs中制备聚乙亚胺和二乙二胺,将ph调节到8.0-8.5的范围,并使聚乙亚胺和二乙二胺与氧化的琼脂糖树脂反应。这形成了在之后的实验中描述的琼脂糖-pei(聚乙亚胺)。
177.用化学改性的尺寸排阻载体(例如,以上所述的示例zeba柱)和非尺寸排阻载体(例如,以上所述的示例sepharose树脂)执行以下实验步骤:1.各自向旋转柱添加0.5ml床体积的化学改性的载体。2.使含有各种化学改性的载体的旋转柱在1000x g下旋转2分钟以去除储存溶液。3.在旋转柱中以100μl将包括a)抗体缀合的染料的样品添加到化学改性的载体上。使柱在1000x g下旋转2分钟并收集流过液。
178.这些实验的结果在图5中描绘,所述图示出了根据本公开的一个实施例的使用方法使用本公开的装置中的两种示例性组合物去除示例性小分子(游离染料)。使用本公开的不同示例组合物,包含尺寸排阻载体去除在本文通过游离染料(dylight
tm
650)体现的小分子(至少两种类型的具有7k和40k尺寸排阻范围的羟乙基纤维素载体各自独立地与包括聚乙亚胺(作为示例性第一部分)和二乙二胺(作为示例性第二部分)的部分的组合缔合)。还在类似条件下对简单的洗涤剂去除树脂的比较效率进行了测试。
179.图5中的凝胶的各个泳道如下上样:泳道1-gam(山羊抗小鼠)dylight
tm
650缀合物(未经清洁的-对照);泳道2-洗涤剂去除树脂(pierce
tm
洗涤剂去除树脂、hippr
tm
洗涤剂去除旋转柱试剂盒);泳道3-琼脂糖-pei(聚乙亚胺);泳道4-zeba 7k-pei(聚乙亚胺);泳道5-zeba 40k-pei(聚乙亚胺)。
180.图5中的框内的两个带显示了来自每个泳道的回收的蛋白质,即,山羊抗小鼠dylight
tm
650缀合蛋白(gam dylight
tm
650缀合物),并且底部的带指示样品中剩余的游离染料dylight
tm
650。游离或未经反应的染料650保留在柱中,并在蛋白质回收后洗脱出来。泳道1是未经清洁的gam 650缀合物。本文使用术语“未经清洁”来描述未穿过任何树脂/载体的gam dylight
tm
650缀合物。“未经清洁”是在凝胶上运行以展示具有“未”通过本公开的组合物、设备和方法去除的游离染料的样品在凝胶上是如何可见的对照。泳道2显示了穿过示例性简单洗涤剂去除树脂(pierce
tm
洗涤剂去除树脂、hippr
tm
洗涤剂去除旋转柱试剂盒)以测试这种类型的树脂是否可以去除小分子(如游离染料)的gam 650缀合蛋白。底部的带的存在表明,与其它泳道(尤其是相比于泳道4和5)相比,未通过此树脂完全或高效去除游离染料。泳道3显示了gam 650缀合蛋白在某种程度上通过固定在琼脂糖树脂上的pei与游离染料分离。然而,与泳道4和5相比,泳道3显示出蛋白质回收相对较差并且游离染料去除较
差。与泳道1、2和3相比,泳道4和泳道5显示出相对最佳的蛋白质回收。在道4和泳道5中完全不存在表明游离染料的底部的带,这表明通过pei改性的尺寸排阻树脂(7k和40k zeba树脂)高效去除了游离染料。然而,相比于通过如泳道4和5中的7k和40k zeba树脂等尺寸排阻树脂的回收,gam 650缀合物通过非尺寸排阻琼脂糖树脂的回收较差。因此,与其它泳道相比,使用本公开的组合物、装置和方法的泳道4和泳道5显示出通过不存在游离染料和高效缀合物-蛋白质(大生物分子)回收对本文示出的小分子的最优去除。其它染料的定量数据在以下实例中显示。
181.因此,在此实验中对本公开的至少两种组合物进行了分析:1.与包括聚乙亚胺(作为示例性第一部分)和二乙二胺(作为示例性第二部分)的部分的组合缔合的具有7k尺寸的羟乙基纤维素尺寸排阻载体;2)与包括聚乙亚胺(作为示例性第一部分)和二乙二胺(作为示例性第二部分)的部分的组合缔合的具有40k尺寸的羟乙基纤维素尺寸排阻载体;并且将本公开的两种组合物的性能与本公开的组合物类似进行化学改性的非尺寸排阻载体的性能进行比较和对比(即,与和包括聚乙亚胺(作为示例性第一部分)和二乙二胺(作为示例性第二部分)的部分的组合缔合的琼脂糖载体以及与洗涤剂去除树脂和“未经清洁的”对照进行比较)。如上面(以及图5中)的实验和结果所示,改性非尺寸排阻载体或洗涤剂去除树脂都不能够像包括改性尺寸排阻载体的本公开的组合物那样高效地去除小分子。
182.实例1b:化学物质2的制备
183.化学物质2:用右旋糖酐部分固定尺寸排阻载体:在此实例中,将7k和40k羟乙基纤维素树脂(zeba
tm
旋转脱盐柱40k和zeba
tm
旋转脱盐柱7k)与右旋糖酐部分缔合以形成本公开的额外组合物。将不同mw的右旋糖酐(在6k道尔顿到280万道尔顿的范围内)固定到7k和40k树脂上。
184.首先,如以下所描述的将分子量范围为1,500,000da-2,800,000da的右旋糖酐固定到树脂上。对羟基纤维素尺寸排阻载体上的邻二醇进行高碘酸盐氧化以产生醛基。使用席夫碱化学物质使乙二胺(eda)或1,5戊二胺(pda)与所产生的醛反应。这在7k和40k尺寸排阻载体两者上产生了末端胺基。然后使用偏高碘酸钠对右旋糖酐溶液进行高碘酸盐氧化以产生醛基。然后使右旋糖酐上产生的醛基与末端胺反应以产生固定在7k和40k树脂上的右旋糖酐。
185.还在琼脂糖的非尺寸排阻载体上制备了类似的组合物和化学改性,以供比较分析。如以上部分中所提到的,琼脂糖不具有尺寸排阻性质。化学反应描述如下:
[0186][0187]
实例1c:化学3的制备
[0188]
化学物质
tm
3:用支化聚乙二醇胺部分固定尺寸排阻载体:如下制备包括具有聚(乙二醇)双(胺)的尺寸排阻载体(赛默飞世尔科技公司的zeba,7k和40k)的组合物:如以上部分所解释的,使用席夫碱化学物质将不同mw的聚(乙二醇)双(胺)的部分(2k道尔顿到20k道尔顿)固定在尺寸排阻载体(7k和40k树脂)上。
[0189]
还在非尺寸排阻琼脂糖载体(通用电气医疗公司的琼脂糖)上进行了类似的化学改性以供比较分析。化学反应在以下描绘:
[0190][0191]
实例1d:化学物质2和3的测试:用化学物质2和3在旋转柱装置中去除游离染料小分子针对小分子去除对以上描述的化学物质2和3的组合物进行测试。
[0192]
使用组装到0.8ml旋转柱中的0.5ml树脂床体积(如以上不同描述的各种化学物质
的树脂床体积)进行了用于去除小分子(除非特别提到为使用其它方法/装置,否则为在此实例和其它实例中)的所有实验以产生本公开的非限制性实施例设备。使旋转柱在1000x g下旋转2分钟以去除储存溶液。然后将旋转柱放置在清洁的2ml离心管中。将100μl的样品体积添加到树脂的中心,并且使柱在1000x g下旋转2分钟,并且将流过液收集在2ml管中。这些实验的结果在图6中描绘。
[0193]
图6描绘了使用包含20k peg二胺zeba 7k、右旋糖酐-pda zeba 7k(其中pda是指1,5戊二胺)的本公开的不同载体和包含zeba 7k(非改性)和起始样品(对照)的对照对另一种示例性小分子(即游离染料dylight
tm 550nhs酯)的去除并与包含zeba 7k和右旋糖酐树脂(交联在一起)的另一种化学物质进行比较。此实验是在没有蛋白质的情况下进行的,以证明与非改性尺寸排阻树脂(如泳道中的非改性zeba 7k树脂)相比,本公开的组合物与如游离染料(例如dylight
tm
)等小分子缔合的能力。
[0194]
在硼酸盐缓冲液中以1.3mg/ml(此1.3mg/ml相当于将20摩尔过量的染料加入到10mg gam蛋白中)制备了dylight
tm 550nhs酯。将500μl的本公开的不同载体和对照组装在0.8ml旋转柱中。将100μl的1.3mg/ml dylight
tm 550nhs酯添加到树脂。使旋转柱在离心机中在1000x g下旋转2分钟。收集流过液。将10μl的流过液添加到90μl的样品缓冲液中。然后在4-20%tris glycine sds凝胶上每孔添加10μl的此样品缓冲液。使凝胶运行40分钟,并且随后使用ibright成像仪(赛默飞世尔科技公司)进行成像。图6中的泳道对应于用于去除游离染料的以下载体组合物:泳道1-20k peg二胺zeba 7k;泳道2-右旋糖酐-pda zeba 7k;泳道3-zeba 7k(非改性);泳道4-zeba 7k和右旋糖酐树脂(交联在一起);泳道5-起始样品或阳性对照(含20摩尔过量的dylight
tm 550nhs酯的硼酸盐缓冲液)。
[0195]
图6泳道1描绘了用于用固定在7k zeba树脂上的peg二胺去除小分子的数据。这种化学物质不能成功去除游离染料。泳道2描绘了固定在去除了100%的游离染料的7k尺寸排阻载体树脂上的右旋糖酐-pda的数据。作为非改性7k zeba树脂(即,仅尺寸排阻树脂,未添加任何部分-无表面化学物质)的泳道3未成功去除游离染料。泳道4对应于通过另一种化学物质制备,以用于与本发明组分化学物质进行比较的树脂。通过使用交联剂使羟乙基纤维素与右旋糖酐交联来制备泳道4树脂,而不是将右旋糖酐固定在zeba树脂上。与其中通过以上描述的还原胺化方法将右旋糖酐固定到尺寸排阻载体上的泳道2化学物质相比,此交联化学物质不是那么有效。如泳道2中所见,游离染料被完全去除,这通过缺失的游离染料带描绘,而泳道4中存在游离染料带,这表明通过交联的树脂未去除游离染料。泳道5显示了如以上部分中描述的传递的“未经清洁的”样品。在此为1.3mg/ml的未在任何树脂上传递的dylight
tm 550nhs-树脂。如以上所描述的在样品缓冲液中以1:10将这种1.3mg/ml溶液稀释并上样到凝胶上。
[0196]
实例1e:化学物质2和3的测试:使用化学物质2和3去除还原剂小分子
[0197]
如化学物质3中所描述的产生包括固定在尺寸排阻载体(赛默飞世尔科技公司的7kzeba)上的单一部分peg(聚乙二醇)二胺的本公开的另一种组合物,并针对其去除起还原剂的作用的小分子的能力如下进行测试:将714μl的70%的载体树脂浆液移液到放置在收集接受器管中的旋转柱中。使旋转柱在1000x g下旋转2分钟以去除储存溶液。然后将旋转柱放置在清洁的2ml离心管中。将包括还原剂,即含浓度为50mm的三(2-羧乙基)膦(tcep)的pbs,的100μl的样品体积添加到包括如以上指出的组合物的旋转柱的中心并在1000x g下
旋转2分钟,并且将流过液收集在2ml管中。通过ellmans测定对从样品中去除tecp进行测试。此测定是通过在96孔板中添加a)250μl ellmans缓冲液、b)10μl ellmans试剂(4mg/ml)、c)50μl样品(1:10稀释)并且随后借助于在色度计上的450nm处读取样品(赛默飞世尔科技公司的multiskan)来测量tcep的量完成的。样品中tcep的量与由450nm处的读数所指示的颜色的强度成正比。因此,450nm处的更高读数对应于样品中存在的更大量的tcep。这些实验的结果在图7中描绘。450nm处的低值表明tcep的高效去除。
[0198]
图7描绘了使用根据本公开的一个实施例的组合物、装置和方法去除示例性小分子还原剂(tcep)并将这些与包含非改性zeba 7k的对照进行比较。如图7所示,第一个条对应于固定在由7k zeba例示的尺寸排阻载体树脂上的peg二胺,并且显示了以50mm添加到树脂中的tcep的97%的去除。第二个条对应于固定到由7k zeba例示的尺寸排阻载体树脂上的右旋糖酐-pda,并且显示了tcep的80%的去除。相反,图7的第三个条显示了将50mm的tcep样品传递到由非改性zeba 7k例示的未化学改性的尺寸排阻载体树脂上的结果,并且显示了tcep的41%的去除。第四个条显示了包括与右旋糖酐交联的7k zeba树脂的另一种化学物质的作用,并且显示了tcep的仅12%的去除。因此,与其它组合物相比,根据化学物质2和化学物质3制成的本公开的组合物显示出小分子还原剂tcep的显著更高的去除。
[0199]
实例2:在旋转柱中并以多孔形式中混合组合物并去除小分子
[0200]
根据在图5、6和7中描绘的实验中获得的数据,单独的尺寸排阻载体树脂(即,没有所缔合部分或化学物质的7k zeba)不能够去除小分子,包含例如染料或如tcep等还原剂。包括尺寸排阻树脂和右旋糖酐的本公开的组合物能够去除包含染料和还原剂的两种类型的小分子。例如,图5和6中的数据描绘了包括例如固定在尺寸排阻载体(图5中的zeba 7k和40k,以及图6中的zeba 7k)上的右旋糖酐的本公开的组合物去除了游离未经反应的染料(染料650、nhs 550),并且图7中的右旋糖酐pda去除了还原剂tcep。然而,包括例如固定在尺寸排阻载体(zeba 7k)上的peg二胺部分的本公开的一些组合物允许去除显著量的小分子还原剂tcep(参见图7和图13)以及dtt(参见图19),但不能够去除小染料(参见图6,泳道1)。
[0201]
因此,诸位发明人创造了包括本文所述的用于产生可以去除几种类型的小分子的组合物的各种组成的共混物的组合物。本公开的一些示例性共混组合物在表1中描述:
[0202]
表1:
[0203]
不同共混物peg二胺-7k右旋糖酐-7k共混物113共混物212共混物311共混物421共混物531
[0204]
以表1的第2和第3列中描述的每种组合物的各种比率制备了表1中描述的包括固定在尺寸排阻7k树脂上的右旋糖酐的组合物和固定在尺寸排阻7k树脂上的peg二胺的组合物的共混物1-5。
[0205]
对以1:1比率制成的表1的共混物去除不同类别的小分子的能力进行了测试,并将所述共混物与对非改性尺寸排阻树脂(7k zeba树脂)的对应对照和未清洁所缀合蛋白的对
照执行的类似测试进行比较。
[0206]
将共混的组合物掺入到各种尺寸(0.8ml、2ml、5ml和10ml)的旋转柱中并且还掺入在96孔过滤板上,以对组合物在本公开的装置中的能力进行测试。使旋转柱或多孔板在离心机中在1000x g下旋转2分钟以去除储存缓冲液。添加包括小分子的适当体积的样品。使柱或多孔板在离心机中在1000x g下再次旋转2分钟,并且将洗脱液收集在流过液中。数据在图8、9和10中示出并且对应于以旋转柱形式执行的实验。
[0207]
对于图8,将与10摩尔过量的dylight
tm
550缀合的700μl山羊抗小鼠igg的样品体积施加到旋转柱的中心,其组成对应于如下所指出的每个泳道。通过sds-page,在ibright成像仪上对凝胶进行成像,之后通过ibright分析软件对染料去除进行量化来评估流过液中的游离染料去除。与具有含10摩尔过量的dylight
tm
550染料的10mg/ml山羊抗小鼠igg的“未清洁”起始样品(泳道4)相比,改性7k 1:1共混样品(泳道1-2)的染料去除大于99%,非改性7k zeba树脂(泳道3)的染料去除为20%。小分子去除的百分比是相比于“未清洁”对照的去除计算的。
[0208]
图8描绘了使用表1的1:1比率的示例性共混组合物从dylight
tm
550山羊抗小鼠igg的蛋白质缀合物中小分子染料去除dylight
tm
550。泳道1具有用于使用1:1右旋糖酐-pda共混物进行的染料去除的数据;泳道2具有用于染料去除1:1右旋糖酐-eda(乙二胺)共混物的数据;泳道3具有用于使用非改性7k zeba尺寸排阻树脂进行的染料去除的数据;并且泳道4具有用于染料dylight
tm
550山羊抗小鼠igg的“未清洁”对照的数据。图7示出了,与对照和泳道3相比,泳道1和2的共混物能够去除显著量的游离染料。这在图7中通过在凝胶的底部处几乎不存在游离染料带描绘的。
[0209]
在图9中,将与10摩尔过量的alexa fluor
tm
488缀合的2ml山羊抗兔igg的样品体积施加到包括对应于以下针对每个泳道描述的那些的组合物的旋转柱的中心。使柱在离心机中在1000x g下旋转2分钟并收集流过液。通过sds-page,在ibright成像仪上对凝胶进行成像,之后通过ibright分析软件对染料去除进行量化来评估每个柱的流过液中的游离染料去除。与由具有10摩尔过量的alexa fluor
tm
488染料的10mg/ml山羊抗兔igg组成的“未清洁”起始样品(泳道4)相比,改性7k 1:1共混样品(泳道1-2)的染料去除大于99%,相比之下而非改性7k zeba树脂(泳道3)的染料去除为49%。
[0210]
图9描绘了使用表1的1:1比率的示例性共混组合物从alexa fluor
tm
488山羊抗兔igg的蛋白质缀合物中小分子染料去除alexa fluor
tm
488,其中泳道1具有用于使用1:1右旋糖酐-pda共混物进行的染料去除的数据;泳道2具有用于染料去除1:1右旋糖酐-eda共混物的数据;泳道3具有用于使用非改性7k zeba尺寸排阻树脂进行的染料去除的数据;并且泳道4具有用于染料alexa fluor
tm
488山羊抗兔igg的“未清洁”对照的数据。图9示出了与泳道4对照和泳道3非改性树脂相比,泳道1和2的共混物去除了显著量的游离染料。这通过在底部处几乎不存在游离染料带描绘的。
[0211]
在图10中,将与10摩尔过量的dylight
tm
650缀合的4ml山羊抗小鼠igg的样品体积施加到旋转柱的中心,其组成对应于如下所指出的每个泳道。通过sds-page,在ibright成像仪上对凝胶进行成像,之后通过ibright分析软件对染料去除进行量化来评估流过液中的游离染料去除。与具有含10摩尔过量的dylight
tm
550染料的10mg/ml山羊抗小鼠igg的“未清洁”起始样品(泳道4)相比,改性7k 1:1共混样品(泳道1-2)的染料去除大于99%,而非改
性7k zeba树脂(泳道3)的染料去除为22%。
[0212]
图10描绘了使用表1的1:1比率的示例性共混组合物从dylight
tm
650山羊抗小鼠igg的蛋白质缀合物中小分子染料去除dylight
tm
650,其中泳道1具有用于使用1:1右旋糖酐-pda共混物进行的染料去除的数据;泳道2具有用于染料去除1:1右旋糖酐-eda共混物的数据;泳道3具有用于使用非改性7k zeba尺寸排阻树脂进行的染料去除的数据;并且泳道4具有用于染料dylight
tm
650山羊抗小鼠igg的“未清洁”对照的数据。fig.10示出了泳道1和2的共混物去除了显著量的游离染料,如通过在底部处几乎不存在游离染料带所示出的。
[0213]
在图8、9和10中,各种染料/小分子的去除的量表示为相比于其在“未清洁”样品中(在凝胶中的每个凝胶的泳道4中)的相应的量的%。
[0214]
还对以1:1比率制成的表1的共混物去除不同类别的小分子的能力进行了测试,并将所述共混物与对对应非尺寸排阻琼脂糖-右旋糖酐执行的类似测试进行了比较,并且还以1:1的比率将琼脂糖-peg二胺树脂共混(在图12(泳道5a和5b)、13、14、15和16中在此被称为ff4共混物)。将0.5ml床体积的这些组合物掺入到08.ml柱容量的旋转柱中,以将其与本公开的组合物和装置进行比较。使旋转柱最初在离心机中在1000x g下旋转2分钟以去除储存缓冲液。添加包括小分子的适当体积的样品。将柱在离心机中在1000x g下再次旋转2分钟,并且将洗脱液收集在流过液中。数据例如在图12(泳道5a和5b)中以及在图13、14、15和16中示出。
[0215]
实例3:在多孔过滤板装置中用经共混的组合物去除游离染料小分子
[0216]
使用多孔过滤板装置形式对以上描述的经共混的组合物的小分子去除进行测试。
[0217]
使用(如上以上不同地描述的不同化学物质的)改性7k 1:1树脂共混物的并组装在微孔/多孔板中的0.5ml树脂床进行用于去除小分子的所有实验以产生本公开的非限制性实施例设备。对于这些实验,将由含有所述化学物质的96孔组成的多孔板放置在96孔洗涤板的顶部上。接下来,将此组合件放置到96孔板载体转子中并在1000x g下离心2分钟以去除储存缓冲液。从离心机中移除板组合件并丢弃洗涤板。然后将96孔板放置在96孔收集板的顶部上。将样品(20μl、50μl和100μl)施加到每个孔的树脂床的中心。将板组合件在1000x g下离心2分钟以收集样品。在游离染料去除的情况下收集抗体缀合物。通过sds-page,在ibright成像仪上对凝胶进行成像,之后通过ibright分析软件对染料去除进行量化来评估游离染料去除。多孔板的结果在图11中描绘。
[0218]
在图11中,泳道1和2对应于施加于改性7k1:1树脂共混物的20μl山羊抗兔igg alexa fluor
tm
647缀合物。泳道3和4对应于施加于改性7k 1:1树脂共混物的50μl山羊抗兔igg alexa fluor
tm
647缀合物。泳道5和6对应于施加于改性7k 1:1树脂共混物的100μl山羊抗兔igg alexa fluor
tm
647缀合物。泳道7对应于未施加于任何树脂共混物的山羊抗兔igg alexa fluor
tm
647缀合物的“未清洁”样品。相比于由与10摩尔过量的alexa fluor
tm
647染料缀合的10mg/ml山羊抗兔igg组成的“未清洁”样品(泳道7),所有样品(泳道1-6)均显示出大于99%的染料去除。将来自20μl样品的泳道1-2流过液施加到树脂床,将来自50μl样品的泳道3和4流过液施加到树脂床,将来自100μl样品的泳道5和6流过液施加到泳道7。
[0219]
实例4:用于小分子游离染料的去除的经共混的组合物
[0220]
图12描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子,即两种示例性游离染料——荧光素和alexa fluor
tm
555。
[0221]
图12实验步骤如下:染料去除方案:1.将1ml 50%树脂浆液移液到放置在收集管中的旋转柱中;2.在1000x g下持续2分钟旋转出液体;3.更换收集管并将抗体样品(gar荧光素缀合物和gam alexa 555缀合物)添加到样品中的每种样品的每个旋转柱中;4.通过在1000x g下离心2分钟从样品中去除游离染料。
[0222]
评估凝胶中的染料去除:1.通过向微量离心管添加以下来制备用于在凝胶上运行的样品:a)20μl含有50mm dtt的2x上样缓冲液以及b)来自由步骤4清洁的抗体的20μl流过液。以上;2.在95℃下将样品加热8分钟;3.在冰上冷却样品;4.将10μl的每个样品上样到凝胶上的单独孔中;5.使凝胶在225v下运行32分钟;6.去除凝胶并冲洗;7.在ibright成像仪上以适当的荧光进行成像。
[0223]
在图12中,泳道1-6(a或b)包括以下经共混的组合物,所述经共混的组合物包含:泳道1a和1b包括作为非改性尺寸排阻树脂的截留分子量为40k的40k zeba;泳道2a和2b包括作为非改性尺寸排阻载体树脂的截留分子量为7k的7k zeba;泳道3a和3b包括作为用右旋糖酐改性的40k树脂与用peg二胺改性的40k树脂的1:1比率的共混物的40k共混物;泳道4a和4b包括作为用右旋糖酐改性的7k树脂与用peg二胺改性的7k树脂的1:1比率共混物的7k共混物;泳道5a和5b包括作为快速流动4琼脂糖(来自通用电气公司)的ff4,即以1:1比率共混的包括用右旋糖酐改性的ff4与用peg二胺改性的ff4的非尺寸排阻树脂;泳道6a和6b包括“未清洁”或未经处理的样品(例如,未穿过任何树脂的染料缀合物)。a泳道(泳道1a-6a)包括gar或山羊抗兔igg-荧光素缀合蛋白,并且b泳道(泳道1b-6b)包括gam或山羊抗小鼠igg-alexa fluor
tm
555缀合蛋白。
[0224]
泳道6a和6b描绘了“未清洁”样品,并且示出了位于顶部的对应于凝胶的底部的减少的抗体带和游离染料带的两条带(泳道6a中的游离染料带对应于游离荧光素染料,并且泳道中6b的游离染料对应于游离alexa fluor
tm
555染料)。在经处理的样品(泳道1a到5a和泳道1b到5b)中,底部染料带的存在表明游离染料(荧光素和alexa fluor
tm
555)的去除不完全或不成功,如泳道1a、1b以及2a和2b中所指出的。泳道1a和2a的底部处存在游离荧光素带表明分别地通过非改性40k和非改性7k zeba树脂对游离荧光素的去除不佳或未去除游离荧光素。类似地,泳道1b和2b的底部处存在游离alexa fluor
tm
555带表明分别地通过非改性40k和非改性7k zeba树脂对游离alexa fluor
tm
555染料的去除不佳。作为40k共混物(1:1)和7k共混物(1:1)的泳道3a和4a表明无游离荧光素带,或底部处几乎不存在表明这两种共混物的出色游离染料去除性质。类似地,作为40k共混物(1:1)和7k共混物(1:1)的泳道3b和4b表明底部处无游离alexa fluor
tm
555带或几乎不存在,这表明这两种树脂的出色游离染料去除性质。泳道5a和5b表明gar抗体缀合的荧光素(5a)和gam抗体缀合的alexa fluor
tm
555(5b)完全丧失,如由缺乏凝胶上的5a和5b的减少的抗体带所证明的。除了去除游离染料外,抗体缀合的荧光素和抗体缀合的alexa fluor
tm
555在泳道3a、4a以及3b和4b中蛋白质回收出色。使用ibright分析软件对来自这些泳道的带进行量化,并且绘制不同树脂的染料去除%和抗体染料缀合物回收%(参见图15和16中的数据)。
[0225]
实例5:用于小分子还原剂的去除的经共混的组合物
[0226]
图13描绘了使用根据本公开的一个实施例的经共混的组合物、装置、试剂盒和方法去除示例性小分子还原剂的数据。实验如下:还原剂去除方案:1.将714μl 70%树脂浆液移液到位于收集管中的旋转柱中;2.在1000x g下持续2分钟旋转出液体;3.更换收集管并
将100μl的含tcep样品(25mm)1mg/ml山羊抗兔抗体的pbs添加到样品中的每个样品的每个旋转柱中;4.通过在1000x g下离心2分钟从样品中去除tcep。
[0227]
通过ellmans测定评估tcep去除:1.通过为96孔板中的每个样品添加以下来测量tcep的量;2.250μl ellmans缓冲液;3.10μl ellmans试剂(4mg/ml);4.50μl样品(1:10稀释);5.读取multiskan读板器上的450nm处的样品;通过a 280nm获取蛋白质回收;6.将4μl的样品移液在nanodrop one上并测量a 280nm。
[0228]
图13是示出了使用7k和40k共混物(与以1:1比率共混的右旋糖酐和peg二胺化学物质共混)去除还原剂tcep的条形图,并且将tcep去除与非改性7k和40k尺寸排阻树脂进行了比较,并且还与包括ff4共混物的非尺寸排阻柱进行了比较。黑色条显示了回收的蛋白质%。灰色条以%形式表示去除的tcep的量。40k和7k树脂去除了7.3%和1.8%的tcep,而40k共混物和7k共混物去除了98.5%和88.7%的tcep。作为在非尺寸排阻树脂上制成的共混物的ff4共混物去除了42.7%的tcep。与展示出68.9%和72.3%的相对较好的蛋白质回收的40k和7k共混物相比,ff4共混物还具有相对较差的蛋白质回收(36.4%)。
[0229]
实例6:用于小分子生物素的去除的经共混的组合物
[0230]
图14描绘了使用本公开的7k和40k共混物去除游离/未经反应的生物素。实验如下:
[0231]
生物素去除方案:1.将1ml 50%树脂浆液移液到位于收集管中的旋转柱中;2.在1000x g下持续2分钟旋转出液体;3.更换收集管并将生物素化抗体样品添加到样品中的每个样品的每个旋转柱中;4.通过在1000x g下离心2分钟从样品中去除游离生物素。
[0232]
评估生物素去除:1.通过为比色皿中的每个样品添加以下来测量生物素的量;a)800μl的pbs缓冲液;b)100μl的比色haba;c)100μl样品(1:10稀释);2.读取multiskan读板器上的500nm处的样品。
[0233]
评估生物素化蛋白质回收:1.将10μl的样品移液在96孔板上;2.根据制造商说明书制备pierce tm rapid gold bca蛋白质测定工作试剂;3.向孔中添加200μl的工作试剂;4.在室温下对板进行5分钟温育;5.读取multiskan读板器上的480nm处的吸光度。
[0234]
图14是示出了使用7k和40k共混物(如以上实例中所描述的)去除游离/未经反应的生物素与使用非改性7k和40k树脂以及ff4共混物(如以上实例中所描述的)去除游离生物素相比的条形图。黑色条表示(gam ab)的蛋白质回收%,并且灰色条以%形式表示去除的游离生物素的量。如所展示的,非改性40k和7k载体分别去除了40%和38.75%的游离生物素,而40k共混物和7k共混物分别去除了80.31%和72.7%的未经反应的/游离生物素。ff4共混物(非尺寸排阻共混物)显示了去除了89.49%的生物素。然而,ff4共混物的蛋白质回收较差,示出了21.4%的蛋白质回收。相比之下,40k和7k共混物表现出良好的蛋白质回收。
[0235]
图12、图13和图14显示了与使用非改性40k和7k尺寸排阻柱相比,使用改性40k和7共混物对包含示例性染料、生物素和还原剂的小分子的相对优异的去除。使用如ff4等非排阻树脂的蛋白质回收相对较差。
[0236]
实例7:用于小分子的去除的经共混的组合物
[0237]
图12、图13和图14显示了与使用非改性40k和7k尺寸排阻柱相比,使用改性40k和7共混物对包含示例性染料、生物素和还原剂的小分子的相对优异的去除。使用如ff4等非排
阻树脂的蛋白质回收相对较差。
[0238]
还用交联剂试剂4-(n马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(smcc)执行了另外的实验,并且结果在下表2中总结。
[0239]
表2显示了使用以上实例中描述的各种共混物对包含染料(荧光素)、生物素、tcep和smcc的几种不同小分子的蛋白质回收的%。如可以看到的,包括非尺寸排阻树脂ff4的共混物对所有小分子的蛋白质回收最小。尽管通过ff4去除了生物素(如实例8所示),但蛋白质回收百分比仍低于最优。
[0240]
表2
[0241]
共混物染料(荧光素)生物素tcepsmcc40k共混物95.7%62.6%68.9%63.1%7k共混物111.9%113.2%72.3%83.8%ff4共混物15.5%21.6%36.4%2%
[0242]
图15和图16是来自实验的条形图,其显示了蛋白质回收和alexa fluor
tm
555去除已经由对应于图12的凝胶量化的带,以确定来自所测试的组合物中的每种组合物中的蛋白质回收%和游离染料去除%。灰色条表示染料去除%,并且黑色条表示蛋白质回收%。如图15和图16所展示的,非改性尺寸排阻树脂40k zeba和7k zeba树脂无法高效去除游离荧光素或游离alexa fluor
tm
555。相比之下,本公开的改性40k和7k共混组合物能够去除》96%的荧光素和》93%的alexa fluor
tm
555。非尺寸排阻ff4共混物表现出gar-荧光素缀合蛋白和gam-alexa fluor
tm
555缀合蛋白两者的蛋白质回收较差,其中蛋白质回收分别为15.5%和14.5%。
[0243]
图17的实验步骤如下:1.在pbs中制备1.33mm bs3交联剂溶液;2.将1ml的50%树脂浆液移液到位于收集管中的旋转柱中;3.在1000x g下持续2分钟旋转出液体;4.更换收集管并向每个旋转柱中添加bs3溶液;5.通过在1000x g下离心2分钟去除bs3。
[0244]
评估bs3去除:1.通过将50μl流过液与450μl pbs混合,在pbs中制备1:50稀释的每种流过液样品;2.在500μl比色皿中读取uv cary上的280nm处的样品。
[0245]
评估bs3交联的蛋白回收:1.将10μl的样品移液在96孔板上;2.根据制造商说明书制备pierce
tm rapid gold bca蛋白质测定工作试剂;3.向孔中添加200μl的工作试剂;4.在室温下对板进行5分钟温育;5.读取multiskan读板器上的480nm处的吸光度。
[0246]
图17的实验步骤如下:1.在pbs中制备1.33mm smcc交联剂溶液;2.将1ml的50%树脂浆液移液到位于收集管中的旋转柱中;3.在1000x g下持续2分钟旋转出液体;4.更换收集管并向每个旋转柱中添加smcc溶液;4.通过在1000x g下离心2分钟去除smcc。
[0247]
评估smcc去除:1.通过将50μl流过液与450μl pbs混合,在pbs中制备1:50稀释的每种流过液样品;2.在500μl比色皿中读取uv cary上的280nm处的样品。
[0248]
评估smcc交联的蛋白回收:1.将10μl的样品移液在96孔板上;2.根据制造商说明书制备pierce tm rapid gold bca蛋白质测定工作试剂;3.向孔中添加200μl的工作试剂;4.在室温下对板进行5分钟温育;5.读取multiskan读板器上的480nm处的吸光度。
[0249]
图17和图18是显示了用作交联剂的小分子的跳线图,所述交联剂包含已使用这些树脂去除的双(磺基琥珀酰亚胺基)辛二酸酯(bs3)和4-(n马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(smcc)。图17显示了bs3交联剂的去除,并且图18显示了smcc交联剂的去
除。在图17中,灰色条对应于以%计的bs3去除,并且表明非改性40k和7k zeba树脂去除了69.1%和63.7%的bs3交联剂,而包括40k共混物和7k共混物的本发明组合物去除了85.9%和88%的bs3交联剂。ff4共混物去除了80%的bs3,然而ff4的蛋白质回收性质为仅约51%。相比之下,40k共混物和7k共混物的本发明组合物的蛋白质回收为80.6%和89.7%。
[0250]
在图18中,灰色条表示以%计的smcc去除,并且表明非改性40k和7k zeba树脂去除了61.6%和53.7%的smcc交联剂,而40k共混物和7k共混物的本发明组合物共混物分别去除了85.9%和89.4%的smcc交联剂。本组合物共混物的性能比非改性7k和40k好20%。ff4共混物去除了84.3%的交联剂,然而ff4的蛋白质回收性质相对较差,并且回收了仅2%的蛋白质。相比之下,40k共混物和7k共混物显示出63.1%和83.8%的蛋白质回收。
[0251]
诸位发明人还表明,包括右旋糖酐和pda部分的共混物以及固定到尺寸排阻载体上的右旋糖酐和eda部分的共混物的本公开的组合物可以去除显著大量的还原剂,如二硫苏糖醇(dtt)。这在图19中进行了描述,在所述附图中黑色条表示dtt的去除%,并且灰色条表示山羊抗兔igg的蛋白质回收%。7k树脂去除了》95%的dtt,其中蛋白质回收》85%。
[0252]
实例8:本公开的组合物对用于蛋白质回收和小分子的去除的其它现有产品(染料、生物素、
[0253]
还原剂)
[0254]
与包括针对类似用途出售的其它现有产品的柱相比,本公开的组合物对于染料、生物素和还原剂去除表现出更好的性能以及优异的蛋白质回收。
[0255]
图20a和图20b描绘了包括本公开的组合物或包括来自其它供应商的针对类似用途出售的产品的旋转柱的用途,以及标准透析,以将染料去除和蛋白质回收进行比较。使用了包括本公开的组合物的旋转柱或包括来自其它供应商的产品的旋转柱以从用10摩尔过量的alexa fluor
tm
647标记的10mg/ml山羊抗兔igg的100μl样品中去除游离alexa fluor
tm
647染料。将相等体积的来自每个流过液的样品和起始样品(泳道7)上样在凝胶中。在将样品在电泳凝胶上运行并在ibright fl1500成像系统(赛默飞世尔科技公司)上成像之后,使用ibright分析软件对游离染料去除进行定量。
[0256]
图20a描绘了用以下进行的电泳凝胶:泳道1:包括本公开的组合物的用于染料和生物素去除的旋转柱;泳道2:biorad p-30;泳道3:g-biosciences gt-100;泳道4:g-biosciences gt-600;泳道5:ge pd10;泳道6:赛默飞世尔科学公司slide-a-lyzer g2透析盒3.5k mwco;泳道7:(阳性对照)起始样品,10mg/ml山羊抗兔igg 10摩尔过量alexa fluor
tm
647。
[0257]
图20b描绘了显示旋转柱的染料去除和蛋白质回收的图形数据,其包含:用于小分子去除的本公开组合物(第一组条)、biorad p-30(标记为“br”的第二组条)、g-biosciences gt-100(第三组标有“gb 1”的条)、g-biosciences gt-600(第四组标有“gb 6”的条)、ge pd10(第五组标有“ge”的条)。
[0258]
如图20a和20b所见,本公开的旋转柱提供了与来自其它供应商的产品相比更高的染料去除与优异的蛋白质回收。
[0259]
图21描绘了包括本公开的组合物的旋转柱或包括来自其它供应商的出售的用于类似用途的产品的旋转柱的用途,以将生物素去除和蛋白质回收进行比较。
[0260]
包括本公开的组合物的旋转柱或包括来自其它供应商的产品的旋转柱用于去除
生物素。100μl样品中存在0.27mm的游离nhs lc生物素。通过pierce
tm rapid gold bca测定试剂盒(赛默飞世尔科技公司目录号#a 53225)对用20x的nhs-lc-生物素标记的山羊抗小鼠(2mg/ml)的蛋白质回收进行了评估。使用了赛默飞世尔科技公司生物素定量试剂盒(赛默飞世尔科技公司目录号#28005)以对游离生物素去除进行定量。
[0261]
图21描绘了显示包括以下的旋转柱的生物素去除和蛋白质回收的图形数据:用于小分子去除的本公开的组合物(第一组条)、biorad p-30(标记为“br”的第二组条)、g-biosciences gt-100(标记为“gb 1”的第三组条)、g-biosciences gt-600(标记为“gb 6”的第四组条)、ge pd10(标记为“ge”的第五组条)。
[0262]
如图21所见,本公开的旋转柱提供了与来自其它供应商的产品相比更高的生物素去除与更高的蛋白质回收。
[0263]
图22描绘了包括本公开的组合物的旋转柱或包括来自其它供应商的出售的用于类似用途的产品的旋转柱的用途,以将还原剂去除进行比较。
[0264]
包括本公开的组合物的旋转柱或包括来自其它供应商的产品的旋转柱用于从于pbs中的含有25mm tcep的1mg/ml山羊抗兔igg中去除还原剂tcep。通过向2ml柱施加700μl的样品来执行还原剂去除。使用ellman测定执行了相比于起始样品从流过液中进行的tcep去除的量化。
[0265]
图22描绘了显示包括以下的旋转柱的tcep去除的图形数据:用于小分子去除的本公开的组合物(第一组条)、biorad p-30(标记为“br”的第二组条)、g-biosciences gt-100(标记为“gb 1”的第三组条)、g-biosciences gt-600(标记为“gb 6”的第四组条)、ge pd10(标记为“ge”的第五组条)。如可以看到的,与所测试的其它旋转柱相比,包括本公开的组合物的旋转柱中的tcep去除%要高得多。
[0266]
实例9:本公开的组合物对用于小分子(染料和生物素)的去除的透析
[0267]
将本公开的组合物与透析进行比较,所述透析是本领域中使用的用于从蛋白质中纯化小分子杂质的标准方法。本公开的组合物展示出对染料和生物素去除的更好的性能,在透析所需时间的一部分内蛋白质回收较高。
[0268]
如图23所示,将包括用于小分子去除的本公开的组合物的旋转柱与标准透析进行比较,以从用alexa fluor
tm
647(10摩尔过量)标记的10mg/ml山羊抗兔igg的样品中去除游离alexa fluor
tm
647染料。通过对起始样品和染料去除后的流过液的a280测量来评估蛋白质回收。在将样品在电泳凝胶上运行并在ibright fl1500成像系统(赛默飞世尔科技公司,产品#a44241)上成像之后,使用ibright分析软件对游离染料去除进行定量。
[0269]
如图23中的图形数据所见,包括用于小分子去除的本公开的组合物的旋转柱的染料去除和蛋白质回收(第一组条)优于用于透析的那些。此外,相比于过夜用三次缓冲液更换进行透析,使用本公开的旋转柱的方法仅需要15分钟。因此,本发明组合物和方法在比透析显著更快的一步过程中提供了令人惊讶的纯蛋白质以及小分子的去除。
[0270]
图24描绘了与用于去除游离nhs-lc-生物素的标准透析相比,包括用于小分子去除的本公开的组合物的旋转柱的数据。通过rapid gold bca测试(赛默飞世尔科技公司,产品#a53225)对用20x的nhs-lc-生物素标记的山羊抗小鼠(2mg/ml)的蛋白质回收进行评估。
[0271]
如图24中的图形数据所见,包括用于小分子去除的本公开的组合物的旋转柱的生物素去除和蛋白质回收(第一组条)优于用于透析的那些。此外,相比于过夜用三次缓冲液
更换进行透析,使用本公开的旋转柱的方法仅需要15分钟。因此,本发明组合物和方法在比透析显著更快的一步过程中提供了令人惊讶的纯蛋白质以及小分子的去除。
[0272]
实例10:旋转板装置中的用于小分子去除的本公开的组合物
[0273]
将本公开的组合物放置在用于测试小分子的去除的旋转板装置中。在一些实施例中,将本公开的组合物放置在96孔过滤板中以测试从多个样品中对小分子的高通量去除。
[0274]
如在图25中可以看到的,将用于小分子的去除的本公开的组合物放置在96孔过滤板中以从用10摩尔过量的alexa fluor
tm
647标记的10mg/ml山羊抗兔igg的50μl(泳道1和2)和100μl样品(泳道3和4)中去除游离alexa fluor
tm
647染料。将相等体积的来自每个流过液的样品和起始样品(泳道5,阳性对照)上样在凝胶中。在将样品在电泳凝胶上运行并在ibright fl1500成像系统(赛默飞世尔科技公司,产品#a44241)上成像之后,使用ibright分析软件对游离染料去除进行定量。证明了染料去除和出色的蛋白质回收。
[0275]
实例11:用于小分子荧光素染料的去除的本公开的组合物
[0276]
将本公开的组合物放置在旋转柱中以测试荧光素染料的去除。
[0277]
如图26中可以看到的,将用于小分子的去除的本公开的组合物放置在旋转柱中以从用15摩尔过量的荧光素标记的10mg/ml山羊抗兔igg的100μl样品中去除游离荧光素染料(赛默飞世尔科技公司目录号#46410)。将相等体积的来自每个流过液的样品(泳道1-3)和起始样品(泳道4)上样在凝胶中。在将样品在电泳凝胶上运行并在ibright fl1500成像系统(赛默飞世尔科技公司,产品#a44241)上成像之后,使用ibright分析软件对游离染料去除进行定量。证明了染料去除和出色的蛋白质回收。
[0278]
实例12:用于免疫荧光应用的本公开的组合物
[0279]
发现本公开的组合物、装置和方法可用于免疫荧光应用。
[0280]
在一个实例中,用alexa fluor
tm
647(赛默飞世尔科技公司,产品#a20006)标记hdac2多克隆抗体(赛默飞世尔科技公司,产品#pa1-861),随后使用包括用于去除小分子的本公开的组合物的旋转柱从未经反应的染料中进行纯化。图27a和图27b显示了hdac2(红色)在a549细胞中的免疫荧光分析。在室温下用含4%多聚甲醛的pbs将细胞固定15分钟,用含0.1%triton x-100的pbs渗透15分钟,并且用含1%bsa的pbs封闭。在室温下避光在封闭缓冲液中以2.5μg/ml的稀释度通过使用具有本公开的组合物的旋转柱清洁(图27b)以及通过不使用本公开的旋转柱不清洁(图27a)未经反应的染料持续1小时,用hdac2多克隆抗体(即alexa fluor
tm
647缀合物)对细胞进行染色。
[0281]
如所看到的,与具有显著降低的残余背景的图27b相比,图27a显示了许多背景荧光。
[0282]
在另一实例中,将免疫荧光中的小分子染料的清洁与使用出售的用于类似用途的现有产品的清洁进行了比较。
[0283]
用alexa fluor
tm
647(赛默飞世尔科技公司,产品#a20006)标记pmp70多克隆抗体(赛默飞世尔科技公司,产品#pa1-650),随后使用包括用于去除小分子的本公开的组合物的旋转柱从未经反应的染料中进行纯化。如下完成a549细胞中的pmp70(原始为红色,然而此处以黑白图显示)的免疫荧光分析。在室温下用含4%多聚甲醛的pbs将细胞固定15分钟,用含0.1%triton x-100的pbs渗透15分钟,并且用含1%bsa的pbs封闭。在室温下避光在封闭缓冲液中以2.5ug/ml的稀释度通过1)不清洁(图28a)、2)使用现有产品ge pd-10柱清洁
(图28b),以及3)使用的本公开的旋转柱(图28c)清洁未经反应的染料持续1小时来用pmp70单克隆抗体(即alexa fluor
tm
647缀合物)对细胞进行染色。用含稀释度为10,000的hoechst染料的封闭缓冲液对核(原始为蓝色,但此处以黑白图显示)进行染色。
[0284]
如所看到的,图28a显示了许多背景免疫荧光,在图28b中看到背景荧光减少,并且图28c显示了显著残余背景荧光,这表明使用本公开的旋转柱对染料的出色清洁。
[0285]
在又另一实例中,用alexa fluor
tm
488(赛默飞世尔科技公司,产品#a20000)标记zo-1单克隆抗体(赛默飞世尔科技公司,产品#ma3-39100),随后使用包括用于去除小分子的本公开的组合物的旋转柱从未经反应的染料中进行纯化。在caco-2细胞中完成zo-1的免疫荧光分析(原始为绿色,但此处以黑白图显示)。在室温下用含4%多聚甲醛的pbs将细胞固定15分钟,用含0.1%triton x-100的pbs渗透15分钟,并且用含1%bsa的pbs封闭。在室温下避光以5ug/ml的稀释度在阻断缓冲液中用通过使用具有本公开的组合物的旋转柱(图29b)清洁,以及通过不使用本公开的旋转柱不进行清洁(图29a)持续1小时来用zo-1多克隆抗体(即,alexa fluor
tm
488缀合物)对细胞进行染色。
[0286]
如所看到的,与具有显著降低的残余背景的图29b相比,图29a示出了许多背景荧光。
[0287]
实例14:本公开的组合物对用于蛋白质回收和小分子的去除的离子交换树脂
[0288]
使用组装到0.8ml旋转柱中的0.5ml树脂床体积(如以上和以下不同描述的各种化学物质的树脂床体积)进行了用于去除小分子(此实例)的所有实验以产生本公开的非限制性实施例设备。在此特定实施例中,用本公开的组合物(在对应附图中标记为roomba)或用离子交换树脂dowex填充旋转柱。使旋转柱在1000x g下旋转2分钟以去除储存溶液。然后将旋转柱放置在清洁的2ml离心管中。将50μl、250μl和400μl的样品体积添加到树脂的中心,并且使柱在1000x g旋转2分钟,并且将流过液收集在2ml管中。收集流过液。将10μl的流过液添加到90μl的样品缓冲液中。然后在4-20%tris glycine sds凝胶上每孔添加10μl的此样品缓冲液。使凝胶运行40分钟,并且随后使用ibright成像仪(赛默飞世尔科技公司)进行成像。
[0289]
此实验使用了两种浓度的山羊抗兔alexa fluor
tm
594缀合物(“gar-594”)——1mg/ml(图30a中描绘的凝胶)和10mg/ml(图31a中描绘的凝胶)。
[0290]
图30a、30b、31a和31b中使用的载体:
[0291]
泳道1-3使用了右旋糖酐peg二胺共混物(本公开的组合物),在图30a-31b中标记为roomba。
[0292]
泳道4-6使用了dowex(非改性离子交换树脂)
[0293]
图30a、30b、31a和31b中使用的抗体染料缀合物的体积:
[0294]
泳道1和泳道4-50μl
[0295]
泳道2和泳道5-250μl
[0296]
泳道3和泳道6-400μl
[0297]
泳道开始-未经清洗的样品(10mg/ml gar-594缀合物,图30a或1mg/ml gar-594缀合物,图31b)
[0298]
这些实验的结果以图30a和31b的凝胶描绘并且在图30b和31b的条形图中描绘。
[0299]
图30a和30b描绘了当以与10mg/ml的染料抗体缀合物不同的体积(50μl、250μl和
400μl)添加到具有不同载体,即,本公开的组合物、右旋糖酐peg 20k共混物(在图30a和30b中标记为roomba)和纯离子交换树脂(未改性离子交换树脂)、dowex的旋转柱中时,去除另一种示例性小分子游离染料alexa fluor
tm
594。
[0300]
标记为“开始”的泳道示出了如以上部分所描述的传递的“未经清洁的”样品(这对应于其中来自蛋白质混合物的未结合染料未旋转以去除染料的阳性对照)。泳道“开始”中的前两个带对应于减少的抗体(轻链和重链)。底部的带对应于游离染料alexa fluor
tm
594。在图30a中,当将前两个带与“开始”泳道进行比较时,泳道1、2和3显示出良好的蛋白质回收。另外,泳道1-3中缺少底部游离染料带,这表明通过具有本公开的树脂组合物的旋转柱去除了游离染料。相比之下,泳道4显示了,当以50μl将缀合物添加到非改性离子交换树脂床时,用离子交换树脂进行的蛋白质回收丧失。这表明当将10mg/ml gar-alexa fluor
tm
594缀合物添加在50μl到500μl的树脂床处时,用右旋糖酐-peg二胺共混物得到了良好的回收,而dowex树脂中的蛋白质产率丧失,所述树脂床具有本公开的组合物右旋糖酐-peg二胺树脂共混物。使用ibright分析软件生成的图形与图像良好相关。
[0301]
图31a描绘了当以不同体积(50μl、250μl和400μl)的1mg/ml的染料抗体缀合物添加时使用不同载体,即,本公开的组合物、右旋糖酐peg 20k共混物和纯离子交换树脂(未改性离子交换树脂)、dowex去除小分子游离染料alexa fluor
tm
594。
[0302]
标记有“开始”的泳道显示出如以上部分中所描述的进行处理的“未经清洁的”(阳性对照)样品。泳道“开始”中的前两个带对应于减少的抗体(轻链和重链)。底部的带对应于游离染料alexa fluor
tm
594。当将前两个带与“开始”泳道进行比较时,图31a中的泳道1、2和3显示出良好的蛋白质回收。另外,泳道1-3中缺少底部游离染料带,这表明用通过本公开的组合物去除了游离染料。泳道4、5和6显示出,当以50μl、250μl和400μl将1mg/ml抗体染料缀合物添加到树脂床时,用离子交换树脂进行的蛋白质回收丧失。这表明,在1mg/ml的gar-alexa fluor
tm
594缀合物的所测试所有体积50μl、250μl、400μl下,与经右旋糖酐-peg二胺共混的树脂相比,dowex树脂的蛋白质回收较差。使用ibright分析软件生成的图形与图像良好相关。
[0303]
图30b和31b中示出的条形图对蛋白质回收的%和染料去除的染料的%进行量化,并且显示了当将0.05mg到4mg gar 594ab-染料缀合物上样时用本公开的组合物(在图30b和31b中描绘为roomba)进行的蛋白质回收》90%,其中染料去除》90%。
[0304]
相比之下,dowex提供了》90%的蛋白质回收以及》90%的染料去除,然而这仅在较低规模下高得多的蛋白质浓度下,即当将2.5mg到4mg的gar 594ab-染料缀合物上样时才发生。
[0305]
此数据显示,与非改性仅离子交换树脂(如dowex)相比,本公开的组合物提供了约50x多的灵活性的更大的灵活性,并允许在更宽范围的样品蛋白质浓度和体积下进行蛋白质回收。
[0306]
因此,此实例证明了本公开的组合物跨宽范围的低和高样品蛋白质浓度以及高和低样品蛋白质体积中实现了高蛋白质回收以及高效的小分子去除(基本上所有小分子的去除)。相比之下,离子交换剂dowex的限制在于其仅在高样品蛋白质浓度和高蛋白质体积下工作,但不能高效去除小分子或在较低样品蛋白质体积和浓度下不具有高蛋白质回收。有利地,本发明组合物、装置和方法提供了高得多的蛋白质回收,即使在要从小分子污染物中
纯化非常低浓度的样品蛋白质时也是如此。
[0307]
以上描述的实验是用dowex或放置在旋转柱中的本公开的组合物完成的。在其它实验中(数据未示出),用于小分子去除的批量处理对于本公开的组合物对dowex是以大批量完成的。所述方法涉及:采用本公开的组合物或dowex的大批量干燥树脂;添加与可以具有自由浮动小分子污染物(如抗体-染料缀合物)的小分子缀合的蛋白质;将干燥树脂与和小分子缀合的蛋白质混合;以及收集滤液中的所缀合蛋白,在滤液中游离未结合的小分子与dowex或本公开的组合物结合。在这些实验中,注意到使用纯离子交换柱dowex需要改变ph(降低ph)以允许离子交换剂与小分子结合。此额外ph改变步骤不是对于本公开的组合物所需要的。因此,本公开的组合物的另外的优点是步骤的数量减少并易于分离。
[0308]
********
[0309]
本文公开的每个实施例可以与所公开的任何其它实施例一起使用或以其它方式组合。任何实施例的任何元素都可以在任何实施例中使用。尽管已经参考具体示例实施例描述了要求保护的实施例,但本领域的技术人员将理解,在不脱离所要求保护的发明的真实精神和范围的情况下,可以做出各种改变并且可以用等同物替代其元素。此外,可以在不脱离本发明的基本教导的情况下进行修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。