1.本发明属于植物组织培养技术领域,特别涉及一种德氏兜兰组织培养快速繁殖及栽培方法。
背景技术:
2.德氏兜兰,又称越南美人兜兰,是兰科杓兰亚科兜兰属宽瓣亚属植物,主要分布于越南、中国的广西及云南等地,其花具有香味,萼片和花瓣均呈白色,唇瓣呈深囊状,近球形,粉红色至浅紫红色,具有较高的观赏价值,是兜兰园艺育种良好的亲本材料。德式兜兰野外资源濒临灭绝,被世界自然保护联盟(iucn)列为极危(cr)物种,目前野生植株大约仅有200株,因此亟需开展德氏兜兰种质资源保护及人工繁育工作。
3.德式兜兰和其他兜兰属物种一样,目前常用的繁殖方式有种子繁殖和分株繁殖两种方法,分株繁殖为传统繁殖方式,其繁殖系数低、速度慢,难以满足对野生资源保育和开发利用的需求。种子繁殖包括共生萌发(与真菌共生)和非共生萌发(无菌播种)两种,共生萌发需要特定的真菌和环境,且繁殖系数低需要的时间更长。因此,通过种子非共生萌发获得大量种苗是兜兰属植物较为常用的繁殖方式。申请号为202110156474.5中国专利公开了一种德氏兜兰种子非共生萌发的方法,采用德氏兜兰种子作为外植体,通过在特定的培养基上和光环境条件下进行播种、分化和壮苗与生根培养成苗,但是存在种子萌发率低(60d萌发率最高为47.7%),培养期间光照条件控制复杂、不同时期需要不同光源和波长,而且没有明确德氏兜兰最佳的蒴果成熟度等。德式兜兰在培育过程中和其他大多数兜兰属植物一样,试管苗发育较缓慢,难以短时间大量繁育,移栽难度较大。通过对多种不同培养基的培养试验,探索其丛生芽增殖和培育壮苗的最佳方案是快速扩大组培苗数量和促进组培苗移栽成活的重要措施。但兜兰的试管成苗过程受兜兰种类、外植体种类、培养基种类等多种条件影响。
4.德氏兜兰的无性组织培养与其他兜兰属植物一样,通常是以芽、叶片和根系为外植体进行繁殖,但由于外植体去污难、易褐化及增殖速度慢等原因,其无性组织培养难度极大,德式兜兰的无性克隆繁殖技术也鲜有报道。。表现优异的野生种和选育的新品种因种苗难以规模化生产而未得到大规模推广,严重影响了兜兰资源保育和产业的发展。因此,兜兰的无性克隆繁殖技术的问题亟待解决。
技术实现要素:
5.本发明的目的在于提供一种德氏兜兰组织培养快速繁殖方法,通过德氏兜兰种子非共生萌发培养、原球茎增殖和分化、茎尖离体诱导培养成小苗、壮苗生根、炼苗移栽等步骤培养健壮的德氏兜兰种苗,建立德式兜兰非共生萌发及无性克隆组织培养快速繁殖技术体系。
6.为实现上述目的,本发明提供了一种德氏兜兰组织培养快速繁殖及栽培方法,包括以下步骤:
10(n-p2o
5-k2o)的肥液;生产期间,基质内部树皮表面发白时,一次性浇透水。
17.与现有的技术相比,本发明具有如下有益效果:1. 本发明的德氏兜兰组织培养快速繁殖及栽培方法,通过无菌播种、增殖继代培养、茎尖离体培养、生根壮苗、炼苗移栽以及菌根真菌促生栽培等步骤,建立德式兜兰非共生萌发、无性克隆组织培养快速繁殖技术体系以及高速栽培技术,德式兜兰非共生萌发无暗处理,生长周期更短;无性克隆组织培养快速繁殖技术包括萌发培养基、增殖培养基、茎尖离体培养基和生根壮苗培养基,用于德氏兜兰的组培快繁,能够快速培养大量健壮的德氏兜兰种苗,种苗萌发率高、健壮、生长周期短,移栽成活率达百分之百;高效栽培技术,有利于提高德式兜兰种苗移栽后培养成健壮植株,缩短栽培周期,促进植株开花;应用于迁地保护、自然回归和产业发展,有利于珍稀濒危野生德氏兜兰的资源保护和可持续发展,并能较好地促进兜兰产业的发展。
18.2. 本发明的德氏兜兰组织培养快速繁殖及栽培方法,通过优化德氏兜兰蒴果成熟度选取和优化萌发培养基的成分及成分含量,提高种子培养萌发率、缩短萌发时间,萌发率可达75.3%以上,萌发时间最短为48天;优化原球茎增殖分化培养基和加入的激素成分和成分含量,提高原球茎增殖系数,促进原球茎分化生长。
19.3. 本发明的德氏兜兰组织培养快速繁殖及栽培方法,采用非共生萌发繁育的无菌组培苗茎尖作为外植体进行培养,可以极大减少培养过程中污染,优化诱导培养基,提高诱导成活率和增殖系数,为经愈伤组织繁殖的无性克隆技术提供技术依据。
20.4. 本发明的德氏兜兰组织培养快速繁殖及栽培方法,通过筛选合适的菌剂进行菌根真菌促生栽培,以及合理的水肥管理、病虫害防治,促进移栽后德式兜兰苗的生长,缩短栽培周期,德式兜兰植株生长健壮,移栽后栽培2.5~3年后开花。
21.5. 本发明的德氏兜兰组织培养快速繁殖及栽培方法,方法简单易操作,生产成本低,为德氏兜兰种质创新、迁地保护、野外回归和商业化生产提供很好的基础。
附图说明
22.图1为本发明实施例1中德氏兜兰组织培养快速繁殖各阶段德氏兜兰不同形态照片,a:种子萌发,b:组培苗,c:茎尖培养长成的小苗,d:生根壮苗培养基中的健壮小苗,e:移栽后的成苗;f:开花的植株。
具体实施方式
23.下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
24.以下实施例和对比例中德氏兜兰蒴果均为广西农业科学院花卉研究所兰科植物种质资源圃内引种驯化的野生德氏兜兰人工授粉获得的蒴果。以非共生萌发获得的德式兜兰无菌组培完整植株为茎尖离体培养繁殖的试验材料。
25.蒴果获取的具体过程为:选择品种纯正、植物学性状一致、农艺性状优良、生长健壮、无病虫害的德式兜兰开花植株;花盛开第6 d~15 d,移除母株花粉,去除母株唇兜或者将唇兜背部靠柱头处戳出洞;选择花型较好、生长健壮的异株花朵作父本,用牙签将父本花粉取出,放在干净的纸张上备用;取适量花粉涂抹在母株凹陷的柱头处;柱头授粉后套袋,
防止昆虫传播其它花粉;授粉后观察果荚变化,选取成熟度为180~240dap(授粉后天数)德氏兜兰蒴果。
26.胶膜菌a6-2和和镰刀菌a-8-2分别按照专利cn105861330b 和cn107746811b公开的分离培养得到。
27.实施例1一种德氏兜兰组织培养快速繁殖及栽培方法,包括以下步骤:(1)无菌播种:取成熟度为220dap(授粉后天数)德氏兜兰蒴果,用棉球蘸取酒精擦拭表面,用自来水冲洗、加入中性洗涤剂再次冲洗、酒精没过果荚浸泡1min,最后经流水冲洗15min后转入超净工作台内,换无菌瓶,75%乙醇浸泡30s进行表面灭菌、无菌水冲洗3次,洗去表面乙醇,1%升汞溶液浸泡10min灭菌,无菌水冲洗5次洗掉升汞,将果荚置于盘中稍沥干表面水分,切开果荚将种子均匀撒于萌发培养基表面;将蒴果内种子接种到萌发培养基中进行培养,萌发培养基为:1/2ms 100ml/l椰汁,种子萌发形成原球茎(见图1a),种子萌发率为75.3%,萌发时间为48d;其中,启动萌发时间以有肉眼可见培养基上种子有明显膨大形成20个左右原球茎为统计标准;启动萌发时间15d后,随机挑取培养基中的种子,每次统计记录100粒种子,数取其中萌发(胚突破种皮形成原球茎)的种子数,以统计萌发率,重复3次重复减少误差;(2)增殖继代培养:将步骤(1)得到的原球茎接种到增殖分化培养基中进行培养,增殖分化培养基为:1/3ms 0.75g/l花宝1号 0.75g/l花宝2号 30g/l蔗糖 6g/l琼脂 1.0mg/l 6-苄基腺嘌呤(6-ba) 0.1mg/l萘乙酸(naa) 1g/l活性炭,增殖分化培养基的ph为5.4,培养20~35d,增殖分化形成组培苗(培养30天后组培苗见图1b),增殖系数为3.5;(3)茎尖离体培养:选取步骤(2)得到的生长情况相近的健康的组培苗,切取茎尖接种诱导培养基中进行诱导培养,诱导培养基为:1/2ms 100ml/l椰汁 30g/l蔗糖 6g/l琼脂 0.6mg/l噻苯隆(tdz),诱导培养基的ph为5.4,培养30~45d形成小苗(培养40天后组培苗见图1c);(4)生根壮苗培养:将步骤(3)得到的小苗转接入生根培养基中培养成健壮小苗(见图1d),生根培养基为:1/2ms 1g/l花宝1号 1g/l花宝2号 100ml/l椰汁;步骤(1)、(2)、(3)、(4)中,培养条件为温度(25
±
2)℃,光照强度2000~3000lx,光照时间12h/d,光源为常规日光灯;(5)炼苗:当步骤(4)中的健壮小苗叶片数4~5片、叶长3.5~4.5cm时,将组培苗移至炼苗室内炼苗,炼苗室温度为18~30℃,光照强度为5000lx;炼苗10d后,移至栽培设施内自然条件下放置3 d,然后打开封口炼苗2d;(6)移栽及菌根真菌促生栽培包括以下步骤:
①
将经过炼苗后的小苗用清水洗净根部附着的培养基,用1000倍多菌灵或百菌清或甲基托布津溶液喷洒,在阴暗处晾干;
②
采用菌剂灌根法栽培:将角膜菌a6-2与清水按体积比1:3比例配制成菌剂悬浊液,然后将步骤
①
得到的小苗植株根部在菌剂悬浊液中浸泡2h,然后种植在装有兰石和松树皮按2:1的体积比配制得到的基质的塑料杯,塑料杯外口径为6cm,每杯种植1株,栽种后基质宜低于沿口约1.0 cm,淋透定根水;
③
种植3d后每植株在根部灌施5ml菌剂悬浊液,每隔10d灌施1次,共灌施4次;(7)栽培后苗期管理:包括:小苗管理、中苗管理、大苗管理;小苗管理包括:环境条件控制:种植后30d内光照强度宜控制在1800~3500lx,空气相对湿度85~90%,30d后逐步提高光照强度到5500~10000lx,空气相对湿度60~90%,温度控制在18~30℃;肥水管理:移栽淋透定根水后,3d内不浇水;移栽15d后,结合喷水加入1 000倍的尿素液或1/2ms大量元素的营养液作追肥喷施一次;定植20~25d后,选用2000~3000倍的9-45-15(n-p2o
5-k2o)肥液、2000~3000倍的20-20-20(n-p2o
5-k2o)肥液和4000倍的20-20-20(n-p2o
5-k2o)肥液,每隔7d交替喷施叶面;生产期间,基质内部树皮表面发白时,一次性浇透水;病虫害防治:定植后喷洒1000倍多菌灵或甲基托布津或百菌清消毒一次;15d内,每5d喷洒一次多菌灵或敌克松1000倍液防治猝倒病;中苗管理包括:移栽:当小苗根系布满穴盘孔洞或塑料杯时,除去小苗根部的基质,除掉烂根和无效根,将植株竖直放置在外口径为7.5cm塑料杯正中央,用基质a填埋种苗根系,基质以不没住种苗基部为度,栽种后基质宜低于盆沿约1.5cm,淋透定根水;基质a为:用兰石和松树皮按照2:1的体积比配制,兰石粒径0.7~1.0cm,树皮粒径0.7~0.9cm,ph为6;环境条件控制:温度15~30℃,空气相对湿度70~90%,光照强度逐步提高到7500 ~12000lx;肥水管理:移栽淋透定根水后,3d内不浇水;移栽15d后,浇灌3000倍的10-20-30(n-p2o
5-k2o)的肥液一次;定植20~25d后,喷施3000倍20-20-20(n-p2o
5-k2o)的肥液,每7~10d一次,每30d喷施一次3000倍的25-10-20(n-p2o
5-k2o)肥液;生产期间,基质内部树皮表面发白时,一次性浇透水;病虫害防治:移栽7d后,喷洒1000倍多菌灵与农用链霉素5000倍液混合液一次。
28.大苗管理包括:移栽:当中苗根系布满塑料杯时,除去中苗根部的基质,除掉烂根和无效根,将植株竖直放置在外口径为9.6cm塑料杯正中央,用基质b填埋种苗根系,基质以不没住种苗基部为度,栽种后基质宜低于盆沿约1.5cm,淋透定根水;基质b为:用兰石和松树皮按照2:1的体积比配制,兰石粒径1.0~1.5cm,树皮粒径1.0~1.3cm,ph为6.5;环境条件控制:温度15~30℃,空气相对湿度70~90%,光照强度逐步提高到8500 ~13000lx;肥水管理:移栽淋透定根水后,3d内不浇水;定植15~20d后,喷施2000倍20-20-20(n-p2o
5-k2o)的肥液,每7~10d一次;每15d喷施一次3000倍的10-20-30(n-p2o
5-k2o)肥液;在花芽抽出前2周,叶面喷施磷酸二氢钾及少量微量元素;开花期喷施1000~1500倍10-30-10(n-p2o
5-k2o)的肥液;生产期间,基质内部树皮表面发白时,一次性浇透水。
29.经过180天左右培养出健壮的组培苗(种苗),组培苗移栽后栽培约2.5年得到开花的德氏兜兰植株(见图1f)。
30.实施例2一种德氏兜兰组织培养快速繁殖及栽培方法,包括以下步骤:
(1)无菌播种:取成熟度为220dap(授粉后天数)德氏兜兰蒴果,用棉球蘸取酒精擦拭表面,用自来水冲洗、加入中性洗涤剂再次冲洗、酒精没过果荚浸泡1min,最后经流水冲洗15min后转入超净工作台内,换无菌瓶,75%乙醇浸泡30s进行表面灭菌、无菌水冲洗3次,洗去表面乙醇,1%升汞溶液浸泡10min灭菌,无菌水冲洗5次洗掉升汞,将果荚置于盘中稍沥干表面水分,切开果荚将种子均匀撒于萌发培养基表面;将蒴果内种子接种到萌发培养基中进行培养,萌发培养基为:1/4ms 100ml/l椰汁,种子萌发形成原球茎,种子萌发率为67.7%,萌发时间为52d;(2)增殖继代培养:将步骤(1)得到的原球茎接种到增殖分化培养基中进行培养,增殖分化培养基为:1/3ms 0.75g/l花宝1号 0.75g/l花宝2号 30g/l蔗糖 6g/l琼脂 1.0mg/l 6-苄基腺嘌呤(6-ba) 0.1mg/l萘乙酸(naa),增殖分化培养基的ph为5.4,增殖分化形成组培苗;(3)茎尖离体培养:选取步骤(2)得到的生长情况相近的健康的组培苗,切取茎尖接种诱导培养基中进行诱导培养,诱导培养基为:1/2ms 100ml/l椰汁 30g/l蔗糖 6g/l琼脂 0.4mg/l噻苯隆(tdz),诱导培养基的ph为5.4,形成小苗;(4)生根壮苗培养:将步骤(3)得到的小苗转接入生根培养基中培养成健壮小苗;生根培养基为:1/2ms 1g/l花宝1号 1g/l花宝2号 100ml/l椰汁 1mg/l萘乙酸(naa);(5)炼苗:与实施例1中相同;(6)移栽及菌根真菌促生栽培:
①
将经过炼苗后的小苗用清水洗净根部附着的培养基,用1000倍多菌灵或百菌清或甲基托布津溶液喷洒,在阴暗处晾干;
②
采用菌剂基质混合法栽培:用兰石和松树皮按2:1的体积比配制基质,基质ph为5.8,兰石粒径0.4~0.7cm,树皮粒径0.3~0.6cm;高温高压灭菌消毒处理,然后在基质中接入角膜菌a6-2,菌剂和基质的体积比为1:2,充分混合使用,室温放置3d,分装至外口径为6cm塑料杯中,将步骤
①
得到的小苗种植在塑料杯,每杯种植1株,栽种后基质宜低于沿口约1.0 cm,淋透定根水;(7)栽培后苗期管理:与实施例1中相同。
31.实施例3本实施例与实施例1不同之处在于:德氏兜兰蒴果的成熟度为180dap,其他步骤和参数与实施例相同。
32.实施例4本实施例与实施例1不同之处在于:德氏兜兰蒴果的成熟度为240dap,其他步骤和参数与实施例相同。
33.实施例5本实施例与实施例1不同之处在于:步骤(6)中菌剂灌根法栽培,采用镰刀菌a-8-2替代角膜菌a6-2,其他步骤与实施例1相同。
34.实施例6本实施例与实施例1不同之处在于:(6)组培苗移栽及菌根真菌促生栽培中,采用菌剂基质混合法栽培,具体步骤包括:
①
将经过炼苗后的小苗用清水洗净根部附着的培养基,用1000倍多菌灵或百菌清或甲基托布津溶液喷洒,在阴暗处晾干;
②
用兰石和松树皮按2:1的体积比配制基质,基质ph为5.8,兰石粒径0.4~0.7cm,树皮粒径0.3~0.6cm;高温高压灭菌消毒处理,然后在基质中接入镰刀菌a-8-2,菌剂和基质的体积比为1:2,充分混合使用,室温放置3d,分装至外口径为6cm塑料杯中,将步骤
①
得到的小苗种植在塑料杯,每杯种植1株,栽种后基质宜低于沿口约1.0 cm,淋透定根水;其他步骤与实施例1相同。
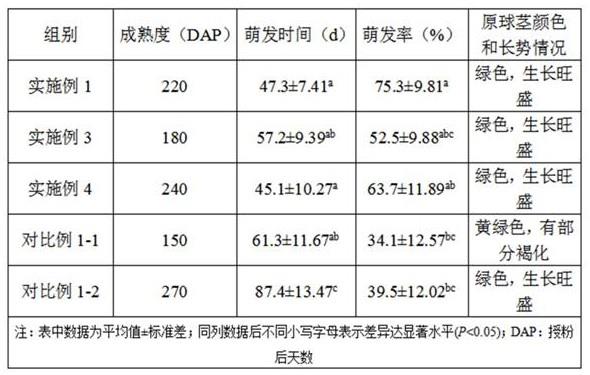
35.对比例1分别选取成熟度为150dap(对比例1-1)、270dap(对比例1-2)饱满德氏兜兰蒴果,采用与实施例1相同消毒处理德氏兜兰蒴果,然后切开果荚将种子均匀撒于萌发培养基(与实施例1相同)表面进行培养,每组随机剪取3个果荚,每组重复3次,统计对比例1-1、对比例1-2、实施例1、实施例3和实施例4组的种子萌发时间和萌发率,启动萌发时间以有肉眼可见培养基上种子有明显膨大形成20个左右原球茎为统计标准;启动萌发时间15d后,随机挑取培养基中的种子,每次统计记录100粒种子,数取其中萌发(胚突破种皮形成原球茎)的种子数,以统计萌发率,重复3次重复减少误差,计算萌发率。以上操作均于超净工作台上进行。具体结果如下表1,由表可知,德氏兜兰种子成熟度会影响到种子的萌发时间、萌发率、原球茎原色和长势,成熟度过低或者过度成熟都不利于种子的萌发,本发明的方法中选取的成熟度蒴果,种子萌发时间较短、萌发率较高、原球茎绿色、长势旺盛。
36.表1 各组德氏兜兰种子萌发时间、萌发率、原球茎颜色和长势情况对比例2取成熟度为220dap(授粉后天数)德氏兜兰蒴果,采用与实施例1相同消毒处理德氏兜兰蒴果,然后切开果荚将种子均匀撒于萌发培养基进行培养,萌发培养基为:1/2ms 1g/l蛋白胨。种子的种子萌发率为56.3%,萌发时间为54d,萌发率明显低于实施例1中萌发率,萌发时间比实施例1长。
37.对比例3本对比例与实施例1不同之处在于:增殖分化培养基中激素含量(6-ba、naa)和活性炭浓度不同,其他成分相同与实施例1相同,各组培养基的激素具体含量和活性炭具体浓度见表2,取采用实施例1中的德氏兜兰种子非共生萌发培养得到的原球茎接种到各组的增殖分化培养基进行培养,培养30d稳定后,调查各组增殖系数,增殖系数=增殖结束时的芽苗总数/增殖起始时的芽苗总数
×
100%,观察增殖分化形成的组培苗的生长情况,具体结果见表2。
38.从表2中可以看出,本发明的分化培养基有利于德氏兜兰原球茎增殖分化,活性炭浓度需要控制在一定范围内,过高的活性炭浓度会对原球茎生长产生了抑制作用。
39.表2 各组德氏兜兰原球茎增殖分化情况对比例4本对比例与实施例1不同之处在于:诱导培养基不同,对比例4-1~5采用不同浓度的6-ba和naa替换实施例1诱导培养基中tdz;其他成分相同与实施例1相同,对比例4-6采用低浓度(0.2mg/l)tdz,其他成分与实施例1相同;对比例4-7~9采用naa和tdz替代替换实施例1诱导培养基中tdz,其他成分与实施例1相同,本对比例中各组诱导培养基的激素成分具体见表3。切取实施例1中得到的组培苗的茎尖,分别接种至各组诱导培养基中进行培养,每个处理3次重复,每个重复接种8个茎尖。培养40天后,调查茎尖离体诱导成活率和增殖系数,具体结果见表3。结果表明采用本发明的诱导培养基能够提高诱导成活率,保证增殖系数。
40.表3 各组德氏兜兰茎尖离体诱导成活率和增殖系数
cm,淋透定根水;基质为用兰石和松树皮按2:1的体积比配制、高温高压灭菌消毒得到,基质ph为5.8,兰石粒径0.4~0.7cm;其他步骤和参数与实施例1相同。
42.将经过炼苗后的小苗,分别按照实施例1、实施例2、实施例5、实施例6、对比例6提供的栽培方法进行栽培,每个处理3次重复,每个重复30株苗。栽培120d后,清洗植株上的泥土并用吸水纸吸干植株表面水分,统计叶片数和根数,使用游标卡尺测量叶长和根长,使用分析天平秤量鲜重。德式兜兰开花后统计栽培周期,栽培周期的计算是以组培苗出瓶设施栽培至花盛开的时间。结果见表5。
43.由表5可知,采用镰刀菌a-8-2和角膜菌a6-2促生栽培较无菌剂添加的对比组长势好,采用多次灌根法处理的种苗明显较基质混合法的种苗长势好、生物量增长较大。
44.表5 各组德式兜兰组培移栽苗生物量增长的影响前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。