1.本发明属于皮肤溃疡技术领域,特别是涉及一种糖尿病猪慢性皮肤溃疡模型构建方法。
背景技术:
2.糖尿病慢性皮肤溃疡发病机制复杂,存在动物模型构建困难,临床治疗效果欠佳问题;
3.现有糖尿病猪慢性皮肤溃疡模型构建方式主要包括:局部放疗、局部施加压力、创造缺血性皮瓣或动脉结扎等方法;其中放疗导致的慢性创面不符合糖尿病及其并发症相关的慢性创面致病机制;缺血性皮瓣往往较大,不适宜在单个猪背部进行多处造创,需要的实验动物个体数量较多,实验成本高;动脉结扎后造创,适用于四肢远端的创面模型,同样存在单个动物造创数量有限,且对实验人员有较高的手术技能要求,存在技术难度高、实验成本高问题。
技术实现要素:
4.本发明的目的开发一种经济实用,易生产,且适宜较厚皮肤的猪慢性皮肤溃疡构建模型;同时提供慢性创面形成时间、病理变化与机制变化多个角度评估标准,检验其成模效益。
5.为解决上述技术问题,本发明是通过以下技术方案实现的:一种糖尿病猪慢性皮肤溃疡模型构建方法,具体步骤如下:
6.巴马小型猪糖尿病模型构建,在巴马小型猪体内构建糖尿病模型;
7.3d打印异物填塞设计,在猪表皮造创并在创口内部填充异物;
8.糖尿病慢性皮肤溃疡模型构建,在猪创口内构建慢性皮肤溃疡模型。
9.进一步地,所述巴马小型猪糖尿病模型构建具体步骤如下:
10.分组,雄性未去势巴马小型猪适应性喂养5周后,按照完全随机设计中的非平衡设计随机分为两组,实验组6只(d1-d6),对照组2只(c1、 c2);
11.巴马小型猪糖尿病模型的建立,对两组进行不同方案饲养,实验组:高脂高糖饲料喂养,对照组:对照饲料喂养;
12.饲养条件,温度控制在18~22℃,光照、黑暗各12小时/日,分笼喂养,自由饮水;
13.stz注射,对实验组体内注射stz;
14.血糖、胰岛素监测,检测实验组体内的血糖以及胰岛素数据。
15.进一步地,所述3d打印异物填塞设计具体步骤如下:
16.填塞异物设计,根据不同部位创面深度设计不同长度柱体,柱体填塞创面后给予局部异物接触与压迫作用;
17.具体设计方案,3d打印异物耗材设计软件为:solidworks,耗材生产通过fdm热熔堆积生产工艺采用allect 334机器进行生产;
18.造创,全麻后在小型猪脊柱两侧旁开3cm,使用手术刀切割5~6个直径为3cm的皮肤全层创面,创面间隔3~4cm;
19.慢性创面定义及其评估指标;
20.he染色;
21.免疫荧光检测巨噬细胞标记物;
22.实时荧光定量pcr检测炎症因子mrna动态变化。
23.进一步地,所述造创具体步骤如下:
24.术前准备,手术前一天为小型猪称重、备皮和标记好拟造创部位;
25.器械与耗材的准备,灭菌手术刀,剪刀(大,小),镊子(有齿,无齿),纱布,生理盐水,无菌手术衣,手术单,直角钩针,18、10号兽用缝合线,3d填塞异物等,提前准备肾上腺素,尼可刹米注射液急救备用;
26.麻醉,术前15min耳后皮下注射硫酸阿托品(0.05mg/kg),后注射舒泰50(0.08ml/kg,即4mg/kg),诱导麻醉;
27.创面,碘伏彻底消毒3遍后,使用手术刀沿皮肤标注区域切开皮肤直至脂肪层,去除皮肤全层组织直至深筋膜,形成全层皮肤缺损创面;
28.创面拍照与描摹,造创缝合结束后,擦干皮肤,对创面进行拍照,分别沿两侧创面边缘描摹用于面积计算;
29.异物填塞并固定,贴近猪背部皮肤,将圆环固定于皮肤表面,注意需将柱体固定圆孔端垂直于脊柱,便于柱体固定;
30.改善术后疼痛,在术后3天内肌注盐酸曲马多注射液1-2ml/只/天;后续根据个体状态调整;
31.造创后敷料交换,换药前30min肌注曲马多镇痛,创后每6天拆除固定缝线,将柱体拔出后,清理创面内坏死组织,后继续填塞清洁消毒后的柱体,并再次固定。
32.进一步地,所述慢性创面定义及其评估指标具体步骤如下:
33.时间评估标准,满足创面面积每周不能缩小10%~15%或超过一个月面积不能缩小50%或创面未愈合至少持续8周中的任意一条,则定义为慢性创面模型建立成功;
34.he病理评估指标,对创面组织进行炎症状态评估;
35.he新生表皮厚度测量,测量范围为新生肉芽与表皮交界区域,避开乳突区域的全层厚度。
36.进一步地,所述he染色具体步骤如下:
37.s1:选取切片,采用自动漂烘仪进行脱蜡,水化;
38.s2:苏木精染色10~20min后自来水冲洗1~3min;
39.s3:盐酸酒精分化5~10s后自来水冲洗1~3min;
40.s4:放入50℃的温水中或弱碱性水溶液返蓝,直到出现蓝色为止;
41.s5:自来水冲洗1~3min;
42.s6:放入85%的酒精3~5min;
43.s7:伊红染色3~5min后水洗3~5s;
44.s8:梯度酒精脱水
45.s9:二甲苯透明后中性树胶封固。
46.进一步地,所述免疫荧光检测巨噬细胞标记物具体步骤如下:
47.s1:将脱蜡后的切片滴加胰酶修复液,孵箱37℃孵育40min;
48.s2:pbs洗3次,每次5min;
49.s3:滴加10%血清封闭液,室温30分钟;
50.s4:滴加一抗(cd68,浓度:1:100),4℃过夜;
51.s5:pbs冲洗同s2项;
52.s6:滴加二抗,控制温度37℃持续30分钟;
53.s7:滴加dapi,室温孵育10min;
54.s8:pbs洗同s2项;
55.s9:使用抗荧光衰减封片剂封片;
56.s10:采用荧光扫描显微镜摄像系统对切片进行图像采集。
57.进一步地,所述糖尿病慢性皮肤溃疡模型构建具体步骤如下:
58.构建巴马小型猪糖尿病模型,通过高脂高糖饮食喂养14周后,联合stz 注射构建猪糖尿病模型;
59.异物填塞成功构建慢性皮肤溃疡模型,采用外科造创联合局部异物填塞压迫的方式构建慢性皮肤溃疡模型。
60.本发明具有以下有益效果:
61.本发明通过适用于皮肤组织较厚的大动物模型,尤其是猪;并且从多个角度对模型形成进行评估,从致病因素、病理变化与机制改变更好的模拟了糖尿病慢性皮肤溃疡的形成。
附图说明
62.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
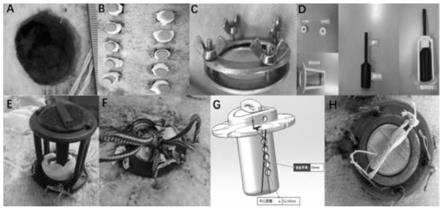
63.图1为本发明的填塞异物设计图;
64.图2为本发明的异物填塞具体操作应用图;
65.图3为本发明的固定圆环缝合图;
66.图4为本发明的慢性创面标本取材示意图;
67.图5为本发明的糖尿病慢性皮肤溃疡造创示意图;
68.图6为本发明的两组两次造创后第18天创面新生表皮厚度比较图;
69.图7为本发明的糖尿病慢性皮肤溃疡随时间变化的组织病理图;
70.图8为本发明的dcu模型构建期间两组小型猪创面组织病理评分图;
71.图9为本发明的两组巨噬细胞标志物cd68荧光强度对比图。
具体实施方式
72.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于
本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
73.请参阅图1-9所示,本发明为一种糖尿病猪慢性皮肤溃疡模型构建方法,具体步骤如下:
74.巴马小型猪糖尿病模型构建,在巴马小型猪体内构建糖尿病模型;
75.巴马小型猪糖尿病模型构建具体步骤如下:
76.分组,雄性未去势巴马小型猪适应性喂养5周后,按照完全随机设计中的非平衡设计随机分为两组,实验组6只(d1-d6),对照组2只(c1、 c2);
77.巴马小型猪糖尿病模型的建立,对两组进行不同方案饲养,实验组:高脂高糖饲料喂养,对照组:对照饲料喂养;
78.饲养条件,温度控制在18~22℃,光照、黑暗各12小时/日,分笼喂养,自由饮水;
79.stz注射,对实验组体内注射stz;
80.stz注射包括配置柠檬酸缓冲液、准备工作、水化、stz注射前、注射、注射后观察以及成模评判标准。
81.配置柠檬酸缓冲液:1.9212g柠檬酸(分子质量192.12)加入100ml 无菌水中配成a液,2.5807g柠檬酸三钠(分子质量258.07)加入100ml 无菌水中配成b液,将a、b液按1:1比例混合,测定ph并调节至4.5 左右。提前用0.22μm孔径滤器过滤高温高压消毒灭菌后备用。
82.准备工作:小型猪禁食12~18小时后测量体重,空腹耳尖血糖;提前安置耳缘静脉与后肢静脉留置针,耳缘静脉用于药物和葡萄糖等注射,后肢静脉用于采血监测血糖、胰岛素变化。
83.水化:每只猪滴注生理盐水500ml左右,留置针安好后,立即进行水化,以10ml/kg/h的速度水化1小时。
84.stz注射前:采空腹静脉血,用于检测空腹血糖和胰岛素。注射前10~ 30min肌注米达唑仑0.3mg/kg镇静,可以分为两次注射,先注射2/3,观察情况后决定是否追加剩余的1/3。
85.注射:首次stz注射剂量为125mg/kg,将称好的stz加入配好的柠檬酸缓冲液中(1g stz:10ml缓冲液),避光,低温,混匀,经耳缘静脉留置针注射stz,2~5分钟注射完,然后用10ml生理盐水冲管。立刻肌注胃复安0.25mg/kg抗吐;
86.注射后观察:严密观察每只小型猪的状态,每2h测耳尖血糖,采集静脉血,后根据耳尖血糖变化,调整测血糖频率。低血糖处理:stz注射24h 期间若血糖出现《3mmol/l,予以猪自由进食,如拒不进食则则给予耳缘静脉注射50%葡萄糖液;因个体差异,不同个体对stz反应时间有所不同,为避免低血糖的发生,前三天允许猪自由进食,高血糖处理:当出现糖尿病酮症或血糖》27.8mmol/l时,启用胰岛素治疗;目标:控制血糖《 27.8mmol/l;推荐方案:
①
甘精胰岛素皮下注射,4u起始,一天一次,根据实时血糖监测进行调整剂量。
②
诺和灵30r皮下注射,4u起始,一天两次,根据实时血糖监测进行调整剂量。观察一月后若能形成稳定的高血糖状态则不再注射stz,否则根据血糖情况再决定二次注射stz的剂量。
87.成模评判标准:在造模过程中,若小型猪无明显的多饮、多食、多尿和体重减少等症状,则以空腹血糖≥7.0mmol/l和随机血糖≥11.1 mmol/l;若仅有空腹血糖≥7.0mmol/l或随机血糖≥11.1mmol/l,则尚需在另外时间再重复一次,仍达以上标准者,才确诊为糖尿
病。必要时在成模后一个月后再行口服葡萄糖耐量试验(ogtt),以明确该糖尿病模型是否稳定。
88.血糖、胰岛素监测,检测实验组体内的血糖以及胰岛素数据;
89.血糖监测:罗氏血糖仪监测空腹耳尖,糖尿病造模前每4周监测一次,成模后每周监测一次。静脉血糖采用氧化还原法测定,用于stz造模期间及ogtt时检测血糖水平。胰岛素检测采用碘125放射性免疫法测定;
90.3d打印异物填塞设计,在猪表皮造创并在创口内部填充异物;
91.3d打印异物填塞设计具体步骤如下:
92.填塞异物设计,根据不同部位创面深度设计不同长度柱体,柱体填塞创面后给予局部异物接触与压迫作用;
93.采用联合聚乳酸材料(pla)与热塑性聚氨酯弹性体橡胶(tpu)结合的3d打印填塞异物;
94.其使用方法如下:根据不同部位创面深度设计不同长度柱体,柱体填塞创面后给予局部异物接触与压迫作用;圆环固定创面边缘,固定柱体为主,也可部分抑制创面向中心收缩;并且在治疗阶段,圆环可用于固定敷料;
95.具体设计方案,3d打印异物耗材设计软件为:solidworks,耗材生产通过fdm热熔堆积生产工艺采用allect 334机器进行生产;
96.其中生产材料为聚乳酸材料(pla),固定圆环生产材料为热塑性聚氨酯弹性体橡胶(tpu);
97.造创,全麻后在小型猪脊柱两侧旁开3cm,使用手术刀切割5~6个直径为3cm的皮肤全层创面,创面间隔3~4cm;
98.造创具体步骤如下:
99.术前准备,手术前一天为小型猪称重、备皮和标记好拟造创部位,手术前一晚20点后禁食禁饮,直到手术当天;
100.器械与耗材的准备,灭菌手术刀,剪刀(大,小),镊子(有齿,无齿),纱布,生理盐水,无菌手术衣,手术单,直角钩针,18、10号兽用缝合线,3d填塞异物等,提前准备肾上腺素,尼可刹米注射液急救备用;
101.麻醉,术前15min耳后皮下注射硫酸阿托品(0.05mg/kg),后注射舒泰50(0.08ml/kg,即4mg/kg),诱导麻醉,5~10min后待小型猪完全麻醉后,进行气管插管。气管插管:使用8号导管,插管成功后,潮气量设置8~10ml/kg,固定1人监测猪麻醉状态,随后用异氟烷维持麻醉;
102.创面,碘伏彻底消毒3遍后,使用手术刀沿皮肤标注区域切开皮肤直至脂肪层,去除皮肤全层组织直至深筋膜,形成全层皮肤缺损创面,后在距创面边缘1cm外区域缝合缝线,用于固定圆环,每个创面至少4处缝合线。术中密切观察小猪的麻醉状态,若切割其皮肤时出现躁动等反应则酌情追加异氟烷剂量;
103.创面拍照与描摹,造创缝合结束后,擦干皮肤,对创面进行拍照(拍照镜头垂直于创面并间隔20cm),由2名固定实验员,使用无菌透明薄膜,分别沿两侧创面边缘描摹用于面积计算;
104.异物填塞并固定,圆环固定方式对模型应用效果至关重要,实践中最佳固定方式
为:(1)术前彻底消毒直角钩针和18号兽用缝合线,采用固定圆环在创面边缘描摹,确定缝合位置;(2)以手术刀在创面边缘5mm 以外,按孔径描摹部位,切割4处全层切口,每处2个切口,每个切口约 2-3mm,用于缝线固定用;(3)采用直角钩针将双股18号缝线从创面内部穿过全层切口,死结固定于切口一侧,留出2条较长双股线;(4)待所有切口均缝合完成,缝合线分别穿过圆环上固定小孔,贴近猪背部皮肤,将圆环固定于皮肤表面,注意需将柱体固定圆孔端垂直于脊柱,便于柱体固定;
105.改善术后疼痛,在术后3天内肌注盐酸曲马多注射液1-2ml/只/天;后续根据个体状态调整;
106.造创后敷料交换,换药前30min肌注曲马多镇痛,创后每6天拆除固定缝线,将柱体拔出后,清理创面内坏死组织,后继续填塞清洁消毒后的柱体,并再次固定,根据创面周边固定处线结炎症反应与创面大小决定是否拆除固定圆环与挖取肉芽组织,每6天取创面边缘处组织用于检测,其中1/2标本用4%多聚甲醛固定,1/2液氮处理后保存于-80℃;
107.慢性创面定义及其评估指标;
108.慢性创面定义及其评估指标具体步骤如下:
109.时间评估标准,满足创面面积每周不能缩小10%~15%或超过一个月面积不能缩小50%或创面未愈合至少持续8周中的任意一条,则定义为慢性创面模型建立成功;
110.he病理评估指标,对创面组织进行炎症状态评估,评估量表如表1-1 和表1-2,其中表1-2为表1-1中性粒细胞和嗜酸性粒细胞补充;
111.表1-1慢性创面炎症状态病理评分
[0112][0113]
表1-2中性粒细胞、嗜酸性粒细胞病理评分
[0114][0115][0116]
he新生表皮厚度测量,测量范围为新生肉芽与表皮交界区域,避开乳突区域的全层厚度,采用pannoramic 250数字切片扫描仪对he染色后切片进行图像采集,每个样本采集1张20倍图片,进行测量,每个样本测量3 组数据,运用annotations中的liner measurement annotation进行测量;
[0117]
he染色;
[0118]
he染色具体步骤如下:
[0119]
s1:选取切片,采用自动漂烘仪进行脱蜡,水化;
[0120]
s2:苏木精染色10~20min后自来水冲洗1~3min;
[0121]
s3:盐酸酒精分化5~10s后自来水冲洗1~3min;
[0122]
s4:放入50℃的温水中或弱碱性水溶液返蓝,直到出现蓝色为止;
[0123]
s5:自来水冲洗1~3min;
[0124]
s6:放入85%的酒精3~5min;
[0125]
s7:伊红染色3~5min后水洗3~5s;
[0126]
s8:梯度酒精脱水
[0127]
s9:二甲苯透明后中性树胶封固。
[0128]
免疫荧光检测巨噬细胞标记物;
[0129]
免疫荧光检测巨噬细胞标记物具体步骤如下:
[0130]
s1:将脱蜡后的切片滴加胰酶修复液,孵箱37℃孵育40min;
[0131]
s2:pbs洗3次,每次5min;
[0132]
s3:滴加10%血清封闭液,室温30分钟;
[0133]
s4:滴加一抗(cd68,浓度:1:100),4℃过夜;
[0134]
s5:pbs冲洗同s2项;
[0135]
s6:滴加二抗,控制温度37℃持续30分钟;
[0136]
s7:滴加dapi,室温孵育10min;
[0137]
s8:pbs洗同s2项;
[0138]
s9:使用抗荧光衰减封片剂封片;
[0139]
s10:采用荧光扫描显微镜摄像系统对切片进行图像采集。
[0140]
实时荧光定量pcr检测炎症因子mrna动态变化;
[0141]
实时荧光定量pcr检测炎症因子mrna动态变化包括组织研磨、组织总rna提取、逆转录以及实时荧光定量pcr;
[0142]
组织研磨;
[0143]
①
预冷磁珠、1.5ml的ep管和离心板;
[0144]
②
将冻存管中适量组织标本,转移至预冷的1.5ml的离心管中,并在其中添加4颗磁珠,1ml的trizol;
[0145]
③
设置研磨模式:60hz,持续30s,中断20s,根据组织研磨效果,持续2~ 4次,直到组织破碎,以上步骤均在低温下操作。
[0146]
组织总rna提取;
[0147]
①
在含trizol的无酶ep管中添加氯仿200μl,剧烈震荡混匀15s后,室温静置5min,后于4℃,12000prm条件下离心15min;
[0148]
②
离心后,小心吸取350-400μl上清至无酶ep管中,向其中加入同体积异丙醇,混匀后室温下静置10min,于4℃,12000prm条件下离心10min;
[0149]
③
弃上清,向ep管中添加1ml 75%乙醇,反复吹打洗涤透,于4℃,7500prm 条件下离心5min,重复洗涤1次。倒掉上清后,再空转1次,吸除多余上清,超净台风干,约5min;
[0150]
④
55℃预热30~50μl depc水,用于溶解rna,吸取其中5μl于95μ l depc水中测rna浓度,剩余置于冰上待逆转录;
[0151]
⑤
浓度检测:取稀释20倍的rna样本在酶标仪上测定rna浓度,od260 /od280的比值大于1.8;根据测得rna浓度,计算1μg cdna所需体积。
[0152]
逆转录;
[0153]
①
去除基因组dna(gdna)反应:参考逆转录试剂盒primescript rtreagent kit with gdna eraser,反应条件为室温,10min,反应体系如表 1-3。
[0154]
表1-3去除基因组dna反应配置
[0155][0156][0157]
②
反转录合成cdna:反应条件为37℃,15min,85℃,5s,4℃,holding (冰上操作)。反应体系如表1-4。
[0158]
表1-4逆转录反应配置
[0159][0160]
③
反应完成的cdna样品放-20℃保存待用。
[0161]
a.实时荧光定量pcr
[0162]
①
引物设计:在设计物种特异性引物,并在进行检验;序列结果如表1-5;
[0163]
②
参考qpcr试剂盒tb green premix ex taqⅱ在lightcycler 96系统进行实验(添加试剂需在冰上操作)。反应体系见表1-6,反应条件见表1-7;
[0164]
③
反应结束后,以gapdh作为mrna相对定量的内参。对每个样本重复测量三次,使用2^(
‑△△
ct)的统计方法计算其相对表达量。
[0165]
表1-5巴马小型猪qpcr引物序列
[0166][0167]
表1-6 qpcr反应配置
[0168][0169]
表1-7 qpcr反应条件
[0170]
[0171][0172]
糖尿病慢性皮肤溃疡模型构建,在猪创口内构建慢性皮肤溃疡模型;
[0173]
糖尿病慢性皮肤溃疡模型构建具体步骤如下:
[0174]
构建巴马小型猪糖尿病模型,通过高脂高糖饮食喂养14周后,联合stz 注射构建猪糖尿病模型;仅d2出现明显多饮、多尿与体重下降症状,空腹血糖高达20mmol/l以上,需要胰岛素治疗外,其他实验组小型猪仅为血糖轻度升高或ogtt诊断糖尿病,但随着时间延长血糖均有一定程度的降低,随后的13周内进行了多次补打后,在48周龄时所有实验组小型猪成功构建稳定的糖尿病模型,stz注射方案如表1-8。其中d1、d2和d4需要长期胰岛素皮下注射治疗,空腹血糖长期控制在8~20mmol/l以下;d3和 d5保持稳定的轻度血糖升高,空腹波动于7~11.3mmol/l。在诱导过程中, d6在第1次补打stz时血糖无明显改变,第2次补打时加大剂量后血糖明显升高,但1周后因胰腺炎死亡。因此,最终实际巴马小型猪糖尿病成模5 只并用于后续实验。
[0175]
在小型猪76周龄时开始构建dcu模型,此时实验组小型猪已形成稳定的糖尿病模型达29周;
[0176]
表1-8 stz注射方案
[0177][0178]
异物填塞成功构建慢性皮肤溃疡模型,采用外科造创联合局部异物填塞压迫的方
式构建慢性皮肤溃疡模型;
[0179]
实验过程中具体造创方案为:第一次,外科造创后,进行异物填塞与创周固定圆环缝合,因皮肤缝合位置表浅,固定线结处炎症反应严重,仅压迫6天便拆除异物;第二次,在创后第18天,综合麻醉风险、创面周边炎症恢复情况,仅对创面进行外科造创(二次造创,直径3cm),术后仅纱布填塞,未予异物填塞及创周固定;第三次,在创后第43天,在第一次方案基础上,对创周皮肤组织进行全层缝合后,创周线结固定部位炎症反应显著改善,异物固定效果达到预期效果;为便于治疗阶段实验,柱体压迫到创后第53天时拔除固定柱体,保留创周圆环用于敷料固定;
[0180]
在造创前与模型构建期间,定期检测小型猪血糖、体重、血常规、白蛋白、总蛋白等指标;结果显示,造创期间两组猪血红蛋白水平、白蛋白/ 总蛋白比值有一定降低;
[0181]
比较第一次和第二次造创后18天时,创面边缘新生表皮厚度,第一次造创后第18天,对照组为130.550
±
33.646μm,实验组为110.114
±ꢀ
16.767μm;第二次造创后第18天,对照组为212.150
±
77.359μm,实验组为167.333
±
38.628μm(图1-9)。结果显示,两组小型猪在第二次创后18天时,表皮厚度均高于首次创后18天,且以实验组差异更显著 (p《0.001);但,实验组新生表皮厚度显著低于正常对照组(p=0.002)。结果提示,糖尿病联合异物填塞(局部压力)可以降低小型猪新生表皮厚度;
[0182]
分别对两组小型猪造创前、创后第6天、24天和56天进行慢性炎症状态评估,结果发现:
[0183]
造创前,对照组皮肤组织表皮结构完整清晰,角化层明显,细胞排列整齐紧密,真皮层内胶原纤维交错排列较致密;而实验组表皮细胞排列较稀疏,真皮层内胶原纤维呈平行排列。两组间正常皮肤组织中均未见明显炎症细胞浸润现象,创前炎症评分均为0分;
[0184]
造创后两组相似表现为:真皮层部分胶原纤维坏死持续至创后第56天,且实验组更为明显;坏死区域和皮下脂肪层见可见淋巴细胞、中性粒细胞和嗜酸性粒细胞浸润,随着时间延长,炎症细胞以淋巴细胞更为多见;从创后第6天开始,两组均有一定成纤维细胞增生、新生血管形成,且在创后第56天时显著增加;造创后两组的差异在于:对照组在创后第6天时即出现表皮增厚现象,而实验组自24天时才表现明显,这也与两次创后第18 天时对照组新生表皮厚度显著高于实验组结果相一致;在造创后各时间点,其炎症评分波动于0-3分间,且多为1-2分。对数据进行分析后显示,两组仅在时间因素上差异有统计学意义(表1-9)。以上结果提示,dcu模型构建前糖尿病“正常”皮肤已出现表皮细胞变薄,真皮胶原纤维平行排列改变;dcu模型构建期间两组创面持续存在以淋巴细胞浸入为主的炎症状态,此外糖尿病小型猪表皮新生能力显著低于对照小型猪;
[0185]
表1-9病理评分的两因素重复测量方差分析
[0186][0187]
对两组小型猪造创前与创后第56天皮肤组织进行巨噬细胞标志物 cd68免疫荧光染色(绿色荧光),结果显示:造创前实验组cd68表达显著高于对照组(p=0.043),而创后第
56天两组间差异无统计学意义;与造创前对比,对照组创后第56天,cd68表达显著升高(p=0.001),而实验组差异无统计学意义;以上结果提示,在巴马小型糖尿病猪模型,正常皮肤组织中巨噬细胞浸润多于正常对照,且造创后巨噬细胞浸润与造创前正常皮肤相似;而在对照组则见造创后巨噬细胞浸润多于造创前正常皮肤,与实验组相似,提示在糖尿病猪模型中,即便是“正常”皮肤,也存在炎性反应,提示在糖尿病猪的“正常”皮肤中,存在着“隐形”损害。
[0188]
在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
[0189]
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
