一种用于牛中常见艾美耳球虫检测和虫种鉴定的巢式pcr方法及试剂盒
技术领域
1.本发明属于分子生物学技术领域。更具体地,涉及一种用于牛中常见艾美耳球虫检测和虫种鉴定的巢式pcr方法及试剂盒。
背景技术:
2.艾美耳球虫(eimeria)是牛科动物中常见的肠道寄生虫,主要引起以急性肠炎和血便为主的牛球虫病,在2岁以内的犊牛感染率可高达到100%,而且具有高致死率,因此对畜牧业危害严重。目前,在我国牛中已发现的艾美耳球虫有13种,分别是椭圆艾美耳球虫(e.ellipsoidalis)、亚球形艾美耳球虫(e.subsperica)、邱氏艾美耳球虫(e.zuernii)、阿拉巴马艾美耳球虫(e.alabamensis)、牛艾美耳球虫(e.bovis)、加拿大艾美耳球虫(e.canadensis)、柱状艾美耳球虫(e.cylindrica)、奥博艾美耳球虫(e.auburnensis)、怀俄明艾美耳球虫(e.wyomingensis),伊利诺斯艾美耳球虫(e.illinoisensis)、巴西艾美耳球虫(e.brasiliensis)、皮利他艾美耳球(e.pellita)和布克朗艾美耳球虫(e.bukidnonensis)。但是现今普遍认为牛艾美耳球虫和邱氏艾美耳球虫是对牛致病性最强的两个艾美耳球虫虫种,会引起肠道损伤,导致严重腹泻,甚至死亡。除了这两种球虫外,其他虫种是否具有致病性尚有争议。所以亟需可以准确区分牛感染的不同艾美耳球虫虫种的方法,以确定引起发病的虫种,同时也有助于牛球虫病的精准防控。
3.目前牛中常见艾美耳球虫的检测和虫种鉴定技术主要有两种,分别是形态学观察和pcr检测。牛中常见的艾美耳球虫虫种在卵囊大小、颜色和形状上具有一定差异,其中部分虫种通过形态学特征加以区分。已有研究者对不同的艾美耳球虫的卵囊和子孢子的形态学数据进行了测量和统计,为其他学者辨认鉴定虫种提供了重要参考。但是,基于形态学的检测和鉴定具有一定的主观性,易造成误判,且通常需要样本中包含大量卵囊,检测灵敏度低、耗时长。近年来,有学者建立了基于pcr的艾美耳球虫分子检测方法,这些方法几乎都是以艾美耳球虫属特异性的核糖体rna基因的内转录间隔区(internal transcribed spacer,its)为目标扩增序列,但不同艾美耳球虫的内转录间隔区的序列长度和多态性差异较大。因此采用艾美耳球虫属特异性的its通过pcr对不同虫种的扩增效率存在明显差异,因此采用同一扩增条件进行扩增时常导致无法对某些虫种有效扩增,即导致假阴性出现。而且,现有的艾美耳球虫its pcr扩增均为单轮pcr,检测灵敏度较低,无法准确检测卵囊量较低的样本,并且易造成非特异性的扩增。
技术实现要素:
4.本发明要解决的技术问题是克服上述问题的缺陷和不足,提供一种用于牛中常见艾美耳球虫检测和虫种鉴定的巢式pcr方法及试剂盒。
5.本发明的第一个目的是提供一种用于牛中常见艾美耳球虫检测和虫种鉴定的pcr引物。
6.本发明的第二个目的是提供一种用于牛中常见艾美耳球虫检测和虫种鉴定的巢式pcr引物。
7.本发明的第三个目的是提供所述pcr、巢式pcr引物的应用。
8.本发明的第四个目的是提供一种用于牛的艾美耳球虫检测和虫种鉴定的方法。
9.本发明的第五个目的是提供一种用于牛中艾美耳球虫的检测和虫种鉴定的检测试剂盒。
10.本发明上述目的通过以下技术方案实现:
11.本发明提供一种用于牛中常见艾美耳球虫检测和虫种鉴定的pcr引物,所述引物设计位点位于牛的艾美耳球虫ssu rrna高度保守区且其扩增片段中存在区分不同虫种的单核苷酸多态性位点。本发明采用的ssu rrna序列来自于奥博艾美耳球虫基因18s rrna序列,其登录号为ab769563.1。
12.ssu rrna基因序列在牛常见艾美耳球虫中即具有保守区域,又具有可变区域(单核苷酸多态性位点),通过针对其保守区域设计pcr引物,扩增的片段大小在牛感染的多种艾美耳球虫中无明显差异,且在同一扩增条件下对牛中常见艾美耳球虫扩增效率基本相同,假阴性低,相应扩增片段中仅包含多个单核苷多态性位点。由于不同虫种的扩增片段中具有特异性的单核苷酸多态性位点,因此根据这些多态性位点可以区分不同的虫种。
13.优选地,所述引物为巢式pcr引物,其退火温度为55~65℃;上、下游引物的tm值相差不超过2℃;pcr产物大小为300~1000bp;引物长度为15~30bp;gc含量为40~60%。
14.进一步优选地,所述引物为巢式pcr引物,采用第一轮pcr上游引物eimeria-f1、第一轮pcr下游引物eimeria-r1和第二轮pcr上游引物eimeria-f2、第二轮pcr下游引物eimeria-r2,其核苷酸序列依次如seq id no:1~4所示。本发明通过牛的艾美耳球虫ssu rrna高度保守区设计的巢式pcr引物的特异性强、灵敏度高,可以更好区分不同虫种。
15.本发明提供一种用于牛的艾美耳球虫检测和虫种鉴定的方法,包括如下步骤:
16.s1.从待测粪便样品中提取dna;
17.s2.以s1所述dna为模板,采用所述pcr引物进行pcr或巢式pcr扩增;
18.s3.对步骤s2中扩增产物进行电泳检测,其中只要扩增出一条条带即为阳性样本,并把阳性样本进行测序分析,根据虫种特异性单核苷酸多态性位点上的碱基序列来鉴定待测样品的虫种。
19.优选地,所述巢式pcr第一轮扩增的反应体系为:1μl dna、25μl 2
×
dreamtaq pcr master mix、1.25μl第一轮pcr上游引物和下游引物、2μl牛血清蛋白,最后加入去离子水至50μl;第二轮扩增的反应体系为:2μl第一轮pcr产物、25μl 2
×
dreamtaq pcr master mix、2μl牛血清蛋白,以及1.25μl第二轮pcr上游引物和下游引物,最后加入去离子水至50μl。
20.更优选地,采用的pcr引物浓度为10μm,牛血清蛋白浓度为10mg/ml。
21.优选地,所述巢式pcr第一轮与第二轮扩增程序相同均为:94℃预变性持续5分钟;94℃变性45秒,52℃退火30秒和68℃延伸30秒,一共循环该过程45次;最后,68℃延伸7分钟。
22.本发明提供上述引物在制备用于牛的艾美耳球虫检测和虫种鉴定试剂盒中的应用。
23.本发明还提供一种用于牛中艾美耳球虫的检测和虫种鉴定的检测试剂盒,包含上
述pcr引物。
24.优选地,所述检测试剂盒还包含pcr所需试剂阳性和阴性对照。
25.优选地,所述检测试剂盒还包含从待测粪便样品中提取dna所需的试剂。
26.本发明具有以下有益效果:
27.本发明针对牛的艾美耳球虫ssu rrna基因序列的保守区域设计引物,使其相应扩增片段中仅包含多个单核苷多态性位点,扩增效率基本相同,假阴性低,可用于艾美耳球虫检测和虫种鉴定。
28.本发明进一步针对牛的艾美耳球虫ssu rrna基因序列的保守区域设计巢式pcr引物,建立了牛中常见艾美耳球虫巢式pcr检测方法;根据巢式pcr产物的凝胶电泳图可检测牛中常见艾美耳球虫,根据pcr产物的测序结果可进行艾美耳球虫的虫种鉴定。克服了现有的牛艾美耳球虫分子诊断工具检测灵敏性低和特异性差的缺点。
29.采用本发明的艾美耳球虫ssu rrna位点的巢式pcr和测序结果分析就可进行虫种鉴定,其检测方法能够最低检测到一个卵囊,其扩增效率高,检测灵敏,克服了现有的艾美耳球虫形态学检测和虫种鉴定技术中耗时长、误差大的缺点。可以准确区分牛感染的不同艾美耳球虫虫种,并确定引起发病的虫的不同虫种,用于牛球虫病的精准防控。
附图说明
30.图1为本发明中ssu rrna巢式pcr扩增序列;
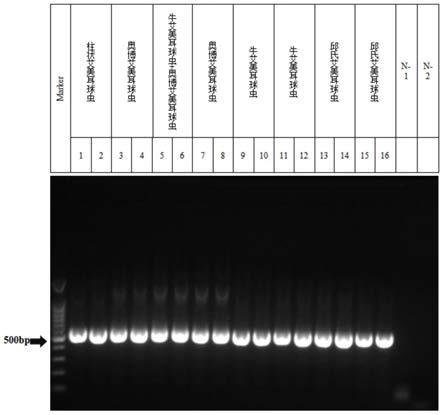
31.图2为采用本发明中ssu rrna巢式pcr第二轮产物的琼脂糖凝胶电泳图谱(注:m为100bp dna ladder,左边标注的数字代表目的条带为500bp,1~20代表琼脂糖凝胶电泳泳道号码,n-1为第一轮pcr阴性对照,n-2为第二轮pcr阴性对照);
32.图3为采用本发明中ssu rrna巢式pcr第二轮产物测序后获得的5个虫种及其序列特征。
具体实施方式
33.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
34.除非特别说明,以下实施例所用试剂和材料均为市购。
35.使用仪器:小型台式高速离心机(eppendorf centifuge 5424r);震荡破碎仪(fast preptm fp120,mp bio 101)配套设备;uvp pcr操作台(coy laborartory products);t100 pcr热循环仪(bio-rad,hercules,ca,usa)。
36.使用软件:chromaspro 2.1.5.0(http://technelysium.com.au/chromaspro.html.);bioedit v7.04(http://www.mbio.ncsu.edu/bioedit/bioedit.html.);clustalx 2.0.11(http://clustal.org.)。
37.使用试剂:dna提取试剂盒fastdnatm spin kit for soil(mp biomedicals);nuclease-free water(thermo scientific,pittsburgh,pa);dreamtaq pcr master mix(2
×
)(thermo scientific,pittsburgh,pa);10mg/ml牛血清白蛋白(biofroxx,germany)。
38.实施例1牛中常见艾美耳球虫检测方法的建立
39.1、引物设计
40.通过序列比对,发现牛的艾美耳球虫ssu(small subunit)rrna位点具有高度保守性,且该区域中存在着多个单核酸突变位点。利用这些突变位点,根据保守区域设计巢式pcr引物:
41.eimeria-f1:5
′‑
tggataaccatggtaattctatggct-3
′
(seq id no:1);
42.eimeria-r1:5
′‑
cctatcctattattccatgctga-3
′
(seq id no:2);
43.eimeria-f2:5
′‑
atgcctccttctctggaggg-3
′
(seq id no:3);
44.eimeria-r2:5
′‑
acacgcaattaagcgcgg-3
′
(seq id no:4)。
45.第二轮引物eimeria-f2和eimeria-r2所扩增的片段长度为553bp左右。
46.2、从粪便样品中提取dna
47.利用市售商业化fastdnatm spin kit for soil试剂盒提取粪便样品dna,具体实验方法较之试剂盒标准操作步骤略有改进,步骤如下:
48.(1)将保存于4℃冰箱、2.5%重铬酸钾溶液中的待检测的粪便样品取出,混合均匀后用移液器吸取500μl粪便悬液移至1.5ml的离心管内,之后加入1ml的去离子水混合均匀,14000g离心10min,弃上清;
49.(2)若为未加保护剂的新鲜粪便样品,则直接取200mg粪便样品,进行步骤(3);
50.(3)向沉淀中加入1ml的去离子水混合均匀,14000g离心10min,弃上清;
51.(4)将沉淀转移至lysing matrix e管中,加入978μl sodium phosphate buffer和122μl mt buffer;
52.(5)将lysing matrix e管放入fast preptm fp120快速核酸提取仪中进行震荡混合,震荡强度5.5m
·
s-1,震荡时间30s;
53.(6)将震荡混匀后的lysing matrix e管移至离心机内,14000g离心5min;
54.(7)将上清转入新的1.5ml离心管中,加入250μl pps试剂,上下颠倒10次后,14000g离心5min,取上清,转至15ml离心管中;
55.(8)取1ml dna binding matrix溶液(充分混匀)加入步骤(6)中的15ml离心管中,上下颠倒2min使得dna与试剂颗粒充分混合,然后静置3min;
56.(9)轻柔地取上清液约1ml,丢弃,重新混匀剩余的液体与沉淀物,将其转移到spintm filter tube中,14000g离心1min,弃掉滤液,重复此操作步骤直至全部沉淀都过滤在spintm filter tube中;
57.(10)向spintm filter中加入500μl sews-m溶液(sews-m原液需加入100ml无水乙醇进行混合处理),然后14000g离心1min;
58.(11)弃滤液,将spintm filter tube放入离心机中,14000g离心2min。将spintm filter tube转移到洁净的catch tube中,室温充分暴露沉淀,自然风干5min;
59.(12)向spintm filter内已干燥的binding matrix中加入100μl的des溶液,用洁净的移液枪头轻轻搅拌,使dna与试剂充分混合;
60.(13)将spintm filter tube放入离心机中,14000g,离心1min;
61.(14)丢弃spintm filter,catch tube中收集的液体即为提取的dna的溶液,可在4℃条件下临时保存,或放于-20℃条件下保存。
62.3、巢式pcr反应
63.以上述提取的粪便dna作为模板,采用seq id no:1~4所示引物序列进行牛的艾美耳球虫特异性的巢式pcr扩增。每个巢式pcr反应体系的总量为50μl,其反应体系如下表1和表2所示。
64.表1巢式pcr第一轮反应体系的试剂配比
[0065][0066]
表2巢式pcr第二轮反应体系的试剂配比
[0067][0068]
巢式pcr反应程序设置包括预变性、变性、退火、扩增和延伸,具体设置为:预变性94℃5min;变性94℃45s、退火52℃30s、延伸68℃30s,扩增45个循环。第一轮pcr引物扩增程序和第二轮pcr引物扩增程序结束后,经过1.5%(w/v)琼脂糖凝胶电泳后,在uv下观察第二轮pcr产物。在扩增结果的两个平行中只要出现一条条带即认为是阳性样本。
[0069]
将上述扩增出的阳性样本的第二轮pcr产物送到生工公司进行双向测序。每个样本的两条序列采用序列由chromaspro 2.1.5.0(http://technelysium.com.au/chromaspro.html.)组装,在bioedit v7.04(http://www.mbio.ncsu.edu/bioedit/bioedit.html.)中编辑,并使用clustalx 2.0.11(http://clustal.org.)与参考序列对齐。根据虫种特异性单核苷酸多态性位点上的碱基序列,进行区分鉴定虫种。不同虫种的ssu rrna巢式pcr扩增序列如图1所示。
[0070]
不同虫种ssu rrna位点巢式pcr第二轮产物的琼脂糖凝胶电泳图谱如图2所示,不同虫种电泳条带大小为500bp左右,电泳条带清晰,表明不同虫种扩增效率一致。
[0071]
实施例2牛中常见艾美耳球虫检测方法的灵敏度检测
[0072]
为了检测上述实施例1中建立的检测方法的灵敏度,我们将不同数量的艾美耳球虫卵囊混合到牛的艾美耳球虫阴性粪便样本中,然后对该粪便样品进行dna提取和ssu rrna pcr检测。牛的阴性粪便样本来自中国广东某奶牛场。
[0073]
卵囊为采用饱和盐水漂浮法从犊牛中纯化的艾美耳球虫卵囊。共设计了9个分组,分别为:1、3、5、7、10、50、100、1000和10000卵囊组,每个水平的卵囊组包含5个生物平行,每个样本进行两个pcr技术平行。
[0074]
1、卵囊组的制备
[0075]
(1)1-10个卵囊组的制备方法如下:准备1个/μl和10个/μl的卵囊液,取1μl卵囊液滴于被1%琼脂糖凝胶薄膜(1-2mm)覆盖的载玻片上,在普通显微镜的10倍物镜下进行观察,若发现视野中仅有相应数目的卵囊后,将相应部分的凝胶薄膜切下并置于2ml的离心管中。
[0076]
(2)50个卵囊组、100个卵囊组、1000个卵囊组和10000个卵囊组的制备方法:准备104/ml的卵囊液和去离子水,采用倍比稀释的方法获得不同数量的卵囊。
[0077]
2、试验方法
[0078]
将准备好的卵囊放入琼脂糖薄膜或者去离子水中,加入1g来自广东某奶牛场的一周龄犊牛的艾美耳球虫阴性的粪便样本,重复进行搅拌。取搅拌后的200mg粪便采用实施例1中dna提取的方法进行提取,最后加入100μl的dna冻存液(dnase/pyrogen-free water)。再利用实施例1中的引物以及扩增程序对提取的dna进行pcr扩增。
[0079]
3、试验结果
[0080]
采用ssu rrna巢式pcr方法检测牛的艾美耳球虫灵敏度实验结果如表3所示,在单个卵囊组的五个生物平行中有一个样品出现阳性,3个卵囊组的五个生物平行中有一个样品出现阳性,5个卵囊组的五个生物平行中有两个样品出现阳性,7个卵囊组的五个生物平行中有一个样品出现阳性,10个卵囊组的五个生物平行中有三个样品出现阳性,50个卵囊组、100个卵囊组、1000个卵囊组和10000个卵囊组全为阳性。由表3试验数据表明,最低一个卵囊都能被检测到,说明本发明的扩增效率高,检测灵敏。
[0081]
表3巢式pcr方法检测牛的艾美耳球虫灵敏度实验结果
[0082]
[0083][0084]
实施例3牛中常见艾美耳球虫的虫种鉴定
[0085]
从广东某奶牛场收集了牛的不同艾美耳球虫显微镜镜检阳性和镜检阴性的粪便样品,其中镜检阴性的样品15份,镜检阳性的样品20份样品。镜检阳性的样品包括单虫种感染(n=17)和混合感染(n=3)。单虫种阳性样品具体包括牛艾美耳球虫(n=6)、柱状艾美耳球虫(n=6)、奥博艾美耳球虫(n=2)、邱氏艾美耳球虫(n=3),混合感染阳性样品具体包括牛艾美耳球虫和柱状艾美耳球虫混合感染(n=2)、邱氏艾美耳球虫和柱状艾美耳球虫混合感染(n=1)。这些样品在分析前均保存在2.5%的重铬酸钾溶液中,之后按照实施例1中的方法提取dna、进行巢式pcr扩增、凝胶电泳实验和pcr产物测序和分析。
[0086]
经pcr检测发现,在25份样品中共有五个虫种,分别为牛艾美耳球虫球虫、柱状艾美耳球虫、邱氏艾美耳球虫、奥博艾美耳球虫和怀俄明艾美耳球虫。各个虫种选取了一个代表性样品进行序列特征展示,如图3所示。
[0087]
镜检阴性样品经pcr检测结果如表4所示,在15份镜检阴性样品中,pcr检测结果显示6份样品为艾美耳球虫阳性,9份样品为艾美耳球虫阴性。镜检阳性样品的巢式pcr扩增结果和镜检结果对比如表5所示,在17份镜检单虫种感染的样品pcr检测均为阳性,测序后发现其中10个样品的测序结果与镜检发现的虫种一致,其余7个样品测序结果和镜检结果存在微小差异,但总体上pcr检测的虫种类别略多于显微镜镜检结果。3份混合感染的样品pcr检测均为阳性,测序结果发现其中两份样品的混合感染虫种和镜检结果一致,另一个样品pcr检测的虫种比镜检结果多一种。
[0088]
表4镜检阴性样品的巢式pcr扩增结果
[0089]
[0090][0091]
表5镜检阳性样品的巢式pcr扩增结果和镜检结果对比
[0092]
[0093][0094]
综上可知,本发明研究的牛的艾美耳球虫ssu rrna区域具有高度保守性,及存在着多个可用于区分虫种的单核酸突变位点,针对上述区域进一步设计巢式pcr引物,建立了牛中常见艾美耳球虫巢式pcr检测方法;根据巢式pcr产物的凝胶电泳图可检测牛中常见艾美耳球虫,根据pcr产物的测序结果可进行艾美耳球虫的虫种鉴定。克服了现有的牛艾美耳球虫分子诊断工具检测灵敏性低和特异性差的缺点。采用本发明的艾美耳球虫ssu rrna位点的巢式pcr和测序结果分析就可进行虫种鉴定,其检测方法能够最低检测到一个卵囊,其扩增效率高,检测灵敏,克服了现有的艾美耳球虫形态学检测和虫种鉴定技术中耗时长、误差大的缺点。
[0095]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。