一种基于吸附态洛伊希瓦氏菌pv-4实现微生物电化学传感器即时检测的方法
技术领域
1.本发明涉及微生物电化学技术领域,具体涉及一种基于吸附态洛伊希瓦氏菌(shewanella loihica)pv-4实现微生物电化学传感器即时检测的方法。
背景技术:
2.生物传感器具有成本低廉、操作简单、选择性强和检测快速等特点,同时检测结果能够真实地反映样品的生物利用度信息,已广泛地应用于生物医学、食药分析、环境监测等领域。一般而言,生物传感器的检测原理主要包含两个过程,首先是利用生物元器件感应样品中的待测物质,然后将生物元器件与待测物质发生的生物学反应转换为电信号。最早所采用的生物元器件是酶,基于酶的特异性催化作用可以实现对目标物的选择性检测。此后,核酸、适配体、抗体、荧光蛋白等也被应用于生物传感器。然而,这些生物活性分子制备过程依赖极高的分子生物学专业技术,需要过表达、纯化、重构等复杂过程,限制了其实际应用。同时,现有的生物元器件与待测物质的生物学反应主要为产生光信号。例如广泛使用的免疫荧光技术的基本原理是生物元器件与待测物质结合后会产生荧光信号,另一项已产业化的酶联免疫吸附技术则是利用生物元器件与待测物质结合后可催化颜色反应的发生。但将待测物质浓度信息转导为荧光或色度等光信号后还需要借助复杂或昂贵的仪器实现光电转换,极大地增加了生物传感器的使用成本。更重要的是,光信号极易受环境和背景色彩的影响,导致检测结果出现假阴性或者假阳性,这也明显降低了检测结果的准确度和可重复性。
3.微生物电化学传感器(microbial electrochemical sensor,meb)有望解决这些问题。meb的核心是电化学活性微生物(electrochemical actively bacteria, eab)。与其他环境微生物相比,eab具有独特的胞外电子传递(extracellularelectron transfer,eet)功能,可以将呼吸链产生的电子传递至胞外形成输出电流(正向eet),或直接消耗输入电流完成能量代谢(反向eet)。因此,当eab 与待测物质发生生化反应后,可以直接影响eet的电子传递速率,最终表现为输出/输入电流的变化。与其他生物传感器相比,eab同时包含了生物活性物质和信号转导元件,不需要额外的信号转导过程即可将待测物质信息直接转导为电信号;同时,eab作为完整的天然细胞,不需要基因工程、蛋白分离、纯化、重构等复杂的分子生物学技术,具有较低的技术门槛和使用成本,被认为是目前最有前景的生物传感器技术。
4.meb技术首次报道于2003年,基于eab的正向eet过程,韩国科学技术研究院byung hong kim教授团队率先实现了对生物利用度评价指标——生化需氧量的快速检测,将传统检测方法所需要5天的检测时间降低至4小时。该方法的基本原理是eab可以将有机物中的化学能转化为电能,因此在eab生物量保持稳定的条件下,输出电流与底物浓度在一定范围内具有良好的线性关系。2007 年,韩国科奥比研究院mia kim等人进一步地利用meb检测了水质生物毒性。与其他水质生物毒性检测技术相比,采用这一技术成功突破了水质生物毒
性实时快速检测的应用瓶颈。该方法的基本原理是利用eab分解有机物产生的电信号,当水体中出现有毒物质时,eab的电信号会出现下降,因此通过测量eab的电信号即可检测水质毒性。与其他水质生物毒性检测技术相比,采用这一技术成功突破了水质生物毒性实时快速检测的应用瓶颈。2020年,我国刘红教授团队创新地采用eab的正向和反向eet,利用meb实现了对水体生化需氧量和硝态氮的同步快速检测。此外,meb还被应用于检测癌症标志物富马酸、肠道微生物重要代谢产物氧化三甲胺等物质。这些方法的基本原理均是利用eab可以直接吸收电子并还原待测物质,因此通过测量输入电流即可分析待测物质的浓度。与传统生物电化学传感器(例如酶电化学传感器或免疫电化学传感器)相比, meb可以将电信号强度提升至毫安级别,比传统研究报道的结果高3-6个数量级,同时meb检测的灵敏度可达到安/摩尔,也较以往研究提高了10-100倍。综上,meb结合全细胞传感器和电化学传感器的特点,仅利用同一生物元器件即可同步实现待测物质识别与生物信号转导,具有高效、快捷、方便、低成本等优势,对生物医学及环境指标的快速检测具有重要意义。
5.尽管meb具有检测成本低、灵敏度高、特异性强及易微型化等优势,但传统meb均使用了eab所形成的成熟生物膜作为传感元件,这导致了冗长和复杂的传感器启动过程(通常需要1-4周)。例如,北京航空航天大学刘红教授团队前期利用meb检测水质生物毒性毒性的研究中,基于纯培养洛伊希瓦氏菌 (shewanella loihica)pv-4的meb启动时间约为8000分钟(约5.5天),而基于以geobacter为优势菌群的混菌meb启动时间约为12000分钟(约8.3天)。在另一项利用meb同步检测水体生化需氧量和硝态氮的研究中,能够检测水体生化需氧量(具有正向eet能力)的eab生物膜成熟时间约为8000分钟(约 5.5天),而能够检测水体硝态氮浓度(具有反向eet能力)的eab生物膜成熟时间超过5000分钟(约3.5天)。因此,由于依赖成熟生物膜作为传感元件,meb 使用前需要长达几周的启动和培养过程。然而,在复杂的实际使用环境中,对于 meb所能够测量的指标(例如水体生化需氧量、水质生物毒性等)检测均存在着即时检测和应急检测的需求。因此,如何避免耗时的生物膜孵育过程、突破性地实现meb即时检测,对于推动meb实际应用具有重要意义。
6.生物膜是微生物所形成的有组织群体,其形成过程主要包括三个阶段。首先,处于悬浮状态下的微生物利用鞭毛等部件,从液相或者气相中迁移至固相载体表面,这称之为定殖阶段;当微生物迁移在载体表面后,微生物与载体的接触能够直接刺激微生物快速表达与胞外聚合物合成、分泌相关的通路,通过分泌大量的蛋白、多糖等物质提高微生物胞体与载体的结合力,即吸附阶段;最后,微生物通过生长增殖,形成具有一定厚度和致密程度的三维复杂且高度有序结构,达到生物膜的成熟阶段。传统meb技术均基于eab成熟生物膜,这主要是由于在尚未形成成熟生物膜的条件下,eab可能不能产生电信号。例如此前基于混菌的研究发现,混菌eab生物膜在成熟阶段产电量超过400mv,但其生物膜早期阶段产电量仅为1mv。有趣的是,发明人近期通过实验发现,模式eab菌株洛伊希瓦氏菌(shewanella loihica)pv-4可以通过外膜具有氧化还原活性的细胞色素c等物质,当吸附在电极表面后即能够完成胞外电子传递过程,展现出明显的电化学活性。
7.因此,为了克服传统meb依赖成熟生物膜的实际应用瓶颈,解决meb无法即时检测的问题,本发明报道了采用吸附态洛伊希瓦氏菌(shewanella loihica) pv-4作为传感元件,实现meb即时检测的方法,具体为:
8.一种基于吸附态洛伊希瓦氏菌(shewanella loihica)pv-4实现微生物电化学传
感器即时检测的方法,该方法的基本原理为当洛伊希瓦氏菌(shewanella loihica) pv-4吸附在电极表面后,即洛伊希瓦氏菌(shewanella loihica)pv-4处于生物膜早期阶段,具有明显的电化学活性和产生生物电信号的能力;该方法的特征在于,以具有正向和反向胞外电子传递能力的电化学活性微生物洛伊希瓦氏菌 (shewanella loihica)pv-4为核心,将洛伊希瓦氏菌(shewanella loihica)pv-4 菌体快速吸附在多孔电极表面,在不需要孵育成熟生物膜的条件下,构建微生物电化学传感器,并基于吸附态洛伊希瓦氏菌(shewanella loihica)pv-4产生的生物电信号,通过检测生物电信号强度变化,实现微生物电化学传感器的即时检测。
9.多孔电极包括碳纤维布、碳纤维纸、碳纤维毡、石墨毡、活性炭、玻璃纤维,利用多孔电极比表面积大、强吸附性的特性,实现将洛伊希瓦氏菌(shewanellaloihica)pv-4菌体快速吸附在多孔电极表面。
10.洛伊希瓦氏菌(shewanella loihica)pv-4菌体,其处于对数生长期或稳定期,菌悬液在600nm处吸光度在0.5-2.0范围内。
11.微生物电化学传感器,包括工作电极、对电极和参比电极,其中工作电极为吸附有洛伊希瓦氏菌(shewanella loihica)pv-4的碳纤维布,碳纤维布尺寸为 1cm*1cm,对电极为1mm*37mm的铂丝电极,参比电极为ag/agcl电极,传感器的工作体积为40ml。
12.该方法可构建能够即时检测氧化三甲胺或富马酸或水质生物毒性或生化需氧量的微生物电化学传感器。
13.该方法体操作流程为:
14.(1)利用luria-bertani培养基扩大化培养洛伊希瓦氏菌(shewanella loihica)pv
‑ꢀ
4,培养方式为好氧培养,环境温度设置为20.0
±
0.5℃,转速为150rpm,接种量为0.2%的体积比;
15.(2)培养12-18h后,洛伊希瓦氏菌(shewanella loihica)pv-4已处于对数生长期或稳定期,菌悬液在600nm处吸光度为1.0-2.0,菌悬液保存备用;
16.(3)将菌悬液10000rpm离心10min,然后用浓度为10mm的4-羟乙基哌嗪乙磺酸缓冲液重悬,重悬后的重悬菌液在600nm处吸光度为2.0;
17.(4)将1cm*1cm的碳纤维布插入重悬菌液中1h,制备快速吸附了洛伊希瓦氏菌 (shewanella loihica)pv-4菌体的电极;
18.(5)在洁净工作台中组装电化学系统,电化学系统工作体积为40ml,包含工作电极、对电极和参比电极,其中工作电极为快速吸附了洛伊希瓦氏菌 (shewanella loihica)pv-4菌体的电极,对电极为1mm*37mm的铂丝电极,参比电极为ag/agcl电极,电化学系统池体为圆柱形玻璃杯,池盖为聚四氟乙烯材质,电化学系统可密封运行;
19.(6)将三电极连接电化学工作站或恒电位仪;
20.(7)将dm电解液加入到生物电化学系统中,每升dm电解液中包含1g nahco3、 0.13g kcl、0.027g cacl2·
2h2o、0.2g mgcl2·
6h2o、5.85g nacl和7.2g hepes,将工作电极电势设置为0v,电解液以3.0ml/min自循环,待生物电信号稳定后,即可用于检测;
21.(8)根据待测样品调整工作电极电势设置方式,将待测样品注射加入到生物电化学系统中,或将待测样品直接替换生物电化学系统的dm电解液,通过测量洛伊希瓦氏菌(shewanella loihica)pv-4产生的生物电信号以实现对氧化三甲胺或富马酸或水质生物
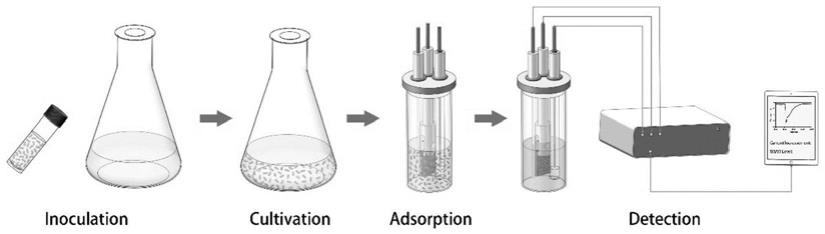
meb即时检测的方法如图1所示,利用该方法能够实现基于meb的氧化三甲胺(tmao)即时检测。
35.首先培养洛伊希瓦氏菌(shewanella loihica)pv-4。洛伊希瓦氏菌(shewanellaloihica)pv-4(atcc baa-1088)购置于美国模式菌种收集中心并置于-80℃保存。使用前,将洛伊希瓦氏菌(shewanella loihica)pv-4从-80℃冰箱取出后,梯度升温后按0.2%的比例接种于luria-bertani培养基中。接种后,在20℃环境中以150rpm转速过夜培养。当洛伊希瓦氏菌(shewanella loihica)pv-4生长达到平台期后(od
600
≈2),离心并用hepes缓冲液重悬至od
600
为2.0。最后,将洛伊希瓦氏菌(shewanella loihica)pv-4菌悬液置于4℃保存,并用于构建基于吸附态洛伊希瓦氏菌(shewanella loihica)pv-4的mes。
36.然后,构建基于吸附态洛伊希瓦氏菌(shewanella loihica)pv-4的mes。组装3个完全相同的三电极电化学系统,各个电化学系统工作体积为40ml,均包括1cm*1cm碳纤维布作为工作电极,直径1mm的铂丝作为对电极,ag/agcl电极(0.205v vs.标准氢电极)作为参比电极。电化学系统组装前各组件均经过灭菌处理,其中ag/agcl电极经紫外照射和75%乙醇浸泡灭菌,其余组件经高温灭菌处理。各个电化学系统组装完成后,在洁净工作台中分别加入40ml的洛伊希瓦氏菌(shewanella loihica)pv-4重悬菌液,当工作电极浸泡于重悬菌液1h 后,倒掉重悬菌液,此时基于吸附态洛伊希瓦氏菌(shewanella loihica)pv-4的 mes制备完成。
37.利用电子扫描显微镜(scanning electron microscope,sem)和激光共聚焦显微镜(confocal laser scanning microscopy,clsm)技术探究吸附态洛伊希瓦氏菌(shewanella loihica)pv-4的微生物形态和活性。当工作电极浸泡于重悬菌液 1h后,经过取样、固定、脱水、风干和喷金处理后,利用sem(jsm-5800,jeol, japan)观察电极表面微生物形态。同时,利用活死菌染色试剂盒对工作电极染色后,利用clsm(tcs sp8,leica,germany)观察电极表面微生物活性。
38.通过对比工作电极在吸附洛伊希瓦氏菌(shewanella loihica)pv-4前后的 sem图片(图2a-d)可以发现,洛伊希瓦氏菌(shewanella loihica)pv-4散落地分布在电极表面,与已报道的生物膜sem图片相比,并未出现微生物群体聚集现象。通过clsm也可以直观地观察到吸附过程中电极表面微生物的变化。对比图2e和图2f可以看到,经过1h吸附后,电极表面出现了大量的有活性洛伊希瓦氏菌(shewanella loihica)pv-4。与此前已经报道的eab三维代谢结构相比,经过1h吸附后,洛伊希瓦氏菌(shewanella loihica)pv-4仅形成了单层结构,且并未充分覆盖电极表面。同时,考虑到大部分的洛伊希瓦氏菌(shewanellaloihica)pv-4均能够直接与电极表面接触,这表明洛伊希瓦氏菌(shewanellaloihica)pv-4可以通过直接电子转移将电极上的电子转移至胞内。
39.通过制备3组基于吸附态洛伊希瓦氏菌(shewanella loihica)pv-4的mes (mes1-3)以即时检测tmao。各组mes加入dm电解液,经除氧处理后,施加0v的恒电势和3ml/min的自循环,持续记录各组mes的输入电流。待输入电流稳定后,将相同体积但不同浓度的缺氧tmao浓缩液依次加入到mes 中,记录mes检测不同浓度tmao的输入电流。所检测的tmao浓度从0μm 逐渐升高至250μm。各组mes检测tmao完成后,利用prism建立tmao浓度与mes最大输入电流的标准曲线模型,并计算传感器的灵敏度和检测限。
40.如图3所示,当dm电解液中不含有tmao时,mes表现出极低的背景电流(约为-0.50
±
0.07μa)。同时,背景电流几乎没有波动,这表明空白样品下mes 具有稳定的信号基线。通过注射的方式将高浓度tmao浓缩液加入mes中,随着溶液中tmao终浓度从0μm升高至25μm,mes的输入电流出现了明显的下降(峰值电流为-1.60
±
0.19μa)。当tmao浓度从0μm逐渐升高至250μm,mes 的峰值电流也相应地明显升高。相比于约-0.5μa的基线信号,mes检测250μm 的tmao时输入电流峰值达到了-6.66
±
0.38μa(图4a-b)。此前大量研究先后报道了mes的峰值电流面积和电流增加值与电子受体浓度间具有良好的线性关系,考虑到即时检测要求更短的检测时间和更高的信噪比,我们选择了利用mes 的电流增加值建立eab生物电信号与tmao浓度的关系(图4c)。利用prism 的线性拟合功能建立tmao浓度与mes电流增加值的关系模型,如公式(1) 所示:
41.y=0.02392x 0.2625
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1)
42.其中y为tmao浓度(μm),x为mes电流增加值(μa)。该模型的决定系数达到了0.989,这表明mes的电流增加值与tmao浓度具有良好的线性关系,利用吸附态洛伊希瓦氏菌(shewanella loihica)pv-4可以准确地检测tmao浓度。基于该标准模型,利用拟合直线斜率得到传感器检测tmao的灵敏度为 23.92μa/μm,这与此前研究中基于固定化tmao还原酶和分子印迹技术的电化学传感器相比,mes的检测结果具有超过10倍的灵敏度。同时,本研究基于吸附态洛伊希瓦氏菌(shewanella loihica)pv-4,不需要酶纯化、酶固定化或分子印迹膜制备等过程,满足即时检测的需求。
43.实施例二:
44.采用与实施例1相同的方法检测富马酸。如图5a所示,当dm电解液中不含有富马酸时,mes展现出稳定且较低的基线电流,基线电流水平约为-0.37μa。通过注射的方式分别检测了500μm、750μm、1000μm、1500μm的富马酸。如图 5b所示,当电解液中出现富马酸时,mes的输入电流产生了明显的峰值,同时峰值电流随着富马酸浓度增加而增加。具体而言,当检测500μm、750μm、 1000μm、1500μm的富马酸时,mes的输入电流峰值达到了-2.12μa、-2.91μa、
ꢀ‑
3.59μa、-4.3μa。与检测tmao相似,我们同样地利用了mes的电流增加值建立eab生物电信号与富马酸浓度的关系(图5c)。利用prism的线性拟合功能建立富马酸浓度与mes电流增加值的关系模型,如公式(2)所示:
45.y=0.002564x 0.2998
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2)
46.其中y为富马酸浓度(μm),x为mes电流增加值(μa)。该模型的决定系数达到了0.964,这表明mes的电流增加值与富马酸浓度具有良好的线性关系,利用吸附态洛伊希瓦氏菌(shewanella loihica)pv-4可以准确地检测富马酸浓度。基于该标准模型,利用拟合直线斜率得到传感器检测富马酸的灵敏度为 2.564μa/μm。与此前研究中基于高效液相色谱的检测技术相比,本研究中基于吸附态洛伊希瓦氏菌(shewanella loihica)pv-4的mes,不需要昂贵的检测仪器和复杂的样品预处理过程,满足即时检测的需求;与此前研究中基于绿色荧光蛋白的检测技术相比,本方法能够直接将富马酸浓度转导为电信号,不需要昂贵的光电信号转导元件,具有操作简单、成本低的优点。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。