sting激动剂脂质体-温敏凝胶及其制备方法和应用
技术领域
1.本发明涉及sting激动剂临床制剂,尤其涉及sting激动剂脂质体-温敏凝胶及其制备方法和在治疗肿瘤中的应用,属于sting激动剂新制剂领域。
背景技术:
2.sting激动剂可激活固有免疫系统,对肿瘤微环境中缺乏t细胞的高危nb显示良好应用前景。然而,其体内递送面临多重挑战。sting激动剂大多为负电性的亲水小分子,限制了其通过质膜的渗透,在结构上,sting激动剂cgamp含有易被胞外核苷酸焦磷酸酶/磷酸二酯酶降解的磷酸二酯键,在体内易被快速降解失活,或被代谢清除。基于此,为了获得足够的生物活性,cgamp通常以相对较高的浓度使用。然而,过度的瘤内cgamp可能会导致肿瘤细胞程序性死亡配体1(pd-l1)过度表达并增加肿瘤浸润性调节性t细胞(tregs),从而对抗肿瘤免疫产生负面影响,严重影响其药效发挥。目前报道的sting激动剂给药方式或给药系统难以保证体内持续稳定的浓度。
3.目前研究阶段的sting激动剂多为全身给药或者瘤内注射,缺乏靶向性,无法实现局部的稳定浓度,并且可能诱导脱靶性炎症或自身免疫性疾病。近年来,少量研究开始报道利用基于生物材料的递送策略来控制sting激动剂的组织和细胞定位,从而改善其免疫活性,如全身给药的peg化脂质纳米粒相比于游离药,可增加sting激动剂摄取入胞的量和诱导促炎基因的表达;局部给药的阳离子二氧化硅纳米粒、聚(β-氨基酯)聚合物纳米粒、酸敏感的缩醛化葡聚糖微粒,均可实现比游离药高出几十倍的免疫应答,具有明显优于游离药的免疫治疗效果,但是目前报道的这几种给药系统均无法实现精准控制sting激动剂稳定的浓度,有待改进。
技术实现要素:
4.本发明的目的之一是提供一种sting激动剂脂质体-温敏凝胶;
5.本发明的目的之二是提供一种制备所述sting激动剂脂质体-温敏凝胶的方法;
6.本发明的目的之三是将所述的sting激动剂脂质体-温敏凝胶应用于治疗肿瘤。
7.本发明的上述目的是通过以下技术方案来实现的:
8.本发明的一方面是提供了sting激动剂脂质体-温敏凝胶,包括:载sting激动剂的脂质体和温敏凝胶。
9.其中,所述的sting激动剂包括环状二核苷酸类sting激动剂,优选为cgamp。
10.所述的载sting激动剂cgamp的脂质体可以是将sting激动剂cgamp采用常规的脂质体制备方法得到载sting激动剂cgamp的脂质体。
11.本发明中所述的“温敏凝胶”是指以溶液状态给药,其用于给药系统后,在体温下形成凝胶状,能很好地释放药物并作用于人体,从而发挥治疗作用。凝胶的温敏性、溶蚀降解性、亲疏水性等可根据载药和释放的需要,通过嵌段组成和比例调控。凝胶骨架可以保护脂质体的完整性,提高其稳定性,适用于局部给药,扩展了脂质体应用范围。
12.作为本发明一种优选的实施方式,所述的温敏凝胶包括壳聚糖、pnipam、peg嵌段聚合物、泊洛沙姆或聚多肽中的任何一种或一种以上的混合物,优选的,所述的原位温敏凝胶是peg嵌段聚合物,更优选的,所述peg嵌段聚合物是plga-peg-plga凝胶。
13.本发明的另一方面是提供了sting激动剂脂质体-温敏凝胶的制备方法,包括:
14.(ⅰ)制备载sting激动剂的脂质体溶液;
15.(ⅱ)向制备的载sting激动剂的脂质体溶液中加入原位温敏凝胶中搅拌至完全溶解,即得。
16.本发明中所述的载sting激动剂的脂质体溶液可采用脂质磷酸钙纳米法、硫酸铵梯度法、醋酸钙梯度法或薄膜分散法中的任何一种方法制备得到;本发明通过试验发现,采用脂质磷酸钙纳米法制备得到载sting激动剂的脂质体溶液的包封率显著优于其它的制备方法,因此,本发明优选采用脂质磷酸钙纳米法制备得到载sting激动剂的脂质体溶液。
17.作为本发明一种优选的具体实施方式,所述的采用脂质磷酸钙纳米法制备得到载sting激动剂的脂质体溶液的方法包括:
18.将na2hpo4水相或由cacl2和sting激动剂组成的水相分别分散到含有壬基酚聚氧乙烯醚(igepal)的环己烷油油相中分散均匀后分别得到na2hpo4相微乳和载sting激动剂的cacl2相微乳,将二者混合后进行破乳、离心得到cap-core;最后,将dspe-peg2000、阳离子脂材和cap-core混合均匀得到载sting激动剂的脂质体溶液。
19.作为一种最优选的实施方式,本发明提供了一种采用脂质磷酸钙纳米法制备载sting激动剂的脂质体溶液的方法,包括;
20.(1)将na2hpo4水溶液加入到由环己烷和igepal组成的油相中超声处理后再加入dopa得到na2hpo4相微乳;(2)将由cacl2和sting激动剂组成的水溶液加入到由环己烷和igepal组成的油相中超声处理得到载sting激动剂的cacl2相微乳;(3)将载sting激动剂的cacl2相微乳加入到na2hpo4相微乳中混合搅拌后破乳,离心,获得cap小球;(4)将cap小球溶于氯仿,离心,弃掉未被dopa包被的磷酸钙沉淀,取上清得到cap-core;(5)将dspe-peg2000、阳离子脂材和cap-core混合均匀,挥发掉氯仿,即得载sting激动剂的脂质体溶液。
21.优选的,步骤(1)中na2hpo4水溶液与由环己烷和igepal组成的油相的体积比为(0.1~5):(10~30),其中,环己烷与igepal的体积比优选为2~5:1,所述na2hpo4的浓度优选为10~50mmol,其ph值为6~9。
22.优选的,步骤(1)中所述的超声条件是50~200w超声1~5mins,超声处理15分钟再加入20mg/ml dopa。
23.优选的,步骤(2)中由cacl2和sting激动剂组成的水溶液与由环己烷和igepal组成的油相的二者体积比优选为(0.1~5):(10~30),其中,环己烷与igepal的体积比为2~5:1。所述的cacl2溶液的浓度优选100~1000mmol,所述sting激动剂的浓度优选为2mg/ml。
24.优选的,步骤(3)中所述的搅拌优选采用磁力搅拌;所述的破乳是加入乙醇进行破乳;所述的离心优选为10000~20000g,离心1~30mins。
25.优选的,步骤(5)中所述阳离子脂材包括但不限于dotap、dotma、dimrie、dotim、dogs、dospa、cholesterol、dc-chol或bgtc中的任何一种或一种以上按照任意比例组成的混合物,更优选的,所述阳离子脂材由dotap和cholesterol组成,二者的质量比优选为1~
10:1。
26.作为一种优选的实施方式,步骤(ⅱ)中向制备的载sting激动剂的脂质体溶液中加入plga-peg-plga凝胶,控制其终浓度在5-30%(w/w)之间,然后在4℃条件下磁力搅拌直至颗粒完全溶解。
27.本发明sting激动剂脂质体-温敏凝胶的制备主要由两步构成:
28.1.载sting激动剂cgamp的脂质体构建:脂质体可防止药物被外核苷酸焦磷酸酶/磷酸二酯酶降解,又可避免其从凝胶亲水性孔道快速释放。
29.2.脂质体-原位温敏凝胶体系:采用有缓释性能的温敏凝胶构建此体系。该系统将脂质体与原位温敏凝胶的优势结合,增加药物的摄入细胞的同时,避免突释,减小副作用,实现良好的缓控释,改善药效。
30.本发明首先制备了一个ph敏感的磷酸钙(cap)核心,核心的中空结构用于靶向递送水溶性药物。核心外使用阴离子磷脂-二油酰磷脂酸(dopa)作为预涂层试剂,制备sting激动剂递送载体,即在纳米尺寸的cap核心形成过程中,sting激动剂被封装在其中。脂质涂层可防止cap核心在离心分离步骤期间聚集,并使其可溶于氯仿中。dopa层是cap表面双层脂质中的内层脂质,将外层脂质材料添加到cap核心的氯仿溶液中,旋蒸、成膜、水化后得到包裹cap核心的双层脂质。
31.本发明sting激动剂脂质体-温敏凝胶的脂质体粒径小、稳定性好、改善了sting激动剂的入胞和释放行为,避免了突释效应,在体内有持续稳定的sting激动剂刺激,进而更好的发挥药效并增加局部药物浓度、减小副作用、改善药效;凝胶骨架可以保护脂质体的完整性,提高其稳定性,适用于局部给药,扩展了脂质体应用范围。同时采用的材料生物相容性好、制备工艺简单,而且原位温敏凝胶的释药性能可以通过改变材料化学结构来调节,从而精准控制sting激动剂的释放。尤其对于亲水性药物,将脂质体和凝胶的优势结合,在增加药物摄取入胞的同时,还可实现良好的缓控释性能。
32.本发明通过试验考察了所构建的sting激动剂脂质体-温敏凝胶的理化性质、体外释放以及药效学,结果证明所构建的sting激动剂脂质体-温敏凝胶可实现长效释放,并对肿瘤的控制发挥了较好的治疗效果。
33.本发明所涉及的缩略术语
34.dopa:阴离子磷脂-二油酰磷脂酸。
35.dotap:(2,3-二油氧基丙基)三甲基氯化铵。
36.dotma:氯化三甲基-2,3-二油烯氧基丙基铵。
37.dmrie:溴化二甲基-2-羟乙基-2,3-双十四烷氧基丙基铵。
38.dotim:1-[2-(油酰氧基)乙基]-2-油基-3-(2-羟乙基)咪唑啉氯化铵。
[0039]
dogs:n-(2-精胺甲酰基)-n’,n
’‑
双十八烷基甘氨酰胺。
[0040]
dospa:三氟乙酸二甲基-2,3-二油烯氧基丙基-2-(2-精胺甲酰氨基)乙基铵。
[0041]
dc-chol:3β-[n-(n’,n
’‑
二甲基胺乙基)胺基甲酰基]胆固醇。
[0042]
bgtc:双胍盐-乙基胺-胆固醇。
[0043]
pnipam:聚(n-异丙基丙烯酰胺)。
附图说明
[0044]
图1本发明的sting激动剂脂质体电镜图。
[0045]
图2本发明的sting激动剂脂质体电镜图。
[0046]
图3本发明的sting激动剂脂质体粒径图。
[0047]
图4本发明的sting激动剂脂质体-温敏凝胶的释放曲线。
[0048]
图5本发明的sting激动剂脂质体-温敏凝胶的治疗肿瘤的肿瘤体积-时间变化。
[0049]
图6本发明的sting激动剂脂质体-温敏凝胶的治疗肿瘤的体重随时间变化。
具体实施方式
[0050]
以下结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
[0051]
预备实施例1sting激动剂脂质体的制备
[0052]
一、采用脂质磷酸钙纳米法制备sting激动剂脂质体
[0053]
(一)cap-core制备
[0054]
1.na2hpo4相微乳的制备
[0055]
油相:10~30ml环己烷/igepal=2~5:1;
[0056]
水相:0.1~5ml10~50mmolna2hpo4ph=6~9;
[0057]
将100~300ul水相加入油相中,50~200w超声1~5mins;
[0058]
过15分钟再加入100~300ul的20mg/mldopa;
[0059]
2.cacl2相微乳的制备
[0060]
油相:10~30ml环己烷/igepal=2~5:1;
[0061]
水相:0.1~5ml100~1000mmolcacl2;
[0062]
10~300ul2mg/mlcgamp;
[0063]
将100~300ul水相加入油相中,50~200w超声1~5mins;
[0064]
3.将步骤2制备的cacl2相微乳加入到步骤1制备的na2hpo4相微乳中,混合10~40mins,并在磁力搅拌器上100~800rpm搅拌;
[0065]
4.加入10~100ml无水乙醇破乳,离心(10000~20000g,1~30mins),乙醇洗2-3次;
[0066]
5.将获得的cap小球溶于1ml氯仿,离心-1000~5000g5mins,弃掉未被dopa包被的磷酸钙沉淀,取上清于4℃保存。
[0067]
(二)cap-liposome制备
[0068]
1.配制脂材的氯仿溶液
[0069]
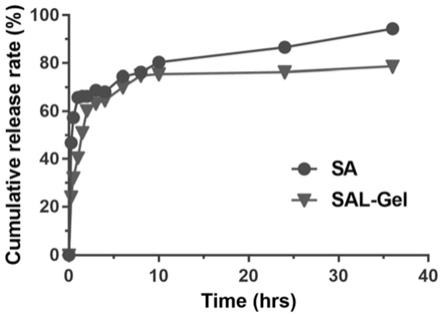
0.01~5mldspe-peg20001~10mmol
[0070]
0.01~5mldotap/cholesterol(1~10:1)1~30mmol(其中阳离子脂材包括但不限于dotap、dotma、dimrie和dotim,多价阳离子脂质dogs和dospa,阳离子胆固醇衍生物dc-chol和bgtc)
[0071]
0.01~5mlcap-core
[0072]
2.挥掉氯仿
[0073]
加入0.1~5ml 5mmol tris-hcl buffer(ph=7.4),超声(10~200w,1~10mins)至淡蓝或澄清。
[0074]
二、采用薄膜分散法制备sting激动剂脂质体
[0075]
精密称取处方量(表1)的dotap、胆固醇(cholesterol;chol)、dspe-mpeg2000、dope于茄形瓶中,加入适量(约30ml)三氯甲烷充分溶解。37℃水浴条件下减压旋蒸抽去溶剂至形成均匀薄膜(约30min)。加入100-300μl cgamp的水溶液(1-3mg cgamp溶解于1-10ml纯水中),涡旋。于70℃水浴条件下载药1h(盖住茄形瓶盖)。使用超声破碎仪对脂质体悬液进行超声至其呈现淡蓝色乳光。过sephadex g-50凝胶柱除去游离cgamp,得到脂质体,倒入小瓶中于4℃保存。
[0076]
表1不同方法制备sting激动剂脂质体的组分用量
[0077]
制备方法dotap(mg)hspc(mg)chol(mg)dspe-mpeg
2000
(mg)dope(mg)薄膜分散法10-25 1-51-51-10醋酸钙梯度法10-2510-251-51-5 硫酸铵梯度法10-2510-251-51-5 [0078]
三、采用醋酸钙梯度法制备sting激动剂脂质体
[0079]
1、精密称取处方量(表1)的hspc、dspe-peg2000及dotap、胆固醇于茄形瓶中,加入适量(约30ml)三氯甲烷充分溶解。37℃水浴条件下减压旋蒸抽去溶剂至形成均匀薄膜(约30min)。加1ml 130mmol
·
l-1醋酸钙水化液(冰醋酸调ph=6.0),涡旋。于70℃水浴条件下水化15min(盖住茄形瓶盖)。使用超声破碎仪(100%)对脂质体悬液进行超声至其呈现淡蓝色乳光。
[0080]
2、待其冷却至室温,过sephadex g-50凝胶柱除去游离醋酸钙,得到空白脂质体。加入100-300μl cgamp水溶液(1-3mg cgamp溶解于1-10ml纯水中);于70℃水浴条件下载药1h。待溶液冷却至室温,过sephadex g-50凝胶柱除去游离cgamp,得到脂质体溶液。
[0081]
四、采用硫酸铵梯度法制备sting激动剂脂质体
[0082]
1、精密称取处方量(表1)的hspc、dspe-peg2000及dotap、胆固醇于茄形瓶中,加入适量(约30ml)三氯甲烷充分溶解。37℃水浴条件下减压旋蒸抽去溶剂至形成均匀薄膜(约30min)。加1ml 120mmol
·
l-1硫酸铵水溶液,涡旋。于70℃水浴条件下水化15min(盖住茄形瓶盖)。使用超声破碎仪(100%)对脂质体悬液进行超声至其呈现淡蓝色乳光。
[0083]
2、待其冷却至室温,过sephadex g-50凝胶柱除去游离硫酸铵,得到空白脂质体。加入100-300μl cgamp水溶液(1-3mg cgamp溶解于1-10ml纯水中);于70℃水浴条件下载药1h。待溶液冷却至室温,过sephadex g-50凝胶柱除去游离cgamp,得到脂质体溶液。
[0084]
将以上四种方法制备的含sting激动剂脂质体中加入triton破膜(其中,采用脂质磷酸钙纳米法制备的脂质体需要加盐酸破坏磷酸钙,使sting激动剂释放出来),hplc方法测包封率:
[0085]
精密量取脂质体1ml至离心管中,加triton涡旋破膜,采用高效液相色谱法(hplc)测定。
[0086]
包封率%=系统中包封药量/投药量
×
100%
[0087]
包封率的比较:脂质磷酸钙纳米法》硫酸铵梯度法》醋酸钙梯度法》薄膜分散法。
[0088]
根据包封率测定结果可见,上述这四种制备方法中,脂质磷酸钙纳米法对sting激动剂的包封率最高。
[0089]
实施例1 sting激动剂脂质体-温敏凝胶的制备
[0090]
采用冷溶法制备脂质体温敏凝胶:
[0091]
向新鲜制备的脂质体溶液(预备实施例1中采用脂质磷酸钙纳米法制备的含sting激动剂脂质体)中加入适量的plga-peg-plga凝胶,控制其终浓度在5-30%(w/w)之间,然后在4℃条件下磁力搅拌直至颗粒完全溶解。
[0092]
空白的凝胶也通过相似的方法制备,即将凝胶加入去离子水中,冰浴搅拌至透明溶液形成。
[0093]
实施例2 sting激动剂脂质体-温敏凝胶的制备
[0094]
采用冷溶法制备脂质体温敏凝胶:向新鲜制备的脂质体溶液(预备实施例1中采用硫酸铵梯度法制备的含sting激动剂脂质体)中加入适量的壳聚糖,控制其终浓度在5-30%(w/w)之间,然后在4℃条件下磁力搅拌直至颗粒完全溶解。
[0095]
实施例3 sting激动剂脂质体-温敏凝胶的制备
[0096]
采用冷溶法制备脂质体温敏凝胶:向新鲜制备的脂质体溶液(预备实施例1中采用醋酸钙梯度法制备的含sting激动剂脂质体)中加入适量的泊洛沙姆,控制其终浓度在5-30%(w/w)之间,然后在4℃条件下磁力搅拌直至颗粒完全溶解。
[0097]
实施例4 sting激动剂脂质体-温敏凝胶的制备
[0098]
采用冷溶法制备脂质体温敏凝胶:向新鲜制备的脂质体溶液(预备实施例1中采用薄膜分散法制备的含sting激动剂脂质体)中加入适量的泊洛沙姆,控制其终浓度在5-30%(w/w)之间,然后在4℃条件下磁力搅拌直至颗粒完全溶解。
[0099]
试验例1 peg嵌段聚合物的嵌段组成和比例调控相变温度筛选试验
[0100]
凝胶的温敏性、溶蚀降解性、亲疏水性等可根据载药和释放的需要,通过peg嵌段聚合物的嵌段组成和比例进行调控。
[0101]
本发明对于peg嵌段聚合物的嵌段组成和比例进行了筛选,其嵌段组成和比例与相变温度的关系见表2。
[0102]
表2peg嵌段聚合物的组成和比例与相变温度
[0103][0104]
试验例2 sting激动剂脂质体-温敏凝胶的理化性质表征试验
[0105]
1.供试材料:实施例1制备的sting激动剂脂质体-温敏凝胶。
[0106]
2.试验方法及结果
[0107]
(1)脂质体电镜图:透射电镜结果显示,脂质体呈球形,粒径结果与dls测定的相
近。透射电镜结果见图1和图2。
[0108]
(2)脂质体温敏凝胶在相变温度以下为流动的液态,37℃时为固态。
[0109]
(3)脂质体粒径图:动态光散射法(dls)测得的sal平均粒径约为186nm,pdi为0.188,透射电镜结果显示,脂质体呈球形,粒径结果与dls测定的结果相近(图3)。
[0110]
(4)体外释放:脂质体和脂质体-温敏凝胶的体外药物释放通过透析袋法进行研究。选择分子量截筛为12000-14000da的透析袋在去离子水中浸泡过夜,预先溶胀。在释放实验开始前,将含有40μg cgamp的不同制剂分别加入透析袋中,透析夹密封后,37℃平衡1-20分钟,浸入1-100ml的pbs释放介质中,在气浴恒温震荡箱中以40转/分钟的速度振摇。在预设的时间点,取出所有的释放介质并补充等体积的释放介质。hplc法测定cgamp浓度,释放曲线见图4。
[0111]
试验例3 sting激动剂脂质体-温敏凝胶的药效学评价试验
[0112]
1.建立荷瘤小鼠模型:鼠神经母细胞瘤neuro2a细胞系培养于含10%胎牛血清和1%双抗的dmem(高糖)培养液中,贴壁后,于对数生长期,pbs冲洗,再用含0.25%edta的胰酶消化,终止消化后,1000rpm离心5min,基础培养基重悬后调整细胞浓度为1.0
×
106/50μl接种到a/j小鼠,接种50μl至胸部腋窝处。
[0113]
2给药方案:当肿瘤体积达到50-100mm3时,将小鼠随机分组,分别向小鼠瘤内注射100μl的sa(sting agonist)、瘤内注射100μl的实施例1制备的sting激动剂脂质体-温敏凝胶(sal-gel),给药剂量相当于30μg/只。监测肿瘤体积,观察小鼠的生存状态,注射部位是否有明显可见的毒性反应,绘制肿瘤体积-时间变化图;同时测量体重,绘制体重随时间变化的曲线。
[0114]
肿瘤体积-时间变化见图5;体重随时间变化见图6。
[0115]
根据试验结果可见,通过将脂质体和温敏凝胶结合,在增加sting激动剂的摄入细胞的同时,避免了突释,实现良好的缓控释,且明显改善了治疗肿瘤的效果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。