1.本发明涉及药物肽制备技术领域,具体涉及一种长效化艾塞那肽的制备方法及其应用。
背景技术:
2.艾塞那肽是一种胰高血糖素样肽-1(glp-1)类似物,序列为:
3.his-gly-glu-gly-thr-phe-thr-ser-asp-leu-ser-lys-gln-met-glu-glu-glu-ala-val-arg-leu-phe-ile-glu-trp-leu-lys-asn-gly-gly-pro-ser-ser-gly-ala-pro-pro-pro-ser-nh2。
4.艾塞那肽主要用于治疗ii型糖尿病。艾塞那肽具有glp-1受体激动剂作用,在分子结构、生物活性、作用靶点及免疫原性等方面与glp-1相似。艾塞那肽的分子结构与glp-1的同源性达53%,结构差异表现在:c端多出9个氨基酸,不易被肽链内切酶降解;n端第二个氨基酸为甘氨酸,不会被二肽基肽酶iv(dpp-iv)分解。特殊的分子结构使艾塞那肽在血浆中的半衰期长达9.57小时,患者每天注射两次且低血糖发生风险小,当血糖升高时,艾塞那肽能够升高细胞内camp,诱导胰岛素释放;当血糖降低时,其诱导胰岛素释放的作用即会消退。然而,由于蛋白质/多肽类药物普遍存在体内半衰期较短,物理、化学稳定性较差,易被体内各种蛋白酶降解等特性,使得这些药物通常需要在一天之内多次注射,这给病人带来了许多痛苦和诸多不便。
5.现有技术中公布了很多制备艾塞那肽的方法以及延长艾塞那肽半衰期的方法,例如cn102532303a公开了使用甲氧基聚乙二醇残基与艾塞那肽分子中赖氨酸残基的氨基或n末端组氨酸残基的氨基缀合,合成聚乙二醇(peg)缀合的艾塞那肽的方法;cn101980725a公开了脂肪酸-peg-艾塞那肽的结构,并且peg的修饰位点在n端his上。然而,使用peg的缺点在于不能形成均一的产物;使用脂肪酸链修饰的链接的缺点在于工艺复杂,成本较高。需开发新的艾塞那肽衍生物,使其在体内作用时间长,稳定性好,降糖效果好,同时保持低毒性和较好的活性。
技术实现要素:
6.本发明的目的在于提供一种半衰期长的长效化艾塞那肽的制备方法;本发明的另一个目的在于提供一种能够作为药物载体用于制备长效化艾塞那肽的darpin蛋白。
7.为达到上述发明目的,采用如下技术方案:
8.一种长效化艾塞那肽的制备方法,包括如下步骤:
9.步骤1:设计长效化艾塞那肽序列,序列中包含darpin序列;
10.步骤2:表达和纯化长效化艾塞那肽;
11.其中darpin的序列如seqidno.1所示。
12.darpin作为药物载体,用于提高艾塞那肽在体内的半衰期,以提高艾塞那肽降血糖能力。
13.优选地,步骤1中长效化艾塞那肽的结构为6his-酶切位点-艾塞那肽-linker-darpin;
14.其中,6his为组氨酸纯化标签,其氨基酸序列为his-his-his-his-his-his;
15.linker为连接肽,其氨基酸序列为:gly-gly-gly-gly-gly;
16.艾塞那肽氨基酸序列为:
17.his-gly-glu-gly-thr-phe-thr-ser-asp-leu-ser-lys-gln-met-glu-glu-glu-ala-val-arg-leu-phe-ile-glu-trp-leu-lys-asn-gly-gly-pro-ser-ser-gly-ala-pro-pro-pro-ser。
18.长效化艾塞那肽能够在在剂量较低的情况下长时间有效降低血糖浓度。
19.优选地,酶切位点为tev酶切位点,其氨基酸序列为:
20.glu-asn-leu-tyr-phe-gln-gly。
21.更优选地,步骤1包括:
22.将艾塞那肽的序列融合构建到darpin的n端,艾塞那肽-darpin之间使用5个甘氨酸作为linker,形成艾塞那肽-(gly)
5-darpin。
23.优选地,步骤2包括:
24.步骤2-1:构建表达载体;
25.步骤2-2:长效化艾塞那肽的表达;
26.步骤2-3:长效化艾塞那肽的纯化;
27.优选地,步骤2-1中的表达载体为pet28a( )载体,选取的酶切位点为ndeⅰ和xhoⅰ。
28.更优选地,步骤2-1包括:
29.将艾塞那肽-(gly)
5-darpin使用酶切位点ndeⅰ和xhoⅰ构建于pet28a( )载体中,所有表达载体保留n端his-tag,并在艾塞那肽序列之前加入tev酶切位点以便于切掉his-tag。
30.优选地,步骤2-2中表达重组蛋白使用大肠杆菌bl21(de3)菌株。
31.优选地,步骤2-2包括:
32.将载体使用化学转化法转入bl21(de3)感受态细胞中,挑取单克隆接入到培养基中,过夜培养后,转接入培养基中培养至od600为0.6-0.8之间,加入iptg诱导,之后5000rpm离心收集菌体。
33.更优选地,步骤2-2包括:
34.将载体使用化学转化法转入bl21(de3)感受态细胞中,挑取单克隆接入到5-10ml lb培养基(8-12g/l蛋白胨,3-8g/l酵母粉和5-15g/l氯化钠,40-70μg/ml卡那霉素或氨苄青霉素)中,35-39℃过夜培养后,按照1-3%的转接量接入3-8l培养基中,35-39℃培养至od600为0.6-0.8之间,加入终浓度0.1-0.2mm iptg于18-20℃诱导12-20小时,离心收集菌体。
35.优选地,步骤2-3中纯化重组蛋白使用的洗脱液包括如下成分:
36.tris/hcl,氯化钠,咪唑。
37.优选地,步骤2-3包括:
38.培养后收集菌体使用裂解缓冲液重悬菌体,高压破碎后离心去掉不溶沉淀;上清液使用镍亲和层析柱进行纯化,使用清洗缓冲液清洗之后,使用洗脱缓冲液洗脱目的蛋白;
洗脱后的目的蛋白透析到透析缓冲液中,进行室温酶切;酶切后透析,蛋白溶液第二次使用镍亲和层析柱结合并收集流穿,以去掉his标签。
39.更优选地,步骤2-3包括:
40.培养后收集菌体使用裂解缓冲液(20-25mm tris/hcl,80-120mm氯化钠,18-23mm咪唑,ph7.5-8.3)重悬菌体,高压破碎后15000rpm、2-5℃条件下离心20-40分钟去掉不溶沉淀;上清液使用镍亲和层析柱进行纯化,使用清洗缓冲液(20-25mm tris/hcl,80-120mm氯化钠,35-45mm咪唑,ph7.5-8.3)清洗8-12个柱体积之后,使用洗脱缓冲液(18-22mm tris/hcl,90-110mm氯化钠,180-210mm咪唑,ph7.5-8.3)洗脱目的蛋白;洗脱后的目的蛋白透析到透析缓冲液(18-22mm tris/hcl,1-2mm edta,ph7.5-8.3)中,使用tev酶和1-2mm dtt进行室温酶切1.5-3小时;透析去掉额外的edta和dtt,蛋白溶液第二次使用镍亲和层析柱结合并收集流穿,以去掉his标签。
41.进一步优选地,洗脱缓冲液还包括铝酸钠和二乙二醇。
42.含有铝酸钠和二乙二醇的洗脱缓冲液可以更好地洗脱目的蛋白,增加目的蛋白的得率。
43.进一步优选地,铝酸钠和二乙二醇的浓度比为:45-70:50-100。
44.进一步优选地,洗脱缓冲液包括如下成分:
45.18-22mm tris/hcl,90-110mm氯化钠,180-210mm咪唑,45-70mm铝酸钠,50-100mm二乙二醇,ph7.5-8.3。
46.本发明还公开了上述制备方法制得的长效化艾塞那肽,其中长效化艾塞那肽基因序列如seqidno.2所示。
47.本发明还公开了上述长效化艾塞那肽在制备降低血糖的药物和/或保健品中的用途。
48.本发明还公开了上述长效化艾塞那肽在制备延长艾塞那肽在血液中半衰期的药物和/或保健品中的用途。
49.与现有技术相比,本发明的有益效果为:
50.本发明提供一种长效化艾塞那肽的制备方法,将艾塞那肽与darpin蛋白进行融合设计,延长了艾塞那肽半衰期。本发明方法不加入额外化学修饰,避免在哺乳动物细胞或其他真核细胞表达体系,降低制备工艺难度。并且该方法能够在大肠杆菌等原核细胞中进行表达,生产制备简单。此外,本发明在洗脱目的蛋白时使用了含有铝酸钠和二乙二醇的洗脱缓冲液,使得洗脱效率更高,增加了目的蛋白的得率。
附图说明
51.图1为长效化艾塞那肽结构示意图;
52.图2为长效化艾塞那肽的sds-page检测结果,m为蛋白质检测的marker;1为长效化艾塞那肽;
53.图3为长效化艾塞那肽的活性检测结果。
具体实施方式
54.这里将详细地对示例性实施例进行说明,以下示例性实施例中所描述的实施方式
并不代表与本公开相一致的所有实施方式。相反,它们仅是与如所附权利要求书中所详述的、本公开的一些方面相一致的方法的例子。
55.下述实施例中的实验方法,如无特殊说明,均为常规方法,或按照制造厂商所建议的条件。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
56.实施例1
57.长效化艾塞那肽的制备
58.步骤1:设计长效化艾塞那肽序列
59.将艾塞那肽的序列融合构建到darpin的n端,艾塞那肽-darpin之间使用5个甘氨酸作为linker,形成艾塞那肽-(gly)
5-darpin。长效化艾塞那肽结构示意图如图1所示。
60.步骤2:表达和纯化长效化艾塞那肽
61.步骤2-1:构建表达载体
62.长效化艾塞那肽使用酶切位点ndeⅰ和xhoⅰ构建于pet28a( )载体中(载体购自北京索莱宝科技有限公司),所有表达载体保留n端his-tag,并在艾塞那肽序列之前加入tev酶切位点以便于切掉his-tag。
63.步骤2-1-1:引物设计
64.根据长效化艾塞那肽基因序列和酶切位点ndeⅰ、xhoⅰ设计如seqidno.3所示的上游引物和seqidno.4所示的下游引物,斜体部分为识别位点,下划线部分为酶切位点:
65.seqidno.3:
66.seqidno.4:
67.步骤2-1-2:长效化艾塞那肽基因扩增:
68.pcr反应体系:tmp-abd基因模板1μl、上游引物、下游引物各1μl,10
×
buffer 5μl、dntp 5μl、taq酶1μl,使用ddh2o补足25μl。
69.pcr反应程序:96℃2min;(94℃30s,65℃30s,72℃30s)
×
30个循环;72℃5min。
70.步骤2-1-3:双酶切:
71.分别使用ndeⅰ和xhoⅰ酶对长效化艾塞那肽基因序列和质粒进行酶切,酶切温度均为37℃,酶切时间均为2h。反应体系分别为:
72.长效化艾塞那肽基因序列酶切体系:
73.长效化艾塞那肽基因扩增产物2μl、10
×
h buffer 5μl、ndeⅰ1μl、xhoⅰ1μl,使用ddh2o补足30μl。
74.质粒酶切体系:
75.pet28a( )质粒2μl、10
×
h buffer 5μl、ndeⅰ1μl、xhoⅰ1μl,使用ddh2o补足30μl。
76.步骤2-1-4:长效化艾塞那肽基因与pet28a( )质粒连接
77.按照如下反应体系进行连接,连接温度为15℃,连接时间为16h。
78.连接反应体系:
79.双酶切后所得长效化艾塞那肽基因序列2μl、双酶切后所得pet28a( )质粒1μl、10
×
ligation buffer 5μl、t4连接酶2μl、ddh2o补足25μl。
80.步骤2-2:重组蛋白表达
81.表达质粒使用化学转化法转入bl21(de3)表达感受态中,挑取单克隆接入到5ml lb培养基(10g/l蛋白胨,5g/l酵母粉和10g/l氯化钠,50μg/ml卡那霉素)中,37℃过夜培养
后,按照1%的转接量接入5l培养基中,37℃培养至od600为0.7,加入终浓度0.1mm iptg于20℃诱导16小时,5000rpm离心收集菌体。
82.步骤2-3:重组蛋白纯化
83.收集的菌体使用裂解缓冲液(20mm tris/hcl,100mm氯化钠,20mm咪唑,ph 8.0)重悬菌体,高压破碎后15000rpm转速,4℃条件下离心30分钟以去掉不溶沉淀,上清液使用镍亲和层析柱进行纯化,使用清洗缓冲液(20mm tris/hcl,100mm氯化钠,40mm咪唑,ph 8.0)清洗10个柱体积之后,使用洗脱缓冲液(20mm tris/hcl,100mm氯化钠,200mm咪唑,ph 8.0)洗脱目的蛋白,洗脱后的目的蛋白透析到缓冲液(20mm tris/hcl,1mm edta,ph 8.0)中。使用tev酶和1mm dtt进行室温酶切2小时,透析去掉额外的edta和dtt,蛋白溶液第二次使用镍亲和层析柱结合并收集流穿,以去掉his-tag标签。
84.其中酶切体系为:tev酶200μl、蛋白溶液10ml、1m dtt 10μl。
85.实施例2
86.长效化艾塞那肽的制备
87.本实施例与实施例1的不同之处在于,使用的洗脱缓冲液包括如下成分:
88.20mm tris/hcl,100mm氯化钠,200mm咪唑,50mm铝酸钠,75mm二乙二醇,ph 8.0。
89.试验例1
90.长效化艾塞那肽溶液的定量
91.(1)取实施例1中制得的长效化艾塞那肽溶液使用sds-page进行蛋白纯度检测:
92.取5μl长效化艾塞那肽溶液,加入5
×
loading buffer进行sds-page,检测结果如图2所示。
93.由图2可知,没有明显杂带出现,说明所提取的长效化艾塞那肽纯度较高。
94.(2)对实施例1和实施例2中的长效化艾塞那肽溶液,蛋白浓度使用bca蛋白定量试剂盒,按照试剂盒说明书进行定量,试剂盒购自宁波普瑞柏生物技术有限公司。
95.取标准蛋白溶液稀释成不同浓度后测定560nm处吸光度,绘制标准曲线为y=0.0142x 0.2105,r2=0.9987。
96.测定长效化艾塞那肽在560nm处吸光度的吸光度并使用标准曲线计算长效化艾塞那肽蛋白浓度可知,实施例1中长效化艾塞那肽浓度为621.4mg/l,实施例2中长效化艾塞那肽浓度为733.6mg/l。实施例2中长效化艾塞那肽浓度明显大于实施例1中长效化艾塞那肽浓度,因此使用含有铝酸钠和二乙二醇的洗脱液可以增加目的蛋白的得率。
97.试验例2
98.长效化艾塞那肽活性测试
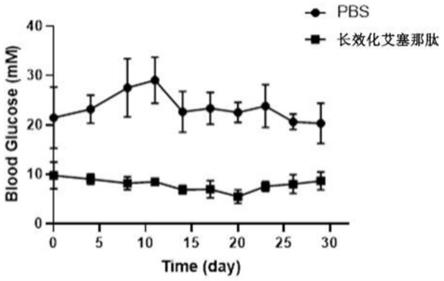
99.使用的c57bl/6雄性小鼠(购自上海杰思捷实验动物有限公司),8-10周龄,体重约20g,给予充足的食物和水进行自由采食,并于12小时光照-黑暗循环的环境中生长,环境温度控制为25℃。环境适应1周之后,开始进行实验。小鼠随机分为pbs组和长效化艾塞那肽组,pbs组为对照;每组6只,按照20nmol/kg的剂量注射小鼠,pbs组注射pbs,长效化艾塞那肽组注射实施例1中制得的长效化艾塞那肽;注射频率按照每3天1次,连续注射30天,从蛋白注射当天起,每天从小鼠尾部静脉取血,使用血糖仪检测小鼠血糖变化。
100.测试结果如图3所示。
101.由图3可知,和pbs组相比,长效化艾塞那肽组小鼠的血糖明显降低,并且持续低于
pbs组;此外,长效化艾塞那肽组小鼠的血糖变化较pbs组更加平稳,没有大幅波动;说明长效化艾塞那肽具有降低血糖以及减少血糖大幅波动的作用;每3天对小鼠进行注射1次,即可保持较低的血糖,说明长效化艾塞那肽具有较长半衰期。
102.试验例3
103.长效化艾塞那肽含量测定
104.使用的c57bl/6雄性小鼠(购自上海杰思捷实验动物有限公司),8-10周龄,体重约20g,给予充足的食物和水进行自由采食,并于12小时光照-黑暗循环的环境中生长,环境温度控制为25℃。环境适应1周之后,开始进行实验。小鼠随机分为艾塞那肽组和长效化艾塞那肽组;每组6只,按照5nmol/kg的剂量注射小鼠,注射后每12h从小鼠尾部静脉取血,离心取上清,对小鼠血清中艾塞那肽含量使用小鼠促胰岛素分泌肽(exendin-4)elisa试剂盒(购自上海舒话生物科技有限公司)按说明书操作进行检测。
105.检测结果如表1所示。
106.表1小鼠血清中艾塞那肽含量
[0107][0108]
由表1可知,在一次注射后长效化艾塞那肽48h后,小鼠血清中仍能检测出艾塞那肽,说明长效化艾塞那肽半衰期较长;而一次注射艾塞那肽之后,仅在24h内从小鼠血清中检测到艾塞那肽,并且检测到的艾塞那肽含量较低,这可能是由于大部分普通艾塞那肽在注射后的12h内已经被代谢掉。
[0109]
本发明的操作步骤中的常规操作为本领域技术人员所熟知,在此不进行赘述。
[0110]
以上所述的实施例对本发明的技术方案进行了详细说明,应理解的是以上所述仅为本发明的具体实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充或类似方式替代等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。