1.本发明涉及生物检测领域,更为具体地,本发明涉及一种胃癌预后生物标志物及其应用。
背景技术:
2.胃癌是严重威胁我国人民身体健康的恶性肿瘤之一。中国胃癌发病率占世界范围约40%,死亡率更居全球第一。更糟糕的是,目前为止胃癌的临床治疗策略,尤其是靶向的临床治疗策略仍十分有限。2021年,由安斯泰来开发抗体,fast研究显示zolbetuximab(一种claudin 18.2单抗)联合eox方案化疗对比单纯eox化疗可显著延长患者pfs时间(7.5个月∶5.3个月;hr=0.44,95%ci:0.29~0.67;p<0.0005)和os时间(13.0个月∶8.3个月;hr=0.55,95%ci:0.39~0.77;p<0.0005)。cldn18.2成为胃癌靶向治疗中最有前景的明星靶点。
3.cldn18是参与细胞间及分子间紧密连接的一类蛋白家族。cldn18.2是cldn18的剪切变异体。与cldn18其它的剪切异变体不同,cldn18.2在胃中特异性表达,cldn18.2蛋白作为一种高度选择性的胃谱系标记物。正常的胃癌组织中,cldn18.2通常表达于短周期分化细胞间连接区域,不表达于胃黏膜的干细胞区。但在胃癌恶性肿瘤组织中,由于恶性肿瘤细胞的极化改变,cldn18.2异位表达激活且抗体结合位点暴露,可轻易被cldn18.2靶向抗体识别并结合。抗cldn18.2靶向治疗则是利用cldn18.2在恶性肿瘤细胞这一表达特性,特异性识别并结合恶性肿瘤细胞cldn18.2分子,进一步通过抗体依赖细胞毒作用(antibody-dependent cellular cytotoxicity,adcc)及补体依赖细胞毒作用(complement-dependent cytotoxicity,cdc)杀死恶性肿瘤细胞。由此可见,对胃癌恶性肿瘤细胞表面的cldn18.2的表达检测对于区分cldn18.2靶向治疗有效人群,提高cldn18.2临床中治疗疗效至关重要。
4.然而目前,胃癌中针对cldn18.2的检测主要基于胃癌病理组织的cldn18.2免疫组织化学检测。但是由于病理组织取材困难,通常只能通过手术或内镜活检得到。同时,对病理组织的cldn18.2的检测仅能对取材时的单一时间进行评估,难以实现肿瘤患者的cldn18.2的表达的动态的变化过程,因此大大限制了病理组织cldn18.2免疫组化技术在cldn18.2靶向治疗临床治疗疗效的实时动态评估中的应用。
5.另一方面,目前针对恶性肿瘤患者的外周血循环肿瘤细胞(circulating tumor cells,ctcs)检测是目前恶性肿瘤诊断及预后监测领域的热点技术。包括cellsearch
®
循环肿瘤细胞检测及差相富集和瘤标免疫荧光染色-染色体荧光原位杂交(se-ifish
®
)整合技术在内的ctc监测技术不断涌现。cellsearch
®ꢀ
ctc检测技术目前仅能实现对恶性肿瘤患者外周血的ctc的个数进行检测,无法对ctc的单细胞表型进行进一步监测。进一步发展的se-ifish
®
技术尽管可在ctc计数基础上进行ctc核型以及肿标监测,但是依然无法实现胃癌患者ctc的单细胞的cldn18.2靶点的精准监测。
技术实现要素:
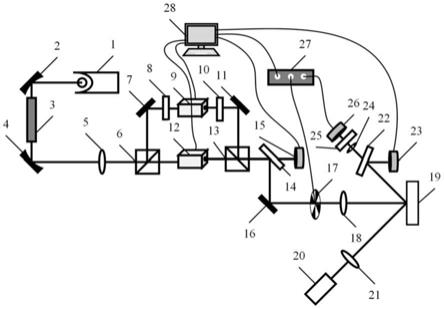
6.为了克服现有技术的缺陷,本发明基于胃癌患者外周血ctc,建立胃癌患者外周血ctc单细胞cldn18.2的表型检测技术。该检测技术仅需抽取胃癌患者6 ml外周血,即可对患者ctc单细胞表面的cldn18.2进行免疫荧光检测。为了实现上述效果,本发明具体提供如下的技术方案:本发明的第一个方面,提供一种cldn18.2作为胃癌预后诊断和/或生存期判断的生物标志物中的应用。
7.本发明的第二个方面,提供一种用于胃癌预后诊断和/或生存期判断的试剂盒,所述试剂盒中包括用于检测样品中cldn18.2的试剂。
8.在一种实施方式中,所述试剂盒为免疫荧光试剂盒。
9.在一种实施方式中,所述样品为患者静脉血或腹水。
10.本发明的第三个方面,提供一种cldn18.2在制备用于胃癌预后诊断和/或生存期判断的试剂盒中的应用。
11.在一种实施方式中,所述试剂盒为免疫荧光试剂盒。
12.本发明相对于现有技术具有如下显著的技术效果:1. 现有的胃癌患者cldn18.2的检测技术主要是对胃癌肿瘤病理组织的cldn18.2进行免疫组织化学检测,而本发明提供的技术方案仅需抽取胃癌患者6 ml外周血标本,无需进行复杂的手术及内镜下病理取材,标本获取过程更微创且安全;2. 相对于病理组织cldn18.2的单点、静态检测,本发明检测技术可实现胃癌患者cldn18.2的动态、多次及实时的监测;3. 目前病理组织cldn18.2的表达对胃癌患者的治疗疗效及预后的预测作用仍无定论,本发明首次披露了在晚期胃癌患者外周血中检出cldn18.2阳性ctc或在腹膜转移胃癌患者腹水中检出cldn18.2阳性的dtc预示患者具有更短的pfs及os,可以有效的在治疗前预测晚期胃癌患者的治疗疗效及总生存;4. 与常规的恶性肿瘤患者的外周血循环肿瘤细胞(circulating tumor cells,ctcs)检测技术仅可进行ctc计数相比,本发明首次实现对所富集ctc的单细胞cldn18.2的靶点表型进行精准监测,是唯一可用于胃癌患者cldn18.2状态监测的外周血检测技术,对于胃癌患者cldn18.2的异质性的表达监测具有独一无二的优势。
附图说明
13.附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:图1. 荧光显微镜下cldn18.2阳性的肿瘤细胞(ctc或
ma
dtc)鉴定;图2. 荧光显微镜下cldn18.2阳性的肿瘤内皮细胞(cec或
ma
dec)鉴定;图3. cldn18.2阳性ctc(a)或四倍体ctc(b)与晚期胃癌患者pfs相关性。(a)中实线为外周血无cldn18.2
ctc的晚期胃癌患者,虚线为外周血存在≥1个/6 ml cldn18.2
ctc的晚期胃癌患者。具有≥1个/6 ml cldn18.2
ctc的晚期胃癌患者(虚线)相比无cldn18.2
ctc的晚期胃癌患者(实线)的pfs时间显著性缩短。(b)中实线为外周血无cldn18.2
8号染色体4倍体的ctc(tetra ctc)的晚期胃癌患者,虚线为外周血存在≥1个/
6 ml cldn18.2
tetra ctc的晚期胃癌患者。具有≥1个/6 ml cldn18.2
tetra ctc的晚期胃癌患者(虚线)相比无cldn18.2
tetra ctc的晚期胃癌患者(实线)的pfs时间显著性缩短;图4. cldn18.2阳性
ma
dtc(a)或多倍体
ma
dtc(b)与腹腔播散胃癌患者os相关性。(a)中实线为腹水中无cldn18.2
ma
dtc的患者,虚线为外周血存在≥1个/10 ml cldn18.2
ma
dtc的患者。具有≥1个/10 ml cldn18.2
ma
dtc的患者(虚线)相比无cldn18.2
ma
dtc的患者(实线)的os时间显著性缩短。(b)中实线为腹水中无cldn18.2
8号染色体多倍体的
ma
dtc(multi ma
dtc)的患者,虚线为外周血存在≥1个/10 ml cldn18.2
multi ma
dtc的患者。具有≥1个/10 ml cldn18.2
multi ma
dtc的腹腔播散转移胃癌患者(虚线)相比无cldn18.2
multi ma
dtc的患者(实线)的os时间显著性缩短。
具体实施方式
14.以下结合附图对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
15.实施例1 患者样本的分离和鉴定方法前瞻性入组2017年11月至2021年5月在北京大学消化肿瘤内科接收治疗的92例晚期胃癌患者。其中,男性患者52名,女性患者40名。69名患者年龄在≤60岁,23名患者年龄 》60岁。所有患者通过病理学诊断确诊晚期胃或胃食管结合部恶性肿瘤。通过mri及ct确诊具有远处转移灶为晚期胃癌。病理确诊为her2阳性的胃癌患者接受化疗联合曲妥珠靶向治疗的标准治疗;病理确诊为her2阴性的患者则接受紫衫联合铂类为主的化疗。入组患者均已签署知情同意书。
16.1、抽取胃癌患者静脉血6 ml或者收集胃癌患者腹水10 ml于acd抗凝管中,常规离心分离血浆备用。
17.2、对血浆中ctc细胞进行富集及分离,具体步骤为:通过向血浆中加入样本密度分离液(cytelligen)提取血浆中单细胞层,之后加入免疫细胞去除磁珠对所提取单细胞层中的cd45
免疫细胞进行去除,通过差向富集对单细胞层中ctc进行浓缩及富集,最终得到的ctc单细胞悬液用于后续步骤。
18.3、对步骤2中制备得到的ctc单细胞进行cldn18.2免疫荧光染色,具体步骤为:富集所得到的ctc单细胞悬液与af488标记cldn18.2抗体,af594标记免疫细胞特异标志物cd45抗体以及cy7标记内皮细胞特异标志物cd31抗体进行室温孵育30 min。孵育后成功荧光标记的ctc单细胞悬液用于后续核型的标记。
19.4、对ctc进行核型的fish鉴定,具体步骤为:步骤4中完成多色免疫荧光染色的ctc单细胞悬液固定于载玻片上,进一步固定细胞与8号染色体(cep8)fish杂交探针(abbott)孵育,与杂交仪中37 o
c杂交3小时后去除封片,进一步进行后续免疫荧光分析。荧光显微镜下,最终确定细胞核中cep8的fish杂交点在≥3个时说明该细胞为肿瘤相关异倍体细胞。其中fish杂交点为3个时定义为8号染色体核型3倍体细胞;fish杂交点为4个时为8号染色体核型4倍体细胞,fish杂交点≥5个时为8号染色体核型多倍体细胞。
20.5、cldn18.2
ctc的免疫荧光鉴定,具体步骤为:利用全自动免疫荧光分析仪(zeiss)及metasystems智能识别系统对ctc细胞载玻片进行全片自动扫描及智能cldn18.2
ctc识别。
21.通常首先,将存在完整细胞核染色(dapi通道细胞核染色完整),细胞表面的白细胞特异性标志物cd45染色阴性,及细胞核8号染色体的fish杂交(cep8通道)≥2倍体的细胞鉴定为非白细胞的肿瘤相关细胞。进一步,筛选肿瘤相关内皮细胞cd31通道表达阴性但cldn18.2通道表达阳性的细胞鉴定为cldn18.2阳性的ctc或madtc;筛选肿瘤相关内皮细胞cd31通道及cldn18.2通道表达均阳性的细胞为cldn18.2阳性的cec或madec。cldn18.2阳性ctc或cec的8号染色体不同核型均通过鉴别cep8通道不同fish杂交点数目进行鉴定。
22.鉴定结果如图1及图2所示。图1中从上而下分别为8号染色体核型3倍体cldn18.2
ctc/
ma
dtc(cep8通道存在3个fish杂交点)、8号染色体核型4倍体cldn18.2
ctc/
ma
dtc(cep8通道存在4个fish杂交点)及8号染色体核型多倍体cldn18.2
ctc/
ma
dtc(cep8通道存在≥5个fish杂交点)。图2中从上到下分别为8号染色体核型3倍体cldn18.2
cec/
ma
dec(cep8通道存在3个fish杂交点)、8号染色体核型4倍体cldn18.2
ctc/
ma
dec(cep8通道存在4个fish杂交点)及8号染色体核型多倍体cldn18.2
ctc/
ma
dec(cep8通道存在≥5个fish杂交点)。
23.实施例2 cldn18.2
ctc的判定1、cldn18.2
ctc的鉴别标准:完成智能扫描后,对cldn18.2
ctc进行鉴定,定义cd45表达阴性,cd31表达阴性及cldn18.2表达阳性的8号染色体异倍体扩增细胞为cldn18.2阳性ctc(cldn18.2
ctc);定义cd45表达阴性,cd31表达阳性及cldn18.2表达阳性的8号染色体异倍体扩增细胞为cldn18.2
循环肿瘤内皮细胞(circulating endothelial cells,cecs)。
24.2、存在cldn 18.2
ctc或cec的胃癌患者的确定:在完成单个cldn18.2
ctc及cec的鉴定后,对每个胃癌患者外周血中总共的cldn18.2
ctc或cec的个数进行统计。外周血中存在≥1 cldn18.2
ctcs或cecs的胃癌患者定义为cldn18.2 ctc或cec阳性胃癌患者,反之则为cldn18.2 ctc或cec阴性胃癌患者。
25.结果如表1所示:表1. 在92例胃癌患者外周血及18例胃癌患者腹水中cldn18.2
细胞检出情况a. 阳性患者定义为利用本技术发明在胃癌患者外周血中或腹水中检出≥1个cldn18.2
细胞b. madtc
指腹水中播散的游离肿瘤细胞(malignant ascites disseminated tumor cells)c.
ma
dec指腹水中播散的游离肿瘤相关内皮细胞(malignant ascites disseminated endothelial cells)无进展生存期(progression-free survival,pfs)在恶性肿瘤治疗中指肿瘤患者从接受治疗开始到治疗耐药肿瘤进展所持续的时间。如果肿瘤患者接受某一肿瘤治疗的
pfs时间越短,说明该治疗对这一肿瘤患者的治疗效果越差,反之则说明该治疗疗效越好。我们通过对92例晚期胃癌患者6 ml外周血中的cldn18.2
ctc进行检出,以每6 ml中可以检出≥1个cldn18.2
ctc作为cldn18.2阳性阈值,发现,外周血cldn18.2阳性的胃癌患者的pfs显著性短于外周血cldn18.2阴性的胃癌患者。如图3a所示,外周血中cldn18.2阳性患者(图3a中虚线对应患者)的平均pfs为3.88个月,显著短于外周血cldn18.2阴性的胃癌患者(图3b中实现对应患者)的平均pfs(7.00个月,p = 0.045)。进一步,利用该技术发明对外周血ctc的cldn18.2及8号染色体同时检测,发现,若胃癌患者外周血同时检出cldn18.2阳性且8号染色体四倍体扩增的ctc (cldn18.2
tetra
ctc),这类患者的pfs同样显著短于外周血cldn18.2阴性的患者。如图3b所示,存在阳性的cldn18.2
tetra
ctcs的晚期胃癌患者(图3b中虚线对应的患者)的平均pfs为2.73个月,显著短于cldn18.2
tetra
ctc为阴性的患者(图3b中实现对应的患者)的平均pfs(6.90个月,p = 0.027)。这一结果说明,基于该技术发明检测胃癌患者外周血中cldn18.2阳性的ctc可以有效在胃癌患者标准治疗(化疗
±
曲妥珠靶向治疗)前预测患者治疗后pfs其可能治疗疗效。外周血中可检出阳性cldn18.2 ctc的胃癌患者可能具有更短的治疗pfs且可能治疗效果欠佳。反之,外周血中未检出阳性cldn18.2 ctc的胃癌患者其治疗可以具有更长的pfs治疗效果更好。
26.实施例3 患者其他样本中cldn18.2
ctc的判定以及与患者生存时间(overall survival,os)的关系除了可以进行外周血中cldn18.2阳性的ctc进行检出外,本发明的检测方法还可以对腹膜转移胃癌患者腹水中的cldn18.2阳性肿瘤相关细胞进行检出并利用所检出cldn18.2阳性进行腹膜转移胃癌患者的预后预测。
27.在恶性肿瘤中,总生存时间是用来评估肿瘤患者预后的关键指标。os指肿瘤患者从恶性肿瘤开始治疗到任何原因死亡期间的时间。os时间越短的患者说明肿瘤治疗预后越好,反之则说明肿瘤治疗预后越差。我们前瞻性入组了18例于2019年8月至2020年9月在北京大学肿瘤医院接受姑息治疗的腹腔播散转移胃癌患者,其腹水中的cldn18.2阳性的肿瘤相关
ma
dtc(腹水中播散的游离肿瘤细胞,malignant ascites disseminated tumor cells)。其检出方法与前述外周血检测相同。基于此方法,检出结果中设定检出≥1个cldn18.2
ma
dtc作为腹水cldn18.2的阳性阈值,发现,腹水cldn18.2阳性的腹膜转移胃癌患者的os显著性短于cldn18.2阴性的腹膜转移胃癌患者。如图4a所示,腹水cldn18.2阳性的腹膜转移胃癌患者(图4a中虚线)的平均os为3.96个月,显著短于腹水cldn18.2阴性的腹膜转移胃癌患者(图4a中实线)的平均os(15.71个月,p = 0.045)。进一步,利用该技术发明对腹水
ma
dtc的cldn18.2及8号染色体同时检测。检测方法与外周血中ctcs的8号染色体核型检测相同(实施例1第4步骤),即经免疫荧光染色完成cldn18.2染色的
ma
dtcs进一步固定于载玻片上,与8号染色体fish杂交探针(abbott)孵育,与杂交仪中37 o
c杂交3小时后去除封片,进一步在荧光显微镜下进行鉴定分析。鉴定分析为在荧光显微镜下观察细胞核中cep8的fish杂交点个数。其中fish杂交点为3个时定义为8号染色体核型3倍体细胞;fish杂交点为4个时为8号染色体核型4倍体细胞,fish杂交点≥5个时为8号染色体核型多倍体细胞。实验结果发现, 若腹膜转移胃癌患者腹水同时检出cldn18.2阳性且8号染色体多倍体扩增的
ma
dtc (cldn18.2
multidtc
),这类患者的os同样显著短于腹水cldn18.2阴性的患者。如图4b所示,存在阳性的cldn18.2
multi
dtcs的腹膜转移胃癌患者(图4b中虚线对应的患者)的平
均os为2.20个月,显著短于cldn18.2 multi
dtc为阴性的患者(图4b中实现对应的患者)的平均os(6.80个月,p = 0.018)。这一结果说明,通过检测腹膜转移胃癌患者腹水中cldn18.2阳性的dtc可以有效在腹膜转移胃癌患者治疗前预测其可能的总生存期。腹水中可检出阳性cldn18.2 dtc的腹膜转移胃癌患者可能具有不良的预后总生存,而腹水中未检出阳性cldn18.2 dtc的腹膜转移胃癌患者其预后总生存可能更长更好。
28.显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。