一种ca-tm融合蛋白及其在检测梅迪-维斯纳病毒中的应用
技术领域
1.本发明涉及生物技术领域。更具体地,涉及一种ca-tm融合蛋白及其在检测梅迪-维斯纳病毒中的应用。
背景技术:
2.梅迪-维斯纳病(maedi-visna disease,mvd)是由梅迪-维斯纳病毒(madedi-visna virus,mvv)引起绵羊缓慢性、接触性、进行性的炎性疾病。mvv基因组长度在9200个核苷酸之间,主要由3个逆转录病毒共同的主要基因(gag、pol和env)和调控基因(vif、tat和rev)组成。编码基因分别对应结构蛋白(gag、pol和env)和调节蛋白(vif、tat和rev)。gag编码保护dna的内部结构蛋白,其中最大的是衣壳蛋白(capsid protein,ca,也称p25),它刺激宿主产生抗体,常用于elisa检测方法。env编码以下两种插入囊膜的蛋白质:表面糖蛋白(surface protein,su,也称gp135)和跨膜糖蛋白(transmembrane protein,tm,也称gp46)。其中,su刺激机体产生抗体,但其具有高度可变性,而tm是一种相对保守得多的蛋白质,它是不同地方国家进行mvd elisa检测的优先抗原选择。目前为止,没有对mvd有效治疗的方法,对受到mvv感染的病畜只能进行隔离、扑杀。mvv具有较长的潜伏期,往往数年才能在羊群中发现病畜,在这段时间中,已经发病的病畜在羊群中仍在通过排出呼吸道分泌物以及密切接触持续传播病毒。正因为以上这些因素,造成了养羊业不同程度的经济损失,世界动物卫生组织(office international des epizooities,oie)将mvd列为b类疫病,中国也将其列为ⅱ类动物疫病。目前只能采用足够的控制程序用来限制病毒的传播或根除疾病。如何能根除mvd在很大程度上取决于如何准确、及时的在羊群中找到发病羊,所以对于mvv的检测手段的使用以及更新就显得尤为重要。
3.因此,建立一种敏感性高、特异性强的检测绵羊mvv的试剂盒对于mvd的防控、监测及公共卫生都具有重要的意义。
技术实现要素:
4.本发明的第一个目的在于提供一种ca-tm融合蛋白,用于快速检测梅迪-维斯纳病毒抗体水平,以判定绵羊梅迪-维斯纳病毒感染情况。
5.本发明的第二个目的在于提供上述ca-tm融合蛋白在检测梅迪-维斯纳病毒中的应用和/或在检测梅迪-维斯纳病毒抗体中的应用。
6.本发明的第三个目的在于提供一种梅迪-维斯纳病毒抗体间接elisa检测试剂盒。
7.本发明的第四个目的在于提供一种梅迪-维斯纳病毒抗体间接elisa检测方法。
8.为达到上述目的,本发明采用下述技术方案:
9.第一方面,本发明提供了一种ca-tm融合蛋白,所述ca-tm融合蛋白的氨基酸序列如seq id no.1所示。
10.本发明ca-tm融合蛋包含了绵羊梅迪-维斯纳病毒中结构蛋白(gag)主要刺激机体产生抗体的衣壳蛋白(ca,也称p25)及囊膜蛋白(env)中较为保守的跨膜蛋白(tm,也称
gp46)。
11.本发明ca-tm融合蛋白可人工合成,也可先合成其编码基因,再进行生物表达得到。在本发明具体的实施方式中,采用生物表达的方式获得,具体方法为:选取绵羊梅迪-维斯纳病毒ca基因和tm基因抗原性强且保守的位点,设计绵羊梅迪-维斯纳病毒ca基因的上游引物和含有linker的下游引物及tm基因的含有linker的上游引物和下游引物。利用pcr技术分别扩增ca基因和tm基因,并对扩增基因进行回收,利用重叠延伸pcr技术,将回收的含有linker的ca基因和tm基因进行融合,最终得到ca-tm融合基因,并将该ca-tm融合基因插入到表达载体peasy-blunt e1中,通过测序验证其准确性,并转化到bl21(de3)表达菌中,通过iptg诱导,经切胶纯化获得ca-tm融合蛋白。
12.第二方面,本发明提供了上述ca-tm融合蛋白在如下任一中的应用:
13.1)检测待测动物血清是否含有梅迪-维斯纳病毒抗体中的应用;
14.2)在制备检测待测动物血清是否含有梅迪-维斯纳病毒抗体产品中的应用;
15.3)检测待测动物是否感染梅迪-维斯纳病毒中的应用;
16.4)在制备检测待测动物是否感染梅迪-维斯纳病毒产品中的应用。
17.本发明ca-tm融合蛋白既包含了gag蛋白(具体为ca蛋白)又包含了env蛋白(具体为tm蛋白),在检测绵羊梅迪-维斯纳病毒的具有特异性强和敏感性高的特点,弥补了只包含gag蛋白对于检测绵羊梅迪-维斯纳病毒的特异性强而敏感性不足和只包含env对于检测绵羊梅迪-维斯纳病毒的敏感性强而特异性不足的问题。
18.第三方面,本发明提供了一种梅迪-维斯纳病毒抗体间接elisa检测试剂盒,所述试剂盒包括以上述ca-tm融合蛋白作为包被抗原的酶标板。
19.进一步,所述ca-tm融合蛋白的包被浓度为0.1-5μg/100ul;优选的为0.1μg/100ul。
20.进一步,所述试剂盒还包括洗涤液、样品稀释液、阳性对照血清、阴性对照血清、酶标二抗浓缩液、酶标二抗稀释液、显色液和终止液中一种或多种。
21.进一步,所述洗涤液为1%吐温-20的0.2m pbs溶液(ph7.2-7.4),配制方法为称取磷酸二氢钾(kh2po4)5.40g、磷酸氢二钠(na2hpo4)28.4g、氯化钠(nacl)160.0g和氯化钾(kcl)4.0g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.2m pbs溶液;每99.0ml的0.2m pbs溶液加入1.0ml吐温-20。
22.进一步,所述样品稀释液为含1%bsa和1%吐温的0.01m pbs溶液(ph7.2-7.4),配制方法为取磷酸二氢钾(kh2po4)0.27g、磷酸氢二钠(na2hpo4)1.42g、氯化钠(nacl)8g和氯化钾(kcl)0.2g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.01m pbs溶液;每98ml的0.01m pbs溶液加入1g bsa及1ml吐温-20。
23.进一步,所述阴性对照血清为健康羊血清,经pcr,id screen mvv抗体检测试剂盒(购买自法国爱
·
迪威公司innovative diagnostics)检测为阴性,样本稀释液900倍稀释,od
450
值<0.4。
24.进一步,所述阳性对照血清为自然感染mvv阳性血清,经pcr,id screen mvv抗体检测试剂盒检测为阳性,样本稀释液900倍稀释,1.5≦od
450
值≦1.9。
25.进一步,所述酶标二抗浓缩液是使用酶标二抗稀释液进行70倍稀释的兔抗羊igg(购买自武汉三鹰生物技术有限公司)。
26.进一步,所述酶标二抗稀释液为含5%胎牛血清的0.01m pbs溶液(ph7.2-7.4),配制方法为称取磷酸二氢钾(kh2po4)0.27g、磷酸氢二钠(na2hpo4)1.42g、氯化钠(nacl)8g和氯化钾(kcl)0.2g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.01m pbs溶液;每95ml的0.01m pbs溶液加入5ml胎牛血清。
27.进一步,所述酶标二抗的稀释倍数为3000-7000倍,优选的为7000倍。
28.进一步,所述显色液为tmb显色液(购买自promega公司)。
29.进一步,所述终止液为2m h2so4,配制方法为将11.1ml的浓硫酸缓慢加入水中稀释,并定容至100ml。
30.进一步,在使用梅迪-维斯纳病毒抗体间接elisa检测试剂盒时,血清的稀释倍数为300-900倍,优选的为900倍。
31.上述梅迪-维斯纳病毒抗体间接elisa检测试剂盒如下任一中的应用也在本发明的保护范围之内:
32.1)检测待测动物血清是否含有梅迪-维斯纳病毒抗体中的应用;
33.2)在制备检测待测动物血清是否含有梅迪-维斯纳病毒抗体产品中的应用;
34.3)检测待测动物是否感染梅迪-维斯纳病毒中的应用;
35.4)在制备检测待测动物是否感染梅迪-维斯纳病毒产品中的应用。
36.在本发明具体的实施方式中,上述梅迪-维斯纳病毒抗体间接elisa检测试剂盒的操作方法为:
37.试剂配制:所有试剂使用前应恢复至室温(21
°±5°
),轻摇或颠倒使其混合均匀;洗涤液用去离子水或蒸馏水10倍稀释;
38.(1)样品准备:待动物全血析出血清后,吸取血清;将血清用样品稀释液按900倍稀释倍数稀释,充分混匀,得到稀释好的待测动物血清;
39.(2)加血清:将稀释好的待测动物血清加入到酶标板中,设阴、阳性对照血清各2孔,100μl/孔,用盖板膜盖住酶标板,置37℃温育60min,弃去反应液,每孔加入200μl洗涤液,洗涤4次;
40.(3)加酶标二抗:用酶标二抗稀释液按100倍稀释倍数稀释酶标二抗浓缩液,得到按7000倍稀释倍数稀释的酶标二抗,加入到酶标板,100μl/孔,用盖板膜盖住酶标板,37℃孵育60min,弃去反应液,每孔加入200μl洗涤液,洗涤4次;
41.(4)显色:加入显色液,100μl/孔,置室温避光显色5min;
42.(5)终止:加入终止液,100μl/孔,终止反应;
43.(6)读取od值:用酶标仪于450nm波长下分别读取阴性对照血清、阳性对照血清及待测动物血清的od值,依次记为p值、n值和s值;
44.当p值≥0.5且p/n值≥3判定检测成立,计算s/p,其中,值代表平均p值,代表平均n值;
45.(7)结果判读:当s/p≥0.44判定为阳性(即待测动物血清为阳性血清,也就是说待测动物血清含有梅迪-维斯纳病毒抗体或待测动物感染梅迪-维斯纳病毒),s/p≤0.39判定为阴性(即待测动物血清为阴性血清,也就是说待测动物血清不含有梅迪-维斯纳病毒抗体
或待测动物未感染梅迪-维斯纳病毒),0.39<s/p<0.44判定为可疑(即待测动物血清疑似为阳性血清,也就是说待测动物血清疑似含有梅迪-维斯纳病毒抗体或待测动物疑似感染梅迪-维斯纳病毒)。
46.第四方面,本发明提供了一种梅迪-维斯纳病毒抗体间接elisa检测方法,包括如下步骤:
47.1)包被抗原:以上述ca-tm融合蛋白作为包被抗原用包被液包被酶标板,洗涤;
48.2)封闭:加入封闭液,反应,洗涤;
49.3)加血清:加入阳性对照血清、阴性对照血清和待测动物血清,反应,洗涤;
50.4)加酶标二抗:加入酶标二抗,反应,洗涤;
51.5)显色:加入显色液,反应;
52.6)终止:加入终止液,终止反应;
53.7)读取od值:用酶标仪于450nm波长下分别读取阳性对照血清、阴性对照血清及待测动物血清的od值,依次记为p值、n值和s值;
54.当p值≥0.5且p/n值≥3判定检测成立,计算s/p,其中,值代表平均p值,代表平均n值;
55.8)结果判读:当s/p≥0.44判定为阳性(即待测动物血清为阳性血清,也就是说待测动物血清含有梅迪-维斯纳病毒抗体或待测动物感染梅迪-维斯纳病毒),s/p≤0.39判定为阴性(即待测动物血清为阴性血清,也就是说待测动物血清不含有梅迪-维斯纳病毒抗体或待测动物未感染梅迪-维斯纳病毒),0.39<s/p<0.44判定为可疑(即待测动物血清疑似为阳性血清,也就是说待测动物血清疑似含有梅迪-维斯纳病毒抗体或待测动物疑似感染梅迪-维斯纳病毒)。
56.在本发明中对抗原包被浓度、包被条件、封闭液、血清稀释倍数和酶标二抗稀释倍数进行优化,得到了最佳抗原包被浓度为0.1μg/100ul,最佳包被条件为37
°
孵育1h,最佳封闭液为含5%脱脂奶粉和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4),最佳血清稀释倍数为900倍,酶标二抗最佳稀释倍数为7000倍。
57.在本发明优选的实施方式中,所述梅迪-维斯纳病毒抗体间接elisa检测方法,包括如下步骤:
58.1)包被抗原:以上述ca-tm融合蛋白作为包被抗原,用包被液(ph9.6的0.05m碳酸盐缓冲液)进行稀释使得抗原包被浓度为0.1μg/100ul,置于酶标板中,100μl/孔,用盖板膜盖住酶标板,37
°
孵育1h,弃去反应液,每孔加入200μl洗涤液(含1%吐温-20的0.2m pbs溶液(ph7.2-7.4)),洗涤4次;
59.2)封闭:加入封闭液(含5%脱脂奶粉和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4)),200μl/孔,用盖板膜盖住酶标板,37℃孵育1h,弃去反应液,每孔加入200μl洗涤液(含1%吐温-20的0.2m pbs溶液(ph7.2-7.4)),洗涤4次;
60.3)加血清:使用样品稀释液(含1%bsa和1%吐温的0.01m pbs溶液(ph7.2-7.4))将阴性对照血清、阳性对照血清和待测动物血清按900倍稀释倍数稀释,分别得到稀释后的阴性对照血清、阳性对照血清和待测动物血清,置于酶标板中,100μl/孔,用盖板膜盖住酶
标板,置37℃孵育60min,弃去反应液,每孔加入200μl洗涤液(含1%吐温-20的0.2m pbs溶液(ph7.2-7.4)),洗涤4次;
61.4)加酶标二抗:用酶标二抗稀释液(含5%胎牛血清的0.01m pbs溶液(ph7.2-7.4))按100倍稀释倍数稀释酶标二抗浓缩液(使用酶标二抗稀释液进行70倍稀释的兔抗羊igg),得到按7000倍稀释倍数稀释的酶标二抗,加入到酶标中,100μl/孔,用盖板膜盖住酶标板,37℃孵育60min,弃去反应液,每孔加入200μl洗涤液(含1%吐温-20的0.2m pbs溶液(ph7.2-7.4)),洗涤4次;
62.5)显色:加入显色液(tmb显色液),100μl/孔,置室温避光显色5min;
63.6)终止:加入终止液(2m h2so4),100μl/孔,终止反应;
64.7)读取od值:用酶标仪于450nm波长下分别读取阴性对照血清、阳性对照血清及待测动物血清的od值,依次记为p值、n值和s值;
65.当p值≥0.5且p/n值≥3判定检测成立,计算s/p,其中,值代表平均p值,代表平均n值;
66.8)结果判读:当s/p≥0.44判定为阳性(即待测动物血清为阳性血清,也就是说待测动物血清含有梅迪-维斯纳病毒抗体或待测动物感染梅迪-维斯纳病毒),s/p≤0.39判定为阴性(即待测动物血清为阴性血清,也就是说待测动物血清不含有梅迪-维斯纳病毒抗体或待测动物未感染梅迪-维斯纳病毒),0.39<s/p<0.44判定为可疑(即待测动物血清疑似为阳性血清,也就是说待测动物血清疑似含有梅迪-维斯纳病毒抗体或待测动物疑似感染梅迪-维斯纳病毒)。
67.在本发明中,所述待测动物为羊,具体的为绵羊。
68.本发明的有益效果如下:
69.本发明基于ca-tm融合蛋白建立了梅迪-维斯纳病毒抗体间接elisa检测方法用于检测梅迪-维斯纳病毒抗体水平,具有特异性强、灵敏度高、重复性好和操作方便等特点,临床检测与现有国际商品化试剂盒符合率较高,可实现大规模检测,为梅迪-维斯纳病血清学检测及流行病学调查提供有效的手段,具有较为广阔的市场前景。
附图说明
70.下面结合附图对本发明的具体实施方式作进一步详细的说明。
71.图1为绵羊梅迪-维斯纳病毒ca基因扩增结果电泳图;其中,m为dl2000marker,1为阳性对照,2为阴性对照,3为目的pcr产物。
72.图2为绵羊梅迪-维斯纳病毒tm基因扩增结果电泳图;其中,m为dl2000marker,1为阳性对照,2为阴性对照,3为目的pcr产物。
73.图3为绵羊梅迪-维斯纳病毒ca基因、tm基因、ca-tm融合基因扩增结果电泳图;其中,m为dl2000marker,1为ca基因,2为tm基因,3为ca-tm融合基因。
74.图4为ca-tm融合基因蛋白表达sds-page考马斯亮兰染色图;其中,m为蛋白marker,1为未诱导菌液,2为诱导菌液,3为破碎菌体后上清,4为破碎菌体后沉淀。
75.图5为ca-tm融合蛋白纯化sds-page考马斯亮兰染色图;其中,m为蛋白marker,1为
blunt-e1空载体按照最佳比例混合,体系为5μl,25℃反应15min后,转化至transl-t1感受态细胞中,经测序确认其表达载体的准确性,最终获得阳性表达载体,命名为ca-tm-e1原核表达载体。
90.三、原核表达载体的诱导表达及可溶性分析
91.将构建好的ca-tm-e1原核表达载体转换至bl21(de3)感受态细胞中,均匀涂布至含氨苄的lb平板,37
°
倒置培养过夜,从lb平板中挑取单克隆菌,接种到20ml含氨苄的lb液体培养基中,待od
600
达0.5-0.8时(取此时的菌液作为未诱导菌液),加入终浓度为0.5mm iptg,于37
°
诱导8h(取此时的菌液作为诱导菌液)。将诱导8h的菌液经12000rpm离心10min,经pbs洗涤三次后,用pbs重悬菌体后,经超声破碎仪对菌体破碎,分别取破碎菌体后上清和破碎菌体后沉淀。将未诱导菌液、诱导菌液、破碎菌体后上清及破碎菌体后沉淀经sds-page凝胶电泳后,用考马斯亮兰染色,结果如图4所示,结果显示:成功诱导表达约40kda ca-tm融合蛋白且该蛋白主要以包涵体形成存在。
92.四、ca-tm融合蛋白的纯化
93.将步骤三得到的ca-tm融合蛋白(即未纯化的ca-tm融合蛋白)sds-page凝胶电泳后的胶块取出,浓缩胶并将胶放入1mmol/l的kcl溶液中浸泡至白色条带显出,将ca-tm融合蛋白对应的40kda大小位置的条带切下,并放入装有蛋白质电泳缓冲液的透析袋中,并使用蛋白质电泳液作为电泳缓冲液,60v电泳12h后将透析袋取出。将透析袋放入装有50ml pbs溶液的烧杯中,并将烧杯放于磁力搅拌器上进行脱盐,时长为6h,期间每隔1h更换烧杯中pbs溶液。将透析袋取出并在透析袋表面覆盖peg粉末进行蛋白质溶液的浓缩,当蛋白质溶液浓缩至1ml时停止,即得到纯化后的ca-tm融合蛋白。
94.采用sds-page对纯化后的ca-tm融合蛋白进行鉴定,考马斯亮兰染色结果如图5所示,结果显示:成功纯化出ca-tm融合蛋白,且与预期大小一致,约为40kda。
95.采用his标签经western blot对纯化后的ca-tm融合蛋白(以peasy blunt e1空载体转化至transl-t1后挑取的菌落为对照)进行验证,结果如图6所示,结果显示:经切胶纯化的蛋白含有his标签,证明该纯化蛋白为ca-tm融合蛋白。
96.通过上述方法,最终得到纯化后的ca-tm融合蛋白,其氨基酸序列如sed id no.1所示。
97.实施例2梅迪-维斯纳病毒抗体间接elisa检测方法的建立及试剂盒
98.1、最佳抗原包被浓度和血清稀释倍数的筛选
99.具体步骤如下:
100.1)包被抗原:以纯化后的ca-tm融合蛋白作为包被抗原,用包被液进行稀释(设置抗原包被浓度为5μg/100ul,1μg/100ul,0.5μg/100ul,0.25μg/100ul,0.1μg/100ul共5个浓度梯度)并分别置于酶标板中,100μl/孔,用盖板膜盖住酶标板,于4℃孵育过夜包被。
101.2)封闭:加入封闭液,200μl/孔,用盖板膜盖住酶标板,37℃孵育1h,弃去反应液,每孔加入200μl洗涤液,洗涤4次;
102.3)加血清:使用样品稀释液将阴性对照血清、阳性对照血清分别按900倍、600倍和300倍稀释倍数稀释,分别得到稀释后的阴性对照血清和阳性对照血清,以pbs作为空白对照,对于每个抗原包被浓度每个稀释后的阴性对照血清和阳性对照血清及空白对照分别设置2孔,100μl/孔,用盖板膜盖住酶标板,置37℃孵育60min,弃去反应液,每孔加入200μl洗
涤液,洗涤4次;
103.4)加酶标二抗:用酶标二抗稀释液稀释酶标二抗浓缩液,得到按5000倍稀释倍数稀释的酶标二抗,加入到酶标板,100μl/孔,用盖板膜盖住酶标板,37℃孵育60min,弃去反应液,每孔加入200μl洗涤液,洗涤4次;
104.5)显色:加入显色液,100μl/孔,置室温避光显色5min;
105.6)终止:加入终止液,100μl/孔,终止反应;
106.7)读取od值:用酶标仪于450nm波长下分别读取阴性对照血清、阳性对照血清及空白对照各孔的od值(即阳性对照血清的od450值(p值)和阴性对照血清的od450值(n值)),并计算p/n值,以p/n值最高时筛选最佳抗原包被浓度和最佳血清稀释倍数。
107.在上述步骤中,各试剂及配制方法或来源分别为:
108.阴性对照血清为健康羊血清,经pcr,id screen mvv抗体检测试剂盒(购买自法国爱
·
迪威公司innovative diagnostics)检测为阴性,样本稀释液900倍稀释,od
450
值<0.4;
109.阳性对照血清为自然感染mvv阳性血清,经pcr,id screen mvv抗体检测试剂盒检测为阳性,样本稀释液900倍稀释,1.5≦od
450
值≦1.9;
110.酶标二抗浓缩液为使用酶标二抗稀释液进行70倍稀释的兔抗羊igg(购买自武汉三鹰生物技术有限公司)。
111.酶标二抗稀释液为含5%胎牛血清的0.01m pbs溶液(ph7.2-7.4),配制方法为称取磷酸二氢钾(kh2po4)0.27g、磷酸氢二钠(na2hpo4)1.42g、氯化钠(nacl)8g和氯化钾(kcl)0.2g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.01m pbs溶液;每95ml的0.01m pbs溶液加入5ml胎牛血清。
112.包被液为ph9.6的0.05m碳酸盐缓冲液,配制方法为na2co
3 1.59g,nahco
3 2.93g,加灭菌ddh2o 800ml溶解,调ph 9.6后加水至1000ml。
113.封闭液为含2%bsa和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4);配制方法为称取磷酸二氢钾(kh2po4)0.27g、磷酸氢二钠(na2hpo4)1.42g、氯化钠(nacl)8g和氯化钾(kcl)0.2g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.01m pbs溶液;每97.95ml的0.01m pbs溶液加入加入2g bsa和50ul吐温-20。
114.样品稀释液为含1%bsa和1%吐温0.01m pbs溶液(ph7.2-7.4),配制方法为称取磷酸二氢钾(kh2po4)0.27g、磷酸氢二钠(na2hpo4)1.42g、氯化钠(nacl)8g和氯化钾(kcl)0.2g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.01m pbs溶液;每98ml的0.01m pbs溶液加入1g bsa及1ml吐温-20。
115.洗涤液为含1%吐温-20的0.2m pbs溶液(ph7.2-7.4),配制方法为称取磷酸二氢钾(kh2po4)5.40g、磷酸氢二钠(na2hpo4)28.4g、氯化钠(nacl)160.0g和氯化钾(kcl)4.0g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.2m pbs溶液;每99.0ml的0.2m pbs溶液加入1ml吐温-20。
116.显色液为tmb显色液,购买自promega公司,货号为:g7431。
117.终止液为2m h2so4,配制方法为将11.1ml的浓硫酸缓慢加入水中稀释,并定容至100ml。
118.所有试剂使用前恢复至室温(21
°±5°
),轻摇或颠倒使其混合均匀;洗涤液用去离
子水或蒸馏水10倍稀释。
119.结果如图7所示,结果显示:当以0.1μg/100μl的抗原包被浓度包被抗原,对血清进行900倍稀释时,p/n值最高。
120.最终筛选最佳抗原包被浓度为0.1μg/100μl,最佳血清稀释倍数为900倍。
121.2、最佳包被条件的筛选
122.按照步骤1中1)-7),将1)中4℃孵育过夜分别替换为4℃孵育过夜,4℃孵育过夜后37
°
孵育1h,4℃孵育过夜后37
°
孵育2h,37
°
孵育1h,37
°
孵育2h,在上述最佳条件下检测各包被条件对p/n值的影响,其他步骤均不变,以p/n值最高时筛选最佳包被条件。
123.结果如图8和表1所示,结果显示:当包被条件为37
°
孵育1h时,p/n值最高。
124.表1不同包被条件的筛选结果
[0125] p值n值p/n空白对照4℃过夜2.20.4554.830.09184℃过夜 37℃1h2.460.4365.640.06964℃过夜 37℃2h3.02450.55055.490.074337℃1h1.5050.104514.40.068637℃2h2.5760.20512.50.0694
[0126]
最终筛选最佳包被条件为37
°
孵育1h。
[0127]
3、最佳封闭液的筛选
[0128]
按照步骤1中1)-7),将2)中封闭液分别替换为含1%bsa和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4)(图和表中以1%bsa表示)、含2%bsa和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4)(图和表中以2%bsa表示)、含5%脱脂奶粉和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4)(图和表中以5%脱脂奶粉表示)和含10%脱脂奶粉和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4)(图和表中以10%脱脂奶粉表示),在上述最佳条件下检测各封闭液对p/n值的影响,其他步骤均不变,以p/n值最高时筛选最佳封闭液。
[0129]
结果如图9和图2所示,结果显示:以含5%脱脂奶粉和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4)(图和表中以5%脱脂奶粉表示)进行封闭时,其p/n值最高。
[0130]
表2不同封闭液的筛选结果
[0131] p值n值p/n1%bsa2.7066670.3633337.472%bsa2.5933330.4785.415%脱脂奶粉2.2366670.14415.5610%脱脂奶粉2.30.1812.78
[0132]
最终筛选最佳封闭液为含5%脱脂奶粉和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4)。
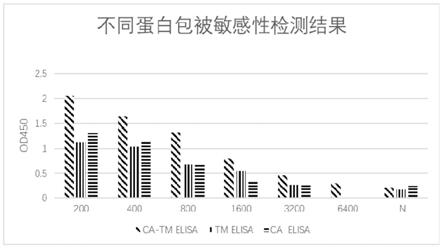
[0133]
4、酶标二抗最佳稀释倍数的筛选
[0134]
按照步骤1中1)-7),将4)中按5000倍稀释倍数分别替换为按3000倍、5000倍、7000倍稀释倍数,在上述最佳条件下检测各稀释倍数对p/n值的影响,其他步骤均不变,以p/n值最高时筛选最佳酶标二抗稀释倍数。
[0135]
结果如图10和表3所示,结果显示:当按7000倍稀释倍数稀释的酶标二抗时,p/n值
最高。
[0136]
表3不同酶标二抗最佳稀释倍数的筛选结果
[0137] p值n值p/n空白对照3000倍稀释2.940.70354.180.09185000倍稀释2.5650.50355.090.06967000倍稀释2.080.32356.430.0743
[0138]
最终筛选酶标二抗最佳稀释倍数为7000倍。
[0139]
5、阴阳临界值确定(即结果判定)
[0140]
按照步骤1中1)-7),根据上述步骤1-4的筛选试验在最佳条件下对10份健康羊血清进行检测,每只健康羊血清设置3个重复,读取每只健康羊血清每个重复的od
450
值后计算每只羊血清平均od
450
值后,计算10只羊血清的od
450
值的总体平均值和标准差(sd),设置当时判为阳性,时判为阳性,时判为阴性,s/p介于和之间的值判为可疑,最终计算得出阴阳性临界值。
[0141]
经计算10只羊血清的od
450
值的总体平均值为0.28,标准差(sd)为0.0537,所以阴阳临界值为0.39和0.44。判定标准为:当s/p≥0.44判定为阳性(即待测羊血清为阳性血清,也就是说待测羊血清含有梅迪-维斯纳病毒抗体或待测羊感染梅迪-维斯纳病毒),s/p≤0.39判定为阴性(即待测羊血清为阴性血清,也就是说待测羊血清不含有梅迪-维斯纳病毒抗体或待测羊未感染梅迪-维斯纳病毒),0.39<s/p<0.44判定为可疑(即待测羊血清疑似为阳性血清,也就是说待测羊血清疑似含有梅迪-维斯纳病毒抗体或待测羊疑似感染梅迪-维斯纳病毒)。
[0142]
6、梅迪-维斯纳病毒抗体间接elisa检测方法
[0143]
根据步骤1-5确定优化后的梅迪-维斯纳病毒抗体间接elisa检测方法,包括如下步骤:
[0144]
1)包被抗原:以纯化后的ca-tm融合蛋白作为包被抗原,用包被液(ph9.6的0.05m碳酸盐缓冲液)进行稀释使得抗原包被浓度为0.1μg/100ul,置于酶标板中,100μl/孔,用盖板膜盖住酶标板,37
°
孵育1h,弃去反应液,每孔加入200μl洗涤液(含1%吐温-20的0.2m pbs溶液(ph7.2-7.4)),洗涤4次;
[0145]
2)封闭:加入封闭液(含5%脱脂奶粉和0.05%吐温-20的0.01m pbs溶液(ph7.2-7.4)),200μl/孔,用盖板膜盖住酶标板,37℃孵育1h,弃去反应液,每孔加入200μl洗涤液(含1%吐温-20的0.2m pbs溶液(ph7.2-7.4)),洗涤4次;
[0146]
3)加血清:使用样品稀释液(含1%bsa和1%吐温的0.01m pbs溶液(ph7.2-7.4))将阴性对照血清、阳性对照血清和待测动物血清按900倍稀释倍数稀释,分别得到稀释后的阴性对照血清、阳性对照血清和待测动物血清,100μl/孔,用盖板膜盖住酶标板,置37℃孵育60min,取出酶标板,弃去反应液,每孔加入200μl洗涤液(含1%吐温-20的0.2m pbs溶液(ph7.2-7.4)),洗涤4次;
[0147]
4)加酶标二抗:用酶标二抗稀释液(含5%胎牛血清的0.01m pbs溶液(ph7.2-7.4))按100倍稀释倍数稀释酶标二抗浓缩液(使用酶标二抗稀释液进行70倍稀释的兔抗羊igg),得到按7000倍稀释倍数稀释的酶标二抗,加入到酶标中,100μl/孔,用盖板膜盖住酶
标板,37℃孵育60min,弃去反应液,每孔加入200μl洗涤液(含1%吐温-20的0.2m pbs溶液(ph7.2-7.4)),洗涤4次;
[0148]
5)显色:加入显色液(tmb显色液),100μl/孔,置室温避光显色5min;
[0149]
6)终止:加入终止液(2m h2so4),100μl/孔,终止反应;
[0150]
7)读取od值:用酶标仪于450nm波长下分别读取阴性对照血清、阳性对照血清及待测动物血清的od值,依次记为p值、n值和s值;
[0151]
当p值≥0.5且p/n值≥3判定检测成立,计算s/p,其中,值代表平均p值,代表平均n值;
[0152]
8)结果判定:当s/p≥0.44判定为阳性(即待测动物血清为阳性血清,也就是说待测动物血清含有梅迪-维斯纳病毒抗体或待测动物感染梅迪-维斯纳病毒),s/p≤0.39判定为阴性(即待测动物血清为阴性血清,也就是说待测动物血清不含有梅迪-维斯纳病毒抗体或待测动物未感染梅迪-维斯纳病毒),0.39<s/p<0.44判定为可疑(即待测动物血清疑似为阳性血清,也就是说待测动物血清疑似含有梅迪-维斯纳病毒抗体或待测动物疑似感染梅迪-维斯纳病毒)。
[0153]
7、梅迪-维斯纳病毒抗体间接elisa检测试剂盒
[0154]
梅迪-维斯纳病毒抗体间接elisa检测试剂盒包括以序列表中seq id no.1所示的ca-tm融合蛋白作为包被抗原的酶标板、样品稀释液、洗涤液、阳性对照血清、阴性对照血清、酶标二抗(以酶标二抗浓缩液的形式存在)、酶标二抗稀释液、显色液和终止液;
[0155]
其中,
[0156]
阴性对照血清为健康羊血清,经pcr,id screen mvv抗体检测试剂盒(购买自法国爱
·
迪威公司innovative diagnostics)检测为阴性,样本稀释液900倍稀释,od
450
值<0.4;
[0157]
阳性对照血清为自然感染mvv阳性血清,经pcr,id screen mvv抗体检测试剂盒检测为阳性,样本稀释液900倍稀释,1.5≦od
450
值≦1.9;
[0158]
酶标二抗浓缩液为使用酶标二抗稀释液进行70倍稀释的兔抗羊igg(购买自武汉三鹰生物技术有限公司)。
[0159]
酶标二抗稀释液为含5%胎牛血清的0.01m pbs溶液(ph7.2-7.4),配制方法为称取磷酸二氢钾(kh2po4)0.27g、磷酸氢二钠(na2hpo4)1.42g、氯化钠(nacl)8g和氯化钾(kcl)0.2g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.01m pbs溶液;每95ml的0.01m pbs溶液加入5ml胎牛血清。
[0160]
样品稀释液为含1%bsa和1%吐温的0.01m pbs溶液(ph7.2-7.4),配制方法为称取磷酸二氢钾(kh2po4)0.27g、磷酸氢二钠(na2hpo4)1.42g、氯化钠(nacl)8g和氯化钾(kcl)0.2g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.01m pbs溶液;每98ml的0.01m pbs溶液加入1g bsa及1ml吐温-20。
[0161]
洗涤液为含1%吐温-20的0.2m pbs溶液(ph7.2-7.4),配制方法为称取磷酸二氢钾(kh2po4)5.40g、磷酸氢二钠(na2hpo4)28.4g、氯化钠(nacl)160.0g和氯化钾(kcl)4.0g,加去离子水约800ml,调节ph至7.4,最后定容至1l,过滤备用,得到0.2m pbs溶液;每99.0ml
的0.2m pbs溶液加入1ml吐温-20。
[0162]
显色液为tmb显色液,购买自promega公司,货号为:g7431。
[0163]
终止液为2m h2so4,配制方法为将11.1ml的浓硫酸缓慢加入水中稀释,并定容至100ml。
[0164]
试剂盒的操作方法为:
[0165]
试剂配制:所有试剂使用前应恢复至室温(21
°±5°
),轻摇或颠倒使其混合均匀;洗涤液用去离子水或蒸馏水10倍稀释;
[0166]
(1)样品准备:待动物全血析出血清后,吸取血清;将血清用样品稀释液按900倍稀释倍数稀释,充分混匀,得到稀释好的待测动物血清;
[0167]
(2)加血清:将稀释好的待测动物血清加入到酶标板中,设阴、阳性对照血清各2孔,100μl/孔,用盖板膜盖住酶标板,置37℃温育60min,弃去反应液,每孔加入200μl洗涤液,洗涤4次;
[0168]
(3)加酶标二抗:用酶标二抗稀释液按100倍稀释倍数稀释酶标二抗浓缩液,得到按7000倍稀释倍数稀释的酶标二抗,加入到酶标板,100μl/孔,用盖板膜盖住酶标板,37℃孵育60min,弃去反应液,每孔加入200μl洗涤液,洗涤4次;
[0169]
(4)显色:加入显色液,100μl/孔,置室温避光显色5min;
[0170]
(5)终止:加入终止液,100μl/孔,终止反应;
[0171]
(6)读取od值:用酶标仪于450nm波长下分别读取阴性对照血清、阳性对照血清及待测动物血清的od值,依次记为p值、n值和s值;
[0172]
当p值≥0.5且p/n值≥3判定检测成立,计算s/p,其中,值代表平均p值,代表平均n值;
[0173]
(8)结果判读:当s/p≥0.44判定为阳性(即待测动物血清为阳性血清,也就是说待测动物血清含有梅迪-维斯纳病毒抗体或待测动物感染梅迪-维斯纳病毒),s/p≤0.39判定为阴性(即待测动物血清为阴性血清,也就是说待测动物血清不含有梅迪-维斯纳病毒抗体或待测动物未感染梅迪-维斯纳病毒),0.39<s/p<0.44判定为可疑(即待测动物血清疑似为阳性血清,也就是说待测动物血清疑似含有梅迪-维斯纳病毒抗体或待测动物疑似感染梅迪-维斯纳病毒)。
[0174]
实施例3梅迪-维斯纳病毒抗体间接elisa检测方法检测不同包被抗原的敏感性试验
[0175]
用实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法以相同条件分别以ca蛋白、tm蛋白及ca-tm融合蛋白作为包被抗原对同一阳性血清(阳性血清分别以200倍、400倍、800倍、1600倍、3200倍和6400倍稀释倍数进行稀释)进行检测,对检测方法的敏感性进行评价。
[0176]
结果如图11和表4所示,结果显示:ca-tm融合蛋白作为包被抗原进行检测时(图和表中以ca-tm elisa表示)最低可在3200倍稀释血清后检测为阳性,而ca蛋白作为包被抗原进行检测时(图和表中以ca elisa表示)及tm蛋白作为包被抗原进行检测时(图和表中以tm elisa表示)分别可在800倍稀释血清和1600倍稀释血清后检测为阳性,表明以ca-tm融合蛋
白作为包被抗原相比于ca和tm作为包被抗原具有更高的敏感性。
[0177]
表4不同包被抗原不同稀释倍数的比较结果
[0178] 200400800160032006400nca-tm elisa2.051.651.330.80.460.30.21tm elisa1.121.040.680.550.27 0.17caelisa1.321.130.670.360.26 0.25
[0179]
实施例4梅迪-维斯纳病毒抗体间接elisa检测方法检测的特异性、敏感性及重复性试验
[0180]
用实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法分别检测绵羊的主要常见疾病:羊布鲁氏菌病(布病)、口蹄疫、小反刍兽疫、绵羊支原体及制备的兔源多克隆抗体ca及tm(绵羊mvv感染时病畜体内出现的主要抗体),结果如图12所示,结果显示:梅迪-维斯纳病毒抗体间接elisa检测方法不能检测除梅迪-维斯纳病以外的其他绵羊常见疾病,表明实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法较强的特异性。
[0181]
将同一阳性血清按以500倍、1000倍、2000倍、4000倍、8000倍、16000倍和32000倍稀释倍数稀释,分别用实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法及id screen mvv抗体检测试剂盒(id screen elisa试剂盒)进行敏感性检测,结果如图13所示,结果显示:实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法最低可检测出16000倍稀释的阳性血清,而id screen elisa试剂盒最低可检测出4000倍稀释的阳性血清,表明实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法具有较高的敏感性。
[0182]
取不同批次(2021.11.18,2021.11.19,2021.11.20,2021.11.21,2021.11.22)包被的酶标板,检测阳性血清(1,2,3,4)及阴性血清(5),每组样品设置2个重复,经实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法进行检测,计算批间变异系数,对实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法的批间重复性进行评价。取一块酶标板,检测阳性血清(1,2,3,4)及阴性血清(5),每组样品设置5个重复,经实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法进行检测,计算批内变异系数,对实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法的批内重复性进行评价。结果如表5所示,结果显示:批内的变异系数在小于3.6%-6.9%之间,批间的变异系数在2.28%-8.5%之间,说明实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法具有较好的重复性。
[0183]
表5间接elisa检测方法批间和批内的重复性结果
[0184][0185]
实施例5梅迪-维斯纳病毒抗体间接elisa检测方法临床应用与国际商品化试剂盒符合率验证
[0186]
应用实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法(ca-tm elisa)及id screen mvv抗体检测试剂盒(id screen elisa试剂盒)对内蒙古自治区某羊场70份临床血清样本检测,结果如表6所示,结果显示:实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法(ca-tm elisa)及id screen mvv抗体检测试剂盒(id screen elisa试剂盒)进行检测时阳性符合率为83.7%,阴性符合率为100%,整理符合率为91.3%,说明实施例2建立的梅迪-维斯纳病毒抗体间接elisa检测方法与id screen mvv抗体检测试剂盒具有较高的符合率。
[0187]
表6 70份临床血清样本的检测结果
[0188]
检测方法/试剂盒阳性阴性可疑阳性符合率阴性符合率整体符合率ca-tm elisa31381
ꢀꢀꢀ
id screen elisa37321
ꢀꢀꢀ
符合数3132083.7%100%91.3%
[0189]
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。