一种c60-rb的制备方法及其荧光脂质体和应用
技术领域
1.本发明涉及荧光脂质体技术领域,更具体的说是涉及一种c60-rb的制备方法及其荧光脂质体和应用。
背景技术:
2.目前,虽然有一些富勒烯的示踪方法,如:同位素法,荧光标记法等。但是,现有富勒烯的示踪剂的合成过程中出现步骤繁琐且产率底,且成本高昂。
3.因此,如何开发一种操作简便、成本低且产率高的方法用于富勒烯使其能在生物医药研究过程中起到示踪作用是本领域技术人员亟需解决的问题。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种c60-rb的制备方法及其荧光脂质体和应用,以解决现有技术中的不足。
5.为了实现上述目的,本发明采用如下技术方案:
6.一种c60-rb的制备方法,具体包括以下步骤:
7.(1)向罗丹明b的乙醇溶液中加入羟胺和氢氧化钠的水溶液,反应,萃取,纯化,获得纯化产物,即为化合物1;
8.(2)向化合物1的无水二氯甲烷溶液中依次加入三乙胺和丙二酸甲酯酰氯,反应,萃取,纯化,获得纯化产物,即为化合物2;
9.(3)向富勒烯(c60)的甲苯溶液中依次加入化合物2和碘单质,搅拌后加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu),继续反应,淬灭反应,分离有机相,纯化,获得纯化产物,即得c60-rb。
[0010]
本发明上述制备方法的合成路线为:
[0011][0012]
进一步,上述步骤(1)中,羟胺的浓度为40wt%-60wt%,优选为50wt%;罗丹明b、
乙醇、50wt%羟胺、氢氧化钠和水的质量体积比为(8-12)g:(40-60)ml:(16-20)ml:(12-18)g:(60-65)ml,优选为10g:50ml:18ml:15g:62ml。
[0013]
采用上述进一步技术方案的有益效果在于,利用罗丹明b在乙醇的溶解下和在氢氧化钠的作用下关环成内脂,再被羟胺开环又关环,转换成内酰胺并保留羟基用于下一步反应,此法一步实现多个过程,并且只保留一个给官能团,使下一步反应能顺利进行。
[0014]
进一步,上述步骤(1)中,萃取的溶剂为二氯甲烷;纯化的方法为快速柱层析法;快速柱层析法的洗脱剂为乙酸乙酯和石油醚,体积比为(2-3):1,优选为2:1。
[0015]
采用上述进一步技术方案的有益效果在于,在二氯甲烷与水分层下能将反应的一些无机物及有机物分离开来,在进行简单的纯化后,再利用有机物的极性不同,利用硅胶对不同有机物极性不同、吸附不同,最后再以硅胶为固定相,在乙酸乙酯与石油醚的极性下,将初步纯化的有机物分离开来,从而得到纯化的目标分子。
[0016]
进一步,上述步骤(2)中,化合物1、无水二氯甲烷、三乙胺和丙二酸甲酯酰氯的质量体积比为(6-7)g:(140-160)ml:(4-5)ml:(9-10)ml,优选为6.8g:150ml:4.16ml:9.6ml。
[0017]
采用上述进一步技术方案的有益效果在于,利用羟基在三乙胺这一碱的作用下可以形成氧负离子,具有较好的取代作用;而另一个底物丙二酸甲酯酰氯本身活性较高,容易受到亲核试剂的进攻,并且其本身还带有亚甲基可用于下一步的反应,于是在三乙胺的作用下,化合物1顺利的对丙二酸甲酯酰氯进行亲核取代,并引入亚甲基用于下一步反应。由于化合物1在二氯甲烷中溶解性较好,并且丙二酸甲酯酰氯由于过于活泼,对水敏感,所以需要用无水的二氯甲烷作为溶剂。
[0018]
进一步,上述步骤(2)中,萃取的溶剂为二氯甲烷;纯化的方法为快速柱层析法;快速柱层析法的洗脱剂为乙酸乙酯和石油醚,体积比为(2-3):1,优选为3:1。
[0019]
采用上述进一步技术方案的有益效果在于,在二氯甲烷与水分层下能将反应的一些无机物及有机物分离开来,在进行简单的纯化后,再利用有机物的极性不同,利用硅胶对不同有机物极性不同、吸附不同,最后再以硅胶为固定相,在乙酸乙酯与石油醚的极性下,将初步纯化的有机物分离开来,从而得到纯化的目标分子。
[0020]
进一步,上述步骤(3)中,富勒烯、甲苯、化合物2、碘单质和1,8-二氮杂双环[5.4.0]十一碳-7-烯的质量体积比为(350-380)mg:(180-220)ml:(380-420)mg:(160-180)mg:(0.15-0.18)ml,优选为360mg:200ml:400mg:170mg:0.17ml。
[0021]
采用上述进一步技术方案的有益效果在于,在1,8-二氮杂双环[5.4.0]十一碳-7-烯这一碱夺质子和碘单质催化的双重作用下,亚甲基可以对甲苯溶解下的富勒烯的双键进行加成,从而实现将一个底物连接到富勒烯上。本发明就是利用这一方法,顺利地将荧光基团前体化合物2连接到了富勒烯上。
[0022]
进一步,上述步骤(3)中,淬灭反应的溶剂为硫代硫酸钠溶液;纯化的方法为制备液相;制备液相的流动相为甲苯,制备柱为buckprep。
[0023]
采用上述进一步技术方案的有益效果在于,在甲苯与水分层下能将反应的一些无机物及有机物分离开来,由于硅胶对产物的吸附作用过强无法使其被洗脱下来,最终发现利用制备液相可以很好的将产物分离出来,所以本发明利用制备液相的方法,以buckprep作为制备柱,成功地获得产物。
[0024]
进一步,上述步骤(1)中,反应的时间为2-4h,优选为3h;步骤(2)中,反应的时间为
2-4h,优选为3h;步骤(3)中,搅拌的时间为15-25min,优选为20min,继续反应的时间为20-40min,优选为30min。
[0025]
本发明还请求保护一种富勒烯荧光脂质体,含有上述制备方法制得的c60-rb。
[0026]
本发明还请求保护一种上述富勒烯荧光脂质体在制备荧光示踪剂中的应用。
[0027]
经由上述的技术方案可知,与现有技术相比,本发明的有益效果如下:
[0028]
1、本发明制备c60-rb所用的原料较为低廉,成本低,获得产物产率均较为可观,步骤较少,反应所需的时间也较短。
[0029]
2、本发明富勒烯荧光脂质体能在生物医药研究过程中起到良好的示踪作用。
附图说明
[0030]
图1为化合物1的1h nmr和
13
c nmr的谱图;
[0031]
图2为化合物2的1h nmr和
13
c nmr的谱图;
[0032]
图3为c60-rb的1hnmr和
13
c nmr的谱图;
[0033]
图4为c60-rb的紫外吸收曲线;
[0034]
图5为c60-rb在三氟乙酸的thf溶液(0.01ml/ml)中的荧光强度;
[0035]
图6为富勒烯荧光脂质体的sem图,其中,图6(a)为bar值为4μm,图6(b)bar值为2μm;
[0036]
图7为富勒烯荧光脂质体的tem图,其中,图7(a)bar值为500nm,图7(b)bar值为100nm;
[0037]
图8为富勒烯荧光脂质体中主要元素的分布图;
[0038]
图9为富勒烯荧光脂质体的水合粒径(a)和表面电荷(b)图;
[0039]
图10为不同浓度富勒烯荧光脂质体对细胞活力的影响;
[0040]
图11为罗丹明b标记的富勒烯荧光脂质体与l02共培养不同时间的细胞摄取情况;
[0041]
图12为罗丹明b标记的富勒烯荧光脂质体与beas-2b共培养不同时间的细胞摄取情况;
具体实施方式
[0042]
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0043]
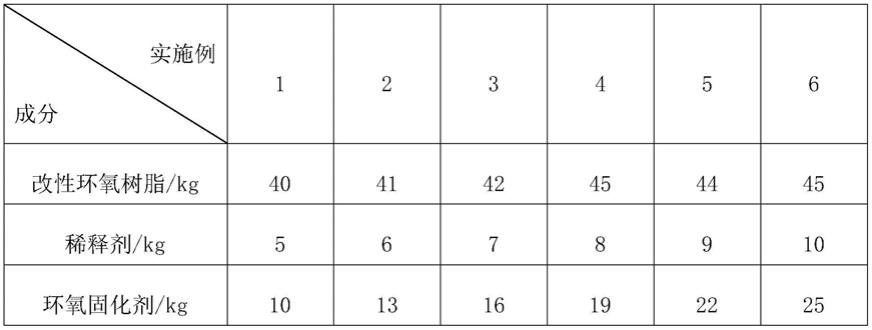
实施例1
[0044]
c60-rb的制备方法,具体包括以下步骤:
[0045]
(1)向10g罗丹明b的50ml乙醇溶液中加入18ml 50wt%的羟胺和15g氢氧化钠的62ml水溶液,反应3h,用二氯甲烷萃取,用快速柱层析法以乙酸乙酯:石油醚=2:1为洗脱剂进行纯化,获得浅褐色纯化的产物,即为化合物1(收率为70%);
[0046]
合成路线为:
[0047][0048]
(2)向6.8g(15mmol)化合物1的150ml无水二氯甲烷溶液中依次加入4.16ml(30mmol)三乙胺和9.6ml(30mmol)丙二酸甲酯酰氯,反应3h,用二氯甲烷萃取,用快速柱层析法以乙酸乙酯:石油醚=3:1为洗脱剂进行纯化,获得无色或紫色纯化的产物,即为化合物2(收率为60%);
[0049]
合成路线为:
[0050][0051]
(3)向360mg富勒烯的200ml甲苯溶液中依次加入400mg(0.72mmol)化合物2和170mg(0.67mmol)碘单质,搅拌20min后加入0.17ml(1.1mmol)1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu),继续反应30min,用硫代硫酸钠溶液淬灭反应,分离有机相,用制备液相以甲苯为流动相,以buckprep为制备柱进行纯化,获得灰色纯化的产物,即得c60-rb(收率为47%);
[0052]
合成路线为:
[0053][0054]
c60-rb及c60-rb荧光脂质体性能表征
[0055]
一、产物结构解析数据
[0056]
1、化合物1的1h nmr和
13
c nmr的谱图如图1所示。
[0057]
图1为化合物1的1h nmr和
13
c nmr的谱图。由图1可知,具体为:1h nmr(400mhz,cdcl3):δ(ppm)7.85(ch,1h),7.43(ch,2h),7.08(ch,1h),6.43(ch,2h),6.29(ch,2h),3.35(nch2ch3,8h),2.54(ch,1h),1.17(nch2ch3,12h);
[0058]
2、化合物2的1h nmr和
13
c nmr的谱图如图2所示。
[0059]
图2为化合物2的1h nmr和
13
c nmr的谱图。由图2可知,具体为:1h nmr(400mhz,
cdcl3):δ(ppm)7.94(ch,1h),7.49(ch,2h),7.09(ch,1h),6.67(ch,2h),6.38(ch,2h),6.31(ch,2h),3.60(och3,3h),3.41(coch2co,2h),3.35(nch2ch3,8h),1.17(nch2ch3,12h);
[0060]
3、c60-rb的1h nmr和
13
c nmr的谱图如图3所示。
[0061]
图3为c60-rb的1h nmr和
13
c nmr的谱图。由图3可知,具体为:1h nmr(400mhz,cdcl3):δ(ppm)7.99(ch,1h),7.48(ch,2h),7.08(ch,1h),6.92(ch,2h),6.34(ch,2h),6.25(ch,2h),4.18(och3,3h),3.27(nch2ch3,8h),1.09(nch2ch3,12h);13c nmr(100mhz,cdcl3):δ165.3,163.34,161.14,152.8,152.3,148.8,145.2,145.2,145.1,145.1,145.0,145.0,145.0,144.9,144.7,144.5,143.9,143.8,143.7,143.1,142.9,142.8,142.4,142.4,142.2,142.1,141.6,140.7,140.7,140.6,137.5,133.9,129.0,128.4,128.2,125.7,123.9,123.4,108.0,98.4,77.2,70.5,66.5,54.2,49.4,44.3,12.6;hrms calcd for c
93h38
n3o5[m h]
1277.2840found 1277.2495。
[0062]
二、c60-rb的荧光波长检测
[0063]
1、c60-rb的紫外吸收
[0064]
结果如图4所示。图4为c60-rb的紫外吸收曲线。由图4可知,557nm即其最大吸收波长。
[0065]
2、c60-rb的荧光发射谱图
[0066]
结果如图5所示。图5为c60-rb在三氟乙酸的thf溶液(0.01ml/ml)中的荧光强度。由图5可知,0.2mg/ml下c60-rb的荧光强度最大。
[0067]
三、含实施例1制得的c60-rb的富勒烯荧光脂质体理化性质表征、体外生物安全性评价和细胞摄取研究
[0068]
1、将富勒烯荧光脂质体悬浮液滴在硅片上,自然干燥后用喷金仪喷金30s,采用扫描电镜(sem)观察富勒烯荧光脂质体的形貌及粒径分布。结果如图6所示。
[0069]
图6为富勒烯荧光脂质体的sem图,其中,图6(a)bar值为4μm,图6(b)bar值为2μm。由图6可知,富勒烯荧光脂质体球型度良好,对颗粒粒径进行测量,其主要分布在100-200nm之间,粒径分布均一,粒径分布较窄。
[0070]
2、将富勒烯荧光脂质体悬浮液滴在铜网上,磷钨酸负染自然干燥后,采用透射电子显微镜(tem)对富勒烯荧光脂质体的形貌进行进一步观察。结果如图7所示。
[0071]
图7为富勒烯荧光脂质体的tem图,其中,图7(a)bar值为500nm,图7(b)bar值为100nm。由图7可知,富勒烯荧光脂质体球型度良好,对颗粒粒径进行测量,其主要分布在100-200nm之间,粒径分布均一,粒径分布较窄。
[0072]
3、采用eds-mapping对富勒烯荧光脂质体的元素分布进行检测。结果如图8所示。
[0073]
图8为富勒烯荧光脂质体中主要元素的分布图。由图8可知,c元素(对应富勒烯)在纳米颗粒内部,p元素(对应脂质体)在纳米颗粒表层,具有明显的核壳结构,验证了富勒烯荧光脂质体的成功包覆。
[0074]
4、配制一定浓度的富勒烯荧光脂质体悬浮液,进一步采用动态光散射仪(dls)对富勒烯荧光脂质体的水合粒径以及表面电荷进行测量。结果如图9所示。
[0075]
图9为富勒烯荧光脂质体的水合粒径(a)和表面电荷(b)图。由图9(a)可知,富勒烯荧光脂质体的平均水合粒径为169.03nm,多分散系数pdi=0.082,表明分散性良好;由图9(b)可知,纳米颗粒表面带少量负电。
[0076]
5、分别以人正常肝细胞l02,人正常肺细胞上皮细胞beas-2b,人正常肠上皮细胞hiec为模型细胞,采用cck-8法对富勒烯荧光脂质体对细胞活力的影响进行检测,以1
×
104每孔接种细胞于96孔板中,于37℃和5%浓度co2的培养箱中培养24h,待细胞完全贴壁后加入一定浓度富勒烯荧光脂质体的完全培养基,继续培养48h,然后用移液枪将孔板中的培养基吸去,并用无菌的pbs溶液漂洗3次,在避光条件下,每孔加入现配的110μl cck-8溶液(10μl cck-8检测液和100μl细胞培养液)。4h后,用酶标仪检测其在450nm波长处的吸光度。计算细胞的相对细胞活力(relativecellviability,rgr),其中,rgr=实验组od值/对照组od值
×
100%。结果如图10所示。
[0077]
图10为不同浓度富勒烯荧光脂质体对细胞活力的影响。由图10可知,富勒烯荧光脂质体具有较良好的生物安全性,与阴性对照相比,浓度在1-100μg/ml时均未表现出明显的细胞毒性。然而,随着浓度的持续升高,达到200μg/ml时,其表现出一定的细胞毒性。
[0078]
6、以人正常肝细胞l02为模型,以1
×
105/孔接种至24孔板。于37℃、5%co2恒温孵箱中培养24h。更换含50μg/ml罗丹明b标记的富勒烯荧光脂质体的培养基,继续培养2h、4h和6h,每组设3个复孔。弃去染液,加pbs漂洗,加入4%的多聚甲醛溶液固定细胞,15min后吸弃固定液,加入dapi避光染色,pbs漂洗3次,激光共聚焦显微镜下观察。结果如图11所示。
[0079]
图11为罗丹明b标记的富勒烯荧光脂质体与l02共培养不同时间的细胞摄取情况。由图11可知,随着时间的延长,红色荧光信号不断增强,表明富勒烯荧光脂质体被人正常肝细胞有效摄取。
[0080]
7、以人正常肺细胞上皮细胞beas-2b为模型,以1
×
105/孔接种至24孔板。于37℃、5%co2恒温孵箱中培养24h。更换含50μg/ml罗丹明b标记的富勒烯荧光脂质体的培养基,继续培养2h,4h,和6h,每组设3个复孔。弃去染液,加pbs漂洗,加入4%的多聚甲醛溶液固定细胞,15min后吸弃固定液,加入dapi避光染色,pbs漂洗3次,激光共聚焦显微镜下观察。结果如图12所示。
[0081]
图12为罗丹明b标记的富勒烯荧光脂质体与beas-2b共培养不同时间的细胞摄取情况。由图12可知,随着时间的延长,红色荧光信号不断增强,表明富勒烯荧光脂质体被人正常beas-2b细胞有效摄取。在6h时红色荧光在细胞核周围分布,说明6h时富勒烯荧光脂质体已全部进入胞内,并靠近细胞核。
[0082]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。