一种大蒜脱毒组培的培养基组及其应用和快速获得脱毒大蒜的方法
1.本技术是申请日为2017年07月17日、申请号为201710580597.5、发明名称为《一种快速获得脱毒大蒜的方法》的分案申请。
技术领域
2.本发明属于大蒜脱毒技术领域,具体涉及一种大蒜脱毒组培的培养基组及其应用和快速获得脱毒大蒜的方法。
背景技术:
3.大蒜气味辛温,含有丰富的蛋白质、脂肪、糖、钙、铁和维生素a、b、c等营养物质,并具有较高的药用价值,有“消炎、理胃、温中、除邪痹毒气”之功效。大蒜头还是常用的调料,在煮瓜、菜、鱼、肉时,放入几瓣,芳香可口。
4.大蒜是无性繁殖植物,即依靠鳞茎进行繁殖,在繁殖过程中病毒会通过蒜种逐年累积并代代相传,导致品种种性严重退化,蒜头弱小,严重制约了大蒜的大规模生产和持续健康发展。
5.但目前没有对大蒜茎尖诱导、继代培养、鳞茎培养、驯化植株等方面进行一系列的脱毒研究,没有试管鳞茎快速高效驯化技术研究,也没有经高灵敏度检测证明脱除oydv、lysv、gclv和slv这四种病毒的脱毒株系。
技术实现要素:
6.针对现有技术中的上述不足,本发明提供了一种大蒜脱毒组培的培养基组及其应用和快速获得脱毒大蒜的方法,能有效去除大蒜携带的病毒,并经过脱毒后的大蒜可直接大规模栽植,成活率高,脱毒效果好。
7.为实现上述目的,本发明解决其技术问题所采用的技术方案是:
8.一种大蒜脱毒组培的培养基组,包括茎尖诱导培养基、花序轴培养基和鳞茎诱导培养基;
9.所述茎尖诱导培养基以ms或b5培养基为基础培养基,还包括以下成分:ba1.5-3mg/l、kt0-0.5mg/l和naa0.01-0.1mg/l;
10.所述花序轴培养基为b5 ba1.5-2.0mg/l naa0.05-0.15mg/l;
11.所述鳞茎诱导培养基以ms培养基为基础培养基,还包括以下成分:ba1mg/l、kt0-0.5mg/l和naa0.1-1.5mg/l。
12.进一步地,所述花序轴培养基为b5 ba2.0mg/l naa0.1mg/l。
13.本发明还提供了前述培养基在加快大蒜脱毒株系繁殖中的应用。
14.本发明还提供了前述培养基在提高增殖系数中的应用。
15.本发明还提供了一种快速获得脱毒大蒜的方法,包括以下步骤:
16.(1)茎尖诱导培养
17.选取0.1-0.2mm茎尖置于茎尖诱导培养基中,在培养温度为23-26℃,光照强度为1800-2200lx,每天光照10-12h条件下培养30-35天;其中,茎尖诱导培养基以ms或b5培养基为基础培养基,还包括以下成分:ba1.5-3mg/l、kt0-0.5mg/l和naa0.01-0.1mg/l;
18.(2)花序轴培养
19.取刚伸出叶鞘的花苞,消毒后切取花序轴接种于花序轴培养基中诱导,培养,培养温度为24-26℃,光照强度为2000-2200lx,每天光照10-12h条件下培养25-30天,得组培苗;花序轴培养基为b5 ba1.5-2.0mg/l naa0.05-0.15mg/l;
20.(3)诱导试管鳞茎
21.将继代培养获得的组培苗繁殖系置于鳞茎诱导培养基中,在培养温度为23-27℃,光照强度为1800-2200lx,每天光照10-12h条件下培养65-70天;其中,鳞茎诱导培养基以ms培养基为基础培养基,还包括以下成分:ba1mg/l、kt0-0.5mg/l和naa0.1-1.5mg/l;
22.(4)用试管鳞茎驯化植株
23.将试管鳞茎种植于消毒的营养土中,用40目尼龙网罩全覆盖,后期按常规方法管理,获得驯化植株;其中营养土包括以下重量份的组分:草炭3-5份、蛭石1-3份和菜园土4-5份;
24.(5)病毒检测
25.收获步骤(4)所得植株叶片,进行脱毒检测。
26.进一步地,步骤(1)中茎尖通过以下方法制备得到:将蒜头于30℃热处理30天后,剥茎尖,制得。
27.进一步地,步骤(1)中在培养温度为25℃,光照强度为2000lx,每天光照12h条件下培养30天。
28.进一步地,步骤(3)中在培养温度为25℃,光照强度为2000lx,每天光照12h条件下培养65天。
29.进一步地,步骤(4)中营养土包括以下重量份的组分:草炭4份、蛭石2份和菜园土4份。
30.进一步地,所述大蒜包括云顶早、二水早、彭县早和温江红七星中的一种或多种。
31.本发明提供的快速获得脱毒大蒜的方法,具有以下有益效果:
32.(1)ms培养基或b5培养基具有维持离体植物细胞基本生命所需要的大部分营养成分,本发明研究大蒜每个生长阶段所需的营养物质及生长过程,尤其是对每个生长阶段所需培养基成分进行研究与验证,筛选出简单有效的培养基成分,其培养基配方简单,用量少,但能有效提高大蒜出芽茎尖数和芽诱导率,增殖倍数,鳞茎诱导率以及种植于土壤后成活率。
33.(2)本发明从茎尖培养和花序轴继代培养及试管鳞茎诱导相结合,将获得的鳞茎种植于田地中获得驯化植株,每个阶段的生长对病毒的降低都起着关键性作用,经过科学合理的处理,再经多次验证,最终快速获得脱毒大蒜,其脱毒率高,成活率高,并且该大蒜可大规模种植,提供了其经济价值。
具体实施方式
34.实施例1茎尖诱导培养
35.以云顶早、二水早、彭县早和温江红七星(简称温江蒜)作为研究对象,将其大蒜头经30℃热处理30天后,剥茎尖,分别选取0.1-0.2mm茎尖置于茎尖诱导培养基中,在培养温度为25℃,光照强度为2000lx,每天光照10-12h条件下培养30-35天。
36.云顶早茎尖诱导培养基的筛选过程:
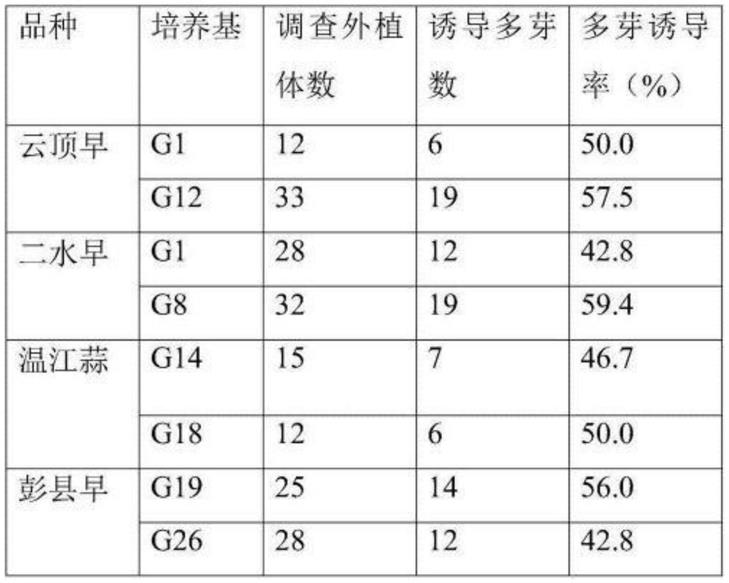
37.(1)云顶早的茎尖诱导培养基以b5 ba2-3.5mg/l kt0.3-0.6mg/l naa0.05-0.15mg/l作为筛选基础,其中,ba含量按0.25mg/l的浓度梯度变化,kt按0.1mg/l的浓度梯度变化,naa按0.025mg/l的浓度梯度变化,进行正交试验,得出多芽诱导率较高的培养基b5 ba3mg/l kt0.5mg/l naa0.1mg/l,标号为g1,诱导率为50%。
38.(2)云顶早的茎尖诱导培养基以ms ba1.5-3.5mg/l naa0.01-0.15mg/l作为筛选基础,其中,ba含量按0.25mg/l的浓度梯度变化,naa按0.025mg/l的浓度梯度变化,进行正交试验,得出多芽诱导率较高的培养基ms ba2.5mg/l naa0.1mg/l,标号为g12,诱导率为57.5%。
39.二水早茎尖诱导培养基的筛选过程:
40.二水早的茎尖诱导培养基以b5 ba2-3.5mg/l kt0.3-0.6mg/l naa0.01-0.15mg/l作为筛选基础,其中,ba含量按0.25mg/l的浓度梯度变化,kt按0.1mg/l的浓度梯度变化,naa按0.025mg/l的浓度梯度变化,进行正交试验,得出多芽诱导率较高的培养基b5 ba3mg/l kt0.5mg/l naa0.1mg/l,标号为g1,诱导率为42.8%和b5 ba3mg/l kt0.1mg/l naa0.1mg/l,标号为g8,诱导率为59.4%。
41.温江红七星茎尖诱导培养基的筛选过程:
42.温江红七星的茎尖诱导培养基以ms ba1.5-3.5mg/l naa0.01-0.15mg/l作为筛选基础,其中,ba含量按0.25mg/l的浓度梯度变化,naa按0.025mg/l的浓度梯度变化,进行正交试验,得出多芽诱导率较高的培养基ms ba1.5mg/l naa0.1mg/l,标号为g14,和ms ba2mg/l naa0.01mg/l,标号为g18,其诱导率分别为46.7%和50%。
43.彭县早茎尖诱导培养基的筛选过程:
44.(1)彭县早的茎尖诱导培养基ms ba1-3mg/l naa0.1-0.5mg/l作为筛选基础,其中,ba含量按0.25mg/l的浓度梯度变化,naa按0.025mg/l的浓度梯度变化,进行正交试验,得出多芽诱导率较高的培养基ms ba2mg/l naa0.3mg/l,标号为g19,其诱导率分别为56.0%
45.(2)彭县早的茎尖诱导培养基以ms kt1-3mg/l naa0.01-0.5mg/l作为筛选基础,其中,kt含量按0.25mg/l的浓度梯度变化,naa按0.025mg/l的浓度梯度变化,进行正交试验,得出多芽诱导率较高的培养基ms kt0.1mg/l naa0.1mg/l,标号为g26,诱导率为42.8%。
46.采用上述筛选出的培养基诱导茎尖,其结果见表1:
47.表1茎尖诱导培养基诱导结果
[0048][0049]
实施例2继代培养
[0050]
1、茎尖继代培养
[0051]
将实施例1获得的茎尖培养物进行继代培养获得试管苗,培养过程中若培养基成分及含量不同,茎尖培养物继代可不定向地产生苗、根、愈伤组织,有的仅仅变绿,甚至死亡,因此继代培养基成分及含量非常重要,该培养基以ms或b5培养基为基础培养基,还包括以下成分:ba、kt和naa,变化ba、kt和naa的含量,筛选出如下培养基,并计算其增殖倍数,具体见表2。
[0052]
g2(b5 ba3.5mg/l kt0.5mg/l naa0.1mg/l)和g21(ms kt1mg/l naa0.5mg/l)适宜云顶早的继代培养;g8(b5 ba3mg/l kt0.1mg/l naa0.1mg/l)和g3(b5 ba4mg/l kt0.5mg/l naa0.1mg/l)适宜二水早的继代培养;g18(ms ba2mg/l naa0.01mg/l)适宜温江蒜的继代培养;g5(b5 ba2mg/l kt0.5mg/l naa0.1mg/l)适宜彭县早的继代培养。
[0053]
表2茎尖继代培养增殖倍数
[0054][0055]
2、花序轴培养
[0056]
按照熊正琴等(2000年)的方法,取刚伸出叶鞘的花苞,消毒后切取花序轴接种于
花序轴培养基中,培养基成分及含量为b5 ba2.0mg/l naa0.1mg/l,诱导幼苗,调查增殖系数。
[0057]
在花序轴培养基上培养,其增殖系数幅度为9~34,平均增殖系数分别为27.3、7.8和22.8,一次性平均增殖26,比茎尖培养增殖系数高8.7倍。
[0058]
由上述可知,茎尖培养继代增殖系数较低,而花序轴培养增殖系数较高,而将热处理茎尖培养和花序轴培养二者结合可加快脱毒株系的繁殖。
[0059]
实施例3诱导试管鳞茎
[0060]
将继代培养获得的组培苗繁殖系置于鳞茎诱导培养基中,在培养温度为25℃,光照强度为2000lx,每天光照12h条件下培养65天;其中,鳞茎诱导培养基以ms培养基为基础培养基,还包括以下成分:ba0.5-1.5mg/l、kt0-0.5mg/l和naa0.1-1.5mg/l;其中,ba含量按0.1mg/l的浓度梯度变化,kt按0.05mg/l的浓度梯度变化,naa按0.1mg/l的浓度梯度变化,进行正交试验,得出有利于4个品种的鳞茎诱导培养基为ms ba1mg/l naa1.5mg/l和ms naa0.1mg/l kt0.5mg/l,其诱导率分别为76.5%和73.9%。
[0061]
将上述诱导的二水早、云顶早、彭县早和温江蒜的鳞茎于8-10月种植于消毒的营养土中,用40目尼龙网罩全覆盖,后期按常规方法管理,如长叶时补充2%尿素,提供氮源,长鳞茎时补充2%磷酸二氢钾,提供磷和钾,于次年4-5月收获,获得脱毒原原种鳞茎,其中营养土包括以下重量份的组分:草炭4份、蛭石2份和菜园土4份。
[0062]
计算其成活率,二水早、云顶早、彭县早和温江蒜的成活率分别为89%、88%、88%和89%。
[0063]
实施例4病毒检测
[0064]
选取33个经茎尖培养驯化成活的大蒜苗样品,检测oydv、lysv、gclv和slv四种病毒,检测出10个样品完全脱去oydv、lysv、gclv和slv四种病毒,脱毒率为30.3%,与脱毒前,slv的检出率几乎为100%,oydv的检出率为41.8%,lysv的检出率为56.5%,gclv的检出率很低相比,可说明本发明方法脱毒效果好。
[0065]
本发明将热处理茎尖培养和花序轴继代培养结合起来,可加快脱毒株系的繁殖,若将获得的继代培养组培苗直接栽植,其成活率较低,约为20%,而经过诱导试管鳞茎后再种植,其成活率为89%,完全脱去oydv、lysv、gclv和slv四种病毒的脱毒率为30.3%。
[0066]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。